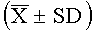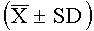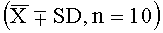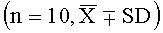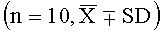Результат интеллектуальной деятельности: ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ EPHEDRAE HERBA, ДЛЯ ЛЕЧЕНИЯ БРОНХИТА, И СПОСОБ ЕЕ ПОЛУЧЕНИЯ
Вид РИД
Изобретение
Область техники
Изобретение относится к области традиционной китайской медицины, в частности к фармацевтической композиции для лечения бронхита и способам ее получения.
Уровень техники
Бронхит представляет собой воспаление слизистой оболочки трахеи и бронхов, вызванное бактериальными и вирусными инфекциями или раздражениями, обусловленными физическими и химическими факторами. Как правило, данное заболевание преимущественно характеризуется кашлем, мокротой, дискомфортом или болью за грудиной, затрудненным дыханием и сопровождающими их симптомам простуды. В соответствии с длительностью заболевания бронхит можно разделить на две категории: острый трахеобронхит и хронический бронхит. Острый трахеобронхит представляет собой бронхит, который обычно длится не более одного месяца и приводит к патологическим изменениям, локализованным только на слизистой оболочке, структура и функция которой может быть полностью восстановлена после выздоровления. Данное заболевание может возникнуть в любом возрасте, и возникает преимущественно весной и зимой. В традиционной китайской медицине бронхит относится к категориям «кашель», «скопление жидкости и флегмы», «астматический синдром» и т.д.
Острый трахеобронхит часто вызван инфицированием верхних дыхательных путей вирусами или бактериями, или физико-химическими аллергическими раздражителями. Среди пациентов старше 10 лет, страдающих от острого трахеобронхита, наиболее распространенными инфекциями являются вирус гриппа, респираторно-синцитиальный вирус и аденовирус. Данное заболевание также является одним из наиболее распространенных внебольничных заболеваний и одним из десяти заболеваний, при котором больные в наибольшей степени нуждаются в проведении медицинского лечения. В 1998 году медицинское лечение получили 2,5 миллиона американцев, страдавших данным заболеванием. Пациенты вынуждены обращаться в стационарные медицинские учреждения и получать лечение из-за того, что их нормальная работоспособность и образ жизни нарушаются в связи с частым кашлем. Затраты на лечение острого трахеобронхита являются значительными. В среднем каждый пациент может получать лечение с помощью двух лекарственных средств и быть не в состоянии нормально работать от 2 до 3 недель.
Данное заболевание связано с различными этиологическими факторами. Заболевание может быть вызвано прямым инфицированием вирусами или бактериями, или инфицированием вирусами или бактериями, распространившимися из зоны острой инфекции верхних дыхательных путей, а также может быть вызвано острым раздражением трахеально-бронхиальной слизистой оболочки, обусловленным такими факторами, как слишком холодный воздух, пыль, раздражающий газ или испарения, или аллерген-индуцированным аллергическим воспалительным ответом в трахее и бронхах. В настоящее время терапия Западной медицины направлена на симптоматическое лечение и инфекционный контроль. В «Руководстве по рациональному применению антибиотиков при острых заболеваниях дыхательных путей (для испытаний)», выпущенном в 2000 году специальной группой по изучению респираторных заболеваний Общества педиатров Медицинской Ассоциации Китая, подчеркнуто, что острый трахеобронхит представляет собой заболевание, развивающееся только после заболевания верхних дыхательных путей (ЗВДП), при котором обычно происходит злоупотребление антибиотиками. За пределами Китая острый трахеобронхит относят к болезням, сопровождаемым кашлем, и главный этиологический фактор заболевания определяют как вирусы или реактивные заболевания дыхательных путей. Таким образом, пациент с продолжительностью заболевания менее 7 дней редко имеет показания к применению антибиотикотерапии. Кроме того, в связи с широким применением антибактериальных средств постоянно появляются штаммы, устойчивые к воздействию лекарств, и часть болезнетворных бактерий проявляют множественную устойчивость к различным антибактериальным средствам, что влечет низкую эффективность антибиотиков по отношению к инфекции.
В традиционной китайской медицине лечение острого трахеобронхита имеет довольно длинную историю. Систематическое обсуждение вопросов, связанных с кашлем, таких как патогенез, классификация симптомов и синдромов, результат болезни и лечение, можно найти еще в «Трактате о внутреннем» императора Хуанди. В рамках традиционной китайской медицины непрерывное исследование, направленное на выявление первопричин, способов, рецептов и лекарственных средств для лечения кашля, проводится врачами на протяжении многих поколений. Как показали современные фармакологические исследования, лечение кашля в рамках традиционной китайской медицины включает различные терапевтические подходы. В традиционной китайской медицине лекарство, приготовленное согласно определенному рецепту, может не только останавливать кашель, удалять флегму, облегчать дыхание, но и способен «чистить» жар, облегчать боль и препятствовать воспалению, а также значительно ослаблять такие симптомы, как кашель и выделение мокроты. Кроме того, данное лекарство имеет меньше побочных эффектов по сравнению с западными лекарственными средствами и подходит для случаев, когда нет показаний к антибиотикотерапии, и в особенности подходит для случаев проявления множественной устойчивости к антибиотикам.
Таким образом, по-прежнему существует потребность в разработке новых рецептов традиционной китайской медицины для лечения острого трахеобронхита.
Краткое описание изобретения
Для удовлетворения вышеуказанной потребности согласно настоящему изобретению предложены фармацевтическая композиция для лечения бронхита, содержащая EPHEDRAE HERBA (траву эфедры), и способ ее получения. Фармацевтическая композиция согласно настоящему изобретению приготовлена из лекарственных материалов в следующих долях по массе:
|
Фармацевтическая композиция согласно настоящему изобретению предпочтительно приготовлена из лекарственных материалов в следующих долях по массе:
|
Более предпочтительно, фармацевтическая композиция согласно настоящему изобретению приготовлена из лекарственных материалов в следующих долях по массе:
|
Как вариант, фармацевтическая композиция приготовлена из лекарственных материалов в следующих долях по массе:
|
Как вариант, фармацевтическая композиция приготовлена из лекарственных материалов в следующих долях по массе:
|
Как вариант, фармацевтическая композиция приготовлена из лекарственных материалов в следующих долях по массе:
|
В лекарственных материалах, применяемых в фармацевтической композиции согласно настоящему изобретению, PINELLIAE RHIZOMA (корневище пинеллии) предпочтительно представляет собой PINELLIAE RHIZOMA PRAEPARATUM CUM ALUMINE, a ARMENIACAE SEMEN AMARUM (семена абрикоса) предпочтительно представляют собой ARMENIACAE SEMEN AMARUM TOSTUM (латинское название соответствует стандарту Китайских травяных препаратов (Standard of Chinese Herbal Pieces) провинции Шаньси, февраль 2008).
В фармацевтической композиции согласно настоящему изобретению EPHEDRAE HERBA и GYPSUM FIBROSUM (сырой гипс) представляют собой основные лекарственные средства. EPHEDRAE HERBA является «теплой» по природе, острой и горькой на вкус и входит в каналы легких и мочевого пузыря. В травнике Шэнь-Нуна указано, что «EPHEDRAE HERBA ослабляет внешний синдром с помощью потоотделения, чистит жар как патогенную ци и останавливает кашель с астмой». Также в Justice Materia medica указано, что «EPHEDRAE HERBA является легкой, очищающей и подвижной по природе, преимущественно удаляет застой в легких и обеспечивает функциональную активность ци и является наиболее важным лекарственным средством для лечения холода. Несмотря на то, что с помощью EPHEDRAE HERBA предлагают облегчать внешнее состояние, фактически данное средство вентилирует легкие. Несмотря на то, что с помощью EPHEDRAE HERBA предлагают рассеивать холод, фактически данное средство устраняет патогенные факторы. Таким образом, с помощью EPHEDRAE HERBA ветер-холод всегда рассеивают во внешнюю среду, то есть тепло-жар всегда вызывают с помощью EPHEDRAE HERBA.» В рецепте EPHEDRAE HERBA применяют для вентиляции легких, тем самым обеспечивая циркуляцию застойной ци в легких, и для чистки жара в сочетании с GYPSUM FIBROSUM. GYPSUM FIBROSUM является острым и сладким на вкус, холодным по природе и входит в каналы легких и желудка. В «Бэнь цао цзин шу» указано, что «острый вкус GYPSUM FIBROSUM может быть полезен для освобождения мышц, а сладкий вкус для снижения патогенного жара. Таким образом, GYPSUM FIBROSUM может быть применен для устранения тяжелого жара из-за собственного сильного холода и острого и сладкого вкуса.» GYPSUM FIBROSUM преимущественно чистит жар и удаляет огонь и может быть полезен для чистки жара в легких в сочетании с EPHEDRAE HERBA. Если жар очищен, флегма уже не будет вырабатываться. Поскольку EPHEDRAE HERBA и GYPSUM FIBROSUM совместимы друг с другом при вентиляции легких и чистке жара, они выступают вместе в качестве основных лекарственных средств.
В фармацевтической композиции согласно настоящему изобретению FORSYTHIAE FRUCTUS (плоды форзиции), SCUTELLARIAE RADIX (корень шлемника), MORI CORTEX (кора шелковицы), ARMENIACAE SEMEN AMARUM и PEUCEDANI RADIX (корень горичника) представляют собой содействующие лекарственные средства. FORSYTHIAE FRUCTUS являются горькими на вкус и «холодными» по природе. Данное средство, действуя наружно, может освобождать мышцы и внешнее и, действуя изнутри, чистить застойный жар, «имеет способность к движению и рассеиванию… может устранять наружные синдромы через мышцы, чистить жар и изгонять ветер. Данное лекарство является существенным для устранения такого патогенного фактора, как ветер-жар» (Yi Xue Zhong Zhong Can Xi Lu). В рецепте востребованы такие функции FORSYTHIAE FRUCTUS, как чистка жара, детоксикация, чистка легких и впускание внешнего. SCUTELLARIAE RADIX является горьким на вкус, «холодным» по природе, входит в канал легких, влияет на чистку жара и сушку влаги, дренирует огонь для обеспечения детоксикации. SCUTELLARIAE RADIX преимущественно чистит жар в легких, так что Дан Си утверждал, что «поскольку SCUTELLARIAE RADIX служит для снижения флегмы, данное средство может быть применено для изгнания огня». С помощью GYPSUM FIBROSUM будет усилен эффект очистки жара в легких. MORI CORTEX является сладкой на вкус, «холодной» по природе и входит в каналы легких и селезенки. MORI CORTEX свойственны функции очистки легких и растворения флегмы, а также опускание ци и облегчения астмы, которые описаны в Bie Lu как «удаление влаги из легких, устранение отхаркивания крови, жажды, возникшей в результате лихорадки, отечности и ощущения переполнения желудка, вздутия живота, регулирование водных путей и удаление тений». SCUTELLARIAE RADIX и MORI CORTEX усиливают действие GYPSUM FIBROSUM при очистке флегмы-жара в легких. ARMENIACAE SEMEN AMARUM являются слабо теплыми по природе, слегка горьковатыми на вкус, входят в каналы легких и толстого кишечника и служат для остановки кашля и облегчения астмы. ARMENIACAE SEMEN AMARUM эффективны при остановке кашля, и облегчении астмы с помощью очищения, и направлении ци вниз, «преимущественно при направлении ци вниз, при этом, пока ци направлена вниз, изгоняется флегма и останавливается кашель» (Ben Cao Bian Du). PEUCEDANI RADIX является горьким и острым на вкус, прохладным по природе, входит в меридиан легких и служит для направления ци вниз, рассеивания флегмы и чистки ветра-жара. В сборнике Materia Medica данные свойства были описаны как «чистка жара в легких, устранение флегмы-жара, рассеивание патогенного ветра», и далее указано, что «данное средство преимущественно направляет ци вниз и, таким образом, может быть применено для лечения таких заболеваний, как астматический кашель, вызываемый флегмой-жаром и спазм диафрагмы с икотой. Когда ци направлена вниз, уничтожается огонь и растворяется флегма». Сочетание ARMENIACAE SEMEN AMARUM и PEUCEDANI RADIX (действующих как понижающие) с EPHEDRAE HERBA (действующей как повышающая) усиливает рассеивающую и опускающую функции легких. Данные пять трав действуют совместно как содействующие лекарственные средства, помогающие усилить влияние основных лекарственных средств на чистку жара в легких путем освобождения и внутреннего, и внешнего и на опускание ци и рассеивание флегмы.
В фармацевтической композиции согласно настоящему изобретению PINELLIAE RHIZOMA, CITRI RETICULATAE PERICARPIUM (околоплодник мандарина), FRITILLARIAE THUNBERGII BULBUS (луковица рябчика Тунберга), ARCTII FRUCTUS (плоды лопуха), LONICERAE FLOS (жимолость японская) и RHEI RADIX ET RHIZOMA (корневище и корень ревеня) представляют собой вспомогательные лекарственные средства. PINELLIAE RHIZOMA является острой на вкус, «теплой» по природе, служит для устранения влаги путем сушки, растворения флегмы и уравновешивает повышенную негативную энергию. В Yao Xing Lun указано, что PINELLIAE RHIZOMA преимущественно «рассеивает флегму, опускает ци легких, повышает аппетит и тонизирует селезенку и рассеивает избыток флегмы в груди», то есть PINELLIAE RHIZOMA является основным лекарственным средством для растворения флегмы и уравновешивания избытка вредоносной энергии и направляет вредоносную энергию вниз, чтобы направить вниз движение влаги-флегмы в легких и желудке. CITRI RETICULATAE PERICARPIUM является острой и горькой на вкус, «теплой» по природе и служит для регулирования ци и растворения флегмы. «Околоплодник мандарина (CITRI RETICULATAE PERICARPIUM) в основном действует на скапливающийся жар и вредоносный поток ци в груди,...острый вкус способен рассеивать, горький вкус способен чистить, и тепло имеет свойство перемещать, таким образом опуская избыток вредоносной ци, предотвращая рвоту и останавливая кашель, в конечном итоге рассеивая скапливающийся жар в груди (Ben Cao Jing Shu)». CITRI RETICULATAE PERICARPIUM является обычной травой для лечения застоя влаги-флегмы, нарушения рассевающей и опускающей функций легких, кашля, избытка флегмы и течения ци в обратном направлении. Сочетание PINELLIAE RHIZOMA и CITRI RETICULATAE PERICARPIUM помогает усилить действие основных и содействующих лекарственных средств при растворении флегмы. FRITILLARIAE THUNBERGII BULBUS является горькой на вкус, «холодной» по природе, входит в каналы легких и сердца и часто применяется для лечения кашля, порождаемого застоем флегмы-жара, из-за большей горечи и холодности данного средства, сильной способности к чистке, более сильным действием при чистке огня и рассеивании масс. Данное средство применяют в рецепте для того, чтобы помогать ARMENIACAE SEMEN AMARUM и PEUCEDANI RADIX растворять флегму и останавливать кашель. ARCTII FRUCTUS являются острыми на вкус, прохладными по природе и преимущественно рассеивают патогенный ветер-жар, и в Ben Cao Jing Shu указано, что это «без преувеличения первая трава для рассеивания ветра, устранения жара и детоксикации». LONICERAE FLOS является холодной по природе и обладает способностью к чистке жара и детоксикации. В Chong Qing Tang Sui Bi указано, что «LONICERAE FLOS чистит ветер-огонь и избыток жара в коллатералях и изгоняет пороки, такие как язва, грязное и мутное». Данная трава входит в канал легких и обладает способностью к чистке жара и детоксикации, а также чистке легких и стимулированию потоотделения. Будучи острой на вкус, холодной и не оказывающей негативного влияния на инь, LONICERAE FLOS помогает FORSYTHIAE FRUCTUS добиться потоотделения, очистки от жара и детоксикации. RHEI RADIX ET RHIZOMA горькие на вкус, холодные по природе, служат для устранения непроходимости кишечника и чистки жара. Из-за того, что легкие и толстая кишка образуют наружно-внутреннюю взаимосвязь, при внезапном опускании ци легких ци кишечника очищается. Таким образом, сочетание RHEI RADIX ET RHIZOMA и EPHEDRAE HERBA приводит к освобождению и внутреннего, и внешнего.
В фармацевтической композиции согласно настоящему изобретению PLATYCODONIS RADIX (корень платикодона) и GLYCYRRHIZAE RADIX ET RHIZOMA (корневище и корень солодки) представляют собой направляющие лекарственные средства. PLATYCODONIS RADIX служит для чистки ци легких и рассеивания флегмы и тем самым помогает EPHEDRAE HERBA чистить ци легких. Кроме того, «PLATYCODONIS RADIX представляет собой траву для чистки и подъема ци легких и способен выступать в качестве переносчика различных трав» (Ben Cao Qiu Zhen). Данная трава перемещает различные травяные ингредиенты к месту локализации патологии, тем самым выполняя функцию вспомогательно-направляющего лекарственного средства. GLYCYRRHIZAE RADIX ET RHIZOMA применяют в неочищенном состоянии по двум причинам. Первая причина заключается в том, что GLYCYRRHIZAE RADIX ET RHIZOMA в качестве вспомогательного лекарственного средства являются сладкими и нейтральными по природе, могут входить в канал легких и достигают эффекта увлажнения легких, остановки кашля и облегчения астмы. Вторая причина заключается в том, что в качестве направляющего средства «GLYCYRRHIZAE RADIX ET RHIZOMA играют роль главного координатора различных трав» и могут регулировать действие лекарственных средств в рецепте, и таким образом служат в качестве вспомогательного и направляющего лекарственного средства.
В заключение необходимо отметить, что комбинированное применение лекарственных веществ, составляющих фармацевтическую композицию, согласно настоящему изобретению вызывает чистку флегмы-жара в легких, рассеивание застоя ци легких и нормализацию рассевающей и опускающей функций легких, тем самым устраняя флегму и останавливая кашель.
В свете настоящего изобретения и в комбинации с общими принципами в данной области специалисты могут заменить любой из отдельных компонентов фармацевтической композиции согласно настоящему изобретению на другой китайский лекарственный материал, имеющий одинаковое или похожее действие в качестве компонента настоящей фармацевтической композиции.
Фармацевтическая композиция согласно настоящему изобретению может быть получена с помощью традиционного способа получения, известного в данной области. Например, различные лекарственные вещества могут быть обработаны в соответствии со «Стандартом обработки веществ традиционной китайской медицины» или «Справочником традиционной китайской медицины». Фармацевтическая композиция согласно настоящему изобретению предпочтительно может быть получена следующим способом, согласно которому:
(1) взвешивают FRITILLARIAE THUNBERGII BULBUS в соответствии с долей, определенной в рецепте, и измельчают указанный материал в мелкий порошок для дальнейшего применения;
(2) взвешивают EPHEDRAE HERBA, FORSYTHIAE FRUCTUS, SCUTELLARIAE RADIX, ARMENIACAE SEMEN AMARUM, PINELLIAE RHIZOMA, ARCTII FRUCTUS и RHEI RADIX ET RHIZOMA в соответствии с долями, определенными в рецепте, и указанные материалы дважды подвергают экстракции 40-70% раствором этанола при кипячении с обратным холодильником, каждый раз в течение 1-4 часов, причем отношение количества раствора этанола к массе лекарственных материалов может составлять 8-10 об./масс. (мл/г) при первой экстракции и 6-9 об./масс. (мл/г) при второй экстракции; объединяют экстракты, а затем фильтруют смешанный раствор; выделяют этанол из фильтрата при пониженном давлении и в то же время концентрируют фильтрат с получением прозрачной пасты с относительной плотностью 1,14-1,16, термически измеренной при 60°С, для дальнейшего применения;
(3) взвешивают GYPSUM FIBROSUM, MORI CORTEX, PEUCEDANI RADIX, CITRI RETICULATAE PERICARPIUM, LONICERAE FLOS, PLATYCODONIS RADIX и GLYCYRRHIZAE RADIX ET RHIZOMA в соответствии с долями, определенными в рецепте, и указанные материалы дважды настаивают в воде, каждый раз в течение 1-4 часов, причем отношение количества воды к массе лекарственных материалов может составлять 9-11 об./масс. (мл/г) при первом настаивании и 7-9 об./масс. (мл/г) при втором настаивании; затем настои объединяют и фильтруют, концентрируют фильтрат при пониженном давлении с получением прозрачной пасты с относительной плотностью 1,14-1,16, термически измеренной при 60°С, и объединяют указанную прозрачную пасту с прозрачной пастой, полученной на этапе (2), для дальнейшего применения.
Мелкий порошок, полученный на этапе (1), и объединенная прозрачная паста, полученная на этапе (3), представляют собой активные компоненты фармацевтической композиции.
Дозированные формы фармацевтической композиции согласно изобретению могут представлять собой твердую капсулу, таблетку, порошок, жидкость для перорального применения, мягкую капсулу, пилюлю, настойку, сироп, суппозиторий, гель, спрей или форму для инъекций.
Дозированные формы для препарата согласно настоящему изобретению могут быть получены в виде фармацевтически приемлемых традиционных дозированных форм обычным способом, известным в данной области, например таким, как способ получения, описанный в Pharmaceutics of Chinese Medicine, Fan Biting (редактор), 1997 год, Шанхайское научно-техническое издательство.
При разработке различных фармацевтических средств согласно настоящему изобретению специалисты могут добавить любой из фармацевтически приемлемых вспомогательных материалов в зависимости от дозированных форм различных лекарственных средств согласно настоящему изобретению и в соответствии с общими принципами в данной области, например, вспомогательные материалы включают наполнитель, разрыхлитель, смазывающее вещество, суспендирующий агент, связующее, вкусовую добавку, ароматизатор, консервант, матрицу или любые их смеси, но не ограничены только ими. Наполнитель включает крахмал, прежелатинизированный крахмал, лактозу, маннитол, хитин, микрокристаллическую целлюлозу, сахарозу или любые их смеси, но не ограничен ими. Разрыхлители включают крахмал, прежелатинизированный крахмал, микрокристаллическую целлюлозу, карбоксиметилкрахмал натрия, поперечно-связанный поливинилпирролидон, низкозамещенную гидроксипропилцеллюлозу, поперечно-связанную натриевую соль карбоксиметилцеллюлозы или любые их смеси, но не ограничен только ими. Смазывающее вещество включает стеарат магния, лаурилсульфат натрия, тальк, диоксид кремния или любые их смеси, но не ограничено только ими. Суспендирующий агент включает поливинилпирролидон, микрокристаллическую целлюлозу, сахарозу, агар, гидроксипропилметилцеллюлозу или любые их смеси, но не ограничено ими. Связующее включает крахмальную суспензию, поливинилпирролидон, гидроксипропилметилцеллюлозу или любые их смеси, но не ограничено только ими. Подсластитель включает сахарин натрия, аспартам, сахарозу, цикламат натрия, глицирретиновую кислоту или любые их смеси, но не ограничен только ими. Вкусовая добавка включает подсластители, различные эссенции или любые их смеси, но не ограничен только ими. Консервант включает парабены, бензойную кислоту, бензоат натрия, сорбиновую кислоту и ее соли, бензалкония бромид, хлоргексидина ацетат, эвкалиптовое масло или любые их смеси, но не ограничен ими. Матрица включает ПЭГ-6000, ПЭГ-4000, воск насекомых или любые их смеси, но не ограничена ими. Чтобы получить вышеописанные дозированные формы в соответствии с фармацевтикой традиционной китайской медицины, при получении данных дозированных форм могут быть дополнительно добавлены другие вспомогательные материалы, которые являются фармацевтически приемлемыми (например, вспомогательные материалы для различных лекарственных форм, описанные в Pharmaceutics of Chinese Medicine, Fan Biting (редактор), 1997 год, Шанхайское научно-техническое издательство).
В предпочтительном варианте реализации изобретения фармацевтическую композицию получают следующим способом, согласно которому:
(1) взвешивают FRITILLARIAE THUNBERGII BULBUS в соответствии с долей, определенной в рецепте, и измельчают указанный материал в мелкий порошок для дальнейшего применения;
(2) взвешивают EPHEDRAE HERBA, FORSYTHIAE FRUCTUS, SCUTELLARIAE RADIX, ARMENIACAE SEMEN AMARUM, PINELLIAE RHIZOMA, ARCTII FRUCTUS и RHEI RADIX ET RHIZOMA в соответствии с долями, определенными в рецепте, и указанные материалы дважды подвергают экстракции 40-70% раствором этанола при кипячении с обратным холодильником, каждый раз в течение 1-4 часов, причем отношение количества раствора этанола 5 к массе лекарственных материалов может составлять 8-10 об./масс. (мл/г) при первой экстракции и 6-9 об./масс. (мл/г) при второй экстракции; объединяют экстракты и фильтруют смешанный раствор; выделяют этанол из фильтрата при пониженном давлении и в то же время концентрируют фильтрат с получением прозрачной пасты с относительной плотностью 1,14-1,16, термически измеренной 10 при 60°С, для дальнейшего применения;
(3) взвешивают GYPSUM FIBROSUM, MORI CORTEX, PEUCEDANI RADIX, CITRI RETICULATAE PERICARPIUM, LONICERAE FLOS, PLATYCODONIS RADIX и GLYCYRRHIZAE RADIX ET RHIZOMA в соответствии с долями, определенными в рецепте, и указанные материалы дважды настаивают в воде, каждый раз в течение 1-4 часов, причем отношение количества добавленной воды к массе лекарственных материалов может составлять 9-11 об./масс. (мл/г) при первом настаивании и 7-9 об./масс. (мл/г) при втором настаивании; затем настои объединяют и фильтруют смешанный раствор, концентрируют фильтрата при пониженном давлении с получением прозрачной пасты с относительной плотностью 1,14-1,16, термически измеренной при 60°С, и объединяют указанную прозрачную пасту с прозрачной пастой, полученной на этапе (2), для дальнейшего применения;
(4) объединенные прозрачные пасты, полученные на этапе (3), сушат распылительной сушкой, и распыленный порошок собирают для дальнейшего применения;
(5) обеспечивают следующие материалы для таблетирования (доли по массе):
|
(6) осуществляют таблетирование в соответствии с традиционным способом приготовления.
В дополнительном предпочтительном варианте реализации изобретения фармацевтическую композицию получают следующим способом, согласно которому:
(1) взвешивают FRITILLARIAE THUNBERGII BULBUS в соответствии с долей, определенной в рецепте, и измельчают указанный материал в мелкий порошок для последующего применения;
(2) взвешивают EPHEDRAE HERBA, FORSYTHIAE FRUCTUS, SCUTELLARIAE RADIX, ARMENIACAE SEMEN AMARUM, PINELLIAE RHIZOMA, ARCTII FRUCTUS и RHEI RADIX ET RHIZOMA в соответствии с долями, определенными в рецепте, и указанные материалы дважды подвергают экстракции 50% раствором этанола при кипячении с обратным холодильником, каждый раз в течение 3 часов, причем отношение количества раствора этанола к массе лекарственных материалов составляет 10 об./масс. (мл/г) при первой экстракции и 6 об./масс. (мл/г) при второй экстракции; объединяют экстракты и фильтруют смешанный раствор; выделяют этанол из фильтрата при пониженном давлении и в то же время концентрируют фильтрат с получением прозрачной пасты с относительной плотностью 1,15, термически измеренной при 60°С, для дальнейшего применения;
(3) взвешивают GYPSUM FIBROSUM, MORI CORTEX, PEUCEDANI RADIX, CITRI RETICULATAE PERICARPIUM, LONICERAE FLOS, PLATYCODONIS RADIX и GLYCYRRHIZAE RADIX ET RHIZOMA в соответствии с долями, определенными в рецепте, и указанные материалы дважды настаивают в воде, каждый раз в течение 2 часов, причем отношение количества добавленной воды к массе лекарственных материалов составляет 10 об./масс. (мл/г) при первом настаивании и 7 об./масс. (мл/г) при втором настаивании; затем настои объединяют и фильтруют смешанный раствор, концентрируют фильтрат при пониженном давлении с получением прозрачной пасты с относительной плотностью 1,15, термически измеренной при 60°C, и объединяют указанную прозрачную пасту с прозрачной пастой, полученной на этапе (2), для дальнейшего применения;
(4) объединенные прозрачные пасты, полученные на этапе (3), сушат распылительной сушкой, и распыленный порошок собирают для дальнейшего применения;
(5) обеспечивают следующие материалы для таблетирования (доли по массе):
|
(6) осуществляют таблетирование в соответствии с традиционным способом приготовления.
Фармацевтическая композиция согласно настоящему изобретению была получена на основе теории заболеваний коллатералей в традиционной китайской медицине в сочетании с современными медицинскими исследованиями в области этиологии и патогенеза бронхита, а также результатами современных фармакологических исследований, связанными с анализом составляющих композицию трав, и клинической практикой. Фармацевтическая композиция способна чистить жар в легких, растворять флегму и останавливать кашель и оказывает хороший эффект при лечении бронхита, в частности отличный эффект при лечении острого трахеобронхита.
Было экспериментально показано, что лекарство согласно настоящему изобретению способно останавливать кашель, рассеивать флегму, облегчать астму, ослаблять жар и препятствовать воспалению и, в частности, оказывает отличный эффект при лечении острого трахеобронхита. Кроме того, было экспериментально показано, что лекарство согласно настоящему изобретению не имеет побочных эффектов и является безопасным.
Подробное описание изобретения
Настоящее изобретение будет дополнительно проиллюстрировано следующими Примерами и Примерами испытаний, которые в любом случае не ограничивают рамки настоящего изобретения.
Пример 1
Способ получения лекарства согласно настоящему изобретению в форме таблеток (таблетки предварительно названы Lian Hua Ji Zhi).
Рецепт:
|
Способ получения:
(1) FRITILLARIAE THUNBERGII BULBUS взвешивали в соответствии с массой, указанной в рецепте, и измельчали в мелкий порошок для дальнейшего применения;
(2) EPHEDRAE HERBA, FORSYTHIAE FRUCTUS, SCUTELLARIAE RADIX, ARMENIACAE SEMEN AMARUM, PINELLIAE RHIZOMA, ARCTII FRUCTUS и RHEI RADIX ET RHIZOMA взвешивали в соответствии с массой, указанной в рецепте, и дважды подвергали экстракции 60% раствором этанола при кипячении с обратным холодильником, каждый раз в течение 2 часов, причем отношение количества раствора этанола к массе лекарственных материалов составляло 9 об./масс. (мл/г) при первой экстракции и 8 об./масс. (мл/г) при второй экстракции; экстракты объединяли и фильтровали; из фильтрата выделяли этанол при пониженном давлении, и концентрировали фильтрат с образованием прозрачной пасты с относительной плотностью 1,14-1,16, термически измеренной при 60°С, для дальнейшего применения;
(3) GYPSUM FIBROSUM, MORI CORTEX, PEUCEDANI RADIX, CITRI RETICULATAE PERICARPIUM, LONICERAE FLOS, PLATYCODONIS RADIX и GLYCYRRHIZAE RADIX ET RHIZOMA взвешивали в соответствии с массой, указанной в рецепте, и дважды настаивали в воде, каждый раз в течение 2 часов, причем отношение количества воды к массе лекарственных материалов составляло 10 об./масс. (мл/г) при первом настаивании и 7 об./масс. (мл/г) при втором настаивании; затем настои объединяли, фильтровали, а фильтрат концентрировали при пониженном давлении с образованием прозрачной пасты с относительной плотностью 1,15, термически измеренной при 60°C, которую объединяли с прозрачной пастой, полученной на этапе (2), для дальнейшего применения;
(4) объединенную прозрачную пасту, полученную на этапе (3), подвергали распылительной сушке, и распыленный порошок собирали для последующего применения;
(5) сырье, примененное для таблетирования, состоит из следующих лекарственных веществ (доли по массе):
распыленный порошок, полученный на этапе (4) - 285,5;
необработанный порошок, полученный на этапе (1) - 105,4;
карбоксиметилкрахмал натрия - 12,5;
микрокристаллическая целлюлоза - 8,5;
стеарат магния - 2,45;
крахмал - необходимое количество;
(6) таблетки были получены в соответствии с традиционным способом приготовления.
Пример 2.
Способ получения лекарства согласно настоящему изобретению в форме капсул
Рецепт:
|
Способ получения:
(1) FRITILLARIAE THUNBERGII BULBUS взвешивали в соответствии с массой, указанной в рецепте, и измельчали в мелкий порошок для дальнейшего применения;
(2) EPHEDRAE HERBA, FORSYTHIAE FRUCTUS, SCUTELLARIAE RADIX, ARMENIACAE SEMEN AMARUM, PINELLIAE RHIZOMA, ARCTII FRUCTUS и RHEI RADIX ET RHIZOMA взвешивали в соответствии с массой, указанной в рецепте, и дважды подвергали экстракции 50% раствором этанола при кипячении с обратным холодильником, каждый раз в течение 2 часов, причем отношение количества раствора этанола к массе лекарственных материалов составляло 8 об./масс. (мл/г) при первой экстракции и 6 об./масс. (мл/г) при второй экстракции; экстракты объединяли и фильтровали; из фильтрата выделяли этанол при пониженном давлении, и концентрировали фильтрат с образованием прозрачной пасты с относительной плотностью 1,14-1,16, термически измеренной при 60°С, для дальнейшего применения;
(3) GYPSUM FIBROSUM, MORI CORTEX, PEUCEDANI RADIX, CITRI RETICULATAE PERICARPIUM, LONICERAE FLOS, PLATYCODONIS RADIX и GLYCYRRHIZAE RADIX ET RHIZOMA взвешивали в соответствии с массой, указанной в рецепте, и дважды настаивали в воде, каждый раз в течение 2 часов, причем отношение количества воды к массе лекарственных материалов составляло 9 об./масс. (мл/г) при первом настаивании и 7 об./масс. (мл/г) при втором настаивании; затем настои объединяли, фильтровали, фильтрат концентрировали при пониженном давлении с образованием прозрачной пасты с относительной плотностью 1,14, термически измеренной при 60°С, которую объединяли с прозрачной пастой, полученной на этапе (2), для дальнейшего применения;
(4) капсулы были получены в соответствии с традиционным способом приготовления.
Пример 3.
Способ получения лекарства согласно настоящему изобретению в форме порошка
Рецепт:
|
Способ получения:
(1) FRITILLARIAE THUNBERGII BULBUS взвешивали в соответствии с массой, указанной в рецепте, и измельчали в мелкий порошок для дальнейшего применения;
(2) EPHEDRAE HERBA, FORSYTHIAE FRUCTUS, SCUTELLARIAE RADIX, ARMENIACAE SEMEN AMARUM, PINELLIAE RHIZOMA, ARCTII FRUCTUS и RHEI RADIX ET RHIZOMA взвешивали в соответствии с массой, указанной в рецепте, и дважды подвергали экстракции 50% раствором этанола при кипячении с обратным холодильником, каждый раз в течение 2 часов, причем отношение количества раствора этанола к массе лекарственных материалов составляло 8 об./масс. (мл/г) при первой экстракции и 7 об./масс. (мл/г) при второй экстракции; экстракты объединяли и фильтровали; из фильтрата выделяли этанол при пониженном давлении, и концентрировали фильтрат с образованием прозрачной пасты с относительной плотностью 1,14-1,16, термически измеренной при 60°С, для дальнейшего применения;
(3) GYPSUM FIBROSUM, MORI CORTEX, PEUCEDANI RADIX, CITRI RETICULATAE PERICARPIUM, LONICERAE FLOS, PLATYCODONIS RADIX и GLYCYRRHIZAE RADIX ET RHIZOMA взвешивали в соответствии с массой, указанной в рецепте, и дважды настаивали в воде, каждый раз в течение 2 часов, причем отношение количества добавленной воды к массе лекарственных материалов составляло 9 об./масс. (мл/г) при первом настаивании и 8 об./масс. (мл/г) при втором настаивании; затем настои объединяли, фильтровали, фильтрат концентрировали при пониженном давлении с образованием прозрачной пасты с относительной плотностью 1,14, термически измеренной при 60°С, и объединяли с прозрачной пастой, полученной на этапе (2), для дальнейшего применения;
(4) порошок был получен в соответствии с традиционным способом приготовления.
Пример 4.
Способ получения лекарства согласно настоящему изобретению в форме жидкости для перорального применения
Рецепт:
|
Способ получения:
(1) FRITILLARIAE THUNBERGII BULBUS взвешивали в соответствии с массой, указанной в рецепте, и измельчали в мелкий порошок для дальнейшего применения;
(2) EPHEDRAE HERBA, FORSYTHIAE FRUCTUS, SCUTELLARIAE RADIX, ARMENIACAE SEMEN AMARUM, PINELLIAE RHIZOMA, ARCTII FRUCTUS и RHEI RADIX ET RHIZOMA взвешивали в соответствии с массой, указанной в рецепте, и дважды подвергали экстракции 40% раствором этанола при кипячении с обратным холодильником, каждый раз в течение часа, причем отношение количества раствора этанола к массе лекарственных материалов составляло 8 об./масс. (мл/г) при первой экстракции и 6 об./масс. (мл/г) при второй экстракции; экстракты объединяли и фильтровали; из фильтрата выделяли этанол при пониженном давлении, и концентрировали фильтрат с образованием прозрачной пасты с относительной плотностью 1,14-1,16, термически измеренной при 60°C, для дальнейшего применения;
(3) GYPSUM FIBROSUM, MORI CORTEX, PEUCEDANI RADIX, CITRI RETICULATAE PERICARPIUM, LONICERAE FLOS, PLATYCODONIS RADIX и GLYCYRRHIZAE RADIX ET RHIZOMA взвешивали в соответствии с массой, указанной в рецепте, и дважды настаивали в воде, каждый раз в течение часа, причем отношение количества добавленной воды к массе лекарственных материалов составляло 9 об./масс. (мл/г) при первом настаивании и 7 об./масс. (мл/г) при втором настаивании; затем настои объединяли, фильтровали, фильтрат концентрировали при пониженном давлении с образованием прозрачной пасты с относительной плотностью 1,14-1,16, термически измеренной при 60°C, и объединяли с прозрачной пастой, полученной на этапе (2), для дальнейшего применения;
из мелкого порошка, полученного на этапе (1), и объединенных прозрачных паст, полученных на этапе (3), была получена жидкость для перорального применения в соответствии с традиционным способом приготовления.
Пример 5.
Способ получения лекарства согласно настоящему изобретению в форме мягких капсул
Рецепт:
|
Способ получения:
(1) FRITILLARIAE THUNBERGII BULBUS взвешивали в соответствии с массой, указанной в рецепте, и измельчали в мелкий порошок для дальнейшего применения;
(2) EPHEDRAE HERBA, FORSYTHIAE FRUCTUS, SCUTELLARIAE RADIX, ARMENIACAE SEMEN AMARUM, PINELLIAE RHIZOMA, ARCTII FRUCTUS и RHEI RADIX ET RHIZOMA взвешивали в соответствии с массой, указанной в рецепте, и дважды подвергали экстракции 70% раствором этанола при кипячении с обратным холодильником, каждый раз в течение 4 часов, причем отношение количества раствора этанола к массе лекарственных материалов составляло 10 об./масс. (мл/г) при первой экстракции и 9 об./масс. (мл/г) при второй экстракции; экстракты объединяли и фильтровали; из фильтрата выделяли этанол при пониженном давлении, и концентрировали фильтрат с образованием прозрачной пасты с относительной плотностью 1,14-1,16, термически измеренной при 60°C, для дальнейшего применения;
(3) GYPSUM FIBROSUM, MORI CORTEX, PEUCEDANI RADIX, CITRI RETICULATAE PERICARPIUM, LONICERAE FLOS, PLATYCODONIS RADIX и GLYCYRRHIZAE RADIX ET RHIZOMA взвешивали в соответствии с массой, указанной в рецепте, и дважды настаивали в воде, каждый раз в течение 4 часов, причем отношение количества добавленной воды к массе лекарственных материалов составляло 11 об./масс. (мл/г) при первом настаивании и 9 об./масс. (мл/г) при втором настаивании; затем настои объединяли, фильтровали, фильтрат концентрировали при пониженном давлении с образованием прозрачной пасты с относительной плотностью 1,14-1,16, термически измеренной при 60°C, и объединяли с прозрачной пастой, полученной на этапе (2), для дальнейшего применения;
из мелкого порошка, полученного на этапе (1), и объединенных прозрачных паст, полученных на этапе (3), были получены мягкие капсулы в соответствии с традиционным способом приготовления.
Пример 6.
Способ получения лекарства согласно настоящему изобретению в форме пилюль
Рецепт:
|
Способ получения:
(1) FRITILLARIAE THUNBERGII BULBUS взвешивали в соответствии с массой, указанной в рецепте, и измельчали в мелкий порошок для дальнейшего применения;
(2) EPHEDRAE HERBA, FORSYTHIAE FRUCTUS, SCUTELLARIAE RADIX, ARMENIACAE SEMEN AMARUM, PINELLIAE RHIZOMA, ARCTII FRUCTUS и RHEI RADIX ET RHIZOMA взвешивали в соответствии с массой, указанной в рецепте, и дважды подвергали экстракции 60% раствором этанола при кипячении с обратным холодильником, каждый раз в течение 3 часов, причем отношение количества раствора этанола к массе лекарственных материалов составляло 9 об./масс. (мл/г) при первой экстракции и 8 об./масс. (мл/г) при второй экстракции; экстракты объединяли и фильтровали; из фильтрата выделяли этанол при пониженном давлении, и концентрировали фильтрат с образованием прозрачной пасты с относительной плотностью 1,14-1,16, термически измеренной при 60°C, для дальнейшего применения;
(3) GYPSUM FIBROSUM, MORI CORTEX, PEUCEDANI RADIX, CITRI RETICULATAE PERICARPIUM, LONICERAE FLOS, PLATYCODONIS RADIX и GLYCYRRHIZAE RADIX ET RHIZOMA взвешивали в соответствии с массой, указанной в рецепте, и дважды настаивали в воде, каждый раз в течение 2,5 часов, причем отношение количества добавленной воды к массе лекарственных материалов составляло 10 об./масс. (мл/г) при первом настаивании и 8 об./масс. (мл/г) при втором настаивании; затем настои объединяли, фильтровали, фильтрат концентрировали при пониженном давлении с образованием прозрачной пасты с относительной плотностью 1,14-1,16, термически измеренной при 60°C, и объединяли с прозрачной пастой, полученной на этапе (2), для дальнейшего применения;
из мелкого порошка, полученного на этапе (1), и объединенных прозрачных паст, полученных на этапе (3), были получены пилюли в соответствии с традиционным способом приготовления.
Пример 7.
Способ получения лекарства согласно настоящему изобретению в форме настойки
Рецепт:
|
Способ получения:
(1) FRITILLARIAE THUNBERGII BULBUS взвешивали в соответствии с массой, указанной в рецепте, и измельчали в мелкий порошок для дальнейшего применения;
(2) EPHEDRAE HERBA, FORSYTHIAE FRUCTUS, SCUTELLARIAE RADIX, ARMENIACAE SEMEN AMARUM, PINELLIAE RHIZOMA, ARCTII FRUCTUS и RHEI RADIX ET RHIZOMA взвешивали в соответствии с массой, указанной в рецепте, и дважды подвергали экстракции 50% раствором этанола при кипячении с обратным холодильником, каждый раз в течение 3,5 часов, причем отношение количества раствора этанола к массе лекарственных материалов составляло 10 об./масс. (мл/г) при первой экстракции и 9 об./масс. (мл/г) при второй экстракции; экстракты объединяли и фильтровали; из фильтрата выделяли этанол при пониженном давлении, и концентрировали фильтрат с образованием прозрачной пасты с относительной плотностью 1,14-1,16, термически измеренной при 60°C, для дальнейшего применения;
(3) GYPSUM FIBROSUM, MORI CORTEX, PEUCEDANI RADIX, CITRI RETICULATAE PERICARPIUM, LONICERAE FLOS, PLATYCODONIS RADIX и GLYCYRRHIZAE RADIX ET RHIZOMA взвешивали в соответствии с массой, указанной в рецепте, и дважды настаивали в воде, каждый раз в течение 3 часов, причем отношение количества добавленной воды к массе лекарственных материалов составляло 10 об./масс. (мл/г) при первом настаивании и 7 об./масс. (мл/г) при втором настаивании; затем настои объединяли, фильтровали, фильтрат концентрировали при пониженном давлении с образованием прозрачной пасты с относительной плотностью 1,14-1,16, термически измеренной при 60°C, и объединяли с прозрачной пастой, полученной на этапе (2), для дальнейшего применения;
из мелкого порошка, полученного на этапе (1), и объединенных прозрачных паст, полученных на этапе (3), была получена настойка в соответствии с традиционным способом приготовления.
Пример 8.
Способ получения лекарства согласно настоящему изобретению в форме сиропа
Рецепт:
|
Способ получения:
(1) FRITILLARIAE THUNBERGII BULBUS взвешивали в соответствии с массой, указанной в рецепте, и измельчали в мелкий порошок для дальнейшего применения;
(2) EPHEDRAE HERBA, FORSYTHIAE FRUCTUS, SCUTELLARIAE RADIX, ARMENIACAE SEMEN AMARUM, PINELLIAE RHIZOMA, ARCTII FRUCTUS и RHEI RADIX ET RHIZOMA взвешивали в соответствии с массой, указанной в рецепте, и дважды подвергали экстракции 70% раствором этанола при кипячении с обратным холодильником, каждый раз в течение часа, причем отношение количества раствора этанола к массе лекарственных материалов составляло 8 об./масс. (мл/г) при первой экстракции и 6 об./масс. (мл/г) при второй экстракции; экстракты объединяли и фильтровали; из фильтрата выделяли этанол при пониженном давлении и концентрировали фильтрат с образованием прозрачной пасты с относительной плотностью 1,14-1,16, термически измеренной при 60°C, для дальнейшего применения;
(3) GYPSUM FIBROSUM, MORI CORTEX, PEUCEDANI RADIX, CITRI RETICULATAE PERICARPIUM, LONICERAE FLOS, PLATYCODONIS RADIX и GLYCYRRHIZAE RADIX ET RHIZOMA взвешивали в соответствии с массой, указанной в рецепте, и дважды настаивали в воде, каждый раз в течение 1 часа, причем отношение количества добавленной воды к массе лекарственных материалов составляло 11 об./масс. (мл/г) при первом настаивании и 9 об./масс. (мл/г) при втором настаивании; затем настои объединяли, фильтровали, фильтрат концентрировали при пониженном давлении с образованием прозрачной пасты с относительной плотностью 1,14-1,16, термически измеренной при 60°C, и объединяли с прозрачной пастой, полученной на этапе (2), для дальнейшего применения;
из мелкого порошка, полученного на этапе (1), и объединенных прозрачных паст, полученных на этапе (3), был получен сироп в соответствии с традиционным способом приготовления.
Пример 9.
Способ получения лекарства согласно настоящему изобретению в форме суппозитория
Рецепт:
|
Способ получения:
(1) FRITILLARIAE THUNBERGII BULBUS взвешивали в соответствии с массой, указанной в рецепте, и измельчали в мелкий порошок для дальнейшего применения;
(2) EPHEDRAE HERBA, FORSYTHIAE FRUCTUS, SCUTELLARIAE RADIX, ARMENIACAE SEMEN AMARUM, PINELLIAE RHIZOMA, ARCTII FRUCTUS и RHEI RADIX ET RHIZOMA взвешивали в соответствии с массой, указанной в рецепте, и дважды подвергали экстракции 40% раствором этанола при кипячении с обратным холодильником, каждый раз в течение 4 часов, причем отношение количества раствора этанола к массе лекарственных материалов составляло 10 об./масс. (мл/г) при первой экстракции и 9 об./масс. (мл/г) при второй экстракции; экстракты объединяли и фильтровали; из фильтрата выделяли этанол при пониженном давлении и концентрировали фильтрат с образованием прозрачной пасты с относительной плотностью 1,14-1,16, термически измеренной при 60°C, для дальнейшего применения;
(3) GYPSUM FIBROSUM, MORI CORTEX, PEUCEDANI RADIX, CITRI RETICULATAE PERICARPIUM, LONICERAE FLOS, PLATYCODONIS RADIX и GLYCYRRHIZAE RADIX ET RHIZOMA взвешивали в соответствии с массой, указанной в рецепте, и дважды настаивали в воде, каждый раз в течение часа, причем отношение количества добавленной воды к массе лекарственных материалов составляло 11 об./масс. (мл/г) при первом настаивании и 9 об./масс. (мл/г) при втором настаивании; затем настои объединяли, фильтровали, фильтрат концентрировали при пониженном давлении с образованием прозрачной пасты с относительной плотностью 1,14-1,16, термически измеренной при 60°C, и объединяли с прозрачной пастой, полученной на этапе (2), для дальнейшего применения;
из мелкого порошка, полученного на этапе (1), и объединенных прозрачных паст, полученных на этапе (3), были получены суппозитории в соответствии с традиционным способом приготовления.
Пример 10.
Способ получения лекарства согласно настоящему изобретению в форме геля
Рецепт:
|
Способ получения:
(1) FRITILLARIAE THUNBERGII BULBUS взвешивали в соответствии с массой, указанной в рецепте, и измельчали в мелкий порошок для дальнейшего применения;
(2) EPHEDRAE HERBA, FORSYTHIAE FRUCTUS, SCUTELLARIAE RADIX, ARMENIACAE SEMEN AMARUM, PINELLIAE RHIZOMA, ARCTII FRUCTUS и RHEI RADIX ET RHIZOMA взвешивали в соответствии с массой, указанной в рецепте, и дважды подвергали экстракции 55% раствором этанола при кипячении с обратным холодильником, каждый раз в течение 2,5 часов, причем отношение количества раствора этанола к массе лекарственных материалов составляло 7 об./масс. (мл/г) при первой экстракции и 9 об./масс. (мл/г) при второй экстракции; экстракты объединяли и фильтровали; из фильтрата выделяли этанол при пониженном давлении и концентрировали фильтрат с образованием прозрачной пасты с относительной плотностью 1,14-1,16, термически измеренной при 60°С, для дальнейшего применения;
(3) GYPSUM FIBROSUM, MORI CORTEX, PEUCEDANI RADIX, CITRI RETICULATAE PERICARPIUM, LONICERAE FLOS, PLATYCODONIS RADIX и GLYCYRRHIZAE RADIX ET RHIZOMA взвешивали в соответствии с массой, указанной в рецепте, и дважды настаивали в воде, каждый раз в течение 3 часов, причем отношение количества добавленной воды к массе лекарственных материалов составляло 9 об./масс. (мл/г) при первом настаивании и 7 об./масс. (мл/г) при втором настаивании; затем настои объединяли, фильтровали, фильтрат концентрировали при пониженном давлении с образованием прозрачной пасты с относительной плотностью 1,14-1,16, термически измеренной при 60°C, и объединяли с прозрачной пастой, полученной на этапе (2), для дальнейшего применения;
из мелкого порошка, полученного на этапе (1), и объединенных прозрачных паст, полученных на этапе (3), был получен гель в соответствии с традиционным способом приготовления.
Пример 11.
Способ получения лекарства согласно настоящему изобретению в форме спрея
Рецепт:
|
Способ получения:
(1) FRITILLARIAE THUNBERGII BULBUS взвешивали в соответствии с массой, указанной в рецепте, и измельчали в мелкий порошок для дальнейшего применения;
(2) EPHEDRAE HERBA, FORSYTHIAE FRUCTUS, SCUTELLARIAE RADIX, ARMENIACAE SEMEN AMARUM, PINELLIAE RHIZOMA, ARCTII FRUCTUS и RHEI RADIX ET RHIZOMA взвешивали в соответствии с массой, указанной в рецепте, и дважды подвергали экстракции 60% раствором этанола при кипячении с обратным холодильником, каждый раз в течение 2,5 часов, причем отношение количества раствора этанола к массе лекарственных материалов составляло 9 об./масс. (мл/г) при первой экстракции и 6 об./масс. (мл/г) при второй экстракции; экстракты объединяли и фильтровали; из фильтрата выделяли этанол при пониженном давлении и концентрировали фильтрат с образованием прозрачной пасты с относительной плотностью 1,14-1,16, термически измеренной при 60°C для дальнейшего применения;
(3) GYPSUM FIBROSUM, MORI CORTEX, PEUCEDANI RADIX, CITRI RETICULATAE PERICARPIUM, LONICERAE FLOS, PLATYCODONIS RADIX и GLYCYRRHIZAE RADIX ET RHIZOMA взвешивали в соответствии с массой, указанной в рецепте, и дважды настаивали в воде, каждый раз в течение 3 часов, причем отношение количества добавленной воды к массе лекарственных материалов составляло 9 об./масс. (мл/г) при первом настаивании и 7 об./масс. (мл/г) при втором настаивании; затем настои объединяли, фильтровали, концентрировали при пониженном давлении с образованием прозрачной пасты с относительной плотностью 1,14-1,16, термически измеренной при 60°С, и объединяли с прозрачной пастой, полученной на этапе (2), для дальнейшего применения;
из мелкого порошка, полученного на этапе (1), и объединенных прозрачных паст, полученных на этапе (3), был получен спрей в соответствии с традиционным способом приготовления.
Пример 12.
Способ получения лекарства согласно настоящему изобретению в форме для инъекций
Рецепт:
|
Способ получения:
(1) FRITILLARIAE THUNBERGII BULBUS взвешивали в соответствии с массой, указанной в рецепте, и измельчали в мелкий порошок для дальнейшего применения;
(2) EPHEDRAE HERBA, FORSYTHIAE FRUCTUS, SCUTELLARIAE RADIX, ARMENIACAE SEMEN AMARUM, PINELLIAE RHIZOMA, ARCTII FRUCTUS и RHEI RADIX ET RHIZOMA взвешивали в соответствии с массой, указанной в рецепте, и дважды подвергали экстракции 60% раствором этанола при кипячении с обратным холодильником, каждый раз в течение 3 часов, причем отношение количества раствора этанола к массе лекарственных материалов составляло 9 об./масс. (мл/г) при первой экстракции и 6 об./масс. (мл/г) при второй экстракции; экстракты объединяли и фильтровали; из фильтрата выделяли этанол при пониженном давлении, и концентрировали фильтрат с образованием прозрачной пасты с относительной плотностью 1,14-1,16, термически измеренной при 60°C, для дальнейшего применения;
(3) GYPSUM FIBROSUM, MORI CORTEX, PEUCEDANI RADIX, CITRI RETICULATAE PERICARPIUM, LONICERAE FLOS, PLATYCODONIS RADIX и GLYCYRRHIZAE RADIX ET RHIZOMA взвешивали в соответствии с массой, указанной в рецепте, и дважды настаивали в воде, каждый раз в течение часа, причем отношение количества добавленной воды к массе лекарственных материалов составляло 9 об./масс. (мл/г) при первом настаивании и 7 об./масс. (мл/г) при втором настаивании; затем настои объединяли, фильтровали, концентрировали при пониженном давлении с образованием прозрачной пасты с относительной плотностью 1,14-1,16, термически измеренной при 60°C, и объединяли с прозрачной пастой, полученной на этапе (2), для дальнейшего применения;
из мелкого порошка, полученного на этапе (1), и объединенных прозрачных паст, полученных на этапе (3), была получена форма для инъекций в соответствии с традиционным способом приготовления.
Согласно настоящему изобретению все применяемые в следующих Примерах испытаний, включающих фармакологические и токсикологические эксперименты, фармацевтические композиции (далее именуемые «лекарство согласно настоящему изобретению») были получены способом, изложенным в Примере 1.
Пример испытания 1 Эксперименты по исследованию способности лекарства согласно настоящему изобретению останавливать кашель.
1. Способность лекарства согласно настоящему изобретению останавливать кашель, вызванный лимонной кислотой, испытанная на морских свинках.
1.1. Объекты эксперимента
1.1.1. Лекарства:
(1) Лекарство согласно настоящему изобретению, 10,4 г лекарственного сырья/г (то есть 1 г лекарства произведен из 10,4 г лекарственного сырья), предоставленное Shijiazhuang Yiling Pharmaceutical Co., Ltd., номер серии 060401, которое было получено в необходимых для эксперимента концентрациях в дистиллированной воде.
(2) Таблетка клоперастина гидрохлорида (TABELLAE CLOPERASTINI HYDROCHLORIDE 10 мг/таблетка, произведенная Beijing Shuguang Pharmaceutical Co., Ltd., номер серии 060619.
(3) Жидкость для перорального применения Цзичжи Сироп 200 мл/флакон, произведенная Fuling Pharmaceutical Factory, Taiji Group, номер разрешения SFDA (Государственного управления по контролю качества медикаментов и продуктов питания КНР) Z50020615, дата изготовления 13 ноября 2006 и номер серии 0611034010.
1.1.2. Животные:
Шестьдесят чистокровных морских свинок класса I, среди которых число самцов и самок было одинаковым, со средней массой тела 238,57±12,14 г, предоставленных Пекинским центром по разведению животных, номер лицензии SCXK (Jing) 2002-0005.
1.1.3. Реагент:
Лимонная кислота, произведенная Пекинским химическим заводом, номер серии 960904.
1.1.4. Аппараты:
Воздушный насос; стеклянный сосуд в форме колокола вместимостью 4 л и стеклянный распылитель.
1.2. Ход эксперимента
Перед началом эксперимента морских свинок по отдельности помещали в герметично закрываемый сосуд в форме колокола вместимостью 4 л и в течение минуты распыляли с помощью стеклянного распылителя 17,5% раствор лимонной кислоты при давлении 400 мм рт.ст. Морские свинки были отобраны с учетом частоты кашля, фиксируемой течение 5 минут. Морские свинки с частотой кашля менее 10 были отбракованы, а свинки, прошедшие отбор, были оставлены для участия в эксперименте.
Шестьдесят отобранных морских свинок, среди которых число самцов и самок было одинаковым, были случайным образом разделены на следующие шесть групп: (1) контрольную группу, которой вводили физиологический раствор (5 мл/кг); (2) группу таблеток клоперастина гидрохлорида (КГТ группу, 7 мг/кг); (3) группу жидкости для перорального применения Цзичжи Сироп (ЖПЦС группу, 9 мл/кг); (4) группу высокой дозировки лекарства согласно настоящему изобретению (группу В-дозировки, 6 г лекарственного сырья/кг); (5) группу средней дозировки лекарства согласно настоящему изобретению (группу С-дозировки, 3 г лекарственного сырья/кг); (6) группу низкой дозировки лекарства согласно настоящему изобретению (группу H-дозировки, 1,5 г лекарственного сырья/кг). Каждому животному внутрижелудочно вводили соответствующее лекарство или, в случае контрольной группы, физиологической раствор один раз в день три дня подряд. Через 30 минут после последнего введения морских свинок по отдельности помещали в герметично закрываемый сосуд в форме колокола вместимостью 4 л и в течение минуты распыляли с помощью стеклянного распылителя 17,5% раствор лимонной кислоты при давлении 600 мм рт.ст. В течение 5 минут за морскими свинками наблюдали, чтобы зафиксировать продолжительность инкубационного периода до возникновения кашля и частоту кашля. Сравнение групп проводили с помощью критерия Стьюдента.
1.3. Результаты испытания
Результаты эксперимента показывают, что высокая, средняя и низкая дозы лекарства согласно настоящему изобретению могут значительно продлить инкубационный период и уменьшить частоту кашля, и демонстрируют значительное различие в действии по сравнению с контрольной группой (Р<0,05, Р<0,01).
|
1.4. Краткое заключение
Приведенные выше результаты показывают, что лекарство согласно настоящему изобретению способно значительно продлить инкубационный период и уменьшить частоту кашля (P<0,05, P<0,01), вызванного лимонной кислотой у морских свинок.
2. Способность лекарства согласно настоящему изобретению останавливать кашель, вызванный водным раствором аммиака, испытанная на мышах.
2.1. Объекты эксперимента
2.1.1. Лекарства:
(1) Лекарство согласно настоящему изобретению, 10,4 г лекарственного сырья/г, предоставленное Shijiazhuang Yiling Pharmaceutical Co., Ltd., номер серии 060401, и полученное в необходимых для эксперимента концентрациях в дистиллированной воде.
(2) Таблетка клоперастина гидрохлорида, 10 мг/таблетка, произведенная Beijing Shuguang Pharmaceutical Co., Ltd., номер серии 060619.
(3) Жидкость для перорального применения Цзичжи Сироп 200 мл/флакон, произведенная Fuling Pharmaceutical Factory, Taiji Group, номер разрешения SFDA Z50020615, дата изготовления 13 ноября 2006 и номер серии 0611034010.
2.1.2. Животные:
Шестьдесят куныминских мышей класса II, среди которых число самцов и самок было одинаковым, со средней массой тела 19,92±0,79 г, предоставленных Институтом изучения лабораторных животных Китайской академии медицинских наук, номер лицензии SCXK (Jing) 2000-0006.
2.1.3. Реагент:
Водный раствор аммиака, произведенный Beijing Century Red Star Chemical Co., Ltd., номер серии 20060310.
2.2. Ход эксперимента.
Шестьдесят здоровых мышей были случайным образом разделены на следующие шесть групп: (1) контрольную группу, которой вводили физиологический раствор (25 мл/кг); (2) группу таблеток клоперастина гидрохлорида (КГТ группу, 12 мг/кг); (3) группу жидкости для перорального применения Цзичжи Сироп (ЖПЦС группу, 16 мл/кг); (4) группу высокой дозировки лекарства согласно настоящему изобретению (группу В-дозировки, 12 г лекарственного сырья/кг); (5) группу средней дозировки лекарства согласно настоящему изобретению (группу С-дозировки, 6 г лекарственного сырья/кг); (6) группу низкой дозировки лекарства согласно настоящему изобретению (группу H-дозировки, 3 г лекарственного сырья/кг). Каждое животное было подвергнуто внутрижелудочному введению соответствующего лекарства или, в случае контрольной группы, физиологического раствора один раз в день три дня подряд. Через 30 минут после последнего введения каждую мышь помещали в лабораторный стакан вместимостью 500 мл с тампоном внутри. 0,2 мл водного раствора аммиака набирали в шприц вместимостью 1 мл и вводили в тампон. Затем стакан быстро переворачивали. В течение 3 минут за мышами наблюдали, чтобы зафиксировать продолжительность инкубационного периода до возникновения кашля и частоту кашля. Сравнение групп проводили с помощью критерия Стьюдента.
2.3. Результаты испытания.
Из Таблицы 2 можно увидеть, что в случае кашля, вызванного у мышей водным раствором аммиака, высокая, средняя и низкая дозы лекарства согласно настоящему изобретению могут значительно продлить инкубационный период и уменьшить частоту кашля и демонстрируют значительную разницу в действии по сравнению с контрольной группой (Р<0,05, Р<0,01).
|
2.4. Краткое заключение.
Приведенные выше результаты показывают, что лекарство согласно настоящему изобретению способно значительно продлить инкубационный период и уменьшить частоту кашля (Р<0,05, Р<0,01, Р<0,001), вызванного у мышей водным раствором аммиака.
3. Вывод:
Два экспериментальных исследования, описанных выше, показывают, что лекарство согласно настоящему изобретению способно останавливать кашель.
Пример испытания 2
Эксперимент по исследованию способности лекарства согласно настоящему изобретению рассеивать флегму.
1. Влияние лекарства согласно настоящему изобретению на количество мокроты, собранной с помощью капиллярной трубки, у крыс.
1.1. Объекты эксперимента.
1.1.1. Лекарства:
(1) Лекарство согласно настоящему изобретению, 10,4 г лекарственного сырья/г, предоставленное Shijiazhuang Yiling Pharmaceutical Co., Ltd., номер серии 060401, и полученное в необходимых для эксперимента концентрациях в дистиллированной воде.
(2) Мукосольван, 30 мг/таблетка, продукция Boehringer Ingelheim Int. Ltd., Германия, дистрибьютор Shanghai Sine Pharmaceutical Co. Ltd., номер серии 205325, номер серии, присвоенный дистрибьютором, 030307.
(3) Жидкость для перорального применения Цзичжи Сироп 200 мл/флакон, произведенная Fuling Pharmaceutical Factory, Taiji Group, номер разрешения SFDA (Государственного управления по контролю качества медикаментов и продуктов питания КНР) Z50020615, дата изготовления 13 ноября 2006 и номер серии 0611034010.
1.1.2. Животные:
Шестьдесят крыс SD категории СПФ (свободные от специфической патогенной микрофлоры), среди которых число самцов и самок было одинаковым, со средней массой тела 162,70±8,25 г, предоставленных Vital River Laboratory Animal Technology Co., Ltd., Пекин, номер лицензии SCXK (Jing) 2002-0003.
1.2. Ход эксперимента.
Шестьдесят здоровых крыс были случайным образом разделены на следующие шесть групп: (1) контрольную группу, которой вводили физиологический раствор (10 мл/кг); (2) группу мукосольвана (11 мг/кг); (3) группу жидкости для перорального применения Цзичжи Сироп (ЖПЦС группу, 11 мл/кг); (4) группу высокой дозировки лекарства согласно настоящему изобретению (группу B-дозировки, 8 г лекарственного сырья/кг); (5) группу средней дозировки лекарства согласно настоящему изобретению (группу C-дозировки, 4 г лекарственного сырья/кг); (6) группу низкой дозировки лекарства согласно настоящему изобретению (группу H-дозировки, 2 г лекарственного сырья/кг). Каждую крысу внутрибрюшинно анестезировали 3,5% раствором хлоралгидрата (10 мл/кг), клали горизонтально на спину и фиксировали. Кожу на шее разрезали и открывали трахею. Отверстие прокалывали иглой шприца посередине на уровне нижнего края щитовидного хряща между двумя хрящами. Стеклянную капиллярную трубку вставляли в отверстие так, чтобы трубка прикасалась только ко внутренней стенке трахеи. Когда стеклянная капиллярная трубка наполнялась мокротой, ее немедленно заменяли на другую. Объем мокроты в капиллярах определяли в течение 1 часа перед введением соответствующих лекарств или, в случае контрольной группы, физиологического раствора. Через час животным дуоденально вводили лекарство (животным из контрольной группы вводили эквивалентное количество физиологического раствора). В течение первого и второго часа после введения определяли среднее количество выделявшейся за час мокроты. Сравнение групп проводили с помощью критерия Стьюдента со средним количеством мокроты, выделявшейся в течение 1 часа перед введением, в качестве нормальной величины.
1.3. Результаты испытания.
Из Таблицы 3 можно увидеть, что высокая, средняя и низкая дозы лекарства согласно настоящему изобретению могут значительно повысить выделение жидкости в дыхательных путях и улучшить выведение мокроты и демонстрируют значительную разницу в действии по сравнению с контрольной группой (Р<0,05, Р<0,01, Р<0,001).
|
1.4. Краткое заключение
Описанные выше результаты показывают, что лекарство согласно настоящему изобретению способно повысить объем выделяемой мокроты (P<0,05, P<0,01, Р<0,001).
2. Способность лекарства согласно настоящему изобретению рассеивать флегму у мышей, измеренная с помощью фенолового красного
2.1. Объекты эксперимента
2.1.1. Лекарства:
(1) Лекарство согласно настоящему изобретению, 10,4 г лекарственного сырья/г, предоставленное Shijiazhuang Yiling Pharmaceutical Co., Ltd., номер серии 060401, и полученное в необходимых для эксперимента концентрациях в дистиллированной воде.
(2) Мукосольван, 30 мг/таблетка, продукция Boehringer Ingelheim Int. Ltd., Германия, дистрибьютор Shanghai Sine Pharmaceutical Co. Ltd., номер серии 205325, номер серии, присвоенный дистрибьютором, 030307.
(3) Жидкость для перорального применения Цзичжи Сироп 200 мл/флакон, произведенная Fuling Pharmaceutical Factory, Taiji Group, номер разрешения SFDA (Государственного управления по контролю качества медикаментов и продуктов питания КНР) Z50020615, дата изготовления 13 ноября 2006 и номер серии 0611034010.
2.1.2. Реагент:
Феноловый красный (индикатор) производства Пекинского химического завода, номер серии 770517.
2.1.3. Животные:
Шестьдесят мышей ICR класса II, среди которых число самцов и самок было одинаковым, со средней массой тела 19,30±1,15 г, предоставленных Vital River Laboratory Animal Technology Co., Ltd., Пекин, номер лицензии SCXK (Jing) 2002-0003.
2.2. Ход эксперимента
Шестьдесят здоровых мышей были случайным образом разделены на следующие шесть групп: (1) контрольную группу, которой вводили физиологический раствор (25 мл/кг); (2) группу мукосольвана (16 мг/кг); (3) группу жидкости для перорального применения Цзичжи Сироп (ЖПЦС группу, 16 мл/кг); (4) группу высокой дозировки лекарства согласно настоящему изобретению (группу В-дозировки, 12 г лекарственного сырья/кг); (5) группу средней дозировки лекарства согласно настоящему изобретению (группу С-дозировки, 6 г лекарственного сырья/кг); (6) группу низкой дозировки лекарства согласно настоящему изобретению (группу Н-дозировки, 3 г лекарственного сырья/кг). Каждой мыши внутрижелудочно вводили соответствующее лекарство или, в случае контрольной группы, физиологической раствор один раз в день три дня подряд до начала эксперимента, при этом мышь была лишена еды, но имела неограниченный доступ к воде. После последнего введения мыши вводили 500 мг/кг физиологического раствора, содержащего 5% фенолового красного. Через 30 минут мышь умерщвляли и фиксировали в положении на спине. Кожу на шее разрезали посередине и открывали трахею. В открытой трахее проделывали небольшое отверстие и через отверстие в трахею примерно на 0,3 см вставляли тупую иглу шприца 7 калибра, а затем крепко перевязывали шелковой нитью. Дыхательные пути несколько раз промывали 0,5 мл физиологического раствора, набираемого в 1 мл шприц, а промывочную жидкость отбирали в пробирку. Вышеуказанные этапы повторяли 3 раза. К промывочной жидкости в пробирке добавляли 0,1 мл раствора NaOH с молярной концентрацией 1 моль/л, делая жидкость основной. Значение оптической плотности (ОП) промывочной жидкости определяли с помощью спектрофотометра UV-120-02, работающего в УФ и видимой областях спектра, при длине волны 546 нм, при этом уровень фенолового красного в промывочной жидкости (мкг/мл) рассчитывали на основе стандартной кривой фенолового красного. Сравнение групп проводили с помощью критерия Стьюдента.
2.3. Результаты испытания.
Результаты в Таблице 3 показывают, что высокая и средняя дозы лекарства согласно настоящему изобретению способны значительно повысить количество фенолового красного, выделяемого слизистой оболочкой дыхательных путей мышей, и демонстрируют значительную разницу в действии по сравнению с контрольной группой. Результаты показывают, что препарат согласно настоящему изобретению оказывает несомненное влияние на рассеивание флегмы (Р<0,05, Р<0,001).
|
2.4. Краткое заключение
Вышеописанный результат показывает, что высокая и средняя дозы лекарства согласно настоящему изобретению способны повысить количество фенолового красного, выделяемого дыхательными путями мышей, таким образом оказывая значительное влияние на рассеивание флегмы у мыши (Р<0,05, Р<0,001).
3. Вывод:
Два экспериментальных исследования, описанных выше, показывают, что лекарство согласно настоящему изобретению способно рассеивать флегму.
Пример испытания 3 Эксперимент по исследованию способности лекарства согласно настоящему изобретению облегчать астматическую затрудненность дыхания.
1. Способность лекарства согласно настоящему изобретению облегчать астматическую затрудненность дыхания, вызванную гистамином, у морских свинок.
1.1. Объекты эксперимента.
1.1.1. Лекарства:
(1) Лекарство согласно настоящему изобретению, 10,4 г лекарственного сырья/г, предоставленное Shijiazhuang Yiling Pharmaceutical Co., Ltd., номер серии 060401, и полученное в необходимых для эксперимента концентрациях в дистиллированной воде.
(2) Аминофиллин, 0,1 г/таблетка, продукция Beijing Zizhu Pharmaceutical Co., Ltd, номер серии 20061202.
(3) Жидкость для перорального применения Цзичжи Сироп 200 мл/флакон, произведенная Fuling Pharmaceutical Factory, Taiji Group, номер разрешения SFDA Z50020615, дата изготовления 13 ноября 2006 и номер серии 0611034010.
1.1.2. Животные:
Шестьдесят чистокровных белых морских свинок класса I, среди которых число самцов и самок было одинаковым, со средней массой тела 181,97±15,85 г, предоставленных Пекинским центром по разведению животных, номер лицензии SCXK (Jing) 2002-0005.
1.1.3. Реагент:
(1) Ацетилхолин хлорид, 1 г/флакон, продукция Пекинской компании химических реактивов, номер серии 060211.
(2) Фосфат гистамина, 5 г/флакон, продукция Шанхайского института биологии Китайской Академии наук, продукт №1702.
1.1.4. Оборудование:
Аппараты, помогающие вызвать астму (воздушный компрессор, стеклянный распылитель), стеклянный сосуд в форме колокола вместимостью 4 л.
1.2. Ход эксперимента.
Здоровые морские свинки, среди которых число самцов и самок было одинаковым, предварительно были подвергнуты отбору. Морских свинок по отдельности помещали в сосуд в форме колокола вместимостью 4 л и в течение 20 с при давлении 400 мм рт.ст. распыляли смешанные в равных объемах жидкости, содержащие соответственно 2% хлорида ацетилхолина и 0,1% фосфата гистамина. В течение 6 минут после распыления за морскими свинками наблюдали, чтобы зафиксировать продолжительность инкубационного периода астматического спазма (времени, через которое происходит астматический спазм, после прекращения распыления). Морские свинки, демонстрирующие продолжительность инкубационного периода астматического спазма свыше 120 с, не прошли отбор.
Шестьдесят отобранных морских свинок были случайным образом разделены на следующие шесть групп: (1) эталонную контрольную группу, которой вводили физиологический раствор (5 мл/кг); (2) группу аминофиллина (0,05 г/кг); (3) группу жидкости для перорального применения Цзичжи Сироп (ЖПЦС группу, 9 мл/кг); (4) группу высокой дозировки лекарства согласно настоящему изобретению (группу В-дозировки, 6 г лекарственного сырья/кг); (5) группу средней дозировки лекарства согласно настоящему изобретению (группу С-дозировки, 3 г лекарственного сырья/кг); (6) группу низкой дозировки лекарства согласно настоящему изобретению (группу H-дозировки, 1,5 г лекарственного сырья/кг). Животным внутрижелудочно вводили соответствующее лекарство или, в случае контрольной группы, физиологический раствор один раз в день три дня подряд и подвергали эксперименту по вызову астмы через 30 мин после последнего введения. Морских свинок по отдельности помещали в стеклянный сосуд в форме колокола вместимостью 4 л и в течение 20 с при давлении 400 мм рт.ст. распыляли смешанные в равных объемах жидкости, содержащие соответственно 2% хлорида ацетилхолина и 0,1% фосфата гистамина. Затем в течение 6 минут за морскими свинками наблюдали, чтобы зафиксировать продолжительность инкубационного периода астматического спазма (так же известного, как инкубационный период вызова астмы), то есть время, через которое происходит астматический спазм, и время падения морской свинки после прекращения распыления. Инкубационный период, который длился более чем 6 мин, считали равным 360 с. Результаты эксперимента в разных группах сравнивали с помощью критерия Стьюдента.
1.3. Результаты испытания.
|
Из результатов в Таблице 5 можно увидеть, что высокая и средняя дозы лекарства согласно настоящему изобретению способны значительно продлить инкубационный период астмы и отсрочить падение по сравнению с контрольной группой (Р<0,05, Р<0,01), в то время как низкая доза может немного продлить инкубационный период и отсрочить падение по сравнению с контрольной группой, но данная разница незначительна.
1.4. Краткое заключение
Результаты эксперимента показывают, что высокая и средняя дозы лекарства согласно настоящему изобретению способны значительно продлить инкубационный период астмы и отсрочить падение, тем самым значительно ослабляя астму, вызванную гистамином, у морских свинок (Р<0,05, Р<0,01).
2. Влияние лекарства согласно настоящему изобретению на аллергический спазм бронхов у морских свинок.
2.1. Объекты эксперимента.
2.1.1. Лекарства:
(1) Лекарство согласно настоящему изобретению, 10,4 г лекарственного сырья/г, предоставленное Shijiazhuang Yiling Pharmaceutical Co., Ltd., номер серии 060401, и полученное в необходимых для эксперимента концентрациях в дистиллированной воде.
(2) Аминофиллин, 0,1 г/таблетка, продукция Beijing Zizhu Pharmaceutical Co., Ltd, номер серии 20061202.
(3) Жидкость для перорального применения Цзичжи Сироп 200 мл/флакон, произведенная Fuling Pharmaceutical Factory, Taiji Group, номер разрешения SFDA Z50020615, дата изготовления 13 ноября 2006 и номер серии 0611034010.
2.1.2. Животные:
Шестьдесят чистокровных белых морских свинок класса I, среди которых число самцов и самок было одинаковым, со средней массой тела 188,15±16,07 г, предоставленных Пекинским центром по разведению животных, номер лицензии SCXK (Jing) 2002-0005.
2.1.3. Антиген:
Овальбумин, 50 г/флакон, продукция Sigma, каталожный номер А5253, дистрибьютор Beijing Hui Ze Ао Technology and Trade Co., Ltd.
2.1.4. Реагент:
Вакцина против коклюша ЗОЮ9 Ед/мл, 2 мл/ампула, продукция Национального института по контролю фармацевтической и биологической продукции, номер серии 04-1.
2.1.5. Оборудование:
Аппараты, помогающие вызвать астму (воздушный компрессор, стеклянный распылитель), стеклянный сосуд в форме колокола вместимостью 4 л.
2.2. Ход эксперимента.
Сенсибилизация морских свинок была проведена следующим образом. Было отобрано шестьдесят здоровых белых морских свинок, и каждой из них в заднюю конечность внутримышечно вводили 4 мг овальбумина (0,1 мл физиологического раствора, содержащего 4% овальбумина) и в это время внутрибрюшинно вводили вакцину против коклюша, содержащую 2×1010 бактерий. В течение 14 дней после сенсибилизации инъецированные животные были подвергнуты эксперименту.
На десятый день после сенсибилизации животных случайным образом разделяли на следующие шесть групп по 10 животных в каждой: (1) контрольную группу, которой вводили физиологический раствор (5 мл/кг); (2) группу аминофиллина (0,05 г/кг); (3) группу жидкости для перорального применения Цзичжи Сироп (ЖПЦС группу, 9 мл/кг); (4) группу высокой дозировки лекарства согласно настоящему изобретению (группу В-дозировки, 6 г лекарственного сырья/кг); (5) группу средней дозировки лекарства согласно настоящему изобретению (группу С-дозировки, 3 г лекарственного сырья/кг); (6) группу низкой дозировки лекарства согласно настоящему изобретению (группу Н-дозировки, 1,5 г лекарственного сырья/кг), и внутрижелудочно вводили соответствующее лекарство или, в случае контрольной группы, физиологической раствор один раз в день пять дней подряд. Через 30 минут после последнего введения морских свинок по отдельности сажали в герметично закрываемый стеклянный сосуд в форме колокола вместимостью 4 л и полминуты при постоянном давлении 400 мм рт.ст. распыляли 5% раствор овальбумина. Затем в течение 6 минут за морскими свинками наблюдали, чтобы зафиксировать продолжительность инкубационного периода астматического спазма и количество животных, у которых проявилась астма, падение, сопровождаемое судорогами, а также смерть. Для животного, у которого в течение 6 минут не проявилась астма, падение, сопровождаемое судорогами, инкубационный период считали равным 360 с. Результаты эксперимента в разных группах сравнивали с помощью критерия Стьюдента. Количество умерших животных было статистически проверено с помощью критерия хи-квадрат (X2). 
2.3. Результаты испытания.
Из результатов в Таблице 6 можно увидеть, что высокая и средняя дозы лекарства согласно настоящему изобретению могут значительно продлить инкубационный период аллергического спазма бронхов, отсрочить возникновение астмы и падение, сопровождаемое судорогами, и снизить число умерших животных, а также демонстрировать значительную разницу в действии по сравнению с контрольной группой (Р<0,05, Р<0,01), в то время как низкая доза может немного продлить инкубационный период аллергического спазма бронхов и отсрочить возникновение астмы и падение, сопровождаемое судорогами, по сравнению с контрольной группой, но данная разница незначительна.
2.4. Краткое заключение
Результаты эксперимента показывают, что высокая и средняя дозы лекарства согласно настоящему изобретению способны значительно продлить инкубационный период, отсрочить возникновение астмы и падение, сопровождаемое судорогами, и снизить число умерших животных, тем самым значительно ослабляя аллергический спазм бронхов, вызванный овальбумином (Р<0.05, Р<0.01).
3. Вывод:
Два экспериментальных исследования, описанных выше, показывают, что лекарство согласно настоящему изобретению способно ослаблять астму.
Пример испытания 4
Эксперимент по исследованию способности лекарства согласно настоящему изобретению прекращать лихорадку.
1. Влияние лекарства согласно настоящему изобретению на лихорадку, вызванную эндотоксином кишечной палочки, у кроликов.
1.1. Объекты эксперимента.
1.1.1. Лекарства:
(1) Лекарство согласно настоящему изобретению, 10,4 г лекарственного сырья/г, предоставленное Shijiazhuang Yiling Pharmaceutical Co., Ltd., номер серии 060401, и полученное в необходимых для эксперимента концентрациях в дистиллированной воде.
(2) Таблетка аспирина, покрытая энтеросолюбильной оболочкой, 0,3 г/таблетка, произведенная Yantai Justaware Pharmaceutical Co., Ltd. (Yantai Second Pharmaceutical Factory), номер серии 061102.
(3) Жидкость для перорального применения Цзичжи Сироп 200 мл/флакон, произведенная Fuling Pharmaceutical Factory, Taiji Group, номер разрешения SFDA Z50020615, дата изготовления 13 ноября 2006 и номер серии 0611034010.
1.1.2. Пироген:
Эндотоксин Е.coli (кишечной палочки), 500 мкг/ампула, продукция Института биологической продукции Министерства здравоохранения Китайской республики, номер серии 891-2.
1.1.3. Животные:
Сорок восемь белых японских кроликов, среди которых число самцов и самок было одинаковым, со средней массой тела 2,10±0,08 кг, предоставленных Питомником лабораторных животных Tongli, Xueyuan Road, район Хайдянь, Пекин; проверенный сертификат NO, номер лицензии SCK (Jing) 2002-0008.
1.2. Ход эксперимента.
Белые японские кролики были разделены на следующие шесть групп, поровну состоящих из самцов и самок, по восемь животных в каждой: (1) эталонную контрольную группу, которой вводили физиологический раствор (3 мл/кг); (2) группу аспирина (100 мг/кг); (3) группу жидкости для перорального применения Цзичжи Сироп (ЖПЦС группу, 6 мл/кг); (4) группу высокой дозировки лекарства согласно настоящему изобретению (группу B-дозировки, 4 г лекарственного сырья/кг); (5) группу средней дозировки лекарства согласно настоящему изобретению (группу C-дозировки, 2 г лекарственного сырья/кг); (6) группу низкой дозировки лекарства согласно настоящему изобретению (группу H-дозировки, 1 г лекарственного сырья/кг). У каждого кролика вызывали жар с помощью эндотоксина Е.coli и измеряли ректальную температуру дважды в день, непосредственно предшествующий эксперименту. В качестве температуры тела перед введением принимали среднюю температуру. Начиная со следующего дня, кролику внутрижелудочно вводили соответствующее лекарство один раз в день три дня подряд (животным эталонной контрольной группы внутрижелудочно вводили эквивалентный объем физиологического раствора, а животным группы аспирина лекарство внутрижелудочно вводили один раз перед введением эндотоксина). Через 30 минут после последнего введения животным групп, на которые оказывали воздействие, в краевую вену уха вводили эндотоксин Е.coli. в количестве 250 нг/мл/кг, через 1, 2, 3, 4, 5 и 6 часов после инъекции определяли температуру тела и рассчитывали изменение температуры тела (∆°C) в каждый момент времени. Сравнение групп проводили с помощью критерия Стьюдента.
1.3. Результаты испытания (см. Таблицу 7).
Из результатов в Таблице 7 можно увидеть, что температура тела животных эталонной контрольной группы начинала расти через 1 час после введения пирогена, достигала пика через 4 часа и постепенно понижалась через 6 часов. Прекращение лихорадки у животных группы аспирина было очевидным, и результаты через 1-6 часов после введения пирогена значительно отличаются от результатов эталонной контрольной группы (Р<0,01-Р<0,001). Прекращение лихорадки у животных группы высокой дозировки через 1-6 часов после введения пирогена было явным, через 2-3 часа даже более явным, и результаты значительно отличаются от результатов эталонной контрольной группы (Р<0,05-Р<0,01). Результаты, отображающие прекращение лихорадки у животных группы средней дозировки, значительно отличаются от результатов эталонной контрольной группы через 1-4 часа после введения пирогена (Р<0,05-Р<0,01). Прекращение лихорадки у животных группы низкой дозировки не было явным.
1.4. Краткое заключение
Высокая и средняя дозы лекарства согласно настоящему изобретению оказывают несомненное влияние на ослабление жара, вызванного эндотоксином Е.coli, у подопытного кролика.
2. Влияние лекарства согласно настоящему изобретению на лихорадку, вызванную дрожжами, у крыс.
2.1. Объекты эксперимента.
2.1.1. Лекарства:
(1) Лекарство согласно настоящему изобретению, 10,4 г лекарственного сырья/г, предоставленное Shijiazhuang Yiling Pharmaceutical Co., Ltd., номер серии 060401, и полученное в необходимых для эксперимента концентрациях в дистиллированной воде.
(2) Таблетка аспирина, покрытая энтеросолюбильной оболочкой, 0,3 г/таблетка, произведенная Yantai JUSTAWARE Pharmaceutical Co., Ltd. (Yantai Second Pharmaceutical Factory), номер серии 061102.
(3) Жидкость для перорального применения Цзичжи Сироп 200 мл/флакон, произведенная Fuling Pharmaceutical Factory, Taiji Group, номер разрешения SFDA Z50020615, дата изготовления 13 ноября 2006 и номер серии 0611034010.
2.1.2. Пироген:
Таблетка высушенных дрожжей, 0,2 г/таблетка, произведенная Zhanjiang Wuzhou Pharmaceutcal Ltd. (ранее известная как Zhuxi Count Pharmaceutical Factory, провинция Гуандун), номер серии 0611237.
2.1.3. Животные:
Шестьдесят крыс SD категории СПФ (свободные от специфической патогенной микрофлоры), среди которых число самцов и самок было одинаковым, со средней массой тела 178,27±10,42 г, предоставленных Vital River Laboratory Animal Technology Co., Ltd., Пекин, номер лицензии SCXK (Jing) 2002-0003.
2.2. Ход эксперимента.
Животные были случайным образом разделены на следующие шесть групп, поровну состоящих из самцов и самок, по десять животных в каждой: (1) эталонную контрольную группу, которой вводили физиологический раствор (10 мл/кг); (2) группу аспирина (0,15 г/кг); (3) группу жидкости для перорального применения Цзичжи Сироп (ЖПЦС группу, 11 мл/кг); (4) группу высокой дозировки лекарства согласно настоящему изобретению (группу B-дозировки, 8 г лекарственного сырья/кг); (5) группу средней дозировки лекарства согласно настоящему изобретению (группу C-дозировки, 4 г лекарственного сырья/кг); (6) группу низкой дозировки лекарства согласно настоящему изобретению (группу H-дозировки, 2 г лекарственного сырья/кг). В день, непосредственно предшествующий эксперименту, дважды измеряли ректальную температуру крыс. В качестве температуры тела перед введением принимали среднюю температуру. Начиная со следующего дня, каждому животному внутрижелудочно вводили соответствующее лекарство один раз в день три дня подряд (животным эталонной контрольной группы внутрижелудочно вводили эквивалентный объем физиологического раствора). Через 30 минут после последнего введения крысам групп, на которые оказывали воздействие, подкожно вводили суспензию, содержащую 15% дрожжей (10 мл/кг), при этом крысам эталонной группы аспирина лекарство внутрижелудочно вводили один раз перед введением дрожжевой суспензии. Температуру тела крыс групп, на которые оказывали воздействие, определяли через 2, 3, 4, 5, 6, 7, 8 и 9 часов после инъекции. Крысам групп, на которые оказывали воздействие, снова внутрижелудочно вводили соответствующие лекарства (в тех же дозах, что указаны выше). В каждый момент времени рассчитывали изменение температуры тела (∆°C). Сравнение групп проводили с помощью критерия Стьюдента.
2.3. Результаты испытания.
Из Таблицы 8 можно увидеть, что температура тела животных эталонной контрольной группы начинала расти через 2 часа после введения пирогена, достигала пика через 5 часов и постепенно понижалась через 6 часов. Прекращение лихорадки у животных группы аспирина было очевидным, и результаты через 2-9 часов после введения пирогена значительно отличаются от результатов эталонной контрольной группы (Р<0,001). Прекращение лихорадки у животных группы высокой дозировки через 2-9 часов после введения пирогена было явным, через 3-5 часов даже более явным, и результаты значительно отличаются от результатов эталонной контрольной группы (Р<0,05, Р<0,01). Результаты, отображающие прекращение лихорадки у животных группы средней дозировки, значительно отличаются от результатов эталонной контрольной группы через 2-5 часов после введения пирогена (Р<0,05-Р<0,01). Прекращение лихорадки у животных группы низкой дозировки не было явным. Результаты эксперимента показывают, что высокая и средняя дозы лекарства согласно настоящему изобретению способны значительно ослабить лихорадку, вызванную дрожжами, у крыс.
2.4. Краткое заключение
В данном эксперименте изучали влияние лекарства согласно настоящему изобретению на ослабление жара, вызванного дрожжами, у подопытных крыс. Результаты показывают, что высокая и средняя дозы лекарства согласно настоящему изобретению могут значительно уменьшить лихорадку, вызванную дрожжами у крыс, и тем самым оказать большее влияние на ослабление жара (Р<0,05, Р<0,01).
3. Вывод:
Два экспериментальных исследования, описанных выше, показывают, что лекарство согласно настоящему изобретению способно ослаблять жар.
Пример испытания 5
Противовоспалительная способность лекарства согласно настоящему изобретению.
1. Влияние лекарства согласно настоящему изобретению на опухание подушечки стопы крыс, вызванное каррагинаном.
1.1. Объекты эксперимента.
1.1.1. Лекарства:
(1) Лекарство согласно настоящему изобретению, 10,4 г лекарственного сырья/г, предоставленное Shijiazhuang Yiling Pharmaceutical Co., Ltd., номер серии 060401, и полученное в необходимых для эксперимента концентрациях в дистиллированной воде.
(2) Таблетка аспирина, покрытая энтеросолюбильной оболочкой, 0,3 г/таблетка, произведенная Yantai JUSTAWARE Pharmaceutical Co., Ltd. (Yantai Second Pharmaceutical Factory), номер серии 061102.
(3) Жидкость для перорального применения Цзичжи Сироп 200 мл/флакон, произведенная Fuling Pharmaceutical Factory, Taiji Group, номер разрешения SFDA Z50020615, дата изготовления 13 ноября 2006 и номер серии 0611034010.
(4) Каррагинан, продукция SIGMA, номер серии 117Н0151, полученный в необходимых для эксперимента концентрациях в дистиллированной воде.
1.1.2. Животные:
Шестьдесят самцов крыс линии Вистар класса I со средней массой тела 130,15±5,79 г, предоставленных Институтом изучения лабораторных животных Китайской академии медицинских наук, номер лицензии SCXK (Jing) 2000-0006.
1.2. Ход эксперимента.
Шестьдесят здоровых крыс были случайным образом разделены на следующие шесть групп: (1) эталонную контрольную группу, которой вводили физиологический раствор (10 мл/кг); (2) группу аспирина (0,15 г/кг); (3) группу жидкости для перорального применения Цзичжи Сироп (ЖПЦС группу, 11 мл/кг); (4) группу высокой дозировки лекарства согласно настоящему изобретению (группу B-дозировки, 8 г лекарственного сырья/кг); (5) группу средней дозировки лекарства согласно настоящему изобретению (группу C-дозировки, 4 г лекарственного сырья/кг); (6) группу низкой дозировки лекарства согласно настоящему изобретению (группу H-дозировки, 2 г лекарственного сырья/кг). Перед введением соответствующего лекарства или, в случае контрольной группы, физиологического раствора объем левой задней конечности (мл) каждого животного измеряли методом капиллярной амплификации и принимали в качестве значения. В качестве пути введения применяли внутрижелудочное введение, лекарства вводили раз в день три дня подряд, в то же время животным эталонной контрольной группы внутрижелудочно вводили эквивалентный объем физиологического раствора. Воспаление у каждой крысы вызывали с помощью подкожной инъекции 1% каррагинана в количестве 0,05 мл на животное в левую подушечку стопы через 30 минут после последнего введения. Объем левой задней конечности крыс определяли через 0,5, 1, 2, 4 и 6 часов после инъекции. Сравнение групп проводили на основании разницы объемов лапы до и после введения вещества, вызывающего воспаление, с помощью критерия Стьюдента.
1.3. Результаты испытания.
Как показано в Таблице 9 высокая доза лекарства согласно настоящему изобретению может значительно сдерживать опухание конечности крысы через 0,5, 1, 2, 4 и 6 часов после введения вещества, вызывающего воспаление, и демонстрирует значительную разницу в действии по сравнению с контрольной группой (Р<0,01, Р<0,001); средняя доза лекарства согласно настоящему изобретению может значительно сдерживать опухание конечности крысы через 0,5, 1, 2, 4 и 6 часов после введения вещества, вызывающего воспаление, и демонстрирует значительную разницу в действии по сравнению с контрольной группой (Р<0,05), а влияние низкой дозы лекарства согласно настоящему изобретению на сдерживание роста опухоли не очевидно.
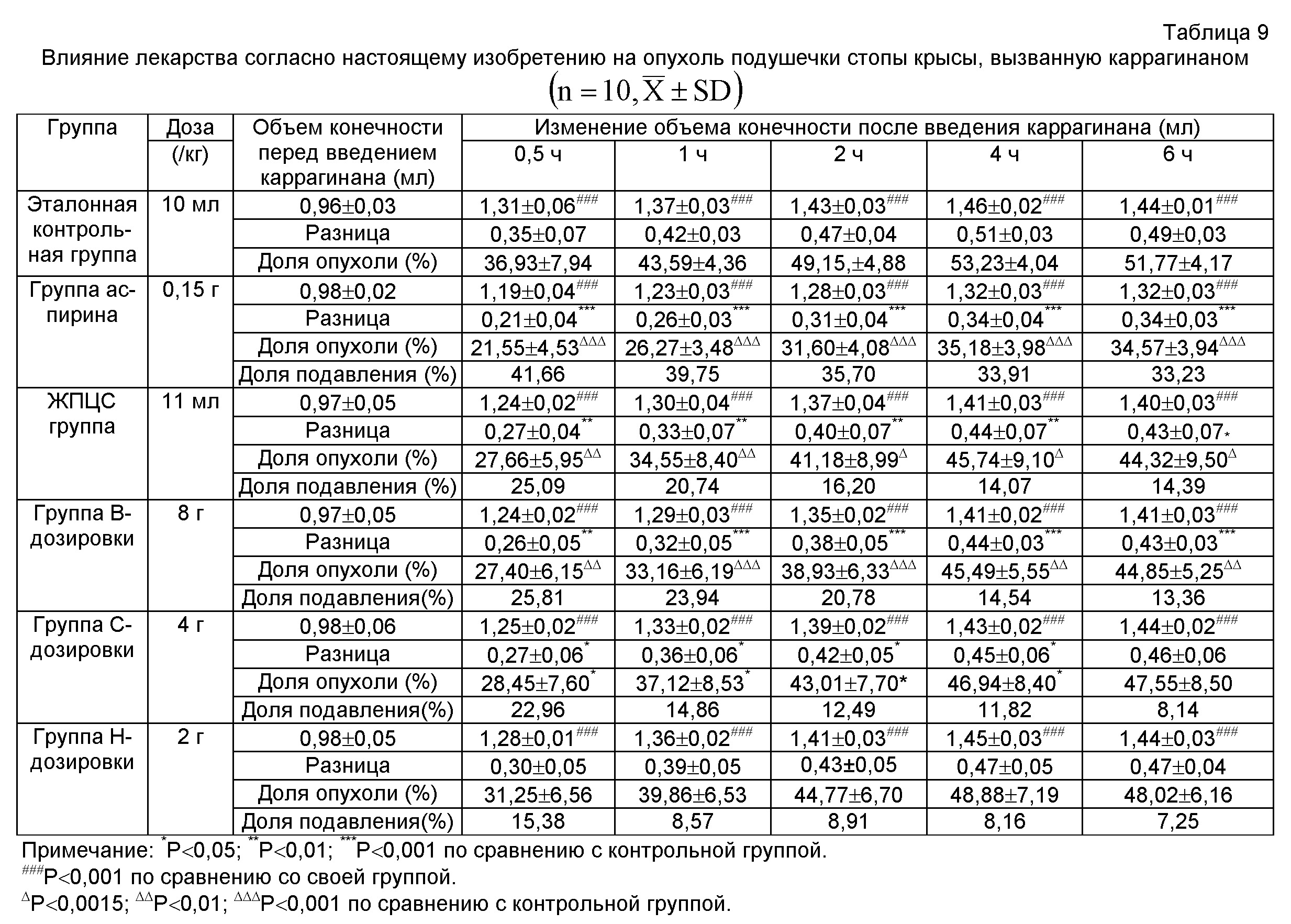
1.4. Краткое заключение
Результаты показывают, что высокая и средняя дозы лекарства согласно настоящему изобретению могут значительно подавлять воспалительную опухоль подушечки стопы крысы, вызванную каррагинаном (Р<0.05, Р<0.01, Р<0.001).
2. Влияние лекарства согласно настоящему изобретению на опухоль уха, вызванного ксилолом, у мышей.
2.1. Объекты эксперимента.
2.1.1. Животные:
Шестьдесят самцов мышей ICR категории СПФ (свободные от специфической патогенной микрофлоры) со средней массой тела 20,35±0,61 г, предоставленных Vital River Laboratory Animal Technology Co., Ltd., Пекин, номер лицензии SCXK (Jing) 2002-0003.
2.1.2. Лекарства:
(1) Лекарство согласно настоящему изобретению, 10,4 г лекарственного сырья/г, предоставленное Shijiazhuang Yiling Pharmaceutical Co., Ltd., номер серии 060401, и полученное в необходимых для эксперимента концентрациях в дистиллированной воде.
(2) Таблетка аспирина, покрытая энтеросолюбильной оболочкой, 0,3 г/таблетка, произведенная Yantai Justaware Pharmaceutical Co., Ltd. (Yantai Second Pharmaceutical Factory), номер серии 061102.
(3) Жидкость для перорального применения Цзичжи Сироп 200 мл/флакон, произведенная Fuling Pharmaceutical Factory, Taiji Group, номер разрешения SFDA Z50020615, дата изготовления 13 ноября 2006 и номер серии 0611034010.
2.1.3. Реагент:
Ксилол, А.Р., произведенный Пекинским химическим заводом, номер серии: 060202.
2.2. Ход эксперимента.
Шестьдесят здоровых мышей были случайным образом разделены на следующие шесть групп по десять животных в каждой: (1) эталонную контрольную группу, которой вводили физиологический раствор (25 мл/кг); (2) группу аспирина (0,2 г/кг); (3) группу жидкости для перорального применения Цзичжи Сироп (ЖПЦС группу, 16 мл/кг); (4) группу высокой дозировки лекарства согласно настоящему изобретению (группу В-дозировки, 12 г лекарственного сырья/кг); (5) группу средней дозировки лекарства согласно настоящему изобретению (группу С-дозировки, 6 г лекарственного сырья/кг); (6) группу низкой дозировки лекарства согласно настоящему изобретению (группу H-дозировки, 3 г лекарственного сырья/кг). Каждой мыши внутрижелудочно вводили соответствующее лекарство или, в случае контрольной группы, физиологической раствор один раз в день три дня подряд и на третий день через 30 минут после введения закапывали 0,1 мл ксилола в правое ухо мыши. Пятнадцать минут спустя животных умертвляли путем смещения позвонков. С помощью дырокола проделывали отверстия диаметром 6 мм в аналогичных местах правого и левого ушей. Кусочки правого и левого ушей по отдельности взвешивали на электронных весах. Степень опухания уха каждой мыши рассчитывали путем вычитания массы кусочка левого уха из массы кусочка правого. Степень опухания уха (мг) у мышей различных групп сравнивали с помощью критерия Стьюдента.
2.3. Результат испытания.
Как показано в Таблице 10, правые уши мышей контрольной группы значительно опухали с увеличением толщины и явно отличались от левых ушей. Высокая и средняя дозы лекарства согласно настоящему изобретению могут значительно сдерживать воспаление уха у мышей, вызванное ксилолом, при этом опухоли правых ушей у мышей значительно уменьшаются, и демонстрирует значительную разницу в действии по сравнению с эталонной контрольной группой (Р<0,05-Р<0,01). Низкая доза лекарства согласно настоящему изобретению не проявляет влияния на сдерживание роста опухоли и демонстрирует незначительную разницу в действии по сравнению с эталонной контрольной группой. Результаты эксперимента показывают, что высокая и средняя дозы лекарства согласно настоящему изобретению оказывают лучшее противовоспалительное действие на опухание уха у подопытной мыши, вызванное ксилолом.
|
2.4. Краткое заключение
Результаты эксперимента показывают, что высокая и средняя дозы лекарства согласно настоящему изобретению оказывают значительное противовоспалительное действие на опухание уха у подопытной мыши, вызванное ксилолом.
3. Вывод:
Два экспериментальных исследования, описанных выше, показывают, что лекарство согласно настоящему изобретению имеет противовоспалительное действие.
Пример испытания 6: Токсикологическое исследование лекарства согласно настоящему изобретению
1. Эксперимент по исследованию острой интоксикации, вызванной настоящим лекарством, проводили на мышах. Поскольку ЛД50 не могла быть измерена, определяли максимальную дозу. Мышам внутрижелудочно вводили лекарство. Результат эксперимента показывает, что не выявлено нежелательной лекарственной реакции и смерти животных при введении максимальной дозы, равной 280 г лекарственного сырья/г, что превышает клиническую дозу в 436 раз (клиническая доза представляет собой 45 г лекарственного сырья/чел/день при массе тела человека, равной 70 кг). По завершении эксперимента животных вскрывали и в каждом из органов не наблюдали никаких патологических изменений, видимых невооруженным глазом.
2. 120 крыс линии Вистар были разделены на контрольную группу и группы, на которых испытывали лекарство согласно настоящему изобретению, вводимое в дозах, равных 15 г, 30 г и 60 г лекарственного сырья/кг (что превышает клиническую дозу соответственно в 25, 50, 100 раз). Лекарство согласно настоящему изобретению внутрижелудочно вводили испытуемым животным 12 и 24 недели подряд, после чего возвращали животных в исходное состояние (то есть прекращали вводить лекарство и ждали еще 4 недели). Результаты эксперимента показывают, что после введения лекарства согласно настоящему изобретению в течение 12 и 24 недель и в период восстановления крысы испытательных групп не обнаруживают значительной разницы в массе тела, количестве принимаемой пищи и времени свертывания крови по сравнению с крысами контрольной группы. Измеренные гематологические показатели свидетельствуют о том, что животные группы высокой дозировки после введения лекарства в течение 12 недель и животные группы средней дозировки в период восстановления имеют повышенный уровень красных кровяных телец и гемоглобина по сравнению с животными контрольной группы (Р<0,05), при этом уровень красных кровяных телец находится в пределах нормального диапазона (7,49±0,64), а уровень гемоглобина может быть связан с немного повышенным уровнем некоторых животных. Разница в значениях всех прочих гематологических показателей животных испытательных групп после введения лекарства в течение 24 недель и в период восстановления незначительна по сравнению с контрольной группой. Разница в количестве ретикулоцитов каждого животного испытательных групп введения лекарства в течение 12 и 24 недель и периода восстановления незначительна по сравнению с контрольной группой. Двенадцать измеренных биохимических показателей крови свидетельствуют, что уровень АЛТ и глюкозы у животных группы средней дозировки и уровень ACT у животных группы низкой дозировки после введения лекарства в течение 12 недель немного повышены по сравнению с контрольной группой (Р<0,05), и все они находятся в пределах нормального диапазона (равного 43,15±21,84, 6,18±2,04 и 139,80±40,25 соответственно, n=630). Разница в значениях всех прочих биохимических показателей крови животных испытательных групп после введения лекарства в течение 24 недель и в период восстановления (отмены введения лекарства на протяжении 4 недель) незначительна по сравнению с контрольной группой. В каждой из групп введения лекарства в течение 12 и 24 недель и периода восстановления (отмены введения лекарства на протяжении 4 недель) аномальные значения электрокардиографических показателей в стандартном отведении II электрокардиограммы, таких как интервал PR, интервал QRS, интервал QT, амплитуда зубца T, частота сердечных сокращений и т.д., не наблюдались. Согласно большому количеству данных исследований в анатомии аномальных изменений в органах животных каждой из групп обнаружено не было, и разница в значениях показателей органов была незначительна. При медико-патологическом исследовании явных патологических изменений органов, вызванных интоксикацией из-за введения лекарства согласно настоящему изобретению, обнаружено не было.
3. Вывод:
С помощью испытания острой (эксперимент с применением максимальной дозы) и хронической токсичности было продемонстрировано, что разница в значениях различных показателей каждой испытательной группы незначительна по сравнению с контрольной группой. При медико-патологическом исследовании явных патологических изменений органов, вызванных интоксикацией из-за введения лекарства согласно настоящему изобретению, обнаружено не было. Таким образом, нетоксичность лекарства согласно настоящему изобретению подтверждена.
В заключение необходимо отметить, что различные аспекты, такие как остановка кашля, рассеивание флегмы, облегчение астмы, снятие воспаления и т.д., подтвердили, что лекарство согласно настоящему изобретению оказывает хороший терапевтический эффект при бронхите, в частности отличный терапевтический эффект при остром трахеобронхите.