Результат интеллектуальной деятельности: БИОКОМПОЗИТ ДЛЯ ОБЕСПЕЧЕНИЯ ВОССТАНОВИТЕЛЬНЫХ ПРОЦЕССОВ ПОСЛЕ ПОВРЕЖДЕНИЯ У МЛЕКОПИТАЮЩЕГО, СПОСОБ ЕГО ПОЛУЧЕНИЯ (ВАРИАНТЫ) И ПРИМЕНЕНИЯ
Вид РИД
Изобретение
Группа изобретений относятся к медицине и ветеринарии и может быть использована для восстановления поврежденных тканей и органов млекопитающих.
Известные в настоящее время инновационные способы восстановления тканей и органов базируются на использовании тканеинженерных конструкций, содержащих либо различные клеточные популяции, либо разнообразные генетические конструкции (нуклеиновые кислоты). Однако оба направления - клеточное и генное - являются, хоть и перспективными, но умеренно ограниченно эффективными.
Известен способ местного введения только генетических конструкций с помощью ультразвука [1, 2]. Однако при безопасных для реципиента параметрах ультразвукового излучения эффективность введения генетических конструкций низкая. Доставка нужного количество генетических конструкций возможна только под действием ультразвука высокой интенсивности, который оказывает на ткани повреждающее действие [3, 4].
Известен способ местного введения нуклеиновых кислот в комплексе с липосомами [5] и его модификация - комбинированное введение конъюгата липосом с генетическим конструкциями под действием физических факторов (ультразвук) [6]. Однако значительная часть липосом разрушается под действием тканевых липолитических ферментов, что снижает эффективность доставки действующего вещества - нуклеиновых кислот. Оставшаяся часть поступает практически единовременно, что не позволяет добиться пролонгированного эффекта. Кроме того, при транспорте в клетки-мишени комплекс «липосома-генетическая конструкция» не разрушается - липосомы поступают в клетки, что снижает безопасность метода.
Известен способ введения нуклеиновых кислот с помощью электропорации [6, 7]. Однако метод основан на применении электрического поля, которое проталкивает генетические конструкции (в «чистом виде» или в комплексах со вспомогательными веществами) через биологические мембраны, в результате чего значительная часть генетических конструкций повреждается. Недостатком метода также является невозможность достичь пролонгированного эффекта, необходимость повторного применения метода.
Известен способ местного введения тканеинженерной конструкции, состоящей из трехмерного носителя и адгезированных к его поверхности клеток [8]. Однако клетки требуют активного кровоснабжения - критическая удаленность от гемомикроциркуляторного русла, более которой клетки неизбежно погибают, составляет 200-500 мкм [9]. В этой связи объем тканеинженерной конструкции, при котором клетки, входящие в ее состав, после введения в организм реципиента могут сохранить жизнеспособность, должны составлять не более 1 см3.
Дефекты такого размера вообще не нуждаются в дополнительных оптимизирующих ход восстановительного процесса влияниях, поэтому существует потребность в замещении протяженных (объемных) костных дефектов, в случае которых показаны к применению тканеинженерные конструкции значимо большего объема (от 1 см3). Однако трансплантация таких больших конструкций неизбежно сопровождается гибелью большей части вводимых клеток (особенно тех из них, которые локализованы в центральной части изделия и в наибольшей степени испытывают нехватку оксигенации), что существенно уменьшает эффективность метода. Клетки нуждаются в оксигенации, поэтому чем больше размер тканеинженерной конструкции, тем больше ее клеток погибает после трансплантации изделия. Таким образом, в тканеинженерных конструкциях больших размеров (более 1 см3) значительная часть клеток гибнет, в связи с чем эффективность целевого действия (обеспечения репаративного процесса) изделия становится сопоставима с эффективностью носителя без клеток вообще, что позволяет сделать следующие выводы: включение только лишь клеток в состав тканеинженерных конструкций не является в достаточной степени эффективным подходом; необходим поиск других более эффективных решений.
Из уровня техники известны активированная матрица, способ ее получения и способ местного введения нуклеиновых кислот на биосовместимых матрицах из различных материалов для обеспечения репаративных процессов [10]. Однако эти технические решения имеют отношение к строго двухкомпонентному продукту, состоящему только из носителя и генетических конструкций. Клеточный элемент, как критически необходимый для оптимального гистотипического восстановления тканей и органов, в данном случае отсутствует, поэтому эффективность применения продукта умеренная.
Ближайшим аналогом является частный вариант трехкомпонентного биокомпозита, состоящий из носителя из полилактокогликолида (PLGA), плазмидной ДНК с геном ВМР-4 и гетерогенной популяции предварительно культивированных стромальных клеток костного мозга [11]. Такой вариант биокомпозита имеет ряд недостатков. Во-первых, обладает недостаточно благоприятным механизмом синергичного действия клеток и генных конструкций, так как экспрессия плазмидных ДНК с геном ВМР-4 клетками материала или реципиента (после трансплантации) способствуют только дифференцировке клеток в остеогенном направлении, при этом не влияет на их выживаемость, которая остается все такой же низкой, как в случае трансплантации двухкомпонентного биокомпозита, состоящего из носителя и клеток. Эти недостатки были признаны и авторами данного исследования, в виду чего они были вынуждены усложнить биокомпозит, добавив к нему четвертый компонент - белок VEGF. Только в этом случае исследователи отметили выраженный положительный эффект в виде усиления гетеротопического остеогенеза. Однако использование в одной системе синтетического носителя, плазмидных ДНК, предварительно культивированных клеток и рекомбинантных белковых факторов роста обусловливает чрезмерную неоправданно высокую стоимость изделия. Кроме того, факторы роста (рекомбинантные белки) являются короткоживущими и короткодистантными, быстро распадаются в кислой среде операционной раны в условиях воспаления, характерного для первой стадии раневого процесса. В этой связи включенный в состав биокомпозита рекомбинантный белок не может в полной мере проявить свое теоретически возможное действие. Подтверждением тому являются данные авторов статьи, которые использовали белок VEGF в трехкомпопентной системе без плазмидных ДНК (носитель из PLGA + клетки + белок VEGF), что не привело к удобоваримому результату - эффективность такого биокомпозита была низкой. По мнению авторов, причиной недостаточной эффективности трехкомпонентных вариантов являлась ограниченность специфической функции каждого из компонентов биокомпозита, в связи с чем исследователи пошли по пути усложнения изделия и добавили четвертый компонент - плазмидные ДНК с геном, кодирующим BMP-4.
Необходимо отметить, что в большинстве исследований авторы ведут работу по пути усложнения биокомпозитов, включая в их состав все большее количество компонентов различной природы (материалы носителей, биологически активные белки, клеточные популяции, генные конструкции, фармацевтические субстанции, липосомальные элементы, экзосомы и т.д.). Однако наряду с возможным положительным эффектом таких систем обратной стороной их многокомпонентности может стать возникновение нежелательных явлений, в частности повышение риска развития реакции индивидуальной непереносимости (гиперчувствительности) к какому либо компоненту (чем больше компонентов, тем, закономерно, выше риск) и т.д. В этой связи идеальным вариантом являлось бы минимальное воздействие (минимальное количество компонентов биокомпозита) с оптимальной эффективностью. Наши изобретения позволяют решить крайне сложную задачу - создание биокомпозита с минимальным, но достаточным для обеспечения репаративной регенерации количеством компонентов, подбор их оптимального состава и технологии объединения в единое медицинское изделие.
Настоящая группа изобретений относится к принципиально новому подходу гистотипического заживления повреждения у млекопитающего за счет введения в организм реципиента единого генно-клеточного комплекса для оптимального - выраженного и пролонгированного - проявления целевого действия. При этом компоненты биокомпозита оптимально подобраны, а варианты технологии совмещения в единое изделие позволяют достичь максимальной концентрации генных конструкций и клеток при сохранении их биологической активности.
В нашем случае были использованы плазмидные ДНК с генами, кодирующими другие факторы роста: VEGF и (или) SDF-1, которые обладают более широким биологическим эффектом, включающим индукцию ангиогенеза. Именно активация ангиогенеза, привлечение дополнительных камбиальных клеток к месту трансплантации биокомпозита за счет экспрессии его генных конструкций обеспечивает в том числе и повышение выживаемости клеток, входящих в состав биокомпозита, что и обеспечивает синергичное действие всех компонентов биокомпозита и, как результат, высокую эффективность активизации репаративного процесса. Другими словами новизна подхода состоит в том, что компоненты, включенные в состав биокомпозита, нацелены не только на непосредственное обеспечение репаративного процесса за счет прямого влияния на клетки реципиентного ложа, но и характеризуются опосредованным действием на репаративную регенерацию посредством взаимного потенцирования: плазмидные ДНК обеспечивают выживаемость клеток биокомпозита, а клетки - доставку плазмидпых ДНК в целевую область, их экспрессию. При этом количество компонентов и сложность биокомпозита являются минимальными, но достаточными для высокой эффективности даже в случае «фреш-популяции» клеток (некультивированных, полученных непосредственно перед введением биокомпозита в организм реципиента), использование которых также удешевляет и ускоряет процесс изготовления биокомпозита.
Кроме того, необходимо отметить, что выбор носителя также является одним из наиболее проблемных аспектов создания биокомпозитов с биологически активными компонентами, особенно трехкомпонентных содержащих клетки и генетические конструкции одновременно. Носитель в этом случае должен обеспечивать как оптимальную адгезию клеток без снижения их морфофункциональной активности, так и характеризоваться высокой «емкостью» для генетических конструкций. При этом биорезорбция материала не должна быть быстрой (менее 2 месяцев) или чрезмерно продолжительной (более года). Так, в работе [11] использован ко-полимер молочной и гликолевой кислот, который в процессе синтеза имеет жидкую фазу, оптимальную для включения в состав нуклеиновых кислот, а также не оказывает токсического действия на клетки, что обеспечивает эффективность его использования как средства доставки биологически активных компонентов. Однако скорость биорезорбции материала довольно высокая - не более 2 мес, а химические вещества, входящие в его состав, не являются структурными компонентами межклеточного матрикса, что в целом ограничивает «самостоятельную» эффективность материала в оптимизации репаративной регенерации тканей.
В ходе проведенных исследований нами были выбраны наиболее эффективные материалы носителя, которые, помимо функции средства доставки, обладают еще и собственной, хоть и умеренной, активностью в обеспечении репаративной регенерации тканей: носители, содержащие коллаген, гидроксиапатит, кальцийфосфат или другие компоненты внеклеточного матрикса.
Таким образом, вопреки сформировавшемуся тренду разработок многокомпонентных сложных биокомпозитов мы разработали варианты трехкомпонентных генно-клеточных изделий, которые оказались высокоэффективными для обеспечения репаративной регенерации тканей.
Создание и применение генно-клеточного материала согласно нашему изобретению позволяет добиться введения максимального количества нуклеиновых кислот и необходимых для оптимального восстановления тканей и органов клеточных элементов в целевую область, достичь синергичного действия активных компонентов, пролонгированного эффекта и избежать недостатков аналогов.
Способ повышает эффективность восстановления тканей и органов за счет:
- оптимальной доставки нуклеиновых кислот, защищенных от повреждающих факторов реципиентного ложа, в организм реципиента, а также пролонгированного высвобождения их из структуры носителя, то есть пролонгирования целевого эффекта;
- введения в организм реципиента необходимой популяции клеток, обеспечивающих гистотипическое восстановление целостности тканей и органов;
- синергичного действия нуклеиновых кислот и клеток, входящих в состав единого биокомпозита медицинского назначения.
В одном аспекте изобретение относится к биокомпозиту для обеспечения восстановительных процессов после повреждения у млекопитающего, состоящему из носителя, содержащего коллаген, и/или гидроксиапатит, и/или кальцийфосфат, и/или продукты внеклеточного матрикса, по меньшей мере одной нуклеиновой кислоты, содержащей гены, кодирующие VEGF и/или SDF-1, и клеток, обеспечивающих репаративную регенерацию.
Нуклеиновые кислоты выбирают из группы: ДНК, кодирующие гены, ДНК, некодирующие гены, ДНК, содержащиеся в векторных молекулах (таких, как плазмиды, вирусы, эписомы, транспозоны), свободные линейные ДНК, одноцепочечные РНК, двуцепочечные РНК, РНК, содержащие модифицированные рибонуклеотиды, РНК, имеющие 5'-кэп или нет, РНК, содержащие 3'-поли А или нет, микроРНК или siPHK. Нуклеиновые кислоты могут быть включены в состав композита в нескольких возможных вариантах в зависимости от того, с каким компонентом носителя они непосредственно связаны. Средство для восстановления тканей и органов содержит по меньшей мере одну нуклеиновую кислоту или различные их сочетания, при этом нуклеиновая кислота может кодировать по меньшей мере один ген. Возможно использование поликассетных генетических конструкций.
Выбор целевого гена или нескольких целевых генов, заключенных в один тип нуклеиновых кислот, либо выбор сразу нескольких типов нуклеиновых кислот, содержащих разные целевые гены, для создания композита определяется тем, за счет каких механизмов планируется реализовать восстановление тканей и органов, и связан с биологическим действием конкретного фактора, кодируемого целевыми генами нуклеиновых кислот. В частности, для восстановления тканей и органов за счет индукции ангиогенеза целесообразно использовать нуклеиновые кислоты, содержащие гены, кодирующие сосудистый эндотелиальный фактор роста (VEGF) или фактор стромальных клеток-1 (SDF-1).
Носитель может быть твердым органической или неорганической природы, выбранным из группы: металлический, коллагеновый, хитозановый, кальцийфосфатный, гидроксиапатитовый, биокерамический, биостеклянный, алюминатный материал, очищенные белки, продукты внеклеточного матрикса или их комбинации.
Носитель может быть жидким, а именно 0,9% раствор NaCL, растворы декстранов, солевые растворы (Рингера, Хенкса), растворы органических кислот - компонентов аморфоного вещества межклеточного матрикса (гиалуроновая, хондроитинсерная кислоты и др.).
Носитель может быть в форме геля (коллагеновый, альгинатный, желатиновый и др.), золя, мази, крема или их комбинации.
Носитель может представлять собой комплексный материал, содержащий твердые, жидкие, гелевые, мазевые и кремовые материалы в различных комбинациях.
Носитель может быть наноструктурированным материалом.
Выбор клеточной популяции определяется гистогенетической природой ткани, на восстановление целостности которой направлен получаемый композит. Для создания композита целесообразно использовать именно те виды клеток, которые либо способны к дифференцировке по направлению в клетки поврежденных тканей, либо уже являются дифференцированными клетками, соответствующими клеткам поврежденных тканей, а также клетки, которые могут “обеспечить процессы гистотипической репаративной регенерации”. К таковым относятся практически любые клетки, способные продуцировать необходимые факторы роста или каким-либо иным опосредованным путем оптимизировать ход репаративного процесса, например путем стимуляции, обеспечения ангиогенеза.
Биокомпозит может содержать аутогенные и/или аллгогенные клетки. Клетки могут являться производными одной или разных цитогенетических линий.
Биокомпозит может содержать стволовые, малодифференцированные прогениторные или дифференцированные клетки или смесь клеток разной степени дифференцировки.
Биокомпозит может содержать клетки, полученные непосредственно от млекопитающего, т.е. клетки, которые использовали сразу же после получения - без лабораторных технологий клеточного процессинга (культивирования, иммунофенотипирования, индукции дифференцировки). Также биокомпозит может содержать клетки, которые предварительно подвергали лабораторным технологиям клеточного процессинга (культивированию, иммунофенотипированию, индукции дифференцировки или трансфекции генетическими конструкциями).
Изобретение также относится к способам получения биокомпозита. Возможны следующие варианты его осуществления:
1. Совмещение, по меньшей мере, одной нуклеиновой кислоты с носителем и последующее добавление клеток, обеспечивающих гистотипическую репаративную регенерацию, к полученному комплексу носитель с, по меньшей мере, одной нуклеиновой кислотой.
2. Совмещение, по меньшей мере, одной нуклеиновой кислоты с носителем и добавление предварительно трансфецированных по меньшей мере одной нуклеиновой кислотой клеток, обеспечивающих гистотипическую репаративную регенерацию, к полученному комплексу носитель с, по меньшей мере, одной нуклеиновой кислотой.
3. Совмещение по меньшей мере одной нуклеиновой кислоты с носителем, при этом нуклеиновую кислоту предварительно объединяют с клетками, обеспечивающими гистотипическую репаративную регенерацию, а после этого трансфецированные клетки добавляют к носителю.
4. Совмещение сначала клеток с носителем, после чего - добавление нуклеиновых кислот.
5. Способ, в котором для создания изделия сначала совмещают одну клеточную популяцию с носителем, в то же время другую клеточную популяцию трансфецируют генетическими конструкциями, а уже после этого трансфецированные клетки и изделие, состоящее из клеток и носителя, объединяют в композит.
Взаимодействие нуклеиновых кислот и носителя может состоять в обратимом взаимодействии генетических конструкций с компонентами носителя в виде слабых (временных) химических связей с компонентами носителя, в виде импрегнации в структуру носителя (например, жидкого, мазевидного или гелевого носителя) или в виде нанесения на поверхность твердого носителя с помощью различных клеящих субстанций. В связи с обратимостью взаимодействия нуклеиновых кислот и носителя после контакта (взаимодействия) композита с биологическими жидкостями (в частности, после введения в организм реципиента) генетические конструкции последовательно высвобождаются под действием факторов реципиентного ложа, а также при биорезорбции носителя (если носитель состоит из биорезорбируемых материалов).
Компонентами носителя, способными образовывать химические связи с нуклеиновыми кислотами, могут служить гидроксиапатит, флуороапатит [12], карбонилимидазол [13], полиакриламид [14], полимеры метакриловой кислоты [15] и др. Носитель защищает действующее вещество - компартментализированную нуклеиновую кислоту - от повреждающих факторов тканей реципиентного ложа и позволяет пролонгировать эффект за счет временной химической связи с генетическими конструкциями. Прочность химической связи нуклеиновых кислот с носителем может быть различной в зависимости от материала носителя и вида нуклеиновых кислот: варьируется в интервале от полного отсутствия таковой до практически необратимой связи.
Взаимодействие нуклеиновых кислот и клеток, входящих в состав композита, состоит в трансфекции клеток генетическими конструкциями. Введение нуклеиновых кислот внутрь клеток может выполняться как in vitro до совмещения с носителем, так и реализовываться уже в объеме носителя, когда сначала совмещают нуклеиновые кислоты с носителем, а уже после этого привносят клетки.
Количество нуклеиновых кислот для создания композита определяется емкостью носителя, то есть максимальным количеством нуклеиновых кислот, которые могут быть размещены на его поверхности или в его объеме, а также количеством нуклеиновых кислот, которым может быть трансфецирована популяция клеток, подлежащих совмещению с носителем для создания композита. Таким образом, количество зависит от конкретной ситуации и может быть легко подобрано специалистом.
Клетки, входящие в состав композита, адгезированы к поверхности твердого носителя за счет реализации разнообразных механизмов клеточно-матриксного и клеточно-клеточного взаимодействия или локализованы в объеме жидкого, гелевого или мазеподобного носителя. Количество клеток, необходимое для создания композита, с одной стороны, определяется площадью поверхности (для твердых) или объемом (для жидких и гелеобразных) носителя, а с другой, минимально необходимой концентрацией для обеспечения репаративной регенерации поврежденных тканей, и также эффективное количество может быть определено специалистом исходя из конкретных условий.
Синергичное действие нуклеиновых кислот и клеток может быть различным в зависимости от технологии их объединения с носителем в единое медицинское изделие, от вида генетических конструкции и типов клеток. Синергичное действие реализуется на двух этапах: при создании изделия и непосредственно после его трансплантации в организм реципиента. На этапе создания изделия синергичность заключается в возможности трансфекции клеток нуклеиновыми кислотами (всеми при трансфекции in vitro или частью при трансфекции в объеме носителя), что позволяет, с одной стороны, повысить количество вводимых нуклеиновых кислот, а с другой, оптимизировать свойства клеточной популяции, индуцировав экспрессию целевых генов, содержащихся во введенных нуклеиновых кислотах. Наиболее эффективными технологиями реализации этого аспекта синергичного действия являются трансфекция клеток in vitro (совмещение клеток и нуклеиновых кислот) и объединение с носителем уже трансфицированных клеток, совмещение клеток с комплексом «носитель-нуклеиновые кислоты», трансфекция клеток in vitro и последующее объединение с комплексом «носитель - нуклеиновые кислоты». Наименее эффективным вариантом является совмещение клеток с носителем с последующим добавлением нуклеиновых кислот, так как технология внесения нуклеиновых кислот включает использование реагентов и физических факторов (высушивание), повреждающих клетки. После введения в организм реципиента генетические конструкции транспортируются клетками реципиентного ложа и клетками трансплантированного изделия, экспрессируются, а продукт экспрессии индуцирует и поддерживает морфофункциональную активность в том числе и введенных в состав изделия клеток.
В другом аспекте изобретение относится к способам применения биокомпозита. Биокомпозит может быть использован для эффективной доставки нуклеиновых кислот млекопитающему.
Также биокомпозит может быть применен в способе обеспечения гистотипического заживления повреждения у млекопитающего.
Способы введения бокомпозита могут быть различными и зависят от его формы и характера повреждений тканей и органов. Так, например, возможно введение непосредственно в область поврежденных тканей при выполнении хирургической операции или манипуляции. Допустимо инъекционное введение композита (носитель которого жидкость или гель) в организм реципиента - внутривенное, внутриартериальное, внутримышечное, внутрикожное, подкожное, внутрикостные, эндолюмбальное, субдуральное, внутрисуставное, эндобульбарное, а также аппликационное применение композита при условиях жидкой, гелевой, кремовой, мазевой формы носителя.
В соответствии с этапностью создания композита возникает необходимость использования двух наборов: первый для содержания в подходящей емкости комплекса «носитель-нуклеиновые кислоты», второй - для совмещения комплекса «носитель-нуклеиновые кислоты» с клетками, его размещения и транспортировки. Первый набор представляет собой изделие из двух оболочек: внутренняя - стерильная и внутри и снаружи (предназначена для размещения комплекса «носитель-нуклеиновые кислоты» и сохранения его стерильности); внешняя - стерильная только изнутри, снаружи нестерильная, плотно фиксирующая внутреннюю, но при этом легко раскрываемая руками без касания внутренней стерильной части и обеспечивающая стерильность внутренней части, защиту от механических повреждений.
Второй набор, предназначенный для совмещения комплекса «носитель-нуклеиновые кислоты», представляет собой стерильную емкость из стекла или полимерных материалов различного объема, необходимого для размещения носителя с нуклеиновыми кислотами, культуральной среды или биологической жидкости (например, кровь) с клетками. Стерильная емкость помещена также в упаковку из двух оболочек - внутренней стерильной с двух сторон и внешней - стерильной изнутри, но нестерильной снаружи.
Таким образом, набор для приготовления биокомпозита содержит в отдельной емкости комплекс носитель с, по меньшей мере, одной нуклеиновой кислотой и емкость для совмещения указанного комплекса с биологической жидкостью или культуральной средой с клетками, обеспечивающими гистотипическую репаративную регенерацию.
Возможность осуществления изобретений целесообразно проиллюстрировать в примерах: создание композита за счет объединения носителя, содержащего гидроксиапатит и костный коллаген, с популяцией аутогенных мононуклеарных клеток крови и генетической конструкцией, содержащей нуклеотидную последовательность с геном VEGF (см. патент RU 2297848), и его применение для обеспечения репаративной регенерации костной ткани - восполнения костного дефекта протяженностью 2 см болышеберцовой кости кролика.
Пример 1. Химическое связывание нуклеиновой кислоты и носителя
1. Подготовка носителя (в данном примере его объем 1 см3):
а) отмывка (инкубирование в 0,5 М фосфата в объеме 1 мл при температуре 37°C при постоянном встряхивании в течение 12 часов);
б) уравновешивание (обработка 10 мМ фосфата в объеме 1 мл при температуре 37°C при постоянном встряхивании, 3 раза по 10 мин);
в) высушивание (инкубирование при температуре 37°C до полного высыхания - 3 часа).
2. Нанесение нуклеиновой кислоты (инкубирование с раствором, содержащим плазмиды ДНК, в объеме 100 мкл в 10мМ фосфата в концентрации 1 мкг/мкл при температуре 37°C и постоянном встряхивании в течение 12 часов) с учетом расчетной емкости носителя для нуклеиновых кислот, которая в данном примере составляет 202,765 нг нуклеиновых кислот на 1 мг носителя.
3. Обработка полученного комплекса «носитель-генетическая конструкция»:
а) промывка (обработка 5 мМ раствором фосфата в объеме 1 мл 3 раза);
б) высушивание (инкубирование при температуре 37°C до полного высыхания - 3 часа).
4. Совмещение комплекса «носитель-нуклеиновые кислоты» с популяцией аутогенных мононуклеарных клеток крови, полученной непосредственно перед операцией - при выполнении операционного доступа. Комплекс «носитель-нуклеиновые кислоты» объемом 1 см3 помещали в стерильную емкость с 5 мл крови пациента, забранной шприцем из области поврежденных тканей при реализации операционного доступа. Время экспозиции составляло несколько минут - время, достаточное для заполнения всех пор носителя с нуклеиновыми кислотами кровью, содержащей аутогенные мононуклеарные клетки, обеспечивающие гистотипическую репаративную регенерацию костной ткани.
Пример 2. Трансплантация полученного в примере 1 комплекса. Этап трансплантации изделия медицинского назначения в эксперименте. Модель: костный дефект протяженностью 2 см большеберцовой кости кролика. Сначала вводят спицы Киршнера для фиксации диастаза и оси конечности, после чего помещают в костный дефект биокомпозит.
На Рисунках приведены данные, подтверждающие эффективность введения химически компартментализованного генетического материала и клеток для обеспечения репаративного остеогенеза.
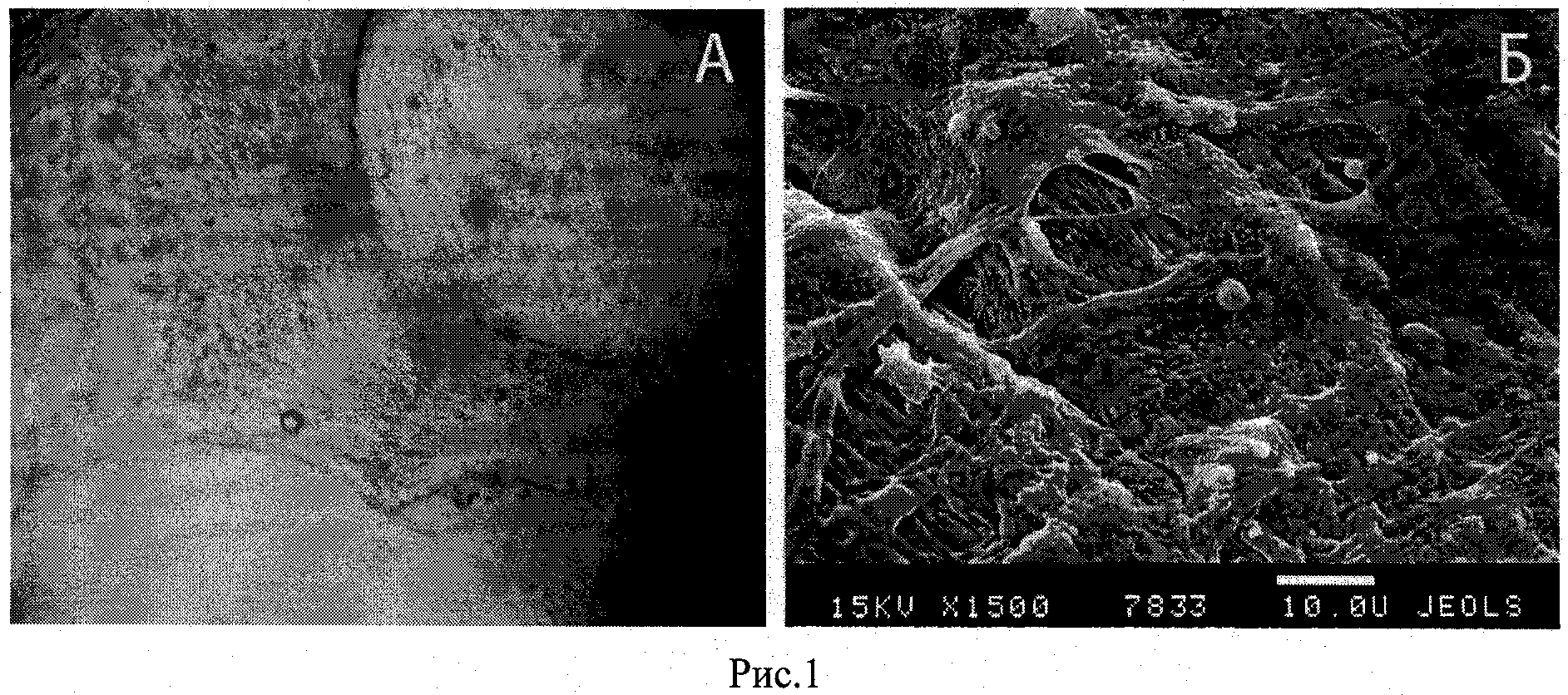
Рис.1. Композит, состоящий из клеток и нуклеиновых кислот, совмещенных с носителем из остеопластического материала: А - световая микроскопия, Б - сканирующая электронная микроскопия.
Рис.2. Этап трансплантации изделия медицинского назначения в эксперименте. А - дефект до введения биокомпозита, введены спицы Киршнера для фиксации диастаза и оси конечности; Б - биокомпозит, введенный в костный дефект.
Рис.3. Большеберцовая кость кролика. В центральной части определяется костный регенерат (обозначен белой стрелкой), образованный с помощью композита.
Рис.4. Костный регенерат, образованный с помощью введенного химически компартментализованного генетического материала и клеток. Гистологическая картина. Окраска: гематоксилин, эозин. Световая микроскопия. Ув. ×100.
Для подтверждения химического связывания нуклеиновой кислоты и носителя из остеопластического материала после промывки и высушивания полученного изделия выполняли диссоциацию - разрушение связи и высвобождение нуклеиновой кислоты в раствор. Для этого изделие обрабатывали 0,5 М фосфата в объеме 50 мкл при 37°C при постоянном встряхивании в течение 10 мин, а раствор с элюированной нуклеиновой кислотой подвергали спектрофотометрии (спектрофотометр Nanodrop-1000). В результате было установлено содержание нуклеиновых кислот в растворе в количестве 202,765 нг на каждый мг носителя (разные носители обладают разной емкостью).
Для подтверждения возможности совмещения популяции аутогенных мононуклеарных клеток крови с изделием выполняли световую микроскопию, идентифицируя клетки, адгезированные к поверхности носителя. Методами световой, сканирующей и трансмиссионной электронной микроскопии было установлено, что клетки адгезированы к поверхности матрикса, распластаны, занимают практически всю свободную поверхность носителя (Рис.1.).
Приведенный пример демонстрирует выполнимость объединения нуклеиновых кислот, клеток и носителя, возможность введения полученного изделия медицинского назначения в организм реципиента, а также демонстрирует более быстрое и эффективное восстановление целостности кости голени кролика.
Пример 3. Получение различных вариантов биокомпозита
Были изготовлены комплексы из различных материалов носителей и нуклеиновых кислот в концентрациях, указанных ниже:
- комплекс из кальция фосфата и нуклеиновых кислот, добавленных в концентрации 72,5 нг на 1 мг носителя;
- комплекс из гидроксиапатита и нуклеиновых кислот, добавленных в концентрации 347,8 нг на 1 мг носителя;
- комплекс из аллогенного деминерализованного костного матрикса и нуклеиновых кислот, добавленных в концентрации 108,4 нг на 1 мг носителя;
- комплекс из ксеногенного депротеинизированного костного матрикса и нуклеиновых кислот, добавленных в концентрации 285,7 нг на 1 мг носителя;
- комплекс из кальция фосфата с гидроксиапатитом и нуклеиновых кислот, добавленных в концентрации 520,1 нг на 1 мг носителя.
Каждый из указанных комплексов был получен с помощью технологии (протокола), указанной в примере 1. Клетки были добавлены к комплексам из носителей и нуклеиновых кислот на втором этапе получения биокомпозита. При этом в каждом случае были использованы различные клеточные типы (выделенные по различным технологиям): культура мультипотентных мезенхимных стромальных клеток, культура фибробластов, культура остеогенных клеток надкостницы, свежая кровь с клетками, стромально-васкулярная фракция клеток жировой ткани, полученная с помощью специального аппарата (Cytori).
Пример 4. Трансплантация полученных в примере 3 комплексов
Полученные биокомпозиты были исследованы в эксперименте на кроликах с краниальными дефектами. Краниальные дефекты диаметром 10 мм были выбраны в качестве модели дефекта критических размеров, так как кости крыши черепа кроликов в этом случае не восстанавливаются самопроизвольно - без дополнительных оптимизирующих влияний. Каждому животному были сформированы билатеральные идентичные дефекты теменных костей. Биокомпозиты трансплантировались в дефекты правых теменных костей (экспериментальная группа), в дефекты левых - носитель без клеток и нуклеиновых кислот (контроль 1) или комплекс из носителя с нуклеиновыми кислотами без клеток (контроль 2). Результаты оценивались через 15, 30, 45, 60 суток.
Было показано, что только в случае трансплантации биокомпозитов (экспериментальные группы) уровень трансфекции клеток реципиентного ложа ДНК-плазмидами (с геном VEGF} был наиболее высок, что привело к статистически значимо более выраженному ангиогенезу и репаративному остеогенезу на всех временных точках по сравнению с контрольными группами.
Таким образом, в наших исследованиях высокая эффективность в активизации репаративной регенерации происходит за счет взаимного действия оптимально подобранных компонентов биокомпозита, их синергичного эффекта.
Носитель обеспечивает доставку клеток и генных конструкций в область повреждения, их защиту и пролонгированность высвобождения генных конструкций в ходе биодеградации носителя. При этом нами было установлено, что наиболее эффективные результаты могут быть достигнуты только за счет использования в качестве носителей материалов, содержащих коллаген, гидроксиапатит, кальцийфосфат или другие компоненты внеклеточного матрикса, обеспечивающие как оптимальную адгезию клеток и фиксацию генетических конструкций (плазмидных ДНК), так и обладающие оптимальной биосовместимостью и положительным влиянием на репаративный процесс. В свою очередь клетки наряду с непосредственным участием в репаративном процессе служат мишенями для генных конструкций и при успешной трансфекции, реализация которой была подтверждена нами в ходе проведенных исследовний, становятся своего рода «биореакторами» терапевтического белка, кодируемого генными конструкциями биокомпозита - в течение определенного времени продуцируют данный белок (VEGF и (или) SDF-1). При этом экспрессия генных конструкций биокомпозита, содержащих гены, кодирующие VEGF и (или) SDF-1, обеспечивает активизацию ангиогенных процессов, а также повышает устойчивость клеток к гипоксии, что в совокупности способствует повышению выживаемости клеток биокомпозита. Другими словами, новизна подхода состоит в том, что компоненты, включенные в состав биокомпозита, нацелены не только на непосредственное обеспечение репаративного процесса за счет прямого влияния на клетки реципиентного ложа, но и характеризуются опосредованным действием на репаративную регенерацию посредством взаимного потенцирования: плазмидные ДНК обеспечивают выживаемость клеток биокомпозита, а клетки - доставку плазмидных ДНК в целевую область и их экспрессию.
Способ применим в медицинской практике, особенно для стимуляции репаративных процессов в тканях, а также в ветеринарии для лечения млекопитающих.
Источники информации
1. Greenleaf W.J., Bolander M.E., Sarkar G. et al. Artificial cavitation nuclei significantly enhance acoustically induced cell transfection. Ultrasound in Medicine and Biology 1998; 24(4): 587-595.
2. Schratzberger P., Krainin J.G., Schratzberger G. et al. Transcutaneous ultrasound augments naked DNA transfection of skeletalmuscle. Molecular Therapy 2002, 6(5): 576-583.
3. Duvshani-Eshet M., Machluf M. Therapeutic ultrasound optimization for gene delivery: a key factor achieving nuclear DNA localization. Journal of Controlled Release 2005; 108(2-3): 513-528.
4. Kim H.J., Greenleaf J.F., Kinnick R.R. Ultrasound-mediated transfection of mammalian cells. Human Gene Therapy 1996; 7(11): 1339-1346,.
5. Fraley R., Subramani S., Berg P. et al. Introduction of liposome-encapsulated SV40 DNA into cells. J Biol Chem. 1980; 255(21): 10431-5.
6. Roos A.K., Eriksson F., Timmons J.A.. Skin electroporation: effects on transgene expression, DNA persistence and local tissue environment. PLoS One. 2009; 4(9): е7226.
7. Schertzer J.D., Lynch G.S. Plasmid-based gene transfer in mouse skeletal muscle by electroporation. Methods Mol Biol. 2008; 433: 115-25.
8. Деев Р.В., Цупкипа Н.В., Бозо И.Я., Пинаев Г.П., Тихилов Р.М. Способ совмещения культивированных остеогенных клеток и трехмерного материала-носителя. Патент №2008150694 от 22.12.2008.
9. Polykandriotis E., Arkudas A., Horch R. et al. Autonomously vascularized cellular constructs in tissue engineering: opening a new perspective for biomedical science. J. Cell Mol. Med. 2007; 11(1): 6-20.
10. Гоулдстейн С.А. Способы переноса генов in vivo для заживления ран. Патент №2170104 от 10.07.2001.
11. Y. Huang, D, Kaigler, K.G. Rice. Combined angiogenic and osteogenic factor delivery enhances bone marrow stromal cell-driven bone regeneration. J. Bone Miner. Res. 2005; 20(5): 848-57
12. Giovannini R., Freitag R. Comparison of different types of ceramic hydroxyapatite for the chromatographic separation of plasmid DNA and a recombinant anti-Rhesus D antibody. Bioseparation 2001; 9: 359-368.
13. Sousa A., Tomaz C.T., Sousa F. et al. Successful application of monolithic innovative technology using a carbonyldiimidazole disk to purify supercoiled plasmid DNA suitable for pharmaceutical applications. J Chromatogr A. 2011; 1218(46): 8333-43.
14. Zhang Y.S., Bai X.F. A simple, rapid and high-resolution banding method in polyacrylamide gels. Yi Chuan. 2008; 30(2): 251-4.
15. Smrekar F., Podgornik A., Ciringer M. et al. Preparation of pharmaceutical-grade plasmid DNA using methacrylate monolithic columns. Vaccine 2010; 28(8): 2039-45.