Результат интеллектуальной деятельности: СПОСОБ ОЦЕНКИ ЭФФЕКТИВНОСТИ СТИМУЛЯЦИИ АНТИОКСИДАНТНОЙ АКТИВНОСТИ
Вид РИД
Изобретение
Известны способы оценки эффективности антиоксидантной активности путем определения роста общего содержания SH-групп белков [Microtubule dynamics and glutathione metabolism in phagocytizing human polymorphonuclear leukocytes / B.R. Burchill, J.M. Oliver, С.B. Pearson et al. // J. of Cell Biology. - 1978. - Vol.76, №2. - P.439-447], но данная методика не позволяет оценить уровень восстановленного глутатиона, а, следовательно, оценить эффективность антиоксидантной активности. Известен также способ косвенного определения содержания восстановленного глутатиона по активности глутатионпероксидазы [Медицинские лабораторные технологии: В 2-х томах. / Под ред. А.И. Карпищенко - Т.2 / А.И. Карпищенко. - СПб.: Интермедика. - 1999. - 656 с.], однако активность этого фермента зависит от конформации активного центра фермента. При изменении конформации активного центра фермента его активность меняется, что не позволяет с высокой точностью оценить уровень восстановленного глутатиона, а, следовательно, оценить эффективность антиоксидантной активности. Известен также способ косвенного определения концентрации восстановленного глутатиона по активности глутатионредуктазы [Медицинские лабораторные технологии: В 2-х томах. / Под ред. А.И. Карпищенко - Т.2 / А.И. Карпищенко. - СПб.: Интермедика. - 1999. - 656 с.], однако активность этого фермента зависит от конформации активного центра фермента. При изменении конформации активного центра фермента его активность меняется, что не позволяет достоверно в любой ситуации оценить с высокой точностью уровень восстановленного глутатиона, а следовательно, оценить эффективность антиоксидантной активности.
Известен также способ оценки эффективности антиоксидантной активности по содержанию восстановленного глутатиона, предложенный М.Е. Anderson (1985) в модификации S. Kojima et al. (2004) [Low dose gamma-rays activate immune functions via induction of glutathione and delay tumor growth / S. Kojima, K. Nakayama, H. Ishida // J. Radiat. Res. - 2004. - Vol.45, №1. - P.33-39], основанный на взаимодействии восстановленного глутатиона (GSH) с 5,5'-дитио-бис(2-нитробензойной) кислотой (ДТНБ). При этом образуется окисленный глутатион (GSSG), который затем восстанавливается и вновь взаимодействует с ДТНБ. Данный способ является наиболее близким к предлагаемому по технической сущности и достигаемому результату и выбран в качестве прототипа.
Недостатком данного способа является невозможность стимуляции эффективности работы антиоксидантной активности.
Целью предлагаемого изобретения является повышение эффективности и точности способа.
Указанная цель достигается дополнительным добавлением в инкубационную среду 1,4-дитиоэритритола и аскорбиновой кислоты для оценки эффективности стимуляции антиоксидантной активности.
Новым в данном способе является внесение в инкубационную среду 1,4-дитиоэритритола и аскорбиновой кислоты, без которых невозможна стимуляция антиоксидантной активности и последующая оценка ее эффективности.
Следовательно, только комплексная модернизация способа-прототипа позволяет получить желаемый результат. Только комплексное внесение в инкубационную смесь 1,4-дитиоэритритола и аскорбиновой кислоты позволяет повысить точность оценки эффективности стимуляции антиоксидантной активности, а именно при увеличении уровня восстановленного глутатиона с 0,75 нмоль/мг белка до 0,90 нмоль/мг белка и более стимуляцию антиоксидантной активности оценивают как эффективную, а при росте уровня восстановленного глутатиона с 0,75 нмоль/мг белка до 0,80 нмоль/мг белка и менее стимуляцию антиоксидантной активности оцениваем как неэффективную.
Антиоксидантная система направлена на эффективную нейтрализацию прооксидантов и снижение токсичной для организма гидроперекиси. Основным компонентом антиокидантной системы является восстановленная форма глутатиона.
Глутатион - трипептид (L-γ-глутамил-L-цистеилглицин) с молекулярной массой 307 Da, занимает особое место среди SH-содержащих соединений. Наличие γ-глутамильной связи защищает трипептид от ферментативной деградации. В организме глутатион присутствует в двух формах: окисленной - GSSG и восстановленной - GSH, причем содержание GSH в клетках на несколько порядков выше, чем GSSG [Колесниченко Л.С, 1989; Wu G. et al., 2004; Смирнова Г.В., Октябрьский О.Н., 2005; Марри Р. и соавт., 2009]. По данным P. Pietarinen-Runtti et al. (2000), концентрация GSH в нейтрофилах составляет около 5 нмоль/мг белка. Содержание глутатиона в сыворотке крови здоровых людей незначительно, поэтому клетки основную потребность в GSH обеспечивают путем нематричного синтеза [Wu G. et al., 2004] в ходе двух последовательных реакций, катализируемых γ-глутамилцистеин-синтетазой (КФ 6.3.2.2) и глутатион-синтетазой (КФ 6.3.2.3) [Кулинский В.И., 1990; Смирнова Г.В., Октябрьский О.Н., 2005; Марри Р. и соавт., 2009]. Лимитирующим звеном синтеза является образование γ-глутамилцистеина, зависящее от наличия L-цистеина и его способности окисляться в L-цистин [Зенков Н.К. и соавт., 2001]. В то же время недостаточность глутатион-синтетазы способствует развитию окислительных повреждений в нейтрофилах [Spielberg S.P. et al., 1979].
Глутатион при физиологических значениях pH имеет две анионные карбоксигруппы, положительно заряженную аминогруппу и SH-группу цистеинового остатка, которая придает GSH свойства восстановителя и способность быстро обезвреживать свободные радикалы и АФК [Day R.M., 2005; Zhu Y., 2007; Circu C.L. et al., 2009]. Глутатин является типичным тиолом и, участвуя в одноэлектронных восстановительных реакциях, становится GS·, который димеризуется до GSSG, легко реагирующего со свободными SH-группами. Второй тип окислительно-восстановительных превращений с участием GSH - это реакции тиолдисульфидного обмена, которые известны как основной путь образования смешанных дисульфидов глутатиона с белками (белок-SSG) и играют роль в регуляции биологических процессов [Chai Y.C. et al., 1994]. В реакциях третьего типа происходит двухэлектронпое окисление глутатиона с образованием интермедиата, который реагирует со второй молекулой GSH (получение GSSG) или иной молекулой (синтез смешанного дисульфида) [Смирнова Г.В., Октябрьский О.Н., 2005].
GSH является ингибитором АФК и стабилизатором мембран [Биленко М.В, 1989; Udupi V., 1992; Trudel S. et al., 2009]. Он защищает клеточные структуры нейтрофилов от высокотоксичного OCI-, производимого МПО [Carr А.С., Winterbourn С.С., 1997], при этом GSH превращается в глутатион-сульфонамид и дегидроглутатион [Harwood D.T. et al., 2006]. Связывая NO, глутатион образует токсичные для клетки нитрозильные комплексы. Моно нитрозоглутатион может активировать апоптоз [Turpaev К.Т. et al., 1997].
Не всегда восстановительного потенциала GSH достаточно для полной нейтрализации прооксидантов. Существует мнение, что взаимодействие GSH с органическими радикалами эффективно только в условиях удаления 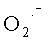 , поэтому глутатион образует с супероксиддисмутазой своеобразную антиоксидантную систему, ибо в противном случае развиваются реакции образования H2O2 и GS· [Панкин В.З. и соавт., 1997; Меньшикова Е.Б. и соавт., 2006]. В сочетании с витамином B12 глутатион, а также N-ацетилцистеин могут потенцировать прооксидантное и цитотоксическое действие на клетку [Соловьева М.Е. и соавт., 2007].
, поэтому глутатион образует с супероксиддисмутазой своеобразную антиоксидантную систему, ибо в противном случае развиваются реакции образования H2O2 и GS· [Панкин В.З. и соавт., 1997; Меньшикова Е.Б. и соавт., 2006]. В сочетании с витамином B12 глутатион, а также N-ацетилцистеин могут потенцировать прооксидантное и цитотоксическое действие на клетку [Соловьева М.Е. и соавт., 2007].
Основной антиоксидантный эффект GSH реализует посредством участия в работе ферментов. Глутатион выступает донором водорода при восстановлении Н2О2 и перекисей липидов глутатион-пероксидазами и глутатион-8-трансферазами (ГТ) [Hirayama К., 1989; Sies Н. et al., 1997; Кулинский В.И., 1990; Hayes J.D. et al., 2005; Зенков H.K.. и соавт., 2009; Liu G. et al., 2010]. Высокая активность глутатион-редуктазы и накопление GSH оказывает протекторный эффект в отношении альвеолярных макрофагов, инкубируемых с прооксидантами in vitro [Pietarinen Р.К. 1995].
С изменением окислительно-восстановительного баланса сопряжено большое количество реакций, поэтому поддержание оптимального редокс-состояния цитозоля выступает важным условием нормальной жизнедеятельности клеток. Высокая концентрация глутатиона в цитоплазме, его редокс-активность и возможность поддержания в восстановленном состоянии делают систему GSH/GSSG важнейшим внутриклеточным редокс-буфером [Reed М.С.et al., 2008]. Концентрация GSH в клетке в 500-1000 раз превышает уровень НАДФН и других внутриклеточных редокс-систем, поэтому изменения соотношения GSH/GSSG прямо отражают изменения редокс-статуса клетки [Кулинский В.И., 2007; Asian М, Canatan D., 2008; Reed М.С, 2008]. Считают, что буферная емкость системы глутатиона защищает репликативную систему клетки, а дефицит GSH в условиях высокой генерации АФК приводит к снижению синтеза ДНК и белков [Poot М., 1991; Панкин В.З., 1997; Day R.M., Suzuki Y.J., 2005; Liu G. et al., 2010].
К природным антиоксидантам относят также аскорбиновую кислоту, которая играет важную роль в развитии окислительного стресса в организме.
Аскорбиновая кислота реализует свое антиоксидантное действие в плазме, межклеточной жидкости и на внеклеточном уровне. В организме человека аскорбиновая кислота преимущественно представлена в L-форме. Стрессовые ситуации увеличивают количество метаболитов витамина С в виде дегидроаскорбиновой кислоты.
Аскорбиновая кислота и дегидроаскорбиновая кислота играют активную роль в нескольких процессах, включая защиту от инфекции, повышении иммунности, в процессах заживления ран, а также принимая участие в образовании антистрессовых гормонов. Аскорбат является кофактором дофамин-β-гидроксилазы, которая катализирует синтез норадреналина и других катехоламинов. Аскорбиновая кислота является восстановителем для L-пролингидроксилазы, которая необходима для синтеза коллагена и соединительной ткани в целом. В организме с участием аскорбиновой кислоты происходит регенерация α-токоферола из токофероксильного радикала. Окислительный стресс коррелирует с ухудшением секреции инсулина, а терапия аскорбиновой кислотой прерывает повреждающее действие свободных радикалов, уменьшает степень проявления инсулиновой резистентности [М.И. Балаболкин и соавт., 2003]. Ионы аскорбата является одним из активных элементов системы антиоксидантной защиты, предохраняя липиды от окисления их пероксидными радикалами. Антиоксидантный эффект аскорбата проявляется при достаточном количестве других антиоксидаитов, таких как α-токоферол и глутатион. Глутатион восстанавливает дегидроаскорбиновую кислоту прямым и неферментативным путем до аскорбиновой кислоты. Эта реакция является одним из основных механизмов антиоксидантной системы, часто описываемых как восстановительные циклы - глутатион/глутатиондисульфид и аскорбиновая/дегидроаскорбиновая кислота. При этом клетки периферических тканей поглощают экзогенную дегидроаскорбиновую кислоту и в присутствии глутатиона конвертируют ее в цитоплазме в аскорбиновую кислоту. Восстановление глутатиондисульфида в глутатион катализируется глутатион редуктазой и требует участия NADPH в качестве кофактора. Недостаточность глутатиона снижает содержание аскорбиновой кислоты в тканях и одновременно повышает концентрацию дегидроаскорбиновой кислоты.
При недостатке α-токоферола и глутатиона может превалировать прооксидантный эффект аскорбата и его метаболитов. Прооксидантный эффект аскорбиновой кислоты может наблюдаться не только при недостатке α-токоферола и глутатиона, но и при применении высоких доз аскорбиновой кислоты. Избежать прооксидантного эффекта аскорбиновой кислоты можно в случае создания адекватного внутриклеточного уровня восстановленного глутатиона.
Исходя из вышесказанного целесообразно использовать в эксперименте комплексное применение аскорбата с протектором SH-групп, а именно 1,4-дитиоэритритолом. Для проникновения внутрь клетки пассивным транспортом происходит превращение аскорбиновой кислоты в дегидроаскорбиновую кислоту, затем последняя подвергается обратимому превращению в аскорбиновую кислоту при участии восстановленного глутатиона. Следовательно, комплексная модернизация способа-прототипа позволяет повысить точность оценки эффективности стимуляции антиоксидантной активности.
Каждый вновь введенный в формулу изобретения признак выполняет функцию повышение точности и эффективности способа: дополнительное добавление в инкубационную среду 1,4-дитиоэритритола и аскорбиновой кислоты для последующего определения восстановленного глутатиона.
Роль антиоксидантной системы клетки заключается в снижении токсического эффекта свободных радикалов, в том числе и гидроперекисей липидов.
Антиоксидантную защиту обеспечивает широкий круг веществ, различных по происхождению, физико-химической природе и механизмам действия. Общим их свойством, по определению J.M. Gutteridge (1992), является способность, присутствуя в низких по сравнению с окисляемым субстратом концентрациях, существенно задерживать или ингибировать его окисление. Постоянное образование прооксидантов должно быть уравновешено их инактивацией, поэтому для поддержания гомеостаза необходима адекватная ситуации непрерывная регенерация антиоксидантной способности клеток [Зенков Н.К. и соавт., 2001; Blokhina O.et al., 2003].
Общепринятой номенклатуры антиоксидантов в настоящее время не существует, хотя ряд авторов [Dirnascio Р., 1990; Kalra V. et al., 2001; Зайцев В.Г. и соавт., 2003] выделяет два класса: превентивные, снижающие скорость инициации цепной реакции окисления, и гасящие (прерывающие цепь), препятствующие развитию цепной реакции. К превентивным относят каталазу и пероксидазы, разрушающие ROOH, а также агенты, образующие хелатные комплексы с металлами переменной валентности, к прерывающим цепь - фенолы, ароматические амины. В условиях in vivo главными гасящими антиоксидантами являются: витамин E, нейтрализующий ROO· в липидной фазе мембран [Jore D. et al., 1990; Hong J.H. et al., 2004], фермент СОД, улавливающий 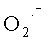 в водной фазе клетки [Fridovich I., 1989; Dirnascio P., 1990; Ciurea D., 1992], и церулоплазмин - белок острой фазы, выполняющий антирадикальную функцию в крови [Marklund S.L., 1987; Atanasiu R.X. et al., 1998].
в водной фазе клетки [Fridovich I., 1989; Dirnascio P., 1990; Ciurea D., 1992], и церулоплазмин - белок острой фазы, выполняющий антирадикальную функцию в крови [Marklund S.L., 1987; Atanasiu R.X. et al., 1998].
Более известно деление антиоксидантов на ферменты и соединения неферментативной природы. Последние в определенных концентрациях всегда присутствуют в липидной фазе мембран и водных средах организма и расходуются первыми при устранении проявлений окислительного стресса [Droge W., 2002; Blokhina О., 2003]. Ферменты наиболее активно присоединяется к АОЗ после включения механизмов индукции [Лущак В.И., 2001]. При возникновении ОС расход антиоксидантов возрастает и меняется экспрессия генов, кодирующих белковые компоненты АОЗ [Дубинина Е.Е., 2006]. Между ферментами и неферментативными элементами АОЗ существует равновесие, причем последние при ряде патологических состояний организма могут выступать в качестве прооксидантов [Зенков Н.К. и др., 2001].
Главную роль среди неферментавных аитиоксидантных систем защиты отводят глутатиону.
В настоящее время в лабораторной практике наиболее распространен способ оценки эффективности антиоксидантной активности с помощью определения восстановленного глутатиона.
Содержание восстановленного глутатиона определяют методом, предложенным М.Е. Anderson (1985) в модификации S. Kojima et al. (2004) [Kojima, S. Low dose gamma-rays activate immune functions via induction of glutathione and delay tumor growth / S. Kojima, K. Nakayama, H. Ishida // J. Radiat. Res. - 2004. - Vol.45, №1. - P.33-39]. Принцип метода основан на взаимодействии GSH с 5,5'-дитио-бис(2-нитробензойной) кислотой (ДТНБ) с образованием тио-2-нитробензойной кислоты, водный раствор которой имеет максимум поглощения при длине волны 412 нм. При этом образуется GSSG, который восстанавливается глутатионредуктазой до GSH и вновь взаимодействует с ДТНБ. Скорость образования окрашенного продукта пропорциональна содержанию общего глутатиона. Для определения содержания GSSG пробы прединкубируются с блокатором SH-групп 2-винилпиридином («Wako», Япония), который необратимо связывает GSH и, следовательно, скорость образования окрашенного продукта пропорциональна содержанию GSSG.
Лизат лимфоцитов крови готовят на 5% сульфосалициловой кислоте, которая осаждает белки, но не ингибирует активность глутатионредуктазы. Количество общего глутатиона (GSH и GSSG) определяют в пробе содержащей 0,1 М Na-фосфатный буфер (pH=7,5) с 1 мМ ЭДТА, 0,4 мМ НАДФН2, 0,3 мМ ДТНБ и 1 U/мл глутатион-редуктазы («Wako», Япония). При измерении уровня GSSG супернатант предварительно инкубируют 30 мин с 10 мМ 2-винилпиридином, после чего определяют скорость реакции в описанной выше инкубационной среде. Расчет содержания общего и окисленного глутатиона производят с помощью калибровочных графиков, для построения которых растворы GSH и GSSG («Sigma», США) в концентрации от 3 до 100 мкМ обрабатывают аналогично опытным пробам. Концентрацию GSH рассчитывают как разницу между концентрацией общего глутатиона и GSSG, выражая результат в нмоль/мг белка.
Концентрацию белка в лимфоцитах крови определяют методом [A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding / M.M. Bradford // Analyt. Biochem. - 1976. - Vol.7, №1, 2. - P.248-254], основанным на взаимодействии Кумасси голубого G-250 с остатками аргинина и лизина в белках. Свободный краситель красного цвета (максимум поглощения - 495 нм) при образовании комплекса с белком переходит в синюю форму (максимум поглощения - 595 нм).
К 0,1 мл лизата лимфоцитов крови добавляют 1,0 мл раствора Кумасси голубого (100 мг красителя, 50 мл 96° этанола, 100 мл 85% H3PO4, H2O до 1,0 л), перемешивают, инкубируют 3 мин при комнатной температуре и измеряют оптическую плотность проб (длина волны 595 нм) против контроля, содержащего 0,1 мл воды и 1,0 мл раствора Кумасси голубого. Содержание белка рассчитывают по калибровочной кривой, построенной по разведениям стандартного раствора альбумина (1,0 мг/мл) и выражают в мг/мл.
В настоящее время крайне важно для оценки эффективности антиоксидантной активности оценить уровень восстановленного глутатиона и осуществить стимуляцию антиоксидантной активности, а затем оценить ее эффективность. Для решения этой задачи предложен новый способ оценки эффективности стимуляции антиоксидантной активности после дополнительного добавления в инкубационную среду 1,4-дитиоэритритола и аскорбиновой кислоты.
Все сказанное свидетельствует о крайней важности разработки способа оценки эффективности стимуляции антиоксидантной активности для защиты клеток от токсического действия активных форм кислорода.
Популярность указанного выше способа обоснован его высокой чувствительностью, простотой осуществления и достаточной адекватностью получаемых результатов, лежащих в основе определения восстановленного глутатиона.
Существенные признаки, характеризующие изобретения проявили в заявленной совокупности новые свойства, явным образом не вытекающие из уровня техники в данной области, и не являются очевидными для специалиста.
Идентичной совокупности признаков не обнаружено при изучении патентной и научной медицинской литературы.
Данное изобретение может быть использовано в медицинской практике для повышения точности оценки эффективности стимуляции антиоксидантной активности при различных заболевания. Таким образом, следует считать предлагаемое изобретение соответствующим условиям патентоспособности: «новизна», «изобретательский уровень», «промышленная применимость».
Метод основан на определении восстановленного глутатиона.
Способ осуществляется следующим образом поэтапно:
1. Выделение лимфоцитов крови из венозной крови.
Пробирки с венозной гепаринизированной кровью (25 Ед./мл) выдерживали при температуре 37°C в течение 40 минут для отделения плазмы и эритроцитов. Затем пробирки переносят в стерильный ламинарный шкаф для выполнения процедуры выделения лимфоцитов крови. Полученную плазму наслаивают на градиент плотности Ficoll-Paque («Pharmacia», Швеция) (ρ=1,077 г/см3) в соотношении 1:2 и центрифугируют при 500 g в течение 20 минут [Bignold L.P., 1987]. После центрифугирования собирают образовавшееся интерфазное кольцо из смеси мононуклеарных клеток в стерильную центрифужную пробирку с 4,5 мл питательной среды ((90% RPMI-1640 («Вектор-Бест», Россия), 10% эмбриональной телячьей сыворотки («Биолот», Россия), инактивированной при температуре 56°C в течение 30 мин, 0,3 мг/мл L-глутамина («Борисовский ЗМП», Беларусь), 100 мкг/мл гентамицина, 2 ммоль/мл Hepes («Flow», Великобритания)), затем центрифугируют 10 минут при 500 g. Процедуру отмывки повторяют дважды: последовательно ресуспендируя клетки и затем центрифугируя в течение 10 минут при 500 g. Выделение лимфоцитов из мононуклеарной фракции клеток проводят на двойном градиенте Перколла [Ulmer A.J., 1979]. Стандартный изоосмотический раствор Перколла (SIP) получают смешиванием одного объема 10х PBS (фосфатно-солевого буфера (pH 7,4)) с девятью объемами Перколла («Sigma», США) (плотность полученного раствора - 1,130 г/мл). Затем готовят 47,5% стандартный изоосмотический раствор Перколла (47,5% SIP) и 15,0% стандартный изоосмотический раствор Перколла (15,0% SIP). К клеточной суспензии добавляют 1,5 мл SIP (4°C), перемешивают и переносят в новую стерильную пробирку. Сверху наслаивают 5 мл 47,5% SIP (4°C). Создают верхнюю фазу посредством 2 мл 15,0% SIP (4°C). Центрифугируют при 1500 g и 4°C 45 минут. Собирают интерфазное кольцо (лимфоцитарную фракцию клеток). Объем доводят до 5 мл питательной средой ((90% RPMI-1640 («Вектор-Бест», Россия), 10% эмбриональной телячьей сыворотки («Биолот», Россия), инактивированной при температуре 56°C в течение 30 мин, 0,3 мг/мл L-глутамина («Борисовский ЗМП», Беларусь), 100 мкг/мл гентамицина, 2 ммоль/мл Hepes («Flow», Великобритания)), температура раствора должна соответствовать 37°C. Далее проводят центрифугирование при 700 g и 20°C в течение 10 минут. Затем удаляют супернатант до конечного объема 1 мл.
2. Количественное определение численности жизнеспособных лимфоцитов крови с помощью окраски трипановым синим микроскопическим методом.
Лимфоциты крови ресуспендируют в 1 мл клеточной взвеси. Отбирают 100 мкл ресуспендированной клеточной суспензии и добавляют 100 мкл 0,1% раствора трипанового синего на физрастворе, хорошо перемешивают и заполняют камеру Горяева. Предварительно к камере притирают покровное стекло так, чтобы появлялись радужные, ньютоновые кольца (только при этих условиях соблюдался правильный объем камеры). Каплю клеточной взвеси с красителем вносят под притертое покровное стекло. Подсчет клеток производят в 5-ти больших квадратах по диагонали камеры Горяеева. Расчет клеточности лимфоцитов крови производят по формуле:
A×106=(число клеток)/4
где, A - клеточность лимфоцитов крови.
3. Внесение в инкубационную смесь заявленных добавок.
В культуральную смесь добавляют соединения: 1,4-дитиоэритритол в концентрации 5 мМ и аскорбиновую кислоту в конечной концентрации 0,14 мМ.
4. Биохимическое исследование восстановленного глутатиона.
Лизат лимфоцитов готовят на 5% сульфосалициловой кислоте, которая осаждает белки, но не ингибирует активность глутатионредуктазы. Количество общего глутатиона (GSH и GSSG) определяют в пробе содержащей 0,1 М Na-фосфатный буфер (pH=7,5) с 1 мМ ЭДТА, 0,4 мМ НАДФН2, 0,3 мМ ДТНБ и 1 U/мл глутатионредуктазы («Wako», Япония). Окисленный глутатион определяют аналогичным способом в клеточном лизате после предварительной инкубации пробы в течение 30 мин с 10 мМ 2-винилпиридином. Расчет содержания общего и окисленного глутатиона производят с помощью калибровочных графиков, для построения которых используют растворы GSH и GSSG («МР», США) в концентрации от 3 до 100 мкМ, обработанные аналогично опытным пробам. Концентрацию GSH рассчитывают как разницу между концентрацией общего глутатиона и GSSG, выражая результат в нмоль/мг белка.
Исследование антиоксидантной активности по способу-прототипу и предлагаемому способу выполнялось 40 раз. Результаты исследования обработаны статистически с использованием пакета программ Stat Soft Statistica 6.0.
При проведении исследования по способу-прототипу уровень восстановленного глутатиона составил 0,75±0,06 нмоль/мг белка, а при оценке по предлагаемому способу в случае эффективной стимуляции антиоксидантной активности уровень восстановленного глутатиона составил 0,92±0,08 нмоль/мг белка, а в случае не эффективной стимуляции антиоксидантной активности уровень восстановленного глутатиона составил 0,80±0,07 нмоль/мг белка (табл.1). То есть при эффективной стимуляции антиоксидантной активности уровень восстановленного глутатиона возрастает на 19% и более, а при неэффективной стимуляции антиоксидантной активности уровень восстановленного глутатиона увеличивается менее чем на 5%.
Полученные результаты уровня восстановленного глутатиона соответствую данным литературы [Смирнова Г.В., Октябрьский О.Н., 2005].
Итак, при применении способа-прототипа был получен недостаточно точный результат, не позволивший установить эффективность стимуляции антиоксидантной активности, что связано с отсутствием биохимической стимуляции процесса, а наиболее эффективным и точным был предлагаемый способ.
При этом предлагаемый способ прост в исполнении и интерпретации полученных результатов.
|

