Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ 2-АЦЕТИЛБЕНЗО[h]ХИНОЛИНА
Вид РИД
Изобретение
Предлагаемое изобретение относится к области органического синтеза, в частности к способу получения 2-ацетилбензо[h]хинолина.
Производные бензохинолинов склонны к образованию комплексов с переходными металлами, что делает привлекательным их применение в фотофизике, и катализе [[1]. Mamane V., Louerat F., Fort Y. Direct Functionalization of Benzoquinolines // Lett. Org. Chem. - 2010. - V.7. - №1. - P.90-93.]. Так, 2-ацетилбензо[h]хинолин и его производные используются в синтезе новых комплексов переходных металлов (железо, рутений, осмий), которые применяются как активные катализаторы для селективного восстановления альдегидов и кетонов до спиртов [[2]. Rigo P., Baratta W., Siega K., Chelucci G.A., Ballico M., Magnolia S. New Ligands of the Benzo[h]quinoline Class and Transition Metal Complexes containing them and use of said Complexes as Catalysts / Патент WO 2009/007443 A2, 15.01.2009., [3]. Baratta W., Ballico M., Baldino S., Chelucci G., Herdtweck E., Siega K., Magnolia S., Rigo P. New Benzo[h]quinoline-Based Ligands and their Pincer Ru and Os Complexes for Efficient Catalytic Transfer Hydrogenation of Carbonyl Compounds // Chem. Eur. J. - 2008. - V.14. - №30. - P.9148-9160.]
2-Ацетилбензо[h]хинолин (1) был синтезирован из 2-бромбензо[h]хинолина (2) по следующей методике [[2]. Rigo P., Baratta W., Siega K., Chelucci G.A., Ballico M., Magnolia S. New Ligands of the Benzo[h]quinoline Class and Transition Metal Complexes containing them and use of said Complexes as Catalysts / Патент WO 2009/007443 A2, 15.01.2009.]:
Раствор (2) (1.52 г, 5.89 ммоль) в ТГФ (36 мл) охлаждают до -78°C и через 10 минут добавляют раствор 2.5 М н-бутиллития в н-гексане (2.47 мл, 6.18 ммоль). Образовавшийся темно-красный раствор перемешивают при -78°C в течение часа, после чего прикалывают N,N-диметилацетамид (0.60 мл, 6.45 ммоль). Далее реакционную массу перемешивают еще 1 час при -78°C. После достижения комнатной температуры в раствор добавляют 1 М HCl (7.4 мл, 7.4 ммоль). Органический слой экстрагируют диэтиловым эфиром (2×15 мл). Сушат безводным Na2SO4 и перегоняют под вакуумом. Остаток очищают флеш-хроматографией (петролейный эфир / этилацетат = 95/5). Выход 2-ацетидбензо[h]хинолина составляет 77% (1 г).
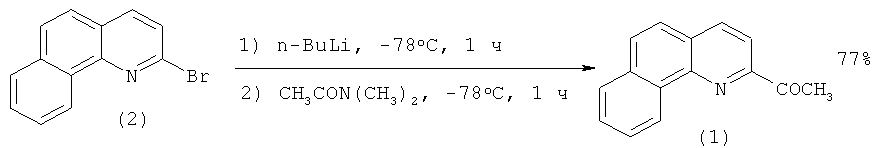
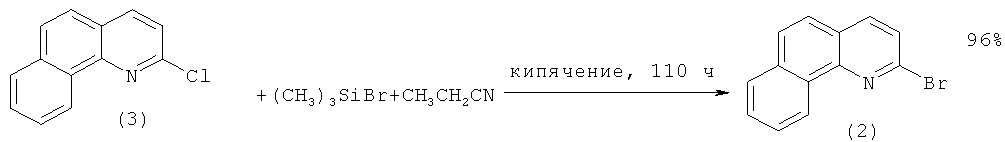
Исходный 2-бромбензо[h]хинолин (2) получают обработкой 2-хлорбензо[h]хинолина (3) бромтриметилсиланом (выход 96%) [[2]. Rigo Р., Baratta W., Siega K., Chelucci G.A., Ballico М., Magnolia S. New Ligands of the Benzo[h]quinoline Class and Transition Metal Complexes containing them and use of said Complexes as Catalysts / Патент WO 2009/007443 A2, 15.01.2009.].
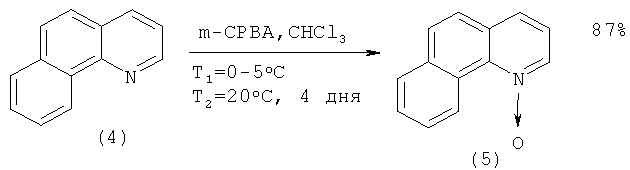
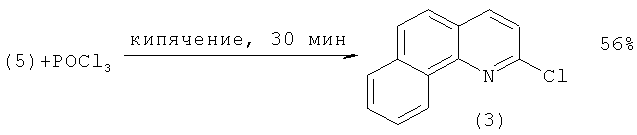
Синтез соединения (3), в свою очередь, осуществляют по следующей схеме: сначала бензо[h]хинолин (4) превращают в N-оксид бензо[h]хинолина (5) окислением м-хлорнадбензойной кислотой (m-СРВА). Оксид (5) затем реагирует с оксихлоридом фосфора (POCl3) с образованием 2-хлорбензо[h]хинолина (3) с 56%-ным выходом. Наряду с (3) в реакционной массе присутствует в минорных количествах 4-хлорбензо[h]хинолин, отделяемый флеш-хроматографией [[4]. Cappelli A., Anzini М., Vomero S., Mennuni L., Makovec F., Doucet E., Hamon М., Bruni G., Romeo M.R., Menziani M.C., De Benedetti P.G., Langer T. Novel Potent and Selective Central 5-НТ3 Receptor Ligands Provided with Different Intrinsic Efficacy. 1. Mapping the Central 5-HT3 Receptor Binding Site by Arylpiperazine Derivatives // J. Med. Chem. - V.41. - №5. - Р.728-741.]:
m-CPBA-мета-хлорнадбензойная кислота
Недостатки метода:
1. Многостадийность процесса.
2. Пожаро- и взрывоопасность процесса из-за использования избытка металлорганического реагента - n-BuLi.
3. Необходимость использования экстремально низкой температуры (до -78°C).
4. Применение в качестве исходных соединений труднодоступных реагентов: (CH3)3SiBr, m-CPBA, CH3CON(СН3)2.
5. Низкая атомарная эффективность процесса.
В работе [[5]. Malkov A.V., Westwater M.-M., Gutnov A., Ramirez. - Lopez P., Friscourt F., Kadlcikova A., Hodacova J., Rankovic Z., Kotora M., Kocovsky P. New Pyridine N-Oxides as Chiral Organocatalysts in the Asymmetric Allylation of Aromatic Aldehydes // Tetrahedron. - 2008. - V.64. - №49. - P.11335-11348.] 2-ацетилбензо[h]хинолин (1) синтезировали восстановлением триметилалюминием метилового эфира 2-бензо[h]хинолинкарбоновой кислоты (6):
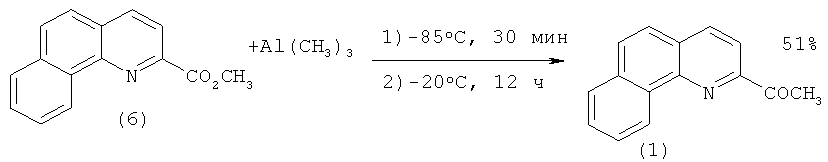
К охлажденному до -85°С раствору (6) (2 г, 8.4 ммоль) в безводном CH2Cl2 (40 мл) добавляют 2М раствор (CH3)3Al (8.43 мл, 16.9 ммоль) в гексане. После того как температура повысится до -20°С, реакционную массу перемешивают 12 ч при -20°C. Далее добавляют 10 М HCl (10-30 мл) и перемешивают при -20°C 10 минут. После достижения температуры раствора до 0°С продолжают перемешивание еще 30 минут, после чего позволяют подняться температуре до комнатной. Реакционную массу экстрагируют хлористым метиленом (3×20 мл), органический экстракт сушат с помощью MgSO4, растворитель отгоняют в вакууме. Сырой продукт очищают хроматографией на колонке, заполненной силикагелем. Элюент петролейный эфир - этилацетат (5:1). Выход 2-ацетилбензо[h]хинолина (1) 0.986 г. (51%).
Исходный метиловый эфир 2-бензо[h]хинолинкарбоновой кислоты (6) получают несколькими путями.
Так, (6) может быть синтезирован из бензо[h]хинолина по следующей схеме: на первой стадии, металлируя бензо[h]хинолин (4) CH3Li, с 66%-ным выходом получают 2-метилбензо[h]хинолин (7), который реагирует с избытком диизопропиламида калия (5 eq.) и диметилдисульфидом с образованием тритиооротэфира (8) (выход 67%). Последующая десульфуризация соединения (8) в присутствии соли ртути (HgCl2) приводит к метиловому эфиру 2-бензо[h]хинолинкарбоновой кислоты (6) с выходом 62% [[1]. Mamane V., Louerat F., Fort Y. Direct Functionalization of Benzoquinolines // Lett. Org. Chem. - 2010. - V.7. - №1. - Р.90-93.]:

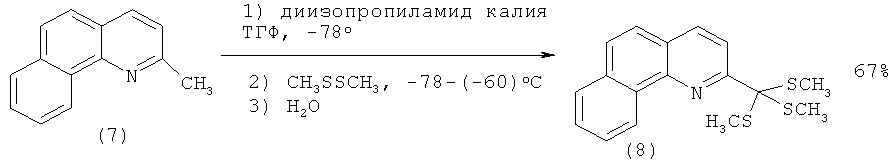
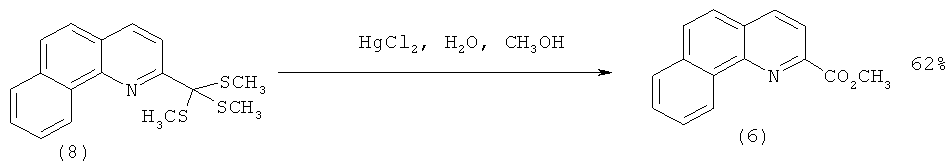
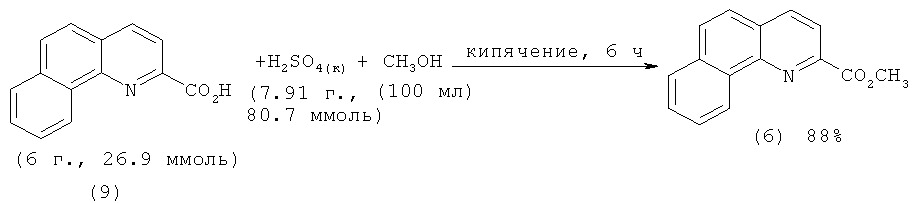
Метиловый эфир 2-бензо[h]хинолинкарбоновой кислоты (6) получают по классической методике: этерификацией самой 2-бензо[h]хинолинкарбоновой кислоты (9) в присутствии избытка серной кислоты. Выход (9) составляет 88% [[5]. Malkov A.V., Westwater M.-M., Gutnov A., Ramirez.-Lopez P., Friscourt F., Kadlcikova A., Hodacova J., Rankovic Z., Kotora M., Kocovsky P. New Pyridine N-Oxides as Chiral Organocatalysts in the Asymmetric Allylation of Aromatic Aldehydes // Tetrahedron. - 2008. - V.64. - №49. - P.11335-11348.].
В работе [[6]. Takahashi K., Mitsuhashi K. Conversion of the Carboxyl Group to the Corresponding Trichloromethyl Group in the Quinoline Series // J. Heterocycl. Chem. - 1977. - V.14. - №5. - Р.881-884.] 2-бензо[h]хинолинкарбоновая кислота (9) получена в две стадии: 1) бромирование 2-метилбензо[h]хинолина (7); 2) гидролиз образующегося 2-трибромметилбензо[h]хинолина (10):
1)
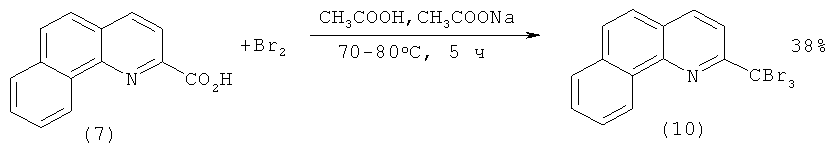
2)

Другой метод синтеза 2-бензо[h]хинолинкарбоновой кислоты (9) основан на реакции гидролиза 2-цианбензо[h]хинолина (11) под действием хлороводородной кислоты [[5]. Malkov A.V., Westwater M.-M., Gutnov A., Ramirez.-Lopez Р., Friscourt F., Kadlcikova A., Hodacova J., Rankovic Z., Kotora M., Kocovsky P. New Pyridine N-Oxides as Chiral Organocatalysts in the Asymmetric Allylation of Aromatic Aldehydes // Tetrahedron. - 2008. - V.64. - №49. - P.11335-11348.]. В свою очередь 2-цианбензо[h]хинолин (11) получают цианированием N-оксида бензо[h]хинолина (3) цианидом калия в присутствии хлористого бензоила [[7]. Colonna M., Fatutta S. Ricerche sugli N-ossidiaromatici. = Reazioni nucleofile sugli N-ossidi delle benzochinoline angolari // Gazz. Chim. Ital. - 1953. - V.83. - P.622-631.]:

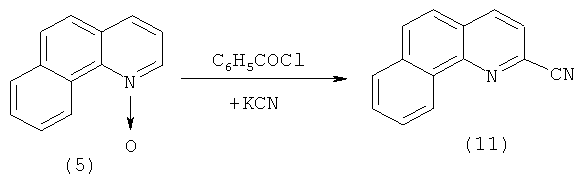
Недостатки метода:
1. Многостадийность процесса.
2. Пожаро- и взрывоопасность процесса из-за использования избытка металлорганических реагентов - (СН3)3Al, CH3Li.
3. Необходимость использования экстремально низкой температуры (до -78°С).
4. Применение в качестве исходных соединений труднодоступных диизопропиламида калия и CH3SSCH3.
5. Использование сильнодействующих ядовитых веществ: хлорида и цианида калия, ртути.
Авторами предлагается способ получения 2-ацетилбензо[h]хинолина (1), не имеющий вышеперечисленных недостатков.
Задачей предлагаемого изобретения является удешевление себестоимости конечного продукта за счет использования доступного исходного соединения и реагентов и упрощение технологии в целом.
Сущность предлагаемого способа заключается во взаимодействии бензо[h]хинолина (2) с этиловым спиртом в присутствии четыреххлористого углерода под действием медьсодержащего катализатора, выбранного из ряда Cu(acac)2, CuOAc, Cu(ОАс)2, C14H10O4Cu·2H2O, C14H10O6Cu, CuBr, CuBr2, CuCl2·2H2O, CuI при температуре 140-160°C в течение 2-10 ч при мольном соотношении: [Cu]:[бензо[h]хинолин]:[этанол]:[CCl4]=[1]:[100]:[500-1500]:[500-1500].
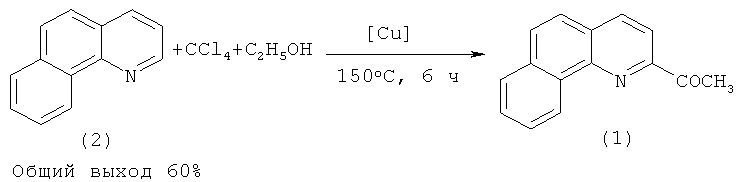
Увеличение продолжительности реакции до 10 ч нежелательно, так как выход 2-ацетилбензохинолина (1) снижается до 40%, что объясняется осмолением продуктов реакции. При проведении реакции при температуре 150°C в течение 6 ч и использовании следующих мольных соотношений катализатора и реагентов: [CuI]:[бензо[h]хинолин]:[этанол]:[CCl4]=[1]:[100]:[1000]:[1000] общий выход 2-ацетилбензохинолина составляет 60%. При использовании других медьсодержащих катализаторов Cu(асас)2, CuOAc, Cu(ОАс)2, C14H10O4Cu·2H2O, C14H10O6Cu, CuBr, CuBr2, CuCl2·2H2O общий выход 2-ацетилбензохинолина был меньше и составил 30-50%.
Преимущества предлагаемого метода.
1. Одностадийность процесса.
2. Доступность и низкая стоимость исходных реагентов - бензо[h]хинолина, этанола и CCl4.
Предлагаемый способ поясняется примерами:
ПРИМЕР 1. Реакции проводили в стеклянной ампуле объемом 10 мл, помещенной в микроавтоклав из нержавеющей стали объемом 17 мл, при постоянном перемешивании и регулируемом нагреве.
В ампулу в токе аргона загружают 0.0021 г (0.01 ммоль) CuI, 0.2 г (1 ммоль) бензо[h]хинолина (2), 1.1 мл (10 ммоль) CCl4 и 0.65 мл (10 ммоль С2Н5ОН). Запаянную ампулу помещают в автоклав, автоклав герметично закрывают и нагревают при 150°С в течение 6 часов с постоянным перемешиванием. После окончания реакции автоклав охлаждают до комнатной температуры, ампулу вскрывают. Реакционную массу пропускают через слой Al2O3, нейтрализуют водным раствором Na2CO3. Экстрагируют CHCl3. Органический слой фильтруют через слой силикагеля (2 грамма) (элюент - хлороформ). Продукт реакции элюируется с первой фракцией растворителя, исходный бензо[h]хинолин (2) в последующей. Выделенный бензо[h]хинолин (2) после упаривания растворителя может быть возвращен в реакцию. Из первой фракции растворитель отгоняют, 2-ацетилбензо[h]хинолин (1) перекристаллизовывают из этилового спирта.
Общий выход 2-ацетилбензо[h]хинолина (1) составляет 60%.
Выделенный 2-ацетилбензо[h]хинолин (1) имел Тпл 115-116°С. (113-115 [[3]. Baratta W., Ballico M., Baldino S., Chelucci G., Herdtweck E., Siega K., Magnolia S., Rigo P.. New Benzo[h]quinoline-Based Ligands and their Pincer Ru and Os Complexes for Efficient Catalytic Transfer Hydrogenation of Carbonyl Compounds // Chem. Eur. J. - 2008. - V.14. - №30. - Р.9148-9160.], 116-118 [[5]. Malkov A.V., Westwater M.-M., Gutnov A., Ramirez.-Lopez P., Friscourt F., Kadlcikova A., Hodacova J., Rankovic Z., Kotora M., Kocovsky P. New Pyridine N-Oxides as Chiral Organocatalysts in the Asymmetric Allylation of Aromatic Aldehydes // Tetrahedron. - 2008. - V.64. - №49. - Р.11335-11348.]).
Спектр ЯМР 1H (CDCl3, δ, м.д.): 3.01 с (3Н, СОСН3), 7.75-7.96 м (2Н), 7.79 д (1Н, 8 Гц), 7.82 д (1Н, J=4 Гц), 7.91 д (1Н, J=8 Гц), 8.28 с (2Н), 9.39 д (1Н, J=8 Гц). Спектр ЯМР 13С (CDCl3, δ, м.д.): 25.77 (С12), 118.91 (С3), 124.49 (С10), 124.95 (С9), 127.52 (С7), 127.99 (С8), 128.39 (С4′), 128.64 (С6), 130.03 (С5), 131.66 (С10′), 133.74 (С6′), 136.54 (С4), 145.44 (С10′′), 151.67 (С2), 200.72 (С11).
Масс-спектр, m/z (Ioтн (%)): 221.10 [M]+ (100), 194.10 (11.06), 193.10 (74.59), 180.10 (11.90), 179.10 (87.51), 178.10 (83.11), 177.10 (20.89), 176.10 (4.25), 153.15 (3.87), 152.15 (10.38), 151.15 (33.51), 150.15 (15.77), 125.15 (3.98), 89.10 (4.17), 75.15 (7.71), 43.05 (10.91).
Другие примеры, подтверждающие способ приведены в таблице 1.
|
![СПОСОБ ПОЛУЧЕНИЯ 2-АЦЕТИЛБЕНЗО[h]ХИНОЛИНА](https://fips.edrid.ru/images/rid/66/42/61/ef03e035fb36a53672bce391182cb091.png)

