Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ 2-(2-ТИЕНИЛ)ПИРРОЛА
Вид РИД
Изобретение
В настоящее время все большее внимание уделяется синтезу производных пиррола и тиофена, полимеры которых обладают пониженным окислительным потенциалом по сравнению с гомополимерами самих пиррола и тиофена [С. Pozo-Gonzalo, J.A. Pomposo, J.A. Alduncin, M. Salsamendi, A.I. Mikhaleva, L.B. Krivdin, B.A. Trofimov Electrochim. Acta, 2007, 52, 4784-4791 (и ссылки в ней)]. В связи с этим особый интерес для получения органических полупроводников с новым улучшенным комплексом электрофизических свойств представляют соединения, содержащие связанные пиррольные и тиофеновые циклы в одной молекуле. Известно, что политиенилпиррольные нанопленки проявляют практически важные электропроводящие и электрохромные свойства [С.Pozo-Gonzalo, J.A. Pomposo, J.A. Alduncin, M. Salsamendi, A.I. Mikhaleva, L.B. Krivdin, B.A. Trofimov Electrochim. Acta, 2007, 52, 4784-4791; С. Pozo-Gonzalo, M. Salsamendi, J.A. Pomposo, H.-J. Grande, E. Yu. Schmidt, Yu. Yu. Rusakov, B.A. Trofimov Macromolecules, 2008, 41, 6886-6894]. Мономеры, относящиеся к классу тиенилпирролов, легко вступают в окислительную поликонденсацию как при химическом, так и при электрохимическом окислении, образуя поли(тиенилпирролы). Такие полимеры способны к дальнейшей сшивке за счет свободных положений пиррольных колец с образованием проводящих сетчатых полимеров с улучшенными механическими свойствами и адгезией по отношению к электродам полимерных аккумуляторов. Таким образом, полимеры тиенилпирролов могут найти применение для получения электропроводящих полимерных слоев с контролируемыми электрофизическими свойствами, в частности как активные компоненты электродов перезаряжаемых полимерных батарей с использованием полианилина или полипиррола как основного полимерного слоя.
Известные методы получения 2-(2-тиенил)пирролов отличаются многостадийностью, требуют применения труднодоступных исходных соединений и, как правило, не обеспечивают высоких выходов целевых соединений [N. Engel; W. Steglich Angew. Chem., 1978, 90, 719-720; J.P. Boukou-Poba, M. Farmer, R. Guilard Tetrahedron Lett., 1979, 19, 1717-1720; S. S. Ghabrial, I. Thomsen, K. B. G. Torssell Acta Chem. Scand., 1987, 41, 426-434; P.G. Aime, P.M. Antonietta, P. Giuseppe J. chem. res. synop, 1993, 6, 210-211; J.Т. Reeves, J.J. Song, Z. Tan, H. Lee, N.K. Yee, С.Н. Senanayake Org. Lett., 2007, 9, 1875-1878]. Самое главное - до сих пор не известно ни одного селективного способа получения самого 2-(2-тиенил)пиррола. Часть известных методов получения тиенилпирролов заключается в построении пиррольного кольца на уже готовом производном тиофена [D.A. Maurizio, D.L. Eliana, M. Giacomo, R. Rocco, S. Giancarlo J. Chem. Soc. Perkin Trans. 1, 1997, 16, 2369-2373].
Кроме того, в качестве исходных часто используются 1,4-дикарбонильные соединения [Н. Steter, W. Haese Chem. Ber., 1984, 777, 682-693; K.A. Hansford, G. S. A. Perez, W.G. Skene, W.D. Lubell J. Org. Chem., 2005, 70, 7996-8000; M. M. M. Raposo, A.M. R.C. Sousa, A. M. C. Fonseca, G. Kirsch Tetrahedron, 2006, 62, 3493-3501].
Вероятно, один из лучших (по выходу) способов получения тиенилпирролов представлен в литературе многостадийным синтезом 1-арил-2-(2-тиенил)пирролов на основе тиофена. Согласно этому способу тиофен на первой стадии ацилируется сукциновым ангидридом с последующей реакцией полученного ацилтиофена с ариламинами в присутствии DCC (1,3-дициклогексилкарбодиимид), с образованием соответствующих амидов, реагирующих далее с реагентом Лавессона (2,4-бис(4-метоксифенил)-1,3,2,4-дитиадифосфетан-2,4-дитион), приводя к смеси 1-арил-2-(2-тиенил)пирролов и 5-ариламино-2,2 с-битиофенов, выход целевых пирролов на последней стадии не превышает 58% [M.M. Raposo, A.M. В.A. Sampaio, G. Kirsch Synthesis, 2005, 0199-0210]. Выход же с учетом всех трех стадий (исходя из взятого в реакцию тиофена) значительно ниже (около 36%).
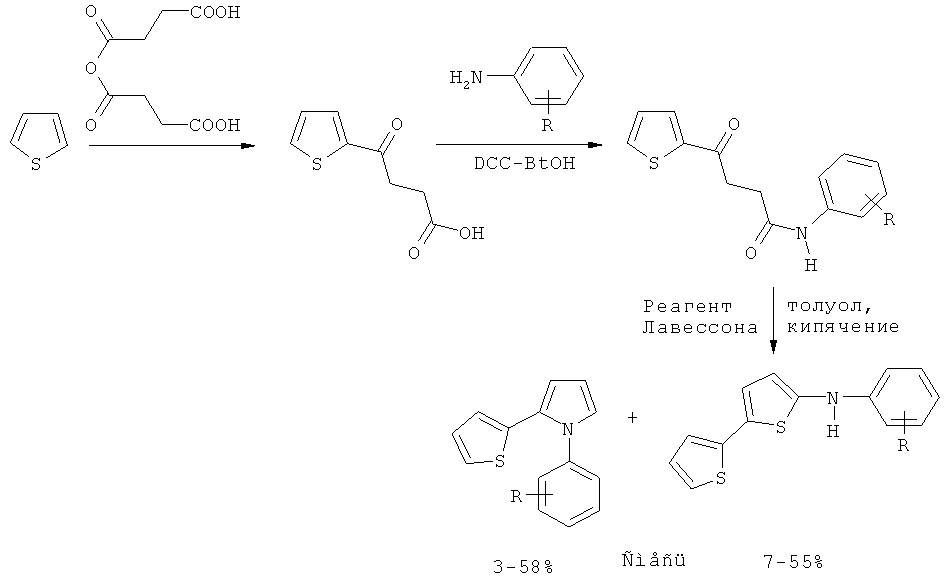
Реагент толуол, Лавессона кипячение
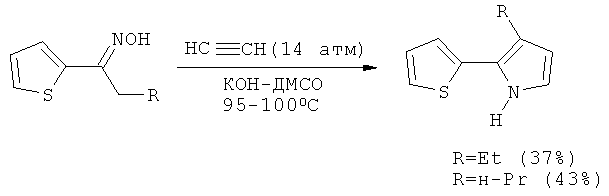
2-(2-Тиенил)-3-этилпиррол и 3-н-пропил-2-(2-тиенил)пиррол с выходами 37 и 43%, соответственно, были получены из соответствующих ацилтиофенов и ацетилена под давлением в (95-100°С, начальное давление при комнатной температуре 14 атм) [С.Pozo-Gonzalo, M. Salsamendi, J.А. Pomposo, H.-J. Grande, E. Yu. Schmidt, Yu. Yu. Rusakov, B.A. Trofimov Macromolecules, 2008, 41, 6886-6894].
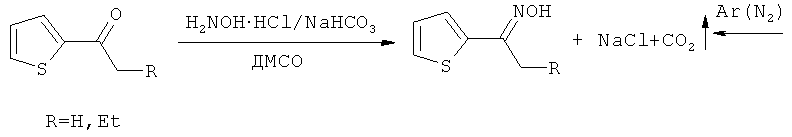
Прототипом настоящего изобретения можно считать синтез тиенилпирролов из ацилтиофенов, которые обрабатываются в отдельном реакторе солянокислым гидроксиламином в присутствии гидрокарбоната натрия в подходящем растворителе с последующим удалением выделяющегося углекислого газа (дополнительная длительная продувка азотом или аргоном). Полученный оксим переносится в другой реактор (автоклав) и после добавления КОН обрабатывается ацетиленом под давлением (14 атм), которое при температуре реакции достигает 20-30 атм [А.И. Михалева, Е.Ю. Шмидт, А.В. Иванов, А.М. Васильцов, Е.Ю. Сенотрусова, Н.И. Процук ЖОрХ, 2007, 43, 236-238, С.Pozo-Gonzalo, М. Salsamendi, J.A. Pomposo, H.-J. Grande, Е. Yu. Schmidt, Yu. Yu. Rusakov, B.A. Trofimov Macromolecules, 2008, 41, 6886-6894].
Этим способом получали 2-(2-тиенил)-3-этилпиррол при температуре 95-100°С (0.5 ч), выход составил 47%. Синтез 1-винил-2-(2-тиенил)пиррола осуществлен при температуре 115-120°С (3 ч), выход 51%. Следует подчеркнуть, что сам незамещенный 2-(2-тиенил)пиррол этим способом синтезирован не был.
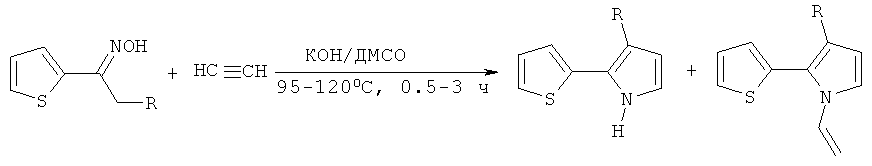
Серьезным технологическим недостатком этого способа является обязательное удаление углекислого газа (длительной продувкой азотом или аргоном), выделяющегося при получении оксима. Остаточные количества CO2 понижают каталитическую активность КОН и даже могут замедлить или остановить процесс формирования пиррольного цикла. Однако главный (фундаментальный) недостаток данного способа, состоящий в химизме процесса, - его неселективность: синтез 2-(2-тиенил)NH-пирролов всегда сопровождается их дальнейшим винилированием, что приводит к образованию в той или иной степени N-винил-2-(2-тиенил)пирролов, обычно трудно отделяемых от целевых продуктов.
Целью настоящего изобретения является разработка селективного технологически реального способа получения 2-(2-тиенил)пиррола, при этом предполагалось также устранить указанный технологический недостаток (необходимость удаления углекислого газа при подготовке реакционной массы). Цель достигается проведением реакции 2-ацетилтиофена с гидрохлоридом гидроксиламина и ацетиленом при атмосферном давлении в присутствии гидроксида калия при температуре 80-120°C в течение 3-5 часов, при этом ацетилен используется в виде насыщенного раствора в диметилсульфоксиде, а гидроксиламин генерируют непосредственно в реакционной среде из солянокислого гидроксиламина и гидроксида калия.
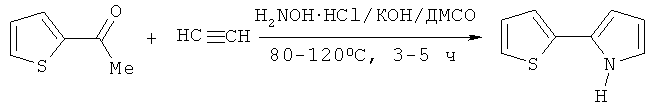
Основным элементом новизны предлагаемого изобретения является использование в качестве реагента не газообразного ацетилена, а его насыщенного раствора в диметилсульфоксиде, что позволяет выдерживать оптимальное соотношение концентраций между образующимся кетоксимом и ацетиленом, не допуская избытка последнего, что обычно и является главной причиной нарушения селективности процесса, т.е. образования нежелательного в данном случае N-винилпиррола. Насыщенный раствор ацетилена в диметилсульфоксиде готовится непосредственно в реакторе при комнатной температуре. При этом целесообразно использовать повышенное давление ацетилена (до 16 атм), которое после насыщения диметилсульфоксида ацетиленом сбрасывается до атмосферного, и далее реакция проводится в закрытом аппарате без подачи ацетилена, только за счет ацетилена, растворенного в реакционной смеси. Известно, что ацетилен с диметилсульфоксидом (как в присутствии гидроксидов щелочных металлов, так и без них) образует комплексы как за счет водородных связей, так и за счет переноса своей π-электронной плотности на разрыхляющую S=O орбиталь диметилсульфоксида [Б.А. Трофимов, А.И. Михалева, Е.Ю. Шмидт, Л.Н. Собенина. Химия пиррола. Новые страницы. Новосибирск: Наука, 2012, 384 с.; R. Boese, М.Т. Kirchner, W.Е. Billups, L.R. Norman, Angew. Chem. Int. Ed. 2003, 42, 1961-1963], что вызывает его дополнительную активацию. Поэтому насыщенный раствор ацетилена в диметилсульфоксиде в данном случае выполняет роль направленно активированного ацетиленового реагента, особо чувствительного к атаке нуклеофила, каковым в данном случае является оксимат-анион.
Другим элементом новизны предлагаемого изобретения является то, что 2-ацетилтиофен, гидрохлорид гидроксиламина и гидроксид калия используются, в мольном соотношении 1:1-1.2:2-2.5, что обеспечивает полное превращение 2-ацетилтиофена в оксимат калия, т.е. достигается максимальная концентрация оксимат-анионов в реакционной среде. При этом выделяется два эквивалента воды:
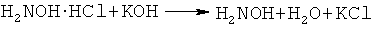
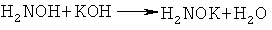
Выделяющаяся в результате этих реакций вода проявляет автоингибирующий эффект по отношению к реакции винилирования образующегося тиенилпиррола [Б.А. Трофимов, А.И. Михалева, Е.Ю. Шмидт, Л.Н. Собенина. Химия пиррола. Новые страницы. Новосибирск: Наука, 2012, 384 с.], что способствует повышению селективности синтеза невинилированного тиенилпиррола.
Принципиально важным для достижения максимально высокой селективности процесса является соблюдение оптимальной концентрации 2-ацетилтиофена в диметилсульфоксиде, что, в конечном счете, и определяет соотношение промежуточно образующегося оксимат-аниона и ацетилена, т.к. количество ацетилена в реакционной смеси определяется в данном случае объемом диметилсульфоксида. Высокая селективность (~90%) при технологически приемлемом выходе (~60% на прореагировавший кетон) и конверсии исходного кетона (~70-80%) достигаются при 5-15%-ной (предпочтительно 10%-ной) концентрации 2-ацетилтиофена в диметилсульфоксиде. При соблюдении указанных условий, которые только в своей совокупности, а не каждое в отдельности, составляют предмет изобретения, в реакционной среде формируется равновесная эволюционирующая каталитическая система, представляющая собой континуум частиц калиевого оксимата 2-ацетилтиофена различной размерности - от молекул, молекулярных кластеров и наночастиц, нанесенных на микрокристаллы образующегося хлорида калия. При этом соотношение каталитических частиц различной размерности и каталитическая активность системы в целом контролируется температурой: при температуре реакции 80-120°C система близка к гомогенной и содержит наибольшее количество молекулярных кластеров и наночастиц, участвующих в реакции, тогда как при охлаждении до комнатной температуры оксимат 2-ацетилтиофена и хлорид калия образуют кристаллический осадок. Таким образом, по элементам новизны предлагаемое изобретение отличается от прототипа на фундаментальном уровне. Полезным эффектом изобретения является достижение высокой селективности (~90%) по целевому продукту. 2-(2-Тиенил)-N-винилпиррол, образующийся соответственно в количестве ~10%, легко отделяющийся от целевого 2-(2-тиенил)пиррола перекристаллизацией из гексана, сам по себе представляет ценный мономер и может найти широкое применение в синтезе органических полупроводниковых материалов.
В целом, изобретение реализуется следующим образом. В 0.5-1.5 М (предпочтительно 0.9-1.0 М) раствор гидрохлорида гидроксиламина в диметилсульфоксиде добавляют 1-1.2 моля полугидрата гидроксида калия КОН·0.5·H2O в расчете на гидрохлорид гидроксиламина, содержащийся в диметилсульфоксиде, и перемешивают смесь при 40-50°C в течение 30-40 мин до полной трансформации гидроксида калия и образования хлорида калия (за счет реакции с солянокислым гидроксиламином). После этого в раствор образовавшегося свободного гидроксиламина в диметилсульфоксиде добавляют 1 моль 2-ацетилтиофена и еще 1 моль гидроксида калия (в расчете на взятый гидрохлорид гидроксиламина), перемешивая смесь при температуре 90°С в течение 30 мин. Полученную смесь насыщают ацетиленом при комнатной температуре под давлением 11-16 атм, давление ацетилена сбрасывается до нуля, реактор герметично закрывается и нагревается при перемешивании (или при вращении, в случае использования вращающегося автоклава) при температуре 80-120°C в течение 3-5 ч. После охлаждения диметилсульфоксид отгоняют (на 80-90%) под вакуумом при температуре куба не выше 80°С. Остаток нейтрализуют водным раствором гидрохлорида аммония и экстрагируют толуолом до исчезновения следов продуктов (контроль ТСХ, силуфол). Толуол отгоняют в вакууме, и остаток перекристаллизовывают из гексана, получая 2-(2-тиенил)пиррол с чистотой, близкой к 100% (ЯМР, ГЖХ). Из маточного раствора обычными приемами выделяют дополнительное количество целевого продукта, небольшие количества N-винил-2-(2-тиенил)пиррола и непрореагировашие 2-ацетилтиофен и его оксим. Суммарная конверсия 2-ацетилтиофена и его оксима составляет 70-80%. Выход чистого 2-(2-тиенил)пиррола находится в пределах 44-70% на вступивший в реакцию 2-ацетилтиофен.
Таким образом, разработан новый высокоселективный способ получения 2-(2-тиенил)пиррола - перспективного мономера для дизайна электропроводящих органических материалов с улучшенными эксплуатационными свойствами, которые могут найти применение в качестве активных компонентов электродов в полимерных перезаряжаемых источниках тока и электрохромных устройствах.
По сравнению с прототипом разработанный способ обладает следующими принципиальными технологическими преимуществами.
1. Позволяет получать с высокой селективностью и технологически приемлемыми выходами и конверсией исходных материалов незамещенный 2-(2-тиенил)пиррол, тогда как в прототипе описаны только 3-алкил-2-тиенилпирролы, которые образуются в смеси с их N-винильными производными.
2. Устраняет из процесса один из компонентов реакционной смеси - гидрокарбонат натрия, использующийся в прототипе.
3. Соответственно не требуется дорогостоящая технологическая операция - удаление из реакционной среды двуокиси углерода путем длительной продувки инертным газом.
4. Дает возможность простой технологической операцией (отгонкой в вакууме) практически полностью регенерировать ценный растворитель (диметилсульфоксид).
5. Способ экологически безопасен: единственными отходами являются небольшие количества хлорида калия и аммиака, которые могут быть использованы как удобрения, т.е. реально стать товарными продуктами.
Следующие неограничивающие примеры иллюстрируют изобретение.
Пример 1
В стальной вращающийся автоклав емкостью 2 литра загружают смесь 30.4 г (0.44 моль) гидрохлорида гидроксиламина, 44.5 г КОН·0.5 H2O (0.68 моль) и 50 г (0.4 моль) 2-ацетилтиофена в диметилсульфоксиде, полученную последовательным растворением в 500 мл диметилсульфоксида указанных количеств гидрохлорида гидроксиламина и гидроксида калия (0.34 моль) при 50°C в течение 30 мин с последующим добавлением 2-ацетилтиофена и дополнительно 22.2 г (0.34 моль) гидроксида калия при нагревании (90°С) и перемешивании (30 мин). Автоклав герметически закрывают и насыщают ацетиленом под давлением 16 атм при комнатной температуре в течение 12 мин. Далее давление ацетилена в автоклаве сбрасывают до атмосферного, автоклав герметически закрывают и нагревают до 110°C при вращении в течение 4 часов.
Из охлажденной до комнатной температуры реакционной смеси отгоняют в вакууме (~1 мм рт.ст.) диметилсульфоксид - 410 мл (82%), следя за тем, чтобы температура куба не превышала 80°C. Остаток нейтрализуют 100 мл водного раствора NH4Cl (36.38 г (0.68 моль) и экстрагируют толуолом (9×40 мл). Толуольный экстракт промывают водой (3×20 мл), отгоняют толуол и получают 55.6 г сырого продукта (состав: 62.1% пиррола, 0.4% кетона, 26.2% оксима, 11.3% винилпиррола), из которого выделяют (перекристаллизацией из н-гексана и колоночной хроматографией маточного раствора) 31.6 г (выход 54% на взятый ацетилтиофен) 2-(2-тиенил)пиррола с чистотой, близкой к 100% (ЯМР, ГЖХ). Кроме того, выделяют 7.6 г оксима ацетилтиофена (экстракцией сырого продукта водной щелочью с последующим подкислением экстракта) и 5.3 г N-винилпиррола.
Выход 2-(2-тиенил)пиррола на вступивший в реакцию 2-ацетилтиофен (с учетом возвращенного его оксима) составляет 62%.
Пример 2
В стальной вращающийся автоклав емкостью 2 литра загружают смесь 30.4 г (0.44 моль) гидрохлорида гидроксиламина, 44.5 г КОН·0.5 H2O (0.68 моль) и 50 г (0.4 моль) 2-ацетилтиофена в диметилсульфоксиде, полученную последовательным растворением в 500 мл диметилсульфоксида указанных количеств гидрохлорида гидроксиламина и гидроксида калия (0.34 моль) при 50°C в течение 30 мин с последующим добавлением 2-ацетилтиофена и дополнительно 22.2 г (0.34 моль) гидроксида калия при нагревании (90°C) и перемешивании (30 мин). Автоклав герметически закрывают и насыщают ацетиленом под давлением 11 атм при комнатной температуре в течение 12 мин. Далее давление ацетилена в автоклаве сбрасывают до атмосферного, автоклав герметически закрывают и нагревают до 110°C при вращении в течение 3 ч.
Из охлажденной до комнатной температуры реакционной смеси отгоняют в вакууме (~2 мм рт.ст.) диметилсульфоксид - 400 мл (80%), следя за тем, чтобы температура куба не превышала 80°C. Остаток нейтрализуют 100 мл водного раствора NH4Cl (21.4 г(0.4 моль) и экстрагируют толуолом (9×40 мл). Толуольный экстракт промывают водой (3×20 мл), отгоняют толуол и получают сырой продукт (состав: 50% пиррола, 15% кетона, 35% оксима, следовые количества винилпиррола), из которого выделяют (перекристаллизацией из н-гексана и колоночной хроматографией маточного раствора) 19.9 г (выход 33% на взятый ацетилтиофен) 2-(2-тиенил)пиррола с чистотой, близкой к 100% (ЯМР, ГЖХ). Кроме того, выделяют 14.7 г оксима ацетилтиофена (экстракцией сырого продукта водной щелочью с последующим подкислением экстракта.
Выход 2-(2-тиенил)пиррола на вступивший в реакцию 2-ацетилтиофен (с учетом возвращенного его оксима) составляет 44%.
Пример 3
В стальной вращающийся автоклав емкостью 2 литра загружают смесь 3074 г (0.44 моль) гидрохлорида гидроксиламина, 44.5 г КОН·0.5 Н2О (0.68 моль) и 50 г (0.4 моль) 2-ацетилтиофена в диметилсульфоксиде, полученную последовательным растворением в 500 мл диметилсульфоксида указанных количеств гидрохлорида гидроксиламина и гидроксида калия (0.34 моль) при 40°C в течение 40 мин с последующим добавлением 2-ацетилтиофена и дополнительно 22.2 г (0.34 моль) гидроксида калия при нагревании (90°C) и перемешивании (30 мин). Автоклав герметически закрывают и насыщают ацетиленом под давлением 14 атм при комнатной температуре в течение 12 мин. Далее давление ацетилена в автоклаве сбрасывают до атмосферного, автоклав герметически закрывают и нагревают до 110°C при вращении в течение 4 часов.
Из охлажденной до комнатной температуры реакционной смеси отгоняют в вакууме (~1 мм рт.ст.) диметилсульфоксид - 450 мл (90%), следя за тем, чтобы температура куба не превышала 80°C. Остаток нейтрализуют 100 мл водного раствора NH4Cl (30.4 г (0.57 моль) и экстрагируют толуолом (10×40 мл). Толуольный экстракт промывают водой (3×20 мл), отгоняют толуол и получают 55.5 г сырого продукта (состав: 64.1% пиррола, 1.7% кетона, 28.1% оксима, 6.1% винилпиррола), из которого выделяют (перекристаллизацией из н-гексана и колоночной хроматографией маточного раствора) 29.3 г (выход 50% на взятый ацетилтиофен) 2-(2-тиенил)пиррола с чистотой, близкой к 100% (ЯМР, ГЖХ). Кроме того, выделяют 10.0 г оксима ацетилтиофена (экстракцией сырого продукта водной щелочью с последующим подкислением экстракта) и 3.0 г N-винилпиррола.
Выход 2-(2-тиенил)пиррола на вступивший в реакцию 2-ацетилтиофен (с учетом возвращенного его оксима) составляет 61%.
Пример 4
В стальной вращающийся автоклав емкостью 2 литра загружают смесь 45.7 г (0.66 моль) гидрохлорида гидроксиламина, 66.7 г КОН·0.5 H2O (1.02 моль) и 75 г (0.6 моль) 2-ацетилтиофена в диметилсульфоксиде, полученную последовательным растворением в 750 мл диметилсульфоксида указанных количеств гидрохлорида гидроксиламина и гидроксида калия (0.51 моль) при 50°C в течение 30 мин с последующим добавлением 2-ацетилтиофена и дополнительно 33.3 г (0.51 моль) гидроксида калия при нагревании (90°С) и перемешивании (30 мин). Автоклав герметически закрывают и насыщают ацетиленом под давлением 16 атм при комнатной температуре в течение 12 мин. Далее давление ацетилена в автоклаве сбрасывают до атмосферного, автоклав герметически закрывают и нагревают до 110°C при вращении в течение 4 часов.
Из охлажденной до комнатной температуры реакционной смеси отгоняют в вакууме (~1 мм рт.ст.) диметилсульфоксид - 670 мл (84%), следя за тем, чтобы температура куба не превышала 80°C. Остаток нейтрализуют 200 мл водного раствора NH4Cl (54.6 г(1.02 моль) и экстрагируют толуолом (9×40 мл). Толуольный экстракт промывают водой (3×20 мл), отгоняют толуол и получают 78.0 г сырого продукта (состав: 64.5% пиррола, 0.7% кетона, 20.4% оксима, 14.4% винилпиррола), из которого выделяют (перекристаллизацией из н-гексана и колоночной хроматографией маточного раствора) 44.3 г (выход 50% на взятый ацетилтиофен) 2-(2-тиенил)пиррола с чистотой, близкой к 100% (ЯМР, ГЖХ). Кроме того, выделяют 12.4 г оксима ацетилтиофена (экстракцией сырого продукта водной щелочью с последующим подкислением экстракта) и 10.2 г N-винилпиррола.
Выход 2-(2-тиенил)пиррола на вступивший в реакцию 2-ацетилтиофен (с учетом возвращенного его оксима) составляет 60%.
Пример 5
В стальной вращающийся автоклав емкостью 2 литра загружают смесь 30.4 г (0.44 моль) гидрохлорида гидроксиламина, 44.5 г КОН·0.5 H2O (0.68 моль) и 50 г (0.4 моль) 2-ацетилтиофена в диметилсульфоксиде, полученную последовательным растворением в 500 мл диметилсульфоксида указанных количеств гидрохлорида гидроксиламина и гидроксида калия (0.34 моль) при 50°C в течение 30 мин с последующим добавлением 2-ацетилтиофена и дополнительно 22.2 г (0.34 моль) гидроксида калия при нагревании (90°C) и перемешивании (30 мин). Автоклав герметически закрывают и насыщают ацетиленом под давлением 11 атм при комнатной температуре в течение 15 мин. Далее давление ацетилена в автоклаве сбрасывают до атмосферного, автоклав герметически закрывают и нагревают до 120°C при вращении в течение 4 часов.
Из охлажденной до комнатной температуры реакционной смеси отгоняют в вакууме (~1 мм рт.ст.) диметилсульфоксид - 440 мл (88%), следя за тем, чтобы температура куба не превышала 80°C. Остаток нейтрализуют 100 мл водного раствора NH4Cl (36.38 г (0.68 моль) и экстрагируют толуолом (8×40 мл). Толуольный экстракт промывают водой (3×20 мл), отгоняют толуол и получают 69.6 г сырого продукта (состав: 63.9% пиррола, следовые количества кетона, 18.3% оксима, 17.8% винилпиррола), из которого выделяют (перекристаллизацией из н-гексана и колоночной хроматографией маточного раствора) 28.0 г (выход 47% на взятый ацетилтиофен) 2-(2-тиенил)пиррола с чистотой, близкой к 100% (ЯМР, ГЖХ). Кроме того, выделяют 11.5 г оксима ацетилтиофена (экстракцией сырого продукта водной щелочью с последующим подкислением экстракта) и 9.3 г N-винилпиррола.
Выход 2-(2-тиенил)пиррола на вступивший в реакцию 2-ацетилтиофен (с учетом возвращенного его оксима) составляет 59%.
Пример 6
В стальной вращающийся автоклав емкостью 2 литра загружают смесь 30,4 г (0.44 моль) гидрохлорида гидроксиламина, 44.5 г КОН·0.5 Н2О (0.68 моль) и 50 г (0.4 моль) 2-ацетилтиофена в диметилсульфоксиде, полученную последовательным растворением в 500 мл диметилсульфоксида указанных количеств гидрохлорида гидроксиламина и гидроксида калия (0.34 моль) при 50°C в течение 30 мин с последующим добавлением 2-ацетилтиофена и дополнительно 22.2 г (0.34 моль) гидроксида калия при нагревании (90°C) и перемешивании (30 мин). Автоклав герметически закрывают и насыщают ацетиленом под давлением 16 атм при комнатной температуре в течение 11 мин. Далее давление ацетилена в автоклаве сбрасывают до атмосферного, автоклав герметически закрывают и нагревают до 90°C при вращении втечение 5 часов.
Из охлажденной до комнатной температуры реакционной смеси отгоняют в вакууме (~2 мм рт.ст.) диметилсульфоксид - 435 мл (87%), следя за тем, чтобы температура куба не превышала 80°C. Остаток нейтрализуют 100 мл водного раствора NH4Cl (36.38 г (0.68 моль) и экстрагируют толуолом (9×40 мл). Толуольный экстракт промывают водой (3×20 мл), отгоняют толуол и получают 57.5 г сырого продукта (состав: 65.7% пиррола, 7.3% кетона, 27.0% оксима), из которого выделяют (перекристаллизацией из н-гексана и колоночной хроматографией маточного раствора) 35.2 г (выход 59% на взятый ацетилтиофен) 2-(2-тиенил)пиррола с чистотой, близкой к 100% (ЯМР, ГЖХ). Кроме того, выделяют 9.3 г оксима ацетилтиофена (экстракцией сырого продукта водной щелочью с последующим подкислением экстракта).
Выход 2-(2-тиенил)пиррола на вступивший в реакцию 2-ацетилтиофен (с учетом возвращенного его оксима) составляет 70%.
Пример 7
В стальной вращающийся автоклав емкостью 2 литра загружают смесь 30.4 г (0.44 моль) гидрохлорида гидроксиламина, 44.5 г КОН·0.5 H2O (0.68 моль) и 50 г (0.4 моль) 2-ацетилтиофена в диметилсульфоксиде, полученную последовательным растворением в 400 мл диметилсульфоксида указанных количеств гидрохлорида гидроксиламина и гидроксида калия (0.34 моль) при 50°C в течение 30 мин с последующим добавлением 2-ацетилтиофена и дополнительно 22.2 г (0.34 моль) гидроксида калия при нагревании (90°C) и перемешивании (30 мин). Автоклав герметически закрывают и насыщают ацетиленом под давлением 16 атм при комнатной температуре в течение 12 мин. Далее давление ацетилена в автоклаве сбрасывают до атмосферного, автоклав герметически закрывают и нагревают до 110°C при вращении в течение 3 часов.
Из охлажденной до комнатной температуры реакционной смеси отгоняют в вакууме (~1 мм рт.ст.) диметилсульфоксид - 440 мл (88%), следя за тем, чтобы температура куба не превышала 80°C. Остаток нейтрализуют 100 мл водного раствора NH4Cl (36.38 г (0.68 моль) и экстрагируют толуолом (8×40 мл). Толуольный экстракт промывают водой (3×20 мл), отгоняют толуол и получают 69.6 г сырого продукта (состав: 63.9% пиррола, следовые количества кетона, 18.3% оксима, 17.8% винилпиррола), из которого выделяют (перекристаллизацией из н-гексана и колоночной хроматографией маточного раствора) 28.0 г (выход 47% на взятый ацетилтиофен) 2-(2-тиенил)пиррола с чистотой, близкой к 100% (ЯМР, ГЖХ). Кроме того, выделяют 11.5 г оксима ацетилтиофена (экстракцией сырого продукта водной щелочью с последующим подкислением экстракта) и 9.3 г N-винилпиррола.
Выход 2-(2-тиенил)пиррола на вступивший в реакцию 2-ацетилтиофен (с учетом возвращенного его оксима) составляет 59%.
Пример 6
В стальной вращающийся автоклав емкостью 2 литра загружают смесь 30,4 г (0.44 моль) гидрохлорида гидроксиламина, 44.5 г КОН·0.5 Н2О (0.68 моль) и 50 г (0.4 моль) 2-ацетилтиофена в диметилсульфоксиде, полученную последовательным растворением в 500 мл диметилсульфоксида указанных количеств гидрохлорида гидроксиламина и гидроксида калия (0.34 моль) при 50°C в течение 30 мин с последующим добавлением 2-ацетилтиофена и дополнительно 22.2 г (0.34 моль) гидроксида калия при нагревании (90°C) и перемешивании (30 мин). Автоклав герметически закрывают и насыщают ацетиленом под давлением 16 атм при комнатной температуре в течение 11 мин. Далее давление ацетилена в автоклаве сбрасывают до атмосферного, автоклав герметически закрывают и нагревают до 90°C при вращении в течение 5 часов.
Из охлажденной до комнатной температуры реакционной смеси отгоняют в вакууме (~2 мм рт.ст.) диметилсульфоксид - 435 мл (87%), следя за тем, чтобы температура куба не превышала 80°C. Остаток нейтрализуют 100 мл водного раствора NH4Cl (36.38 г (0.68 моль) и экстрагируют толуолом (9×40 мл). Толуольный экстракт промывают водой (3×20 мл), отгоняют толуол и получают 57.5 г сырого продукта (состав: 65.7% пиррола, 7.3% кетона, 27.0% оксима), из которого выделяют (перекристаллизацией из н-гексана и колоночной хроматографией маточного раствора) 35.2 г (выход 59% на взятый ацетилтиофен) 2-(2-тиенил)пиррола с чистотой, близкой к 100% (ЯМР, ГЖХ). Кроме того, выделяют 9.3 г оксима ацетилтиофена (экстракцией сырого продукта водной щелочью с последующим подкислением экстракта).
Выход 2-(2-тиенил)пиррола на вступивший в реакцию 2-ацетилтиофен (с учетом возвращенного его оксима) составляет 70%.
Пример 7
В стальной вращающийся автоклав емкостью 2 литра загружают смесь 30.4 г (0.44 моль) гидрохлорида гидроксиламина, 44.5 г КОН·0.5 H2O (0.68 моль) и 50 г (0.4 моль) 2-ацетилтиофена в диметилсульфоксиде, полученную последовательным растворением в 400 мл диметилсульфоксида указанных количеств гидрохлорида гидроксиламина и гидроксида калия (0.34 моль) при 50°C в течение 30 мин с последующим добавлением 2-ацетилтиофена и дополнительно 22.2 г (0.34 моль) гидроксида калия при нагревании (90°C) и перемешивании (30 мин). Автоклав герметически закрывают и насыщают ацетиленом под давлением 16 атм при комнатной температуре в течение 12 мин. Далее давление ацетилена в автоклаве сбрасывают до атмосферного, автоклав герметически закрывают и нагревают до 110°C при вращении в течение 3 часов.
Из охлажденной до комнатной температуры реакционной смеси отгоняют в вакууме (~1 мм рт.ст.) диметилсульфоксид - 340 мл (85%), следя за тем, чтобы температура куба не превышала 80°C. Остаток нейтрализуют 100 мл водного раствора NH4Cl (36.38 г (0.68 моль) и экстрагируют толуолом (9×40 мл). Толуольный экстракт промывают водой (3×20 мл), отгоняют толуол и получают 58.8 г сырого продукта (состав: 61.5% пиррола, 1.1% кетона, 20.9% оксима, 16.5% винилпиррола), из которого выделяют (перекристаллизацией из н-гексана и колоночной хроматографией маточного раствора) 29.8 г (выход 50% на взятый ацетилтиофен) 2-(2-тиенил)пиррола с чистотой, близкой к 100% (ЯМР, ГЖХ). Кроме того, выделяют 8.5 г оксима ацетилтиофена (экстракцией сырого продукта водной щелочью с последующим подкислением экстракта) и 7.1 г N-винилпиррола.
Выход 2-(2-тиенил)пиррола на вступивший в реакцию 2-ацетилтиофен (с учетом возвращенного его оксима) составляет 59%.
Пример 8
В стальной вращающийся автоклав емкостью 2 литра загружают смесь 30.4 г (0.44 моль) гидрохлорида гидроксиламина, 65.0 г КОН·0.5 Н2О (1.0 моль) и 50 г (0.4 моль) 2-ацетилтиофена в диметилсульфоксиде, полученную последовательным растворением в 500 мл диметилсульфоксида указанных количеств гидрохлорида гидроксиламина и гидроксида калия (0.5 моль) при 50°C в течение 30 мин с последующим добавлением 2-ацетилтиофена и дополнительно 32.5 г (0.5 моль) гидроксида калия при нагревании (90°C) и перемешивании (30 мин). Автоклав герметически закрывают и насыщают ацетиленом под давлением 14 атм при комнатной температуре в течение 12 мин. Далее давление ацетилена в автоклаве сбрасывают до атмосферного, автоклав герметически закрывают и нагревают до 100°C при вращении в течение 4 часов.
Из охлажденной до комнатной температуры реакционной смеси отгоняют в вакууме (~1 мм рт.ст.) диметилсульфоксид - 450 мл (90%), следя за тем, чтобы температура куба не превышала 80°C. Остаток нейтрализуют 100 мл водного раствора NH4Cl (53.49 г (1.0 моль) и экстрагируют толуолом (9×40 мл). Толуольный экстракт промывают водой (3×20 мл), отгоняют толуол и получают 60.0 г сырого продукта (состав: 59.2% пиррола, 8.4% кетона, 18.8% оксима, 13.6% винилпиррола), из которого выделяют (перекристаллизацией из н-гексана и колоночной хроматографией маточного раствора) 29.2 г (выход 49% на взятый ацетилтиофен) 2-(2-тиенил)пиррола с чистотой, близкой к 100% (ЯМР, ГЖХ). Кроме того, выделяют 6.9 г оксима ацетилтиофена (экстракцией сырого продукта водной щелочью с последующим подкислением экстракта) и 6.0 г N-винилпиррола.
Выход 2-(2-тиенил)пиррола на вступивший в реакцию 2-ацетилтиофен (с учетом возвращенного его оксима) составляет 56%.

