Результат интеллектуальной деятельности: СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ФИКСИРОВАННОГО ВИРУСА БЕШЕНСТВА ШТАММА "МОСКВА 3253"
Вид РИД
Изобретение
Изобретение относится к биотехнологии и вирусологии и может быть использовано специалистами, работающими в области производства медицинских иммунобиологических препаратов (МИБП).
Изобретение выполнено в рамках реализации федеральной целевой программы «Национальная система химической и биологической безопасности Российской Федерации (2009-2013 гг.)» и в соответствии с Государственным контрактом №54-Д от 04.06.2012 г.
До настоящего времени бешенство остается одной из самых опасных инфекционных болезней, от которой ежегодно в мире погибает около 50000 человек и 1 млн животных [1]. Неблагоприятная эпидемиологическая ситуация по бешенству, сложившаяся практически во всех регионах Российской Федерации из-за повышения заболеваемости диких и домашних животных, обусловливает резко возросший уровень численности людей, ежегодно обращающихся за антирабической помощью - свыше 450000 человек. Половина из этого числа получает курс антирабического лечения [3], что диктует необходимость интенсификации исследований по совершенствованию качества антирабических препаратов.
Для постэкспозиционной профилактики бешенства у людей в Российской Федерации применяют концентрированную культуральную антирабическую вакцину в сочетании с антирабическим иммуноглобулином.
На сегодняшний день гетерологичный антирабический иммуноглобулин можно считать приемлемой и безопасной альтернативой гомологичному препарату, получаемому из иммунной сыворотки крови человека. Использование современных методов очистки иммуноглобулиновых препаратов позволило значительно снизить частоту побочных эффектов до 1-2%, проявляющихся в результате применения антирабического иммуноглобулина животного происхождения [15].
Для иммунизации продуцентов при получении лошадиной гипериммунной сыворотки используют рабический антиген на основе фиксированного вируса бешенства штамма «Москва 3253». При получении антигена необходима стандартизация количественной оценки содержания вируса бешенства «Москва 3253» в материале для иммунизации.
В настоящее время количество вируса в исследуемом материале можно определять различными способами.
Известны способы определения количества вируса в исследуемом материале по локальным повреждениям в зараженных культурах клеток и на хорион-аллантоисной оболочке (ХАО) куриных эмбрионов, в которых количество вируса учитывают в бляшкообразующих единицах (БОЕ), оспообразующих единицах (ООЕ). Однако использование методов затруднено в связи с тем, что при высокой концентрации вируса в исследуемом материале избежать слияния бляшек невозможно и соответственно невозможно провести количественную оценку [4]. Метод выполняют с живым вирусом, он трудоемкий и длительный по исполнению (72-96 часов).
Известен метод определения титра вируса в единицах 50% инфекционного действия. По этому методу за единицу количества вируса принимается такая его доза, которая способна вызывать инфекционный эффект у 50% зараженных животных. Способ определения титра вируса заключается в заражении животных вирусом с последующим учетом клинических особенностей проявления инфекционного процесса у каждого животного (явления признаков паралича на 4-7 сутки) и определением 50% эффективной дозы. Однако этот метод титрования вирусов довольно трудоемкий, длительный и требует большого количества животных. Недостатками данного метода также является то, что более высокая доза вируса не всегда вызывает и более высокий инфекционный эффект, что связано с индивидуальной чувствительностью каждого вида животного [4].
Известен метод, основанный на способности агглютинировать эритроциты определенных видов животных при определенных условиях. Титр таких вирусов выражают в гемагглютинирующих единицах (ГАЕ). Суспензию эритроцитов и вируссодержащий материал в разведениях смешивают в равных объемах, инкубируют при 37°С и учитывают реакцию агглютинации. Однако не все вирусы способны агглютинировать эритроциты, поэтому недостатком данного метода является возможность постановки реакции только с гемагглютинирующими вирусами [4].
Все вышеописанные методы определения содержания вируса бешенства в материале основаны на воздействии живого возбудителя на различные биологические клетки и ткани и не пригодны для количественной оценки инактивированного вируса бешенства.
Одним из перспективных подходов к количественной оценке вирусов в инактивированном антигеном материале является использование молекулярно-генетических методов.
При классической ПЦР с электрофоретическим учетом результатов отсутствует возможность количественного определения ДНК/РНК инфекционных агентов в исследуемом материале. Кроме того, наличие стадии электрофореза предъявляет более строгие требования к организации ПЦР-лаборатории и возрастает риск контаминации продуктами ПЦР. При использовании ПЦР с гибридизационно-флуоресцентным учетом результатов в режиме реального времени, возможно количественное определение ДНК/РНК инфекционных агентов в исследуемом материале, с автоматическим регистрированием и интерпретацией полученных результатов. Отсутствие стадии электрофореза позволяет минимизировать число ложноположительных результатов. Поскольку регистрация результатов проводится непосредственно в процессе ПЦР, весь анализ можно выполнять в одной-двух комнатах лаборатории и нет необходимости в отдельном помещении для детекции продуктов реакции [2].
Данный подход нашел успешное применение для определения концентрации РНК желтой геморрагической лихорадки, человеческого герпес вируса-6 и цитомегаловируса [8, 9]. Доказана эффективность использования ПЦР с электрофоретическим, гибридизационно-флуоресцентным и секвенационным учетом результатов для выявления РНК вируса бешенства в биологическом материале от животных и человека [5, 6, 7, 10, 11, 12, 13, 14]. Во всех работах определение количества вирусных частиц в материале для исследований не проводилось.
Задачей предлагаемого изобретения является создание высокоспецифичного, чувствительного, простого и быстрого в исполнении способа количественного определения фиксированного вируса бешенства штамма «Москва 3253 » с использованием полимеразной цепной реакции в режиме реального времени при производстве антирабического иммуноглобулина.
Технический результат изобретения заключается в сокращении времени исполнения, получении количественных характеристик используемого антигена, что способствует стандартизации этапа приготовления рабического антигена при производстве антирабического иммуноглобулина.
Технический результат достигается способом, включающим обеззараживание и выделение РНК из вируссодержащего материала, постановку реакции обратной транскрипции и полимеразной цепной реакции с гибридизационно-флуоресцентным учетом результатов в режиме «реального времени» с использованием специфичных праймеров PV5-5'-GTTGGGCACTGAAACTGCTA-3',
RV6-5'-GAATCTCCGGGTTCAAGAGT-3'
и зонда RV7-5'-ROX-AATCCTCCTTGAACTCCATGCGACAGA-BHQ2, обеспечивающих амплификацию фрагмента G-L области генома фиксированного вируса бешенства штамма «Москва 3253», отжиг праймеров проводят при температуре 60°С в течение 10 циклов, затем при 56°С в течение 35 циклов, а количественную оценку вируса определяют на основании регистрации сигнала флуоресценции исследуемого образца и сравнения его с сигналом флуоресценции ПЦР-стандартов, содержащих различные количества ДНК-мишени.
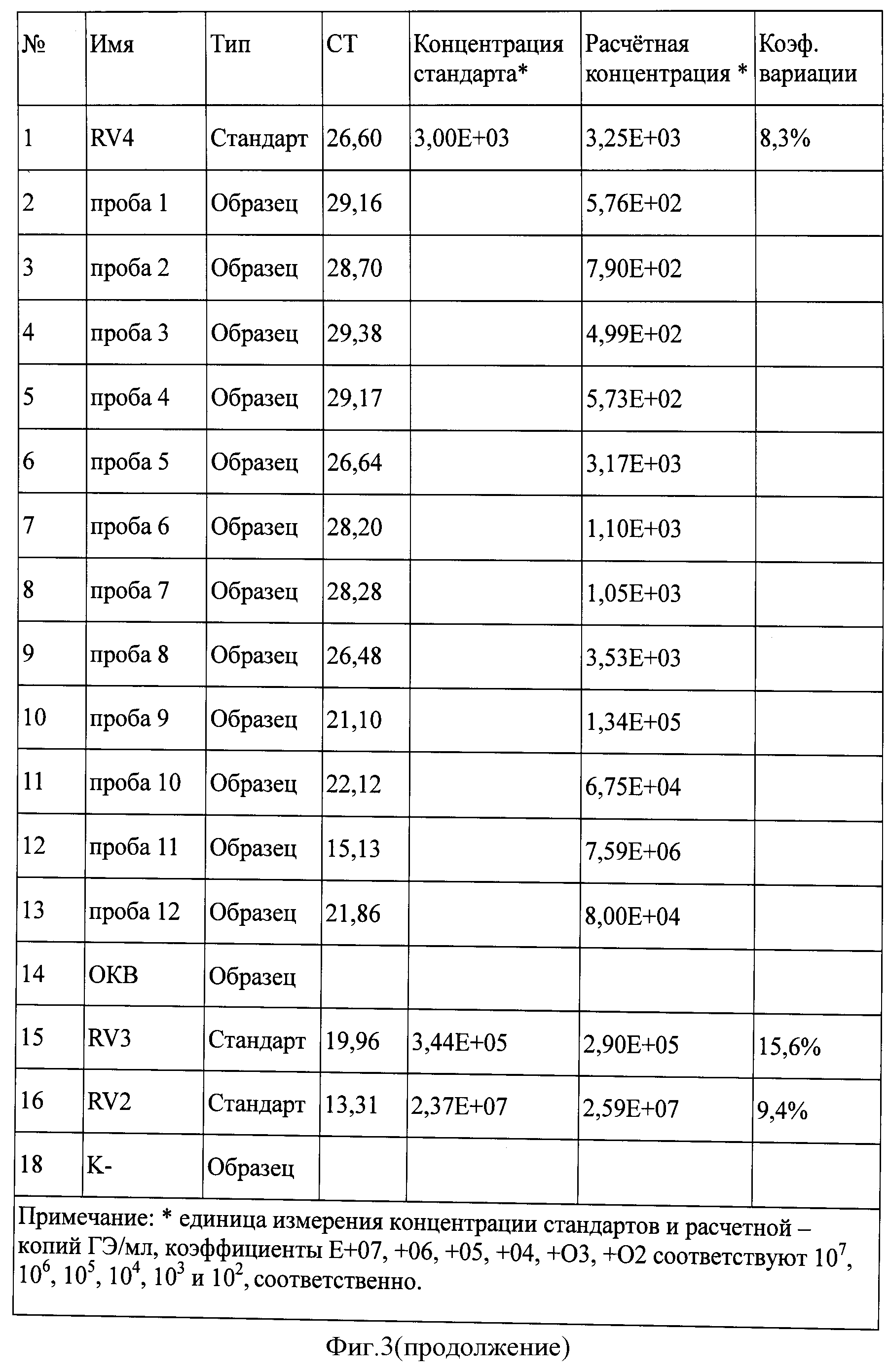
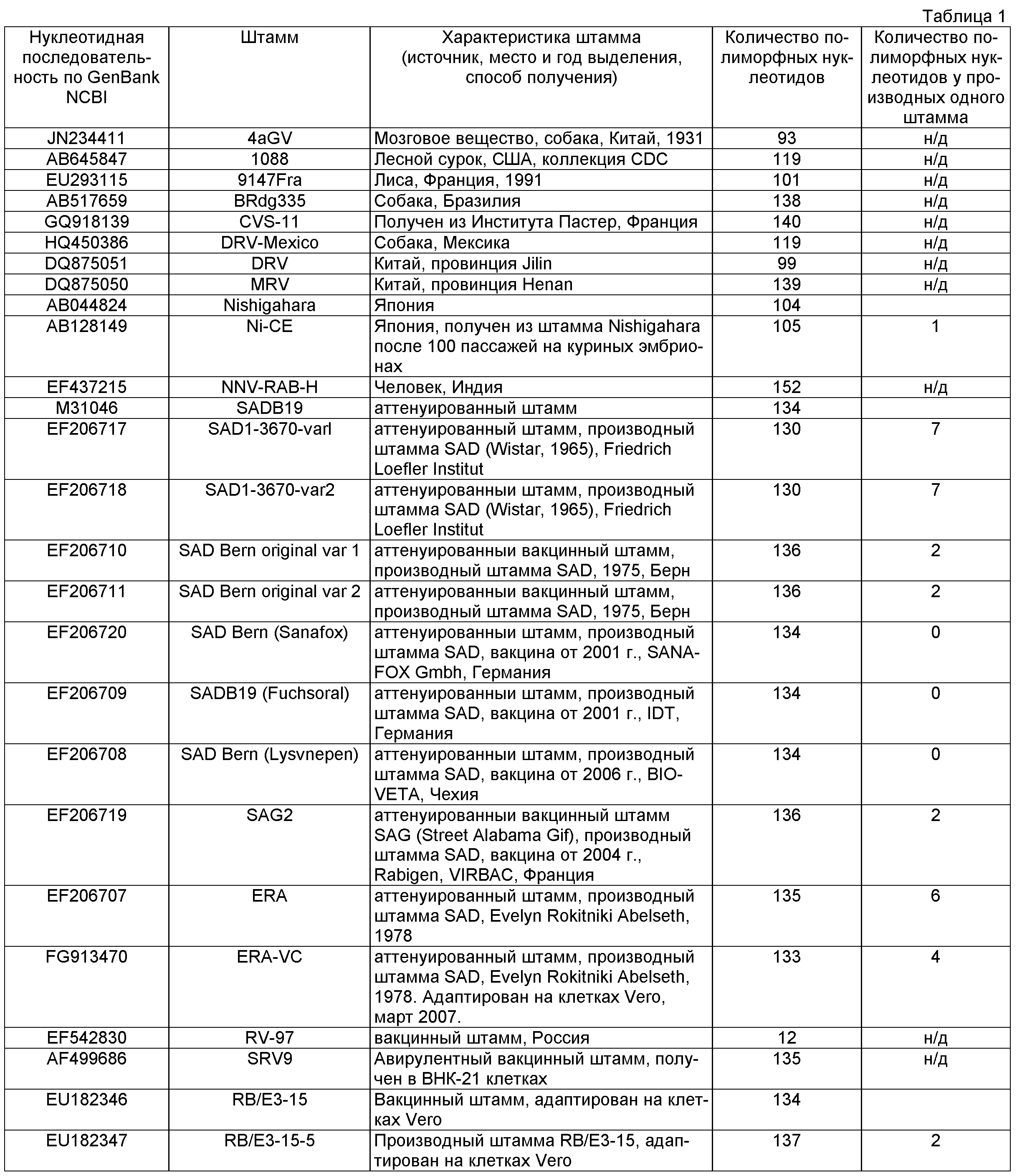
В качестве ДНК-мишени для разработки способа количественного определения фиксированного вируса бешенства штамма «Москва 3253» был выбран фрагмент G-L области вируса бешенства размером 881 н.п. При изучении этой нуклеотидной последовательности установлено, что последовательность G-L области штамма вируса бешенства «Москва 3253» уникальна и имеет отличия от других последовательностей данного участка от 12 нуклеотидов у штамма RV-97 до 152 нуклеотидов для изолята NNV-RAB-H. Результаты анализа представлены в табл.1. Анализ нуклеотидной последовательности проводили с помощью алгоритма AlignX и программы Mega 3.1, а также алгоритма BLAST и генетической базы данных GenBank. При изучении нуклеотидной последовательности данного локуса у штамма вируса бешенства «Москва 3253» установлена ее высокая стабильность во всех пассажах вируса, используемых в производстве антирабического иммуноглобулина. На основании полученных результатов выведена консенсусная последовательность фрагмента G-L области у фиксированного штамма вируса бешенства «Москва 3253». Проведенный анализ гомологии исследуемой области фрагмента G-L области у производных штамма SAD В19, показал идентичность у штаммов после пассажей на куриных эмбрионах и клетках Vero на 99,8% и 99,7%, соответственно, что также подтверждает высокую специфичность указанного фрагмента.
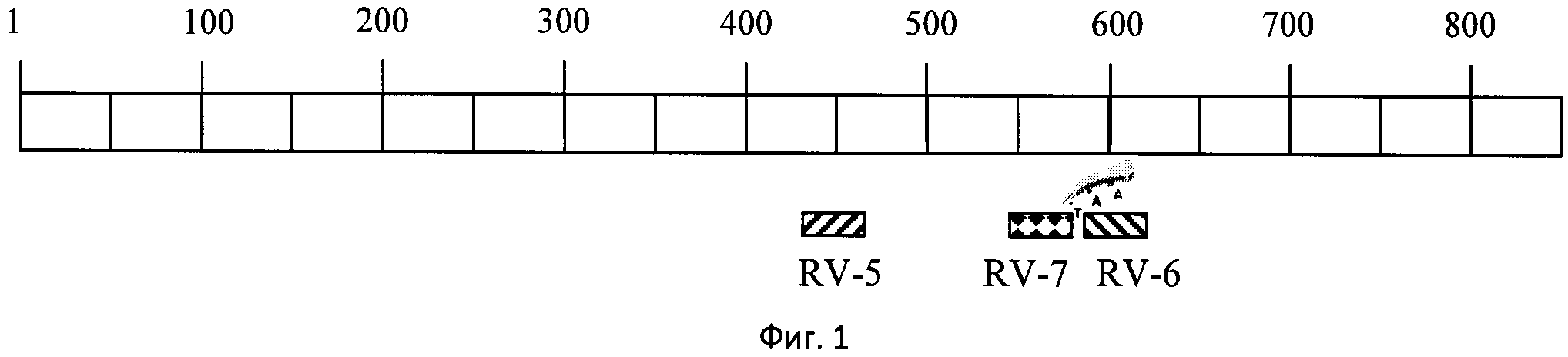
На основании консенсусной последовательности выбранного участка G-L области с помощью программы Primer Premier- V5 (Premier Bio Soft International), интернет-сайта www.genscript.com и алгоритма BLAST подобранны олигонуклеотидные праймеры RV5 и RV6, обеспечивающие амплификацию фрагмента в пределах 436-585 нуклеотида полной последовательности локуса и зонд формата TaqMan RV7 с флуоресцентными меткой ROX и гасителем BHQ2 в позиции 542-565 нуклеотида полной последовательности локуса, позволяющие учитывать результаты реакции в режиме реального времени:
RV5-5'-GTTGGGCACTGAAACTGCTA-3',
RV6-5'-GAATCTCCGGGTTCAAGAGT-3'
RV7-5'-ROX-AATCCTCCTTGAACTCCATGCGACAGA-BHQ2,
Анализ соответствия выбранных праймеров и зонда по количеству вариабельных нуклеотидов представлен в табл.2. Полученные результаты указывают на высокую специфичность праймеров RV-5, RV-6 и зонда RV-7 по отношению к указанному выше фрагменту последовательности G-L области штамма вируса бешенства «Москва 3253». Для повышения эффективности гидролиза зонда RV7 за счет 5'-экзонуклеазной активности фермента Taq-полимеразы к 5'-концу зонда добавлено три нуклеотида «ААТ», некомплементарных последовательности локуса. Схема расположения праймеров и зондов представлена на фигуре 1.
Экспериментально установлен оптимальный состав реакционной смеси для выполнения ПЦР с гибридизационно-флуоресцентным учетом результатов. Подобраны оптимальные параметры реакции амплификации с олигонуклеотидными праймерами и зондом. В частности, для постановки ПЦР с гибридизационно-флуоресцентным учетом результатов ПЦР-смесь 1 содержит праймеры RV5 и RV6, зонд RV7, четыре дезоксинуклеотидтрифосфата, азид натрия, воду, свободную от нуклеаз; реакционная ПЦР-смесь 2 содержит 10×Taq буфер с сульфатом аммония, магния хлорид, воду свободную от нуклеаз.
Экспериментально подобран режим отжига праймеров и эффективное число циклов амплификации. Отжиг праймеров проводят при температуре 60°С в течение 10 циклов, затем при 56°С в течение 35 циклов. Учет флуоресценции по каналу ROX осуществляют при температуре 56°С путем сравнения с ПЦР-стандартами RV1, RV2, RV3, RV4, содержащих различные количества ДНК-мишени и обеспечивающих проведение количественной ПЦР.
Реализация заявляемого способа представлена в примерах.
Пример 1. Количественное определение концентрации вируса бешенства штамма «Москва 3253» в рабическом антигене органо-тканевого происхождения.
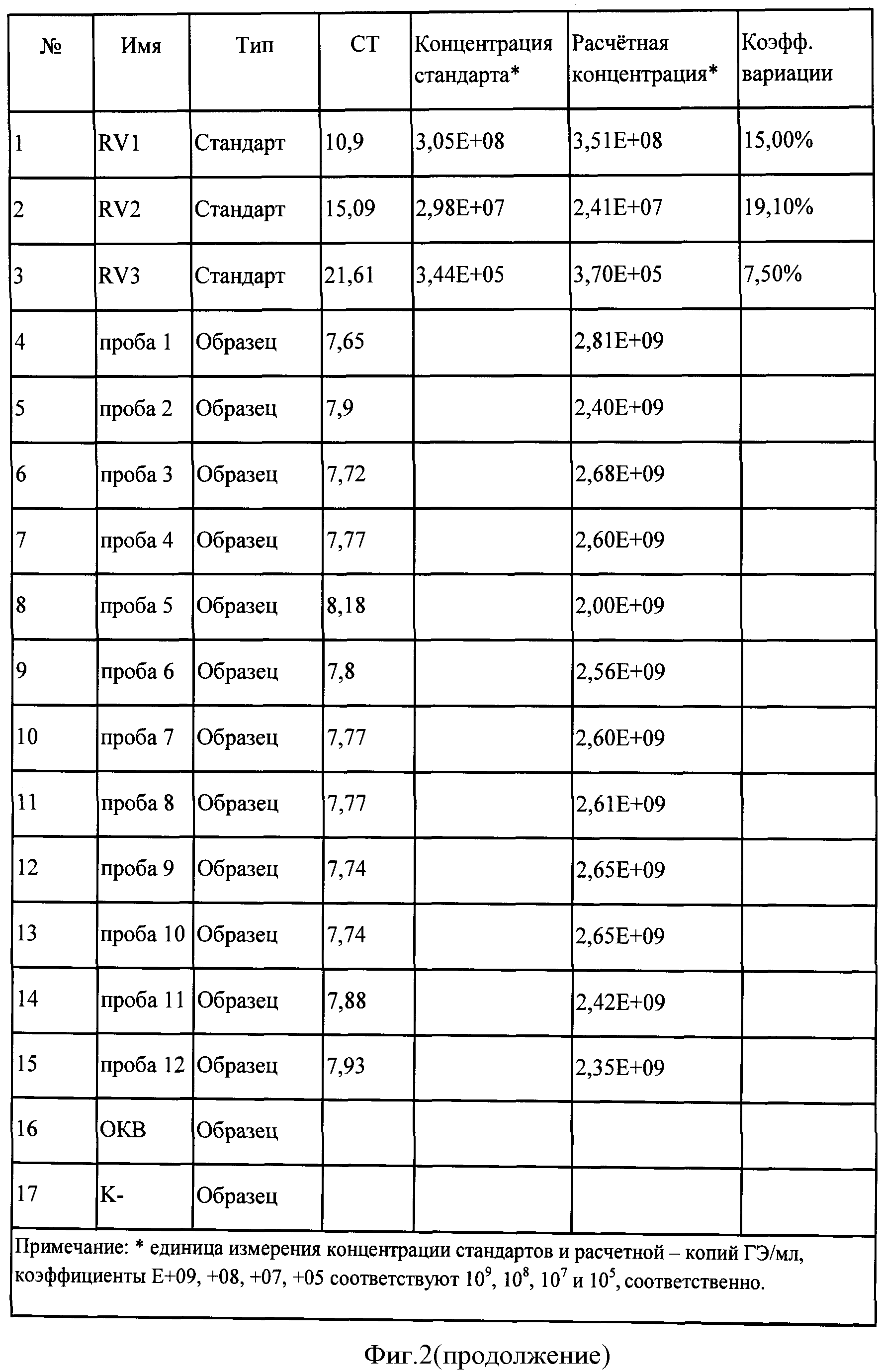
Рабический антиген органо-тканевого происхождения получают из мозговой суспензии кроликов, которым предварительно вводят вирус бешенства штамма «Москва 3253». Для анализа было отобрано 12 проб мозговой суспензии кроликов.
Определение концентрации вируса бешенства выполняли в несколько этапов.
Обеззараженные в соответствии с МУ 1.3.2569-09 пробы рабического антигена органо-тканевого происхождения отбирали по 100 мкл и переносили в 12 микроцентрифужных пробирок объемом 1,5 мл. Дополнительно в отдельную микроцентрифужную пробирку объемом 1,5 мл вносили 100 мкл ТЕ-буфера (ОКБ).
Выделение РНК. Для выделения РНК использовали «комплект реагентов для выделения РНК/ДНК из клинического материала «РИБО-сорб», выпускаемый фирмой (ООО «ИнтерЛабСервис», Россия). Комплект реагентов для выделения РНК состоит из лизирующего раствора, раствора для отмывки 1, раствора для отмывки 3, раствора для отмывки 4, сорбента и РНК-буфера. В 12 микроцентрифужных пробирок со 100 мкл обеззараженного рабического антигена органо-тканевого происхождения и 1 пробирку ОКВ добавляли по 450 мкл предварительно прогретого при температуре (62±2)°С в течение 5-10 мин лизирующего раствора и тщательно перемешивали. Оставляли в штативе на 5-8 мин, 3-4 раза перемешивая. Центрифугировали в течение 5 с при 3000-5000 об/мин. Сорбент тщательно ресуспендировали и добавляли по 30 мкл в каждую пробирку. Перемешивали, оставляли в штативе на 1 мин, еще раз перемешивали и оставляли на 5 мин. Центрифугировали пробирки при 10000 об/мин в течение 45 с. Супернатант удаляли, а к осадку добавляли по 400 мкл раствора для отмывки 1. Перемешивали до полного ресуспендирования сорбента, центрифугировали в течение 45 с при 10000 об/мин. После удаления супернатанта добавляли в пробирки по 500 мкл раствора для отмывки 3. Сорбент тщательно ресуспендировали и пробирки центрифугировали в течение 45 с при 10000 об/мин. После удаления супернатанта операцию повторяли еще раз. Затем в пробирки добавляли по 400 мкл раствора для отмывки 4, тщательно ресуспендировали и центрифугировали в течение 45 с при 10000 об/мин. Надосадочную жидкость удаляли и помещали пробирки в термостат при температуре 60°С на 10 мин, при этом крышки оставляли открытыми.
После сушки в каждую пробирку добавляли по 50 мкл РНК-буфера, перемешивали и помещали в твердотельный термостат при температуре 60°С на 3 мин. Перемешивали и центрифугировали в течение 1 мин при 13000 об/мин. Надосадочная жидкость содержит очищенную РНК вируса.
Проведение реакции обратной транскрипции.
Для постановки реакции обратной транскрипции использовали комплект реагентов для получения кДНК на матрице РНК «Реверта-L» (ООО «ИнтерЛабСервис», Россия). Комплект реагентов для получения кДНК на матрице РНК содержит RT-G-mix-1, RT-mix-0,125 мл, ревертазу (MMLv) и ДНК-буфер.
Перед началом работы из морозильной камеры извлекали пробирки с RT-mix и RT-G-mix-1 (RT-G-mix-2). После размораживания содержимого пробирок при комнатной температуре тщательно перемешивали и центрифугировали в течение 5 с при 3000-5000 об/мин для осаждения капель со стенок. Для приготовления реакционной смеси в пробирку с RT-mix вносили по 5 мкл RT-G-mix-1 (RT-G-mix-2), тщательно перемешивали, центрифугировали в течение 5 с при 3000-5000 об/мин для осаждения капель со стенок. К полученному раствору добавляли 6 мкл ревертазы MMLv, аккуратно перемешивали и центрифугировали в течение 5 с при 3000-5000 об/мин для осаждения капель со стенок. Отбирали 12 микроцентрифужных пробирок объемом 0,6 мл, соответствующие числу исследуемых проб и ОКБ. В каждую пробирку вносили по 10 мкл полученной реакционной смеси, затем в пробирки добавляли по 10 мкл препарата РНК и 10 мкл ТЕ-буфера в ОКВ. Пробирки инкубировали в амплификаторе или твердотельном термостате в течение 30 мин при температуре 37°С. Во все пробирки добавляли по 20 мкл ДНК-буфера и аккуратно 8-10 раз перемешивают. Полученную кДНК использовали для постановки ПЦР с гибридизационно-флуоресцентным учетом результатов.
Постановка ПЦР.
Из морозильной камеры извлекали микропробирки объемом 0,2 мл, содержащих ПЦР-смесь-1, ПЦР-смесь-2, ТЕ-буфер, фермент Taq ДНК-полимеразу с активностью 5 ед/мкл, набор ПЦР-стандартов RV1, RV2, RV3 различных концентраций для определения высоких и низких концентраций вируса. Содержимое пробирок полностью размораживали.
ПЦР-смесь-1 в объеме 5 мкл содержит раствор праймеров RV5, RV6 и зонда RV7 в количестве 8 и 4 пМоль, соответственно, 1 мМоль каждого из четырех дНТФ, 0,025% раствор азида натрия и воду свободную от нуклеаз. ПЦР-смесь-1 переносили по 5 мкл в 17 микроцентрифужных пробирок объемом 0,2 мл. В каждую пробирку на поверхность ПЦР-смеси-1 наслаивали расплавленный 20% раствор парафина в минеральном масле.
ПЦР-смесь-2 в объеме 10 мкл, содержащую 2,5×Taq буфер с сульфатом аммония, 6,25 мМоль магния хлорида, фермент Taq ДНК-полимеразу, воду свободную от нуклеаз.
Полученную ПЦР-смесь-2 перемешивали на микроцентирифуге/встряхивателе и переносили по 10 мкл в 17 микропробирок с ПЦР-смесью-1, не повреждая слой парафина.
В 12 микропробирок вносили по 10 мкл пробы кДНК, в 3 микропробирки вносили по 10 мкл каждого ПЦР-стандарта RV1, RV2, RV3, в 1 микропробирку вносили 10 мкл из ОКВ-пробы, содержащей ТЕ-буфер, исследование которой происходит вместе с анализируемыми образцами, начиная с этапа выделения ДНК. Это позволяет оценить отсутствие контаминации на этапах выделения ДНК и постановки обратной транскрипции. В 1 микропробирку с отрицательным контролем амплификации (К-) вносили 10 мкл ТЕ-буфера. Позволяет оценить отсутствие контаминации на этапе проведения амплификации: контроль чистоты реагентов и отсутствие ошибок оператора.
Подготовленые микропробирки помещали в термоциклер RotorGene 6000 и проводили ПЦР с гибридизационно-флуоресцентным учетом результатов при режиме отжига праймеров при температуре 60°С в течение 10 циклов, затем при 56°С в течение 35 циклов. Учет флуоресценции по каналу ROX осуществляли при температуре 56°С.
ПЦР-анализ выполняется с обеззараженным материалом и занимает 3,5-4,0 ч.
Учет результатов.
Количественную оценку содержания кДНК вируса бешенства в исследуемом материале проводили при наличии отрицательного результата в пробах К- и ОКВ по значению интенсивности флуоресценции сигнала путем сравнения исследуемого образца с ПЦР-стандартами RV1, RV2, RV3, предназначенными для выявления высоких концентраций. Количественную оценку определяли с помощью программного обеспечения термоциклера RotorGene 6000.
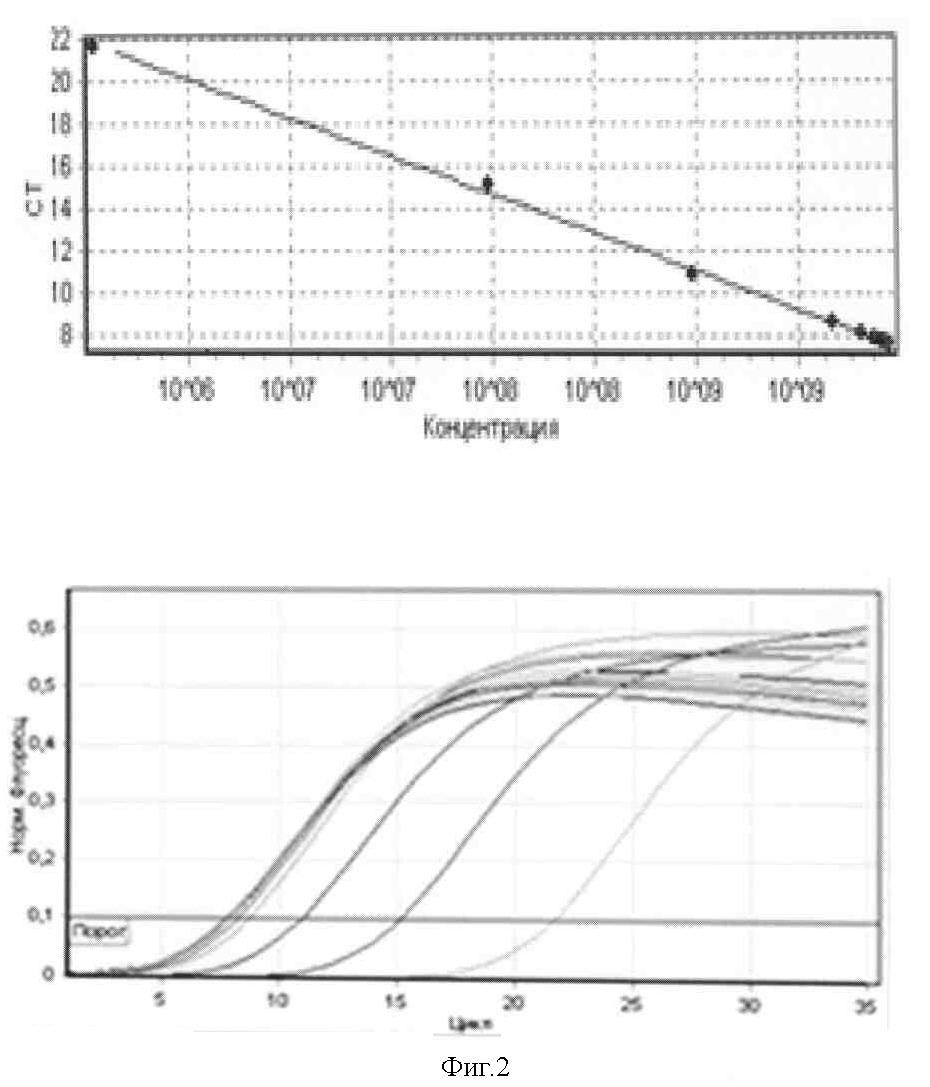
Концентрация фиксированного вируса бешенства штамма «Москва 3253» в 12 исследуемых пробах мозговой суспензии кроликов составила от 2×109 копий/мл до 2,81×109 копий/мл (фигура 2). Значения коэффициента корреляции составили 0,99708, эффективности реакции - 0,89667.
Пример 2. Количественное определение концентрации вируса бешенства штамма «Москва 3253» в рабическом антигене культурального происхождения при стационарном способе выращивания.
Для исследования взяты 12 проб рабического антигена, полученного при стационарном способе выращивания Virus fixe на культуре клеток Vero. Этапы обеззараживания антигена культурального происхождения, выделение РНК, реакцию обратной транскрипции и ПЦР проводили аналогично примера 1, только при проведении ПЦР использовали ПЦР-стандарты RV2, RV3, RV4, предназначенных для выявления низких концентраций.
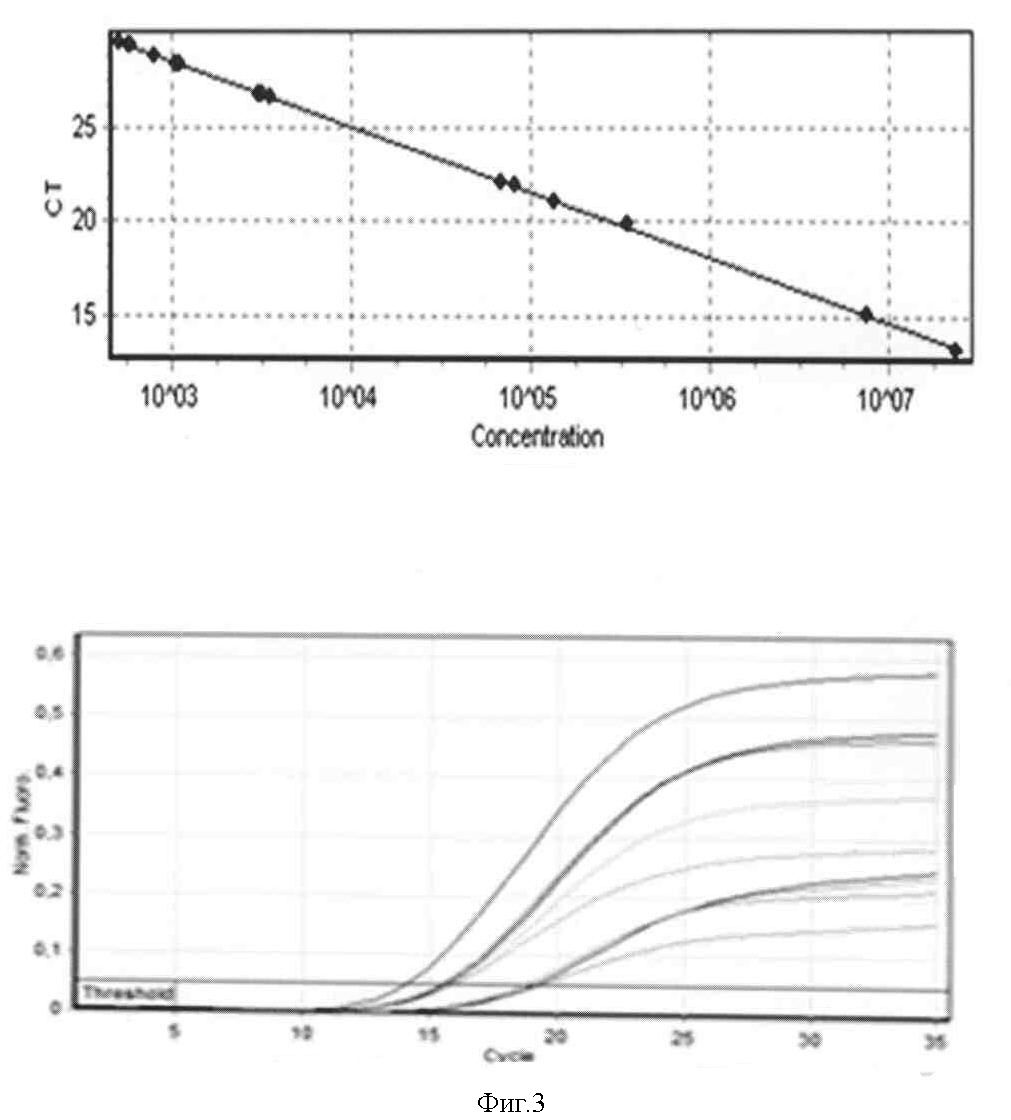
Концентрация фиксированного вируса бешенства штамма «Москва 3253» в исследуемых пробах составила от 4,99×102 копий/мл до 7,59×106 копий/мл (фигура 3). Значения коэффициента корреляции составили 0,99893, эффективности реакции - 0,96566.
Таким образом, заявляемый способ количественного определения фиксированного вируса бешенства штамма «Москва 3253» методом полимеразной цепной реакции с гибридизационно-флуоресцентным учетом результатов в режиме реального времени позволяет определить количественное содержание вируса в рабическом антигене органо-тканевого и культурального происхождения и обеспечивает простоту и безопасность работы. Значительно сокращает время исполнения анализа. Использование данного способа способствует стандартизации этапа приготовления рабического антигена в производстве гетерологичного антирабического иммуноглобулина.
Литература
1. Груздев К.Н., Недосеков В.В. Бешенство животных. М.: 2001. 16-24 с.
2. Екимов А.Н., Шипулин Г.А., Бочкарев Е.Г., Рюмин Д.В. Новейшие технологии в генодиагностике: полимеразная цепная реакция в реальном времени (Real-Time PCR). // Вестник последипломного медицинского образования. - 2001. - N 3. - С.7-10.
3. Онищенко Г.Г. О санитарно-эпидемиологической обстановке в Российской Федерации в 2009 году: Государственный доклад. М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора. 2010. 334-336 с.
4. Троценко Н.И., Белоусова Р.В., Преображенская Э.А. Практикум по ветеринарной вирусологии. М.: 2000. 103-125 с.
5. Black E.M., Lowings J.P., Smith J. et al. A rapid RT-PCR method to differentials six established genotypes of rabies and rabies-related viruses using TaqMan technology // J. Viral. Methods. - 2002. - Vol.105. - P.25-35; Waheley P.R., Johnson N., Me Elhinney et al. Development of a real-time, TaqMan Reverse Transcription PCR assay for detection and differentiation of Lyssavirus genotypes 1,5, and, 6 // J. Clin. Microbiol. 2005. - Vol.43. - P.2786-2792.
6. Bourhy П., Kissi В., Tordo N. Molecular diversity of the Lyssavirus genus // Virology. - 1993. - Vol.194. - P.70-81.
7. Heaton P.R., Johnsbone P., McElhinney L.M. et al. Heminested PCR assay for detection of six genotypes of rabies and rabies-related viruses // J. Clin. Microbiol. - 1997. - Vol.35. - P.2762-2766; Dantasjunior J.V., Kimura L.M.S., Ferreira M.S.R. et al. Reverse transcription polymerase chain reaction assay for rabies virus detection // Arq. Bras. Med. Vet. Zootec. - 2004. - Vol.56. - P.398-400; Bordignon J., Brazil-dos-Anjos G., Bumo C.R. et al. Detection and characterization of rabies virus in Southern Brazil by PCR amplification and sequencing of the nucleoprotein gene // Arch Virol. - 2005. - Vol.150. - P.695-708; Nagaraj Т., Vasanth J.P., Desai A. et al. Ante mortem diagnosis of human rabies using saliva samples: comparison of real-time and conventional RT-PCR techniques // J. Clin. Virol. - 2006. - Vol.36. - P.17-23; Saengseesom W., Mitmoonpitak C., Kasempimolpom S., Sitprija V. Real-time PCR analysis of dog cerebrospinal fluid and saliva samples for ante-mortem diagnosis of rabies // Southeast Asian J. Trop.Med. Public Health. - 2007. - Vol.38. - P.53-57.
8. Kosinova Е. et al. Real-time PCR for quantitation of bovine viral diarrhea virus RNA using SYBR Green I fluorimetry. Veterinarian medicine, 52, 2007; 6: 259-261 p.
9. Radonic A., Thuike S. et al. Reference gene selection for quantitative real-time PCR analysis in virus infected cells: SARS corona virus. Yellow fever virus. Human Herpesvirus-6, Cameplox virus and Cytomegalovirus infections. Virology. 2005; 7: Tab2.
10. Sato G. et al. 2005 Sato G., Tanabe H., Shoji Y. et al. Rapid discrimination of rabies viruses isolated from various host species in Brazil by multiplex reverse transcription-polymerase chain reaction // J. Clin. Virol. - 2005. - Vol.33(4). - P.267-273.
11. Sato G., Itou Т., Shoji Y. et al. Genetic and phylogenetic analysis of glycoprotein of rabies virus isolated from several species in Brazil // J. Vet. Med. Sci. - 2004. - Vol.66. - P.747-753.
12. Tordo N., Kouknetroff A. The rabies virus genome: an overview // J. Vet. Res. - 1993. - Vol.60. - P.263-269.
13. Tordo N., Poch O., Ermine A. et al. Walking along the rabies genome: is the large G-L intergenic region a remnant gene? // Proc Nati Acad Sci USA. - 1986. - Vol.83. - P.3914-3918; Wunner W.H., Larson J.K., Dietzschold В., Smith C.L. The molecular biology of rabies viruses // Rev. Infect. Dis. - 1988. - Vol.10. - P.1149-1158.
14. Wacharapluesadee S. 2008 Wacharapluesadee S., Sutipauya J., Damrougwatanapokin S. et el. Development of a TaqMan real-time RT-PCR assay for the detection of rabies virus // JJ. Virol. Methods. - 2008. - Vol.151(2). - P.317-320.
15. WHO Expert Consultation on Rabies 931, Женева, 2004.
|