Результат интеллектуальной деятельности: СПОСОБ МОДЕЛИРОВАНИЯ РЕНОПАРЕНХИМАТОЗНОЙ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ У КРЫС
Вид РИД
Изобретение
Изобретение относится к медицине, а именно к экспериментальной кардиологии, и может быть использовано для моделирования ренопаренхиматозной артериальной гипертензии (АГ) у крыс.
Артериальная гипертензия является одним из основных нефрологических синдромов, который может возникнуть на любом этапе почечного заболевания [2; 3]. В патогенетическом и фармакотерапевтическом плане АГ, вызванная патологией вещества почки является наименее изученной, когда глубина повреждения паренхимы почки затрудняют выбор лекарственного препарата и зачастую ведет к развитию парадоксальных клинических, биохимических и фармакологических реакций. По современным представлениям связь между заболеваниями почек и АГ можно представить в виде порочного круга, в котором почки являются одновременно и причиной развития АГ, и органом-мишенью ее воздействия [5]. Для изучения патофизиологии артериальной гипертензии в настоящее время используются различные экспериментальные модели повреждения вазомоторных центров головного мозга [7].
Известны способы моделирования артериальной гипертензии с помощью препаратов, влияющих на нервные, эндотелио-зависимые и гуморальные механизмы регуляции кровотока - L-NAME-индуцированная гипертензия [12; 14], альдостерон-индуцированная гипертензия [13; 17], АГ, ассоциированная с алиментарной дислипидемией [11; 18]. Известные методы позволяют добиться выраженного повышения артериального давления (АД), с развитием селективного и зависимого от данной модели повреждения в органах-мишенях - сердце, сосудах, почках [8; 9].
Недостатком известных моделей является то, что длительность гипертензивного синдрома определяется временем введения препаратов. Кроме того, фармакологически-индуцированные варианты экспериментальной артериальной гипертензии позволяют исследовать лишь отдельные патогенетические механизмы регуляции АД.
Известны методы формирования экспериментальных гипертензивных состояний с помощью селективного разрушения нейрональных центров регулирующих гемодинамику [7]. Результатом данных воздействий может стать длительное и выраженное повышение артериального давления.
Недостатком известных методов является то, что их исполнение требует наличия специализированной и дорогостоящей аппаратуры (стереотаксические приборы) и высокого профессионального мастерства экспериментатора. Сложность выполнения стереотаксических манипуляций и особенности механического, термического или иного воздействия на нервные центры не всегда позволяет добиться развития экспериментально патологии, что снижает воспроизводимость результатов.
Известны и широко используются в экспериментальной практике методы исследования артериальной гипертензии у генетически модифицированных животных, предрасположенных к развитию гипертензивного синдрома [15; 16]. Несмотря на наличие стойкого, выраженного и воспроизводимого результата, известные методы требуют наличия селективных линейных животных, весьма дорогих в приобретении и содержании. Кроме того, важным недостатком большинство из вышеописанных методов является отсутствие прямых аналогов в клинике.
Учитывая важную роль почек в поддержании гемодинамического баланса и развитии сдвигов артериального давления, а также, принимая во внимание высокую долю нефрогеныых гипертензивных синдромов в клинической практике, формирование селективных воздействий, приводящих к развитию нефрогенных вариантов АГ в эксперименте является весьма актуальной задачей [9]. Важную роль в регуляции уровня артериального давления почки выполняют, благодаря присущей им прессорной и депрессорной функции. Прессорная функция почек осуществляется ренин-ангиотензин-альдостероновой системой (РААС), а депрессорная - калликреин-кининовой системой и простогландинами. Нарушение нормальных взаимоотношений между этими функциями, ведущее к нарастанию артериального давления, зачастую носит комплексный характер и прогрессирует по мере нарастания выраженности и длительности гипертензивного синдрома [3]. Адекватный баланс прессорных и депрессорных почечных механизмов зависит от таких ренальных показателей, как адекватность почечного кровотока и морфо-функциональную сохранность почечной паренхимы [4]. Поэтому в клинической практике ассоциированный с дисфункцией почек гипертензивный синдром условно подразделяют на реновазогенный и ренопаренхиматозный.
В экспериментальной практике моделирования ренальной артериальной гипертензии наиболее широко используется способ воспроизведения реновазогенного варианта, предложенный Н.Goldblatt еще в прошлом веке (1934, 1939). Накладывая зажимы на одну или обе почечные артерии, и вызывая сужение их просвета, автору удалось получить развитие артериальной гипертензии у подопытных собак. Было установлено, что от степени сужения просвета артерии зависит выраженность гипертензии: при легкой степени сужения отмечалось небольшое либо умеренное повышение артериального давления, при значительном сжатии почечной артерии развивалась высокая стабильная, а иногда и злокачественная гипертензия. Разработанная H. Goldblatt экспериментальная модель почечной артериальной гипертензии, явилась важным фактором, способствовавшим изучению механизма развития не только симптоматических почечных артериальных гипертензии, но и гипертонической болезни. H. Goldblatt считал, что возникновение артериальной гипертензии у наблюдавшихся им подопытных животных, обусловлено уменьшением магистрального почечного кровотока в результате сдавления почечной артерии и развитием ишемии почки, что приводило к увеличению концентрации в крови ренина [1]. Необходимо отметить, что стойкое повышение АД удается получить в эксперименте лишь после сужения обеих почечных артерий или же только одной, но после удаления второй почки. Это связано с высокими компенсаторными возможностями здоровой почечной ткани млекопитающих животных.
Хроническую почечную гипертонию можно воспроизводить и другими способами, близкими к методике, предложенной H. Goldblatt. Сужение абдоминальной аорты выше отхождения почечных артерий ведет к развитию длительной гипертонии.
Недостатком развития экспериментальной реноваскулярной гипертензии является падение артериального давления до нормальных показателей в период развивающейся гипертрофии миокарда. Это связано с распространением коллатеральных сосудов в почку из окружающих тканей и восстановлением нормального кровообращения в почках [4].
Формирование артериальной гипертензии у экспериментальных животных вызвано значительным уменьшением объема почечной ткани [12].
Известен способ моделирования ренопривной гипертензии или (гипертензии Гроллмена) 1949 г. [6], взятый за прототип, сущность которого заключается в следующем: у собак воспроизводится двусторонняя нефрэктомия в условиях поддержания их жизни с помощью перитонеального диализа. Появление этого вида гипертензии связывают с отсутствием или значительным уменьшением почечной ткани и потерей депрессорной функции почек.
Недостаток прототипа в том, что, несмотря на высокую воспроизводимость и развитие патологических событий, сходных с клиническими вариантами ренопаренхиматозной артериальной гипертензии, требует объемной полостной операции и длительного реабилитационного периода у экспериментальных животных и применения адекватной фармакологической поддержки для ликвидации септических, атонических и уродинамических последствий. Данные обстоятельства зачастую затрудняют интерпретацию получаемых данных, особенно при анализе ранних ренальных событий (первые недели), формирующих предпосылки для развития гипертензивного синдрома.
Таким образом, нарушение адекватных взаимодействий между прессорными (ренин-ангйотензин-альдостерон) и депрессорных (простагландины, каллекрии-кинины) ренальных механизмов регуляции АД создает предпосылки к изменению уровня артериального давления и артериальной гипертензии [3; 7]. При этом большинство моделей ориентированы на редукцию почечного кровотока и, таким образом, воссоздают патологическую экспериментальную ситуацию, сходную с клиническим вариантом вазоренальной АГ [10]. При этом многие аспекты ренопаренхиматозного типа АГ в настоящее время не имеют адекватных моделей для своего экспериментального изучения. Кроме того, большинство моделей А Г отличаются сравнительно мягким течением, при которых нарастание АД носит нестойкий характер и зачастую не приводят к морфологическим перестройкам в органах-мишенях [11]. Методологические сложности выполнения эксперимента и отсутствие достаточно близкого аналога в клинике не позволяют рекомендовать их к широкому использованию.
Задачей заявляемого изобретения является устранение недостатков прототипа и разработка способа моделирования ренопаренхиматозной артериальной гипертензии, при которой динамическое повышение АД сопровождается формированием стойких морфо-функциональных изменений в органах-мишенях.
Поставленная задача решается способом моделирования ренопаренхиматозной артериальной гипертензии у крыс, при котором химически повреждается паренхима почек.
У взрослых крыс-самцов массой 250-300 грамм производится химическое повреждение паренхимы почек путем введения 0,1 мл 4% параформальдегида в верхний полюс обеих почек для формирования гипертензивного синдрома. Операция проводится под легким эфирным наркозом. Объем вводимого раствора точно дозируется при использовании шприцов типа «Гамильтон». Игла погружается на глубину 0,7 см, вводя ее по нижнему краю реберной дуги, другой рукой придерживая хорошо пальпируемую и подвижную почку со стороны живота.
В заявляемой модели почечной гипертензии наличие последней подтверждено высокими показателями систолического артериального давления (до 195 мм. рт.ст. к 6 неделе после операции), типичными изменениями стенки аорты (гиперплазией и расслоением ее эластических мембран), активацией прессорной ренин-ангиотензин-альдостероновой системы, а также развитием гипертрофии миокарда, через 6 месяцев от начала эксперимента.
Технический результат изобретения состоит в более коротком сроке (6 недель), необходимом для получения стойкого повышения АД после операции, высокой воспроизводимости результата (по сравнению с прототипом), простоте выполнения оперативной процедуры, ее малой инвазивности, коротком реабилитационном периоде, не требующем дополнительной фармакологической нагрузки на животное; в формировании значимых морфологических и биохимических перестроек в органах-мишенях, аналогичных клиническим вариантам ренопаренхиматозной АГ. Формируемые в результате системные гемодинамические, биохимические и морфо-функциональные изменения позволяют изучить вопросы патогенеза нефрогенной артериальной гипертензии и использовать данную модель для скрининговых и детальных фармакологических исследований.
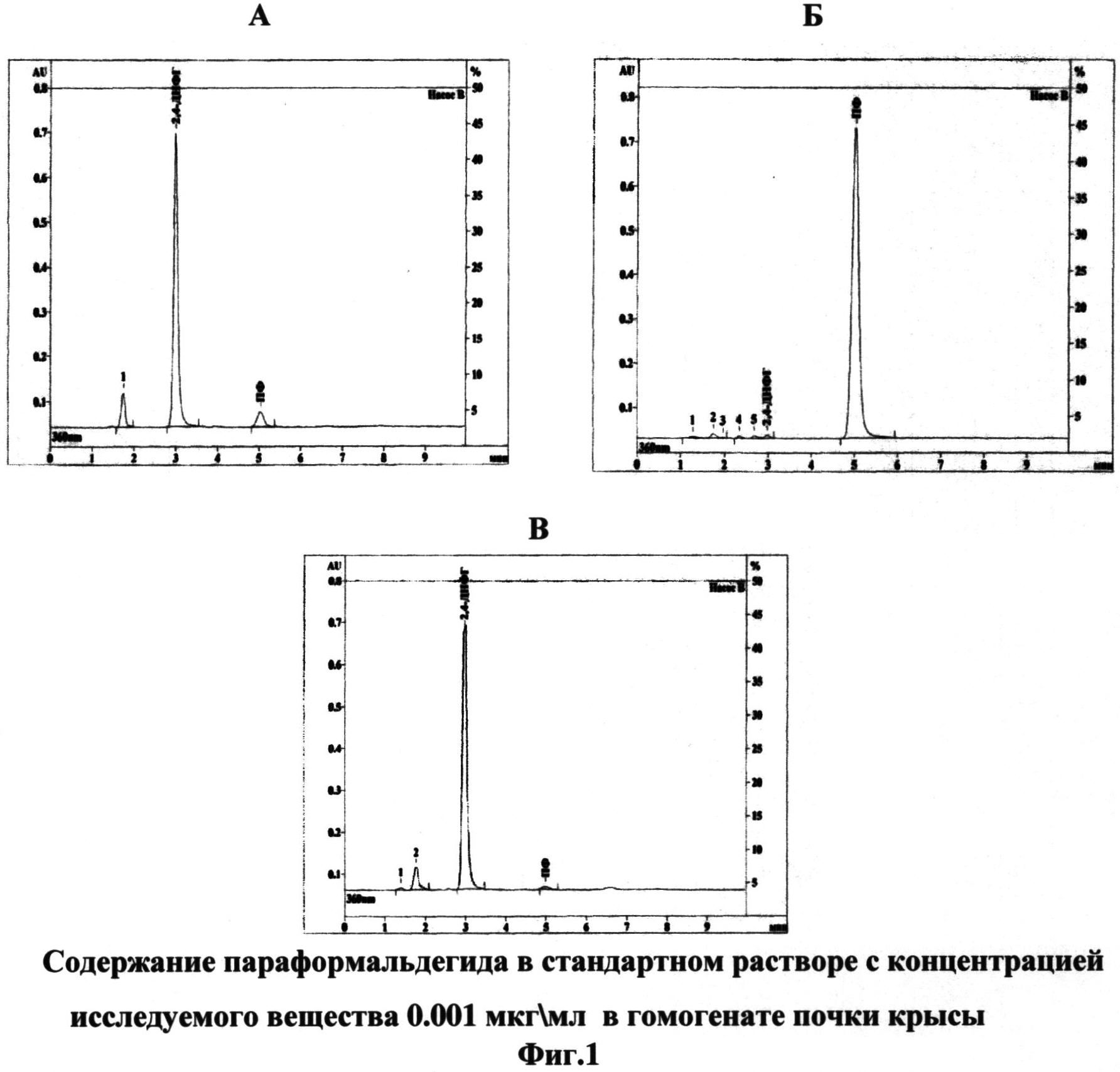
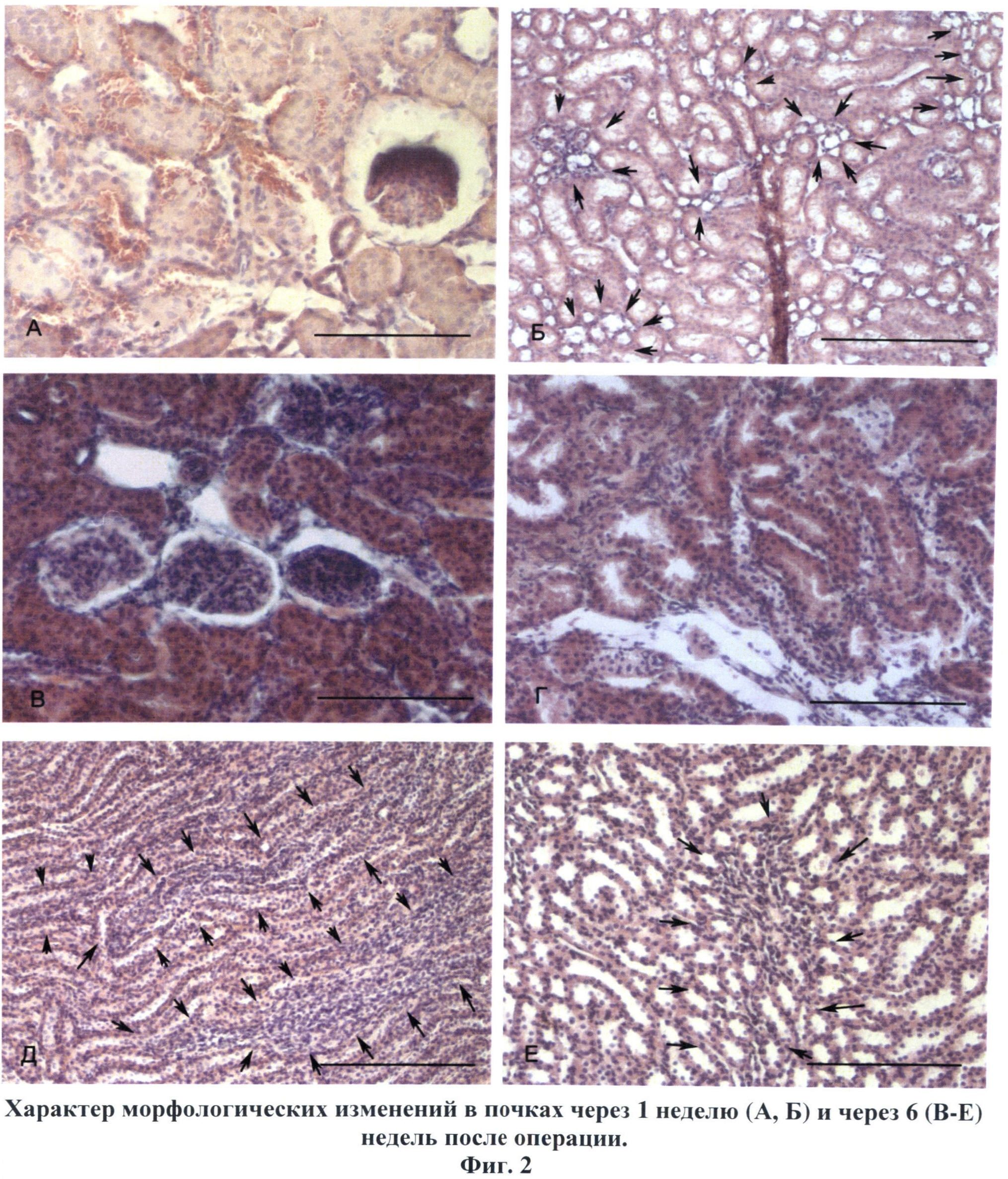
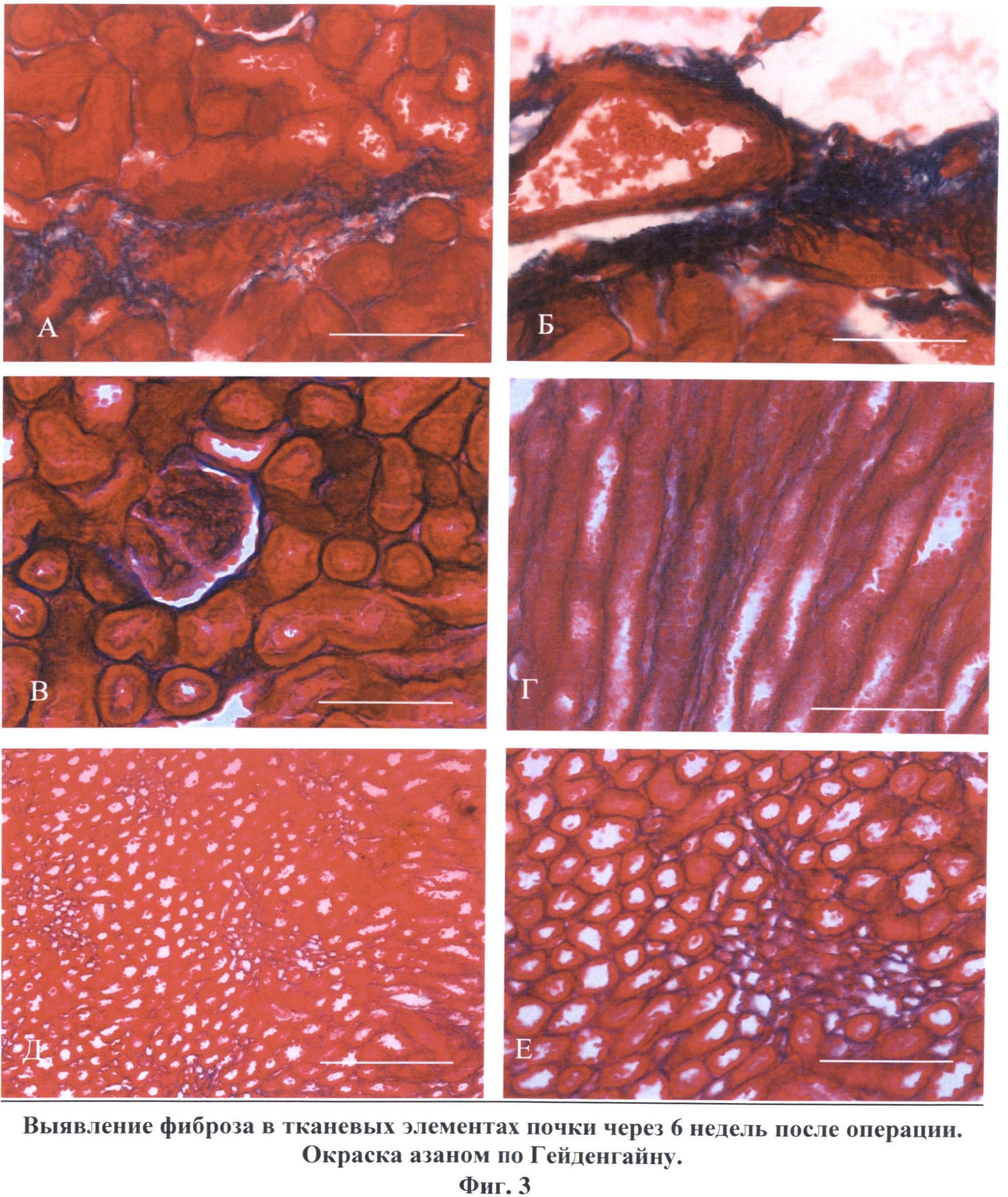
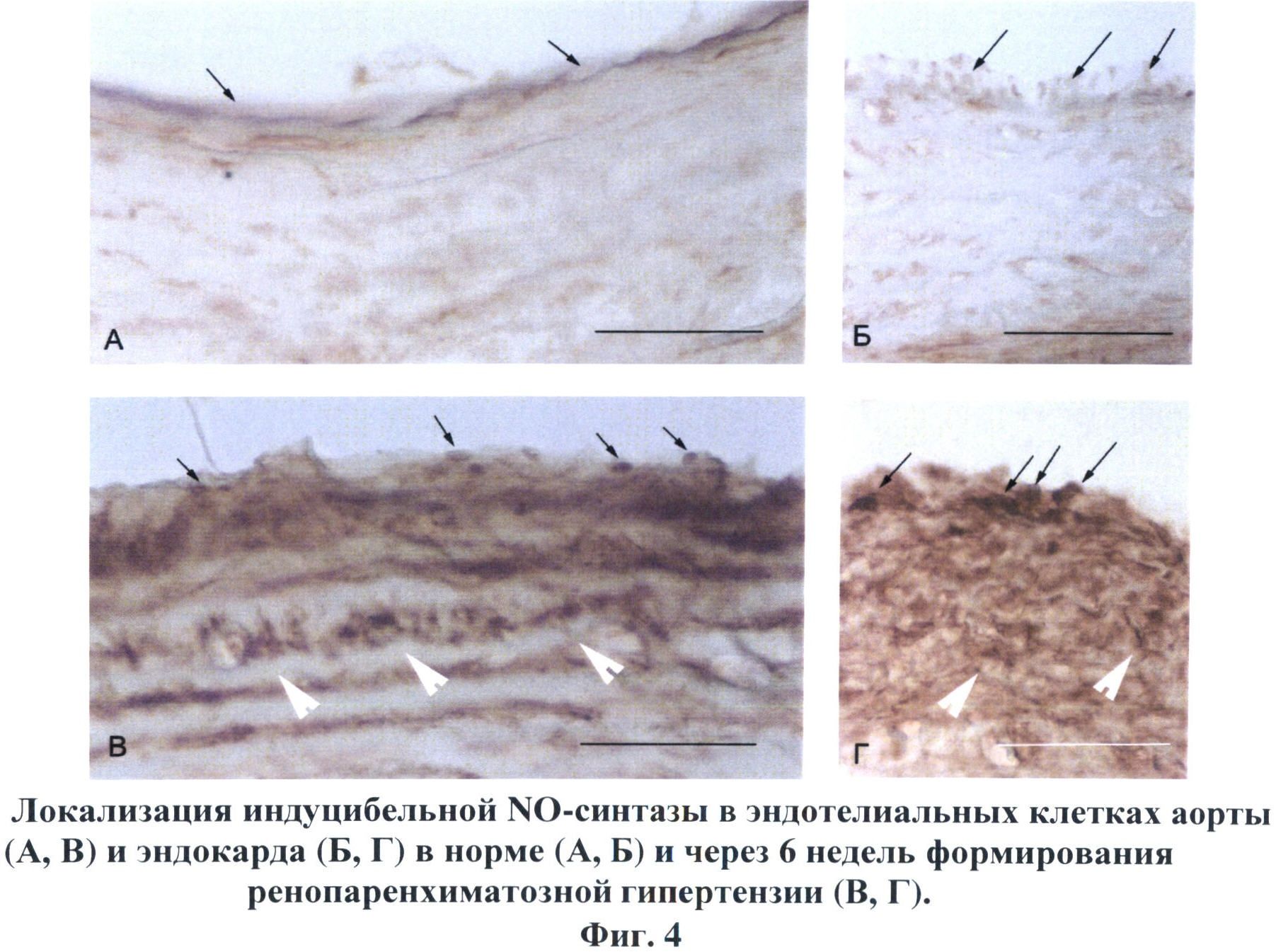
Сущность изобретения поясняется чертежами, где на фиг.1 изображены хроматограммы, иллюстрирующие содержание параформальдегида в стандартном растворе с концентрацией исследуемого вещества 0.001 мкг\мл (А), в гомогенате почки крысы через 5 минут (Б) и через 30 минут (В) после введения препарата; на фиг.2 показано геморрагическое пропитывание (А), некроз (А, Б) и фиброзирование (Б, отмечены стрелками) стромы коркового (Б, Г) и мозгового (Д, Е) вещества). Окраска гематоксилин-эозином. Масштаб: 50 мкм (А, В. Г), 75 мкм (Г) и 100 мкм (Б, Д); на фиг.3. изображены соединительнотканные волокна, окрашенные в темно-синий цвет.Развитие артериальной гипертензии сопровождается фиброзированием стромы коркового вещества (А), адвентициальной и срединной оболочек сосудов (Б), утолщением и разволокнением капсулы клубочков и разрастанием соединительной ткани в мезангии клубочков (В), очаговым фиброзом в мозговом веществе (Г-Е). Окраска азаном по Гейденгайну. Масштаб: 50 мкм (А-Г), 100 мкм (Е) и 200 мкм (Д); на фиг.4. изображена локализация индуцибельной NO-синтазы в эндотелиальных клетках аорты (А, В) и эндокарда (Б, Г) в норме (А, Б) и через 6 недель формирования ренопаренхиматозной гипертензии (В, Г) длинными стрелками показаны эндотелиоциты, короткими - субэндотелиальные соединительнотканные структуры. Иммуногисгохимия iNOS, масштаб 50 мкм.
Заявляемый способ реализован следующим образом.
Для тестирования предлагаемой модели было проведено исследование, выполненное на 90 здоровых половозрелых нелинейных крысах-самцах, массой 250-300 грамм. Животных содержали в виварии в соответствии с «Санитарными правилами по устройству, оборудованию и содержанию экспериментально-биологических клиник» (от 6.04.1993 г.). Кормили в соответствии с нормами, утвержденными приказом МЗ СССР от 10.03.1996 г. №163. Все эксперименты выполнены в соответствии правилами бережного обращения с лабораторными животными в соответствии с Приложением 4 к приказу №755 МЗ СССР.
Все крысы были разделены на 5 групп. В 1 группу вошли животные с моделью АГ и не получавшие лекарственной терапии (группа АГ). Начиная с 28 дня после операции (крысы с моделью АГ), 2-4 группе ежедневно вводились антигипертензивные препараты: крысам 2 группы внутрибрюшинно вводили петлевой диуретик фуросемид (1 мг/кг), животным 3 группы внутримышечно вводили а 2-адреномиметик клонидин (0,01 мг/кг), животным 4 группы внутримышечно вводили спазмолитик дибазол (0,1 мг/кг). Животных 2-4 экспериментальных групп выводили из эксперимента путем декапитирования под эфирным наркозом на 7, 14, 28 и 42 сутки после начала фармакологической коррекции (по 5 крыс в каждой точке), животных группы АГ забивали на 7, 14, 28 и 42 сутки после операции. В качестве контроля использовались 5 ложнооперированных крыс, которым аналогичным способом в почки вводили физиологический раствор (группа 5). Нормой считались интактные животные одного возраста и веса №5. Верификацию места инъекции проводится после эвтаназии животных макро- и микроскопически. Определяется масса тела животного, масса сердца, вычисляется сердечный индекс. Для подтверждения развития патоморфологических и биохимических изменений исследуется кровь, почки, сосуды, сердце. Биологический материал (сердце, аорту и почки) фиксируется в 4% растворе параформальдегида, обрабатывается по общепринятым методикам с последующей заливкой в парафин. Гистологические срезы толщиной 7 мкм окрашиваются гематоксилин-эозином, метиленовым синим и азаном по Гейденгайну. Выявление индуцибельной NO-синтазы в клетках интимы сосудов осуществляется иммуногистохимическим методом с использованием поликлональных кроличьих антител (abeam, №15323, 1:100).
Функциональнальная подвижность церебральных артерий при воздействии фармакологических стимулов оценивается с помощью магнитно-резонансной томографии (МРТ). Изучается эндотелийзависимаявазодилатация (ЭЗВД) на введение ацетилхолина, эндотелий независимаявазодилатация (ЭНЗВД) на введение нитроглицерина, эндотелийзависимаявазоконстрикция (ЭЗВК) на введение N-нитро-L-аргинина метилового эфира (L-NAME), эндотелийнезависимаявазоконстрикция (ЭНЗВК) на введение норадреналина. МРТ головного мозга проводится на томографе «PharmaScan US 70/16» (Bruker, Германия) с напряженностью магнитного поля 7,0 Тесла, частотой 300 MHz и катушкой типа BGA 09Р. За нормальную ЭЗВД принимаются показатели прироста диаметра артерии на 10% и более от исходного, за нормальную ЭНЗВД - прирост более 15%.
Меньшая степень вазомоторного ответа или парадоксальный ответ считается патологической реакцией.
Содержание ренина и альдостерона в плазме определяется радиоиммунным методом (набор реактивов «Radioimmunoassaykit», Cis, Франция) на автоматическом гамма-счетчике «Wizard» (Финляндия). Содержение основных метаболитов NO нитрат-нитрит-ионов определяется спектрофотометрически с помощью реактива Грисса.
Мониторинг артериального давления осуществляется 1 раз в неделю неинвазивным методом в аппарате PanLab-LE501 (Испания). Для определения концентрации формалина в почке используется метод обращенно-фазовой высокоэффективной жидкостной хроматографии на приборе Милихром А/02. Обработка результатов проводится с помощью программы Мультихром-спектр для Windows. Для фотографирования препаратов используется видео-компьютерная система, смонтированная на микроскопе Jenaval (Karl-Zeiss, Германия) и оснащенная программой обработки данных Axio Vision Rel.4.8 Software. Цифровая обработка изображения проводится также с помощью программ Adobe Photoshop 7.0 и Image.).
Статистическая обработка проводится с использованием пакета прикладных программ Statistica 6.0 (StatSoftInc.CIIIA). Все результаты представляются как М±m, достоверность различий между величинами оценивается по t критерию Стьюдента (p≤0.05 и p≤0.001).
Динамика биохимических сдвигов, индуцированных введением параформалъдегида.
Для исключения мнения о том, что в развитии морфологических и биохимических изменений в исследуемых органах ведущим фактором является системные токсические эффекты вводимого параформалъдегида, мы анализировали содержания данного вещества в паренхиме почек через 5, 30 минут и через 1 сутки после инъекции. На фиг.1 приведены хроматограммы, иллюстрирующие содержание параформальдегида в стандартном растворе с концентрацией исследуемого вещества 0.001 мкг\мл (А), в гомогенате почки крысы через 5 минут (Б) и через 30 минут (В) после введения препарата.
Резкое возрастание содержания параформальдегида отмечается через 5 минут после его введения в ткань почки. Спустя 30 минут после инъекции связывание вещества с белками тканей приводит к резкому снижению его содержания в исследуемых тканях до уровня, сопоставимого с концентрацией эндогенного параформальдегида. Данное состояние регистрируется в ткани почки и через 24 часа.
Таким образом, использование внутрипочечной инъекции параформальдегида для моделирования артериальной гипертензии сопровождается исключительно локальным повреждением паренхимы почек, не вызывая системного токсического эффекта.
Динамика морфологических изменений в паренхиме почек.
Через сутки после инъекции формалина в почке нарушается микроциркуляция. Капилляры расширены и переполнены эритроцитами. В течение 1-2 недели после травмы область повреждения в почках имела более темную окраску и четкие границы с интактной зоной. В этот период зона повреждения характеризовалась наличием обширных очагов кровоизлияния, многочисленных воспалительных инфильтратов и участков некроза всех слоев почечной паренхимы. В областях, прилегающих зонам некроза, заметна пролиферация соединительной ткани. Ее созревание на 3-4 неделе эксперимента приводит к образованию Рубцовых изменений в корковом и мозговом веществе, перемежающихся с мелкими островками относительно сохранной почечной паренхимы. На фиг.2 изображено геморрагическое пропитывание А, некроз А, Б и фиброзирование Б, отмечены стрелками стромы коркового Б, Г и мозгового Д, Е вещества. В поздних сроках (на 6 неделе наблюдения) поврежденный участок выглядел сморщенным и уменьшенным в размерах в сравнении с интактной зоной. Микроскопически в этот период доминирующими признаками патологии были обширные очаги фиброза, который отчетливо выявляется на препаратах, окрашенных по Гейдегайну, и характеризуется разрастанием соединительной ткани в мезангии клубочков, капсуле почечных телец, средней оболочке артерий и интерстициальной ткани коркового и мозгового вещества. На фиг.3 показаны соединительнотканные волокна, окрашенные в темно-синий цвет. Развитие артериальной гипертензии сопровождается фиброзированием стромы коркового вещества А, адвентициальной и срединной оболочек сосудов Б, утолщением и разволокнением капсулы клубочков и разрастанием соединительной ткани в мезангии клубочков В, очаговым фиброзом в мозговом веществе Г-Е. В заднем полюсе почки умеренные склеротические изменения сочетаются с наличием структурно сохранных участков коркового и мозгового вещества.
Динамика показателей артериального давления.
Из последующего наблюдения исключили животных (5%), уровень артериального давления которых оставался на контрольных значениях через 2 недели. Морфологический анализ их почек не демонстрировал видимых изменений, что может быть объяснено погрешностями в выполнении процедуры введения параформальдегида.
У большинства экспериментальных животных (95%) формирование гипертензивного синдрома происходило постепенно в течение 2 месяцев наблюдения. Систолическое артериальное давление у крыс контрольной группы до операции составило 120±3,7 мм. рт.ст., через 2 недели после операции повысилось до 167±2,7 мм. рт.ст., а через 6 недель достигало 195±5,2 мм. рт.ст. и сохранялось на этом уровне до конца эксперимента. Диастолическое давление до операции составляло 79±3,3 мм. рт.ст., при развитии экспериментальной гипертензии наблюдалось его повышение - через 2 недели 95±4,8 мм. рт.ст., через 4 недели до 101±4,6 мм. рт.ст., через 6 недель до 118±4,24 мм. рт.ст.
Динамика морфологических и морфо-химических изменений в сердце и сосудах.
Развитее артериальной гипертензии сопровождается гипертрофией сердца, о чем свидетельствует достоверное увеличение массы сердца на 11% уже на 3 неделе эксперимента. Измерение абсолютной массы сердца крыс, подвергнутых операции, показало увеличение ее у всех животных пропорционально продолжительности опыта. Наибольшую абсолютную массу сердце имело в конце эксперимента. Сердечный индекс (СИ) - количество (мг) массы сердца, приходящееся на 1 грамм массы тела. Колебания СИ как более точного показателя развития гипертрофии миокарда сердца, также демонстрировали стойкую тенденцию к нарастанию пропорционально увеличению массы сердца и увеличен и ю диаметра кардиомиоцитов.
В табл.1 отражена динамика морфо-химических изменений, сопутствующих развитию экспериментальной артериальной гипертензии. У нормотензивных крыс диаметр кардиомиоцитов составляет 16.4±1.4. В гипертрофированном миокарде экспериментальных животных к концу 6-ой недели диаметр клеток левого желудочка увеличился на 71% и составил 23.4±1.3 (p≤0.001).
Развитие артериальной гипертензии вызывает значительные изменения в сосудах эластического (аорта) и мышечного типа (сосуды головного мозга). Развитие гипертензивного синдрома сопровождалось утолщением стенки грудной аорты. Волокна внутренней эластической мембраны имели признаки гиперплазии, они были утолщены и расщеплены, что является характерным для синдрома АГ [9].
|
На фоне нарастающего артериального давления в сосудах головного мозга также наблюдались признаки морфологической перестройки - изменялись толщина средней оболочки, периметр внутренней поверхности и также соотношение этих параметров, характеризующее морфологический тип ремоделирования сосуда. В средней мозговой артерии заметное утолщение медии начало регистрироваться к 4 неделе эксперимента и сопровождалось снижением коэффициента толщина\диаметр. В базиллярной артерии уменьшение данного коэффициента происходило за счет увеличения просвета сосуда; при этом в течение всего периода наблюдения, заметного изменения толщины стенки артерии не зафиксировано. В 6 неделе эксперимента эндотелиоциты и фибробласты аорты, эндокарда и мозговых сосудов экспрессируют высокий уровень активности индуцибельной NOS. На фиг.4 показана локализация индуцибельной NO-синтазы в эндотелиальных клетках аорты (А, В) и эндокарда (Б, Г) в норме (А, Б) и через 6 недель формирования ренопаренхиматозной гипертензии (В, Г) длинными стрелками указаны эндотелиоциты, короткими - субэндотелиальные соединительнотканные структуры.
Изменение биохимической активности вазопрессорных систем.
Экспрессия индуцибельного типа NO-синтазы в сосудах мышечного и эластического типа и прогрессирующее нарастание артериального давления сопровождается нарастанием содержания основных метаболитов N0 в сыворотке крови - к 6 неделе эксперимента их концентрация в крови возрастала примерно в 2 раза в сравнении с контрольной группой. Результаты исследования содержания вазопрессорных гормонов в плазме крови свидетельствуют об активации ренин-ангиотензин-альдостероновой системы, проходящей параллельно с нарастанием АД. В конце первой недели у крыс исследуемой группы отмечена высокая гиперренинемия (8.73±1.02 нг/мл/ч) по сравнению с крысами контрольной группы (2.14±0.04 нг/мл/ч), что в 4 раза превышает показатели контрольных значений. Высокие показатели ренина в крови регистрируются до конца наблюдения. Одновременно у всех животных происходило нарастание содержания альдостерона в периферической крови до 296.03±23.91 пг/мл, в 3 раза превышая его содержание в крови контрольных животных (103.5±9.40 пг/мл).
Изменение параметров функциональной активности сосудов головного мозга.
Сосуды головного мозга при введении экспериментальных веществ демонстрировали патологический характер вазомоторного ответа - недостаточную вазодилатацию в ответ на введение ацетилхолина, патологическую вазоконстрикцию на введение норадреналина, недостаточную вазодилатацию на введение норадреналина и L-NAME. В табл.2 представлены параметры вазомоторной активности церебральных артерий у крыс АГ.
|
Заявляемый способ обладает рядом преимуществ перед прототипом, а именно, повышение артериального давления сопровождается рядом функциональных, биохимических и морфологических изменений в органах сердечно-сосудистой системы, свойственных ренопаренхиматозному типу гипертонической болезни у человека [4]. При данном типе патологии нарастание АД протекает на фоне повышенного содержания метаболитов NO в плазме крови источником которого, по-видимому, является индуцибельная NO-синтаза. Экспрессия этого фермента определяет парадоксальный тип реагирования сосудов мышечного типа на введение вазоактивных препаратов и, по-видимому, участвует в их патологическом ремоделировании.
Сопоставительный анализ заявляемого решения с прототипом показывает, что заявляемый способ прост в выполнении - повреждение паренхимы почек не требует тяжелой полостной операции, так как это предусматривается при удалении почки или перевязке аорты и почечных артерий. Кроме того, постепенное нарастание АД в эксперименте сопровождается ремоделированем органов - мишеней и характерными для ренопаренхиматозного типа АГ биохимическими изменениями прессорной системы -изменениями стенки аорты (гиперплазией и расслоением ее эластических мембран), активацией ренин-ангиотензин-альдостероновой системы, развитием гипертрофии миокарда. Структурные изменения сосудов мышечного типа (средняя мозговая артерия) происходит при данном варианте экспериментального гипертензивного синдрома по гипертрофическому типу ремоделирования мышечной оболочки [10].
Таким образом, заявляемая модель ренопаренхиматозной АГ, характеризующейся стойкой гипертензией, но с минимальной смертностью подопытных животных, а также используется наиболее доступный биологический вид - крысы, что является важным и соответствует поставленной цели. Модель нефрогенной артериальной гипертензии у крыс приводит к формированию комплекса функциональных, морфологических и биохимических изменений в органах сердечно-сосудистой системы, свойственных некоторым вариантам гипертонической болезни у человека. Результаты исследования свидетельствуют о несомненной экономической привлекательности использования данной модели. В первую очередь, модель ренопаренхиматозной АГ может позиционироваться в области хронических экспериментов для оценки степени нарушения функционального состояния системы кровообращения, и поиска эффективных фармакотерапевтических средств коррекции АГ, так как животные сохраняются в течение 5-и месяцев.
Заявляемый способ делает возможным проведение экспериментов, результаты которых совершенно необходимы для решения практических клинических задач.
Проведенные исследования позволили получить новую экспериментальную модель АГ, в основе которой лежит комплексное сочетание биохимических и морфо-функциональных изменений в системе регуляции гемодинамики, приводящих к развитию стойкой АГ и сопровождающихся патологическим ремоделированием в органах-мишенях.
Источники информации:
1. Арутюнов Г.П., Соколова А.В, Оганезова Л.Г. Экспериментальные модели поражения тубулоинтерстициальной ткани почек при артериальной гипертензии // Клиническая нефрология. 2011. №2. С.75-78.
2. Задионченко B.C., Адашева Т.В. Дисфункция эндотелия и артериальная гипертония: терапевтические возможности // Рус. мед. жур. 2002. Т.22, №11. С.13-25.
3. Затейщиков Д.А. Эндотелиальная регуляция сосудистого тонуса: методы исследования и клиническое значение // Кардиология. 1998. №9. С.68-81.
4. Кутырина И.М. Современные аспекты патогенеза почечной артериальной гипертонии // Нефрология. 2000. Т.4, №1. С.112-115.
5. Небиеридзе Д.В Клиническое значение дисфункции эндотелия при артериальной гипертонии // Системные гипертензии. 2005. Том 7, №1. С.58-61.
6. Пальцева Е.М. Экспериментальные модели хронических заболеваний почек // Клиническая фармакология. 2009, №2, С.37-42 (прототип).
7. Раевский К.С, Башкатова В.Г., Ванин А.Ф. Роль оксида азота в глутаматергической патологии мозга // Вестник Рос. АМН. 2000. Т.4. С.11-15.
8. Терегулов Ю.Г., Хусаинова Д.К. К методологии проведения пробы и оценки эндотелий-зависимой дилатации плечевой артерии // Эхография. 2004. №5. С.217.
9. Шанар Ж. Гипертония, соль и почки // Нефрология. 2000. Т.4, №2. С.98-100.
10. Шляхто Е.В., Моисеева О.М. Клеточные аспекты ремоделирования сосудов при артериальной гипертензии // Артериальная гипертензия. 2002. Т.8, №2. С.12-16.
11. Kataoka Н., Otsuka F., Ogura Т. et.ol The role of nitric oxide and the renin-angiotensin system in salt-restricted Dahl rats // H Am J Hypertens. 2001. Vol.14, N 3. P.276-85.
12. Maschio G., Oldrizzi L., Marcantoni C. Hypertension and progression of renal disease // J. Nephrol. 2000. Vol.13. P.225-227.
13. Mattel R., Virdis A., Ghiadoni L. Endothelial function in hypertension // J. Nephrol. 1997. Vol.10. N4. P.192-197.
14. Reckelhoff J.F., Zhang H. Testosterone exacerbates hypertension and reduces pressure-natriuresis in male spontaneously hypertensive rats // Hypertension. 1998. Vol.31. P.435-439.
15. Vaziri N., Ni Z., Wang X. Downregulation of nitric oxide synthase in chronic renal insufficiency: role of excess PTH // Am J. Physiol. 1998. (Apr.). Vol.274, N 4 (Pt 2). P.642-649.
16. Wang D., Wei J., Hsu K. Effects of nitric oxide synthase inhibitors on systemic hypotension, cytokinesand inducible nitric oxide synthase expression and lung injury following endotoxin administration in rats // J. Biomed. Sci. 1999. Vol.6, N 1. P.28-35.
17. Патент RU №2359338; кл.G09B 23/28, 2009, бюл. №17.
18. Патент RU №2327228; кл.G09B 23/28, 2008, бюл. №17.
Способ моделирования ренопаренхиматозной артериальной гипертензии у крыс, включающий повреждение паренхимы почек для формирования гипертензивного синдрома, отличающийся тем, что формирование гипертензивного синдрома лабораторным животным (крысам) осуществляют химическим повреждением паренхимы почек путем введения 0,1 мл 4%-ного параформальдегида в верхний полюс обеих почек.