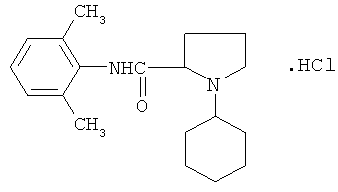
Результат интеллектуальной деятельности: 2,6-ДИМЕТИЛАНИЛИД N-ЦИКЛОГЕКСИЛПИРРОЛИДИН-2-КАРБОНОВОЙ КИСЛОТЫ ГИДРОХЛОРИД, ПРОЯВЛЯЮЩИЙ АКТИВНОСТЬ ПРИ ПОВЕРХНОСТНОЙ, ИНФИЛЬТРАЦИОННОЙ И ПРОВОДНИКОВОЙ АНЕСТЕЗИИ
Вид РИД
Изобретение
Заявляемое соединение относится к области органической химии классу ариламидов азациклоалканкарбоновых кислот, а именно новому биологически активному 2,6-диметиланилиду N-циклогексилпирролидин-2-карбоновой кислоты гидрохлориду (I) формулы:
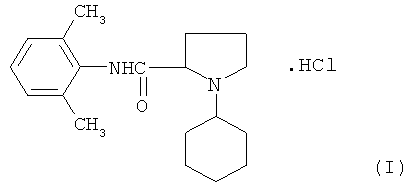
который может найти применение в качестве лекарственного поверхностноанестезирующего средства.
В качестве эталонов местноанестезирующего действия использовались известные и широко применяемые местные анестетики бупивакаин и ропивакаин [Машковский М.Д. Лекарственные средства. - 15-е изд., перераб., испр. и доп. - М.: РИА «Новая волна»: Издатель Умеренков, 2008. - 1206 с.: ил.].
Целью предлагаемого изобретения является получение нового неописанного ранее 2,6-диметиланилида N-циклогексилпирролидин-2-карбоновой кислоты гидрохлорида, обладающего анестезирующим действием. Поставленная цель достигается путем бромирования δ-хлорвалериановой кислоты с последующим переводом ее в хлорангидрид с помощью хлористого тионила. Затем хлорангидрид аминируется 2,6-диметиланилином и циклизуется с помощью циклогексиламина в 2,6-диметиланилид N-циклогексилпирролидин-2-карбоновой кислоты, который с помощью газообразного хлороводорода переводится в гидрохлорид. Схема синтеза:
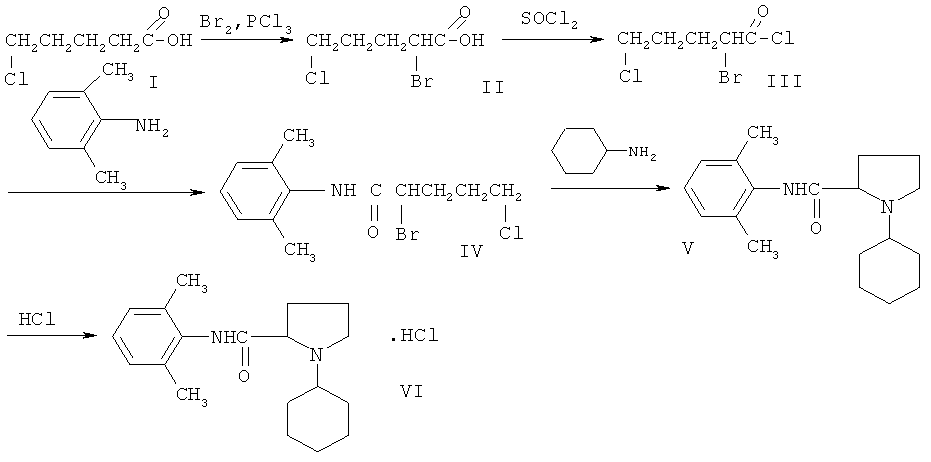
Синтез 2,6-диметиланилида N-циклогексилпирролидин-2-карбоновой кислоты гидрохлорида осуществлен по известной методике с некоторыми изменениями. [Лихошерстов А.М, Прянишникова Н.Т., Лебедева А.С. и др. Азациклоалканы XIX. Синтез и анестезирующая активность некоторых мезидидов пирролидинкарбоновой-2 кислоты. // Хим-фарм. ж., 1976, т.7, с.36-40.]:
α-бром-δ-хлорвалериановая к-та (II). Смесь 52,2 г δ-хлорвалериановой кислоты (I), 76,8 г сухого брома и 4 мл треххлористого фосфора помещали в кругло донную колбу на 250 мл с обратным холодильником и нагревали на водяной бане в течение 20 ч при 80°C, а затем 2 ч при 100°C. Реакционную массу промывали водой в конической колбе (Эрленмейера) на 500 мл, маслянистый слой отделяли с помощью делительной воронки на 500 мл, а водный экстрагировали несколько раз бензолом. Бензольные экстракты соединяли с маслом и раствор сушили сульфатом магния. После отгонки бензола в остатке получали 75,1 г II, выход 90,7%.
Хлорангидрид α-бром-δ-хлорвалериановой кислоты (III). К 103,6 г хлористого тионила в круглодонной колбе на 250 мл с обратным холодильником прибавляли 75,1 г II, смесь кипятили в течение 1,5 ч на водяной бане. Избыток хлористого тионила отгоняли, выход 73,9 г, 90,7%.
2,6-диметиланилид α-бром-δ-хлорвалериановой кислоты (IV). В трехгорлую круглодонную колбу на 250 мл, снабженную капельной воронкой и электромешалкой, помещали раствор 12,94 г 2,6-диметиланилина и 10,8 г триэтиламина в 50 мл хлороформа. Далее прибавляли в течение 45 мин по каплям раствор 25,0 г хлорангидрида α-бром-δ-хлорвалериановой кислоты в 40 мл хлороформа при температуре 0-10°C (температурного режима добивались путем помещения колбы в холодную воду со льдом), с постоянным перемешиванием электромешалкой. Полученный раствор кипятили в круглодонной колбе на 250 мл с обратным холодильником на водяной бане 1 ч. Выпавший осадок отфильтровывали. Фильтрат промывали 3% раствором соляной кислоты, а затем водой до нейтральной реакции среды. После отгонки растворителя получали аморфный порошок 2,6-диметиланилида α-бром-δ-хлорвалериановой кислоты, который перекристаллизовывали из гексана, выход составил 20,4 г, 60%.
2,6-диметиланилид N-циклогексилпирролидин-2-карбоновой кислоты (V). К раствору 7,37 г IV в 100 мл толуола в трехгорлой круглодонной колбе, снабженной капельной воронкой и электромешалкой, прибавляли по каплям раствор 3,44 г циклогексиламина и 4,6 г триэтиламина (с целью экономии циклогексиламина) в 100 мл толуола. Затем в реакционную массу вносили 0,2 г йодистого калия и смесь кипятили на песчаной бане в круглодонной колбе с обратным холодильником 28 часов. Далее выпавший осадок отфильтровывали. Фильтрат встряхивали с насыщенным раствором поташа. Толуольный слой отделяли и упаривали досуха. Выход V составил 3,67 г, 53%.
Гидрохлорид 2,6-диметиланилида N-циклогексилпирролидин-2-карбоновой кислоты (VI). Остаток V растворяли в 200 мл эфира и пропускали сухой хлористый водород. Выпавший осадок гидрохлорида VI отфильтровывали, несколько раз промывали ацетоном, сушили и перекристаллизовывали из этилового спирта, выход 3,70 г, 90%.
Заявляемое соединение представляет собой белое кристаллическое вещество с температурой плавления 278-280°C (с разложением), медленно растворимое в этаноле, воде, растворимое в ДМСО, не растворимое в ацетоне, гексане, диэтиловом эфире. В спектре ЯМР 1H (Mercury - 300 МГц) в ДМСО, внутренний стандарт - TMS) соединения (I) имеются: три мультиплета шести протонов метиленовых групп циклогексильного радикала при гетероатоме азота пирролидинового цикла в области 1,06-1,63 м.д., мультиплет двух протонов метиленовой группы пирролидинового цикла при 1,79-2,01 м.д., мультиплет четырех протонов метиленовых групп циклогексильного радикала при гетероатоме азота пирролидинового цикла при 2,01-2,12 м.д., синглет шести протонов двух метальных групп ароматического кольца при 2,17 м.д., мультиплет двух протонов метиленовой группы пирролидинового цикла при 2,54-2,62 м.д., мультиплет двух протонов метиленовой группы пирролидинового цикла при 3,25-3,40 м.д., мультиплет CH-группы циклогексильного радикала при гетероатоме азота пирролидинового цикла в области 3,55-3,69 м.д., триплет одного протона CH-группы пирролидинового цикла при 4,690-4,780 м.д., мультиплет трех протонов ароматического кольца в области 7,07-7,16 м.д., синглет протона -NH- группы при 9,34 м.д., синглет протона хлороводородной кислоты при 10,65 м.д.
Исследование биологической активности
Исследование активности при поверхностной анестезии проводили по методу Ренье [Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ / Под общей ред. чл.-кор. РАМН, профессора Р.У. Хабриева. - 2 изд., перераб. и доп. - М., 2005. - 832 с.]. Ненаркотизированных кроликов помещали в специальный ящик с отверстием, фиксирующим голову. Определяли порог чувствительности роговицы глаза кролика к тактильному воздействию. С этой целью применяли тонкую металлическую проволоку в виде петли, не травмирующую роговицу. Соединение и эталоны сравнения (бупивакаин и ропивакаин) вводили в конъюнктивальный мешок глаза кролика в виде 0,5% растворов (в 0,9% растворе натрия хлорида). Определяли время начала анестезии. Первое определение поверхностной анестезии проводили на 8 минуте опыта и повторяли на 10, 12, 15, 20 и т.д. до 60 минуты, всего 13 измерений. Активность веществ оценивали по 2 показателям: индексу Ренье (показатель глубины анестезии) и продолжительности анестезии. Каждое вещество исследовали на 6 кроликах (12 глаз). Результаты экспериментов обрабатывали статистически с использованием критерия Стьюдента при p≤0,05.
Активность веществ при проводниковой анестезии определяли в опытах при нанесении 0,5% растворов (в 0,9% растворе натрия хлорида) соединения и эталонов сравнения на седалищные нервы крыс [Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ / Под общей ред. чл.-кор. РАМП, профессора Р.У. Хабриева. - 2 изд., перераб. и доп. - М., 2005. - 832 с.]. Электрическое раздражение нервов производили с помощью электростимулятора ЭСЛ-2 выше места блокады. Определяли порог раздражения, то есть минимальное напряжение электрического тока, вызывающее сокращение мышц. Затем нерв обертывали ватной муфтой и наносили 0,2 мл раствора исследуемого вещества или эталона. Определяли продолжительность анестезии в минутах и глубину анестезии по увеличению порога раздражения, выражая ее в процентах к исходной величине порога (превышение исходного порога раздражения более чем в 2 раза считали за 100% глубину анестезии). Каждое вещество оценивали на 4 крысах (8 опытов). Результаты экспериментов обрабатывали статистически с использованием критерия Стьюдента при p≤0,05.
Изучение активности веществ при инфильтрационной анестезии оценивали в опытах на крысах по методу Bulbring и Waida (Bulbring E., Wajda J. Biological comparison of local anaesthetica. J. Pharmacol. and Exp. Therap., 1945, vol.85, N1, p.7-84). Белым крысам внутрикожно (0,05 мл) и подкожно (0,45 мл) вводили 0,5% растворы (в 0,9% растворе натрия хлорида) исследуемых веществ. Обезболивающее действие их исследовали при дозированном электрическом раздражении кожи животного. Определяли порог раздражения, то есть минимальное напряжение электрического тока, вызывающее сокращение мышц. Определяли продолжительность анестезии в минутах и глубину анестезии по увеличению порога раздражения, выражая ее в процентах к исходной величине порога (превышение исходного порога раздражения более чем в 2 раза считали за 100% глубину анестезии). Каждое вещество оценивали на 4 крысах (8 опытов). Результаты экспериментов обрабатывали статистически с использованием критерия Стьюдента при p≤0,05.
Острую токсичность при подкожном введении (п/к) определяли на белых нелинейных мышах обоего пола массой 19-25 г. Исследуемое вещество и препараты сравнения вводили в виде 0,5% растворов (на основе 0,9% раствора хлорида натрия) в возрастающих дозах. Результаты обрабатывали по Прозоровскому с вычислением средней смертельной дозы (ЛД50) при P≤0,05 [Прозоровский В.В., Прозоровская М.П., Демченко В.М. Фармакол. токсикол., т.41, №4, с.497-502, 1978].
Результаты исследования поверхностноанестезирующей активности и острой токсичности соединения I, бупивакаина и ропивакаина представлены в таблице 1.
|
Результаты исследования активности при инфильтрационной и проводниковой анестезии соединения I, бупивакаина и ропивакаина представлены в таблице 2.
|
Как видно из таблицы 1, заявляемое соединение формулы (I) в 1,3 раза превосходит бупивакаин и в 2,0 раза ропивакаин по глубине поверхностноанестезирующего действия. Вещество формулы (I) в 1,6 раза в сравнении с бупивакаином и в 2,5 раза в сравнении с ропивакаином проявляет более длительную поверхностноанестезирующую активность. Кроме того, соединение формулы (I) проявляет токсичность, равную токсичности ропивакаина и является менее токсичным, чем бупивакаин в 1,6 раза.
Как видно из таблицы 2, заявляемое соединение формулы (I) в 1,6 раза в сравнении с ропивакаином проявляет более длительную инфильтрационноанестезирующую активность, не уступая по этому же показателю бупивакаину. Вещество формулы (I) в 1,4 раза превосходит бупивакаин и в 1,6 раза ропивакаин по продолжительности проводниковоанестезирующего эффекта.
Таким образом, 2,6-диметиланилид N-циклогексилпирролидин-2-карбоновой кислоты гидрохлорид проявляет более выраженное и более длительное поверхностноанестезирующее действие при равной или меньшей токсичности, чем бупивакаин и ропивакаин. Вещество формулы (I) значительно превосходит по продолжительности активность ропивакаина и бупивакаина при проводниковой анестезии, превосходя, кроме того, длительность эффекта ропивакаина при инфильтрационной анестезии. Следовательно, заявляемое соединение (I) может найти применение в медицине в качестве местноанестезирующего лекарственного средства для поверхностной, инфильтрационной и проводниковой анестезии.
2,6-Диметиланилид N-циклогексилпирролидин-2-карбоновой кислоты гидрохлорид, проявляющий активность при поверхностной, инфильтрационной и проводниковой анестезии.