Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ 1,3-ДИМЕТИЛАДАМАНТАНА
Вид РИД
Изобретение
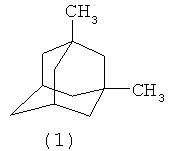
Изобретение относится к области органической химии, в частности, к способу получения 1,3-диметиладамантана (1).
1,3-Диметиладамантан (1) является важнейшим соединением адамантанового ряда. Он находит применение в синтезе ряда производных адамантана. Так, 1,3-диметиладамантан (1) является исходным соединением для синтеза 1-амино-3,5-диметиладамантана - действующего вещества известного лекарственного препарата «мемантина». (Е.И. Багрий. Адамантаны. М.: Наука, 256 с. (1989). [1]; S. Hala, M. Kuras, P. Zachar. Sb. VSCHT Praze D.S. V.33, p.305-321, (1976), РЖХим., 13П337 (1977) [2]; R.C. Fort. Adamantane: The chemistry of diamond molecules. N.Y.; Dekker. 385 p. (1976) [3]; M.A. McKervey. Tetrahedron. V.36, p.971-992 (1980) [4]; C.A. Cupas, P.R. Schleyer, D.J. Trecker. J. Am. Chem. Soc. V.87, p.917-918 (1965) [5]).
Большинство методов получения 1,3-диметиладамантана (1) основано на изомеризации циклических углеводородов состава С12Н20 под действием кислотных катализаторов.
Так, в известном методе к смеси 0.15 моля пергидроаценафтена (2) и 0.12 моля измельченного AlBr3 при перемешивании прибавляли 2 мл трет-бутилбромида и нагревали 6 ч при 60°C. После охлаждения верхний слой слили со смолы, смолу экстрагировали гексаном. Гексановый раствор промыли водой и высушили. После упаривания растворителя перегонкой в вакууме получено 63-70% 1,3-диметиладамантана (1). (Л.И. Захаркин, Г.Г. Жигарева, А.П. Прянишникова, С.Т. Овсеенко. Изв. АН, сер. хим. №10, с.2256-2259 (1986) [6]; Г.А. Толстиков, В.П. Юрьев, И.М. Салимгареева, А.В. Кучин. Изв. АН, сер. хим. №7, с.1631-1632 (1974) [7]; M.J.T. Robinson, H.J.F. Tarratt. Tetr. Lett. №1, p.5-7 (1968) [8]).
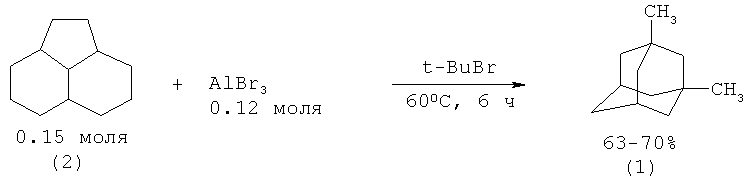
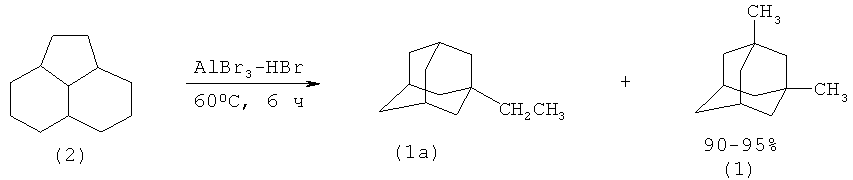
Аналогичная методика была использована при изомеризации (2) в (1) присутствии комплекса AlBr3-HBr, полученного при 50°С. Реакцию проводили при 0-25°С под давлением водорода в 40 атм в течение 40 мин. Была получена смесь алкиладамантанов (1, 1а) с выходом 90-95%. (A. Schneider, R.W. Warren, E.I. Janoski. J. Am. Chem. Soc. V.86, p.5365 (1964) [9]; A., Warren R.W., Janoski E.I. J. Org. Chem. V.31, p.1617 (1966) [10]).
Указанные методы имеют следующие недостатки:
1. В качестве катализатора используется большое количество галогенидов алюминия, что ведет к осмолению реакционной массы, реакциям фрагментации и образованию побочных продуктов.
2. Из-за присутствия в системе газообразных галогеноводородов и высокого давления водорода (40 атм) реакцию проводят в специальных аппаратах высокого давления.
3. Используется труднодоступный трет-бутилбромид.
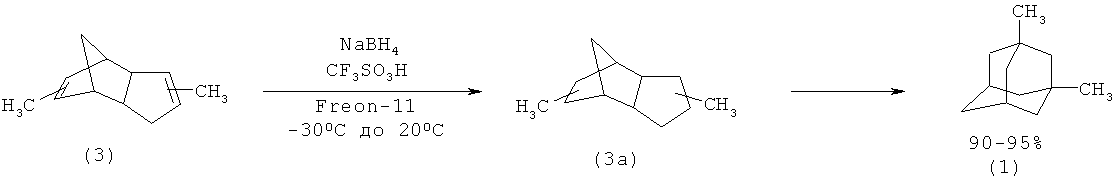
В работе [11] в качестве исходного воединения для получения (1) использован гидрированный димер метилциклопентадиена (3а). К хорошо перемешиваемой гетерогенной смеси димера метилциклопентадиена (3) (7.6 ммоль) и NaBH4 (22.8 ммоль) (под аргоном или азотом) в сухом фреоне-113 (40 мл) при -30°С в токе сухого Ar или N2 добавляют в течение 30 мин 12 мл CF3SO3H (137 ммоль). Во время добавления кислоты из-за экзотермичности реакции смесь охлаждают до -78°С, затем выдерживают при комнатной температуре в течение 3-5 часов. Выход 1,3-диметиладамантана (1) по данному методу достигает 90%. (G.A. Olah, A. Wu, O. Farooq, G.K.S. Prakash. J. Org. Chem. V.54, №6, p.1450-1451 (1989) [11]).
Недостатки метода:
1. Труднодоступность и дороговизна реагентов (NaBH4, CF3SO3H, димера метилциклопентадиена (3)).
2. Сильная коррозия оборудования под действием суперкислот.
3. Необходимость проведения реакции в атмосфере сухого аргона или азота из-за использования пожаро- и взрывоопасного боргидрида натрия.
4. Необходимость охлаждения смеси до -78°С из-за экзотермичности реакции.
С высоким выходом (86%) 1,3-диметиладамантан (1) получен изомеризацией пергидроаценафтена (2) над хлорированным алюминий-платиновым катализатором Al2(PtCl6)3, взятым в 7-кратном избытке. (D.E. Johnston, М.А. McKervey, J.J. Rooney. J. Am. Chem. Soc. V.93, p.2798-2799 (1971) [12]).
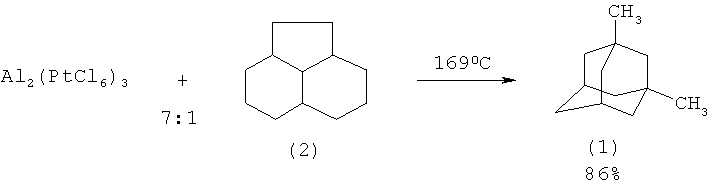
На основании сходства по трем признакам (каталитическая изомеризация, использование в качестве исходного соединения пергидроаценафтена (2), образование в результате реакции 1,3-диметиладамантана (1)) за прототип взят метод изомеризации пергидроаценафтена (2) в присутствии катализатора Al2(PtCl6)3 [12].
Недостатки прототипа:
1. Большой избыток дорогостоящего реагента - комплекса платины.
Задачей настоящего изобретения является упрощение технологии получения 1,3-диметиладамантана (1) и удешевление процесса в целом за счет использования доступных и недорогих реагентов.
Это достигается проведением скелетной изомеризации циклического углеводорода пергидроаценафтена (2) в растворе гексана в присутствии катализатора цеолита Y в HNa-форме со степенью ионного обмена Na+ на H+ 97%, подвергнутого термообработке при 450°С в течение 3-5 ч в атмосфере воздуха, при массовом соотношении [пергидроаценафтен]:[HNaY]:[гексан]=100:50÷100:50÷100 при температуре 300-320°C в течение 3-15 часов.
В оптимальных условиях единственным продуктом реакции является 1,3-диметиладамантан (1), а конверсия пергидроаценафтена (2) составляет 100%.
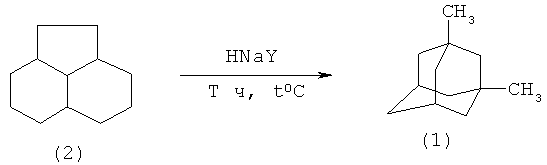
Таким образом, в предложенном методе для получения 1,3-диметиладамантана (1) из пергидроаценафтена (2) используется дешевый и доступный гетерогенный катализатор цеолит Y в HNa-форме со степенью ионного обмена 97%, предварительно подвергнутый термообработке при 450°С в атмосфере воздуха.
Новый метод имеет следующие преимущества.
1. Доступность катализатора (цеолит Y в HNa-форме выпускается АО «Салаватнефтеоргсинтез»).
2. Отсутствие коррозии и простота аппаратурного и технологического оформления.
3. Высокая селективность реакции по 1,3-диметиладамантану (1).
Известно использование цеолита HY для получения (1) путем изомеризации тетрацикло(6.2.1.1.0)додекана (4). Для увеличения селективности реакцию проводят в присутствии газообразного HCl в атмосфере водорода (давление 30 кг/см2). Изомеризация (4) проходит при 250°С в течение 4 ч и приводит к образованию смеси 1,3-диметил- (1) и 1-этиладамантанов (1а) с выходом 55% и 13% соответственно. (К. Honna, N. Shimizu, K.O. Kurisaki. US Patent 4022845 (1977) [13]).
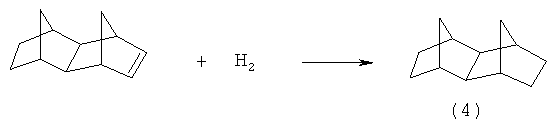
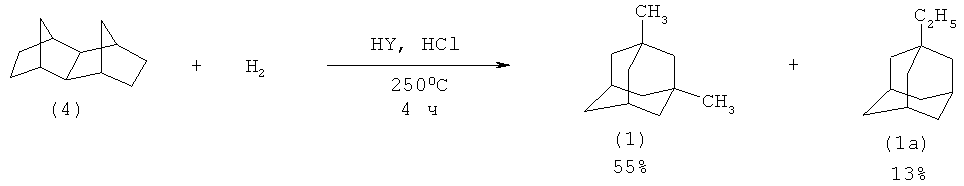
Недостатки метода:
1. Реакция протекает под давлением водорода (30 кг/см2), что усложняет технологическое оформление процесса.
2. Необходимость использования агрессивного вспомогательного реагента - газообразного хлороводорода.
3. Умеренный выход целевого продукта.
Применение цеолита HNaY для изомеризации пергидроаценафтена неизвестно.
Общая методика изомеризации (2aR,5aα,8aR,8bα)-декагидроаценафтена (2) в 1,3-диметиладамантан (1).
В стеклянную ампулу помещали предварительно подвергнутый термообработке при 450°С цеолит Y в HNa-форме со степенью ионного обмена 97% в количестве 50-100 мас.%, пергидроаценафтен (2), гексан в качестве растворителя, ампулу запаивали, помещали в микроавтоклав, герметично закрывали и нагревали в течение 3-15 часов при 300-320°С. После окончания реакции микроавтоклав (ампулу) охлаждали до комнатной температуры, вскрывали, после отфильтровывания катализатора растворитель отгоняли, остаток очищали на колонке с силикагелем (гексан). Выход 1,3-диметиладамантана (1) составил 30-65%.
ПРИМЕР 1. В стеклянную ампулу (V=20 мл) помещали 1 г (2aR,5аα,8aR,8bα)-декагидроаценафтена (2), 1 г цеолита Y в HNa-форме со степенью ионного обмена 97%, 1 мл гексана, ампулу запаивали, помещали в микроавтоклав, герметично закрывали и нагревали при 300°С в течение 10 часов. После окончания реакции микроавтоклав (ампулу) охлаждали до комнатной температуры, вскрывали, после фильтрования катализатора, удаления растворителя и очистке остатка на колонке с силикагелем (гексан) был выделен 1,3-диметиладамантана (1) с выходом 65%.
Ик спектр (ν, см-1): 2890 (СН3), 1449 (СН2). Спектр ЯМР 13С (CDCl3, δ, м.д.): 29.50 (С5, С8), 30.70 (С1, С3), 31.15 (2СН3), 36.30 (С7), 44.00 (С2, С10, С8, С4), 51.95 (С2). Найдено, %: С 87.73; Н 12.27. C12H20. Вычислено, %: С 87.79; Н 12.33.
Результаты опытов по изомеризации пергидроаценафтена (2) в 1,3-диметиладамантана (1) приведены в таблице 1.
|