Результат интеллектуальной деятельности: РЕКОМБИНАНТНАЯ ПЛАЗМИДА, РЕКОМБИНАНТНЫЙ ШТАММ, РЕКОМБИНАНТНЫЙ БЕЛОК ВМР-7 И СПОСОБ ВЫДЕЛЕНИЯ РЕКОМБИНАНТНОГО БЕЛКА В ДИМЕРНОЙ ФОРМЕ
Вид РИД
Изобретение
Изобретение относится к биотехнологии, генной инженерии и медицине и может быть использовано для получения обладающей биологической активностью димерной формы рекомбинантного костного морфогенетического белка ВМР-7, которая может применяться в качестве остеоиндуктивного компонента костнопластических материалов медицинского назначения: имплантатов, покрытий и др.
Одним из ключевых компонентов современных костнопластических материалов, обеспечивающих их высокую остеоиндуктивность, являются костные морфогенетические белки. На сегодняшний день известно около двадцати видов костных морфогенетических белков, которые играют важную роль в регуляции роста, дифференцировки и апоптоза клеток различных типов, включая остеобласты, хондробласты, нервные клетки, эпителиальные клетки и др. [Sakou T. Bone morphogenetic proteins: from basic studies to clinical approaches. Bone. 1998, Vol.22, P.591-603].
Ведущая роль в формировании и регенерации костной и хрящевой тканей принадлежит костным морфогенетическим белкам, обладающим выраженными остеоиндуктивными свойствами [Urist M.R., Strates B.S. Bone morphogenetic protein. J Dent Res. 1971, Vol.50, P.1392-1406; Urist M.R., Nogami H., Mikulski A. A bone morphogenetic polypeptide. Calcif Tissue Res. Suppl. 1976, P.81-87]. Среди всего многообразия костных морфогенетических белков ведущую роль в остеогенезе играют нескольких факторов, в том числе BMP-7. В норме BMP-7 находится в костной ткани в комплексе с высокомолекулярными гликозоаминогликанами и высвобождается при повреждениях кости, что способствует миграции мезенхимальных клеток и их дифференцировке в остеобласты, а также стимулирует пролиферацию клеток. Основной функцией костного морфогенетического белка 7 является поддержание нормального остеогенеза в организме [Chen D., Zhao M., Mundy G.R. Bone morphogenetic proteins. Growth Factors. 2004, Vol.22, P.233-241; Bessa P.C., Casal M., Reis R.L. Bone morphogenetic proteins in tissue engineering: the road from the laboratory to the clinic, part I (basic concepts). J Tissue Eng Regen Med. 2008, Vol.2, P.1-13].
Нативный белок BMP-7 является гомодимером, который состоит из двух полипептидных цепей, соединенных S-S-связью остатков цистеина каждой субъединицы. Каждая мономерная единица в составе белка также имеет внутренние S-S-связи, образованные остатками цистеинов. Показано, что только в форме димера, стабилизированного S-S-связями, ВМР-7 обладает биологической активностью и способен взаимодействовать с рецепторами остеогенных клеток - трансмембранными серин/треониновыми киназами, активируя пролиферацию и дифференцировку остеобластов [Reddi A.H. Morphogenesis and tissue engineering of bone and cartilage: inductive signals, stem cells, and biomimetic biomaterials. Tissue Eng. 2000, Vol.6, P.351-359].
Выделение и очистка рекомбинантного белка BMP-2, получаемого методом бактериального синтеза в клетках E.coli, сопряжено с рядом сложностей, связанных с необходимостью удаления липополисахаридов, балластных белков, ДНК и РНК штаммов-продуцентов, а также получения белка в функционально активной димерной форме, т.е. отделения фракций, содержащих мономеры, тримеры и т.д. [Шарапова Н.Е., Котнова А.П., Галушкина З.М., Лаврова Н.В., Полетаева Н.Н., Тухватулин А.Э., Семихин А.С., Громов А.В., Соболева Л.А., Ершова А.С., Зайцев В.В., Сергиенко О.В., Лунин В.Г., Карягина А.С. Получение рекомбинантного костного морфогенетического белка 2 человека в клетках Escherichia coli и тестирование его биологической активности in vitro и in vivo. Молекулярная биология. 2010, №6, С.1036-1044]. Аналогичные проблемы наблюдаются при выделении и очистке рекомбинантного BMP-7, наработанного в бактериальных продуцентах. Кроме того, следует отметить сравнительно более низкий уровень экспрессии рекомбинантного BMP-7 по сравнению с рекомбинантным ВМР-2.
Установлено, что различные BMP способны связываться с рецепторами двух типов: типа I и типа II. Наиболее хорошо изучены условия взаимодействия BMP с рецепторами типа I, к которым относятся такие рецепторы, как BMPRIA (ALK3), BMPRIB (ALK6), ActRIA (ALK2) и др., способные взаимодействовать с этими белками только в форме димера и образовывать с ними комплексы [Kirsch T., Nickel J., Sebald W. Isolation of recombinant BMP receptor IA ectodomain and its 2:1 complex with BMP-2. FEBS Letters. 2000, Vol.468, P.215-219]. В работе коллектива ten Dijke P. показано, что в присутствии рецептора типа II (DAF4) ВМР-4 максимально эффективно взаимодействует с BMPRIA и BMPRIB, a BMP-7 - с ActRIA и BMPRIB, и гораздо слабее - с BMPRIA [ten Dijke P., Yamashita H., Sampath Т.K., Reddi A.H., Estevez M., Riddle D.L., Ichijo H., Heldin C.H., Miyazono K. Identification of type I receptors for osteogenicprotein-1 and bone morphogenetic protein-4. J Biol Chem. 1994, Vol.269 (25), P.16985-16988]. В отсутствие рецептора типа II BMP-7 связывается с BMPRIB, но гораздо слабее, чем при наличии рецептора типа II.
В другой работе изучалось связывание BMP с иммобилизованными рецепторами [Heinecke K., Seher A., Schmitz W., Mueller T.D., Sebald W., Nickel J. Receptor oligomerization and beyond: a case study in bone morphogenetic proteins. BMC Biol. 2009, Vol.7, P.59]. Результаты свидетельствуют о том, что ВМР-7 связывается с BMPRIA и BMPRIB, при этом BMPRIA связывает BMP-7 очень слабо (KDkin=58), a BMPRIB связывает ВМР-2 слабее, чем BMPRIA (KDkin=2,7), зато лучше связывает BMP-7 (KDkin=9).
Описанные свойства рецепторов могут быть использованы для выделения и очистки биологически активных димерной формы белка BMP-7.
В качестве ближайшего аналога может быть принято изобретение (патент №2408730 от 10.01.2011), в котором решена задача получения рекомбинантного белка BMP-7 за счет его синтеза в бактериальных клетках в форме бифункционального белка Collbd-BMP7 с коллагенсвязывающим доменом, что позволяет иммобилизовать его на коллагенсодержащем носителе. Однако, использование предлагаемого способа иммобилизации на коллагене для выделения белка затруднительно по двум причинам. Во-первых, при иммобилизации путем аффинного взаимодействия коллагенсвязывающего домена белка Collbd-BMP7 с коллагенсодержащим носителем будет происходить связывание всех форм белка: мономеров, димеров, тримеров и т.д., т.е., выделение биологически активной димерной формы таким способом невозможно. Во-вторых, следует отметить, что коллагенсо держащие носители довольно дороги.
Задачей, решаемой заявленной группой изобретений, является разработка эффективной технологии получения и очистки рекомбинантного белка BMP-7, обеспечивающей получение препаратов белков в биологически активной форме димера высокой степени очистки.
Упомянутая задача решается за счет получения рекомбинантного белка BMPRIB, являющегося рецептором BMP-7, в частности, за счет введения в его состав целлюлозосвязывающего домена (CBD), а также за счет введения между функциональными доменами спейсерной последовательности для сохранения возможности каждого домена связываться со своим лигандом. Помимо этого, упомянутая задача решается за счет возможности одностадийной иммобилизации рекомбинантного белка BMPRIB с целлюлозосвязывающим доменом (CBD), на целлюлозосодержащей колонке, а также способности димерной формы BMP-7 связываться с рецептором BMPRIB.
Сущность изобретения заключается в том, что способ получения рекомбинантного белка BMP-7 включает следующие стадии:
- подготовка сорбента с иммобилизованным белком BMPRIB, куда входят следующие операции: получение рекомбинантной плазмиды pBMPRIB, выращивание клеток штамма Escherichia coli M15 [pREP4, pBMPRIB], индукция синтеза белка BMPRIB-CBD, разрушение клеток и получение супернатанта, содержащего белок BMPRIB-CBD, иммобилизация белка BMPRIB-CBD и отмывание целлюлозосодержащего сорбента со связавшимся белком;
- заполнение хроматографической колонки подготовленным сорбентом;
- сорбция димерной формы рекомбинантного белка ВМР-7;
- элюирование димерной формы сорбированного белка BMP-7;
- анализ собранной фракции методом электрофореза в неденатурирующих условиях по Лэммли;
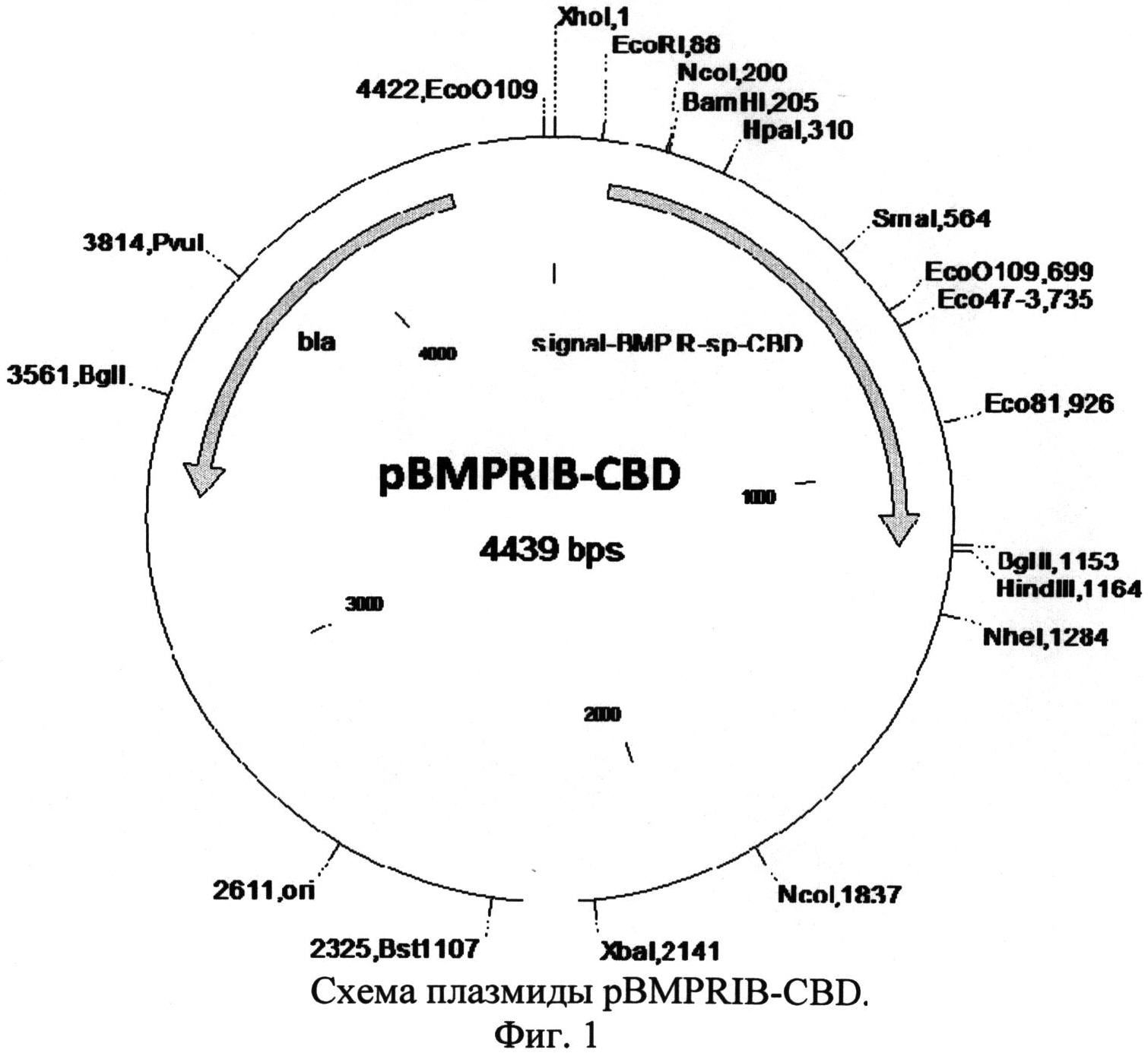
и отличается тем, что рекомбинантная плазмида pBMPRIB размером 4439 п.н. обеспечивает экспрессию рекомбинантного белка BMPRIB-CBD, состоящего из сигнала L-аспарагиназы E.coli, эктодомена рецептора BMPRIB человека, спейсера из остатков глицина и серина и целлюлозосвязывающего домена CBD, и содержит:
- искусственный бактериальный оперон химерных белков, включающий: промоторную область раннего промотора бактериофага Т5 (7-87 п.н.), обеспечивающую эффективную транскрипцию контролируемой мРНК; рекомбинантный ген, обеспечивающий экспрессию целевого химерного белка (сигнал L-аспарагиназы - рецептор BMPRIB - спейсер - целлюлозосвязывающий домен CBD) (148-1155 п.н.); нетранслируемую область терминации транскрипции бактериального оперона, обеспечивающую эффективное окончание транскрипции (1195-1289 п.н.);
- бактериальный оперон bla (3374-4234 п.н. комплементарной цепи), кодирующий белок бета-лактамазу, являющуюся селективным маркером для отбора клонов-трансформантов E.coli методом селекции на ампициллине;
- бактериальный участок инициации репликации типа ColEl, обеспечивающий репликацию плазмиды в штаммах E.coli (1661 п.н.).
Рекомбинантный белок BMPRIB-CBD состоит из сигнального пептида из L-аспарагиназы AspB E.coli, эктодомена рецептора BMPRIB человека, спейсера из остатков глицина и серина и целлюлозосвязывающего домена CBD, и одновременно обладает способностью BMPRIB связываться со своим лигандом - BMP-7 в форме димера, а также способностью CBD взаимодействовать с целлюлозосодержащим сорбентом.
Штамм Escherichia coli M15 [pREP4, pBMPRIB-CBD], полученный трансформацией штамма Escherichia coli M15/pREP4 плазмидой pBMPRIB-CBD, который является продуцентом рекомбинантного белка BMPRIB-CBD, состоящего из сигнала L-аспарагиназы AspB E.coli, эктодомена рецептора BMPRIB человека, спейсера из остатков глицина и серина и целлюлозосвязывающего домена CBD.
Техническим результатом заявленного изобретения является обеспечение получения хроматографически чистого белка ВМР-7 в димерной форме высокой степени очистки, пригодного для использования в качестве компонента костнопластических материалов нового поколения.
Таким образом, технический результат достигается за счет того, что разработана технология выделения и очистки BMP-7, основанная на специфическом взаимодействии белка с рецептором BMPRIB.
Также указанный технический результат достигается тем, что создана рекомбинантная плазмида pBMPRIB-CBD, кодирующая бифункциональный рекомбинантный белок BMPRIB-CBD, с одной стороны, содержащий аминокислотную последовательность рецептора BMPRIB, а с другой стороны - обладающий способностью связываться с целлюлозосодержащим сорбентом, благодаря наличию целлюлозосвязывающего домена CBD из Anaerocellum thermophillum.
Упомянутый технический результат достигается с помощью создания штамма Escherichia coli M15 [pREP4, pBMPRIB-CBD], являющегося продуцентом рекомбинантного белка BMPRIB-CBD. При этом отсутствие в клетках E.coli белков, способных связываться с целлюлозой, служит гарантией того, что рекомбинантный белок BMPRIB-CBD является единственным белком штамма [pREP4, pBMPRIB-CBD], прочно связывающимся с целлюлозосодержащим сорбентом.
Таким образом, технический результат достигается за счет нижеследующего:
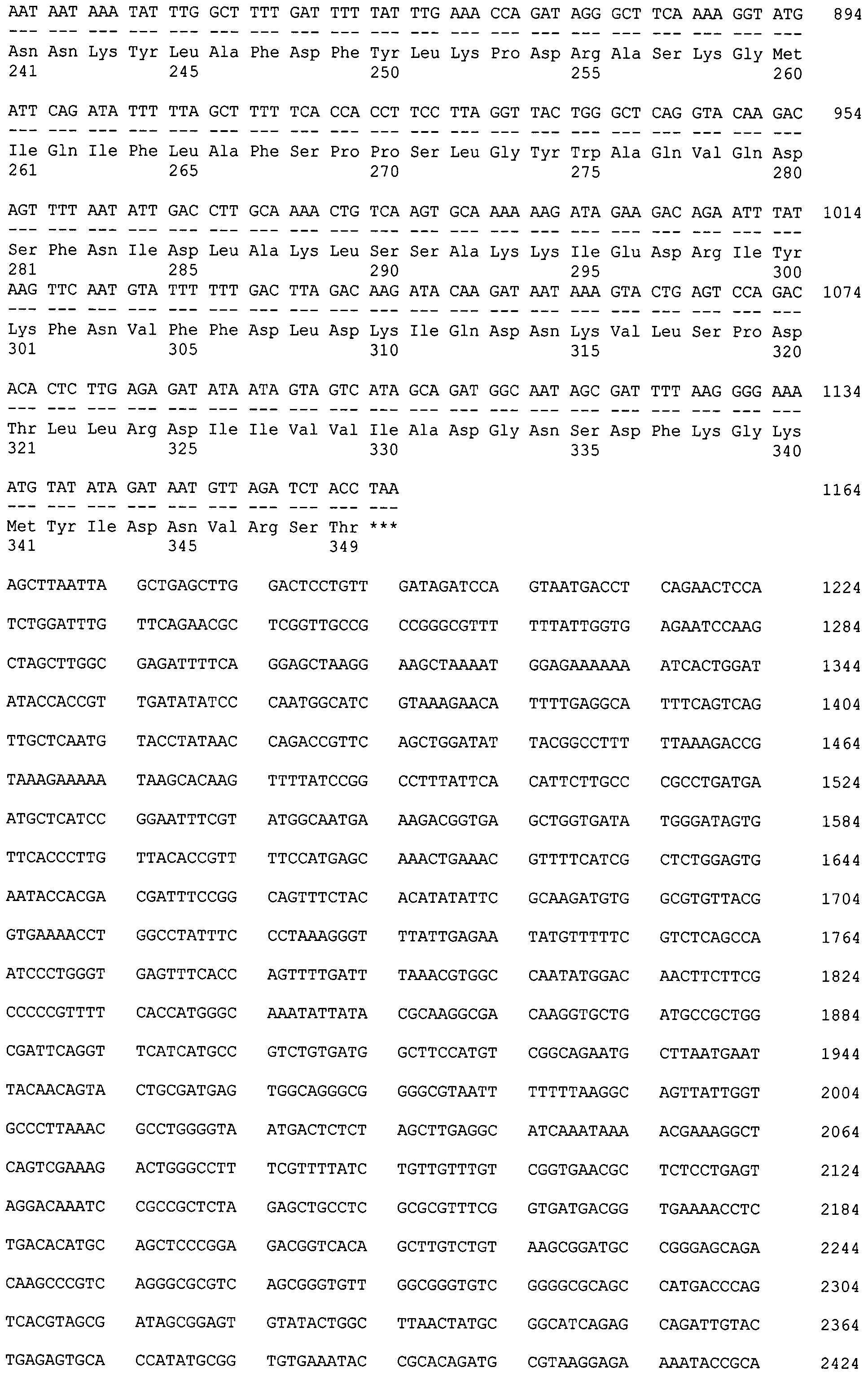
во-первых, рекомбинантной плазмиды pBMPRIB-CBD размером 4439 п.н. с последовательностью SEQ ID NO:1, обеспечивающей экспрессию рекомбинантного белка BMPRIB-CBD по п.1., состоящего из сигнала L-аспарагиназы E.coli, эктодомена рецептора BMPRIB человека, спейсера из остатков глицина и серина и целлюлозосвязывающего домена CBD, и состоящая из следующих структурных элементов:
- искусственный бактериальный оперон химерных белков, включающий: промоторную область раннего промотора бактериофага Т5 (7-87 п.н.), обеспечивающую эффективную транскрипцию контролируемой мРНК; рекомбинантный ген, обеспечивающий экспрессию целевого химерного белка (сигнал L-аспарагиназы - рецептор BMPRIB - спейсер - целлюлозосвязывающий домен CBD) (148-1155 п.н.); нетранслируемую область терминации транскрипции бактериального оперона, обеспечивающую эффективное окончание транскрипции (1195-1289 п.н.);
- бактериальный оперон bla (3374-4234 п.н. комплементарной цепи), кодирующий белок бета-лактамазу, являющуюся селективным маркером для отбора клонов-трансформантов E.coli методом селекции на ампициллине;
- бактериальный участок инициации репликации типа ColEl, обеспечивающий репликацию плазмиды в штаммах E.coli (1661 п.н.).
Во-вторых, штамма Escherichia coli M15 [pREP4, pBMPRIB-CBD], полученного трансформацией штамма Escherichia coli M15/pREP4 плазмидой по п.1., продуцент рекомбинантного белка BMPRIB-CBD, состоящего из сигнала L-аспарагиназы AspB E.coli, эктодомена рецептора BMPRIB человека, спейсера из остатков глицина и серина и целлюлозосвязывающего домена CBD.
В-третьих, рекомбинантного белка BMPRIB-CBD для выделения рекомбинантного белка ВМР-7 в димерной форме из раствора, состоящего из сигнального пептида из L-аспарагиназы AspB E.coli из сигнального пептида из L-аспарагиназы AspB E.coli с последовательностью SEQ ID NO:2, эктодомена рецептора BMPRIB человека из сигнального пептида из L-аспарагиназы AspB E.coli с последовательностью SEQ ID NO:3, спейсера из остатков глицина и серина из сигнального пептида из L-аспарагиназы AspB E.coli с последовательностью SEQ ID NO:4 и целлюлозосвязывающего домена CBD из сигнального пептида из L-аспарагиназы AspB E.coli с последовательностью SEQ ID NO:5, и обладает одновременно способностью BMPRIB связываться со своим лигандом - BMP-7 в форме димера, а также способностью CBD взаимодействовать с целлюлозосо держащим сорбентом.
В-четвертых, за счет способа выделения рекомбинантного белка BMP-7 в димерной форме из раствора, включающего следующие стадии:
- подготовка сорбента с иммобилизованным белком BMPRIB-CBD, включающая следующие операции: получение рекомбинантной плазмиды pBMPRIB-CBD, выращивание клеток штамма Escherichia coli M15 [pREP4, pBMPRIB-CBD], индукция синтеза белка BMPRIB-CBD, разрушение клеток и получение супернатанта, содержащего белок BMPRIB-CBD, иммобилизация белка BMPRIB-CBD и отмывание целлюлозосодержащего сорбента со связавшимся белком;
- заполнение хроматографической колонки подготовленным сорбентом и раствором рекомбинантного белка BMP-7;
- сорбция димерной формы рекомбинантного белка BMP-7;
- элюирование димерной формы сорбированного белка BMP-7;
- анализ собранной фракции методом электрофореза в неденатурирующих условиях.
Штамм Е.coli M15 [pREP4], содержащий плазмиду pBMPRIB-CBD, - продуцент рекомбинантного белка BMPRIB-CBD и штамм Е.coli M15 [pREP4], содержащий плазмиду pBMPRIB-CBD, - продуцент рекомбинантного белка BMPRIB-CBD характеризуются следующими признаками.
Культурально-морфологические признаки. Клетки прямые, палочковидные, неподвижные, грамотрицательные. При рассеве на чашке с 1,5% LB-агаром рост в виде отдельных колоний, иногда в R-форме с неровными краями. Хорошо растет на плотных и жидких питательных средах (LB-бульон, LB-arap, МПА, МПБ).
Физиолого-биохимические признаки. Клетки растут в пределах +4-42°C при оптимуме pH 6,8-7,5. Штаммы разлагают глюкозу, маннит с образованием кислоты, не разлагают сахарозу, арабинозу, галактозу, сбраживают мальтозу, ксилозу, сорбит, рамнозу. Существенным при использовании данных штаммов является их чувствительность к налидиксовой кислоте (25 мг/мл), стрептомицину (20 мг/мл) и рифампицину (25 мг/мл). Проявляют устойчивость к ампициллину (до 100 мкг/мл), обусловленную наличием плазмиды pBMPRIA-CBD или pBMPRIB-CBD, и к канамицину (до 25 мкг/мл), обусловленную наличием плазмиды pREP4. Указанный технический результат достигается также тем, что рекомбинантный белок BMPRIB-CBD, включающий в себя аминокислотную последовательность, определяющую его способность связываться с целлюлозосодержащим сорбентом, обеспечивает возможность его иммобилизации на сорбенте прямо из лизата, получаемого после разрушения и центрифугирования бактериальных клеток-продуцентов, и не требует проведения предварительной очистки.
Также упомянутый технический результат достигается с помощью анализа полученных фракций белка ВМР-7 методом электрофореза в неденатурирующих условиях, что позволяет оценить соотношение и количество разных олигомерных форм белка (мономеров, димеров, тетрамеров и др. в анализируемом образце.
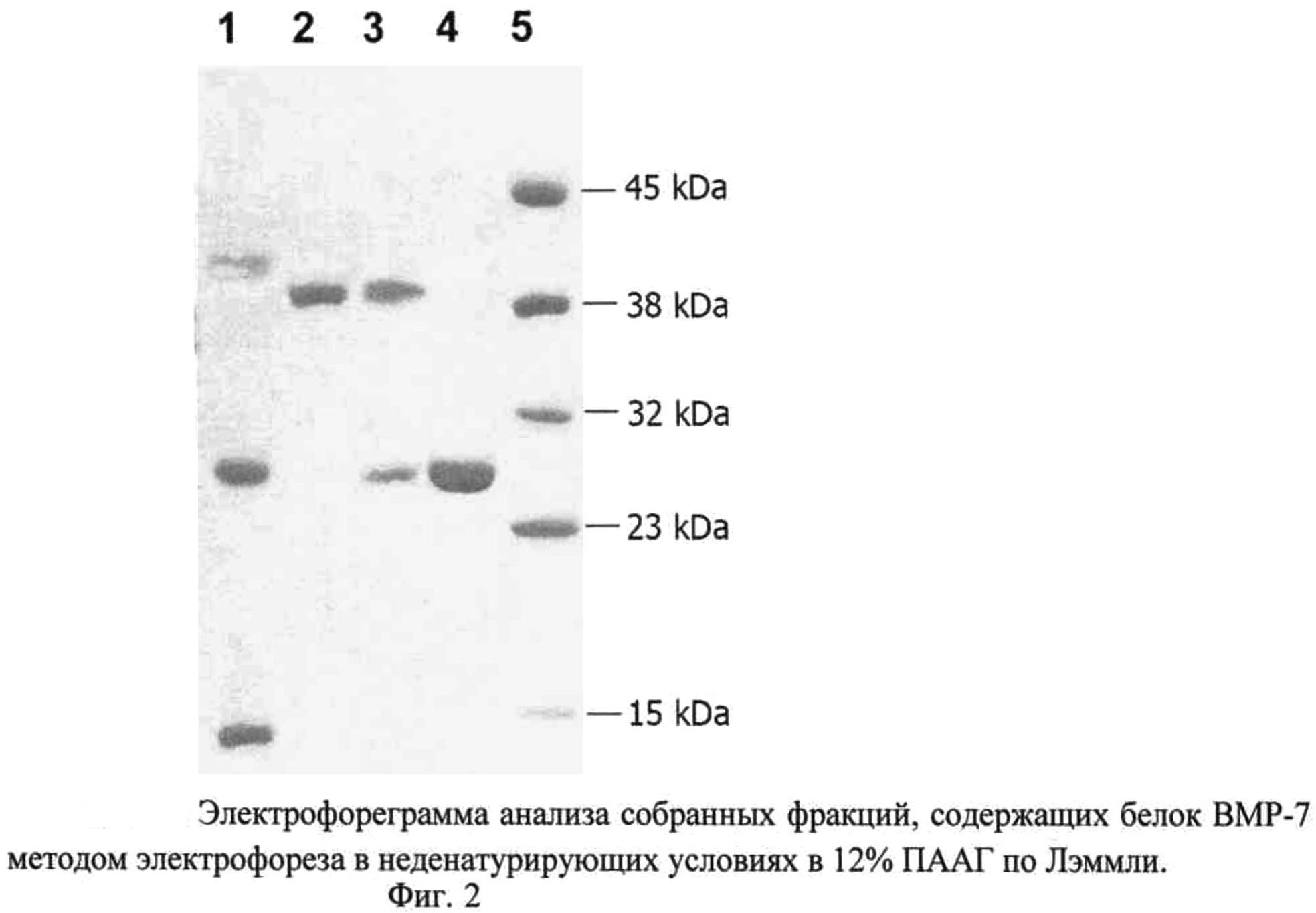
Изобретение проиллюстрировано чертежами, на которых изображены на фиг.1 - схема плазмиды pBMPRIB-CBD, на фиг.2 - элекгрофореграмма анализа собранной фракции белка BMP-7 методом электрофореза в неденатурирующих условиях по Лэммли (1-препарат рекомбинантного белка BMP-7, до очистки; 2-рекомбинантный белок BMPRIB-CBD, мол. масса 38,3 кДа; 3-сорбированный белок BMP-7 (мол. масса 28 кДа) в комплексе с BMPRB-CBD (мол. масса 38,3 кДа) и целлюлозосодержащим сорбентом; 4-препарат белка BMP-7 (димер) после элюирования с сорбента, мол. масса 28 кДа; 5 - маркер молекулярной массы, 15 кДа, 23 кДа, 32 кДа, 38 кДа, 45 кДа.); последовательность нуклеотидов плазмиды pBMPRIB-CBD - последовательность №1, последовательность аминокислот сигнального пептида L-asparaginase (AsnB) E.coli - последовательность №2, последовательность аминокислот эктодомена рецептора костного морфогенетического белка IB (BMPRIB) - последовательность №3, последовательность аминокислот глицин-серинового спейсера - последовательность №4, последовательность аминокислот целлюлозосвязывающего домена CBD - последовательность №5.
Все стандартные генно-инженерные и микробиологические манипуляции, а также амплификацию и секвенирование ДНК проводили по известным методикам (Маниатис Т., Фрич Э., Сэмбрук Дж., Молекулярное клонирование. М., Мир, 1984; Под ред. Гловера Д., Клонирование ДНК. Методы. Пер. с англ. М., Мир, 1988; Saiki R.K., Gelfand D.H, Stoffel S., Sharf S.J., HiguchiR., Horn G.T., Mullis K.B., Erlich H.A. Science. 1988, Vol.239, №4839, P.487-491; Sanger F, Nicklen S., Coulson A.R. Proc. Nat. Acad. Sci. USA. 1977, Vol.74, P.5463-5467).
Ниже приведены примеры, иллюстрирующие изобретение.
Пример 1. Подготовка сорбента с иммобилизованным белком BMPRIB-CBD.
а) Получение рекомбинантной плазмиды pBMPRIB-CBD.
Фрагмент гена, кодирующий экто домен рецептора BMPR-IB, получали синтетически. Для этого участок нуклеотидной последовательности гена BMPRIB, кодирующий эктодомен рецептора BMPRIB, разбивали на 8 олигонуклеотидов. Олигонуклеотиды спланированы таким образом, что при гибридизации они образуют двухцепочечный фрагмент ДНК, содержащий липкие концы, соответствующие сайтам гидролиза рестриктаз NcoI (CCATGG) и BglII (AGATCT). При синтезе олигонуклеотиды были фосфорилированы по 5'- концу.
Для получения двухцепочечного фрагмента ДНК смесь олигонуклетидов в эквимолярном количестве (по 20 пкМ) прогревали при 95°C (10 мин) и в течение 4 часов охлаждали до 25°C.
Затем плазмидный вектор ptt10, содержащий участок, кодирующий глицин-сериновый спейсер - целлюлозосвязывающий домен CBD, гидролизовали эндонуклеазами рестрикции NcoII и BamHI при 37°C в буфере, содержащем 66 мМ Трис-ацетата (pH 7,9 при 37°C), 20 мМ ацетата магния, 132 мМ ацетата калия и 0,2 мг/мл BSA в течение 1,5 ч.
Полученную смесь, содержащую двухцепочечные фрагменты гена эктодомена рецептора BMPRIB размером 286 п.н., объединяли с фрагментом плазмиды ptt10 (4153 п.н.), гидролизованной эндонуклеазами рестрикции NcoI и BamHI. Лигирование проводили с помощью ДНК-лигазы фага Т4 в буфере, содержащем 40 мМ Трис-HCl (pH 7,8 при 25°C), 10 мМ хлористого магния, 10 мМ ДТТ и 5 мМ АТФ. Лигированную смесь ДНК использовали для трансформации клеток E.coli M15 [pREP4] методом электропорации. Трансформированные клетки отбирали на агаризованной среде LB с антибиотиками канамицином (25 мкг/мл) и ампициллином (100 мкг/мл). Из отобранных рекомбинантных клонов выделяли плазмидную ДНК pBMPRIB-CBD методом щелочного лизиса. Отобранные клоны секвенировали и подтвердили наличие вставки, кодирующей эктодомен рецептора BMPRIB человека.
б) Выращивание клеток штамма Escherichia coli M15 [pREP4, pBMPRIB-CBD].
Для получения штамма E.coli - продуцента рекомбинантного белка BMPRIB-CBD, клетки штамма E.coli M15 [pREP4] (Nals, Strs, rifs, lac-, ara-, gal-, mtl-, F-, recA+, uvr+) трансформировали плазмидой pBMPRIB-CBD. Трансформированные клетки выращивали в 500 мл среды LB при 37°C до оптической плотности, соответствующей 1 ед. поглощения при длине волны 600 нм.
в) Индукция синтеза белка BMPRIB-CBD.
По достижении культурой оптической плотности, соответствующей 1 ед. поглощения при длине волны 600 нм, индуцировали синтез рекомбинантного белка BMPRIB-CBD путем добавления в среду 150 мкл 0,1 М раствора изопропил-бета-D-тиогалактопиранозида. Затем культуру выращивали в течение 4 часов.
г) Разрушение клеток и получение супернатанта, содержащего белок BMPRIB-CBD.
Биомассу клеток (2 г) суспендировали в 50 мл буфера, содержащего 1% тритона Х-100, 100 мМ NaCl, 25 мМ трис-HCl, pH 8,0. Добавляли лизоцим до концентрации 8 мкг/мл, инкубировали в течение 20-30 мин и разрушали клетки ультразвуком (амплитуда 55%, 1,5 мин дважды с перерывом в 10 мин). Лизат осветляли центрифугированием при 13000 g в течение 30 мин. Супернатант содержал растворимый рекомбинантный белок BMPRIB-CBD.
д) Иммобилизация белка BMPRIB-CBD и отмывание целлюлозосодержащего сорбента со связавшимся белком.
Полученный супернатант, содержащий белок BMPRIB-CBD, инкубировали с 10 мл 50% суспензии целлюлозосодержащего сорбента (perloza MT 200, Iontosorb, Чехия) в течение 4-18 часов. Затем сорбент тщательно и многократно отмывали от несвязавшегося белка раствором, содержащим 1% тритона Х-100, 100 мМ NaCl, 25 мМ трис-HCl, pH 8,0, путем суспендирования сорбента в буфере и последующего центрифугирования. Полученный сорбент содержал в качестве аффинного лиганда иммобилизованный BMPRIB-CBD (приблизительно 0,8 мг белка на 1 мл сорбента) (фиг.2, дорожка 2).
Пример 2. Заполнение хроматографической колонки подготовленным сорбентом.
В колонку вносили 10 мл сорбента с BMPRIB-CBD и для уравновешивания пропускали через нее десятикратный объем буферного раствора, содержащего 100 мМ NaCl, 25 мМ трис-HCl, pH 8,0.
Пример 3. Сорбция димерной формы рекомбинантного ВМР-7.
Раствор рекомбинантного белка ВМР-7, содержащий мономерные, димерные и другие олигомерные формы белка (фиг.2, дорожка 1) пропускали через подготовленную колонку со скоростью 1 мл в мин. Димерная форма BMP-7 связывалась с иммобилизованным на сорбенте белком BMPRIB-CBD (фиг.2, дорожка 3).
Пример 4. Элюирование димерной формы сорбированного белка BMP-7.
Колонку со связавшимся белком BMP-7 промывали пятикратным объемом буфера, содержащего 100 мМ NaCl, 25 мМ трис-HCl, pH 8,0. Элюирование связавшейся димерной формы белка BMP-7 проводили с помощью пропускания через колонку 10 мл буферного раствора, содержащего 1,5 М NaCl в 25 мМ трис-HCl, pH 8,0, со скоростью 1 мл в минуту (фиг.2, дорожка 4).
Пример 5. Анализ собранных фракций методом электрофореза в неденатурирующих условиях по Лэммли.
Для анализа собранных фракций рекомбинантного белка BMP-7 в димерной форме применяли метод электрофореза в ПААГ в неденатурирующих условиях. Разделение белков проводили в 12% полиакриламидном геле в стандартной системе буферов (электродный буфер: 25 мМ Трис-HCl, 192 мМ глицина, 0,1% додецилсульфата натрия, pH 8,3; буфер для геля: 375 мМ Трис-HCl, pH 8,8). Образцы вносили в лунки концентрирующего геля (4% акриламида и 3% N,N- метиленбисакриламида, 0,125 М трис-HCl, pH 6,8) в лизирующем буфере, содержащем 50 мМ Трис-HCl, pH 6,8, 10% глицерина, 0,01% бромфенолового синего. Электрофоретическое разделение проводили при токе 20 мА до достижения бромфеноловым синим нижней границы разделяющего геля. Белковые зоны окрашивали красителем Кумасси R 250, растворенным в смеси вода/спирт/уксусная кислота в соотношении 5:3:1, а затем неокрашенные зоны отмывали раствором, содержащим 10% ледяной уксусной кислоты и 10% изопропанола (фиг.2).
Пример 6. Определение биологической активности препаратов рекомбинантных белка BMP-7 в форме димеров. Проверку биологической активности препаратов рекомбинантного белка BMP-7 осуществляли в системе in vitro в культурах клеток линий С2С12 и С3Н10Т1/2 [Шарапова Н.Е., Котнова А.П., Галушкина З.М., Лаврова Н.В., Полетаева Н.Н., Тухватулин А.Э., Семихин А.С., Громов А.В., Соболева Л.А., Ершова А.С., Зайцев В.В., Сергиенко О.В., Лунин В.Г., Карягина А.С. Получение рекомбинантного костного морфогенетического белка 2 человека в клетках Escherichia coli и тестирование его биологической активности in vitro и in vivo. Молекулярная биология. 2010, №6, С.1036-1044].
Клетки мышей линий С2С12 и С3Н10Т1/2 засевали в концентрации 104 клеток на лунку в 48-луночном планшете и культивировали с использованием среды DMEMF12 (Biofluids, США), содержащей 10% фетальной сыворотки крупного рогатого скота (Gibco, США), при 37°C во влажной камере в атмосфере 5% CO2 в течение 24 часов. Затем клетки в течение трех суток инкубировали в 400 мл среды DMEMF12, содержащей 0,5% фетальной сыворотки крупного рогатого скота и рекомбинантный белок ВМР-7 (1, 10, 100 мкг). Отмывали клетки фосфатно-солевым буферным раствором и разрушали их с помощью добавления 0,1% раствора Тритон-Х-100 в фосфатно-солевом буферном растворе и трехкратной процедуры замораживания-оттаивания для разрушения клеточных мембран. Активность щелочной фосфатазы определяли по общепринятой методике с использованием р-нитрофенилфосфата в качестве субстрата. Концентрацию белка определяли по методу Бредфорд. В качестве положительного контроля использовали коммерческий препарат белка ВМР-2 человека (BioVision Research Products), в качестве отрицательного - буферный раствор.
Удельная активность препаратов рекомбинантного BMP-7 составила 103 ед. акт. щелочной фосфатазы на 1 мг белка.