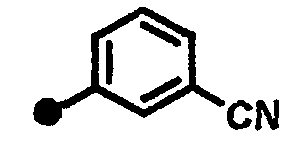
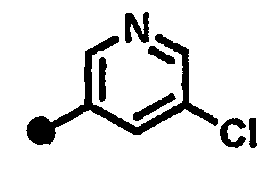
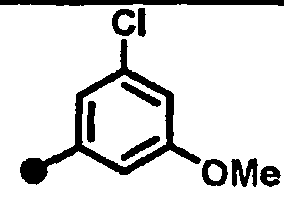
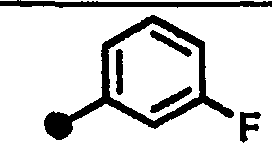
Результат интеллектуальной деятельности: 7-ПИПЕРИДИНОАЛКИЛ-3,4-ДИГИДРОХИНОЛОНОВЫЕ ПРОИЗВОДНЫЕ, ОБЛАДАЮЩИЕ АНТАГОНИСТИЧЕСКИМ ДЕЙСТВИЕМ НА РЕЦЕПТОР МСН (МЕЛАНИН-КОНЦЕНТРИРУЮЩЕГО ГОРМОНА)
Вид РИД
Изобретение
Область техники
Настоящее изобретение относится к соединению, имеющему антагонистическое действие на рецептор меланин-концентрирующего гормона, его фармацевтически приемлемой соли или гидрату.
Уровень техники
Депрессия и тревожные расстройства составляют основные психические заболевания. Предполагается, что распространенность на протяжении жизни депрессии и тревожных расстройств в последние годы постоянно повышается. В настоящее время разработаны трициклические антидепрессанты (ТСА), селективные ингибиторы повторного поглощения серотонина (SSRI), ингибиторы повторного поглощения серотонина и норадреналина (SNRI) и т.п. как антидепрессанты на основе моноаминной гипотезы. В качестве анксиолитиков используют бензодиазепины на основании механизма действия γ-аминомасляной кислоты (GABA). В последние годы показано, что SSRI и SNRI также эффективны против тревожных расстройств, таких как паническое расстройство и обсессивно-компульсивное расстройство, в случае которых бензодиазепины неэффективны, и они также являются первоочередными средствами лечения в случае тревожных расстройств. Однако SSRI и SNRI неэффективны для пациентов при лечении рефрактерной депрессии, и например, их необходимо принимать в течение нескольких недель для начала антидепрессивного и анксиолитического действия, что невыгодно. Соответственно, желательно разработать антидепрессант и анксиолитик на основании механизма действия, отличающегося от механизма действия существующих лекарственных средств.
Меланин-концентрирующий гормон (МСН) - нейропептид, состоящий из 19 аминокислот, синтезируется и широко распространен в лимбической системе и т.п. головного мозга. Рецептор 1 меланин-концентрирующего гормона (MCH1R) и рецептор 2 меланин-концентрирующего гормона (MCH2R) уже известны как два подтипа рецептора МСН. MCH2R не экспрессируется у грызунов, и его физиологические функции пока не выяснены; однако выяснено, что MCH1R глубоко ассоциируется с поведением во время еды и энергетическим метаболизмом. Конкретнее, имеется сообщение, что поглощение пищи крысой усиливается инъекцией МСН. Имеется другое сообщение о том, что снижение массы тела и усиление метаболизма наблюдают у генномодифицированных мышей с недостатком МСН (см. непатентный документ 1). Соответственно, антагонист MCH1R, вероятно, можно использовать как профилактическое или терапевтическое лекарственное средство в случае ожирения, пищевого расстройства, расстройства аппетита, гиперфагии, булимии, патологического отвращения к пище и т.д.
С другой стороны, сообщается, что MCH1R также глубоко вовлекается в регуляцию стрессовой реакции и эмоции. Активация системы гипоталамус - гипофиз - надпочечник (НРА) МСН антагонизируется антагонистом MCH1R и нейтрализующими антителами против кортикотропин-рилизинга фактора (CRF). Предполагается, что МСН активирует систему НРА через облегчение высвобождения CRF из гипоталамуса. MCH1R преимущественно распространен в прилежащих областях, вовлеченных в мотивацию и вознаграждение. Когда МСН инъецируют в указанную область, в испытании с принудительным плаванием наблюдают депрессивноподобные симптомы, в то время как у МСН-нокаутированных мышей наблюдают антидепрессивноподобные симптомы. Исследование с использованием MCH1R-нокаутированных мышей показывает, что MCH1R отрицательно регулирует активность дофаминергических нейронов, вовлеченных в прилежащих областях в вознаграждение. Более того, непептидный антагонист MCH1R АТС0175 на экспериментальных животных моделях оказывает действие, схожее с антидепрессивным и анксиолитическим (непатентный документ 2). На основании фактов, указнных выше, предполагается, что MCH1R вовлекается не только в регуляцию поведения во время еды и энергетический метаболизм, но также в возникновение депрессии и тревоги, и можно ожидать, что антагонист рецептора МСН, в частности, антагонист MCH1R, может быть антидепрессантом и анксиолитиком с механизмом действия, отличающимся от механизма действия известных антагонистов.
Недавно раскрыты антагонисты рецептора МСН, имеющие структуру нафталина и структуру 1,3-бензодиоксола (патентный документ 1 и непатентные документы 3, 4, 5 и 6). Однако в указанных документах не раскрывается и не предполагается структура соединения по настоящему изобретению.
Патентный документ 1: публикация заявки на патент США № 2005/209274
Непатентный документ 1: Trends Endocrinol. Metab., vol.11, p. 299-303 (2000)
Непатентный документ 2: Drug Development Research, vol.65, p. 278-290 (2005)
Непатентный документ 3: 224th The American Chemical Society MEDI-343 (2002)
Непатентный документ 4: Bioorganic & Medicinal Chemistry Letters, vol.16, p. 5445-5450 (2006)
Непатентный документ 5: Bioorganic & Medicinal Chemistry Letters, vol.15, p. 3412-3416 (2005)
Непатентный документ 5: Bioorganic & Medicinal Chemistry Letters, vol.17, p. 874-878 (2007)
Раскрытие изобретения
Проблемы, решаемые изобретением
Задача настоящего изобретения состоит в предоставлении нового соединения, применимого благодаря его антагонистическому действию на рецептор МСН, для предупреждения или лечения заболеваний, таких как депрессия, тревожные расстройства (такие как генерализованное тревожное расстройство, посттравматический стресс, паническое расстройство, обсессивно-компульсивное расстройство или социальное тревожное расстройство), дефицит внимания, мания, маниакально-депрессивный психоз, шизофрения, расстройство настроения, стресс, расстройства сна, припадки, ухудшение памяти, когнитивное ухудшение, деменция, амнезия, делирий, ожирение, расстройство пищевого поведения, расстройство аппетита, гиперфагия, булимия, патологическое отвращение к пище, диабет, сердечно-сосудистые заболевания, гипертензия, дислипидемия, инфаркт миокарда, нарушение движений (такое как болезнь Паркинсона, эпилепсия, конвульсия или тремор), лекарственная зависимость, наркомания или половая дисфункция, его фармацевтически приемлемая соль или его гидрат.
Способы решения проблемы
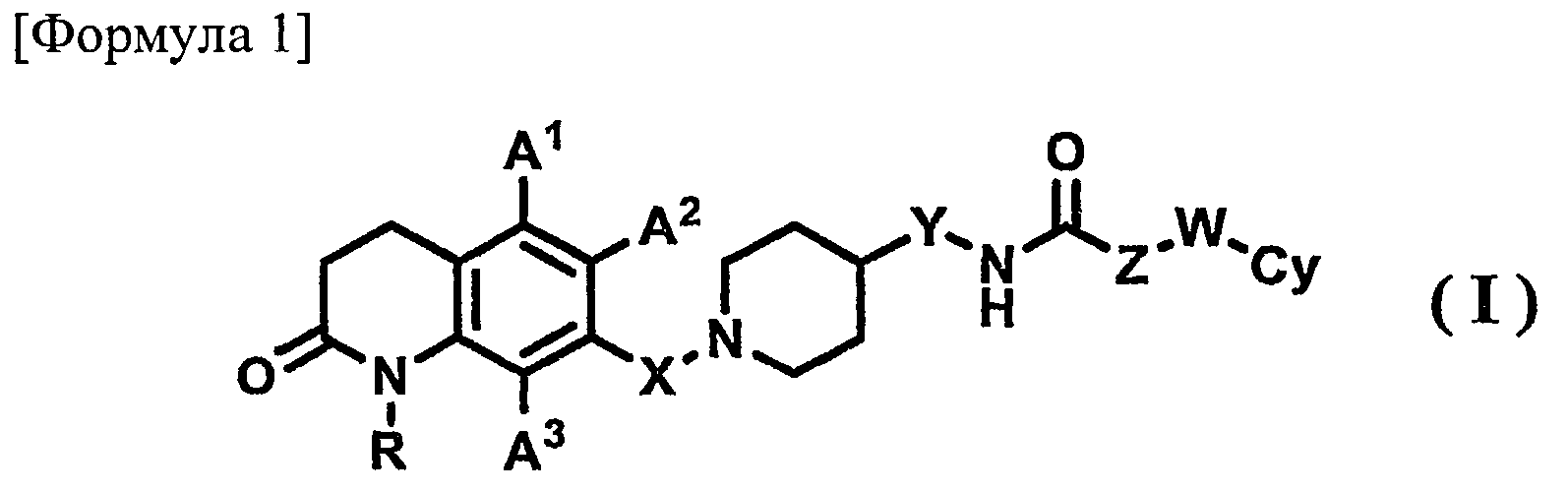
В результате интенсивных исследований, проведенных авторами изобретения, было обнаружено, что 7-пиперидиноалкил-3,4-гидрохинолоновое производное, представленное приведенной далее формулой (I), обладает превосходным антагонистически действием на рецептор МСН. На основании такого результата осуществлено настоящее изобретения.
Конкретнее, настоящее изобретение относится к
1) соединению, представленному формулой (I), его фармацевтически приемлемой соли или гидрату
[Формула 1]
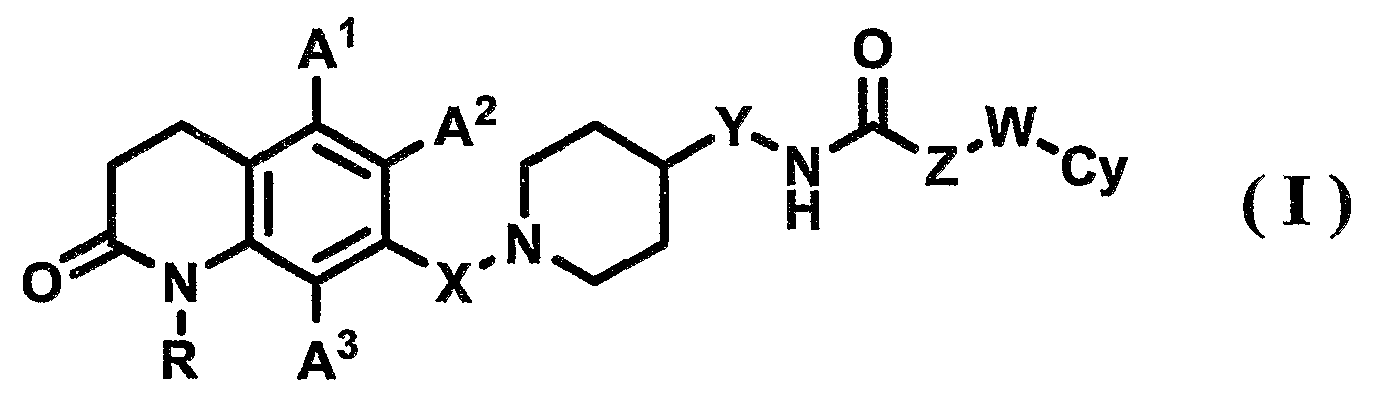
где в указанной формуле (I)
R представляет собой атом водорода или С1-6-алкильную группу;
А1, А2 и А3, которые могут быть одинаковыми или различными, представляют собой, каждый, атом водорода, атом галогена, С1-6-алкильную группу или С1-6-алкоксигруппу;
Х представляет собой С1-6-алкиленовую группу;
Y представляет собой связь или С1-6-алкиленовую группу;
Z представляет собой связь или С1-6-алкиленовую группу, где С1-6-алкиленовая группа может быть замещена арильной группой;
W представляет собой связь или атом кислорода; и
Су представляет собой арильную группу или гетероарильную группу, где арильная группа или гетероарильная группа может иметь от одного до трех заместителей, которые могут быть одинаковыми или различными и выбраны из группы, состоящей из атома галогена, цианогруппы, С1-6-алкильной группы, С1-6-алкоксигруппы, где С1-6-алкильная группа или С1-6-алкоксигруппа могут быть замещены от одного до трех атомов галогена, и С2-6-алканоильной группы;
2) соединению, его фармацевтически приемлемой соли или гидрату согласно указанному выше разделу 1), в которых в формуле (I)
R представляет собой атом водорода;
А1, А2 и А3 представляют собой, каждый, атом водорода;
Х представляет собой С1-6-алкиленовую группу;
Y представляет собой связь;
Z представляет собой связь или С1-6-алкиленовую группу, где С1-6-алкиленовая группа может быть замещена арильной группой;
W представляет собой связь или атом кислорода; и
Су представляет собой фенильную группу или пиридильную группу, где фенильная группа или пиридильная группа может иметь от одного до трех заместителей, которые могут быть одинаковыми или различными и выбраны из группы, состоящей из атома галогена, цианогруппы, С1-6-алкильной группы, С1-6-алкоксигруппы, где С1-6-алкильная группа или С1-6-алкоксигруппа могут быть замещены от одного до трех атомов галогена и С2-6-алканоильной группы;
3) соединению, его фармацевтически приемлемой соли или гидрату согласно указанному выше разделу 1), в которых в формуле (I)
R представляет собой атом водорода;
А1, А2 и А3 представляют собой, каждый, атом водорода;
Х представляет собой метиленовую группу, где метиленовая группа может быть замещена метильной группой;
Y представляет собой связь;
Z представляет собой связь или метиленовую группу;
W представляет собой связь или атом кислорода; и
Су представляет собой фенильную группу, где фенильная группа может иметь от одного до трех заместителей, которые могут быть одинаковыми или различными и выбраны из группы, состоящей из атома галогена, С1-6-алкильной группы, С1-6-алкоксигруппы и С2-6-алканоильной группы;
4) соединению, его фармацевтически приемлемой соли или гидрату согласно указанному выше разделу 1), где соединение, представленное формулой (I), представляет собой
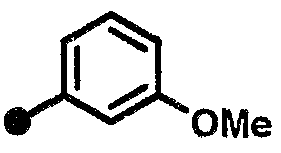
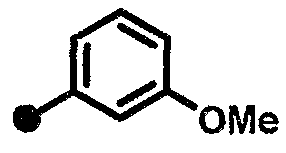
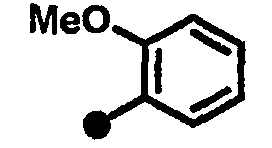
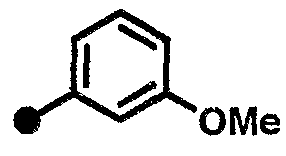
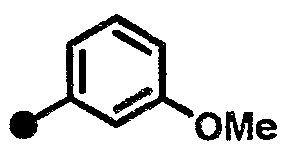
3-метокси-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
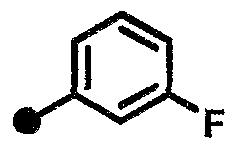
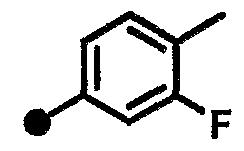
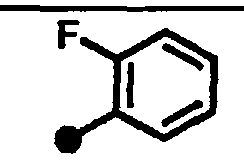
3-фтор-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
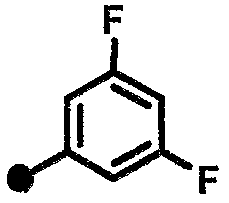
3,5-дифтор-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
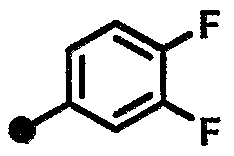
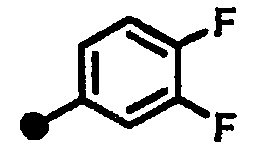
3,4-дифтор-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
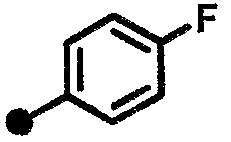
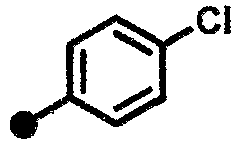
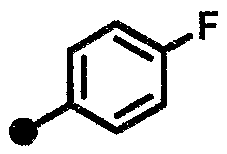
4-фтор-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
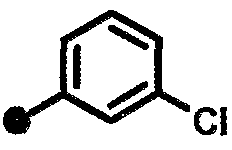
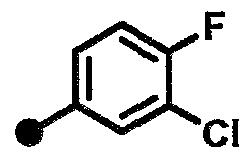
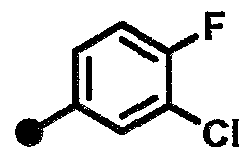
3-хлор-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
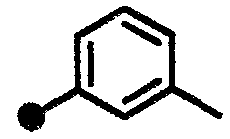
3-метил-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
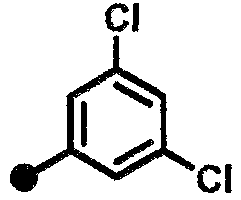
3,5-дихлор-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
3,4-дихлор-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
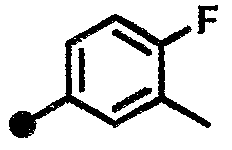
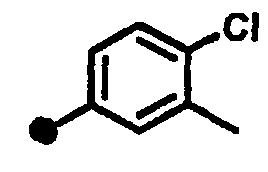
4-фтор-3-метил-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
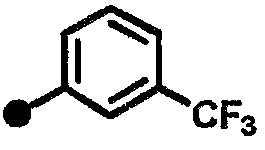
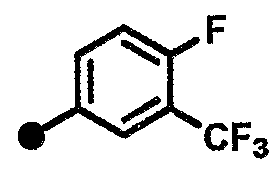
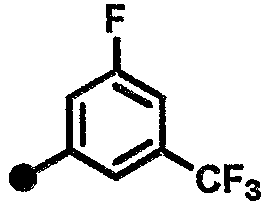
4-фтор-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}-3-(трифторметил)бензамид,
3-фтор-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}-5-(трифторметил)бензамид,
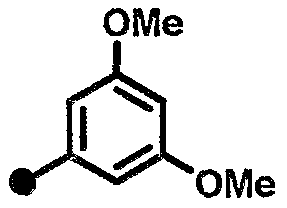
3,5-диметокси-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
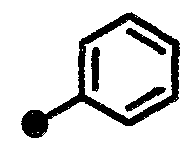
N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}-2,2-дифенилацетамид,
4-хлор-3-фтор-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
3-бром-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
3-фтор-5-метокси-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
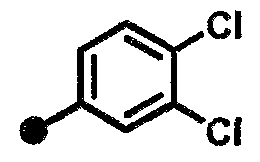
3-хлор-4-фтор-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
3-ацетил-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
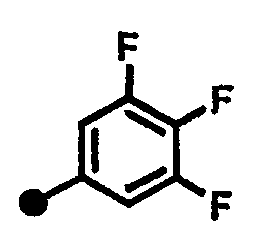
3,4,5-трифтор-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
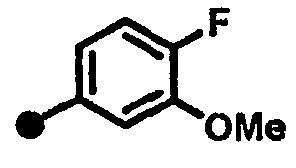
4-фтор-3-метокси-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
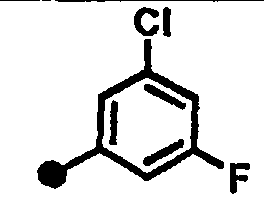
3-хлор-5-фтор-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
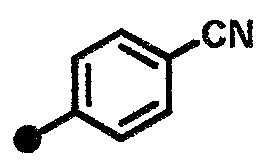
3-циано-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
5-хлор-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}пиридин-3-карбоксамид,
3-хлор-5-метокси-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
4-хлор-3-метил-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
2-(3-хлор-4-фторфенокси)-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}ацетамид,
2-(3-хлорфенокси)-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}ацетамид,
3-хлор-4-фтор-N-{1-[1-(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)этил]пиперидин-4-ил}бензамид
или
N-{1-[(6-фтор-2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}-3-метоксибензамид;
5) фармацевтической композиции, содержащей в качестве активного ингредиента соединение, его фармацевтически приемлемую соль или гидрат согласно любому из указанных выше разделов 1)-4);
6) фармацевтической композиции согласно указанному выше разделу 5), которая является антагонистом рецептора меланин-концентрирующего гормона; и
7) профилактическому или терапевтическому лекарственному средству, содержащему в качестве активного ингредиента соединение, его фармацевтически приемлемую соль или гидрат согласно любому из указанного выше в разделах 1)-4), в случае депрессии, тревожных расстройств, дефицита внимания, мании, маниакально-депрессивного психоза, шизофрении, расстройства настроения, стресса, расстройств сна, припадков, ухудшения памяти, когнитивного ухудшения, деменции, амнезии, делирия, ожирения, расстройства пищевого поведения, расстройства аппетита, гиперфагии, булимии, патологического отвращения к пище, диабета, сердечно-сосудистых заболеваний, гипертензии, дислипидемии, инфаркта миокарда, нарушения движений, лекарственной зависимости, наркомании или половой дисфункции.
Преимущества изобретения
Обнаружено, что соединение по настоящему изобретению обладает антагонистической активностью к рецептору МСН. Лечебное лекарственное средство, содержащее соединение по настоящему изобретению, на основании антагонистического действия на рецептор МСН применимо в качестве профилактического или лечебного лекарственного средства в случае депрессии, тревожных расстройств (таких как генерализованное тревожное расстройство, посттравматический стресс, паническое расстройство, обсессивно-компульсивное расстройство или социальное тревожное расстройство), дефицита внимания, мании, маниакально-депрессивного психоза, шизофрении, расстройства настроения, стресса, расстройств сна, припадков, ухудшения памяти, когнитивного ухудшения, деменции, амнезии, делирия, ожирения, расстройства пищевого поведения, расстройства аппетита, гиперфагии, булимии, патологического отвращения к пище, диабета, сердечно-сосудистых заболеваний, гипертензии, дислипидемии, инфаркта миокарда, нарушения движений (такого как болезнь Паркинсона, эпилепсия, конвульсия или тремор), лекарственной зависимости, наркомании или половой дисфункции.
Наилучший способ осуществления изобретения
Термины, используемые в данном описании, имеют значения, указанные далее.
«Атом галогена» представляет собой атом фтора, атом хлора, атом брома и атом йода.
«С1-6-алкильная группа» представляет собой линейную алкильную группу с 1-6 атомами углерода или разветвленную алкильную группу с 3-6 атомами углерода. Линейная алкильная группа представляет собой метильную группу, этильную группу, пропильную группу, бутильную группу, пентильную группу и гексильную группу. Разветвленная алкильная группа представляет собой, например, изопропильную группу, изобутильную группу, трет-бутильную группу, изопентильную группу, 1-этилпропильную группу и изогексильную группу.
«С1-6-алкоксигруппа» представляет собой линейную алкоксигруппу с 1-6 атомами углерода или разветвленную алкоксигруппу с 3-6 атомами углерода. Линейная алкоксигруппа представляет собой метоксигруппу, этоксигруппу, пропоксигруппу, бутоксигруппу, пентилоксигруппу и гексилоксигруппу. Разветвленная алкоксигруппа представляет собой, например, изопропоксигруппу, изобутоксигруппу, трет-бутоксигруппу, изопентилоксигруппу, 1-этилпропоксигруппу и изогексилоксигруппу.
«С1-6-алкиленовая группа» представляет собой линейную алкиленовую группу с 1-6 атомами углерода или разветвленную алкиленовую группу с 3-6 атомами углерода, например, в том числе, метиленовую группу, этиленовую группу, пропиленовую группу, бутиленовую группу, пентиленовую группу, гексиленовую группу, изопропиленовую группу, изобутиленовую группу, трет-бутиленовую группу, изопентиленовую группу, 1-этилпропиленовую группу и изогексиленовую группу, и т.д.
«С2-6-алканоильная группа» представляет собой карбонильную группу с С1-5-алкильной группой. Ее примеры включают метилкарбонильную группу, этилкарбонильную группу, пропилкарбонильную группу, бутилкарбонильную группу, пентилкарбонильную группу, гексилкарбонильную группу, изопропилкарбонильную группу, изобутилкарбонильную группу, трет-бутилкарбонильную группу, изопентилкарбонильную группу, 1-этилпропилкарбонильную группу и изогексилкарбонильную группу.
«Арильная группа» представляет собой моноциклические-тетрациклические ароматические карбоциклические группы, образованные 6-18 атомами углерода. Ее примеры включают фенильную групу, нафтильную группу, антраценильную группу и 9Н-флуоренильную группу.
«Гетероарильная группа» представляет собой моноциклические-бициклические ароматические гетероциклические группы, образованные 5-10 атомами, включающими, кроме атомов углерода, 1-3 гетероатома, выбранных из атома азота, атома кислорода и атома серы. Ее примеры включают пирролильную группу, пиразолильную группу, имидазолильную группу, фурильную группу, оксазолильную группу, изоксазолильную группу, тиенильную группу, тиазолильную группу, изотиазолильную группу, пиридильную группу, пиримидинильную группу, пиридазинильную группу, пиразинильную группу, индолильную группу, бензофурильную группу, бензотиенильную группу, бензимидазолильную группу, бензоксазолильную группу, бензотиазолильную группу, бензопиразолильную группу, бензизоксазолильную группу, бензизотиазолильную группу, хинолильную группу, изохинолильную группу, хиназолинильную группу, хиноксалинильную группу, фталазинильную группу, хинолинильную группу и 9Н-ксантенильную группу.
Аспект, касающийся соединения по настоящему изобретению, относится к 7-пиперидиноалкил-3,4-дигидрохинолоновому производному, его фармацевтически приемлемой соли или гидрату, представленным формулой (I)
[Формула 2]
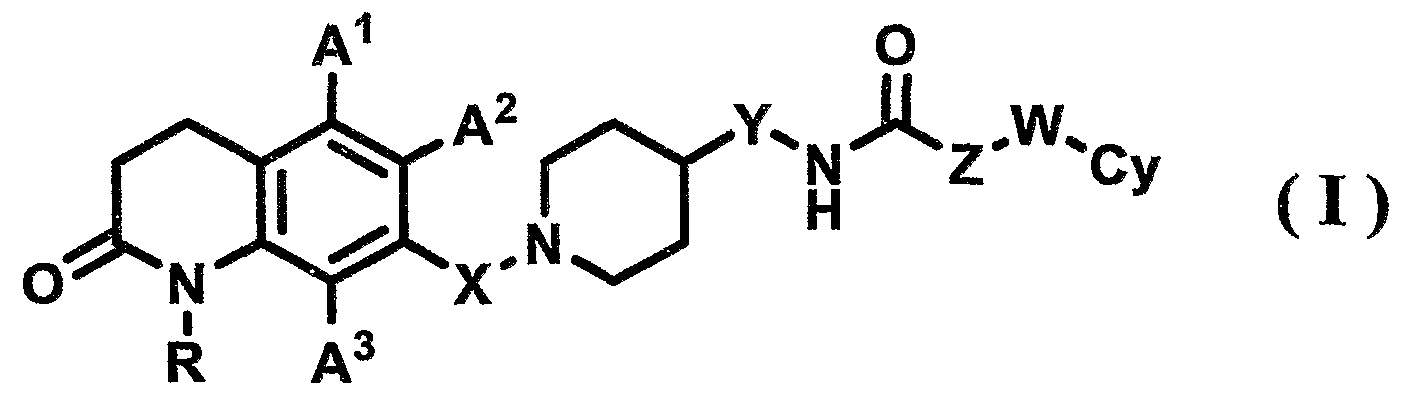
{где в формуле (I) R, X, Y, Z, W, A1, A2, A3 и Су имеют значения, указанные выше}.
Предпочтительным аспектом соединения по настоящему изобретению является следующее. В формуле (I) R представляет собой атом водорода, А1, А2 и А3 представляют собой, каждый, атом водорода, Х представляет собой С1-6-алкиленовую группу, Y представляет собой связь, Z представляет собой связь или С1-6-алкиленовую группу (где С1-6-алкиленовая группа может быть замещена арильной группой), W представляет собой связь или атом кислорода, и Су представляет собой фенильную группу или пиридильную группу (где фенильная группа или пиридильная группа могут иметь от одного до трех заместителей, которые могут быть одинаковыми или различными и выбраны из группы, состоящей из атома галогена, цианогруппы, С1-6-алкильной группы, С1-6-алкоксигруппы, где С1-6-алкильная группа или С1-6-алкоксигруппа могут быть замещены от одного до трех атомов галогена, и С2-6-алканоильной группы).
Другим предпочтительным аспектом соединения по настоящему изобретению является следующее. В формуле (I) R представляет собой атом водорода, А1, А2 и А3 представляют собой, каждый, атом водорода, Х представляет собой метиленовую группу (где метиленовая группа может быть замещена метильной группой), Y представляет собой связь, Z представляет собой связь или метиленовую группу, W представляет собой связь или атом кислорода, и Су представляет собой фенильную группу (где фенильная группа может иметь от одного до трех заместителей, которые могут быть одинаковыми или различными, и выбраны из группы, состоящей из атома галогена, С1-6-алкильной группы, С1-6-алкоксигруппы и С2-6-алканоильной группы). Вышеуказанная фенильная группа предпочтительно является незамещенной фенильной группой или замещенной фенильной группой, представленной одной из формул (IIa)-(IId)
[Формула 3]
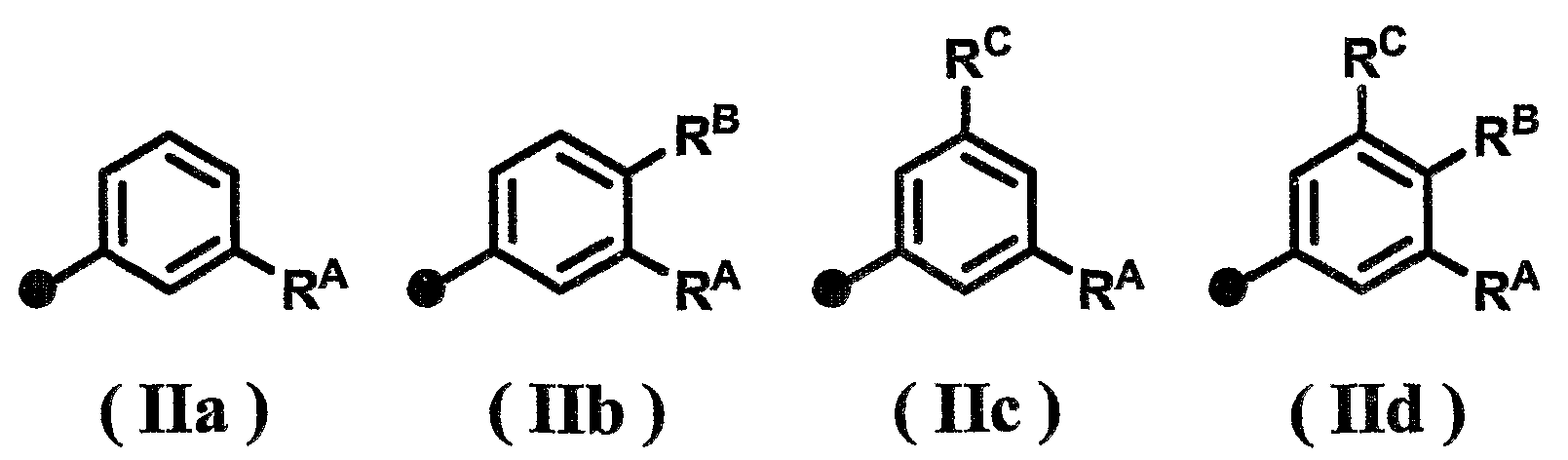
{где RA, RB и RC, которые могут быть одинаковыми или различными, представляют собой, каждый, атом галогена, С1-6-алкильную группу, С1-6-алкоксигруппу или С2-6-алканоильную группу}.
Предпочтительное конкретное соединение по настоящему изобретению представляет собой
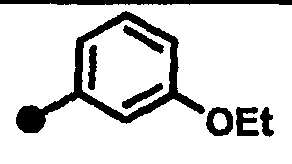
3-метокси-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
3-фтор-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
3,5-дифтор-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
3,4-дифтор-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
4-фтор-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
3-хлор-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
3-метил-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
3,5-дихлор-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
3,4-дихлор-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
4-фтор-3-метил-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
4-фтор-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}-3-(трифторметил)бензамид,
3-фтор-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}-5-(трифторметил)бензамид,
3,5-диметокси-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}-2,2-дифенилацетамид,
4-хлор-3-фтор-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
3-бром-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
3-фтор-5-метокси-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
3-хлор-4-фтор-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
3-ацетил-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
3,4,5-трифтор-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
4-фтор-3-метокси-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
3-хлор-5-фтор-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
3-циано-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
5-хлор-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}пиридин-3-карбоксамид,
3-хлор-5-метокси-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
4-хлор-3-метил-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамид,
2-(3-хлор-4-фторфенокси)-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}ацетамид,
2-(3-хлорфенокси)-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}ацетамид,
3-хлор-4-фтор-N-{1-[1-(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)этил]пиперидин-4-ил}бензамид,
N-{1-[(6-фтор-2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}-3-метоксибензамид,
фармацевтически приемлемую соль или гидрат любого из указанных соединений.
Аспектом, касающимся соединения по настоящему изобретению, является лечебное лекарственное средство, содержащее в качестве активного ингредиента, по меньшей мере, одно из соединений или их фармацевтически приемлемых солей, описанных в данном описании.
Аспектом, касающимся соединения по настоящему изобретению, является лечебное лекарственное средство, содержащее в качестве активного ингредиента, по меньшей мере, одно из соединений или их фармацевтически приемлемых солей, описанных в данном описании, служащее в качестве антагониста рецептора МСН.
Аспектом, касающимся соединения по настоящему изобретению, является профилактическое или терапевтическое лекарственное средство, содержащее в качестве активного ингредиента, по меньшей мере, одно из соединений или их фармацевтически приемлемых солей или гидратов, описанных в данном описании, против депрессии, тревожных расстройств (таких как генерализованное тревожное расстройство, посттравматический стресс, паническое расстройство, обсессивно-компульсивное расстройство или социальное тревожное расстройство), дефицита внимания, мании, маниакально-депрессивного психоза, шизофрении, расстройства настроения, стресса, расстройств сна, припадков, ухудшения памяти, когнитивного ухудшения, деменции, амнезии, делирия, ожирения, расстройства пищевого поведения, расстройства аппетита, гиперфагии, булимии, патологического отвращения к пище, диабета, сердечно-сосудистых заболеваний, гипертензии, дислипидемии, инфаркта миокарда, нарушения движений (такого как болезнь Паркинсона, эпилепсия, конвульсия или тремор), лекарственной зависимости, наркомании или половой дисфункции. Предпочтительным аспектом является профилактическое или терапевтическое лекарственное средство, содержащее в качестве активного ингредиента, по меньшей мере, одно из соединений, их фармацевтически приемлемых солей или гидратов, описанных в данном описании, против депрессии и тревожных расстройств. Другим предпочтительным аспектом является профилактическое или терапевтическое лекарственное средство, содержащее в качестве активного ингредиента, по меньшей мере, одно из соединений, их фармацевтически приемлемых солей или гидратов, описанных в данном описании, против ожирения, расстройства пищевого поведения, расстройства аппетита, гиперфагии, булимии и патологического отвращения к пище.
Предпочтительное соединение по настоящему изобретению обладает превосходным антагонистическим действием на рецептор МСН, однако имеет низкую аффинность связывания с каналом hERG. Соединение с высокой аффинностью связывания с каналом hERG может создавать опасность оказания побочного действия на сердечно-сосудистую систему. Поэтому ожидается, что соединение с указанным выше действием будет проявлять превосходную лекарственную эффективность и обладать высокой безопасностью.
Соединение (I) по настоящему изобретению, его фармацевтически приемлемую соль или гидрат можно синтезировать различными способами синтеза, известными специалистам в данной области техники. Их примеры включают способы получения, описанные ниже, однако настоящее изобретение ими не ограничивается. Также на приведенных далее реакционных схемах R, X, Y, Z, W, A1, A2, A3 и Су имеют значения, указанные выше.
«Инертный растворитель» представляет собой, например, ароматический растворитель, такой как бензол, толуол, ксилол и пиридин; углеводородный растворитель, такой как гексан, пентан и циклогексан; галогенированный углеводородный растворитель, такой как дихлорметан, хлороформ, 1,2-дихлорэтан и четыреххлористый углерод; простой эфир, такой как тетрагидрофуран, диэтиловый эфир, 1,2-диметоксиэтан и 1,4-диоксан; сложный эфир, такой как этилацетат и этилформиат; спиртовый растворитель, такой как метанол, этанол, изопропиловый спирт, трет-бутиловый спирт и этиленгликоль; кетон, такой как ацетон и метилэтилкетон; амидный растворитель, такой как N,N-диметилформамид, N-метилпирролидон и N,N-диметилацетамид; сульфоксидный растворитель, такой как диметилсульфоксид; нитрильный растворитель, такой как ацетонитрил и пропионитрил; воду и гомогенную или негомогенную смесь таких растворителей. Такие инертные растворители соответственно выбирают в зависимости от различных условий реакций, известных специалистам в данной области техники.
«Основание» представляет собой, например, гидриды щелочного металла или щелочноземельного металла, такие как гидрид лития, гидрид натрия, гидрид калия и гидрид кальция; амиды щелочного металла или щелочноземельного металла, такие как амид лития, амид натрия, диизопропиламид лития, дициклогексиламид лития, гексаметилдисилазид лития, гексаметилдисилазид натрия и гексаметилдисилазид калия; низшие алкоксиды щелочного металла или щелочноземельного металла, такие как метоксид натрия, этоксид натрия и трет-бутоксид калия; алкиллитий, такой как бутиллитий, втор-бутиллитий, трет-бутиллитий и метиллитий; гидроксиды щелочного металла или щелочноземельного металла, такие как гидроксид натрия, гидроксид калия, гидроксид лития и гидроксид бария; карбонаты щелочного металла или щелочноземельного металла, такие как карбонат натрия, карбонат калия и карбонат цезия; гидрокарбонаты щелочного металла или щелочноземельного металла, такие как гидрокарбонат натрия и гидрокарбонат калия; амины, такие как триэтиламин, N-метилморфолин, N,N-диизопропилэтиламин, 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU), 1,5-диазабицикло[4.3.0]нон-5-ен (DBN) и N,N-диметиланилин; и гетероциклические соединения основного характера, такие как пиридин, имидазол и 2,6-лутидин. Такие основания соответственно выбирают в зависимости от различных условий реакций, известных специалистам в данной области техники.
«Кислота» представляет собой, например, неорганическую кислоту, такую как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота и фосфорная кислота, и органическую кислоту, такую как п-толуолсульфоновая кислота, метансульфоновая кислота, трифторуксусная кислота, муравьиная кислота и уксусная кислота. Такие кислоты соответственно выбирают в зависимости от различных условий реакций, известных специалистам в данной области техники.
[Способ получения 1]
Соединение (I) по настоящему изобретению можно получить способом, показанным на схеме 1.
(Схема 1)
[Формула 4]
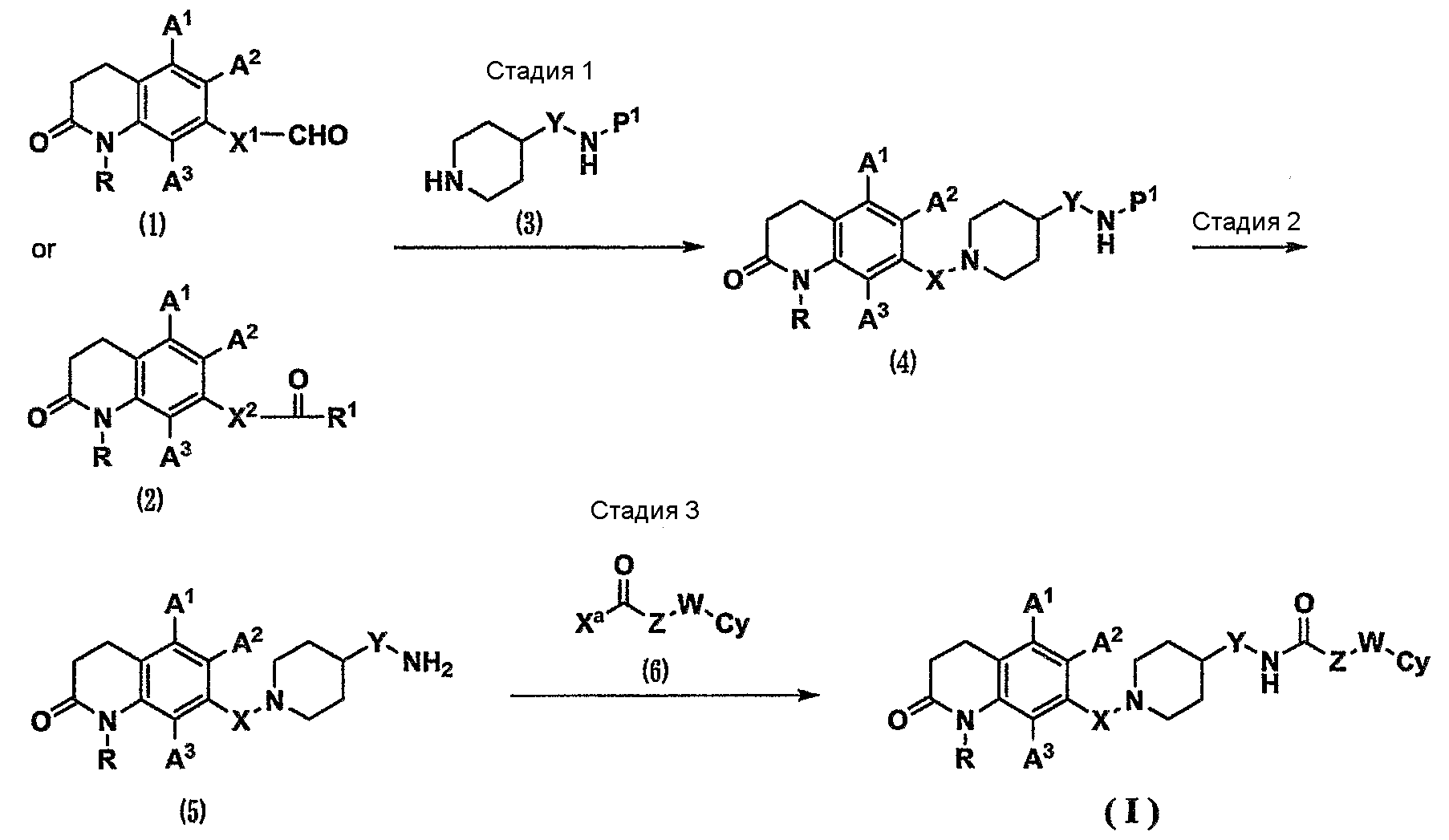
где Х1 представляет собой связь или С1-5-алкиленовую группу;
Х2 представляет собой связь или С1-4-алкиленовую группу;
Ха представляет собой атом галогена или гидроксильную группу;
R1 представляет собой С1-5-алкильную группу;
при условии, что сумма атомов углерода Х2 и R1 равна 1-5; и
Р1 представляет собой атом водорода или защитную группу для аминогруппы, такую как метоксикарбонильная группа, этоксикарбонильная группа, трет-бутоксикарбонильная группа, бензилоксикарбонильная группа, ацетильная группа или бензильная группа (см. Protective Groups in Organic Synthesis, the third edition, John Wiley & Sons, INC.).
Стадия 1. Карбонильное соединение (1) или (2) и амин (3) подвергают реакции восстановительного аминирования с использованием восстановителя в инертном растворителе и в присутствии кислоты или в ее отсутствие. В результате можно получить соединение (4) (см. Comprehensive Organic Transformations, 1989, VCH Publishers, INC.). Карбонильное соединение (1) или (2), используемое в данном случае, доступно как коммерчески доступное соединение. Кроме того, карбонильное соединение (1) или (2) можно синтезировать из коммерчески доступных соединений или известных соединений, используя различные способы органического синтеза, известные специалистам в данной области техники. Восстановитель, используемый в данном случае, представляет собой, например, триацетоксиборгидрид натрия, цианоборгидрид натрия и боргидрид натрия.
Стадия 2. Защитную группу Р1 для аминогруппы соединения (4) удаляют, используя различные способы органического синтеза, известные специалистам в данной области техники (см. Protective Groups in Organic Synthesis, the third edition, John Wiley & Sons, INC.). В результате можно получить амин (5). Кроме того, также в случае соединения (3), в котором Р1 представляет собой атом водорода, амин (5) можно получить непосредственно, осуществляя такую же реакцию восстановительного аминирования, как на стадии 1.
Стадия 3. Амин (5) и галоидангидрид (6), где Ха представляет собой атом галогена, или карбоновую кислоту (6), где Ха представляет собой гидроксильную группу, подвергают реакции амидирования в инертном растворителе и в присутствии основания или в его отсутствие. В результате можно получить соединение по настоящему изобретению (I). Галоидангидрид (6) или карбоновая кислота (6) являются доступными как коммерчески доступные соединения или известные соединения. Кроме того, галоидангидрид (6) или карбоновую кислоту (6) можно синтезировать из коммерчески доступных соединений или известных соединений, используя различные способы органического синтеза, известные специалистам в данной области техники. Реакция амидирования, используемая в данном случае, относится к реакции амидирования с использованием конденсирующего агента, такого как N,N'-дициклогексилкарбодиимид, гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида, дифенилфосфорилазид или карбонилдиимидазол, в инертном растворителе и в присутствии основания или в его отсутствие, или реакции амидирования через смешанный ангидрид с использованием этилхлоркарбоната, изобутилхлоркарбоната, пивалоилхлорида или подобного вещества (см. Fundamental and Experiment of Peptide Synthesis, 1985, Maruzen Co., Ltd.). В данном случае в реакции амидирования с использованием конденсирующего агента при необходимости можно использовать добавку, такую как 1-гидроксибензотриазол.
Кроме того, карбонильное соединение, которое является исходным веществом по схеме 1, можно получить как соединение (11) или (13) способом, показанным на схеме 2.
(Схема 2)
[Формула 5]
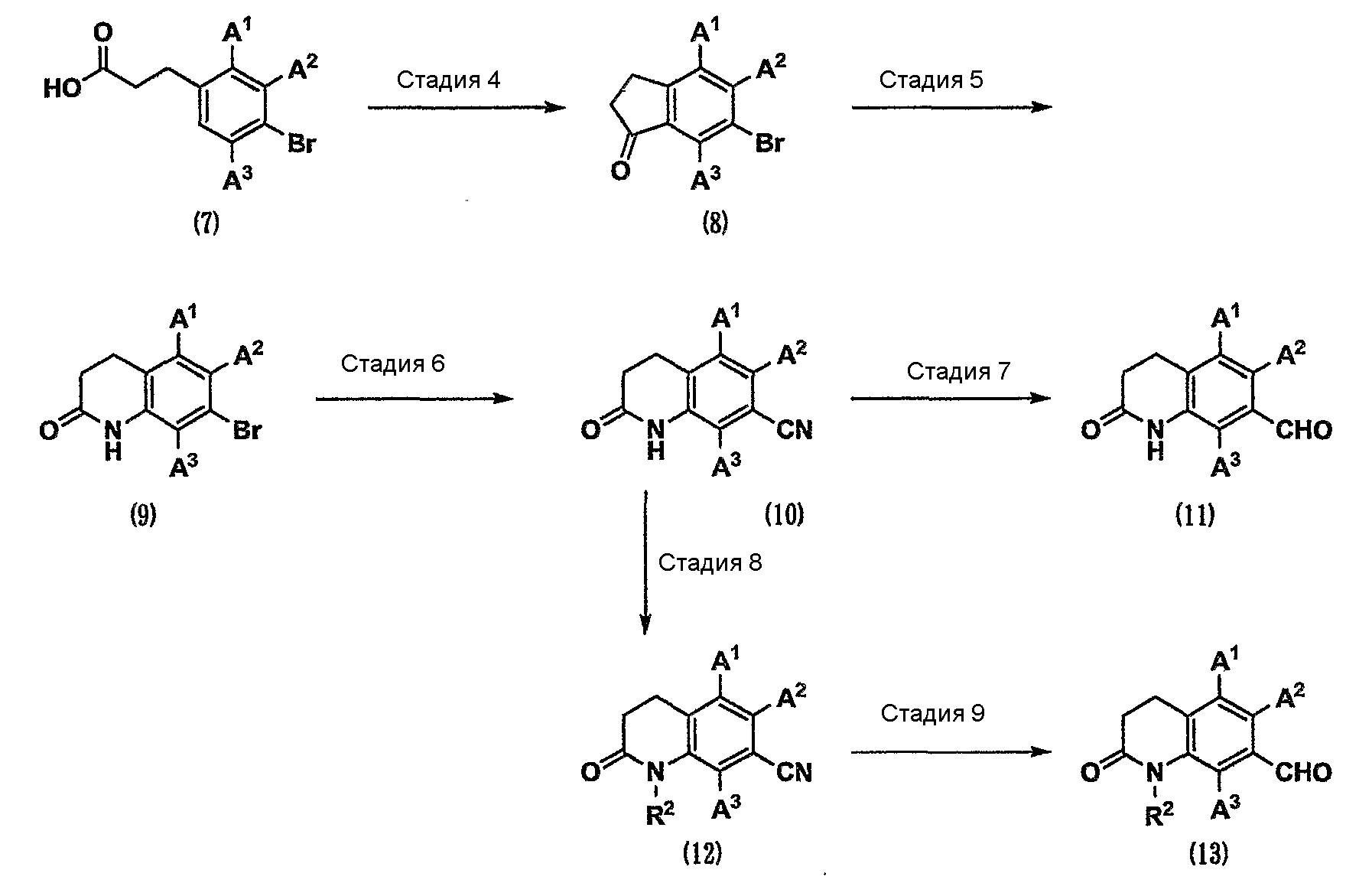
где R2 представляет собой С1-6-алкильную группу.
Стадия 4. Карбоновую кислоту (7) подвергают реакции Фриделя-Крафтса в присутствии кислотного катализатора. В результате можно получить карбонильное соединение (8). К кислотному катализатору, используемому в данном случае, относятся трихлорид алюминия, сульфонилхлорид и полифосфорная кислота (см. Tetrahedron, 2007, Vol.63, p. 389-395).
Стадия 5. Карбонильное соединение (8) подвергают реакции Шмидта (см. Strategic Applications of Named Reactions in Organic Synthesis, 2005, Elsevier, INC., или патент США № 2006/0063799) с использованием азида натрия или подобного вещества в присутствии кислотного катализатора, такого как метансульфоновая кислота, серная кислота, полифосфорная кислота и тетрахлорид титана. В результате можно получить амид (9).
Стадия 6. Соединение (9) вводят во взаимодействие с цианидом цинка, цианидом меди, цианидом калия или подобным соединением в присутствии палладиевого катализатора или в его отсутствие. В результате можно получить нитрил (10) (см. Tetrahedron, 2006, Vol.62, p. 4705-4708).
Стадия 7. Нитрил (10) восстанавливают в инертном растворителе в присутствии металлического катализатора. В результате можно получить карбонильное соединение (11) (см. Comprehensive Organic Transformations, 1989, VCH Publishers, INC., или международную публикацию WO 1996/20180). В качестве металлического катализатора используют никель Ренея и дихлорид олова и т.д.
Стадия 8. Нитрил (10) можно превратить в нитрил (12) различными реакциями алкилирования, известными специалистам в данной области техники (см. Comprehensive Organic Transformations, 1989, VCH Publishers, INC.).
Стадия 9. Нитрил (12) можно можно превратить в карбонильное соединение (13) таким же способом, как на стадии 7.
Кроме того, карбонильное соединение (1), которое является исходным веществом по схеме 1, можно получить как карбонильное соединение (17) способом, показанным на схеме 3.
(Схема 3)
[Формула 6]
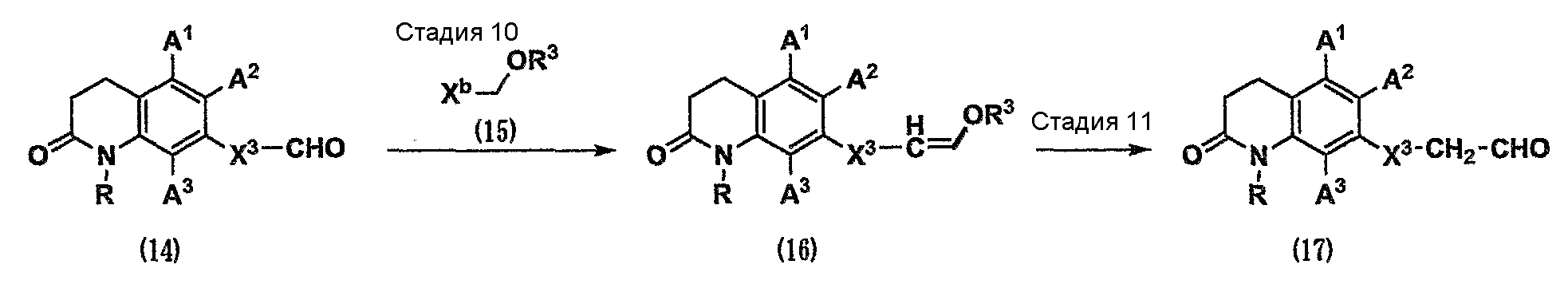
где Х3 представляет собой связь или С1-4-алкилен;
Xb представляет собой группу, используемую в реагенте Виттига или реагенте Хорнера-Эммонса (таком как соль фосфония или диэфир фосфорной кислоты, и т.д.); и
R3 представляет собой С1-6-алкильную группу.
Стадия 10. Карбонильное соединение (14) вводят во взаимодействие с реагентом Виттига или реагентом Хорнера-Эммонса (15) в инертном растворителе и в присутствии основания (см. Comprehensive Organic Transformations, 1989, VCH Publishers, INC.). В результате можно получить олефин (16).
Стадия 11. Олефин (16) можно превратить в карбонильное соединение (17) различными реакциями гидролиза, известными специалистам в данной области техники (см. Protective Groups in Organic Synthesis, the third edition, John Wiley & Sons, INC.).
Кроме того, карбонильное соединение (1), которое является исходным веществом по схеме 1, можно получить как карбонильное соединение (19) способом, показанным на схеме 4.
(Схема 4)
[Формула 7]
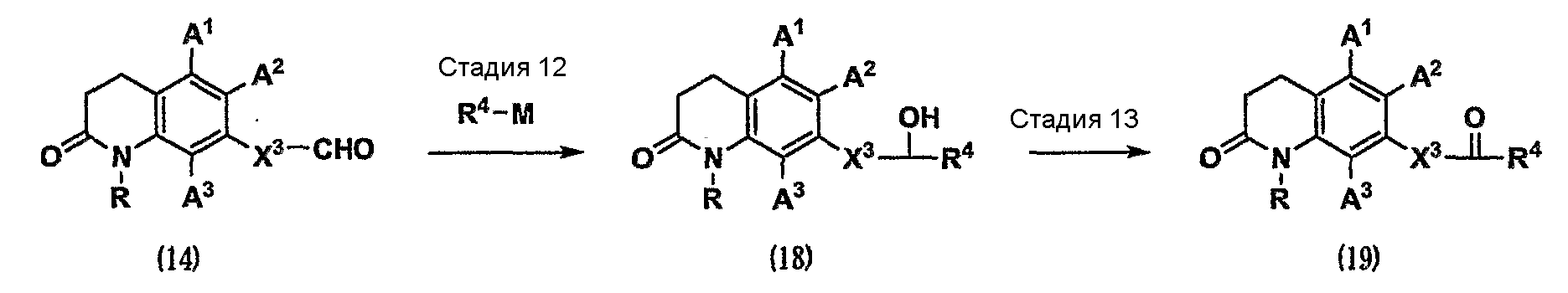
где Х3 имеет значения, указанные выше;
R4 представляет собой С1-5-алкильную группу;
при условии, что сумма атомов углерода в Х3 и R4 равна 1-5; и
М представляет собой металл, используемый в реакции алкилирования. Металл, используемый в данном случае, представляет собой, например, такой металл как галогенид лития и магния, и т.д.
Стадия 12. Карбонильное соединение (14) подвергают реакции алкилирования с использованием металлоорганического реагента, представленного формулой R4-M (см. Comprehensive Organic Transformations, 1989, VCH Publishers, INC.), в инертном растворителе. В результате можно получить соединение (18).
Стадия 13. Спирт (18) можно превратить в карбонильное соединение (19) реакцией окисления, известной специалистам в данной области техники (см. Oxidation in Organic Chemistry, 1990, American Chemical Society), в инертном растворителе. Реакция окисления, известная специалистам в данной области техники, относится, например, к реакции окисления хромовой кислотой с использованием дихромата пиридиния или хлорхромата пиридиния и т.д., реакции марганцевого окисления с использованием диоксида марганца и т.д., реакции диметилсульфоксидного окисления с использованием в качестве агента активации оксалилхлорида (окисление по Сверну) или дициклогексилкарбодиимида (окисление по Моффатту) и т.д., реакции 2,2,6,6-тетраметил-1-пиперидинилоксиокисления (окисление ТЕМРО) с использованием соокислителя, такого как гидрохлорит натрия, или реакции окисления с использованием реагента Десса-Мартина.
Кроме того, соединение (24), которое представляет собой карбонильное соединение (1), служащее в качестве исходного вещества по схеме 1, где, по меньшей мере, один из А1, А2 и А3 представляет собой атом галогена, можно получить способом, показанным на схеме 5.
(Схема 5)
[Формула 8]
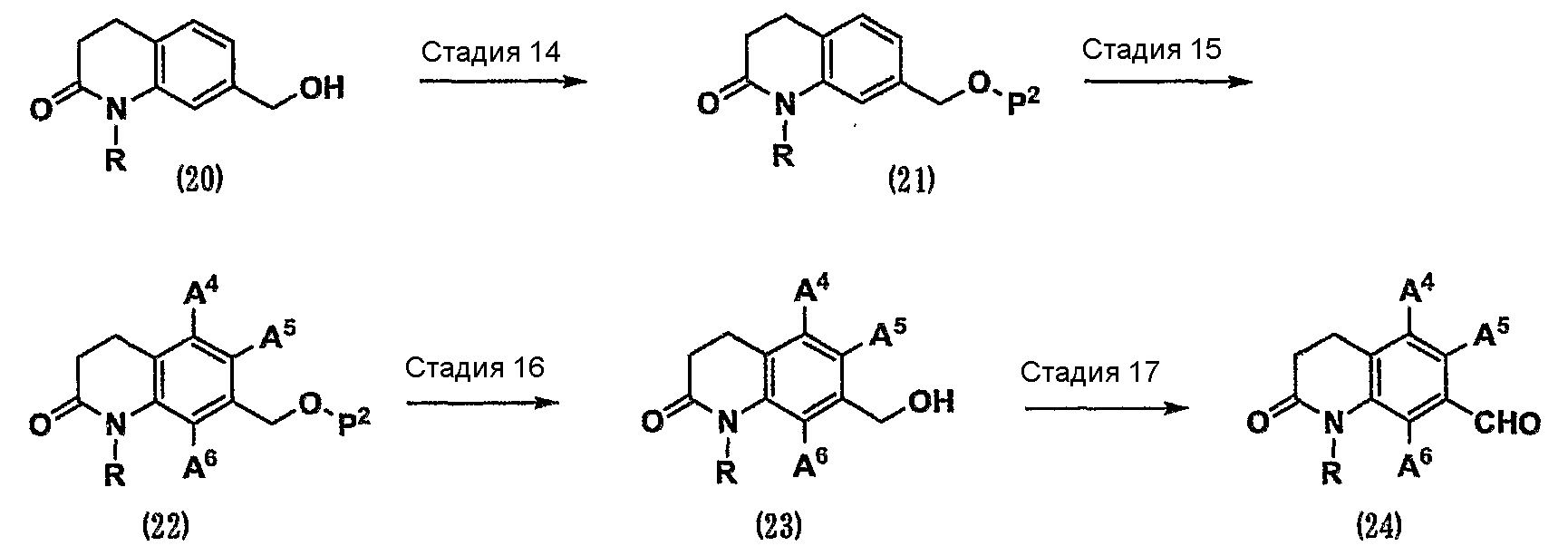
где А4, А5 и А6, которые могут быть одинаковыми или различными, представляют собой, каждый, атом водорода или атом галогена;
при условии, что, по меньшей мере, один из А4, А5 и А6 представляет собой атом галогена;
Р2 представляет собой защитную группу для гидроксильной группы, такую как трет-бутилдиметилсилильная группа, трет-бутилдифенилсилильная группа, тетрагидропиранильная группа, метоксиметильная группа, ацетильная группа, бензоильная группа или бензильная группа (см. Protective Groups in Organic Synthesis, the third edition, John Wiley & Sons, INC.).
Стадия 14. Гидроксильную группу спирта (20) защищают защитной группой, такой как трет-бутилдиметилсилильная группа, трет-бутилдифенилсилильная группа, тетрагидропиранильная группа, метоксиметильная группа, ацетильная группа, бензоильная группа или бензильная группа (см. Protective Groups in Organic Synthesis, the third edition, John Wiley & Sons, INC.). В результате можно получить соединение (21).
Стадия 15. Соединение (21) превращают в соединение (22), имеющее галогенный заместитель в ароматическом цикле, различными реакциями галогенирования, известными специалистам в данной области техники (см. Comprehensive Organic Transformations, 1989, VCH Publishers, INC., или Tetrahedron Letters, 1999, Vol.40, p. 2673-2676).
Стадия 16. Защитную группу Р2 соединения (22) удаляют с использованием различных процедур органического синтеза, известных специалистам в данной области техники (см. Protective Groups in Organic Synthesis, the third edition, John Wiley & Sons, INC.). В результате можно получить спирт (23).
Стадия 17. Спирт (23) можно превратить в карбонильное соединение (24) таким же способом, как на стадии 13.
[Способ получения 2]
Соединение (I) по настоящему изобретению можно получить способом, показанным на схеме 6.
(Схема 6)
[Формула 9]
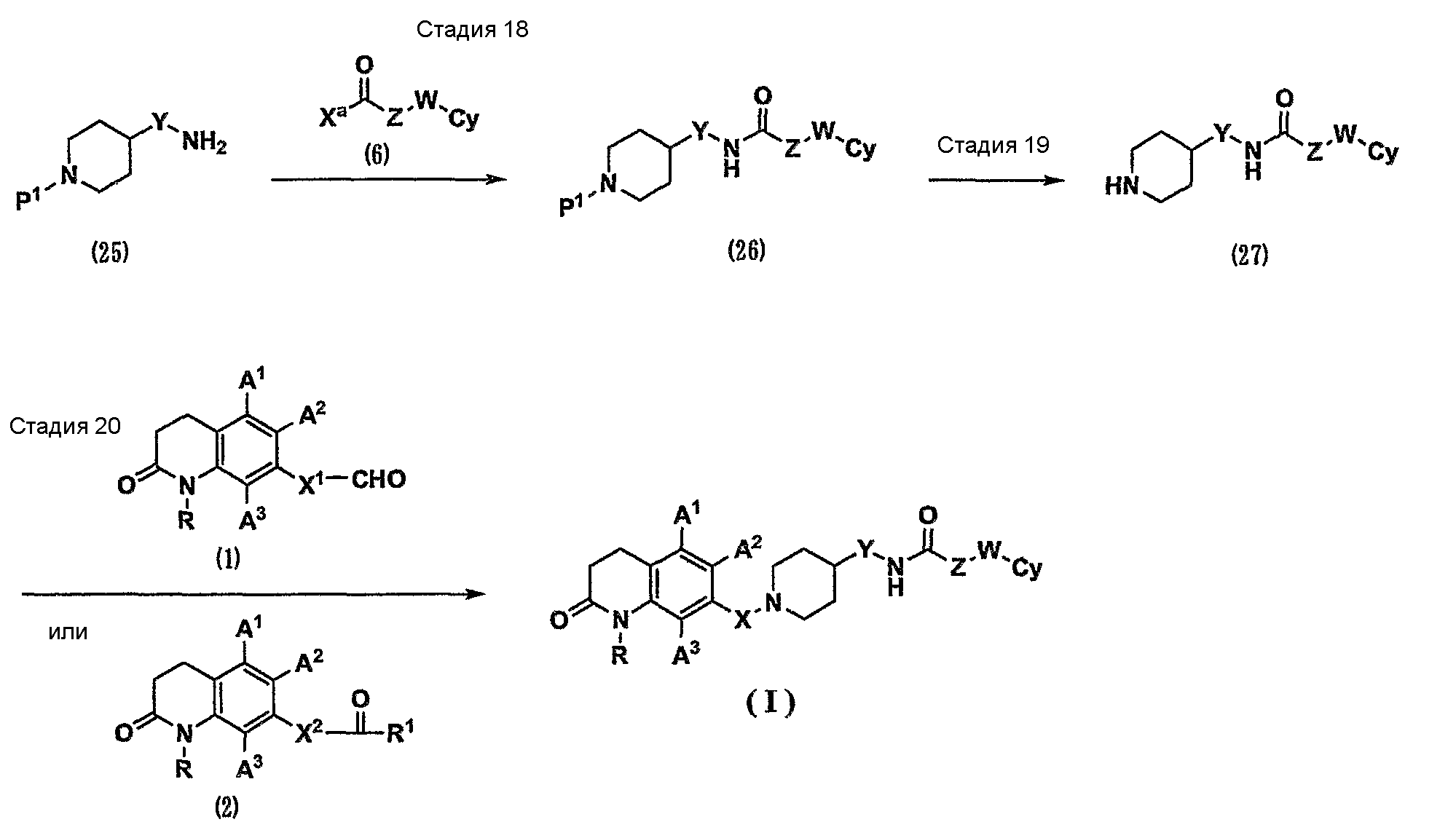
где Х1, Х2, Ха, R1 и Р1 имеют значения, указанные выше.
Стадия 18. Соединение (25) можно превратить в соединение (26) таким же способом, как на стадии 3 на схеме 1.
Стадия 19. Соединение (26) можно превратить в соединение (27) таким же способом, как на стадии 2 на схеме 1. Кроме того, также в случае соединения (25), где Р1 представляет собой атом водорода, осуществляют такую же реакцию амидирования, как на стадии 3 на схеме 1. В результате можно непосредственно получить соединение (27).
Стадия 20. Карбонильное соединение (1) или (2) подвергают реакции восстановительного аминирования с амином (27) таким же способом, как на стадии 1 на схеме 1. В результате можно получить соединение (I) по настоящему изобретению.
Кроме того, нитрил (10) на схеме 2 можно получить из фенольного соединения (28) способом, показанным на схеме 7.
(Схема 7)
[Формула 10]
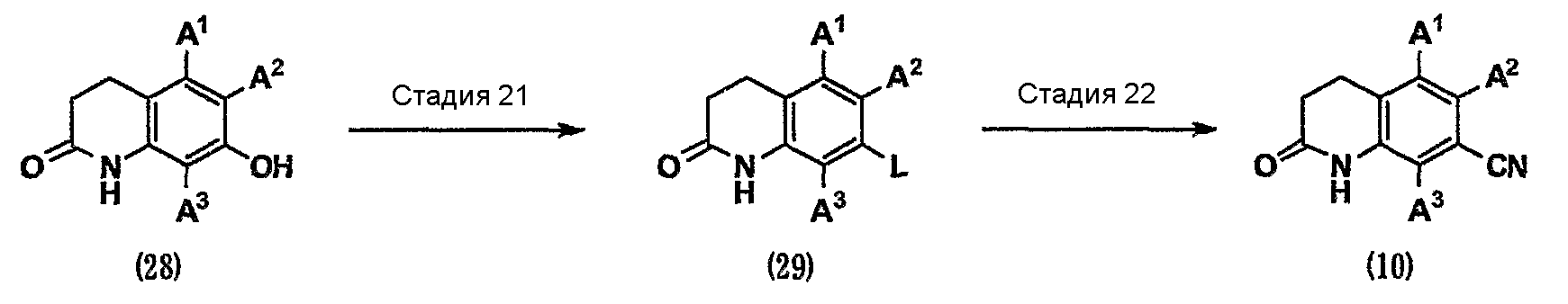
где L представляет собой удаляемую группу, такую как атом галогена, метансульфонилоксигруппа, трифторметансульфонилоксигруппа или п-толуолсульфонилоксигруппа, и т.д.
Стадия 21. Фенольное соединение (28), используемое в данном случае, доступно как коммерчески доступное соединение или известное соединение. Кроме того, фенольное соединение (28) можно синтезировать из коммерчески доступных соединений или известных соединений с использованием способов органического синтеза, известных специалистам в данной области техники. Когда L представляет собой атом галогена, соединение (29) можно получить, осуществляя реакцию галогенирования гидроксильной группы соединения (28) агентом галогенирования, таким как бром или оксалилхлорид, в инертном растворителе в присутствии триметилфосфина, трибутилфосфина, трифенилфосфина или подобного соединения, или осуществляя реакцию галогенирования гидроксильной группы агентом галогенирования, таким как тионилхлорид, трихлорид фосфора, пентахлорид фосфора, трибромид фосфора, пентабромид фосфора или оксихлорид фосфора, в инертном растворителе или без него в присутствии основания или в его отсутствие. С другой стороны, когда L представляет собой метансульфонилоксигруппу, трифторметансульфонилоксигруппу или п-толоулсульфонилоксигруппу, соединение (29) можно получить взаимодействием гидроксильной группы соединения (28) с метансульфонилхлоридом, метансульфоновым ангидридом, трифторметансульфоновым ангидридом, N-фенилбис(трифторметансульфонимидом) или п-толоулсульфонилхлоридом, в инертном растворителе в присутствии основания или в его отсутствие [см. Comprehensive Organic Transformations, 1989, VCH Publishers, INC.].
Стадия 22. Соединение (29) можно превратить в нитрил (10) таким же способом, как на стадии 6 на схеме 2.
Когда соединение (I) по настоящему изобретению образует соль и используется как лекарственное средство, соль предпочтительно представляет собой фармацевтически приемлемую соль. Как фармацевтически приемлемую соль можно использовать, например, соль с неорганической кислотой, такую как гидрохлорид, сульфат, гидробромат, нитрат или фосфат; или соль с органической кислотой, такую как ацетат, оксалат, лактат, цитрат, малат, тартрат, малеат, фумарат, сукцинат, соль метансульфоновой кислоты, этансульфонат, бензолсульфонат или п-толуолсульфонат; однако фармацевтически приемлемая соль не ограничивается указанными примерами.
Кроме того, как фармацевтически приемлемую соль можно упомянуть соль щелочного металла (например, натриевую соль, калиевую соль), щелочноземельного металла (например, кальциевую соль, магниевую соль, бариевую соль), соль с неорганическим основанием, такую как соль алюминия, или соль с органическим основанием, таким как триметиламин, триэтиламин, пиридин, пиколин, этаноламин, диэтаноламин, триэтаноламин, дициклогексиламин или N,N-дибензилэтилендиамин.
Когда соединение (I) по настоящему изобретению включает оптический изомер, стереоизомер, региоизомер и поворотный изомер, в соединение по настоящему изобретению включаются отдельные соединения и их смеси. Кроме того, когда соединение (I) по настоящему изобретению образует гидрат или сольват, они также включаются в объем изобретения. Кроме того, соединение (I) по настоящему изобретению может быть помечено изотопом (например, D, 3H, 13C, 14C, 15N, 35S, 125I и т.д.).
Как антагонист рецептора МСН, так и лекарственное средство по настоящему изобретению получают формулированием в препарат хорошо известным способом соединения (I) по настоящему изобретению, его фармацевтически приемлемой соли или гидрата как такового или вместе с фармакологически приемлемым носителем. В качестве фармакологически приемлемого носителя можно упомянуть различные типы органических и неорганических веществ, обычно используемых в качестве материалов для препаратов. Например, можно упомянуть эксципиент, используемый в твердых препаратах (например, лактозу, белый сахар, D-маннит, крахмал, кукурузный крахмал, кристаллическую целлюлозу, легкий ангидрид кремниевой кислоты), смазывающее вещество (например, стеарат магния, стеарат кальция, тальк, коллоидный диоксид кремния), связующее вещество (например, кристаллическую целлюлозу, белый сахар, D-маннит, декстрин, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, поливинилпирролидон, крахмал, сахарозу, желатин, метилцеллюлозу, натрийкарбоксиметилцеллюлозу), вещество, способствующее рассыпанию (например, сахарозу, карбоксиметилцеллюлозу, кальций-карбоксиметилцеллюлозу, натрий-кросскармелозу, натрий-карбоксиметилкрахмал, гидроксипропилцеллюлозу с низкой степенью замещения), или растворитель, используемый в жидких препаратах (например, воду для инъекций, спирт, пропиленгликоль, макроголь, кунжутное масло, кукурузное масло), солюбилизатор (например, полиэтиленгликоль, пропиленгликоль, D-маннит, бензилбензоат, этанол, трисаминометан, холестерин, триэтаноламин, карбонат натрия, цитрат натрия), суспендирующее вещество (например, поверхностно-активное вещество, такое как стеарилтриэтаноламин, лаурилсульфат натрия, лауриламинопропионат, лецитин, хлорид бензалкония, хлорид бензетония и моностеарат глицерина, или гидрофильный полимер, такой как поливиниловый спирт, поливинилпирролидон, натрий-карбоксиметилцеллюлоза, метилцеллюлоза, гидроксиметилцеллюлоза и гидроксипропилцеллюлоза), вещество, придающее тоничность (например, глюкозу, D-сорбит, хлорид натрия, глицерин, D-маннит), буфер (например, фосфатный, ацетатный, карбонатный, цитратный) или смягчающее вещество (например, бензиловый спирт) и т.д. Кроме того, при получении препарата при необходимости можно использовать антисептик (например, параоксибензоаты, хлорбутанол, бензиловый спирт, фенетиловый спирт, дегидроацетовую кислоту, сорбиновую кислоту), антиоксидант (например, сульфит, аскорбиновую кислоту), краситель, подслащивающее вещество, адсорбент и увлажняющее вещество и т.д.
Антагонист рецептора МСН и лекарственное средство по настоящему изобретению можно вводить перорально или парентерально (например, внутривенной, местной, ректальной инъекцией). Примеры лекарственной формы включают таблетки (в том числе таблетки с сахарным покрытием и пленочным покрытием), порошки, гранулы, дустовые композиции, пастилки, капсулы (в том числе, мягкие капсулы), жидкости, препарат для инъекции (например, подкожной инъекции, внутримышечной инъекции, интраперитонеальной инъекции), наружные препараты (например, средство для трансназального введения, трансдермальный препарат, мазь, крем), суппозитории (например, ректальный суппозиторий, вагинальный суппозиторий), средства с отсроченным высвобождением (например, микрокапсулу с отсроченным высвобождением), пилюли и капли. Все формы можно получать обычными методами получения (например, методами, описанными в 15-м исправленном издании фармакопеи Японии).
Дозу антагониста рецептора МСН и лекарственного средства по настоящему изобретению соответственно выбирают в зависимости от цели введения, способа введения, заболевания, возраста пациента, массы тела и симптомов. Например, когда лечат взрослого пациента, доза составляет 1-2000 мг в сутки. Дозу вводят однократно в сутки или раздельно по частям.
Когда антагонист рецептора МСН используют в качестве активного ингредиента лекарственного средства, следует отметить, что предполагается применение не только для людей, но также для других млекопитающих. Например, согласно последним достижениям в области заботы о здоровье животных считается, что антагонист рецептора МСН можно использовать для лечения ожирения у домашних животных (например, кошек, собак) и также использовать для других домашних животных (например, животных, годных в пищу, таких как коровы, домашняя птица, рыба), заболевание или расстройство которых неизвестно.
ПРИМЕРЫ
Настоящее изобретение будет конкретнее описываться с помощью приведенных далее примеров; однако, указанные примеры не следует рассматривать как ограничивающие изобретение, и они могут быть модифицированы в объеме изобретения.
«Комнатная температура» в связи с примерами представляет 0°С-40°С. «Силикагель 60 N» и «Chromatorex NH», используемые при очистке с применением колоночной хроматографии, коммерчески доступны от Kanto Chemical Co., Inc., и Fuji Silysia, соответственно.
В примерах данные, которые получены с помощью аппаратуры, получают с помощью измерительной аппаратуры, указанной далее.
Спектры МС: Shimadzu LCMS-2010EV или micromass Platform LC.
Спектры ЯМР: 600 МГц (JNM-ECA 600, JEOL Ltd.) или 200 МГц (GEMINI 2000/200, Varian Inc.).
Соединения в примерах называют согласно ACD/Name (ACD/Labs 11.00, Advanced Chemistry Development Inc).
Аббревиатуры, используемые в примерах, указаны ниже:
Ас2О (уксусный ангидрид), АсОН (уксусная кислота), APCI (химическая ионизация при атмосферном давлении), ушс (уширенный синглет), CDCl3 (дейтерированный хлороформ), CHCl3 (хлороформ), CH3CN (ацетонитрил), д (дублет), дд (двойной дублет), ддд (двойной двойной дублет), DMAP (N,N-диметил-4-аминопиридин), ДМФА (N,N-диметилформамид), ДМСО-d6 (дейтерированный диметилсульфоксид), дт (двойной триплет), EDC [1-этил-2-(3-диметиламинопропил)карбодиимид], EI (ионизация электронным ударом), ESI (ионизация электронным распылением), Et3N (триэтиламин), Et2O (диэтиловый эфир), EtOAc (этилацетат), EtOH (этанол), Н (протон), HCl (гидрохлорид или хлороводородная кислота), Н2О (вода), HOBt (1-гидроксибензотриазол), Гц (герц), IPA (изопропиловый спирт), IPE (изопропиловый эфир), J (константа взаимодействия), К2СО3 (карбонат калия), м (мультиплет), MeI (метилиодид), MeMgBr (метилмагнийбромид), МеОН (метанол), МеОН-d4 (дейтерированный метанол), MgSO4 (сульфат магния), MnO2 (диоксид марганца), МС (масс-спектрометрия), NaBH4 (борогидрид натрия), NaH (гидрид натрия), NaHCO3 (гидрокарбонат натрия), Na2SO4 (сульфат натрия), NH4Cl (хлорид аммония), ЯМР (спектроскопия ядерного магнитного резонанса), NaBH(OAc)3 (триацетоксиборгидрид натрия), NaNH2 (амид натрия), NaOH (гидроксид натрия), Pd2(dba)3 [трис(дибензилиденацетон)дипалладий], Ph3PCH2OMe•Br [бромид (метоксиметил)трифенилфосфония], изоPr2Net (диизопропилэтиламин), к (квартет), с (синглет), т (триплет), тд (тройной дублет), ТГФ (тетрагидрофуран), TMEDA (тетраметилэтилендиамин), об./об. (объем/объем), ксантфос [4,5-бис(дифенилфосфино)-9,9-диметилксантен].
Пример 1. Синтез 3-метокси-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамида
Стадия 1-1. К сульфонилхлориду (1,19 л) при охлаждении льдом добавляют 3-(4-бромфенил)пропановую кислоту (91,1 г), и смесь перемешивают в течение 2 часов. При охлаждении льдом реакционную смесь постепенно добавляют к Н2О (2,00 л), и смесь экстрагируют 6 раз CHCl3. Объединенные органические слои промывают насыщенным водным раствором NaHCO3, сушат над Na2SO4 и концентрируют при пониженном давлении. К полученному остатку добавляют МеОН и смесь кипятят с обратным холодильником в течение 30 минут. Твердое вещество отделяют фильтрацией и получают твердое вещество А. Фильтрат концентрируют при пониженном давлении и получают таким способом твердое вещество В. Затем фильтрат снова концентрируют при пониженном давлении, и получают таким способом твердое вещество С. Твердые вещества А, В и С объединяют и получают 6-бром-2,3-дигидро-1Н-инден-1-он (59,3 г, светло-желтое твердое вещество).
1H ЯМР (600 МГц, CDCl3, δ): 2,66-2,75 (м, 2H), 3,04-3,12 (м, 2H), 7,36 (д, J=8,3 Гц, 1H), 7,67 (дд, J=8,0, 2,1 Гц, 1H), 7,86 (д, J=1,8 Гц, 1H); ESI/APCI МС m/z 210 [М+H]+.
Стадия 1-2. К раствору в CHCl3 (560 мл) полученного на стадии 1-1 соединения (39,5 г) и метансульфоновой кислоты (122 мл) при охлаждении льдом добавляют по частям азид натрия (36,5 г), и затем смесь кипятят с обратным холодильником в течение 2,5 часов. При охлаждении льдом реакционную смесь добавляют к Н2О (400 мл), доводят рН до 9 28% водным раствором аммиака, и смесь экстрагируют CHCl3 три раза. Объединенные органические слои сушат над Na2SO4 и концентрируют при пониженном давлении. Затем остаток очищают колоночной хроматографией (силикагель 60 N, подвижная фаза EtOAc/гексан = 50/50-75/25, об./об.). Полученное твердое вещество суспендируют в смеси EtOAc/гексан (1/1, об./об.), и смесь перемешивают при комнатной температуре в течение одного часа. Твердое вещество отделяют фильтрацией, и получают 7-бром-3,4-дигидрохинолин-2(1Н)-он (15,5 г, светло-желтое твердое вещество).
1H ЯМР (200 МГц, CDCl3, δ): 2,59-2,68 (м, 2H), 2,88-2,97 (м, 2H), 6,91-7,16 (м, 3H), 8,27 (ушир.с, 1H); ESI/APCI MC m/z 226 [M+H]+.
Стадия 1-3. К раствору в ДМФА (14,5 мл) полученного на стадии 1-2 соединения (3,00 г) добавляют цианид цинка (1,04 г), Pd2(dba)3 (122 мг), ксантфос (154 мг) и TMEDA (590 мкл) и смесь перемешивают при воздействии микроволнового излучения (180°С) в течение 5 минут. К реакционной смеси добавляют CHCl3, и смесь фильтруют через целит, который промывают ДМФА. Фильтрат концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией (силикагель 60 N, подвижная фаза EtOAc/гексан = 50/50-100/0, об./об.). К полученному твердому веществу при комнатной температуре добавляют EtOAc и смесь перемешивают в течение 30 минут. Твердое вещество отделяют фильтрацией и промывают EtOAc, и получают 2-оксо-1,2,3,4-тетрагидрохинолин-7-карбонитрил (15,5 г, светло-желтое твердое вещество).
1H ЯМР (600 МГц, CDCl3, δ): 2,64-2,68 (м, 2H), 3,00-3,04 (м, 2H), 7,04 (с, 1H), 7,23-7,29 (м, 2H), 8,46 (ушир.с, 1H); ESI/APCI MC m/z 173 [M+H]+.
Стадия 1-4. К раствору в муравьиной кислоте (250 мл) полученного на стадии 1-3 соединения (32,6 г) добавляют катализатор никель Ренея (50,0 г), и смесь перемешивают при 50°С в течение 2 часов. После фильтрации реакционной смеси через целит фильтрат концентрируют при пониженном давлении. К остатку добавляют насыщенный водный раствор NaHCO3, смесь доводят до рН 6 и фильтруют, и получают твердое вещество А. Фильтрат экстрагируют три раза CHCl3, и объединенные органические слои сушат над Na2SO4 и концентрируют при пониженном давлении. Остаток и твердое вещество А объединяют и суспендируют в смеси EtOAc/CHCl3/ацетон (10/10/1, об./об./об.), смесь перемешивают при комнатной температуре в течение одного часа и фильтруют, и получают 2-оксо-1,2,3,4-тетрагидрохинолин-7-карбальдегид (19,8 г, светло-желтое твердое вещество).
1H ЯМР (200 МГц, CDCl3, δ): 2,65-2,76 (м, 2H), 3,02-3,13 (м, 2H), 7,31-7,38 (м, 2H), 7,49-7,55 (м, 1H), 9,13 (ушир.с, 1H), 9,95 (с, 1H); ESI/APCI MC m/z 176 [M+H]+.
Стадия 1-5. Раствор в CHCl3 (450 мл) полученного на стадии 1-4 соединения (19,8 г) и трет-бутилпиперидин-4-илкарбамата (24,8 г) перемешивают при 70°С в течение 1,5 часов и охлаждают до комнатной температуры. Затем к смеси при охлаждении льдом добавляют NaBH(OAc)3 (35,9 г), и смесь перемешивают при комнатной температуре в течение 12 часов. К реакционной смеси добавляют насыщенный водный раствор NaHCO3, и затем водный слой и органический слой разделяют. Водный слой экстрагируют три раза CHCl3. Объединенные органические слои сушат над Na2SO4 и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией (силикагель 60 N, подвижная фаза МеОН/CHCl3 = 33/66-100/0, об./об.), и получают трет-бутил-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}карбамат (37,8 г, бесцветное твердое вещество).
1H ЯМР (600 МГц, CDCl3, δ): 1,35-1,51 (м, 11H), 1,82-1,96 (м, 2H), 2,07 (т, J=10,5 Гц, 2H), 2,49-2,66 (м, 2H), 2,78 (ушир.с, 2H), 2,93 (т, J=7,6 Гц, 2H), 3,29-3,55 (м, 3H), 4,48 (ушир.с, 1H), 6,76 (с, 1H), 6,90 (д, J=7,3 Гц, 1H), 7,08 (д, J=7,8 Гц, 1H), 8,37 (ушир.с, 1H); ESI/APCI MC m/z 360 [M+H]+.
Стадия 1-6. К раствору в EtOAc (130 мл) полученного на стадии 1-5 соединения (37,8 г) при охлаждении льдом добавляют 4М раствор HCl в EtOAc (263 мл), и смесь перемешивают при комнатной температуре в течение одного часа. Реакционную смесь концентрируют при пониженном давлении. Остаток суспендируют в EtOAc (200 мл), смесь фильтруют и получают твердое вещество. К твердому веществу добавляют CHCl3 (200 мл) и Н2О (200 мл), и смесь перемешивают в течение 15 минут. После разделения водного слоя и органического слоя водный слой дважды промывают CHCl3. К водному слою добавляют 2М водный раствор NaOH для доведения рН до 10 и затем раствор экстрагируют 30 раз CHCl3. Объединенные органические слои сушат над Na2SO4 и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией (Chromatorex NH, подвижная фаза МеОН/CHCl3 = 1/4, об./об.), и получают 7-[(4-аминопиперидин-1-ил)метил]-3,4-дигидрохинолин-2(1Н)-он (17,9 г, бесцветное твердое вещество).
1H ЯМР (600 МГц, CDCl3, δ): 1,32-1,49 (м, 2H), 1,74-1,88 (м, 2H), 1,93-2,09 (м, 2H), 2,54-2,70 (м, 3H), 2,80 (д, J=11,9 Гц, 2H), 2,93 (т, J=7,6 Гц, 2H), 3,41 (с, 2H), 6,74 (с, 1H), 6,90 (д, J=9,2 Гц, 1H), 7,07 (д J=7,3 Гц, 1H), 8,28 (ушир.с, 1H); ESI/APCI MC m/z 260 [M+H]+.
Стадия 1-7. К раствору в CHCl3 (5,00 мл) полученного на стадии 1-6 соединения (250 мг) добавляют изоPr2NEt (370 мкл) и 3-метоксибензоилхлорид (180 мг) и смесь перемешивают при комнатной температуре в течение трех суток. К реакционной смеси добавляют насыщенный водный раствор NaHCO3, и раствор экстрагируют CHCl3 четыре раза. Объединенные органические слои сушат над Na2SO4 и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией [(силикагель 60 N, подвижная фаза МеОН/CHCl3 = 0/100-10/90, об./об.) и (Chromatorex NH, подвижная фаза CHCl3) в указанном порядке], и получают твердое вещество. К полученному твердому веществу при комнатной температуре добавляют IPA, смесь перемешивают в течение одного часа, фильтруют и промывают IPA и гексаном, и получают названное в заголовке соединение (159 мг, бесцветное твердое вещество).
1H ЯМР (600 МГц, CDCl3, δ): 1,48-1,62 (м, 2H), 1,94-2,06 (м, 2H), 2,10-2,21 (м, 2H), 2,57-2,67 (м, 2H), 2,78-2,87 (м, 2H), 2,90-2,99 (м, 2H), 3,44 (с, 2H), 3,85 (с, 3H), 3,94-4,05 (м, 1H), 6,01 (д, J=7,8 Гц, 1H), 6,74 (с, 1H), 6,91 (д, J=7,3 Гц, 1H), 7,02 (дд, J=7,6, 2,1 Гц, 1H), 7,09 (д, J=7,8 Гц, 1H), 7,21-7,27 (м, 1H), 7,29-7,35 (м, 2H), 7,85 (с, 1H); ESI/APCI MC m/z 394 [M+H]+.
Пример 2. Синтез моногидрата моногидрохлорида 3-метокси-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамида
К суспензии в EtOAc (1,70 мл) полученного на стадии 1-7 соединения (167 мг) добавляют 4М раствор HCl в EtOAc (140 мкл), смесь перемешивают при комнатной температуре в течение 1,5 часов и фильтруют, и получают названное в заголовке соединение (160 мг, бесцветное твердое вещество).
1H ЯМР (600 МГц, MeOH-d4, δ): 1,98 (ушир.с, 2H), 2,18 (ушир.с, 2H), 2,53-2,62 (м, 2H), 2,98 (т, J=7,6 Гц, 2H), 3,03-3,19 (м, 2H), 3,50 (ушир.с, 2H), 3,81 (с, 3H), 4,11 (ушир.с, 1H), 4,23 (ушир.с, 2H), 6,98 (с, 1H), 7,05-7,15 (м, 2H), 7,27-7,39 (м, 4H); ESI/APCI MC m/z 394 [M(свободный)+H]+
Соединения примера 3 - примера 30 получают таким же способом, как в примере 1.
|
|
|
|
|
|
|
|
|
|
Пример 31. Синтез 3-хлор-4-фтор-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамида
К раствору в ДМФА (2,50 мл) полученного на стадии 1-6 соединения (250 мг) добавляют 3-хлор-4-фторбензойную кислоту (191 мг), Et3N (320 мкл), HOBt•H2O (222 мг) и EDC•HCl (222 мг), и смесь перемешивают при комнатной температуре в течение трех суток. К реакционной смеси добавляют насыщенный водный раствор NaHCO3 и раствор экстрагируют четыре раза CHCl3. Объединенные органические слои сушат над Na2SO4 и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией [(силикагель 60 N, подвижная фаза МеОН/CHCl3 = 0/100-10/90, об./об.) и (Chromatorex NH, подвижная фаза CHCl3) в указанном порядке]. Добавляют при комнатной температуре IPA, и смесь перемешивают в течение одного часа. Выпавшее в осадок вещество отделяют фильтрацией и промывают IPA и гексаном, и получают названное в заголовке соединение (263 мг, бесцветное твердое вещество).
1H ЯМР (600 МГц, CDCl3, δ): 1,53-1,64 (м, 2H), 1,96-2,04 (м, 2H), 2,10-2,20 (м, 2H), 2,58-2,67 (м, 2H), 2,80-2,90 (м, 2H), 2,94 (т, J=7,6 Гц, 2H), 3,45 (с, 2H), 3,93-4,04 (м, 1H), 6,18 (ушир.с, 1H), 6,77 (с, 1H), 6,90 (д, J=7,3 Гц, 1H), 7,10 (д, J=7,8 Гц, 1H), 7,18 (т, J=8,7 Гц, 1H), 7,67 (ддд, J=8,6, 4,5, 2,1 Гц, 1H), 7,83-7,95 (м, 2H); ESI/APCI MC m/z 416 [M+H]+.
Соединения примеров 32-47 получают таким же способом, как в примере 31.
|
|
|
|
|
|
Пример 48. Синтез 3-хлор-4-фтор-N-{1-[(1-метил-2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамида
Стадия 48-1. К раствору в ДМФА (20 мл) соединения (1,25 г), полученного на стадии 1-3, при охлаждении льдом добавляют NaH (0,29 г), и смесь перемешивают в течение 30 минут. К смеси добавляют MeI (1,12 г), и смесь перемешивают при комнатной температуре в течение 12 часов. После добавления воды реакционную смесь экстрагируют три раза EtOAc. Объединенные органические слои промывают водой и рассолом, сушат над MgSO4 и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией (силикагель 60 N, подвижная фаза EtOAc/гексан = 30/70-50/50, об./об.), и получают 1-метил-2-оксо-1,2,3,4-тетрагидрохинолин-7-карбонитрил (0,94 г, бесцветное твердое вещество).
1H ЯМР (600 МГц, CDCl3, δ): 2,64-2,73 (м, 2H), 2,92-3,04 (м, 2H), 3,37 (с, 3H), 7,21-7,23 (м, 1H), 7,26-7,29 (м, 1H), 7,31-7,34 (м, 1H); EI MC m/z 186 [M]+.
Стадия 48-2. Из соединения (0,92 г), полученного на стадии 48-1, получают 1-метил-2-оксо-1,2,3,4-тетрагидрохинолин-7-карбальдегид (0,93 г, светло-желтое масло) таким же способом, как на стадии 1-4.
1H ЯМР (600 МГц, CDCl3, δ): 2,69-2,75 (м, 2H), 3,00-3,06 (м, 2H), 3,45 (с, 3H), 7,35-7,40 (м, 1H), 7,51-7,53 (м, 1H), 7,54-7,57 (м, 1H), 10,02 (с, 1H); EI MC m/z 189 [M]+.
Стадия 48-3. К раствору в CHCl3 (20 мл) соединения (0,93 г), полученного на стадии 48-2, при комнатной температуре добавляют трет-бутилпиперидин-4-илкарбамат (0,82 г) и АсОН (0,27 г) и NaBH(OAc)3 (1,30 г), и смесь перемешивают при комнатной температуре в течение 12 часов. После добавления насыщенного водного раствора NaHCO3 водный слой и органический слой разделяют. Водный слой экстрагируют три раза CHCl3. Объединенные органические слои сушат над Na2SO4 и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией (Chromatorex NH, подвижная фаза EtOAc/гексан = 50/50, об./об.), и получают трет-бутил-{1-[(1-метил-2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}карбамат (0,78 г, бесцветное аморфное вещество).
1H ЯМР (600 МГц, CDCl3, δ): 1,37-1,44 (м, 2H), 1,45 (с, 9H), 1,84-1,97 (м, 2H), 2,07-2,13 (м, 2H), 2,60-2,68 (м, 2H), 2,75-2,84 (м, 2H), 2,85-2,91 (м, 2H), 3,36 (с, 3H), 3,42-3,55 (м, 3H), 4,44 (ушир.с, 1H), 6,91-6,98 (м, 2H), 7,09 (д, J=7,3 Гц, 1H); ESI/APCI MC m/z 374 [M+H]+.
Стадия 48-4. Из соединения (0,77 г), полученного на стадии 48-3, получают 7-[(4-аминопиперидин-1-ил)метил]-1-метил-3,4-дигидрохинолин-2(1Н)-он (0,57 г, бесцветное твердое вещество) таким же способом, как на стадии 1-6.
1H ЯМР (600 МГц, CDCl3, δ): 1,33-1,45 (м, 2H), 1,76-1,82 (м, 2H), 2,00-2,07 (м, 2H), 2,58-2,67 (м, 2H), 2,66-2,71 (м, 1H), 2,79-2,85 (м, 2H), 2,86-2,90 (м, 2H), 3,37 (с, 3H), 3,48 (с, 2H), 6,95 (д, J=7,8 Гц, 1H), 6,98 (с, 1H), 7,09 (д, J=7,3 Гц, 1H); ESI/APCI MC m/z 274 [M+H]+.
Стадия 48-5. Из соединения (200 мг), полученного на стадии 48-4, и 3-хлор-4-фторбензойной кислоты (141 мг) получают названное в заголовке соединение таким же способом, как в примере 31.
1H ЯМР (600 МГц, CDCl3, δ): 1,51-1,58 (м, 2H), 1,98-2,05 (м, 2H), 2,18 (т, J=10,8 Гц, 2H), 2,60-2,68 (м, 2H), 2,83-2,91 (м, 4H), 3,36 (с, 3H), 3,50 (с, 2H), 3,94-4,02 (м, 1H), 5,89 (д, J=7,8 Гц, 1H), 6,95 (д, J=7,3 Гц, 1H), 6,96-6,99 (м, 1H), 7,09 (д, J=7,3 Гц, 1H), 7,18 (т, J=8,7 Гц, 1H), 7,63 (ддд, J=8,6, 4,5, 2,1 Гц, 1H), 7,81 (дд, J=6,9, 2,3 Гц, 1H); ESI/APCI MC m/z 430 [M+H]+.
Пример 49. Синтез 3-хлор-4-фтор-N-({1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}метил)бензамида
Стадия 49-1. Из соединения (0,87 г), полученного на стадии 1-4, и трет-бутил (пиперидин-4-илметил)карбамата (0,88 г) получают трет-бутил ({1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}метил)карбамат (0,68 г, бесцветное твердое вещество) таким же способом, как на стадии 48-3.
1H ЯМР (600 МГц, CDCl3, δ): 1,20-1,31 (м, 2H), 1,43 (с, 9H), 1,43-1,45 (м, 1H), 1,61-1,67 (м, 2H), 1,88-1,98 (м, 2H), 2,60-2,67 (м, 2H), 2,83-2,90 (м, 2H), 2,90-2,98 (м, 2H), 2,99-3,05 (м, 2H), 3,42 (с, 2H), 4,56-4,63 (м, 1H), 6,73 (с, 1H), 6,91 (д, J=7,8 Гц, 1H), 7,09 (д, J=7,3 Гц, 1H), 7,86 (с, 1H); ESI/APCI MC m/z 374 [M+H]+.
Стадия 49-2. Из соединения (0,66 г), полученного на стадии 49-1, получают 7-{[4-(аминометил)пиперидин-1-ил]метил}-3,4-дигидрохинолин-2(1Н)-он (0,35 г, бесцветное аморфное вещество) таким же способом, как на стадии 1-6.
1H ЯМР (600 МГц, CDCl3, δ): 1,17-1,30 (м, 2H), 1,27-1,33 (м, 1H), 1,66-1,73 (м, 2H), 1,90-1,97 (м, 2H), 2,56-2,60 (м, 2H), 2,61-2,66 (м, 2H), 2,85-2,92 (м, 2H), 2,92-2,97 (м, 2H), 3,42 (с, 2H), 6,76 (с, 1H), 6,92 (д, J=7,3 Гц, 1H), 7,09 (д, J=7,8 Гц, 1H), 8,16 (ушир.с, 1H); ESI/APCI MC m/z 274 [M+H]+.
Стадия 49-3. Из соединения (211 мг), полученного на стадии 49-2, и 3-хлор-4-фторбензойной кислоты (145 мг) получают названное в заголовке соединение (120 мг, бесцветное твердое вещество) таким же способом, как в примере 31.
1H ЯМР (600 МГц, CDCl3, δ): 1,29-1,40 (м, 2H), 1,59-1,67 (м, 1H), 1,68-1,74 (м, 2H), 1,92-2,00 (м, 2H), 2,58-2,65 (м, 2H), 2,86-2,91 (м, 2H), 2,91-2,96 (м, 2H), 3,30-3,37 (м, 2H), 3,42 (с, 2H), 6,07-6,13 (м, 1H), 6,70 (с, 1H), 6,90 (д, J=7,3 Гц, 1H), 7,08 (д, J=7,3 Гц, 1H), 7,18 (т, J=8,7 Гц, 1H), 7,45 (ушир.с, 1H), 7,64 (ддд, J=8,4, 4,5, 2,3 Гц, 1H), 7,82 (дд, J=7,1, 2,1 Гц, 1H); ESI/APCI MC m/z 430 [M+H]+.
Пример 50. Синтез 3-метокси-N-{1-[2-(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)этил]пиперидин-4-ил}бензамида
Стадия 50-1. Смесь Ph3PCH2OMe•Br (4,97 г), включающую NaNH2 в ТГФ (20 мл), перемешивают при охлаждении льдом в течение 10 минут. К смеси постепенно, по каплям, добавляют раствор в ТГФ (80 мл) соединения (1,00 г), полученного на стадии 1-4. По завершении добавления по каплям смесь перемешивают при комнатной температуре в течение 4 часов. К реакционной смеси добавляют насыщенный водный раствор NaHCO3, и раствор экстрагируют один раз EtOAc и дважды CHCl3. Объединенные органические слои промывают рассолом, сушат над MgSO4 и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией (силикагель 60 N, подвижная фаза EtOAc/гексан = 20/80-40/60, об./об.), и получают 7-(2-метоксиэтенил)-3,4-дигидрохинолин-2(1Н)-он (0,60 г, бесцветное твердое вещество).
1H ЯМР (600 МГц, CDCl3, δ): 2,48-2,76 (м, 2H), 2,79-3,07 (м, 2H), 3,59-3,84 (м, 3H), 5,10-7,18 (м, 5H), 8,17-8,76 (м, 1H); ESI/APCI MC m/z 204 [M+H]+.
Стадия 50-2. К раствору в ТГФ (11,8 мл) соединения (590 мг), полученного на стадии 50-1, при охлаждении льдом добавляют концентрированную HCl (8,9 мл), и смесь перемешивают при той же температуре в течение одного часа. К реакционной смеси добавляют насыщенный раствор К2СО3, и раствор экстрагируют CHCl3. Органический слой сушат над MgSO4 и концентрируют при пониженном давлении, и получают (2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)ацетальдегид (0,51 г, бесцветное аморфное вещество).
1H ЯМР (600 МГц, CDCl3, δ): 2,60-2,70 (м, 2H), 2,91-3,01 (м, 2H), 3,57-3,76 (м, 2H), 6,58-7,20 (м, 3H), 9,72-9,77 (м, 1H); EI MC m/z 189 [M]+.
Стадия 50-3. К суспензии в ДМФА (780 мл) трет-бутил-4-аминопиперидин-1-карбоксилата (78,0 г) и 3-метоксибензойной кислоты (65,2 г) добавляют Et3N (130 мл), HOBt•H2O (71,7 г) и EDC•HCl (82,8 г) и смесь перемешивают при комнатной температуре в течение 12 часов. Добавляют Н2О (1,56 л) и смесь перемешивают на водяной бане в течение 1,5 часов. Выпавшее в осадок вещество отфильтровывают и получают трет-бутил-4-[(3-метоксибензоил)амино]пиперидин-1-карбоксилат (126 г, бесцветное твердое вещество). К суспензии в EtOAc (900 мл) соединения, полученного способом, описанным выше, добавляют 4М раствор HCl в EtOAc (900 мл) и смесь перемешивают при комнатной температуре в течение 4 часов. Реакционный раствор концентрируют при пониженном давлении, затем к остатку добавляют CHCl3 (2,00 л) и 2М водный раствор NaOH (1,00 л) и смесь перемешивают в течение 15 минут. Водный слой отделяют от органического слоя и затем дважды экстрагируют CHCl3 (800 мл). Объединенные органические слои сушат над Na2SO4 и концентрируют при пониженном давлении, и получают 3-метокси-N-пиперидин-4-илбензамид (87,8 г, светло-желтое твердое вещество).
1H ЯМР (200 МГц, CDCl3, δ): 1,30-1,52 (м, 2H), 1,97-2,12 (м, 2H), 2,75 (дт, J=12,0, 2,4 Гц, 2H), 3,11 (дт, J=12,8, 3,5 Гц, 2H), 3,85 (с, 3H), 3,96-4,18 (м, 1H), 6,00 (д, J=7,9 Гц, 1H), 6,98-7,07 (м, 1H), 7,21-7,38 (м, 3H); ESI MC m/z 235 [M+H]+.
Стадия 50-4. Из соединения (0,51 г), полученного на стадии 50-2, и соединения (0,57 г), полученного на стадии 50-3, получают названное в заголовке соединение (0,22 г, бесцветное твердое вещество) таким же способом, как на стадии 48-3.
1H ЯМР (600 МГц, CDCl3, δ): 1,50-1,62 (м, 2H), 2,00-2,11 (м, 2H), 2,19-2,27 (м, 2H), 2,54-2,65 (м, 4H), 2,72-2,78 (м, 2H), 2,88-2,99 (м, 4H), 3,84 (с, 3H), 3,96-4,06 (м, 1H), 5,96 (д, J=7,8 Гц, 1H), 6,59 (с, 1H), 6,79-6,86 (м, 1H), 7,02 (дд, J=8,3, 1,8 Гц, 1H), 7,07 (д, J=7,8 Гц, 1H), 7,22-7,28 (м, 1H), 7,29-7,36 (м, 2H), 7,80 (с, 1H); ESI/APCI MC m/z 408 [M+H]+.
Пример 51. Синтез 3-хлор-4-фтор-N-{1-[1-(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)этил]пиперидин-4-ил}бензамида
Стадия 51-1. К раствору в ТГФ (150 мл) соединения (1,25 г), полученного на стадии 1-4, добавляют 3М раствор MeMgBr в Et2O, и смесь перемешивают при комнатной температуре в течение одного часа. К реакционной смеси добавляют насыщенный водный раствор NH4Cl, смесь перемешивают в течение одного часа и затем органический слой отделяют, Водный слой экстрагируют три раза CHCl3. Объединенные органические слои сушат над MgSO4 и концентрируют при пониженном давлении. Затем к остатку добавляют IPE и смесь перемешивают в течение 10 минут. Выпавшее в осадок вещество отфильтровывают, и получают 7-(1-гидроксиэтил)-3,4-дигидрохинолин-2(1Н)-он (1,02 г, светло-желтое твердое вещество).
1H ЯМР (600 МГц, CDCl3, δ): 1,48 (д, J=6,4 Гц, 3H), 2,59-2,67 (м, 2H), 2,91-3,01 (м, 2H), 4,81-4,91 (м, 1H), 6,76-6,79 (м, 1H), 6,96-7,00 (м, 1H), 7,13-7,16 (м, 1H), 7,57 (ушир.с, 1H); ESI/APCI MC m/z 192 [M+H]+.
Стадия 51-2. К раствору в CHCl3 (120 мл) соединения (1,00 г), полученного на стадии 51-1, добавляют MnO2 (13,6 г), и смесь перемешивают при комнатной температуре в течение 4 часов. Реакционную смесь фильтруют через слой целита и фильтрат концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией (силикагель 60 N, подвижная фаза МеОН/CHCl3 = 0/100-10/90, об./об.), и получают 7-ацетил-3,4-дигидрохинолин-2(1Н)-он (0,58 г, бесцветное твердое вещество).
1H ЯМР (600 МГц, CDCl3, δ): 2,56-2,62 (м, 3H), 2,62-2,72 (м, 2H), 2,99-3,09 (м, 2H), 7,18-7,32 (м, 1H), 7,34-7,40 (м, 1H), 7,51-7,65 (м, 1H), 8,18 (ушир.с, 1H); ESI/APCI MC m/z 190 [M+H]+.
Стадия 51-3. К раствору в CHCl3 (350 мл) трет-бутил-4-аминопиперидин-1-карбоксилата (35,0 г) при охлаждении льдом добавляют Et3N (122 мл) и 3-хлор-4-фторбензоилхлорид (37,1 г) и смесь перемешивают при той же температуре в течение 1,5 часов. К реакционной смеси добавляют насыщенный водный раствор NaHCO3 и раствор экстрагируют три раза CHCl3. Объединенные органические слои сушат над MgSO4 и концентрируют при пониженном давлении, и получают трет-бутил-4-[(3-хлор-4-фторбензоил)амино]пиперидин-1-карбоксилат (62,0 г). К суспензии в EtOAc (300 мл) полученного соединения добавляют 4М раствор HCl в EtOAc (300 мл) и смесь перемешивают при комнатной температуре в течение 4 часов. Реакционную смесь концентрируют при пониженном давлении, к остатку добавляют 1М водный раствор NaOH (300 мл), и раствор три раза экстрагируют CHCl3. Объединенные органические слои сушат над MgSO4 и концентрируют при пониженном давлении, Остаток суспендируют в смеси EtOAc/гексан (200 мл, 1/1, об./об.), и смесь перемешивают в течение одного часа. Выпавшее в осадок вещество отфильтровывают, и получают 3-хлор-4-фтор-N-пиперидин-4-илбензамид (37,7 г, бесцветное твердое вещество).
1H ЯМР (200 МГц, CDCl3, δ): 1,30-1,53 (м, 2H), 1,94-2,12 (м, 2H), 2,75 (тд, J=12,0, 2,4 Гц, 2H), 3,10-3,14 (м, 2H), 3,93-4,17 (м, 1H), 5,87-6,09 (м, 1H), 7,19 (т, J=8,6 Гц, 1H), 7,59-7,70 (м, 1H), 7,83 (дд, J=7,0, 2,2 Гц, 1H); ESI MC m/z 257 [M+H]+.
Стадия 51-4. К раствору в МеОН (15 мл) соединения (206 мг), полученного на стадии 51-2, соединения (560 мг), полученного на стадии 51-3, и АсОН (327 мг) при комнатной температуре добавляют NaBH3CN (274 мг), и смесь кипятят с обратным холодильником в течение 12 часов. После охлаждения реакционной смеси до комнатной температуры добавляют NaBH3CN (274 мг) и смесь кипятят с обратным холодильником в течение 72 часов. После добавления насыщенного водного раствора NaHCO3 водный слой и органический слой разделяют. Водный слой три раза экстрагируют CHCl3. Объединенные органические слои сушат над MgSO4 и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией [(силикагель 60 N, подвижная фаза МеОН/CHCl3 = 0/100-20/80, об./об.) и (Chromatorex NH, подвижная фаза МеОН/CHCl3 = 0/100-10/90, об./об.) в указанном порядке], и получают названное в заголовке соединение (7 мг, бесцветное твердое вещество).
1H ЯМР (600 МГц, CDCl3, δ): 1,30-1,37 (м, 3H), 1,44-1,64 (м, 2H), 1,89-2,20 (м, 4H), 2,60-2,67 (м, 2H), 2,72-3,07 (м, 2H), 2,90-2,97 (м, 2H), 3,30-3,37 (м, 1H), 3,88-3,98 (м, 1H), 6,10 (д, J=7,3 Гц, 1H), 6,73 (с, 1H), 6,87-6,92 (м, 1H), 7,09 (д, J=7,8 Гц, 1H), 7,18 (т, J=8,5 Гц, 1H), 7,66 (ддд, J=8,7, 4,6, 2,3 Гц, 1H), 7,79 (ушир.с, 1H), 7,85 (дд, J=6,9, 2,3 Гц, 1H); ESI/APCI MC m/z 430 [M+H]+.
Пример 52. Синтез N-{1-[(8-фтор-2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}-3-метоксибензамида
Стадия 52-1. К раствору в МеОН (10,0 мл) соединения (1,00 г), полученного на стадии 1-4, при охлаждении льдом добавляют NaBH4 (216 мг), и смесь перемешивают при той же температуре в течение 30 минут. К реакционной смеси добавляют насыщенный водный раствор NaHCO3 и смесь концентрируют при пониженном давлении. Затем к остатку добавляют Н2О и раствор три раза экстрагируют CHCl3. Объединенные органические слои сушат над Na2SO4 и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией (силикагель 60 N, подвижная фаза МеОН/CHCl3 = 0/100-10/90, об./об.), и получают 7-(гидроксиметил)-3,4-дигидрохинолин-2(1Н)-он (550 мг, бесцветное твердое вещество).
1H ЯМР (600 МГц, CDCl3, δ): 2,56-2,61 (м, 2H), 2,92 (т, J=7,6 Гц, 2H), 4,62 (д, J=6,0 Гц, 2H), 6,76 (с, 1H), 6,94 (д, J=7,8 Гц, 1H), 7,11 (д, J=7,3 Гц, 1H), 7,90 (ушир.с, 1H); ESI/APCI MC m/z 178 [M+H]+.
Стадия 52-2. К раствору в CHCl3 (30,0 мл) соединения (670 мг), полученного на стадии 52-1, при охлаждении льдом добавляют Ас2О (536 мкл), DMAP (20,0 мг) и Et3N (1,05 мл), и смесь перемешивают при комнатной температуре в течение 45 минут. К реакционной смеси добавляют насыщенный водный раствор NaHCO3 и раствор три раза экстрагируют CHCl3. Объединенные органические слои сушат над Na2SO4 и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией (силикагель 60 N, подвижная фаза МеОН/CHCl3=0/100-10/90, об./об.), и получают (2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метилацетат (767 мг, светло-желтое твердое вещество).
1H ЯМР (600 МГц, CDCl3, δ): 2,09 (с, 3H), 2,61-2,65 (м, 2H), 2,96 (т, J=7,6 Гц, 2H), 5,04 (с, 2H), 6,74 (с, 1H), 6,96-6,99 (м, 1H), 7,15 (д, J=7,3 Гц, 1H), 7,72 (ушир.с, 1H); ESI/APCI MC m/z 220 [M+H]+.
Стадия 52-3. К раствору в CH3CN (22,0 мл) соединения (958 мг), полученного на стадии 52-2, добавляют бистетрафторборат 1-фтор-4-гидрокси-1,4-диазониабицикло[2,2,2]октана (1,91 г), и смесь перемешивают при комнатной температуре в течение трех суток. После концентрирования реакционной смеси при пониженном давлении остаток очищают колоночной хроматографией (силикагель 60 N, подвижная фаза МеОН/CHCl3 = 0/100-10/90, об./об.), и получают твердое вещество А и твердое вещество В. К раствору в МеОН (2,00 мл) твердого вещества А добавляют К2СО3 (69,0 мг), и смесь перемешивают при комнатной температуре в течение 2 часов. К реакционной смеси добавляют Н2О, смесь концентрируют при пониженном давлении и три раза экстрагируют CHCl3. Объединенные органические слои промывают рассолом, сушат над Na2SO4 и концентрируют при пониженном давлении, Остаток очищают колоночной хроматографией (силикагель 60 N, подвижная фаза МеОН/CHCl3 = 0/100-15/85, об./об.), и получают 8-фтор-7-(гидроксиметил)-3,4-дигидрохинолин-2(1Н)-он (37,0 мг, бесцветное твердое вещество).
1H ЯМР (600 МГц, CDCl3, δ): 2,63-2,66 (м, 2H), 2,98-3,01 (м, 2H), 4,74 (с, 2H), 6,95 (д, J=7,8 Гц, 1H), 7,02 (т, J=7,6 Гц, 1H), 7,53 (ушир.с, 1H); ESI/APCI MC m/z 196 [M+H]+.
Таким же способом из твердого вещества В получают 6-фтор-7-(гидроксиметил)-3,4-дигидрохинолин-2(1Н)-он (76,0 мг, бесцветное твердое вещество).
1H ЯМР (600 МГц, CDCl3, δ): 2,60-2,62 (м, 2H), 2,94 (т, J=7,6 Гц, 2H), 4,72 (с, 2H), 6,79 (д, J=6,4 Гц, 1H), 6,88 (д, J=10,1 Гц, 1H), 7,38 (ушир.с, 1H); ESI/APCI MC m/z 196 [M+H]+.
Стадия 52-4. К раствору полученного на стадии 52-3 8-фтор-7-(гидроксиметил)-3,4-дигидрохинолин-2(1Н)-она (39,0 мг) в CHCl3 (6,00 мл) и ацетоне (6,00 мл) добавляют MnO2 (152 мг) и смесь перемешивают при комнатной температуре в течение 2 суток. Реакционную смесь фильтруют через целит. Фильтрат концентрируют при пониженном давлении и получают 8-фтор-2-оксо-1,2,3,4-тетрагидрохинолин-7-карбальдегид (40,0 мг, бесцветное твердое вещество).
1H ЯМР (600 МГц, CDCl3, δ): 2,68-2,71 (м, 2H), 3,06-3,09 (м, 2H), 7,09 (д, J=7,8 Гц, 1H), 7,47 (д, J=7,8 Гц, 1H), 7,60 (ушир.с, 1H), 10,29 (с, 1H); ESI/APCI MC m/z 194 [M+H]+.
Стадия 52-5. Из соединения (40,0 мг), полученного на стадии 52-4, и 3-метокси-N-(пиперидин-4-ил)бензамида (73,0 мг) получают твердое вещество таким же способом, как на стадии 1-5. К полученному твердому веществу при комнатной температуре добавляют IPA, и смесь перемешивают в течение одного часа. Выпавшее в осадок вещество отфильтровывают, промывают IPA и гексаном, и получают названное в заголовке соединение (8,0 мг, бесцветное твердое вещество).
1H ЯМР (600 МГц, CDCl3, δ): 1,47-1,60 (м, 2H), 2,00-2,05 (м, 2H), 2,20-2,31 (м, 2H), 2,63-2,67 (м, 2H), 2,87 (ушир.с, 2H), 2,99 (т, J=7,6 Гц, 2H), 3,57 (ушир.с, 2H), 3,84 (с, 3H), 3,99 (ушир.с, 1H), 5,91 (ушир.с, 1H), 6,90-6,98 (м, 2H), 7,02 (дд, J=8,3, 1,8 Гц, 1H), 7,22-7,25 (м, 1H), 7,30-7,33 (м, 2H), 7,51 (ушир.с, 1H); ESI/APCI MC m/z 412 [M+H]+.
Пример 53. Синтез N-{1-[(6-фтор-2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}-3-метоксибензамида
Стадия 53-1. Из 6-фтор-7-(гидроксиметил)-3,4-дигидрохинолин-2(1Н)-она (76,0 мг), полученного на стадии 52-3, получают 6-фтор-2-оксо-1,2,3,4-тетрагидрохинолин-7-карбальдегид (32,0 мг, бесцветное твердое вещество) таким же способом, как на стадии 52-4.
1H ЯМР (600 МГц, CDCl3, δ): 2,63-2,66 (м, 2H), 3,02-3,05 (м, 2H), 7,03 (д, J=9,6 Гц, 1H), 7,18 (д, J=5,5 Гц, 1H), 7,54 (ушир.с, 1H), 10,30 (с, 1H); ESI/APCI MC m/z 194 [M+H]+.
Стадия 53-2. Из соединения (32,0 мг), полученного на стадии 53-1, и 3-метокси-N-(пиперидин-4-ил)бензамида (58,0 мг) получают названное в заголовке соединение (38,0 мг, бесцветное твердое вещество) таким же способом, как на стадии 52-5.
1H ЯМР (600 МГц, CDCl3, δ): 1,51-1,62 (м, 2H), 2,00-2,05 (м, 2H), 2,21-2,28 (м, 2H), 2,59-2,63 (м, 2H), 2,81-2,88 (м, 2H), 2,93 (т, J=7,6 Гц, 2H), 3,52 (ушир.с, 2H), 3,84 (с, 3H), 4,00 (ушир.с, 1H), 5,97 (ушир.с, 1H), 6,76 (д, J=5,5 Гц, 1H), 6,86 (д, J=9,6 Гц, 1H), 7,02 (дд, J=8,7, 2,3 Гц, 1H), 7,22-7,26 (м, 1H), 7,30-7,34 (м, 2H), 7,42-7,46 (м, 1H); ESI/APCI MC m/z 412 [M+H]+.
Ссылка 1. Синтез 3-метокси-N-{1-[(2-оксо-1,2,3,4-тетрагидрохинолин-7-ил)метил]пиперидин-4-ил}бензамида
Стадия R1-1. К суспензии 7-гидрокси-3,4-дигидрохинолин-2(1Н)-она (200 г) в CHCl3 (2,0 л) при комнатной температуре в течение 10 минут добавляют пиридин (212 г). К смеси в течение 35 минут добавляют Tf2O (344 г), поддерживая температуру ниже 10°С. После нагревания смеси до 15°С в течение 1 часа реакционную смесь охлаждают до 0°С и реакцию гасят, добавляя воду (2,0 л), Органический слой отделяют, промывают дважды водным насыщенным раствором KHSO4 и водой, сушат над Na2SO4 и концентрируют, и получают 2-оксо-1,2,3,4-тетрагидрохинолин-7-илтрифторметансульфонат в виде бледно-желтого твердого вещества (346 г).
1H ЯМР (200 МГц, CDCl3, δ): 2,63-2,72 (м, 2H), 2,96-3,05 (м, 2H), 6,75 (д, J=2,2 Гц, 1H), 6,90 (дд, J=8,4, 2,2 Гц, 1H), 7,20-7,26 (м, 1H), 8,83 (ушир.с, 1H); ESI/APCI MC m/z 294 [M-H]-.
Стадия R1-2. Смесь 2-оксо-1,2,3,4-тетрагидрохинолин-7-илтрифторметансульфоната (338 г), Zn(CN)2 (134 г) и Pd(PPh3)4 (33,5 г) в DMP (3,0 л) греют при 100°С в течение 4 часов и охлаждают до комнатной температуры. К смеси добавляют Zn(CN)2 (134 г) и Pd(PPh3)4 (12,7 г), и смесь перемешивают при 100°С в течение 2 часов. После охлаждения до 60°С реакционную смесь фильтруют через слой целита. Фильтрат концентрируют и получают твердое вещество. Твердое вещество промывают дважды EtOAc, и получают 2-оксо-1,2,3,4-тетрагидрохинолин-7-карбонитрил в виде бледно-желтого твердого вещества (165 г).
1H ЯМР (600 МГц, ДМСО-d6, δ): 2,43-2,45 (м, 2H), 2,90-2,97 (м, 2H), 7,12 (с, 1H), 7,31-7,37 (м, 2H), 10,29 (с, 1H); ESI/APCI MC m/z 171 [M-H]-.
Стадия R1-3. К суспензии 2-оксо-1,2,3,4-тетрагидрохинолин-7-карбонитрила (160 г) в НСО2Н (1,6 л) при комнатной температуре в течение 30 минут добавляют катализатор никель Ренея (суспензия в воде, 160 г). Смесь греют при 100°С в течение 2 часов. После охлаждения смеси до комнатной температуры реакционную смесь фильтруют через слой целита и промывают НСО2Н. Фильтрат концентрируют и получают твердое вещество. Твердое вещество перемешивают с водой (1,3 л), смесь фильтруют и получают 2-оксо-1,2,3,4-тетрагидрохинолин-7-карбальдегид в виде бледно-коричневого твердого вещества (156 г).
1H ЯМР (600 МГц, ДМСО-d6, δ): 2,43-2,45 (м, 2H), 2,94 (т, J=7,6 Гц, 2H), 7,30 (с, 1H), 7,38 (д, J=7,3 Гц, 1H), 7,44-7,49 (м, 1H), 9,87 (с, 1H), 10,29 (с, 1H); ESI/APCI MC m/z 176 [M+H]+.
Стадия R1-4. К раствору трет-бутил-4-аминопиперидин-1-карбоксилата (150 г) и Et3N (209 мл) в IPA (1,0 л) при охлаждении льдом в течение 40 минут добавляют 3-метоксибензоилхлорид (102 мл). Смесь перемешивают при комнатной температуре в течение 2 часов. После охлаждения до 0°С к смеси в течение 30 минут добавляют 12М водный раствор соляной кислоты (0,5 л) и смесь перемешивают при 50°С в течение 1 часа. После охлаждения до 0°С к реакционной смеси в течение 40 минут добавляют 12М водный раствор NaOH (0,5 л) и воду (0,4 л). Органический слой отделяют и водный слой экстрагируют EtOAc. Объединенные органические слои промывают рассолом, сушат над MgSO4 и концентрируют, и получают 3-метокси-N-(пиперидин-4-ил)бензамид в виде бледно-коричневого твердого вещества (160 г).
1H ЯМР (600 МГц, ДМСО-d6, δ): 1,52-1,61 (м, 2H), 1,78-1,86 (м, 2H), 2,71 (тд, J=12,3, 2,5 Гц, 2H), 3,06-3,15 (м, 2H), 3,79 (с, 3H), 3,84-4,02 (м, 1H), 7,07 (ддд, J=8,0, 2,5, 0,92 Гц, 1H), 7,33-7,46 (м, 3H), 8,32 (д, J=7,8 Гц, 1H); ESI/APCI MC m/z 235 [M+H]+.
Стадия R1-5. К суспензии 2-оксо-1,2,3,4-тетрагидрохинолин-7-карбальдегида (135 г) в CHCl3 (1,4 л) при комнатной температуре добавляют 3-метокси-N-(пиперидин-4-ил)бензамид (190 г) и АсОН (45 мл). Смесь перемешивают при комнатной температуре в течение 2 часов. После охлаждения до 0°С к смеси добавляют по частям NaBH(OAc)3. Смесь перемешивают при комнатной температуре в течение 19 часов. После охлаждения до 0°С к реакционной смеси добавляют 8М водный раствор NaOH (0,5 л) и воду (0,5 л). Органический слой отделяют, промывают водой и рассолом, сушат над MgSO4 и концентрируют, и получают бесцветное твердое вещество. Твердое вещество суспендируют в EtOAc (3,0 л), и смесь кипятят с обратным холодильником в течение 1 часа и охлаждают до комнатной температуры. Выпавшее в осадок вещество отфильтровывают, и получают бесцветное твердое вещество. Твердое вещество снова суспендируют в EtOAc (2,4 л), и смесь кипятят с обратным холодильником в течение 1 часа и охлаждают до комнатной температуры. Выпавшее в осадок вещество отфильтровывают и получают названное в заголовке соединение в виде бесцветного твердого вещества (229 г).
1H ЯМР (600 МГц, CDCl3, δ): 1,48-1,62 (м, 2H), 1,94-2,06 (м, 2H), 2,10-2,21 (м, 2H), 2,57-2,67 (м, 2H), 2,78-2,87 (м, 2H), 2,90-2,99 (м, 2H), 3,44 (с, 2H), 3,85 (с, 3H), 3,94-4,05 (м, 1H), 6,01 (д, J=7,8 Гц, 1H), 6,77 (с, 1H), 6,91 (д, J=7,3 Гц, 1H), 7,02 (дд, J=7,6, 2,1 Гц, 1H), 7,09 (д, J=7,8 Гц, 1H), 7,21-7,27 (м, 1H), 7,29-7,35 (м, 2H), 8,00 (с, 1H); ESI/APCI MC m/z 394 [M+H]+.
|
|
|
|
|
Пример 54 (кальциевый оценочный тест для MCH1R)
Анализом FDSS можно измерить внутриклеточную концентрацию кальция и с использованием в качестве показателя концентрации кальция можно оценить активность Gq-связанного рецептора. Например, в анализе можно определить, является ли аналит антагонистом, обратным агонистом или агонистом для Gq-связанного рецептора, Создана система FDSS6000™ (Hamamatsu Photonics K,K,) для осуществления оценки на основе такой функциональности, как измерение внутриклеточного кальция, для высокопроизводительного скрининга. Высвобождение внутриклеточного кальция путем активации Gq-связанного рецептора можно измерить флуорометрически путем введения в клетки индикатора кальция (такого как Fluo4). С другой стороны, в анализе можно измерить активацию Gi- и Go-связанных рецепторов, поскольку активация не ассоциируется с путями передачи сигналов кальция.
Внутриклеточную флуоресценцию можно быстро и успешно измерить в 96-луночном микропланшете или в 384-луночном микропланшете с использованием флурометрической системы для прочтения планшетов, FDSS6000™ может измерять флуоресценцию одновременно во всех лунках с хорошей чувствительностью, точно и в течение секунд. Такая система идеальна для функционального анализа в клетках, такого как контроль за потоком внутриклеточного кальция, генерируемым в пределах нескольких секунд после активации Gq-связанного рецептора.
Метод испытания
Накануне испытания клетки, устойчиво экспрессирующие неэндогенный активный MCH1R, высевают в 96-луночный микропланшет при плотности 3×104 клеток на лунку. Для культивирования используют 100 мкл на лунку среды, содержащей 10% фетальной телячьей сыворотки, 2 мМ глутамина, 1 мМ пирувата натрия и 0,5 мг/мл G418, pH 7,4). В день испытания среду удаляют и добавляют буфер для анализа (сбалансированный солевой раствор Хэнкса, содержащий 20 мМ HEPES, 0,5 мМ пробенецида, 0,05 мг/мл амаранта и 0,2% бычьего сывороточного альбумина (BSA), рН 7,4), содержащий 2 мкМ Fluo4-АМ и 0,04% плюроника F127, по 100 мкл на лунку, с последующей инкубацией в камере с 5% СО2 при 37°С в течение 30 минут. Добавляют буфер для анализа, содержащий каждую концентрацию МСН, по 50 мкл на лунку, и контролируют транзиторные изменения концентрации кальция, вызванные МСН, с использованием FDSS6000™ при экст. (Ex.) 488 нм и эмм. (Em.) 530 нм в течение 180 секунд. При проверке антагонистической активности аналита МСН добавляют в конечной концентрации 50 нМ. Получают кривую ингибирования с различными концентрациями аналита, и концентрацию аналита, ингибирующую на 50% возрастание внутриклеточного кальция, когда добавляют 50 нМ МСН (величина IC50), вычисляют с использованием обработки данных анализа программой Origin, версия 6.
Из числа соединений по настоящему изобретению ниже показаны соединения, имеющие величину IC50 50 нМ или менее:
примеры № 1, 2, 3, 4, 5, 6, 7, 8, 10, 12, 14, 15, 18, 19, 23, 27, 28, 29, 30, 31, 32, 33, 35, 36, 37, 38, 39, 43, 46, 47, 51 и 53.
Кроме того, величины IC50 некоторых соединений по настоящему изобретению показаны в таблице 4.
|
Промышленная применимость
Соединение по настоящему изобретению обладает антагонистическим действием на рецетор МСН и используется в качестве профилактического или терапевтического лекарственного средства в случае заболевания, связанного с МСН, и конкретнее, может быть использовано в качестве профилактического или терапевтического лекарственного средства в случае депрессии, тревожных расстройств (таких как генерализованное тревожное расстройство, посттравматический стресс, паническое расстройство, обсессивно-компульсивное расстройство или социальное тревожное расстройство), дефицита внимания, мании, маниакально-депрессивного психоза, шизофрении, расстройства настроения, стресса, расстройств сна, припадков, ухудшения памяти, когнитивного ухудшения, деменции, амнезии, делирия, ожирения, расстройства пищевого поведения, расстройства аппетита, гиперфагии, булимии, патологического отвращения к пище, диабета, сердечно-сосудистых заболеваний, гипертензии, дислипидемии, инфаркта миокарда, нарушения движений (такого как болезнь Паркинсона, эпилепсия, конвульсия или тремор), лекарственной зависимости, наркомании или половой дисфункции.