Результат интеллектуальной деятельности: ВНУТРИЛЕГОЧНОЕ ВВЕДЕНИЕ ФЛУОРОХИНОЛОНА
Вид РИД
Изобретение
Настоящая заявка притязает на приоритет предварительной заявки на патент США №61/127780, зарегистрированной 15 мая 2008 г., содержание которой полностью включено в настоящее описание в качестве ссылки.
Предпосылки создания изобретения
Один или несколько вариантов осуществления настоящего изобретения относится(ятся) к фармацевтическим композициям, которые содержат один или несколько флуорохинолонов, таких как ципрофлоксацин. Один или несколько вариантов осуществления настоящего изобретения относится(ятся) к порошкам, содержащим бетаиновое производное одного или нескольких флуорохинолонов, такое как ципрофлоксацина бетаин. Один или несколько вариантов осуществления настоящего изобретения относится(ятся) к способам получения, применения и/или введения таких фармацевтических композиций, содержащих их лекарственных форм и устройствам, системам и способам, предназначенным для внутрилегочного введения таких композиций.
Настоящее изобретение относится к композициям и способам лечения бактериальных инфекций и, прежде всего, относится к лечению муковисцидоза (CF), не связанного с муковисцидозом (не-CF) бронхоэктаза и острых осложнений хронического обструктивного заболевания легких.
Муковисцидоз представляет собой наиболее распространенное укорачивающее жизнь генетическое заболевание в Соединенных Штатах и Северной Европе, которое поражает примерно 30000 человек в Соединенных Штатах и близкое к этому количество людей в Западной Европе. Генетический дефект, вызывающий это аутосомальное рецессивное заболевание, представляет собой мутацию в гене муковисцидозного трансмембранного регулятора проводимости (CFTR), который кодирует белок хлоридного канала. Индивидуумы с CF, как правило, страдают хроническими эндобронхиальными инфекциями, синуситом и малабсорбцией, что обусловлено панкреатической недостаточностью, повышенной потерей соли при потении, обструктивным гепатобилиарным заболеванием и пониженной фертильностью. Респираторное заболевание является основной причиной заболеваемости и обусловливает 90% случаев смерти среди людей, страдающих CF. Важным прогностическим фактором выживаемости при CF является легочная функция (которую оценивают путем измерения односекундного объема воздуха при форсированном выдохе (предсказанный % FEV1)), Двулетний срок выживания для данной популяции пациентов с CF снижается в 2 раза при каждом 10%-ном уменьшении предсказанного % FEV1, а для индивидуумов, у которых FEV1 составляет менее 30% от предсказанного, выживаемость в течение 2 лет составляет менее 50% (Kerem E. и др., «Prediction of Mortality in Patients with Cystic Fibrosis», N Engi J Med 326, 1992, ее. 1187-1191). Коэффициенты потери легочной функции варьируются как между индивидуумами, так и для конкретного индивидуума с течением времени. Ретроспективный анализ изменений с течением времени продемонстрировал, что коэффициенты снижения варьируются от менее чем 2% от предсказанного % FEV1 в год до более чем 9% от предсказанного % FEV1 в год, при этом в целом коэффициент снижения выражено ассоциирован с возрастом наступления смерти.
Пациенты с CF страдают утолщением слизистой оболочки, которое, как полагают, вызывается нарушением транспорта ионов, ухудшающим защиту организма-хозяина легких, что приводит к повышению чувствительности к возникающим в раннем возрасте эндобронхиальным инфекциям, вызываемым Staphylococcus aureus, Haemophilus influenzae и Pseudomonas aeruginosa. В пубертатном возрасте у большинства индивидуумов, страдающих CF, в мокроте присутствует Р. aeruginosa. Хронические эндобактериальные инфекции, прежде всего вызываемые Р. aeruginosa, провоцируют устойчивый воспалительный ответ в дыхательных путях, который ускоряет прогрессирование обструктивного заболевания, характеризующегося диффузным бронхоэктазом; Winnie G.B. и др., «Respiratory Tract Colonization with Pseudomonas aeruginosa in Cystic Fibrosis: Correlations Between AxAi-Pseudomonas aeruginosa Antibody Levels And Pulmonary Function», Pediatr Pulmonol 10, 1991, ее. 92-100. Существенное снижение выживаемости, ассоциированное с хронической инфекцией, вызываемой Р. aeruginosa (Henry R.L. и др., «Mucoid Pseudomonas aeruginosa is a Marker of Poor Survival in Cystic Fibrosis», Pediatr Pulmonol 12(3), 1992, ее. 158-161), и выраженная ассоциация приобретения в раннем возрасте хронической инфекции, вызываемой Р. aeruginosa, и детской смертностью (Demko С.А. и др., «Gender Differences in Cystic Fibrosis: Pseudomonas aeruginosa infection», J Clin Epidemiol 48, cc. 1041-1049), позволяет предположить наличие связи между приобретением хронической эндобактериальной инфекции, вызываемой Р. aeruginosa, легочным воспалением, потерей легочной функции и, в конце концов, наступлением смерти.
Были предприняты попытки лечения вызываемых Р. aeruginosa инфекций у пациентов, страдающих CF, с использованием различных терапевтических подходов. Целью таких терапий являлось либо снижение бактериальных нагрузок в легком, либо снижение возникающего при этой инфекции воспаления. Было установлено, что такие терапии приводят к уменьшению коэффициентов снижения легочной функции у инфицированных пациентов, но при этом обладают определенными недостатками.
Исторически, стандартная терапия при лечении эндобактериальных инфекций, вызываемых Р. aeruginosa, заключалась в парентеральном введении в течение 14-21 дня так называемых «антипсевдомонадных» антибиотиков (антибиотиков, обладающих активностью в отношении штаммов Pseudomonas aeruginosa), как правило, включающих аминогликозид. Однако недостаточная способность указанных агентов эффективно проникать из кровотока в легочную ткань и секреция из дыхательных путей приводили к тому, что в области-мишени достигались лишь субтерапевтические концентрации. В результате этого повторное парентеральное введение аминогликозидов приводило к развитию устойчивых изолятов, с которыми ассоциировано повышенное производство слизи и различные вирулентные факторы. Для обеспечения адекватных концентраций лекарственного средства в области инфекции путем его парентерального введения необходимы уровни в сыворотке, которые ассоциированы с нефротоксичностью, токсичностью в отношении преддверия лабиринта и ототоксичностью («American Academy of tolaryngology. Guide for the evaluation of hearing handicap», JAMA 241(19), 1979, ее. 2055-2059); Brummett R.E., «Drug-induced ototoxicity», Drugs 19, 1980, сс.412-428).
Введение путем ингаляции антибиотиков, таких как аминогликозиды, явилось привлекательным альтернативным подходом, позволяющим обеспечивать высокие концентрации антибиотиков непосредственно в области инфекции в эндобронхиальном пространстве, минимизируя при этом системную биодоступность.
Например, TOBI®, содержащий аминогликозид тобрамицин, разрешен для осуществления ингаляционной терапии при лечении эндобронхиальных инфекций у пациентов, страдающих CF [NDA 50-753]. После получения этого разрешения TOBI® (фирма Novartis, Базель, Швейцария) стал стандартным средством для лечения пациентов, страдающих CF, организм которых хронически колонизирован Р. aeruginosa. Пациентам вводят номинальную дозу, составляющую 300 мг, с помощью стандартного струйного распылителя дважды в день. Для уменьшения возможности развития устойчивых бактериальных штаммов пациенты проходят курс лечения, состоящий из 28 дней «он-периода» (период, когда вводят лекарственное средство), за которым следует состоящий из 28 дней «офф-период» (период, когда лекарственное средство не вводят). Однако при этом из дозы, составляющей 300 мг, в легкие поступает только примерно 10% или 30 мг. Клинические опыты, проведенные с использованием TOBI®, продемонстрировали, что вводимый путем ингаляции тобрамицин обладает существенно меньшими системными побочными действиями. Введение в виде аэрозоля дозы объемом 5 мл препарата, содержащего 300 мг тобрамицина в ¼ - нормальном физиологическом растворе, с целью подавления Р. aeruginosa в эндобронхиальном пространстве пациента описано в патенте США №5508269, содержание которого полностью включено в настоящее описание в качестве ссылки.
Существует ряд ограничений, касающихся применения тобрамицина для пациентов, страдающих CF. Системное введение тобрамицина путем IV инъекции может вызывать серьезные побочные действия, включая почечную токсичность и ототоксичность. Распыляемые жидкости могут вызывать действия, связанные с препаратом и его введением, а также развитие повышенной устойчивости (т.е. повышение величины минимальной ингибирующей концентрации, MIC) P. aeruginosa в процессе лечения. Несмотря на риск ухудшения легочной функции, необходимо соблюдать режим лечения, предусматривающий терапевтические «он-периоды» продолжительностью 1 месяц и «офф-периоды» продолжительностью 1 месяц для того, чтобы избежать развития устойчивости, позволяющей чувствительным патогенам осуществлять репопуляцию. В настоящее время недостаточно изучено продолжительное воздействие вводимых путем ингаляции аминогликозидов на почечную функцию. Введение дозы, составляющей 5 мл, занимает примерно 15-20 мин, кроме того, требуется дополнительное время для зарядки и очистки распылителя. Распыление может иметь также и другие недостатки, такие как стоимость, эффективность и воспроизводимость, риск бактериального загрязнения и недостаточная мобильность (необходимость в громоздких компрессорах или баллонах со сжатым газом и источниках энергии).
Помимо вводимых путем ингаляции антибиотиков, таких как поступающие в продажу продукты с товарным знаком TOBI, обычно прописывают ряд других осуществляемых в течение длительного времени терапий с целью снижения количества разрушительных циклов обструкции, инфекции и воспаления в легком индивидуума, страдающего CF. Такие виды терапии, как интенсивный клиренс дыхательных путей, ингаляция бронходилататоров и введение муколитических средств, таких как рекомбинантная человеческая дорназа альфа, все назначают на длительный период времени, создавая тем самым предпосылку для существенного увеличения связанного с лечением бремени для индивидуумов, страдающих CF. Многие пациенты, страдающие CF, тратят более четырех часов ежедневно для осуществления терапии. Не удивительно, что выдерживание терапевтического лечения представляет собой значительную проблему для пациентов, страдающих CF, и что степень недостаточности выдерживания режима лечения может варьироваться в зависимости от конкретного лечения. Принимая во внимание то, что для лечения необходимо продолжительное время, следует признать, что любые режимы, которые позволяют существенно уменьшить время введения и увеличить удобства, связанные с введением (например, мобильность устройства и простоту применения), являются предпочтительными, они потенциально улучшают соблюдение пациентом режима лечения и улучшают результаты лечения. Кроме того, разработка альтернативных предназначенных для ингаляции препаратов, содержащих антибиотики, которые можно вводить в «офф-период» ТОВ-терапии, может явиться основой для альтернативного подхода к лечению, который не приводит к репопуляции чувствительных патогенов и потере легочной функции.
Ципрофлоксацин представляет собой синтетический фторированный карбоксихинолон с широким спектром активности. Ципрофлоксацин избирательно ингибирует синтез бактериальной дезоксирибонуклеиновой кислоты (ДНК) путем воздействия на ДНК-гиразу и топоизомеразу IV. Эти необходимые ферменты контролируют топологию ДНК и принимают участие в репликации, репарации и транскрипции ДНК. Было установлено, что Ципрофлоксацин обладает высокой бактерицидной активностью in vitro в отношении многих патогенов, вызывающих респираторные инфекции, включая Mycobacterium tuberculosis, Mycobacterium avium-M. intracellulare, Bacillus anthracis, Hemophilus influenzae, Neisseria meningitidis и Pseudomonas aeruginosa. В настоящее время Ципрофлоксацин рассматривается как один из флуорохинолонов, который обладает наибольшей, если не самой высокой, активностью в отношении Р. aeruginosa и очень сильными бактерицидными свойствами. Предназначенные для орального и внутривенного введения формы ципрофлоксацина применяли в клинических условиях для лечения инфекций дыхательных путей.
Несмотря на успех, достигнутый при применении ципрофлоксацина, существуют некоторые факторы, которые ограничивают клиническую применимость лекарственного средства для лечения легочных инфекций, к ним относятся его низкая растворимость при физиологических значениях рН, горький вкус при его нахождении в растворе и быстрый почечный клиренс. Например, для того, чтобы внутривенно ввести дозу, составляющую 500 мг, лекарственное средство необходимо развести до концентрации <2 мг/мл и осуществлять медленную инфузию, чтобы избежать осаждения в месте инъекции. Ципрофлоксацин при его внутривенном или оральном введении характеризуется также неблагоприятными фармакокинетическими профилями в нижних дыхательных путях, в том числе сравнительно коротким периодом элиминации (время полужизни составляет от 1,0 до 1,6 ч) и малой площадью под кривой зависимости концентрации от времени, которая составляет от 43 до 113 мг·ч/л.
Следует ожидать, что введение путем ингаляции ципрофлоксацина пациентам, нуждающимся в этом, такими как пациенты, страдающие CF, страдающие ХОЗЛ пациенты и страдающие антраксом (сибирская язва) пациенты, приводит к высоким концентрациям бактерицида в дыхательных путях. Ципрофлоксацин даже в субингибирующих концентрациях воздействует на вирулентность Р. aeruginosa (чувство кворума («quorum sensing»)) и потенциально может снижать встречаемость хронических инфекций дыхательных путей у пациентов, страдающих CF. Снижение бактериальной нагрузки в дыхательных путях и возможное замедление повторной инфекции может приводить к улучшению легочной функции и способствовать улучшению отдаленного прогноза. Кроме того, применение ингаляции ципрофлоксацина может позволить преодолеть возможность возникновения почечной недостаточности, которая отмечена после лечения аминогликозидами.
Однако оказалось, что эффективное внутрилегочное введение ципрофлоксацина является трудно осуществимым. Препятствием, ассоциированным с введением противоинфекционных средств, таких как Ципрофлоксацин, в легкие является возможность быстрого клиренса лекарственного средства вследствие: (а) мукоцилиарного клиренса из дыхательных путей; (б) абсорбции лекарственного средства в системный кровоток; (в) клиренса, опосредуемого легочными макрофагами. После внутритрахеального введения растворимый гидрохлорид ципрофлоксацина быстро абсорбируется из легких в системный кровоток, что характеризуется временем полужизни, составляющим ровно 0,2 ч (Wong J.P., Cherwonogroszky J.W., DiNinno V.L. и др: Liposome-encapsulated ciprifloxacin for the prevention and treatment of infectious diseases caused by intracellular pathogens, в: «Liposomes in Biomedical Applications», под ред. Florence А.Т., Gregoriadis G., изд-во Harwood Academic Press, Amsterdam, 1995, cc.105-120). Такой промежуток времени является слишком коротким для того, чтобы обеспечить эффективное лечение эндобронхиальных инфекций, вызываемых Р. aeruginosa, и это представляет собой существенное ограничение при разработке препаративной формы.
Для преодоления быстрого клиренса гидрохлорида ципрофлоксацина из легких исследователи провели изучение возможности капсулирования в носителях, обеспечивающих контролируемое высвобождение, таких как липосомы. Например, Wong с соавторами продемонстрировали на модели с использованием грызунов, что липосомы позволяют добиться существенного увеличения времени нахождения ципрофлоксацина в легких, что приводит к эффективному лечению инфекций, вызываемых Francicella tularensis. Ограничениями для введения посредством распыления ципрофлоксацина с использованием липосом являются: (а) большие промежутки времени, необходимые для введения, что обусловлено низкими уровнями лекарственной нагрузки и ограничениями на концентрации дисперсии, приемлемые для распыления (ограничение по вязкости); (б) недостаточный контроль кинетики высвобождения. В исследованиях, проведенных Wong, применяли стандартный распылитель. Такие распылители, как правило, обеспечивают скорость потока, составляющую от 0,1 до 0,2 мл/мин. При концентрации лекарственного средства, составляющей 10-40 мкг/мл, скорость потока составляла от 1 до 8 мкг/мин. Если предположить, что эффективность введения составляет примерно 10%, то в легкие можно вводить только от 0,1 до 0,8 мкг/мин. Следовательно, с практической точки зрения с использованием данной модели нецелесообразно вводить в легкие дозы, превышающие 10 мг.
В клинической практике не нашло своего развития применение полимерных носителей в качестве средств увеличения продолжительности времени пребывания гидрохлорида ципрофлоксацина. Сохраняются опасения, связанные с медленным клиренсом полимерных носителей из легких.
При значениях рН ниже pK1 (6,0) и выше pK2 (8,8) ципрофлоксацин имеет чистый заряд и обладает высокой растворимостью. В диапазоне значений рН от 6,0 до 8,8 соединение является цвиттерионным и практически нерастворимым (растворимость при значении рН 7 составляет 60 мкг/мл). Результаты исследований продемонстрировали, что находящийся в цвиттерионной форме ципрофлоксацина бетаин характеризуется увеличенным временем нахождения в легких (Endermann R., Labischinski H., Ladel С. и др.: Treatment of bacterial diseases of the respiratory organs, заявка на патент США 2004/0254194 A1). Однако Endermann с соавторами не описали введение ципрофлоксацина бетаина в форме, которая позволяет осуществлять легкое, эффективное и воспроизводимое введение в организм пациента.
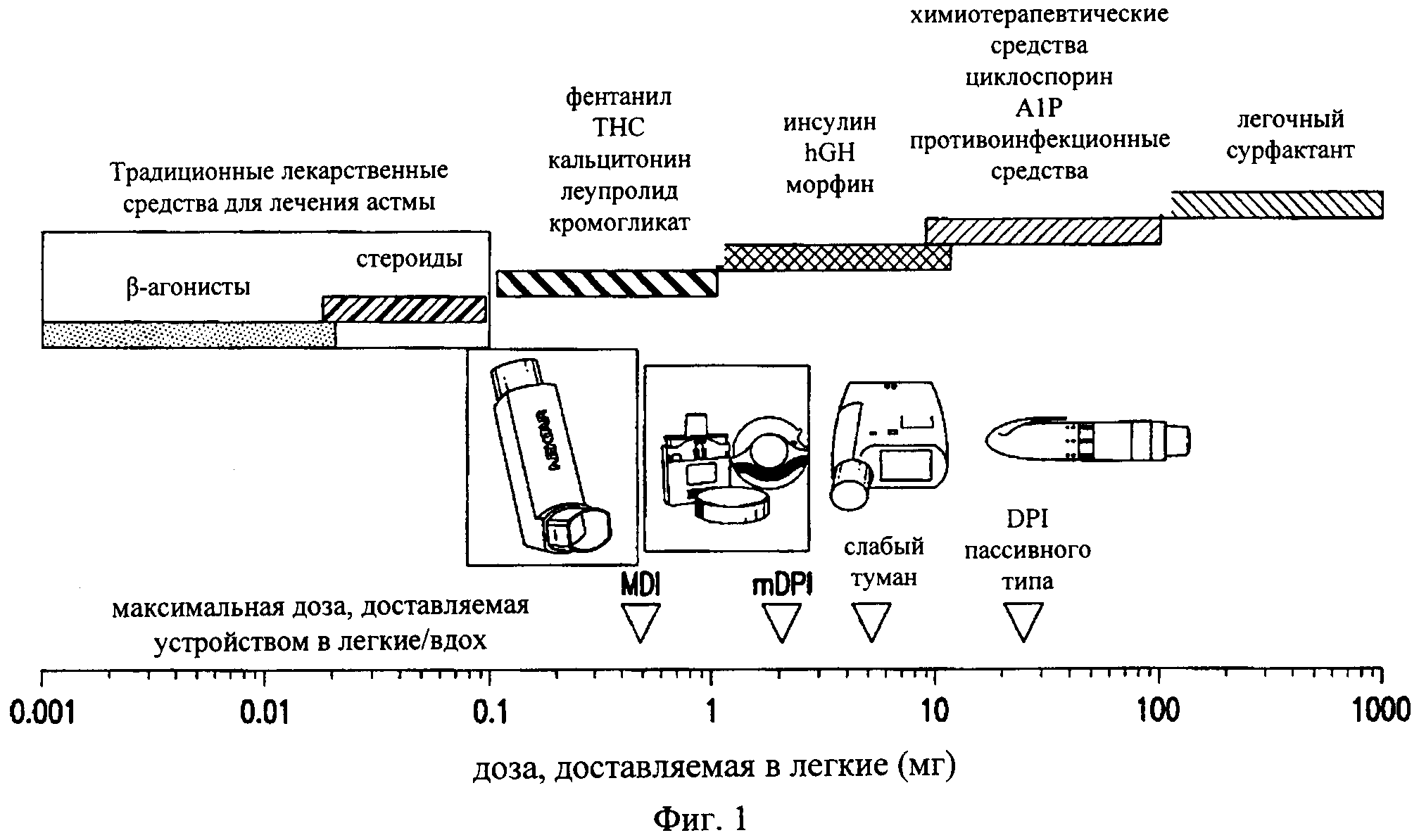
Кроме того, одним из основных препятствий, с которыми сталкиваются при осуществлении внутрилегочного введения противоинфекционных средств, является то, что в этом случае требуются величины терапевтических доз для легкого (>10 мг). На рынке средств, предназначенных для введения в виде аэрозоля, доминируют противоастматические терапевтические средства (например, бронходилататоры и кортикостероиды). Как продемонстрировано на фиг.1, противоастматические лекарственные средства обладают высокой эффективностью при введении в легкие в дозах, составляющих менее чем примерно 100 микрограммов (мкг) (см. также у Weers J., dark A., Challoner P., High dose inhaled powder delivery: challenges and techniques. B: «Respiratory Drug Delivery IX», под ред. R.N. Dalby, P.R. Byron, J. Peart, J.D. Suman, S.J. Farr, изд-bo Davis Healthcare Inti Publishing, River Grove, IL, 2004, cc.281-288).
Таким образом, существующие терапевтические методы имеют ряд недостатков. Принимая во внимание известные системы, предназначенные для введения содержащих антибиотик аэрозолей, можно считать, что сохраняется потребность в создании высокоэффективных и более удобных систем. Один или несколько вариантов осуществления настоящего изобретения позволяет удовлетворить одну или несколько из указанных потребностей.
Краткое изложение сущности изобретения
Настоящее изобретение позволяет удовлетворить указанные существующие в настоящее время потребности.
Одним из объектов изобретения является фармацевтическая композиция для внутрилегочного введения, содержащая флуорохинолон, такой как ципрофлоксацин, моксифлоксацин или левофлоксацин, которая находится в форме, пригодной для эффективного введения в легкие.
Другой объект изобретения относится к порошкообразной композиции для внутрилегочного введения, состоящей из частиц, которые содержат флуорохинолон и эксципиент. Частицы имеют массовый медианный аэродинамический диаметр, составляющий от примерно 1 до примерно 5 мкм. Флуорохинолон характеризуется временем полужизни в легких, составляющим по меньшей мере 1,5 ч.
Следующий объект изобретения относится к порошкообразной композиции для внутрилегочного введения, состоящей из частиц, которые содержат флуорохинолон и эксципиент. Частицы имеют массовый медианный аэродинамический диаметр, составляющий от примерно 1 до примерно 5 мкм, и насыпную плотность, составляющую менее чем примерно 0,6 г/см3, и шероховатость, составляющую от примерно 3 до примерно 10. Флуорохинолон характеризуется временем полужизни в легких, составляющим по меньшей мере 1,5 ч.
Еще один объект изобретения относится к композиции для внутрилегочного введения, состоящей из частиц, которые содержат флуорохинолона бетаин и эксципиент.
Еще один объект изобретения относится к композиции для внутрилегочного введения, состоящей из частиц, которые содержат флуорохинолона бетаин и эксципиент, где частицы представляют собой частицы порошка с шероховатостью, составляющей от примерно 3 до примерно 10.
Еще один объект изобретения относится к композиции для внутрилегочного введения, состоящей из частиц, которые содержат ципрофлоксацина бетаин, где ципрофлоксацина бетаин состоит практически из ципрофлоксацина бетаина 3,5-гидрохлорида (ципрофлоксацина бетаин 3,5Н2О).
Еще один объект изобретения относится к стандартной лекарственной форме для внутрилегочного введения, представляющей собой резервуар, который содержит композицию, находящуюся в порошкообразной форме, где композиция содержит флуорохинолона бетаин.
Еще один объект изобретения относится к стандартной лекарственной форме для внутрилегочного введения, представляющей собой резервуар, который содержит композицию, находящуюся в порошкообразной форме, где композиция содержит флуорохинолона бетаин. Частицы имеют массовый медианный аэродинамический диаметр, составляющий от примерно 1 до примерно 5 мкм, насыпную плотность, составляющую менее чем примерно 0,6 г/см3, и шероховатость, составляющую от примерно 3 до примерно 10.
Еще один объект изобретения относится к системе введения, которая содержит стандартную лекарственную форму, представляющую собой резервуар, который содержит композицию, находящуюся в порошкообразной форме, где композиция содержит флуорохинолона бетаин. Кроме того, система введения содержит ингалятор для сухого порошка, содержащий камеру, приспособленную для помещения в нее капсулы.
Следующий объект изобретения относится к способу изготовления частиц для внутрилегочного введения, заключающемуся в том, что приготавливают жидкий исходный продукт, содержащий флуорохинолона бетаин и эксципиент. Жидкость удаляют из исходного продукта, получая частицы, содержащие флуорохинолона бетаин и эксципиент. Образовавшиеся частицы имеют массовый медианный аэродинамический диаметр, составляющий от примерно 1 до примерно 5 мкм.
Еще один объект изобретения относится к способу изготовления частиц для внутрилегочного введения, заключающемуся в том, что приготавливают жидкий исходный продукт, содержащий флуорохинолона бетаин и эксципиент. Жидкость удаляют из исходного продукта, получая частицы, содержащие флуорохинолона бетаин и эксципиент.Образовавшиеся частицы имеют массовый медианный аэродинамический диаметр, составляющий от примерно 1 до примерно 5 мкм, насыпную плотность, составляющую менее чем примерно 0,6 г/см3, и шероховатость, составляющую от примерно 3 до примерно 10.
Следующий объект изобретения относится к способу лечения эндобронхиальной инфекции, заключающемуся в том, что пациенту, нуждающемуся в этом, вводят путем ингаляции в эффективном количестве композицию, где композиция содержит частицы, содержащие флуорохинолона бетаин и по меньшей мере один эксципиент, и где частицы имеют массовый медианный аэродинамический диаметр, составляющий от примерно 1 до примерно 5 мкм.
Еще один объект изобретения относится к способу лечения эндобронхиальной инфекции, заключающемуся в том, что пациенту, который нуждается в этом, вводят путем ингаляции в эффективном количестве композицию, где композиция содержит частицы, содержащие флуорохинолона бетаин и по меньшей мере один эксципиент, и где частицы имеют массовый медианный аэродинамический диаметр, составляющий от примерно 1 до примерно 5 мкм, насыпную плотность, составляющую менее чем примерно 0,6 г/см3, и шероховатость, составляющую от примерно 3 до примерно 10.
Еще один объект изобретения относится к способу лечения эндобронхиальной инфекции, заключающемуся в том, что пациенту, который нуждается в этом, вводят путем ингаляции в эффективном количестве композицию, где композиция содержит частицы, содержащие флуорохинолона бетаин и по меньшей мере один эксципиент, и где частицы имеют массовый медианный аэродинамический диаметр, составляющий от примерно 1 до примерно 5 мкм, и где композицию в эффективном количестве вводят посредством четырех или меньшего количества ингаляций, предпочтительно посредством трех, более предпочтительно посредством одной ингаляции.
Еще один объект изобретения относится к способу лечения эндобронхиальной инфекции, заключающемуся в том, что пациенту, который нуждается в этом, вводят путем ингаляции в эффективном количестве композицию, где композиция содержит частицы порошка, содержащие флуорохинолон и по меньшей мере один эксципиент, и где частицы имеют массовый медианный аэродинамический диаметр, составляющий от примерно 1 до примерно 5 мкм, и где флуорохинолон имеет время полужизни в легких, составляющее по меньшей мере 1,5 ч.
Еще один объект изобретения относится к способу лечения эндобронхиальной инфекции, заключающемуся в том, что пациенту, который нуждается в этом, вводят путем ингаляции в эффективном количестве композицию, где композиция содержит частицы порошка, содержащие флуорохинолон и по меньшей мере один эксципиент, и где частицы имеют массовый медианный аэродинамический диаметр, составляющий от примерно 1 до примерно 5 мкм, насыпную плотность, составляющую менее чем примерно 0,6 г/см3, и шероховатость, составляющую от примерно 3 до примерно 10, и где флуорохинолон имеет время полужизни в легких, составляющее по меньшей мере 1,5 ч.
Один или несколько вариантов осуществления настоящего изобретения относится(ятся) к порошкообразной композиции, содержащей флуорохинолона бетаин, такой как ципрофлоксацина бетаин, которую можно вносить в капсулу размера №2 (или имеющую меньший объем), и которая обеспечивает при внутрилегочном введении посредством одной ингаляции поступление в легкие дозы, составляющей по меньшей мере примерно 10 мг.
Один или несколько вариантов осуществления настоящего изобретения относится(ятся) к порошкообразной композиции, содержащей флуорохинолона бетаин, такой как ципрофлоксацина бетаин, которую можно вносить в капсулу размера №2 (или имеющую меньший объем), и которая обеспечивает при внутрилегочном введении посредством трех или четырех, или меньшего количества ингаляций поступление в легкие терапевтической дозы.
Один или несколько вариантов осуществления настоящего изобретения относится(ятся) к порошкообразной композиции, содержащей флуорохинолона бетаин, такой как ципрофлоксацина бетаин, которую можно вносить в капсулу размера №2 (или имеющую меньший объем), и которая обеспечивает при внутрилегочном введении посредством двух ингаляций поступление в легкие терапевтической дозы.
Один или несколько вариантов осуществления настоящего изобретения относится(ятся) к порошкообразной композиции, содержащей флуорохинолона бетаин, такой как ципрофлоксацина бетаин, которую можно вносить в капсулу размера №2 (или имеющую меньший объем), и которая обеспечивает при внутрилегочном введении посредством одной ингаляции поступление в легкие терапевтической дозы.
В одном или нескольких вариантах осуществления настоящего изобретения порошкообразная композиция, представляет собой частицы, содержащие в количестве от 50 до 70 мас.% кристаллический ципрофлоксацина бетаин, на который нанесено пористое покрытие из насыщенного фосфатидилхолина с длинной цепью, где частицы имеют массовый медианный диаметр, составляющий от примерно 1 до примерно 5 мкм, массовый медианный аэродинамический диаметр, составляющий от примерно 1 до примерно 5 мкм, и шероховатость (Sv), составляющую от примерно 3 до примерно 10.
В одном или нескольких вариантах осуществления настоящего изобретения порошкообразная композиция, представляет собой частицы, содержащие кристаллический ципрофлоксацина бетаина 3,5-гидрат, который имеет остаточное содержание влаги, составляющее от 10 до 15 мас.%, и значение рН после восстановления, составляющее от 6,0 до 8,8.
В одном или нескольких вариантах осуществления настоящего изобретения порошкообразная композиция, представляет собой частицы, содержащие кристаллический ципрофлоксацина бетаина 3,5-гидрат и эксципиент, где удельная площадь поверхности частиц составляет от 8 до 20 м2/г, пористость частиц составляет от 5 до 20 см3/г, и шероховатость (Sv) составляет от 3 до 10.
В одном или нескольких вариантах осуществления настоящего изобретения порошкообразная композиция, представляет собой частицы, содержащие кристаллический ципрофлоксацина бетаина 3,5-гидрат, на которые нанесен пористый слой покрытия из эксципиента, где удельная площадь поверхности частиц составляет от 8 до 20 м2/г, пористость частиц составляет от 5 до 20 см3/г, и шероховатость (Sv) составляет от 3 до 10.
В одном или нескольких вариантах осуществления настоящего изобретения порошок, содержащий флуорохинолон, вносят в резервуар, такой как капсула, где порошок имеет насыпную плотность по данным измерений методом одноосевого сжатия, составляющую от 0,1 до 0,6 г/см3.
В одном или нескольких вариантах осуществления настоящего изобретения порошок, содержащий флуорохинолон, вносят в резервуар, такой как капсула, где порошок имеет насыпную плотность по данным измерений методом одноосевого сжатия, составляющую менее 0,6 г/см3, и более предпочтительно составляющую от 0,2 до 0,5 г/см3.
В одном или нескольких вариантах осуществления настоящего изобретения фармацевтическая композиция представляет собой порошок, содержащий в терапевтически эффективном количестве ципрофлоксацина бетаин и фармацевтически приемлемые эксципиенты, где порошок представляет собой частицы, содержащие кристаллический ципрофлоксацина бетаин в количестве, составляющем от 50 до 70 мас.%, и смесь дистеароилфосфатидилхолина и дигидрата хлорида кальция в молярном соотношении 2:1 в количестве, составляющем от 30 до 50 мас.%
В одном или нескольких вариантах осуществления настоящего изобретения стандартная лекарственная форма представляет собой контейнер, содержащий фармацевтическую композицию, которая представляет собой порошок, содержащий в терапевтически эффективном количестве ципрофлоксацина бетаин и фармацевтически приемлемые эксципиенты, где порошок представляет собой частицы, содержащие кристаллический ципрофлоксацина бетаин в количестве, составляющем от 50 до 70 мас.%, и смесь дистеароилфосфатидилхолина и дигидрата хлорида кальция в молярном соотношении 2:1 в количестве, составляющем от 30 до 50 мас.%.
В одном или нескольких вариантах осуществления настоящего изобретения система введения включает ингалятор для сухого порошка и фармацевтическую композицию, которая представляет собой порошок, содержащий в терапевтически эффективном количестве ципрофлоксацина бетаин и фармацевтически приемлемые эксципиенты, где порошок представляет собой частицы, содержащие кристаллический ципрофлоксацина бетаин в количестве, составляющем от 50 до 70 мас.%, и смесь дистеароилфосфатидилхолина и дигидрата хлорида кальция в молярном соотношении 2:1 в количестве, составляющем от 30 до 50 мас.%.
В одном или нескольких вариантах осуществления настоящего изобретения способ изготовления высушенных распылением частиц заключается в том, что суспендируют кристаллический ципрофлоксацина бетаин в жидкости, представляющей собой субмикронную эмульсию капель, стабилизированную фармацевтически приемлемыми эксципиентами, с образованием исходного продукта, и подвергают исходный продукт распылительной сушке с получением высушенных распылением частиц, где частицы содержат ципрофлоксацина бетаин, на который нанесено пористое покрытие из фармацевтически приемлемых эксципиентов, где частицы имеют массовый медианный диаметр, составляющий от 1 до 5 мкм, массовый медианный аэродинамический диаметр, составляющий от 1 до 5 мкм, и шероховатость (Sv), составляющую от 3 до 10.
В одном или нескольких вариантах осуществления настоящего изобретения способ изготовления высушенных распылением частиц заключается в том, что суспендируют кристаллический ципрофлоксацина бетаин в жидкости, представляющей собой субмикронную эмульсию капель, стабилизированную фармацевтически приемлемыми эксципиентами, с образованием исходного продукта, и подвергают исходный продукт распылительной сушке с получением высушенных распылением частиц, где частицы содержат кристаллы ципрофлоксацина бетаина 3,5-гидрата, на который нанесено пористое покрытие из фармацевтически приемлемых эксципиентов, где частицы имеют массовый медианный диаметр, составляющий от 1 до 5 мкм, массовый медианный аэродинамический диаметр, составляющий от 1 до 5 мкм, и шероховатость (Sv), составляющую от 3 до 10.
В одном или нескольких вариантах осуществления настоящего изобретения способ лечения легочных инфекций заключается в том, что пациенту, нуждающемуся в этом, вводят путем ингаляции в эффективном количестве композицию, содержащую ципрофлоксацина бетаин, где композиция находится в форме порошка, представляющего собой частицы, которые содержат ципрофлоксацина бетаин в количество, составляющем от 50 до 70 мас.%, и имеют массовый медианный диаметр, составляющий от 1 до 5 мкм, массовый медианный аэродинамический диаметр, составляющий от 1 до 5 мкм, и шероховатость (Sv), составляющую от 3 до 10.
В одном или нескольких вариантах осуществления настоящего изобретения порошки для внутрилегочного введения изготавливают путем распылительной сушки исходного продукта на основе эмульсии с помощью мобильной сушилки небольшой мощности фирмы Niro при температуре на входе от 125 до 145°С и температуре на выходе от 60 до 80°С. Получаемые в результате частицы характеризуются пластинчатой морфологией, характерной для лекарственной субстанции, и на них наносят пористый слой покрытия из эксципиентов, при этом шероховатость (Sv) частиц составляет от 3 до 10.
В одном или нескольких вариантах осуществления настоящего изобретения порошки представляющие собой частицы, которые содержат флуорохинолон, вносят в капсулы №2 из гидроксипропилметилцеллюлозы (ГПМЦ), при этом вносимая масса составляет от 20 до 60 мг.
В одном или нескольких вариантах осуществления настоящего изобретения порошки, предлагаемые в настоящем изобретении, содержат в качестве лекарственной субстанции ципрофлоксацина бетаин и обладают временем полужизни, превышающим 3 ч, что способствует повышению эффективности в отношении Р. aeruginosa.
В одном или нескольких вариантах осуществления настоящего изобретения порошки, содержащие ципрофлоксацин, позволяют осуществлять лечение инфекций, вызываемых Pseudomonas aeruginosa, у пациентов, страдающих CF, в течение месячного «офф-периода», который следует после месячного «он-периода» лечения путем ингаляции тобрамицина TOBI®.
В одном или нескольких вариантах осуществления настоящего изобретения порошки, содержащие ципрофлоксацин, позволяют осуществлять лечение инфекций у страдающих ХОЗЛ пациентов.
В одном или нескольких вариантах осуществления настоящего изобретения порошки, содержащие ципрофлоксацин, позволяют осуществлять лечение вызываемых возбудителем сибирской язвы инфекций.
В одном или нескольких вариантах осуществления настоящего изобретения полученные путем сушки распылением порошки, содержащие ципрофлоксацин, оказывают позитивное воздействие на качество жизни пациентов, страдающих CF, путем улучшения продолжительной легочной функции (FEV1), при этом они требуют небольшого времени, например, менее пяти минут, для введения с помощью портативного ингалятора.
В одном или нескольких вариантах осуществления настоящего изобретения соотношение величин AUCв мокроте/АUСв плазме, обеспечиваемое эффективным направленным введением ципрофлоксацина бетаина в легкие, превышает 50, предпочтительно превышает 100, и более предпочтительно превышает 250.
В одном или нескольких вариантах осуществления настоящего изобретения частицы, предлагаемые в настоящем изобретении, которые содержат ципрофлоксацина бетаин, не требуется смешивать с грубыми частицами носителя, представляющего собой лактозу, для обеспечения очень высокой флуидизации и диспергирования порошка.
В одном или нескольких вариантах осуществления настоящего изобретения композиция, содержащая флуорохинолона бетаин, такой как ципрофлоксацина бетаин, характеризуется эффективностью введения в легкие с помощью портативных ингаляторов пассивного типа для сухого порошка, превышающей 30, 40, 50, 60% или более.
В одном или нескольких вариантах осуществления настоящего изобретения комбинация лекарственное средство/устройство содержит композицию, содержащую флуорохинолона бетаин, такой как ципрофлоксацина бетаин, которая может обеспечивать введение в легкие целевых доз (>10 мг) посредством одной ингаляции.
В одном или нескольких вариантах осуществления настоящего изобретения предлагаемая в настоящем изобретении терапевтическая препаративная форма, содержащая ципрофлоксацина бетаин, предназначена для лечения муковисцидоза, не-CF бронхоэктаза, больничной пневмонии, острого осложнения хронического бронхита или сибирской язвы.
Другие варианты осуществления изобретения включают любые два или большее количество из указанных выше отличительных признаков, аспектов, версий или вариантов осуществления изобретения.
Часть из дополнительных вариантов осуществления и отличительных признаков изобретения представлена в приведенном ниже описании, а часть должна стать очевидной для специалистов в данной области после изучения описания, или они могут быть реализованы при осуществлении настоящего изобретения на практике. Отличительные признаки и преимущества изобретения могут быть реализованы и достигнуты с помощью инструментальных средств, комбинаций и способов, представленных в описании.
Описание чертежей
Варианты осуществления настоящего изобретения дополнительно пояснены в приведенном ниже описании со ссылкой на представленные не ограничивающие объем изобретения чертежи, на которых показано:
на фиг.1 - график, иллюстрирующий примерные дозы различных терапевтических средств, которые необходимо вводить в легкие посредством внутрилегочного пути введения. Представлены также максимальные дозы, которые можно вводить в легкие посредством одной ингаляции с помощью портативных аэрозольных устройств. Противоинфекционные средства, такие как аминогликозиды и флуорохинолоны, требуют введения больших доз в легкие (10-100 мг), что приводит к тому, что типы возможных препаративных форм/устройств ограничены распылителями и ингаляторами для сухого порошка капсульного типа,
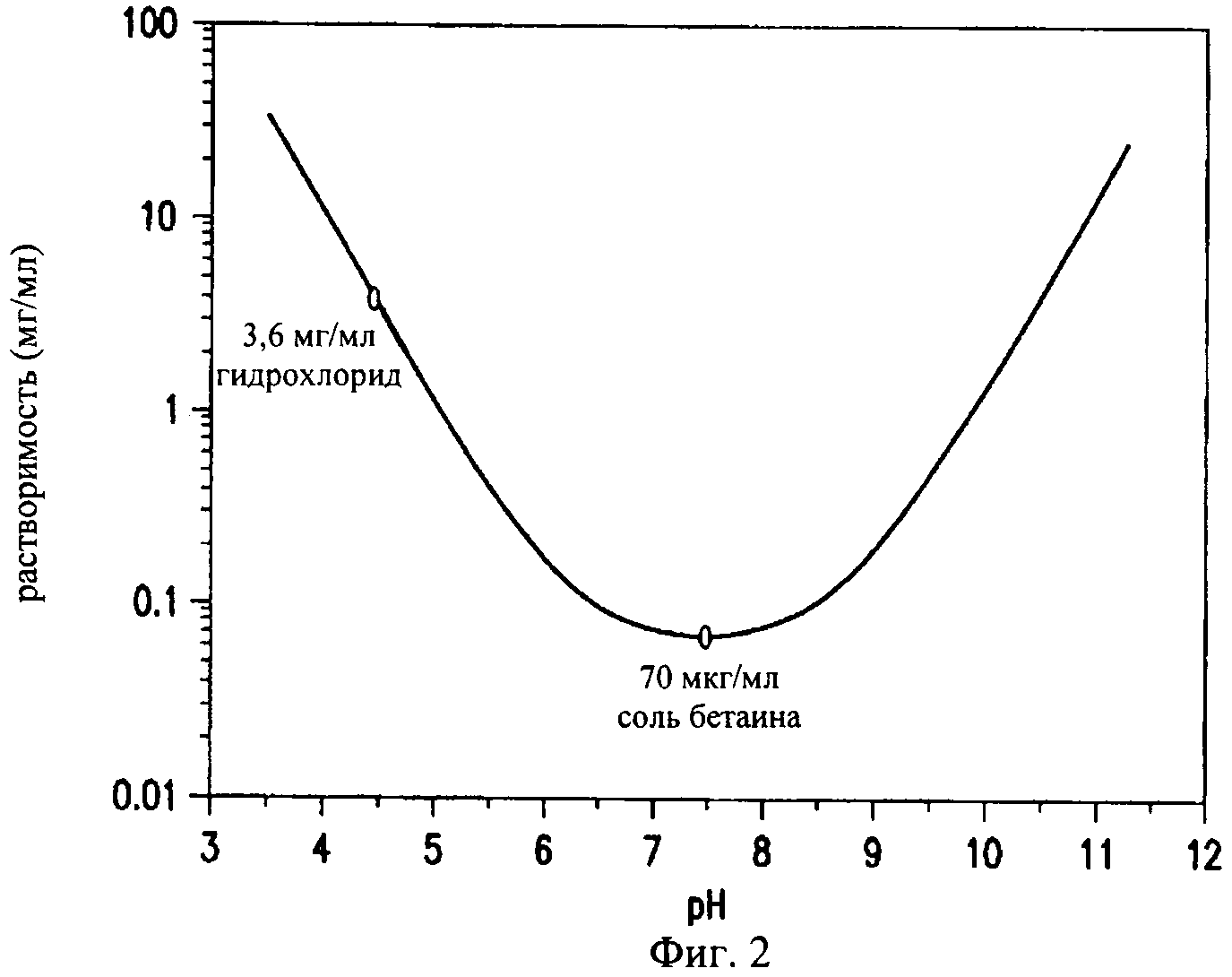
на фиг.2 - график, иллюстрирующий растворимость в воде ципрофлоксацина в 0,15М KCl в зависимости от значения рН. Ципрофлоксацина бетаин присутствует в цвиттерионной форме при значениях рН от 6,0 до 8,8. Растворимость в воде ципрофлоксацина бетаина при нейтральных значениях рН очень мала (70 мкг/мл), что позволяет его применять для получения препаративной формы с помощью процесса приготовления эмульсии на основе суспензии, в результате осуществления которого получают кристаллы с нанесенным на них покрытием в виде пористого слоя из гидрофобного фосфолипида,
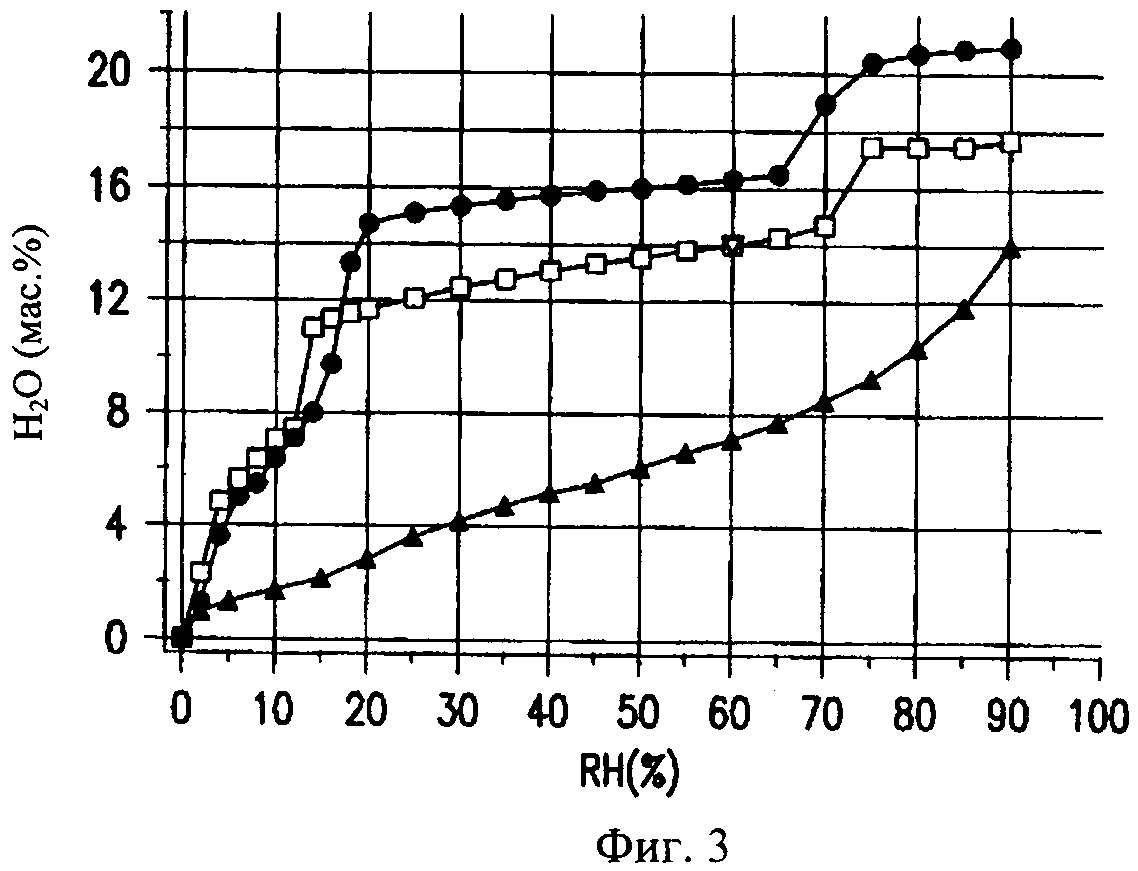
на фиг.3 - график, на котором представлены изотермы (при Т=25°С) равновесной сорбции паров воды лекарственной субстанцией, представляющей собой ципрофлоксацина бетаин (закрашенные кружочки), ингаляционным порошкообразным ципрофлоксацина бетаином, предлагаемым в настоящем изобретении, CIP (закрашенные квадраты) и порошком, представляющим собой плацебо (закрашенные треугольники). Представлена также отдельная экспериментальная точка (перевернутый треугольник), полученная для CIP методом титриметрии по Карлу Фишеру при относительной влажности (RH) 60%,
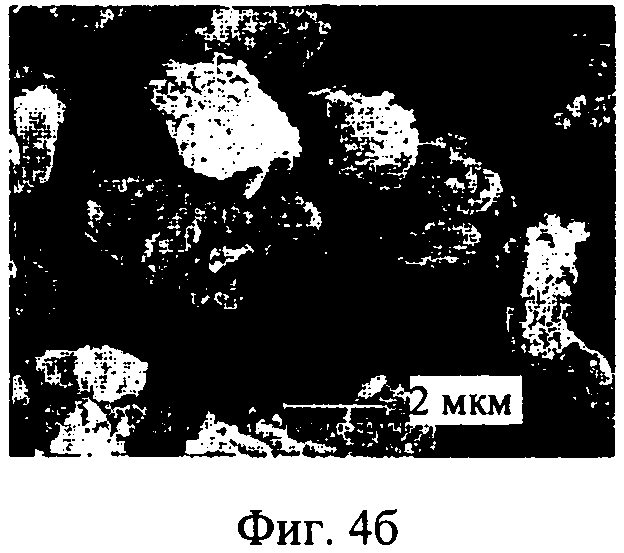
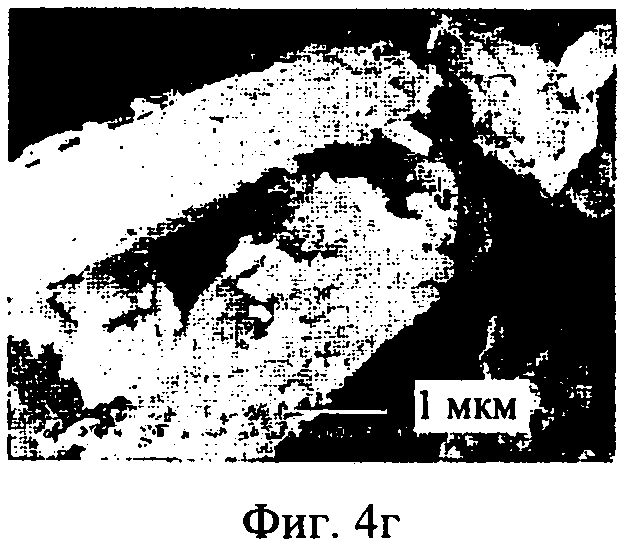
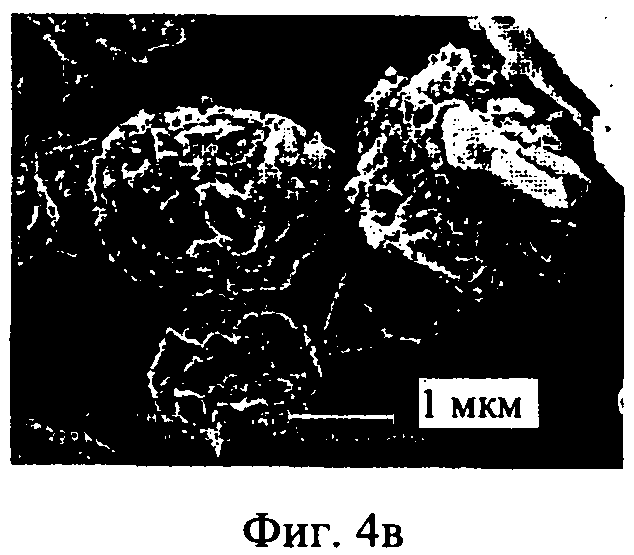
на фиг.4а-4г - полученные с помощью сканирующего электронного микроскопа фотографии тонкоизмельченного ципрофлоксацина бетаина (фиг.4Б, 4Г) и ингаляционного порошка ципрофлоксацина бетаина, предлагаемого в настоящем изобретении, CIP, неуплотненного порошка (фиг.4а, 4в) при увеличении 10000× и 20000× соответственно,
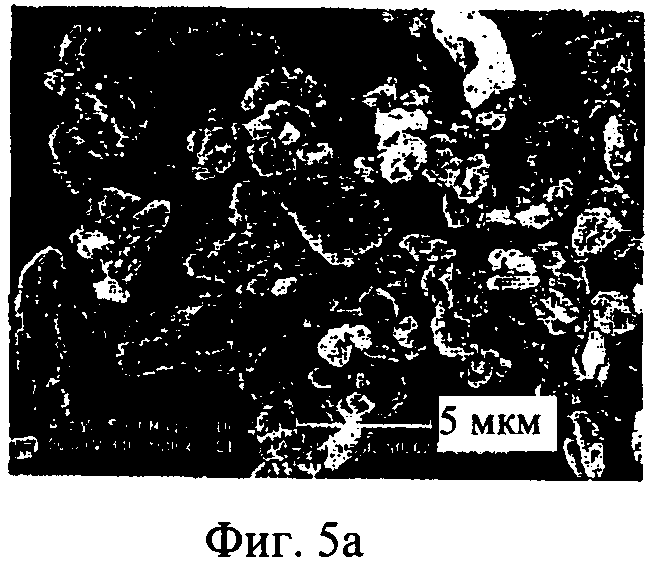
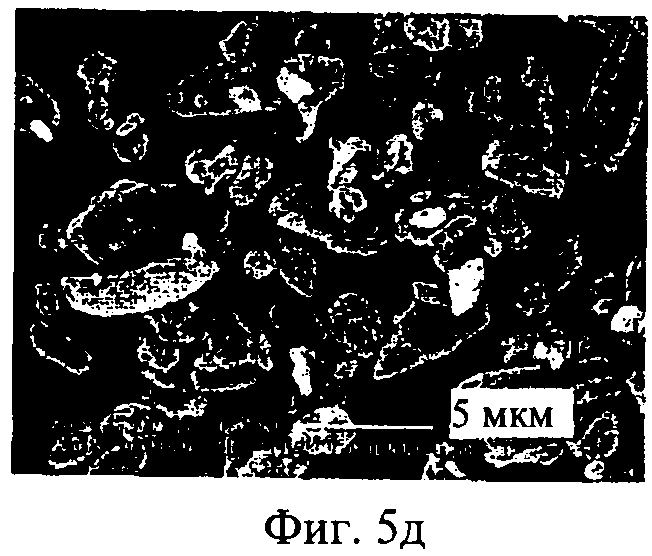
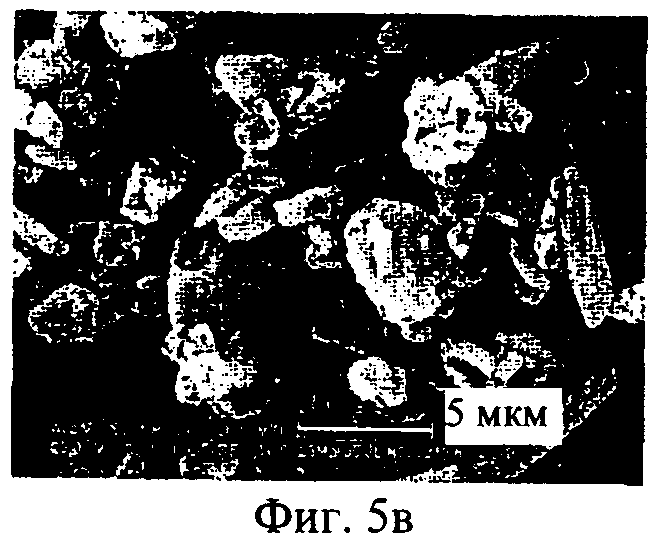
на фиг.5а-5е - полученные с помощью сканирующего электронного микроскопа фотографии нескольких образцов полученного распылительной сушкой ингаляционного содержащего ципрофлоксацина бетаин порошка, CIP, где образцы препаратов имеют различное содержание лекарственной субстанции 5(а): 50%, лот Н020239; 5(б): 50%, лот N020242; 5(в): 60%, лот N020240; 5(г): 60%, лот N020243; 5(д): 70%, лот N020241 и 5(е); 70%, лот N020244.
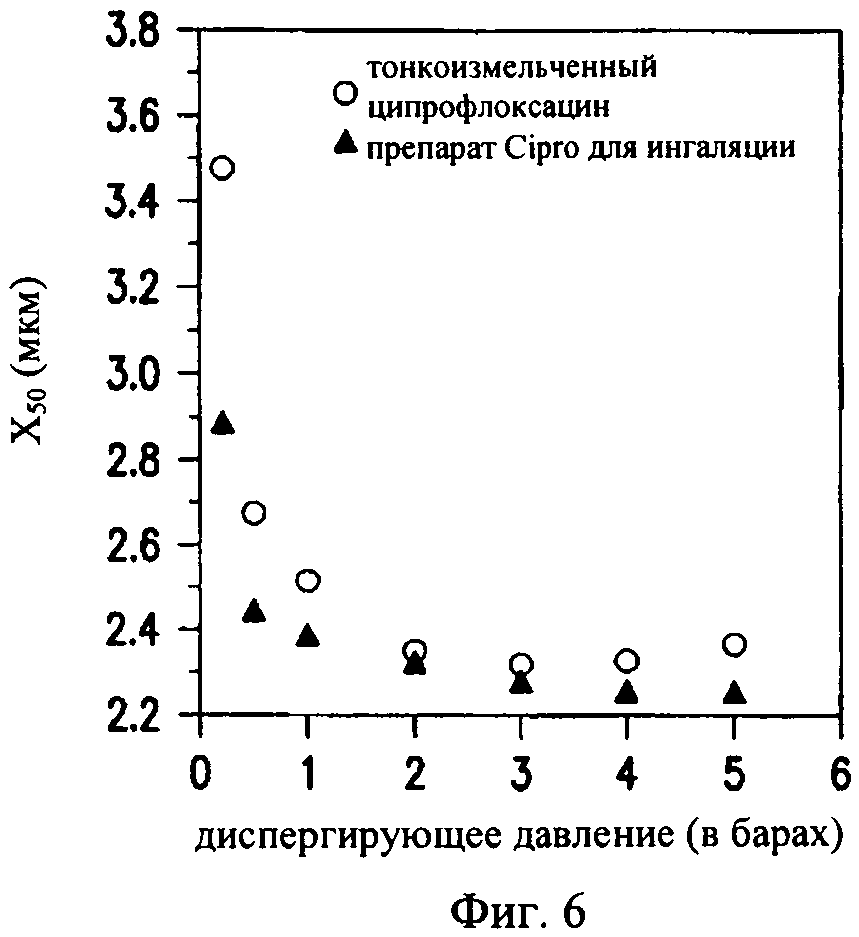
на фиг.6 - сравнение диспергируемости тонкоизмельченного ципрофлоксацина бетаина и полученного распылительной сушкой ингаляционного порошка ципрофлоксацина бетаина, предлагаемого в настоящем изобретении, CIP. Диспергируемость порошка оценивали количественно на основе измерения медианного диаметра частиц в зависимости от выталкивающего давления в распылителе типа RODOS, присоединенном к лазерному дифракционному устройству для измерения размеров фирмы Sympatec. CIP диспергируется до первичных частиц при намного меньшем выталкивающем давлении, чем тонкоизмельченное лекарственное средство, что является отражением уменьшения когезивных сил между частицами вследствие наличия пористого покрытия из фосфолипида,
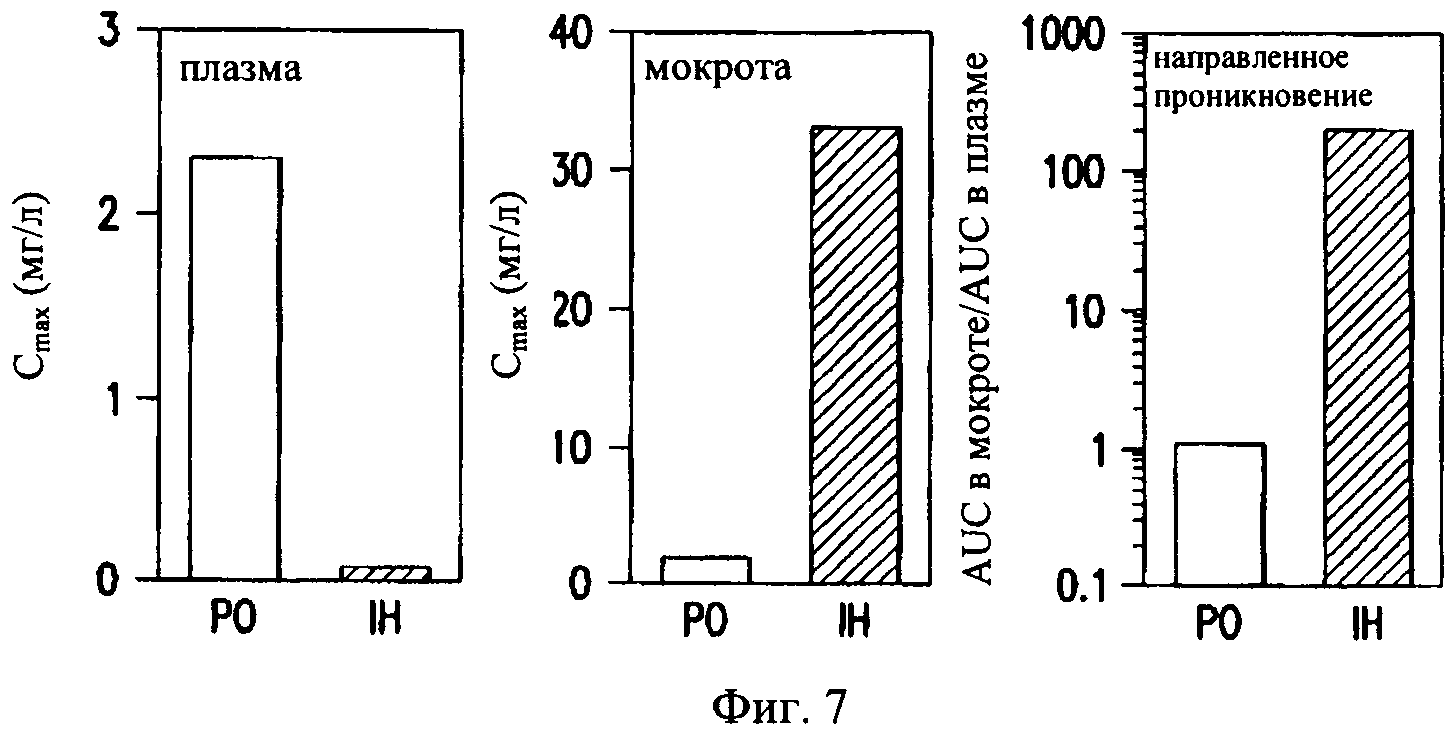
на фиг.7 - график, иллюстрирующий улучшенную способность направленно проникать в легкие при ингаляции ингаляционного порошка, содержащего ципрофлоксацина бетаин, предлагаемого в настоящем изобретении. На левой панели показано различие между величинами Cmax в плазме после орального введения (РО) 500 мг BID Cipro и введения путем ингаляции (IH) 32,5 мг QD ингаляционного порошка ципрофлоксацина бетаина, предлагаемого в настоящем изобретении, т.е. CIP. На средней панели представлены соответствующие уровни в мокроте. Наконец, на правой панели проиллюстрировано улучшенное направленное проникновение, обеспечиваемое ингаляцией, что видно по соотношению AUC в мокроте и AUC в плазме. Ингаляция ципрофлоксацина приводит к существенно более высоким концентрациям в мокроте и соответственно к низким системным уровням лекарственного средства. Направленное проникновение в легкие увеличивается в 250 раз при введении лекарственного средства путем ингаляции.
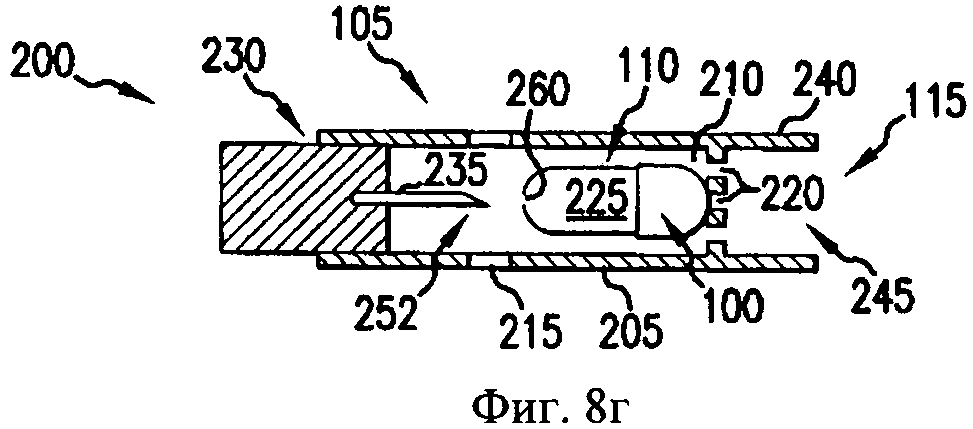
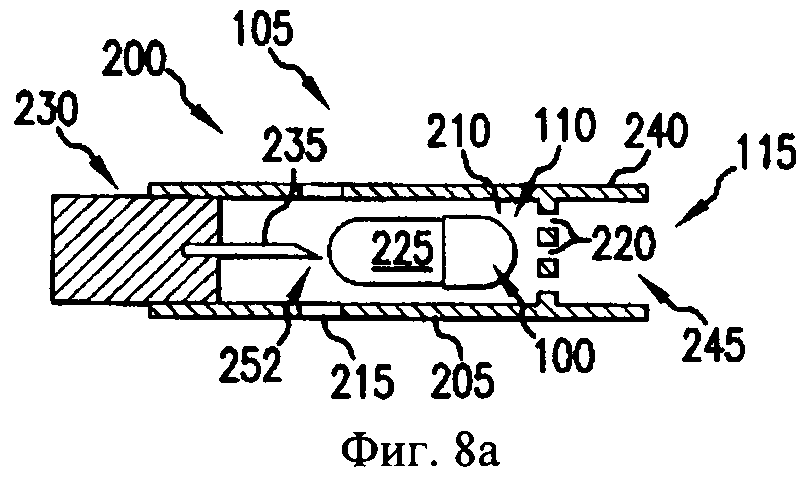
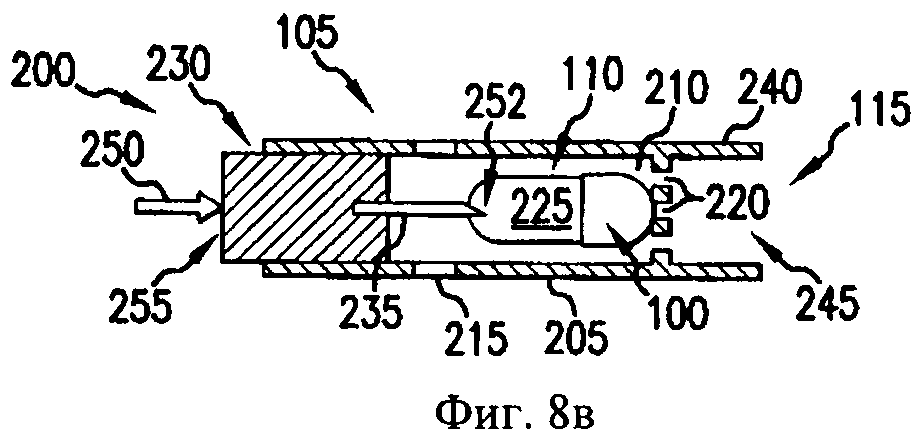
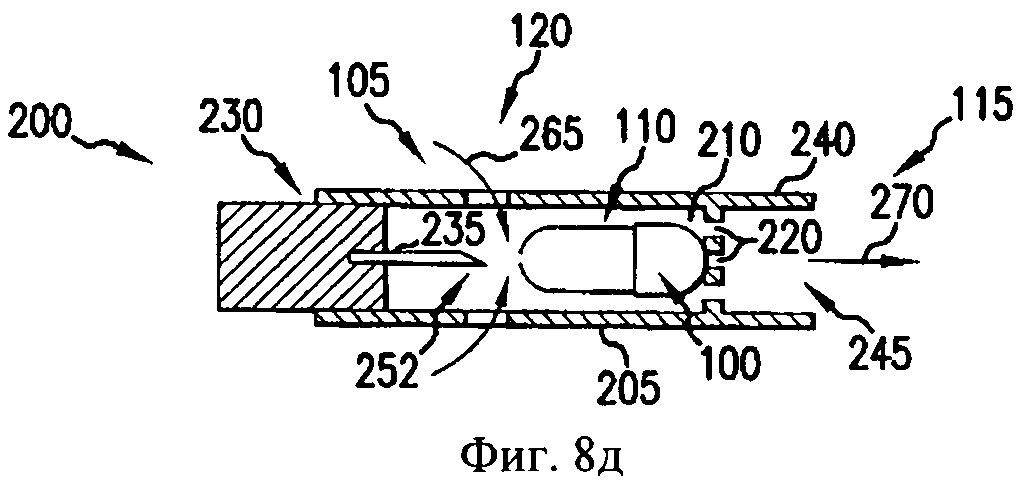
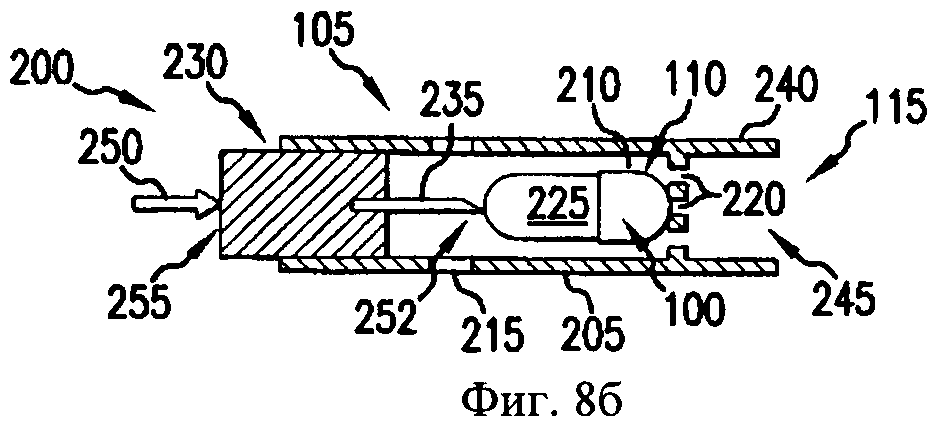
На фиг.8а-8д - схематичные изображения боковых проекций, иллюстрирующие работу ингалятора для сухого порошка, который можно применять для получения аэрозоля фармацевтической препаративной формы, предлагаемой в изобретении.
Описание
Определения
Следует иметь в виду, что, если не указано иное, то объем настоящего изобретения не ограничен конкретными компонентами препаративной формы, системами, предназначенными для введения лекарственного средства, методами изготовления, стадиями введения или т.п., поскольку их можно варьировать. Если не указано иное, то ссылка на соединение или компонент относится как к указанному соединению или компоненту индивидуально, так и к соединению, входящему в комбинацию с другими соединениями или компонентами, такую как смесь соединений.
Перед дальнейшим обсуждением даны определения ряда понятий, которые должны способствовать лучшему пониманию вариантов осуществления настоящего изобретения.
В контексте настоящего описания формы единственного числа включают также и множественное число, если из контекста ясно не следует иное. Так, например, понятие «фосфолипид» относится как к одному фосфолипиду, так и к двум или большему количеству фосфолипидов, входящих в комбинацию или смесь, если из контекста ясно не следует иное.
Когда указан диапазон величин, то подразумевается, что при этом имеется в виду также любая конкретная попадающая в него величина, которая находится между верхней и нижней границами на расстоянии до одной десятой величины его нижней границы. Он включает каждый меньший диапазон между любой указанной величиной или попадающей в указанный диапазон величиной и любой другой указанной величиной или попадающей в указанный диапазон величиной. Верхняя и нижняя границы этих меньших диапазонов могут быть независимо друг от друга включены в диапазон или исключены из него, и каждый диапазон, у которого любая одна, ни одной или обе границы включена(ы) в меньшие диапазоны, относится также согласно изобретению к любой конкретной исключенной границе в указанном диапазоне. Когда указанный диапазон включает одну или обе границы, то он включает также диапазоны, в которых исключена(ы) любая одна или обе границы.
Следует иметь в виду, что в контексте настоящего изобретения понятия «один из вариантов осуществления изобретения», «одна из версий» или «один из объектов» включают также один или несколько таких вариантов осуществления изобретения, версий или объектов, если из контекста ясно не следует иное.
В контексте настоящего изобретения понятия «лечить» и «лечение» относятся к уменьшению серьезности и/или частоты возникновения симптомов устранению симптомов и/или лежащей в их основе причины, снижению вероятности возникновения симптомов и/или лежащей в их основе причины и уменьшению или исцелению повреждения. Так, «лечение» пациента с помощью действующего вещества, предлагаемого в настоящем изобретении, включает предупреждение возникновения конкретного состояния, заболевания или нарушения у чувствительного индивидуума, а также лечение индивидуума, имеющего клинические симптомы.
В контексте настоящего изобретения понятие «терапевтически эффективное количество» относится к количеству, эффективному для достижения требуемого терапевтического результата. Терапевтически эффективное количество конкретного действующего вещества, как правило, должно варьироваться в зависимости от таких факторов, как тип и серьезность нарушения или заболевания, подлежащего лечению, и возраста, пола и веса пациента.
В контексте настоящего изобретения понятие «респираторные инфекции» включает, но, не ограничиваясь только ими, инфекции нижних дыхательных путей, такие как бронхоэктаз (как с муковисцидозными, так и не-муковисцидозными проявлениями), бронхит (как острый бронхит, так и острое осложнение хронического бронхита) и пневмонию (включая различные типа осложнений, возникающих в результате вирусных и бактериальных инфекций, в том числе в результате больничных и внебольничных инфекций).
В контексте настоящего изобретения понятие «насыпная плотность» относится к плотности, измеренной методом одноосевого сжатия при давлении, составляющем примерно 100000 фунтов/кв. дюйм. Это давление соответствует давлению, применяемому при автоматическом заполнении порошком резервуаров, таких как капсулы.
В контексте настоящего изобретения понятие «массовый медианный диаметр» или «MMD» относится к медианному диаметру множества частиц, как правило, находящихся в виде полидисперсной популяции частиц, т.е. популяции, в которой размеры частиц находятся в определенном диапазоне. Указанные в настоящем описании величины MMD определены методом лазерной дифракции (фирма Sympatec Helos, Клаусталь-Целлерфельд, Германия), если из контекста не следует иное. Как правило, образцы порошка вносят непосредственно в загрузочную воронку устройства для диспергирования сухого порошка типа RODOS фирмы Sympatec. Это можно осуществлять вручную или путем механического встряхивания, возбуждаемого концом вибрационного запитывающего элемента VIBRI. Образцы диспергируют до образования первичных частиц путем приложения сжатого воздуха (при давлении от 2 до 4 бар), при вакуумной откачке, максимальном для данного диспергирующего давления. Диспергированные частицы зондируют лучом лазера при длине волны 632,8 нм, который пересекает траекторию диспергированных частиц под прямыми углами. Свет лазера, рассеянный на ансамбле частиц, попадает на концентрический набор фотомножительных детекторных элементов с помощью набора линз с обратным Фурье-преобразованием. Рассеянный свет регистрируют с временными интервалами по 5 мс. Размеры частиц определяют методом обратного расчета с помощью запатентованного алгоритма на основе пространственного распределения/распределения интенсивности рассеянного света.
В контексте настоящего изобретения относительную диспергируемость полученных сушкой распылением порошков определяют по методу фирмы Sympatec (на основе лазерной дифракции), варьируя диспергирующее давление, создаваемое диспергирующим устройством RODOS, от примерно 0,2 до 4,0 бар. В контексте настоящего изобретения коэффициент диспергируемости, δ (дельта), определяют в виде отношения величины х50, измеренной при диспергирующем давлении 0,2 бара, к величине х50, измеренной при диспергирующем давлении 4,0 бара. Если коэффициент δ=1, то это свидетельствует о том, что порошок легко диспергируется при низком диспергирующем давлении, в то время как коэффициенты, меньшие 1, свидетельствуют о том, что при низких диспергирующих давлениях имеет место неполное диспергирование порошка.
В контексте настоящего изобретения удельная площадь поверхности (SSA) представляет собой SSA, рассчитанную на основе результатов оценки газовой адсорбции согласно теоретическому методу, разработанному Brunauer, Emmett и Teller (J Amer Chem Soc, 60, 1938, с.309), который обычно называют методом BET.
В контексте настоящего изобретения пористость частиц представляет собой общий объем пор, выраженный в %, который рассчитывают на основе результатов оценки абсорбции газообразного азота. При адсорбции азота происходит заполнение (и опустошение) пор азотом в соответствии с уравнением капиллярной конденсации Кельвина. При увеличении парциального давления азота конденсация газа должна начинаться в малых порах и затем охватывать все более и более крупные поры до тех пор, пока не наступит объемная (общая) конденсация. При использовании этой методики сначала азот конденсируют в порах, устанавливая парциальное давление азота на уровне, близком к насыщающему. Затем постепенно осуществляют ступенчатую десорбцию азота, понижая давление паров. Распределение размеров пор рассчитывают путем анализа изотермы десорбции азота с использованием уравнения Кельвина, определяя количество конденсированного в порах азота (предполагая, что поры имеют цилиндрическую форму), при этом потеря адсорбтива на каждом шаге представляет собой объем поровых каналов, опустошенных на этом шаге. Расчет производится автоматически на основе алгоритма, предложенного Barrett с соавторами (Barrett E.P., Joyner L.G., Halenda P.P.: The determination of pore volume and area distributions in porous substances I. computations from nitrogen isotherms. J Amer Chem Soc 73, 1951, сс.373-380). Такой подход применим для пор диаметром вплоть до примерно 2 нм, т.е. вплоть до уровня микропор.
Шероховатость (Sv) представляет собой меру неровности поверхности изготовленного порошка. Для целей настоящего изобретения шероховатость рассчитывают на основе удельной площади поверхности, полученной измерениями по методу BET, истинной плотности, измеренной методом гелиевой пикнометрии, и отношения площадь поверхности/объем частиц, полученного методом лазерной дифракции (метод фирмы Sympatec), а именно, по формуле: 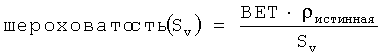 , в которой Sv=6/D32.
, в которой Sv=6/D32.
В контексте настоящего описания «массовый медианный аэродинамический диаметр» или «MMAD» представляет собой медианный аэродинамический размер множества частиц, как правило, находящихся в виде полидисперсной популяции частиц. «Аэродинамический диаметр» представляет собой диаметр сферы единичной плотности, которая имеет такую же скорость осаждения, как правило, в воздухе, что и порошок, и следовательно является пригодной характеристикой распыленного в виде аэрозоля порошка или иной диспергированной частицы, или состоящей из частиц препаративной формы с точки зрения процесса его(их) осаждения. Аэродинамический диаметр позволяет учесть форму частицы или частиц, плотность и физический размер частицы или частиц. Для целей настоящего изобретения MMAD определяют с помощью каскадного импактора, если из контекста ясно не следует иное.
В контексте настоящего изобретения понятие «испускаемая доза» или «ED» относится к характеристике поступления сухого порошка из ингаляторного устройства после приведения его в действие или образования дисперсии из содержащего порошок элемента или резервуара. ED определяют в виде отношения дозы, доставляемой ингаляторным устройством, к номинальной дозе (т.е. массы доставляемого порошка, испускаемой массы, к массе единичной дозы порошка, помещенной в соответствующее ингаляторное устройство перед его запуском). ED представляет собой определяемое экспериментальным путем количество и эту величину можно измерять в условиях in vitro с помощью установки, которая имитирует введение доз пациенту. Согласно настоящему изобретению для определения величины ED помещают номинальную дозу сухого порошка (как она определена в настоящем описании) в пригодное устройство для ингаляции, такое, например, как устройство для ингаляции сухого порошка (DPI) Turbospin® (фирма РН&Т, Италия), описанное в патентах США №4069819 и 4995385, содержание которых полностью включено в настоящее описание в качестве ссылки. Устройство для ингаляции приводят в действие, осуществляя диспергирование порошка. Затем образовавшееся облако аэрозоля откачивают из устройства с помощью вакуума (со скоростью 60 л/мин) в течение 2 с после приведения устройства в действие, при этом аэрозоль захватывают на тарированный стекловолоконный фильтр (фирма Gelman, диаметр 47 мм), присоединенный к мундштуку устройства. Количество порошка, которое достигает фильтра, представляет собой доставляемую дозу. Например, для капсулы, содержащей 5 мг сухого порошка, которую помещают в устройство для ингаляции, если диспергирование порошка приводит к удерживанию 4 мг порошка на тарированном фильтре, то величина ED для композиции сухого порошка составляет 80% [4 мг (доставляемая доза)/5 мг (номинальная доза)].
В контексте настоящего описания понятие «эффективное количество» относится как терапевтически эффективным количествам, так и к профилактически эффективным количествам.
В контексте настоящего описания понятие «ингалятор пассивного типа для сухого порошка» относится к устройству для ингаляции, в котором требуются вдыхающее усилие пациента для флуидизации и диспергирования фармацевтической композиции, содержащейся в устройстве в резервуаре или в форме стандартной дозы.
В контексте настоящего описания понятие «ингалятор активного типа для сухого порошка» относится к устройству для ингаляции, которое содержит средства, обеспечивающие подачу энергии для флуидизации и диспергирования композиции лекарственного средства, такие как сжатый газ и/или колеблющиеся или вращающиеся элементы.
Полное содержание и описание каждого процитированного в настоящем описании документа, включая любой и все патенты США и заявки на патент РСТ (или ex-US) и публикации заявок на патент США и заявок на патент РСТ (или ex-US), включены в настоящее описание в качестве ссылки для всех целей.
Описание изобретения
Настоящее изобретение относится к внутрилегочному введению действующего вещества в эффективной дозе в легкие с целью лечения легочных инфекций.
В одном или нескольких вариантах осуществления изобретения, представленных в настоящем описании, лекарственную субстанцию, представляющую собой действующее вещество, выбирают из семейства хинолоновых или хинолонподобных лекарственных средств (включая флуорохинолоны), таких как, но, не ограничиваясь только ими, налидиксиновая кислота, циноксацин, норфлоксацин, ципрофлоксацин, офлоксицин, эноксацин, моксифлоксацин, левофлоксацин и пефлоксацин. В одной конкретной версии препаративные формы и композиции содержат ципрофлоксацин, поскольку он обладает очень большой активностью в отношении Р. aeruginosa.
В одном или нескольких вариантах осуществления настоящего изобретения время нахождения в легких не контролируют путем капсулирования в систему носителя (например, в липосомы или полимерные носители), вместо этого требуемое время нахождения в легких (а также внутрилегочное введение в соответствующие области) обеспечивают с использованием препаративных форм, содержащих флуорохинолона бетаин, в форме, пригодной для ингаляции, которая представлена в настоящем описании. Так, в одном или нескольких вариантах осуществления настоящего изобретения они содержат флуорохинолона бетаин, такой как ципрофлоксацина бетаин, пригодный для ингаляции, и обеспечивают время полужизни в легких, превышающее 3 ч, что сопровождается повышением эффективности в отношении Р. aeruginosa по сравнению с растворимыми формами флуорохинолона, такими как ципрофлоксацина гидрохлорид.
Как правило, бактерии, вызывающие инфекции дыхательных путей (RTI) типа бронхита, острого осложнения хронического бронхита (АЕСВ) и CF, располагаются в полостях дыхательных путей, на поверхности слизистых клеток и внутри ткани бронхиальной слизистой оболочки. Установлено, что при пневмонии бактерии в основном присутствуют в альвеолах. Для того, чтобы достичь своих мишеней, а именно вызывающих заболевание патогенов, вводимые оральным или внутривенным путем антибактериальные агенты должны проникнуть в альвеолярное пространство; агенты должны пройти через альвеолярную мембрану, которая является относительно трудно проницаемой, и должны распределиться в жидкости эпителиальной выстилки (ELF), покрывающей поверхность слизистых клеток. Таким образом, концентрации антибактериальных агентов в ELF/мокроте можно рассматривать в качестве пригодного для клинических целей индикатора концентраций в области мишени. Следовательно, цель настоящего изобретения заключается в разработке препаративных форм для ингаляции, которые могут обеспечивать вдыхаемые в легкие дозы, составляющие 10-30 мг, за несколько вдохов (например, посредством одной ингаляции). Один или несколько вариантов осуществления изобретения относится(ятся) к комбинации препаративная форма/устройство, обеспечивающей эффективность введения в легкие, составляющую от 20 до 60 мас.%, это соответствует номинальной дозе, составляющей от 15 до 150 мг или от 0,3 до 3,0 мг/кг для молодого человека весом 50 кг.
Один или несколько вариантов препаративных форм, предлагаемых в настоящем изобретении, позволяют достигать высоких концентраций в области инфекции, превышающих величины MIC для Р. aeruginosa. Таким образом, фармакокинетические характеристики, обусловливающие воздействие на рост Р. aeruginosa и снижение вирулентности Р. aeruginosa, должны оказывать влияние на FEV1 в качестве фармако динамического коррелята. Кроме того, препаративные формы, предлагаемые в настоящем изобретении, могут снижать количество случаев возникновения и серьезность острых осложнений и улучшать качество жизни пациентов с CF за счет значительного уменьшения времени, требуемого для введения лекарственного средства.
Настоящее изобретение обладает дополнительными преимуществами. Например, как указано выше, для большинства других аэрозольных терапевтических средств требуются существенно более высокие дозы в легких, вне зависимости от того, для чего их вводят, для лечения местного заболевания легких или в качестве системного средства. Введение в легкие больших доз (>10 мг), которое традиционно осуществляли с помощью струйных распылителей, что является стандартной технологией при использовании препаративных форм и устройств для терапевтического лечения астмы (например, ингаляторов с дозировочной шкалой и многодозовых ингаляторов для сухого порошка), является неэффективным в случае введения доз такой величины. Как указано выше, вызываемые Р. aeruginosa инфекции у пациентов, страдающих муковисцидозом (CF) (вводимая в легкие доза ≈ 30 мг), в настоящее время лечат путем струйного распыления водных растворов аминогликозида тобрамицина (TOBI®, фирма Novartis, Эмеривилл, шт.Калифорния) с помощью распылителя типа PARI LC Plus. Установлено, что продолжительное время, необходимое для введения, и то, что струйные распылители не являются портативными, а также необходимость осуществлять большое количество ингаляций, оказывают негативное влияние на качество жизни пациентов, страдающих CF. В результате лечащий врач сталкиваются с проблемами соблюдения схемы и режима лечения. Вследствие того, что программы лечения требуется неукоснительно соблюдать, любая экономия времени, необходимого для лечения, рассматривается как огромный стимул для соблюдения пациентом схемы и режима лечения и улучшения его качества жизни. Возможность применять портативный ингалятор, который можно носить в кармане рубашки или сумочке, также является огромным преимуществом, поскольку пациент оказывается более не связанным с громоздким компрессором, требующим электрического питания. Таким образом, пациент может совершать длительные прогулки или заниматься какой-либо деятельностью вне дома и при этом иметь возможность вводить свое лекарственное средство.
Как указано выше, время нахождения водорастворимых флуорохинолонов, таких как ципрофлоксацина гидрохлорид, в легких является очень непродолжительным (время полужизни составляет примерно 0,2 ч) (Wong и др. в: «Liposomes in biomedical applications», под ред. А.Т. Florence, G. Gregoriadis, изд-во Harwood Academic Press, Amsterdam, 1995, сс. 105-120). Так, в одной из версий настоящего изобретения приготавливают препаративную форму композиции таким образом, чтобы флуорохинолон, такой как ципрофлоксацин, после введения в легкие имел время полужизни, составляющее по меньшей мере 0,3 ч. Еще более предпочтительно, когда время полужизни является существенно большим, например, составляет по меньшей мере 1,5 ч, более предпочтительно по меньшей мере 3 ч, и еще более предпочтительно по меньшей мере 6 ч.
Установлено, что в отличие от непродолжительного времени полужизни растворимого ципрофлоксацина время полужизни цвиттерионной формы, а именно ципрофлоксацина бетаина, при значениях рН, близких к нейтральным, существенно больше (Endermann R., Labischinski H., Ladel С.и др., Treatment of bacterial diseases of the respiratory organs, заявка на патент США 2004/0254194 A1).
Таким образом, один или несколько вариантов осуществления настоящего изобретения относится(ятся) к препаративным формам в виде сухого порошка ципрофлоксацина бетаина, предназначенным для ингаляции. Варианты ципрофлоксацина бетаина (и других флуорохинолонов) и методы лечения с использованием таких соединений описаны в публикации заявки на патент США 2004/0254194, содержание которой полностью включено в настоящее описание в качестве ссылки. Препаративные формы, содержащие бетаиновые производные других флуорохинолонов (например, левофлоксацин, моксифлоксацин), можно применять согласно настоящему изобретению вместо ципрофлоксацина бетаина или в дополнение к нему. Ципрофлоксацина бетаин обладает очень низкой растворимостью в воде (см. фиг.2). Так, один или несколько вариантов осуществления настоящего изобретения относится(ятся) к препаративной форме ципрофлоксацина бетаина в виде тонкоизмельченных кристаллов, на которые нанесено покрытие в виде пористого слоя из гидрофобного эксципиента, предпочтительно пористого слоя фосфолипида. Ципрофлоксацина бетаин образуется при значениях рН от 6,0 до 8,8. Предпочтительными являются значения рН, близкие к нейтральным.
В одном или нескольких вариантах осуществления изобретения по меньшей мере 50% кристаллических частиц ципрофлоксацина бетаина имеют массовый медианный диаметр (х50), составляющий менее чем примерно 5 мкм, более предпочтительно менее чем примерно 3 мкм, и еще более предпочтительно менее чем примерно 2 мкм. В одном или нескольких вариантах осуществления изобретения по меньшей мере 90% кристаллических частиц ципрофлоксацина бетаина имеют массовый медианный диаметр (х90), составляющий менее чем 10 мкм, более предпочтительно менее чем 7 мкм, и еще более предпочтительно менее чем 5 мкм. Величина MMAD образовавшихся частиц порошка зависит от исходного размера частиц, представляющих собой кристаллы ципрофлоксацина бетаина. Чем меньше величина MMD кристалла, тем меньше величина MMAD образовавшихся частиц порошка, содержащих ципрофлоксацина бетаин.
В одном или нескольких вариантах осуществления изобретения более крупные кристаллы ципрофлоксацина бетаина можно измельчать до достижения требуемого размера с помощью стандартных методов измельчения, включая, но, не ограничиваясь только ими, измельчение в струйной мельнице и измельчение в мельнице мокрого помола (гомогенизация при высоком давлении).
В альтернативном варианте или дополнительно измельчение можно осуществлять с помощью процессов осаждения, при осуществлении которых лекарственное средство растворяют в растворе и затем осаждают. К таким методам относятся распылительная сушка и сублимационная распылительная сушка. В данной области известны и другие процессы измельчения, которые включают но, не ограничиваясь только ими, методы обработки на основе сверхтекучей жидкости, такие как методы, описанные в WO 95/01221, WO 96/00610 и WO 98/36825, криогенное измельчение, мокрое измельчение, гомогенизация ультразвуком при повышенном давлении, микрофлуидизация, процессы кристаллизации, а также процессы, описанные в US №5858410, которые все полностью включены в настоящее описание в качестве ссылки.
Композиции, предлагаемые в настоящем изобретении, содержащие флуорохинолона бетаин, такой как ципрофлоксацина бетаин, могут включать действующее вещество в различных количествах. Например, количество флуорохинолона бетаина, такого как ципрофлоксацина бетаин, может составлять по меньшей мере примерно 30, 40, 50, 60, 70, 80 или 90 мас.%. В некоторых вариантах осуществления изобретения необходимые характеристики флуидизации и диспергируемости порошка получают в том случае, когда флуорохинолона бетаин, такой как ципрофлоксацина бетаин, присутствует в композиции в количестве, составляющем примерно от 50 до 70 мас.%.
Один или несколько вариантов осуществления изобретения относится(ятся) к фармацевтической композиции или препаративной форме, содержащей флуорохинолона бетаин, такой как ципрофлоксацина бетаин, и необязательно один или несколько фармацевтически приемлемых эксципиентов.
В одном или нескольких вариантах осуществления изобретения фармацевтически приемлемый эксципиент представляет собой один или несколько по меньшей мере частично гидрофобных эксципиентов. Например, гидрофобные эксципиенты могут представлять собой одно или несколько веществ, выбранных из группы, включающей липиды, мыла, представляющие собой соли жирных кислот с длинной цепью (такие, например, как стеарат магния, стеарат калия), гидрофобные аминокислоты или пептиды (такие, например, как лейцин, трилейцин), и холестерин.
В одном или нескольких вариантах осуществления изобретения фармацевтически приемлемые эксципиенты представляют собой липид, такой как фосфолипид. В одной из версий формируют фосфолипидный матрикс. Примеры фосфолипидных матриксов описаны в WO 99/16419, WO 99/16420, WO 99/16422, WO 01/85136 и WO 01/85137, и в патентах США №5874064; 5855913; 5985309 и 6503480, и в находящейся в процессе одновременного рассмотрения и в совместном владении заявке на патент США №10/750934, зарегистрированной 31 декабря 2003 г., содержание всех указанных документов полностью включено в настоящее описание в качестве ссылки.
В одном или нескольких вариантах осуществления изобретения эксципиенты присутствуют в виде пористого шероховатого покрытия, нанесенного на действующее вещество. Когда их таким образом отбирают и включают в состав препаративной формы, эксципиенты обеспечивают улучшение способности порошка к флуидизации и его диспергируемость по сравнению с «гладкими» покрытиями, характеризующимися малой пористостью или шероховатостью.
Фосфолипиды, полученные из природных или синтетических источников, можно применять в различных количествах. Когда фосфолипиды присутствуют, то их количество, как правило, должно быть достаточным для того, чтобы на действующее(ие) вещество(а) можно было нанести фосфолипидный слой, достаточный для образования пористого покрытия. Содержание фосфолипидов, в том случае, когда они присутствуют, как правило, составляет от примерно 10 до примерно 70 мас.%, например, от примерно 30 до примерно 50 мас.%.
Как правило, пригодными фосфолипидами являются такие фосфолипиды, которые имеют температуру фазового перехода из геля в жидкие кристаллы, превышающую примерно 40°С, например, превышающую примерно 60°С, или превышающую примерно 80°С. Пригодные для включения фосфолипиды могут представлять собой насыщенные липиды с относительно длинной цепью (например, С16-С22). Примерами фосфолипидов, которые можно применять в стабилизированных препаративных формах, предлагаемых в изобретении, являются, но, не ограничиваясь только ими, фосфатидилхолины, такие как дипальмитоилфосфатидилхолин и дистеароилфосфатидилхолин, и гидрогенизированный фосфатидилхолин из яичного желтка или из сои (например, Е-100-3, S-100-3, поступающие в продажу от фирмы Lipoid KG, Людвигсхафен, Германия). Встречающиеся в естественных условиях фосфолипиды предпочтительно являются гидрогенизированными с низким йодным числом (<10).
Фосфолипиды необязательно можно объединять с двухвалентным ионом металла. Присутствие такого двухвалентного иона металла приводит к снижению гидратации головной группы фосфолипида, усиливая тем самым фазовый переход фосфолипида из геля в жидкие кристаллы, и смачиваемость порошков в жидкости выстилки легких.
Примерами ионов металлов могут служить, но, не ограничиваясь только ими, двухвалентные катионы, включая ионы кальция, магния, цинка и т.п. Например, когда применяют фосфолипиды, то фармацевтическая композиция может содержать также поливалентный катион, как это описано в WO 01/85136 и WO 01/85137, содержание которых полностью включено в настоящее описание в качестве ссылки. Поливалентный катион может присутствовать в количестве, эффективном для повышения температуры плавления (tпл) фосфолипида таким образом, чтобы фармацевтическая композиция имела tпл, превышающую примерно 60°С, предпочтительно превышающую примерно 80°С или превышающую примерно 100°С. Молярное соотношение поливалентного катиона и фосфолипида может составлять по меньшей мере примерно 0,05:1, например, от примерно 0,05:1 до примерно 0,5:1. В одном или нескольких вариантах осуществления изобретения молярное соотношение поливалентного катиона и фосфолипида составляет примерно 0,5:1. Предполагается, что двухвалентный ион металла связывается с фосфатной группой на цвиттерионной головной группе фосфатидилхолина, вытесняя в процессе этого молекулы воды. Если молярные соотношения ионов металла и фосфолипида превышают 0,5, то это может приводить к тому, что свободные ионы металла не будут связываться с фосфатными группами. Это может существенно повышать гигроскопичность образующегося сухого порошка. Когда поливалентный катион представляет собой ион кальция, то он может находиться в форме хлорида кальция. Хотя в фосфолипид часто включают ионы металла, такого как кальций, не требуется присутствия других ионов (например, фосфата, который может приводить к осаждению ионов кальция в виде фосфата кальция) в препаративной форме, и их присутствие может приводить к определенным проблемам.
В одном или нескольких вариантах композиции, предлагаемой в настоящем изобретении, эксципиент может дополнительно или альтернативно включать добавки для дополнительного повышения стабильности или биосовместимости препаративной формы. Например, для этой цели можно рассматривать различные соли, буферы, хелаторы и маскирующие неприятный привкус вещества. Применение таких добавок известно обычным специалистам в данной области, и их конкретные количества, соотношения и типы веществ можно определять эмпирически без проведения излишних экспериментов.
В одном или нескольких вариантах композиции, предлагаемой в настоящем изобретении, эксципиент может дополнительно или альтернативно включать эксципиенты, которые выполняют сходные и/или альтернативные функции. Например, композиция может включать эксципиенты, обеспечивающие направленный перенос, для усиления направленного переноса частиц к конкретным клеткам (например, легочным макрофагам). В одной из версий изобретения фармацевтическая препаративная форма может содержать один или несколько обеспечивающих направленный перенос агентов. Например, фармацевтическая препаративная форма может содержать обеспечивающий направленный перенос агент, который направляет частицы и/или действующее вещество к клеткам-мишеням, таким как легочные макрофаги. Это особенно важно в том случае, когда фармацевтическую препаративную форму вводят с целью лечения инфекционного заболевания, когда патоген поглощается легочными макрофагами. Такие инфекционные заболевания трудно поддаются лечению общепринятыми методами системной терапии с использованием противоинфекционных действующих веществ. Однако при включении в них обеспечивающего направленный перенос агента частицы могут легче поддаваться поглощению легочными макрофагами и более эффективно транспортироваться к области инфекции. Такой метод лечения особенно эффективен при лечении туберкулеза, заболеваний, вызываемых крупными бактериологическими агентами, такими как возбудитель сибирской язвы, и некоторых типов рака. Обеспечивающие направленный перенос агенты могут представлять собой, например, один или несколько таких субстанций, как фосфатидилсерин, hIgG и мурамилдипептид, описанных в публикациях РСТ WO 99/06855, WO 01/64254, WO 02/09674 и WO 02/87542 и в патенте США 6630169, содержание всех документов полностью включено в настоящее описание в качестве ссылки. Процесс направленного переноса может быть более эффективным в том случае, когда действующее вещество остается в легких в течение продолжительного периода времени. В соответствии с этим в одной из версий фармацевтическая препаративная форма содержит обеспечивающий направленный перенос агент и липидный компонент в количестве, достаточном для гарантии того, что действующее вещество будет присутствовать в легком в течение заранее определенного периода времени, достаточного для лечения инфекционного заболевания, в том случае, когда патоген поглощается легочными макрофагами. Когда фармацевтическая препаративная форма содержит такой обеспечивающий направленный перенос агент, особенно важно, чтобы размер частиц предпочтительно был менее 6 мкм, поскольку более крупные частицы не могут легко поглощаться легочными макрофагами.
В одном или нескольких вариантах композиции, предлагаемой в настоящем изобретении, эксципиент может дополнительно или альтернативно включать пэгилированные фосфатидилэтаноламины, такие как ПЭГ2000-ФЭ и/или ПЭГ5000-ФЭ (где число обозначает молекулярную массу ПЭГ-звена), для еще большего увеличения времени нахождения в легких за счет того, что избегается клиренс с помощью макрофагов, и/или для облегчения проникновения частиц композиции в слой слизи или мокроты, выстилающий легочный эпителий. Частицы, имеющие геометрический размер менее 1 мкм, могут проникать также в биологические мембраны Pseudomonas aeruginosa.
Ципрофлоксацина бетаин можно получать в форме различных полиморфов и/или гидратов. В одном или нескольких вариантах осуществления изобретения ципрофлоксацина бетаин находится в форме 3,5-гидрата, которая, как было установлено, обладает очень высокой химической и физической стабильностью в условиях применения согласно настоящему изобретению. В одном или нескольких вариантах осуществления изобретения ципрофлоксацина бетаин, входящий в композицию, практически полностью находится в форме 3,5-гидрата. Как продемонстрировано на фиг.3, 3,5-гидрат присутствует в том случае, когда содержание воды в полученных распылительной сушкой порошках составляет примерно от 10 до 15 мас.%. Можно применять альтернативно или дополнительно также и другие полиморфы или гидраты, или смеси ципрофлоксацина бетаина, однако в условиях применения настоящего изобретения предпочтительным является 3,5-гидрат. При создании изобретения было установлено, что полиморфный ципрофлоксацина бетаин превращается в одну полиморфную форму, а именно в 3,5-гидрат, при осуществлении распылительной сушки с применением представленного в настоящем описании процесса распылительной сушки с использованием эмульсии. Это превращение имеет место, несмотря на то, что кристаллы остаются нерастворенными в процессе изготовления. Другие методы обработки, как правило, приводят к получению смеси гидратов.
В одной или нескольких версиях композиция для внутрилегочного введения находится в форме дискретных частиц, каждая из которых содержит флуорохинолон и эксципиент. Флуорохинолон присутствует в форме, в которой его время полужизни в легких составляет по меньшей мере 1,5 ч. Например, флуорохинолон может представлять собой флуорохинолона бетаин, такой как ципрофлоксацина бетаин. Согласно этой версии частицы имеют массовый медианный аэродинамический диаметр, составляющий от примерно 1 до примерно 5 мкм, и насыпную плотность, составляющую менее чем примерно 1,0 г/см3, более предпочтительно менее чем примерно 0,6 г/см3, и еще более предпочтительно от примерно 0,2 до примерно 0,5 г/см3.
В одной или нескольких версиях флуорохинолона бетаин, такой как ципрофлоксацина бетаин, включают в матрикс эксципиента, который образует дискретную частицу, и фармацевтическая композиция представляет собой множество дискретных частиц. Дискретные частицы можно откалибровать таким образом, чтобы их можно было легко вводить, и/или таким образом, чтобы их можно было применять по мере необходимости. Например, в случае пригодной для получения аэрозоля фармацевтической композиции частицы должны иметь размер, который позволяет частицам образовывать аэрозоль и позволяет вводить их в дыхательные пути пациента путем ингаляции.
В некоторых версиях фармацевтическая композиция находится в форме частиц, которые имеют массовый медианный диаметр, составляющий менее чем примерно 10 мкм, например, менее чем примерно 5 мкм, менее чем примерно 3 мкм или менее чем примерно 1 мкм, и он может составлять от 1 до 10 мкм, например, примерно от 1 до 5 мкм. В одном или нескольких вариантах осуществления изобретения массовый медианный диаметр частиц порошка составляет примерно от 1 до 3 мкм.
В одном или нескольких вариантах осуществления изобретения насыпная плотность полученного распылительной сушкой порошка составляет примерно 1,0 г/см3, более предпочтительно менее чем примерно 0,6 г/см3 и еще более предпочтительно от 0,2 до 0,6 г/см3.
В одном или нескольких вариантах осуществления изобретения значение рН порошка после восстановления составляет от 6,0 до 8,8. В одном или нескольких вариантах осуществления изобретения рН имеет такое значение, которое позволяет получать кристаллический ципрофлоксацина бетаин после восстановления.
В одном или нескольких вариантах осуществления изобретения содержание влаги в порошке составляет примерно от 10 до 15 мас.%. В одном или нескольких вариантах осуществления изобретения содержание влаги в полученном распылительной сушкой порошке является таким, которое позволяет получать полиморф, представляющий собой кристаллический ципрофлоксацина бетаина 3,5-гидрат.
В одном или нескольких вариантах осуществления изобретения удельная площадь поверхности частиц порошка составляет от 8 до 20 м2/г. В одном или нескольких вариантах осуществления изобретения пористость составляет примерно от 5 до 20%. В одном или нескольких вариантах осуществления изобретения шероховатость (Sv) составляет от 3 до 10. В одном или нескольких вариантах осуществления изобретения порошок, предлагаемый в настоящем изобретении, характеризуется по меньшей мере двумя из указанных в настоящем описании величин удельной площади поверхности, пористости и шероховатости. В одном или нескольких вариантах осуществления изобретения порошок, предлагаемый в настоящем изобретении, характеризуется по меньшей мере тремя из указанных в настоящем описании величин удельной площади поверхности, пористости и шероховатости.
В одном или нескольких вариантах осуществления изобретения порошок, предлагаемый в настоящем изобретении, имеет массовый медианный аэродинамический диаметр, составляющий от примерно 1 до примерно 5 мкм, например, от примерно 1,5 до примерно 4 мкм, или от примерно 2 до примерно 4 мкм. Как правило, если частицы слишком крупны, то лишь небольшое количество частиц может достичь нижней части легкого. Если частицы слишком малы, то больший процент частиц может быть удален в результате выдоха. Для того чтобы обеспечить поступление в легкие дозы, превышающей 10 мг, за требуемое количество ингаляций, предпочтительно, чтобы доза респирабельных частиц, т.е. частиц размером менее 4,7 мкм, составляла более 10 мг, более предпочтительно превышала 16 мг, и еще более предпочтительно превышала 20 мг.
В одном или нескольких вариантах осуществления настоящего изобретения применяют процесс распылительной сушки с использованием эмульсии для получения кристаллов флуорохинолона бетаина, на которые нанесено покрытие в виде пористого слоя, состоящего из гидрофобного эксципиента. Полученные в результате частицы можно вводить в высокой дозе нуждающимся в этом пациентам, которые страдают CF, посредством минимального количества ингаляций, например, посредством менее четырех, предпочтительно менее трех, более предпочтительно менее двух, и наиболее предпочтительно одной ингаляции.
В одном или нескольких вариантах осуществления изобретения композиции, предлагаемые в настоящем изобретении, находятся в форме порошков, состоящих из дискретных частиц. В одном или нескольких вариантах осуществления изобретения порошки получают с помощью процесса удаления растворителя. Хотя согласно настоящему изобретению можно применять несколько процедур, наиболее предпочтительные варианты осуществления изобретения, как правило, относятся к перфорированным микроструктурам или пористым частицам, которые образуются при распылительной сушке или сублимационной сушке. Хорошо известно, что распылительная сушка представляет собой процесс, при котором происходит превращение жидкого исходного продукта в высушенные частицы порошка. Касательно применений в фармацевтике, следует иметь в виду, что распылительную сушку применяют для получения порошкообразного продукта, предназначенного для введения различными путями, включая ингаляцию.
В одном или нескольких вариантах осуществления изобретения порошкообразные композиции, предлагаемые в настоящем изобретении, получают распылительной сушкой. В служащем в качестве примера варианте осуществления изобретения исходный продукт представляет собой флуорохинолона бетаин. Например, в одной из версий исходный продукт представляет собой тонкоизмельченные кристаллы флуорохинолона бетаина, такого как ципрофлоксацина бетаин, диспергированные в непрерывной фазе, представляющей собой эмульсию типа масло в воде. Исходный продукт может содержать также гидрофобный эксципиент, такой как фосфолипид. Диспергированная фаза в субмикронной эмульсии капель может содержать фторуглерод, но может и не содержать его. В одном или нескольких вариантах осуществления изобретения фторуглерод выбирают из группы, включающей перфтороктилбромид, перфтордекалин, перфтороктилэтан и их смеси. В одном или нескольких вариантах осуществления изобретения фторуглерод стабилизируют с помощью монослоя эксципиента, представляющего собой фосфолипид. В процессе распылительной сушки эмульсия капель способствует образованию пористого фосфолипидного покрытия на поверхности кристаллов бетаина. Концентрация действующего вещества и необязательных действующих веществ зависит от требуемого количества действующего вещества в конечном порошке и от типа ингалятора, предназначенного для применения. В одном или нескольких вариантах осуществления изобретения эти концентрации могут быть назначены заранее. Объем фторуглеродной фракции в исходном продукте, если фторуглерод присутствует, может составлять от 3 до 50% (мас./об.), предпочтительно примерно от 5 до 30% (мас./об.). Примеры полученных распылительной сушкой частиц, представляющих собой кристаллы с липидным покрытием, можно найти в WO 2004/060351, в патенте США 7326691 и в заявке на патент США 2006/0165606, содержание всех документов полностью включено в настоящее описание в качестве ссылки.
В одном или нескольких вариантах осуществления изобретения исходный продукт может содержать порообразователь. Порообразователь предпочтительно представляет собой фторированное соединение (например, перфторгексан, перфтороктилбромид, перфтордекалин, перфторбутилэтан), который испаряется в процессе распылительной сушки, как правило, оставляя после себя пористые частицы, такие как кристаллы бетаина с пористым покрытием из 1,2-дистеароил-sn-глицеро-3-фосфохолина (DSPC), которые являются «аэродинамически легкими». Как более подробно описано ниже, можно применять и другие пригодные порообразователи, такие как нефторированные масла, хлороформ, фреоны, этилацетат, спирты и углеводороды. В качестве пригодных порообразователей можно рассматривать также газообразный азот и диоксид углерода.
Хотя перфорированные микроструктуры предпочтительно следует формировать с использованием указанного выше порообразователя, следует иметь в виду, что в некоторых случаях не требуется применять дополнительных порообразователей и водную дисперсию лекарственного средства и/или эксципиентов и поверхностно активного вещества или поверхностно активных веществ можно непосредственно подвергать распылительной сушке. В таких случаях препаративная форма должна подходить для условий процесса (например, для повышенных температур), которые могут приводить к формированию сравнительно пористых микрочастиц.
При создании изобретения было установлено, что безотносительно к тому, какой порообразователь в конце концов выбран, если он вообще присутствует, пригодные микроструктуры наиболее эффективно можно получать с использованием распылительной минисушилки типа Buchi (модель В-191, Швейцария). Специалистам в данной области должно быть известно, что температуру на входе распылительной сушилки и температуру на выходе из распылительной сушилки следует выбирать на таком уровне, чтобы обеспечивать достижение требуемого размера частиц и получать продукт, обладающий требуемой активностью лекарственного средства. Поэтому температуры на входе и на выходе регулируют в зависимости от характеристик плавления компонентов препаративной формы и композиции исходного продукта. Специалистам в данной области известны поступающие в продажу распылительные сушилки, и для любой конкретной дисперсии легко можно определять пригодные регулировочные параметры путем стандартного эмпирического тестирования с учетом информации, приведенной в представленных ниже примерах.
Наиболее предпочтительные варианты осуществления настоящего изобретения относятся к полученным распылительной сушкой препаратам, содержащим поверхностно активное вещество, такое как фосфолипид, и действующее вещество, представляющее собой ципрофлоксацина бетаин. В других вариантах осуществления изобретения полученный распылительной сушкой препарат может дополнительно включать эксципиент, содержащий гидрофильный фрагмент, такой, например, как углевод (а именно, глюкозу, лактозу или крахмал), помимо любого выбранного поверхностно активного вещества. Для этой цели согласно настоящему изобретению можно применять различные крахмалы и дериватизированные крахмалы. Другими необязательными компонентами могут являться обычные модификаторы вязкости, буферы, такие как фосфатный буфер или другие обычные биосовместимые буферы или вещества, служащие для регулирования значения рН, такие как кислоты или основания, и вещества, служащие для регулирования осмотического давления (для обеспечения изотоничности, гиперосмолярности или гипоосмолярности). Примерами пригодных солей являются фосфат натрия (как одноосновный, так и двухосновный), хлорид натрия, фосфат кальция, хлорид кальция и другие физиологически приемлемые соли.
Когда в качестве материала матрикса используют фосфолипиды, то предпочтительно в исходный продукт дополнительно включают поливалентный катион, что описано в РСТ WO 01/85136 и WO 01/85137, содержание которых полностью включено в настоящее описание в качестве ссылки. Пригодными поливалентными катионами предпочтительно являются двухвалентные катионы, включая катионы кальция, магния, цинка, железа и т.п. Поливалентный катион присутствует в количестве, эффективном для повышения tпл фосфолипида таким образом, чтобы состоящая из частиц композиция имела tпл, превышающую ее температуру хранения ts по меньшей мере на 20°С, предпочтительно по меньшей мере на 40°С.
Какие бы компоненты не были выбраны, начальная стадия получения частиц, как правило, заключается в приготовлении исходного продукта. Предпочтительно выбранное лекарственное средство растворяют в воде с получением концентрированного раствора. В случае нерастворимых кристаллических действующих веществ, что, как правило, имеет место при осуществлении настоящего изобретения, лекарственное средство можно непосредственно диспергировать в эмульсии. Используемая концентрация действующего вещества или обладающего биологической активностью вещества зависит от требуемого количества агента в конечном порошке и от рабочих характеристик применяемого устройства для введения (например, от дозы респирабельных частиц для устройств типа MDI (ингалятор с дозировочной шкалой) или DPI (ингалятор для сухого порошка)). При необходимости к исходному продукту можно добавлять также дополнительные эксципиенты, например, из числа указанных выше.
В определенных вариантах осуществления изобретения затем приготавливают в отдельном сосуде эмульсию типа масло в воде. В качестве масла предпочтительно применяют фторуглерод (например, перфтороктилбромид, перфтордекалин), который эмульгируют с использованием поверхностно активного вещества, такого как насыщенный фосфолипид с длинной цепью. Например, можно гомогенизировать один грамм фосфолипида в 150 г горячей дистиллированной воды (например, при 60°С) с помощью пригодного механического смесителя с высокими сдвиговыми усилиями (например, смесителя типа Ultra-Turrax, модель Т-25) при 8000 об/мин в течение периода времени, составляющего от 2 до 5 мин. Как правило, добавляют по каплям при перемешивании от 5 до 25 г фторуглерода к диспергированному раствору поверхностно активного вещества. Затем образовавшуюся эмульсию перфторуглерода в воде обрабатывают с помощью гомогенизатора высокого давления для уменьшения размера частиц. Как правило, эмульсию обрабатывают при давлении, составляющем от 12000 до 18000 фунтов/кв. дюйм, осуществляя 5 отдельных включений устройства, и выдерживают при температуре от 50 до 80°С.
В каждом случае условия обработки, такие как температура на вход и на выходе, скорость подпитки, давление распыления, скорость потока воздуха, применяемого для сушки, и конфигурация сопла, следует выбирать в соответствии с инструкциями производителя для получения частиц требуемого размера и выхода конечного продукта в виде сухих микроструктур. Примерами регулировочных параметров являются: температура на входе от 60 до 170°С; температура на входе от 40 до 120°С; скорость подпитки от 3 до примерно 15 мл/мин; и скорость потока вдыхаемого воздуха 300 л/мин и скорость потока воздуха, применяемого для сушки, составляющую от 25 до 50 л/мин. Выбор соответствующего устройства и условий обработки находится в компетенции специалиста в данной области, и после ознакомления с настоящим описанием он может быть сделан без излишних экспериментов. В любом случае применение указанных и иных практически эквивалентных им методов обеспечивает формирование пористых «аэродинамически легких» микросфер с диаметрами частиц, при которых может происходить отложение аэрозоля в легком, т.е. пористых микроструктур, которые выглядят почти как соты или их внешний вид напоминает пену. В наиболее предпочтительных вариантах осуществления изобретения перфорированные микроструктуры представляют собой пористые полученные распылительной сушкой частицы. Содержание твердых частиц в полученном распылительной сушкой исходном продукте, как правило, должно составлять от 0,5 до 10 мас.%, например, от 1,0 до 5,0 мас.%. Регулировочные параметры, естественно, должны варьироваться в зависимости от типа применяемого оборудования. В любом случае применение указанных и иных практически эквивалентных им методов обеспечивает формирование кристаллов с нанесенным покрытием, которые имеют диаметры, при которых может происходить отложение аэрозоля в легком. Одним из имеющих решающее значение моментов является то, что температуру на выходе и температуру коллектора сушилки необходимо поддерживать на уровнях, не превышающих величины tпл образовавшейся препаративной формы.
Исходный продукт на основе эмульсии можно получать, осуществляя сначала диспергирование поливалентного катиона и фосфолипида в горячей дистиллированной воде (например, при 70°С) с помощью пригодного механического смесителя с высокими сдвиговыми усилиями (например, смесителя типа Ultra-Turrax, модель Т-25). Обычными условиями процесса могут являться перемешивание при 8000 об/мин в течение периода времени, составляющего от 2 до 5 мин. Затем по каплям при перемешивании добавляют фторуглерод к раствору диспергированного поверхностно-активного вещества. Затем образовавшуюся эмульсию фторуглерод в воде можно обрабатывать с помощью гомогенизатора высокого давления для уменьшения размера частиц. Как правило, эмульсию обрабатывают при давлении от 8000 до 20000 фунтов/кв. дюйм, осуществляя пять отдельных запусков устройства, в результате чего получают капли с медианным диаметром менее 600 нм. После этого в непрерывную фазу эмульсии добавляют тонкоизмельченный ципрофлоксацина бетаин и смешивают и/или гомогенизируют.
В одной из версий фармацевтическая препаративная форма состоит из пористых микроструктур и характеризуется насыпной плотностью, составляющей менее 1,0 г/см3, более предпочтительно менее чем 0,5 г/см3, более предпочтительно менее чем 0,3 г/см3, и в ряде случае менее 0,1 г/см3. В одной из конкретных версий насыпная плотность порошка составляет от 0,2 до 0,6 г/см3. За счет создания частиц с очень малой насыпной плотностью уменьшается минимальная масса порошка, который можно вносить в контейнер, рассчитанный на стандартную дозу, что уменьшает и часто устраняет необходимость в частицах-носителях. Таким образом, относительно низкая плотность порошков, предлагаемых в настоящем изобретении, позволяет обеспечивать воспроизводимое введение относительно низких доз фармацевтических соединений. Кроме того, отсутствие частиц-носителей потенциально должно минимизировать отложение в глотке и любой «рвотный» эффект, поскольку крупные частицы используемой в качестве носителя лактозы, которые, как правило, применяют в данной области, оказывают воздействие на глотку и верхние дыхательные пути вследствие своего размера. Применение настоящего изобретения может позволить устранить необходимость в таких крупных частицах.
В одном или нескольких вариантах осуществления изобретения порошкообразная препаративная форма, предлагаемая в изобретении, содержит действующее вещество, такое как флуорохинолон, в количестве, составляющем от примерно 50 до примерно 70 мас.%, более предпочтительно примерно 65 мас.%, гидрофобный эксципиент, такой как фосфолипид, в количестве, составляющем от примерно 15 до примерно 35 мас.%, более предпочтительно примерно 20 мас.%, материал, содержащий катион металла, в количестве, составляющем от примерно 1 до примерно 3 мас.%, более предпочтительно примерно 2 мас.%, воду в количестве, составляющем от примерно 10 до примерно 15 мас.%, более предпочтительно примерно 12 мас.%. В одной из конкретных версий порошкообразная препаративная форма, предлагаемая в изобретении, содержит ципрофлоксацина бетаин, предпочтительно в форме 3,5-гидрата, в количестве, составляющем от примерно 50 до примерно 70 мас.%, более предпочтительно примерно 65 мас.%, дистеароилфосфатидилхолин в количестве, составляющем от примерно 15 до примерно 35 мас.%, более предпочтительно примерно 20 мас.%, и дигидрат хлорида кальция в количестве, составляющем от примерно 1 до примерно 3 мас.%, более предпочтительно примерно 2 мас.%, воду в количестве, составляющем от примерно 10 до примерно 15 мас.%, более предпочтительно примерно 12 мас.%, и остаточное количество перфтороктилбромида, составляющее <1 мас.%.
Порошкообразную фармацевтическую препаративную форму можно вводить с помощью устройства для создания аэрозоля. В предпочтительной версии препаративная форма представляет собой порошок и ее вводят с помощью ингалятора для сухого порошка согласно процедуре, описанной в заявке на патент США, сер. номер 09/888311, зарегистрированной 22 июня 2001 г., в WO 02/83220, в патенте США 6546929 и в заявке на патент США сер. номер 10/616448, зарегистрированной 8 июля 2003 г. В альтернативном варианте устройство для создания аэрозоля может представлять собой распылитель, описанный в WO 99/16420. Содержание всех указанных патентов и заявок на патент полностью включено в настоящее описание в качестве ссылки.
В одной из версий порошкообразная композиция находится в форме сухого порошка и содержится в резервуаре, рассчитанном на стандартную дозу, который можно вставлять в аэрозолирующее устройство или помещать рядом с ним для того, чтобы превращать в аэрозоль стандартную дозу композиции. Такая версия обладает тем преимуществом, что сухую порошкообразную форму можно хранить в резервуаре, рассчитанном на стандартную дозу, в течение продолжительного периода времени. Кроме того, эта версия удобна тем, что в этом случае для получения аэрозоля не требуется ни охлаждения, ни внешнего источника энергии.
В некоторых случаях желательно вводить в легкие посредством одной ингаляции стандартную дозу действующего вещества, составляющую 5 мг или более, более предпочтительно 10 мг или более, и еще более предпочтительно 16 мг или более. Описанные выше содержащие фосфолипид пористые частицы сухого порошка позволяют вводить путем одной ингаляции и удобным образом дозы, составляющие 5 мг или более, 10 мг или более, 16 мг или более, 25 мг или более, и 32 мг или более. В альтернативном варианте дозу можно вводить путем двух, трех или четырех ингаляций. Для обеспечения этого насыпная плотность порошка должна предпочтительно составлять менее 1,0 г/см3, более предпочтительно менее чем 0,6 г/см3. В целом, в тех случаях, когда требуется вводить в легкие дозу, превышающую 5 мг, желательно также, чтобы нагрузка лекарственным средством составляла более чем 5%, более предпочтительно более чем 10%, еще более предпочтительно более чем 20%, еще более предпочтительно более чем 30%, и наиболее предпочтительно более чем 40%. Такие стандартные дозы фармацевтических препаративных форм могут содержаться в капсулах, которые можно вставлять в аэрозолирующее устройство. Для того, чтобы в них можно было помещать фармацевтическую препаративную форму и чтобы фармацевтическая препаративная форма находилась в пригодном для использования состоянии, капсулы должны иметь соответствующую форму, размер и должны быть сделаны из соответствующего материала. Например, капсулы могут иметь стенку, сделанную из материала, который не вступает в нежелательную реакцию с фармацевтической препаративной формой. Кроме того, стенка может быть сделана из материала, который позволяет вскрывать капсулы для того, чтобы иметь возможность превращать фармацевтическую препаративную форму в аэрозоль. В одной из версий, стенка состоит из одного или нескольких материалов, таких как желатин, гидроксипропилметилцеллюлоза (ГПМЦ), содержащие полиэтиленгликоль ГПМЦ, гидроксипропилцеллюлоза, агар или т.п. В одной из версий капсулы могут состоять из телескопически соединяемых секций, как это описано, например, в патенте США 4247066, содержание которого полностью включено в настоящее описание в качестве ссылки. Размер капсулы следует выбирать таким образом, чтобы он соответствовал содержащейся в ней дозе фармацевтической препаративной формы.
Размеры капсулы, как правило, варьируются от размера 5 до размера 000, при этом внешние диаметры варьируются от примерно 4,91 до 9,97 мм, высоты варьируются от примерно 11,10 до примерно 26,14 мм, и объемы варьируются от примерно 0,13 до примерно 1,37 мл соответственно, что проиллюстрировано в таблице 1. Пригодные капсулы поступают в продажу, например, от таких фирм, как Shionogi Qualicaps Co., Напа, Япония и Capsugel, Гринвуд, шт.Южная Каролина. После заполнения верхнюю часть можно помещать поверх нижней части, в результате чего образуется форма капсулы, внутри которой содержится порошок, как это описано в патентах США 4846876 и 6357490, и заявке на патент РСТ WO 00/07572, опубликованной 17 февраля 2000 г., содержание которых полностью включено в настоящее описание в качестве ссылки. В одной из версий порошок вносят в капсулы размера 2 или меньшего размера.
Предпочтительно применяют капсулы размера 2 и 3 для того, чтобы увеличивать до максимума дозу, которую можно вводить, но не превысить при этом объем или массу порошка, который/которую можно ввести путем одной ингаляции ребенку, страдающему CF.
|
После заполнения верхнюю часть можно помещать поверх нижней части, в результате чего образуется форма капсулы, внутри которой содержится порошок, как это описано в патентах США 4846876 и 6357490, и заявке на патент РСТ WO 00/07572, опубликованной 17 февраля 2000 г., содержание которых полностью включено в настоящее описание в качестве ссылки. После того как верхнюю часть помещают поверх нижней части, капсулу необязательно можно перевязывать.
Пример аэрозолизирующего устройства для сухого порошка, которое наиболее пригодно для аэрозолизации фармацевтической препаративной формы 100, предлагаемой в настоящем изобретении, схематически изображен на фиг.8А. Аэрозолизирующее устройство 200 содержит корпус 205, образующий камеру 210, которая имеет одно или несколько впускных отверстий 215 для воздуха и одно или несколько выпускных отверстий 220 для воздуха. Камера 210 имеет размер, позволяющий помещать в ней капсулу 225, которая содержит пригодную для аэрозолизации фармацевтическую препаративную форму. Например, капсула может содержать композицию в форме частиц, содержащих флуорохинолона бетаин, такой как ципрофлоксацина бетаин. Прокалывающий механизм 230 содержит прокалывающий элемент 235, который может перемещаться внутри камеры 210. Вблизи выходного отверстия 220 или непосредственно примыкая к нему находится концевая секция 240, которая может иметь такие размеры и форму, позволяющие вводить ее в рот или нос пользователя таким образом, чтобы пользователь мог вдыхать через отверстие 245 в концевой секции 240, соединяющееся с выпускным отверстием 220.
В аэрозолизирующем устройстве 200 для сухого порошка для аэрозолизации фармацевтической препаративной формы, находящейся в капсуле 225, применяют воздух, протекающий через камеру 210. Например, на фиг.8а-8д проиллюстрирована работа версии аэрозолизирующего устройства 200, в котором для аэрозолизации фармацевтической препаративной формы применяют воздух, протекающий через впускное отверстие 215, и аэрозолизированная фармацевтическая препаративная форма протекает через выпускное отверстие 220 так, что она может поступать в организм пользователя через отверстие 245 в концевой секции 240. Аэрозолизирующее устройство 200 для сухого порошка изображено в исходном состоянии на фиг.8а. Капсулу 225 помещают в камеру 210, и фармацевтическая препаративная форма находится в капсуле 225.
При применении аэрозолизирующего устройства 200 открывают доступ к фармацевтической препаративной форме, находящейся в капсуле 225, для превращения ее в форму аэрозоля. В версии, проиллюстрированной на фиг.8а-8д, прокалывающий механизм 230 поступательно перемещают в камере 210 путем приложения силы 250 к прокалывающему механизму 230. Например, пользователь может нажимать на поверхность 255 прокалывающего механизма 230 для того, чтобы заставить прокалывающий механизм 230 скользить внутри корпуса 205 так, чтобы прокалывающий элемент 235 пришел в контакт с капсулой 225, находящейся в камере 210, что проиллюстрировано на фиг.8б.
Если продолжать прикладывать силу 250, то это заставляет прокалывающий элемент 235 проникать в и через стенку капсулы 225, что проиллюстрировано на фиг.8в. Прокалывающий элемент может иметь один или несколько заостренных кончиков 252 для облегчения проникновения через стенку капсулы 225. Затем прокалывающий механизм 230 возвращают назад в положение, показанное на фиг.8г, оставляя отверстие 260 в стенке капсулы 225, открывающее доступ к фармацевтической препаративной форме, находящейся в капсуле 225. После этого пропускают воздух или иной газ через впускное отверстие 215, как показано стрелками 265 на фиг.8д. Поток воздуха вызывает превращение фармацевтической препаративной формы в аэрозоль.
Когда пользователь осуществляет вдох 270 через концевую секцию 240, то аэрозолизированная фармацевтическая препаративная форма поступает в дыхательные пути пользователя. В одной из версий поток воздуха 265 может создаваться при осуществляемом пользователем вдохе 270. В другой версии для создания аэрозолизирующего потока воздуха 265 можно впускать сжатый воздух или иной газ через впускное отверстие 215.
Конкретная версия аэрозолизирующего устройства 200 для сухого порошка описана в патенте США 4069819, патенте США 4995385, заявках на патент США №№10/298177; 10/295783; 10/821652; 10/821624; 10/822850; 10/704160; 10/714511 и 10/313419, содержание которых полностью включено в настоящее описание в качестве ссылки. При таком расположении камера 210 имеет продольную ось, которая, как правило, совпадает с направлением ингаляции, и капсулу 225 помещают в продольном положении в камеру 210 таким образом, чтобы продольная ось капсулы оказалась параллельной продольной оси камеры 210. Камера 210 имеет размер, достаточный для того, чтобы в ней помещалась капсула 225, содержащая фармацевтическую препаративную форму, таким образом, чтобы капсула имела возможность перемещаться внутри камеры 210. Впускные отверстия 215 имеют несколько тангенциально ориентированных прорезей. Когда пользователь осуществляет вдох через концевую секцию, то это заставляет внешний воздух протекать через тангенциальные прорези. Этот поток воздуха создает завихренный поток воздуха внутри камеры 210.
Завихренный поток воздуха заставляет капсулу 225 приходить в контакт с перегородкой и затем двигаться внутри камеры 210 таким образом, чтобы это заставляло фармацевтическую препаративную форму выходить из капсулы 225 и захватываться завихренным потоком воздуха. Эта версия наиболее эффективна для соответствующей аэрозолизации высоких доз фармацевтической препаративной формы. В одной из версий капсула 225 вращается внутри камеры 210 таким образом, что продольная ось капсулы остается под углом меньшим нескольких градусов, и предпочтительно меньше 45° по отношению к продольной оси камеры. Движение капсулы 225 в камере 210 может вызываться в том случае, когда ширина камеры 210 меньше, чем длина капсулы 225. В одной из конкретных версий камера 210 имеет скошенную секцию, которая оканчивается на кромке. Под действием завихренного потока воздуха в камере 210, передний конец капсулы 225 приходит в контакт с перегородкой и остается на ней, а боковая стенка капсулы 225 приходит в контакт с кромкой и скользит и/или вращается вдоль кромки. Такое движение капсулы наиболее эффективно для высвобождения большого количества фармацевтической препаративной формы через одно или несколько отверстий 260 в задней части капсулы 225.
В другой версии аэрозолизирующее устройство 200 для сухого порошка может иметь конфигурацию, отличную от конфигурации, представленной на фиг.8а-8д. Например, камера 210 может иметь такие размеры и форму, чтобы при помещении в нее капсулы 225 капсула 225 располагалась ортогонально к направлению ингаляции, как это описано в патенте США 3991761, содержание которого включено в настоящее описание в качестве ссылки. В патенте США 3991761 описано также, что прокалывающий механизм 230 может прокалывать оба конца капсулы 225. В другой версии в камеру можно помещать капсулу 225 таким образом, чтобы воздух протекал через капсулу 225, как это описано, например, в патенте США 4338931 и патенте США 56199S5. В другой версии аэрозолизацию фармацевтической препаративной формы можно осуществлять с помощью сжатого газа, протекающего через впускные отверстия, как это описано, например, в патенте США 5458135, патенте США 5785049 и патенте США 6257233, или с помощью пропеллента, как это описано в опубликованной заявке РСТ WO 00/72904 и патенте США 4114615. Содержание всех указанных выше ссылок полностью включено в настоящее описание в качестве ссылки.
В одной из версий частицы порошка вносят в резервуар капсульного типа и применяют в ингаляторе, например, одного из типов, представленных на фиг.8а-8д. В одном или нескольких вариантах осуществления изобретения испускаемая из капсулы масса составляет более чем примерно 50 мас.%, более предпочтительно более чем примерно 60 мас.%, более предпочтительно более чем примерно 70 мас.%, и еще более предпочтительно более чем примерно 80 мас.% или более чем примерно 90 мас.%. Относительное стандартное отклонение для испускаемой дозы предпочтительно может составлять менее 7%, и предпочтительно 4% или менее. Это обеспечивает очень высокую однородность содержимого дозы, которая может удовлетворять все возрастающим строгим регламентирующим стандартам. Композиция, которая получена не в соответствии с настоящим изобретением, может не удовлетворять такому критерию.
В альтернативном варианте можно применять другие ингаляторы для сухого порошка пассивного или активного типа. В одной из версий предпочтительно применяют ингалятор для сухого порошка пассивного типа вследствие простоты его применения и воспроизводимой аэрозолизации. Пригодными ингаляторами для сухого порошка пассивного типа могут служить как капсульные ингаляторы, так и блистерные ингаляторы. Наиболее предпочтительными являются капсульные ингаляторы пассивного типа вследствие того, что в них можно применять стандартные дозы большего объема (по сравнению с современными блистерными устройствами), что облегчает введение больших доз при одном вдохе.
Можно применять также устройства, которые имеются на рынке или поступают в продажу под следующим товарным знаком и/или следующими товарными знаками: Handihaler (фирма Boehringer Ingelheim), Eclipse (фирма Aventis), ингалятор AIR (фирма Alkermes), Cyclohaler (фирма Plastiape), Concept 1 (фирма Novartis), Flowcaps (фирма Hovione), Turbospin (фирма РН&Т), Monohaler (фирма Pfizer), Spinhaler (фирма Aventis), Rotahaler (фирма GSK). Пригодными блистерными ингаляторами являются: Diskus и Gemini (фирма GSK), устройство Nektar Therapeutics, описанное в заявке на патент РСТ US 2007/022830, содержание которой включено в настоящее описание в качестве ссылки, Gyrohaler (фирма Vectura), E-Flex, Microdrug, Diskhaler (фирма GSK). Под объем настоящего изобретения подпадают также ингаляторы для сухого порошка активного типа, которые описаны в патенте США 6257233, содержание которого включено в настоящее описание в качестве ссылки, Aspirair (фирма Vectura) и ингалятор Microdose (фирма Microdose).
Устройства пассивного типа в сочетании с порошками, предлагаемыми в настоящем изобретении, позволяют осуществлять независимое от скорости потока отложение в легких, за счет компенсации различий в инерционном отложении при увеличении пиковой скорости вдыхаемого потока (PIFR) в результате создания несколько более диспергированного порошка. В отличие от этого устройства активного типа могут приводить к обратной зависимости от скорости потока, т.е. когда дисперсия порошка является постоянной, но повышение инерционного уплотнения при увеличении PIFR может приводить к меньшему отложению при более высоких величинах PIFR.
Фармацевтическая композиция, представленная в одном или нескольких вариантах осуществления настоящего изобретения, как правило, обладает более высокой эффективностью с точки зрения испускаемой дозы. Следовательно, фармацевтическую композицию можно вводить в высоких дозах с использованием аэрозолизирующих устройств и способов, представленных в настоящем описании.
В одной или нескольких версиях настоящего изобретения фармацевтическую композицию, содержащую ципрофлоксацина бетаин, можно аэрозолизировать так, чтобы ее можно было вводить в легкие пациента путем ингаляции пациентом. В результате этого содержащийся в фармацевтической композиции ципрофлоксацин поступает непосредственно в область инфекции. Это представляет собой преимущество по сравнению с системным введением. Поскольку действующее(ие) вещество(а) часто вызывают почечную или иную токсичность, то часто дозу определяют исходя из минимизации системного воздействия. Следовательно количество действующего вещества или действующих веществ, которое(ые) можно вводить в легкие не внутрилегочными путями, например, путем системного введения, ограничено минимальной фармакологически эффективной дозой. При введении действующего вещества или действующих веществ непосредственно в легкие их можно вводить в большем количестве в область, нуждающуюся в лечении, значительно снижая при этом системное действие.
Так, один или несколько вариантов фармацевтических композиций, предлагаемых в настоящем изобретении, обладают эффективностью при лечении муковисцидоза, в том числе путем осуществления дополнительных лечебных мероприятий.
В одном или нескольких вариантах осуществления изобретения фармацевтическую композицию, содержащую флуорохинолона бетаин, такой как ципрофлоксацина бетаин, вводят в легкие пациента, нуждающегося в этом. Например, пациент может представлять собой пациента, у которого диагностирован муковисцидоз, не-CF бронхоэктаз, ХОЗЛ или больничная пневмония.
Так, фармацевтические композиции, предлагаемые в одном или нескольких вариантах осуществления настоящего изобретения, можно применять для лечения и/или профилактики пациентов с широким спектром заболеваний. Пациентом, пригодным для применения способов лечения и/или профилактики, предлагаемых в настоящем изобретении, может являться любое млекопитающее, нуждающееся в этом, прежде всего больной человек или больное животное. Примерами пациентов являются, но не ограничиваясь только ими, больные дети, взрослые пациенты и престарелые пациенты.
В одной или нескольких версиях аэрозолируемую фармацевтическую композицию, содержащую ципрофлоксацина бетаин, вводят в легкие пациента таким образом, чтобы обеспечить эффективную концентрацию ципрофлоксацина в легком, прежде всего, в нижней части легкого и/или в верхних дыхательных путях. В одном или нескольких вариантах осуществления изобретения количество или концентрация ципрофлоксацина и/или ципрофлоксацина бетаина, которая достигает легкого, представляет собой терапевтически эффективное количество, такое как количество, эффективное в отношении лечения CF. В одном или нескольких вариантах осуществления изобретения количество ципрофлоксацина бетаина, которое достигает легких при введении одной дозы, может составлять от примерно 10 до примерно 50 мг, например, от примерно 30 до примерно 40 мг.
В одном или нескольких вариантах осуществления изобретения терапевтическую дозу ципрофлоксацина бетаина вводят в организм пациента, нуждающегося в этом, посредством трех или четырех ингаляций, или меньшего количества, например, двух ингаляций, или посредством одной ингаляции. В предпочтительных вариантах осуществления изобретения терапевтическую дозу ципрофлоксацина бетаина вводят в организм пациента, нуждающегося в этом, посредством трех или меньшего количества ингаляций, например, двух ингаляций, или посредством одной ингаляции. В одном или нескольких вариантах осуществления изобретения терапевтическую дозу ципрофлоксацина бетаина вводят в течение промежутка времени, составляющего менее чем примерно три минуты, предпочтительно менее чем примерно две минуты или менее чем примерно одну минуту.
В одном или нескольких вариантах осуществления изобретения введение пригодной для ингаляции препаративной формы ципрофлоксацина бетаина страдающему муковисцидозом пациенту с применением композиций и устройств, представленных в настоящем описании, приводит к существенному улучшению качества жизни или улучшению соблюдения пациентом режима и схемы лечения, или к обоим указанным результатам.
Режим лечения с использованием ципрофлоксацина бетаина, предлагаемый в настоящем изобретении, можно применять индивидуально или в сочетании со средством, предназначенным для лечения эндобронхиальных инфекций, прежде всего инфекций, вызываемых Р. aeruginosa. Согласно этому объекту изобретения одно или несколько средств, применяемых для лечения эндобронхиальных инфекций, может(гут) представлять собой антибиотик, и его(их) можно вводить во время первого периода лечения с использованием ципрофлоксацина бетаина (или другого флуорохинолона бетаина), во время второго периода, в течение которого ципрофлоксацина бетаин не вводят в эндобронхиальную систему пациента, или во время и первого и второго периодов лечения. В одном из вариантов осуществления этого объекта изобретения одно или несколько средств, применяемых для лечения эндобронхиальных инфекций, вводят во время второго периода, в течение которого ципрофлоксацина бетаин не вводят в эндобронхиальную систему пациента. Пригодными средствами лечения эндобронхиальных инфекций являются, например, аминогликозиды, такие как тобрамицин, не-аминогликозидные противоинфекционные средства, такие как монобактам, β-лактам, макролид и/или соединения из группы гликопептидных антибиотиков. Например, не-аминогликозидное противоинфекционное средство может представлять собой азтреонам.
Согласно одному из конкретных режимов лечения, предлагаемых в настоящем изобретении, флуорохинолона бетаин, такой как ципрофлоксацина бетаин, вводят в течение «офф-периодов» лечения с использованием тобрамицина. Например, тобрамицин можно вводить в течение «он-периода» (например, в течение примерно одного месяца) и затем не вводить в течение «офф-периода» (например, в течение примерно одного месяца). В этой версии порошок, предлагаемый в настоящем изобретении, вводят в течение «офф-периода». В альтернативном варианте или дополнительно порошок, предлагаемый в настоящем изобретении, можно вводить в течение «он-периода». Продолжительности «оп-периода» и «офф-периодов» могут составлять один день, несколько дней, одну неделю, несколько недель, 28 дней, один месяц или несколько месяцев, или можно применять любую комбинацию указанных вариантов.
В других версиях композиция может содержать одно или несколько действующих веществ, отличных от описанных выше флуорохинолонов. Например, согласно настоящему изобретению можно приготавливать препаративные формы, включающие любое нерастворимое и/или кристаллическое действующее вещество.
Приведенное выше описание должно стать более понятным после ознакомления с представленными ниже примерами. Однако в указанных примерах представлены только репрезентативные способы воплощения на практике одного или нескольких вариантов осуществления настоящего изобретения и их не следует рассматривать как ограничивающие объем изобретения.
Примеры
Пример 1. Растворимость в воде ципрофлоксацина в зависимости от значения рН
Растворимость ципрофлоксацина в воде зависит от значения рН раствора (фиг.2). При значениях рН ниже значения pK для карбоновой кислоты (pK1=6,0) лекарственное средство находится в виде гидрохлорида и обладает очень высокой растворимостью в воде. Лекарственное средство растворимо также при значениях рН, превышающих значение pK для аминогруппы (pK2=8,8). Растворимость цвиттерионного ципрофлоксацина бетаина при значениях рН, близких к нейтральным, резко снижается примерно до 70 мкг/мл.
Пример 2. Динамическая сорбция паров содержащими ципрофлоксацин порошками
В одной из версий порошкообразная препаративная форма содержит ципрофлоксацина бетаина 3,5-гидрат в количестве, составляющем примерно 65 мас.%, дистеароилфосфатидилхолин в количестве, составляющем примерно 20 мас.%, и дигидрат хлорида кальция в количестве, составляющем примерно 2 мас.%, воду в количестве, составляющем примерно 12 мас.%, и остаточный перфтороктилбромид в количестве, составляющем менее 1 мас.%. Ниже в настоящем описании эта препаративная форма обозначена как CIP (порошок ципрофлоксацина для ингаляции).
Изотермы равновесной сорбции водяных паров (при 25°С) CIP, лекарственной субстанцией и порошком плацебо представлены на фиг.3. Все изотермы измеряли гравиметрическим методом сорбции водяных паров. Для оценки точности получения изотермы CIP, образец порошка уравновешивали при 25°С/60% RH и измеряли содержание воды титриметрическим методом Карла Фишера. Хороший уровень совпадения измеренного количества воды с величиной, полученной гравиметрическим методом сорбции, свидетельствует о том, что последний метод позволяет осуществлять точное измерение изотермы. Изгибы на изотерме лекарственной субстанции, представляющей собой ципрофлоксацин, характерны для кристаллического материала, образующего стехиометрические гидраты. Изменения наклона изотермы при величинах RH, равных примерно 5%, 17% и 65%, обусловлены трансформациями типа гидрат-гидрат. В изученном диапазоне величин RH наиболее стабильная твердофазная композиция существует в широкой пологой области при величинах RH от 20 до 60%. В этой области композиция находится в форме, соответствующей формуле ципрофлоксацин · 3,5H2O (или ципрофлоксацин2 · 7Н2О), в которой теоретическое содержание воды составляет 16,0 мас.%. Присутствие кристаллического 3,5-гидрата было подтверждено с помощью спектроскопии комбинационного рассеяния (данные не представлены). Изотерма сорбции водяных паров CIP качественно и количественно соответствует изотермам входящих в него компонентов, лекарственного продукта, представляющего собой ципрофлоксацин, и полученного распылительной сушкой плацебо (псевдокомпонент, содержащий DSPC и CaCl2). Качественно изотерма CIP напоминает изотермы его компонентов; изотерма CIP имеет изломы, характерные для лекарственной субстанции, представляющей собой ципрофлоксацин, и имеет несколько больший наклон в каждой точке (по сравнению с изотермой лекарственной субстанции), что обусловлено присутствием DSPC/CaCl2. С количественной точки зрения изотерма CIP представляет собой примерно линейную суперпозицию изотерм лекарственной субстанции, представляющей собой ципрофлоксацин, и плацебо. Так, изотерма CIP расположена примерно на 69% расстояния между изотермами его основных компонентов, как этого и следовало ожидать, исходя из содержания лекарственной субстанции в CIP (номинальное содержание 70%). Это не является неожиданным. Поскольку лекарственная субстанция и фосфолипид присутствуют в CIP в основном в виде раздельных фаз, то изотерма продукта, представляющего собой препаративную форму, должна представлять собой приблизительно взвешенную сумму изотерм входящих в него компонентов.
В области величин RH примерно от 20 до 65% ципрофлоксацина бетаин присутствует в форме 3,5-гидрата. Это соответствует содержанию влаги в полученном распылительной сушкой порошке, составляющему от 10 до 15 мас.%. Присутствие 3,5-гидрата в полученных распылительной сушкой порошках подтверждали методом спектроскопии комбинационного рассеяния. Было установлено, что 3,5-гидрат обладает стабильностью при хранении.
Пример 3. Получение содержащего ципрофлоксацин порошка, предназначенного для ингаляции
Содержащий цпрофлоксацин порошок, предназначенный для ингаляции (CIP), был разработан с конкретной целью, а именно, для улучшения направленного переноса ципрофлоксацина в бронхиальные дыхательные пути по сравнению с оральным и парентеральным путем введения, и повышения при этом также удобства применения пациентом (т.е., улучшения портативности и уменьшения времени, необходимого для введения) по сравнению с применяемыми в настоящее время распыляемыми антибиотиками.
CIP получали с помощью распылительной сушки гомогенизированной субмикронной эмульсии типа масло-в воде перфлуброна (перфтороктилбромид, PFOB) и воды для орошения (WFIr), содержащей 1,2-дистеароил-sn-глицеро-3-фосфохолин (DSPC), хлорид кальция и суспендированный ципрофлоксацина бетаин в количестве, указанном в приведенной ниже таблице 2. Тонкоизмельченные частицы ципрофлоксацина бетаина получали с использованием стандартных процессов измельчения в струйной мельнице или гомогенизации при высоком давлении. Состав исходного продукта, полученного на основе суспензии, для заданного размера партии 1 кг подробно указан в таблице 2. Объемная фракция диспергированного PFOB составляет примерно 0,1, а массовое соотношение PFOB/DSPC составляет примерно 20/1.
|
Исходный продукт получают, осуществляя сначала диспергирование DSPC и CaCl2 в теплой WFIr с помощью высокоскоростного смесителя (например, типа UltraTurrax) с образованием многослойных липосом. Затем медленно добавляют при перемешивании PFOB с образованием крупнозернистой эмульсии. Затем размер капель образовавшейся эмульсии уменьшают путем гомогенизации при высоком давлении с помощью гомогенизатора плунжерно-клапанного типа или микрофлуидизатора. Затем тонкоизмельченную лекарственную субстанцию добавляют к эмульсии, получая требуемый исходный продукт на основе суспензии. PFOB и водную фазу содержащего лекарственную субстанцию исходного продукта на основе эмульсии/суспензии выпаривают посредством распылительной сушки в распылительной сушилке типа Niro Mobile Minor, получая ципрофлоксацина бетаин, DSPC и хлорид кальция в форме безводных частиц. Полученные распылительной сушкой частицы содержат в остаточном количестве воду и PFOB, что указано в таблице 4.
|
Все применяемые нефармакопейные эксципиенты соответствуют требованиям, указанным в соответствующих монографиях USP/NF.
Препаративную форму в виде неуплотненного порошка вносят в индивидуальные пригодные для применения при ингаляции прозрачные капсулы из гидроксипропилметилчеллюлозы (ГПМЦ) размера 2, содержащие CIP в номинальном количестве 50 мг (CIP содержит ципрофлоксацина бетаин в количестве, составляющем примерно 65%, следовательно, каждая капсула содержит ципрофлоксацина бетаин в количестве, составляющем 32,5 мг или по меньшей мере примерно 32 мг).
Пример 4. Физико-химические свойства неуплотненного порошка CIP
Физико-химические свойства четырех партий неуплотненного порошка CIP, полученных согласно методу, описанному в примере 3, представлены в таблице 4. Идентичность, содержание и чистоту ципрофлоксацина определяли с помощью жидкостной хроматографии высокого разрешения с обращенной фазой (ОФ-ЖХВР) с УФ-обнаружением (согласно монографии Европейской Фармакопеи, посвященной описанию ципрофлоксацина). Тестирование идентичности CIP проводили на основе критерия идентичности времени удерживания (время удерживания пика для образца ципрофлоксацина не должно отличаться более чем на 0,5 мин от времени удерживания для референс-стандарта), и критерия идентичности УФ-спектра (в УФ-спектре образца ципрофлоксацина пик абсорбции наблюдается при длине волны 278±2 нм). Содержание ципрофлоксацина определяли по отношению к его содержанию в референс-стандарте, а чистоту рассчитывали путем стандартизации площади. Критерием приемлемости содержания ципрофлоксацина было присутствие ципрофлоксацина в количестве, составляющем от 90 до 110% от целевого среднего содержания (целевое количество = 32,5 мг) ципрофлоксацина на капсулу. Количественно оценивали присутствующие в ципрофлоксацине примеси В, С и D, указанные в ЕР, и в качестве критерия приемлемости для каждого вида примеси принимали величину ≤0,50%.
Содержание воды в CIP измеряли методом кулонометрической титриметрии по Карлу Фишеру. Система измерения по Карлу Фишеру включает кулонометр Карла Фишера типа Metrohm, модель 831, модель 800 Dosino и печь-автосэмплер для образца, модель 774 Oven Sample Processor. Для анализа образца автосэмплер вносит пузырек с образцом в печь при 140°С. Над нагретым образцом пропускают поток сухого азота (60±5 мл/мин) для переноса испаряющейся воды в титрационную ячейку, где она вступает во взаимодействие с безводным реагентом Карла Фишера. Титрование заканчивают, когда относительный стоп-дрейф достигает величины, составляющей 5 мкг/мин. Рабочие характеристики системы проверяли путем измерения содержания воды в стандартных образцах моногидрата цитрата калия (печь типа Hydranal®-Water Standard KF, фирма Riedel de Haen, 34748) до и после проведения измерений для образцов с неизвестным содержанием воды. Для каждого образца отвешивали по 10-70 мг порошка CIP в стеклянный пузырек, который закрывали пробкой и вносили в автосэмплер. Образцы приготавливали в трех повторностях. Для оценки количества воды, вносимого KF-системой и окружающей средой, в тех же условиях (RH и температура), которые использовали для приготовления образцов порошка, приготавливали три пустых «контрольных» пузырька.
Среднюю величину содержания воды в контроле вычитали из содержания воды, полученного титрованием для каждого образца.
Остаточное количество перфлуброна в неуплотненном порошке измеряли методом газовой хроматографии с использованием пламенно-ионизационного детектора. Процент остаточного содержания перфлуброна в неуплотненном порошке CIP определяли на основе сравнения с референс-стандартом USP перфлуброна. Предел количественной оценки составлял 0,05 мас.%.
Проводили испытание на микробиологическую чистоту (Microbial Limit Test, MLT) для подтверждения того, что содержание микробов в порошке, содержащемся в капсулах, удовлетворяет требованиям, указанным в проекте руководства, и Европейской Фармакопее. Пределы приемлемости общего количества аэробных микроорганизмов и общего количества дрожжей и плесневых грибов были выбраны на основе соответствующих пределов для вводимых путем ингаляции продуктов, предложенных в Pharmacopeial Forum, том 29(5), с.1733. Пределы приемлемости для грамотрицательных бактерий и энтеробактерий были выбраны таким образом, чтобы они соответствовали требованиям, указанным в Ph. Eur.5.1.4, касательно продуктов, предназначенных для введения в дыхательные пути. Предел приемлемости для специфических патогенов был выбран на основе USP<61>.
|
Содержание ципрофлоксацина в достаточной степени удовлетворяло критериям приемлемости. Процесс распылительной сушки оказывал лишь незначительное влияние на чистоту лекарственной субстанции, поскольку чистота сохранялась на уровне >99,93% для всех четырех лотов, при этом уровень ни одной из индивидуальных примесей не превышал 0,1%. Профиль примесей для ципрофлоксацина хорошо охарактеризован и соответствовал спецификациям лекарственной субстанции, указанным в монографиях USP и ЕР. Примеси В, С и D представляли собой единственные примеси, присутствовавшие в лекарственной субстанции, а примесь С представляла собой лишь родственную субстанцию, которая являлась также продуктом расщепления ципрофлоксацина. Другие известные для ципрофлоксацина примеси (Е и F), хотя они и перечислены в ЕР <1089>, не присутствовали ни в необработанном продукте, представляющем собой ципрофлоксацин, ни в продукте в виде препаративной формы. Ни одна из индивидуальных примесей не присутствовала в CIP в количестве, превышающем 0,1 мас.%.
Благодаря тому что созданные частицы получали с использованием водной суспензии лекарственного средства, размер первичных частиц в значительной степени определялся распределением размеров частиц лекарственной субстанции. Для четырех лотов, подробно охарактеризованных в таблице 4, величина х50 составляла от 2,4 до 2,5 мкм (при диспергирующем давлении 2 бара).
Остаточные уровни перфлуброна находились ниже предела количественного обнаружения (LOQ) для трех протестированных лотов (LOQ=0,05%), и лишь немного превышали LOQ (0,07%) для четвертого лота. Низкие остаточные уровни свидетельствуют о том, что используемые при осуществлении процесса вспомогательные средства эффективно удалялись в процессе производства (см. таблицу 4).
Результаты испытания на микробиологическую чистоту, проведенного для определения общего количества дрожжей и плесневых грибов, а также специфических патогенов, все удовлетворяли критериям приемлемости, установленным для продуктов в виде сухого порошка, предназначенного для ингаляции.
Пример 5. Аэрозольные свойства CIP-001
Аэрозольные свойства CIP из трех лотов, приготовленных согласно методу, описанному в примере 3, оценивали для аэрозолей, создаваемых с использованием портативного ингалятора для сухого порошка (а именно ингалятора, проиллюстрированного на фиг.8а-8е), представлены в таблице 5.
Средняя испускаемая масса порошка, как правило, составляла более 90 мас.%, при этом величины RSD, как правило, составляли менее 5%. Массовый медианный аэродинамический диаметр составлял примерно 3,6 мкм, при этом доля респирабельных частиц (FPF<4,7 мкм) составляла примерно 60 мас.% от номинальной дозы. Можно ожидать, что полученная в результате FPD<4,7 мкм после ингаляции дозы ципрофлоксацина бетаина, составляющей 32,5 мг, обеспечивает достижение терапевтической дозы менее чем за 3 вдоха или менее чем за два вдоха, например, за один вдох.
|
Пример 6. Стабильность при хранении препаративной формы CIP
Стабильность при хранении препаративной формы CIP, полученной согласно методу, описанному в примере 3, при 25°С/60% RH (таблица 6) и при 40°С/75% RH (таблица 7), подробно охарактеризована ниже. Препаративная форма CIP обладала очень высокой физической, химической и аэрозольной стабильностью в течение тридцати месяцев в условиях хранения при 25°С/60% RH и в течение 6 месяцев в условиях хранения при 40°С/75% RH.
|
|
Не было выявлено никаких существенных изменений в содержании ципрофлоксацина, чистоте ципрофлоксацина, содержании воды, средней массе и RSD (%) испускаемого порошка, массовом медианном аэродинамическом диаметре и дозе респирабельных частиц <4,7 мкм в указанных условиях хранения.
Пример 7. Влияние состава препаративной формы на свойства порошка
Влияние вариаций препаративной формы на свойства порошка CIP проиллюстрировано в таблице 8. Образцы порошка приготавливали согласно методу, описанному в примере 3. Указанные лоты получали с использованием распылительной сушилки типа Buchi. Для качественного анализа морфологии полученных распылительной сушкой частиц применяли электронную сканирующую микроскопию (SEM) (фиг.5а-5е). Для этой цели образцы закрепляли на кремниевые пластины, которые затем закрепляли на верхней стороне двухсторонней угольной ленты на алюминиевой стойку для SEM. На закрепленные образцы порошка наносили методом напыления покрытие из золота-палладия с помощью распылительной установки для нанесения покрытия типа Denton в течение 60-90 с при давлении 75 мТорр и токе 42 мА. Это позволяло создавать покрытие толщиной примерно 150 Å. Изображения получали с помощью системы типа Philips XL30 ESEM с использованием источника LaB6, работающего в режиме глубокого вакуума, и с применением детектора типа Everhart-Thornley для захвата вторичных электронов с целью визуализации композиции. Ускоряющее напряжение устанавливали на уровне 20 кВ и величину тока в луче устанавливали на уровне 33 мА. Рабочее расстояние составляло от 5 до 6 мм. Структура тонкоизмельченного ципрофлоксацина бетаина имела форму плоских пластинчатых кристаллов с широким распределением размеров от десятков нанометров до нескольких микронов (фиг.4б, 4г). Нанокристаллы лекарственного средства присутствовали в виде агломератов с более крупными кристаллами. Большая площадь контакта, характерная для плоских кристаллов, приводила к возникновению между частицами больших когезивных сил. В отличие от этого полученный распылительной сушкой неуплотненный порошок CIP имел более сферическую форму и меньшее содержание наночастиц. Морфологический признак в виде пористой поверхности четко выражен у частиц, полученных методом PulmoSphere (фиг.4а, 4в, 5а-5е). Не было выявлено изменений характеристик неуплотненного порошка (MMS, чистота, содержание влаги) при вариации лекарственной нагрузки в диапазоне от 50 до 70 мас.%.
|
Аэрозольные свойства указанных выше препаративных форм подробно описаны в таблице 9. Вариации лекарственной нагрузки (вплоть до содержания лекарственного средства, составляющего 70%) не приводили к изменению требуемых аэрозольных характеристик, а именно испускаемой дозы (ED), MMAD и FPF. Таким образом, лекарственные нагрузки, составляющие 50 или 60, или 70 мас.%, подпадают под объем предпочтительных вариантов осуществления настоящего изобретения.
|
Пример 8. Физико-химические свойства тонкоизмельченного ципрофлоксацина бетаина и CIP
Характеристики поверхности порошков CIP, полученных распылительной сушкой сложного исходного продукта, содержащего тонкоизмельченный ципрофлоксацина бетаин, диспергированный в непрерывной фазе эмульсии типа масло - в воде, представлены в таблице 10. Видно, что удельная площадь поверхности, пористость и шероховатость (Sv) частиц с фосфолипидным покрытием существенно выше, чем у тонкоизмельченной лекарственной субстанции. Следует ожидать, что увеличение шероховатости поверхности и/или пористости должно приводить к уменьшению когезивных сил между частицами в случае созданных частиц, повышая тем самым флуидизацию и диспергируемость порошка. В конечном итоге это приводит к достижению наблюдаемой очень высокой способности к образованию аэрозоля (большая испускаемая масса, низкая величина RSD) и к улучшению направленного введения аэрозоля в легкие.
|
Пример 9. Влияние неровности поверхности на диспегирование порошка Относительную диспергируемость порошкообразных препаративных форм можно изучать с помощью метода лазерной дифракции при варьировании диспергирующего давления в дозирующем устройстве типа RODOS. Сравнение характеристик тонкоизмельченного ципрофлоксацина бетаина и неуплотненного порошка CIP представлено на фиг.6. Хотя обе кривые сходятся до величин х50», составляющих от 2,3 до 2,4 мкм, при диспергирующем давлении примерно 4 бара, но при более низких диспергирующих давлениях кривые значительно расходятся. Величина xso Для тонкоизмельченного ципрофлоксацина бетаина при диспергирующем давлении 0,2 бара составляла 3,5 мкм, в то время как величина х50 для полученного распылительной сушкой порошка CIP составляла 2,9 мкм. Соотношение медианных размеров частиц, измеренных при низком и высоком диспергирующих давлениях, представляет собой характеристику диспергируемости порошка. В настоящем исследовании для тонкоизмельченной лекарственной субстанции был получен коэффициент диспергируемости δ, равный 0,67, а для полученного распылительной сушкой порошка - 0,78. Следовательно, для диспергирования полученного распылительной сушкой порошка CIP требуется намного меньше энергии, чем для диспергирования тонкоизмельченной лекарственной субстанции.
Пример 10. Влияние объемной фракции PFOB на свойства порошка CIP
Влияние объемной фракции PFOB на свойства порошка CIP проиллюстрировано в таблице 12 и таблице 13. Порошки получали согласно методу, описанному в примере 3, для партии размером 100 г с использованием составов исходного продукта для распылительной сушки, указанных в таблице 11. Указанные лоты приготавливали с использованием распылительной сушилки типа Niro Mobile Minor согласно методу, описанному в примере 3, и тестировали с помощью того же метода, который описан в примерах 4 и 5.
|
Вариации объемной фракции PFOB в пределах от 4,5 до 9% (мас./об.) в содержащем ципрофлоксацина бетаин исходном продукте для распылительной сушки не приводило к изменению размера первичных частиц (х10, x50 и x90) (таблица 12) и содержания ципрофлоксацина или требуемых аэрозольных характеристик, а именно ЕМ, MMAD и FPF (таблица 13). Однако, если PFOB совсем отсутствует, то характеристики размера первичных частиц смещаются в сторону более мелких частиц, поскольку на получаемых распылительной сушкой содержащих ципрофлоксацина бетаин частицах не образуется пористого покрытия из DSPC (таблица 12). Кроме того, отсутствие PFOB в исходном продукте для распылительной сушки приводит к образованию частиц, которые менее эффективно флуидизируются и диспергируются из заполненных капсул (таблица 13). Снижение способности к флуидизации порошка отражается в уменьшении средней испускаемой массы (ЕМ) (82% по сравнению с 93-94%), и в более высокой вариабельности испускаемой массы (RSD=9,4% по сравнению с 1,0%) по сравнению с препаративными формами, содержащими порообразующий агент. Снижение диспергируемости порошка в случае препаративных форм, не содержащих порообразующий агент, отражается в увеличении MMAD и уменьшении FPF. Хотя указанные различия оказались сравнительно небольшими в применяемых условиях тестирования (Q=60 л/мин, V=2 л), следует ожидать, что величина различий между препаративными формами будет еще больше возрастать при низких скоростях потока и вдыхаемых объемах, которые, как можно предполагать, характерны для некоторых пациентов, страдающих CF. Таким образом, исходные продукты для получения распылительной сушкой CIP, которые содержат объемные фракции PFOB, превышающие 4,5% (мас./об.) подпадают под объем предпочтительных вариантов осуществления настоящего изобретения.
|
|
Пример 11. Влияние размера кристаллов ципрофлоксацина бетаина на аэрозольные характеристики полученного распылительной сушкой CIP
Влияние распределения размеров частиц тонкоизмельченного ципрофлоксацина бетаина на аэрозольные характеристики полученных распылительной сушкой порошков CIP проиллюстрировано в таблице 14.
|
Было установлено, что при увеличении размера кристаллов содержащей ципрофлоксацин лекарственной субстанции наблюдается существенное увеличение MMAD и уменьшение FPF и FPD. Следует отметить тот факт, что способность к флуидизации порошка, которая определяется пористой природой фосфолипидного покрытия, нанесенного на кристаллы лекарственной субстанции, сохранялась вне зависимости от размера кристаллов.
Пример 12. Фармакокинетические характеристики вводимого путем ингаляции CIP
Фармакокинетические характеристики ципрофлоксацина изучали на здоровых добровольцах и пациентах с CF после введения путем ингаляции одной дозы CIP. Фармакокинетические характеристики в плазме и мокроте представлены в таблице 15 и таблице 16 соответственно. По сравнению с вводимым путем ингаляции гидрохлоридом ципрофлоксацина (ципрофлоксацин·HCl), для которого время полужизни в легких крыс составляет менее 1 ч, CIP обладал более продолжительным временем нахождения в легких (время полужизни в мокроте составляло от 5,5 до 9,0 ч в зависимости от дозы). Было установлено, что системные уровни ципрофлоксацина являлись очень низкими.
Улучшенное направленное введение в легкие вводимого посредством ингаляции CIP по сравнению с вводимым оральным путем ципрофлоксацином проиллюстрировано на фиг.7. Направленное введение в легкие охарактеризовано с помощью соотношения AUC в мокроте/AUC в плазме, величина которого в случае вводимого путем ингаляции CIP, более чем в 250 раз превышала соответствующую величину, достигаемую при оральном введении ципрофлоксацина.
|
|
Несмотря на то, что настоящее изобретение было очень подробно описано на примере его определенных предпочтительных версий, возможны и другие версии, и специалистам в данной области после ознакомления с описанием и изучения чертежей должны быть очевидны изменения, перестановки и эквиваленты проиллюстрированной версии. Можно также объединять разнообразными путями различные отличительные признаки представленных в настоящем описании версий, получая дополнительные версии настоящего изобретения. Кроме того, следует иметь в виду, что конкретная терминология была использована для обеспечения большей ясности описания, но не для ограничения настоящего изобретения. Следовательно, любой из пунктов прилагаемой формулы изобретения не ограничивается только представленными в настоящем описании предпочтительными версиями, и он должен включать все такие изменения, перестановки и эквиваленты, которые соответствуют истинной сущности и объему настоящего изобретения.