Результат интеллектуальной деятельности: КОМПОЗИЦИИ НА ОСНОВЕ ТАПЕНТАДОЛА ДЛЯ ЛЕЧЕНИЯ БОЛИ
Вид РИД
Изобретение
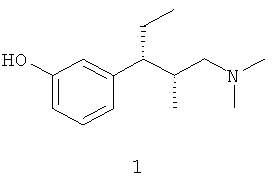
Тапентадол, 3-(3-диметиламино-1-этил-2-метилпропил)фенол (соединение 1) представляет собой центрально действующий анальгетик с двойным действием: агонизмом в отношении p-опиоидного рецептора и ингибированием обратного захвата серотонина. Его двойное действие обеспечивает обезболивание на том же уровне, что и в случае боли активных наркотических анальгетиков, таких как гидрокодон, оксикодон и морфин, с более переносимым профилем побочных эффектов. Тапентадол был описан впервые в патенте ЕР №693475 и в настоящее время его рассматривает FDA (Federal Drug Administration).
Традиционные составы на основе тапентадола для орального введения обеспечивают быстрое выделение лекарства в желудочно-кишечном тракте и, вследствие этого, его обезболивающее действие начинается быстро. Однако, наблюдается быстрое снижение анальгетической активности. Следовательно, лечение при помощи тапентадола требует повторного введения фармацевтической композиции с довольно короткими интервалами, часто от 4 до 10 раз в день, для поддержания требуемой концентрации активного ингредиента в плазме крови пациента. Необходимость в повторном дозировании может приводить к ошибкам при введении и к неспособности поддерживать желаемую концентрацию в плазме, что оказывается вредным для переносимости лекарства пациентом и для терапевтических целей, особенно если пациент испытывает хроническую боль или состояние, связанное с болью. Соответственно, существует необходимость в фармацевтических композициях с медленным или контролируемым высвобождением для орального введения активного ингредиента, тапентадола. Далее имеется необходимость в композициях, пригодных для длительного лечения боли и состояний, связанных с болью, особенно потому, что такие состояния очень распространены среди пожилых людей в обществе.
Прегабалин (соединение 2), аналог гамма-аминомасляной кислоты (GABA), является противосудорожным лекарством, которое применяется как вспомогательное средство при парциальных припадках, нейропатической боли и генерализованном тревожном расстройстве. Прегабалин был создан как более активный преемник габапентина и продается фирмой Pfizer под торговой маркой Lyrica®. Недавние исследования показали, что прегабалин эффективен при лечении хронической боли в случае таких расстройств, как фибромиалгия и повреждении спинного мозга.
Габаггентин (соединение 3) представляет собой другой аналог GABA, похожий на прегабалин, и был синтезирован для симуляции химической структуры нейротрансмиттера гамма-аминомасляной кислоты (GABA), но считается, что он не действует на те же рецепторы в мозгу. Точный механизм его действия неизвестен, но полагают, что его терапевтическое действие на нейропатическую боль вовлекает кальциевые потенциалозависимые каналы N-типа.
Большинство противовоспалительных лекарств, таких как нестероидные противовоспалительные лекарства (NSAIDs) ассоциируется с повышенным риском серьезных осложнений в верхнем желудочно-кишечном тракте. Считают, что этот риск зависит от дозы и может увеличиваться в тех случаях, когда вводится более одного противовоспалительного лекарства. Следовательно, когда это возможно, противовоспалительные лекарства должны вводиться как монотерапия. Этот риск может особенно проявляться в случае не являющихся производными аспирина нестероидных противовоспалительных (NA-NSAID) лекарств. Прием лекарств из группы NA-NSAIDs связан с четырех - пятикратным увеличением осложнений в верхнем желудочно-кишечном тракте (UGIC), Данные свидетельствуют, что указанный риск зависит от дозы. Подсчитанные обобщенные относительные сердечно-сосудистые риски (RR) при проведении недавнего мета-анализа составляли 3,0 (95% C1, 2,6-3,4) для низких доз, 4,1 (95% C1, 3,6-4,5) для средних доз и 6,9 95% C1, 5,8-8,1) для высоких доз. Последние исследования показывают, что NA-NSAID как терапевтический класс имеют RR порядка 4,1 (95% C1, 3,6-4,8).
Мелоксикам (соединение 4), производное оксикама, представляет собой член группы энольных кислот из класса нестероидных противовоспалительных лекарств (NSAIDs). Сообщается, что он является селективным ингибитором СОХ-2. Химическое название мелоксикама-4-гидрокси-2-метил-N-(5-метил-2-тиазолил)-2Н-1,2-бензотиазин-3-карбоксамид-1,1-диоксид. Он доступен под торговым названием MOBIC®, Мелоксикам показан для облегчения признаков и симптомов остеоартита и ревматоидного артрита, полиартикулярного ювенильного ревматоидного артрита или ювенильного ревматоидного артрита с олигосуставным поражением у пациентов в возрасте 2-х лет и старше.
Напроксен (соединение 5) является еще одним нестероидным противовоспалительным лекарством (NSAID), обычно используемым для ослабления слабой умеренной боли, лихорадки, воспаления и тугоподвижности, вызванной такими состояниями, как остеоартрит, ревматоидный артрит, псориазный артрит, зуд, анкилозирующий спондилит, травма (такая как трещины), менструальные боли, тендонит, бурсит, и для лечения первичной дисменореи. Химическое название напроксена-(+)-(S)-2-(6-метоксинафталин-2-ил)-пропановая кислота, он и его натриевая соль продаются под различными торговыми названиями, включая Aleve, Anaprox, Naprogesic, Naprosyn, Naprelan и Synflex. Были сообщения о том, что напроксен вызывает нарушения в желудочно-кишечном тракте, как и другие NSAIDs. Дополнительные NSAIDs включают, без ограничения, соединение 6, диклофенак; соединение 7, целекоксиб; соединение 8, дифлунисал; соединение 9, этодолак; соединение 10, фенопрофен; соединение 11, ибупрофен; соединение 12, индометацин; соединение 13, кетопрофен и соединение 14, кеторолак.
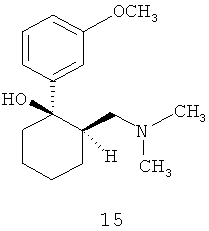
Трамадол (соединение 15) представляет собой действующий центрально синтетический опиоидный анальгетик. Его химическое название - (±)-цис-2-[(диметиламино)метал]-1-(3-метоксифенил)пиклогексанола гидрохлорид. Его коммерчески доступной формой является гидрохлоридная соль в виде таблеток Ultram. Трамадол применяли для ослабления умеренно сильной боли у взрослых. Трамадол является не-NSAID анальгетиком, считают, что он не приводит к увеличенному риску появления язв в желудке и внутреннему кровотечению, связанному с применением нестероидных противовоспалительных лекарств (NSAID). Однако, его применение приводит к появлению побочных эффектов, включая рвоту, констипацию, головокружение, головную боль, сонливость и тошноту. Другие побочные эффекты включают кожный зуд, потливость, сухость во рту, диарею, мимолетную сыпь, нарушение зрения и вертиго. Следовательно, было бы желательным предотвращение или уменьшение этих побочных эффектов при применении меньших доз трамадола без уменьшения ослабления боли.
В литературных источниках указано, что NSAIDs, такие как напроксен, могут ингибировать выделение натрия и лития. Следовательно, желательно контролировать их дозировку для ослабления побочных эффектов у пациентов без уменьшения степени ослабления боли. Точно так же сообщалось, что у субъектов, принимавших аналоги GABA, такие как прегабалин, отмечались такие побочные эффекты, как головокружение, сонливость, сухость во рту, отек, расплывчатое зрение, потеря веса, "аномальное мышление" (в основном, затруднения с концентрацией/вниманием).
Существует большая неудовлетворенная потребность в лекарствах, которые не приводят к появлению побочных эффектов, связанных с применением трамадола, прегабалина и NSAIDs. С учетом того, что такие лекарства часто применяются в течение длительного промежутка времени пожилыми пациентами для лечения боли, которая часто бывает хронической, композиции, которые позволяют уменьшить дозы или частоту приема лекарства, или и то, и другое без уменьшения терапевтического эффекта, могут отвечать этой медицинской неудовлетворенной потребности.
Для снижения количества опиоида, необходимого для обеспечения эквивалентной степени обезболивания и уменьшения побочных эффектов, возникающих при его приеме, опиоиды комбинировали с другими лекарствами, включая неопиоидные обезболивающие агенты. Сообщалось, что некоторые из таких комбинированных продуктов обеспечивают также синергический обезболивающий эффект. См., например, A.Takemori, Annals New York Acad. Sci., 281, 262 (1976), где указано, что композиции, включая комбинации опиоидных анальгетиков с неанальгетиками, проявляют различные эффекты, например, почти аддитивную (ингибирующую), аддитивную или сверх аддитивную активность. В источнике R. Taber et al., J. Pharm. Expt. Thera., 169 (1), 29 (1969) также описана комбинация морфиа и метадона, другого опиоидного анальгетика. В патенте США №4571400 описана комбинация дигидрокодеина, опиоидного анальгетика, и ибупрофена, неопиоидного анальгетика. См. также патенты США №№4587252 и 4569937, в которых описаны другие комбинации ибупрофена с опиоидами. А.Pircio et al., Arch. Int. Pharmacodyn., 235, 116 (1978) сообщали о смеси 1: 125 буторфанола, еще одного опиоидного анальгетика, и ацетаминофена, неопиоидного анальгетика, которая обеспечивает достижение большего эффекта, чем эта смесь в отношении 1:10.
Для того, чтобы избежать появления побочных эффектов, связанных с опиоидами, были получены комбинации неопиоидных анальгетиков, и такие комбинации имеют преимущество, состоящее в том, что для их получения требуется меньшее количество каждого ингредиента, они могут также обеспечивать появление дополнительных эффектов. См., например, G. Stacher et al., Int. J.Clin. Pharmacol. Biopharmacy, 17, 250 (1979), патенты США №№4260629, 4132788. Однако предупреждалось, что ежедневный прием смесей неопиоидных анальгетиков и прием одного неопиоидного анальгетика в больших количествах или в течение длительного времени может быть вредным (см., D.Woodbury and E Fingi, page 349). Кроме того, ибупрофен, аспирин и некоторые другие NSAIDs могут вызывать побочные эффекты в желудочно-кишечном тракте, особенно, если их принимать неоднократно. См., например, M.J. Langman, Am. J. Med. 84 (Suppl. 2A): 15-19, 1988); P.A.Insel in "Goodman and Gilman's The Pharmacological Basis of Therapeutics". Gilman AG, Rail TW, Nies AS, et al. (eds). Pergamon Press, 8th Ed, 1990, Chapter 26, pp.664-668.
Считается, что нейропатическая боль вызвана первичным повреждением или дисфункцией нервной системы. Нейропатическую боль подразделяют на периферическую нейропатическую боль, вызванную повреждением периферической нервной системы, и центральную боль вследствие поражения центральной нервной системы. Преобладание нейропатической боли по подсчетам составляет около 1%. Было показано, что нейропатическая боль устойчива к терапии. Однако для лечения нейропатической боли применяли ряд агентов, включая NSAIDs, опиоиды, антидепрессанты, противосудорожные средства, антагонисты возбуждающих аминокислот, GABA - ергические агонисты, антагонисты вещества Р и т.д. Вообще для лечения нейропатической боли рекомендованы низкие дозы карбамазепина и амитриптилина. Побочные эффекты, вызываемые агонистами GABA, такими как габапентин, прегабалин и т.д., зафиксированы в литературе. Однако желательно снижать их дозы для уменьшения у пациентов побочных эффектов без уменьшения степени облегчения боли.
В настоящее время для облегчения боли рекомендуют ряд способов лечения, включающих введение отдельных лекарств. Было показано, что отдельное применение наркотического и ненаркотического анальгетиков и NSAIDs приводит к облегчению боли. Сообщалось также, что в случае диабетической нейропатии некоторые антиэпилептические средства, такие как габапентин и прегабалин, облегчают боль.
Несмотря на преимущества от введения отдельных лекарств эти схемы лечения имеют недостатки. Существует настоятельная не удовлетворенная медицинская потребность в лекарствах, не приводящих к появлению побочных эффектов, характерных для тапентадола, трамадола, аналога GABA или NSAIDs. При этом следует учесть возможность возникновения нежелательных побочных эффектов, вызываемых многими схемами лечения, которые применяются в настоящее время. Опиоидные анальгетики, такие как морфин, прописывают обычно неохотнее для лечения боли вследствие хорошо известных эффектов привыкания. Известно также, что тапентадол вызывает неблагоприятные эффекты, включая тошноту, рвоту, сонливость, головокружение, кожный зуд, сухость во рту, потливость, торможение и констипацию.
Однако необходима фармацевтическая композиция, содержащая тапентадол с замедленным высвобождением и второй анальгетик, где второй анальгетик представляет собой трамадол, аналог гамма - аминомасляной кислоты (GABA) или NSAID, для лечения пациента, нуждающегося в этом. Кроме того, в уровне техники не описан способ лечения боли или нарушения, связанного с болью путем введения млекопитающему, нуждающемуся в этом, фармацевтической композиции, включающей тапентадол с замедленным высвобождением и второй анальгетик, при этом второй анальгетик представляет собой трамадол, аналог гамма - аминомасляной кислоты (GABA) или NSAID. Существует постоянная необходимость в наличии обезболивающих препаратов, обеспечивающих высокоэффективное облегчение боли при уменьшении появления нежелательных эффектов.
Сущность изобретения
Данное изобретение предусматривает фармацевтическую комбинацию, включающую тапентадол с замедленным высвобождением и второй анальгетик. Вторым обезболивающим агентом может быть трамадол, аналог гамма - аминомасляной кислоты (GABA) или NSAID. Изобретение предусматривает также способ лечения боли или расстройств, связанных с болью у млекопитающего, включающий введение указанному млекопитающему эффективного количества композиции, содержащей тапентадол с замедленным высвобождением и второй анальгетик.
Согласно другому варианту настоящее изобретение предусматривает комбинацию тапентадол/анальгетик для лечения болезненных состояний с болью от умеренной до сильной, вызванных диабетической нейропатией, ревматоидным артритом, остеоартритом и т.п. путем введения субъекту, нуждающемуся в этом, обезболивающей фармацевтической композиции, включающей от примерно 25 до примерно 400 мг тапентадола с медленным (контролируемьм) высвобождением и второй анальгетик, при этом второй анальгетик представляет собой гидрохлорид трамадола в количестве от примерно 5 до примерно 500 мг, агонист GABA в количестве от примерно 5 до примерно 500 мг или NSAID в количестве от примерно 5 до примерно 500 мг с фармацевтически приемлемым носителем для лучшего лечения боли. В этой фармацевтической композиции тапентадол находится в виде формы с контролируемым высвобождением и гидрохлорид трамадола, аналог GABA или NSAID находятся в виде формы с немедленным высвобождением, пролонгированным (контролируемым) высвобождением или формы с замедленным высвобождением вместе с фармацевтически приемлемым носителем.
Преимущество таких композиций заключается в уменьшении доз активных ингредиентов, таких как трамадол, аналог GABA или NSAIDs, что улучшает переносимость лекарств пациентом. Кроме того, композиции, содержащие от примерно 25 до примерно 400 мг тапентадола с медленным высвобождением и второй обезболивающий агент, причем второй анальгетик представляет собой гидрохлорид трамадола, агонист GABA или NSAID, вместе с фармацевтически приемлемым носителем, обеспечивают более эффективное лечение боли.
Краткое описание фигур
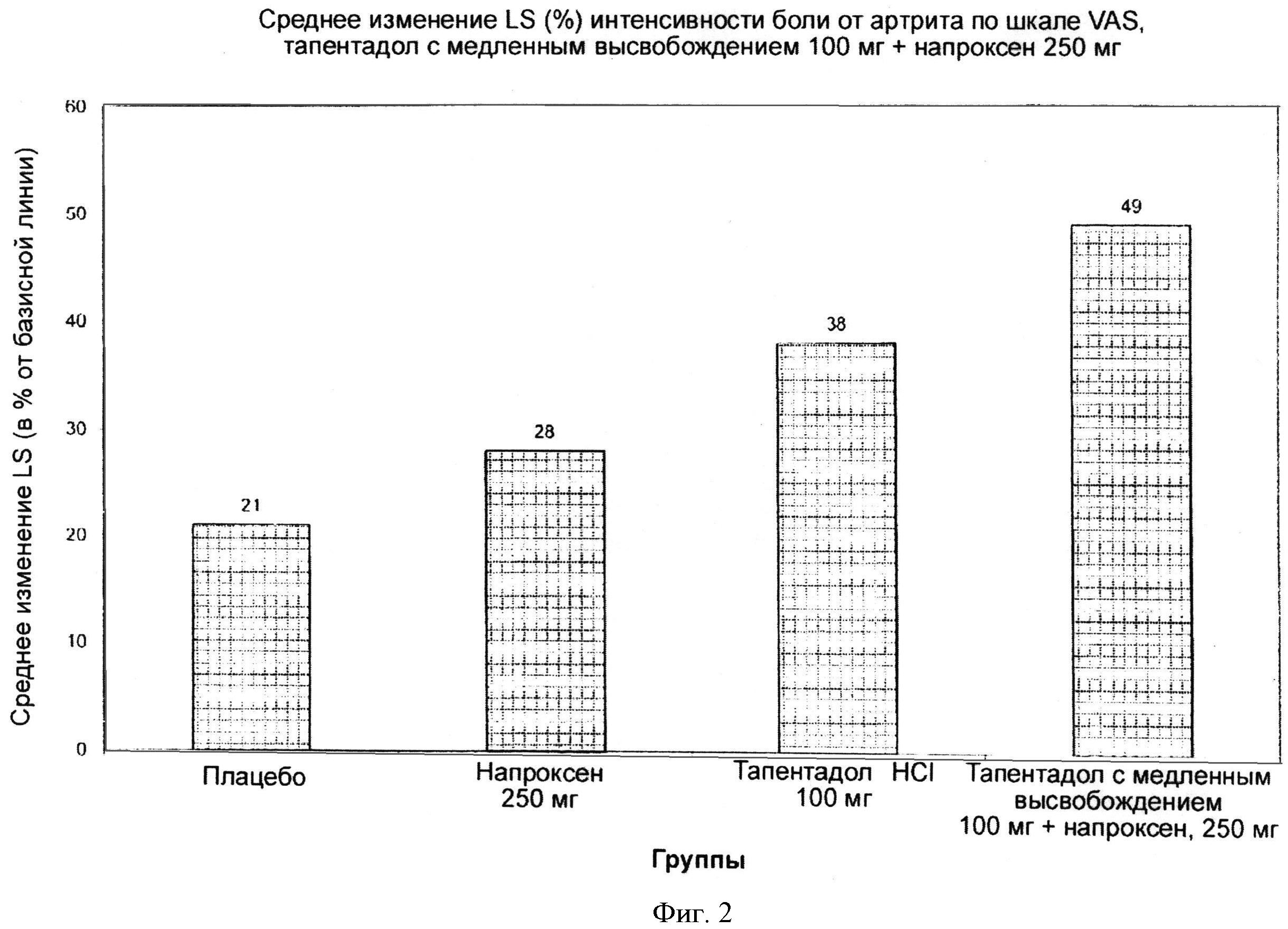
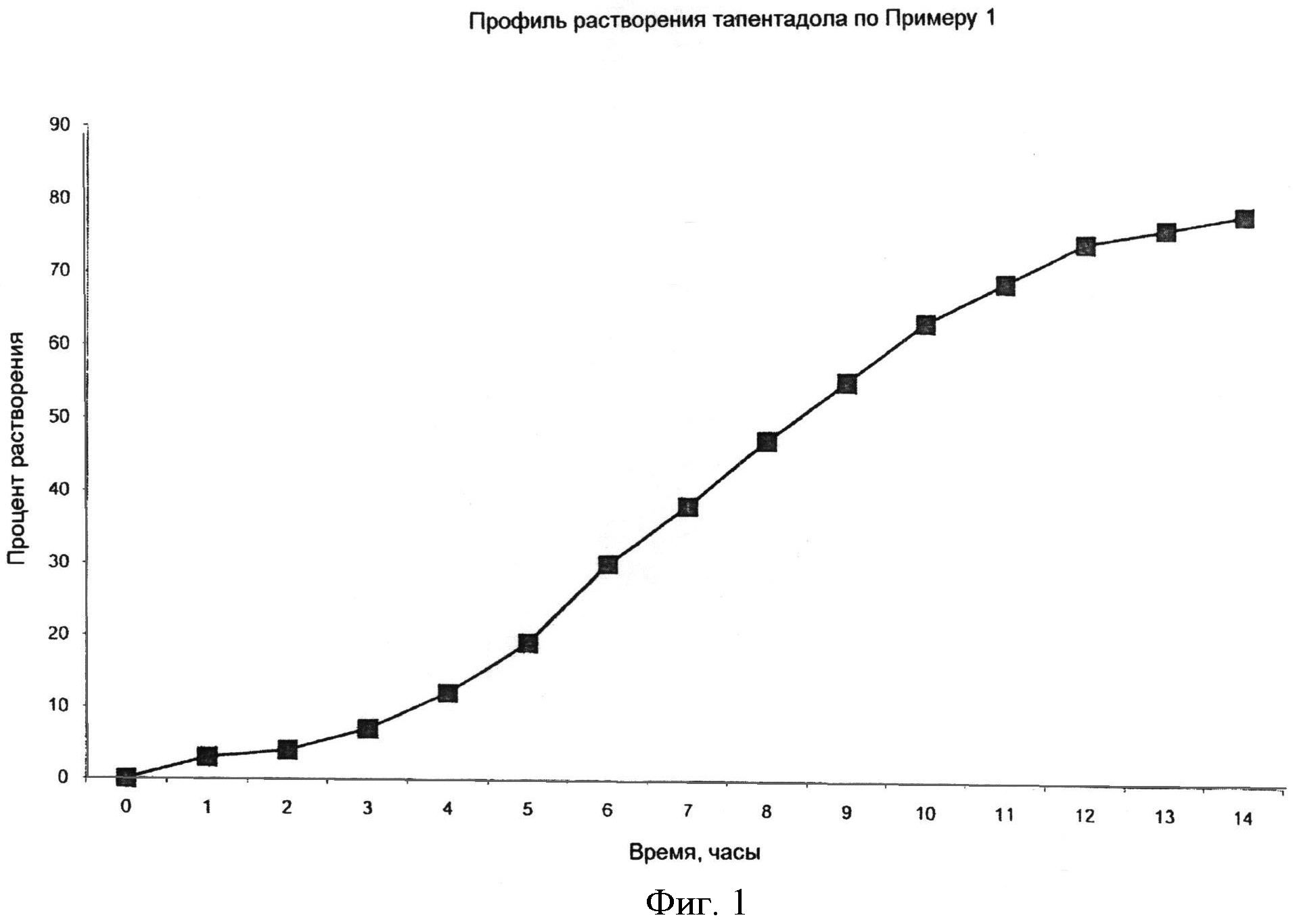
Фигура 1 иллюстрирует сравнение in vitro профилей растворения гидрохлорида тапентадола в случае таблеток, содержащих 100 мг гидрохлорида тапентадола и 250 мг напроксена.
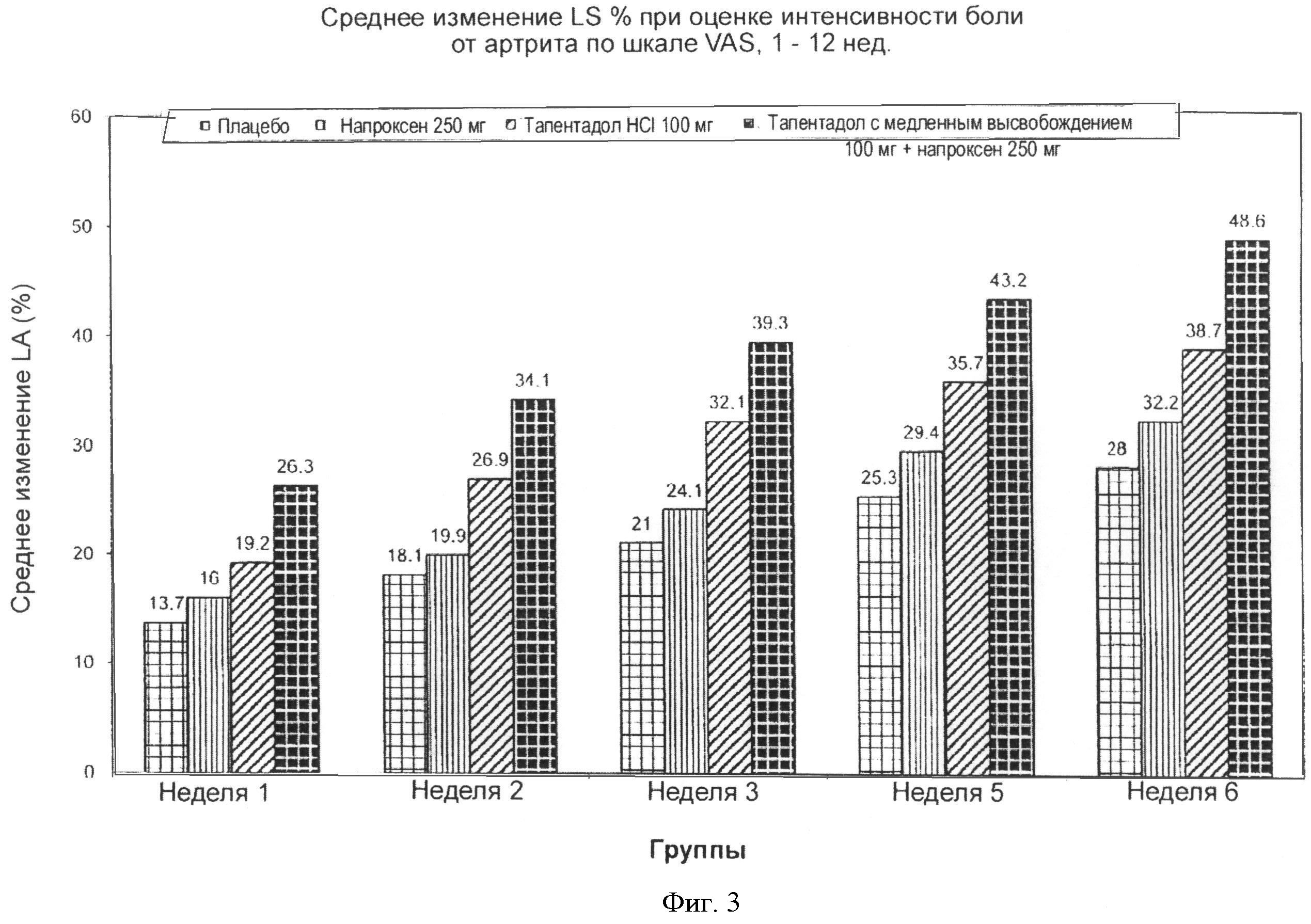
На Фигуре 2 показано сравнение среднего изменения LS от базовой линии по шкале VAS (визуально - аналоговая шкала) для комбинации лекарств, содержащей 100 мг тапентадола с медленным высвобождением и 250 мг напроксена с монотерапией тапентадолом и напроксеном в течение недель 1-6 в среднем.
Фигура 3 иллюстрирует недельные средние изменения LS от базовой линии для четырех групп пациентов.
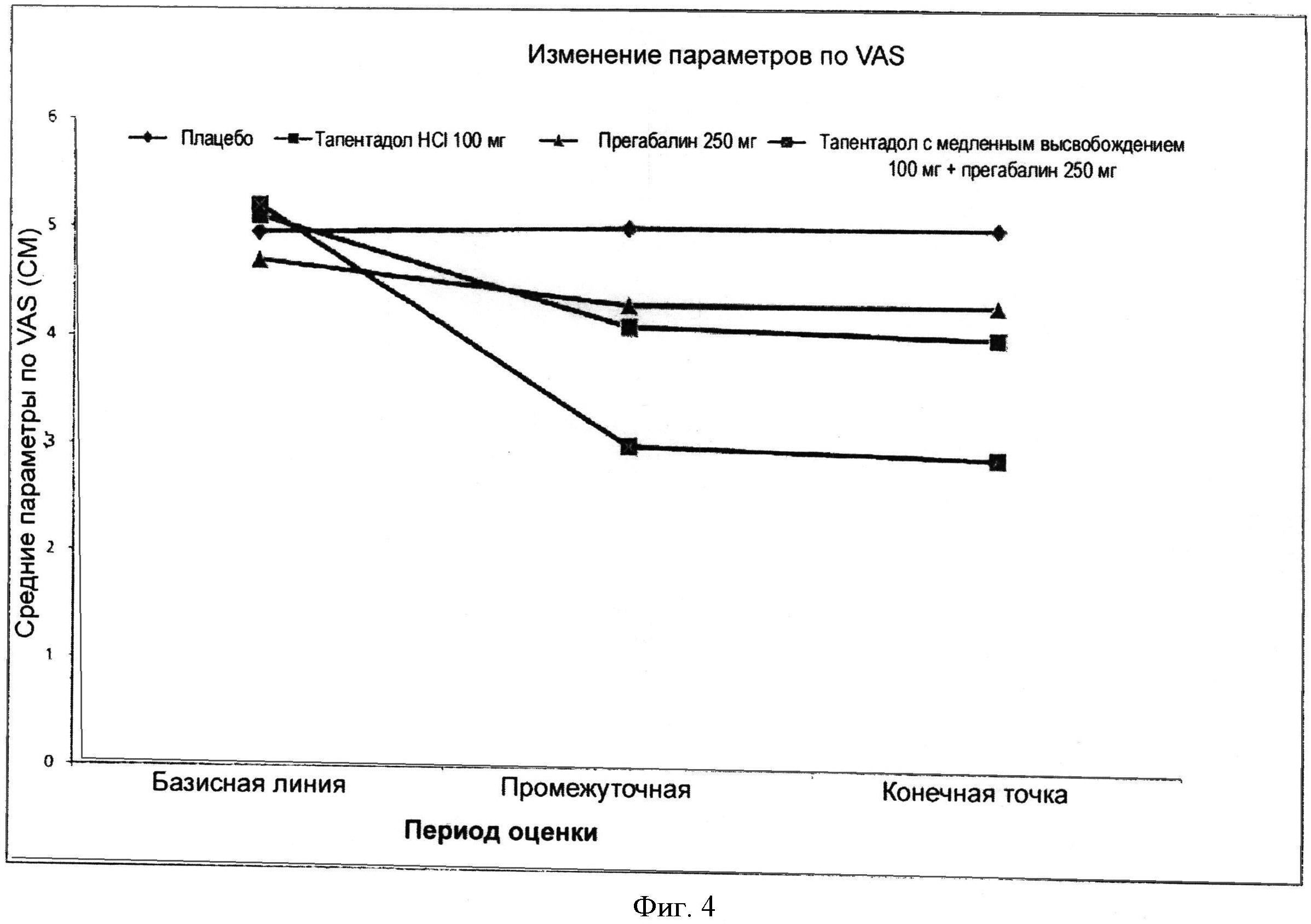
На Фигуре 4 показаны средние изменения показателей выраженности боли по шкале VAS для четырех составов; тапентадол 100 мг, прегабалин 250 мг и тапентадол с медленным высвобождением 100 мг+прегабалин 250 мг в случае фиксированных доз.
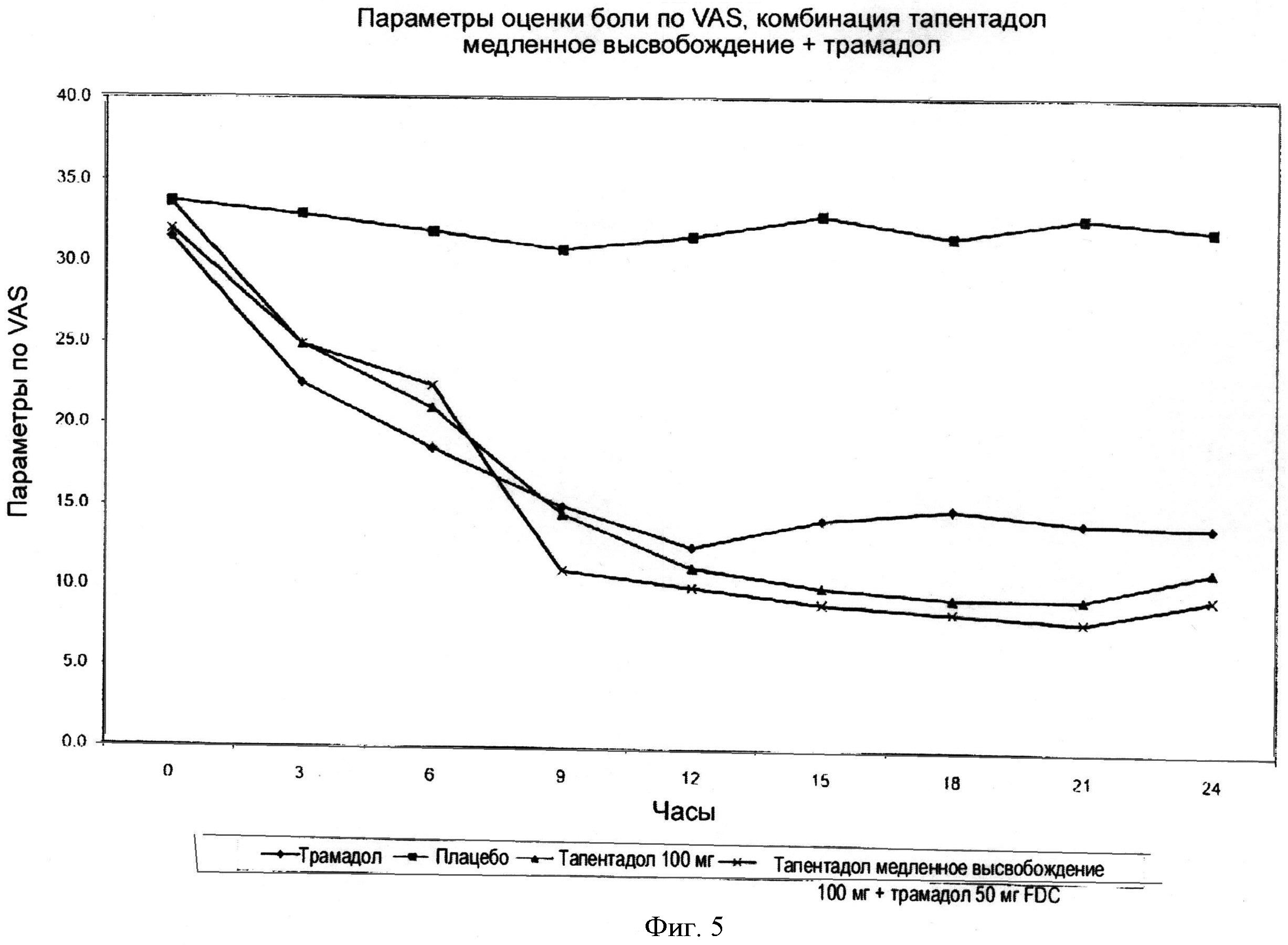
Фигура 5 иллюстрирует среднее изменение показателей по шкале VAS для трех составов; трамадол 50 мг, тапентадол 100 мг, плацебо и тапентадол с медленным высвобождением 100 мг + трамадол 50 мг при фиксированных дозах.
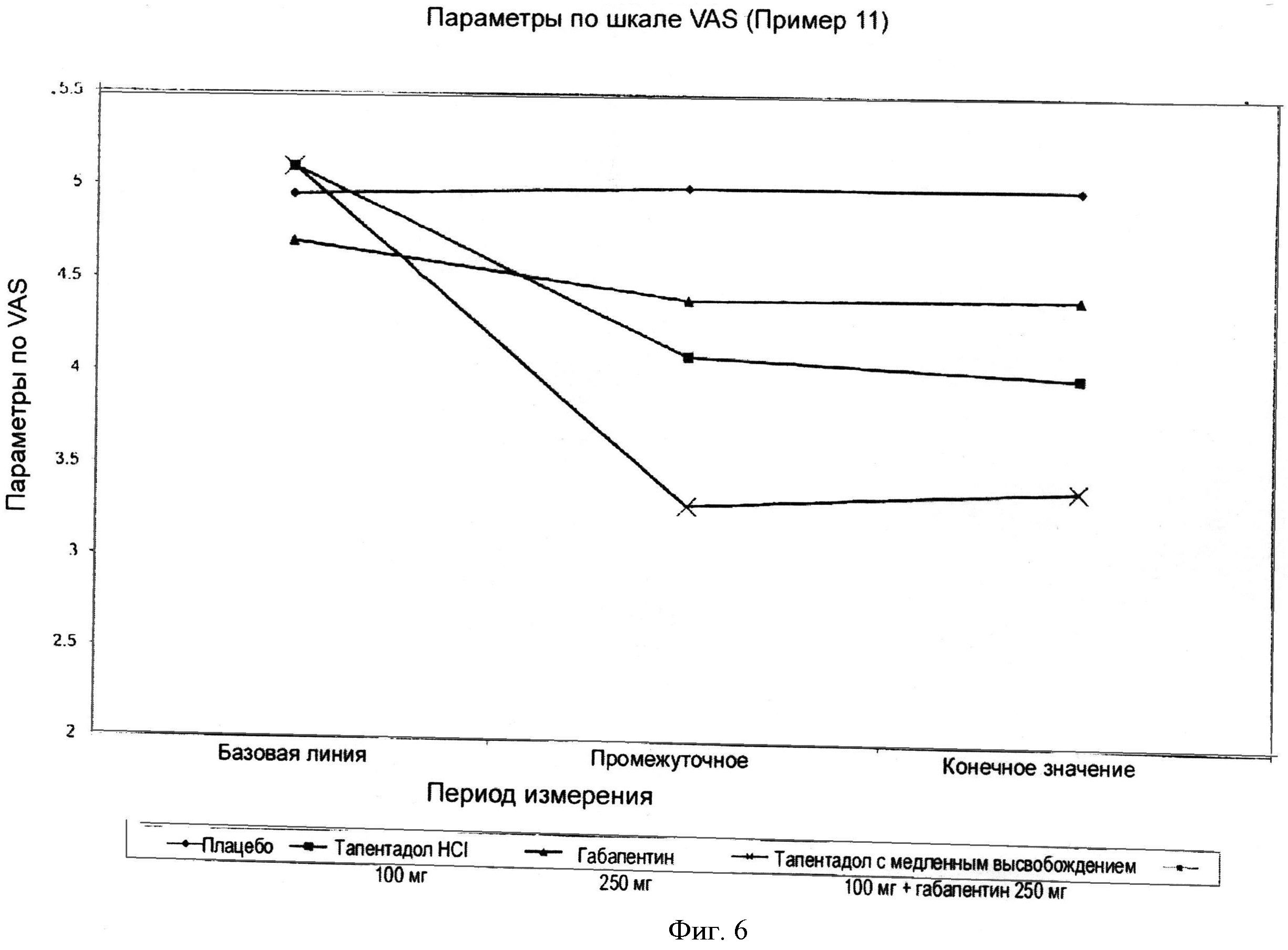
Фигура 6 иллюстрирует среднее изменение показателей по шкале VAS для четырех составов; тапентадол 100 мг, габапентин 250 мг и тапентадол с медленным высвобождением 100 мг + габапентин 250 мг при фиксированных дозах.
Подробное описание
Одной целью данного изобретения является разработка способов, которые могут быть применены для лечения боли и болезней, связанных с болью, при этом способы включают введение терапевтически эффективного количества тапентадола с медленным высвобождением и второго обезболивающего агента, при этом второй обезболивающий агент представляет собой трамадол, аналог гамма - аминомасляной кислоты (GABA) или NSAID, пациенту, нуждающемуся в этом.
Оба обезболивающих агента, например, тапентадол с медленным высвобождением и второй обезболивающий агент, могут вводить совместно в одном препарате или их можно вводить раздельно в виде двух препаратов. Кроме того, первое лекарство (тапентадол) можно принимать по схеме, которая включает дополнительное введение второго лекарства отдельно или в композиции с первым лекарством.
Согласно еще одному варианту данное изобретение предусматривает введение тапентадола с медленным высвобождением и второго обезболивающего агента в субоптимальных дозах.
Согласно еще одному варианту изобретение предусматривает введение тапентадола с медленным высвобождением и второго обезболивающего агента в количествах и в течение времени, которые достаточны для получения синергического эффекта.
Согласно другому варианту данное изобретение предусматривает композицию, в которой второй активный агент входит в состав покрытия с немедленным высвобождением.
Согласно еще одному варианту изобретение предусматривает двухслойную композицию, в которой один слой включает тапентадол и один слой включает второй активный агент.
Согласно еще одному варианту предусмотрен способ лечения боли от умеренной до сильной, путем введения субъекту, нуждающемуся в этом, фармацевтической композиции, содержащей 5-500 мг тапентадола или второго обезболивающего агента, при этом второй анальгетик представляет собой гидрохлорид трамадола в количестве от примерно 5 до примерно 500 мг, агонист GABA в количестве от примерно 5 до примерно 500 мг или NSAID в количестве от примерно 5 до примерно 500 мг, в смеси с фармацевтически приемлемым носителем.
Далее, настоящее изобретение предусматривает режим дозирования с титрованием дозы для введения пациентам тапентадола с медленным высвобождением, Режим дозирования с титрованием дозы позволяет значительно уменьшить появление нежелательных эффектов при введении тапентадола с медленным высвобождением, что облегчает соблюдение режима и улучшает переносимость лекарств.
Согласно дальнейшему варианту данное изобретение предусматривает композицию на основе тапентадола и второго обезболивающего агента или их фармацевтически приемлемых солей для применения при лечении (например, при лечении боли, в том числе нейропатической боли).
Согласно еще одному варианту данное изобретение предусматривает способ применения тапентадола и второго обезболивающего агента или их фармацевтически приемлемых солей для приготовления лекарственного вещества для лечения боли у млекопитающих (например, человека).
Согласно другому варианту данное изобретение предусматривает фармацевтический набор, включающий состав на основе тапентадола и второго обезболивающего агента или его фармацевтически приемлемой соли.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Термин "анальгетик", используемый при описании изобретения, включает любое лекарство, применяемое для облегчения боли, включая парацетамол (ацетаминофен), нестероидные противовоспалительные лекарства (NSAIDs), такие как салицилаты, наркотические лекарства, такие как морфин, синтетические лекарства с наркотическими свойствами, такие как трамадол, аналоги GABA, такие как прегабалин, габапентин, и различные другие классы лекарств, обычно не считающиеся анальгетиками, которые используются для лечения синдромов нейропатической боли; эти лекарства включают трициклические антидепрессанты и противосудорожные средства.
Термин "диапазон параметров" для целей данного изобретения определяется как разница между параметрами in vitro растворения составов с контролируемым высвобождением, когда сравнивается профиль растворения (кривая), полученный после окончания изготовления продукта с покрытием (до начала хранения) и профиль растворения, полученный после того, как продукт с покрытием хранился в ускоренных условиях хранения, параметр выражался как изменение количества активного агента, высвободившегося из продукта с покрытием в любой момент процесса растворения на кривых растворимости.
Термин "совместное введение", применяемый в данной заявке, означает введение двух лекарств (агентов) вместе (например, одновременно в виде смеси) или же последовательно. Последовательное введение тапентадола можно осуществлять до или после введения второго обезболивающего агента с перерывом от минут до примерно 48 ч после введения первого из агентов. Предпочтительно вводить тапентадол в период до примерно 24 ч до введения второго обезболивающего агента и, более предпочтительно, в период до примерно 12 ч до введения второго обезболивающего агента.
Термин "эффективное количество", применяемый в данной заявке, означает дозу, обеспечивающую желательный эффект. Например, эффективное количество анальгетика означает количество, которое достаточно для того, чтобы у пациента уменьшилась боль по сравнению с периодом до лечения.
Термин "аналог GABA" в данной заявке означает любой аналог нейротрансмиттера у млекопитающих, представляющего собой гамма - аминомасляную кислоту (GABA), которая ингибирует высвобождение некоторых нейротрансмиттеров, таких как глутамат, норадреналин и вещество Р. Неограничивающие примеры аналогов GABA включают прегабалин, габапентин, их фармацевтически эквивалентные соли, изомеры, полиморфы, гидраты, комплексы или клатраты и т.п.
Термин "NSAID", применяемый в данном описании, означает любое нестероидное противовоспалительное лекарство. Неограничивающие примеры включают целекоксиб, диклофенак, дифлунизал, этодолак, фенопрофен, флурбирофен, ибупрофен, индометацин, кетопрофен, кеторолак, мефенамовую кислоту, мелоксикам, набуметон, напроксен, оксапрозин, пироксикам, сулиндак и толметин и их фармацевтически эквивалентные соли, изомеры, полиморфы, гидраты, комплексы или клатраты и т.п. Неограничивающие примеры аналогов GABA включают габапентин, прегабалин или их фармацевтически приемлемые соли.
Согласно еще одному варианту данное изобретение предусматривает композицию, в которой второй активный агент входит в состав покрытия с немедленным высвобождением. Это может быть фармацевтическая композиция по любому из пп.1-5 формулы изобретения, которая характеризуется таким профилем in vitro растворения, что через 2 ч высвобождается от примерно 0% до примерно 30% по весу тапентадола, через 4 ч высвобождается от примерно 5% до примерно 22% по весу тапентадола, через 6 ч высвобождается от примерно 15% до примерно 30% по весу тапентадола и через 8 ч высвобождается более примерно 40% по весу тапентадола; при этом измерения проводят по методу USP Basket при скорости 75 об/мин в 900 мл 0,1 NHCl при температуре 37°С.
Термин "лекарственное вещество", применяемый в данной заявке, означает фармацевтическую композицию, пригодную для введения фармацевтически активного соединения пациенту.
Термин "фармацевтически приемлемая соль" относится к солям, которые сохраняют биологическую эффективность и свойства описанных соединений и которые не являются нежелательными с биологической или другой точки зрения. Во многих случаях описанные соединения способны образовывать кислые или основные соли за счет наличия аминогрупп или карбоксильных групп или подобных групп. Получение солей и подходящие для этого кислоты и основания известны из уровня техники, Термин "субоптимальная доза" означает дозу, величина которой меньше оптимальных доз для этого соединения, когда оно применяется для монотерапии.
Термин "аддитивный эффект", применяемый в данной заявке, означает эффект, получаемый как сумма эффектов, получаемых при введении индивидуальных компонентов,
Термин "синергический эффект" означает эффект, который превышает аддитивный эффект, который получается как сумма эффектов от введения двух индивидуальных соединений.
Термин "лечение болезни", применяемый в данной заявке, означает лечение и излечение пациента, у которого уже развились болезнь, состояние или расстройство. Цель лечения состоит в борьбе с болезнью, состоянием или расстройством. Лечение включает введение активных соединений для устранения или контролирования болезни, состояния или расстройства, а также ослабления симптомов или осложнений, связанных с болезнью, состоянием или расстройством.
Термин "профилактика болезни", применяемый в данной заявке, означает лечение и излечение пациента от риска развития болезни до клинического начала этой болезни. Цель профилактики заключается в борьбе с развитием болезни, состояния или расстройства и профилактика включает введение активных соединений для предотвращения или задержки развития симптомов или осложнений и для предотвращения или задержки развития болезней, состояний или расстройств.
Термин "боль или состояния, связанные с болью", применяемый в данной заявке, означает любую боль, возникшую из-за медицинского состояния, включая нейропатическую боль, остеоартрит, ревматоидный артрит, фибромиалгию и скелетно-мышечную боль в спине, анкилозирующий спондилит, ювенильный ревматоидный артрит, мигрени, зубную боль, боли в брюшной полости, ишемическую боль, боль после операции или боль после анестезии или хирургического вмешательства.
Термин "материал с пролонгированным высвобождением", который находится во внутренней фазе, состоящей из твердых частиц или во внешней твердой непрерывной фазе, относится к одному или нескольким гидрофильным полимерам и/или к одному или нескольким гидрофобным полимерным материалам и/или одному или нескольким гидрофобным материалам другого типа, таким как, например, один или несколько восков, алифатических спиртов и/или эфиров жирных кислот."Материал с пролонгированным высвобождением", содержащийся во внутренней твердой фазе, состоящей из частиц, может быть таким же, как "материал с пролонгированным высвобождением", который содержится во внешней твердой непрерывной фазе, или отличаться от него,
Термин "медленное высвобождение" или "контролируемое высвобождение" относится к любому виду высвобождения лекарства из состава, который отличается от немедленного высвобождения, когда высвобождение активного ингредиента является медленным по природе. Он включает различные термины, которые являются взаимозаменяемыми в фармацевтическом смысле, такие как пролонгированное высвобождение, замедленное высвобождение, длительное высвобождение, контролируемое высвобождение, высвобождение во времени, специфическое высвобождение и целевое высвобождение и т.д.
Термин "кандидат для пролонгированного высвобождения" охватывает все характеристики лекарства, которые делают его кандидатом для получения на его основе состава с пролонгированным высвобождением, такие как короткий период полувыведения и последующее дозирование более одного раза в день, при этом одна доза продукта с пролонгированным высвобождением дает лучшие клинические результаты и устраняет побочные эффекты, связанные с немедленным высвобождением и т.д.
Термин "связующий агент", применяемый в данной заявке, относится к любому общеизвестному фармацевтически приемлемому связующему, такому как поливинилпирролидон, гидроксипропилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилметилцеллюлоза, этилцеллюлоза, полиметакрилат, поливиниловый спирт, воски и т.п. Можно также использовать смеси указанных выше связующих агентов. Предпочтительными связующими являются растворимые в воде материалы, такие как поливинилпирролидон со средним молекулярным весом от 25000 до 3000000. Связующее может составлять примерно от 0 до примерно 40% от общего веса ядра и, предпочтительно, примерно от 3% до примерно 15% от общего веса ядра. Согласно одному из вариантов применение связующего агента в ядре является необязательным.
Термин "фармацевтически приемлемое производное" означает различные фармацевтические изомеры, энантиомеры, комплексы, соли, гидраты, полиморфы, сложные эфиры и т.д. тапентадола или трамадола, или аналога GABA, или NSAID.
Термин "терапевтически эффективное количество" означает количество, которое вызывает биологический ответ у млекопитающего, включая субоптимальное количество.
Термин "гидрофильные полимеры" включает, без ограничения, гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу, натриевую соль карбоксиметилцеллюлозы, кальциевую соль карбоксиметилцеллюлозы, альгинат аммония, альгинат натрия, альгинат калия, альгинат пропиленгликоля, альгиновую кислоту, поливиниловый спирт, повидон, карбомер, пектат калия, пектинат калия и т.д.
Термин "гидрофобный полимер", проименяемый в данной заявке, включает, без ограничения*, этилцеллюлозу, гидроксиэтилцеллюлозу, сополимер метакрилата аммония (Eudragit™ RL или Eudragit™ RS), сополимеры метакриловой кислоты (Eudragit™ L или Eudragit™ S), сополимер метакривловой кислоты с этиловым эфиром акриловой кислоты (Eudragit™ L 100-5), нейтральный сополимер эфиров метакриловой кислоты (Eudragit™ NE30D), сополимер диметиламиноэтилметакрилата с эфирами метакриловой кислоты (Eudragit™ E100), сополимеры винилметилового эфира с малеиновым ангидридом, их соли и эфиры (Gantrez™) и т.д.
Другие гидрофобные материалы, которые могут быть применены во внутренней твердой фазе частиц и/или во внешней твердой непрерывной фазе, включают, без ограничения, воски, такие как пчелиный воск, карнаубский воск, микрокристаллический воск и озокерит; алифатические спирты, такие как цетостеариловый спирт, стеариловый спирт, цетиловый спирт, миристиловый спирт и т.д.; эфиры жирных кислот, такие как глицерилмоностеарат, глицерилмоноолеат, ацетилированные моноглицериды, тристеарин, трипалъмитин, воскообразные цетиловые эфиры, глицерилпальмитостеарат, глицерилбегенат, гидрированное касторовое масло и т.д.
Неограничивающие примеры NSAIDs включают целекоксиб, диклофенак, дифлунисал, этодолак, фенопрофен, флурбирофен, ибупрофен, индометацин, кетопрофен, кеторолак, мефенамовую кислоту, мелоксикам, набуметон, напроксен, оксапрозин, пироксикам, сулиндак и толметин и их фармацевтически эквивалентные соли, изомеры, полиморфы, гидраты, комплексы или клатраты и т.п. Неограничивающие примеры аналогов GABA включают габапентин, прегабалин или их фармацевтически приемлемые соли.
Описанные фармацевтические композиции характеризуются таким профилем in vitro растворения, что через 2 ч высвобождается от примерно 0% до примерно 30% по весу тапентадола, через 4 ч высвобождается от примерно 5% до примерно 22% по весу тапентадола, через 6 ч высвобождается от примерно 15% до примерно 30% по весу тапентадола и через 8 ч высвобождается более примерно 40% по весу тапентадола; при этом измерения проводят по методу USP Basket при скорости 75 об/мин в 900 мл 0,1 NHCl при температуре 37°С,
Трамадол представляет собой любой (1R, 2R или IS, 2S) - (диметиламинометил) 1-(3-метоксифенил)-циклогексанол (трамадол), его N-окись ("N-окись трамадола") и его O-десметильное производное ("O-десметилтрамадол") или их смеси. Это может быть индивидуальный стереоизомер, смесь стереоизомеров, включая рацематы, фармацевтически приемлемая соль аминов, такая как гидрохлорид, сольват и полиморф трамадола. Трамадол коммерчески доступен в фирме Grunenthal и может быть получен способом, описанным в патенте США №3652589, который включен в данную заявку в качестве ссылки.
Комбинация лекарств может содержать тапентадол с медленным высвобождением и второй анальгетик, при этом второй анальгетик представляет собой трамадол, аналог гамма - аминомасляной кислоты (GABA) или NSAID. Эта композиция предпочтительно содержит терапевтически эффективное количество тапентадола или его фармацевтически приемлемой соли, при этом тапентадол содержится в стандартной дозе в количестве от примерно 5 до примерно 800 мг, предпочтительно от примерно 50 до примерно 600 мг, более предпочтительно от примерно 100 до примерно 400 мг и, более предпочтительно от примерно 200 до примерно 300 мг (в расчете на гидрохлорид тапентадола), а терапевтически эффективное количество второго анальгетика трамадола составляет от примерно 5 до примерно 500 мг, в случае аналога гамма - аминомасляной кислоты (GABA) оно составляет от примерно 5 до примерно 500 мг и в случае NSAID оно составляет от примерно 5 до примерно 500 мг.
Описанная композиция может быть, например, в виде гранул, сферических частиц, микрочастиц, капсул, таблеток, саше, суспензий с контролируемым высвобождением или в виде любой другой приемлемой лекарственной формы, содержащей такие гранулы, сферы, таблетки или мультичастицы,
Композиции могут быть, например, в виде таблеток с покрытием, при этом покрытие включает по меньшей мере один нерастворимый в воде, водопроницаемый пленкообразующий полимер, по меньшей мере один пластификатор и по меньшей мере один растворимый в вводе полимер и второй активный агент. Согласно предпочтительному варианту покрытие может содержать по меньшей мере один нерастворимый в воде, водопроницаемый пленкообразующий полимер в количестве от примерно 20% до примерно 90% от сухого веса покрытия, количество по меньшей мере одного пластификатора составляет от примерно 5% до примерно 30% от сухого веса покрытия и количество по меньшей мере одного водорастворимого полимера составляет от примерно 10% до примерно 75% от сухого веса покрытия.
Предпочтительный нерастворимый в воде, водопроницаемый пленкообразующий полимер представляет собой этилцеллюлозу. Предпочтительным не растворимым в воде полимером является поливинилпирролидон. Предпочтительный пластификатор представляет собой дибутилсебацинат.
Один или несколько из активных ингредиентов в комбинации по изобретению может быть включен в матрицу. Это может быть любая матрица, известная специалисту, которая обеспечивает медленное высвобождение тапентадола в течение по меньшей мере примерно 12 ч и, предпочтительно, обеспечивает скорости in vitro растворения и скорости in vivo абсорбции тапентадола в терапевтически эффективных пределах.
Комбинация по изобретению может предпочтительно включать матрицу с медленным высвобождением. Или же можно применять матрицы с нормальным высвобождением с покрытием, которое обеспечивает медленное высвобождение тапентадола.
Матрица с медленным высвобождением, применяемая в комбинации по изобретению, может также содержать другие фармацевтически приемлемые ингредиенты, используемые в фармацевтике, такие как разбавители, смазочные агенты, связующие, средства для гранулирования, красители, ароматизаторы, поверхностно-активные вещества, регуляторы рН, добавки против слипания и для скольжения, например, дибутилсебацинат, гидроокись аммония, олеиновую кислоту и коллоидную двуокись кремния. Для приготовления такой комбинации можно применять любой известный разбавитель, например, микрокристаллическую целлюлозу, лактозу и дикальцийфосфат, подходящие смазочные агенты, например, стеарат магния и стеарилфумарат натрия. Подходящими связующими являются гидроксипропилметилцеллюлоза, повидон и метилцеллюлоза. Подходящие дезинтегранты представляют собой крахмал, натрийгликолят крахмала, кросповидон и натриевую соль кроскармеллозы.
Поверхностно-активные вещества, пригодные для применения по изобретению, включают полоксамер 188.RTM, полисорбат 80 и лаурилсульфат натрия. Подходящими добавками, способствующими текучести, являются тальк и коллоидная безводная двуокись кремния. Неограничивающие примеры растворимых в воде полимеров, которые могут быть применены для получения матрицы, включают PEG со средним молекулярным весом в пределах от примерно 1000 до примерно 6000. Комбинация, содержащая тапентадол с медленным высвобождением, обычно может содержать пленочное покрытие на основе любого пленкообразующего материала, обычно используемого в фармацевтике, но предпочтительно применять покрытие на основе водной пленки.
Или же, альтернативно, комбинация, включающая тапентадол с медленным высвобождением и второй анальгетик, причем второй анальгетик представляет собой трамадол, аналог гамма - аминомасляной кислоты (GABA) или NSAID, может содержать матрицу с нормальным высвобождением, включающую покрытие с медленным высвобождением. Предпочтительно, чтобы композиция содержала сфероиды, содержащие активный ингредиент и сфероидизирующий агент. Сфероидизирующим агентом может быть любой подходящий фармацевтически приемлемый материал, который может участвовать в процессе сфероидизации вместе с активным ингредиентом с получением сфероидов. Предпочтительным Сфероидизирующим агентом согласно изобретению является микрокристаллическая целлюлоза. Используемая микрокристаллическая целлюлоза согласно изобретению может представлять собой, например, Avicel™ РН 101 или Avicel™ РН 102 (FMC Corporation). Сфероиды могут содержать другие фармацевтически приемлемые ингредиенты, применяемые в фармацевтике, такие как связующие, наполнители и красители. Подходящие связующие могут включать водорастворимые полимеры, водорастворимые гидроксиалкилцеллюлозы, такие как гидроксипропилцеллюлоза, или не растворимые в воде полимеры (которые также могут придавать свойства, контролирующие высвобождение), такие как акрильные полимеры или сополимеры, например, этилцеллюлозу. Подходящие наполнители включают лактозу.
Сфероиды содержат покрытие на основе материала, который обеспечивает высвобождение активного ингредиента с низкой скоростью в водной среде. Подходящие материалы для покрытия с медленным высвобождением, которые могут быть применены по изобретению, включают не растворимые в воде воски и полимеры, такие как полиметакрилаты (например, полимеры Eudragit™) или нерастворимые в воде целлюлозы, в частности, этилцеллюлозу. Могут быть также включены растворимые в воде полимеры, такие как поливинилпирролидон, или растворимые в воде целлюлозы, такие как гидроксипропилметилцеллюлоза или гидроксипропилцеллюлоза. Могут быть также добавлены другие растворимые в воде агенты, такие как полисорбат 80.
Далее, согласно альтернативному варианту в мембрану может быть также введен агент, способствующий обильному истечению или покрытие с медленным высвобождением может включать один из описанных выше полимеров. Агент, способствующий обильному истечению, может увеличивать объем жидкости, впитываемой ядром для того, чтобы обеспечить распределение лекарственной формой практически всего тапентадола через канал и/или пористую мембрану. Таким агентом может быть растворимое в воде вещество или растворимый в кишечнике материал. Примеры предпочтительных материалов, которые пригодны в качестве таких агентов, включают, без ограничения, хлорид натрия, хлорид калия, сахарозу, сорбит, манит, полиэтиленгликоли (PEG), пропиленгликоль, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, фталат гидроксипропилметилцеллюлозы, ацетатфталат целлюлозы, поливиниловые спирты, сополимеры метакриловой кислоты, полоксамеры (такие как LUTROL™ F68, LUTROL F127, LUTROL F108, доступные в фирме BASF) и их смеси. Предпочтительным агентом, способствующим истечению, применяемым по изобретению, является PEG 400.
Агентом, способствующим обильному истечению, может также быть смешивающееся с водой/растворимое в воде лекарство, такое как тапентадол или его фармацевтически приемлемые соли или же им может быть лекарство, которое растворяется в кишечнике. Если агентом, способствующим обильному истечению, является лекарство, такая фармацевтическая композиция имеет дополнительное преимущество, заключающееся в обеспечении немедленного высвобождения лекарства, которое было выбрано в качестве такого агента. Агент, способствующий обильному истечению, растворяется или выходит из мембраны или покрытия с пролонгированным высвобождением с образованием каналов в мембране или в покрытии с пролонгированным высвобождением, что позволяет жидкости попадать в ядро и растворять активный ингредиент. Согласно предпочтительному варианту агент, способствующий обильному истечению, содержится в количестве примерно от 0 до примерно 40% от общего веса покрытия, наиболее предпочтительно в количестве от примерно 2% до примерно 20% от общего веса покрытия.
Для изготовления мембраны или покрытия с медленным высвобождением можно также применять известный эксципиент, такой как пластификатор. Некоторые общеизвестные пластификаторы включают, без ограничения, адипинат, азелаинат, энзоат, цитрат, стеарат, изоэбукат, себацинат, триэтилацитрат, три-н. бутилцитрат, ацетилтри-н, бутилцитрат, эфиры лимонной кислоты и все те соединения, которые описаны в Encyclopedia of Polymer Science and Technology, vol.10 (1969), John Wiley and Sons. Предпочтительными пластификаторами являются триацетин, ацетилированный моноглицерид, масло из виноградных косточек, оливковое масло, кунжутное масло, ацетилтрибутилцитрат, ацетилтриэтилцитрат, сорбит с глицерином, диэтилоксалат, диэтилмалеат, диэтилфумарат, дибутилсебацинат, диэтилмалонат, диоктилфталат, дибутилсебацинат, триэтилцитрат, трибутилцитрат, глицерилтрибутират и т.п. Хотя точное количество пластификатора зависит от типа применяемого пластификатора, обычно его количество составляет от 0 до примерно 25% и, предпочтительно, от примерно 2% до примерно 15% от общего веса мембраны или покрытия с пролонгированным высвобождением.
Обычно мембрана или покрытие с пролонгированным высвобождением вокруг ядра составляет от примерно 1% до примерно 20% и, предпочтительно, от примерно 2% до примерно 10% от общего веса ядра и покрытия. Согласно предпочтительному варианту мембрана или покрытие с пролонгированным высвобождением, окружающее ядро, может также содержать проход, который обеспечивает контролируемое высвобождение лекарства из ядра. Используемый в данной заявке термин "канал" включает отверстие, щель, канал, дыру, ослабленный участок или элемент, такой как желатиновая пробка, которая разрушается с образованием осмотического прохода для высвобождения тапентадола из лекарственной формы. Такие каналы согласно изобретению хорошо известны и описаны в патентах США №3845770; 3916899; 4034758; 4077407; 4783337 и 5071607.
Следующие примеры 1-13 приведены для иллюстрации изобретения, относящегося к комбинации, содержащей тапентадол с медленным высвобождением и второй анальгетик, причем второй анальгетик представляет собой трамадол, аналог гамма - аминомасляной кислоты (GABA) или NSAID. Согласно этому изобретению, где мы применяли гидрохлорид трамадола, конкретные аналоги GABA прегабалин и габапентин, конкретные NSAIDs мелоксикам и напроксен только как примеры с целью иллюстрации, эти примеры никоим образом не ограничивают объем изобретения. Специалисту очевидно, как можно осуществить модификацию изобретения с применением других аналогов GABA или других NSAIDs, таких как целекоксиб, диклофенак, дифлунисал, этодолак, фенопрофен, флурбирофен, ибупрофен, индометацин, кетопрофен, кеторолак, мефенамовую кислоту, мелоксикам, набуметон, напроксен, оксапрозин, пироксикам, сулиндак и толметин и других известных из уровня техники способов.
Пример 1:
|
Способ изготовления
Комбинацию, содержащую гидрохлорид тапентадола с медленным высвобождением и напроксен, получали двухстадийным способом по стандартной методике получения покрытия. Во время фазы I гидрохлорид тапентадола вводится в ядро, на которое затем наносят покрытие с медленным высвобождением для того, чтобы получить ядро, характеризующееся медленным высвобождением тапентадола. Во время фазы II на это ядро с тапентадола гидрохлоридом с медленным высвобождением наносят слой покрытия, который характеризуется немедленным высвобождением и содержит напроксен. Подробности осуществления этого способа описаны ниже.
Фаза I, получение ядра: Гидрохлорид тапентадола смешивают с микрокристаллической целлюлозой и коллоидной двуокисью кремния и с одним или несколькими наполнителями и гранулируют, применяя подходящий известный способ с использованием раствора связующего, содержащего Поливинилпирролидон или поливиниловый спирт. Гранулированный гидрохлорид тапентадола сушат и просеивают. Затем вводят смазывающий агент, применяя гидрированное растительное масло вместе с добавкой, способствующей скольжению или без нее. Смесь, содержащую смазку, прессуют в таблетки, используя пресс.
Раствор для покрытия и получения покрытия; Раствор для покрытия готовят с применением водной дисперсии не растворимой в воде, водопроницаемой этилцеллюлозы и водорастворимых поливинилпирролидона или гидроксипропилметилцеллюлозы. Смесь с полиэтиленгликолем получают, используя пропеллерную мешалку, и гомогенизируют с применением подходящего гомогенизатора. На таблетки - ядра наносят покрытие из раствора для покрытия при помощи стандартного устройства типа O'Hara pan coater 4” со скоростью распыления 25 мл/пуск/мин при температуре около 45°С, давление распыления составляет 10-35 ф/дюйм2, скорость поддона равна 5-8 об/мин, поток воздуха 350 CFM.
Фаза II: Во время фазы II готовят напроксен, используя метод гранулирования, известный из уровня техники, затем его смешивают с дезинтегрантом и смазочным агентом. Таблетки тапентадола с медленным высвобождением, полученные на стадии I, покрывают слоем напроксена со смазочным агентом, используя устройство для покрытия, при этом таблетки с медленным высвобождением тапентадола используют в качестве ядра, а слой состава на основе напроксена с немедленным высвобождением образует внешний слой,
Покрытие на основе напроксена наносят на таблетки, содержащие 100 мг гидрохлорида тапентадола с медленным высвобождением с применением указанного выше устройства для покрытия. На эти таблетки со 100 мг гидрохлорида тапентадола, покрытые слоем на основе напроксена, наносят окрашенное покрытие. Распыление осуществляют при температуре 46-47°С и давлении распыления равном 60 ф/дюйм2, скорость распыления составляет 180 г/мин/три пуска. Скорость поддона составляет 4-8 об/мин и объем воздуха равен 1000±100.
Затем таблетки с цветным покрытием высушивают и, возможно, полируют с применением воска Cindrella, полученные таблетки упаковывают во флаконы из HDPE с подходящим десикантом и проводят определение стабильности и клинические исследования. В примере 1 получали фармацевтическую композицию, содержащую 100 мг тапентадола с медленным высвобождением и 250 мг напроксена в соответствии с Таблицей 1.
Способы изготовления, приведенные в примерах, описаны только с целью иллюстрации, фармацевтические композиции могут быть получены с применением ряда хорошо известных методов. Другие составы указаны ниже в Таблицах 2-5.
Пример 2:
|
Пример 3:
|
Пример 4:
|
Пример 5:
|
Получение ядра: Смешивают гидрохлорид тапентадола и коллоидную двуокись кремния и пропускают через сито 1,0 мм. Поливиниловый спирт растворяют в очищенной воде. Порошок смеси гидрохлорида тапентадола и коллоидной двуокиси кремния гранулируют вместе с водным раствором поливинилового спирта в грануляторе с псевдоожиженным слоем, Glatt GPCG1 и затем сушат. После гранулирования гранулы смешивают со стеарилфумаратом натрия и пропускают через сито 1,0 мм. Затем смесь прессуют, получая ядра таблеток, с применением Manesty Betapress.
Получение покрытия: Взвешивают этиловый спирт и изопропанол и смешивают. К смеси добавляют дибутилсебацинат и этилцеллюлозу и растворяют полученную смесь в этиловом спирте и изопропиловом спирте при перемешивании пропеллерной мешалкой, Coframo RZR1. Дают полностью раствориться этилцеллюлозе и дибутилсебацинату. Добавляют поливинилпирролидон. Pan створ перемешивают до растворения всех компонентов. Раствор пропускали через гомогенизатор высокого давления Mini DeBee 2000 с соплом #7, Bee International. Ядра таблеток покрывали, используя раствор для покрытия, в устройстве O'Hara Labcoat II 136" Pan, Vector LCDS. Параметры способа нанесения покрытия указаны в Таблице 6.
|
Пример 6
В еще одном примере описана фармацевтическая композиция, которая может быть эффективно использована при лечении боли и болезней, связанных с наличием боли, при этом композиция содержит терапевтически эффективное количество тапентадола с медленным высвобождением и NSAID и вводится пациенту, нуждающемуся в этом, эта композиция может быть получена другими способами. Например, комбинация, включающая тапентадол с медленным высвобождением и NSAID, такое как напроксен, может быть получена в виде двухслойной таблетки, как описано ниже:
Слой 1:
|
Слой 2:
|
Получение слоя 1: Гидрохлорид тапентадола, микрокристаллическую целлюлозу и коллоидную двуокись кремния гранулируют с поливиниловым спиртом и сушат. Высушенные гранулы смешивают с этилцеллюлозой и гидроксиэтилцеллюлозой и добавляют смазывающий агент стеарилфумарат натрия.
Получение слоя 2: Напроксен смешивают с микрокристаллической целлюлозой и гранулируют вместе с повидоном. Гранулы сушат и смешивают с натриевой солью кроскармеллозы и затем добавляют смазывающий агент стеарат магния.
Прессование: Составы слоя 1 и слоя 2 загружают в воронку устройства для прессования двухслойных изделий и прессуют.
Пример 7
|
Пример 8
|
Способ изготовления таблеток на основе гидрохлорида тапентадола с медленным высвобождением и мелоксикама
Комбинацию, содержащую гидрохлорид тапентадола с медленным высвобождением и мелоксикам получают, используя стандартный способ гранулирования и получения покрытия. Гидрохлорид тапентадола и лактозу гранулируют в грануляторе и распыляют в смеси с этилцеллюлозой и водой. Гранулированный гидрохлорид тапентадола сушат и пропускают через сито. Гранулы гидрохлорида тапентадола смешивают с цетостеариловым спиртом. Затем смешивают их с тальком и стеаратом магния и прессуют гранулы с получением таблеток. На таблетки затем наносят покрытие из раствора для покрытия. Затем на полученные таблетки с медленным высвобождением тапентадола наносят покрытие из раствора Opadry Clear (YS-1-7006) при помощи стандартного устройства типа O'Hara pan coater, 4” со скоростью распыления 25 мл/пуск/мин при температуре около 45°С, давление распыления от 10 до 35 ф/дюйм2 и скорости поддона равной 5-8 об/мин и потоке воздуха 350 CFM. Покрытие на основе мелоксикама наносили на таблетки, содержащие 100 мг гидрохлорида тапентадола, используя описанное выше устройство. Затем на эти таблетки, содержащие 100 мг гидрохлорида тапентадола и 7,5 мг мелоксикама в составе покрытия, наносят окрашенное покрытие. Распыление проводят при температуре 46-47°С, давление распыления 40-60 ф/дюйм2 и скорости равной 180 г/мин/три пуска. Скорость вращения поддона составляет 4-8 об/мин и объем воздуха равен 1000±100.
Затем таблетки с окрашенным покрытием сушат и полируют, используя воск Cindrella, полученные таблетки упаковывают во флаконы из HDPE с подходящим десикантом и определяют их стабильность и проводят клинические испытания.
Пример 9
|
Пример 10
|
|
Пример 11
|
Пример 12
|
Пример 13
|
Описанные композиции могут быть также получены способами, хорошо известными из уровня техники. Они могут быть получены из составов приведенных в Таблицах 14 и 15.
|
|
МЕТОД ВВЕДЕНИЯ
Данное изобретение предусматривает также способ лечения боли и состояний, связанных с наличием боли. Проводили контролируемые клинические исследования на людях с применением каждого вида комбинаций. Типичный опыт заключался в определении эффективности комбинации, включающей тапентадол с медленным высвобождением и прегабалин, комбинации, включающей тапентадол с медленным высвобождением и напроксен (NSAID) и комбинации, включающей тапентадол с медленным высвобождением и трамадол. Каждую из этих комбинаций сравнивали с соответствующими лекарствами, используемыми в монотерапии для лечения боли и состояний, связанных с наличием боли.
Клинические испытания
Во всех исследованиях применяли следующие общие методы.
Рандомизация: Рандомизацию осуществляли при помощи параметров, сгенерированных случайно с помощью компьютерной программы при блоковой рандомизации 10 испытуемых. Коды рандомизации при проведении монотерапии или комбинационной терапии находились в пронумерованных непрозрачных запечатанных конвертах в центре биопсии. Когда вызывали пациента и получали его согласие на участие в опыте, оператор, который до начала лечения не знал код рандомизации, открывал следующий пронумерованный конверт.
Шкала и измерение: Оценку боли проводили с использованием визуальной аналоговой шкалы (VAS), представляющей собой линию с делениями 0-100 мм. Ощущение боли определяли во время каждого визита в первую неделю 1, во вторую неделю 2, в третью неделю 3, в четвертую неделю 4, в пятую неделю бив шестую неделю 6. Пациентов знакомили со стандартным методом применения шкалы VAS с делениями от 0 до 100 мм для оценки интенсивности боли, испытываемой во время лечения. На этой шкале левая точка 0 означала отсутствие боли, а самая правая точка 100 означала "худшую возможную боль", которую может представить себе пациент. Других отметок на линии не было. Интенсивность боли оценивалась расстоянием в мм от левого края шкалы. Пациентов просили оценить интенсивность боли после приема лекарств, боль оценивалась пациентом в ежедневном дневнике. Врачи, которые прописывали лекарства, получали все экземпляры от каждого пациента.
Статистический анализ: Данные выражали как средние значения ±SD (стандартное отклонение). Разницу параметров по VAS анализировали, используя t - тест Стьюдента для непарных величин и разницу в параметрах оценки боли у двух групп анализировали при помощи U - теста Манн-Уитни для сравнения медиан двух распределений. Похожие статистические опыты применяли для оценки других переменных. Две двусторонние величины Р менее 0,5 показали статистическую значимость. Для статистического анализа применяли программу SAS.
Исследование I. Комбинация тапентадола и NSAID
Пациенты: эффективность фиксированной дозы таблеток тапентадола ER с медленным высвобождением и напроксена, тапентадола и напроксена при лечении остеоартрита коленных суставов оценивали методом двойного слепого рандомизированного параллельного исследования пациентов в трех группах в течение 6 нед. Исследование охватывало 50 пациентов в возрасте от 18 до 75 лет, страдающих от боли в умеренной или сильной степени вследствие остеоартрита с функциональным классом 1-111. Критерии включения выбирали таким образом, чтобы в каждой группе минимум 30 пациентов завершали лечение. Пациенты, которые ответили критериям включения и исключения при отборе, после подписания согласия на участие в исследовании проходили 7 - дневную процедуру вымывания, когда прекращали прием всех анальгетиков. Во время визита 2 в начале первой недели исследования, пациенты, которые сообщали об интенсивности боли в коленном суставе, соответствующей отметке 240 мм на визуальной аналоговой шкале (VAS) измеряли параметр для базовой линии на шкале VAS и распределяли случайно в одну из трех групп: в группу с фиксированной дозой тапентадола ER и напроксена, или в группу с фиксированной дозой тапентадола, или в группу с фиксированной дозой напроксена. В Таблице 16 приведены данные, полученные в ходе этого исследования.

Лекарства и группы пациентов: Группы пациентов и схема приема лекарств указаны ниже. Группа пациентов Лекарство/день для пациента
|
Пациентам прописывали или плацебо, или 100 мг гидрохлорида тапентадола, или 250 мг напроксена или фиксированную дозу комбинации 100 мг тапентадола и 250 мг напроксена. Пациентов, на которых лечение не действовало или которые характеризовались неприемлемыми побочными эффектами, исключали. Пациенты возвращались для измерения эффективности в неделю 1, неделю 2, неделю 3, неделю 4, неделю 5 и неделю 6.
Первичное измерение эффективности заключалось в определении интенсивности боли от артрита по шкале VAS (визуальной аналоговой шкале) во время визитов пациентов. Применение VAS при артрите является наиболее распространенным для оценки интенсивности боли, VAS рекомендована FDA для оценки лекарств в качестве анальгетиков.
Мы считали, что клинически значимое преимущество применения фиксированной дозы гидрохлорида тапентадола и напроксена заключается в уменьшении параметра оценки боли (VAS) по меньшей мере на 15% по сравнению с монотерапией при использовании или гидрохлорида тапентадола, или напроксена. Или же значительным преимуществом можно было бы считать уменьшение дозы или напроксена, или тапентадола по меньшей мере на 15% при применении комбинации по сравнению с монотерапией.
Цели данного изобретения достигаются следующими результатами клинических испытаний. Были рандомизированы и оценены с точки зрения безопасности 206 пациентов. Из них поддавались оценке 170 пациентов в популяции в зависимости от назначенного лечения (ITT). Популяция ITT включала всех пациентов, оцениваемых с точки зрения безопасности, которые обладали первичной информацией об эффективности, записанной во время базового визита (визит 2) и во время визита в первую неделю (визит 3). Популяция ITT включала также всех пациентов, которые были исключены до визита в неделю 1 из-за отсутствия эффективности лечения. Средний возраст включенных пациентов составлял 61 год и средняя продолжительность остеоартрита составляла 10 лет.
Фиксированная доза комбинации, включающей тапентадол с медленным высвобождением и напроксен, обеспечивала статистически значимое и клинически значимое уменьшение боли по сравнению с монотерапией при применении или тапентадола, или напроксена, при этом первичная эффективность менялась при оценке интенсивности боли, вызванной остеоартритом коленного сустава.
Тапентадол в комбинации с аналогом GABA, исследование II
Исследование проводили методом двойной слепой перекрестной, двухпериодной рандомизации с применением плацебо в качестве контроля. Через 2 нед 32 пациента, больных диабетом (17 мужчин, 15 женщин с диабетом типа 2, возраст [средний + SE) 61,7±1,6 года, продолжительность болезни 8,8±1,5 года, продолжительность болезненной нейропатии составляла 2,2±0,4 года) распределяли вслепую на группы, принимавшие или плацебо, или гидрохлорид тапентадола, 100 мг, или прегабалин 250 мг/габапентин 250 мг FDC в течение 43 нед, затем в течение 2 нед лекарства вымывали и проводили лечение в течение еще 4 нед. Пациентам распыляли спрей на обе ступни перед сном. Два раза в неделю оценивали интенсивность боли и другие симптомы, используя визуальную аналоговую шкалу (VAS). Характеристики пациентов приведены в Таблице 17.
|
Каждый пациент длительно испытывал боли при нейропатии и пробовал принимать различные лекарства, такие как ацетаминофен, дулокситин, амитриптилин или габапентин и прекращал их прием, так как симптомы не реагировали на лечение или появлялись неприемлемые побочные эффекты. Подходящие пациенты включали субъектов с диабетом типа 1 и типа 2, не принимавшие любые другие лекарства от нейропатической боли и проходившие стабильный контроль над протеканием диабета. Критерии исключения включали ошибочный гликемический контроль, болезнь периферических сосудов (PVD) с отсутствием пульса в нижних конечностях, наличие активных язв на ступнях, лечение подъязычным глицерилтринитратов, прием лекарств от эректильной дисфункции, факторы, влияющие на оценку интенсивности боли пациентом и наличие других причин периферической нейропатии. В течение цикла исследования не было значительных изменений в способе лечения диабета.
Пациентов оценивали с неврологической точки зрения в начале опыта в период, после которого пациентом случайно назначали плацебо, или 100 мг тапентадола гидрохлорида или прегабалин 250 мг/габапентин 250 мг, или гидрохлорид тапентадола 100 мг + прегабалин 250 мг / габапентин 250 мг FDC в течение 4 нед. Применяли визуальную аналоговую шкалу (VAS) длиной 10 см дважды в неделю для оценки интенсивности боли на этой шкале точка О означала отсутствие боли и точка 10 означала максимально возможную боль. Эффективность лечения определялась как разница между конечным параметром и базисным параметром на шкале Ликерта на каждой фазе лечения.
Цели данного изобретения достигаются применением фиксированной дозы комбинации, включающей тапентадол с медленным высвобождением и прегабалин/габапентин, что обеспечивало статистически значимое и клинически значимое уменьшение боли по сравнению с монотерапией с применением или тапентадола, или прегабалина; при этом первичная эффективность уменьшения интенсивности боли от диабетической нейропатии менялась. Мы считаем, что клинически значимое преимущество применения фиксированной дозы гидрохлорида тапентадола с медленным высвобождением и прегабалина/габапентина будет состоять в уменьшении параметра оценки интенсивности боли по меньшей мере на 15% по сравнению с другими способами лечения.
Комбинация тапентадола и трамадола, исследование III
Фиксированную дозу комбинации гидрохлорида тапентадола и гидрохлорида трамадола испытывали клинически на людях. Во время этого исследования участие принимали 40 пациентов, страдающих от хронической боли, вызванной не раком (CNCP), длившейся более 6 мес, включая нейропатическую боль, остеоартрит, ревматоидный артрит, фибромиалгию и боль в спине и скелетно-мышечную боль. При этом не делалась попытка разделить пациентов в зависимости от вида боли или оценить степень облечения боли на основе вида боли. Пациенты с мигренью, зубной болью, болями в брюшной полости (от хронического панкреатита, камней в почках и т.д.), ишемической болью от сосудистых заболеваний были исключены, так как обычно они не классифицируются как CNCP. Из числа участников были также исключены пациенты, характеризующиеся привыканием (к алкоголю или лекарствам). Характеристики пациентов и параметры оценки боли по VAS приведены ниже в Таблицах 18 и 19.
|
|
Цели изобретения достигаются применением фиксированной дозы комбинации, содержащей тапентадол с медленным высвобождением и трамадол, которая обеспечивает статистически значимое и клинически значимое уменьшение интенсивности боли по сравнению с монотерапией с использованием или тапентадола, или трамадола, при этом первичная эффективность характеризовалась различной интенсивностью боли, связанной с диабетической нейропатией. Мы считаем, что клинически значимое преимущество применения фиксированной дозы комбинации гидрохлорида тапентадола и трамадола (Пример 13) заключается в уменьшении параметра оценки интенсивности боли (по VAS) по меньшей мере на 15% по сравнению с другими способами лечения.
Результаты Цели изобретения достигаются путем получения следующих результатов.
На Фигуре 1 показан профиль in vitro растворения гидрохлорида тапетадола в таблетках, содержащих 100 мг гидрохлорида тапентадола и 250 мг напроксена, полученных по Примеру 1.
На Фигуре 2 сравниваются результаты средней величины изменения LS по сравнению с базисной линией по шкале VAS для комбинации лекарств, содержащей тапентадол с медленным высвобождением, 100 мг, и напроксен, 250 мг (пример 1) и для монотерапий с применением тапентадола и напроксена в среднем в течение 6 нед. В конечной точке (изменение LS со сравнению с базисной линией через 6 нед) Величина изменения составила 49,0% для параметра интенсивности боли по шкале VAS для комбинации лекарств, содержащей тапентадол с медленным высвобождением и напроксен, 250 мг по сравнению с 38% для тапентадола, 28% для напроксена и 21% для плацебо.
На Фигуре 3 показаны величины еженедельного изменения LS по сравнению с базисной линией для четырех групп, получавших лечение. Разница в ответах на лечение возникала, когда пациенты получали или тапентадола гидрохлорид, 100 мг × 2 или напроксен, 250 мг × 2. в течение самой первой недели. Данные включали реакцию на введение плацебо в период от недели 1 до недели 6. Ответ на введение комбинации лекарств был гораздо больше, чем на монотерапию с применением тапентадола или напроксена.
На Фигуре 4 показаны средние величины оценки интенсивности боли по шкале VAS для четырех курсов лечения: тапентадол 100 мг, прегабалин 250 мг, а также фиксированная комбинированная доза - тапентадол с медленным высвобождением 100 мг + прегабалин 250 мг (пример 10).
Фигура 5 отражает средние величины оценки интенсивности боли по шкале VAS для трех курсов лечения: трамадол 50 мг, тапентадол 100 мг, плацебо и фиксированная комбинированная доза - тапентадол с медленным высвобождением 100 мг + трамадол 50 мг Пример 13).
Сокращения, используемые в данной заявке, имеют свое обычное значение в области химии и биологии. Все публикации, патенты и патентные документы, цитировавшиеся в описании, включены в данную заявку в качестве ссылок. В случае каких-либо несоответствий данное описание, включающее любые определения, будет иметь преобладающее значение. Данное изобретение было описано со ссылкой на различные конкретные и предпочтительные варианты и методики. Однако следует иметь в виду, что могут быть сделаны многие изменения и модификации в объеме данного изобретения и в соответствии с его замыслом.