Результат интеллектуальной деятельности: ЗАМЕЩЕННЫЕ НИКОТИНАМИДНЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ В ЛЕКАРСТВЕННЫХ СРЕДСТВАХ
Вид РИД
Изобретение
Изобретение относится к замещенным никотинамидным соединениям, к способу их получения, к лекарственным средствам, содержащим эти соединения, и к применению этих соединений для приготовления лекарственных средств.
Лечение боли, в особенности нейропатической боли, является очень важной проблемой в медицине. Во всем мире существует потребность эффективного лечения боли. Настоятельная потребность воздействия для направленного на мишень лечения хронических и нехронических болезненных состояний, подходящих для пациента, которые были бы успешными и удовлетворительными для лечения боли у пациента, также описана во различных научных работах, которые были опубликованные в последнее время в области применения обезболивающих средств и фундаментальных исследований в области ноцицепции.
Патофизологической особенностью хронической боли является повышенная возбудимость нейронов. На возбудимость нейронов, очевидно, оказывает влияние активность K+ каналов, поскольку это определяется убедительно согласно мембранному потенциалу покоя клетки и, следовательно, порогу возбудимости. Гетерометрические K+ каналы молекулярного подтипа KCNQ2/3 (Kv7.2/7.3) экспрессируются в нейронах различных участков центральной (гиппокампа, миндалевидного тела) и периферической (ганглии задних корешков) нервной системы и регулируют их возбудимость. Активация KCNQ2/3 K+ каналов приводит к гиперполяризации клеточной мембраны и связанным с ней снижением электрической возбудимости этих нейронов. Экспрессирующие KCNQ2/3 нейроны ганглий задних корешков вовлечены в трансмиссию ноцицептивных стимулов из периферии в спинной мозг (Passmore и др., J. Neurosci. 2003; 23(18): 7227-36). Таким образом, представляется возможным определить аналгетическую активность в предклинической невропатии и на моделях воспалительной боли для антагониста KCNQ2/3 ретигабина (Blackburn-Munro и Jensen, Eur J Pharmacol. 2003; 460 (2-3); 109-16; Dost и др., Naunyn Schmiedebergs Arch Pharmacol 2004; 369 (4): 382-390). Таким образом, KCNQ2/3 K+ канал является подходящей исходной точкой для лечения боли; в особенности боли, выбранной из группы, включающей хроническую боль, невропатическую боль, воспалительную боль и мышечную боль (Nielsen и др., Eur J Pharmacol. 2004; 487(1-3): 93-103), в особенности невропатическую и воспалительную боль.
Кроме того, KCNQ2/3 K+ канал является подходящей мишенью для лечения различных других заболеваний, таких как, например, мигрень (US 2002/0128277), когнитивные заболевания (Gribkoff, Expert Opin Ther Targets 2003; 7(6): 737-748), состояния тревоги (Korsgaard и др., J Pharmacol Exp Ther. 2005, 14(1): 282-92), эпилепсия (Wickenden и др., Expert Opin Ther Pat 2004; 14 (4): 457-469) и недержание мочи (Streng и др., J Urol 2004; 172: 2054-2058).
Таким образом, объектом настоящего изобретения является обеспечение новых соединений, которые являются пригодными в особенности в качестве фармакологически активных компонентов в лекарственных средствах, предпочтительно, в лекарственных средствах для лечения нарушений или заболеваний, которые по меньшей мере частично опосредованы KCNQ2/3 K+ каналами.
Сейчас неожиданно было обнаружено, что замещенные никотинамидные соединения общей формулы I, представленные ниже, пригодны для лечения боли и также обладают очень хорошим сродством к KCNQ2/3 K+ каналу и, следовательно, пригодны для лечения нарушений или заболеваний, которые по меньшей мере частично опосредованы KCNQ2/3 K+ каналами.
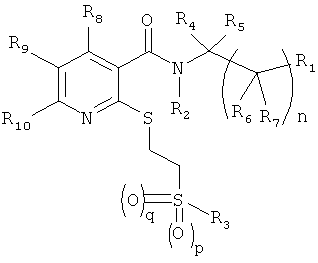
Таким образом, настоящее изобретение обеспечивает замещенные никотинамидные соединения общей формулы 1
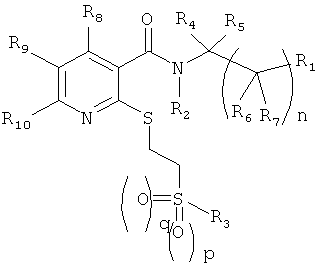
в которой
n=0, 1 или 2
р=0 или 1
q=0 или 1,
R1 представляет собой арил или гетероарил, незамещен или моно- или поли-замещен; C1-6-алкил, С3-10-циклоалкил или гетероциклил, незамещен или моно- или поли-замещен;
R2 представляет собой Н; C1-6-алкил, незамещен или моно- или поли-замещен;
R3 представляет собой арил или гетероарил, незамещен или моно- или поли-замещен; C1-6-алкил или С3-10-циклоалкил, в каждом случае незамещен или моно- или поли-замещен;
R4, R5, R6 и R7 независимо друг от друга представляют собой Н; C1-6-алкил, незамещен или моно- или поли-замещен;
R8, R9 и R10 независимо друг от друга представляют собой Н, F, Cl, Br, O-C1-6-алкил, CF3, OCF3, SCF3, C1-6-алкил;
при условии, что если R3 представляет собой 3-трифторметилфенил или 4-трифторметил-2-пиридил, R2, R4 и R5 представляют собой Н и n представляет собой 0, то R1 не представляет собой 2-пиридил или 2-тиенил
и
если R3 представляет собой фенил или метил, R2, R4 и R5 представляют собой Н и n представляет собой 0, то R1 не представляет собой 2-тиенил,
в форме рацемата; энантиомеров, диастереизомеров, смесей энантиомеров или диастереизомеров или отдельного энантиомера или диастереоизомера; оснований и/или солей физиологически приемлемых кислот.
По отношению к "фенилу", "фенилокси", "бензилу", "бензилокси", "алкиларилу", термин в каждом случае включает незамещенную структуру, а также структуру, замещенную F, Cl, ОСН3, CF3, OCF3, SCF3 и СН3.
В объеме настоящего изобретения, выражение "C1-6-алкил" включает ациклические насыщенные или ненасыщенные углеводородные радикалы, которые могут быть разветвленными или неразветвленными и незамещенными или моно- или поли-замещенными, содержащими от 1 до 6 атомов углерода, то есть C1-6-алканы, С2-6-алкены и С2-6-алкины. В контексте данной заявке, алкенилы содержат по меньшей мере одну С-С двойную связь и алкины содержат по меньшей мере одну С-С тройную связь. Алкил благоприятно выбирают из группы, включающей метил, этил, н-пропил, 2-пропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, неопентил, гексил, этиленил (винил), этинил, пропенил (-СН2СН=СН2, -СН=СН-СН3, -С(=СН2)-СН3), пропинил (-СН-С≡СН, -С≡С-СН3), бутенил, бутинил, пентенил, пентинил, гексенил и гексинил. Особенно благоприятными являются метил, этил и трет-бутил.
Для целей настоящего изобретения, выражение "циклоалкил" или "С3-10-циклоалкил" представляет собой циклические углеводороды, содержащие 3, 4, 5, 6, 7, 8, 9 или 10 атомов углерода, где углеводороды могут быть насыщенными или ненасыщенными (но не ароматическими), незамещенными или моно- или поли-замещенными, мостиковыми или немостиковыми. С3-8-Циклоалкил благоприятно выбирают из группы, включающей циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклопентенил, циклогексенил, циклогептенил, циклооктенил, бицикло[3,3,1]гептанил и адамантил.
Термин "гетероциклил" включает насыщенные или ненасыщенные (но не ароматические) циклоалкилы, содержащие от трех до восьми кольцевых членов, в которых один или два атома углерода заменены гетероатомом S, N или О. Гетероциклильные радикалы благоприятно выбирают из тетрагидропиранила, диоксанила, диоксоланила, морфолинила, пиперидинила, пиперазинила, пиразолинонила и пирролидинила.
В объеме настоящего изобретения, выражение "арил" представляет собой ароматические углеводороды, содержащие вплоть до 14 кольцевых членов, в частности, фенилы и нафтилы. Арильные радикалы также могут быть конденсированы с другими насыщенными, (частично) ненасыщенными или ароматическими кольцевыми системами, которые необязательно содержат один или два гетероатома из группы О, N и S. Каждый арильный радикал может быть незамещен или моно- или поли-замещен, где заместители на ариле могут быть одинаковыми или разными и могут находиться в любом желательном и возможном положении на ариле. Арил благоприятно выбирают из группы, включающей фенил, 1-нафтил, 2-нафтил, каждый из которых может быть незамещенным или моно- или поли-замещен.
Выражение "гетероарил" представляет собой 5-, 6- или 7-членный циклический ароматический радикал, который содержит по меньшей мере 1, необязательно также 2, 3, 4 или 5 гетероатомов, где гетероатомы являются одинаковыми или разными и гетероциклическое кольцо может быть незамещено или моно- или поли-замещено; в случае замещения на гетероциклическом кольце, заместители могут быть одинаковыми или разными и могут находиться в любом желательном и возможном положении гетероарила. Гетероциклическое кольцо также может являться частью би- или поли-циклической системы, содержащий вплоть до 14 кольцевых членов. Предпочтительными гетероатомами являются азот, кислород и сера. Предпочтительно гетероарильный радикал выбирают из группы, включающей пирролил, индолил, фурил (фуранил), бензофуранил, тиенил (тиофенил), бензотиенил, бензотиадиазолил, бензотиазолил, бензотриазолил, бензодиоксоланил, бензодиоксанил, фталазинил, пиразолил, имидазолил, тиазолил, оксадиазолил, изоксазолил, пиридил, пиридазинил, пиримидинил, пиразинил, индазолил, пуринил, индолизинил, хинолинил, изохинолинил, хиназолинил, карбазолил, феназинил и оксадиазолил, где связывание с соединениями общей структуры I может осуществляться посредством любого желательного и возможного кольцевого члена гетероарильного радикала. Особенно предпочтительными являются пиридил, фурил и тиенил.
Применительно к "алкилу", "гетероциклилу" и "циклоалкилу", термин "замещенный" понимается в объеме настоящего изобретения как замена радикала водорода радикалом F, Cl, Br, I, -CN, NH2, NH-C1-6-алкил, NH-C1-6-алкил-ОН, C1-6-алкил, N(C1-6-алкил)2, N(C1-6-алкил-ОН)2, NO2, SH, S-C1-6-алкил, S-бензил, O-C1-6-алкил, ОН, O-C1-6-алкил-ОН, =O, O-бензил, С(=O)C1-6-алкил, CO2H, CO2-C1-6-алкил, фенил, фенокси, морфолинил, пиперидинил, пирролидинил или бензил, где полизамещенные радикалы понимаются как радикалы, которые несколько раз замещены, например, два или три раза, либо на различных атомах либо на одном атоме, например, три раза на одном атоме углерода, как в случае CF3 или -CH2CF3, или в различных местах, как в случае -CH(OH)-CH=CH-CHCl2. Полизамещение может осуществляться с помощью одинаковых или различных заместителей.
Применительно к "арилу" и "гетероарилу", "моно- или поли-замещен" понимается в объеме настоящего изобретения как замена один или несколько раз, например, два, три или четыре раза, одного или нескольких атомов водорода кольцевой системы на F, Cl, Br, I, CN, NH2, NH-C1-6-алкил, NH-C1-6-алкил-ОН, N(C1-6-алкил)2, N(C1-6-алкил-ОН)2, NO2, SH, S-C1-6-алкил, ОН, O-C1-6-алкил, O-C1-6алкил-ОН, С(=O)С1-6-алкил, С(=O)NHC1-6-алкил; о-пиридил; С(=O)-арил; С(=O)-N-морфолин; С(=O)-пиперидин; (С=O)-пирролидин; (С=O)-пиперазин; NHSO2C1-6-алкил, NHCOC1-6-алкил, CO2H, CH2SO2-фенил, CO2-C1-6-алкил, OCF3, SCF3, CF3, 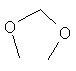 ,
,  , C1-6-алкил, пирролидинил, пиперидинил, морфолинил, бензилокси, фенокси, фенил, пиридил, алкиларил, имидазолил, пиразолил, тиенил или фурил; на одном или необязательно разных атомах, где заместитель сам необязательно может быть замещен, но не с помощью дополнительного арильного или гетероарильного кольца. Полизамещение в контексте данной заявке осуществляется с одинаковыми или различными заместителями. Предпочтительными заместителями для "арила" или "гетероарила" являются F, Cl, Br, ОСН3, CF3, OCF3, SCF3 и СН3.
, C1-6-алкил, пирролидинил, пиперидинил, морфолинил, бензилокси, фенокси, фенил, пиридил, алкиларил, имидазолил, пиразолил, тиенил или фурил; на одном или необязательно разных атомах, где заместитель сам необязательно может быть замещен, но не с помощью дополнительного арильного или гетероарильного кольца. Полизамещение в контексте данной заявке осуществляется с одинаковыми или различными заместителями. Предпочтительными заместителями для "арила" или "гетероарила" являются F, Cl, Br, ОСН3, CF3, OCF3, SCF3 и СН3.
В объеме настоящего изобретения, термин «соль, образованная с физиологически приемлемой кислотой» обозначает соли конкретного активного компонента с неорганическими или органическими кислотами, которые являются физиологически приемлемыми - в особенности, когда они используются у людей и/или млекопитающих. Особенно предпочтительным является гидрохлорид. Примерами физиологически приемлемых кислот являются: соляная кислота, бромистоводородная кислота, серная кислота, метансульфоновая кислота, муравьиная кислота, уксусная кислота, щавелевая кислота, янтарная кислота, винная кислота, миндальная кислота, фумаровая кислота, малеиновая кислота, молочная кислота, лимонная кислота, глутаминовая кислота, 1,1-диоксо-1,2-дигидро1λ6-бензо[d]изотиазол-3-он (сахарная кислота), монометилсебациновая кислота, 5-оксо-пролин, гексан-1-сульфоновая кислота, никотиновая кислота, 2-, 3- или 4-аминобензойная кислота, 2,4,6-триметил-бензойная кислота, α-липоновая кислота, ацетилглицин, гиппуровая кислота, фосфорная кислота и/или аспарагиновая кислота. Особенно предпочтительными являются лимонная кислота и соляная кислота.
Предпочтительными в объеме настоящего изобретения являются замещенные никотинамидные соединения общей формулы I, в которых
n=0, 1 или 2;
р=0 или 1;
q=0 или 1;
R1 представляет собой арил или гетероарил, незамещен или моно- или поли-замещен; C1-6-алкил, С3-10-циклоалкил или гетероциклил, незамещен или моно- или поли-замещен;
R2 представляет собой Н; C1-6-алкил, незамещен или моно- или поли-замещен;
R3 представляет собой арил или гетероарил, незамещен или моно- или поли-замещен; C1-6-алкил или С3-10-циклоалкил, в каждом случае незамещен или моно- или поли-замещен;
R4, R5, R6 и R7 независимо друг от друга представляют собой Н; C1-6-алкил, незамещен или моно- или поли-замещен;
R8, R9 и R10 независимо друг от друга представляют собой Н, F, Cl, Br, O-C1-6-алкил, CF3, OCF3, SCF3, C1-6-алкил;
при условии, что если R3 представляет собой 3-трифторметилфенил или 4-трифторметил-2-пиридил, R2, R4 и R5 представляют собой Н и n представляет собой 0, то R1 не представляет собой 2-пиридил или 2-тиенил;
и
если R3 представляет собой фенил или метил, R2, R4 и R5 представляют собой Н и n представляет собой 0, то R1 не представляет собой 2-тиенил;
где
"алкил, замещенный", "гетероциклил, замещенный" и "циклоалкил, замещенный" обозначает замену водородного радикала на F, Cl, Br, I, -CN, NH2, NH-C1-6-алкил, NH-C1-6-алкил-ОН, C1-6-алкил, N(C1-6-алкил)2, N(C1-6-алкил-ОН)2, NO2, SH, S-C1-6-алкил, S-бензил, O-C1-6-алкил, ОН, O- C1-6-алкил-ОН, =O, O-бензил, С(=O)С1-6-алкил, CO2H, CO2-C1-6-алкил, фенил, фенокси, морфолинил, пиперидинил, пирролидинил или бензил;
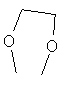
и "арил, замещенный" и "гетероарил, замещенный" обозначает замену один или несколько раз, например, два, три или четыре раза, одного или нескольких атомов водорода кольцевой системы на F, Cl, Br, I, CN, NH2, NH-C1-6-алкил, NH-C1-6-алкил-ОН, N(С1-6-алкил)2, N(C1-6-алкил-OH)2, NO2, SH, S-C1-6-алкил, ОН, O-C1-6-алкил, O-C1-6алкил-ОН, С(=O)С1-6-алкил, C(=O)NHC1-6-алкил; o-пиридил; С(=O)-арил; C(=O)-N-морфолин; С(=O)-пиперидин; (С=O)-пирролидин; (С=O)-пиперазин; NHSO2C1-6-алкил, NHCOC1-6-алкил, CO2H, CH2SO2-фенил, CO2-C1-6-алкил, OCF3, SCF3, CF3,  ,
,  , C1-6-алкил, пирролидинил, пиперидинил, морфолинил, бензилокси, фенокси, фенил, пиридил, алкиларил, имидазолил, пиразолил, тиенил или фурил.
, C1-6-алкил, пирролидинил, пиперидинил, морфолинил, бензилокси, фенокси, фенил, пиридил, алкиларил, имидазолил, пиразолил, тиенил или фурил.
Предпочтительными являются замещенные никотинамидные производные общей формулы I, в которых р и q каждый представляют собой 1 (сульфоны).
Также предпочтительными являются замещенные никотинамидные производные общей формулы I, в которых р и q каждый представляют собой 0 (простые тиоэфиры).
Предпочтительными также являются замещенные никотинамидные соединения общей формулы I, в которых R8, R9 и R10 представляют собой Н.
Предпочтительными являются замещенные никотинамидные производные общей формулы I, в которых
R1 представляет собой пирролил, фурил, тиенил, пиразолил, имидазолил, тиазолил, оксадиазолил, изоксазолил, пиридил, пиримидинил, пиразинил, тиадиазолил, оксазолил, изотиазолил, фенил, нафтил, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, тетрагидропиранил, диоксанил или C1-6-алкил, в каждом случае незамещен или моно- или поли-замещен;
в особенности
R1 представляет собой трет-бутил, фенил, пиридил, тиенил, фурил или циклогексил, незамещенный или моно- или поли-замещен.
Особенно предпочтительными являются замещенные никотинамидные производные общей формулы I, в которых R1 представляет собой циклогексил; фенил, незамещенный или моно- или поли-замещен с помощью F, СН3, Cl, Br, CF3, ОСН3, SCF3 или OCF3; пиридил, тиенил или фурил, незамещенный или моно- или поли-замещен с помощью СН3.
Предпочтительным значением для R2 является СН3 или Н, в особенности Н.
Также предпочтительно, когда R4, R5, R6 и R7 независимо друг от друга представляют собой Н или СН3, в особенности Н.
n предпочтительно представляет собой 0 или 1, особенно предпочтительно 0.
Также предпочтительными являются замещенные никотинамидные производные, в которых R3 представляет собой арил или гетероарил, незамещенный или моно- или поли-замещен,
предпочтительно
R3 представляет собой фенил или пиридил, незамещенный или моно- или поли-замещен, в особенности фенил, который моно- или поли-замещен с помощью F, СН3, CF3, OCF3, ОСН3, SCF3 или Cl.
Особенно предпочтительными являются замещенные никотинамидные производные, в которых R3 представляет собой фенил, который незамещен или замещен с помощью CF3 или СН3.
Особенно предпочтительными также являются соединения, в которых предпочтительные определения, перечисленные для радикалов R1-R7, комбинируются друг с другом.
Наиболее предпочтительными являются замещенные никотинамидные производные из группы
1 2-(2-(фенилсульфонил)этилтио)-N-(пиридин-2-илметил)никотинамид
2 2-(2-(фенилсульфонил)этилтио)-N-(пиридин-4-илметил)никотинамид
3 N-(3-фторфенетил)-2-(2-(фенилсульфонил)этилтио)никотинамид
4 N-метил-N-(3-метилбензил)-2-(2-(фенилсульфонил)этилтио)никотинамид
5 N-(4-метилбензил)-2-(2-(фенилсульфонил)этилтио)никотинамид
6 2-(2-(фенилсульфонил)этилтио)-N-(2-(трифторметил)бензил)никотинамид
7 2-(2-(фенилсульфонил)этилтио)-N-(пиридин-3-илметил)никотинамид
8 N-(3,5-дифторбензил)-2-(2-(фенилсульфонил)этилтио)никотинамид
9 N-метил-N-фенетил-2-(2-(фенилсульфонил)этилтио)никотинамид
10 N-(3-метоксибензил)-N-метил-2-(2-(фенилсульфонил)этилтио)никотинамид
11 N-(2-фторбензил)-2-(2-(фенилсульфонил)этилтио)никотинамид
12 N-(3,4-дифторбензил)-2-(2-(фенилсульфонил)этилтио)никотинамид
13 N-(3-бромбензил)-N-метил-2-(2-(фенилсульфонил)этилтио)никотинамид
14 N-(2-метоксибензил)-2-(2-(фенилсульфонил)этилтио)никотинамид
15 N-(3-фторбензил)-2-(2-(фенилсульфонил)этилтио)никотинамид
16 N-(фуран-2-илметил)-N-метил-2-(2-(фенилсульфонил)этилтио)никотинамид
17 N-(4-метоксибензил)-2-(2-(фенилсульфонил)этилтио)никотинамид
18 N-(2-хлорбензил)-2-(2-(фенилсульфонил)этилтио)никотинамид
19 N-(3,4-дихлорбензил)-2-(2-(фенилсульфонил)этилтио)никотинамид
20 N-(4-фторбензил)-2-(2-(фенилсульфонил)этилтио)никотинамид
21 N-(2-метоксифенетил)-2-(2-(фенилсульфонил)этилтио)никотинамид
22 N-(2,6-дифторбензил)-2-(2-(фенилсульфонил)этилтио)никотинамид
23 N-(2-метилбензил)-2-(2-(фенилсульфонил)этилтио)никотинамид
24 N-(3,5-диметоксибензил)-2-(2-(фенилсульфонил)этилтио)никотинамид
25 N-(3-хлорбензил)-2-(2-(фенилсульфонил)этилтио)никотинамид
26 N-(2,4-дихлорбензил)-2-(2-(фенилсульфонил)этилтио)никотинамид
29 N-(4-хлорбензил)-2-(2-(фенилсульфонил)этилтио)никотинамид
30 N-(2,3-дихлорбензил)-2-(2-(фенилсульфонил)этилтио)никотинамид
31 N-(4-бромбензил)-N-метил-2-(2-(фенилсульфонил)этилтио)никотинамид
32 N-((1,3-диоксолан-2-ил)метил)-N-метил-2-(2-(фенилсульфонил)этилтио)никотинамид
33 N-бензил-N-метил-2-(2-тозилэтилтио)никотинамид
34 N-(пиридин-2-илметил)-2-(2-тозилэтилтио)никотинамид
35 N-(пиридин-4-илметил)-2-(2-тозилэтилтио)никотинамид
36 N-(тиофен-2-илметил)-2-(2-тозилэтилтио)никотинамид
37 N-(3-фторфенетил)-2-(2-тозилэтилтио)никотинамид
38 N-метил-N-(3-метилбензил)-2-(2-тозилэтилтио)никотинамид
39 N-(фуран-2-илметил)-2-(2-тозилэтилтио)никотинамид
40 N-(пиридин-3-илметил)-2-(2-тозилэтилтио)никотинамид
41 N-(3,5-дифторбензил)-2-(2-тозилэтилтио)никотинамид
42 N-(3-метоксибензил)-N-метил-2-(2-тозилэтилтио)никотинамид
43 N-(2-фторбензил)-2-(2-тозилэтилтио)никотинамид
44 N-(3-метилбензил)-2-(2-тозилэтилтио)никотинамид
45 N-(3,4-дифторбензил)-2-(2-тозилэтилтио)никотинамид
46 N-(3-бромбензил)-N-метил-2-(2-тозилэтилтио)никотинамид
47 N-(4-метоксибензил)-2-(2-тозилэтилтио)никотинамид
48 N-(2-хлорбензил)-2-(2-тозилэтилтио)никотинамид
49 N-(4-фторбензил)-2-(2-тозилэтилтио)никотинамид
50 N-(3,5-диметоксибензил)-2-(2-тозилэтилтио)никотинамид
51 N-(3-хлорбензил)-2-(2-тозилэтилтио)никотинамид
52 2-(2-тозилэтилтио)-N-(3-(трифторметил)бензил)никотинамид
54 N-бензил-2-(2-(фенилсульфонил)этилтио)никотинамид
55 N-бензил-N-метил-2-(2-(фенилсульфонил)этилтио)никотинамид
56 N-(циклогексилметил)-2-(2-(фенилсульфонил)этилтио)никотинамид
57 2-(2-(фенилсульфонил)этилтио)-N-(1-(3-(трифторметил)фенил)этил)никотинамид
58 N-(2-циклогексилэтил)-2-(2-(фенилсульфонил)этилтио)никотинамид
59 2-(2-(циклогексилтио)этилтио)-N-(тиофен-2-илметил)никотинамид
60 N-(неопентил)-2-(2-(фенилсульфонил)этилтио)никотинамид
61 N-(5-метилфуран-2-илметил)-2-(2-(фенилсульфонил)этилтио)никотинамид
62 N-(фуран-2-илметил)-2-(2-(фенилсульфонил)этилтио)никотинамид
63 2-(2-(фенилсульфонил)этилтио)-N-(тетрагидро-2Н-пиран-4-илметил)никотинамид
64 2-(2-(фенилсульфонил)этилтио)-N-(4-(трифторметилтио)бензил)никотинамид
65 2-(2-(фенилсульфонил)этилтио)-N-(3-толилметил)никотинамид
66 (R)-N-(1-циклогексилэтил)-2-(2-(фенилсульфонил)этилтио)никотинамид
67 N-(1-(3,4-диметилфенил)этил)-2-(2-(фенилсульфонил)этилтио)никотинамид
68 N-(1-тиофен-2-илэтил)-2-(2-(фенилсульфонил)этилтио)никотинамид
69 N-(1-(3,5-диметилфенил)метил)-2-(2-(фенилсульфонил)этилтио)никотинамид
70 N-(циклогексилметил)-2-(2-(3-трифторметилфенилсульфонил)этилтио)никотинамид
71 (S)-N-(1-циклогексилэтил)-2-(2-(фенилсульфонил)этилтио)никотинамид
72 N-(1-(3,5-диметилфенил)этил)-2-(2-(фенилсульфонил)этилтио)никотинамид
73 N-(тиофен-2-илметил)-2-(2-(3-(трифторметил)фенилтио)этилтио)никотинамид
74 N-(циклопентилметил)-2-(2-(фенилсульфонил)этилтио)никотинамид
75 N-(циклобутилметил)-2-(2-(фенилсульфонил)этилтио)никотинамид
76 N-((1,4-диоксан-2-ил)метил)-2-(2-(фенилсульфонил)этилтио)никотинамид
77 2-(2-(фенилсульфонил)этилтио)-N-(4-(пиридин-2-илокси)бензил)никотинамид
78 N-(2-метилбутил)-2-(2-(фенилсульфонил)этилтио)никотинамид
79 N-(2-этилбутил)-2-(2-(фенилсульфонил)этилтио)никотинамид
80 N-(циклопропилметил)-2-(2-(фенилсульфонил)этилтио)никотинамид
81 N-(3-(2-метоксиэтокси)пропил)-2-(2-(фенилсульфонил)этилтио)никотинамид
82 2-(2-(фенилсульфонил)этилтио)-N-(1-(4-(трифторметилтио)фенил)этил)никотинамид
83 N-(3-(1Н-пиразол-1-ил)бензил)-2-(2-(фенилсульфонил)этилтио)никотинамид
84 N-((2,3-дигидробензофуран-5-ил)метил)-2-(2-(фенилсульфонил)этилтио)никотинамид
85 N-(4-феноксибензил)-2-(2-(фенилсульфонил)этилтио)никотинамид
86 N-(((1R,2S,5R)-6,6-диметилбицикло[3.1.1]гептан-2-ил)метил)-2-(2-(фенилсульфонил)этилтио)никотинамид
87 N-(тиофен-2-илметил)-2-(2-(3-(трифторметил)фенилсульфонил)этилтио)никотинамид
88 2-(2-(фенилсульфонил)этилтио)-N-(3-(трифторметил)бензил)никотинамид
93 N-изобутил-2-(2-(фенилсульфонил)этилтио)никотинамид
94 2-[2-(бензолсульфонил)этилтио]-N-(2-тетрагидропиранилметил)-никотинамид
95 2-[2-(бензолсульфонил)этилтио]-N-[(5-метил-2-тиенил)метил]-никотинамид
96 2-[2-(бензолсульфонил)этилтио]-N-[(4-метил-2-тиенил)метил]-никотинамид
97 N-(1-адамантилметил)-2-[2-(бензолсульфонил)этилтио]-никотинамид
98 2-[2-(бензолсульфонил)этилтио]-N-[(3-морфолинофенил)метил]-никотинамид
99 2-[2-(4-хлорфенил)сульфонилэтилтио]-N-(2-тиенилметил)-никотинамид
100 2-[2-(4-фторфенил)сульфонилэтилтио]-N-(2-тиенилметил)-никотинамид
101 N-(2-тиенилметил)-2-[2-[3-(трифторметокси)фенил]сульфонилэтилтио]-никотинамид
102 N-(2-тиенилметил)-2-[2-[4-(трифторметил)фенил]сульфонилэтилтио]-никотинамид
103 N-(2-тиенилметил)-2-[2-[4-(трифторметокси)фенил]сульфонилэтилтио]-никотинамид
104 2-[2-(м-толилсульфонил)этилтио]-N-(2-тиенилметил)-никотинамид
105 2-[2-(м-толилтио)этилтио]-N-(2-тиенилметил)-никотинамид
106 2-[2-(3-фторфенил)сульфонилэтилтио]-N-(2-тиенилметил)-никотинамид
107 2-[2-(бензолсульфонил)этилтио]-N-(3,3-диметилбутил)-никотинамид
108 2-[2-(бензолсульфонил)этилтио]-N-(2-бензотиофенилметил)-никотинамид
109 2-[2-(фенилтио)этилтио]-N-(2-тиенилметил)-никотинамид
110 2-[2-(бензолсульфинил)этилтио]-N-(2-тиенилметил)-никотинамид
111 2-(2-циклогексилсульфонилэтилтио)-N-(2-тиенилметил)-никотинамид
112 N-(2-тиенилметил)-2-[2-[[2-(трифторметил)фенил]тио]этилтио]-никотинамид
113 N-(2-тиенилметил)-2-[2-[2-(трифторметил)фенил]сульфинилэтилтио]-никотинамид
114 N-(2-тиенилметил)-2-[2-[2-(трифторметил)фенил]сульфонилэтилтио]-никотинамид
115 2-[2-(бензолсульфонил)этилтио]-N-[(5-хлор-2-тиенил)метил]-никотинамид
116 2-[2-(2-фторфенил)сульфонилэтилтио]-N-(2-тиенилметил)-никотинамид
117 2-[2-[3,5-бис(трифторметил)фенил]сульфонилэтилтио]-N-(2-тиенилметил)-никотинамид
118 2-[2-(3-метоксифенил)сульфонилэтилтио]-N-(2-тиенилметил)-никотинамид
119 2-[2-(4-метоксифенил)сульфонилэтилтио]-N-(2-тиенилметил)-никотинамид
120 2-[2-(бензолсульфонил)этилтио]-N-(4-тетрагидротиопиранилметил)-никотинамид
121 2-[2-(4-этилфенил)сульфонилэтилтио]-N-(2-тиенилметил)-никотинамид
122 N-(2-тиенилметил)-2-[2-[[4-(трифторметил)фенил]тио]этилтио]-никотинамид
123 2-[2-(о-толилтио)этилтио]-N-(2-тиенилметил)-никотинамид
124 2-[2-[(3-фторфенил)тио]этилтио]-N-(2-тиенилметил)-никотинамид
125 2-[2-[(3,4-дифторфенил)тио]этилтио]-N-(2-тиенилметил)-никотинамид
126 2-[2-[(2,4-дифторфенил)тио]этилтио]-N-(2-тиенилметил)-никотинамид
127 2-[2-(бензолсульфонил)этилтио]-N-[2-(2-тиенил)этил]-никотинамид
128 2-[2-(бензолсульфонил)этилтио]-N-фентил-никотинамид
129 2-[2-(бензолсульфонил)этилтио]-N-(3-фенилпропил)-никотинамид
130 2-[2-(3,4-дифторфенил)сульфонилэтилтио]-N-(2-тиенилметил)-никотинамид
131 2-[2-(2,4-дифторфенил)сульфонилэтилтио]-N-(2-тиенилметил)-никотинамид
132 2-[2-[(2-фторфенил)тио]этилтио]-N-(2-тиенилметил)-никотинамид
133 2-[2-[(4-фторфенил)тио]этилтио]-N-(2-тиенилметил)-никотинамид
134 2-[2-[(4-хлорфенил)тио]этилтио]-N-(2-тиенилметил)-никотинамид
135 2-[2-(п-толилтио)этилтио]-N-(2-тиенилметил)-никотинамид
136 2-[2-(бензолсульфонил)этилтио]-N-изопентил-никотинамид
137 2-[2-(бензолсульфонил)этилтио]-N-(2-циклопропилэтил)-никотинамид
138 2-[2-(бензолсульфонил)этилтио]-N-(2-циклопентилэтил)-никотинамид
139 N-(3,3-диметилбутил)-2-[2-[3-(трифторметил)фенил]сульфонилэтилтио]-никотинамид
140 N-(циклопентилметил)-2-[2-[3-(трифторметил)фенил]сульфонилэтилтио]-никотинамид
141 2-[2-(бензолсульфонил)этилтио]-6-метил-N-(2-тиенилметил)-никотинамид
142 2-[2-(бензолсульфонил)этилтио]-N-(2-тиенилметил)-6-(трифторметил)-никотинамид
143 2-[2-(бензолсульфонил)этилтио]-6-фтор-N-(2-тиенилметил)-никотинамид
144 2-[2-(бензолсульфонил)этилтио]-N-[(3-метилциклогексил)метил]-никотинамид
145 2-[2-(бензолсульфонил)этилтио]-N-(циклогептилметил)-никотинамид
146 2-[2-(бензолсульфонил)этилтио]-N-[(2-метилциклогексил)метил]-никотинамид
147 2-[2-(бензолсульфонил)этилтио]-N-[(4-метилциклогексил)метил]-никотинамид
148 2-[2-(бензолсульфонил)этилтио]-5-фтор-N-(2-тиенилметил)-никотинамид
149 2-[2-(бензолсульфонил)этилтио]-5-метил-N-(2-тиенилметил)-никотинамид
150 2-[2-(бензолсульфонил)этилтио]-N-(2-тиенилметил)-5-(трифторметил)-никотинамид.
Замещенные никотинамидные соединения в соответствии с изобретением, и в каждом случае соответствующие кислоты, основания, соли и сольваты, пригодны в качестве фармацевтически активных компонентах в лекарственных средствах.
Следовательно, настоящее изобретение дополнительно обеспечивает лекарственное средство, содержащее по меньшей мере одно замещенное никотинамидное соединение общей формулы I в соответствии с изобретением, где
n=0, 1 или 2
р=0 или 1
q=0 или 1,
R1 представляет собой арил или гетероарил, незамещен или моно- или поли-замещен; C1-6-алкил, С3-10-циклоалкил или гетероциклил, незамещен или моно- или поли-замещен;
R2 представляет собой Н; C1-6-алкил, незамещен или моно- или поли-замещен;
R3 представляет собой арил или гетероарил, незамещен или моно- или поли-замещен; C1-6-алкил или С3-10-циклоалкил, в каждом случае незамещен или моно- или поли-замещен;
R4, R5, R6 и R7 независимо друг от друга представляют собой Н; C1-6-алкил, незамещен или моно- или поли-замещен;
R8, R9 и R10 независимо друг от друга представляют собой Н, F, Cl, Br, O-C1-6-алкил, CF3, OCF3, SCF3, C1-6-алкил;
и необязательно одно или несколько фармацевтически приемлемых вспомогательных веществ.
Предпочтительными являются лекарственные средства в вышеуказанных предпочтительных диапазонах и их комбинации.
Особенно предпочтительными являются лекарственные средства из следующей группы:
89 2-(2-(фенилсульфонил)этилтио)-N-(тиофен-2-илметил)никотинамид
90 N-(пиридин-2-илметил)-2-(2-(3-(трифторметил)фенилсульфонил)этилтио)никотинамид
91 N-(пиридин-2-илметил)-2-(2-(5-(трифторметил)пиридин-2-илсульфонил)этилтио)никотинамид
92 N-(тиофен-2-илметил)-2-(2-(5-(трифторметил)пиридин-2-илсульфонил)этилтио)никотинамид.
Эти лекарственные средства в соответствии с изобретением пригодны для воздействия на KCNQ2/3 каналы и проявляют агонистическое или антагонистическое, в особенности агонистическое, действие.
Лекарственные средства в соответствии с изобретением предпочтительно пригодны для лечения нарушений или заболеваний, которые по меньшей мере частично опосредованы KCNQ2/3 каналами.
Лекарственное средство в соответствии с изобретением предпочтительно пригодно для лечения одного или нескольких заболеваний, выбранных из группы, включающих боль, предпочтительно боль, выбранную из группы, включающей острую боль, хроническую боль, невропатическую боль, мышечную боль и воспалительную боль, мигрень; эпилепсию, состояния тревоги и недержание мочи. Лекарственные средства в соответствии с изобретением особенно предпочтительно пригодны для лечения боли, наиболее предпочтительно хронической боли, невропатической боли, воспалительной боли и мышечной боли.
Соединения в соответствии с изобретением более предпочтительно пригодны для лечения эпилепсии.
Настоящее изобретение также обеспечивает применение по меньшей мере одного замещенного никотинамидного соединения в соответствии с изобретением и необязательно одного или нескольких фармацевтически приемлемых вспомогательных веществ для приготовления лекарственного средства для лечения нарушений или заболеваний, которые по меньшей мере частично опосредованы KCNQ2/3 каналами.
Предпочтительным является применение по меньшей мере одного замещенного никотинамидного соединения в соответствии с изобретением и необязательно одного или нескольких фармацевтически приемлемых вспомогательных веществ для приготовления лекарственного средства для лечения боли, предпочтительно боли, выбранной из группы, включающей острую боль, хроническую боль, невропатическую боль, мышечную боль и воспалительную боль; мигрень; эпилепсию, состояния тревоги и недержание мочи.
Особенно предпочтительным является применение по меньшей мере одного замещенного никотинамидного соединения в соответствии с изобретением и необязательно одного или нескольких фармацевтически приемлемых вспомогательных веществ для приготовления лекарственного средства для лечения боли, наиболее предпочтительно хронической боли, невропатической боли, воспалительной боли и мышечной боли. Чрезвычайно предпочтительным в дальнейшем является применение по меньшей мере одного замещенного никотинамидного соединения в соответствии с изобретением и необязательно одного или нескольких фармацевтически приемлемых вспомогательных веществ для приготовления лекарственного средства для лечения эпилепсии.
Эффективность относительно боли может быть продемонстрирована, например, на модели Bennett или Chung, описанной в настоящей заявке далее. Эффективность относительно эпилепсии может быть показана, например, на модели DBA/2 мышей (De Sarro и др., Naunyn-Schmiedeberg's Arch. Pharmacol. 2001, 363, 330-336).
Настоящее изобретение также обеспечивает способ приготовления замещенных никотинамидных соединений в соответствии с изобретением. Химические вещества и компоненты реакции, применяемые в реакциях, представленных выше, являются коммерчески доступными или в каждом случае могут быть получены с помощью общепринятых методов, известных для специалиста в данной области техники.
Общий синтез
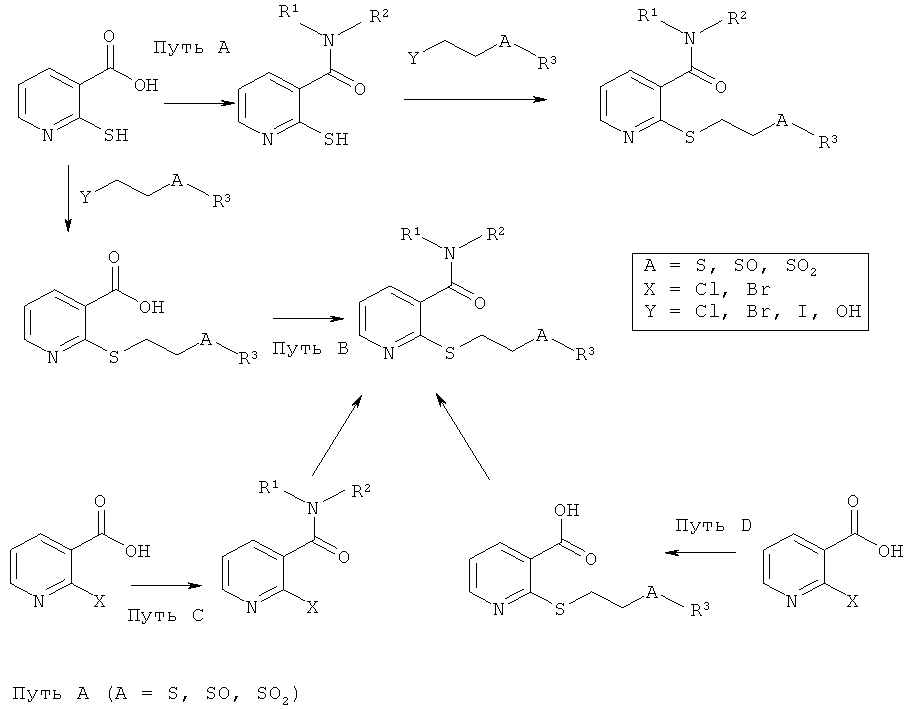
Исходную реакцию ацилирования аминов с помощью карбоновых кислот, в этом случае меркаптоникотиновой кислоты, используя основания и необязательно связующие реагенты, можно осуществлять в растворителях, таких как, например, метанол, ДМФА или ДХМ. Примерами оснований, которые можно использовать, являются метанолат натрия, триэтиламин, диизопропилэтиламин или N-метилморфолин. Подходящими связующими реагентами являются, например, EDCI, HOBt, DCC, CDI, HBTU, DMAP или пентафторфенилдифенил фосфинат. Время реакции может изменяться от 1 часа до 3 дней.
Тем не менее, также представляется возможным сначала превращать меркаптоникотиновую кислоту в хлорид карбоновой кислоты. Подходящими реагентами для этой цели являются, например, COCl2, PCl3, POCl3, P2O5, SOCl2 или SiCl4 в растворителях, таких как, например, пиридин, ДХМ, ДМФА или толуол.
Для последующего образования простого тиоэфира, может быть необходимым приготавливать галогенированный простой тиоэфир Y-CH2-CH2-A-R3 (где А=S). Для этого, например, соответствующий тиол можно подвергать реакции под воздействием УФ-облучения с винилгалогенидами. Кроме того, галогенированный простой тиоэфир Y-CH2-CH2-A-R3 (где А=S) можно осуществлять, например, путем взаимодействия соответствующего тиола со смесью ацетилена и брома в четыреххлористом углероде. В дальнейшем методе используют взаимодействие 1,2-дигалоалканов с тиолом в бензоле, толуоле или метаноле в присутствии оснований, таких как, например, NaOH, КОН или метанолат натрия, необязательно с добавлением гидразина или хлорида трикаприлметиламмония.
Соответствующий галогенированный простой тиоэфир Y-CH2-CH2-A-R3 (где А=S) необязательно может быть окислен до соответствующего сульфоксида Y-CH2-CH2-A-R3 (где А=SO). Это окисление можно осуществлять с такими окислителями, как, например, H2O2, NaIO4, NaClO2, м-хлорпербензойная кислота или оксон в растворителях, таких как, например, ледяная уксусная кислота, вода, метанол, этанол, 2-пропанол, ДХМ или ТГФ или в смесях этих растворителей.
Взаимодействие соответствующего галогенированного тиола Y-CH2-CH2-A-R3 (где А=S), сульфоксида Y-CH2-CH2-A-R3 (где А=SO) или сульфона Y-CH2-CH2-A-R3 (где А=SO2) с амидом меркаптоникотиновой кислоты, можно осуществлять также с йодидами, бромидами или хлоридами в присутствии оснований, таких как, например, карбонат калия, КОН, NaOH, триэтиламин, диизопропилэтиламин, метанолат или этанолат натрия или ацетат натрия, в растворителях, таких как, например, простой диэтиловый эфир, ТГФ, ДМФА, ацетон, ацетонитрил, ДХМ, вода, этанол или метанол.
Простой тиоэфир также может быть образован путем взаимодействия меркаптоникотинамида с соответствующим спиртом HO-CH2-CH2-A-R3 (где А=S, SO, SO2), используя реагенты, такие как, например, серная кислота, фосфорная кислота, перхлорная кислота, уксусный ангидрид или тетрахлорид циркония. Кроме того, дополнительно к этим кислотным реагентам, также представляется возможным использовать основания, такие как, например, гидрид натрия. Тем не менее, в качестве дополнительных связующих реагентов также пригодны йодид (N-метил-N-фениламино)трифенилфосфония, фенил метансульфонат, триамид гексаметилфосфорной кислоты или бромид 1-пентил-3-метилимидазолия. Указанные реагенты могут использоваться как отдельно, так и в комбинациях. Примерами подходящих растворителей являются вода, простой диэтиловый эфир, уксусная кислота и ДМФА.
Соответствующий спирт HO-CH2-CH2-A-R3 (где А=SO) получают путем окисления соответствующего простого тиоэфира HO-CH2-CH2-A-R3 (где А=S) с окислителями, такими как, например, H2O2, NaIO4, NaClO2, м-хлорпербензойная кислота или оксон в растворителях, таких как, например, ледяная уксусная кислота, вода, метанол, этанол, 2-пропанол, ДХМ или ТГФ или в смесях этих растворителей.
Путь В (А=S, SO, SO2)
Простой тиоэфир меркаптоникотиновой кислоты может быть образован путем взаимодействия меркаптоникотиновой кислоты с соответствующим спиртом HO-CH2-CH2-A-R3 (где А=S, SO, SO2), используя реагенты, такие как, например, серная кислота, фосфорная кислота, перхлорная кислота, уксусный ангидрид или тетрахлорид циркония. Кроме того, дополнительно к этим кислотным реагентам, также представляется возможным использовать основания, такие как, например, гидрид натрия. Тем не менее, в качестве дополнительных связующих реагентов также пригодны йодид (N-метил-N-фениламино)трифенилфосфония, фенил метансульфонат, триамид гексаметилфосфорной кислоты или бромид 1-пентил-3-метилимидазолия. Указанные реагенты могут использоваться как отдельно, так и в комбинациях.
Примерами подходящих растворителей является вода, простой диэтиловый эфир, уксусная кислота и ДМФА.
Взаимодействие соответствующего галогенированного соединения НО-СН2-CH2-A-R3 (где А=S, SO, SO2, Y=Cl, Br, I) с меркаптоникотиновой кислотой, можно осуществлять также с йодидами, бромидами или хлоридами в присутствии оснований, таких как, например, карбонат калия, КОН, NaOH, триэтиламин, диизопропилэтиламин, метанолат или этанолат натрия или ацетат натрия, в растворителях, таких как, например, простой диэтиловый эфир, ТГФ, ДМФА, ацетон, ацетонитрил, ДХМ, вода, этанол или метанол.
Последующее ацилирование, используя основания и необязательно связующие реагенты, можно осуществлять в растворителях, таких как, например, метанол, ДМФА или ДХМ. Примерами оснований, которые можно использовать, являются метанолат натрия, триэтиламин, диизопропилэтиламин или N-метилморфолин. Подходящими связующими реагентами являются, например, EDCI, HOBt, DCC, CDI, HBTU, DMAP или пентафторфенилдифенил фосфинат. Время реакции может изменяться от 1 часа до 3 дней.
Тем не менее, также представляется возможным сначала превращать карбоновую кислоту в хлорид карбоновой кислоты. Подходящими реагентами для этой цели являются, например, COCl2, PCl3, POCl3, P2O5, SOCl2 или SiCl4 в растворителях, таких как, например, пиридин, ДХМ, ДМФА или толуол.
Путь С (А=S, SO2)
Исходную реакцию ацилирования аминов с помощью карбоновых кислот, в этом случае галогенированной никотиновой кислотой, используя основания и необязательно связующие реагенты, можно осуществлять в растворителях, таких как, например, метанол, ДМФА или ДХМ. Примерами оснований, которые можно использовать, являются метанолат натрия, триэтиламин, диизопропилэтиламин или N-метилморфолин. Подходящими связующими реагентами являются, например, EDCI, HOBt, DCC, CDI, HBTU, DMAP или пентафторфенилдифенил фосфинат. Время реакции может изменяться от 1 часа до 3 дней.
Тем не менее, также представляется возможным сначала превращать карбоновую кислоту в хлорид карбоновой кислоты. Подходящими реагентами для этой цели являются, например, COCl3, PCl3, POCl3, P2O5, SOCl2 или SiCl4 в растворителях, таких как, например, пиридин, ДХМ, ДМФА или толуол.
В последующей реакции замещения с соответствующими тиолами HS-CH2-CH2-A-R3 или тиолатами -S-CH2-CH2-A-R3 пригодны как производные хлора, так и производные брома (X=Cl, Br) никотиновой кислоты.
Замещение можно применять в растворителях, таких как, например, метанол, этанол, 2-пропанол, 2-метил-2-пропанол, бензол, толуол, ТГФ, диоксан, ацетонитрил, хлороформ, ДМФА, ДМСО или смеси растворителей.
Подходящими основаниями для получения тиолата являются, например, КОН, NaOH, карбонат калия, метанолат натрия, этанолат натрия, трет-бутилат калия, триэтиламин, гидрид натрия, а также, например, натрия. В качестве добавок можно использовать, например, такие соединения, как йодид натрия, бромид тетрабутиламмония, хлорид или гидросульфат, или НМРТ.
Путь D (А=S, SO2)
Производные хлора, а также производные брома никотиновой кислоты (X=Cl, Br) пригодны для реакции замещения с тиолами HS-CH2-CH2-A-R3 или тиолатами -S-CH2-CH2-A-R3.
Замещение можно применять в растворителях, таких как, например, метанол, этанол, 2-пропанол, 2-метил-2-пропанол, бензол, толуол, ТГФ, диоксан, ацетонитрил, хлороформ, ДМФА, ДМСО или смеси растворителей.
Подходящими основаниями для получения тиолата являются, например, КОН, NaOH, карбонат калия, метанолат натрия, этанолат натрия, трет-бутилат калия, триэтиламин, гидрид натрия, а также, например, калия. В качестве добавок можно использовать, например, такие соединения, как йодид натрия, бромид тетрабутиламмония, хлорид или гидросульфат, или НМРТ.
Последующую реакцию ацилирования аминов с помощью карбоновых кислот, используя основания и необязательно связующие реагенты, можно осуществлять в растворителях, таких как, например, метанол, ДМФА или ДХМ. Примерами оснований, которые можно использовать, являются метанолат натрия, триэтиламин, диизопропилэтиламин или N-метилморфолин. Подходящими связующими реагентами являются, например, EDCI, HOBt, DCC, CDI, HBTU, DMAP или пентафторфенилдифенил фосфинат. Время реакции может изменяться от 1 часа до 3 дней.
Тем не менее, также представляется возможным сначала превращать карбоновую кислоту в хлорид карбоновой кислоты. Подходящими реагентами для этой цели являются, например, COCl2, PCl3, POCl3, P2O5, SOCl2 или SiCl4 в растворителях, таких как, например, пиридин, ДХМ, ДМФА или толуол.
Кроме того, реакции, описанные выше, можно в каждом случае осуществлять в общепринятых условиях, известных для специалиста в данной области техники, например, в отношении давления, температуры, атмосферы защитного газа или последовательности добавления компонентов. Оптимальный технологический процесс в конкретных условиях необязательно могут быть определены специалистом в данной области техники с помощью предварительных опытных исследований.
Все стадии способов, описанные выше, и в каждом случае также очистки и/или выделения промежуточных соединений или конечных продуктов, можно осуществлять частично или полностью в атмосфере инертного газа, предпочтительно в атмосфере азота или атмосфере аргона.
Замещенные никотинамидные соединения в соответствии с изобретением могут быть выделены как в виде их свободных оснований, так и их свободных кислот и в каждом случае также в форме соответствующих солей, в особенности физиологически приемлемых солей.
Свободные основания предпочтительных замещенных никотинамидных соединений в соответствии с изобретением могут быть превращены в соответствующие соли, предпочтительно физиологически приемлемые соли, например, путем взаимодействия с неорганической или органической кислотой, предпочтительно с соляной кислотой, бромистоводородной кислотой, серной кислотой, фосфорной кислотой, метансульфоновой кислотой, п-толуолсульфоновой кислотой, угольной кислотой, муравьиной кислотой, уксусной кислотой, щавелевой кислотой, малеиновой кислотой, яблочной кислотой, янтарной кислотой, винной кислотой, миндальной кислотой, фумаровой кислотой, молочной кислотой, лимонной кислотой, глутаминовой кислотой или аспарагиновой кислотой.
Свободные основания предпочтительных замещенных никотинамидных соединений в соответствии с изобретением также могут быть превращены в соответствующие физиологически приемлемые соли со свободной кислотой или солью сахарозаменителя, такого как, например, сахарин, цикламат или ацесульфам.
Соответствующим образом, свободные кислоты замещенных никотинамидных соединений в соответствии с изобретением могут быть превращены в соответствующие физиологически приемлемые соли путем взаимодействия с подходящим основанием. Примерами, которые могут быть упомянуты, являются соли щелочных металлов, соли щелочноземельных металлов или соли аммония [NHxR4-х]+, где х=0, 1, 2, 3 или 4 и R представляет собой линейный или разветвленный C1-4-алкильный радикал.
Замещенные никотинамидные соединения в соответствии с изобретением необязательно, как и соответствующие кислоты, соответствующие основания или соли этих соединений, также могут быть получены в форме их сольватов, предпочтительно в виде их гидратов, с помощью общепринятых методов, известных специалисту в данной области техники.
Если замещенные никотинамидные соединения в соответствии с изобретением получают после их приготовления в форме смеси их стереоизомеров, предпочтительно в форме их рацематов или других смесей их различных энантиомеров и/или диастереизомеров, то они могут быть разделены с помощью общепринятых способов, известных специалисту в данной области техники, и необязательно выделены. Примерами, которые могут быть упомянуты, являются процессы хроматографического разделения, в частности процессы жидкостной хроматографии при нормальном давлении или при повышенном давлении, предпочтительно процессы ЖХСД и ВЭЖХ, и процессы фракционированной кристаллизации. В контексте данной заявке, индивидуальные энантиомеры, например, диастереомерные соли, образованные с помощью ВЭЖХ на хиральной неподвижной фазе или с помощью кристаллизации с хиральной кислотой, например (+)-винной кислотой, (-)-винной кислотой или (+)-10-камфорсульфоноваяой кислотой, могут, в частности, быть отделены друг от друга.
Лекарственное средство в соответствии с изобретением может находиться в форме жидкого, полутвердого или твердого лекарственного средства, например, в форме растворов для инъекций, капель, соков, сиропов, спреев, суспензий, таблеток, трансдермальных терапевтических систем, капсул, пластырей, суппозиториев, мазей, кремов, лосьонов, гелей, эмульсий, аэрозолей или в виде лекарственной формы, состоящей из множества частиц, например, в форме пеллет или гранул, необязательно спрессованных в таблетки, заполненных в капсулы или суспендированных в жидкости, и также могут вводить сами по себе. Дополнительно к по меньшей мере одному замещенному никотинамидному соединению в соответствии с изобретением, лекарственное средство в соответствии с изобретением обычно содержит дополнительные физиологически приемлемые фармацевтические вспомогательные вещества, которые предпочтительно могут быть выбраны из группы, включающей носители, наполнители, растворители, разбавители, поверхностно-активные вещества, красители, консерванты, распадающиеся вещества, добавки, снижающие трение, смазывающие вещества, ароматизаторы и связующие вещества.
Выбор используемых физиологически приемлемых вспомогательных веществ и их количеств зависит от того предназначенного пути введения лекарственного средства, а именно перорального, подкожного, парентерального, внутривенного, внутрибрюшинного, внутрикожного, внутримышечного, интраназального, буккального, ректального или локального, например, при инфекциях кожи, слизистых оболочек и в глаза. Составы в виде таблеток, таблеток с покрытиями, капсул, гранул, пеллет, капель, соков и сиропов предпочтительно пригодны для перорального введения, тогда как растворы, суспензии, легковосстанавлимые высушенные составы и спреи пригодны для парентерального, местного и ингаляционного введения.
Замещенные никотинамидные соединения, используемые в лекарственном средстве в соответствии с изобретением, могут находиться в форме депо, в растворенной форме или в пластыре, необязательно с добавлением веществ, которые способствуют проникновению через кожу, в виде подходящих составов для чрескожного введения.
Лекарственные формы, которые могут использоваться перорально или чрескожно, также могут высвобождать конкретное замещенное никотинамидное соединение в соответствии с изобретением замедленным образом.
Приготовление лекарственных средств в соответствии с изобретением осуществляют с помощью общепринятых средств, устройств, методов и процессов, известных из уровня техники, таких как описанные, например, в "Remingtons Pharmaceutical Sciences", редактор A.R.Gennaro, 17-oe издание, Mack Publishing Company, Easton, Pa, 1985, в особенности в части 8, разделы 76-93. Соответствующее описание включено в настоящую заявку в качестве ссылки и составляет часть описания.
Количество конкретного используемого замещенного никотинамидного соединения в соответствии с изобретением, которое вводят пациенту, может изменяться и зависеть, например, от веса или возраста пациента и способа введения, показания и тяжести заболевания. Подходяще вводят от 0,005 до 100 мг/кг, предпочтительно от 0,05 до 75 мг/кг веса тела пациента по меньшей мере одного такого соединения в соответствии с изобретением.
Далее изобретение поясняется с помощью некоторых примеров. Они служат для пояснения изобретения и не должны истолковываться как ограничивающие.
Синтез иллюстративных соединений
Описание синтеза предшественников
Синтез 2-меркапто-N-(тиофен-2-илметил)никотинамида (предшественник V1)
Суспензию 8,0 г (51,5 ммоль) 2-меркаптоникотиновой кислоты, 5,8 г (51,5 ммоль) 2-(аминометил)-тиофена и 3,5 г (25,8 ммоль) трихлорида фосфора в хлорбензоле (260 мл) нагревали в течение 3 часов в колбе с обратным холодильником (145°С). После охлаждения реакционного раствора до 60°С, осуществляли фильтрацию с отсасыванием при этой температуре. Полученное твердое вещество ресуспендировали в смеси ДХМ/МеОН (3:1, vv, 300 мл) и промывали водой (2×50 мл). Органическую фазу высушивали над MgSO4, фильтровали и концентрировали в вакууме. При кристаллизации остатка из этилацетата получали 3,1 г (12,4 ммоль, 24%) 2-меркапто-N-(тиофен-2-илметил)никотинамида.
1Н ЯМР (400 МГц, ДМСО-d6) d част. на млн. 4,73 (d, J=5,52 Гц, 2Н) 6,97 (dd, J=5,02, 3,51 Гц, 1Н) 7,01-7,11 (m, 2Н) 7,41 (dd, J=5,27, 1,25 Гц, 1Н) 7,98 (td, J=6,27, 2,01 Гц, 1Н) 8,54 (dd, J=7,53, 2,01 Гц, 1Н) 11,28 (t, J=5,52 Гц, 1Н) 14,06 (br.s., 1Н)
Предшественники V2 и V3:
Синтез (2-бромэтил)(циклогексил)сульфана (предшественник V2)
19,4 мл (225,0 ммоль) 1,2-дибромэтана и 4,1 г (30,0 ммоль) K2СО3 добавляли к раствору 3,7 мл (30,0 ммоль) циклогексантиола в ДМФА (46 мл). После перемешивания в течение 2 часов при КТ, смесь разводили простым диэтиловым эфиром (200 мл) и промывали насыщенным водным раствором NaCl. Органическую фазу высушивали над MgSO4, фильтровали и концентрировали в вакууме. Полученные 6,1 г неочищенного продукта (2-бромэтил)(циклогексил)сульфан использовали в дальнейшей реакции без дополнительной очистки.
Синтез (2-бромэтил)(3-(трифторметил)фенил)сульфана (предшественник V3)
Согласно способу, описанному для V2, 10,5 г (58,9 ммоль) 3-трифторметил-тиофенола превращали в 19,3 г неочищенного продукта (2-бромэтил)(3-(трифторметил)фенил)сульфана, который использовали в дальнейшей реакции без дополнительной очистки.
Синтез 2-хлор-6-метил-N-(тиофен-2-илметил)никотинамида (предшественник V4)
2,67 г (7,0 ммоль) HATU и 4,0 мл (23,2 ммоль) DIPEA добавляли при 0°С к раствору 1,0 г (5,8 ммоль) 2-хлор-6-метил-никотиновой кислоты в ДМФА (20 мл), и смесь перемешивали в течение 20 минут при 0°С. При этой температуре, добавляли 656 мг (5,8 ммоль) тиофен-2-илметиламина. После этого перемешивали в течение 16 часов при КТ. Затем смесь разводили с помощью ЕА и промывали с отсасыванием с нас. водн. раствором NaHCO3 и соляным раствором. Органическую фазу высушивали над Na2SO4, фильтровали и концентрировали в вакууме. При СС (гексан/ЕА4:1) остатка получали 966 мг (3,6 ммоль, 63%) 2-хлор-6-метил-N-(тиофен-2-илметил)никотинамида.
Синтез (2-хлорэтил)(3,4-дифторфенил)сульфана (предшественник V9)
5,7 мл (68,4 ммоль) 1-бром-2-хлорэтана и 1,9 г (13,7 ммоль) K2CO3 добавляли к раствору 2,0 г (13,7 ммоль) 3,4-дифтортиофенола в ДМФА (20 мл). После этого перемешивали в течение 5 часов при 60°С и в течение 16 часов при КТ. Затем смесь разводили с помощью ЕА (50 мл) и промывали с отсасыванием с 1М водн. раствором Na2CO3 и соляным раствором. Органическую фазу высушивали над MgSO4, фильтровали и концентрировали в вакууме. Получали в виде остатка 2,7 г (12,9 ммоль, 95%) (2-хлорэтил)-(3,4-дифторфенил)сульфана, который подвергали дальнейшей реакции без дополнительной очистки.
Синтез 4-(2-хлорэтилсульфонил)-1,2-дифторбензола (предшественник V10)
Раствор 3,06 г (12,5 ммоль) м-хлорпербензойной кислоты в ДХМ (10 мл) добавляли по каплям при 5-10°С к раствору 1,04 г (5,0 ммоль) (2-хлорэтил)-(3,4-дифторфенил)сульфана в ДХМ (10 мл). После этого перемешивали в течение 150 минут при 10°С. Затем смесь промывали в каждом случае дважды с 1М водн. раствором NaHCO3 и с нас. водн. раствором Na2SO3. Органическую фазу высушивали над MgSO4, фильтровали и концентрировали в вакууме. Получали в виде остатка 1,2 г (4,94 ммоль, 99%) 4-(2-хлорэтилсульфонил)-1,2-дифторбензола, который подвергали дальнейшей реакции без дополнительной очистки.
Синтез (2-хлорэтилсульфинил)бензола (предшественник V11)
Раствор 1,67 г (7,5 ммоль) м-хлорпербензойной кислоты в ДХМ (10 мл) добавляли по каплям при 5-10°С к раствору 1,30 г (7,5 ммоль) (2-хлорэтилсульфинил)бензола в ДХМ (18 мл). После этого перемешивали в течение 120 минут при 10°С. Затем смесь промывали в каждом случае дважды с 1М водн. раствором NaHCO3 и один раз с соляным раствором. Органическую фазу высушивали над MgSO4, фильтровали и концентрировали в вакууме. Получали в виде остатка 1,34 г (7,1 ммоль, 95%) (2-хлорэтилсульфинил)бензола, который подвергали дальнейшей реакции без дополнительной очистки.
Синтез 1-(2-хлорэтилсульфонил)-4-этилбензола (предшественник V12)
Раствор 1,0 мл (14,0 ммоль) тионилхлорида в толуоле (15 мл) по каплям добавляли, при охлаждении на льду, к раствору 1,0 г (4,67 ммоль) 2-(4-этилфенилсульфонил)-этанола и 56 мкл (0,70 ммоль) пиридина в толуоле (20 мл). Затем смесь нагревали в течение 3 часов в колбе с обратным холодильником. Затем осуществляли закаливания со льдом и водой. Фазы разделяли и водную фазу два раза экстрагировали с помощью ДХМ. Объединенные органические фазы высушивали над MgSO4, фильтровали и концентрировали в вакууме. Получали в виде неочищенного продукта 1,19 г незначительно загрязненного 1-(2-хлорэтилсульфонил)-4-этилбензола, который подвергали дальнейшей реакции без дополнительной очистки.
Дальнейшие предшественники получали аналогично вышеописанным процессам. В таблице Т1 обобщено, какие предшественники получены с помощью соответствующего способа. Для специалиста в данной области техники является понятным, какие исходные вещества использовали в каждом случае.
|
Используемые амины (Таблица Т2)
Следующие амины использовали для синтеза примеров:
|
Упомянутые амины либо являются коммерчески доступными от таких производителей, как АВСК, ACBBlocks, Acros, Aldrich, Array Biopharma, BASF, Fulcrum Scientific, Indofine, Interchim, Lancaster, Matrix, Maybridge, Rare Chemicals или Synchem либо были синтезированы, как в случае А75, А82, А84 и А92.
Синтез 1-(3,4-диметилфенил)этиламина (А75)
16,4 мл (150,0 ммоль) тетрапропил ортотитаната добавляли к раствору 4,46 г (30,0 ммоль) 3,4-диметилацетофенона в 2 М этанольном растворе аммиака (75 мл), и смесь перемешивали в течение 6 часов при КТ. Затем добавляли 1,7 г (45,0 ммоль) борогидрида натрия, и продолжали перемешивать дополнительно в течение 16 часов при КТ. После этого, реакционный раствор вливали в насыщенный водный раствор аммиака (75 мл). Образованный осадок отфильтровывали с отсасыванием, и затем промывали этилацетатом. Водный фильтрат концентрировали в вакууме, после этого два раза экстрагировали этилацетатом. Объединенные этилацетатные фазы три раза экстрагировали с помощью 2 М соляной кислоты. Объединенные водные фазы доводили до рН 11 с помощью 2 М водн. раствора NaOH и затем три раза экстрагировали этилацетатом. Объединенные органические фазы высушивали над MgSO4, фильтровали и концентрировали в вакууме. При СС (этилацетат/МеОН 9:1) получали 799 мг (5,4 ммоль, 18%) 1-(3,4-диметилфенил)этиламина.
1Н ЯМР (400 МГц, ДМСО-d6) d част. на млн. 1,20 (d, J=6,6 Гц, 3Н) 2,17 (s, 3H) 2,19 (s, 3H) 3,89 (q, J=6,6 Гц, 1Н) 6,99-7,07 (m, 2H) 7,08-7,15 (m, 1H)
Синтез 4-(трифторметилтио)фенил)метиламина (А82)
Согласно способу, описанному для предшественника А75, 5,0 г (24,2 ммоль) 4-(трифторметилтио)-бензальдегида превращали в 64 мг (0,31 ммоль, 1%) 4-(трифторметилтио)фенил)метиламина.
1Н ЯМР (400 МГц, ДМСО-d6) d част. на млн. 3,77 (s, 2Н) 7,50 (d, J=8,03 Гц, 2Н) 7,65 (d, J=8,03 Гц, 2Н)
Синтез 1-(3,5-диметилфенил)этиламина (А84)
Согласно способу, описанному для предшественника А75, 2,17 г (14,6 ммоль) 3,5-диметилацетофенона превращали в 1,08 г (7,2 ммоль, 50%) 1-(3,5-диметилфенил)этиламина.
1Н ЯМР (400 МГц, ДМСО-d6) d част. на млн. 1,20 (d, J=7,0 Гц, 3Н) 2,23 (s, 6H), 3,88 (q, J=7,0 Гц, 1Н) 6,77-6,83 (m, 1Н) 6,91-7,00 (m, 2Н)
Синтез 1-(4-(трифторметилтио)фенил)этанамина (А92)
Согласно способу, описанному для предшественника А75, 4,4 г (20,0 ммоль) 4'-(трифторметилтио)ацетофенона превращали в 1,78 г (8,0 ммоль, 40%) 1-(4-(трифторметилтио)фенил)этанамина.
1Н ЯМР (400 МГц, ДМСО-d6) d част. на млн. 1,24 (d, J=6,6 Гц, 3Н) 4,03 (q, J=6,6 Гц, 1Н) 7,54 (d, J=8,53 Гц, 2Н) 7,64 (d, J=8,03 Гц, 2Н)
Используемые кислоты
2-(2-(Фенилсульфонил)этилтио)никотиновая кислота S1 является коммерчески доступной от производителей Alfa Aesar и ABCR.
Синтез 2-(2-тозилэтилтио)никотиновой кислоты (кислота S2)
Раствор 7,3 г (47 ммоль) 2-меркаптоникотиновой кислоты и 9,6 г (48 ммоль) 2-(п-толуолсульфонил)-этанола растворяли в ДМФА (80 мл). Затем осторожно по каплям добавляли 0,5 мл конц. H2SO4, и продолжали перемешивать в течение ночи в колбе с обратным холодильником. Реакционную смесь концентрировали, используя Genevac (EZ2). Остаток растворяли в ацетонитриле и твердое вещество отделяли. Маточную жидкость концентрировали, и добавляли МеОН. Полученное твердое вещество отфильтровывали и высушивали, получали 2,35 г (7 ммоль, 14,8%) 2-(2-тозилэтилтио)никотиновой кислоты в виде твердого вещества.
1Н ЯМР (400 МГц, CDCl3) d част. на млн. 2,48 (s, 3Н) 3,31-3,44 (m, 2Н) 3,48-3,59 (m, 2Н) 7,09 (dd, J=7,78, 4,77 Гц, 1Н) 7,40 (d, J=8,03 Гц, 2Н) 7,85 (d, J=8,53 Гц, 2Н) 8,27 (dd, J=7,78, 1,76 Гц, 1Н) 8,40 (dd, J=4,52, 2,01 Гц, 1Н)
Синтез 2-(2-(3-(трифторметил)фенилсульфонил)этилтио)никотиновой кислоты (кислота S3)
683 мг (4,92 ммоль) K2CO3 добавляли к суспензии 349 мг (2,25 ммоль) 2-меркаптоникотиновой кислоты в ДМФА (5 мл), и смесь перемешивали в течение 30 минут при КТ. Затем добавляли 614 мг (2,25 ммоль) 2-хлорэтил-(3-(трифторметил)фенил)сульфона, и продолжали перемешивать дополнительно в течение 72 часов при КТ. Реакционный раствор концентрировали в вакууме, полученный остаток ресуспендировали в этилацетате, и добавляли воду. Значение рН доводили до 3 с помощью 2 М соляной кислоты, и фазы разделяли. Водную фазу экстрагировали этилацетатом. Объединенные органические фазы высушивали над MgSO4, фильтровали и концентрировали в вакууме. Получали 778 мг (1,99 ммоль, 88%) 2-(2-(3-(трифторметил)фенилсульфонил)этилтио)никотиновой кислоты в виде остатка.
1Н ЯМР (400 МГц, ДМСО-d6) d част. на млн. 3,20-3,29 (m, 2Н) 3,72-3,86 (m, 2H) 7,23 (dd, J=7,78, 4,77 Гц, 1Н) 7,96 (t, J=8,03 Гц, 1Н) 8,15-8,22 (m, 2H) 8,23-8,32 (m, 2H) 8,34 (dd, J=4,77, 1,76 Гц, 1H)
Синтез 5-метил-2-(2-(фенилсульфонил)этилтио)никотиновой кислоты (кислота S4)
а) Синтез 2-меркапто-5-метилникотиннитрила Каталитическое количество (16 мкл) 2-(диметиламино)-этанола добавляли к раствору 1,7 г (20 ммоль) 2-цианотиоацетамида и 2,3 г (20,0 ммоль) 3-этоксиметакролеина в EtOH (50 мл), и перемешивали в течение 24 часов в колбе с обратным холодильником. После этого смесь существенным образом концентрировали в вакууме. Полученный осадок отфильтровывали и промывали холодным этанолом. Таким образом получали 1,45 г (9,6 ммоль, 48%) 2-меркапто-5-метилникотиннитрила, который подвергали дальнейшей реакции без дополнительной очистки.
b) Синтез 5-метил-2-(2-(фенилсульфонил)этилтио)никотиннитрила 1,9 г (14,0 ммоль) K2CO3 и 1,9 г (9,3 ммоль) (2-хлорэтилсульфонил)бензола добавляли к раствору 1,40 г (9,3 ммоль) 2-меркапто-5-метилникотиннитрила в ацетоне (30 мл), и после этого перемешивали в течение 16 часов при 60°С. Затем смесь отфильтровывали и фильтрат концентрировали в вакууме. Остаток ресуспендировали в воде и экстрагировали с помощью ЕА (3×50 мл). Объединенные органические фазы промывали соляным раствором, высушивали над Na2SO4, фильтровали и концентрировали в вакууме. При СС (гексан/ЕА 4:1) остатка получали 1,41 г (4,4 ммоль, 47%) 5-метил-2-(2-фенилсульфонил)этилтио)никотиннитрила.
с) Синтез 5-метил-2-(2-(фенилсульфонил)этилтио)никотиновой кислоты Раствор 1,40 г (4,4 ммоль) 5-метил-2-(2-(фенилсульфонил)этилтио)никотиннитрила в 50% водн. серной кислоте (10 мл) нагревали в течение 4 дней в колбе с обратным холодильником. После этого смесь вливали в смесь воды со льдом и полученный осадок отфильтровывали. Затем промывали холодной водой. Получали в виде остатка 1,2 г (3,6 ммоль, 81%) 5-метил-2-(2-(фенилсульфонил)этилтио)никотиновую кислоту, которую подвергали дальнейшей реакции без дополнительной очистки.
Описание синтеза примеров
Примеры 1×52:
100 мколь соответствующего раствора кислоты (0,05 М в ДХМ, 2 мл) сначала помещали при комнатной температуре в реакционный сосуд (Heidolph), добавляли 105 мкмоль раствора CDI (0,105 М в ДХМ, 1 мл), и смесь встряхивали в течение 1 часа при комнатной температуре. Затем добавляли 100 мкмоль соответствующего амина (0,1 М в ДХМ, 1 мл) при комнатной температуре, и продолжали встряхивать дополнительно в течение 12 часов при КТ. После завершения реакции, добавляли 3 мл воды, встряхивали в течение 15 минут, и затем органическую фазу отделяли.
Растворитель удаляли, используя Genevac, и продукты очищали с помощью ВЭЖХ.
Следующие соединения синтезировали согласно этому методу (Таблица Т3):
|
Пример 54:
Синтез N-бензил-2-(2-(фенилсульфонил)этилтио)никотинамида
132 мг (0,81 ммоль) CDI добавляли к раствору 250 мг (0,77 ммоль) 2-(2-(фенилсульфонил)этилтио)никотиновой кислоты в ДХМ (6 мл), и смесь перемешивали в течение 1 часа при КТ. Затем добавляли раствор 82 мг (0,77 ммоль) бензиламина в ДХМ (6 мл), и продолжали перемешивать дополнительно в течение 16 часов при КТ. После этого реакционный раствор промывали три раза в каждом случае насыщенным водным раствором хлорида аммония и насыщенным водным раствором NaHCO3. Органическую фазу высушивали над MgSO4, фильтровали и концентрировали в вакууме. Получали 266 мг (0,64 ммоль, 83%) N-бензил-2-(2-(фенилсульфонил)этилтио)никотинамида в виде остатка.
1Н ЯМР (600 МГц, ДМСО-d6) d част. на млн. 3,16-3,26 (m, 2Н) 3,56-3,68 (m, 2H) 4,38-4,49 (m, 2H) 7,19 (dd, J=7,55, 5,29 Гц, 1Н) 7,22-7,28 (m, 1H) 7,29-7,37 (m, 4H) 7,70 (t, J=7,55 Гц, 2H) 7,79 (t, J=7,18 Гц, 1H) 7,88 (d, J=6,80 Гц, 1H) 7,95 (d, J=7,55 Гц, 2H) 8,31 (d, J=3,78 Гц, 1H) 9,02 (t, J=5,67 Гц, 1H)
Пример 55:
Синтез N-бензил-N-метил-2-(2-(фенилсульфонил)этилтио)никотинамида
132 мг (0,81 ммоль) CDI добавляли к раствору 250 мг (0,77 ммоль) 2-(2-(фенилсульфонил)этилтио)никотиновой кислоты в ДХМ (6 мл), и смесь перемешивали в течение 1 часа при КТ. Затем добавляли раствор 93 мг (0,77 ммоль) N-бензил-N-метиламина в ДХМ (6 мл), и продолжали перемешивать дополнительно в течение 16 часов при КТ. После этого реакционный раствор промывали три раза в каждом случае насыщенным водным раствором хлорида аммония и насыщенным водным раствором NaHCO3. Органическую фазу высушивали над MgSO4, фильтровали и концентрировали в вакууме. При СС с остатком (ДХМ→ДХМ/МеОН 99,5:0,5) получали 152 мг (0,36 ммоль, 46%) N-бензил-N-метил-2-(2-(фенилсульфонил)этилтио)никотинамида.
1Н ЯМР (600 МГц, ДМСО-d6) d част. на млн. 3,30 (s, 3H) 3,31-3,37 (m, 2H) 3,58-3,71 (m, 2H) 4,28 (s, 1H) 4,65 (s, 1H) 7,12-7,18 (m, 1H) 7,19-7,27 (m, 1H) 7,28-7,34 (m, 1H) 7,35-7,43 (m, 2H) 7,65 (d, J=6,80 Гц, 1H) 7,68-7,75 (m, 2H) 7,79 (t, J=6,42 Гц, 1H) 7,95 (d, J=7,55 Гц, 2H) 8,25-8,35 (m, 1H)
Пример 56:
Синтез N-(циклогексилметил)-2-(2-(фенилсульфонил)этилтио)никотинамида
264 мг (1,62 ммоль) CDI добавляли к раствору 500 мг (1,55 ммоль) 2-(2-(фенилсульфонил)этилтио)никотиновой кислоты в ДХМ (12 мл), и смесь перемешивали в течение 1 часа при КТ. Затем добавляли раствор 200 мкл (1,55 ммоль) циклогексанметиламина в ДХМ (12 мл), и продолжали перемешивать дополнительно в течение 16 часов при КТ. После этого реакционный раствор промывали три раза в каждом случае насыщенным водным раствором хлорида аммония и насыщенным водным раствором NaHCO3. Органическую фазу высушивали над MgSO4, фильтровали и концентрировали в вакууме. Получали 624 мг (1,49 ммоль, 96%) N-(циклогексилметил)-2-(2-(фенилсульфонил)этилтио)никотинамида в виде остатка.
МС: m/z 419,1 [М+Н]+
Пример 57:
Синтез 2-(2-(фенилсульфонил)этилтио)-N-(1-(3-(трифторметил)фенил)этил)никотинамида
264 мг (1,62 ммоль) CDI добавляли к раствору 500 мг (1,55 ммоль) 2-(2-(фенилсульфонил)этилтио)никотиновой кислоты в ДХМ (12 мл), и смесь перемешивали в течение 1 часа при КТ. Затем добавляли раствор 292 мг (1,55 ммоль) 1-(3-(трифторметил)фенил)этиламина в ДХМ (12 мл), и продолжали перемешивать дополнительно в течение 16 часов при КТ. После этого реакционный раствор промывали три раза в каждом случае насыщенным водным раствором хлорида аммония и насыщенным водным раствором NaCl. Органическую фазу высушивали над MgSO4, фильтровали и концентрировали в вакууме. При СС с остатком (этилацетат/гексан 1:1) получали 462 мг (0,93 ммоль, 60%) 2-(2-(фенилсульфонил)этилтио)-N-(1-(3-(трифторметил)фенил)этил)никотинамида. МС: m/z 495,1 [М+Н]+.
Пример 58:
Синтез N-(2-циклогексилэтил)-2-(2-(фенилсульфонил)этилтио)никотинамида
158 мг (0,93 ммоль) CDI добавляли к раствору 300 мг (0,93 ммоль) 2-(2-(фенилсульфонил)этилтио)никотиновой кислоты в ДХМ (8 мл), и смесь перемешивали в течение 1 часа при КТ. Затем добавляли раствор 151 мг (0,93 ммоль) гидрохлорида 2-циклогексилэтиламина и 157 мкл (0,93 ммоль) диизопропилэтиламина в ДХМ (8 мл), и продолжали перемешивать дополнительно в течение 16 часов при КТ. После этого реакционный раствор промывали три раза в каждом случае насыщенным водным раствором хлорида аммония и насыщенным водным раствором NaHCO3. Органическую фазу высушивали над MgSO4, фильтровали и концентрировали в вакууме. Получали 390 мг (0,90 ммоль, 97%) N-(2-циклогексилэтил)-2-(2-(фенилсульфонил)этилтио)никотинамида в виде остатка. МС: m/z 433,2 [M+H]+.
Пример 59:
Синтез 2-(2-(циклогексилтио)этилтио)-N-(тиофен-2-илметил)никотинамида
607 мг (4,4 ммоль) K2CO3 добавляли к раствору 500 мг (2,0 ммоль) 2-меркапто-N-(тиофен-2-илметил)никотинамида (V1) в ДМФА (5 мл), и смесь перемешивали в течение 1 часа при КТ. Затем добавляли 446 мг (2-бромэтил)(циклогексил)сульфана (неочищенный продукт V2), и продолжали перемешивать дополнительно в течение 18 часов при КТ. Затем смесь разводили этилацетатом, и добавляли воду. Фазы разделяли и водную фазу экстрагировали этилацетатом. Объединенные органические фазы высушивали над MgSO4, фильтровали и концентрировали в вакууме. При СС (этилацетат/н-гексан 1:1) с остатком получали 268 мг (0,68 ммоль, 34%) 2-(2-(циклогексилтио)этилтио)-N-(тиофен-2-илметил)никотинамида. МС: m/z 393,1 [М+Н]+.
Пример 100:
Синтез 2-[2-(4-фторфенил)сульфонилэтилтио]-N-(2-тиенилметил)никотинамида
303 мг (2,2 ммоль) K2CO3 добавляли к раствору 500 мг (2,0 ммоль) 2-меркапто-N-(тиофен-2-илметил)никотинамида в ДМФА (5 мл), и перемешивали в течение 30 минут при КТ. Затем добавляли 445 мг (2,0 ммоль) 1-(2-хлорэтилсульфонил)-4-фторбензола и продолжали перемешивать дополнительно в течение 2 дней при КТ. После этого смесь концентрировали в вакууме, остаток ресуспендировали в ЕА, и добавляли 1М водный раствор NaHCO3. Фазы разделяли и водную фазу экстрагировали с помощью ЕА. Объединенные органические фазы высушивали над MgSO4, фильтровали через силикагель и концентрировали в вакууме. При СС (ДХМ/ЕА 4:1) остатка получали 365 мг (0,84 ммоль, 48%) 2-[2-(4-фторфенил)сульфонилэтилтио]-N-(2-тиенилметил)-никотинамида. МС: m/z 437,0 [М+Н]+
Пример 106:
Синтез 2-[2-(3-фторфенил)сульфонилэтилтио]-N-(2-тиенилметил)никотинамида
Раствор 408 мг (2,0 ммоль) 2-(3-фторфенилсульфонил)этанола в ДХМ (5 мл) охлаждали до 0°С; к нему добавляли 304 мкл (2,2 ммоль) NEt3 и 154 мкл (2,0 ммоль) хлорида метансульфоновой кислоты, и перемешивали в течение 16 часов при КТ. В другой сосуд, 275 мг (2,0 ммоль) K2CO3 добавляли к раствору 500 мг (2,0 ммоль) 2-меркапто-N-(тиофен-2-илметил)никотинамида в ДМФА (6 мл), и перемешивали в течение 30 минут при КТ. К этому раствору ДХМ реакционный раствор, и продолжали перемешивать в течение 72 часов при КТ. Затем смесь разводили с помощью ЕА и промывали 1 н. водн. раствором NaHCO3. Органическую фазу высушивали над MgSO4, фильтровали и концентрировали в вакууме. При СС (ДХМ/ЕА 4:1) остатка получали 194 мг (0,44 ммоль, 22%) 2-[2-(3-фторфенил)сульфонилэтилтио]-N-(2-тиенилметил)-никотинамида. МС: m/z 437,0 [М+Н]+
Пример 112:
Синтез N-(2-тиенилметил)-2-[2-[[2-(трифторметил)фенил]тио]этилтио]-никотикамида
227 мг (1,65 ммоль) K2CO3 добавляли к раствору 375 мг (1,5 ммоль) 2-меркапто-N-(тиофен-2-илметил)никотинамида в ДМФА (6 мл), и перемешивали в течение 60 минут при КТ. Затем добавляли 361 мг (1,5 ммоль) (2-хлорэтил)(3-(трифторметил)фенил)сульфана и продолжали перемешивать дополнительно в течение 16 часов при КТ. Затем смесь разводили с помощью ЕА и экстрагировали водой. Органическую фазу высушивали над MgSO4, фильтровали и концентрировали в вакууме. При осуществлении СС (гексан/ЕА 1:1) остатка, с последующей дополнительной СС (ДХМ/ЕА 19:1) полученного остатка, получали 274 мг (0,60 ммоль, 40%) N-(2-тиенилметил)-2-[2-[[2-(трифторметил)фенил]тио]этилтио]-никотинамида. МС: m/z 455,0 [M+H]+
Пример 141:
Синтез 2-[2-(бензолсульфонил)этилтио]-6-метил-N-(2-тиенилметил)никотинамида
336 мг (3,0 ммоль) трет-бутилата калия добавляли при 0°С к раствору 607 мг (3,0 ммоль) 2-(фенилсульфонил)этантиола в ДМФА (10 мл). После перемешивания в течение 10 минут при 0°С, добавляли 534 мг (2,0 ммоль) 2-хлор-6-метил-N-(тиофен-2-илметил)никотинамида и затем смесь нагревали в течение 16 часов при 50°С. После этого разводили с помощью ЕА и промывали соляным раствором. Органическую фазу высушивали над Na2SO4, фильтровали и концентрировали в вакууме. При СС (гексан/ЕА 7:3) остатка получали 556 мг (1,28 ммоль, 64%) 2-[2-(бензолсульфонил)этилтио]-6-метил-N-(2-тиенилметил)-никотинамида. МС: m/z 433,1 [М+Н]+
Пример 143:
Синтез 2-[2-(бензолсульфонил)этилтио]-6-фтор-N-(2-тиенилметил)никотинамида
258 мг (2,3 ммоль) трет-бутилата калия добавляли при 0°С к раствору 465 мг (2,3 ммоль) 2-(фенилсульфонил)этантиола в ДМФА (7 мл). После перемешивания в течение 10 минут при 0°С, добавляли 381 мг (1,5 ммоль) 2,6-дифтор-N-(тиофен-2-илметил)никотинамида и затем смесь нагревали в течение 16 часов при 50°С. После этого разводили с помощью ЕА и промывали соляным раствором. Органическую фазу высушивали над Na2SO4, фильтровали и концентрировали в вакууме. При СС (гексан/ЕА 7:3) остатка получали 298 мг (0,68 ммоль, 45%) 2-[2-(бензолсульфонил)этилтио]-6-фтор-N-(2-тиенилметил)-никотинамида. МС: m/z 437,0 [М+Н]+
Пример 149:
Синтез 2-[2-(бензолсульфонил)этилтио]-5-метил-N-(2-тиенилметил)никотинамида
456 мг (1,2 ммоль) HATU и 680 мкл (4,0 ммоль) DIPEA добавляли при 0°С к раствору 337 мг (1,0 ммоль) 5-метил-2-(2-(фенилсульфонил)этилтио)никотиновой кислоты в ДМФА (3 мл). После перемешивания дополнительно в течение 15 минут при 0°С, добавляли 113 мг (1,0 ммоль) тиофен-2-илметиламина и перемешивали в течение 16 часов при КТ. Затем смесь разводили с помощью ЕА и промывали с отсасыванием с насыщенным водным раствором лимонной кислоты, насыщенным водным раствором Na2CO3 и соляным раствором. Органическую фазу высушивали над Na2SO4, фильтровали и концентрировали в вакууме. При СС (гексан/ЕА 7:3) остатка получали 418 мг (0,97 ммоль, 97%) 2-[2-(бензолсульфонил)этилтио]-5-метил-N-(2-тиенилметил)-никотинамида. МС: m/z 433,1 [М+Н]+
Примеры 60-88 и 94-150:
Синтез примеров 60-88 и 94-150 осуществляли аналогично способам, описанным в примерах 56-59, 100, 106, 112, 141, 143 и 149. Примеры, которые получали с помощью этого процесса, обобщены в Таблицах Т4 и Т5.
|
Дальнейшие тестируемые соединения:
|
Пример 93:
Синтез N-(изобутил)-2-(2-(фенилсульфонил)этилтио)никотинамид
171 мг (1,05 ммоль) CDI добавляли к раствору 323 мг (1,00 ммоль) 2-(2-(фенилсульфонил)этилтио)никотиновой кислоты в ДХМ (16 мл), и смесь перемешивали в течение 1 часа при КТ. Затем добавляли 99 мкл (1,00 ммоль) изобутиламина, и продолжали перемешивать дополнительно в течение 5 дней при КТ. После этого реакционный раствор промывали в каждом случае два раза с помощью 4 М водного раствора хлорида аммония и 1 М водного раствора гидрокарбоната натрия. Органическую фазу высушивали над MgSO4, фильтровали и концентрировали в вакууме. Полученный остаток ресуспендировали в этилацетате (30 мл) и промывали 0,4 М соляной кислотой (5 мл). Органическую фазу снова высушивали над MgSO4, фильтровали и концентрировали в вакууме. Получали 160 мг (0,42 ммоль, 42 N-(изобутил)-2-(2-(фенилсульфонил)этилтио)никотинамида в виде остатка. МС: m/z 379,1 [M+H]+
|
Биологические данные
Флуоресцентный анализ, используя потенциалочувствительный краситель
Клетки СНО-К1 человека, экспрессирующие KCNQ2/3 каналы, культивировали до слияния при 37°С, 5% CO2 и 95% влажности во флаконах для культивирования клеток (например, сосуды 80 см2 ТС, Nunc) с DMEM высоким содержанием глюкозы (Sigma Aldrich, D7777), включая 10% FCS (PAN Biotech, например, 3302-Р270521) или альтернативно со средой MEM Alpha (1×, жидкость, Invitrogen, #22571), 10% фетальной телячьей сывороткой (FCS) (Invitrogen, #10270-106, инактивированная нагреванием) и необходимыми антибиотиками для селекции.
Перед высеванием для измерений, клетки промывали с помощью 1 × DPBS буфера без Са2+/Mg2+ (например, Invitrogen, #14190-094) и отсоединяли от дна сосуда для культивирования с помощью аккутазы (РАА Laboratories, #L11-007) (инкубация с аккутазой в течение 15 минут при 37°С). После этого подсчитывали количество присутствующих клеток, с помощью CASY™ устройства для подсчета клеток (ТСС модель, Schärfe System) для последующего применения, в соответствии с оптимизации плотности для отдельной клеточной линии, 20 тыс. - 30 тыс. клеток/лунку/100 мкл описанной питательной среды в планшеты для измерения на 96 лунок Corning™ CellBIND™ типа (черные полистирольные микропланшеты с плоским прозрачным дном, #3340). После этого инкубировали в течение одного часа при комнатной температуре, без газирования или подгонки влажности, с последующим инкубированием в течение 24 часов при 37°С, 5% CO2 и 95% влажности.
Потенциалочувствительный флуоресцентный краситель от Membrane Potential Assay Kit (Red™ Bulk format part R8123 для FLIPR, MDS Analytical Technologies™) готовили путем растворения содержимого сосуда Membrane Potential Assay Kit Red Component А в 200 мл внеклеточного буфера (ES буфер, 120 мМ NaCl, 1 мМ KCl, 10 мМ HEPES, 2 мМ CaCl2, 2 мМ MgCl2 10 мМ глюкоза; рН 7,4). После удаления питательной среды, клетки промывали с помощью 200 мкл ES буфера, затем покрывали слоем 100 мкл раствора красителя, приготовленного выше, и инкубировали в течение 45 минут при комнатной температуре при отсутствии света.
Измерения флуоресценции осуществляли с помощью приборов BMG Labtech FLUOstar™ или BMG Labtech NOVOstar™ или BMG Labtech POLARstar™ (возбуждение 525 нм, эмиссия 560 нм, режим анализа дна). После инкубирования с красителем, в отдельные углубления планшета для измерения вносили 50 мкл тестируемых веществ в желательных концентрациях, или 50 мкл ES буфера для контроля и инкубировали в течение 30 минут при комнатной температуре, при этом экранировали от воздействия света. После этого измеряли интенсивность флуоресценции красителя в течение 5 минут и таким образом определяли значение флуоресценции F1 каждой лунки при данном, постоянном времени. После этого в каждую лунку добавляли 15 мкл 100 мМ раствора KCl (конечная концентрация 92 мМ). После этого определяли изменение флуоресценции до тех пор, пока не получали всех релевантных измеренных величин (преимущественно 5-30 минут). В определенный момент времени после введения KCl, определяли значение флуоресценции F2, в данном случае во время пика флуоресценции.
Для расчета, интенсивность флуоресценции F2 сравнивали с интенсивностью флуоресценции F1, и на основе этих данных определяли агонистическую активность целевого соединения на калиевый канал. F2 и F1 рассчитывали следующим образом:
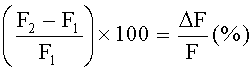
Для определения наличия у вещества агонистической активности, 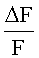 например, можно сравнивать с
например, можно сравнивать с 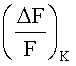 контрольных клеток.
контрольных клеток. 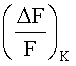 определяли путем добавления в реакционную партию только буферного раствора вместо тестируемого вещества, определения значения F1K интенсивности флуоресценции, добавления ионов калия, как описано выше, и изменения значения F2K интенсивности флуоресценции. Затем рассчитывали F2K и F1K следующим образом:
определяли путем добавления в реакционную партию только буферного раствора вместо тестируемого вещества, определения значения F1K интенсивности флуоресценции, добавления ионов калия, как описано выше, и изменения значения F2K интенсивности флуоресценции. Затем рассчитывали F2K и F1K следующим образом:
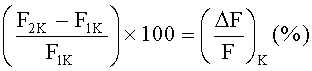
Вещество обладает агонистической активностью на калиевый канал, если 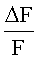 больше, чем
больше, чем 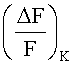 :
:
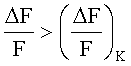
Независимо от сравнения 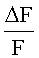 с
с 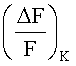 , также можно сделать вывод, что целевое соединение обладает агонистической активностью, если наблюдается повышение
, также можно сделать вывод, что целевое соединение обладает агонистической активностью, если наблюдается повышение 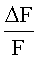 при повышении дозы целевого соединения.
при повышении дозы целевого соединения.
Расчет значений ЕС50 и IC50 осуществляли с помощью программного обеспечения "Prism v4.0" (GraphPad Software™).
В качестве примера, были определены следующие значения:
|
Измерения фиксации напряжения
Для подтверждения KCMQ2/3-агонистического действия веществ электрофизиологически, осуществляли измерения фиксации напряжения (Hamill и др., 1981) в режиме фиксации напряжения на стабильно трансфектированной hKCNQ2/3 CHO-K1 клеточной линии. После образования гига-перемычки, сначала клетки фиксировали при исходном потенциале -60 мВ.
После этого, применяли деполяризирующие скачки напряжения вплоть до потенциала +20 мВ (шаг: 20 мВ, продолжительность: 1 секунда) для подтверждения функциональной экспрессии KCMQ2/3-типичных токов. Тестирование веществ осуществляли при потенциале -40 мВ. Повышение тока, индуцированное ретигабином (10 мкМ) при -40 мВ сначала записывали в качестве положительного контроля для каждой клетки. После завершения вымывания действия ретигабина (продолжительность: 80 с), добавляли тестируемое вещество (10 мкМ). Повышение тока, индуцированное тестируемым веществом, стандартизировали относительно влияния ретигабина и указывали в виде относительной эффективности (см. ниже).
Hamill OP, Marty A, Neher Е, Sakmann В, Sigworth FJ.: Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches. Pflugers Arch. 1981 Aug; 391(2):85-100.
Измерения фиксации напряжения осуществляли только для выбранных соединений:
|
Формалиновый тест на крысах
Исследования для определения антиноцицептивной активности соединений осуществляли в формалиновом тесте на самцах крыс (Sprague-Dawley, 150-170 г).
В формалиновом тесте, различия проводили между первой (ранней) фазой (0-15 мин. после инъекции формалина) и второй (поздней) фазой (15-60 мин. после инъекции формалина) (D. Dubuisson, S.G. Dennis, Pain 4, 161-174 (1977)). Ранняя фаза, в качестве прямой реакции на инъекцию формалина, представляет собой модель острой боли, тогда как поздняя фаза рассматривается как модель постоянной (хронической) боли (T.J.Coderre, J.Katz, A.L.Vaccarino, R.Melzack, Pain, том 52, с.259, 1993).
Соединения в соответствии с изобретением исследовали во второй фазе формалинового теста для получения информации относительно активности веществ в случае хронической/воспалительной боли.
Ноцицептивную реакцию индуцировали у свободно подвижных подопытных животных путем единичной подкожной инъекции формалина (50 мкл, концентрация 5%) в тыльную поверхность правой задней лапы, обнаружение реакции осуществляли согласно следующим поведенческим параметрам: поднимание и удерживание пораженной лапы (оценка 1), дрожание или подергивание (оценка 2), облизывание и кусание (оценка 3). Различие поведения, индуцированные инъекцией формалина, определяли непрерывно путем наблюдения за животными на поздней фазе формалинового теста и оценивали различия распределения веса. Нормальное поведение, при котором животное распределяли свой вес равномерно на все четыре лапы, записывали как бал 0. Время введения перед инъекцией формалина выбирали в зависимости от выбранного способа введения соединений в соответствии с изобретением (внутрибрюшинное: 15 мин., внутривенное: 5 мин.). После инъекции веществ, которые обладают антиноцицептивной активностью в формалиновом тесте, описанные поведения (оценки 1-3) животных уменьшались или затем устранялись. Сравнивали с контрольными животными, которые получали наполнитель (растворитель) перед введением формалина. Ноцицептивное поведение рассчитывали в виде так называемой степени боли (PR). Для различных поведенческих параметров задавали различные весовые коэффициенты (множитель 0, 1, 2, 3). Расчеты проводили в 3-х минутными интервалами согласно следующей формуле:
PR=[(Т0×0)+(T1×1)+(T2×2)+(Т3×3)]/180,
где T0, T1, Т2 и Т3 каждый соответствует времени в секундах, в течение которого животное проявляет поведение 0, 1, 2 или 3. Группы, получавшие вещество и наполнитель, каждые содержали n=10 животных. Согласно расчетам PR, определяли активность вещества в виде изменения по сравнению с контролем в процентах.
|
Дополнительно, пример 89 исследовали в тесте Chung на крысах. В случае в.в. ведения, определяли ED50 6,3 мг/кг (Kim, S.H. и Chung, J.M., An experimental model for peripheral neuropathy produced by segmental spinal nerve ligation in the rat, Pain, 50 (1992) 355-363).
Сокращения
|