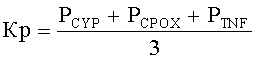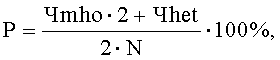Результат интеллектуальной деятельности: СПОСОБ ПРОГНОЗИРОВАНИЯ ПОПУЛЯЦИОННЫХ НАРУШЕНИЙ БИОТРАНСФОРМАЦИИ ЧУЖЕРОДНЫХ ВЕЩЕСТВ, ОБУСЛОВЛЕННЫХ ВОЗДЕЙСТВИЕМ ТЕХНОГЕННЫХ ХИМИЧЕСКИХ ФАКТОРОВ СРЕДЫ ОБИТАНИЯ
Вид РИД
Изобретение
Изобретение относится к области медицины, а именно к области молекулярной биологии и генетики, и может быть использовано для профилактического обеспечения путей защиты и стабилизации генома этнической популяции в условиях возрастающего загрязнения окружающей среды.
Здоровье человека постоянно подвергается негативному воздействию химических мутагенов. В связи с этим, актуальной проблемой является разработка методов выявления (прогнозирования) адаптивности отдельной популяции к действию химических мутагенов (ксенобиотиков), связанной с полиморфизмом генов.
Вследствие генетической гетерогенности популяции человека в ней присутствуют индивиды, генетические особенности которых обуславливают повышенную чувствительность к действию мутагенов.
Изучение генов ферментов метаболизма ксенобиотиков на молекулярном уровне позволяет прогнозировать вероятность возникновения патологических эффектов, связанных с особенностями токсического действия анализируемого техногенного химического фактора среды обитания.
Биотрансформация (детоксикация) всех чужеродных веществ, в том числе вредных химических веществ, попадающих в организм через среду обитания, обеспечивается сложной метаболической системой, представленной многочисленными ферментами. Гены, контролирующие синтез соответствующих ферментов, объединены под общим названием «гены метаболизма».
Для поиска и идентификации ДНК-полиморфизма в настоящее время разработаны и широко применяются различные методы, число которых приближается к ста.
В зависимости от целей исследования все молекулярно-генетические методы можно подразделить на две группы: методы, направленные на поиск неизвестных мутаций (первичная идентификация), и анализ известных мутаций.
Методы, применяемые для первичной идентификации мутаций, то есть позволяющие скринировать на наличие ДНК-поломок достаточно протяженные фрагменты генов включают: метод анализа конформационного полиморфизма однонитевой дезоксирибонуклеиновой кислоты (ДНК); денатурирующий градиентный гель-электрофорез; метод гетеродуплексного анализа; метод химического расщепления некомплементарных сайтов; метод тестирования «неполноценного» белка; метод масс-спектрометрии и метод биочипов.
Выявление мутаций этими известными методами должно обязательно подтверждаться результатами прямого секвенирования изучаемого ДНК-фрагмента гена. Таким образом, большинство перечисленных известных методов (за исключением масс-спектрометрии и биочипов) позволяет выявить только подозрительные на наличие точковых и других мутаций участки ДНК, и только метод секвенирования дает полную информацию о типе и характере нуклеотидных изменений. Зачастую первичный поиск нарушений в кодирующих областях гена проводят именно таким образом.
Одним из самых часто используемых молекулярных методов, позволяющих идентифицировать многие уже известные мутации, является полимеразная цепная реакция (ПЦР) (Патенты РФ №№2343480, 2324937, 2431149 и т.д.). Кроме того, этот метод лежит в основе других методов изучения генома. При этом чаще всего используют так называемое резонансное тушение флюоресценции в TaqMan системе, позволяющее контролировать кинетику ПЦР амплификации непосредственно в ходе реакции. Для детекции мутаций используют зонды, несущие на 5'- и 3'-концах соответственно различные флюорофоры (светители) и их «тушители», которые, находясь рядом, подавляют флюоресценцию. При этом зонды должны быть комплементарны последовательности амплифицируемой ДНК и отличаться лишь одним нуклеотидом, характерным для одного и другого аллеля. Зонд, содержащий на 3'-конце краситель FAM, полностью комплементарен аллелю 1 и при гибридизации дает устойчивый дуплекс. При гибридизации этого зонда с аллелем 2 будет происходить неполное спаривание нуклеотидов и возникает так называемый «мисматч». Соответственно зонд, имеющий метку VIC, полностью комплементарен аллелю 2, но при гибридизации с аллелем 1 не дает устойчивого дуплекса.
Непосредственно перед реакцией в ПЦР-смесь добавляют зонды, которые гибридизуются с комплементарными им последовательностями ДНК. В случае гетерозиготы по исследуемым аллелям гибридизуются оба зонда.
Достраивая комплементарную последовательность ДНК, TaqF-полимераза за счет своей экзонуклеазной активности разрушает только устойчивые дуплексы. При этом происходит отщепление соответствующего флюорофора, который переходит в раствор и, не находясь под влиянием «тушителя», дает свой флюоресцентный сигнал. В зависимости от сигнала свечения можно судить каким аллелем (аллелями) представлен данный образец ДНК. Интенсивность сигнала флюоресценции зависит от числа циклов ПЦР. Размер амплифицируемого фрагмента ДНК обычно не превышает 150 нуклеотидов, что серьезно ограничивает применение этого метода. Вместе с тем прохождение реакции ПЦР можно контролировать в реальном времени, что является его главным преимуществом. Для того, чтобы диагностировать наличие мутации, иногда достаточно провести менее 25 циклов амплификации.
Из уровня техники известен способ прогнозирования бесплодия у женщин - работниц нефтехимических производств (Патент РФ №2386133), который направлен на определение риска развития нарушений репродуктивной функции у работниц нефтехимического производства, подвергшихся комбинированному комплексному воздействию химических веществ. При этом, согласно способу, выделяют ДНК из лимфоцитов периферической венозной крови, проводят генотипирование полиморфизма A2455G и Т3801С гена CYP1A1 и -163С/А и -2467delT гена CYP1A2. При обнаружении гаплотипа CYP1A1*2A, генотипа *1А*1А полиморфных локусов -163С/А и -2467delT гена CYP1A2, гаплотипа CYP1A2*ID прогнозируют развитие бесплодия. При определении гаплотипа CYP1A2*1L прогнозируют устойчивость к формированию бесплодия у работниц.
Использование известного изобретения позволяет получить прогностические критерии развития бесплодия или устойчивости к нему на основе молекулярно-генетических маркеров у женщин-работниц нефтехимических производств.
Однако указанный известный способ является узконаправленным и позволяет устанавливать лишь генетический полиморфизм системы цитохрома р450. Этим способом невозможно идентифицировать полиморфизм генов ферментов 2-й фазы детоксикации, отвечающей за ферментные системы обеспечивающих конъюгацию гаптенов, а также полиморфизм генов, характеризующих иммунный ответ.
Также известен способ прогнозирования риска развития профессиональной бронхолегочной патологии (Заявка на патент РФ №2010134590), включающий забор венозной крови, выделение генетического материала, проведение полимеразной цепной реакции со специфическими праймерами, определение нуклеотидной последовательности и на основании этого определение полиморфных вариантов гена матриксной металлопротеиназы 1 - полиморфизм 1607delG, причем при проведении полимеразной цепной реакции используют специфические праймеры MP1-F 138F BIOTIN - GCG ТСА AGA CTG АТА ТСТ ТАС ТСА ТАА АСА АТА и MP1-R 138R АСА TgT TAT gCC ACT TAg ATg Agg AAA, а после проведения полимеразной цепной реакции проводят реакцию пиросеквенирования в режиме реального времени с использованием специфического праймера MP1-S 138S gTA gTT AAA ТАА ТТА gAA Ag и детекцию нуклеотидной последовательности с помощью хемилюминисцентного сигнала, далее производят сравнение полученной нуклеотидной последовательности с референсными последовательностями и по полученной пирограмме определяют какой вариант полиморфизма 1607delG имеет место в нуклеотидной последовательности, причем при выявлении отсутствия инсерций/делеций гуанина прогнозируют риск развития профессиональной бронхолегочной патологии менее 20% при воздействии на организм вредных производственных факторов, при выявлении гиперсекреторного гетерозиготного варианта 1G мутации в нуклеотидной последовательности прогнозируют риск развития профессиональной бронхолегочной патологии (30÷50)% при воздействии на организм вредных производственных факторов, а при выявлении гиперсекреторного гомозиготного варианта 2G мутации в нуклеотидной последовательности прогнозируют риск развития профессиональной бронхолегочной патологии (60÷80)% при воздействии на организм вредных производственных факторов.
Однако указанный известный способ позволяет устанавливать лишь генетический полиморфизм генов 2-й фазы детоксикации. Этим способом невозможно идентифицировать полиморфизм генов 1-й фазы метаболизма, кодирующих ферментные системы процессов окисления гаптенов (прежде всего гидроксилирования), а также полиморфизм генов иммунного ответа.
Задачей создания заявляемого изобретения является разработка объективного способа прогнозирования популяционных нарушений биотрансформации чужеродных веществ, обусловленных воздействием вредных химических факторов среды обитания, с обеспечением доступности подобных исследований за счет использования традиционного оборудования.
Технический результат, достигаемый предлагаемым изобретением, заключается в получении критериев оценки течения популяционных нарушений при воздействии вредных химических факторов среды обитания, позволяющих прогнозировать биотрансформацию под воздействием указанных факторов, с обеспечением точности и достоверности результатов.
Указанный технический результат достигается предлагаемым способом прогнозирования популяционных нарушений биотрансформации чужеродных веществ, обусловленных воздействием техногенных химических факторов среды обитания, согласно которому производят отбор группы одной этнической популяции, проживающей на территории воздействия вредных химических факторов, у исследуемого контингента отбирают пробы биологического материала, а именно буккального эпителия, осуществляют выделение из указанной пробы дезоксирибонуклеиновой кислоты ДНК, далее на детектирующем амплификаторе с использованием полимеразной цепной реакции ПЦР проводят генотипирование полиморфизма - 9893A/G гена CYP1A1, 921А/С гена СРОХ и G308A гена TNF-альфа путем исследования аллельного состояния каждого из выбранных генов, устанавливают одно из следующих состояний гена: гетерозиготное, или нормальное гомозиготное, или минорное гомозиготное, рассчитывают распространенность минорного аллеля для каждого гена по формуле:
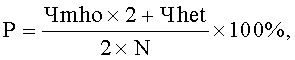 где
где
Р - распространенность минорного аллеля в исследуемой группе (%);
Чmho - число лиц с минорным гомозиготным генотипом;
Чhet - число лиц с гетерозиготным генотипом;
N - общее число лиц исследуемой группы одной этнической популяции; рассчитывают коэффициент распространенности минорных аллелей для изучаемых генов по формуле:
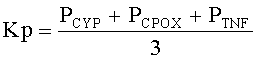 , где
, где
Kp - коэффициент распространенности минорных аллелей в исследуемой группе (%);
P - распространенности минорных аллелей соответствующих генов в исследуемой группе (%);
и при превышении указанного коэффициента распространенности минорных аллелей более 10%, при одновременном превышении более, чем на 30% количества лиц в исследуемой группе, в крови которых присутствует в концентрации более, чем референтной, по меньшей мере, одно из приоритетных для среды обитания указанной территории, вредное химическое вещество, прогнозируют популяционные нарушения, связанные с биотрансформацией чужеродных веществ, обусловленных воздействием техногенных химических факторов среды обитания.
Указанный технический результат обеспечивается за счет следующего.
Для понимания существа вопроса ниже приведено пояснение действия вредных химических веществ среды обитания с учетом нуклеотидных изменений.
Большинство ксенобиотиков, попадая в организм, не оказывают прямого биологического эффекта, а вначале подвергаются различным превращениям, так называемой биотрансформации, которая завершается их выведением из организма. Как правило, она представляет собой многоступенчатый, «каскадный» процесс, в котором одновременно или поочередно участвуют многие ферменты системы детоксикации. В наиболее типичном варианте биотрансформация ксенобиотиков представлена двухэтапным процессом, включающим в себя активацию (1 фаза), детоксикацию (2 фаза), а также процессами, ассоциированными с состоянием иммунной системы.
В заявляемом способе в качестве генов, характеризующих популяционные нарушения биотрансформации чужеродных веществ, предлагается использовать ген CYP1A1, ген СРОХ и ген TNF-альфа, а в качестве их полиморфизмов участки: 9893A/G гена CYP1A1, 921А/С гена СРОХ и G308A гена TNF-альфа. Исследования показали, что только при использовании указанных полиморфизмов обеспечивается достоверное и точное прогнозирование популяционных нарушений в условиях воздействия на популяцию техногенных химических факторов (ТХФ) среды обитания (под ТХФ понимаются факторы техногенного характера, формирующие химическое загрязнение окружающей среды вредными химическими веществами и оказывающие негативное влияние на здоровье). Ниже приведены сведения об участии указанных генов в процессах метаболизма техногенных химических соединений
В результате действия ферментов 1-й фазы происходит активация ксенобиотиков с образованием промежуточных электрофильных метаболитов (свободные радикалы, перекиси, активные кислород и азот). Фаза активации обеспечивается, главным образом, суперсемейством цитохрома Р-450 (CYP), а также многочисленным семейством нецитохромных окислителей (гидролазы, эстеразы, амидазы, дегидрогеназы и др.). Их основные функции заключаются в присоединении к молекуле ксенобиотика гидрофильных групп, благодаря чему происходит детоксикация десятков тысяч веществ.
Суперсемейство цитохромов Р-450 (CYP-450) отвечает за микросомальное окисление и представляет собой группу ферментов, имеющих множество изоформ (более 1000), которые не только осуществляют метаболизм лекарств, но и участвуют в синтезе стероидных гормонов, холестерина и других веществ. Изоферменты цитохромов на основании гомологии нуклеотидной и аминокислотной последовательностей подразделяют на семейства, которые, в свою очередь, делят на подсемейства. Каждый изофермент цитохрома Р-450 кодируется своим геном, которые локализуются на разных хромосомах.
Семейство Р-450 CYP1 метаболизирует сравнительно небольшую часть техногенных химических факторов, самые важные из которых представлены полициклическими ароматическими углеводородами (ПАУ). Особенно важная роль в этом принадлежит генам CYP1A1 и CYP1A2, локализованным на хромосоме 15.
CYP1A1 кодирует фермент арилуглеводородкарбоксилазу, который участвует в метаболизме эстрогенов, некоторых лекарственных средств и ПАУ - основных компонентов табачного дыма и продуктов сжигания органического топлива. Этот фермент контролирует начальный метаболизм ПАУ и ряда других органических соединений, приводящий к образованию канцерогенов (например, бенз(а)пирена). Участвует в биоактивации нитрозаминов.
2-я фаза (детоксикация) отвечает за перенос на активированные продукты 1-й фазы ацетильных, метальных, сульфгидрильных групп либо глутатиона, в результате чего образуются гидрофильные конъюгаты.
Ферменты 2-й фазы детоксикации обеспечивают эффективный перевод промежуточных электрофильных метаболитов в водорастворимые, нетоксические соединения, которые выводятся из организма. В процессе 2-й фазы происходит глюкуронирование (УДФ-глюкуронилтрансферазы), ацетилирование (N-ацетилтрансферазы), S-метилирование (тиопуринметилтрансфераза), сульфатирование (сульфотрансферазы), водная конъюгация (эпоксидгидролазы), конъюгация с глютатионом (глютатионтрансферазы), декарбоксилирование копропорфириногеноксидазой.
Ген СРОХ кодирует синтез фермента копропорфириногеноксидазы, который катализирует окислительное декарбоксилирование металлопорфиринов. Металлопорфирины являются макроциклическими комплексами металлов (Mn, Со, Fe, Hg) и гетероциклических органических соединений (пиррол) и отличаются от бесчисленного множества других групп макроциклических комплексов тем, что являются ароматическими макроциклами с уникальной сопряженной σ-системой. В этом сопряженном состоянии металлы проявляют свою биологическую активность. При нарушении синтеза металлопорфиринов, обусловленных дефектом гена, происходит накопление неактивных форм металлоорганических соединений в печени, селезенке, коже и вызывает развитие симптомов интоксикации - гипербилирубинемию, гемолитическую анемию, повышение чувствительности к солнечному свету, неврологические нарушения, злокачественные опухоли.
Исключительная роль в элиминации техногенных химических факторов принадлежит иммунной системе. Отсюда важность имеющих место в иммунной системе полиморфизмов.
Продукт гена TNF-альфа - фактор некроза опухоли альфа относится к цитокиновой системе и представляет собой клеточный медиатор макрофагов и лимфоцитов, играет важную роль в регуляции процессов дифференцировки, роста и метаболизма клеток, является медиатором воспалительных процессов, инициирует образование свободных радикалов и может способствовать развитию оксидативного стресса.
Роль TNF-альфа в развитии оксидативного стресса заключается в активации индуцибельной NO-синтетазы (NOS) - энзима, ответственного за синтез оксида азота, играющего важную роль в образовании и трансформации свободных радикалов.
Известно, по крайней мере, 8 полиморфных вариантов гена TNF-альфа. Полиморфизм промоторной области гена TNF-альфа G-308A ассоциирован с повышением продукции TNF-альфа и, таким образом, способствует повышению содержания NOS, что сопровождается увеличением концентрации свободных радикалов, которые имеют цитотоксические свойства и играют важную роль в иммуновоспалительных процессах и в развитии оксидативного стресса. Накопление свободных радикалов, в свою очередь, вызывает дегрануляцию тучных клеток. При этом высвобождается широкий спектр биологически активных веществ, обуславливающих гиперчувствительность и гиперреактивность.
Таким образом, выбор в качестве информационного критерия полиморфизмов - 9893A/G гена CYP1A1, 921А/С гена СРОХ и G308A гена TNF-альфа обеспечивает адекватный прогноз популяционных нарушений биотрансформации чужеродных веществ, обусловленных воздействием техногенных химических факторов, а их идентификация является комплексным критерием ключевых дефектов метаболизма техногенных соединений, ассоциированных с несостоятельностью иммунной системы,
Использование других полиморфизмов указанных генов не позволит точно оценить вероятность популяционных нарушений, потому что другие локусы исследуемых генов имеют цитируемый полиморфизм принципиально отличный от 10%-го. В этом случае наблюдаемый полиморфизм будет либо типичным вариантом нормы, либо не совместимым с функцией гена вариантом мутации.
Благодаря использованию в предлагаемом способе в качестве исследуемого материала пробы биологического материала - буккального эпителия, обеспечивается простота и надежность исследований, а также получение нужной информативности.
Использование для определения заявленных полиморфизмов генов полимеразной цепной реакции (далее ПЦР), осуществляемой с помощью детектирующего амплификатора, обеспечивает точность и специфичность диагностики, поскольку предполагает четкую идентификацию последовательности нуклеотидов ДНК и их комбинаций.
Благодаря в последующем установлению одного из следующих состояний гена: гетерозиготное, или нормальное гомозиготное, или минорное гомозиготное, обеспечивается идентификация степени функциональности гена, соответствия его здоровому (дикому) аллельному варианту.
Расчет распространенности минорного аллеля для каждого гена по заявленной формуле позволяет установить приоритетность вклада каждого из них в формирование популяционных нарушений биотрансформации чужеродных веществ.
А последующий расчет коэффициента распространенности минорных аллелей в исследуемой группе позволяет количественно охарактеризовать величину негативных полиморфизмов
Использование показателя превышения расчетного коэффициента распространенности минорных аллелей более, чем 10%, позволяет прогнозировать популяционные нарушения, связанные с биотрансформацией чужеродных веществ, обусловленных воздействием вредных химических факторов среды обитания. Показатель 10% обусловлен наличием устойчивого аллельного популяционного фона, который может сдвигаться под воздействием стрессовой техногенной нагрузки как в отношении аллельности каждого из анализируемых генов, так и их комбинации.
Использование, наряду с вышеуказанным, в качестве дополнительного прогнозного критерия - превышение более, чем на 30% количества лиц в исследуемой группе, в крови которых присутствует в концентрации более, чем референтной, по меньшей мере, одно из приоритетных для среды обитания указанной территории, вредное химическое вещество, который обусловлен тем, что наличие нарушенного аллельного фона по анализируемым полиморфизмам не получит негативной реализации для здоровья без критической распространенности в популяции «носительства» в крови более, чем референтных концентраций техногенных химических факторов.
Предлагаемый способ реализуется следующим образом.
1. Выбирают территорию экологического риска, характеризующуюся наличием техногенных химических факторов - химических токсикантов, обусловленных экологической средой обитания. Исследования были проведены на территории г. Чусовой, характеризующейся наличием предприятия металлургической промышленности; на территории г.Перми, характеризующейся наличием предприятия химической промышленности; на территории Пермского района Пермского края, характеризующейся наличием предприятия нефтеорганического синтеза.
2. На указанной территории производят отбор группы лиц одной этнической популяции. Затем производят отбор пробы крови у обследуемого человека, в которой определяют содержание вредных химических веществ (контаминантов), приоритетных для территории среды проживания человека. При этом определение вредных веществ в крови проводят по МУК 4.1.2102-4.1.2116-06 «Определение вредных веществ в биологических средах» (Москва, 2008) и по МУК 4.1.763-4.1.779-99 «Определение химических соединений в биологических средах» (Москва, 2000) и устанавливают, имеется ли превышение концентрации этого контаминанта в пробе крови над его референтным уровнем.
Также производят отбор пробы в виде мазка со слизистой оболочки щеки (буккальный эпителий), причем забор осуществляют сухими стерильными зондами с ватными тампонами вращательными движениями без травматизации после предварительного полоскания полости рта водой.
После забора материала тампон (рабочую часть зонда с ватным тампоном) помещают в стерильную пробирку типа «Эппендорф» с 500 мкл транспортной среды (стерильный 0,9%-ный раствор NaCl). Конец зонда отламывают или отрезают, с расчетом, чтобы он позволил плотно закрыть крышку пробирки. Пробирку с раствором и рабочей частью зонда закрывают.
3. Далее производят выделение ДНК из пробы. Для этого пробы в количестве 100 мкл лизируют 300 мкл лизирующего раствора, представляющего собой 0,5%-ный раствор саркозила и протеиназы К (20 мг/мл) в ацетатном буфере (pH 7,5). Затем добавляют сорбент (каолин) и последовательными процедурами промывки отмывают фосфатно-солевым буфером (pH 7,2) пробы от белков и смесью изопропиловый спирт:ацетон от липидов. Нуклеиновые кислоты остаются при этом на сорбенте. Далее адсорбированные на сорбенте ДНК из пробы экстрагируют ТЕ-буфером, представляющим собой смесь 10 мМ трис-HCl и 1 мМ ЭДТА (pH 8,0). Экстракт подвергают центрифугированию. После центрифугирования пробирки надосадочная жидкость содержит очищенную ДНК.
4. Полученный материал готов к постановке полимеразной цепной реакции (ПЦР). Полимеразную цепную реакцию проводят на детектирующем амплификаторе с гибридизационно-флуоресцентной детекцией в режиме «реального времени» с использованием готовых наборов праймеров и зондов производства Applied Biosystems, в котором в качестве праймеров использовались участки ДНК гена цитохрома Р-450 -CYP1A1 (9893A/G), гена фермента копропорфириногеноксидазы СРОХ (921А/С) и гена фактора некроза опухолей TNF-альфа (G308A). Каждый раз используется два праймера, каждый из которых комплементарен лишь одному аллельному варианту выбранного участка гена. Эти участки выбраны из базы данных однонуклеотидных замен (SNP) и имеют соответствующее международное обозначение. Для CYP1A1 был выбран участок - rs4646521, для СРОХ - rs1131857, для TNF - rs1800629.
5. Проводят реакцию амплификации, это достигается тем, что для исследования аллельного состояния каждого гена у отдельного человека готовят свою реакционную смесь. В пробирку вносят 0,1 мкл готовой смеси праймеров и зондов для выбранного гена. В эту же пробирку добавляют остальные компоненты необходимые для осуществления ПЦР: нуклеотиды (дезоксинуклеозидтрифосфаты: по 10 мМ дАТФ, дТТФ, дГТФ, дЦТФ), буфера (100 мМ трис-HCl-буфера, 500 мМ КСl, 40 мМ MgCl2) и Tag F-полимеразы. Вносят пробу в количестве 10 мкл. Таким образом, общий объем реакционной смеси составляет 25 мкл. Пробирка плотно закрывается пробкой и устанавливается в амлификатор.
6. При проведении ПЦР амплификацию и детекцию проводят на детектирующем амплификаторе CFX96 фирмы Bio-Rad.
Используется универсальная программа амплификации, подобранная производителем реактивов. Она включает в себя несколько этапов: 1 этап -активация TaqF-полимеразы (режим «горячего старта») продолжается 15 мин при 95°C; 2 этап - установочные циклы амплификации без измерения флуоресценции (5 циклов); 3 этап - рабочие циклы амплификации с измерением флюоресценции (40 циклов).
Каждый цикл амплификации включает в себя денатурацию ДНК (5 с при 95°C), отжиг праймеров (20 с при 60°C) и саму реакцию полимеризации ДНК (15 с при 72°C).
Регистрация сигнала флюоресценции, возникающего при накоплении продуктов амплификации участков ДНК, проводится в режиме «реального времени» после стадии отжига праймеров для выбранных генов по каналу VIC - для детекции одного из аллельных вариантов генов, и по каналу FAM - для альтернативного варианта.
Результаты интерпретируются на основании наличия (или отсутствия) пересечения кривой флюоресценции с установленной на заданном уровне пороговой линией, что соответствует наличию (или отсутствию) значения порогового цикла (N) в соответствующей графе в таблице результатов, отображаемой в программном обеспечении для амплификатора CFX96.
По соотношению пороговых циклов, полученных по двум каналам детекции, определяют состояние гена в исследуемом участке ДНК (метод аллельной дискриминации). Возможных вариантов состояния гена было два: гомозиготное - в случае, когда одно из значений порогового цикла не определяется (ниже пороговой линии) и гетерозиготное - в случае, когда получено два значения пороговых циклов и по этим каналам получены параболические кривые флюоресценции. В зависимости от того, накопление какого продукта амплификации происходит в реакции, устанавливается гетерозиготное, или нормальное гомозиготное, или минорное состояние гена.
При проведении массовых исследований регистрируются частоты аллельных вариантов изучаемых генов и частоты состояний генов (генотипов) в соответствии с таблицей 1.
|
Примечание: В таблице приведены варианты аллельных состояний анализируемых генов (гетерозиготное и гомозиготное). Для каждого варианта генов приведены сочетания нуклеотидов, характерные для нормальных и минорных комбинаций.
Частоты аллелей используются в дальнейшем для расчета их распространенности в популяциях по формуле:
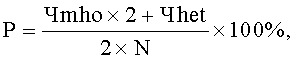 где
где
P - распространенность минорного аллеля в исследуемой группе (%);
Чmho - число лиц с минорным гомозиготным генотипом;
Чhet - число лиц с гетерозиготным генотипом;
N - число наблюдений в популяции.
Далее рассчитывают коэффициент распространенности минорных аллелей для выбранных генов по формуле:
 , где
, где
Kp - коэффициент распространенности минорных аллелей в исследуемой группе (%);
P - распространенности минорных аллелей соответствующих генов в исследуемой группе (%).
7. Для прогнозирования популяционных нарушений биотрансформации чужеродных веществ, обусловленных воздействием техногенных химических факторов среды обитания, сравнивают установленный коэффициент распространенности минорных аллелей в исследуемой группе с величиной 10% и при превышении указанного коэффициента более этой величины и одновременно при превышении более, чем на 30% количества лиц в исследуемой группе, в крови которых присутствует в концентрации более чем референтной, по меньшей мере, одно из приоритетных для среды обитания указанной территории, вредное химическое вещество, прогнозируют указанные популяционные нарушения.
Предлагаемый способ был испытан в клинических условиях.
Для апробации предлагаемого способа были исследованы 188 ребенка европеоидной расы (возраст 3-7 лет), проживающие на территории Пермского Прикамья в условиях внешнесредовой экспозиции следующих приоритетных для конкретных городских территорий проживания указанных детей вредных химических веществ: метанол, фенол, формальдегид, бенз(а)пирен, свинец.
Для доказательства достоверности предлагаемого способа была исследована контрольная популяция детей (возраст 3 - 7 лет) в количестве 33 человек, проживающих в сельской местности, в которой отсутствовали вышеуказанные вредные химические соединения.
Ниже в таблице 2 приведены результаты, полученные при реализации предлагаемого способа, на территориях, для которых характерны в качестве приоритетных вышеуказанные вредные химические соединения.
|
Пример расчета частоты минорных аллелей и коэффициента их распространенности в исследуемой и контрольной группах (данные из таблицы 2):
 (для исследуемой группы)
(для исследуемой группы)
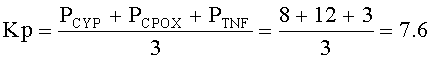 (для контрольной группы)
(для контрольной группы)
Данные, приведенные в таблице 2, показывают следующее.
Распространенность минорной гомозиготы по гену CYP1A1 (-9893A/G) в исследуемой и контрольной группах составила 4% и 0%, соответственно, а распространенность минорного аллеля A в них составила 14% и 8%.
CYP1A1 характеризуется преимущественно монооксигеназной активностью, которая индуцируется полициклическими ароматическими углеводородами, и он участвуя в промежуточном обмене многих эндогенных метаболитов, кроме того, осуществляет активацию бенз(а)пирена. Высокая активность этого фермента ассоциирована с заменой нуклеотида и сопровождается повышенным риском онкозаболеваний при воздействии ПАУ.
Распространенность минорной гомозиготы по гену СРОХ 921А/С в исследуемой и контрольной группах составила 5% и 0%, соответственно, а распространенность минорного аллеля A в них составила 8,9% и 12%. Измененный полиморфизм СРОХ 921А/С характеризуется повышением чувствительности к гаптенам и развитием симптомов интоксикации при следовых количествах ксенобиотиков.
Распространенность минорных гомозигот по гену TNF-альфа в исследуемой и контрольной группах составила 3% и 0%, соответственно, а распространенность минорного аллеля A в них составила 14% и 3%. У гомозиготных носителей аллеля A (замена G308A в гене TNF-альфа) не происходило адекватного иммунного ответа на антиген. Индивиды с носительством минорного аллеля в промоторной области гена TNF-альфа были ассоциированы с нарушениями дифференцировки клеток, аутоиммунными, инфекционными заболеваниями.
Таким образом, несмотря на соответствие нормальному (не превышает 10%) распределению минорного аллеля СРОХ 921А/С, суммарный полиморфизм генов, участвующих в формировании мажорного полиморфизма, не обеспечивает адекватную адаптацию к внешнесредовой химической нагрузке.
Таким образом, изучение исключительно суммарного полиморфизма генов по ключевым по отношению к детоксикации приоритетных техногенных химических факторов с детекцией распространенности контаминации ими биосред позволит получить достоверную информацию об их опасности для организма.
Таким образом, предлагаемый способ позволяет точно и достоверно прогнозировать популяционные нарушения биотрансформации чужеродных веществ, обусловленных воздействием техногенных химических факторов среды обитания, что позволит своевременно проводить профилактические мероприятия по обеспечению путей защиты и стабилизации генома этнической популяции, оптимизировать с точки зрения обеспечения безопасности жизнедеятельности жизненный и профессиональный маршрут.
Способ прогнозирования популяционных нарушений биотрансформации чужеродных веществ, обусловленных воздействием техногенных химических факторов среды обитания, характеризующийся тем, что производят отбор группы одной этнической популяции, проживающей на территории воздействия вредных химических факторов, у исследуемого контингента отбирают пробы биологического материала, а именно буккального эпителия, осуществляют выделение из указанной пробы дезоксирибонуклеиновой кислоты (ДНК), далее на детектирующем амплификаторе с использованием полимеразной цепной реакции ПЦР проводят генотипирование полиморфизма - 9893A/G гена CYP1A1, 921А/С гена СРОХ и G308A гена TNF-альфа путем исследования аллельного состояния каждого из выбранных генов, устанавливают одно из следующих состояний гена: гетерозиготное или нормальное гомозиготное, или минорное гомозиготное, рассчитывают распространенность минорного аллеля для каждого гена по формуле: где P - распространенность минорного аллеля в исследуемой группе, %;Чmho - число лиц с минорным гомозиготным генотипом;Чhet - число лиц с гетерозиготным генотипом;N - общее число лиц исследуемой группы одной этнической популяции;рассчитывают коэффициент распространенности минорных аллелей для изучаемых генов по формуле: ,где Kp - коэффициент распространенности минорных аллелей в исследуемой группе, %;P - распространенности минорных аллелей соответствующих генов в исследуемой группе, %;и при превышении указанного коэффициента распространенности минорных аллелей более 10%, при одновременном превышении более чем на 30% количества лиц в исследуемой группе, в крови которых присутствует в концентрации более чем референтной, по меньшей мере, одно из приоритетных для среды обитания указанной территории вредное химическое вещество, прогнозируют популяционные нарушения, связанные с биотрансформацией чужеродных веществ, обусловленных воздействием техногенных химических факторов среды обитания.