Результат интеллектуальной деятельности: СПОСОБ ВЫЯВЛЕНИЯ НАЛИЧИЯ СИСТЕМНОЙ РЕАКЦИИ СОЕДИНИТЕЛЬНОЙ ТКАНИ, ОБУСЛОВЛЕННОЙ РАЗВИТИЕМ СИНДРОМА СОЧЕТАННЫХ ДИСТРОФИЧЕСКИ-ДЕГЕНЕРАТИВНЫХ ИЗМЕНЕНИЙ МЕЗЕНХИМАЛЬНЫХ ПРОИЗВОДНЫХ ПРИ ЛОКАЛЬНОМ ХРОНИЧЕСКОМ ВОСПАЛИТЕЛЬНОМ ПРОЦЕССЕ
Вид РИД
Изобретение
Изобретение относится к области медицины и может быть использовано для уточнения патогенеза проявлений патологии соединительной ткани, в частности для выявления наличия системной реакции соединительной ткани, обусловленной развитием синдрома сочетанных дистрофически-дегенеративных изменений мезенхимальных производных при локальном хроническом воспалительном процессе (ССДДИМП при ЛХВП).
Современные условия техногенной цивилизации способствуют широкому распространению воспалительных заболеваний. Многие исследователи связывают высокую частоту хронических заболеваний различных органов и систем с воздействием неблагоприятных экологических факторов, несвоевременным и неадекватным лечением острых инфекционно-воспалительных процессов, развивающихся на фоне несовершенного иммунного ответа на этиологический фактор (Пекарева Н.А., Трунова Л.А., Белоусова Т.В., Горбенко О.М., Шваюк А.П., Трунов А.Н. К вопросу об активности иммуновоспалительного процесса у детей с хроническим пиелонефритом в стадии клинической ремиссии / Бюллетень СО РАМН, №3 (131), 2008. - С.52-55; Медуницын Н.В, Покровский В.И. Основы иммунопрофилактики и иммунотерапии инфекционных болезней: Учеб. пособие. - М.: ГЭОТАР-Медиа, 2005. - 512 с.; Бухарин О.В. Значение персистенции бактериальных патогенов для клинической практики / Российские медицинские вести, №3, т.V, 2000. - С.18-25; Карпин В.А. Общая теория патологии: хронический инфекционный процесс / Успехи современного естествознания, №4, 2005. - С.17-20).
Длительное существование фокальной персистирующей инфекции вызывает определенное изменение функционирования основных гомеостатических систем, и, как следствие, структурную перестройку органов и тканей.
Описан синдром сочетанных дистрофически-дегенеративных изменений мезенхимальных производных при локальном хроническом воспалительном процессе. Он включает следующие симптомокомплексы и патологические изменения в организме (Команденко Н.И., Жураковский И.П., Рыжов А.И. Синдром сочетанных дистрофически-дегенеративных изменений в производных мезенхимы при воздействии фокальной персистирующей инфекции. Свидетельство об интеллектуальной собственности, зарегистрированное ВНТИЦ 07.08.2002 г. №72200200029) (прототип):
1. симптомокомплексы, обусловленные локализацией и степенью активности очага хронического воспаления (тонзиллит, холецистит, аднексит, пиелонефрит и тд.), сопровождающиеся неспецифическими признаками хронического воспаления (увеличение содержания α2 и γ-глобулинов, серомукоидов, фибриногена, появление С-реактивного белка, легкая эозинофилия, моно- и лимфоцитоз, тенденция к угнетению красного ростка крови) и признаками иммунологической недостаточности;
2. вызванные фокальной персистирующей инфекцией дистрофически-дегенеративные изменения соединительнотканных образований вне места локализации хронического воспалительного процесса (ХВП):
- изменения в хрящевой ткани (метаэпифизарном хряще, межпозвоночных дисках, суставах) и обусловленные ими заболевания позвоночника и артропатии. В детском возрасте - это повышенная вероятность аномалий строения скелета, а также болезнь Шауэрмана-Мау. После периода полового созревания - это дистрофически-дегенеративные изменения межпозвоночных дисков, заболевания суставов;
- изменения в плотной оформленной волокнистой соединительной ткани (связки, сухожилия), вызывающие клинические варианты проявлений остеофиброза, периартрозов, туннельных синдромов. При этом особенностью развития в детском возрасте являются признаки диспластических изменений соединительной ткани опорно-двигательного аппарата (гипермобильность суставов, плоскостопие, сколиоз);
- изменения в рыхлой волокнистой соединительной ткани проявляются усиленным фиброгенезом на фоне неспецифических реактивных воспалительных процессов.
3. Изменения глазного яблока (гиперметропия, астигматизм).
4. Субклинически протекающий васкулит, характерной особенностью которого является миграция симптоматики;
5. Изменения со стороны нервной системы:
- склонность к развитию рубцово-спаечного процесса в оболочках головного и спинного мозга (церебральные и спинальные арахноидиты) с соответствующей клинической симптоматикой;
- полинейропатии, множественные мононейропатии с преимущественным поражением чувствительных нейронов;
- дисфункция вегетативной нервной системы с явлениями вовлечения в процесс сегментарного и надсегментарного отделов;
- астено-невротический симптом за счет повышенной истощаемости высшей нервной деятельности.
Учитывая вышеотмеченные патологические проявления, которые наблюдаются при СДДИМП при ЛХВП, перед клиницистами стоит достаточно актуальная задача в плане дифференцировки состояний, обусловленных развитием системной реакции соединительной ткани при этом синдроме, от заболеваний, имеющих другой этиопатогенез, но фенотипически похожих (т.е. отличить дегенеративные изменения межпозвонковых дисков, наблюдаемые при ССДДИМП при ЛХВП от дегенеративных изменений при остеохондрозе позвоночника; рубцово-спаечные изменения оболочек головного или спинного мозга, наблюдаемые при ССДДИМП при ЛХВП, от сходных изменений при спинальном или церебральном арахноидите т.д.). Дифференцировка этих состояний позволит более адекватно подбирать схемы лечения пациентов, что скажется на эффективности проводимого терапевтического курса.
Диагностику вышеописанных проявлений ССДДИМП при ЛХВП (симптомокомплексов и патологических изменений в организме) можно рассматривать как способ выявления наличия ССДДИМП при ЛХВП, т.е. как прототип предлагаемого способа. Однако, данный способ достаточно сложен: нужно привлечь группу узких специалистов (окулиста для выявления миопатии, астигматизма, невропатолога для выявления вовлечения нервной системы, вертеброневролога - дистрофически-дегенеративных заболеваний позвоночника, терапевта для диагностики неспецифических реактивных заболеваний внутренних органов), а также множество методов исследования (МРТ головного мозга, позвоночника, УЗИ внутренних органов, рентгенологическое исследование суставов, электронейромиография).
В настоящее время не разработаны другие способы выявления системной реакции соединительной ткани, обусловленной развитием ССДДИМП при ЛХВП.
Раскрытие изобретения
Предлагаемый способ выявления наличия системной реакции соединительной ткани, обусловленной развитием синдрома сочетанных дистрофически-дегенеративных изменений мезенхимальных производных при локальном хроническом воспалительном процессе (ССДДИМП при ЛХВП) характеризуется тем, что выявляют неспецифические признаки хронического воспаления, выполняют биопсию кожи, делают срезы образца, определяют в них сульфатированные гликозаминогликаны, иммуногистохимические маркеры индукции апоптоза (белок р53 и один из белков группы: Bad, Bax, Bik, Bak, Bcl-xs; или определяют наличие одной из активированных каспаз (каспазы-3, каспазы-6 или каспазы-7)), тучные клетки.
Признаками наличия системной реакции соединительной ткани, обусловленной развитием ССДДИМП при ЛХВП являются:
- неспецифические признаки хронического воспаления,
- резкое снижение содержания сульфатированных гликозаминогликанов (СГАГ) в сетчатом слое дермы (СГАГ выявляются только в области волосяных фолликулов и сальных желез);
- проапоптотические изменения клеточных элементов сетчатого слоя дермы (появление фибробластов, экспрессирующих белок р53 и один из белков группы: Bad, Bax, Bik, Bak, Bcl-xs; или появление одной из активированных каспаз (каспазы-3, каспазы-6, каспазы-7)),
- появление тучных клеток в наружных слоях сетчатого слоя дермы.
Дополнительным признаком наличия системной реакции соединительной ткани, обусловленной развитием ССДДИМП при ЛХВП может служить рекрутизация в гиподерму тучных клеток, которые выявляются не только в непосредственной близости к кровеносным сосудам (как в норме), но и на значительном отдалении от них, т.е. по всей гиподерме.
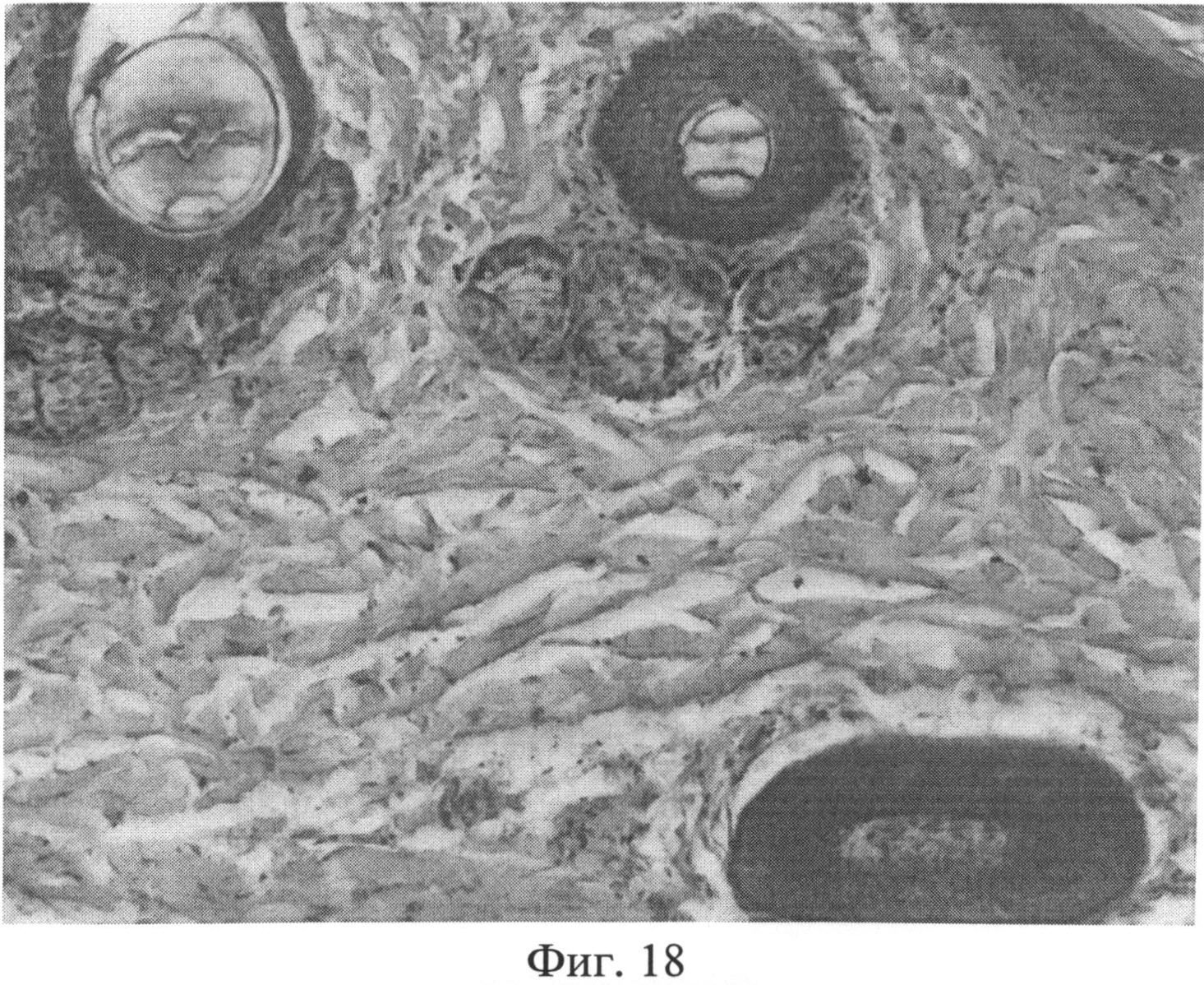
Другими дополнительными признаками наличия системной реакции соединительной ткани, обусловленной развитием ССДДИМП при ЛХВП могут служить изменение тинкториальных свойств коллагеновых волокон (они приобретают желто-оранжевую окраску) и нарушение их компактного расположения (появление просветов между волокнами), что обнаруживается при выявлении коллагеновых волокон.
Технические результаты изобретения:
1) выявление наличия системной реакции соединительной ткани, обусловленной развитием ССДДИМП при ЛХВП, что дает возможность проводить дифференциальную диагностику между заболеваниями соединительной ткани, имеющими наследственную или инволюционную этиологию, и состояниями, обусловленными системной реакцией соединительной ткани на фоне развития ССДДИМП при ЛХВП;
2) предлагаемый способ по сравнению с прототипом является более простым в осуществлении, менее затратным по времени; нет необходимости в привлечении множества специалистов и дорогостоящей аппаратуры;
3) предлагаемый способ дает возможность донозологической диагностики, т.к. предполагает определение состояния реакции соединительной ткани на наличие очага хронического воспаления, а прототип дает возможность диагностики патологии различных органов.
Перечень фигур иллюстративного материала
Фигуры, иллюстрирующие наличие ССДДИМП при ЛХВП:
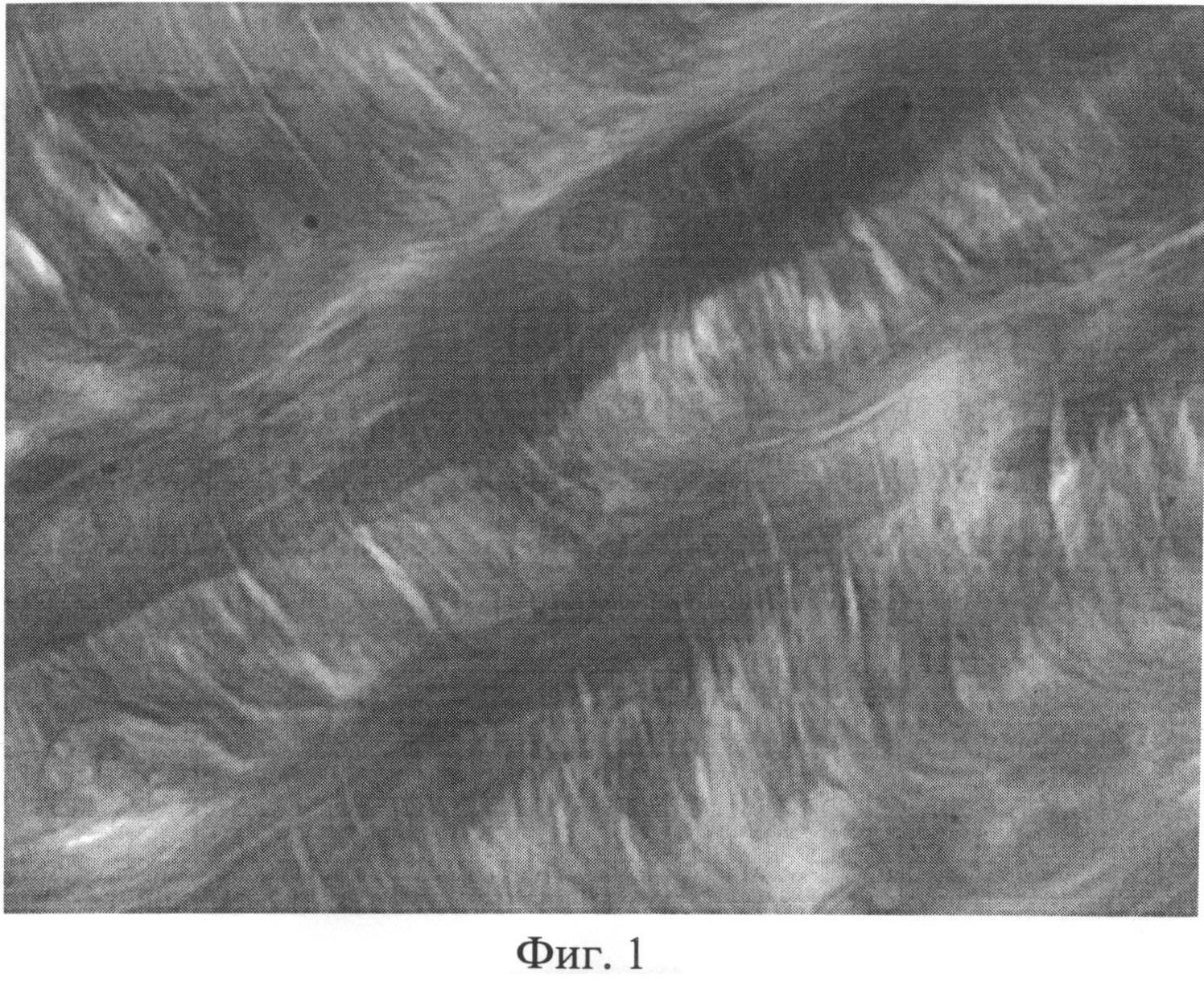
Фиг.1. Участок межпозвоночного диска крысы через 2 месяца после создания очага бактериальной инфекции. Снижение интенсивности выявления сульфатированных гликозаминогликанов по мере удаления от хондробластов. Окраска альциановым синим при pH 1,0 с последующей докраской ядер кармалюмом Майера. Ув.×400.
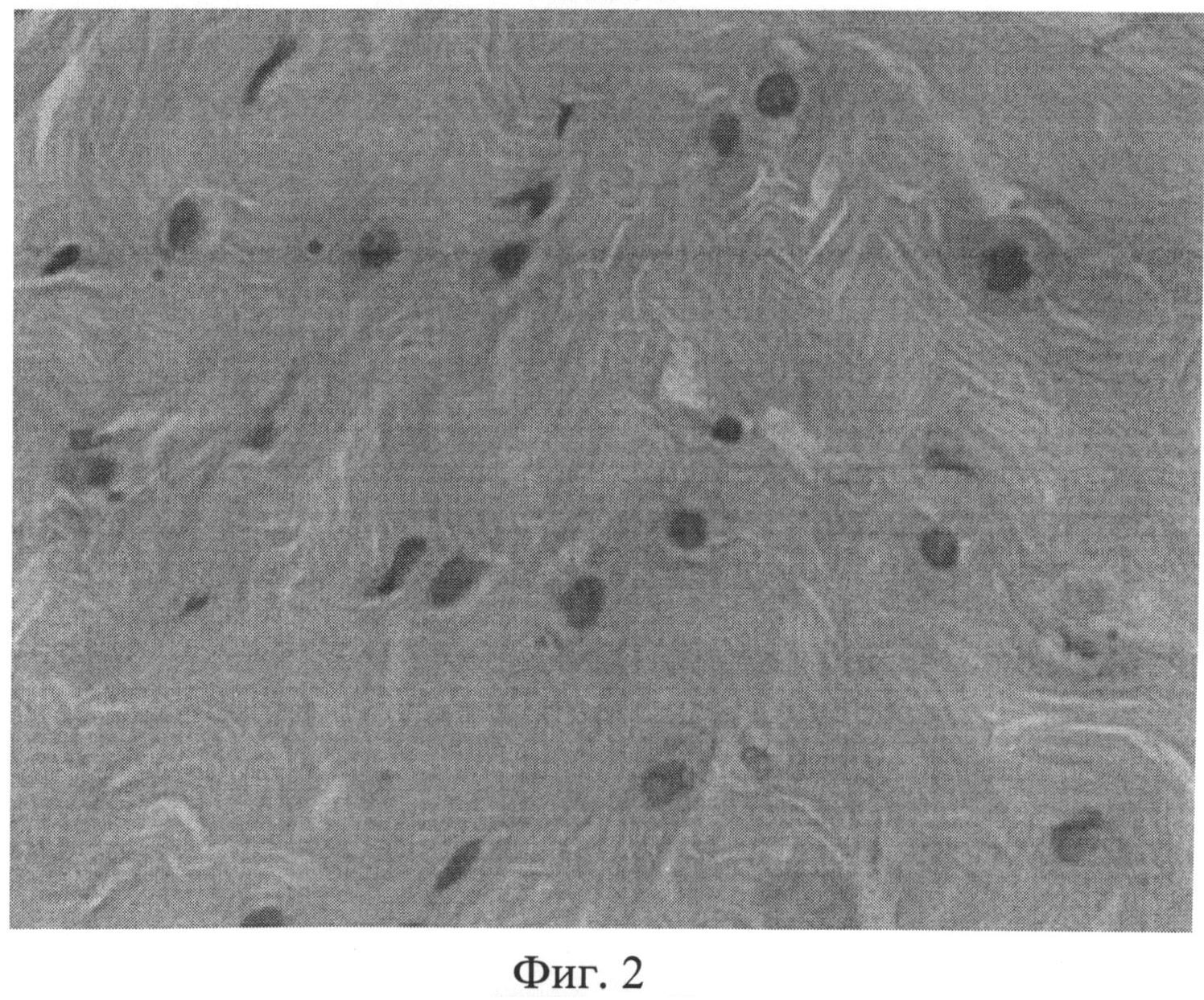
Фиг.2. Участок межпозвоночного диска крысы через 3 месяца после создания очага бактериальной инфекции с дистрофически измененными клеточными элементами, ядра которых проявляют разную степень сродства к основному красителю. Окраска гематоксилином Эрлиха и эозином. Ув.×400.
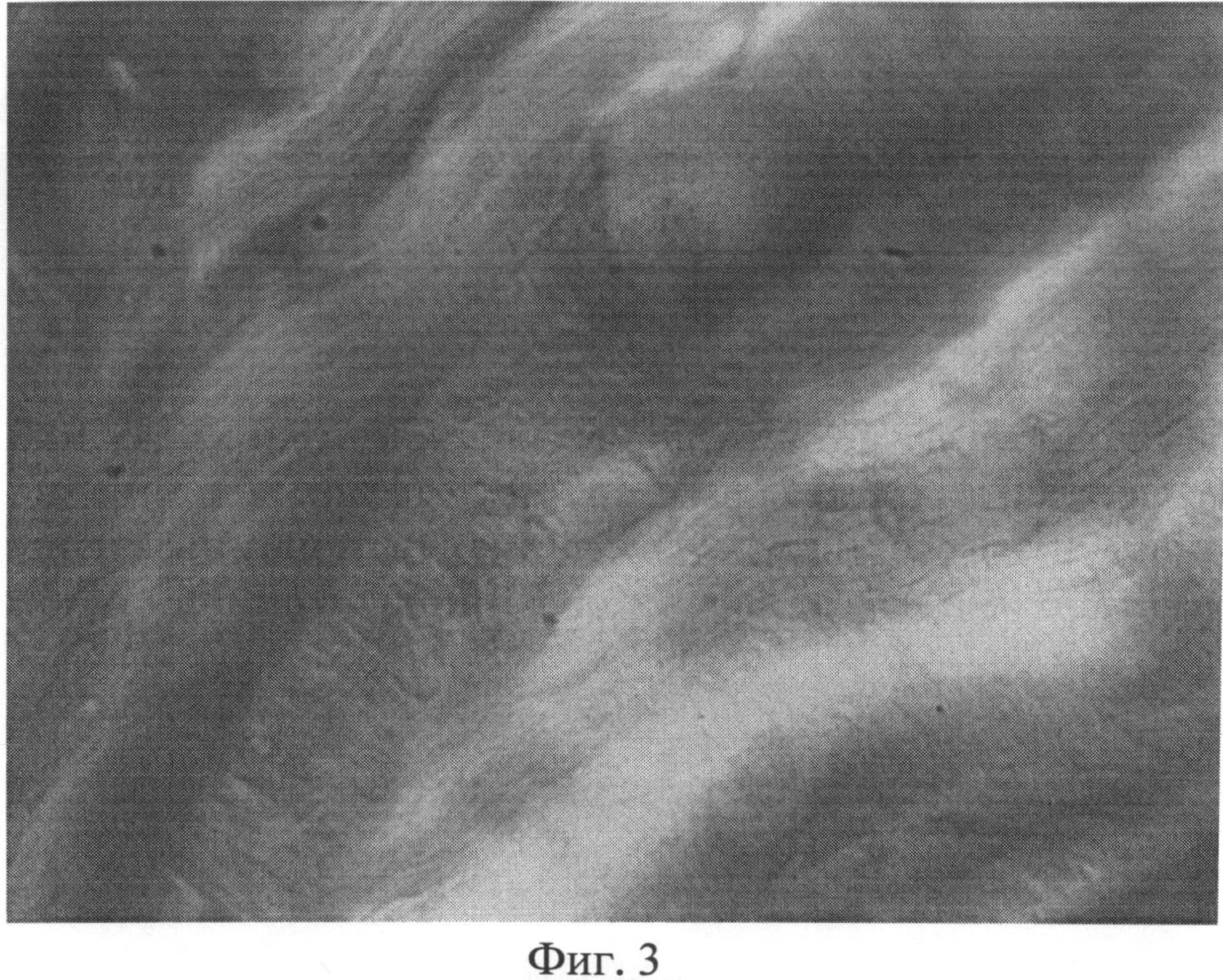
Фиг.3. Участок фиброзного кольца межпозвоночного диска крысы через 3 месяца после создания очага бактериальной инфекции с зоной, лишенной сульфатированных гликозаминогликанов. Окраска альциановым синим при pH 1,0 с последующей докраской ядер кармалюмом Майера. Ув.×400.
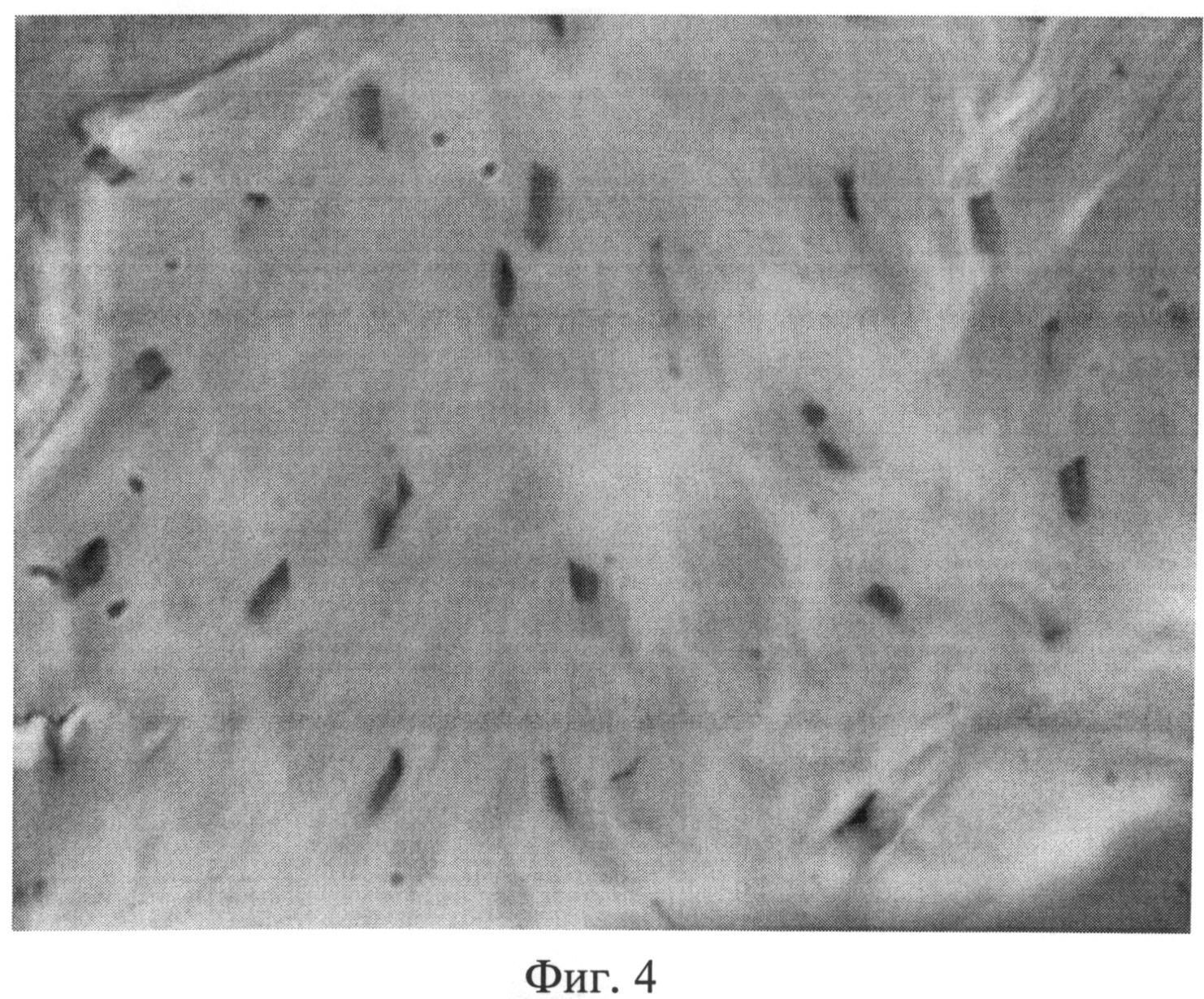
Фиг.4. Поперечный срез сухожилия мышц хвоста крысы через 2 месяца после создания очага бактериальной инфекции. Наряду с неизмененными фиброцитами встречаются одиночные клеточные элементы, ядра которых гиперхромны. Окраска пикрофуксином по Ван Гизону. Ув.×400.
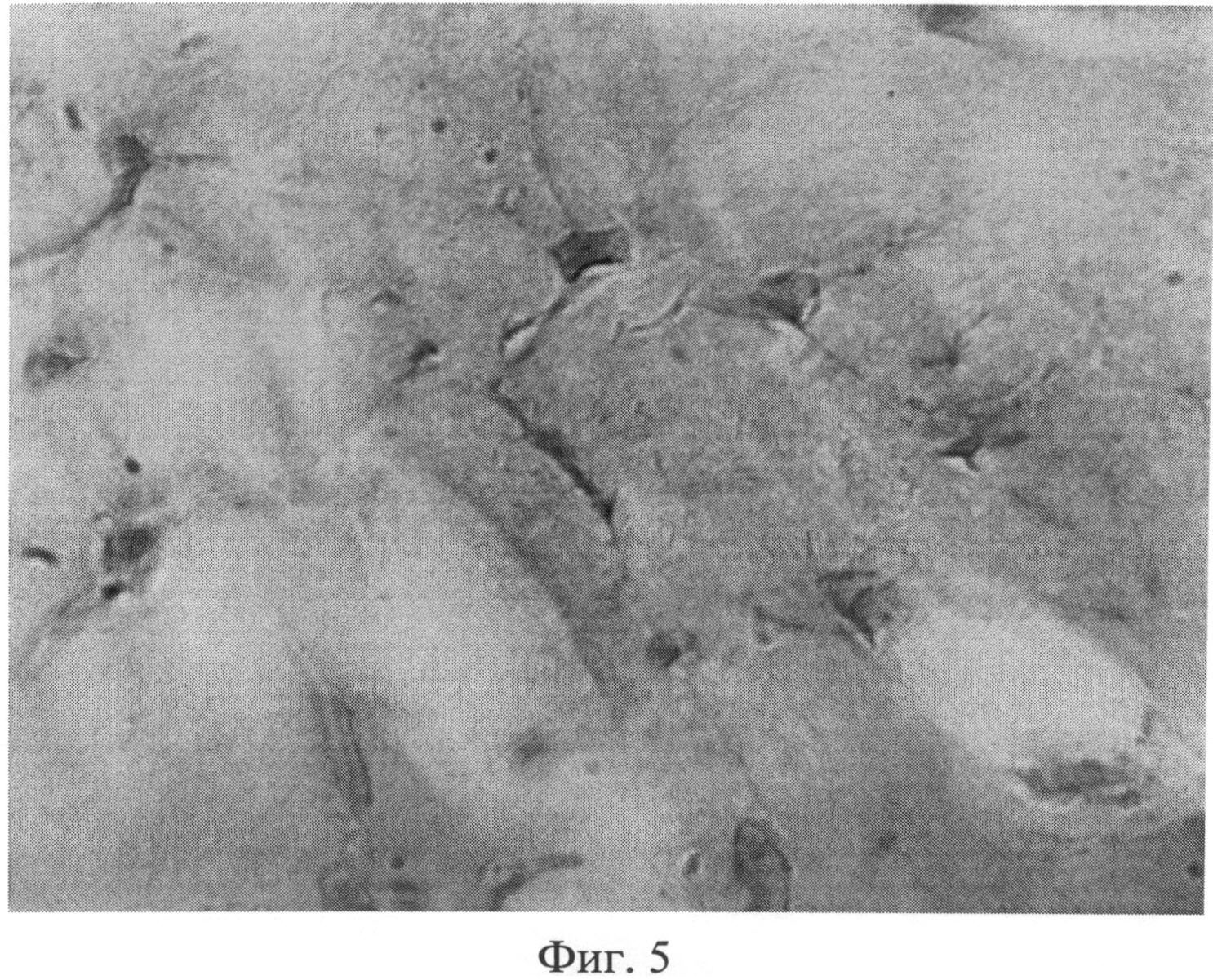
Фиг.5. Поперечный срез сухожилия мышц хвоста крысы через 3 месяца после создания очага бактериальной инфекции. Дистрофически измененные клеточные элементы, имеющие причудливую форму: округлые, треугольные, многогранные клетки, нередко увеличенные в размерах. Кариоплазма фиброцитов проявляет неодинаковое сродство к основному красителю, в результате чего можно видеть как гипо-, так и гиперхромные ядра. Окраска пикрофуксином по Ван Гизону. Ув.×400.
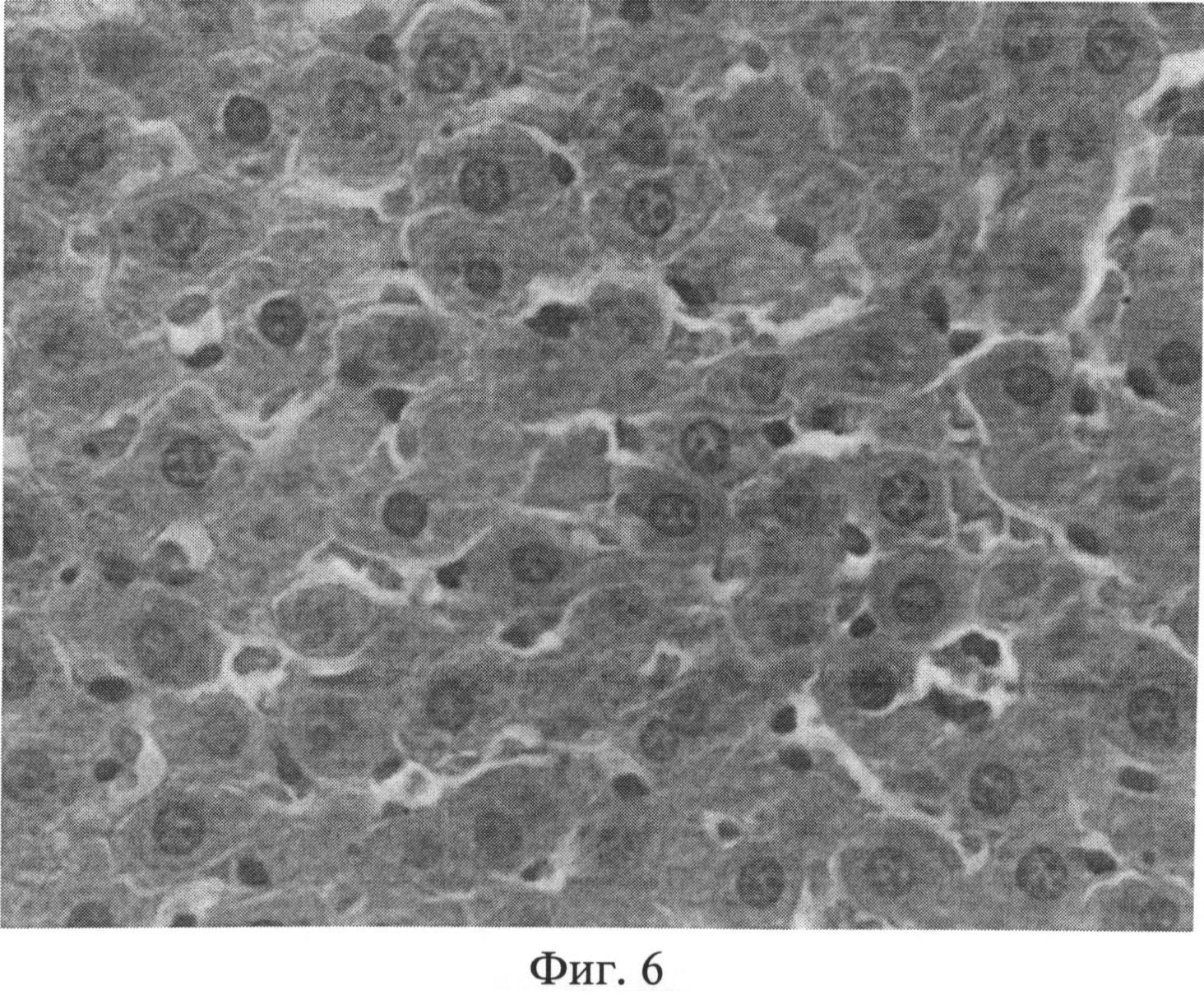
Фиг.6. Участок паренхимы печени крысы через 1 месяц после создания очага бактериальной инфекции. Отмечается полиморфизм гепатоцитов: клеточные элементы имеют мелкие или, наоборот, крупные размеры, выявляется разная степень конденсации хроматина. Отдельные гепатоциты дистрофически изменены, цитоплазма таких клеточных элементов имеет повышенное сродство к эозину (более темное и гомогенное окрашивание), а ядра чаще пикнотично изменены.
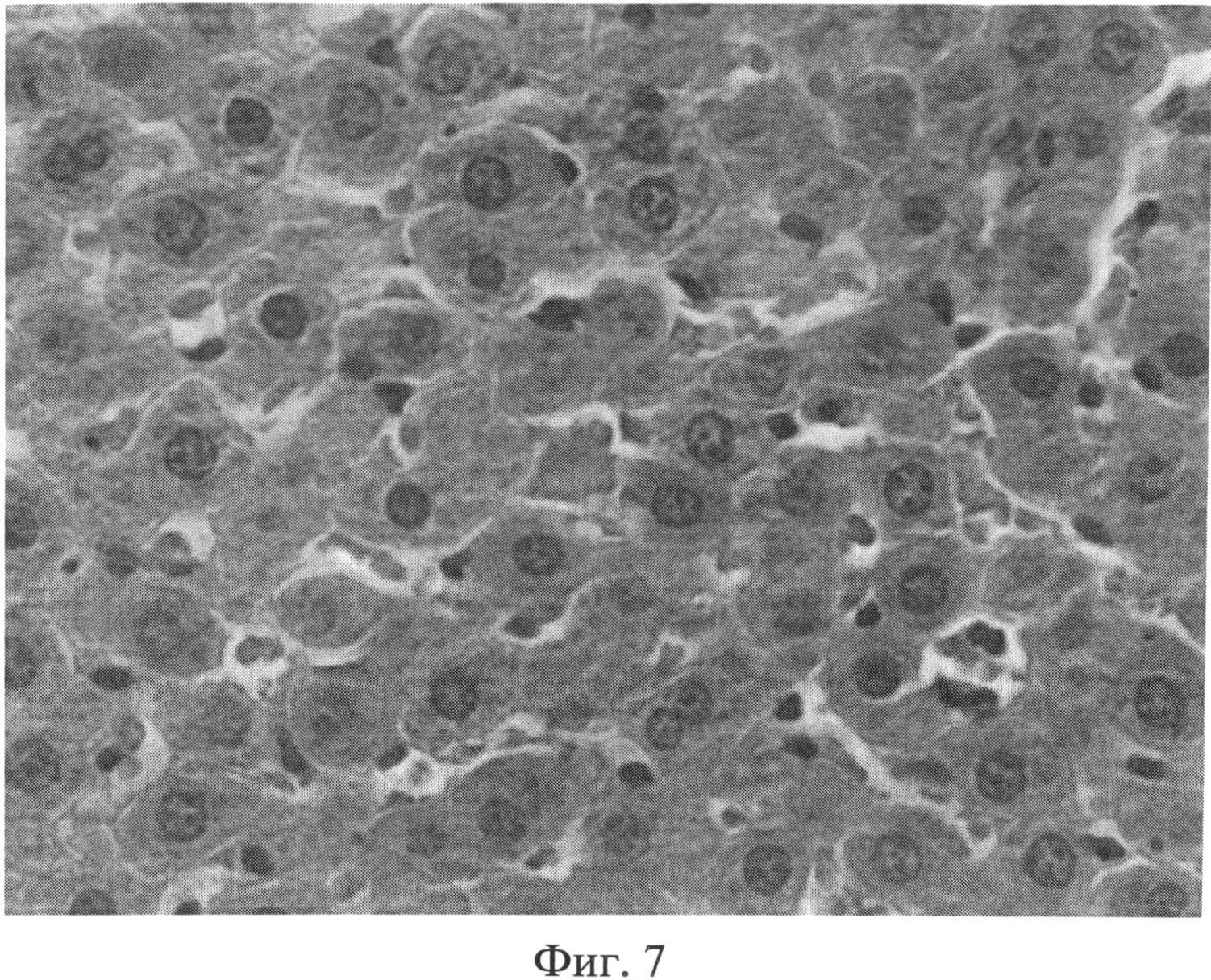
Фиг.7. Участок паренхимы печени крысы через 2 месяца после создания очага бактериальной инфекции. Внутри печеночных долек отмечается умеренное расширение синусоидных капилляров, в просвете которых часто выявляются множественные эритроцитарные агрегаты. Окраска гематоксилином Эрлиха и эозином. Ув.×400.
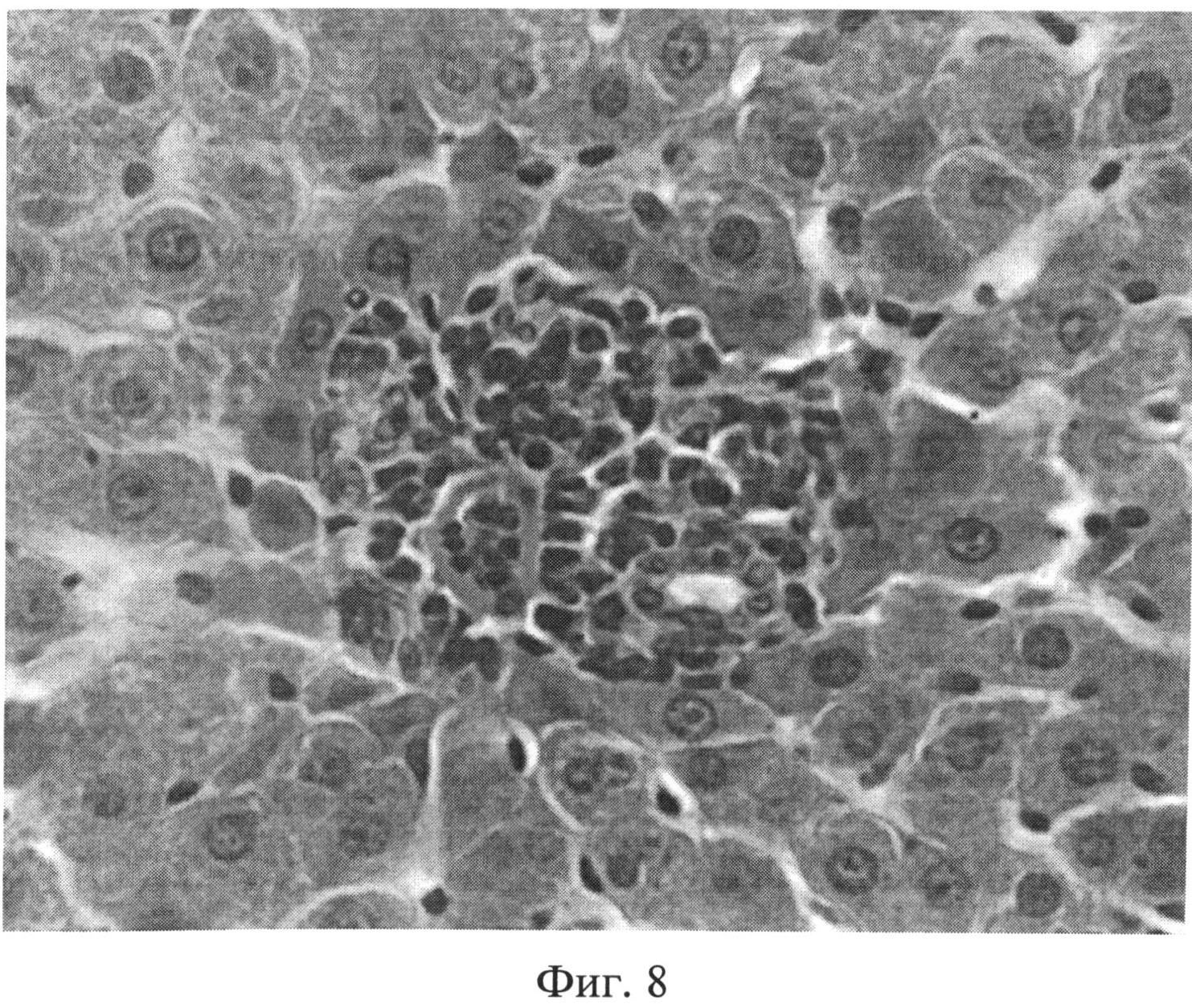
Фиг.8. Инфильтрация портального тракта лимфогистиоцитарными элементами через 2 месяца после создания очага бактериальной инфекции. Окраска гематоксилином Эрлиха и эозином. Ув.×400.
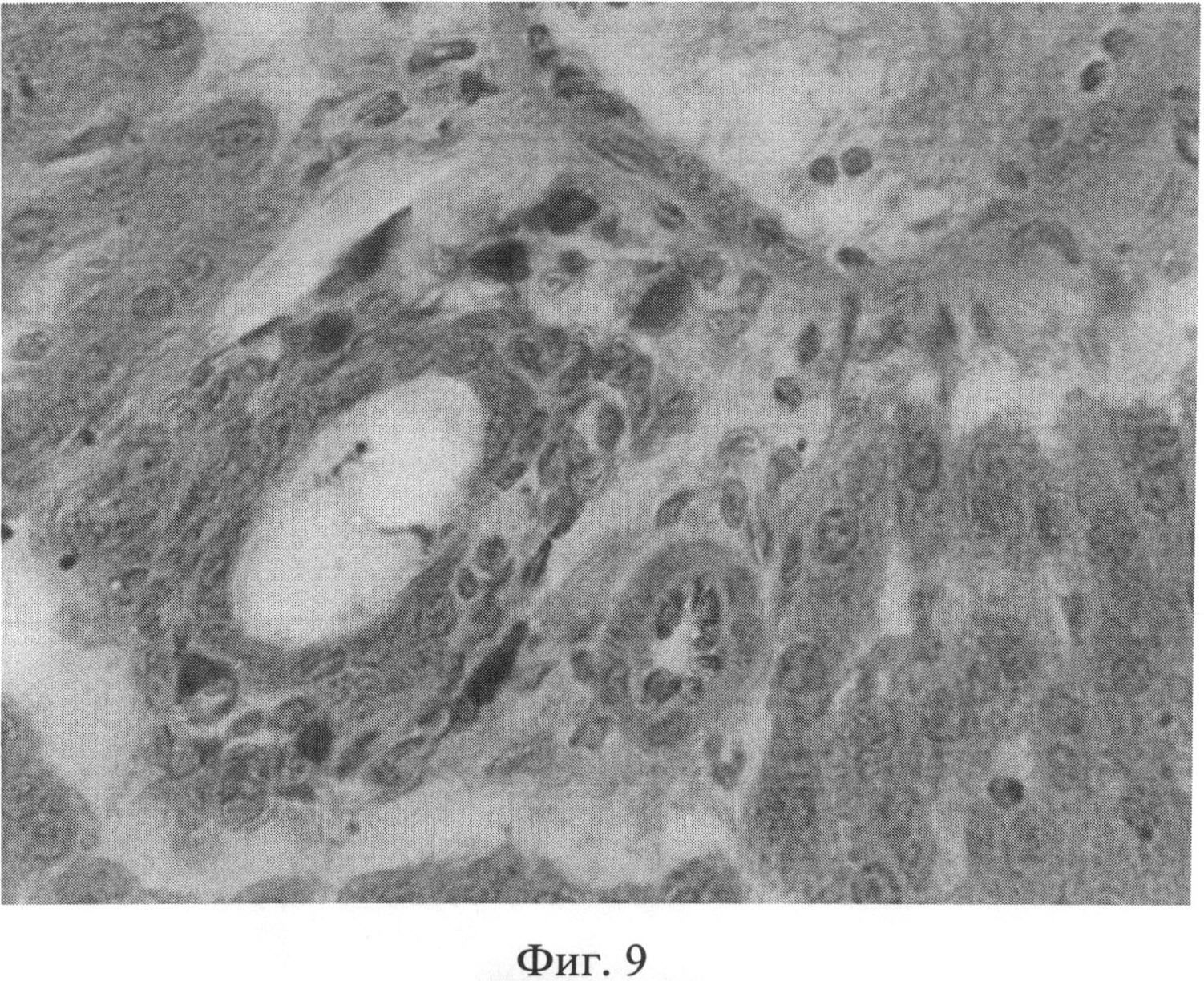
Фиг.9. Повышение количества тучных клеток (интенсивно окрашенные клеточные элементы) в области портальных трактов через 2 месяца после создания очага бактериальной инфекции. Окраска альциановым синим при pH 1,25 с последующей докраской ядер кармалюмом Майера. Ув.×400.
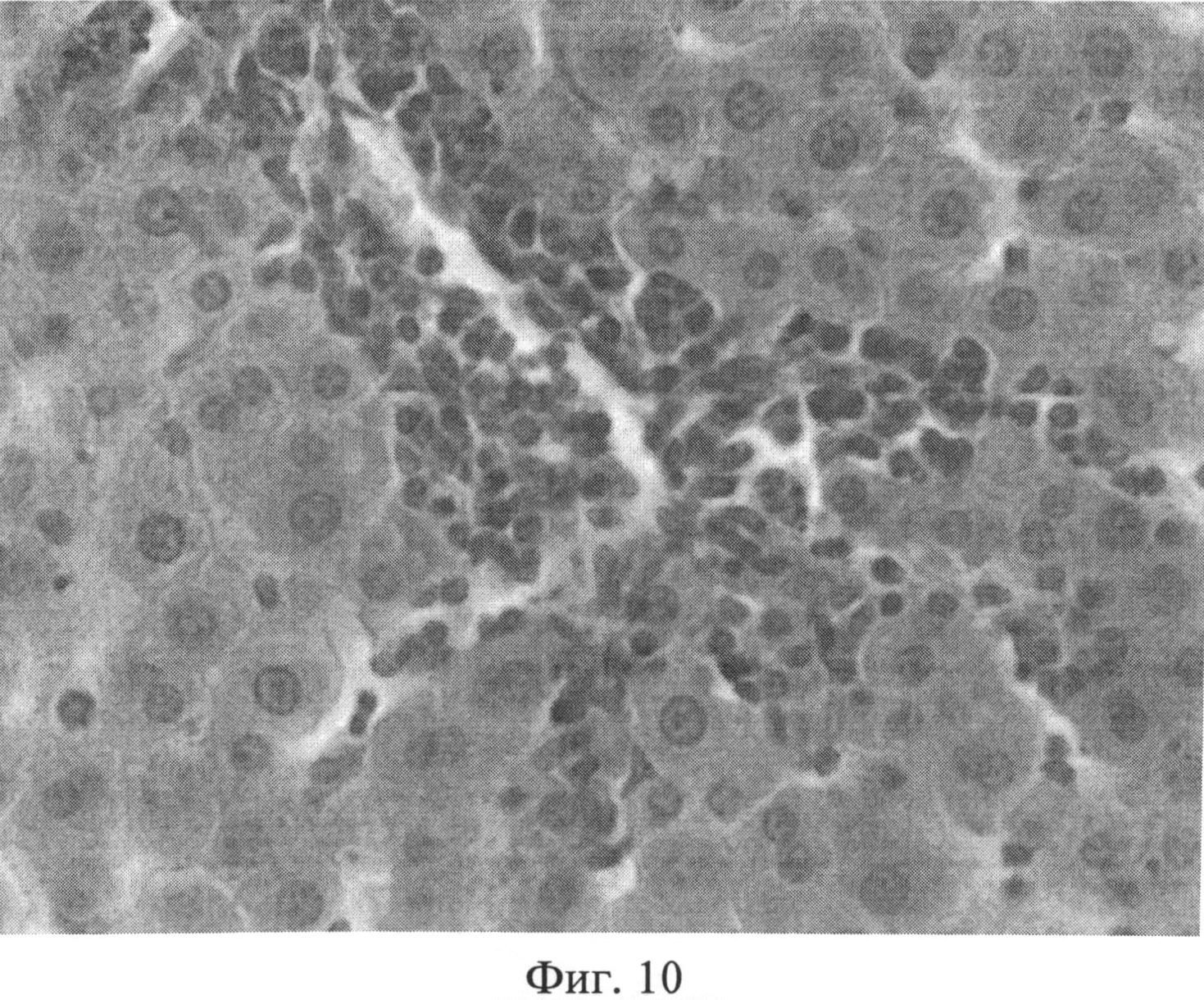
Фиг.10. Портальный тракт печени крысы через 3 месяца после создания очага бактериальной инфекции. Прослойки междольковой соединительной ткани вокруг триад увеличены, разволокнены, пространства Малла значительно расширены, отмечается инфильтрация портального тракта лимфогистиоцитарными элементами с выходом последних из портальной стромы в периферические отделы дольки. Окраска гематоксилином Эрлиха и эозином. Ув.×400.
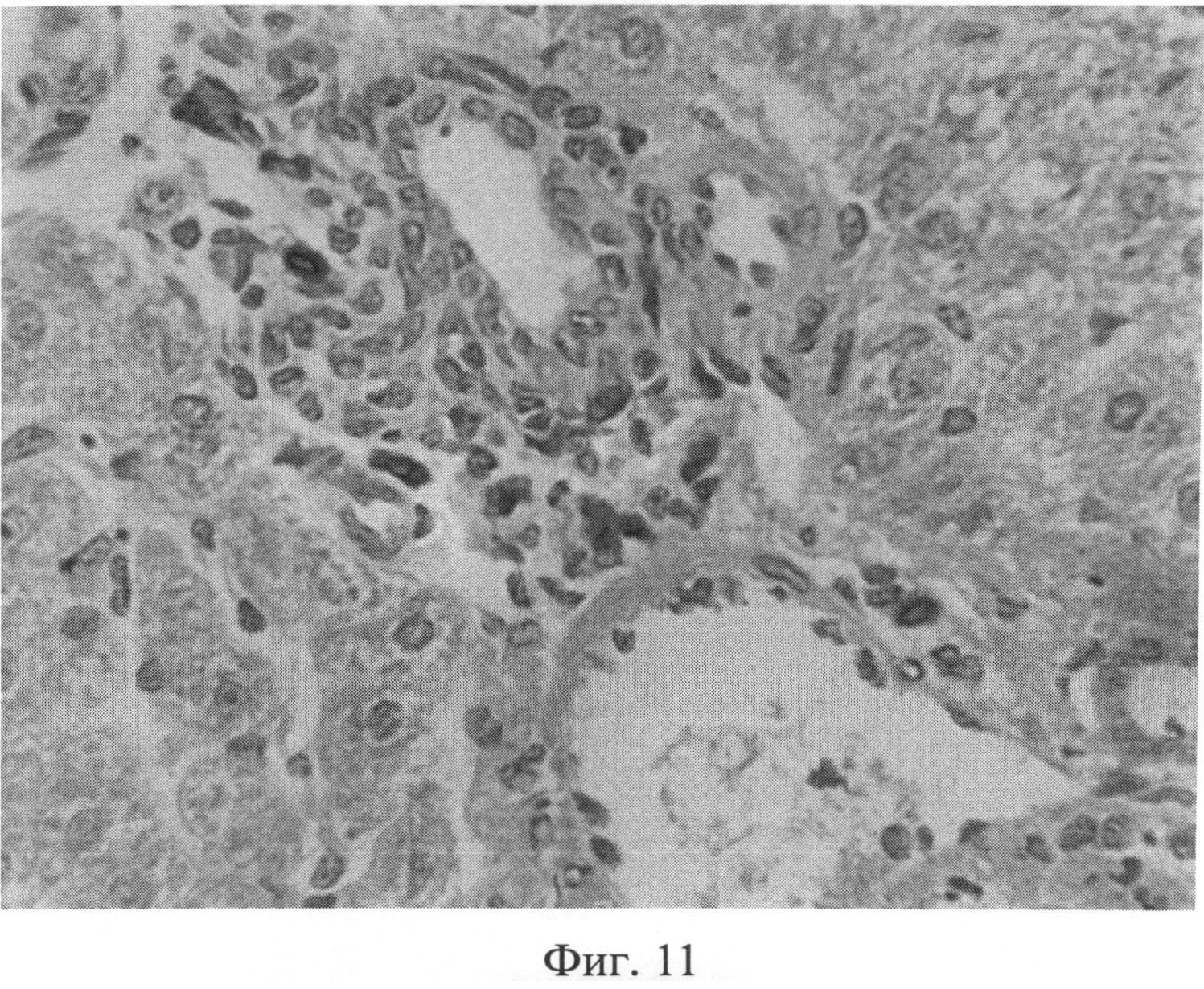
Фиг.11. Сохранение возросшего количества тучных клеток (интенсивно окрашенные клеточные элементы) в области триад через 3 месяца после создания очага бактериальной инфекции. Окраска альциановым синим при pH 1,25 с последующей докраской ядер кармалюмом Майера. Ув.×400.
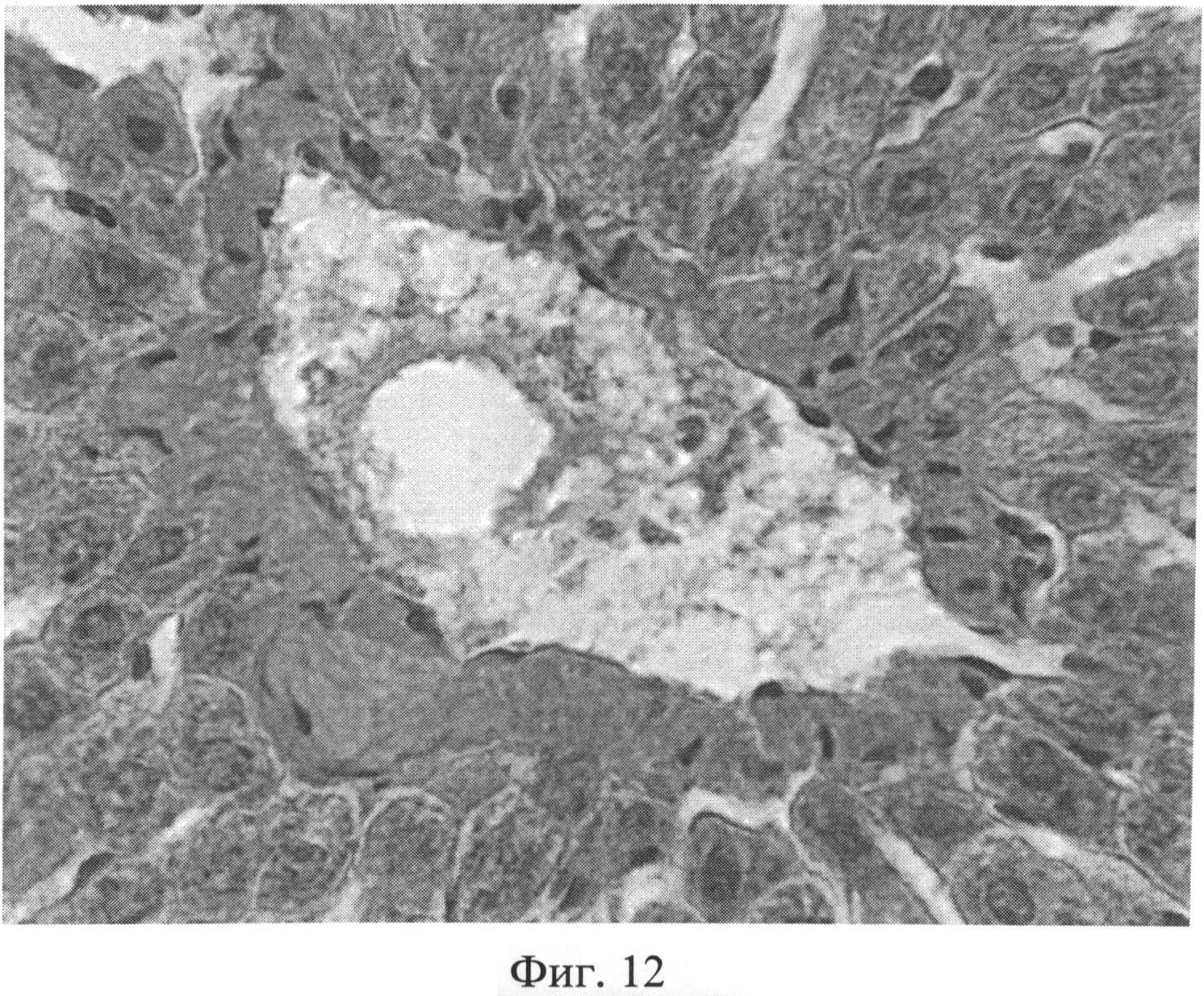
Фиг.12. Увеличение количества коллагеновых волокон в стенках центральной вены через 3 месяца после создания очага бактериальной инфекции. Окраска пикрофуксином по Ван Гизону. Ув.×400.
Фигуры, иллюстрирующие морфологическую картину кожи интактных животных:
Фиг.13. Участок кожи интактного животного. Специфической (темнокоричневой) окраски, свидетельствующей об экспрессии белка р53, в клеточных элементах не наблюдается. Иммуногистохимическое выявление белка р53. Ув.×400.
Фиг.14. Участок кожи интактного животного. Специфической (темнокоричневой) окраски, свидетельствующей об экспрессии белка Bax, в клеточных элементах не наблюдается. Иммуногистохимическое выявление белка Bax. Ув.×400.
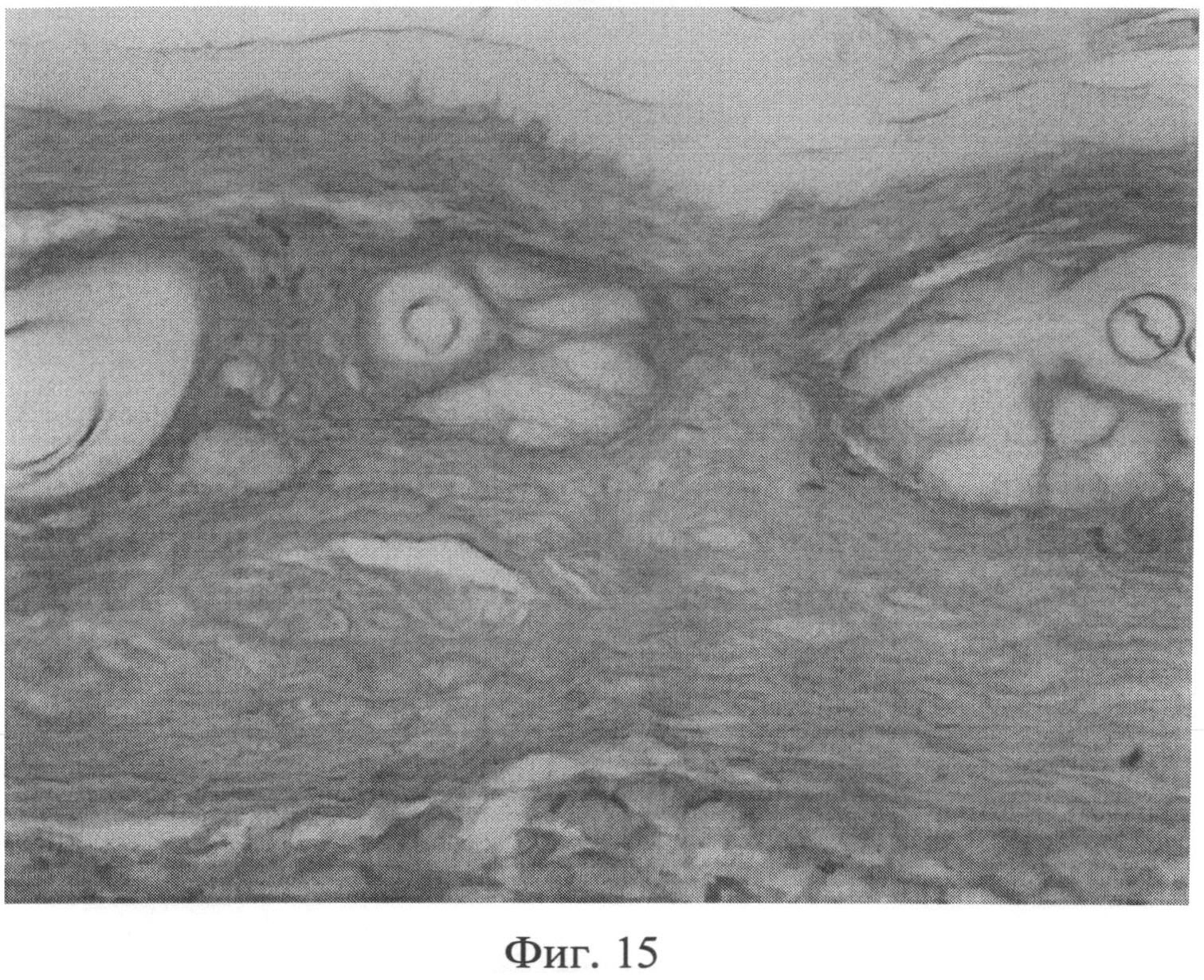
Фиг.15. Участок кожи интактного животного. Сульфатированные гликозаминогликаны в сетчатом слое дермы распределяются равномерно, интенсивность их окрашивания высокая. Окраска альциановым синим при pH 1,0. Ув.×100.
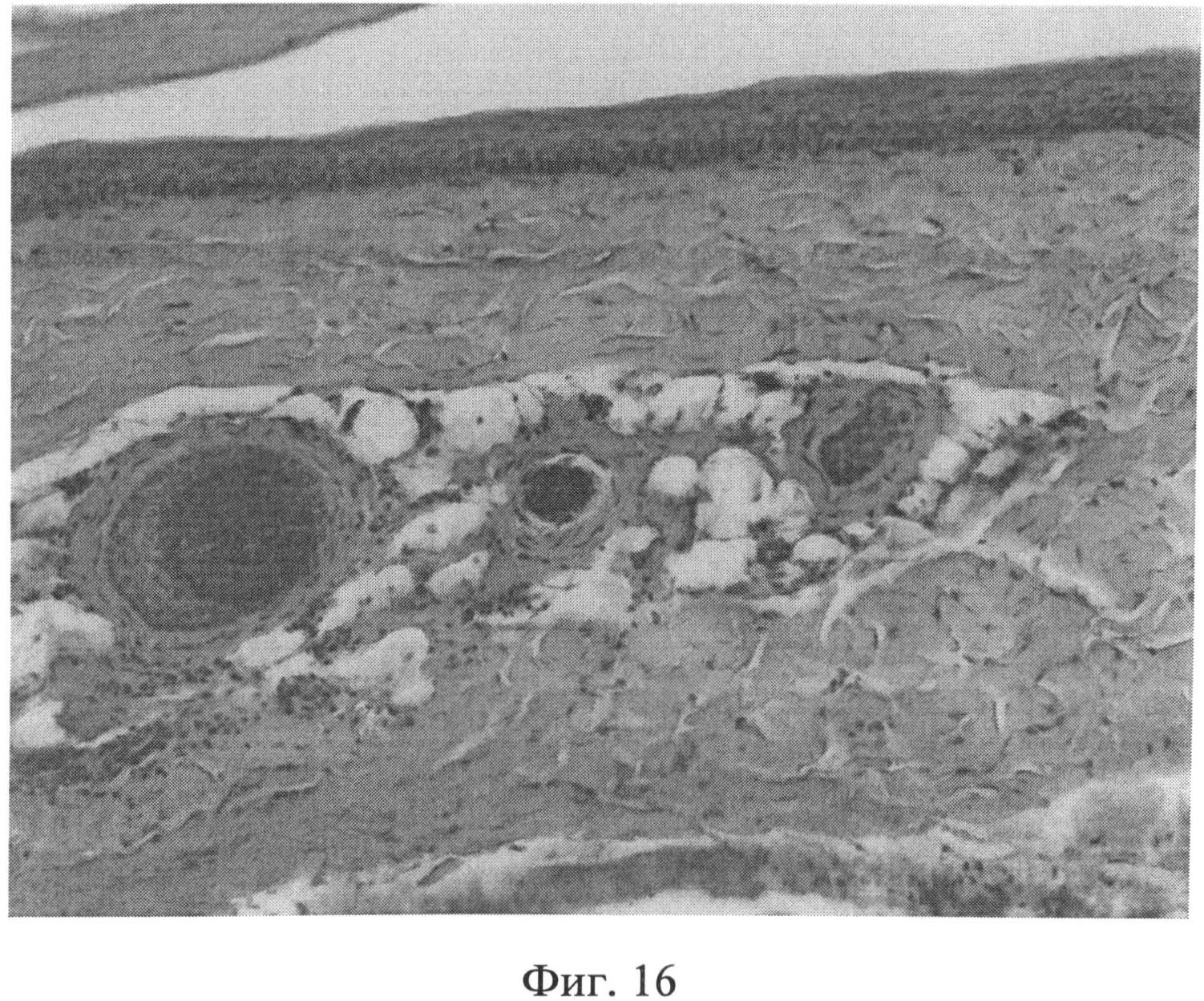
Фиг.16. Участок кожи интактного животного. Коллагеновые волокна интенсивно окрашиваются в ярко красный цвет, располагаются компактно. Окраска пикрофуксином по Ван Гизону. Ув.×100.
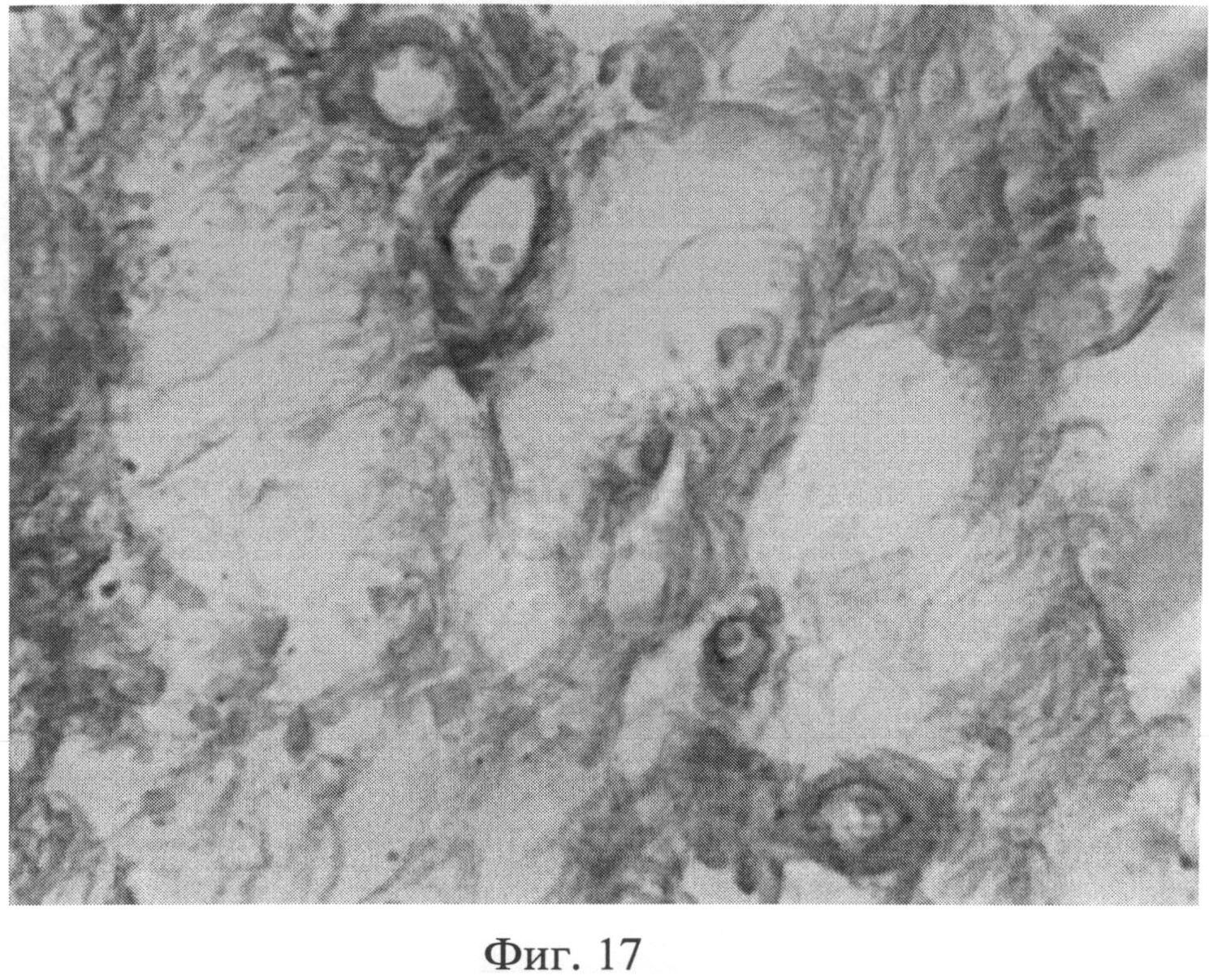
Фиг.17. Участок гиподермы интактного животного. Тучные клетки (интенсивно окрашенные клеточные элементы) выявляются в небольшом количестве и только рядом с кровеносными сосудами. Окраска альциановым синим при pH 1,25 с последующей докраской ядер кармалюмом Майера. Ув.×400.
Фигуры, иллюстрирующие изменения в коже при наличии ССДДИМП, вызванного ЛХВП:
Фиг.18. Нарушение компактного расположения коллагеновых волокон в сетчатом слое дермы через 1 месяц после создания очага персистирующей инфекции, в результате чего на срезах выявляются просветы между отдельно лежащими волокнами. Окраска пикрофуксином по Ван Гизону. Ув.×100.
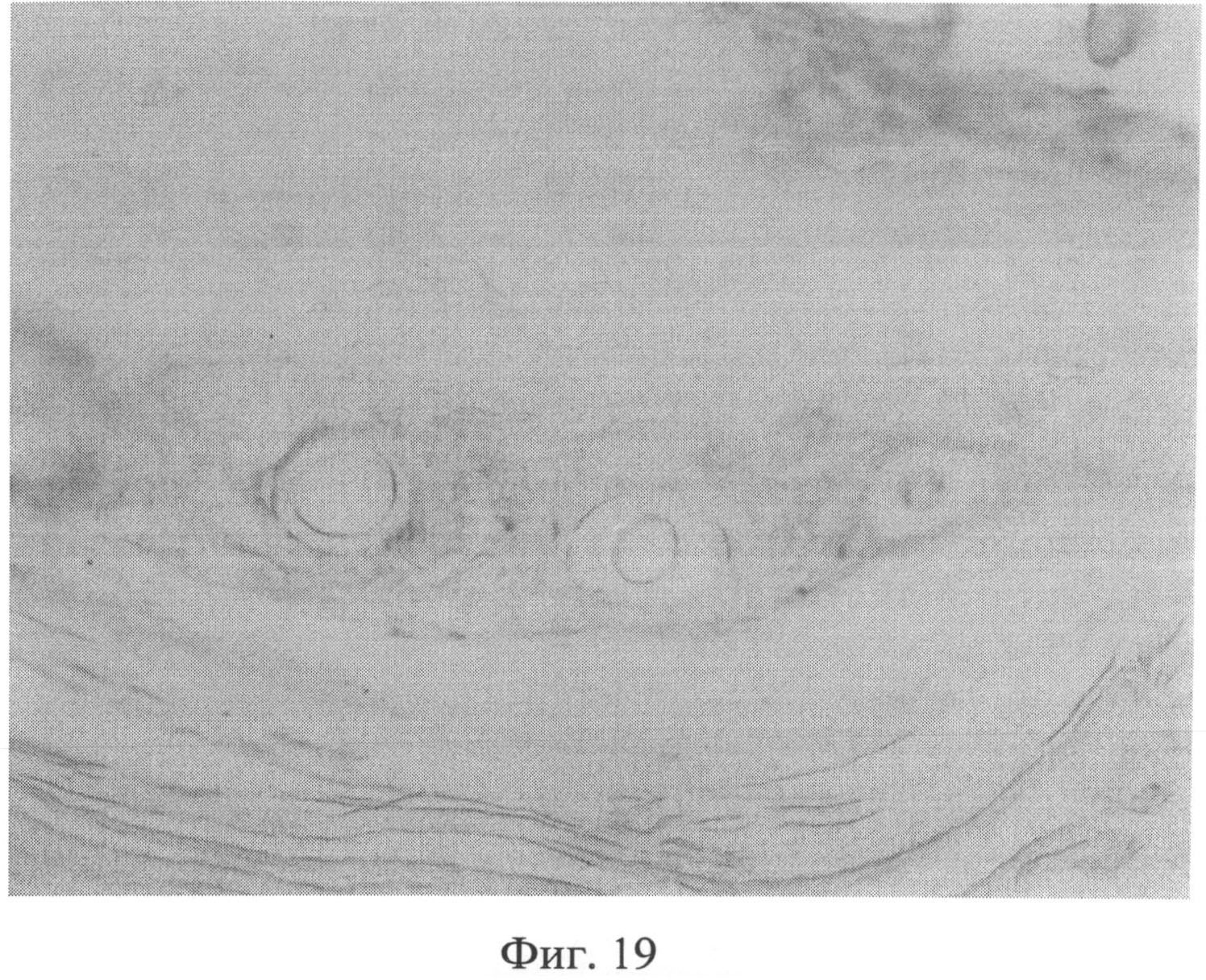
Фиг.19. Резкое снижение содержания сульфатированных гликозаминогликанов (СГАГ) в сетчатом слое дермы через 2 месяца после создания очага персистирующей инфекции. Незначительное количество СГАГ сохраняется лишь в области, прилежащей к волосяным фолликулам и сальным железам. Окраска альциановым синим при pH 1,0. Ув.×100.
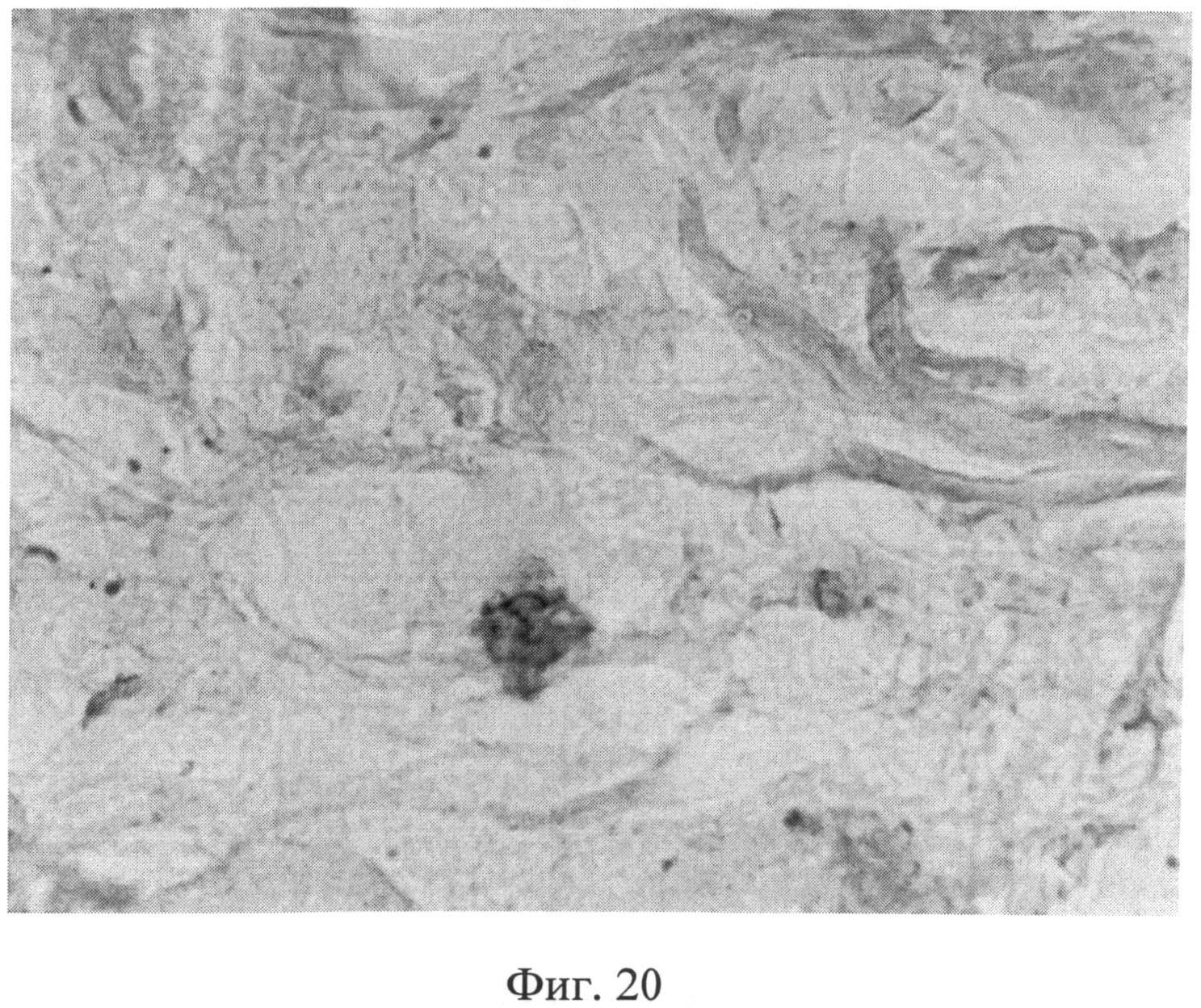
Фиг.20. Участок сетчатого слоя дермы крысы через 2 месяца после создания очага персистирующей инфекции. Клеточный элемент со специфической (темнокоричневой) окраской, свидетельствующей об усилении в нем экспрессии белка р53. Иммуногистохимический метод выявления белка р53. Ув.×400.
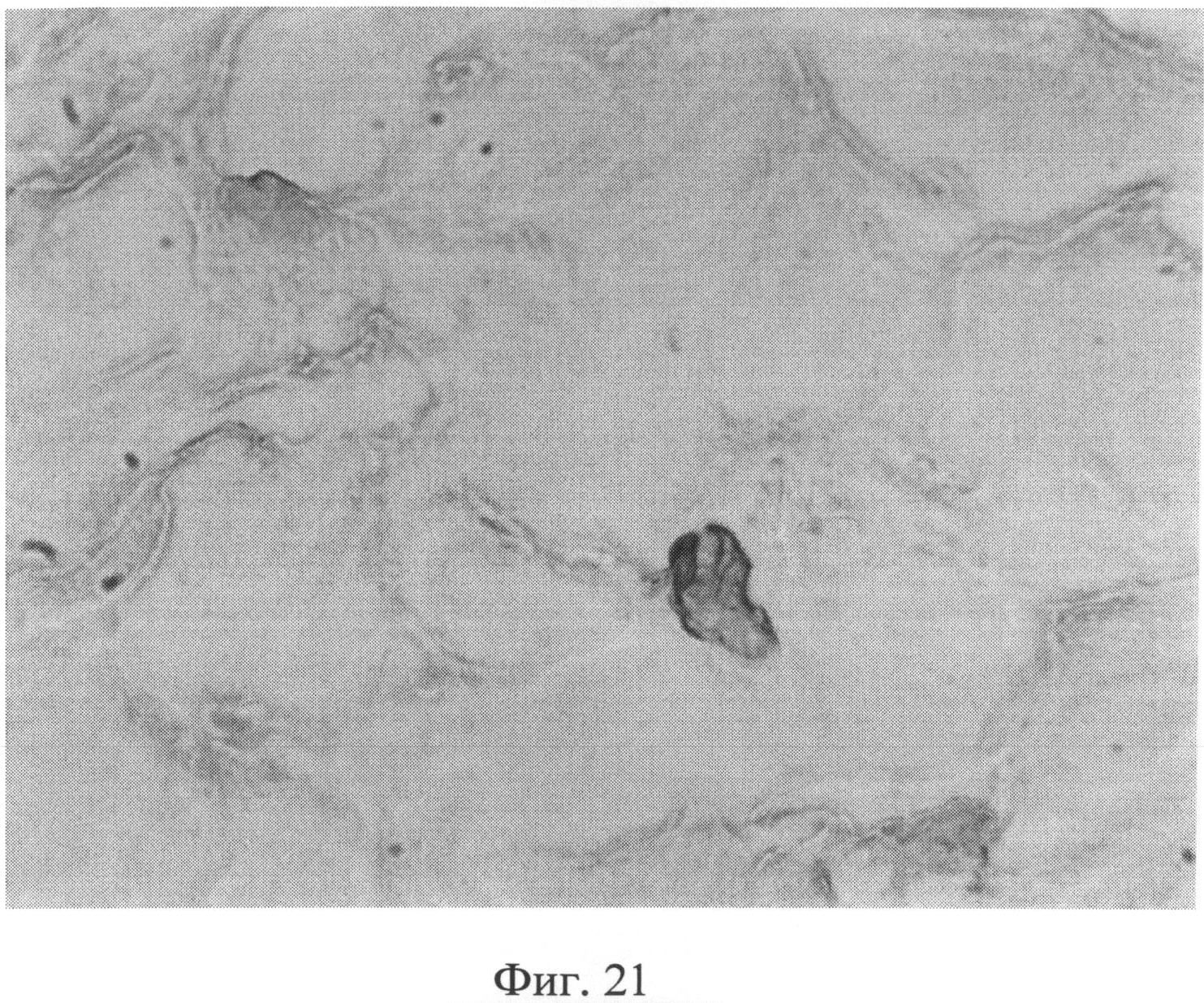
Фиг.21. Участок сетчатого слоя дермы крысы через 2 месяца после создания очага персистирующей инфекции. Клеточный элемент со специфической (темнокоричневой) окраской, свидетельствующей об усилении в нем экспрессии белка Bax. Иммуногистохимический метод выявления белка Bax. Ув.×400.
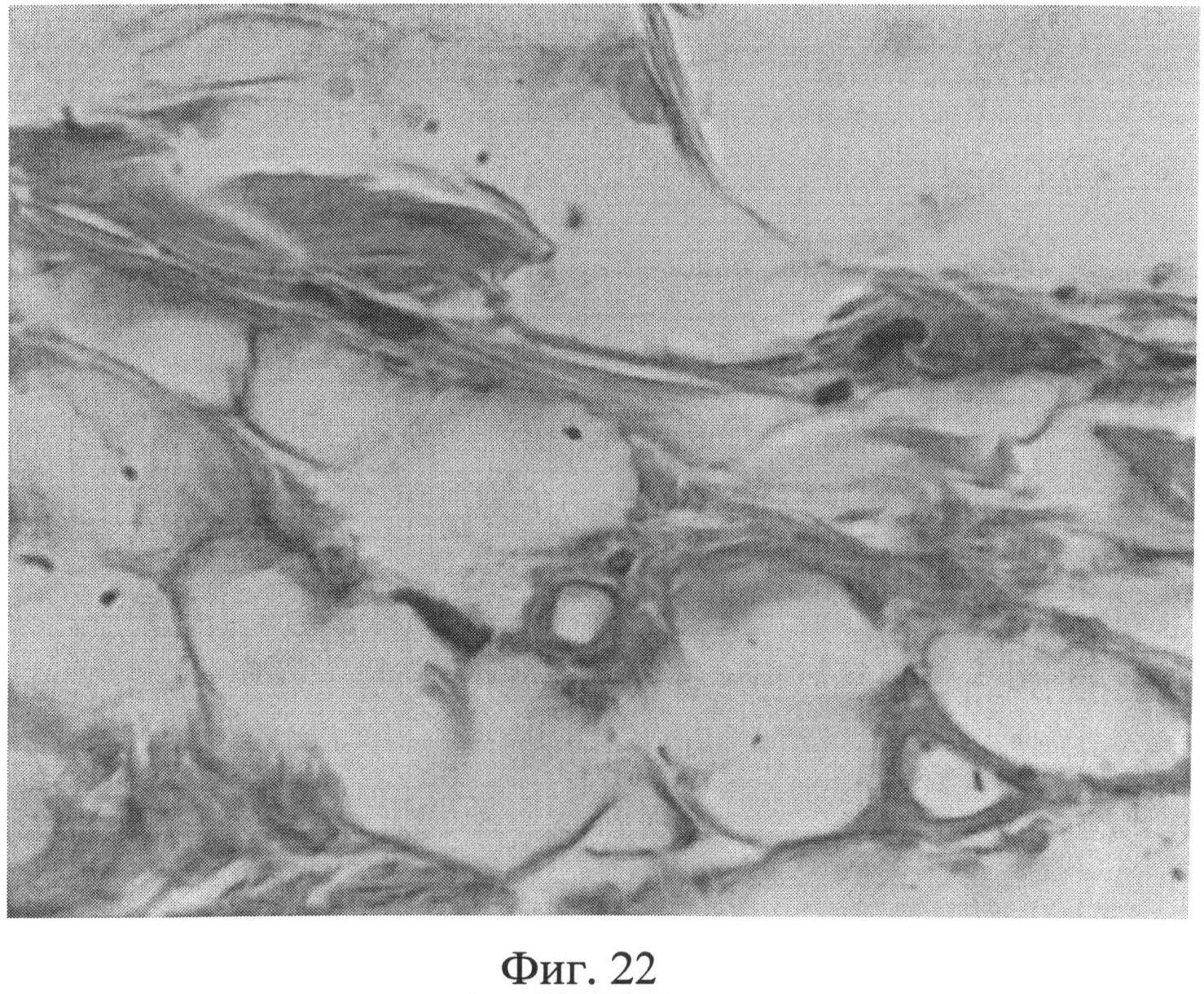
Фиг.22. Участок сетчатого слоя дермы крысы через 2 месяца после создания очага персистирующей инфекции. Отмечается повышение количества тучных клеток в гиподерме (интенсивно окрашенные клеточные элементы), располагающиеся не только в непосредственной близости от кровеносных сосудов, но и на значительном удалении от них. Окраска альциановым синим при pH 1,25 с последующей докраской ядер кармалюмом Майера. Ув.×400.
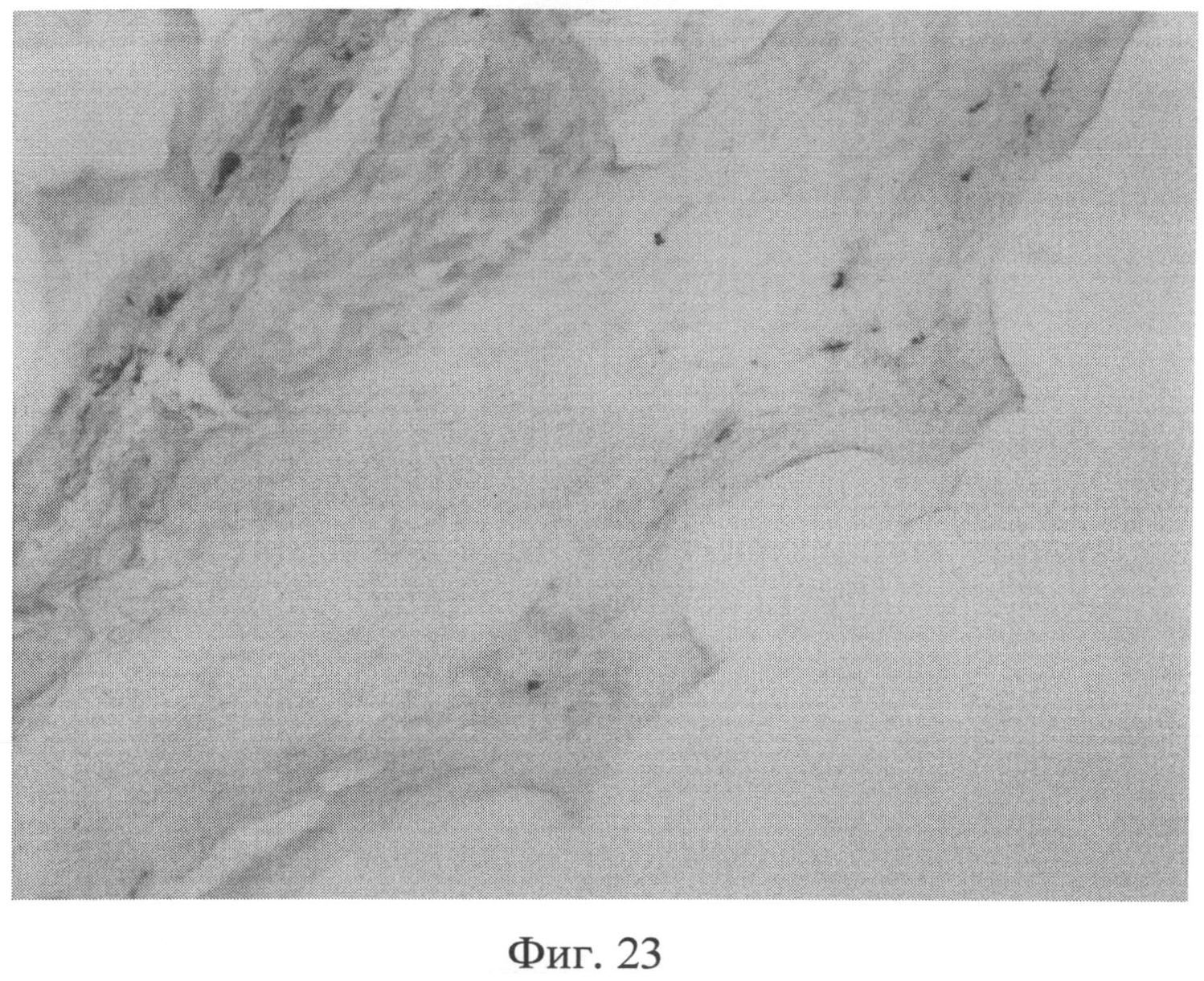
Фиг.23. Участок кожи крысы через 3 месяца после создания очага персистирующей инфекции. Резкое снижение сульфатированных гликозаминогликанов в сетчатом слое дермы, что приводит к тому, что данная область выглядит прозрачной. Появление тучных клеток в наружных слоях сетчатого слоя дермы (интенсивно окрашенные клеточные элементы), а также повышение их количества в гиподерме. Окраска альциановым синим при pH 1,0. Ув.×100.
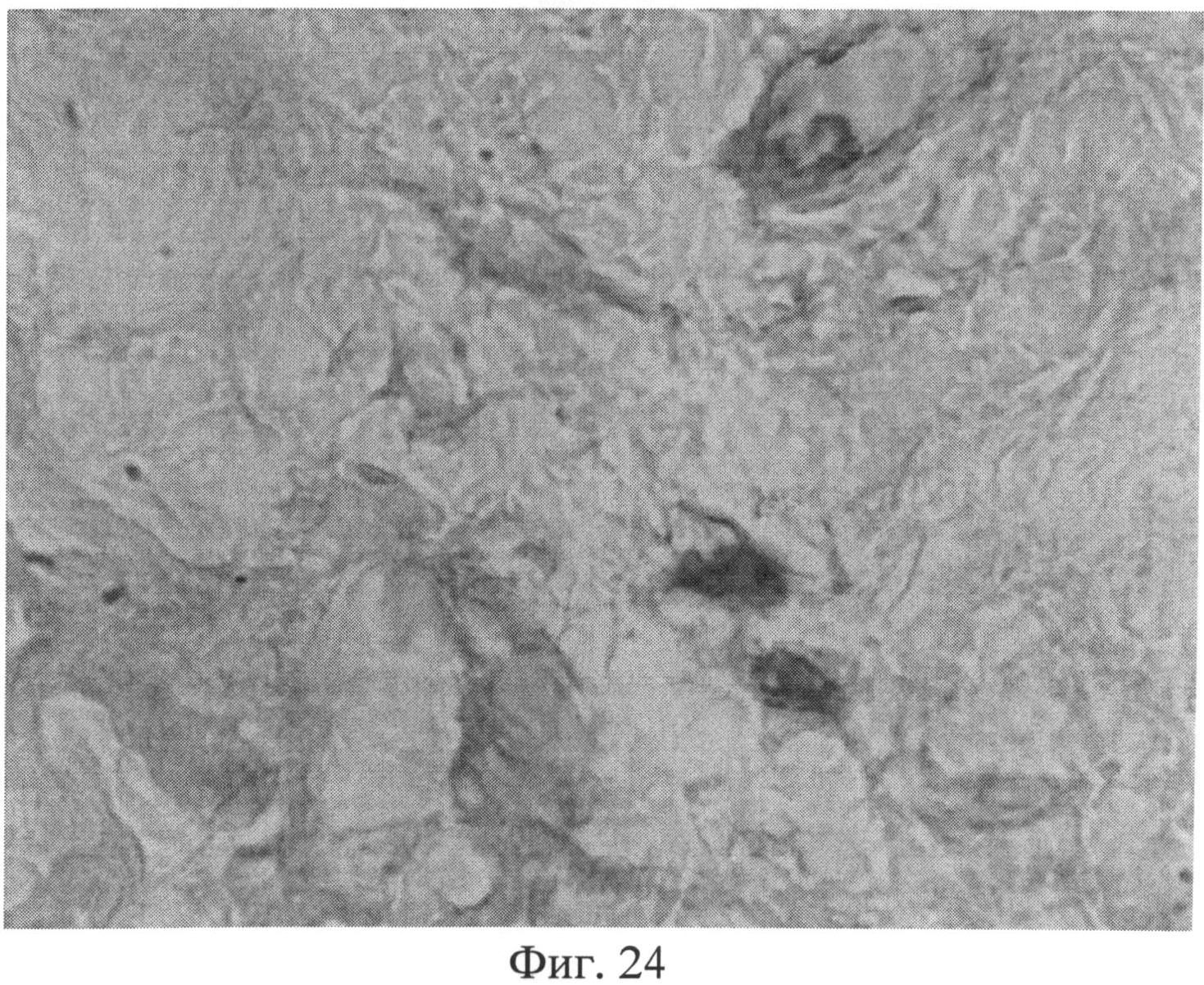
Фиг.24. Участок сетчатого слоя дермы крысы через 3 месяца после создания очага персистирующей инфекции. Клеточные элементы со специфической (темнокоричневой) окраской, свидетельствующей об усилении в них экспрессии белка р53. Иммуногистохимический метод выявления белка р53. Ув.×400.
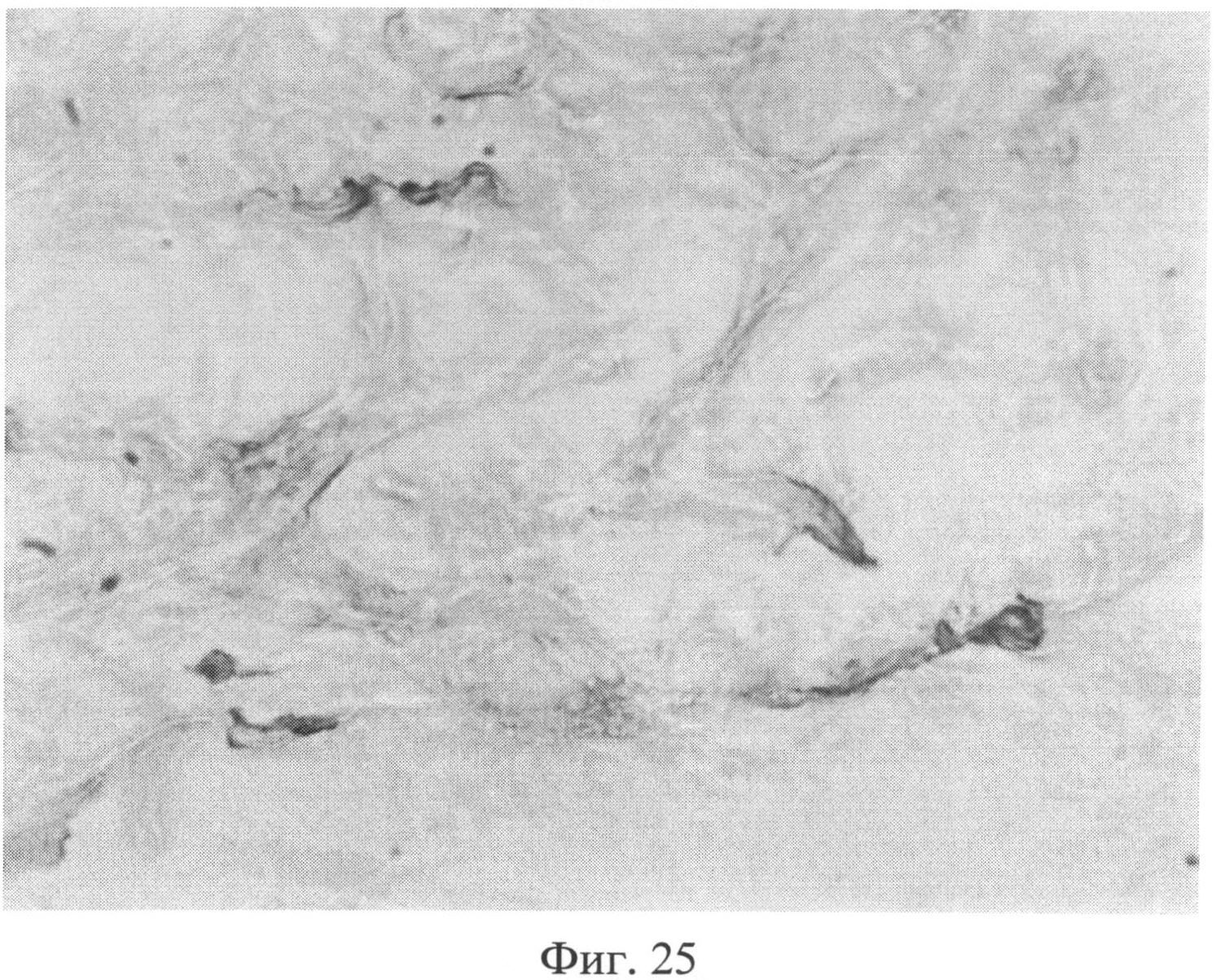
Фиг.25. Участок сетчатого слоя дермы крысы через 3 месяца после создания очага персистирующей инфекции. Клеточные элементы со специфической (темнокоричневой) окраской, свидетельствующей об усилении в них экспрессии белка Bax. Иммуногистохимический метод выявления белка Bax. Ув.×400.
Осуществление изобретения
Исследования были проведены на 24 половозрелых крысах-самцах Вистар. Все животные были разделены на 4 группы по 6 животных в каждой группе. В одной группе (четвертой) были интактные животные. У остальных животных с помощью Золотистого стафилококка (штамм 209) была воспроизведена адаптированная для мелких лабораторных животных модель вторичной дезорганизации соединительной ткани, которая отражает ССДДИМП при ЛХВП (Жураковский И.П., Рыжов А.И., Мичурина С.В. Способ моделирования вторичной дезорганизации соединительной ткани. Патент РФ на изобретение №2307397. Опубл в Бюл. №27 27.09.2007).
Животных выводили из эксперимента через 1 (группа 1), 2 (группа 2) и 3 (группа 3) месяца с момента создания очага бактериальной инфекции.
Материал (кожу, сухожилия мышц хвоста, межпозвоночные диски, печень) фиксировали в 12% формалине и жидкости Теллесницкого. Из залитых в парафин объектов делали серийные срезы толщиной 7 мкм. Состояние соединительной ткани оценивалось при обзорной микроскопии после окраски срезов гематоксилином Эрлиха и эозином. Коллагеновые волокна выявлялись пикрофуксином по Ван Гизону, сульфатированные гликозаминогликаны - альциановым синим при pH 1,0. Популяция тучных клеток оценивалась на препаратах, окрашенных альциановым синим при pH 1,25 с последующей докраской ядер кармалюмом Майера.
Для изучения экспрессии в фиброцитах кожи различных белков, принимающих участие в механизмах инициации и пролонгировании апоптотического процесса в клетках (Bax, р53), применяли двухэтапный Иммуногистохимический метод. Для иммуногистохимической окраски срезов использовали набор "Novocastra Peroxidase Detection System". Демаскировку антигенов проводили при инкубировании депарафинированных срезов в растворе тритона X100. Препараты последовательно инкубировали с «первыми антителами» к соответствующим маркерам, вторыми биотинилированными антителами, стрептавидин-пероксидазным комплексом и на конечном этапе окраски - в растворе диаминобензидина (DAB), содержащем H2O2. Зоны клеточных мембран или цитоплазмы, содержащие выявляемые антигены, окрашивались в «специфический» темно-коричневый цвет. Интенсивность такой окраски прямо пропорциональна количеству экспрессируемого маркера.
Исследование цитокинового профиля в сыворотке крови проводилось наборами реагентов производства ЗАО «Вектор Бест» (г.Новосибирск) для иммуноферментного определения концентрации цитокинов IL-1β, IL-1β RA, IL-2, IL-4, IL-6, IL-10, IL-17, IL-18, TNF-α, INF-γ с использованием Wellwasf 4 Mk2 фирмы Thermo scientific (Finland) и спектрофотометра Multiscan Spectmm фирмы Thermo scientific (Finland).
Статистическая обработка полученных в ходе исследования данных проводилась с использованием программного пакета SPSS v 13.0 for Windows. Для обработки полученных результатов применялись непараметрические критерии. Сравнение независимых групп проводили с использованием критерия Крускала-Уоллиса с последующим межгрупповым сравнением с помощью критерия Манна-Уитни. Различия между значениями сравниваемых параметров расценивались как статистически значимые при достижении уровня статистической значимости (p) менее чем 0,05 (p<0,05). Полученные в ходе исследования данные представлены в таблице, как средняя (М) ± стандартная ошибка средней (m).
Ниже приведены результаты изучения мезенхимальных производных (волокнистый хрящ межпозвоночных дисков, плотная волокнистая оформленная соединительная ткань сухожилий мышц хвоста, рыхлая волокнистая неоформленная соединительная ткань печени), которые отражают развитие ССДДИМП при ЛХВП и подтверждают его наличие через три месяца от момента создания очага бактериальной инфекции.
Волокнистый хрящ межпозвоночных дисков
При изучении межпозвоночных дисков у животных 1-й и 2-й групп, было установлено, что большинство из них по своему строению мало отличалось от контроля. Однако в некоторых случаях, в наружных пластинах фиброзного кольца межпозвоночных дисков определялись участки межклеточного вещества со сниженным количеством сульфатированных гликозаминогликанов. В этих случаях, при окраске альциановым синим при pH 1,0 с последующей докраской ядер кармалюмом Майера, сульфатированные гликозаминогликаны выявлялись в непосредственной близости от хондробластов (фиг.1). По мере отдаления от клеточных элементов наблюдалось прогрессирующее снижение интенсивности бирюзовой окраски и появление сродства межклеточного матрикса к дающему розовое окрашивание кармалюму Майера. Здесь же можно было видеть одиночные хондроциты, в которых, в результате значительной степени деформации и пикноза, ядра принимали необычную форму. В части клеток гранулы хроматина в ядрах выявлялись по периферии кариоплазмы, либо на одном из полюсов в виде небольшой гиперхромной частицы.
Возникшие на ранних этапах эксперимента под воздействием фокальной персистирующей инфекции дистрофические изменения в волокнистом хряще в дальнейшем характеризовались значительным нарастанием. Так, в препаратах третьей группы наряду с неизмененными, отмечались участки с нарушением расположения волокон. Значительно чаще, чем у животных предыдущих серий (1-й и 2-й групп), встречались дистрофически измененные клеточные элементы, ядра которых проявляли разную степень сродства к основному красителю (фиг.2). Нередко выявлялись обширные участки фиброзного кольца, лишенные сульфатированных гликозаминогликанов (фиг.3). Как правило, здесь же располагались крупные округлые клетки, нередко достигающие значительных размеров.
Таким образом, через три месяца наблюдаются необратимые дистрофически-дегенеративные изменения межпозвоночных дисков.
Плотная оформленная волокнистая соединительная ткань
При изучении плотной оформленной волокнистой соединительной ткани, представленной сухожилиями мышц хвоста, через 1 и 2 месяца после создания очага персистирующей инфекции большинство объектов по своему строению мало чем отличалось от контроля. Вместе с тем наблюдалось более компактное расположение коллагеновых волокон в пучках первого порядка. В связи с тем, что отдельные волокна не дифференцировались, пучки первого порядка выглядели более гомогенными, стекловидными, чем в группе интактных животных. Наряду с неизмененными фиброцитами можно было видеть одиночные клеточные элементы, ядра которых были гиперхромными (фиг.4).
Возникшие на ранних этапах эксперимента под воздействием фокальной персистирующей инфекции дистрофические изменения в плотной оформленной волокнистой соединительной ткани характеризовались дальнейшим нарастанием. Так, через 3 месяца после воспроизведения хронического остеомиелита, в отличие от предыдущих групп (1 и 2 месяца), встречались дистрофически измененные клеточные элементы, имеющие причудливую форму: округлые, треугольные, многогранные клетки, нередко увеличенные в размерах (фиг.5). В отличие от контроля кариоплазма фиброцитов проявляла неодинаковое сродство к основному красителю, в результате чего можно видеть как гипо-, так и гиперхромные ядра.
Таким образом, через три месяца наблюдаются дистрофически-дегенеративные изменения клеток и межклеточного вещества сухожилий мышц хвоста.
Паренхима и строма печени
При изучении срезов печени, окрашенных гематоксилином Эрлиха и эозином, через 1 и 2 месяца после воспроизведения очага хронической инфекции была выявлена следующая морфологическая картина. Отмечался полиморфизм гепатоцитов: часто встречались клеточные элементы, имеющие мелкие или, наоборот, крупные размеры, выявлялась разная степень конденсации хроматина, в ядрах отдельных клеточных элементов гранулы хроматина выявлялись нечетко, было нарушено его распределение. Встречались участки паренхимы с дистрофически измененными клеточными элементами. Цитоплазма таких гепатоцитов имела повышенное сродство к эозину, а ядра чаще были пикнотично изменены (фиг.6). Кроме того, отдельные гепатоциты были некротически изменены. В местах скопления дистрофически измененных гепатоцитов концентрировались лимфоидные элементы. В отдельных случаях формировались временные лимфоидные образования. Внутри печеночных долек отмечались участки как умеренного, так и значительного расширения синусоидных капилляров с соответствующими изменениями выстилающих их эндотелиоцитов. Последние часто были в значительной степени уплощены, их ядра были прижаты к базальной мембране, гиперхромны. В просвете синусоидных капилляров часто выявлялись множественные эритроцитарные агрегаты (фиг.7). Центральные вены в большинстве долек были расширены, иногда значительно. В части из них отмечался стаз. В области триад наблюдался отек, пространства Малла были расширены. Отдельные портальные тракты были инфильтрированы лимфогистиоцитарными элементами (фиг.8). На срезах, окрашенных альциановым синим при pH 1,25 с последующей докраской ядер кармалюмом Майера, отмечалось повышение количества тканевых базофилов (тучных клеток) в области портальных трактов (фиг.9).
Таким образом, в печени присутствуют морфологические признаки неспецифического реактивного гепатита (полиморфизм и дистрофия гепатоцитов, расширение сосудов, нарушение микроциркуляции, инфильтрация портальных трактов лимфогистиоцитарными элементами, присутствие тучных клеток в области портальных трактов).
При оценке препаратов печени через 3 месяца после воспроизведения очага хронической инфекции отмечалась следующая динамика. В дольках гепатоциты, принимающие участие в образовании печеночных балок, имели полиморфное строение: они были несколько увеличены в размерах или напротив уменьшены. Подавляющее большинство гепатоцитов интенсивно воспринимало эозин, и гранулярное строение их цитоплазмы не всегда было четко выражено. В ядрах гепатоцитов гранулы хроматина выявлялись нечетко, было несколько нарушено их распределение. В единичных клетках имели место нарушения кариолеммы. Отмечались явления кариорексиса и кариолизиса. При изучении разных участков печени было отмечено неодинаковое строение ядер гепатоцитов в дольках, которое касалось, прежде всего, содержания хроматина и характера распределения гранул в кариоплазме. Наблюдалось смещение гранул к кариолемме и снижение содержания гранул, центральные части таких ядер оказывались светлыми (пустыми). В балках синусоидные капилляры были значительно расширены, в их просвете часто выявлялись агрегаты эритроцитов. Синусоидные клетки, как правило, были укрупнены, их ядра несколько гиперхромны и пикнотизированы, цитоплазма часто содержала мелкие включения. Прослойки междольковой соединительной ткани вокруг триад выглядели увеличенными, разволокненными, пространства Малла были значительно расширены, отмечалась инфильтрация портальных трактов лимфогистиоцитарными элементами. В некоторых случаях воспалительный инфильтрат выходил из портальной стромы в периферические отделы дольки, нося дискретный характер (фиг.10). На срезах, окрашенных альциановым синим при pH 1,25 с последующей докраской ядер кармалюмом Майера, сохранялось возросшее количество тучных клеток в области триад (фиг.11). При изучении срезов печени, окрашенных пикрофуксином по Ван Гизону, было отмечено увеличение площади коллагеновых волокон межклеточного вещества соединительной ткани в области триад, образованных вокругдольковыми, междольковыми сосудами, а также в стенках и окружении центральных вен (фиг.12).
Полученные данные свидетельствуют о том, что в печени на данном сроке (3 месяца) наблюдается развитие фиброзных изменений на фоне неспецифического реактивного гепатита.
Таким образом, представленные выше данные (выраженные дистрофические изменения клеток и межклеточного вещества фиброзного кольца межпозвоночных дисков, умеренные изменения фиброцитов и коллагеновых волокон сухожилий хвостовых мышц, усиленный фиброгенез в печени на фоне неспецифического реактивного гепатита, развившиеся на фоне персистенции бактериальной инфекции) позволяют сделать вывод о наличии у животных третьей группы ССДДИМП при ЛХВП.
При морфологическом изучении препаратов кожи интактных животных отмечалось типичное для крыс строение эпидермиса, дермы и гиподермы. Фибробласты сетчатого слоя дермы было однородные, веретенообразной формы, хроматин располагался равномерно по кариоплазме. При иммуногистохимическом выявлении экспрессии белков р53 (фиг.13) и Bax (фиг.14) в этих клеточных элементах специфической (темнокоричневой) окраски не наблюдалось. При окраске альциановым синим при pH 1,0 сульфатированные гликозаминогликаны в сетчатом слое дермы распределялись равномерно, интенсивность их окрашивания была высокой (фиг.15). Коллагеновые волокна, при окраске пикрофуксином по Ван Гизону, интенсивно окрашивались в ярко красный цвет, располагались компактно (фиг.16). Тучные клетки (мастоциты) в наружных слоях дермы не выявлялись, в гиподерме их было умеренное количество, располагались мастоциты в непосредственной близости к кровеносным сосудам (фиг.17).
На фоне развития ССДДИМП при ЛХВП наблюдалась следующая динамика изменений клеток и межклеточного вещества в коже.
При изучении препаратов кожи крыс через месяц после создания очага персистирующей инфекции было отмечено, что большинство объектов по своему строению мало чем отличалось от контроля. Вместе с тем имело место нарушение компактного расположения коллагеновых волокон в сетчатом слое дермы, в результате чего на срезах выявлялись просветы между отдельно лежащими волокнами (фиг.18). Клеточные элементы имели обычную форму и размеры. Усиления экспрессии белков р53 и Bax в фиброцитах не наблюдалось. Количество тучных клеток не отличалось от контроля.
Морфологическое исследование препаратов кожи через 2 месяца после создания очага бактериальной инфекции позволило выявить в сетчатом слое дермы резкое снижение содержания сульфатированных гликозаминогликанов, которые сохранялись лишь в области, примыкающей к волосяным фолликулам и сальным железам (фиг.19). Также было отмечено сохраняющееся нарушение компактного расположения коллагеновых волокон. При иммуногистохимическом методе исследования в клеточных элементах сетчатого слоя дермы было выявлено усиление экспрессии белков как р53 (фиг.20), так и Bax (фиг 21), о чем свидетельствовало появление специфической темно-коричневой окраски в клеточных элементах.
В настоящее время установлен механизм, приводящий к апоптозу через конкурентное ингибирование Bcl-2, которое осуществляется путем регуляции через белок р53, замедляющий в нормальных клетках митотическую активность (Yu J. The transcriptional targets of р53 in apoptosis control / Yu J., Zhang L. // Biochem Biophys Res Commun. - 2005. - Vol.331. - P.851-858). Известно, что некоторые стимулы, например гипоксия, активируют ген р53, переводя клетку на апоптотический путь. Белок р53 - транскрипционный фактор, регулирующий клеточный цикл, задерживает клетку в фазе G1/S клеточного цикла (через репрессию генов, регулирующих транскрипцию), чтобы дать время для работы репаративных систем. На уровне транскрипции транскрипционный фактор р53 регулирует экспрессию генов, участвующих в блокаде клеточного цикла, а также взаимодействует либо с комплексами, определяющими синтез и репарацию ДНК, либо с белками, модулирующими апоптоз. Если повреждение ликвидировать не удается, то р53 запускает апоптоз (Harris S.L. The р53 pathway: positive and negative feedback loops / Harris S.L., Levine A.J. // Oncogene. - 2005. - Vol.24. - P.2899-2908; Akhtar RS, Geng Y, Klocke BJ, Roth KA. Neural precursor cells possess multiple p53-dependent apoptotic pathways // Cell Death Differ. 2006 Oct; 13(10):1727-39; Schuler M., Green D.R. Transcription, apoptosis and p53: Catch-22 // Trends Genet. - 2005. - Vol.21. - P.182-187). Происходит это через инактивирование Bcl-2 при связывании с белком Bax. Одновременное увеличение экспрессии белков р53 и Bax свидетельствует о вовлечении части фибробластов сетчатого слоя дермы в процесс апоптоза клеток.
На срезах, окрашенных альциановым синим при pH 1,25 с последующей докраской ядер кармалюмом Майера, отмечалось повышение количества тканевых базофилов (тучных клеток) в гиподерме (фиг.22).
Изучение кожи животных через 3 месяца с момента создания очага бактериальной инфекции позволило выявить нарастание признаков, свидетельствующих о развитии системной реакции соединительной ткани, обусловленной развитием ССДДИМП при ЛХВП. Так, на срезах, окрашенных альциановым синим при pH 1,0, выявлялось резкое снижение сульфатированных гликозаминогликанов в сетчатом слое дермы. Это приводило к тому, что данная область оказывалась прозрачной (фиг.23), и лишь зоны, примыкающие к волосяным фолликулам и сальным железам, оказывались окрашенными в слабо бирюзовый цвет. При окраске по Ван Гизону было обращено внимание не только на сохранение нарушения компактного расположения коллагеновых волокон, но и на изменение их тинкториальных свойств (наблюдалось смещение типичной ярко красной окраски в оранжевую часть спектра), что отражало преобладание старых коллагеновых волокон над молодыми, вследствие нарушения синтеза последних. Изучение препаратов кожи при окраске на белки р53 (фиг.24) и Bax (фиг.25) позволило выявить дальнейшее увеличение количества клеточных элементов, экспрессирующих эти маркеры, по сравнению с предыдущими группами (1 и 2 месяца).
На срезах, окрашенных альциановым синим, отмечалось как появление тучных клеток в наружных слоях сетчатого слоя дермы (фиг.23), так и повышение их количества в гиподерме. Данные изменения сочетались с увеличением толщины гиподермы преимущественно за счет развития рыхлой волокнистой соединительной ткани.
Следует сказать, что изменения в мезенхимальных производных (межпозвоночных дисках, сухожилиях, строме печени) через 3 месяца являются необратимыми и приобретают характер конкретных нозологических единиц.
Изменения в коже, характерные для реакции соединительной ткани при ССДДИМП при ЛХВП, появляются уже через 2 месяца от воспроизведения очага хронического воспаления, вследствие чего эти изменения можно использовать в качестве прогностических признаков развития ССДДИМП при ЛХВП.
Описанные выше изменения кожи у животных с воспроизведенной моделью вторичной дезорганизации соединительной ткани происходят на фоне повышенной реактивности гуморального звена иммунной защиты (повышение про- и противовоспалительных цитокинов) (таблица 1). Это является отражением хронического воспалительного процесса, вызванного персистенцией бактериальной инфекции.
|
Таким образом, для наличия системной реакции соединительной ткани, обусловленной развитием ССДДИМП при ЛХВП, наряду с изменениями волокнистого хряща (межпозвоночные диски), плотной (сухожилия) и рыхлой волокнистой соединительной ткани (строма паренхиматозных органов), наблюдаемыми на фоне неспецифических признаков хронического воспаления (в частности повышении концентрации в сыворотке крови про- и противовоспалительных цитокинов), являются характерными изменения в коже, которые могут служить в качестве диагностических признаков наличия ССДДИМП при ЛХВП:
1. резкое снижение содержания сульфатированных гликозаминогликанов (СГАГ) в сетчатом слое дермы (СГАГ выявляются только в области волосяных фолликулов и сальных желез; в норме они распределяются равномерно),
2. проапоптотические изменения клеточных элементов сетчатого слоя дермы (например, появление в нем фибробластов, экспрессирующих белки р53 и Bax).
Указанные проапопточеские изменения могут быть выявлены также по появлению экспрессируемых фибробластами белков Bad, Bik и Bak, Bax, Bcl-xs, каспаз (каспазы-3, каспазы-6 или каспазы-7).
О связи проапопточеских изменений с данными белками свидетельствуют следующие источники информации:
- о связи белков Bad, Bik и Bak с индукцией апоптоза: Urnowey S., Ansai T., Bitko V., Nakayama K., Takehara T., Barik S. Temporal activation of anti- and pro-apoptotic factors in human gingival fibroblasts infected with the periodontal pathogen, Porphyromonas gingivalis: potential role of bacterial proteases in host signaling // BMC Microbiol. - 2006. - №6. - P.26; Ceryak S., Zingariello C., O'Brien T., Patiemo S.R. Induction of pro-apoptotic and cell cycle-inhibiting genes in chromium (VI)-treated human lung fibroblasts: lack of effect of ERK // Mol. Cell Biochem. - 2004. - Vol.255. - №1. - P.139-149;
- о связи повышенной экспрессии белков группы Bax, Bik, Bcl-xs с высокой вероятностью индукции апоптоза в клетках различного гистогенеза: Santos-Beneit A. and Mollinedo F. Expression of genes involved in initiation, regulation, and execution of apoptosis in human neutrophils and during neutrophil differentiation of HL-60 cells // J. Leukocyte Biol. - 2000. - Vol.67. - P.712-724; Yu Hsu S., Kaipia A., E. Mcgee, Lomeli M., Hsuen A. Bok is a pro-apoptotic Bcl-2 protein with restricted expression in reproductive tissues and heterodimerizes with selective anti-apoptotic Bcl-2 family members // Proc. Natl. Acad. Sci. - Vol.94. - P.12401-12406; Alt A. Molecular Mechanisms of Apoptosis. Brief Review // Eur. Asian. J. BioMed. - 2008. - Vol.1. - No.5. - P.19-23;
- о том, что накопление в клетках одной из активированных эффекторных каспаз (каспазы-3, каспазы-6 или каспазы-7), расщепляющих различные клеточные белки, сопровождается последующими апоптотическими изменениями в клетках: Kurokawa M., Kombluth S. Caspases and kinases in a death grip // Cell. - 2009. - Vol.138. - №5. - P.838-854; Pradelli L.A., Beneteau M., Ricci J.E. Mitochondrial control of caspase-dependent and -independent cell death // Cell. Mol. Life Sci. - 2010. - Vol.67. - №10. - P.1589-1597;
3. появление тучных клеток в наружных слоях сетчатого слоя дермы,
4. нарушение компактного расположения коллагеновых волокон (появление просветов между волокнами) и изменение их тинкториальных свойств (смещение цвета окраски из характерного для нормы ярко-красного в желто-оранжевый спектр),
5. рекрутизация в гиподерму тучных клеток, которые выявляются не только в непосредственной близости к кровеносным сосудам (как в норме), но и на значительном отдалении от них, т.е. по всей гиподерме.
Данные признаки могут служить для дифференциальной диагностики между заболеваниями соединительной ткани, имеющими наследственную или инволюционную этиологию, и состояниями, обусловленными системной реакцией соединительной ткани на фоне развития синдрома дистрофически-дегенеративных изменений мезенхимальных производных при локальном хроническом воспалительном процессе.