Результат интеллектуальной деятельности: ТИА(ДИА)ЗОЛЫ КАК БЫСТРО ДИССОЦИИРУЮЩИЕ АНТАГОНИСТЫ РЕЦЕПТОРА ДОПАМИНА 2
Вид РИД
Изобретение
Область техники, к которой относится изобретение
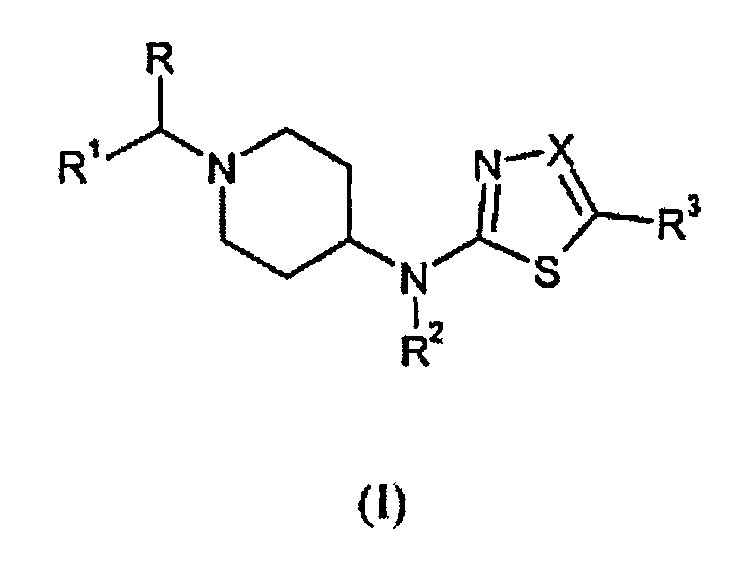
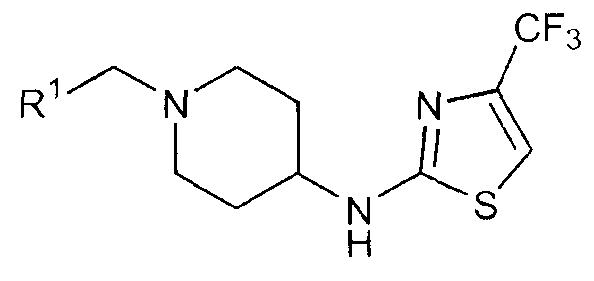
Изобретение относится к производным [1-(бензил)пиперидин-4-ил]-([1,3,4]тиадиазол-2-ил)амина и [1-(бензил)пиперидин-4-ил]-(тиазол-2-ил)амина формулы (I), которые представляют собой быстро диссоциирующие антагонисты рецепторов допамина 2, к способам получения указанных соединений и к фармацевтическим композициям, содержащим такие соединения в качестве активного ингредиента. Эти соединения можно использовать в качестве лекарственных средств для лечения или профилактики заболеваний центральной нервной системы, например, шизофрении, поскольку они оказывают антипсихотический эффект без побочных моторных эффектов.
Описание изобретения
Шизофрения представляет собой тяжелое хроническое заболевание психики, которое поражает приблизительно 1% населения. Клинические симптомы появляются в относительно раннем возрасте, как правило, у подростков или молодых людей. Симптомы шизофрении принято подразделять на так называемые позитивные, которые включают галлюцинации, бред и дезорганизованное мышление, и так называемые негативные, которые включают социальную самоизоляцию, обеднение эмоций, скупость речи и неспособность испытывать удовольствие. Кроме того, больные шизофренией страдают когнитивными нарушениями, такими как расстройство внимания и памяти. Этиология этого заболевания до сих пор неизвестна, однако существует предположение, что симптомы шизофрении могут быть связаны с нарушением функционирования нейромедиаторов. Допаминергическая гипотеза, являющаяся одной из наиболее распространенных, заключается в том, что позитивные симптомы, наблюдаемые у больных шизофренией, обусловлены повышенной активностью допаминовой передачи. Данная гипотеза основана на том, что лекарственные средства, усиливающие действие допамина, например, амфетамин или кокаин, могут индуцировать психоз, а также на корреляции клинических доз антипсихотических средств с их способностью блокировать рецепторы допамина D2. Терапевтическое действие всех присутствующих на рынке антипсихотических средств в отношении позитивных симптомов шизофрении опосредовано блокированием рецептора допамина D2. Помимо клинического действия основные побочные эффекты антипсихотических средств, например, экстрапирамидальные симптомы (EPS) и поздняя дискинезия, также связаны с антагонизмом в отношении допамина. Такие ослабляющие больных побочные эффекты чаще всего проявляются при использовании типичных антипсихотических средств, или антипсихотических средств первого поколения (например, галоперидола). Они выражены в меньшей степени при использовании атипичных антипсихотических средств, или антипсихотических средств второго поколения (например, рисперидона, оланзапина), и даже практически отсутствуют при лечении клозапином, который принято считать прототипом атипичных антипсихотических средств. Среди разных теорий, предложенных для объяснения пониженной встречаемости EPS при лечении атипичными антипсихотическими средствами, в течение последних пятнадцати лет большое внимание уделяется мультирецепторной гипотезе. Она основана на результатах исследований по рецепторному связыванию, демонстрирующих, что многие атипичные антипсихотические средства помимо рецепторов допамина D2 взаимодействуют с другими рецепторами нейромедиаторов, особенно с рецепторами серотонина 5-НТ2, тогда как типичные антипсихотические средства, такие как галоперидол, более избирательно связываются с рецепторами D2. В последние годы эта теория поставлена под сомнение, поскольку все основные атипичные антипсихотические средства в клинически приемлемых дозах полностью занимают рецепторы серотонина 5-НТ2, но все-таки отличаются друг от друга по индуцированию побочных моторных эффектов. В качестве альтернативы мультирецепторной гипотезе Kapur и Seeman ("Does fast dissociation from the dopamine D2 receptor explain the action of atypical antipsychotics?: A new hypothesis", Am. J. Psychiatry 2001, 158:3 p.360-369) выдвигают предположение, что атипичные антипсихотические средства можно отличить от типичных антипсихотических средств по скорости, с которой они отсоединяются от рецепторов допамина D2. Быстрая диссоциация комплексов с рецептором D2 делает антипсихотические средства более приспособленными для физиологической допаминовой передачи, то есть, позволяет реализовать антипсихотический эффект без побочных моторных эффектов. Эта гипотеза выглядит особенно убедительно в случае клозапина и кветиапина. Эти лекарственные средства характеризуются самой высокой скоростью диссоциации комплексов с рецепторами допамина D2 и самым низким риском индуцирования EPS у человека. И наоборот, типичные антипсихотические средства, характеризующиеся высокой частотой EPS, являются наиболее медленно диссоциирующими антагонистами рецептора допамина D2. Следовательно, идентификация новых лекарственных средств на основе скорости диссоциации их комплекса с рецептором D2 является эффективной стратегией создания новых атипичных антипсихотических средств. Дополнительной задачей является сочетание способности к быстрой диссоциации с избирательностью в отношении рецепторов D2. Считается, что многорецепторный профиль современных атипичных антипсихотических средств служит причиной других побочных эффектов, таких как увеличение массы и развитие сахарного диабета. Такой подход, как поиск селективных антагонистов D2, некоторое время игнорировался, однако авторы изобретения полагают, что применение в клинике более селективных соединений может уменьшить встречаемость метаболических нарушений, связанных с используемыми в настоящее время атипичными антипсихотическими лекарственными средствами.
Целью настоящего изобретения является предоставление новых соединений, представляющих собой быстро диссоциирующие антагонисты рецептора допамина D2, которые характеризуются благоприятным фармакологическим профилем, как описано выше, в особенности, уменьшением побочных моторных эффектов и умеренными или пренебрежимо малыми взаимодействиями с другими рецепторами, что приводит к низкому риску развития метаболических нарушений.
Указанная цель достигается новыми соединениями настоящего изобретения, которые соответствуют формуле (I):
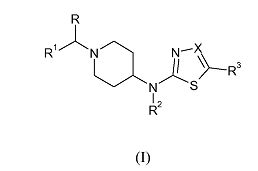
их фармацевтически приемлемыми солями, гидратами и сольватами, а также стереоизомерными формами, где
R обозначает водород или C1-6алкил;
R1 обозначает фенил; фенил, замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, включающей галоген, циано, С1-4алкил, С1-4алкокси, перфторС1-4алкил и перфторС1-4алкокси; тиенил; тиенил, замещенный 1 или 2 заместителями, выбранными из группы, включающей галоген и
С1-4алкил; С1-4алкил или С1-4алкил, замещенный гидроксилом,
С3-8циклоалкилом или C5-7циклоалкенилом;
R2 обозначает водород или C1-6алкил;
R3 обозначает водород, трифторметил или циано; и
Х обозначает N или CR4, где R4 обозначает водород, трифторметил или циано.
Соединения настоящего изобретения представляют собой быстро диссоциирующие антагонисты рецептора D2. Данное свойство делает соединения настоящего изобретения особенно пригодными для применения в качестве лекарственного средства для лечения или профилактики шизофрении, шизофреноподобного расстройства, шизоаффективного расстройства, бредового расстройства, короткого психотического расстройства, индуцированного психотического расстройства, психотического расстройства вследствие общего состояния здоровья, психотического расстройства, индуцированного веществами, недифференцированного психотического расстройства, психоза, связанного с деменцией, большого депрессивного расстройства, дистимического расстройства, предменструального дисфорического расстройства, недифференцированного депрессивного расстройства, биполярного расстройства I, биполярного расстройства II, циклотимического расстройства, недифференцированного биполярного расстройства, расстройства настроения вследствие общего состояния здоровья, расстройства настроения, индуцированного веществами, недифференцированного расстройства настроения, генерализованного тревожного расстройства, обсессивно-компульсивного расстройства, панического расстройства, острого стрессового расстройства, посттравматического стрессового расстройства, умственной отсталости, общих расстройств психического развития, синдрома дефицита внимания, синдрома дефицита внимания и гиперактивности, синдрома агрессивного поведения, параноидных расстройств личности, шизоидных расстройств личности, шизотипических расстройств личности, тиковых расстройств, синдрома Туретта, зависимости от веществ, злоупотребления веществами, синдрома отмены веществ, трихотилломании.
Опытный специалист может выбрать соединения на основе экспериментальных данных, приведенных ниже в экспериментальной части. Все выбранные соединения входят в объем настоящего изобретения.
К первой группе относятся соединения формулы (I) и их стереоизомерные формы, в которых
R обозначает водород;
R1 обозначает фенил; фенил, замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, включающей водород, галоген, циано, C1-4алкил, C1-4алкилокси, перфторC1-4алкил и трифторметокси; тиенил; тиенил, замещенный 1 или 2 заместителями, выбранными из группы, включающей галоген и C1-4алкил; C1-4алкил; C1-4алкил, замещенный гидроксилом,
C3-8циклоалкилом или C5-7циклоалкенилом;
R2 обозначает водород или метил;
X обозначает азот и
R3 обозначает трифторметил.
Ко второй группе относятся соединения формулы (I) и их стереоизомерные формы, в которых
R обозначает водород;
R1 обозначает фенил; фенил, замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, включающей водород, галоген, циано, C1-4алкил, C1-4алкилокси, перфторC1-4алкил и трифторметокси; тиенил; тиенил, замещенный 1 или 2 заместителями, выбранными из группы, включающей галоген и C1-4алкил; C1-4алкил или C1-4алкил, замещенный гидроксилом,
C3-8циклоалкилом или C5-7циклоалкенилом;
R2 обозначает водород или метил;
X обозначает азот и
R3 обозначает циано.
К третьей группе относятся соединения формулы (I) и их стереоизомерные формы, в которых
R обозначает водород;
R1 обозначает фенил; фенил, замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, включающей водород, галоген, циано, C1-4алкил, C1-4алкилокси, перфторC1-4алкил и трифторметокси; тиенил; тиенил, замещенный 1 или 2 заместителями, выбранными из группы, включающей галоген и C1-4алкил; C1-4алкил или C1-4алкил, замещенный гидроксилом,
C3-8циклоалкилом или C5-7циклоалкенилом;
R2 обозначает водород или метил;
R3 обозначает водород; и
X обозначает CR4, где R4 обозначает трифторметил.
Среди соединений формулы (I) и их стереоизомерных форм наибольший интерес представляют, например:
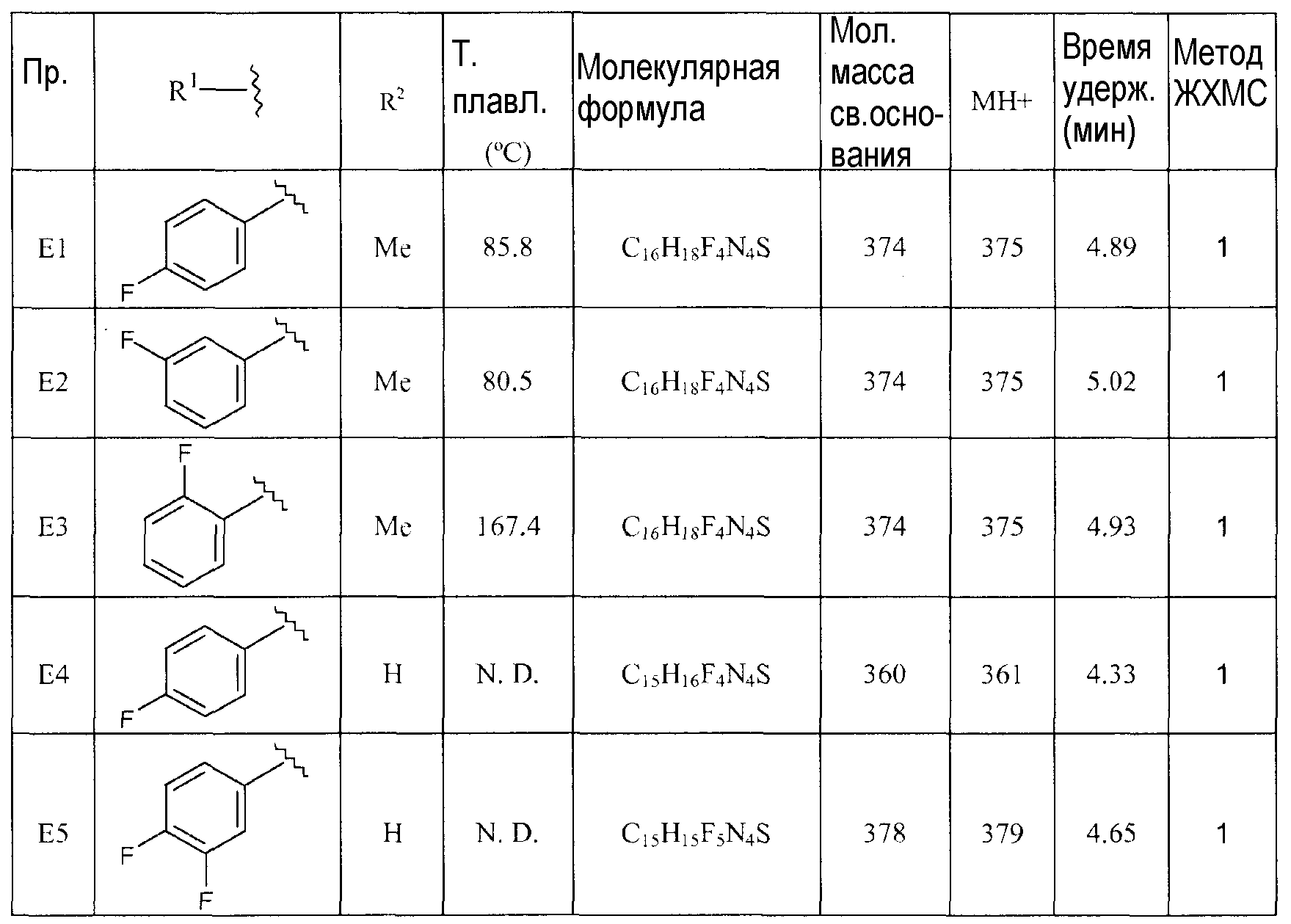
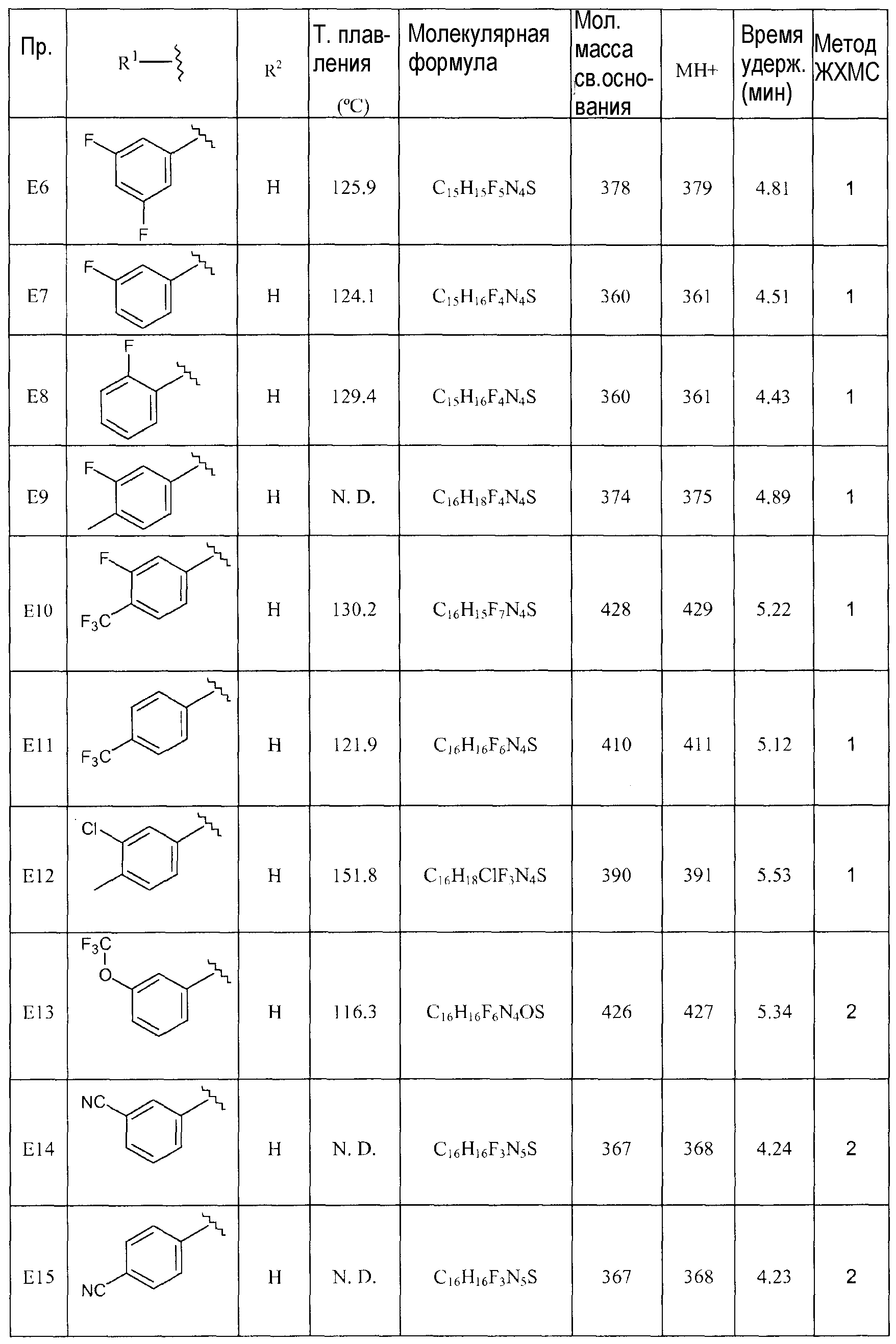
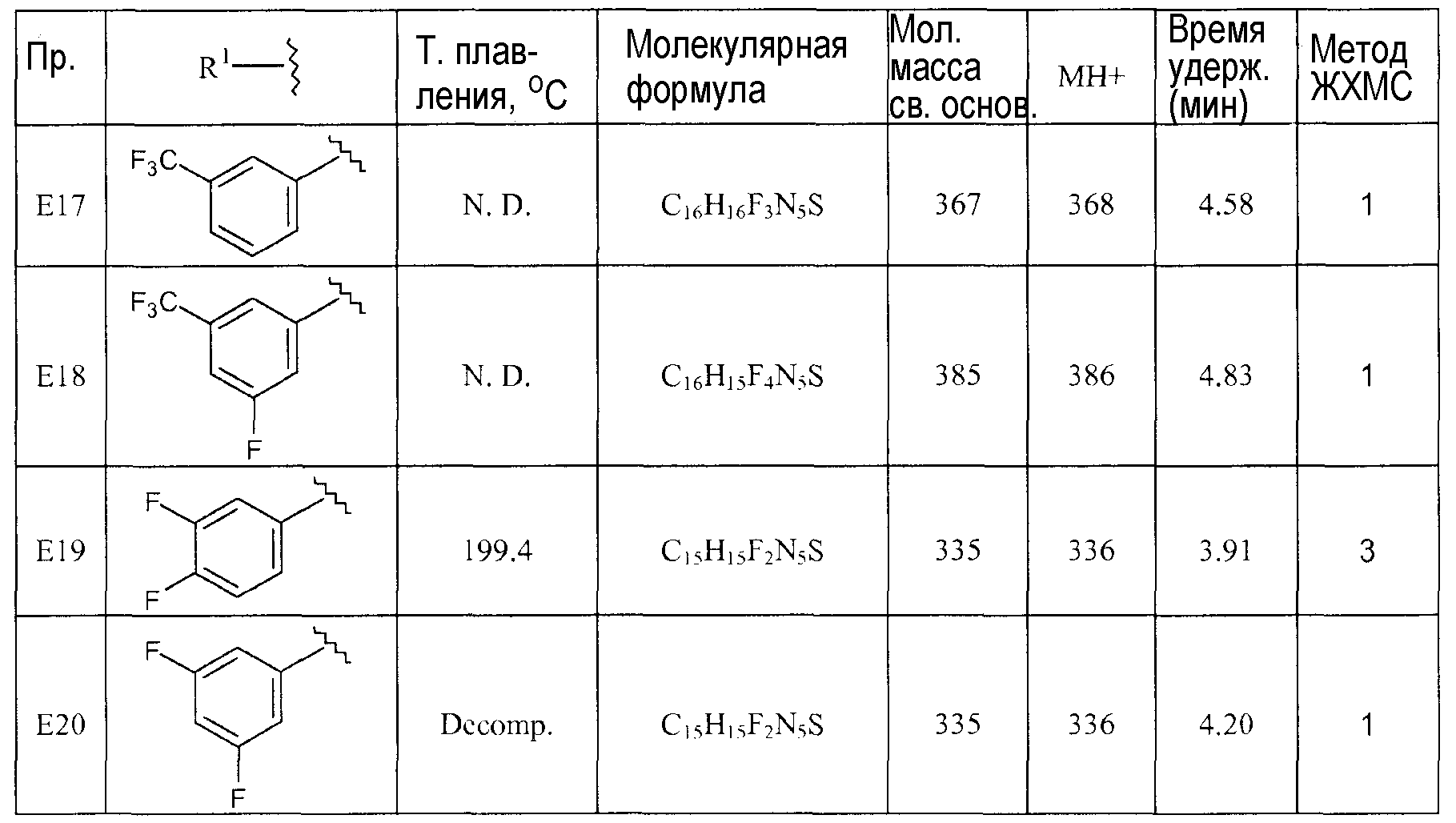
[1-(4-Фторбензил)пиперидин-4-ил]-метил-(5-трифторметил-[1,3,4]тиадиазол-2-ил)амин (E1),
[1-(3-Фторбензил)пиперидин-4-ил]-метил-(5-трифторметил-[1,3,4]тиадиазол-2-ил)амин (E2),
[1-(4-Фторбензил)пиперидин-4-ил]-(5-трифторметил-[1,3,4]тиадиазол-2-ил)амин (E4),
[1-(3,4-Дифторбензил)пиперидин-4-ил]-(5-трифторметил-[1,3,4]тиадиазол-2-ил)амин (E5),
[1-(3-Фтор-4-метилбензил)пиперидин-4-ил]-(5-трифторметил-[1,3,4]тиадиазол-2-ил)амин (E9),
[1-(3-Фтор-4-трифторметилбензил)пиперидин-4-ил]-(5-трифторметил-[1,3,4]тиадиазол-2-ил)амин (E10),
[1-(3-Трифторметоксибензил)пиперидин-4-ил]-(5-трифторметил-[1,3,4]тиадиазол-2-ил)амин (E13),
5-[1-(3-Трифторметилбензил)пиперидин-4-иламино]-[1,3,4]тиадиазол-2-карбонитрил (E17),
5-[1-(3-Фтор-5-трифторметилбензил)пиперидин-4-иламино]-[1,3,4]тиадиазол-2-карбонитрил (E18),
5-[1-(3,4-Дифторбензил)пиперидин-4-иламино]-[1,3,4]тиадиазол-2-карбонитрил (E19),
5-[1-(3,4,5-Трифторбензил)пиперидин-4-иламино]-[1,3,4]тиадиазол-2-карбонитрил (E21),
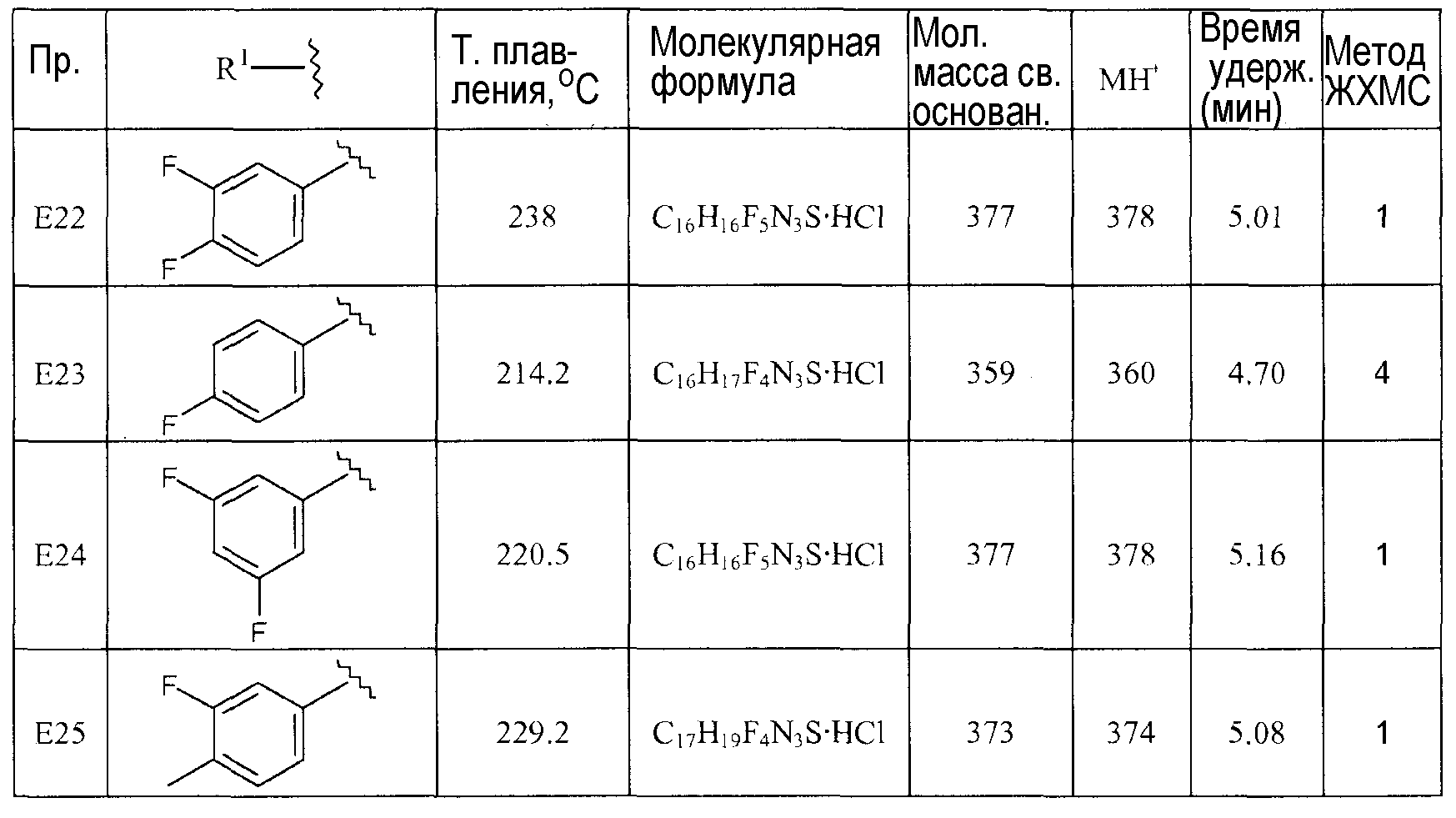
[1-(3,4-Дифторбензил)пиперидин-4-ил]-(4-трифторметилтиазол-2-ил)амин (E22),
(1-Бензилпиперидин-4-ил)-(5-трифторметил-[1,3,4]тиадиазол-2-ил)амин (D3) и
(1-Бензилпиперидин-4-ил)-(4-трифторметилтиазол-2-ил)амин (D8).
В настоящей заявке термин "C1-4алкил", используемый отдельно или в сочетаниях, таких как "C1-4алкилокси", "перфторC1-4алкил", "диC1-4алкиламино", включает, например, метил, этил, пропил, бутил, 1-метилпропил, 1,1-диметилэтил, термин "перфторC1-4алкил" включает, например, трифторметил, пентафторэтил, гептафторпропил и нонафторбутил; "C3-8циклоалкил" включает циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил; "C5-7циклоалкенил" включает циклопентенил, циклогексенил и циклогептенил. Термин галоген включает фтор, хлор, бром и иод.
Фармацевтически приемлемые соли по определению включают терапевтически активные, нетоксичные кислотно-аддитивные солевые формы, которые могут образовывать соединения формулы (I). Указанные соли можно получить путем обработки основных форм соединений формулы (I) подходящими кислотами, например, неорганическими кислотами, такими как галогенводородная кислота, в частности, хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота и фосфорная кислота, а также органическими кислотами, такими как уксусная кислота, гидроксиуксусная кислота, пропионовая кислота, молочная кислота, пировиноградная кислота, щавелевая кислота, малоновая кислота, янтарная кислота, малеиновая кислота, миндальная кислота, фумаровая кислота, яблочная кислота, винная кислота, лимонная кислота, метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, цикламовая кислота, салициловая кислота, п-аминосалициловая кислота, памовая кислота и миндальная кислота. И, наоборот, указанные солевые формы можно преобразовать в свободные формы путем их обработки подходящим основанием.
Термин сольваты относится к гидратам и алкоголятам, которые могут образовывать соединения формулы (I).
Термин "стереохимические изомеры" в данном описании относится ко всем возможным изомерным формам соединений формулы (I). Если специально не оговорено, или не указано иначе, химическое название соединений охватывает смесь всех возможных стереохимических изомеров, причем такие смеси включают все диастереомеры и энантиомеры основной молекулярной структуры. В частности, стереогенные центры могут иметь R- или S-конфигурацию; заместители двухвалентных циклических (частично) насыщенных радикалов могут иметь цис- или транс-конфигурацию. Соединения, содержащие двойные связи, могут иметь Е- или Z-конфигурацию по указанным двойным связям. Все стереохимические изомеры соединений формулы (I) входят в объем данного изобретения.
Соединения формулы (I), полученные с помощью описанных ниже способов, можно синтезировать в виде рацемических смесей энантиомеров, которые можно разделить с помощью известных в данной области методов разделения. Рацемические соединения формулы (I) можно превратить в соответствующие диастереомерные солевые формы путем взаимодействия с подходящей хиральной кислотой. Указанные диастереомерные солевые формы разделяют, например, методом избирательной или фракционированной кристаллизации, после чего энантиомеры высвобождают путем обработки щелочами. Альтернативный способ разделения энантиомерных форм соединений формулы (I) включает жидкостную хроматографию с применением хиральной стационарной фазы. Указанные чистые стереохимические изомеры можно также получить из соответствующих чистых стереохимических изомеров подходящих исходных веществ, при условии, что реакция протекает стереоспецифически. Предпочтительно конкретный стереоизомер можно синтезировать с помощью стереоспецифических способов. В таких способах преимущественно используют энантиомерно чистые исходные материалы.
Фармакология
Чтобы найти антипсихотические соединения, активные против позитивных симптомов шизофрении и обладающие улучшенным профилем безопасности (низкой встречаемостью EPS и отсутствием метаболических расстройств), авторы изобретения подвергают скринингу соединения, способные селективно взаимодействовать с рецептором допамина D2 и быстро отсоединяться от этого рецептора. Вначале соединения подвергают скринингу на аффинность к D2 с помощью анализа связывания с использованием [3Н]спиперона и клеточных мембран, содержащих человеческий рецептор D2L. Чтобы определить скорость диссоциации, соединения, имеющие IC50 менее 1 мкМ, тестируют с помощью адаптированного непрямого анализа, разработанного на основе метода, описанного Josee Е. Leysen and Walter Gommeren, Journal of Receptor Research, 1984, 4(7), 817-845.
Затем соединения подвергают скринингу по отношению более чем к 50 обычным G-белок-сопряженным рецепторам (CEREP), получая ровный профиль с низкой аффинностью к тестируемым рецепторам.
Некоторые соединения дополнительно тестируют на моделях in vivo, например, на "антагонизм по отношению к индуцированному апоморфином возбуждению у крыс", демонстрируя активность и биологическую доступность при пероральном введении.
Вышеупомянутые фармакологические свойства свидетельствуют о том, что соединения формулы (I) пригодны для применения в качестве лекарственных средств, в особенности, антипсихотических. Более конкретно, указанные соединения можно использовать в качестве лекарственных средств для лечения или профилактики шизофрении, шизофреноподобного расстройства, шизоаффективного расстройства, бредового расстройства, короткого психотического расстройства, индуцированного психотического расстройства, психотического расстройства вследствие общего состояния здоровья, психотического расстройства, индуцированного веществами, недифференцированного психотического расстройства, психоза, связанного с деменцией, большого депрессивного расстройства, дистимического расстройства, предменструального дисфорического расстройства, недифференцированного депрессивного расстройства, биполярного расстройства I, биполярного расстройства II, циклотимического расстройства, недифференцированного биполярного расстройства, расстройства настроения вследствие общего состояния здоровья, расстройства настроения, индуцированного веществами, недифференцированного расстройства настроения, генерализованного тревожного расстройства, обсессивно-компульсивного расстройства, панического расстройства, острого стрессового расстройства, посттравматического стрессового расстройства, умственной отсталости, общих расстройств психического развития, синдрома дефицита внимания, синдрома дефицита внимания и гиперактивности, синдрома агрессивного поведения, параноидных расстройств личности, шизоидных расстройств личности, шизотипических расстройств личности, тиковых расстройств, синдрома Туретта, зависимости от веществ, злоупотребления веществами, синдрома отмены веществ, трихотилломании.
Чтобы оптимизировать лечение пациентов, страдающих от упомянутого в предыдущем параграфе нарушения, соединения формулы (I) можно вводить вместе с другими психотропными соединениями. Так, в случае шизофрении лечение может быть направлено на негативные и когнитивные симптомы.
Настоящее изобретение также предлагает способ лечения теплокровных животных, страдающих от таких нарушений, причем указанный способ включает системное введение терапевтического количества соединения формулы (I), эффективного для лечения вышеописанных нарушений.
Настоящее изобретение также относится к применению определенных выше соединений формулы (I) для получения лекарственного средства, в особенности, антипсихотического лекарственного средства, более конкретно, лекарственного средства для лечения или профилактики шизофрении, шизофреноподобного расстройства, шизоаффективного расстройства, бредового расстройства, короткого психотического расстройства, индуцированного психотического расстройства, психотического расстройства вследствие общего состояния здоровья, психотического расстройства, индуцированного веществами, недифференцированного психотического расстройства, психоза, связанного с деменцией, большого депрессивного расстройства, дистимического расстройства, предменструального дисфорического расстройства, недифференцированного депрессивного расстройства, биполярного расстройства I, биполярного расстройства II, циклотимического расстройства, недифференцированного биполярного расстройства, расстройства настроения вследствие общего состояния здоровья, расстройства настроения, индуцированного веществами, недифференцированного расстройства настроения, генерализованного тревожного расстройства, обсессивно-компульсивного расстройства, панического расстройства, острого стрессового расстройства, посттравматического стрессового расстройства, умственной отсталости, общих расстройств психического развития, синдрома дефицита внимания, синдрома дефицита внимания и гиперактивности, синдрома агрессивного поведения, параноидных расстройств личности, шизоидных расстройств личности, шизотипических расстройств личности, тиковых расстройств, синдрома Туретта, зависимости от веществ, злоупотребления веществами, синдрома отмены веществ, трихотилломании.
Специалисты, имеющие опыт в лечении указанных заболеваний, могут определить ежедневное терапевтически эффективное количество таких лекарств, опираясь на результаты описанных ниже исследований. Ежедневное терапевтически эффективное количество составляет приблизительно от 0,01 до 10 мг/кг массы тела, более предпочтительно, приблизительно от 0,05 до 1 мг/кг веса тела.
Изобретение также относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель и, в качестве активного ингредиента, терапевтически эффективное количество соединения формулы (I).
Для простоты введения соединения, являющиеся предметом изобретения, могут быть получены в виде фармацевтических форм, предназначенных для разных способов введения. Соединения настоящего изобретения, в частности, соединения формулы (I), их фармацевтически приемлемые кислотно- или основно-аддитивные соли, стереохимические изомеры, N-оксиды, пролекарства или любые их подгруппы, или сочетания можно получить в виде фармацевтических форм, предназначенных для разных способов введения. В качестве подходящих композиций можно упомянуть композиции, традиционно используемые для системного введения лекарств. Фармацевтические композиции данного изобретения получают путем однородного смешивания эффективного количества конкретного соединения, необязательно в виде аддитивной соли, используемого в качестве активного ингредиента, с фармацевтически приемлемым носителем, причем такой носитель может широко варьировать в зависимости от формы препарата, необходимой для способа введения. Предпочтительно указанные фармацевтические композиции находятся в виде единичных дозированных форм, подходящих, в частности, для перорального, ректального, чрескожного, парентерального или ингаляционного введения. Например, при получении композиций в виде пероральной дозированной формы можно использовать любые традиционные фармацевтические среды, такие как, например, вода, гликоли, масла, спирты и тому подобное, в случае жидких препаратов, таких как суспензии, сиропы, эликсиры, эмульсии и растворы, или твердые носители, такие как крахмалы, сахара, каолин, разбавители, лубриканты, связующие средства, дезинтегрирующие средства и тому подобное в случае порошков, пилюль, капсул и таблеток. Вследствие простоты введения таблетки и капсулы представляют собой наиболее предпочтительные единичные дозированные формы для перорального введения, для получения которых, естественно, используются твердые фармацевтические носители. Носитель для парентеральных композиций обычно содержит стерильную воду, составляющую, по меньшей мере, большую его часть, хотя он может содержать и другие ингредиенты, например, повышающие растворимость. Для получения растворов для инъекций можно использовать, например, носитель, который содержит физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Для получения растворов для инъекций можно использовать, например, носитель, который содержит физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Чтобы обеспечить пролонгированное действие, растворы для инъекций, содержащие соединения формулы (I), могут быть приготовлены в масле. Подходящими маслами для этой цели являются, например, арахисовое масло, кунжутное масло, хлопковое масло, кукурузное масло, соевое масло, синтетические эфиры глицерина и длинноцепочечных жирных кислот, а также смеси указанных и других масел. Чтобы получить суспензии для инъекций, используют подходящие жидкие носители, суспендирующие средства и т.п. В объем изобретения также входят твердые препараты, предназначенные для преобразования в жидкие препараты непосредственно перед применением. Для получения композиций, подходящих для чрескожного введения, можно использовать носитель, который необязательно содержит средство, усиливающее проницаемость, и/или подходящее увлажняющее средство, необязательно в сочетании с подходящими добавками любой природы, используемыми в минорных количествах, которые не оказывают существенного вредного воздействия на кожу. Указанные добавки могут облегчать введение лекарственного средства через кожу и/или получение желательных композиций. Такие композиции можно вводить разными способами, например, посредством трансдермального пластыря, точечного нанесения или мази. Для получения водных композиций предпочтительно использовать кислотно- или основно-аддитивные соли соединений формулы (I), поскольку они лучше растворяются в воде, чем соответствующие кислые или основные формы.
Особенно предпочтительно получать вышеупомянутые фармацевтические композиции в виде единичных дозированных форм, обеспечивающих простоту введения и единообразие доз. Термин единичная дозированная форма в данном описании относится к физически дискретным единицам, подходящим для введения однократных доз, т.е. каждая единица содержит предварительно определенное количество активного ингредиента, рассчитанное так, чтобы получить желательный терапевтический эффект, в сочетании с необходимым фармацевтическим носителем. Примерами таких единичных дозированных форм являются таблетки (в том числе рифленые или покрытые оболочкой), капсулы, пилюли, пакетики с порошками, облатки, суппозитории, растворы или суспензии для инъекций и тому подобное, а также их раздельные сочетания.
Поскольку соединения настоящего изобретения обладают активностью при пероральном введении, особенно предпочтительны фармацевтические композиции, содержащие указанные соединения, которые предназначены для перорального введения.
Чтобы повысить растворимость и/или стабильность соединений формулы (I), в состав фармацевтических композиций предпочтительно вводить α-, β- или γ-циклодекстрины или их производные, особенно гидроксиалкил-замещенные циклодекстрины, например, 2-гидроксипропил-бета-циклодекстрин. Кроме того, растворимость и/или стабильность соединений настоящего изобретения можно повысить путем добавления в фармацевтические композиции вспомогательных растворителей, таких как спирты.
Способы получения
Соединения формулы (I), где R, R1, R2 и R3 имеют указанные выше значения, а X обозначает азот, можно получить путем взаимодействия соединения формулы (II),
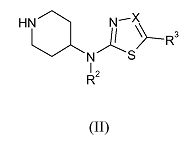
где R2 и R3 имеют указанные выше значения, а X обозначает азот, с реагентом формулы R1-CHY-R (III-a), где R и R1 имеют указанные выше значения, а Y обозначает уходящую группу, такую как галоген, например, хлор, бром или иод, или сульфонилоксильная группа, например, метилсульфонилокси, трифторметилсульфонилокси, или метилфенилсульфонилокси, в присутствии основания, такого как диизопропилэтиламин, или иммобилизованного на полимере 1,5,7-триазабицикло[4.4.0]дец-5-ена, в подходящем растворителе, таком как ацетонитрил, и в подходящих условиях реакции, таких как подходящая температура, которую обеспечивают либо путем обычного нагревания, либо путем микроволнового облучения, в течение периода времени, позволяющего достичь завершения реакции.
Альтернативно соединения формулы (I), где R, R1, R2 и R3 имеют указанные выше значения, а X обозначает азот, можно получить путем взаимодействия соединения формулы (II), где R2 и R3 имеют указанные выше значения, а X обозначает азот, с реагентом формулы R1-C(=O)-R (III-b), где R и R1 имеют указанные выше значения, методом восстановительного N-алкилирования в присутствии подходящего восстанавливающего реагента, такого как триацетоксиборгидрид натрия или иммобилизованный на полимере триацетоксиборгидрид, подходящего кислого катализатора, такого как уксусная кислота, в подходящем для реакции инертном растворителе, таком как дихлорметан, 1,2-дихлорэтан или N,N-диметилформамид.
Соединения формулы (II), где R2 и R3 имеют указанные выше значения, а X обозначает азот, можно получить после удаления защитной группы с промежуточного соединения формулы (IV)
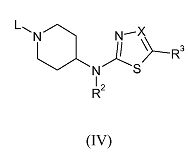
где L обозначает подходящую уходящую группу, такую как бензилоксикарбонил, бензил или трет-бутоксикарбонил, R2 и R3 имеют указанные выше значения, а X обозначает азот, в подходящих условиях, таких как присутствие хлористоводородной кислоты, если L обозначает бензилоксикарбонильную группу, присутствие трифторуксусной кислоты в дихлорметане, если L обозначает трет-бутоксикарбонильную группу, или путем взаимодействия с 1-хлорэтилхлорформиатом, в присутствии подходящего основания, такого как диизопропилэтиламин, в дихлорметане, если L обозначает бензильную группу.
Соединения формулы (IV), где R2 и R3 имеют указанные выше значения, X обозначает азот, а L обозначает подходящую уходящую группу, можно получить путем взаимодействия соединения формулы (V),
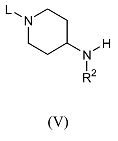
где R2 имеет указанные выше значения, а L обозначает подходящую уходящую группу, такую как бензилоксикарбонил, бензил или трет-бутоксикарбонил, с 5-хлор-[1,3,4]тиадиазолом формулы (VI)
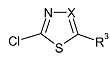
где R3 имеет указанные выше значения, а X обозначает азот, в присутствии основания, такого как диизопропилэтиламин, в подходящем растворителе, таком как ацетонитрил, и в подходящих условиях реакции, таких как подходящая температура, которую обеспечивают либо путем обычного нагревания, либо путем микроволнового облучения, в течение периода времени, позволяющего достичь завершения реакции.
5-Хлор-[1,3,4]тиадиазол формулы (VI), где R3 обозначает трифторметил, а X обозначает азот, можно получить с помощью способов, подобных описанным в DE 82/3218482.
5-Хлор-[1,3,4]тиадиазол формулы (VI), где R обозначает циано, а X обозначает азот, можно получить с помощью способов, подобных описанным в US 5736545.
Соединения формулы (I), где R, R1, R2 и R3 имеют указанные выше значения, а X обозначает азот, также можно получить путем взаимодействия 5-хлор-[1,3,4]тиадиазола формулы (VI), где R3 обозначает трифторметил или циано, а X обозначает азот, с производным пиперидина формулы (VII)
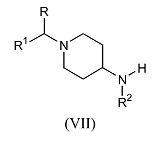
где R, R1 и R2 имеют указанные выше значения, в присутствии подходящего основания, такого как диизопропилэтиламин, в подходящем растворителе, таком как ацетонитрил, и в подходящих условиях реакции, таких как подходящая температура, которую обеспечивают либо путем обычного нагревания, либо путем микроволнового облучения, в течение периода времени, позволяющего достичь завершения реакции.
Соединения формулы (VII), где R и R1 имеют указанные выше значения, а R2=H, можно получить путем взаимодействия трет-бутилового эфира пиперидин-4-илкарбаминовой кислоты (VIII)
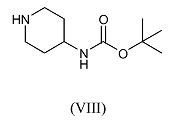
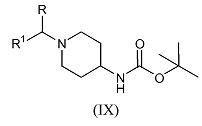
с реагентом формулы R1-CHY-R (III-a), где R и R1 имеют указанные выше значения, а Y обозначает уходящую группу, такую как галоген, например, хлор, бром или иод, или сульфонилоксильная группа, например, метилсульфонилокси, трифторметилсульфонилокси, или метилфенилсульфонилокси, в присутствии основания, такого как диизопропилэтиламин, в подходящем растворителе, таком как дихлорметан, с последующим удалением защитной трет-бутилоксикарбонильной группы с промежуточного соединения формулы (IX) путем обработки кислотой, такой как трифторуксусная кислота, с получением соединения формулы (VII), где R2=H.
Альтернативно, соединения формулы (VII), где R и R1 имеют указанные выше значения, можно получить путем взаимодействия трет-бутилового эфира пиперидин-4-илкарбаминовой кислоты с реагентом формулы R1-C(=O)-R (III-b), где R и R1 имеют указанные выше значения, методом восстановительного N-алкилирования в присутствии подходящего восстанавливающего реагента, такого как триацетоксиборгидрид натрия, подходящего кислого катализатора, такого как уксусная кислота, в подходящем для реакции инертном растворителе, таком как 1,2-дихлорэтан, с последующим удалением защитной трет-бутилоксикарбонильной группы с промежуточного соединения формулы (IX) путем обработки кислотой, такой как трифторуксусная кислота, с получением соединения формулы (VII), где R2=H.
Соединения формулы (VII), в которых R2 обозначает C1-4алкил, можно получить путем взаимодействия соединения формулы (X)
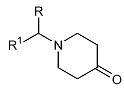
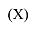
где R и R1 имеют указанные выше значения, с C1-4алкиламином формулы R2-NH2 (XI) в присутствии подходящего восстанавливающего реагента, такого как водород, подходящего катализатора, такого как палладий на угле, и в подходящем для реакции инертном растворителе, таком как этанол.
Соединения формулы (X), где R и R1 имеют указанные выше значения, можно получить путем взаимодействия 4,4-этилендиоксипиперидина (XII)
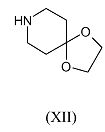
с реагентом формулы R1-C(=O)-R (III-b), где R и R1 имеют указанные выше значения, в присутствии подходящего восстанавливающего реагента, такого как триацетоксиборгидрид натрия, подходящего кислого катализатора, такого как уксусная кислота, в подходящем для реакции инертном растворителе, таком как 1,2-дихлорэтан, с последующим удалением защитной группы с промежуточного соединения формулы (XIII)
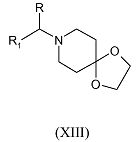
где R и R1 имеют указанные выше значения, путем обработки кислотой, такой как хлористоводородная кислота.
Соединения формулы (I), где R, R1, R2 и R4 имеют указанные выше значения, R3 обозначает водород, X обозначает углерод, а R4 обозначает трифторметил, можно получить путем взаимодействия соединения формулы (II),
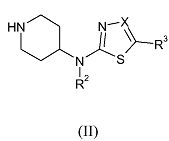
где R2 и R4 имеют указанные выше значения, R3 обозначает водород, а X обозначает углерод, с реагентом формулы R1-CHY-R (III-a), где R и R1 имеют указанные выше значения, а Y обозначает уходящую группу, такую как галоген, например, хлор, бром или иод, или сульфонилоксильная группа, например, метилсульфонилокси, трифторметилсульфонилокси, или метилфенилсульфонилокси, в присутствии основания, такого как диизопропилэтиламин, в подходящем растворителе, таком как ацетонитрил, и в подходящих условиях реакции, таких как подходящая температура, которую обеспечивают либо путем обычного нагревания, либо путем микроволнового облучения, в течение периода времени, позволяющего достичь завершения реакции.
Альтернативно соединения формулы (I), где R, R1, R2 и R4 имеют указанные выше значения, R3 обозначает водород, а X обозначает углерод, можно получить путем взаимодействия соединения формулы (II), где R2 и R4 имеют указанные выше значения, R3 обозначает водород, а X обозначает углерод, с реагентом формулы R1-C(=O)-R (III-b), где R и R1 имеют указанные выше значения, методом восстановительного N-алкилирования в присутствии подходящего восстанавливающего реагента, такого как триацетоксиборгидрид натрия, подходящего кислого катализатора, такого как уксусная кислота, в подходящем для реакции инертном растворителе, таком как 1,2-дихлорэтан.
Соединения формулы (II), где R2 и R4 имеют указанные выше значения, R3 обозначает водород, а X обозначает углерод, можно получить после удаления защитной группы с промежуточного соединения формулы (IV)
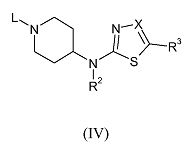
где R2 и R4 имеют указанные выше значения, R3 обозначает водород, X обозначает углерод, а L обозначает подходящую уходящую группу, такую как бензил, в подходящих условиях, таких как взаимодействие с 1-хлорэтилхлорформиатом в присутствии подходящего основания, такого как диизопропилэтиламин, в дихлорметане.
Соединения формулы (IV), где R2 и R4 имеют указанные выше значения, R3 обозначает водород, X обозначает углерод, а L обозначает подходящую уходящую группу, можно получить путем взаимодействия (пиперидин-4-ил)-тиомочевины формулы (XIV),
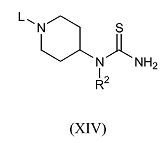
где R2 имеет указанные выше значения, а L обозначает подходящую уходящую группу, с производным 3-бромацетона формулы Br-CH2-C(=O)-CH2-R4 (XV) в подходящем растворителе, таком как этанол, и в подходящих условиях реакции, таких как подходящая температура, которую обеспечивают либо путем обычного нагревания, либо путем микроволнового облучения, в течение периода времени, позволяющего достичь завершения реакции.
(Пиперидин-4-ил)-тиомочевину формулы (XIV), где R2 имеет указанные выше значения, а L обозначает подходящую уходящую группу, можно получить с помощью способов, подобных описанным в WO 03/062215.
Альтернативно соединения формулы (I), где R, R1, R2 и R4 имеют указанные выше значения, R3 обозначает водород, а X обозначает углерод, получают путем взаимодействия соединения формулы (XVI)
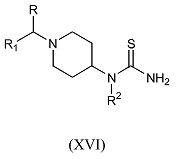
где R, R1 и R2 имеют указанные выше значения, с производным 3-бромацетона формулы Br-CH2-C(=O)-CH2-R4 (XV) в подходящем растворителе, таком как этанол, при подходящей температуре, которую обеспечивают либо путем обычного нагревания, либо путем микроволнового облучения, в течение периода времени, позволяющего достичь завершения реакции.
Соединения формулы (XVI), где R, R1 и R2 имеют указанные выше значения, можно получить из пиперидина формулы (VII) с помощью способов, подобных описанным в WO 03/062215.
Экспериментальная часть
Химия
Реакции с использованием микроволнового облучения проводят в однорежимном микроволновом реакторе Emrys™ Optimizer (Personal Chemistry A.B., currently Biotage). Описание прибора можно найти на сайте www.personalchemistry.com.
Спектры 1H регистрируют на спектрометрах Bruker DPX 400 или Bruker AV-500. Значения химических сдвигов выражают в м.д. по отношению к тетраметилсилану.
Температуру плавления определяют с помощью прибора Mettler FP62.
Градиент ВЭЖХ обеспечивают с помощью системы HP 1100 от Agilent Technologies, включающей насос для четырехкомпонентных смесей с дегазатором, автодозатор, термостат для колонки (установленный на 40°C за исключением способа 4, в котором используют температуру 60°C), детектор на диодной матрице (DAD) и колонку, вид которой указан ниже в соответствующих способах. Часть потока, исходящего из колонки, направляется в МС-детектор. МС-детектор оборудован источником ионизации электрораспылением. В качестве распыляющего газа используют азот. Температуру источника поддерживают при 140°C. Данные регистрируют с помощью программного обеспечения MassLynx-Openlynx.
Способ 1
В добавление к общей процедуре: ВЭЖХ на обращенной фазе проводят на колонке ACE-C18 (3,0 мкм, 4,6×30 мм), Advanced Chromatography Technologies, со скоростью потока 1,5 мл/мин при 40°C. Условия градиента: от 80% A (раствор ацетата аммония 0,5 г/л), 10% B (ацетонитрил), 10% C (метанол) до 50% B и 50% C в течение 6,5 минут, и затем до 100% B в течение 7 минут, после чего уравновешивают до начальных условий в течение 7,5-9,0 минут. Объем вводимого образца 5 мкл. Масс-спектрометрию высокого разрешения (с времяпролетным анализатором, TOF) проводят только в режиме положительной ионизации со сканированием от 100 до 750 в течение 0,5 секунды и временем пребывания 0,1 секунды. Напряжение на конце капилляра составляет 2,5 кВ в режиме положительной ионизации, а напряжение на конусе составляет 20 В. В качестве стандарта для фиксированной калибровки массы используют лейцин-энкефалин.
Способ 2
В добавление к общей процедуре: ВЭЖХ на обращенной фазе проводят на колонке ACE-C18 (3,0 мкм, 4,6×30 мм), Advanced Chromatography Technologies, со скоростью потока 1,5 мл/мин при 40°C. Условия градиента: от 80% A (раствор ацетата аммония 0,5 г/л), 10% B (ацетонитрил), 10% C (метанол) до 50% B и 50% C в течение 6,5 минут, и затем до 100% B в течение 7 минут, после чего уравновешивают до начальных условий в течение 7,5-9,0 минут. Объем вводимого образца 5 мкл. Масс-спектр низкого разрешения (детектор ZQ; квадрупольный анализатор) получают путем сканирования от 100 до 1000 в течение 1,0 секунды с временем пребывания 0,3 секунды. Напряжение на конце капилляра составляет 3 кВ. Напряжение на конусе составляет 20 В и 50 В в режиме положительной ионизации и 20 В в режиме отрицательной ионизации.
Способ 3
В добавление к общей процедуре: ВЭЖХ на обращенной фазе проводят на картридже XDB-C18 (1,8 мкм, 2,1×30 мм), Agilent, со скоростью потока 1 мл/мин при 60°C. Условия градиента: от 90% A (раствор ацетата аммония 0,5 г/л), 5% B (ацетонитрил), 5% C (метанол) до 50% B и 50% C в течение 6,5 минут, и затем до 100% B в течение 7 минут, после чего уравновешивают до начальных условий в течение 7,5-9,0 минут. Объем вводимого образца 2 мкл. Масс-спектрометрию высокого разрешения (с времяпролетным анализатором, TOF) проводят только в режиме положительной ионизации со сканированием от 100 до 750 в течение 0,5 секунды и временем пребывания 0,1 секунды. Напряжение на конце капилляра составляет 2,5 кВ, а напряжение на конусе составляет 20 В. В качестве стандарта для фиксированной калибровки массы используют лейцин-энкефалин.
Способ 4
Проводят, как и способ 1, используя для введения образец объемом 10 мкл.
Описание 1
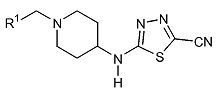
4-[Метил-(5-трифторметил-[1,3,4]тиадиазол-2-ил)-амино]-пиперидин-1-карбоновой кислоты бензиловый эфир (D1)
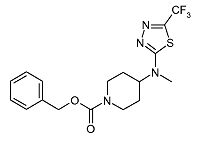
Смесь 2-хлор-5-трифторметил-[1,3,4]тиадиазола (0,70 г, 3,72 ммоль) (полученного по способу, аналогичному описанному в DE 82/3218482), гидрохлорида бензилового эфира 4-метиламинопиперидин-1-карбоновой кислоты (1,06 г, 3,72 ммоль) и диизопропилэтиламина (1,60 мл, 9,30 ммоль) в ацетонитриле (10 мл) перемешивают при 120°C в течение 30 мин при микроволновом облучении. После охлаждения до комнатной температуры реакционную смесь разбавляют дихлорметаном и экстрагируют 10% раствором хлорида аммония (25 мл). Органический слой отделяют, сушат (Na2SO4) и растворитель упаривают в вакууме. Неочищенный продукт очищают хроматографией на короткой открытой колонке (силикагель; 0-0,5% аммиак в метаноле (7M)/дихлорметан). Целевые фракции собирают и упаривают в вакууме, получая D1 (0,91 г, 62%) в виде твердого вещества. C17H19F3N4O2S требует 400; обнаружено: 401 (MH+).
Описание 2
Метилпиперидин-4-ил-(5-трифторметил-[1,3,4]тиадиазол-2-ил)амин (D2)
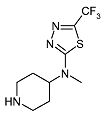
Раствор бензилового эфира 4-[метил-(5-трифторметил-[1,3,4]тиадиазол-2-ил)амино]пиперидин-1-карбоновой кислоты (D1) (0,91 г, 2,27 ммоль) в 6н растворе хлористоводородной кислоты (15 мл) перемешивают при 150°C в течение 10 мин при микроволновом облучении. После охлаждения до комнатной температуры реакционную смесь разбавляют водой и экстрагируют дихлорметаном (25 мл). Водный слой подщелачивают насыщенным раствором карбоната натрия и экстрагируют дихлорметаном (3×25 мл). Объединенные органические экстракты сушат (Na2SO4) и растворитель упаривают в вакууме, получая D2 (0,56 г, 93%) в виде твердого вещества. C9H13F3N4S требует 266; обнаружено: 266 (MH+).
1H ЯМР (400 МГц, Хлороформ-d) δ м.д. 1,67-1,80 (м, 2H), 1,86 (с, 2H), 2,74 (тд, J=12,13, 2,28 Гц, 2H), 3,08 (с, 3H), 3,16-3,26 (м, 2H), 4,01-4,15 (м, 1H).
Описание 3
(1-Бензилпиперидин-4-ил)-(5-трифторметил-[1,3,4]тиадиазол-2-ил)амин (D3)
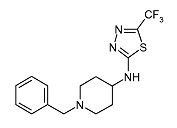
Смесь 2-хлор-5-трифторметил-[1,3,4]тиадиазола (0,42 г, 2,24 ммоль) (полученного по способу, аналогичному описанному в DE 82/3218482), 4-аминометил-1-бензилпиперидина (0,4 мл, 1,95 ммоль) и диизопропилэтиламина (0,5 мл, 2,90 ммоль) в ацетонитриле (6 мл) перемешивают при 120°C в течение 15 мин при микроволновом облучении. После охлаждения до комнатной температуры реакционную смесь разбавляют дихлорметаном и экстрагируют 10% раствором хлорида аммония (25 мл). Органический слой отделяют, сушат (Na2SO4) и растворитель упаривают в вакууме. Неочищенный продукт очищают хроматографией на короткой открытой колонке (силикагель; 0-0,5% аммиак в метаноле (7M)/дихлорметан). Целевые фракции собирают и упаривают в вакууме, получая D3 (0,368 г, 48%) в виде твердого вещества. C15H17F3N4S требует 342; обнаружено: 343 (MH+).
1H ЯМР (400 МГц, Хлороформ-d) δ м.д. 1,62-1,71 (м, 2H), 2,05-2,24 (м, 4H), 2,85 (с, 2H), 3,40-3,51 (м, 1H), 3,53 (с, 2H), 5,83 (д, J=6,63 Гц, 1H), 7,22-7,36 (м, 5H).
Описание 4
Пиперидин-4-ил-(5-трифторметил-[1,3,4]тиадиазол-2-ил)амин (D4)
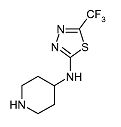
К перемешиваемому раствору (1-бензилпиперидин-4-ил)-(5-трифторметил-[1,3,4]тиадиазол-2-ил)амина (D3) (0,50 г, 1,46 ммоль) и диизопропилэтиламина (0,76 мл, 4,38 ммоль) в дихлорметане (20 мл) при 0°C добавляют 1-хлорэтилхлорформиат (0,47 мл, 4,38 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 2 ч, после чего растворитель упаривают в вакууме. Неочищенный продукт растворяют в метаноле (30 мл) и реакционную смесь перемешивают при кипении с обратным холодильником в течение 1,5 ч. После упаривания растворителя неочищенный продукт растворяют в воде и экстрагируют диэтиловым эфиром (2×25 мл) и дихлорметаном (3×25 мл). Водный слой отделяют и упаривают в вакууме. Неочищенный продукт очищают методом ВЭЖХ на обращенной фазе. Целевые фракции собирают и упаривают в вакууме, получая D4 (0,29 г, 79%) в виде твердого вещества. C8H11F3N4S требует 252; обнаружено: 253 (MH+).
1H ЯМР (400 МГц, DMSO-d6) δ м.д. 1,59-1,73 (м, 2H), 2,04-2,14 (м, 2H), 2,54 (с, 1H), 2,88-2,97 (м, 2H), 3,17-3,25 (м, 2H), 3,88-3,96 (м, 1H), 8,91 (шир. с, 1H).
Описание 5
4-(5-Циано-[1,3,4]тиадиазол-2-иламино)пиперидин-1-карбоновой кислоты трет-бутиловый эфир (D5)
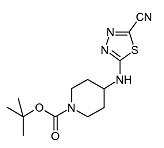
Смесь 5-хлор-[1,3,4]тиадиазол-2-карбонитрила (0,5 г, 3,44 ммоль) (полученного по способу, аналогичному описанному в US 5736545), трет-бутилового эфира 4-аминопиперидин-1-карбоновой кислоты (0,69 г, 3,44 ммоль) и диизопропилэтиламина (0,72 мл, 4,13 ммоль) в ацетонитриле (10 мл) перемешивают при 130°C в течение 30 мин при микроволновом облучении. Затем растворитель упаривают в вакууме. Неочищенный продукт растворяют в дихлорметане и экстрагируют насыщенным раствором хлорида аммония. Органический слой отделяют, сушат (Na2SO4) и растворитель упаривают в вакууме. Неочищенный продукт очищают хроматографией на короткой открытой колонке (силикагель; 3-5% аммиак в метаноле (7M)/дихлорметан). Целевые фракции собирают и упаривают в вакууме, получая D5 (0,97 г, 63%) в виде белого твердого вещества. C13H19N5O2S требует 309; обнаружено: 308 (MH-).
Описание 6
5-(Пиперидин-4-иламино)-[1,3,4]тиадиазол-2-карбонитрил (D6)
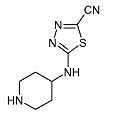
К перемешиваемому раствору трет-бутилового эфира 4-(5-циано-[1,3,4]тиадиазол-2-иламино)пиперидин-1-карбоновой кислоты (D5) (0,973 г, 3,12 ммоль) в дихлорметане (55 мл) при 0°C добавляют трифторуксусную кислоту (3 мл). Реакционную смесь перемешивают при 0°C в течение 1 ч и при комнатной температуре в течение еще 18 ч. Затем реакционную смесь экстрагируют насыщенным раствором карбоната натрия. Водный слой экстрагируют этилацетатом (2×25 мл). Органический слой отделяют, сушат (Na2SO4) и растворитель упаривают в вакууме, получая D6 (0,60 г, 92%) в виде твердого вещества. C8H11N3S требует 209; обнаружено: 210 (MH+).
Описание 7
1-(3,4-Дифторбензил)пиперидин-4-иламин (D7)
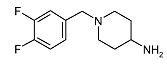
Смесь трет-бутилового эфира пиперидин-4-илкарбаминовой кислоты (5 г, 25,0 ммоль), 3,4-дифторбензилбромида (4,7 г, 22,7 ммоль) и диизопропилэтиламин (5,9 мл, 34,0 ммоль) в дихлорметане (50 мл) перемешивают при комнатной температуре в течение 2 ч. Затем добавляют трифторуксусную кислоту (31 мл) и реакционную смесь перемешивают еще 2 ч. Растворитель упаривают в вакууме и добавляют насыщенный раствор карбоната натрия. Смесь экстрагируют дихлорметаном, отделенные органические слои сушат (Na2SO4), фильтруют и растворитель упаривают в вакууме, получая D7 (5,2 г, 93%) в виде твердого вещества. C12H16F2N2 требует 226; обнаружено: 227 (MH+).
Описание 8
(1-Бензилпиперидин-4-ил)-(4-трифторметилтиазол-2-ил)амин (D8)
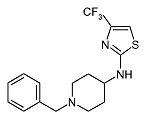
К перемешиваемому раствору (1-бензилпиперидин-4-ил)-тиомочевины (0,5 г, 2,0 ммоль) (полученной по способу, аналогичному описанному в WO 03/062215) в этаноле (15 мл) добавляют 3-бром-1,1,1-трифторацетон (0,22 мл, 2,1 ммоль) и реакционную смесь нагревают при кипении с обратным холодильником в течение 1 ч. После упаривания растворителя неочищенный продукт кристаллизуют из ацетонитрила и получают D8 (0,61 г, 88%) в виде белого твердого вещества. C16H18F3N3S-HBr в виде свободного основания требует 341; обнаружено: 342 (MH+).
Температура плавления (ацетонитрил): 247,9°C.
1H ЯМР (400 МГц, DMSO-d6) δ м.д. 1,56-1,75 (м, 1,5H), 1,92-2,10 (м, 1H), 2,18 (д, J=12,85 Гц, 1,5H), 3,03-3,22 (м, 2H), 3,23-3,47 (м, 2H), 3,70-3,86 (м, 0,75H), 3,95 (шир. с, 0,25H), 4,29 (д, J=4,98 Гц, 1,5H), 4,34 (д, J=4,98 Гц, 0,5H), 7,35-7,57 (м, 5H), 8,20 (д, J=7,26 Гц, 0,75H), 8,26 (д, J=5,80 Гц, 0,25H), 9,43 (шир. с, 0,75H), 9,51 (шир. с, 0,25H).
Описание 9
Пиперидин-4-ил-(4-трифторметилтиазол-2-ил)амин (D9)
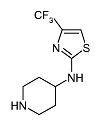
К перемешиваемому раствору (1-бензилпиперидин-4-ил)-(4-трифторметилтиазол-2-ил)амина (D8) (0,57 г, 1,68 ммоль) и диизопропилэтиламина (1,04 мл, 5,88 ммоль) в дихлорметане (15 мл) при 0°C добавляют 1-хлорэтилхлорформиат (0,45 мл, 4,2 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 3 ч, после чего разбавляют дихлорметаном и экстрагируют насыщенным раствором гидрокарбоната натрия (5 мл). Органический слой отделяют, сушат (Na2SO4) и растворитель упаривают в вакууме. Неочищенный продукт растворяют в метаноле (5 мл), после чего реакционную смесь перемешивают при кипении с обратным холодильником в течение 3 ч. После упаривания растворителя неочищенный продукт очищают колоночной хроматографией (силикагель; 5-8% аммиак в метаноле (7M)/дихлорметан). Целевые фракции собирают и упаривают в вакууме. Неочищенный продукт кристаллизуют из ацетонитрила, получая D9 (0,34 г, 81%) в виде белого твердого вещества. C9H12F3N3S требует 251; обнаружено: 252 (MH+).
Температура плавления (ацетонитрил): 133,0°C.
1H ЯМР (400 МГц, Хлороформ-d) δ м.д. 1,38-1,48 (м, 2H), 2,07-2,14 (м, 2H), 2,69-2,76 (м, 2H), 3,11 (дт, J=13,01, 3,65 Гц, 2H), 3,42-3,51 (м, J=14,36, 6,27, 4,15, 4,04 Гц, 1H), 5,28 (д, J=7,26 Гц, 1H), 6,92 (с, 1H).
Пример 1
[1-(4-Фторбензил)пиперидин-4-ил]-метил-(5-трифторметил-[1,3,4]тиадиазол-2-ил)амин (E1)
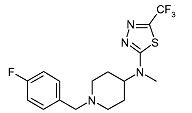
Смесь метилпиперидин-4-ил-(5-трифторметил-[1,3,4]тиадиазол-2-ил)амина (D2) (0,050 г, 0,19 ммоль), 4-фторбензилхлорида (0,029 мл, 0,24 ммоль) и диизопропилэтиламина (0,050 мл, 0,28 ммоль) в ацетонитриле (3 мл) перемешивают при 120°C в течение 30 мин при микроволновом облучении. После охлаждения до комнатной температуры реакционную смесь разбавляют дихлорметаном и экстрагируют 10% раствором хлорида аммония (25 мл). Органический слой отделяют, сушат (Na2SO4) и растворитель упаривают в вакууме. Неочищенный продукт очищают колоночной флэш-хроматографией (силикагель; 0-1,5% аммиак в метаноле (7M)/дихлорметан) и получают E1 (0,061 г, 87%) в виде твердого вещества. C16H18F4N4S требует 374; обнаружено: 375 (MH+).
Температура плавления: 85,8°C.
1H ЯМР (400 МГц, Хлороформ-d6) δ м.д. 1,75-1,93 (м, 4H), 2,11 (дт, J=I 1,45, 3,21 Гц, 2H), 2,98 (с, 2H), 3,07 (с, 3H), 3,49 (с, 2H), 3,91-4,08 (м, 1H), 6,95-7,06 (м, 2H), 7,22-7,33 (м, 3H).
Пример 2
[1-(3-Фторбензил)пиперидин-4-ил]-метил-(5-трифторметил-[1,3,4]тиадиазол-2-ил)амин (E2)
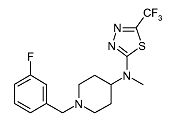
Смесь метилпиперидин-4-ил-(5-трифторметил-[1,3,4]тиадиазол-2-ил)амина (D2) (0,050 г, 0,19 ммоль), 3-фторбензилбромида (0,030 мл, 0,24 ммоль) и диизопропилэтиламина (0,050 мл, 0,28 ммоль) в ацетонитриле (3 мл) перемешивают при 100°C в течение 5 мин при микроволновом облучении. После охлаждения до комнатной температуры реакционную смесь разбавляют дихлорметаном и экстрагируют 10% раствором хлорида аммония (25 мл). Органический слой отделяют, сушат (Na2SO4) и растворитель упаривают в вакууме. Неочищенный продукт очищают колоночной флэш-хроматографией (силикагель; 0-1,5% аммиак в метаноле (7M)/дихлорметан) и получают E2 (0,062 г, 88%) в виде твердого вещества. C16H18F4N4S требует 374; обнаружено:375 (MH+).
Температура плавления: 80,5°C.
1H ЯМР (400 МГц, DMSO-d6) δ м.д. 1,73 (с, 2H), 1,86 (д.кв., J=12,02, 3,73 Гц, 2H), 2,09 (тд, J=11,71, 2,07 Гц, 2H), 2,84-2,96 (м, 2H), 3,07 (с, 3H), 3,52 (с, 2H), 3,81-3,94 (м, 1H), 7,04-7,11 (м, 1H), 7,11-7,18 (м, 2H), 7,32-7,42 (м, 1H).
Пример 4
[1-(4-Фторбензил)пиперидин-4-ил]-(5-трифторметил-[1,3,4]тиадиазол-2-ил)амин (E4)
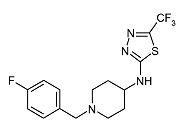
Смесь пиперидин-4-ил-(5-трифторметил-[1,3,4]тиадиазол-2-ил)амина (D4) (0,040 г, 0,16 ммоль), 4-фторбензилхлорида (0,023 мл, 0,19 ммоль) и диизопропилэтиламина (0,042 мл, 0,24 ммоль) в ацетонитриле (3 мл) перемешивают при 120°C в течение 30 мин при микроволновом облучении. После охлаждения до комнатной температуры реакционную смесь разбавляют дихлорметаном и экстрагируют 10% раствором хлорида аммония (25 мл). Органический слой отделяют, сушат (Na2SO4) и растворитель упаривают в вакууме. Неочищенный продукт очищают колоночной флэш-хроматографией (силикагель; 0-3% аммиак в метаноле (7M)/дихлорметан) и получают E4 (0,042 г, 73%) в виде твердого вещества. C15H16F4N4S требует 360; обнаружено:361 (MH+).
1H ЯМР (400 МГц, Хлороформ-d) δ м.д. 1,61-1,74 (м, 2H), 2,05-2,14 (м, 2H), 2,19 (с, 2H), 2,80-2,89 (м, 2H), 3,38-3,48 (м, 1H), 3,50 (с, 2H), 6,39 (шир. с, 1H), 6,97-7,05 (м, 2H), 7,24-7,31 (м, 2H).
Пример 5
[1-(3,4-Дифторбензил)пиперидин-4-ил]-(5-трифторметил-[1,3,4]тиадиазол-2-ил)амин (E5)
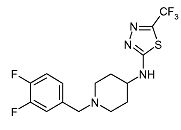
Смесь пиперидин-4-ил-(5-трифторметил-[1,3,4]тиадиазол-2-ил)амина (D4) (0,040 г, 0,16 ммоль), 3,4-дифторбензилбромида (0,024 мл, 0,19 ммоль) и диизопропилэтиламина (0,042 мл, 0,24 ммоль) в ацетонитриле (3 мл) перемешивают при 100°C в течение 5 мин при микроволновом облучении. После охлаждения до комнатной температуры реакционную смесь разбавляют дихлорметаном и экстрагируют 10% раствором хлорида аммония (25 мл). Органический слой отделяют, сушат (Na2SO4) и растворитель упаривают в вакууме. Неочищенный продукт очищают колоночной флэш-хроматографией (силикагель; 0-3% аммиак в метаноле (7M)/дихлорметан) и получают E5 (0,048 г, 80%) в виде твердого вещества. C15H15F5N4S требует 378; обнаружено: 379 (MH+).
1H ЯМР (400 МГц, Хлороформ-d) δ м.д. 1,61-1,76 (м, 2H), 2,06-2,14 (м, 2H), 2,19 (т, J=11,09 Гц, 2H), 2,78-2,87 (м, 2H), 3,37-3,46 (м, 1H), 3,47 (с, 2H), 6,66 (д, J=5,18 Гц, 1H), 6,98-7,04 (м, 1H), 7,05-7,13 (м, 1H), 7,17 (ддд, J=11,20, 7,88, 2,07 Гц, 1H).
Пример 9
[1-(3-Фтор-4-метилбензил)пиперидин-4-ил]-(5-трифторметил-[1,3,4]тиадиазол-2-ил)амин (E9)
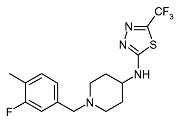
Смесь пиперидин-4-ил-(5-трифторметил-[1,3,4]тиадиазол-2-ил)амина (D4) (0,025 г, 0,1 ммоль), 3-фтор-4-метилбензилбромида (0,012 мл, 0,11 ммоль) и иммобилизованного на полимере 1,5,7-триазабицикло[4.4.0]дец-5-ена (2,9 ммоль/г) (0,102 г, 0,30 ммоль) в ацетонитриле (3 мл) перемешивают при 80°C в течение 30 мин. После охлаждения до комнатной температуры реакционную смесь фильтруют через картридж Isolute SCX-2. Затем картридж промывают метанолом. Неочищенный продукт элюируют 7M раствором аммиака в метаноле. Растворитель упаривают в вакууме. Неочищенный продукт очищают колоночной флэш-хроматографией (силикагель; 5% аммиак в метаноле (7M)/дихлорметан) и получают E9 (0,017 г, 45%) в виде твердого вещества. C16H18F4N4S требует 374; обнаружено: 375 (MH+).
1H ЯМР (400 МГц, Хлороформ-d) δ м.д. 1,59-1,74 (м, 2H), 2,05-2,22 (м, 4H), 2,26 (д, J=1,45 Гц, 3H), 2,75-2,89 (м, 2H), 3,38-3,49 (м, 1H), 3,48 (с, 2H), 6,17 (д, J=5,60 Гц, 1H), 6,93-7,02 (м, 2H), 7,11 (т, J=7,77 Гц, 1H).
Пример 10
1-(3-Фтор-4-трифторметилбензил)пиперидин-4-ил]-(5-трифторметил-[1,3,4]тиадиазол-2-ил)амин (E10)
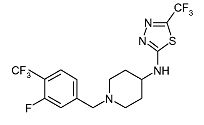
Смесь пиперидин-4-ил-(5-трифторметил-[1,3,4]тиадиазол-2-ил)амина (D4) (0,040 г, 0,16 ммоль), 3-фтор-4-(трифторметил)бензальдегида (0,038 мл, 0,32 ммоль), иммобилизованного на полимере триацетоксиборгидрида (2,07 ммоль/г) (0,197 г, 0,95 ммоль) и уксусной кислоты (0,050 мл) в дихлорметане (2 мл) встряхивают при комнатной температуре в течение 16 ч. Затем реакционную смесь фильтруют через картридж Isolute SCX-2. Картридж промывают метанолом. Неочищенный продукт элюируют 7M раствором аммиака в метаноле. Растворитель упаривают в вакууме. Неочищенный продукт очищают колоночной флэш-хроматографией (силикагель; 5% аммиак в метаноле (7M)/дихлорметан) и получают E10 (0,029 г, 43%) в виде белого твердого вещества. C16H15F7N4S требует 428; обнаружено: 429 (MH+).
Температура плавления: 130,2°C.
1H ЯМР (500 МГц, Хлороформ-d) δ м.д. 1,64-1,76 (м, 2H), 2,07-2,17 (м, 2H), 2,23 (т, J=10,55 Гц, 2H), 2,74-2,89 (м, 2H), 3,41-3,53 (м, 1H), 3,56 (с, 2H), 6,40 (шир. с, 1H), 7,16-7,25 (м, 2H), 7,54 (т, J=7,66 Гц, 1H).
Пример 13
[1-(3-Трифторметоксибензил)пиперидин-4-ил]-(5-трифторметил-[1,3,4]тиадиазол-2-ил)амин (E13)
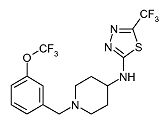
Смесь пиперидин-4-ил-(5-трифторметил-[1,3,4]тиадиазол-2-ил)амина (D4) (0,025 г, 0,10 ммоль), 3-трифторметоксибензальдегида (0,034 мл, 0,29 ммоль) и иммобилизованного на полимере триацетоксиборгидрида (2,07 ммоль/г) (0,165 г, 0,29 ммоль) в 1,2-дихлорэтане (2 мл) встряхивают при комнатной температуре в течение 16 ч. Затем реакционную смесь фильтруют через картридж Isolute SCX-2. Картридж промывают метанолом. Неочищенный продукт элюируют 7M раствором аммиака в метаноле. Растворитель упаривают в вакууме. Неочищенный продукт очищают колоночной флэш-хроматографией (силикагель; 5% аммиак в метаноле (7M)/дихлорметан) и получают E13 (0,029 г, 68%) в виде белого твердого вещества. C16H16F6N4OS требует 426; обнаружено: 427 (MH+).
Температура плавления: 116,3°C.
1H ЯМР (500 МГц, Хлороформ-d) δ м.д. 1,61-1,70 (м, 2H), 2,09-2,16 (м, 2H), 2,21 (т, J=10,98 Гц, 2H), 2,81-2,87 (м, 2H), 3,46-3,57 (м, 1H), 3,54 (с, 2H), 5,75 (д, J=5,78 Гц, 1H), 7,11 (д, J=8,09 Гц, 1H), 7,23 (дд, 2H), 7,34 (т, J=7,80 Гц, 1H).
Пример 17
5-[1-(3-Трифторметилбензил)пиперидин-4-иламино]-[1,3,4]тиадиазол-2-карбонитрил (E17)
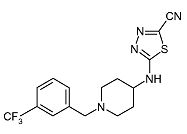
Смесь 5-(пиперидин-4-иламино)-[1,3,4]тиадиазол-2-карбонитрила (D6) (0,16 г, 0,76 ммоль), 3-(трифторметил)бензальдегида (0,152 мл, 1,14 ммоль) и триацетоксиборгидрида натрия (0,24 г, 0,95 ммоль) в N,N-диметилформамиде (3 мл) перемешивают при комнатной температуре в течение 16 ч. Затем реакционную смесь разбавляют этилацетатом и экстрагируют насыщенным раствором карбоната натрия (25 мл). Органический слой отделяют, сушат (Na2SO4) и растворитель упаривают в вакууме. Неочищенный продукт очищают колоночной флэш-хроматографией (силикагель; 1-4% аммиак в метаноле (7M)/дихлорметан) и получают E17 (0,025 г, 9%) в виде белого твердого вещества. C16H16F3N5S требует 367; обнаружено: 368 (MH+).
1H ЯМР (500 МГц, Хлороформ-d) δ м.д. 1,68-1,80 (м, 2H), 2,06-2,15 (м, 2H), 2,22 (т, J=10,69 Гц, 2H), 2,82-2,92 (м, 2H), 3,32-3,45 (м, 1H), 3,58 (с, 2H), 7,45 (т, J=7,66 Гц, 1H), 7,49-7,55 (м, 2H), 7,59 (с, 1H), 7,61-7,68 (м, 1H).
Пример 18
5-[1-(3-Фтор-5-трифторметилбензил)пиперидин-4-иламино]-[1,3,4]тиадиазол-2-карбонитрил (E18)
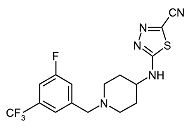
Смесь 5-(пиперидин-4-иламино)-[1,3,4]тиадиазол-2-карбонитрила (D6) (0,16 г, 0,76 ммоль), 3-фтор-5-(трифторметил)бензилбромида (0,124 мл, 0,76 ммоль) и диизопропилэтиламина (0,20 мл, 1,14 ммоль) в ацетонитриле (2 мл) и N,N-диметилформамиде (0,5 мл) перемешивают при комнатной температуре в течение 48 ч. Затем реакционную смесь разбавляют дихлорметаном и экстрагируют насыщенным раствором хлорида аммония (25 мл). Органический слой отделяют, сушат (Na2SO4) и растворитель упаривают в вакууме. Неочищенный продукт очищают колоночной флэш-хроматографией (силикагель; 2-3% аммиак в метаноле (7M)/дихлорметан) и получают E18 (0,019 г, 7%) в виде твердого вещества. C16H15F4N5S требует 385; обнаружено: 386 (MH+).
1H ЯМР (500 МГц, Хлороформ-d) δ м.д. 1,57-1,70 (м, 2H), 2,07-2,15 (м, 2H), 2,22 (т, J=11,13 Гц, 2H), 2,81-2,93 (м, 2H), 3,19 (шир. с, 1H), 3,58 (с, 2H), 3,64-3,73 (м, 1H), 7,24 (д, J=8,09 Гц, 1H), 7,28 (д, J=8,96 Гц, 1H), 7,40 (с, 1H).
Пример 19
5-[1-(3,4-Дифторбензил)пиперидин-4-иламино]-[1,3,4]тиадиазол-2-карбонитрил (E19)
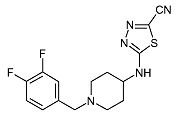
Смесь 5-хлор-[1,3,4]тиадиазол-2-карбонитрила (0,3 г, 2,06 ммоль) (D6) (полученного по способу, аналогичному описанному в US 5736545), 1-(3,4-дифторбензил)пиперидин-4-иламина (D7) (0,47 г, 2,06 ммоль) и диизопропилэтиламина (0,54 мл, 3,09 ммоль) в ацетонитриле (5 мл) в герметично закрытой пробирке перемешивают при 80°C в течение 1 ч при микроволновом облучении. Затем реакционную смесь разбавляют дихлорметаном и экстрагируют насыщенным раствором карбоната натрия (25 мл). Органический слой отделяют, сушат (Na2SO4) и растворитель упаривают в вакууме. Неочищенный продукт очищают хроматографией на короткой открытой колонке (силикагель; 0-2,5% аммиак в метаноле (7M)/дихлорметан). Целевые фракции собирают и упаривают в вакууме. Неочищенный продукт осаждают из ацетонитрила, получая E19 (0,17 г, 25%) в виде твердого вещества. C15H15F2N5S требует 335; обнаружено: 336 (MH+).
Температура плавления (ацетонитрил): 199,4°C.
1H ЯМР (500 МГц, Хлороформ-d) δ м.д. 1,64-1,83 (м, 2H), 2,15 (д, J=11,85 Гц, 2H), 2,24 (т, J=10,11 Гц, 2H), 2,89 (д, J=10,98 Гц, 2H), 3,46-3,58 (м, 3H), 6,74 (шир. с, 1H), 7,02-7,08 (м, 1H), 7,09-7,16 (м, 1H), 7,22 (т, J=9,25 Гц, 1H).
Пример 21
5-[1-(3,4,5-Трифторбензил)пиперидин-4-иламино]-[1,3,4]тиадиазол-2-карбонитрил (E21)
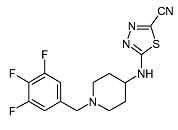
Смесь 5-хлор-[1,3,4]тиадиазол-2-карбонитрила (0,3 г, 2,06 ммоль) (D6) (полученного по способу, аналогичному описанному в US 5736545), 1-(3,4,5-трифторбензил)пиперидин-4-иламина [полученного по способу, описанному для (D1)] (0,50 г, 2,06 ммоль) и диизопропилэтиламина (0,54 мл, 3,09 ммоль) в ацетонитриле (5 мл) в герметично закрытой пробирке перемешивают при 80°C в течение 1 ч при микроволновом облучении. Затем реакционную смесь разбавляют дихлорметаном и экстрагируют насыщенным раствором карбоната натрия (25 мл). Органический слой отделяют, сушат (Na2SO4) и растворитель упаривают в вакууме. Неочищенный продукт очищают хроматографией на короткой открытой колонке (силикагель; 0-2,5% аммиак в метаноле (7M)/дихлорметан). Целевые фракции собирают и упаривают в вакууме. Неочищенный продукт осаждают из смеси ацетонитрил/диизопропиловый эфир и получают E21 (0,18 г, 24%) в виде твердого вещества. C15H14F3N5S требует 353; обнаружено: 354 (MH+).
Температура плавления (ацетонитрил/диизопропиловый эфир): 211,3°C.
1H ЯМР ((500 МГц, DMSO-d6) δ м.д. 1,47-1,59 (м, 2H), 1,98 (д, J=10,69 Гц, 2H), 2,15 (т, J=10,55 Гц, 2H), 2,73 (д, J=11,27 Гц, 2H), 3,48 (с, 2H), 3,64-3,75 (м, 1H), 7,21-7,32 (м, 2H), 8,81 (шир. с, 1H).
Пример 22
[1-(3,4-Дифторбензил)пиперидин-4-ил]-(4-трифторметилтиазол-2-ил)амин (E22)
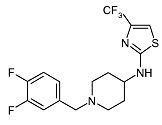
Смесь пиперидин-4-ил-(4-трифторметилтиазол-2-ил)амина (D9) (0,050 г, 0,2 ммоль), 3,4-дифторбензилбромида (0,028 мл, 0,22 ммоль) и диизопропилэтиламина (0,053 мл, 0,32 ммоль) в ацетонитриле (1 мл) перемешивают при 120°C в течение 5 мин при микроволновом облучении. Реакционную смесь разбавляют дихлорметаном и экстрагируют водой. Органический слой отделяют, сушат (Na2SO4) и растворитель упаривают в вакууме. Неочищенный продукт очищают колоночной хроматографией (силикагель; AcOEt). Целевые фракции собирают и упаривают в вакууме. Полученный продукт растворяют в ацетонитриле (0,5 мл) и обрабатывают раствором хлористоводородной кислоты в диэтиловом эфире (2M), получая соответствующую хлористоводородную соль E22 (0,071 г, 85%) в виде белого твердого вещества. C16H16F5N3S-HCl в виде свободного основания требует 377; обнаружено: 378 (MH+).
Температура плавления (ацетонитрил): 238°C.
1H ЯМР (400 МГц, DMSO-d6) δ м.д. 1,78-1,93 (м, 1,5H), 1,95-2,06 (м, 0,5H), 2,13 (м, 2H), 2,97-3,11 (м, 1,5H), 3,11-3,27 (м, 1H), 3,34 (м, 1,5H), 3,69-3,85 (м, 0,75H), 3,90-3,98 (м, 0,25H), 4,25 (д, J=5,18 Гц, 1,5H), 4,30 (д, J=5,39 Гц, 0,5H), 7,36 (д, J=1,24 Гц, 0,75H), 7,41 (д, J=1,04 Гц, 0,25H), 7,43-7,60 (м, 2H), 7,82 (ддд, J=11,51, 7,88, 1,97 Гц, 1H), 8,30 (шир. с, 0,75H), 8,48 (д, J=5,60 Гц, 0,25H), 11,03 (шир. с, 0,25H), 11,22 (шир. с, 0,75H).
Соединение примера (E3) получают из (D2) и соответствующего алкилирующего реагента по способу, используемому для получения соединения примера (E2). Соединения примеров (E6-E8) получают из (D4) и соответствующих алкилирующих реагентов по способу, используемому для получения соединения примера (E5). Соединения примеров (E11-E12) получают из (D4) и соответствующих альдегидов по способу, используемому для получения соединения примера (E10). Соединения примеров (E14-E16) получают из (D4) и соответствующих альдегидов по способу, используемому для получения соединения примера (E13).
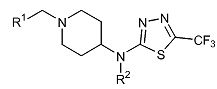

Соединения примеров (E20-E21) получают из 5-хлор-[1,3,4]тиадиазол-2-карбонитрила (D6) и соответствующих производных 1-(бензил)пиперидин-4-иламина по способу, используемому для получения соединения примера (E19). Соответствующие производные 1-(бензил)пиперидин-4-иламина получают из трет-бутилового эфира пиперидин-4-илкарбаминовой кислоты и соответствующих алкилирующих реагентов по способу, используемому в описании (D7).

Нижеследующие соединения дополнительных примеров (E23-E25) получают из (D9) и соответствующих алкилирующих реагентов по способу, используемому для получения соединения примера (E22). Соединения примеров (E22-E25) выделяют в виде солей хлористоводородной кислоты.
Фармакология
Анализ аффинности связывания человеческого рецептора D2 L in vitro
Замороженные мембраны клеток CHO, трансфицированных человеческим рецептором допамина D2L, оттаивают, гомогенизируют в течение короткого периода времени с помощью гомогенизатора Ultra-Turrax T25 и разбавляют буфером для анализа Tris-HCl, содержащим NaCl, CaCl2, MgCl2, KCl (50, 120, 2, 1 и 5 мМ, соответственно, доведенного до pH 7,7 с помощью HCl), до получения подходящей концентрации белка, оптимизированной для специфического и неспецифического связывания. Радиоактивно меченный лиганд [3H]спиперон (NEN, удельная активность ~70 Ки/ммоль) разбавляют буфером для анализа до концентрации 2 нмоль/л. Затем полученный раствор радиоактивно меченного лиганда (50 мкл) вместе с 50 мкл либо 10% ДМСО в качестве контроля, либо бутакламола (конечная концентрация 10-6 моль/л), либо тестируемого соединения, инкубируют (30 мин, 37°C) с 400 мкл полученного мембранного препарата. Мембрано-связанную активность фильтруют с помощью харвестера Packard Filtermate на GF/B Unifilterplates и промывают охлажденным на льду буфером Tris-HCl (50 мМ; pH 7,7; 6×0,5 мл). Фильтры оставляют сохнуть, затем добавляют сцинтилляционную жидкость и считают в сцинцилляционном счетчике Topcount. Процент специфического связывания и кривые конкурентного связывания рассчитывают с помощью программного обеспечения S-Plus (Insightful). Соединения имеют значения pIC50>5,0.
Быстрая диссоциация
Чтобы определить скорость диссоциации, соединения, имеющие IC50 менее 10 мкм, тестируют с помощью непрямого анализа, разработанного на основе способа, описанного Josee E. Leysen and Walter Gommeren, Journal of Receptor Research, 1984, 4(7), 817-845. Соединения в концентрации, превышающей их IC50 в 4 раза, вначале инкубируют в течение одного часа с клеточными мембранами, содержащими человеческий рецептор D2L, в объеме 2 мл при 25°C, после чего фильтруют через фильтр из стекловолокна под вакуумом, используя 40-луночный держатель. Сразу после этого вакуум убирают. На фильтр добавляют 0,4 мл заранее нагретого буфера (25°C), содержащего 1 нМ [3H]спиперона, и инкубируют в течение 5 минут. Инкубацию останавливают вакуумированием и сразу промывают 2×5 мл охлажденного на льду буфера. Связанную с фильтром радиоактивность измеряют с помощью жидкостного сцинтилляционного спектрометра. В основе анализа лежит допущение, что чем быстрее соединение отсоединяется от рецептора D2, тем быстрее [3H]спиперон связывается с рецептором D2. Например, если рецепторы D2 инкубируют с клозапином в концентрации 1850 нМ (4×IC50), связывание [3H]спиперона после 5 минут инкубации на фильтре составляет 60-70% от его общей связывающей способности (измеряемой в отсутствие лекарственного средства). При инкубации с другими антипсихотическими средствами связывание [3H]спиперона варьирует от 20 до 50%. Тестируемые соединения считают быстро диссоциирующими антагонистами D2, если они диссоциируют так же быстро, как и клозапин, или быстрее чем клозапин, который используют при каждой фильтрации. Соединения имеют скорость диссоциации, превышающую скорость диссоциации клозапина, то есть, >50%.