Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ ОСОБО ЧИСТОГО ПРЕПАРАТА ФЕРРОКСИДАЗЫ ЦЕРУЛОПЛАЗМИНА И/ИЛИ ФАКТОРА СВЕРТЫВАНИЯ КРОВИ ПРОТРОМБИНА. АФФИННЫЙ НЕОМИЦИНОВЫЙ СОРБЕНТ ДЛЯ ИХ ПОЛУЧЕНИЯ
Вид РИД
Изобретение
Изобретение относится к области медицины и фармакологии и применимо для получения чистых препаратов церулоплазмина (CP) и/или протромбина (FII).
Изобретением является способ выделения препаратов путем двух последовательных хроматографии, позволяющий быстро и с высоким выходом получить высокоочищенный CP из плазмы крови или сыворотки человека и других млекопитающих, а также выделить чистый FII, профермент сериновой протеазы тромбина (FIIa), из плазмы крови человека для использования его в дальнейшем в качестве сырья для количественной наработки гемостатика FIIa. Для разделения фракций CP и FII создан аффинный сорбент на основе антибиотика неомицина.
Церулоплазмин (CP, ферро:O2-оксидоредуктаза) - основной медьсодержащий белок плазмы крови с М~132 кДа. Являясь белком острой фазы воспаления [J. Biol. Chem., 1988, V.263, №13, P.6281-6287], CP проявляет широкий спектр антиоксидантных активностей: ферроксидазная [J. Biol. Chem., 1966, V.241, №21. P.5053-5059], купрооксидазная [FEBS Letters, 2003, V.554, №3. P.422-426], супероксиддисмутазная [Биохимия, 1988, Т.53, №12, С.2051-2058], NO-оксидазная [Nat. Chem. Biol., 2006, V.2, №9, P.486-493], глутатион-пероксидазная [FEBS Letters, 1998, V.437, №3. P.293-296].
Известно, что только интактный CP обладает глутатион-пероксидазной активностью [FEBS Letters, 1998, V.437, №3, P.293-296]], встраивает по безрадикальному пути окисляемое железо в ферритин [Arch. Biochem. Biophys., 2000, V.381, №1, Р.119-126] и ингибирует провоспалительные свойства миелопероксидазы [Free Rad. Res., 2008, V.42, №11-12, P.989-998] и 5-липоксигеназы [Биохимия, 2010, Т.75, №12, С.1687-1694].
Среди многочисленных функций CP, главная, ферроксидазная, т.к. при наследственном заболевании человека, ацерулоплазминемии, обусловленной дефектами гена CP [Biometals, 2003, V.16, P.295-213], у таких пациентов обнаружено нарушение обмена железа с массивными его отложениями в биоптатах печени [J. Hepatology, 2002, V.36, P.851-856].
CP является лекарственным средством и интенсивно изучается наукой: более 7200 статей в PubMed можно найти по ключевому слову «церулоплазмин» на 2011 год. Разработка эффективного способа очистки и, особенно важно, выделение непротеолизованного CP, что всегда являлось большой проблемой при всех способах его получения, с перспективой использования в фармацевтической промышленности, представляется актуальной в настоящее время.
Выделение препаратов CP сопряжено с рядом трудностей: 1) данный белок чрезвычайно подвержен протеолитической деградации [FEBS Letters, 1971, V.18, №2, P.321-325]; 2) одной из основных примесей CP является FII [J. Biol. Chem., 1999, V.274, №29, P.20265-20270], который может быть источником FIIa, вызывающего протеолитическую деградацию CP при хранении [Мед. Акад. Жур. 2010, Т.10, №5, С.63-64]; 3) при изменении pH среды (ниже 5 или выше 9) или добавлении хелаторов (ЭДТА, 1,10-фенантролин) CP может терять ионы меди [J. Biol. Inorg. Chem., 1999, V.4, №4, P.441-446., Biochem. J., 1967, V.105, №1, P.243-250], что требует использования буферов с нейтральными значениями pH, отсутствия высоких концентраций стабилизаторов плазмы с хелатирующими свойствами, а также изучения свойств сорбентов, используемых для выделения белка, на отсутствие у них способности удалять ионы меди из СР.
Одним из методических подходов, направленных на снижение вероятности протеолитической деградации CP, является добавление в исходную плазму ингибиторов сериновых и металлзависимых протеиназ [Eur. J. Biochem. 1979, V.94, №1, P.127-134, Arch. Biochem. Biophys. l994, V.309, №2. P.392-395]. Однако классический ингибитор сериновых протеиназ, PMSF (фенилметилсульфонилфторид), довольно быстро гидролизуется в водной среде и после этого не способен ингибировать спонтанно образующиеся из проферментов сериновые протеиназы [Biotechnol. Bioeng. 1996, V.50, №3, P.329-335], а добавление спиртового раствора PMSF на всех этапах выделения CP грозит денатурацией белка.
Ингибиторы металлзависимых протеиназ, например, ЭДТА и 1,10-фенантролин, хелатириуют ионы меди CP и снижают его активность [Biochem. J., 1967, V.105, №1, P.243-250], поэтому их применяют только на первой стадии очистки CP, т.е. добавляют в исходную плазму.
Авторами было показано, что при «спонтанном» протеолизе препаратов CP в результате хранения, спектр фрагментов совпадает со спектром, полученным при ограниченном протеолизе CP FIIa [Мед. Акад. Жур. 2010, Т.10, №5, С.63-64]. Кроме того, по данным Вестерн-блоттинга было обнаружено, что добавление ингибитора FIIa, гирудина, препятствует протеолизу белка при хранении плазмы в стерильных условиях. Таким образом, было доказано, что FIIa является главной протеиназой, вызывающей протеолитическую деградацию CP в его препаратах, а, возможно, и в русле крови, где по данным Вестерн-блоттинга, CP человека уже протеолизован на 10%.
На основе этих данных установлено, что удаление примесей FIIa и FII является необходимым условием для получения препарата CP, стабильного при хранении [Мед. Акад. Жур. 2010, Т.10, №5, С.63-64].
Среди предложенных до сих пор способов выделения CP известны следующие подходы: осаждение белка охлажденной смесью этанол-хлороформ (9:1) [Acta. Chem. Scand., 1948, V.2, №7, P.550-556] и хроматография на разных носителях: на гидроксилапатите [J. Biol. Chem. 1964, V.239, P.3325-3330], на «аминоэтил-агарозе» [Biochem. Int. 1988, V.16, №2, P.199-208], на пара-фенилендиамин-сефарозе [FEBS Letters 1992, V.298, №2-3, P.105-108], на протамин-сефарозе [Биоорг. Химия, 2005, Т.31, №3, С.269-279] и описанном недавно сорбенте на основе ахаран сульфата [Arch. Pharm. Res. 2009, V.32, №5, P.693-698]. Все указанные методы имеют свои недостатки.
Известно, что осаждение CP добавлением к белку 2-3-х объемов охлажденной смеси этанол-хлороформ (9:1), хотя и приводит к необратимой денатурации значительного количества примесных белков, но при этом также денатурирует и часть самого СР. Чем более очищен от примесных белков препарат CP, тем выше доля его потерь при процедуре осаждения и последующего растворения в буфере. Способ также неудобен для осаждения CP из больших объемов, поскольку требует центрифугирования и подбора материалов, инертных к хлороформу. Кроме того, производные хлороформа (в т.ч. фосген), спонтанно накапливающиеся при его хранении, способствуют поперечным сшивкам белка. Полимерные формы CP неоднократно были описаны независимо несколькими группами исследователей, проводивших очистку CP с применением такой методики [Биоорг. Химия, 2005, Т.31, №3, С.269-279., J. Biol. Chem., 1990, V.265, №5. P.2533-2537].
Известно, что хроматография на гидроксилапатите, хотя и позволяет эффективно разделить изоформы CP, отличающиеся по углеводному составу, приводит к частичной потере белком ионов меди и переходу его в апо-форму [J. Biol. Chem. 1964, V.239, P.3325-3330].
Известен способ очистки CP с получением сорбента «аминоэтил-агарозы» [Biochem. Int. 1988, V.16, №2, Р.199-208, Biochem. Int. 1992, V.27, №2, P.281-289 J. Biol. Chem., 1999, V.274, №29, P.20265-20270], позволяющий получить CP в один этап. Но способ трудно воспроизводится из-за жестких условий синтеза: высокощелочная среда, температура 70° и применение 2-хлорэтиламина, образующего в данных условиях летучее высокотоксичное вещество, этиленимин. Существенным недостатком этого сорбента является, так называемый, «свертывающий» эффект, выражающийся в спонтанном свертывании плазмы крови в процессе хроматографии [Biochem. Int. 1988, V.16, №2, P.199-208., Prep. Biochem. 1994, V.24, №3-4. P.237-250]. Этот эффект сопряжен с сорбцией на том же сорбенте FII, очистка которого осуществляется ступенчатой элюцией хлоридом кальция [Biometals 1996, V.9, №1. P.66-72]. Кроме того, в элюированном с сорбента CP частично восстановлены ионы меди I типа, что затрудняет измерение основного критерия чистоты CP A610/A280 - соотношения поглощения характерного для этих ионов, A610, и ароматических аминокислот белка, A280. Данный критерий чистоты можно измерить только после окисления аликвоты препарата CP пероксидом водорода [Biochemistry 1998, V.37, №26. P.9570-9578].
Известен сорбент на основе пара-фенилендиамина (р-PD). Он требует многостадийного синтеза, лиганд частично окисляется, как в процессе синтеза, так и при хроматографии на нем CP, что делает неудобной визуальную оценку сорбции белка на колонке. Кроме того, данный сорбент не позволяет получить высокоочищенный CP и требует иммуноаффинной хроматографии для удаления примесей белка [FEBS Letters 1992, V.298, №2-3. Р.105-108].
Известен сорбент, протамин-сефароза, на основе протамина, низкомолекулярного белка спермы лососевых, содержащего более 80% катионных групп аргинина, позволяющий получить очищенный CP за счет его взаимодействия с протамином [Биоорг. Химия, 2005, Т.31, №3. С.269-279]. Но при многократном применении сорбент постепенно теряет сродство к CP из-за протеолитической деградации протамина под действием протеиназ плазмы крови. Кроме того, осуществление такого способа требует фильтрации исходной плазмы либо препарата CP через колонки с аргинин- и гепарин-сефарозой для удаления FII и FIIa.
Известен сорбент на основе полисахарида африканских улиток, ахаран сульфата [Arch. Pharm. Res. 2009, V.32, №5. P.693-698]. Такой сорбент требует выделения лиганда из улиток и не отличается высоким выходом белка, поскольку авторы описали выделение 6 мг CP из 250 мл плазмы, что составляет не более 10% от количества CP, которое должно содержаться в таком объеме плазмы. Отсутствие в публикации критерия чистоты полученного препарата CP, A610/A280, и данных о его стабильности затрудняет оценку практической ценности данного сорбента.
Целью изобретения было синтезировать доступный сорбент, который бы позволил получать высокоочищенный препарат CP без примеси FII, не деградирующий под действием компонентов плазмы крови, и разработать с его помощью способ выделения, не требующий осаждения CP органическими растворителями и лиофилизации. Целью изобретения было также выделить препарат FII в качестве сырья для наработки в дальнейшем гемостатика FIIa.
Задача решена с помощью создания сорбента на основе антибиотика неомицина. Сущностью изобретения является способ выделения препаратов путем двух последовательных хроматографии на анионных сорбентах, позволяющий быстро и с высоким выходом получить высокоочищенный CP из плазмы крови или сыворотки человека и других млекопитающих, а также выделить чистый FII из плазмы крови человека. Для второй аффинной хроматографии используют сорбент, синтезированный авторами, представляющий собой антибиотик неомицин, пришитый к агарозе. Наличие в сорбенте аминогрупп позволяет сорбировать отрицательно-заряженные CP и FII. В способе выделения используются водно-солевые растворы с физиологическими значениями рН, препарат CP не требует лиофилизации и сохраняет свои характеристики при хранении в растворе в течение 2-х месяцев в стерильных условиях даже при +37°C. При разделении фракций на неомицин-агарозе также получен препарат FII, что делает возможным его использование для получения FIIa, широко используемого в медицине в качестве наружного гемостатического средства.
Процедура выделения CP из 1.4 л цитратной плазмы человека занимает всего 2 дня, включает ионообменную хроматографию на UNOQ-Sphere (сильный анионный сорбент, содержащий -(+)N(СН3)3 - функциональные группы, «BIO-RAD») и аффинную хроматографию на неомицин-агарозе - сорбенте, синтезированном авторами. Это увеличивает степень очистки образца по активности, т.е. содержащихся в исходной плазме 348 мг CP в 412 раз.
Выход CP по активности с неомицин-агарозы при 3-х независимых процедурах выделения составляет от 98 до 99%, т.е. результат статистически достоверен. Полученный препарат CP человека содержит 5.9±0.1 моль меди на моль CP, обладает высоким критерием чистоты A610/A280~0.052 (основной критерий чистоты CP, характеризуется соотношением поглощения, характерного для ионов меди 1 типа, A610, и ароматических аминокислот белка, A280), не содержит иммунореактивных FII и активного FIIa, главной протеиназы, вызывающей протеолитическую деградацию СР. В результате такой препарат CP стабилен при хранении в физиологическом растворе (рН 7.4) в стерильных условиях при +37°С в течение 2-х месяцев, а при +4°C - до 6 месяцев.
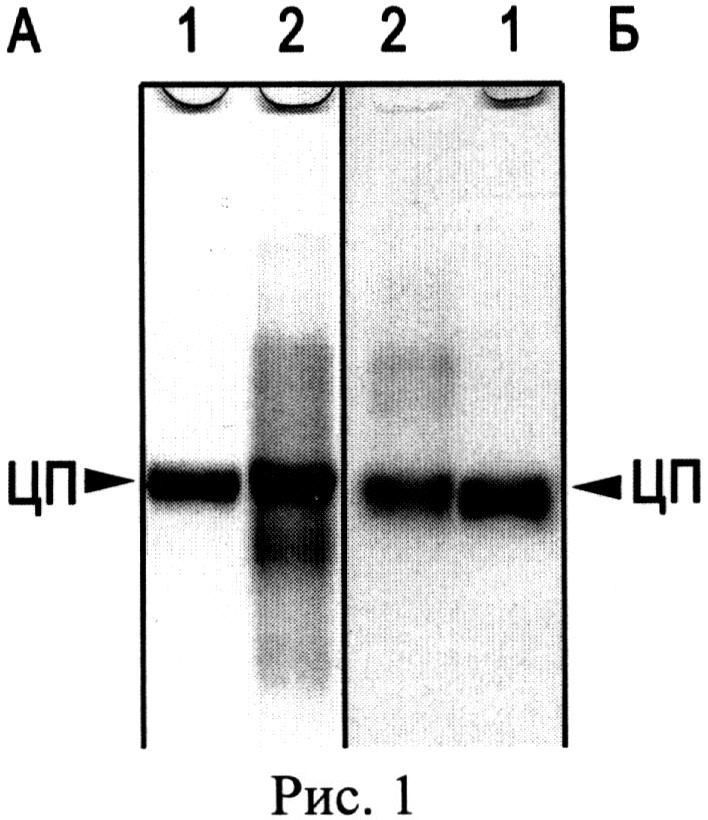
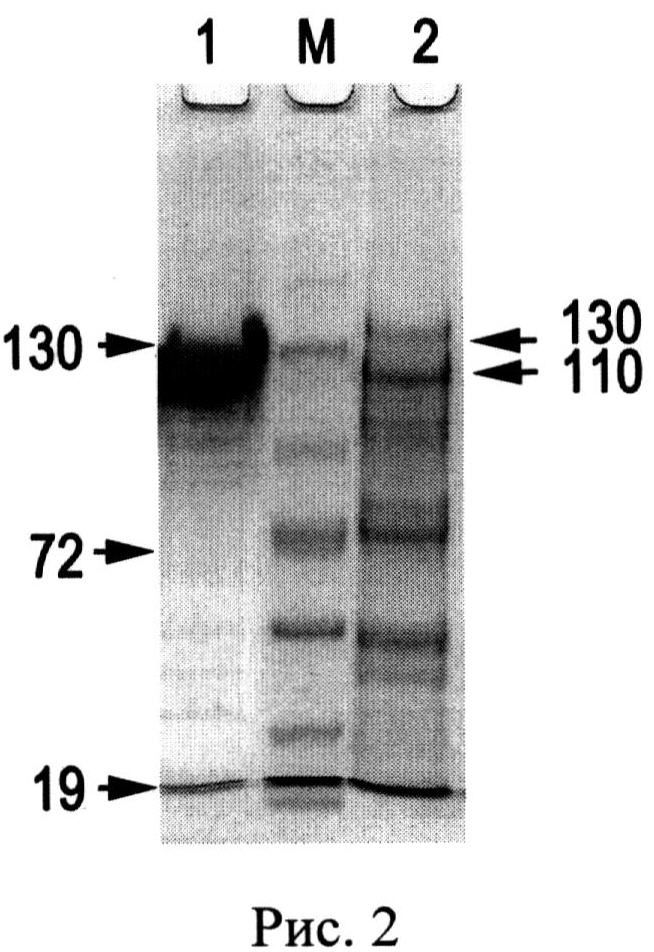
Известен лекарственный препарат лиофилизированного церулоплазмина человека для инъекций, выпускаемый ФГУП НПО «Микроген» МЗ РФ, утвержденный в 1990 году Фармакологическим комитетом (регистрационный номер 90/411/1). Лекарственное средство CP применяют для стимуляции гемопоэза, в качестве антиоксиданта в комплексной терапии онкологических больных и раннем послеоперационном периоде у больных с массивной кровопотерей. Проверка такого препарата в лабораторных условиях показала низкий показатель чистоты A610/A280=0.0087, его неоднородность (Рис.1. Электрофореграмма после диск-электрофореза без SDS в ПААГ: А - окраска Кумасси R-250, Б - окраска о-дианизидином на оксидазную активность, 50 мкг белка на дорожке: 1 - препарат CP человека, выделенный описанным способом, 2 - лекарственный препарат CP человека) и наличие до 90% протеолизованного CP (Рис.2. Электрофореграмма после электрофореза в SDS-ПААГ, окраска Кумасси R-250, 50 мкг белка на дорожке: 1 - препарат CP человека, выделенный описанным способом, 2 - лекарственный препарат CP человека. М - окрашенные маркеры молекулярной массы, стрелками указаны значения М в кДа).
Выделенный заявляемым способом препарат CP содержит 90% 132 кДа недеградированного CP, а протеолитические фрагменты составляют не более 10% от общего белка (Рис.2,1). Аптечный препарат CP содержит всего 10% 132 кДа недеградированного белка и представлен, в основном, протеолитическими фрагментами с меньшей молекулярной массой: 110 кДа, 67 кДа, 52 кДа и менее (Рис.2,2). Такой фрагментированный CP теряет важные антиоксидантные свойства. Например, не ингибирует миелопероксидазу, прооксидантный фермент нейтрофилов, продуцирующий цитотоксический гипохлорид-ион (ClO-) при воспалении [Free Rad. Res., 2008, V.42, №11-12. P.989-998]. Кроме того, процесс лиофилизации, использованный в производстве лекарственного препарата, способствует потере ионов меди CP: по данным измерения содержания ионов меди в аптечном препарате CP оказалось, что около 75% ионов меди не входит в состав активного белка этого медьпротеида. Следовательно, у такого препарата снижены оксидазные свойства. Лиофилизированный CP проявляет в 5 раз меньшую удельную активность в отношении общепринятого субстрата, пара-фенилендиамина (р-PD): 0.195 U/мг, по сравнению с 0.994 U/мг - удельной активности CP, выделенного заявляемым способом.
При поиске альтернативных лигандов для выделения CP авторы заявляемого изобретения обратили внимание на антибиотики аминогликозидного ряда: гентамицин, канамицин и неомицин. Наличие в их структуре нескольких аминогрупп, выведение из кровотока в неизменном виде и относительно низкое связывание с белками плазмы крови, по данным фармокинетики [Infection 1978, V.6, №2. P.57-64], позволило, с одной стороны, ожидать, что анионный CP будет связываться с ними по электростатическому принципу, а с другой, предполагало наличие незначительного количества примесей других белков плазмы и стабильность сорбентов, полученных на их основе к действию компонентов плазмы.
Предварительные опыты по сорбции CP на иммобилизованных на BrCN-активированной агарозе гентамицине, канамицине и неомицине показали наилучшую сорбцию в последнем случае, что качественно совпало с увеличением количества первичных аминогрупп: 2, 4 и 6, соответственно. Очевидно, структура неомицинового сорбента и его химический состав играют важную роль в процессе качественной очистки с высоким выходом конечных продуктов, CP и FII.
Иммобилизацию неомицина осуществляют добавлением трисульфата неомицина (SIGMA-Aldrich) к BrCN-активированной агарозе в PBS (100 мг/мл влажного геля). Бромциан получают бромированием KCN в двухфазной системе: вода-дихлорэтан. Полученный раствор BrCN в дихлорэтане используют для активации агарозного геля Bio-Gel А 1.5 m fine [Биоорг. Химия. 2005. Т31, №3, С.269-279]. PBS (phosphate buffer saline) - 0.15 M NaCl, pH 7.4, 1.9 мМ Na2HPO4/8.1. мМ NaH2PO4.
Анионный сорбент, неомицин-агароза, содержащий NH2-группы, ранее не был получен и использован где-либо. С неомицин-агарозой аффинно взаимодействуют некоторые отрицательно заряженные белки плазмы крови, например, CP и FII, которые можно разделить и очистить при элюциии линейным градиентом CaCl2. Удельная динамическая сорбция (УДС) обоих белков составляет от 7-10 мг/мл неомицинового сорбента. При очистке CP из сыворотки крови крысы и кролика УДС была несколько ниже и составляла от 3-х до 5 мг CP/мл сорбента.
Сыворотка крови, получаемая в результате коагуляции, в отличие от плазмы содержит только следы FII, активирующегося в FIIa, который удаляют с фибриновым сгустком. Поэтому неомициновый сорбент не подходит для выделения FII из сыворотки крови.
Разработанный 2-стадийный способ получения особо чистого CP с хроматографической очисткой на UNOQ-Sphere и на неомицин-агарозе из плазмы/сыворотки крови дает высокий выход очищенного и стабильного при хранении CP, не содержащего примесей FII и FIIa. Фракции FII-элюата с неомицин-агарозы содержат его с высокой концентрацией и достаточной чистотой для использования в качестве полуфабриката для получения гемостатика FIIa.
При работе с объемами плазмы менее 0.5 л процедура выделения занимает 1 рабочий день, а при объеме 1.4 л - 2 рабочих дня.
Заявляемый способ выделения CP состоит из 2-х последовательных стадий:
1. Хроматография цельной, без разведения цитратной плазмы на колонке UNOQ-sphere (30×2.5 см). Последовательная отмывка колонки от балластных белков PBS и 40 мМ триэтаноламина-HCI, рН 7.4. Элюция белковых фракций CP (окрашены в синий цвет за счет ионов меди I типа), содержащих FII, линейным градиентом по 200 мл 0-0.5 М NaCI, содержащим 40 мМ триэтаноламина-HCI, рН 7.4;
2. Хроматография на колонке с неомицин-агарозой (12×2.5 см), разведенных в 10 раз 20 мМ триэтаноламином-HCI, рН 7.4, объединенных «синих» фракций CP, содержащих примесь FII. Колонку отмывают 40 мМ триэтаноламин-HCI (рН 7.4). Чистые фракции CP и FII получают линейным градиентом по 120 мл 0-100 мМ CaCl2, содержащим 40 мМ триэтаноламина-HCI, рН 7.4.
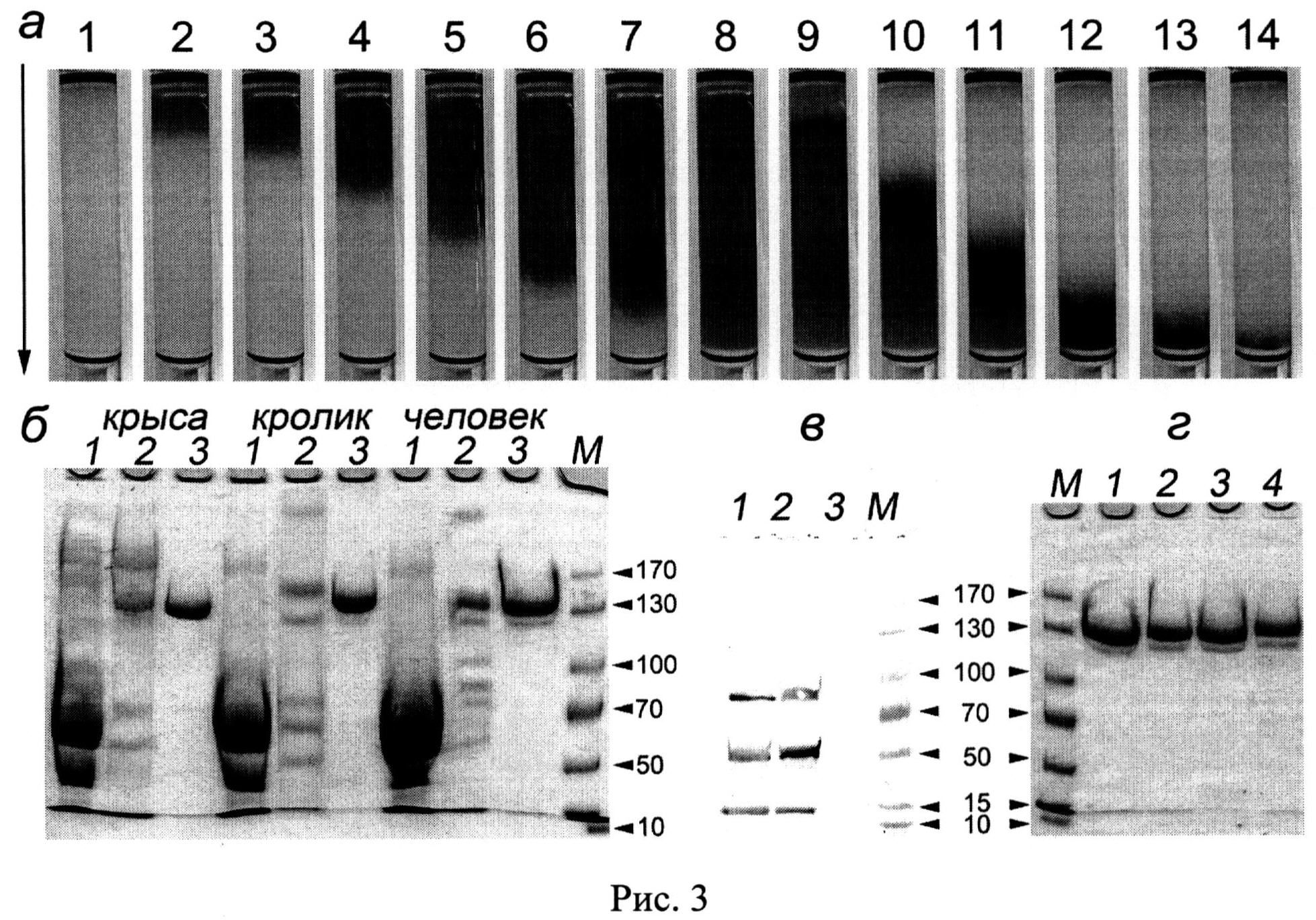
(Рис.3: Постадийная очистка препаратов CP крысы, кролика и человека.
а - вид колонки с неомицин-агарозой при хроматографии CP человека, полученного с UNOQ-Sphere: 1 - до нанесения CP-содержащей фракции, 2-7 - сорбция «синего» CP на неомицин-агарозе, 8 - колонка после отмывки балластных белков, 9-11 - элюция CP градиентом CaCl2, 12-14 - выход СР-содержащей фракции с колонки. Стрелкой указано направление потока; б, г - Электрофореграммы после электрофорез в SDS-ПААГ, окраска Кумасси R-250, б-1 - исходных плазмы человека и сыворотки крови кролика и крысы, б-2 - объединенных CP-фракций, элюированных с UNOQ-Sphere и б-3 - очищенных CP человека, кролика и крысы после неомицин-агарозы; г - Препарат CP человека, хранившийся в стерильных условиях при 37°: 1 - исходный препарат, 2 - через 1 неделю, 3 - через 1 месяц, 4 - через 2 месяца после выделения. М - окрашенные маркеры молекулярной массы, стрелками указаны значения М в кДа).
Рабочий вариант выполнения.
Пример №1. Синтез неомицин-агарозы:
Иммобилизацию неомицина осуществляют добавлением трисульфата неомицина (SIGMA-Aldrich) к BrCN-активированной агарозе в PBS (70-100 мг/мл влажного геля). Бромциан получают бромированием KCN в двухфазной системе: вода-дихлорэтан. Полученный раствор BrCN в дихлорэтане используют для активации агарозного геля Bio-Gel А 1.5 m fine.
Пример №2. Способ очистки CP и выделения FII:
В качестве источника CP человека используют цитратную плазму крови, получаемую при плазмаферезе у больных подагрой в токсикологическом отделении ВМА (Санкт-Петербург), которую хранят замороженной после медицинской процедуры и с информированного согласия пациентов предоставляют для выделения белка. В течение первого рабочего дня работу ведут в холодной комнате (+4 - +8°С), плазму размораживают, сгустки фибрина удаляют фильтрацией на флизелиновом фильтре. К 1.4 л профильтрованной плазмы добавляют 0.5 мкМ ЭДТА и 2 мМ 6-аминокапроновой кислоты и наносят ее со скоростью 10 мл/мин на колонку с UNOQ-Sphere (30×2.5 см), предварительно уравновешенную PBS. Колонку последовательно отмывают от балластных белков PBS и 40 мМ триэтаноламин-HCl (рН 7.4) до A280<0.005 в оттекающем с колонки растворе. Раствором триэтаноламин-HCl (рН 7.4) заменяют PBS, т.к. фосфатный буфер формирует с CaCl2 нерастворимый осадок. Отмытую колонку оставляют на ночь в холодной комнате. На следующий день колонку соединяют с хроматографом Bio-Rad DuoFlow 20 и используют при хроматографии растворы, охлажденные на льду. Элюцию белков проводят со скоростью 2 мл/мин линейным градиентом по 200 мл 0→0.5 М NaCl, содержащим 40 мМ триэтаноламин-HCl, рН 7.4. Окрашенные в синий цвет за счет ионов меди фракции CP объединяют, разбавляют в 10 раз 20 мМ триэтаноламин-HCl, рН 7.4 и наносят со скоростью 5 мл/мин на колонку с неомицин-агарозой (12×2.5 см), уравновешенную 40 мМ триэтаноламин-HCl, рН 7.4. Колонку промывают 40 мМ триэтаноламин-HCl, рН 7.4 до A280<0.005 в оттекающем с колонки растворе. Элюцию белков проводят со скоростью 2 мл/мин с помощью линейного градиента по 120 мл 0→100 мМ CaCl2, содержащих 40 мМ триэтаноламин-HCl, рН 7.4. Окрашенные в синий цвет фракции CP объединяют, концентрируют на ячейке VivaSpin 20, дважды разбавляя сконцентрированный до 2 мл белок 18 мл 40 мМ триэтаноламин-HCl (рН 7.4), для удаления CaCl2.
На всех стадиях очистки анализируют активность CP в отношении p-PD [Lab. Clin. Med. 1961, V.58, P.161-168]. Для этого смешивают 1/100 СР-содержащей аликвоты (1-10 мкМ) с 0.4 М натрий-ацетатным буфером, рН 5.5, добавляя 0.05% p-PD. Удельную активность выражают в U на мг общего белка, где U - расчетное количество CP в мг, полученное измерением поглощения при А530 после 1 часа инкубации проб при +37°C [Lab. Clin. Med. 1961, V.58, P.161-168], умноженное на экспериментально определенный коэффициент, 0.875, мг/мл чистого CP и объем фракции в мл. Содержание общего белка определяют по методу Брэдфорда с использованием CP в качестве стандарта [Anal. Biochem., 1976, V.72. P.248-254]: в основе метода лежит образование окрашенного комплекса белка с красителем Кумасси G-250. Анализ гомогенности препарата проводят с помощью электрофореза в Ds-Na-ПААГ (7.5%-ный полиакриламидный гель с 0.1% додецилсульфатом Na) [Nature, 1970. V.227, №5260, P.680-685]. Наличие FII и FIIa определяют с помощью Вестерн-блоттинга (электропереноса белковых зон, полученных при электрофорезе в Ds-Na-ПААГ, на нитроцеллюлозу) по окраске 4-хлор-1-нафтолом иммунореактивных зон с антителами кролика к FII с помощью вторых антител против антител кролика, коньюгированных с пероксидазой хрена [Electrophoresis 1982, V.3, P.135-142], а также по активности FIIa гидролизом в PBS 0.1 мг/мл хромогенного субстрата Z-Ala-Ala-Arg-pNA·HBr [Клин. Лаб. Диагн. 2004. Т.7, С.18-21].
При нанесении на колонку с неомицин-агарозой объединенных фракций CP после хроматографии на UNOQ-Sphere, сорбцию CP наблюдают по увеличению вдоль сорбента синей границы, обусловленной окраской ионов меди I типа в CP (Рис.3-а). УДС CP человека составляет 9-10 мг CP на 1 мл неомицин-агарозы. Учитывая, что активность CP не снижается в процессе выделения белка, можно заключить, что при хроматографиях CP не утрачивает ионы меди, необходимые для проявления его оксидазных свойств. Действительно, определение содержания ионов меди в полученном препарате выявило 5.9±0.1 моль ионов на 1 моль CP, что согласуется с литературными данными о наличии в активном центре молекулы 6 ионов меди. По данным электрофореза в Ds-Na-ПААГ, в полученном CP преобладает зона недеградированного 132 кДа-белка (Рис.2.1).
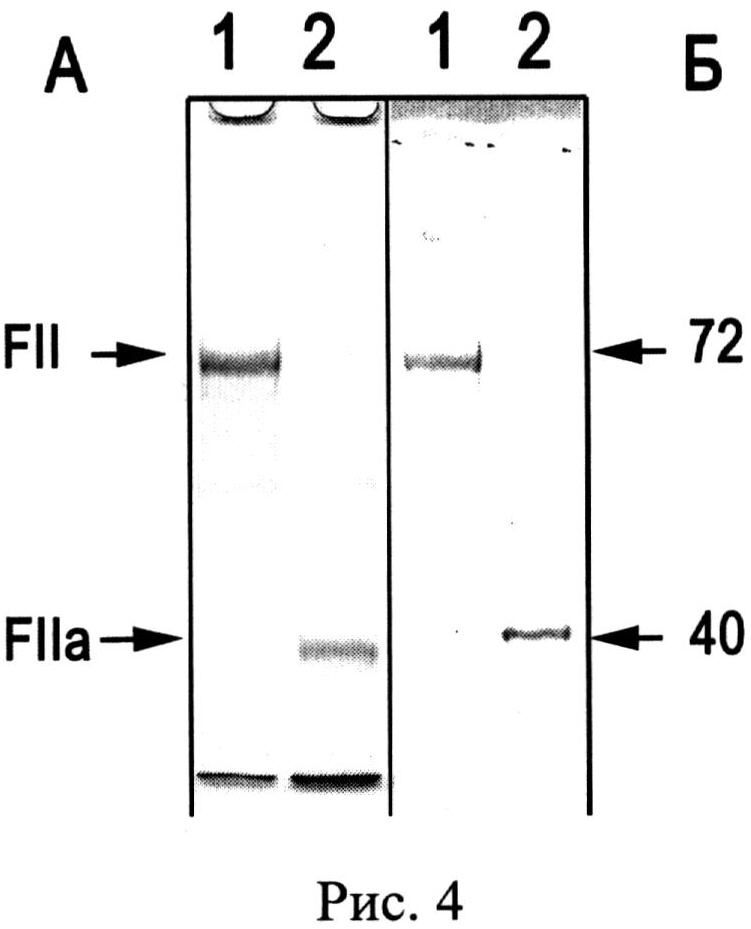
Определение иммунореактивных FII-зон во фракциях показывает,что после первого этапа хроматографии на UNOQ-Sphere, его примесь содержится в препарате CP человека (Рис.3, в-1,2). На втором этапе, при аффинной хроматографии такого препарата CP на неомицин-агарозе, элюция градиентом CaCl2 разделяет эти белки: FII элюируется в начале градиента, а CP - в конце градиента. Количество выделенного заявленным способом FII из 1.4 л плазмы человека составляет 75 мг. УДС неомицин-агарозы для FII составляет 7-10 мг/мл сорбента. FII хранят до активации при -20°C. FII можно использовать для получения антител к FII и FIIa и как полуфабрикат для получения FIIa, применяемого в качестве наружного гемостатического средства для медицинских и аналитических целей. Активацию FII в FIIa проводят, например, при пропускании FII через колонку с трипсин-сефарозой (Рис.4. Результаты активации протромбина (FII) при пропускании через трипсин-сефарозу. А - Вестерн-блоттинг с антителами к FII (1:10000, меченные пероксидазой вторые антитела 1:5000, окраска 4-хлор-1-нафтолом и H2O2), Б - Электрофореграмма после электрофореза в SDS-ПААГ, окраска Кумасси R-250, 20 мкг белка на дорожке: 1 - исходный FII, полученный на неомицин-сефарозе, 2 - тромбин (FIIa), полученный однократной фильтрацией FII через колонку, содержащую 5 мл трипсин-сефарозы, стрелками указаны значения Мв кДа). После активации, разведенный в 400 раз FIIa, сворачивает фибриноген (20 мг/мл) в фибрин в течение 1 мин. Т.о., с учетом хроматографии FII на трипсин-сефарозе, FIIa можно получить в 3 этапа.
По данным Вестерн-блоттинга с антителами против FII во фракциях CP после второй стадии очистки не содержится иммунореактивныех FII и Flla (Рис.3. в - Вестерн-блоттинг с антителами к FII (1:10000, меченные пероксидазой вторые антитела 1:5000, окраска 4-хлор-1-нафтолом и H2O2), 50 мкг белка на дорожке: 1 - исходная цитратная плазма человека, 2 - объединенные CP-содержащие фракции, элюированные с UNOQ-Sphere, 3 - объединенные CP-содержащие фракции, элюированные с неомицин-агарозы). Активный FIIa содержится только в исходной плазме и фракциях, элюированных с UNOQ-Sphere (Рис.3, в - 1,2), но отсутствует в препаратах очищенного на неомицин-агарозе CP (Рис.3, в-3). Критерий чистоты А610/А280 полученного CP, равен 0.052, что соответствует высокой степени очистки медьсодержащего белка. Конечный выход CP по активности составляет 99%.
На неомицин-агарозе из 1.4 л плазмы также получено 75 мг FII. Если считать, что FII содержится в плазме крови не более 70 мг/л и что он трудно поддается очистке [Зубаиров Д.М. в кн. «Молекулярные основы свертывания крови и тромбообразования», ФЭН, Казань 2000, с.63-82], описанным способом получен в 2 этапа и с хорошим выходом FII - 71%.
Данные по очистке CP человека суммированы в Таблице 1.
|
Процедура выделения CP из плазмы была независимо повторена 3 раза и каждый раз был получен CP с одинаково высокими характеристиками чистоты и высоким выходом конечного продукта.
Пример №3. Способ выделения особо чистого CP человека осуществляли аналогично примеру №2 с использованием 1400 мл цитратной плазмы крови, получаемой при плазмаферезе. Получено 348 мг СР. Конечный выход CP по активности приблизился к 98%. При хроматографии на неомицин-агарозе из элюата также получено 75 мг FII, выход которого составляет 71%.
Пример №4. Способ выделения особо чистого CP и препарата FII человека осуществляли аналогично примеру №2 с использованием 1.4 л цитратной плазмы крови, получаемой при плазмаферезе. Конечный выход CP по активности составил 99%. Выход FII составил 70%.
В примерах выполнения №3, №4 проведено выделение аналогично примеру №2 со средним выходом FII 70.5%, a CP по активности - 98.5%.
Хранение полученного CP в растворе в стерильных условиях при +37°C в течение 2-х месяцев не приводит к протеолитической деградации белка (Рис.3, г-4). Таким образом, полученный авторами высокоочищенный препарат не содержит активных FIIa и других протеиназ крови, способных приводить к протеолитической деградации CP, и, следовательно, не требует его лиофилизации. Хранение при +4°C без доступа воздуха позволяет хранить особо чистый препарат CP до 6 месяцев без потери основных характеристик препарата.
Суммарные данные по трем независимым процедурам выделения CP человека приведены в Таблице 2.
|
Точно также можно получать CP из сыворотки крови других млекопитающих, в частности, крысы и кролика, но без получения FII, который активируется в FIIa фибринового сгустка при коагуляции.
Пример №5. Выделение CP из сыворотки крови крыс (100-200 мл) проводили аналогично примеру №2.
Пример №6. Выделение CP из сыворотки крови кролика (100-200 мл) проводили аналогично примеру №2.
Данные по очистке CP крысы и CP кролика приведены в Таблице 3.
|
Т.о. заявляемый способ работает для выделения CP из плазмы/сыворотки крови человека и других млекопитающих, например, крысы и кролика.
Качественные отличия изобретения:
1. Высокий выход активного белка CP (до 99%);
2. Полученный препарат CP не содержит примесей протеиназ крови (FIIa и других), способных приводить к его протеолитической деградации. Это дает возможность хранить CP в стерильных условиях в физиологическом растворе без потери основных характеристик препарата, не применяя процесса лиофилизации;
3. Предлагаемый способ выделения CP отличается низкой ценой, поскольку UNOQ-Sphere, неомицин и активированные гели для присоединения лигандов, содержащих аминогруппы, коммерчески доступны и не дороги;
4. Процедуры хроматографии и синтеза сорбента легко воспроизводимы в лабораторных условиях и не требуют дополнительного фракционирования органическими растворителями. Условия выделения позволяют применять буферно-солевые растворы с физиологическими значениями рН, не повреждающие CP, выделяемый из плазмы/сыворотки крови человека и других млекопитающих;
5. Существенным преимуществом предлагаемого способа является отсутствие необходимости разведения исходной цитратной плазмы на первом этапе очистки, тогда как для выделения CP из плазмы или сыворотки на диэтиламиноэтил-сорбентах, «аминоэтил-агарозе» и «пара-фенилендиамин-сефарозе», исходный материал требует разведения от 3-х до 20 раз, что существенно увеличивает время сорбции белка на колонке и его контакта с балластными компонентами плазмы, в том числе протеиназами крови;
6. Короткое время выделения, 1-2 дня, в зависимости от объема плазмы: сорбенты UNOQ-Sphere эффективно сорбируют целевой белок из неразведенной плазмы или сыворотки на скоростях потока 10 мл/мин и более. Учитывая, что CP-содержащие фракции после элюции с первого сорбента разводят в 10 раз 20 мМ триэтаноламином-HCI, суммарное время, необходимое для нанесения CP и элюцию балластных белков с колонки неомицин-агарозы, не превышает 2-х часов;
7. Важным преимуществом заявляемого способа и неомицинового сорбента является возможность многократного использования колонки с неомицин-агарозой без жестких условий ее санации, т.к. применение первого шага с фракционированием белков плазмы на сорбентах UNOQ-Sphere уменьшает вероятность контаминации препарата CP компонентами плазмы.
8. Колонки с UNOQ-Sphere и неомицин-агарозой с адсорбированными CP и FII после элюции балластных белков можно законсервировать и хранить при +4°C в течение, по крайней мере, недели без заметного уменьшения активности или выхода белков с колонки;
9. Выделяя чистый целевой продукт CP с неомицин-агарозы, дополнительно выделяем достаточно чистый FII (из плазмы крови), который может быть пригоден и использован для аналитических и медицинских целей, в качестве полуфабриката для получения FIIa, применяемого как наружное кровоостанавливающее средство;
10. Заявленный способ выделения CP и FII человека может быть легко применим для промышленного производства обоих белковых препаратов.