Результат интеллектуальной деятельности: СПОСОБ КРУПНОМАСШТАБНОГО ПОЛУЧЕНИЯ, ВЫДЕЛЕНИЯ И ОЧИСТКИ РЕКОМБИНАНТНОГО ГРАНУЛОЦИТАРНОГО КОЛОНИЕСТИМУЛИРУЮЩЕГО ФАКТОРА ЧЕЛОВЕКА
Вид РИД
Изобретение
Изобретение относится к биотехнологии, конкретно к производству рекомбинантного гранулоцитарного колониестимулирующего фактора человека (рчГ-КСФ) в промышленном масштабе и представляет собой способ получения выделения и очистки рекомбинантного человеческого Г-КСФ в качестве препарата, в том числе медицинского назначения, из биомассы бактериальных клеток, содержащих рекомбинантную плазмидную ДНК с геном Г-КСФ человека.
Гранулоцитарный колониестимулирующий фактор человека является основным регулятором выработки нейтрофилов. Г-КСФ - гликопротеин с молекулярной массой 18-20 кДа, изоэлектрической точкой 5.5, проявляющий активность в мономерной форме (Dr. Ken Alibek 27s lecture G-CSF). Он продуцируется многими клетками организма: стромальными клетками костного мозга, эндотелиальными клетками, макрофагами, гранулоцитами, фибробластами, астроцитами (Dr. Ken Alibek).
Функциями Г-КСФ являются: стимуляция, дифференциация и функциональная активация клеток-предшественников нейтрофилов; влияние на иммунную систему путем регуляции функций Т-клеток и дендритных клеток (Dr. Ken Alibek); влияние на нервную систему через оказание противовоспалительного действия, подавление апоптоза и стимуляцию нейрогенеза (Solaroglu I, et al, A novel neuroprotectant granulocyte-colony stimulating factor, Stroke 2006).
В медицине применяется рекомбинантный Г-КСФ как гликозилированный, так негликозилированный. Его клинический эффект не зависит от гликозилирования молекулы (Bönig Н, Silbermann S, et al. Glycosylated vs non-glycosylated granulocyte colony-stimulating factor (G-CSF) - results of a prospective randomised monocentre study, 2001; Hoglund M. Glycosylated and non-glycosylated recombinant human granulocyte colony-stimulating factor (rhG-CSF) - what is the difference? Med Oncol. 1998 Dec)
Рекомбинантный Г-КСФ человека широко применяется в онкологии и гематологии при лечении нейтропении разной этиологии (David С. et al, «А Randomized Controlled Phase 3 Trial of Recombinant Human Granulocyte Colony-Stimulating Factor (Filgrastim) for Treatmentof Severe Chronic NeutropeniaBlood», 1993), аутоиммунных болезней человека (Rutella S et al, Granulocyte colony-stimulating factor: a novel mediator of T-cell tolerance, 2005), инфаркта миокарда, инсульта, ВИЧ-инфекции (Dr. Kuritzkes. Neutropenia, Neutrophil Dysfunction, and Bacterial Infection in Patients with Human Immunodeficiency Virus Disease: The Role of Granulocyte Colony-Stimulating Factor, 2000), нейтропении у новорожденных (A Randomized, Placebo-Controlled Trial of Recombinant Human Granulocyte Colony-Stimulating Factor Administration in Newborn Infants With Presumed Sepsis: Significant Induction of Peripheral and Bone Marrow Neutrophilia Blood, 1994).
Растущие потребности в Г-КСФ, высокая эффективность в терапии целого ряда заболеваний иммунной и кроветворной систем, высокая стоимость зарубежных аналогов делают актуальной задачей разработку крупномасштабного способа его получения.
Использование микробиологического синтеза на основе технологии рекомбинантных молекул ДНК обеспечивает возможность масштабирования процесса получения целевого продукта с высоким выходом из сравнительно недорого и безопасного сырья.
В литературе описаны несколько способов получения рчГ-КСФ из клеток Е. coli (Welte К. et al // Proc. Natl. Acad. Sci. USA, 1985, V.82, No.5, p.1526-1530; Nomura H. et al. // EMBO J., 1985, V.5, No.5, p.891-896; Morioka E. et al. // Res. Exp. Med. (Berl.), 1990, V.190, No.4, p.229-238). Однако в одних применяются органические растворители, приводящие к частичной денатурации белка (Welte K. et al), в других используются дорогостоящие реактивы, например, окисленный глютатион (Morioka Е et al). Общим недостатком является низкий выход целевого белка, а масштабирование описанных процессов осложнено применением хроматографии с низкими скоростями.
Известен способ получения Г-КСФ из клеток E.coli SG20050, трансформированных плазмидой pGGF8 (RU 2201962). Клетки разрушали при помощи ультразвука, тела включения отмывали и растворяли при помощи 8М мочевины, ренатурацию рчГ-КСФ проводили разбавлением нейтральным буфером. Хроматографическую очистку рчГ-КСФ осуществляли при помощи одноэтапной ионообменной хроматографии на двух последовательно соединенных колонках с ДЕАЕ-целлюлозой и SP-сефарозой при pH 4.4 с последующим элюированием целевого белка с колонки с SP-сефарозой в линейном градиенте хлористого натрия (0-0.4 M) в 20 мМ натрий ацетатном буфере при рН 4.4-4.5. Выход целевого продукта составил 24-30 мг из одного литра культуры клеток E.Coli SG20050/pGGF8. Очищенный препарат содержал 200 нг бактериальных белков и 80 пкг ДНК на 1 мг рчГ-КСФ. К недостаткам этого способа относятся большие потери целевого белка на подготовительных этапах при отмывке НФК, а также на основных этапах в связи с низкой эффективностью процесса ренатурации. Получаемые препараты рчГ-КСФ характеризуются значительным содержанием примесных белков и ДНК штамма-продуцента (около 200 нг и 80 пк на 1 мг рчГ-КСФ соответственно).
Наиболее близким к заявляемому способу является способ получения рчГ-КСФ из клеток E.coli SG20050/pGGF8 (RU 2278870), в котором трансформированные клетки E.coli/pGGF8, выращенные как описано ранее (RU 2326169), разрушают при помощи френч-пресса или ультразвука при температуре (6±3)°C. Тела включения, содержащие рчГ-КСФ, отделяют от фракции растворимых клеточных белков при помощи лабораторного центрифугирования. Для удаления примесных бактериальных белков тела включения отмывают буферным раствором с рН 7-9, содержащим детергенты и 2 М мочевины. Осадок тел включения снова отделяют центрифугированием и растворяют в буферном растворе с рН 7-9, содержащим 8 M мочевины и 10-30 мМ 2-меркаптоэтанола или 2-5 мМ дитиотреитола. Ренатурацию восстановленного рчГ-КСФ проводят разбавлением буферным раствором с рН 7-9, содержащим детергенты, глицерин и ЭДТА до концентрации суммарного белка 0.1-0.3 мг/мл при температуре (4-20)°C в течение 20-48 часов или при помощи диализа в диализных трубках восстановленного рчГ-КСФ против буферного раствора с pH 7-9, содержащего детергенты, глицерин и ЭДТА при температуре (4-20)°C в течение 20-48 часов.
После окончания процесса ренатурации полученный раствор окисленного белка пропускают через хроматографическую колонку диаметром 50-90 мм с анионообменным сорбентом, уравновешенным буферным раствором с pH 7-9, с объемной скоростью 5-10 мл/мин. К объединенным фракциям, не связавшимся с сорбентом, добавляют уксусную кислоту до pH 4-5, и полученный раствор наносят на хроматографические колонки с анионообменным и катионообенным сорбентами диаметром 50 мм и 25 мм с высотой слоя сорбента 50 и 70 мм соответственно. РчГ-КСФ элюируют с катионообменного сорбента в линейном градиенте хлорида натрия с объемной скоростью 1-2 мл/мин. Фракции, содержащие целевой белок, объединяют и диализуют в диализных трубках против буферного раствора с pH 4-5. Получаемые препараты рчГ-КСФ содержат 25-33 нг примесных белков и 10-13 пк ДНК штамма-продуцента на 1 мг рчГ-КСФ.
Недостатками способа-прототипа являются:
1) Описанный способ является лабораторным, осуществляется на лабораторном оборудовании (лабораторные центрифуги, хроматографические колонки малых размеров, FPLC с максимальной скоростью потока 10 мл/мин и т.д.) с соответствующими методами (элюирование в линейном градиенте, диализ в диализных трубках и т.д.) и подходами, что делает описанный процесс открытым и дискретным. Однако прямой перенос результатов получения целевого белка от лабораторной технологии к промышленному способу является неочевидным, так как методы теории подобия, позволяющие получать критерии масштабирования, в биотехнологии непригодны;
2) Лабораторное количество клеток, вовлеченное в технологический процесс 10 грамм, не позволяет получить целевой белок в достаточном для производства количестве.
Задачей изобретения является разработка и поиск оптимальных условий для крупномасштабного получения (15-20 г за один цикл), выделения и очистки Г-КСФ человека с высокой степенью гомогенности и чистоты, а также с улучшенным качеством, пригодного для создания лекарственного препарата, в том числе медицинского назначения.
Сущность предлагаемого способа заключается в следующем:
1) Культуральную жидкость, полученную со стадии культивирования штамма-продуцента E.coli в ферментере, рабочим объемом 250 л, концентрируют в 10 раз, клетки разрушают при помощи френч-пресса и нерастворимые фракции клеток (НФК) сепарируют.
2) Для удаления примесных бактериальных белков НФК отмывают буферным раствором рН 7-9, содержащим детергенты и мочевину. НФК снова отделяют сепарированием.
3) Отмытый осадок тел включения растворяют в буфере pH 8.0±0.5, содержащем Трис HCl, мочевину и 2-меркаптоэтанола в течение 20 часов.
4) Ренатурацию восстановленного белка проводят 10-кратным разбавлением, добавляя раствор денатурированного белка в охлажденный буфер. Ренатурация заканчивается через 70-90 часов. Процент гомогенности ренатурированного белка составляет 60-80%.
5) Раствор ренатурированного белка подвергают дополнительной очистке от примесных белков, пропуская через колонку с анионообменным сорбентом со скоростью 500-700 мл/мин, уравновешенную буферным раствором pH 7-9. В общем объеме не связавшихся с сорбентом фракций понижают pH буфера до значений 4-5. Осадок, сформировавшийся при температуре 10-12°C в течение 24 часов, отделяют с помощью мембран.
6) Концентрирование целевого белка проводится на последовательно соединенных колонках с анионообменным и катионообменным сорбентами. Фракции, содержащие рчГ-КСФ, с гомогенностью по ВЭЖХ выше 80% объединяют. При этом рабочий объем раствора белка уменьшается в 40-50 раз.
7) Очистку проводят с помощью катионообменной хроматографии в режиме рецикла фракций для повышения степени извлечения целевого белка и увеличения его чистоты и гомогенности по ВЭЖХ.
8) Объединенные целевые фракции рчГ-КСФ диафильтруют на ультрафильтрационных мембранах с порогом отсечения 10 кДа.
В качестве детергентов используются неионные детергенты тритон X-100, твин-20 или их смесь.
Процесс очистки рчГ-КСФ является закрытым. Все операции проводятся в стерильных условиях с использованием апирогенных сорбентов и буферных растворов.
В качестве катионообменного сорбента используют SP-sepharosa, KM-sepharosa, SO3 fractogel.
В качестве анионообменного сорбента используют DEAE-sephacel, ДЕАЕ sepharosa.
Выход электрофоретически гомогенного рчГ-КСФ с чистотой более 98% составляет 60-80 мг из 1 л культуры клеток штамма E.coli SGK25/ pA3GF (Методы контроля медицинских иммунбиологичеких препаратов, вводимых людям. Методические указания, МУК 4.1/4.2/588-96, М., 1998). Специфическая (гемостимулирующая) активность полученного препарата рчГ-КСФ, определенная in vivo на мышах, у которых путем введения цитостатика воспроизводилась гипоплазия кроветворения, составляет 1000-1400%. Специфическая активность, определенная in vitro по стимуляции мышиных клеток М-NFS-60 составляет более 10+8МЕ/мг белка. Содержание белков штамма - продуцента составляет 30 нг/мг рчГ-КСФ. Содержание ДНК составляет менее 10 пг/мг рчГ-КСФ (Общие требования к медицинским иммунобиологическим препаратам, проученным методами генной инженерии. РД 42-68-9-89, М., 1989).
Предлагаемая схема позволяет получать в промышленном масштабе стабильные препараты рчГ-КСФ с большим количественным выходом, высокими показателями чистоты, гомогенности и активности, которая превышает активность КСФ, полученного по прототипу, что позволяет использовать их, в том числе в качестве субстанции для создания лекарственных средств нового поколения.
Новым по сравнению со способом-прототипом является:
- введение промышленной схемы отмывки НФК с получением обобщенного пула отмытых тел включения; реализация лабораторного подхода отмывки тел включения в промышленном масштабе невозможна;
- увеличение количества тел включения, вовлекаемых в биотехнологический процесс до 290-350 г, что соответствует промышленному уровню производства белка;
- изменение объема и условий ренатурации применительно к крупномасштабному процессу:
- увеличение объема раствора целевого белка на стадии ренатурации до 350-450 л
- разбавление восстановленного раствора тел включения буферным раствором pH 7-9 в десять раз, содержащим ЭДТА, путем внесения раствора белка в общий объем с фиксированной скоростью при перемешивании.
- увеличение времени ренатурации до 70-90 часов при температуре 10-15°C.
- увеличение времени инкубации раствора белка при снижении значения pH свободной фракции после проведения анионообменной хроматографии до 24 часов при 10-15°C.
- концентрирование целевого белка в 40-50 раз с помощью катионообменников с целью уменьшения рабочего объема растворов.
- проведение катионообменной хроматографии в режиме рецикла фракций для повышения степени извлечения целевого белка, степени чистоты и гомогенности рчГ-КСФ по ВЭЖХ.
- сокращение времени осуществления технологических стадий путем включения в состав промышленных хроматографических систем фильтров, позволяющих отделять осадки в процессе нанесения растворов белков на сорбенты.
- использование мембранных технологий для стабилизации свойств целевого белка на конечной стадии получения лекарственной субстанции.
Введенные изменения позволяют масштабировать процесс получения рГ-КСФ до промышленного уровня с сохранением характеристик по выходу продукта заявленных в лабораторном способе прототипе. При этом общий выход целевого белка с гомогенностью более 97% по ВЭЖХ составляет 15-20 г.
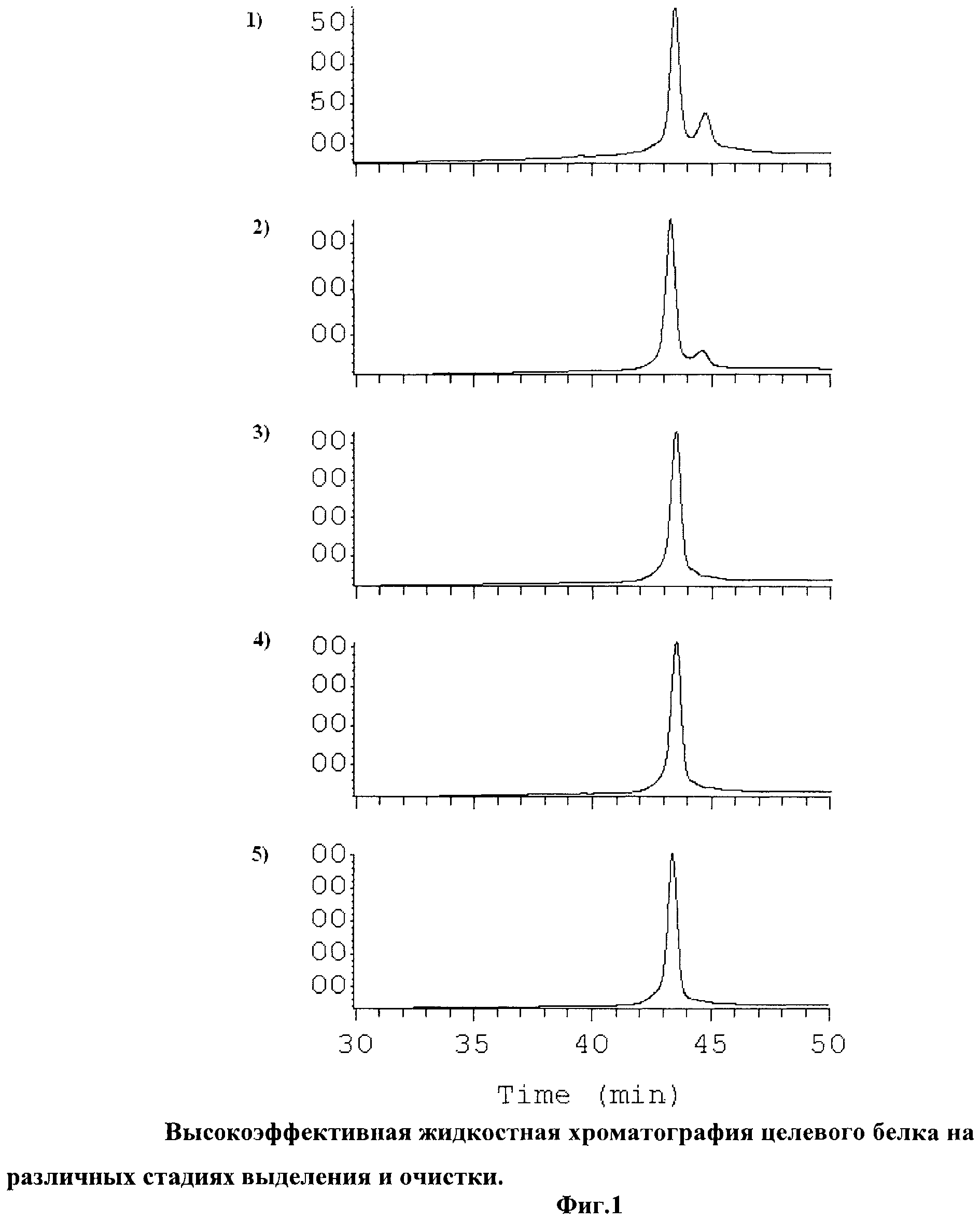
Предлагаемое изобретение иллюстрируется фигурой графического изображения (см. фиг.1), где представлены:
1. Стадия ренатурации 72 часа.
2. Стадия концентрирования
3. 1-й цикл хроматографической
4. 2-й цикл хроматографической очистки
5. 3-й цикл хроматографической очистки Примеры конкретного выполнения способа приведены ниже.
ПРИМЕР 1
(приближение к промышленному способу)
1.1. Получение и отмывка тел включения из 150 грамм клеток штамма-продуцента E.coli SGK25/pA3GF.
Часть биомассы (150 г), полученной в ферментере с рабочим объемом 250 литров, суспендируют в лизирующем буфере объемом 1000 мл до получения однородной массы и разрушают при помощи френч-пресса при 1100 бар, охлаждая лизат клеток. Полученную суспензию сепарируют на сепараторе. Осадок отмывают с помощью ультрафильтрационных мембран с порогом отсечения 10 кДа в буфере отмывки, содержащем Твин-20, Тритон X-100 и мочевину.
Вес полученных тел включения составляет 20 г, содержание целевого белка 72%.
1.2. Солюбилизация тел включения. Восстановление белка.
Полученные тела включения суспендируют в буферном растворе pH 7-9 объемом 2500 мл, содержащим мочевину, добавляют 2-меркаптоэтанол до конечной концентрации 20 мМ и перемешивают в течение 20 часов при комнатной температуре. Образовавшийся осадок отделяют фильтрованием.
1.3. Ренатурация белка.
Раствор восстановленного белка разбавляют в 10 раз охлажденным до 8°C буфером для ренатурации, содержащим 10 мМ натрия фосфата и 10 мМ ЭДТА pH 8.0. Ренатурацию проводят 72 часа при 8°C, образовавшийся в ходе ренатурации осадок отделяют фильтрованием. Эффективность ренатурации оценивают методом ВЭЖХ. Гомогенность ренатурированного рчГ-КСФ по ВЭЖХ составляет 73%.
1.4 Удаление примесных бактериальных белков.
Полученный раствор белков наносят на колонку ХК 45/50 (Pharmacia Швеция), содержащую 100 мл ДЕАЕ сефарозы, уравновешенной буфером Трис HCl, pH которого составляет 8.0±0,05, со скоростью 50 мл/мин при температуре 8 C°. Несвязавшиеся фракции, содержащие рчГ-КСФ, собирают как целевые. В растворе частично очищенного белка снижают рН до значения 4,0±0,05. Раствор инкубируют в течение 20 часов при 8°C, осадок отделяют фильтрованием.
1.5. Концентрирование рчГ-КСФ.
Полученный раствор белка последовательно наносят на колонки ХК 45/50 (Pharmacia Швеция) с анионообменным (ДЕАЕ сефарозой (100 мл)) и катионообменным (SO3 фрактогелем (85 мл)) сорбентами, уравновешенными ацетатным буфером с pH 4.5±0,05, со скоростью 10 мл/мин. Целевой белок элюируют с SO3 фрактогеля в изократическом режиме уравновешивающим буфером, содержащим 0.9 M хлористого натрия. Элюат собирают в общий объем 1750 мл. Гомогенность целевого белка по ВЭЖХ составляет 83%.
1.6. Хроматографическая очистка на катионообменниках в режиме рецикла фракций.
Раствор частично очищенного белка наносят на колонку с катионообменником SO3-фрактогелем (85 мл) со скоростью 5 мл/мин, уравновешенную ацетатным буфером с pH 4.5±0,05. Сорбент промывают уравновешивающим буфером, содержащим 0.2 M хлористого натрия и белок элюируют в градиенте хлористого натрия от 0.2 до 1.0 M в 20 объемах колонки. Фракции с гомогенностью целевого белка по ВЖЭХ 92% объединяют.
Объединенные фракции, содержащие целевой белок в тех же условиях снова наносят на колонку с катионообменником SO3 фрактогелем. Сорбент промывают уравновешивающим буфером и белок элюируют аналогичным способом. Фракции с гомогенностью целевого белка по ВЖЭХ более 95% объединяют в качестве целевого продукта.
1.7. Стабилизация очищенного рчГ-КСФ.
Объединенные фракции диализуют против 10 объемов буфера для диализа 5 мМ натрия ацетата pH 4.0. Выход целевого белка 1003 мг. Раствор белка подвергают стерилизующей фильтрации и хранят при 8°C.
ПРИМЕР 2
2.1. Получение клеток штамма-продуцента E.coli SGK25/pA3GF проводят по п.1.1., описанному в Примере 1. Культуральная жидкость из ферментера с рабочим объемом 300 л подверглась концентрированию с помощью мембран до объема 20-30 л. Суспензию клеток дважды обрабатывали при помощи френч-пресса при 1200 бар. Содержание целевого белка в НФК составляет по данным гель-эелектрофореза в ПААГе 40-60%.
2.2. Солюбилизацию тел включения и восстановление белка проводят по п.1.2. Объем раствора восстановленного белка составляет 40 л.
2.3. Ренатурацию белка проводят по 1.3. Объем раствора ренатурирующего белка 400 л. Гомогенность ренатурированного рчГ-КСФ составляет 70% по данным ВЭЖХ.
2.4. Удаление примесных бактериальных белков проводят по 1.4. Полученный раствор белков наносят на колонку диаметром 300 мм, содержащую 6000 мл ДЕАЕ сефарозы со скоростью 600-1000 мл/мин при температуре 20°C. Закисленный раствор белка инкубируют в течение 24 часов при 12°C.
2.5. Концентрирование рчГ-КСФ проводят по 1.5. Полученный раствор белка последовательно наносят на колонки диаметром 300 мм с ДЕАЕ сефарозой (6000 мл) и SO3 фрактогелем (6000 мл), со скоростью 200-300 мл/мин. Объем элюата 34000 мл. Гомогенность целевого белка по ВЭЖХ составляет 82%.
2.6. Хроматографическую очистку на катионообменниках в режиме рецикла фракций проводят по 1.6. Раствор белка наносят на колонку диаметром 170 мм с катионообменником СМсефароза (5000 мл) со скоростью 200-250 мл/мин, уравновешенную ацетатным буфером. Сорбент промывают уравновешивающим буфером. Белок элюируют в изократическом режиме раствором 0.13 M хлористого натрия. Фракции с гомогенностью целевого белка по ВЖЭХ 92% объединяют.
Объединенные целевые фракции белка в тех же условиях снова наносят на колонку с катионообменником. Фракции с гомогенностью целевого белка по ВЖЭХ более 95% объединяют в качестве целевого продукта.
2.7. Стабилизация очищенного рчГ-КСФ в качестве субстанции проводят по 1.7. Объединенные целевые фракции подвергают диафильтрации с использованием ультрафильтрационных мембран с порогом отсечения 10 кДа. Белковый раствор диафильтруют до выравнивания его проводимости с проводимостью буфера для хранения белка. Выход целевого белка составляет 17840 мг. Раствор белка подвергают стерилизующей фильтрации и хранят при 8°C.
Таким образом, предлагаемый способ позволяет получать за один цикл стабильный препарат рчГ-КСФ с гомогенностью более 97% по ВЭЖХ в количестве 15-20 грамм, что в 60-100 раз больше по сравнению со способом-прототипом. При этом относительный выход белка составляет 60-80 мг/ на литр культуральной жидкости его активность составляет 1000-1400%, что превышает значения активности прототипа, а продолжительность процесса получения практически соответствуют лабораторной методике получения Г-КСФ в способе-прототипе.