Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ АЛКИЛОВЫХ ЭФИРОВ БЕНЗОЙНОЙ КИСЛОТЫ
Вид РИД
Изобретение
Изобретение относится к области органического синтеза, в частности, к способу получения алкиловых эфиров бензойной кислот.
Сложные эфиры бензойной кислоты (от метилового до амилового), обладающие характерным запахом, используются в парфюмерной промышленности [1. Войткевич С.А. 865 душистых веществ для парфюмерии и бытовой химии, 1994, М.: Пищевая пром-ть, с.594]. Бензойная кислота применяется в медицине для лечения кожных заболеваний наружно как антисептическое, противомикробное и противогрибковое средство. Натриевая соль бензойной кислоты (бензоат натрия) применяется в качестве отхаркивающего и жаропонижающего средства. Бензойная кислота и ее натриевая соль служат консервантами пищевых продуктов (Е210, Е211, Е212, Е213).
Бензойную кислоту можно получить окислением толуола азотной [2. WO 0230862 (2002); 3. Bacon, R.G.R., Doggart, J.R. // J. Chem. Soc., 1960, 1332-1338; 4. US 1576999 (1926)] или хромовой кислотами [5. US 1458491 (1923)].
Промышленный метод получения бензойной кислоты основан на окислении толуола с помощью кислорода воздуха (3 атм) в присутствии солей кобальта при 140°C. Впервые этот процесс был осуществлен в Германии в середине прошлого века. Сырой продукт содержал ~50% бензойной кислоты, непревращенный толуол, бензиловый спирт и бензальдегид.
В дальнейшем были предприняты многочисленные попытки улучшения процесса получения бензойной кислоты окислением толуола за счет изменения состава катализатора (применение сокатализаторов стеаратов или ацетатов лития, никеля, марганца, бензоата марганца) [6. SU 187767 (1966); 7. SU 852857 (1980), 8. SU 7895051 (1981)], введения промоторов (соединения брома, иода, алкилсилоксанов) [9. SU 453824 (1975); 10. SU 1026650 (1983); 11. SU 250765 (1970)], применения комбинированных окислителей [12. SU 262899 (1970)], увеличения концентрации кислорода в воздушной смеси [13. SU 249363 (1969)] и увеличения давления кислорода до 10 атм [14. SU 1779241 (1992)].
В литературе довольно широко описаны альтернативные методы получения бензойной кислоты окислением бензилового спирта [15. RU 2335341 (2007) (Б.И. №28 от 2008)].
Особый интерес представляют методы получения бензойной кислоты непосредственно из бензола.
Довольно широко известен метод получения бензойной кислоты из бензола через металлпроизводные. Так, н-бутиллитий или t-бутоксид калия в стехиометрических количествах реагируют с бензолом с образованием фениллития или фенилкалия, которые при последующем карбоксилировании с помощью CO2 превращаются в бензойную кислоту [16. Schlosser М, Choi J. Н., Takagishi S. // Tetrahedron (1990), 46(16), 5633-5648]. Выход бензойной кислоты по данному методу после обработки и выделения составляет 65%.
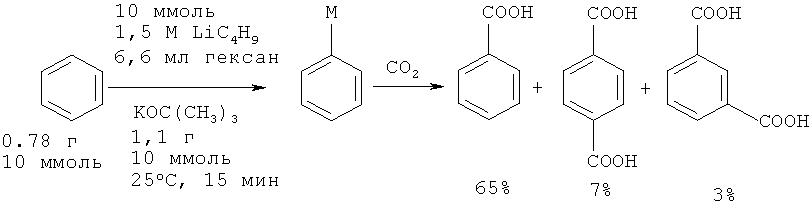
Недостатки методов:
1. Необходимость использования стехиометрических количеств высокореакционных, пожароопасных металлорганических реагентов бутиллития и трет-бутоксида калия.
2. Проведение реакции под давлением из-за использования газообразного диоксида углерода.
3. Низкая селективность реакции.
Карбонилирование бензола с одновременным окислением (окислительное карбонилирование) приводит к образованию бензойной кислоты с выходом 9,3% [17. Калиновский И.О., Лещева А.А., Кутейникова М.М., Гельбштейн А.И. // ЖОХ. 1990, 60(1), 123-130]. Реакцию проводили в присутствии каталитической системы, состоящей из комплексов Pd, соли Cu, трифторуксусной кислоты в смеси с трифторуксусным ангидридом.

При введении в состав каталитической системы в качестве катализаторов реокисления палладия соединений Fe и V и проведение реакции в среде трифторуксусной кислоты и ее ангидрида выход бензойной кислоты составил 53% [18. Калиновский И.О., Погорелов В.В., Гельбштейн А.И. // ЖОХ. 2001, 71(9), 1545-1547].

В работе [19. Fujiwara Y., Kawata I., Sugimoto H., Taniguchi H. // J. Organometal. Chem. 1983, 256(2), C35-C36.] было осуществлено одностадийное карбоксилирование бензола монооксидом углерода и трет-бутилгидропероксидом до бензойной кислоты с помощью системы Pd(OAc)2-CH2=CHCH2Cl. Выход бензойной кислоты составил ~1%.
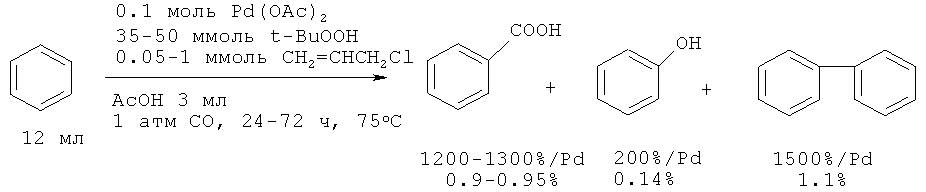
Бензол карбоксилируется с помощью реагента CO-K2S2O8 в присутствии системы Pd(OAc)2-CF3COOH при комнатной температуре, но за продолжительное время (120 ч). При этом выход бензойной кислоты составляет 5.9% [20. Taniguchi Y., Yamaoka Y., Nakata K., Takaki K., Fujiwara Y. // Chem. Let., 1995, 5, 345-346].
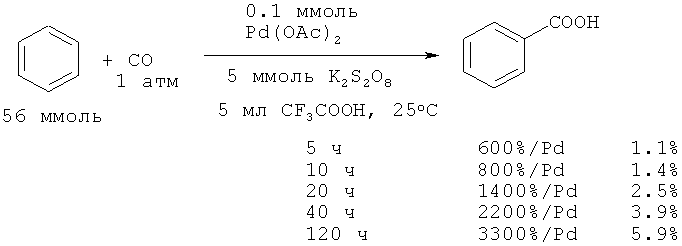
Бензойная кислота с выходом 12,8% получена прямым карбонилированием бензола с помощью монооксида углерода и кислорода, как окислителя под действием Co(ОАс)2-PPh3 и трихлоруксусной кислоты [21. Zhao W.J., Jiang X.Z., Zhuo G.L. // J. Mol. Catal. A: Chem., 2005, 225(1), 131-135].
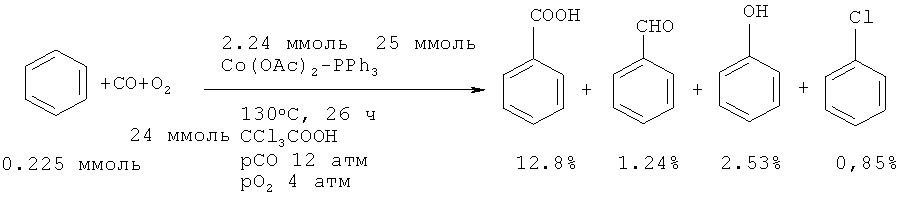
Японские исследователи осуществили реакцию одновременного гидроксилирования-карбоксилирования бензола с помощью НСООН в присутствии катализатора Pd(OCOCF3) и окислителя K2S2O8 в среде трифторуксусной кислоты. Выход бензойной кислоты составил 106 каталитических циклов [22. Shibahara F., Kinoshita S., Nozaki K. // Org. Letters, 2004, 6(14), 2437-2439].
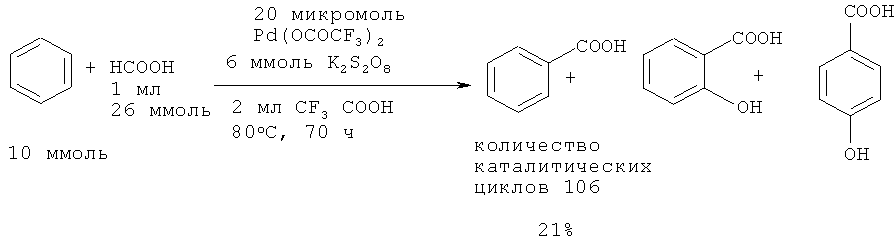
В работе [23. Sakakibara K., Yamashita М., Nozaki K. // Tetrahedron Letters., 2005, 46(6), 959-962] для увеличения выхода бензойной кислоты использовали добавку трифлат фосфония (L), а также трифторуксусный ангидрид как растворитель.
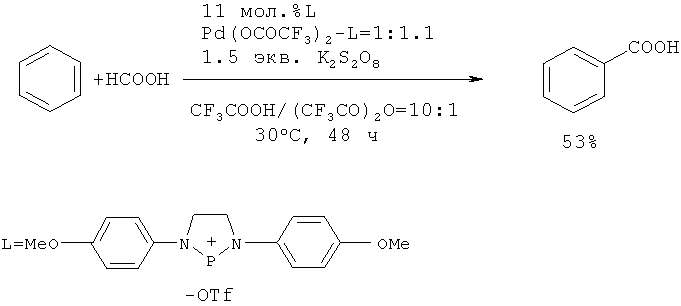
Недостатки методов
1. Применение дорогостоящих реагентов: палладиевый катализатор, трифторуксусная кислота и ее ангидрид.
2. Значительная продолжительность реакции (48-72 ч).
3. Проведение эксперимента в среде агрессивной трифторуксусной кислоты.
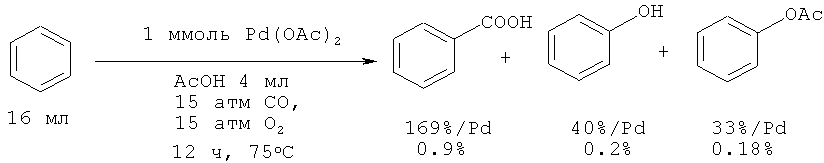
При гидроксилировании бензола с помощью СО и O2 под действием Pd(OAc)2 была получена смесь продуктов: бензойная кислота (выход 0.9%), фенол (выход 0.2%) и фенилацетат (выход 0.18%) [24. Jintoku Т., Taniguchi Н., Fujiwara Y. // Chem. Let., 1987, 9, 1865-1868].
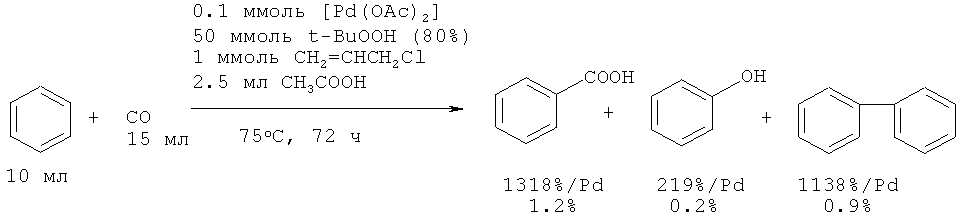
Бензойная кислота получена реакцией бензола с монооксидом углерода на Pd катализаторе [25. Jintoku Т., Fujiwara Y., Kawata I., Kawauchi Т., Taniguchi H. // J. Organometal. Chem., 1990, 385(2), 297-306]. Выход бензойной кислоты составил 1.3% (температура 100°C, соотношение катализатор: бензол = 1:20).

Повысить выход бензойной кислоты удалось за счет введения аллилхлорида (предполагается, что образовавшийся в ходе реакции Pd0 повторно окисляется до Pd2+ с помощью аллилхлорида) и t-BuOOH. Так, при использовании системы Pd(OAc)2-CH2=CHCH2Cl при карбоксилировании бензола с помощью CO и t-BuOOH выход бензойной кислоты составил 1.2% (температура 75°C, соотношение катализатор: бензол = 1:1140).
Недостатки методов
1. Низкий выход целевого продукта (~3%).
2. Использование дорогостоящих катализаторов на основе соединений палладия и родия.
3. Проведение реакции в агрессивной среде уксусной, трихлоруксусной или трифторуксусной кислот.
4. Значительная продолжительность реакций (до 72 ч).
5. Все реакции карбонилирования проводятся в специальных аппаратах под давлением.
6. Низкая селективность реакций.
Карбонилирование бензола осуществлено облучением в присутствии катализатора RhCl(CO)(PPh3)2 [26. Sakakura Т., Tanaka МЛ Chem. Let., 1987, 2, 249-252]. Основным продуктом реакции является бензальдегид (0.15% за 94 ч), который затем окисляется кислородом воздуха до бензойной кислоты с низким выходом (0.006%) за продолжительное время (94 ч).
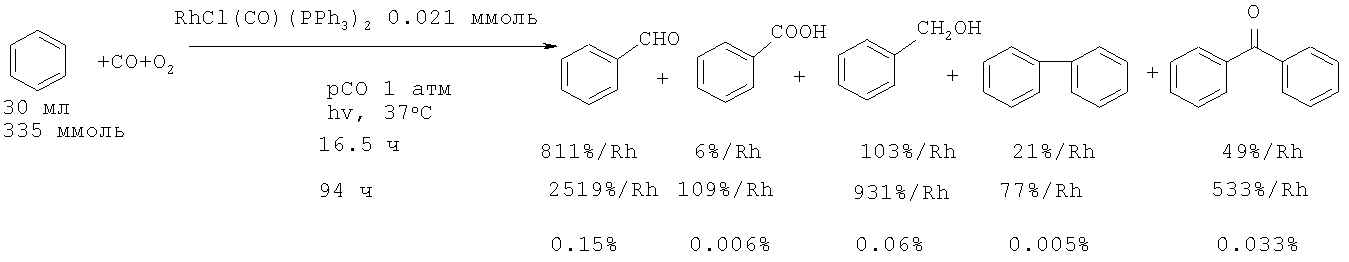
В аналогичных условиях, но в присутствии в качестве катализатора RhCl(CO)(P(CH3)3)2 из бензола и СО получена бензойная кислота (выход 0.006%), а основным продуктом реакции является бензальдегид (0.4%) [27. Sakakura Т., Tanaka М. // Chem. Let., 1987, 6, 1113-1116].
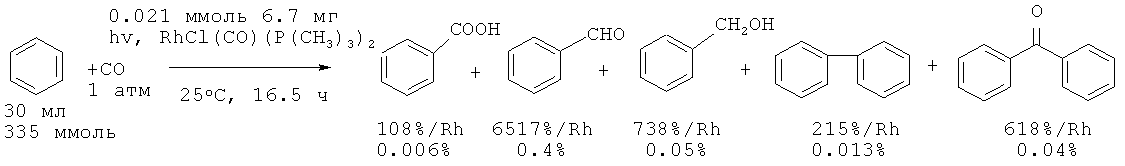
Недостатки методов
1. Низкий выход целевого продукта, не превышающий 0.01% при низкой селективности реакции.
2. Использование дорогостоящих родийсодержащих катализаторов.
3. Обратимости реакции 
В дальнейшем авторы работы [28. Lu W., Yamaoka Y., Taniguchi Y., Tsugio K., Takaki K., Fujiwara Y. // J. Organometal. Chem., 1999, 580(2), 290-294] за счет использования большого количества катализатора Pd(OAc)2 ([Pd]:[бензол]=1:2) и окислительного агента K2S2O8, повысили выход бензойной кислоты до 50%.
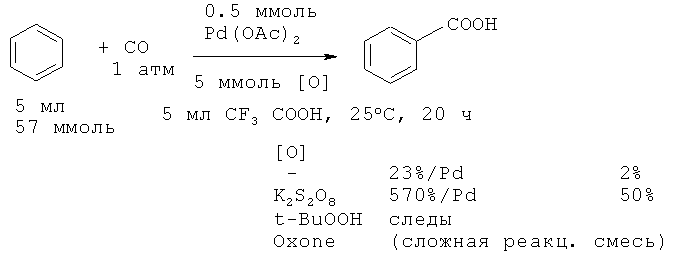
Недостатки метода
1. Большой расход палладиевого катализатора (1:12).
2. Использование окислителя.
3. Необходимость использования специальной аппаратуры для работы под давлением.
Трифторацетат ртути (II), полученный взаимодействием ртути с трифторуксусной кислотой под действием концентрированной HNO3, реагирует с монооксидом углерода в среде метанола с образованием метилового эфира бензойной кислоты с выходом 65%. [29. Baird W.C. Jr., Hartgerink R.L., Surridge J.H. // J. Org. Chem., 1985, 50(23), 4601-4605].
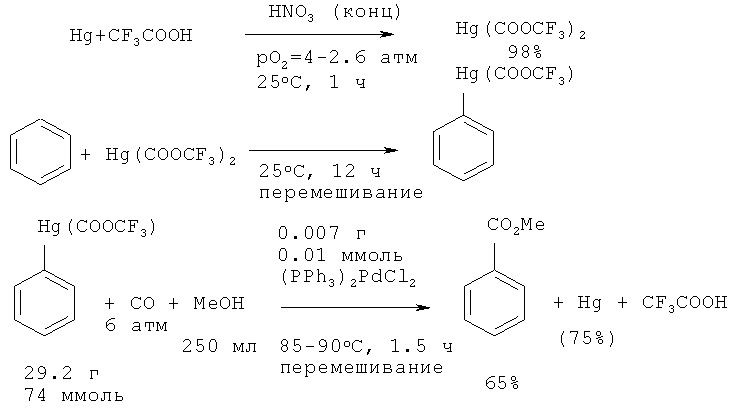
Недостатки метода
1. Использование токсичной ртути и потери ртути в ходе реакции до 25%.
2. Многостадийность процесса.
3. Необходимость проведения процесса под давлением.
4. Применение дорогостоящего палладиевого катализатора.
5. Наличие большого количества сточных вод из-за использования соединений ртути и концентрированной азотной кислоты.
При взаимодействии бензола с оксалилдихлоридом (COCl)2 образуется бензоилхлорид, который затем претерпевает гидролиз с образованием бензойной кислоты [30. Staudinger, Ber. 1908, 41, 3558; 31. Ayrey, G.; Moore, С.G. // J. Chem. Soc., 1956, 1356-1359; 32. Villani A.J., Etzkorn F., Rotert G.A // J. Label. Comp. Radiopharmac, 1988, 25(12), 1339-1347].
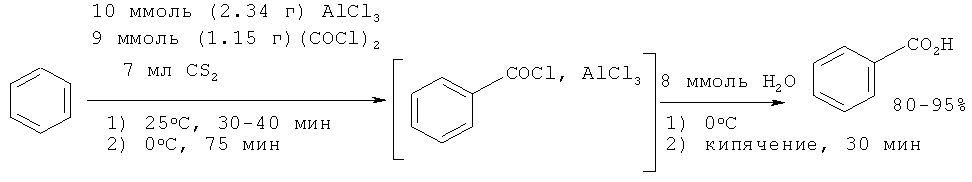
Недостатки метода
1. Применение труднодоступного оксалилдихлорида (обладающего резким запахом, что осложняет работу) и токсичного, взрывоопасного сероуглерода (растворитель).
2. Необходимость проведения реакции при пониженной температуре 0°C.
3. Образование большого количества неорганических отходов и сточных вод.
Бензойная кислота была получена прямым карбоксилированием бензола с помощью диоксида углерода в присутствии Al2Cl6/Al. Выход бензойной кислоты по данному методу составил 88% [33. Olah, G.А.; Toeroek, B.; Joschek, J.P.; Bucsi, I.; Esteves, P.M.; Rasul, G.; Prakash, G.K. // J. Am. Chem. Soc, 2002, 124(38), 11379-11391].
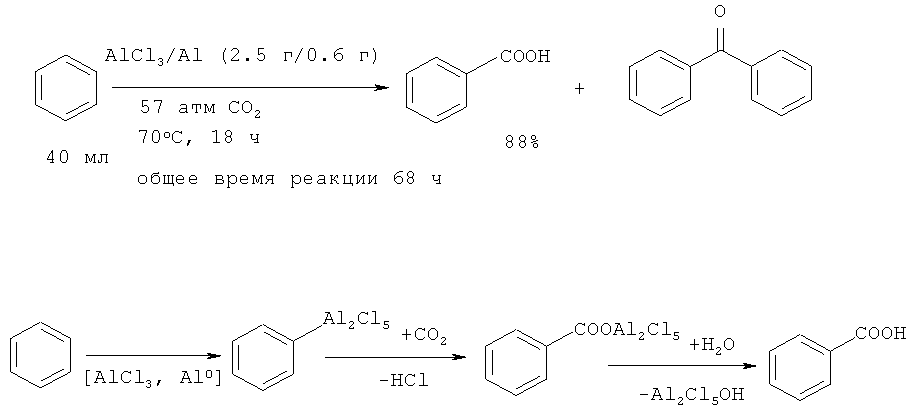
Недостатки метода
1. Значительная продолжительность реакции (18 ч).
2. Проведение реакции под давлением 57 атм CO2
3. Образование большого количества неорганических отходов и сточных вод.
Реакцией бензола и трихлорацетальдегида (хлораль) Cl3CCHO в присутствии кислоты Льюиса AlCl3 при -10°C был получен 1-фенил-2,2,2-трихлорэтанол C6H5CH(OH)CCl3 (выход 82%), гидролиз и окисление которого смесью H2O2-H2O-NaOH приводит к образованию бензойной кислоты с общим выходом 74% [34. Menegheli P., Rezende М.C. // Zucco C. // Synth. Commun., 1987, 17(4), 457-464].
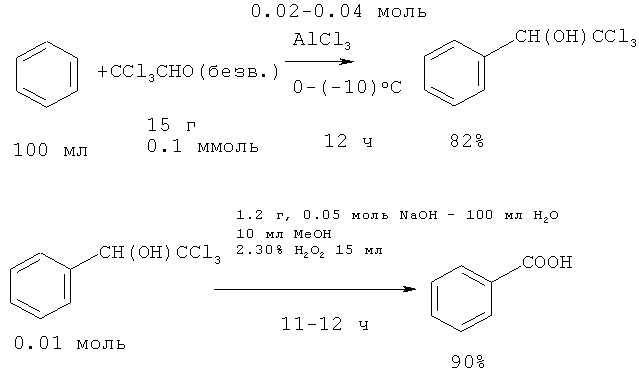
Недостатки метода
1. Использование труднодоступного хлораля.
2. Продолжительность реакции 12 ч.
3. Проведение реакции при пониженной температуре до -10°C.
4. Низкая атомная эффективность.
5. Образование большого количества неорганических отходов и сточных вод из-за использования избытка AlCl3 и NaOH.
В работе [35. Gross Н., Rusche J., Mirsch MM Chem. Ber., 1963, 96 1382-1386] синтез бензойной кислоты осуществлен с использованием в качестве исходного соединения дихлорметилацеталя пирокатехина. При взаимодействии дихлорметилацеталя пирокатехина с бензолом в присутствии AlCl3 образуется монобензоат пирокатехина, последующий гидролиз которого приводит к бензойной кислоте с выходом 84%. Дихлорметилацеталь пирокатехина в свою очередь получают термической реакцией карбоната пирокатехина с PCl5 (нагревание при 130°C в течение 0.5-1 ч), затем при 200°C медленно удаляют POCl3. Выход дихлорметилацеталя пирокатехина составляет 85%, а бензойной кислоты 84%.
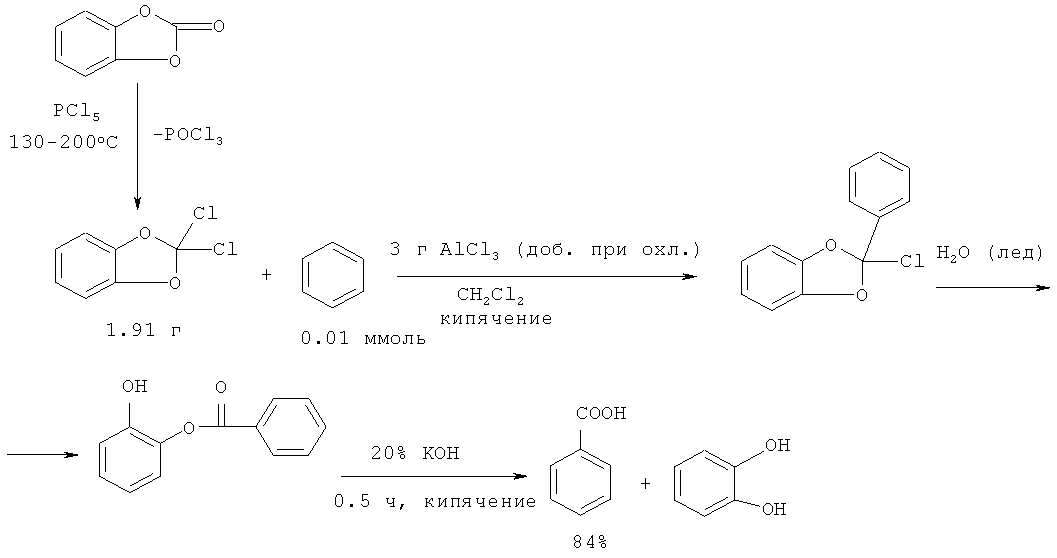
Недостатки метода
1. Многостадийность процесса
2. Применение ядовитого PCl5.
3. Использование избытка КОН.
4. Образование большого количества отхбдов, содержащих POCl3, Al(OH)3, KCl.
В работе [36. Brusotti G., Habermann J., Azzolina O., Collina S. // Let. Org. Chem., 2006, 3(12), 943-947] бензойная кислота синтезирована из бензола в 4 стадии. Вначале бензол ацилируют по реакции Фриделя-Крафтса с помощью уксусного ангидрида под действием AlCl3, затем ацетофенон при постоянно контролируемой температуре (удаляют дибромированный продукт) бромируется пербромидом пиридиния, нанесенным на полимер. На следующей стадии ω-бромацетофенон обрабатывают поли(4-винил)пиридином в толуоле с получением полимерно-связанной соли пиридиния по реакции Крохне. После обработки микроволновым излучением и выделения общий выход бензойной кислоты составил 78%.
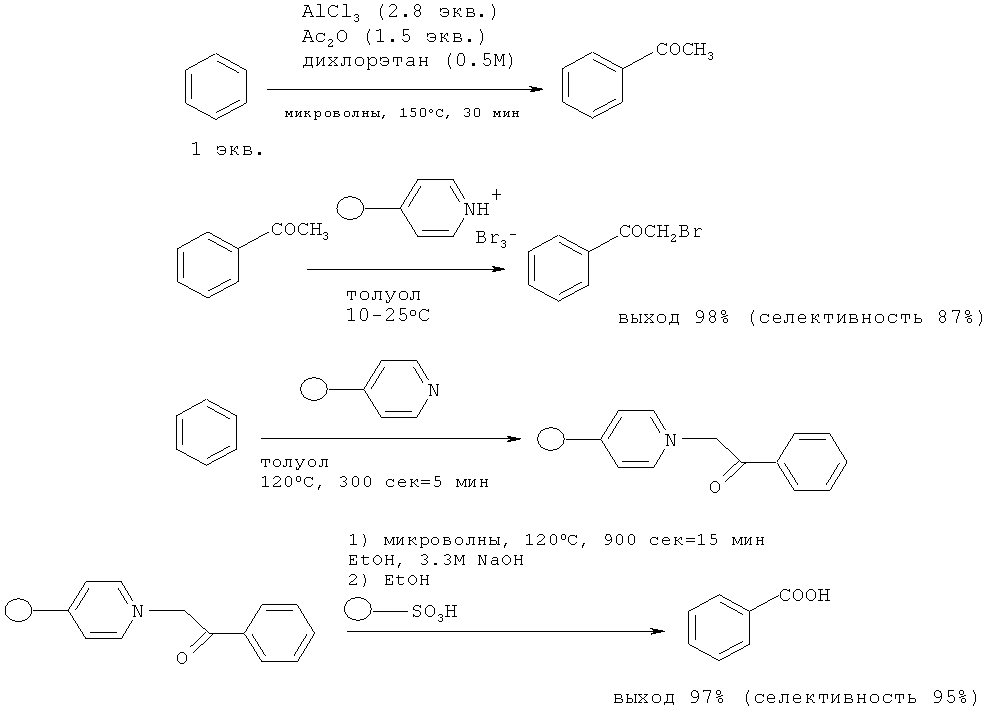
Недостатки метода
1. Применение в качестве ацилирующего агента уксусного ангидрида (прекурсор).
2. Многостадийность процесса.
3. Использование микроволнового реактора, который трудно масштабируется.
Бензойную кислоту с выходом 12% можно получить взаимодействием бензола с CCl4 в присутствии тетрагидрата хлорида таллия (III) [37. Uemura, S.; Sasaki, О.; Okano М. // Chem. Commun., 1970, 18, 1139-40]. Авторы предполагают, что хлорид таллия (III), взятый в каталитическом количестве, промотирует гидролиз бензотрихлорида. В результате реакции кроме целевого продукта образуются побочные: фосген, хлористый водород и TlCl (I).
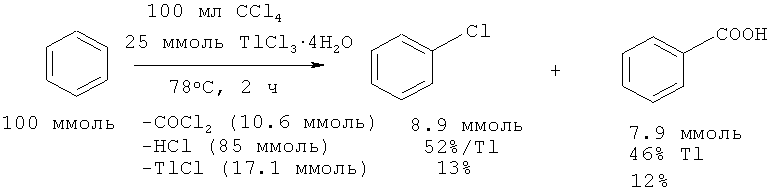
Недостатки метода
1. Использование труднодоступного и токсичного T1Cl3 .4H2O.
2. Большое количество отходов, содержащих ядовитые и агрессивные соединения: фосген, Т1С1(1), соляную кислоту.
Карбонизацией бензола с помощью СО под действием системы ацетат палладия (II) - диалкилсульфид была получена бензойная кислота с общим выходом 30% [38. Fuchita Y., Hiraki K., Kamogawa Y., Suenaga M. // J. Chem. Soc., Chem. Commun., 1987, 12, 941-942].
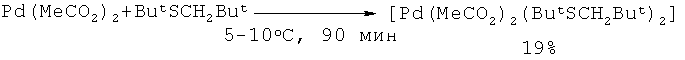
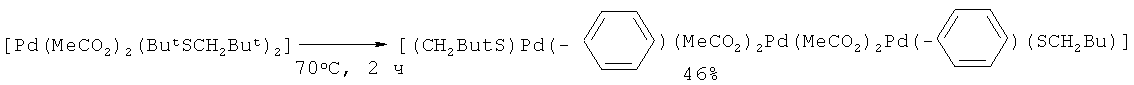
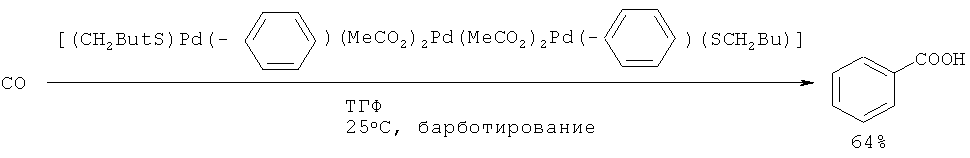
Недостатки метода
1. Использование дорогостоящего катализатора Pd(OAc)2 и труднодоступного сульфида.
2. Многостадийность процесса.
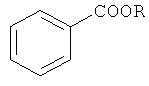
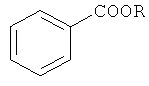
Авторами предлагается способ получения алкиловых эфиров бензойной кислоты, не имеющий вышеперечисленных недостатков.
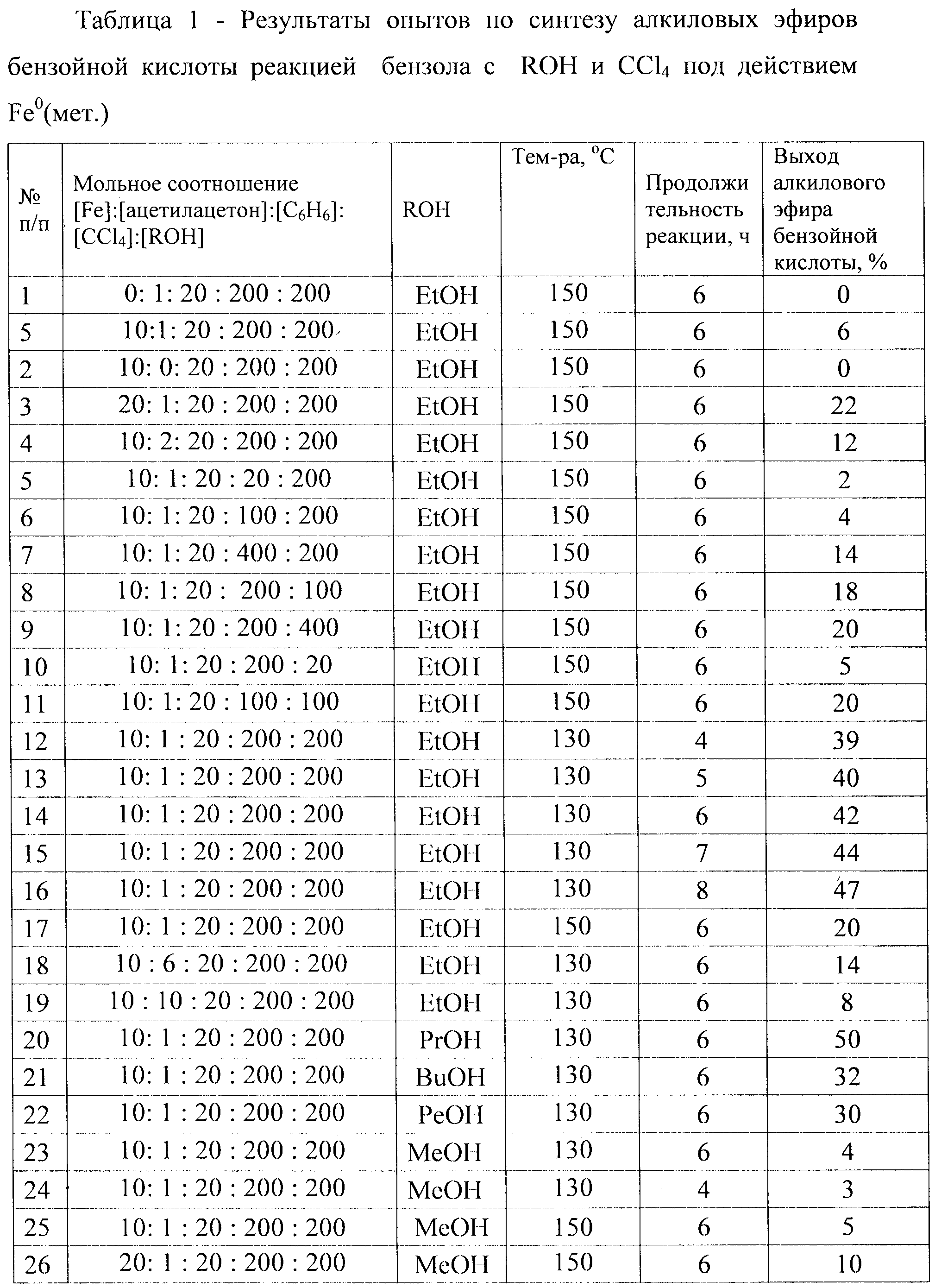
Сущность способа заключается во взаимодействии бензола с четыреххлористым углеродом и спиртом в присутствии металлического железа и ацетилацетона при температуре 130-150°C в течение 4-8 ч при мольном соотношении [Fe0(мет.)]:[ацетилацетон]:[бензол]:[CCl4]:[спирт]=10-20:1-10:20:20-400:20-400. Оптимальными для проведения реакции являются следующие соотношения катализатора и реагентов [Fe0(Мет.)]:[ацетилацетон]:[бензол]:[CCl4]:[спирт]=10:1:20:200:200. При температуре 130°C и продолжительности реакции 6 ч выход алкиловых эфиров бензойной кислоты достигает 50%. Синтез проводят в атмосфере аргона.
В отсутствие катализатора, ацетилацетона, CCL4 или спирта (любого из компонентов) реакция не проходит.
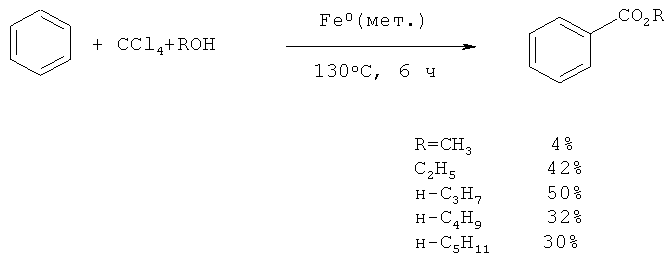
Побочными продуктами реакции являются HCl и гомоэфир ROR. В случае метанола низкий выход метилового эфира бензойной кислоты объясняется легкостью образования продуктов окисления метанола (диметиловый эфир, метилформиат, диметилацеталь формальдегида, формальдегид) в условиях реакции по уравнению:
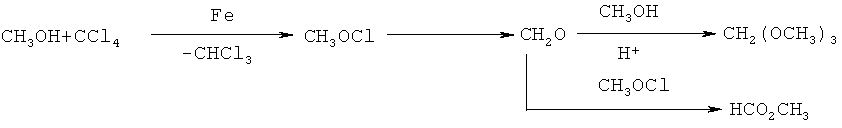
Существенные отличия предлагаемого способа от прототипа.
Для получения алкиловых эфиров бензойной кислоты из бензола используют систему Fe0(мет.)-ацетилацетон-CCl4-ROH.
Преимущества предлагаемого метода.
1. Высокий выход целевого продукта (50% для н-пропилового эфира бензойной кислоты).
2. Селективность процесса.
3. Отсутствие агрессивных окислителей.
4. Доступность и дешевизна исходных реагентов и компонентов.
5. Удешевление себестоимости и упрощение технологии в целом за счет уменьшения энерго- и трудозатрат.
Предлагаемый способ поясняется примерами:
ПРИМЕР 1. Реакции проводили в стеклянной ампуле объемом 10 мл, помещенной в микроавтоклав из нержавеющей стали объемом 17 мл, при постоянном перемешивании и регулируемом нагреве.
В ампулу в токе аргона загружали 10 ммоль Fe0(мет.), 1 ммоль ацетилацетона, 20 ммоль бензола, 200 ммоль четыреххлористого углерода и 200 ммоль спирта. Запаянную ампулу помещали в автоклав, автоклав герметично закрывали и нагревали при 130°C в течение 6 ч при постоянном перемешивании. После окончания реакции автоклав охлаждали до комнатной температуры, ампулу вскрывали, реакционную массу нейтрализовали и фильтровали через бумажный фильтр. Растворитель отгоняли, остаток перегоняли под вакуумом.
Строение полученных соединений доказано методами ЯМР, масс-спектрометрии, а также сравнением с известными образцами и справочными данными [39. Mizyuk V., Shibanov V. // Chem. &Chem. Techn., 2010, 4(1), 23-28].