Результат интеллектуальной деятельности: СПОСОБ ИДЕНТИФИКАЦИИ ЭЛЕМЕНТОВ, ОБЛАДАЮЩИХ СПОСОБНОСТЬЮ ТЕРМИНИРОВАТЬ ТРАНСКРИПТЫ
Вид РИД
Изобретение
Суть изобретения
Предлагается способ, используемый для конструирования трансгенных конструкций, содержащих эффективно работающие регуляторные элементы, в биотехнологии, молекулярной биологии. Сущность изобретения: способ идентификации терминирующих последовательностей ДНК путем использования репортерной системы на основе бицистронной модели, транзиентно экспрессированной в культурах клеток с целью использования идентифицированных элементов для предотвращения нежелательной экспрессии с интегрированных в геном генетических конструкций.
Описание изобретения
Настоящее изобретение относится к области молекулярной биологии и биотехнологии, в частности к методам идентификации регуляторных последовательностей ДНК, которые обладают способностью обрывать новосинтезирующиеся транскрипты. Известны методы, которые могут детально описывать обрывы транскриптов. Применение этих методов ограничено тем, что анализ транскриптов требует проведения громоздких и длительных серий экспериментов, в частности выделение мРНК с последующими Нозерн-блот гибридизациями, ОТ-ПЦР и т.п. Таким образом, применение известных методов ограничивается исследованием активности нескольких регуляторных элементов. В то же время не имеется способов быстрого скрининга элементов на способность обрывать транскрипты, необходимых при создании продуктов в биотехнологии, сельском хозяйстве, медицине. В результате проверка последовательности на способность терминировать транскрипцию занимает много времени. Кроме того, используемые методы дорогостоящи и хороши лишь при детальном изучении механизмов терминации транскрипции. Они не являются гарантией остановки нежелательной транскрипции в трансфецированных геномах, что приводит к выработке нежелательных продуктов и снижает ценность полученных продуцентов. Поэтому поиск эффективных терминаторов транскрипции является актуальной задачей.
Существует способ идентификации терминации транскрипции - 3'RACE (Rapid Amplification of cDNA 3' Ends). Однако применение данного метода ограничивается определением только точки разрыва транскрипта, в то же время эффективность прохождения процесса терминации остается неизвестной. Кроме этого техника 3'RACE требует проведения дорогостоящих и занимающих продолжительное время серий экспериментов (выделение молекул РНК, получение из них кДНК, проведение полимеразной цепной реакции со специфичными праймерами, клонирование полученных фрагментов в плазмиды с последующим секвенированием) (продукт для постановки данного способа предлагают многие фирмы, например Clontech (U.S. Patents 5962271, 5962272)). Существуют бицистронные вектора для наработки целевых белков в культурах клеток (U.S. Patents 6096505, 6319707, 6143520). Но они не используются для идентификации элементов, обладающих способностью терминировать транскрипты. Наиболее близким к предлагаемому является способ RPA (Ribonuclease Protection Assay) (U.S. Patent 5770370), но его применение ограничено сложностью экспериментальных подходов (выделение молекул РНК, подготовка нескольких меченых РНК-зондов, гибридизация проб с последующей ферментативной обработкой, электрофорезом, переносом на мембрану и детекцией меченых молекул), кроме этого применяя данный метод нельзя узнать, насколько корректными формируются 3' концы молекул РНК при использовании тестируемой терминирующей последовательности и окажутся ли синтезированные молекулы РНК способны к транспорту из ядра в цитоплазму и последующей трансляции.
Задачей изобретения являлось создание эффективного способа идентификации элементов, способных терминировать транскрипцию. Для решения этой задачи был разработан способ идентификации элементов, обладающих способностью терминировать транскрипты, включающий в себя: подготовку тестируемых на способность терминировать транскрипты элементов; создание репортерной бицистронной системы, предназначенной для транзиентной трансфекции в культуру клеток и содержащей бицистронную матрицу следующей структуры: расположенные под общим промотором друг за другом открытые рамки считывания маркерных белков цистрон 1 и цистрон 2, за последним цистроном встроен известный терминатор транскрипции; между цистронами встроены стоп-кодоны и участок для внутренней инициации трансляции (IRES); тестируемый на способность терминировать транскрипты элемент встраивается между стоп-кодонами цистрона 1 и участком для внутренней инициации трансляции; расположенный в теле плазмиды ген устойчивости к антибиотику для отбора клеток, содержащих данную плазмиду; трансфекцию репортерной системой подходящего типа клеток с последующим культивированием и регистрацией полученных данных люминесценции или флуоресценции, в зависимости от типа используемой бицистронной системы.
Поставленная задача решалась использованием рекомбинантной плазмиды, предназначенной для транзиентной трансфекции в культуру клеток. Данная плазмида содержит бицистронную модель, состоящую из расположенных друг за другом открытых рамок считывания для двух белков, между которыми встроены стоп-кодоны и участок для внутренней инициации трансляции. Такой химерный ген находится под контролем эффективно работающего в данной культуре клеток промотора.
Пример 1. Способ идентификации элементов, обладающих способностью терминировать транскрипты, используемый для конструирования рекомбинантной плазмиды pAcRrF
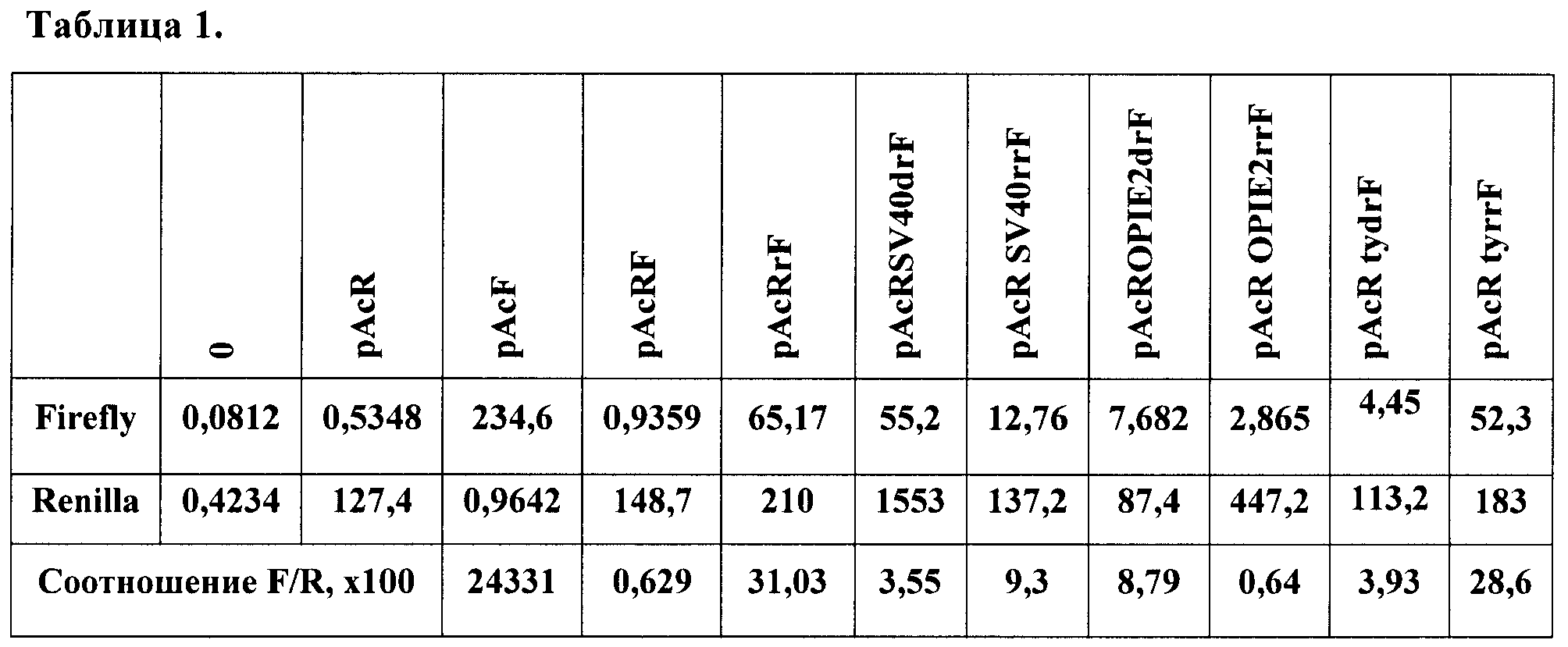
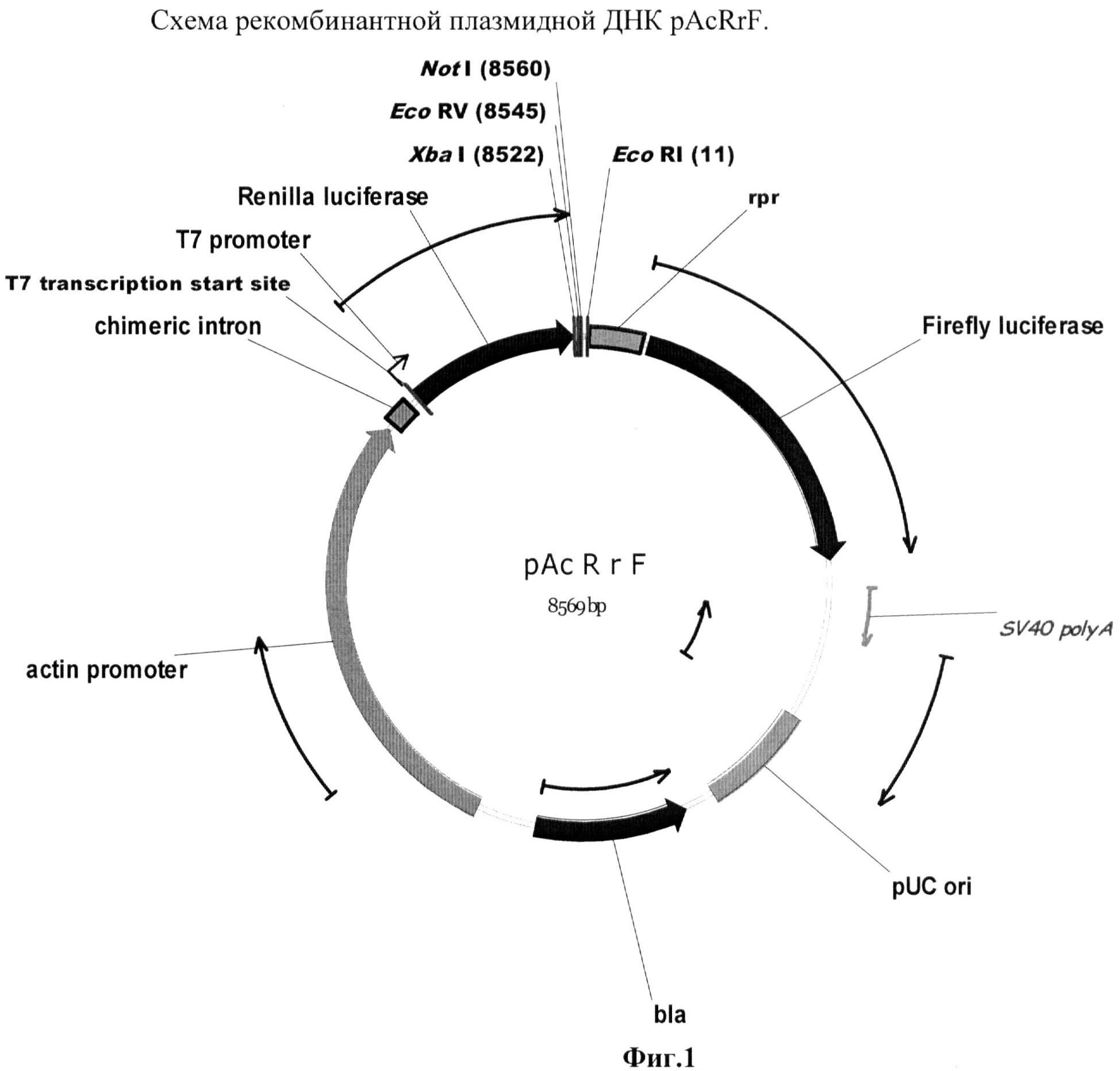
Была создана рекомбинантная плазмида pAcRrF (фиг.1), предназначенная для транзиентной трансфекции в культуру клеток дрозофилы S2 (Schneider 2). Данная плазмида содержала бицистронную модель, состоящую из расположенных друг за другом открытых рамок считывания для люцифераз медузы и светлячка, между которыми встроены стоп-кодоны и участок для внутренней инициации трансляции. Такой химерный ген находился под контролем актинового промотора, который способен эффективно работать в культуре клеток S2.
Рекомбинантная плазмидная ДНК pAcRrF кодирует 2 цистрона люцифераз медузы (933 п.н.) и светлячка (1650 п.н.) под контролем актинового промотора (2438 п.н.), содержащая между цистронами сайт для внутренней посадки рибосомы (IRES) из гена rpr (299 п.н.); выше rpr IRES расположен уникальный сайт рестрикции EcoRV; гены и генетические маркеры: ген bla, обеспечивающий синтез β-лактамазы; бицистрон FR, обеспечивающий синтез люцифераз медузы и светлячка.
В качестве маркерных генов в данном случае использовались Renilla (медуза) и Firefly (светлячок) люциферазы. Первый цистрон представлен люциферазой медузы, второй - светлячка. Выше первого цистрона находится актиновый промотор, для которого показано, что он эффективно работает в культуре клеток S2. Между цистронами помещен rpr IRES. В этой системе подобран эффективно работающий IRES элемент из гена reaper, не обладающий субпромоторной активностью. Конструкции с терминирующими элементами были получены путем встройки выше IRES'а по сайту EcoRV элементов в прямой и обратной ориентациях, чтобы определить, присуща ли тестируемым терминаторам полярность действия и насколько эффективно они работают.
Известна плазмида рАс5.1, способная транзиентно экспрессироваться в культуре клеток S2 и содержащая актиновый промотор и SV40 терминатор, со встроенным между ними полилинкером.
A) Получение моноцистронной плазмиды
В плазмиду рАс5.1, обработанную рестриктазой XbaI, встраивается ген люциферазы светлячка длиной 1650 п.н. (pAcF).
В плазмиду рАс5.1, обработанную рестриктазой XbaI, встраивается ген люциферазы медузы длиной 936 п.н. (pAcR).
Б) Конструирование бицистронной плазмиды
В моноцистронную плазмиду pAcF по сайту рестрикции EcoRI, выше люциферазы светлячка, встраивается ген люциферазы медузы длиной 936 п.н. Таким образом, получается рекомбинантная плазмида pAcRF, на которой синтезируется мРНК, содержащая открытые рамки для трансляции двух белков. Однако транслируется по кэп-зависимому механизму только первый цистрон (люцифераза медузы). Для того чтобы с одной молекулы мРНК можно было получить 2 белка, необходимо встроить между цистронами участок для внутренней посадки рибосомы. В качестве такого участка был выбран элемент из гена reaper, который встраивался в бицистронную плазмиду по сайту XhoI (pAcRrF). В этом участке отсутствуют сайты сплайсинга и нет субпромоторной активности. Поэтому в результате транскрипции образуется одна длинная молекула мРНК, содержащая в себе 2 цистрона, с которых синтезируются 2 белка (люциферазы медузы и светлячка).
B) Получение тестовых конструкций для проверки эффективности работы терминаторов
В бицистронную плазмиду pAcRrF (фиг.1) в разных оринетациях (прямой и обратной соответственно) по сайту EcoRV были встроены охарактеризованные терминаторы вируса SV40 (pAcRSV40drF и pAcRSV40rrF), OpIE2 бакуловируса OpMNPV (pAcROPIE2drF и pAcROPIE2rrF) и ty из гена yellow дрозофилы (pAcR tydrF и pAcR tyrrF). Если данные элементы способны эффективно терминировать транскрипцию, в данной модельной системе будет преимущественно синтезироваться молекула мРНК, содержащая только первый цистрон, и нарабатываться в большом количестве будет только люцифераза медузы.
Пример 2. Способ идентификации элементов, обладающих способностью терминировать транскрипты, используемый для анализа работы бицистронной системы в культуре клеток S2
Подготовленные плазмиды с конструкциями были трансфецированы при помощи липофекции в эмбриональную культуру клеток дрозофилы S2. Данная культура клеток Drosophila Schneider S2 поддерживается при температуре 27°С в бессывороточной среде HyQ SFX (Hyclone). Пересев проводится 1 раз в неделю до концентрации 0,5·106 клеток/мл. Для трансфекции берут 1 мл суспензии клеток (2×106 клеток). За два часа до трансфекции клетки промывают средой. Трансфекцию проводят с использованием трансфецирующего реагента Cellfectin (Invitrogen). На 1 трансфекцию берут 1 мкг ДНК. Смешивают ее со 100 мкл среды. Берут 5 мкл Cellfectin, предварительно ресуспендированного, и смешивают со 100 мкл среды. Оба раствора смешивают и инкубируют 1 час при комнатной температуре. Добавляют 800 мкл среды и переносят в чашки с клетками, выращивают клетки 12 часов, после добавляют 1 мл среды. Через 72 часа после трансфекции проводят детекцию уровней активности люцифераз. Непосредственно с чашек Петри, в которых инкубируют клетки, отбирают среду, а клетки промывают фосфатно-солевым буфером, затем заливают лизирующим буфером (500 мкл на 35 мм чашку) из набора производства Promega (Dual Luciferase Reporter Assay System). Затем чашки Петри инкубируют при комнатной температуре при покачивании в течение 20 мин. После этого полученный лизат осветляют центрифугированием, пробы разносят в планшет из белого непрозрачного пластика и добавляют субстрат для детекции люциферазы светлячка. В люминометре проводят измерение активности данной люциферазы, после этого добавляют субстрат для люциферазы медузы, который одновременно ингибирует активность люциферазы светлячка. Таким образом, в одной и той же пробе последовательно и независимо измеряют активности двух люцифераз - светлячка и медузы. Анализ на люминометре проводят с 10-секундным измерением. Специфический сигнал определяют по отношению активности люциферазы светлячка к активности люциферазы медузы. Фоновый уровень определяют по уровню люминесценции контрольных нетрансфецированных клеток. В табл.1 представлены полученные значения для каждой конструкции.
Выбранный IRES способен эффективно запускать трансляцию цистрона Firefly люциферазы, почти в 60 раз усиливая эффективность трансляции. Таким образом, в разработанной модели получается значение, четко отличимое от контроля. При встройке различных терминирующих элементов выше rpr IRES'а происходит резкое снижение активности люциферазы светлячка. При этом стоит отметить, что используемые вирусные терминаторы оказались способны терминировать транскрипты после первого цистрона как в прямой, так и в обратной ориентациях. Тем не менее небольшая полярность действия была детектирована для каждого элемента. В то же время терминатор, взятый из генома дрозофилы, в котором он специфически терминирует транскрипт гена yellow, способен эффективно работать только в нативной, геномной, ориентации относительно промотора. Таким образом, можно сделать вывод, что, используя данную модельную систему, можно быстро и эффективно идентифицировать элементы на способность терминировать транскрипцию.
Пример 3. Способ идентификации элементов, обладающих способностью терминировать транскрипты, используемый для конструирования рекомбинантной плазмиды pCMV_RFP_EMCV_eGFP
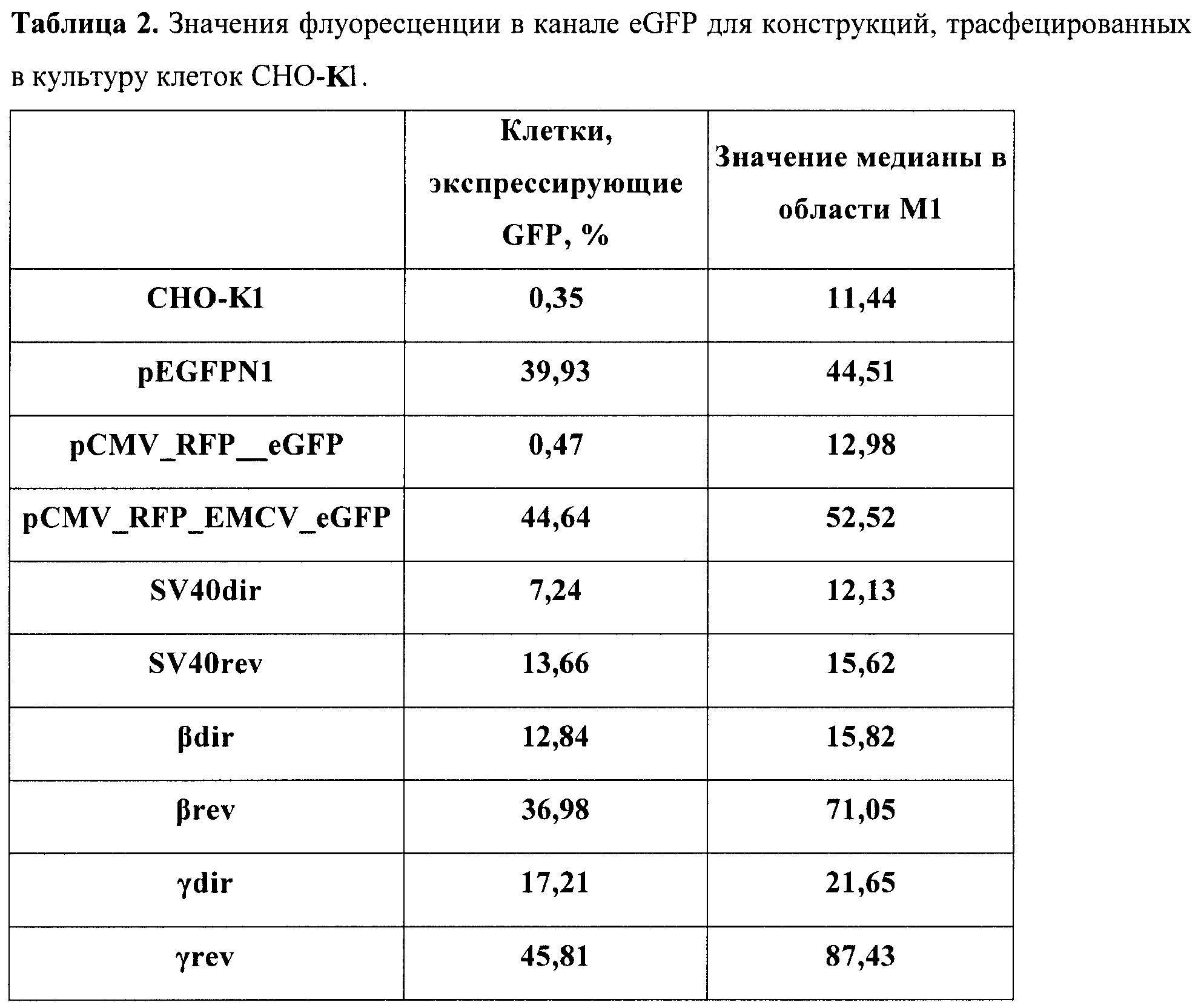
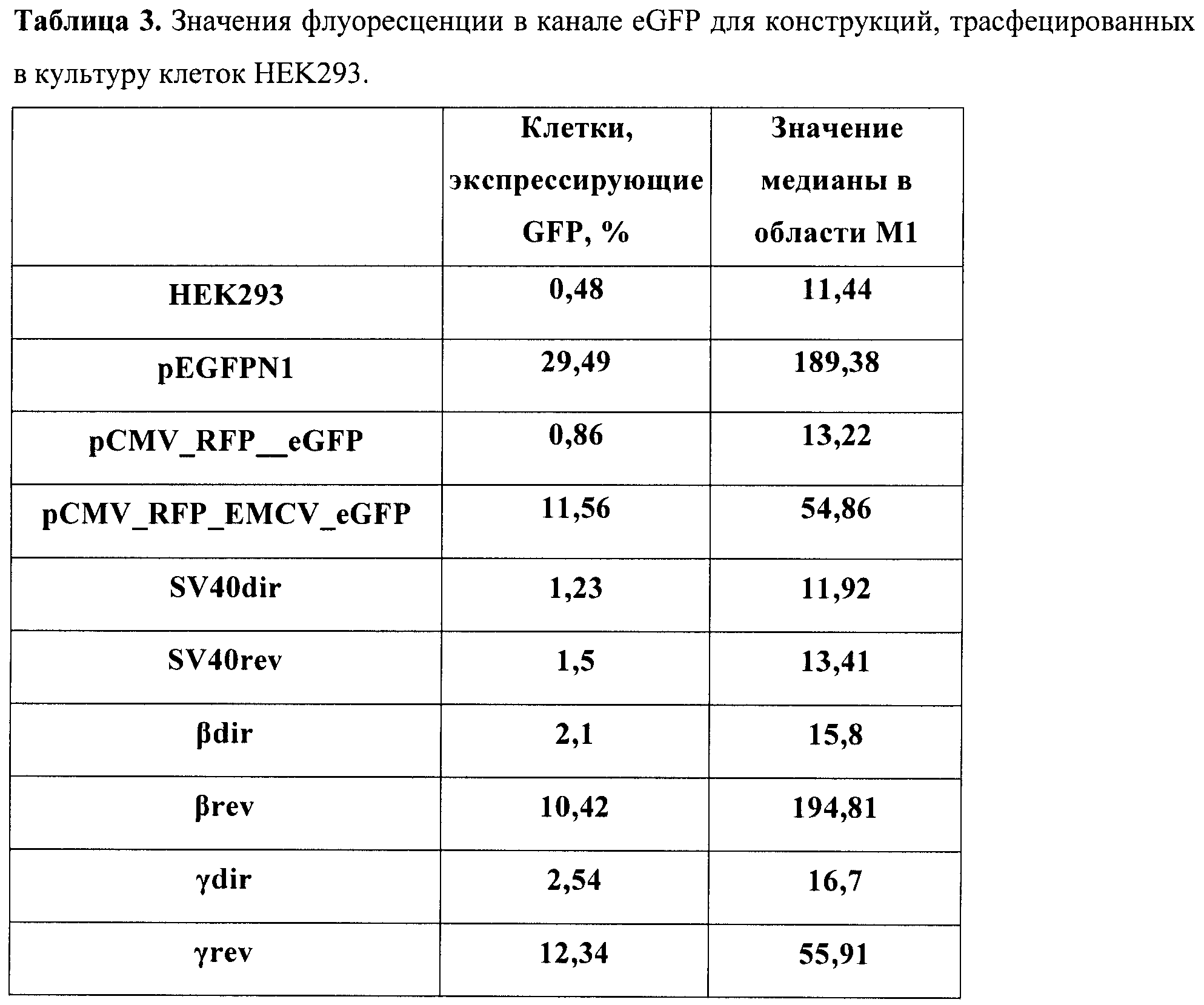
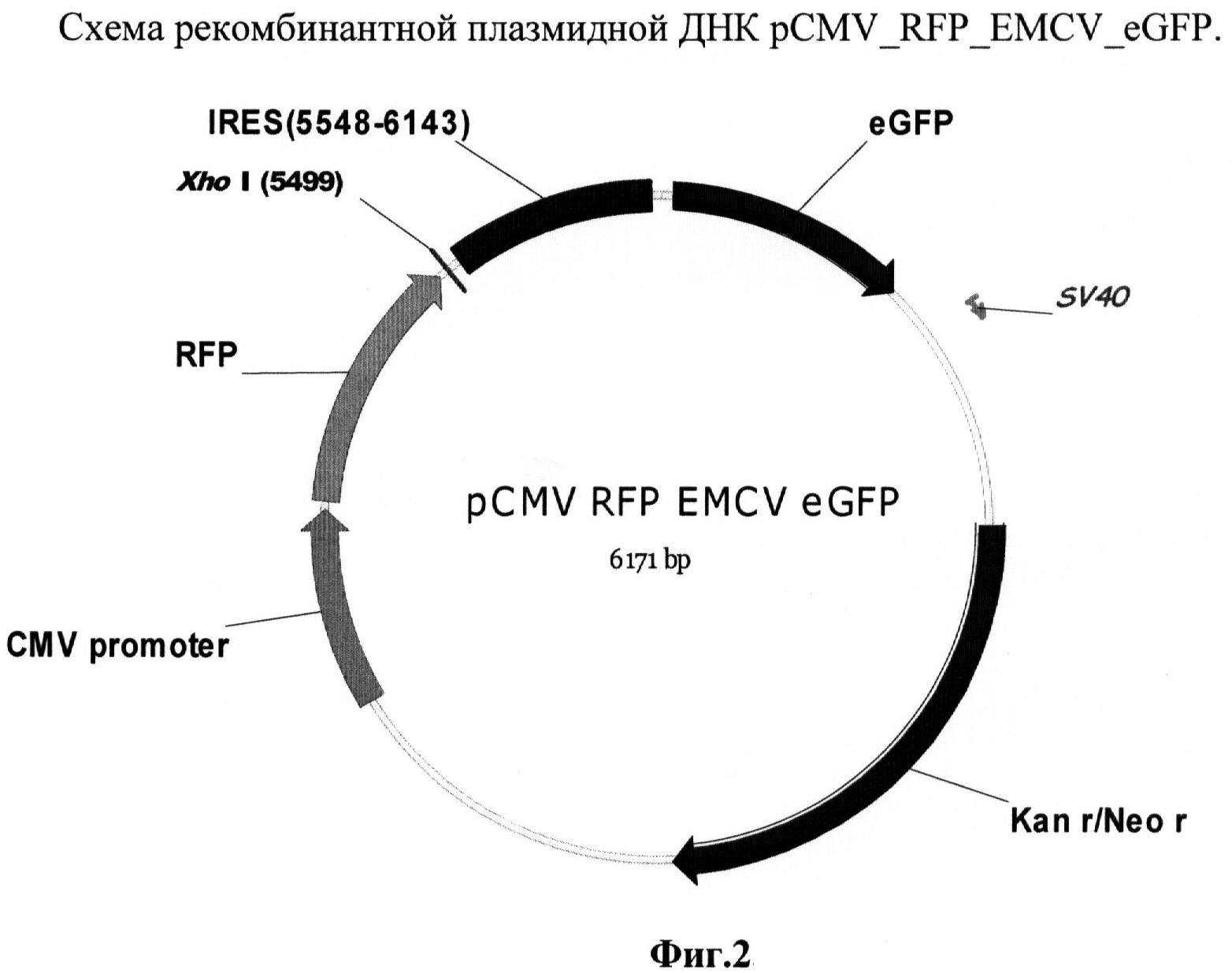
Была также создана рекомбинантная плазмида pCMV_RFP_EMCV_eGFP (фиг.2), предназначенная для транзиентной трансфекции в культуры клеток млекопитающих. Данная плазмида содержит бицистронную модель, состоящую из расположенных друг за другом открытых рамок считывания для красного и зеленого флуоресцентных белков, между которыми встроены стоп-кодоны и участок для внутренней инициации трансляции вируса энцефаломиокардита. Такой химерный ген находится под контролем цитомегаловирусного промотора, который способен эффективно работать в широком спектре клеточных линий млекопитающих.
Рекомбинантная плазмидная ДНК pCMV_RFP_EMCV_eGFP кодирует 2 цистрона красного флуоресцентного белка (761 п.н.) и зеленого флуоресцентного белка (727 п.н.) под контролем цитомегаловирусного промотора (589 п.н.), содержащая между цистронами сайт для внутренней посадки рибосомы (IRES) из вируса энцефаломиокардита (EMCV) (596 п.н.); выше EMCV IRES расположен уникальный сайт рестрикции Xhol; гены и генетические маркеры: ген neoR, обеспечивающий устойчивость к антибиотику неомицину; бицистрон RG, обеспечивающий синтез красного и зеленого флуоресцентных белков.
В качестве маркерных генов в данном случае использовались красный и зеленый флуоресцентные белки. Первый цистрон представлен геном красного флуоресцентного белка, второй - зеленого флуоресцентного белка. Выше первого цистрона находится цитомегаловирусный промотор, для которого показано, что он эффективно работает в обширном спектре культур клеток млекопитающих. Между цистронами помещен EMCV IRES. Данный элемент способен эффективно работать в культурах клеток и не обладает при этом субпромоторной активностью. Конструкции с терминирующими элементами были получены путем встройки выше IRES'а по сайту EcoRV элементов в прямой и обратной ориентациях, чтобы определить, присуща ли тестируемым терминаторам полярность действия и насколько эффективно они работают.
Известна плазмида pEGFPN1, способная транзиентно экспрессироваться в культуре клеток млекопитающих и содержащая цитомегаловирусный промотор, ген зеленого флуоресцентного белка и SV40 терминатор.
А) Конструирование бицистронной плазмиды
В моноцистронную плазмиду pEGFPN1 по сайту рестрикции Есо47III, выше гена зеленого флуоресцентного белка, встраивается ген красного флуоресцентного белка длиной 761 п.н. Таким образом, получается рекомбинантная плазмида pCMV_RFP_eGFP, на которой синтезируется мРНК, содержащая открытые рамки для трансляции двух белков. Однако транслируется по кэп-зависимому механизму только первый цистрон (красный флуоресцентный белок). Для того чтобы с одной молекулы мРНК можно было получить 2 белка, необходимо встроить между цистронами участок для внутренней посадки рибосомы. В качестве такого участка был выбран элемент из вируса энцефаломиокардита (EMCV), который встраивался в бицистронную плазмиду по сайтам EcoRI-SalI (pCMV_RFP_EMCV_eGFP). В этом участке отсутствуют сайты сплайсинга и нет субпромоторной активности. Поэтому в результате транскрипции образуется одна длинная молекула мРНК, содержащая в себе 2 цистрона, с которых синтезируются 2 белка (красный и зеленый флуоресцентные белки).
Б) Получение тестовых конструкций для проверки эффективности работы терминаторов
В бицистронную плазмиду pCMV_RFP_EMCV_eGFP (фиг.2) в разных ориентациях (прямой и обратной соответственно) по сайту XhoI были встроены охарактеризованные терминаторы вируса SV40, а также терминаторы из β- и γ-глобиновых генов человека. Если данные элементы способны эффективно терминировать транскрипцию, в данной модельной системе будет преимущественно синтезироваться молекула мРНК, содержащая только первый цистрон, и зеленый флуоресцентный белок нарабатываться не будет.
Пример 4. Способ идентификации элементов, обладающих способностью терминировать транскрипты, используемый для анализа работы бицистронной системы в культурах клеток СНО-K1 и НЕK293
Подготовленные плазмиды с конструкциями были трансфецированы при помощи липофекции в культуры клеток млекопитающих. Работу проводили на культурах клеток яичника китайского хомячка СНО-K1 и рака почки человека НЕK293Т. Клетки выращивали в среде ДМЕМ, содержащей 8% фетальной бычьей сыворотки ("HyClone", США) и антибиотики (пенициллин, стрептомицин) в стандартной концентрации. Клетки культивировали при температуре 37°С в атмосфере 5%-ного СO2 и высокой влажности.
За сутки до проведения трансфекции клетки рассаживали на чашки Петри диаметром 6 см в количестве около 8×105 клеток на чашку. При такой плотности рассева через 24 часа клетки достигали 90-95%-ной конфлюэнтности. Непосредственно перед проведением трансфекции культуральную среду в чашках заменяли свежей полной средой для культивирования (с сывороткой). Трансфекцию проводили с помощью реагента Lipofectamin 2000 согласно инструкции производителя. Для трансфекции использовали по 4 мкг кольцевой ДНК, представляющей собой исследуемые генно-инженерные конструкции. ДНК растворяли в 250 мкл среды DMEM без сыворотки. Lipofectamin 2000 перед использованием аккуратно перемешивали и для каждой реакции растворяли 10 мкл реагента в 250 мкл среды DMEM без сыворотки. После этого объединяли раствор ДНК с раствором Lipofectamin 2000 и оставляли при комнатной температуре на 20 мин. Затем в каждую чашку добавляли по 500 мкл комплексов ДНК-Lipofectamin 2000, перемешивали, покачивая чашку, и помещали в инкубатор. Спустя 24 часа клетки рассаживали на 2 культуральные чашки Петри диаметром 6 см в концентрации 2×104 кл./мл и на 1 чашку Петри диаметром 6 см в концентрации 105 кл./мл. Затем спустя еще 24 часа проводили детекцию на проточном цитофлуориметре. В качестве контрольных клеток для анализа использовали нетрансфецированные клетки СНО-K1 и НЕK293Т.
В табл.2 представлены полученные значения для каждой конструкции в культуре клеток СНО-K1, в табл.3 - в культуре клеток НЕK293.
Результаты измерений контрольных конструкций показали, что созданной бицистронной моделью можно успешно пользоваться в культуре клеток. Так, моноцистронные системы показали, что уровень флуоресценции eGFP в транзиентных экспериментах успешно детектируется уже через 48 часов после трансфекции (конструкт pEGFPN1) и превышает пороговое значение аутофлуоресценции приблизительно в 6 раз. Крайне важным моментом при работе с создаваемой бицистронной системой является доказательство того, что второй цистрон не способен экспрессироваться за счет реинициации рибосомой за стоп-кодоном первого цистрона. Для этого был тестирован конструкт (pCMV_RFP_eGFP), и он продемонстрировал практически недетектируемый сдвиг относительно порогового значения интенсивности флуоресценции. Таким образом, контрольные конструкты показали правомерность использования данной модели. Можно сделать вывод, что данная система не дает артефактов, связанных с перекрыванием спектров флуоресценции.
Выбранный IRES способен эффективно запускать трансляцию цистрона зеленого флуоресцентного белка, почти в 100 раз усиливая эффективность трансляции в клетках СНО-K1 и в 10 раз - в клетках НЕK293. Таким образом, в разработанной модели получается значение, четко отличимое от контроля. При встройке различных терминирующих элементов выше IRES'а происходит резкое снижение количества ярко светящихся клеток. При этом стоит отметить, что используемый терминатор вируса SV40 подтвердил свою биполярность действия. В то же время терминаторы из глобинового локуса человека согласно полученным данным способны эффективно работать только в нативной, геномной, ориентации относительно промотора. Таким образом, можно сделать вывод, что используя данную модельную систему, можно быстро и эффективно идентифицировать элементы на способность терминировать транскрипцию.