Результат интеллектуальной деятельности: ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО ДЛЯ НЕПРЕРЫВНОГО ВНУТРИВЕННОГО ВВЕДЕНИЯ, СОДЕРЖАЩЕЕ ЦИТИДИНОВОЕ ПРОИЗВОДНОЕ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Данное изобретение касается противоопухолевого средства, непрерывно вводимого внутривенно пациентам с раковым заболеванием.
Уровень техники
1-(3-C-Этинил-β-D-рибопентофуранозил)цитозин (ECyd, представленный следующей формулой) является новым антиметаболитом, имеющим структуру, в которой 3'-β-положение рибозы цитидина замещено этинильной группой.
[F1]

ECyd является цитидиновым аналогом, впервые синтезированным в Японии. В отличие от пиримидинового производного (5-FU) или дезоксицитидинового производного (гемцитабин), являющихся противоопухолевыми средствами, обычно используемыми в клинических ситуациях, ECyd оказывает слабое действие на ДНК и, в основном, ингибирует синтез РНК. В частности, согласно предложенному механизму ECyd фосфорилируется внутриклеточной уридин/цитидин-киназой, образуя при этом трифосфат (ECTP), который ингибирует РНК-полимеразы I, II и III, приводя к гибели соответствующих клеток.
Многие противоопухолевые средства, которые обычно используются в клинических ситуациях и действие которых основано на ингибировании синтеза ДНК, в качестве основного воздействия, оказывают ингибирующий эффект в S-фазе. Опухолевые клетки, используемые в испытаниях на животных, обычно характеризуются сравнительно быстрой пролиферацией. Однако исследования показали, что в клинических ситуациях опухолевые клетки пролиферируют с низкой скоростью и малое число клеток находится в S-фазе. Поскольку в отличие от средств, ингибирующих синтез ДНК, противоопухолевое действие ECyd, основанное на действии, ингибирующем синтез РНК, не зависит от клеточного цикла опухолевых клеток, выдвинуто предположение, что ECyd может служить в качестве клинически полезного противоопухолевого средства, отличающегося от средств, обычно используемых в клинических ситуациях, ингибирующих синтез ДНК.
ECyd обладает эффективным противоопухолевым действием на широкий ряд опухолей (непатентные документы 1 и 2). В испытании на задержку роста опухолей с использованием животных моделей было установлено, что ECyd оказывает эффективное противоопухолевое действие на ряд человеческих опухолевых штаммов при быстрой внутривенной инъекции (т.е. болюсной внутривенной инъекции) раз в неделю в течение двух недель (непатентный документ 3). На животных моделях практически несущественные отрицательные действия были обнаружены при эффективной дозе ECyd, обеспечивающей противоопухолевый эффект, и поэтому ECyd является подходящим претендентом на полезное в клинической ситуации лекарственное средство.
При этом фаза I клинического испытания предназначенного для лечения ракового заболевания лекарственного средства, содержащего ECyd в качестве активного ингредиента, была проведена в Соединенных Штатах. В испытании в случае введения ECyd путем быстрой внутривенной инъекции при схеме введения раз в три недели или схеме введения раз в неделю в течение трех недель и перерывом в одну неделю был обнаружен достаточный уровень ECyd в крови. Испытание показало, что ECyd проявляет задерживающее опухолевый рост действие в отношении пациентов с множественными злокачественными опухолями, не поддающихся лечению общепринятым лекарственным средством.
Однако была обнаружена периферическая нейротоксичность как дозолимитирующая токсичность, затрудняющая дальнейшее увеличение дозы ECyd в целях оценки ECyd в качестве противоопухолевого средства и препятствующая непрерывному введению ECyd. Таким образом, противоопухолевое терапевтическое действие ECyd является неудовлетворительным в клинической ситуации (непатентные документы 4 и 5).
Непатентный документ 1: J. Med. Chem., 39, 5005-5011, 1996.
Непатентный документ 2: Oncol. Rep., 3, 1029-1034, 1996.
Непатентный документ 3: Jpn. J. Cancer Res., 92, 343-351, 2001.
Непатентный документ 4: EORTC-NCI-AACR Symposium, Abs. 67A, 2002.
Непатентный документ 5: EORTC-NCI-AACR Symposium, Abs. 364, 2002.
Раскрытие изобретения
Проблемы, решаемые изобретением
Данное изобретение направлено на разработку нового способа применения ECyd, указанный способ позволяет достигнуть значительного противоопухолевого эффекта и предполагает малый риск возникновения выраженной периферической нейротоксичности.
Способы решения проблем
Настоящими заявителями проведены интенсивные исследования по применению ECyd, и установлено, что при внутривенном введении пациенту ECyd в течение длительного периода времени может быть достигнут значительный противоопухолевый эффект и токсичность может быть снижена, что делает способ введения эффективным для продления жизни пациента.
Таким образом, данное изобретение касается следующих аспектов 1)-7).
1) Противоопухолевое средство, содержащее ECyd или его соль, вводимое пациенту с раковым заболеванием путем непрерывного внутривенного введения в дозе от 1,30 до 8,56 мг/м2 в пересчете на ECyd для каждого периода введения от 2 до 336 часов.
2) Противоопухолевое средство по вышеуказанному абзацу 1), где период введения составляет от 4 до 72 часов.
3) Противоопухолевое средство по вышеуказанному абзацу 1), где период введения равен 24 часам.
4) Противоопухолевое средство по любому из вышеприведенных абзацев 1)-3), вводимое в дозе от 2,80 до 8,56 мг/м2 в пересчете на ECyd.
5) Противоопухолевое средство по любому из вышеприведенных абзацев 1)-3), вводимое в дозе 6,85 мг/м2 в пересчете на ECyd.
6) Применение 1-(3-C-этинил-β-D-рибопентофуранозил)цитозина или соли указанного соединения для производства противоопухолевого средства, где противоопухолевое средство вводят пациенту с раковым заболеванием путем непрерывного внутривенного введения в дозе от 1,30 до 8,56 мг/м2 в пересчете на 1-(3-C-этинил-β-D-рибопентофуранозил)цитозин для каждого периода введения от 2 до 336 часов.
7) Способ лечения ракового заболевания, включающий введение пациенту с раковым заболеванием противоопухолевого средства, содержащего 1-(3-C-этинил-β-D-рибопентофуранозил)цитозин или его соль, путем непрерывного внутривенного введения в дозе от 1,30 до 8,56 мг/м2 в пересчете на 1-(3-C-этинил-β-D-рибопентофуранозил)цитозин для каждого периода введения от 2 до 336 часов.
Эффекты изобретения
Противоопухолевое средство по данному изобретению позволяет достигнуть значительного противоопухолевого эффекта при малом риске возникновения выраженной периферической нейротоксичности. Другими словами, путем лечения ракового заболевания с применением противоопухолевого средства жизнь пациента, несомненно, может быть продлена при снижении риска временной приостановки лечения, которая была бы иначе вызвана отрицательными воздействиями.
Краткое описание чертежей
Фиг. 1
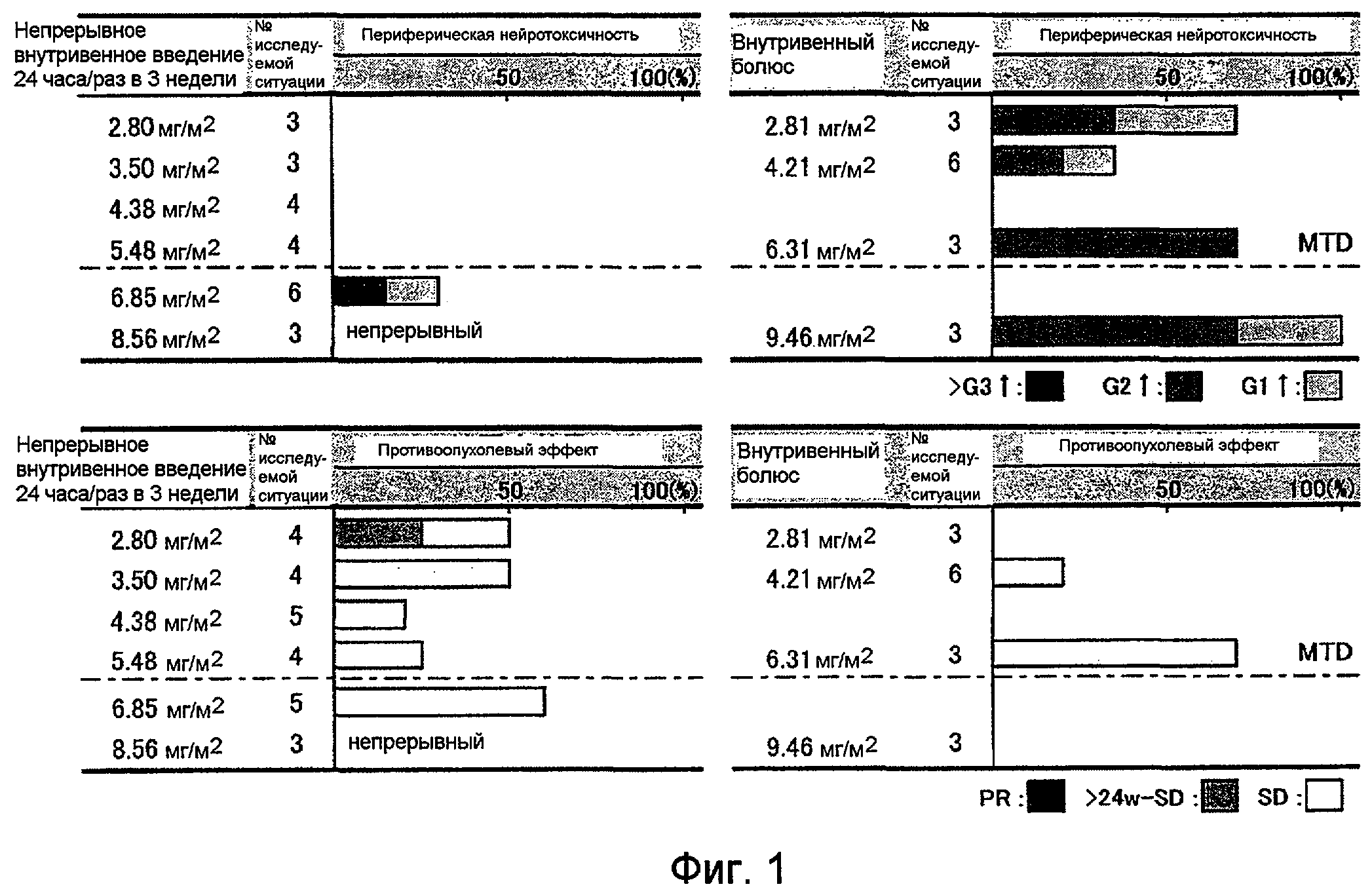
Графы представляют выражение нейротоксичности, являющейся дозолимитирующей при лечении ракового заболевания, и эффективности терапии при введении состава на основе ECyd посредством быстрого внутривенного введения раз в три недели или посредством непрерывного внутривенного введения (PR: частичный ответ, SD: устойчивое заболевание). Продольный отрезок отражает появление нейротоксичности (%) или появление терапевтической эффективности (%).
Фиг. 2
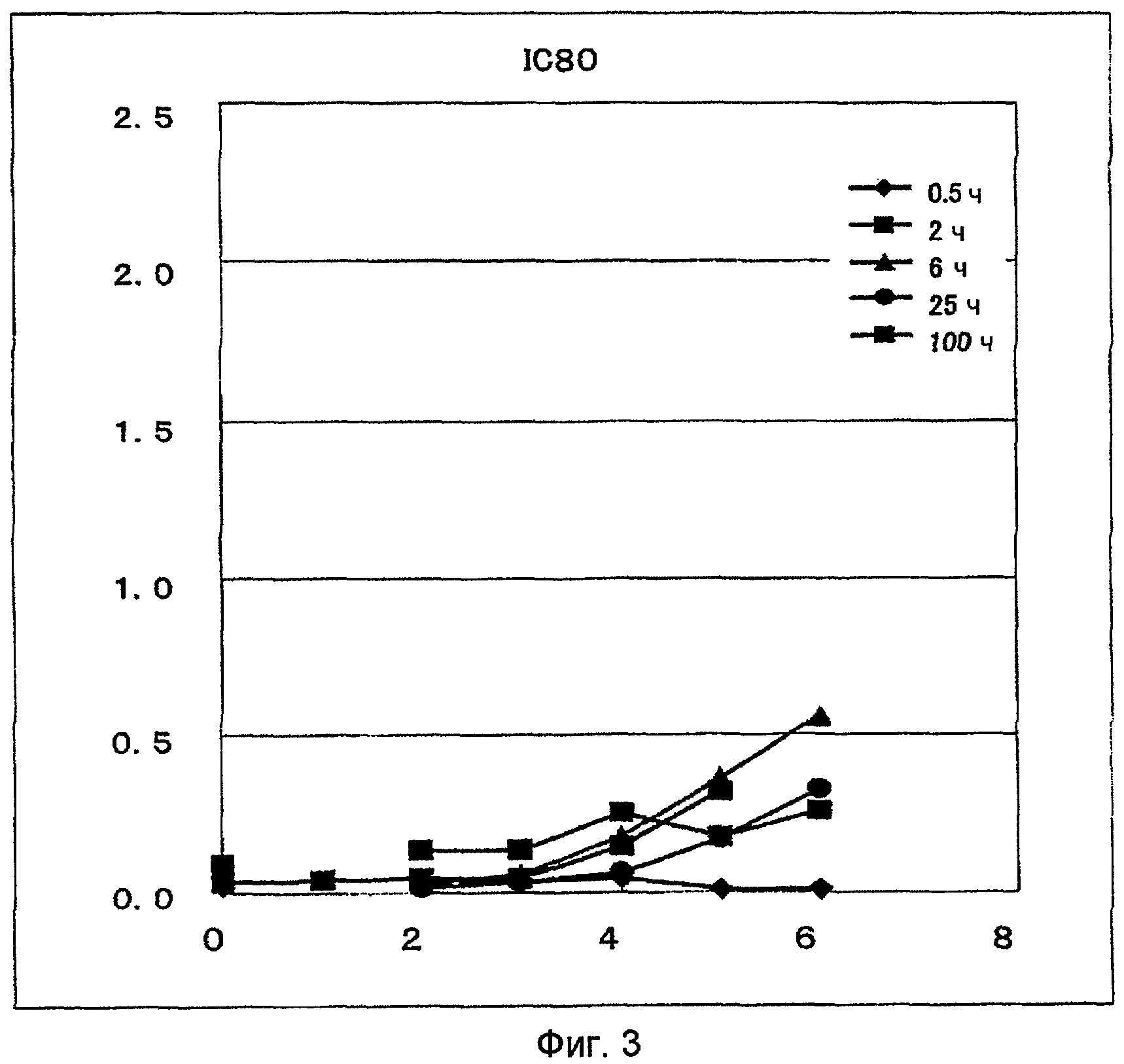
График представляет влияние схемы введения ECyd на задержку роста происходящих из нервного гребешка хромаффинных клеток мозгового вещества надпочечника крыс (штамм PC12).
Фиг. 3
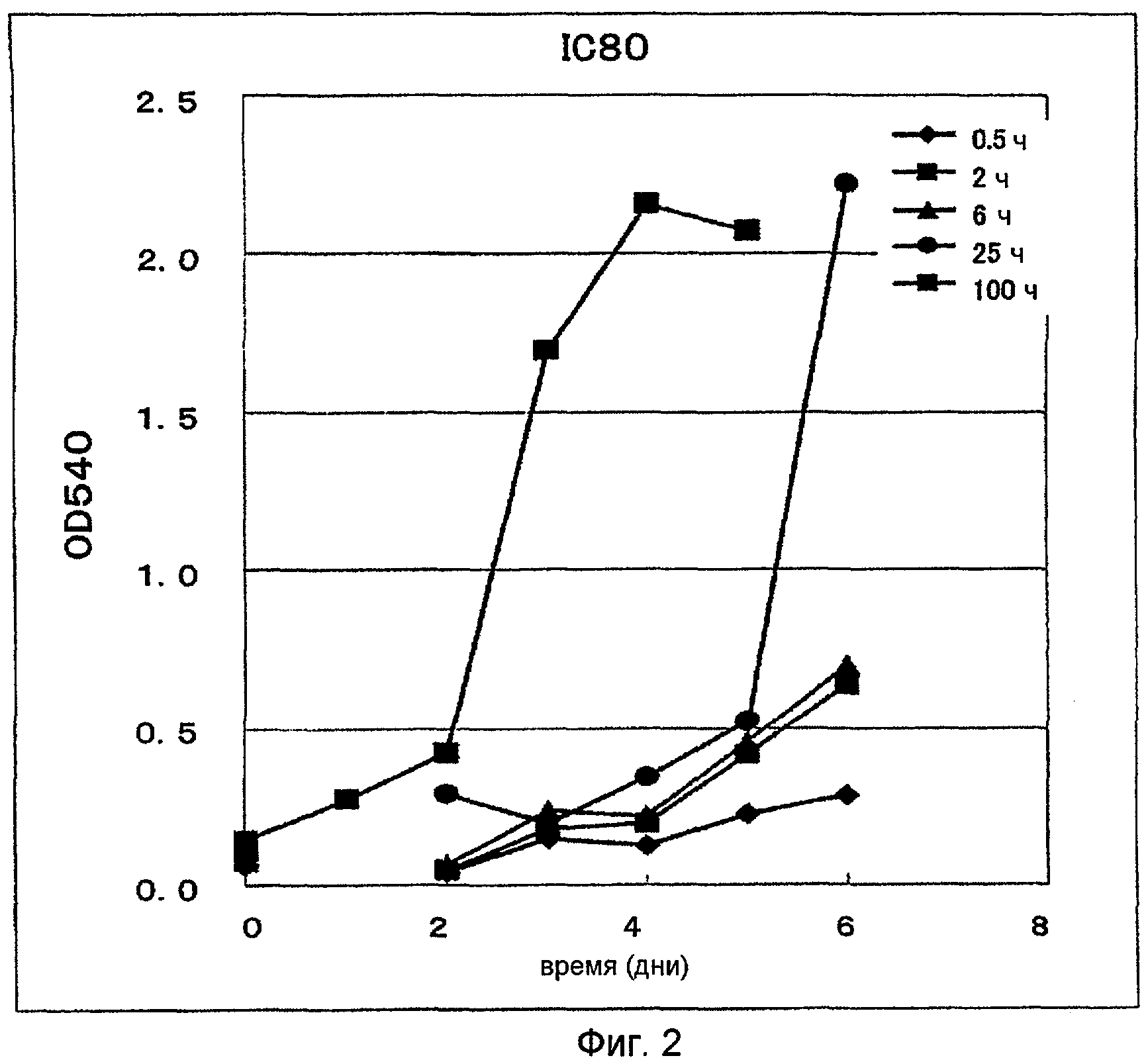
График представляет влияние схемы введения ECyd на задержку роста легочных опухолевых клеток человека (штамм A549).
Наилучший вариант осуществления изобретения
ECyd, 1-(3-C-этинил-β-D-рибопентофуранозил)цитозин, используемый в качестве активного ингредиента противоопухолевого средства по данному изобретению, является известным соединением и, как известно, оказывает противоопухолевое действие на ряд злокачественных опухолей путем ингибирующего действия на синтез РНК. Причем никогда не сообщалось, что рак можно эффективно лечить, подавляя при этом отрицательные действия, путем непрерывного внутривенного введения ECyd.
Не налагаются особые ограничения на соль ECyd при условии, что указанная соль является фармацевтически приемлемой. Примеры соли включают соли неорганических кислот, такие как гидрохлориды, гидробромиды, сульфаты, нитраты и фосфаты; и соли органических кислот, такие как ацетаты, пропионаты, тартраты, фумараты, малеаты, малаты, цитраты, метансульфонаты, п-толуолсульфонаты и трифторацетаты.
ECyd или его соль, используемые в данном изобретении, могут быть получены известным способом, например способом, описанным в JP-B-3142874.
Противоопухолевое средство по данному изобретению вводят пациентам внутривенно, и лекарственной формой является инъекция. Инъекция может представлять собой жидкий состав для инъекции или твердый состав для инъекции, такие как лиофилизированный и порошковый составы для инъекции, которые могут быть восстановлены при употреблении.
Противоопухолевое средство по данному изобретению может быть получено добавлением ECyd или его соли к фармакологически приемлемому носителю и переработкой смеси рутинным способом. Примеры носителя, используемого в изобретении, включают органические и неорганические носители, обычно используемые в качестве материалов для лекарственных составов. В частности, наполнитель, смазывающее вещество, связующее вещество, разрыхлитель и проч. могут быть добавлены к твердому составу для инъекции, и разбавитель, солюбилизирующее вещество, суспендирующее средство, средство для создания тоничности, регулирующее pH средство, буфер, стабилизатор, успокаивающее средство и т.д. могут быть добавлены к жидкому составу для инъекции. При желании могут также быть использованы добавки к лекарственным составам, такие как антисептическое средство, антиоксидант и краситель.
Примеры наполнителя включают такие вещества, как лактоза, сахароза, хлорид натрия, глюкоза, мальтоза, маннит, эритрит, ксилит, мальтит, инозит, декстран, сорбит, альбумин, мочевина, крахмал, карбонат кальция, каолин, кристаллическая целлюлоза, кремниевая кислота, метилцеллюлоза, глицерин, альгинат натрия, гуммиарабик и смеси указанных веществ. Примеры смазывающего вещества включают такие вещества, как очищенный тальк, стеараты, бура, полиэтиленгликоль и смеси указанных веществ. Примеры связующего вещества включают такие вещества, как простой сироп, жидкая глюкоза, жидкий крахмал, желатиновый раствор, поли(виниловый спирт), простой поли(виниловый эфир), поливинилпирролидон, карбоксиметилцеллюлоза, шеллак, метилцеллюлоза, этилцеллюлоза, вода, этанол, фосфат калия и смеси указанных веществ. Примеры разрыхлителя включают такие вещества, как сухой крахмал, альгинат натрия, порошкообразный агар, порошкообразная ламинария, гидрокарбонат натрия, карбонат кальция, полиоксиэтиленовые эфиры сорбита и жирных кислот, лаурилсульфат натрия, стеариновый моноглицерид, крахмал, лактоза и смеси указанных веществ. Примеры разбавителя включают воду, этиловый спирт, макрогол, пропиленгликоль, этоксилированный изостеариловый спирт, полиоксилированный изостеариловый спирт, полиоксиэтиленовые эфиры сорбита и жирных кислот и смеси указанных веществ. Примеры стабилизатора включают пиросульфит натрия, этилендиаминтетрауксусную кислоту, тиогликолевую кислоту и тиомолочную кислоту и смеси указанных веществ. Примеры средства для создания тоничности включают хлорид натрия, борную кислоту, глюкозу, глицерин и смеси указанных веществ. Примеры регулирующего pH средства и буфера включают цитрат натрия, лимонную кислоту, ацетат натрия, фосфат натрия и смеси указанных веществ. Примеры успокаивающего средства включают прокаингидрохлорид, лидокаингидрохлорид и смеси указанных веществ.
Дозу противоопухолевого средства по данному изобретению устанавливают с учетом соотношения между риском отрицательного действия и противоопухолевым эффектом. Доза такого средства предпочтительно составляет от 1,30 до 8,56 мг/м2 в пересчете на ECyd, более предпочтительно от 2,80 до 8,56 мг/м2 и в особенности предпочтительно 6,85 мг/м2.
Противоопухолевое средство по данному изобретению вводят пациенту с раковым заболеванием в течение каждого периода введения, от 2 до 336 часов, путем непрерывного внутривенного введения. С учетом соотношения между риском отрицательного действия и противоопухолевым эффектом время введения предпочтительнее составляет от 4 до 72 часов, в особенности предпочтительно 24 часа.
Путем непрерывного внутривенного введения в течение такого длительного времени мишеневая злокачественная опухоль может быть подвергнута эффективному лечению при подавлении наступления отрицательного действия, такого как периферическая нейротоксичность.
При непрерывном внутривенном введении противоопухолевого средства по данному изобретению конкретная схема введения служит в качестве одного из курсов, предпочтительно повторяемых с целью достижения большего противоопухолевого эффекта при подавлении периферической нейротоксичности. Схема введения предпочтительно представляет собой непрерывное внутривенное введение раз в одну-три недели, более предпочтительно раз в три недели.
По одной из предпочтительных схем введения противоопухолевого средства по данному изобретению курс, включающий 24-часовое непрерывное внутривенное введение раз в три недели, при дозе от 1,30 до 8,56 мг/м2 в пересчете на ECyd для каждого введения проводят один или несколько раз. По другой предпочтительной схеме введения курс, включающий 4-часовое непрерывное внутривенное введение раз в три недели, превышающий непрерывный четырехнедельный период, при дозе от 1,30 до 8,56 мг/м2 в пересчете на ECyd для каждого введения проводят один или несколько раз. Согласно более предпочтительной схеме введения курс, включающий 24-часовое непрерывное внутривенное введение раз в три недели, при дозе 6,85 мг/м2 в пересчете на ECyd для каждого введения проводят один или несколько раз. По другой, более предпочтительной схеме введения, курс, включающий 4-часовое непрерывное внутривенное введение раз в три недели, превышающий непрерывный четырех-недельный период, при дозе 1,30 мг/м2 в пересчете на ECyd для каждого введения проводят один или несколько раз.
Не налагаются особые ограничения на злокачественную опухоль, применительно к которой используют противоопухолевое средство по данному изобретению. Примеры ракового заболевания включают такие, как рак шеи и головы, рак пищевода, рак желудка, рак ободочной и прямой кишки, рак печени, рак желчного пузыря/желчного протока, рак поджелудочной железы, рак легких, рак молочной железы, рак яичника, рак мочевого пузыря, рак предстательной железы, рак яичка, саркома кости и мягких тканей, злокачественная лимфома, лейкоз, рак шейки матки, рак кожи и опухоль головного мозга. Из числа перечисленного наиболее предпочтительны рак шеи и головы, рак легких, рак желудка, рак ободочной и прямой кишки, рак поджелудочной железы и рак молочной железы.
Пациентом с раковым заболеванием, которому вводится противоопухолевое средство по данному изобретению, может быть пациент с раковым заболеванием, который не получал лечения от рака, пациент с раковым заболеванием, который в настоящее время получает лечение от рака, или пациент с раковым заболеванием, который когда-либо получал лечение от рака.
Противоопухолевое средство по данному изобретению может быть использовано в комбинации с другим противоопухолевым средством или облучением. Примеры противоопухолевого средства, которое может быть использовано в комбинации, включают 5-FU, состав тегафур-урацил, состав тегафур-гемирацил-отерацилкалий, доксорубицин, эпирубицин, иринотекангидрохлорид, этопозид, доцетаксел, паклитаксел, цисплатин, карбоплатин, оксалиплатин, крестин, лентинан и пицибанил.
Примеры
Далее настоящее изобретение описано подробно с помощью примеров, которые не рассматриваются как ограничивающие данное изобретение.
Пример 1
Группу пациентов с раковым заболеванием многократно подвергают курсу, включающему 24-часовое непрерывное внутривенное введение раз в три недели, при дозе от 2,80 до 8,56 мг/м2 в пересчете на ECyd для каждого введения. Другую группу пациентов с раковым заболеванием многократно подвергают курсу, включающему быстрое внутривенное введение раз в три недели, при дозе от 2,81 до 9,46 мг/м2 в пересчете на ECyd. В обоих случаях изучают наступление нейротоксичности и терапевтического эффекта под действием ECyd.
Вышеуказанное исследование эквивалентно фазе I клинического испытания, которое проводят, главным образом, для того, чтобы оценить безопасность испытуемого лекарственного средства и определить рекомендуемую дозу (RD) лекарственного средства, которая гарантирует безопасность препарата без отрицательных воздействий на фазе II клинического испытания, выполняемого относительно рака, представляющего объект исследования. Испытание проводят на пациентах с солидным раком (например, желудочно-кишечным раком, раком головы и шеи и раком молочной железы), который не может быть вылечен стандартным терапевтическим методом или к которому никакой эффективный метод не применим. После проведения испытания по возможности оценивают терапевтический эффект в отношении мишеневой опухоли. В следующих примерах терапевтический эффект в отношении мишеневой опухоли оценивают RECIST методом (см. Journal of the National Cancer Institute, 2000, Vol. 92, № 3, p. 205-216). Влияние ECyd на сморщивание опухоли подтверждают обычно на мишеневом очаге (очаге, имеющем размер, равный или больше, чем измеримый размер, в зависимости от ширины среза, полученного путем CT или подобными способами) и немишеневых очагах (все очаги, кроме мишеневого очага). В вышеуказанном испытании PR (частичный ответ) означает состояние, при котором сумма наибольших диаметров мишеневых очагов снижается на 30% или более по сравнению с соответствующей суммой, установленной до введения лекарственного средства, эффект сморщивания поддерживается, как правило, в течение некоторого периода (обычно четырех недель) и никакого обострения на немишеневых очагах во время испытания не наблюдается. PD (прогрессирующее заболевание) означает состояние, при котором сумма наибольших диаметров мишеневых очагов возрастает на 20% или более по сравнению с наименьшей суммой наибольших диаметров, регистрируемой после начала испытания, или состояние, при котором наблюдается явное обострение на немишеневых очагах или наблюдается новый очаг. SD (устойчивое заболевание) означает состояние, при котором степень сморщивания опухоли не может быть оценена как PR, и которое не может быть оценено как PD, и при котором развитие опухоли останавливается и никакого обострения не наблюдается. MR (незначительный ответ) означает случай, при котором сохраняется некоторая степень сморщивания опухоли, порядка 15% (хотя указанная степень и ниже 30%), или при котором терапевтический эффект, соответствующий PR, временно наблюдается. Результаты приведены на фиг. 1.
Фиг. 1 представляет результаты введения состава на основе ECyd (инъекция) раз в три недели в дозе 2,80-9,46 мг/м2 посредством быстрого внутривенного введения и результаты 24-часового непрерывного внутривенного введения. В случае быстрого внутривенного введения наблюдаются две из трех ситуаций (66%), при которых используемая доза 2,81 мг/м2 дает периферическую нейротоксичность и никакого терапевтического эффекта не наблюдается. При повышении дозы до 6,31 мг/м2 два из трех случаев дают периферическую нейротоксичность и терапевтическая эффективность (SD или большая) наблюдается в двух из трех случаев. Напротив, при осуществлении непрерывного внутривенного введения в дозе от 2,80 мг/м2 до 5,48 мг/м2 периферическая нейротоксичность не наблюдается и установленная терапевтическая эффективность (SD или большая) составляет 20-50%.
Следовательно, непрерывное внутривенное введение ECyd можно считать способом, обеспечивающим высокую терапевтическую эффективность пациентам с солидным раком (например, желудочно-кишечным раком, раком головы и шеи и раком молочной железы), которые не могут быть вылечены стандартным терапевтическим методом или к которым никакой эффективный метод не применим, при этом наступление периферической нейротоксичности подавляется.
Пример 2
Курс, включающий 4-часовое непрерывное внутривенное введение раз в три недели, превышающий непрерывный четырехнедельный период, при дозе 1,30 мг/м2 в пересчете на ECyd для каждого введения проводят несколько раз. Также несколько раз проводят курс, включающий быстрое внутривенное введение раз в три недели, превышающий непрерывный четырехнедельный период, при дозе 1,30 мг/м2 в пересчете на ECyd для каждого введения. В обоих случаях изучают наступление нейротоксичности и терапевтического эффекта под действием ECyd. В примере 2 выбор пациентов и методов и шкала оценок те же, что используются в примере 1.
Результаты испытаний следующие. В случае быстрого внутривенного введения одна из трех ситуаций (33%) приводит к периферической нейротоксичности и не наблюдается никакой терапевтической эффективности (SD или выше). Напротив, при проведении непрерывного внутривенного введения периферическая нейротоксичность наблюдается в одном из трех случаев (33%), а установленная терапевтическая эффективность (SD или выше) равна 66%.
Следовательно, непрерывное внутривенное введение ECyd можно считать способом, обеспечивающим высокую терапевтическую эффективность пациентам с солидным раком (например, желудочно-кишечным раком, раком головы и шеи и раком молочной железы), которые не могут быть вылечены стандартным терапевтическим методом или к которым никакой эффективный метод не применим, при этом наступление периферической нейротоксичности подавляется.
Пример 3
Изучено влияние схемы введения ECyd на задержку роста происходящих из нервного гребешка хромаффинных клеток мозгового вещества надпочечника крыс (штамм PC12).
Эксперимент по примеру 3 выполняют при постоянном значении AUC (произведение времени контакта и концентрации ECyd). В частности, при каждом исследуемом режиме AUC поддерживают на таком уровне, что концентрацию ECyd доводят до величины, обеспечивающей IC80 (0,08 мкМ) в результате контакта ECyd и PC12 клеток в течение 100 часов. При каждом исследуемом режиме PC12 клетки высевают в чашку и обрабатывают ECyd. Затем производят замену клеточной культуральной жидкости. После чего получают профиль клеточного роста путем окрашивания кристаллическим фиолетовым. Результаты приведены на фиг. 2.
В случае когда время контакта равно 0,5 часа, рост PC12 клеток практически не возобновляется на день 6. В случаях когда время контакта составляет 25 и 100 часов, рост PC12 клеток возобновляется. Возобновление роста клеток достигается тем быстрее, чем больше время контакта. Таким образом, установлено, что задержка роста нервных клеток PC12 более успешна при Cmax и задержка в случает контакта ECyd низкой концентрации в течение длительного периода времени не более значительна, чем в случае контакта ECyd высокой концентрации в течение короткого периода времени.
Таким образом, установлено, что влияние непрерывного введения ECyd на задержку роста нервных клеток незначительно.
Пример 4
Изучено влияние схемы введения ECyd на задержку роста легочных опухолевых клеток (A549 штамм) человека.
Эксперимент по примеру 4 выполняют при постоянном значении AUC (произведение времени контакта и концентрации ECyd). В частности, при каждом исследуемом режиме AUC поддерживают на таком уровне, что концентрацию ECyd доводят до величины, обеспечивающей IC80 (0,08 мкМ) в результате контакта ECyd и A549 клеток в течение 100 часов. При каждом исследуемом режиме A549 клетки высевают в чашку и обрабатывают ECyd. Затем производят замену клеточной культуральной жидкости. После чего получают профиль клеточного роста путем окрашивания кристаллическим фиолетовым. Результаты приведены на фиг. 3.
В случае когда время контакта составляет от 0,5 до 100 часов, рост A549 клеток практически не возобновляется на день 6. Таким образом, установлено, что на задержку роста опухолевых клеток Cmax не влияет.
Итак, установлено, что непрерывное введение ECyd достигает эффекта задержки роста опухолевых клеток, эквивалентного эффекту, обеспечиваемому быстрым введением.
Как описано здесь, установлено, что непрерывное введение ECyd по данному изобретению является эффективной терапией рака, обеспечивающей высокую степень задержки роста опухолевых клеток, не вызывающей периферическую нейротоксичность.