Результат интеллектуальной деятельности: СПОСОБ ПРИГОТОВЛЕНИЯ ФАРМАЦЕВТИЧЕСКОГО ПРОДУКТА
Вид РИД
Изобретение
Настоящее изобретение относится к способам приготовления фармацевтических продуктов, включающим заполнение фармацевтических носителей порошками активных фармацевтических ингредиентов с помощью дозировочно-наполнительного вакуумного устройства. Раскрываемые здесь способы можно использовать в непрерывном процессе, таком как высокопроизводительный процесс производства фармацевтического продукта.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Составление препаратов активной фармацевтической субстанции (АФС) с момента ее разработки, в период от начальных фаз клинических испытаний до поздних фаз клинических испытаний и конечного коммерческого продукта затратно и ресурсоемко. Коммерческий препарат, содержащий АФС, и связанный с ним производственный процесс обычно включают смешивание или гранулирование формообразующих. Геометрическое разбавление, влажное гранулирование и сухое смешивание применяются, в частности, при изготовлении препаратов, содержащих низкие дозы. Много усилий затрачивается на создание адекватного метода смешивания для обеспечения однородности дозирования и равномерности распределения формообразующих и АФС. Кроме того, большое внимание уделяется операциям масштабирования, и составление препарата осуществляют заново всякий раз, когда состав препарата на начальной фазе (или при первом подходе) демонстрирует неожиданный биофармацевтический профиль или оказывается неадекватным для проведения поздней фазы. Для ускорения разработки АФС можно с большой точностью дозировать в капсулы на начальной фазе. Принцип дозирования из перечницы в сочетании с классическим взвешиванием (Xcelodose®) - это широко распространенное решение. Однако, на более поздних фазах, классическое составление препарата с формообразующими еще требуется разрабатывать.
При использовании в капсуле неразбавленной АФС можно сократить время разработки состава препарата путем простой оценки совместимости оболочки капсулы и АФС вместо исследования совместимости с формообразующим и полного проведения составления лекарственной формы. Также можно сократить период разработки аналитического метода, поскольку не требуется уточнения специфичности, так как отсутствуют мешающие формообразующие. Таким образом, аналитический метод для лекарственного вещества может быть достаточен для лекарственного продукта. Однако, трудности достижения точного наполнения АФС в капсулы с воспроизводимым наполнением все равно существуют, особенно в случаях малого наполняемого веса.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к инженерной и производственной концепции, имеющей целью непосредственное инкапсулирование неразбавленной АФС (или АФС с очень низким количеством добавок) в очень широком диапазоне доз на всем пути разработки лекарственного продукта до коммерческого производства. Способ настоящего изобретения особенно полезен для непрерывного процесса, такого как высокопроизводительный процесс производства фармацевтического продукта.
Уникальность способа настоящего изобретения заключается в том, что он пригоден для необычайно широкого разнообразия свойств порошка, включая порошки, которыми невозможно заполнять какое-либо другое оборудование, что позволяет пользователю платформы справляться с особенностями порошков неразбавленной АФС (например, с излишним слипанием, адгезией, плохой сыпучестью и т.д.). Раскрываемый способ способен разрешить множество сложных аспектов разработки лекарств при относительно простых технологическом оформлении и организационных решениях, что радикально упрощает разработку и изготовление лекарственных форм для перорального применения. Этот способ можно применять как таковой к любой новой АФС, вступающей в стадию разработки в фармацевтическом исследовании и разработке (если ее собственные характеристики растворимости достаточно благоприятны), вплоть до коммерческого производства.
Для реализации вышеописанных целей в способе настоящего изобретения применяются необычные аппаратурное оформление и технологии, а также новые процедуры, позволяющие понять, прогнозировать, выбирать, модифицировать и контролировать свойства порошка.
Соответственно, настоящее изобретение предлагает способ приготовления фармацевтического продукта, включающий стадии:
(a) предоставления активной фармацевтической субстанции (АФС), которая соответствует по меньшей мере пяти из следующих параметров (i) - (viii), определенных с помощью порошкового реометра FT4:
(i) основной удельной энергии потока (sBFE) не более 60 мДж/г;
(ii) индексу стабильности (SI) от 0,75 до 1,25;
(iii) удельной энергии (SE) не более 10 мДж/г;
(iv) наибольшему главному напряжению при 15 кПа (MPS-15) не более 40;
(v) функции тока при 15 кПа (FF-15) не менее 1,3;
(vi) уплотненной объемной плотности при 15 кПа (CBD-15) не менее 0,26 г/мл;
(vii) сжимаемости не более 47%; и
(viii) углу трения у стенки (WFA) не более 40°;
(b) дозирования АФС со стадии (a) в нижнюю часть фармацевтического носителя с помощью дозировочно-наполнительного вакуумного устройства; и
(c) капсулирования нижней части указанного фармацевтического носителя соответствующей закрывающей частью указанного фармацевтического носителя, тем самым получая фармацевтический продукт.
В родственном аспекте настоящего изобретения предложен способ наполнения фармацевтического носителя или лекарственной формы порошком неразбавленной активной фармацевтической субстанции (АФС), причем способ включает в себя:
(а) дозирование порошка АФС в нижнюю часть фармацевтического носителя или лекарственной формы с помощью дозировочно-наполнительного вакуумного устройства; и
(b) капсулирование нижней части указанного фармацевтического носителя или лекарственной формы соответствующей закрывающей частью указанного фармацевтического носителя или лекарственной формы, тем самым получая наполненный фармацевтический носитель или лекарственную форму;
где неразбавленная АФС соответствует по меньшей мере пяти из следующих параметров (i) - (viii), определенных с помощью порошкового реометра FT4:
(i) основной удельной энергии потока (sBFE) не более 60 мДж/г;
(ii) индексу стабильности (SI) от 0,75 до 1,25;
(iii) удельной энергии (SE) не более 10 мДж/г;
(iv) наибольшему главному напряжению при 15 кПа (MPS-15) не более 40;
(v) функции тока при 15 кПа (FF-15) не менее 1,3;
(vi) уплотненной объемной плотности при 15 кПа (CBD-15) не менее 0,26 г/мл;
(vii) сжимаемости не более 47%; и
(viii) углу трения у стенки (WFA) не более 40°.
Таким образом, фармацевтический носитель/лекарственная форма, однажды заполненные и запечатанные, обычно содержат только неразбавленную АФС (отмечая, что неразбавленная АФС может содержать не более 5%, 4%, 3%, 2%, 1%, 0,5% или 0,1% добавок).
Настоящее изобретение также предлагает фармацевтический носитель/лекарственную форму, такую как пероральную лекарственную форму, содержащую только неразбавленную АФС (отмечая, что неразбавленная АФС может содержать не более 5%, 4%, 3%, 2%, 1%, 0,5% или 0,1% добавок), полученные или получаемые способом данного изобретения, описанным в данном документе в любом из вариантов осуществления.
Авторы настоящего изобретения разработали способ для прогнозирования того, подходит ли АФС для составления в фармацевтический продукт непосредственно в виде неразбавленной АФС или нуждается в доработке (модификации частиц). Соответственно, этап (а) представляет собой проверку качества, на котором определяют новый минимальный стандарт определенных параметров порошка, требуемых для составления АФС в фармацевтическом продукте в виде неразбавленной АФС.
Таким образом, в настоящем изобретении также предложен способ для прогнозирования того, подходит ли АФС для составления в фармацевтический продукт непосредственно в виде неразбавленной АФС, причем способ включает в себя определение с помощью порошкового реометра FT4, соответствует ли АФС по меньшей мере пяти из следующих параметров (i)-(viii), измеренных с помощью порошкового реометра FT4:
(i) основной удельной энергии потока (sBFE) не более 60 мДж/г;
(ii) индексу стабильности (SI) от 0,75 до 1,25;
(iii) удельной энергии (SE) не более 10 мДж/г;
(iv) наибольшему главному напряжению при 15 кПа (MPS-15) не более 40;
(v) функции тока при 15 кПа (FF-15) не менее 1,3;
(vi) уплотненной объемной плотности при 15 кПа (CBD-15) не менее 0,26 г/мл;
(vii) сжимаемости не более 47%; и
(viii) углу трения у стенки (WFA) не более 40°.
Невзирая на то, что применение дозировочно-наполнительного вакуумного устройства, такого как технология барабанного наполнения, в фармацевтической индустрии было описано ранее в применении к продуктам для ингаляции, содержащим формообразующие (такие как смеси с лактозой или модифицированные частицы, например, PulmoSpheresTM), его применение в случае лекарственных форм, изготавливаемых с использованием неразбавленной АФС, включая пероральные лекарственные формы, рассматривается как единственное в своем роде. В промышленности наиболее распространено дозирование составных смесей или гранулированного материала в капсулу с использованием принципов наполнения дозатором или набивочным штифтом.
В дополнительных вариантах осуществления описан вакуумный барабанный дозатор, содержащий желоб для порошка, снабженный приспособлением для псевдоожижения, в частности акустическим преобразователем, более конкретно, ультразвуковым преобразователем. Кроме того, АФС можно уплотнять в нижней части фармацевтического носителя с помощью вибрации, встряхивания или постукивания перед стадией (с).
В конкретном варианте осуществления фармацевтический продукт представляет собой лекарственную форму для перорального применения. Примером лекарственной формы для перорального применения является литой под давлением носитель в форме таблетки, описанный в приведенном ниже варианте осуществления и в других разделах описания.
В одном варианте осуществления фармацевтический носитель на стадии (с) представляет собой носитель в форме таблетки (также упоминаемый здесь как PrescidoTM) в качестве новой фармацевтической лекарственной формы. Этот носитель предназначен иметь функциональность стандартной фармацевтической капсулы при сохранении привлекательной для пациента формы таблетки. Носители, описанные здесь, изготавливаются с помощью процесса точного литья под давлением с использованием композиции, разработанной для работы в термических процессах. Высокие показатели композиции в процессе литья под давлением обеспечивают гибкость при конструировании носителей, что позволяет надежно изготавливать конструктивные элементы с очень малыми размерами - это обычно сложная задача при литье под давлением. Конструктивные и производственные признаки, а также их преимущества включают, в том числе, тонкостенные секции (быстрое время распадения носителя в водной среде), небольшие защелкивающие элементы (плотное закрытие предотвращает открывание носителя во время транспортировки и ограничивает возможность злонамеренного вскрытия носителя), нумерацию полостей (отслеживание и сортировка деталей перед использованием) и высокую точность веса и размеров (надежные процессы обработки).
В дополнение к удобным для термической обработки свойствам, разработанная композиция придает носителям ряд преимуществ по сравнению с традиционными капсулами, такие как, например, низкое содержание воды (улучшенная совместимость с активными веществами, чувствительными к воде), низкие поглощение и восприимчивость к влаге в условиях стандартного производства и сравнительно быстрое растворение (быстрый разрыв носителя в водных средах). Таким образом, носители PrescidoTM обладают преимуществом перед традиционными капсулами благодаря предпочтительному содержанию воды и сорбционным свойствам, что является преимуществом для обработки и стабильности чувствительных к воде соединений.
Краткое описание графических материалов
На Фигуре 1 показана упрощенная схема измерения с использованием датчика емкостного сопротивления в машине для наполнения капсул,
На Фигуре 2 показана блок-схема стадий, составляющих способ приготовления фармацевтического продукта,
На Фигуре 3 показана упрощенная схема измерения с использованием нескольких датчиков емкостного сопротивления в машине для наполнения капсул,
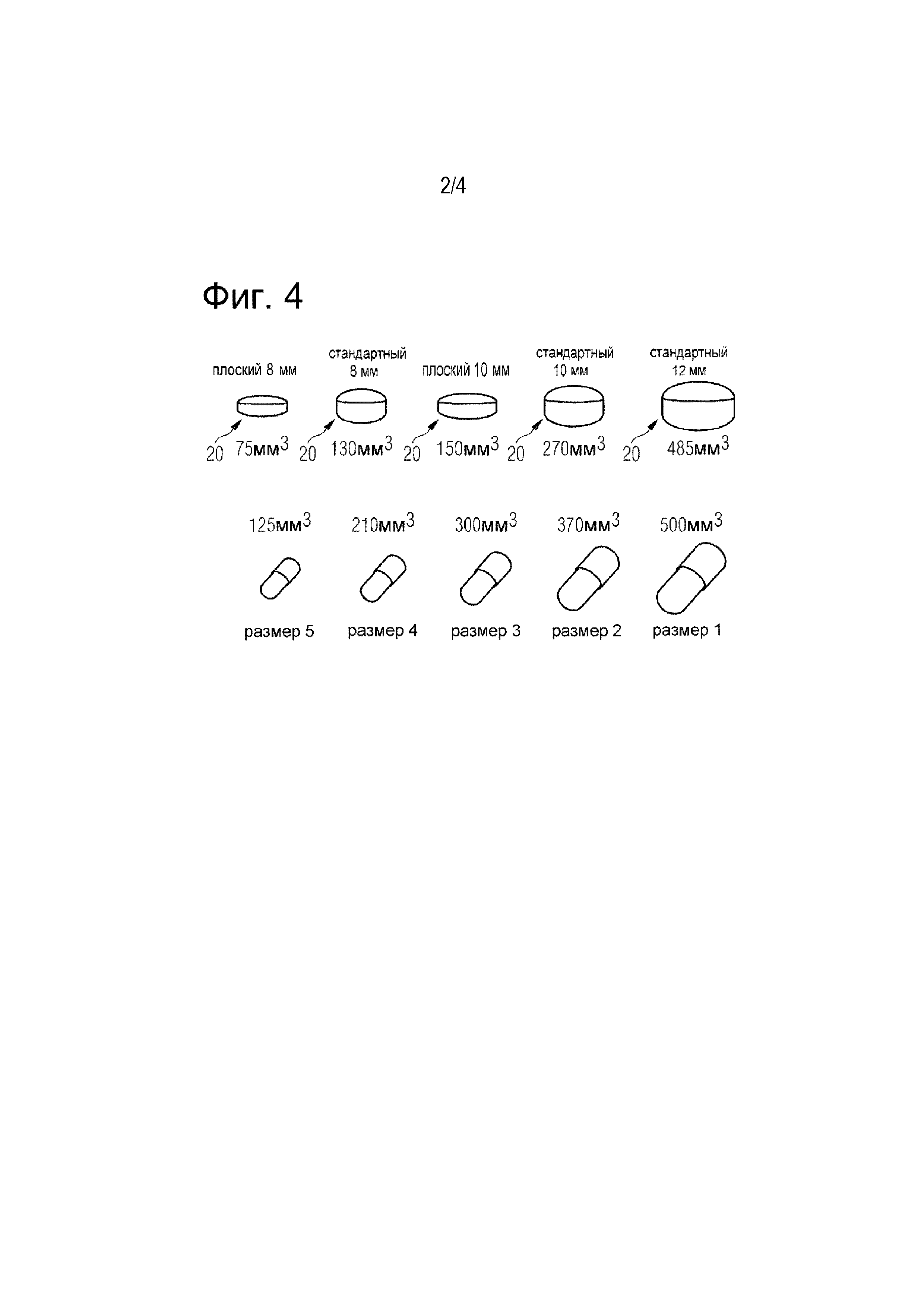
На Фигуре 4 показаны различные конструкции фармацевтического носителя,
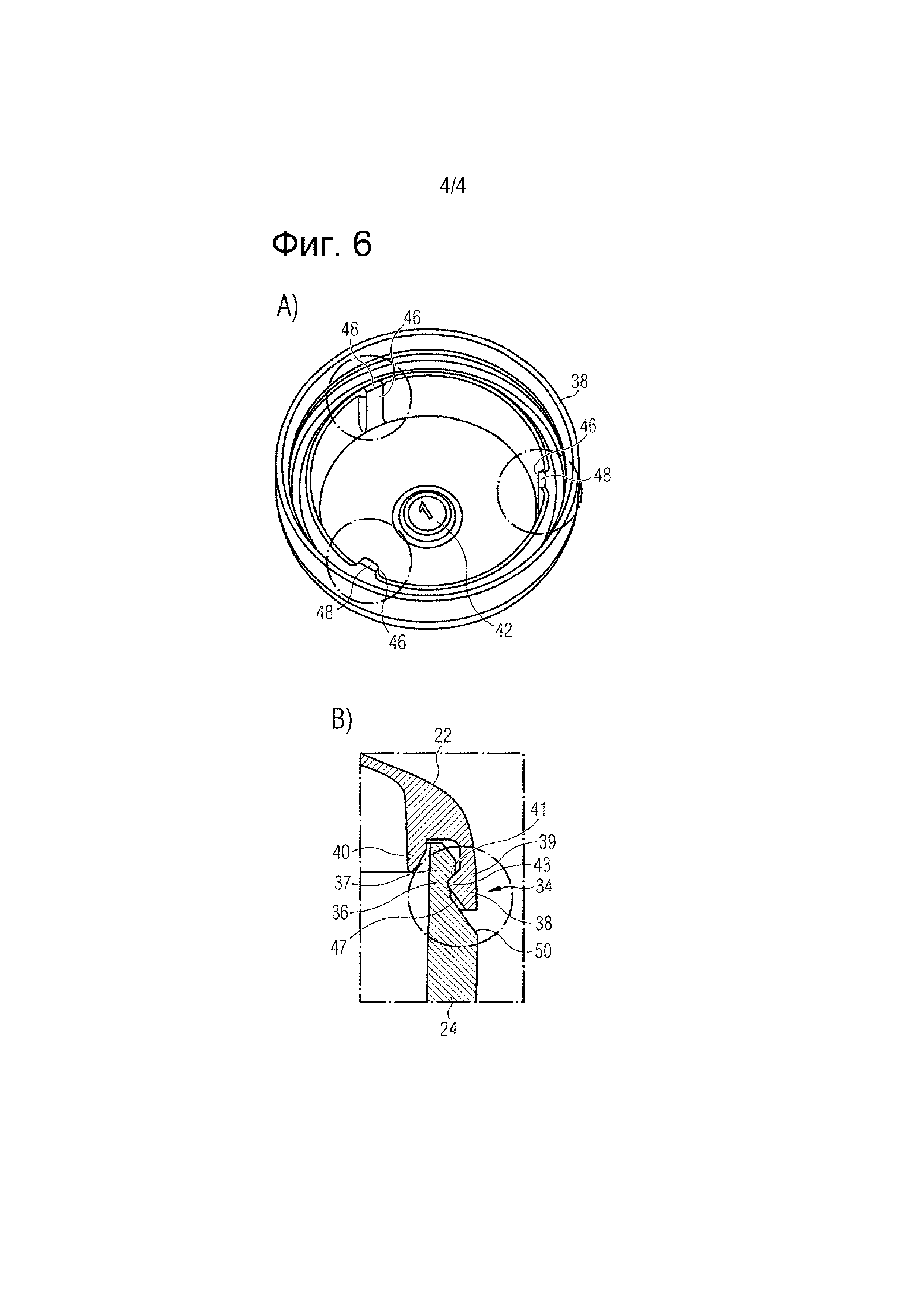
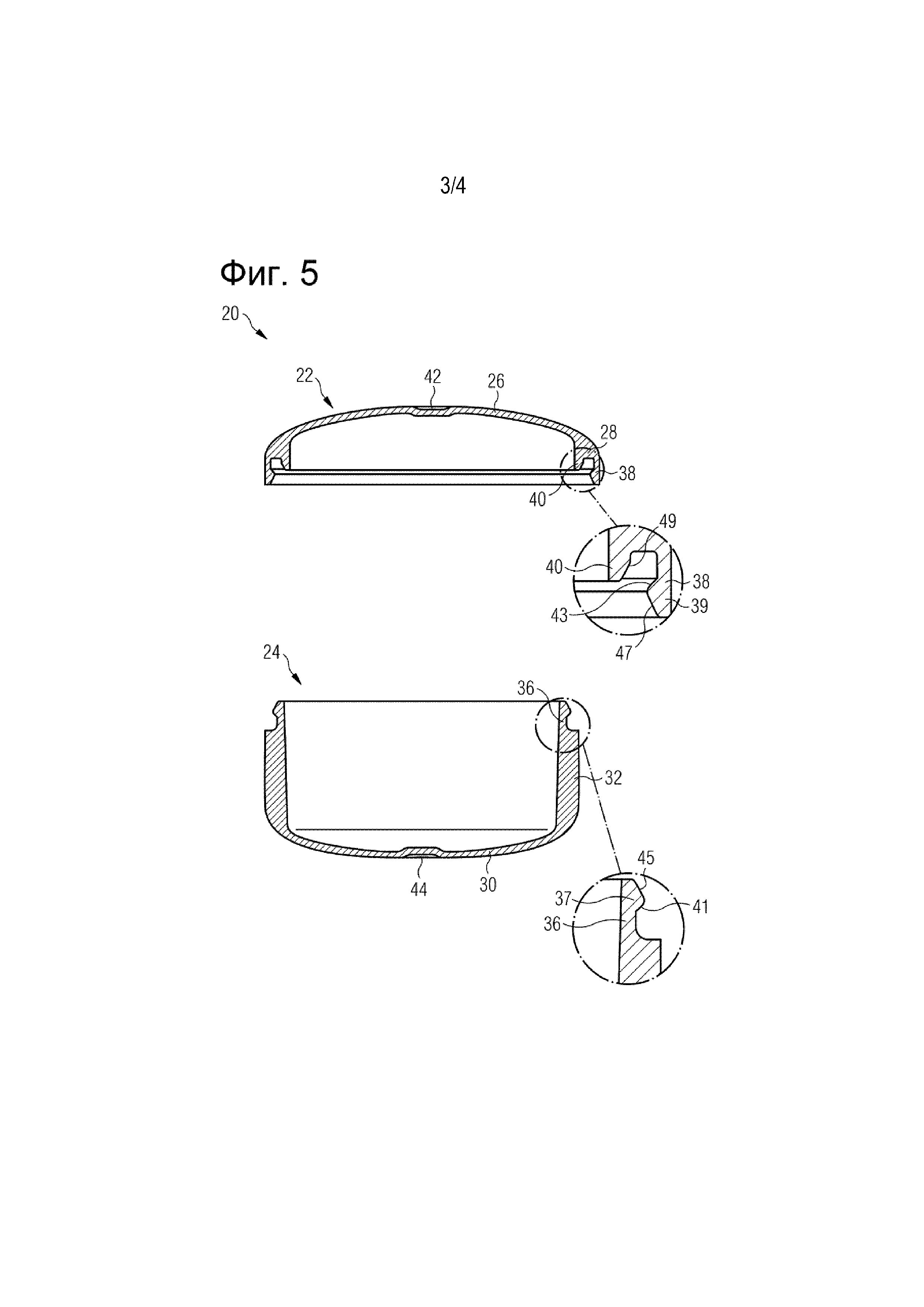
На Фигуре 5 показаны виды в разрезе закрывающей части (слева) и нижней части (справа) примера варианта осуществления фармацевтического носителя в соответствии с Фигурой 4, включая укрупненные виды запирающего механизма, предусмотренного на закрывающей части и нижней части,
На Фигуре 6А показан трехмерный вид нижней части носителя, как показано справа ни Фигуре 5,
На Фигуре 6В показан еще один укрупненный вид запирающего механизма, предусмотренного на закрывающей части и нижней части фармацевтического носителя в соответствии с Фигурой 5.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Настоящее изобретение предлагает способ приготовления фармацевтического продукта, включающий стадии:
(a) предоставления активной фармацевтической субстанции (АФС), которая соответствует по меньшей мере пяти из следующих параметров (i) - (viii), определенных с помощью порошкового реометра FT4:
(i) основной удельной энергии потока (sBFE) не более 60 мДж/г;
(ii) индексу стабильности (SI) от 0,75 до 1,25;
(iii) удельной энергии (SE) не более 10 мДж/г;
(iv) наибольшему главному напряжению при 15 кПа (MPS-15) не более 40;
(v) функции тока при 15 кПа (FF-15) не менее 1,3;
(vi) уплотненной объемной плотности при 15 кПа (CBD-15) не менее 0,26 г/мл;
(vii) сжимаемости не более 47%; и
(viii) углу трения у стенки (WFA) не более 40°;
(b) дозирования АФС со стадии (a) в нижнюю часть фармацевтического носителя с помощью дозировочно-наполнительного вакуумного устройства; и
(c) капсулирования нижней части указанного фармацевтического носителя соответствующей закрывающей частью указанного фармацевтического носителя, тем самым получая фармацевтический продукт, как далее определено формулой изобретения.
Блок-схема способа, раскрываемого в данном документе, пригодная для любого объема производства, представлена на Фигуре 2.
Выбор и модифицирование неразбавленной АФС
Мы разработали «8-параметрическую модель», способную различать и прогнозировать характеристики порошков при наполнении. Этими восемью параметрами являются:
sBFE: основная удельная энергия потока (мДж/г): рассчитанная как BFE (измеренная с помощью стандартной исследовательской платформы FT4) деленная на раздробленную массу образца
SI: индекс стабильности, стандартная переменная, безразмерная
SE: удельная энергия (мДж/г), стандартная переменная
MPS при 15 кПа: наибольшее главное напряжение, стандартная переменная
FF при 15 кПа: функция тока (безразмерная), измерена в сдвиговой ячейке, стандартная переменная
CBD при 15 кПа: уплотненная объемная плотность (г/мл), стандартная переменная (измерена в сдвиговой ячейке)
CPS: сжимаемость (%), стандартная переменная
WFA: угол трения у стенки (градус°), стандартная переменная
В приведенной ниже таблице указаны интервалы значений и предпочтительные интервалы значений для каждого параметра, который является частью модели. Каждый интервал значений - предпочтительный и наиболее предпочтительный - для каждого параметра можно независимо комбинировать с каждым интервалом значений - предпочтительным и наиболее предпочтительным - для любого другого параметра.
|
В предпочтительных вариантах осуществления параметры порошка на стадии (а) соответствуют следующим требованиям, предпочтительно - по меньшей мере пяти из следующих требований:
(i) sBFE - не более 25 мДж/г, в частности, не более 6 мДж/г; и/или
(ii) SI - от 0,83 до 1,18, в частности, от 0,9 до 1,1; и/или
(iii) SE - не более 8 мДж/г, в частности, не более 6 мДж/г; и/или
(iv) MPS-15 - не более 33, в частности, не более 25; и/или
(v) FF-15 - не менее 3, в частности, не менее 10; и/или
(vi) CBD-15 - не менее 0,45 г/мл, в частности, не менее 0,6 г/мл; и/или
(vii) сжимаемость - не более 35%, в частности, не более 3-15%; и/или
(viii) WFA - не более 34°, в частности, не более 28°.
Для стандартного порошкового реометра FT4 существует как минимум 6 методов определения характеристик порошка (для каждого диаметра измерительного цилиндра). Для анализа выбраны следующие из них:
25mm_1C_Split_Rep+VFR_R01;
25mm_Shear_15kPa;
25mm_Compressibility_1-15kPa;
25mm_Wall (Friction_30kPa).
Параметры можно подразделять на четыре группы, основываясь на этих четырех выбранных методах определения характеристик.
Группа 1 - (i) sBFE; (ii) SI; (iii) SE
Группа 2 - (iv) MPS-15; (v) FF-15; (vi) CBD-15
Группа 3 - (vii) CPS
Группа 4 - (viii) WFA.
Порошковые реометры FT4 можно приобрести у Freeman Technology.
Если четыре из этих параметров выходят за пределы указанных интервалов значений, то технологичность такого порошка сомнительна. Если более четырех параметров входят за пределы указанных интервалов значений, то порошок скорее всего практически не пригоден для любого автомата, описанного здесь, в случае неразбавленной АФС. Кроме того, было обнаружено, что если MPS очень высоко, а WFA также большой, хотя и в меньшей степени, то порошок имеет тенденцию накапливаться в дозировочно-наполнительном устройстве. Для технологии звукового/ультразвукового наполнения это является отрицательной характеристикой. С другой стороны, если SI слишком высокий, порошок со временем меняет свои характеристики, что делает его более чувствительным к сдвиговому усилию. Такой порошок менее пригоден для использования в стандартной вакуумной барабанной технологии заполнения, в которой используется мешалка.
В предпочтительном варианте осуществления по меньшей мере один из параметров выбран из параметров (i)-(iii) и по меньшей мере один из параметров выбран из параметров (iv)-(vi) - т.е. по меньшей мере один из Группы 1 и по меньшей мере один из Группы 2. Предпочтительно, чтобы по меньшей мере один из параметров Группы 1 являлся параметром (i) или (iii), и по меньшей мере один из параметров Группы 2 являлся параметром (iv) или (v).
В другом варианте осуществления, который может быть объединен с предыдущим вариантом осуществления, по меньшей мере один из параметров представляет собой параметр (vii) или (viii), т.е. Группу 3 или Группу 4.
Там, где дозировочно-наполнительное вакуумное устройство оснащено ультразвуковым приспособлением для выполнения замера и дозирования АФС, предпочтительное значение sBFE может быть равно 29 или меньше, например не более 25. В данной ситуации CPS может быть вплоть до 65%.
В одном варианте осуществления значение WFA составляет не более 34 и/или значение CPS быть не более 35.
Там, где дозировочно-наполнительное вакуумное устройство оснащено мешалкой для выполнения замера и дозирования АФС, предпочтительное значение SI может быть в пределах от 0,83 до 1,18, например, от 0,9 до 1,1 а значение CPS может быть не более 35%.
Таким образом, в настоящем изобретении также предложен способ для прогнозирования того, подходит ли АФС для составления фармацевтического продукта непосредственно в виде неразбавленной АФС, с использованием описанной выше 8-параметрической модели (всех вариантов ее осуществления).
Зачастую стадия (a) способа включает влажную фазу (Фигура 2, крайняя левая часть), в которой получают неразбавленную АФС. Обычно такая влажная фаза включает стадию кристаллизации. Эту стадию кристаллизации уже можно контролировать таким образом, чтобы получать требуемый размер кристаллов неразбавленной АФС. Параметры и средства для контроля размера частиц в процессе кристаллизации хорошо известны в данной области и включают выбор соответствующих температуры, влажности, pH, перемешивания, а также выбор подходящих солей, буферов и органических растворителей. Выбор этих параметров варьируется в случае каждой АФС, и их определение является частью производственного процесса АФС. После кристаллизации АФС обычно фильтруют и сушат.
Однако в дополнительных вариантах осуществления стадия (а) способа может дополнительно включать влажное измельчение АФС, которое еще больше уменьшает размер частиц.
Размер частиц также можно контролировать путем добавления добавок в ходе влажной фазы. Подходящие добавки обычно используются в виде суспензий, растворов или в твердом виде. Характер добавки и момент времени, в который эту добавку вводят в ходе процесса, являются специфическими для АФС, для которой разрабатывается процесс. В альтернативном случае или дополнительно, добавки в АФС можно вносить во влажной фазе для улучшения производительности процесса или улучшения свойств поверхности, таких как улучшение смачиваемости.
Добавки можно вносить в один или несколько моментов времени в ходе процесса производства, например, в ходе стадии кристаллизации, в ходе стадии фильтрования и/или в ходе стадии сушки. Например, на исходные частицы АФС можно нанести покрытие из полимеров во влажной фазе в ходе кристаллизации или в суспензии после кристаллизации или после размола.
Соотношение, в котором используется добавка, всегда на столько низкое, на сколько оно не оказывает влияние на однородность содержания АФС или на точность измерения датчика массы. Такой подход отличается от традиционного составления препаратов, где АФС всегда разбавляется значительным количеством формообразуюших, особенно в случае низких доз. В соответствии с этим количество добавляемых добавок очень мало. Например, одну или несколько добавок можно вводить в ходе или после стадии кристаллизации, стадии фильтрации или стадии сушки до ее содержания (массовой доли) не более 2%, предпочтительно - не более 1,5%, более предпочтительно - не более 1%, еще более предпочтительно - не более 0,5% и наиболее предпочтительно - не более 0,1%. Одну или несколько добавок можно выбирать из группы, состоящей из гидроксипропилцеллюлозы, гидроксипропилметилцеллюлозы, поливинилпирролидона, акриловых полимеров, лаурилсульфата натрия, желатина, сложных эфиров сахаров, таких как моностеарат сахарозы и монопальмитат сахарозы, и любой их комбинации.
После влажной фазы, в сухой фазе, АФС можно необязательно дополнительно приводить в соответствие с требованиями. Например, стадия (а) способа может дополнительно включать сухое измельчение и/или просеивание АФС. Просеивание может быть выбрано из просеивания через коническое просеивающее оборудование, вибрационного просеивания или просеивания на сите с помощью ультразвуковой вибрации.
Также в сухой фазе частицы АФС можно обрабатывать и дополнительно наносить на них покрытие из мелко размолотых добавок для улучшения физических свойств АФС, чтобы увеличить производительность процесса (добавки, облегчающие обработку и улучшающие свойства поверхности; см. Фигуру 2, слева в центре). Соответственно, в некоторых вариантах осуществления стадия (а) способа дополнительно включает сухую фазу, в которой одну или несколько добавок вводят до ее/их содержания (массовой доли) не более 5%, предпочтительно - не более 4%, более предпочтительно - не более 3%, еще более предпочтительно - не более 2%, и наиболее предпочтительно - не более 1%.
Добавку обычно можно вводить после выделения АФС во влажной фазе, добавляя ее непосредственно перед процессом приведения АФС в соответствие с требованиями в сухой фазе или как часть этого процесса. Можно утилизировать уже имеющиеся технологии, используемые в условиях коммерческого производства. Например, одну или несколько добавок вносят путем (i) смешивания с низким усилием сдвига, в частности в барабанном смесителе, (ii) смешивания с высоким усилием сдвига, в частности, в роторном смесителе, или (iii) смешивания с очень высоким усилием сдвига, в частности в установке механосинтеза. Смешивание обычно проводят в течение как минимум 3 минут вплоть до трех часов.
Во время сухой фазы добавки обычно используют в виде твердых веществ. В определенных вариантах осуществления одну или несколько добавок выбирают из группы, состоящей из гидрофобного коллоидного диоксида кремния, гидрофильного коллоидного диоксида кремния, стеарата магния, стеариновой кислоты, стеарилфумарата натрия, полоксамера 188, гидрогенизированного растительного масла или любой их комбинации.
Целью внесения добавок и применения различных способов их обработки на стадии (а) изобретения настоящего способа является, в первую очередь, достижение достаточного уровня реологических характеристик порошка.
В любом случае, конечная неразбавленная АФС, получаемая на стадии (а), содержит массовую долю добавки не более 5%, предпочтительно - не более 4%, более предпочтительно - не более 3%, еще более предпочтительно - не более 2% и наиболее предпочтительно - не более 1%.
Как отмечено выше, специалист в данной области техники знает, как адаптировать параметр порошка так, чтобы он соответствовал требованиям, изложенным на стадии (а). Аналогично, добавки можно также добавлять в указанных пределах, чтобы достичь улучшения с точки зрения биофармацевтического профиля АФС. Кроме того, сканирующая электронная микроскопия (СЭМ) позволяет получать качественное представление о размере и форме частиц. Ее можно использовать только в качестве визуального наблюдения, поскольку небольшой размер выборки может не отражать характеристики партии целиком.
Наполнение неразбавленной АФС в капсулы
На стадии (b) способа АФС со стадии (а) дозируют в нижнюю часть фармацевтического носителя с помощью дозировочно-наполнительного вакуумного устройства. Такое устройство позволяет дозировать от менее чем 0,25 мг до половины грамма, обеспечивая высокую точность дозирования во всем диапазоне. Таким образом, способ настоящего изобретения позволяет дозировать всю заполняемую массу, которая может составлять всего 0,25 мг, с высокой точностью без использования какой-либо классической стадии составления препарата. Устройство для дозирования и наполнения с помощью вакуума позволяет наполнять плохо текучие и слипающиеся порошки. Во время формирования дозы к порошку прикладывается низкое механическое напряжение, что уменьшает риск прилипания к поверхностям оборудования по сравнению с другими принципами наполнения. Эти преимущества расширяют диапазон свойств обрабатываемого порошка и повышают надежность процесса капсулирования неразбавленного лекарственного вещества по сравнению с традиционными технологиями, которые обычно используют для крупномасштабного капсулирования твердых пероральных продуктов.
Осуществление стадии (b) происходит только в том случае, если выполняются требования стадии (а), и по этой причине стадии (а) и (b) взаимосвязаны. Соответственно, настоящее изобретение позволяет определить, можно ли распределять и дозировать порошок, используя дозировочно-наполнительное вакуумное устройство. В то же время настоящее изобретение представляет собой ценное руководство для специалиста, раскрывая как должна быть изменена структура определенной АФС, чтобы сделать ее пригодной для дозирования с помощью дозировочно-наполнительного вакуумного устройства.
Хотя использование дозировочно-наполнительного вакуумного устройства, такого как технология барабанного наполнения, хорошо известно в фармацевтической промышленности в применении к ингаляционным продуктам, его применение для изготовления пероральных лекарственных форм с использованием неразбавленной АФС представляется уникальным. Поэтому в предпочтительном варианте осуществления фармацевтический продукт представляет собой лекарственную форму для перорального применения. В промышленности наиболее распространено дозирование составных смесей или гранулированного материала в капсулу с использованием принципов наполнения дозатором или набивочным штифтом.
Использование дозировочно-наполнительного вакуумного устройства является особым преимуществом, поскольку оно позволяет применять способ настоящего изобретения в непрерывном процессе. Как следствие, способ настоящего изобретения можно применять в высокопроизводительном процессе производства фармацевтического продукта, что позволяет производить 70000 единиц/час или даже больше. В результате настоящий способ позволяет получать фармацевтический продукт с использованием неразбавленной АФС, то есть АФС, содержащей массовую долю добавки не более 5% на всех стадиях разработки фармацевтического препарата, включая его окончательное коммерческое производство. Способы известного уровня техники, которые не включают стадии (а) и (b) настоящего способа, обеспечивают только лишь низкую производительность. Для достижения высокопроизводительного производства было необходимо составить другую фармацевтическую композицию АФС на различных стадиях разработки.
В предпочтительном варианте осуществления дозировочно-наполнительное вакуумное устройство представляет собой вращающийся барабан. Например, в полости барабана создается вакуум от -100 до -800 мбар, например, от -200 до -800 мбар, предпочтительно - от -300 до -800 мбар, более предпочтительно - от -400 до -800 мбар, например, от -500 до -800 мбар или даже от -600 до -800 мбар. В определенных вариантах осуществления вакуум также может быть выше чем -800 мбар. Независимо от применяемого вакуума АФС можно дозировать при давлении эжекции от 100 до 1500 мбар, предпочтительно - от 200 до 1500 мбар, более предпочтительно - от 300 до 1500 мбар, например, от 400 до 1500 мбар, в частности, от 500 до 1500 мбар, более предпочтительно - от 600 до 1500 мбар, например, от 700 до 1500 мбар, еще более предпочтительно - от 800 до 1500 мбар, в частности, от 900 до 1500 мбар, или даже от 1000 до 1500 мбар. В определенных вариантах осуществления может быть даже предпочтительно дозировать АФС при давлении эжекции более 1500 мбар.
В случае, когда дозировочно-наполнительное вакуумное устройство представляет собой вращающийся барабан, этот вращающийся барабан может быть снабжен некоторыми специфическими дополнительными приспособлениями, которые позволяют наполнять порошок с более широким диапазоном характеристик. Они включают псевдоожижение порошка в желобе вблизи полостей барабана с использованием ультразвукового преобразователя (звукового преобразователя), который псевдоожижает порошок вблизи зонда и позволяет АФС более свободно течь в полостях барабана, чтобы компенсировать плохие характеристики текучести некоторых порошков. Например, дозировочно-наполнительное вакуумное устройство может быть оснащено мешалкой, причем мешалка устанавливается на 1-4 оборота за цикл, например, от примерно 2 до примерно 4 оборотов за цикл, или от примерно 1 до примерно 3 оборотов за цикл, или от примерно 2 до примерно 3 оборотов за цикл. В альтернативном варианте дозировочно-наполнительное вакуумное устройство может быть оснащено звуковым/ультразвуковым устройством, в частности, штырем или рейкой, которые проталкивают порошок в полости вращающегося барабана и разрушают образующиеся в порошке микроперемычки. Например, штырь или рейка работают при частоте от 10000 до 180000 Гц, предпочтительно - от 11000 до 170000 Гц, более предпочтительно - от 12000 до 160000 Гц, более предпочтительно - от 13000 до 150000 Гц, более предпочтительно - от 14000 до 140000 Гц, более предпочтительно - от 15000 до 130000 Гц, более предпочтительно - от 16000 до 120000 Гц, более предпочтительно - от 17000 до 110000 Гц, более предпочтительно - от 18000 до 100000 Гц, более предпочтительно - от 19000 до 90000 Гц, более предпочтительно - от 20000 до 80000 Гц, более предпочтительно - от 21000 до 70000 Гц, более предпочтительно - от 21500 до 60000 Гц, более предпочтительно - от 22000 до 50000 Гц, более предпочтительно - от 22000 до 40000 Гц, более предпочтительно - от 22000 до 30000 Гц и наиболее предпочтительно при частоте около 22000 Гц.
Специалист может выбирать между мешалкой или звуковым/ультразвуковым приспособлением в зависимости от реологии порошка АФС. В частности, если MPS-15 равно 28 или менее и/или WFA равен 31° или менее, АФС подходит для использования в сочетании с дозировочно-наполнительным вакуумным устройством, оборудованным звуковым/ультразвуковым приспособлением для выполнения замера и дозирования АФС. С другой стороны, если значение SI более 1,1, АФС не подходит для использования в сочетании с дозировочно-наполнительным вакуумным устройством, оборудованным мешалкой для выполнения замера и дозирования АФС. См. также примеры, приведенные ниже.
Другие варианты осуществления включают использование акустического приспособления и камеры, которые выравнивают АФС в желобе и обеспечивают равномерный слой порошка. Аналогичная акустическая система также используется для кондиционирования порошка в загрузочном бункере и обеспечения потока от бункера к желобу. Соответственно, в дополнительных вариантах осуществления дозировочно-наполнительное вакуумное устройство может содержать желоб для порошка, оборудованный приспособлением для псевдоожижения. Примером такого устройства является акустический динамик, который может работать в сочетании с ультразвуковым преобразователем или без него. В конкретных вариантах осуществления предусматривается, что подача происходит из вибрационного бункера в желоб для порошка, причем бункер, предпочтительно, активируется датчиком. В предпочтительных вариантах осуществления датчик представляет собой емкостный датчик. В определенных вариантах осуществления подача происходит из бункера в желоб для порошка, каждый из которых оборудован звуковым приспособлением, работающим при частоте от 100 до 1000 Гц, причем бункер предпочтительно активируется датчиком, в частности емкостным датчиком, в желоб для порошка. Можно также использовать частоты от 200 до 900 Гц, от 300 до 800 Гц, от 400 до 700 Гц или от 500 до 600 Гц.
Дозировку АФС на стадии (b) можно подходящим образом выбирать в пределах от 0,1 до 550 мг, предпочтительно - от 0,2 до 500 мг, и наиболее предпочтительно - от 0,25 до 450 мг. Предпочтительно, чтобы дозирование АФС на стадии (b) имело относительное стандартное отклонение (RSD) менее 5%, предпочтительно - менее 4%, более предпочтительно - менее 3%. Обычно дозирование АФС на стадии (b) контролируют по весу с использованием технологии измерения наполняемой массы. Например, дозирование АФС можно контролировать по весу в автономном режиме с использованием взвешивания брутто-тара. Однако в предпочтительном варианте осуществления дозирование АФС контролируют по весу в реальном времени с использованием емкостного и/или микроволнового датчика, в частности, с использованием емкостного датчика, который позволяет достичь 100%-ного контроля наполняемого веса. Этот вид проверки массы наполнения «в потоке» доступен как для оборудования с низкой производительностью, так и для оборудования с высокой производительностью. Датчик работает по принципу микроволнового и/или емкостного бесконтактного измерения порошка, падающего сквозь пространство между двумя пластинами конденсатора. Во время измерения изменение электрического поля регистрируется и соотносится с наполняемым весом порошка.
В настоящее время емкостные датчики встроены в машины для наполнения капсул и обычно используются для дозирования нескольких миллиграммов порошка. Известно, что теоретически можно установить работу датчика в диапазоне менее миллиграмма, для этого расстояние между пластинами конденсатора датчика необходимо уменьшить, что приведет к усилению электрического поля. Однако это в конечном итоге приводит к уменьшению диаметра каналов сенсора, сквозь которые падает спрессованный в шайбу порошок и производятся измерения. Для неоптимизированных порошков это часто приводит к столкновению спрессованного в шайбы порошка со стенками канала или даже к падению на верхний край датчика или вне корпуса капсулы. Кроме того, дозирование обычных порошков часто приводит к возникновению беспорядочно падающих спрессованных шайб, в результате чего во время динамического измерения таких падающих объектов показания датчика неадекватны. Для использования таких емкостных датчиков в субмиллиграммовом диапазоне состав должен производить стабильную порошковую шайбу или единичную массу, переносимую воздухом, способную проходить через тонкий диаметр канала датчика, не разбиваясь на части или не падая беспорядочно, что требовалось и было достигнуто с помощью способа настоящего изобретения.
На Фигуре 1 показана упрощенная схема измерения с использованием такого датчика в машине для наполнения капсул. Машина для наполнения капсул содержит вакуумный барабан 10, который вращается вокруг оси R и который снабжен полостью 12. По меньшей мере, дно полости 12 выполнено из проницаемого под давлением материала, такого как, например, фильтрующий материал, который позволяет создать желаемое давление внутри полости 12. Чтобы заполнить полость 12 порошком, вакуумный барабан 10 вращают так, чтобы поместить полость 12 под хранилищем порошка (не показано). Кроме того, внутри полости 12 устанавливается давление ниже атмосферного. В результате порошок из хранилища порошка подается в полость 12, в которой дозирование порошка можно контролировать с высокой точностью. После этого вакуумный барабан 10 поворачивается в положение, показанное на фигуре 1, и внутри полости 12 устанавливается давление выше атмосферного давления. В результате, порошковая шайба 14, сформированная в полости 12, выталкивается из полости 12. Порошковая шайба 14, сформированная в полости 12, падает через емкостный датчик 16 в корпус капсулы 18, что позволяет измерять «в потоке» наполняемую массу порошка.
Измерение в динамическом режиме происходит практически мгновенно; оно нечувствительно к вибрациям работающей машины и, в частности, напрямую определяет наполняемый вес нетто в реальном времени. Кроме того, принципы такого измерения не зависят от колебаний веса оболочек капсул. Эти датчики обычно используются для мониторинга, предпочтительно для 100% сортировки обычных носителей, таких как капсулы, или специализированных носителей, которые имеют вид таблетки, наиболее предпочтительно для контроля готовой продукции в режиме реального времени. Эти датчики обычно используются для определения наполняемого веса носителя. Были разработаны процедуры для аналитической проверки этих датчиков. Эти процедуры проверки были адаптированы из методов спектроскопии ближнего инфракрасного диапазона, используемых для планшетов, где обычной практикой является параллельное индивидуальное тестирование NIR по сравнению с ВЭЖХ с использованием среднеквадратичных ошибок прогнозов. Как следствие, при использовании контроля веса в режиме реального времени с использованием емкостного и/или микроволнового датчика, датчик имеет среднеквадратичную ошибку прогнозирования (RSMP) менее 5%, предпочтительно - менее 4,5%, более предпочтительно - менее 4%, и наиболее предпочтительно - менее 3,5% по отношению к аналитическому контрольному инструменту, такому как ВЭЖХ или весы.
Неразбавленную или модифицированную АФС затем инкапсулируют в традиционные фармацевтические носители, имеющие по меньшей мере две части, такие как закрывающая и нижняя часть. В вариантах осуществления АФС уплотняют в нижней части фармацевтического носителя с помощью вибрации, встряхивания или постукивания перед стадией (с).
Компоненты носителя - корпуса и крышки - отдельно загружаются в машину, которая способна принимать, ориентировать и перемещать детали по двум независимым каналам до станции наполнения порошком. После наполнения нижняя и верхняя части сцепляются и сжимаются вместе, чтобы сформировать конечный единый носитель.
Расширение технологий может быть легко достигнуто путем разделения потоков дозирующих линий, что обеспечивает репрезентативные и переносимые результаты на всех этапах испытаний наполнения в процессе разработки. Система датчиков, используемая с оборудованием, всегда одинакова. Эта общая комбинация приводит к очень гибкой системе наполнения, которая позволяет быстро реагировать на различные клинические и рыночные потребности, работая с широким спектром лекарственных продуктов на основе различных АФС, занимая небольшую площадь на производственных участках и потенциально снижая затраты на разработку и подготовку лекарств. Соответственно, настоящее изобретение предусматривает использование описанного выше способа в непрерывном процессе и/или в высокопроизводительном процессе производства фармацевтического продукта. В этом контексте высокая производительность означает, по меньшей мере, 25000 единиц/час, предпочтительно - более 30000 единиц/час, более предпочтительно - более 40000 единиц/час, более предпочтительно - более 50000 единиц/час, более предпочтительно - более 60000 единиц/час, и наиболее предпочтительно - по меньшей мере 70000 единиц/час.
На Фигуре 3 показана упрощенная схема измерения с использованием нескольких датчиков 16 в машине для наполнения капсул (например, три дорожки). Порошковые шайбы 14, которые получают в барабане 10 с несколькими полостями 12, как подробно описано со ссылкой на Фигуру 1 выше, падают через датчики 16 в капсулы 18, позволяя производить измерения массы порошка «в потоке» для множества станций дозирования, дающие индивидуальные значения наполняемого веса.
Фармацевтические носители
Фармацевтические носители включают пероральные лекарственные формы, а также однодозовые лекарственные формы для порошковых ингаляторов. Фармацевтические носители включают обычные капсулы, такие как капсулы, состоящие из двух частей, изготовленные из таких материалов, как желатин или гипромеллоза. В качестве альтернативы наполнению неразбавленной или модифицированной АФС в обычные капсулы, АФС также можно наполнять в отлитые под давлением контейнеры, такие как контейнеры PrescidoTM, описанные в данном документе. Контейнеры PrescidoTM представляют собой капсулы, которые наполняют так же, как и капсулу, но имеют вид таблетки с пленочным покрытием. Это создает дополнительные разновидности для маркетинга, чтобы предоставить выбор, если желательна разновидность лекарственной формы, отличаюшаяся от обычной капсулы. На Фигуре 4 (верхний ряд) показан ряд конструкций платформы PrescidoTM.
Как видно из фигуры 4, контейнеры PrescidoTM могут иметь различную конструкцию и разные объемы наполнения. В частности, контейнеры могут иметь различные диаметры и высоты, чтобы можно было выбрать подходящий контейнер, например, в зависимости от объема порошка, который должен быть заполнен в контейнеры. Контейнеры обычно выбирают так, чтобы они имели форму таблетки, например форму диска, а не форму капсулы. При рассмотрении крышки, дна и части фармацевтического носителя форма капсулы должна быть вытянута вдоль центральной оси, проходящей от центра нижней части к центру закрывающей части. Таким образом, для традиционной капсулы отношение поперечного размера, в частности диаметра закрывающей и нижней части, к высоте закрывающей и нижней частей в сборе вдоль центральной оси будет менее 1:1, например, 0,5:1 или менее. Например, капсула типа 000 имеет диаметр 5,32 мм и высоту 14,3 мм (соотношение 0,37:1), а капсула типа 4 имеет диаметр 9,55 мм и высоту 26,1 мм (такое же соотношение 0,37:1). Напротив, носитель в форме таблетки имеет более плоскую форму и будет иметь отношение больше 1 (1:1 - это практически сфера). Таким образом, фармацевтический носитель предпочтительно выполнен таким образом, что отношение поперечного размера, в частности диаметра закрывающей и нижней части, к высоте закрывающей и нижней частей в сборе составляет > 1, предпочтительно ≥ 1,4, более предпочтительно ≥ 1,5, еще более предпочтительно ≥ 2, наиболее предпочтительно ≥ 2,4 и, в частности, ≥ 2,5.
Предпочтительно, закрывающая часть и нижняя часть указанного фармацевтического носителя имеют дополнительный закрывающий механизм. Кроме того, предпочтительно, чтобы дополнительный закрывающий механизм представлял собой сцепляющий защелкивающий механизм. Этот принцип работы является уникальным и впервые в мире реализован на фармацевтической порошковой наполняющей машине.
Поступающие в продажу капсулы изготавливаются нанесением покрытия методом погружения. Это предполагает наличие резервуара из смеси полимер/вода и погружение штифтов, покрывая их смесью. Затем штифты извлекают из смеси, и полимерную смесь на штифте сушат до образования твердой капсулы перед снятием со штифта. Альтернативным образом, носители Prescido TM изготавливаются методом литья под давлением. Литье под давлением включает плавление материалов в экструдере со шнеком, который затем используется для впрыска расплава под высоким давлением в форму, где он быстро охлаждается перед его выталкиванием. Этот процесс имеет ряд преимуществ перед нанесением покрытия погружением: этот процесс может быть чрезвычайно точным, поскольку электрические приводы точно контролируют движение машины, что в сочетании с очень строгим контролем параметров процесса, таких как температура, давление и точность пресс-формы, приводит к высокой однородности частей.
Кроме того, использование литья под давлением открывает возможности для получения деталей сложной геометрической формы. При формовании окунанием как внешняя, так и внутренняя геометрическая форма капсулы ограничены формой штифтов, в то время как форма отлитых под давлением деталей определяется формой пресс-формы, которая может иметь несколько элементов на каждой поверхности носителя.
Состав традиционных капсул ограничен теми полимерами, которые при диспергировании в воде обладают правильными реологическими и пленкообразующими свойствами. Однако литье под давлением представляет собой процесс, оперирующий с горячим расплавом, для которого нужны совершенно другие свойства материала. Это дает возможность отойти от традиционных капсульных материалов, таких как желатин (животного происхождения, механические свойства которого зависят от условий окружающей среды) и ГПМЦ (длительное время растворения), и в то же время является сложной задачей, поскольку процесс литья под давлением очень требователен к свойствам материала. Материалы должны быть термически стабильными во время процесса, иметь хорошие свойства текучести расплава - особенно в условиях высокого сдвига, быть достаточно гибкими при охлаждении, чтобы выталкиваться из машины, а для данного применения - быть механически прочными, чтобы обеспечить возможность фармацевтической обработки, и быстро растворяться в воде. Кроме того, материал должен быть пригоден для потребления человеком и одобрен для фармацевтического применения.
Авторы настоящего изобретения обнаружили, что состав, подходящий для литья под давлением, может быть основан на полиэтиленоксиде (ПЭО). Соотношения ПЭО с различной молекулярной массой были испытаны для получения состава с правильными физико-химическими свойствами.
В этом контексте настоящее изобретение дополнительно предлагает композицию для литья под давлением фармацевтического носителя, где композиция содержит массовую долю 43,5-97% одного или нескольких полиэтиленоксидных полимеров, имеющих среднемассовую молекулярную массу MW 94000- 188000; 3-7% средства против клейкости; и, необязательно, одно или несколько формообразующих.
Подходящие составы для литья под давлением фармацевтического носителя имеют среднемассовую молекулярную массу M W 94000-188000. В предпочтительных вариантах осуществления указанный полиэтиленоксидный полимер имеет среднемассовую молекулярную массу MW 95000-185500, более предпочтительно MW 97500-183000, более предпочтительно МW 100000-175000, более предпочтительно MW 102000-165000, более предпочтительно MW 105000-150000, еще более предпочтительно - 107500-130000, и наиболее предпочтительно MW 110000-115000.
Полиэтиленоксидный полимер может содержать и предпочтительно состоит из одного или нескольких полиэтиленоксидов, имеющих среднемассовую молекулярную массу примерно MW 100000, полиэтиленоксида, имеющего среднемассовую молекулярную массу примерно MW 200000, полиэтиленоксида, имеющего среднемассовую молекулярную массу примерно MW 300000, полиэтиленоксида, имеющего среднемассовую молекулярную массу примерно MW 600000 и полиэтиленоксида, имеющего среднемассовую молекулярную массу MW 8000. Такие полиэтиленоксиды имеются в продаже.
В конкретном предпочтительном варианте осуществления указанный полиэтиленоксидный полимер содержит массовую долю 35-80% первого полиэтиленоксида, имеющего среднемассовую молекулярную массу MW 100000; и массовую долю 4-28,5% второго полиэтиленоксида, имеющего среднемассовую молекулярную массу MW 200000. В других предпочтительных вариантах осуществления состав может содержать массовую долю 41-77,5%, предпочтительно - 42-76%, более предпочтительно - 43-75%, более предпочтительно - 45-74%, более предпочтительно - 50-74%, и наиболее предпочтительно - примерно 73,5% указанного первого полиэтиленоксида. В определенных предпочтительных вариантах осуществления состав содержит массовую долю 4-27,5%, предпочтительно - 5-25%, более предпочтительно - 6-22%, более предпочтительно - 10-21%, более предпочтительно - 11-20,5%, и наиболее предпочтительно - около 20% указанного второго полиэтиленоксида.
В других вариантах осуществления композиция для литья под давлением фармацевтического носителя содержит массовую долю 3,5-6,5%, предпочтительно - 4-6%, еще более предпочтительно - 4,5-5,5%, и наиболее предпочтительно - около 5% средства против клейкости. Особенно предпочтительным средством против клейкости является тальк.
В одном варианте осуществления композиция содержит массовую долю 0-6% одного или нескольких красителей и/или замутнителей, предпочтительно - 0,01-5% одного или нескольких красителей и/или замутнителей, более предпочтительно - 0,25- 4% одного или нескольких красителей и/или замутнителей, более предпочтительно - 0,5-3% одного или нескольких красителей и/или замутнителей, более предпочтительно - 0,75-2,5% одного или нескольких красителей и/или замутнителей, более предпочтительно - 1-2% одного или нескольких красителей и/или замутнителей, более предпочтительно - 1-1,5% одного или нескольких красителей и/или замутнителей, и наиболее предпочтительно - примерно 1% одного или нескольких красителей и/или замутнителей.
Кроме того, предпочтительно, чтобы состав содержал массовую долю 0,01-1% антиоксиданта, предпочтительно - 0,05-0,8% антиоксиданта, более предпочтительно - 0,1-0,75 антиоксиданта, более предпочтительно - 0,2-0,7 антиоксиданта, более предпочтительно - 0,3-0,6 антиоксиданта, более предпочтительно - 0,4-0,5 антиоксиданта, и наиболее предпочтительно - примерно 0,5% антиоксиданта.
В определенных вариантах осуществления состав содержит массовую долю 30-38% наполнителя, предпочтительно - 32-38%, более предпочтительно - 34-36%; в частности, когда наполнитель представляет собой тальк.
По меньшей мере одна из частей - закрывающей части и нижней части - имеет первый участок стенки толщиной 180-250 мкм, предпочтительно - 185-225 мкм, и еще более предпочтительно - 190-220 мкм, и второй участок стенки толщиной 350 -450 мкм, предпочтительно - 375-425 мкм, более предпочтительно - 390-410 мкм, и наиболее предпочтительно примерно 400 мкм.
Оптимальная толщина первого участка стенки составляет 190-220 мкм. Эта толщина достаточна для того, чтобы во время изготовления фармацевтического носителя литьем под давлением материал мог течь через тонкий первый участок стенки и все же надежно заполнять область с более толстыми стенками второго участка стенки, но при этом оставаясь достаточно тонкой для быстрого распадения носителя, необходимого для достижения профилей растворения при немедленном высвобождении наполненных соединений. Оптимальная толщина второго участка стенки составляет 400 мкм. Здесь соблюдается баланс между большим внутренним объемом для наполнения, и механической прочностью, необходимой для наполнения и работы с носителями (включая сопротивление открыванию после наполнения).
Первый участок стенки закрывающей части может определять, по меньшей мере, часть верха закрывающей части. Предпочтительно, чтобы первый участок стенки закрывающей части определял весь верх закрывающей части так, чтобы при распадении тонкого первого участка стенки происходило быстрое и надежное высвобождение соединений, наполненных в фармацевтический носитель, через распадающийся верх закрывающей части.
Второй участок стенки закрывающей части может определять, по меньшей мере, боковую стенку закрывающей части. Например, второй участок стенки закрывающей части может определять плечо или угол закрывающей части, который расположен рядом с верхом закрывающей части. В частности, второй участок стенки закрывающей части может проходить от первого участка стенки, то есть, в частности, от верха закрывающей части, вдоль ее внешней окружности, в направлении нижней части. Эта конструкция обеспечивает механическую устойчивость закрывающей части, которая требуется для того, чтобы работать с закрывающей частью и соединять ее с нижней частью, чтобы сформировать фармацевтический носитель, как это требуется.
В предпочтительном варианте осуществления фармацевтического носителя первый участок стенки нижней части определяет, по меньшей мере, часть дна нижней части. Предпочтительно, чтобы первый участок стенки нижней части определял все дно нижней части так, чтобы при распадении тонкого первого участка стенки происходило быстрое и надежное высвобождение соединений, наполненных в фармацевтический носитель, через распадающееся дно нижней части.
Второй участок стенки нижней части может определять, по меньшей мере, боковую стенку нижней части. В частности, второй участок стенки нижней части может проходить от первого участка стенки, то есть, в частности, от дна нижней части, вдоль ее внешней окружности, в направлении закрывающей части. Предпочтительно, чтобы высота второго участка стенки нижней части была больше, чем высота второго участка стенки закрывающей части. Другими словами, в предпочтительном варианте осуществления фармацевтического носителя нижняя часть имеет обычно полую цилиндрическую форму и, следовательно, определяет «сосуд», который может быть заполнен фармацевтическим соединением. Наоборот, закрывающая часть, которая может быть снабжена вторым участком стенки, который только определяет плечо или угол, окружающие верх закрывающей части, может иметь в целом «плоскую» форму. Большая толщина стенки второго участка стенки по сравнению с первым участком стенки сообщает механическую прочность и стабильность нижней части, что обеспечивает беспрепятственное заполнение нижней части фармацевтическим соединением.
В предпочтительных вариантах осуществления закрывающая часть и нижняя часть соединены друг с другом с помощью дополнительного закрывающего механизма. Дополнительный закрывающий механизм обеспечивает надежное и простое соединение между закрывающей частью и нижней частью.
Более конкретно, закрывающий механизм может содержать первую защелкивающуюся часть, которая выступает из второго участка стенки нижней части так, что она обращена и взаимодействует со второй защелкивающейся частью, которая выступает из второго участка стенки закрывающей части. При закрывании фармацевтического носителя, то есть при соединении закрывающей части с нижней частью, по меньшей мере одна из первой и второй защелкивающихся частей может быть упруго деформирована. Когда закрывающая часть и нижняя часть достигают своих конечных относительных положений, то есть когда закрывающая часть расположена сверху нижней части, чтобы укупоривать внутреннюю часть нижней части должным образом, упругая деформация по меньшей мере одной из первой и второй защелкивающихся частей может исчезать таким образом, чтобы защелкивающиеся части не повреждали друг друга, при этом закрывающая часть и нижняя часть надежно соединяются.
Например, первая защелкивающаяся часть может содержать выступ, который приспособлен для зацепления с соответствующим выступом, предусмотренным на второй защелкивающейся части, чтобы противодействовать разъединению первой защелкивающейся части и второй защелкивающейся части и, таким образом, разъединению закрывающей части и нижней части. В частности, выступ первой защелкивающейся части может содержать первую примыкающую поверхность, которая обращена к нижней части и которая приспособлена для прилегания ко второй примыкающей поверхности, которая сформирована на второй защелкивающейся части и которая обращена к закрывающей части, когда нижняя часть и закрывающая часть соединены друг с другом. Первая примыкающая поверхность, сформированная на первой защелкивающейся части, может проходить под углом от 90 до 150° к боковой стенке нижней части. Вторая примыкающая поверхность, сформированная на второй защелкивающейся части, может проходить под углом от 90 до 150° к боковой стенке закрывающей части.
Выступ, предусмотренный на первой защелкивающейся части, может сужаться в направлении свободного конца первой защелкивающейся части, чтобы образовать первую наклонную поверхность зацепления. Первая наклонная поверхность зацепления может быть приспособлена для взаимодействия со второй наклонной поверхностью зацепления, образованной на выступе, предусмотренном на второй защелкивающейся части, который сужается в направлении свободного конца второй защелкивающейся части. После соединения закрывающей части с нижней частью фармацевтического носителя вторая наклонная поверхность зацепления может скользить вдоль первой наклонной поверхности зацепления, направляя таким образом выступ, предусмотренный на первой защелкивающейся части, в зацепление с соответствующим выступом, предусмотренным на второй защелкивающейся части. В результате упрощается соединение закрывающей части с нижней частью.
Одна из первой и второй защелкивающихся частей может выступать из второго участка стенки закрывающей части или нижней части в области внутренней окружности второго участка стенки, при этом другая из первой и второй защелкивающихся частей может выступать из второго участка стенки закрывающей части или нижней части в области внешней окружности второго участка стенки нижней части. Предпочтительно первая защелкивающаяся часть, предусмотренная на нижней части фармацевтического носителя, проходит от второго участка стенки нижней части в области внутренней окружности второго участка стенки. Сконструированная таким образом первая защелкивающаяся часть особенно подходит для взаимодействия со второй защелкивающейся частью, которая выступает из сформованного в виде плеча или угла второго участка стенки закрывающей части в области внешней окружности второго участка стенки закрывающей части.
Запирающий механизм может дополнительно содержать внутреннее ребро, которое выступает из второго участка стенки закрывающей части или нижней части в области внутренней окружности второго участка стенки на расстоянии от первой или второй защелкивающейся части, которая выступает из второго участка стенки закрывающей части или нижней части в области внешней окружности второго участка стенки. В частности, запирающий механизм может содержать внутреннее ребро, которое выступает из второго участка стенки закрывающей части в области ее внутренней окружности и, следовательно, на расстоянии от второй защелкивающейся части, которая выступает из сформованного в виде плеча или угла второго участка стенки закрывающей части в области ее внешней окружности. В результате внутреннее ребро и вторая защелкивающаяся часть образуют зазор между ними, который приспособлен для размещения первой защелкивающейся части, когда закрывающая часть и нижняя часть фармацевтического носителя соединены друг с другом. В соединенном состоянии закрывающей части и нижней части первая защелкивающаяся часть удерживается в зазоре между внутренним ребром и второй защелкивающейся частью благодаря взаимодействию со второй защелкивающейся частью, то есть, в частности, взаимодействию первой примыкающей поверхности, сформированной на первой защелкивающейся части, со второй примыкающей поверхностью, сформированной на второй защелкивающейся части, тогда как внутреннее ребро обеспечивает дополнительную механическую стабильность и жесткость запирающего механизма.
Однако также возможно снабдить нижнюю часть фармацевтического носителя внутренним ребром, в частности, в том случае, когда нижняя часть снабжена первой защелкивающейся частью, которая выступает из второго участка стенки нижней части в области его внешней окружности, и которая приспособлена для взаимодействия со второй защелкивающейся частью, которая выступает из второго участка стенки закрывающей части в области ее внутренней окружности. В этом случае внутреннее ребро и первая защелкивающаяся часть могут образовывать зазор между ними, который приспособлен для размещения второй защелкивающейся части когда закрывающая часть и нижняя часть фармацевтического носителя соединены друг с другом.
Предпочтительно, чтобы внутреннее ребро было короче защелкивающейся части, расположенной напротив внутреннего ребра. Другими словами, предпочтительно, чтобы защелкивающаяся часть, которая вместе с внутренним ребром образует зазор для размещения другой защелкивающейся части, выступала дальше от второго участка стенки закрывающей части или нижней части, чем внутреннее ребро. Кроме того, внутреннее ребро может сужаться в направлении свободного конца внутреннего ребра, чтобы образовывать третью наклонную поверхность зацепления, обращенную к первой или второй защелкивающейся части, которая выступает из второго участка стенки закрывающей части или нижней части в области внешней окружности второго участка стенки и, следовательно, расположена напротив внутреннего ребра. Предпочтительно, чтобы третья наклонная поверхность зацепления, предусмотренная на внутреннем ребре, проходила практически параллельно примыкающей поверхности, предусмотренной на выступе защелкивающейся части, расположенной напротив внутреннего ребра. В результате защелкивающаяся часть, которая приспособлена для размещения в зазоре, образованном между внутренним ребром и защелкивающейся частью, расположенной напротив внутреннего ребра, при соединении закрывающей части и нижней части фармацевтического носителя направляется в зацепление с защелкивающейся частью, расположенной напротив внутреннего ребра. Кроме того, внутреннее ребро предотвращает открывание защелки.
В предпочтительном варианте осуществления фармацевтического носителя первый участок стенки закрывающей части, в частности в области, которая определяется местом впрыска материала в форму при изготовлении закрывающей части, снабжен углублением. Это углубление может иметь толщину стенки, которая больше толщины стенки оставшейся части первого участка стенки, но меньше толщины стенки второго участка стенки закрывающей части. Например, углубление может быть расположено в центральной области верха закрывающей части. Знак, который указывает на полость, в которой закрывающая часть была отлита в многоместной пресс-форме во время процесса литья под давлением, может быть отпечатан на поверхности, в частности на внутренней поверхности углубления. Это позволяет автоматически сортировать закрывающие части по полости, в которой ее формовали, для применений, где требуется точная однородность по массе.
Альтернативно или дополнительно, первый участок стенки нижней части, в частности в области, которая определяется местом впрыска материала в форму при изготовлении нижней части, снабжен углублением. Это углубление может иметь толщину стенки, которая больше толщины стенки оставшейся части первого участка стенки, но меньше толщины стенки второго участка стенки закрывающей части. Например, углубление может быть расположено в центральной области дна нижней части. Знак, который указывает на полость, в которой нижняя часть была отлита в многоместной пресс-форме во время процесса литья под давлением, может быть отпечатан на поверхности, в частности на внутренней поверхности углубления. Это позволяет автоматически сортировать нижние части по полости, в которой ее формовали, для применений, где требуется точная однородность по массе.
По меньшей мере одна из закрывающей части и нижней части, в области ее внутренней поверхности, может быть снабжена множеством внутренних выступов, которые выступают вовнутрь в радиальном направлении от внутренней поверхности второго участка стенки и/или внутренней поверхности внутреннего ребра. В случае, когда закрывающая часть или нижняя часть, снабженная внутренними выступами, также снабжена внутренним ребром, внутренние выступы в направлении центральной оси закрывающей части или нижней части могут проходить от верха закрывающей части или дна нижней части вдоль второго участка стенки закрывающей части нижней части и, наконец, вдоль внутреннего ребра, которое выступает из второго участка стенки в области ее внутренней окружности. В случае, когда закрывающая часть нижней части, которая снабжена внутренними выступами, не содержит внутреннего ребра, внутренние выступы в направлении центральной оси закрывающей части или нижней части могут проходить от верха закрывающей части или дна нижней части вдоль второго участка стенки закрывающей части или нижней части. По меньшей мере, один из и, в частности, каждый из внутренних выступов может содержать выступающий шип, который выступает за пределы второго участка стенки и/или внутреннего ребра.
Внутренние выступы, в частности, когда они снабжены выступающими шипами, уменьшают явление, называемое «гнездование», то есть сцепление частей и/или нижних частей, сложенных одна на другую. В результате могут быть устранены трудности при ручной и автоматической работе с ними, которые могут быть вызваны «гнездами» сложенных одна на другую частей, которые трудно отделить.
В предпочтительном варианте осуществления фармацевтического носителя нижняя часть снабжена идущим под углом буртом. Идущий под углом бурт может быть сформован в области внешней поверхности второго участка стенки нижней части, в частности, рядом с первой защелкивающейся частью. Идущий под углом бурт может быть наклонен радиально вовне от внешней окружности первой защелкивающейся части к внешней поверхности второго участка стенки. Порошкообразные соединения, которые должны быть загружены в фармацевтический носитель, и которые непреднамеренно падают на бурт нижней части после наполнения или закрывания фармацевтического носителя, могут быть легко удалены.
Фармацевтический носитель 20 показан на Фигурах 5, 6А и 6В в качестве примера. Носитель 20 содержит закрывающую часть 22 и нижнюю часть 24. Закрывающая часть 22, которая показана слева на Фигуре 5 и на Фигуре 6А, содержит первый участок стенки 26, который определяет верх закрывающей части 22, и второй участок стенки 28, который определяет боковую стенку закрывающей части 22. В частности, второй участок стенки 28 закрывающей части 22 определяет плечо или угол закрывающей части 22, который расположен рядом с верхом закрывающей части 22. В частности, второй участок стенки 28 закрывающей части 22 проходит от верха закрывающей части 22, вдоль ее внешней окружности, в направлении нижней части 24. Первый участок стенки 26 имеет толщину стенки, которая меньше толщины стенки второго участка стенки 28. В предпочтительном варианте осуществления носителя 20, показанного на Фигуре 5, первый участок стенки 26 имеет толщину стенки от 190 до 220 мкм, тогда как второй участок стенки 28 имеет толщину стенки примерно 400 мкм.
Аналогично, нижняя часть 24, которая показана справа на Фигуре 5, содержит первый участок стенки 30, который определяет дно нижней части 24, и второй участок стенки 32, который определяет боковую стенку нижней части 24. Второй участок стенки 32 нижней части 24 проходит от дна нижней части 24 вдоль ее внешней окружности в направлении закрывающей части 22. Первый участок стенки 30 имеет толщину стенки, которая меньше толщины стенки второго участка стенки 32. В предпочтительном варианте осуществления носителя 20, показанного на Фигуре 5, первый участок стенки 30 имеет толщину стенки от 190 до 220 мкм, тогда как второй участок стенки 32 имеет толщину стенки примерно 400 мкм.
Закрывающая часть 22 и нижняя часть 24 соединены друг с другом посредством дополнительного запирающего механизма 34, который более подробно показан на укрупненных видах, показанных на Фигуре 5, а также на Фигуре 6В. Запирающий механизм 34 содержит первую защелкивающуюся часть 36 в форме крючка, которая выступает из второго участка стенки 32 нижней части 24 в области внутренней окружности второго участка стенки 32. Первая защелкивающаяся часть 36 в форме крючка обращена ко и взаимодействует со второй защелкивающейся частью 38 в форме крючка соответствующей формы, которая выступает из второго участка стенки 28 закрывающей части 22 в области внешней окружности второго участка стенки 28. Однако также можно обеспечить запирающий механизм 34 первой защелкивающейся частью 36, которая выступает из второго участка стенки 32 нижней части 24 в области внешней окружности второго участка стенки 32 и второй защелкивающейся частью 36, которая выступает из второго участка стенки 28 закрывающей части 22 в области внутренней окружности второго участка стенки 28.
Как видно из укрупненных видов, показанных на Фигуре 5 и Фигуре 6В, первая защелкивающаяся часть 36 содержит выступ 37, который после соединения закрывающей части 22 и нижней части 24 приспособлен для сцепления с соответствующим выступом 39, предусмотренным на второй защелкивающейся части 38. Выступ 37 первой защелкивающейся части 36 содержит первую примыкающую поверхность 41, которая обращена к нижней части 24. Аналогично, выступ 39 закрывающей части 22 содержит вторую примыкающую поверхность 43, которая обращена к закрывающей части 22. Первая примыкающая поверхность 41, сформированная на выступе 37 первой защелкивающейся части 36, проходит под углом примерно 135° к боковой стенке нижней части 24. Вторая примыкающая поверхность 43, сформированная на выступе 39 второй защелкивающейся части 38, проходит под углом примерно 135° к боковой стенке закрывающей части 22. Кроме того, выступ 37, предусмотренный на первой защелкивающейся части 36, сужается в направлении свободного конца первой защелкивающейся части 36, чтобы образовать первую наклонную поверхность зацепления 45. Аналогично, выступ 39, предусмотренный на второй защелкивающейся части 38, также сужается в направлении свободного конца первой защелкивающейся части 38, чтобы образовать вторую наклонную поверхность зацепления 47.
Запирающий механизм 34 дополнительно содержит внутреннее ребро 40, которое выступает из сформованного в виде плеча или угла второго участка стенки 28 закрывающей части 22 в области внутренней окружности второго участка стенки 28. Следовательно, внутреннее ребро 40 выступает от второго участка стенки 28 закрывающей части 22 на расстоянии от второй защелкивающейся части 36, которая выступает из второго участка стенки 28 закрывающей части 22 в области внешней окружности второго участка стенки 28. В результате внутреннее ребро 40 и вторая защелкивающаяся часть 38 образуют зазор между ними, который приспособлен для размещения первой защелкивающейся части 36, когда закрывающая часть 22 и нижняя часть 24 фармацевтического носителя 20 соединены друг с другом. Однако в случае, когда закрывающая часть 22 снабжена второй защелкивающейся частью 38, которая расположена в области внутренней окружности второго участка стенки 28, чтобы взаимодействовать с первой защелкивающейся частью 38, которая расположена в области внешней части окружности второго участка стенки 32 нижней части 24, также возможно, чтобы запирающий механизм 34 содержал внутреннее ребро 40, которое выступает из второго участка стенки 32 нижней части 24 в области внутренней окружности второго участка стенки 32. В этом случае именно первая защелкивающаяся часть 36 вместе с внутренним ребром 40 образует зазор, который приспособлен для размещения второй защелкивающейся части 38, когда закрывающая часть 22 и нижняя часть 24 фармацевтического носителя 20 соединены с друг с другом.
Внутреннее ребро 40 короче, чем вторая защелкивающаяся часть 38, расположенная напротив внутреннего ребра 40, то есть вторая защелкивающаяся часть 38 выступает дальше от второго участка стенки 28 закрывающей части 22, чем внутреннее ребро 40. Кроме того, внутреннее ребро 40 сужается в направлении свободного конца внутреннего ребра 40, чтобы образовать третью наклонную поверхность зацепления 49, обращенную ко второй защелкивающейся части 38, которая выступает из второго участка стенки 28 закрывающей части 22 в область внешней окружности второго участка стенки 28 и расположена напротив внутреннего ребра 40. Третья наклонная поверхность зацепления 49 проходит, по существу, параллельно второй примыкающей поверхности 43, предусмотренной на выступе 39 второй защелкивающейся части 38, расположенной напротив внутреннего ребра 40. В случае, когда закрывающая часть 22 снабжена второй защелкивающейся частью 38, которая расположена в области внутренней окружности второго участка стенки 28, чтобы взаимодействовать с первой защелкивающейся частью 38, которая расположена в области внешней окружности второго участка стенки 32 нижней части 24, третья наклонная поверхность зацепления 49, сформованная на внутреннем ребре 40, может быть обращена к первой защелкивающейся части 36, которая выступает из второго участка стенки 32 нижней части 24 в области внешней окружности второго участка стенки 32 и расположена напротив внутреннего ребра 40.
При закрывании фармацевтического носителя 20, то есть после соединения закрывающей части 22 с нижней частью 24, первая наклонная поверхность зацепления 45, предусмотренная на выступе 37 первой защелкивающейся части 36, вступает в контакт со второй наклонной поверхностью зацепления 47, предусмотренной на выступе 39 второй защелкивающейся части 38. Когда закрывающая часть 22 приближается к нижней части 24, вторая наклонная поверхность зацепления 47 скользит вдоль первой наклонной поверхности зацепления 45, что приводит к небольшой упругой деформации первой и второй защелкивающихся частей 36, 38. В частности, первая защелкивающаяся часть 38 слегка изогнута радиально вовнутрь, тогда как вторая защелкивающаяся часть 36 слегка изогнута радиально вовне. Однако изгибание вовнутрь первой защелкивающейся части 38 ограничено внутренним ребром 40. Кроме того, третья наклонная поверхность зацепления 49, предусмотренная на внутреннем ребре 40, направляет вторую защелкивающуюся часть 38 в ее конечное положение в зазоре между второй защелкивающейся частью 38 и внутренним ребром 40, см. Фигуру 6В.
Когда закрывающая часть 22 и нижняя часть 24 достигают своих конечных относительных положений, то есть когда закрывающая часть 22 расположена сверху нижней части 24, укупоривая внутреннюю часть нижней части 24, упругая деформация первой и второй защелкивающихся частей 36, 38 устраняется, и первая примыкающая поверхность 41, предусмотренная на выступе 37 первой защелкивающейся части 36, упирается во вторую примыкающую поверхность 43, предусмотренную на выступе 39 второй защелкивающейся части 38. Взаимодействие между первой и второй примыкающими поверхностями 41, 43 препятствует отсоединению нижней части 24 от закрывающей части 22. Внутреннее ребро 40 обеспечивает дополнительную механическую стабильность и жесткость запирающего механизма 34.
Первый участок стенки 26 закрывающей части 22 в центральной области, которая определяется местом впрыска материала в форму при изготовлении закрывающей части 22, снабжен углублением 42, толщина стенки которого больше толщины стенки оставшейся части первого участка стенки 26, но все же меньше толщины стенки второго участка стенки 28 закрывающей части 22. Число - на чертежах номер «1» - отпечатано на внутренней поверхности углубления 42, оно указывает на полость, в которой закрывающая часть 22 была отлита в многоместной пресс-форме. Аналогичным образом, первый участок стенки 30 нижней части 24 в центральной области, которая определяется местом впрыска материала в форму при изготовлении нижней части 24, снабжен углублением 44, толщина стенки которого больше толщины стенки оставшейся части первого участка стенки 30, но все же меньше толщины стенки второго участка стенки 32 нижней части 24. Число (не показано на чертежах) отпечатано на внутренней поверхности углубления 44, и оно указывает на полость, в которой нижняя часть 24 была отлита в многоместной пресс-форме.
Как видно из Фигуры 6А, закрывающая часть 22 дополнительно снабжена множеством внутренних выступов 46, которые выступают вовнутрь в радиальном направлении от внутренней поверхности второго участка стенки 28 и внутренней поверхности внутреннего кольца 40, соответственно. В конкретном варианте осуществления закрывающей части 22, показанной в графических материалах, предусмотрены три внутренних выступа 46. Однако также возможно в закрывающей части 22 предусмотреть меньше или больше чем три внутренних выступа 46. Внутренние выступы 46 служат для предотвращения заклинивания частей 22, сложенных одна на другую, во время работы с ними. Каждый из внутренних выступов 46 содержит шип 48, выступающий из внутреннего ребра 40, который дополнительно снижает риск заклинивания частей 22, сложенных одна на другую. В варианте осуществления носителя 20, показанном в графических материалах, только закрывающая часть 22 снабжена внутренними выступами 46. Однако альтернативно или дополнительно, также возможно, чтобы нижняя часть 24 носителя 20 была снабжена описанными здесь внутренними выступами.
Наконец, как видно из Фигуры 6В, нижняя часть 24 снабжена идущим под углом буртом 50, который сформован в области внешней поверхности второго участка стенки 32 рядом с первой защелкивающейся частью 36 в форме крючка и наклонен в радиальном направлении вовне от наружной окружности защелкивающейся части 38 в форме крючка в направлении наружной поверхности второго участка стенки 32. Порошок, который непреднамеренно падает на бурт 50 при закрывании носителя 20, может быть легко удален.
Предпочтительно, чтобы фармацевтический носитель демонстрировал стандартное отклонение массы соответствующих частей носителя менее чем 1 мг, предпочтительно - менее чем 0,8 мг, более предпочтительно - менее чем 0,6 мг, еще более предпочтительно - менее чем 0,4 мг, еще более предпочтительно - менее чем 0,3 мг, еще более предпочтительно - менее чем 0,2 мг, и наиболее предпочтительно - менее чем 0,1 мг.
Изобретение дополнительно описано следующими вариантами осуществления.
1. Способ приготовления фармацевтического продукта, включающий стадии:
(a) предоставления активной фармацевтической субстанции (АФС), которая соответствует по меньшей мере пяти из следующих параметров (i) - (viii), определенных с помощью порошкового реометра FT4:
(i) основной удельной энергии потока (sBFE) не более 60 мДж/г;
(ii) индексу стабильности (SI) от 0,75 до 1,25;
(iii) удельной энергии (SE) не более 10 мДж/г;
(iv) наибольшему главному напряжению при 15 кПа (MPS-15) не более 40;
(v) функции тока при 15 кПа (FF-15) не менее 1,3;
(vi) уплотненной объемной плотности при 15 кПа (CBD-15) не менее 0,26 г/мл;
(vii) сжимаемости не более 47%; и
(viii) углу трения у стенки (WFA) не более 40°;
(b) дозирования АФС со стадии (a) в нижнюю часть фармацевтического носителя с помощью дозировочно-наполнительного вакуумного устройства; и
(c) капсулирования нижней части указанного фармацевтического носителя соответствующей закрывающей частью указанного фармацевтического носителя, тем самым получая фармацевтический продукт.
2. Способ согласно варианту осуществления 1, где
(i) sBFE - не более 25 мДж/г, в частности, не более 6 мДж/г; и/или
(ii) SI - от 0,83 до 1,18, в частности, от 0,9 до 1,1; и/или
(iii) SE - не более 8 мДж/г, в частности, не более 6 мДж/г; и/или
(iv) MPS-15 - не более 33, в частности, не более 25; и/или
(v) FF-15 - не менее 3, в частности, не менее 10; и/или
(vi) CBD-15 - не менее 0,45 г/мл, в частности, не менее 0,6 г/мл; и/или
(vii) сжимаемость - не более 35%, в частности, не более 3-15%; и/или
(viii) WFA - не более 34°, в частности, не более 28°.
3. Способ варианта осуществления 1 или 2, в котором параметры (i) - (viii) определяют с использованием порошкового реометра FT4 и методов определения характеристик порошка для каждого диаметра измерительного цилиндра.
(i) 25mm_1C_Split_Rep+VFR_R01;
(ii) 25mm_Shear_15kPa;
(iii) 25mm_Compressibility_1-15kPa; и
(iv) 25mm_Wall Friction_30kPa.
4. Способ согласно любому одному из вариантов осуществления 1-3, в котором дозировочно-наполнительное вакуумное устройство представляет собой вращающийся барабан (10).
5. Способ варианта осуществления 4, в котором в полости барабана создается вакуум от -100 до -800 мбар, и/или АФС дозируют при давлении эжекции от 100 до 1500 мбар.
6. Способ варианта осуществления 4 или 5, в котором дозировочно-наполнительное вакуумное устройство представляет собой вращающийся барабан (10), который либо оборудован мешалкой, либо звуковым/ультразвуковым приспособлением для выполнения замера и дозирования АФС.
7. Способ варианта осуществления 6, в котором дозировочно-наполнительное вакуумное устройство снабжено мешалкой, и при этом мешалка установлена на 1-4 оборота за цикл.
8. Способ варианта осуществления 6, в котором дозировочно-наполнительное вакуумное устройство снабжено звуковым/ультразвуковым устройством, в частности, штырем или рейкой, которые проталкивают порошок в полости вращающегося барабана и разрушают образующиеся в порошке микроперемычки, в частности, в котором штырь или рейка работают при частоте от 10000 Гц до 180000 Гц, предпочтительно - примерно 22000 Гц.
9. Способ согласно любому одному из вариантов осуществления 6-8, в котором
(i) если MPS-15 равно 28 или менее и/или WFA равен 31° или менее, АФС подходит для использования в сочетании с дозировочно-наполнительным вакуумным устройством, оборудованным звуковым/ультразвуковым приспособлением для выполнения замера и дозирования АФС; и
(ii) если значение SI более 1,1, АФС не подходит для использования в сочетании с дозировочно-наполнительным вакуумным устройством, оборудованным мешалкой для выполнения замера и дозирования АФС.
10. Способ согласно любому одному из вариантов осуществления 4-8, в котором дозировочно-наполнительное вакуумное устройство содержит желоб для порошка, снабженный приспособлением для псевдоожижения, в частности акустическим динамиком, в дополнение к ультразвуковому преобразователю.
11. Способ варианта осуществления 10, в котором подача происходит из вибрационного бункера в желоб для порошка, причем бункер предпочтительно активируется датчиком, в частности емкостным датчиком, в желоб для порошка.
12. Способ варианта осуществления 11, в котором подача происходит из бункера в желоб для порошка, каждый из которых оборудован звуковым приспособлением, работающим при частоте от 100 до 1000 Гц, причем бункер предпочтительно активируется датчиком, в частности емкостным датчиком, в желоб для порошка.
13. Способ согласно любому одному из вариантов осуществления 1-12, в котором дозирование АФС контролируют по весу с использованием технологии измерения наполняемой массы.
14. Способ варианта осуществления 13, в котором дозирование АФС контролируют по весу в реальном времени с использованием емкостного и/или микроволнового датчика (16), в частности, с использованием емкостного датчика.
15. Способ варианта осуществления 14, в котором датчик (16) имеет среднеквадратичную ошибку прогнозирования (RMSP) менее 5%, предпочтительно - менее 4,5%, более предпочтительно - менее 4%, и наиболее предпочтительно - менее 3,5% по отношению к аналитическим справочным инструментам, таким как ВЭЖХ или весы.
16. Способ варианта осуществления 13, в котором дозирование АФС контролируют по весу в автономном режиме с использованием взвешивания брутто-тара.
17. Способ согласно любому одному из вариантов осуществления 1-16, в котором АФС содержит массовую долю добавки не более 5%, предпочтительно - не более 4%, более предпочтительно - не более 3%, еще более предпочтительно - не более 2%, и наиболее предпочтительно - не более 1%.
18. Способ варианта осуществления 17, в котором одну или несколько добавок выбирают из группы, состоящей из гидрофобного коллоидного диоксида кремния, гидрофильного коллоидного диоксида кремния, стеарата магния, стеариновой кислоты, стеарилфумарата натрия, лаурилсульфата натрия, полоксамера 188, гидрогенизированного растительного масла или любой их комбинации.
19. Способ согласно любому одному из вариантов осуществления 1-18, в котором стадия (а) дополнительно включает просеивание АФС, где просеивание выбирают из просеивания с помощью конического просеивающего оборудования, вибрационного просеивания или просеивания на сите при помощи ультразвуковой вибрации.
20. Способ согласно любому одному из вариантов осуществления 1-19, где дозирование АФС на стадии (b) производится в пределах от 0,1 мг до 550 мг, предпочтительно - от 0,2 мг до 500 мг, и наиболее предпочтительно - от 0,25 до 450 мг.
21. Способ согласно любому одному из вариантов осуществления 1-20, в котором дозирование АФС на стадии (b) имеет относительное стандартное отклонение (RSD) менее 5%, предпочтительно - менее 4%, более предпочтительно - менее 3%.
22. Способ согласно любому одному из вариантов осуществления 1-21, в котором АФС уплотняют в нижней части фармацевтического носителя с помощью вибрации, встряхивания или постукивания перед стадией (с).
23. Способ согласно любому одному из вариантов осуществления 1-22, в котором по меньшей мере одна из закрывающей части (22) и нижней части (24) фармацевтического носителя (20) имеет первый участок стенки (26, 30) толщиной 180-250 мкм, предпочтительно - 185-225 мкм, и еще более предпочтительно - 190-220 мкм, и второй участок стенки (28, 32) толщиной 350-450 мкм, предпочтительно - 375-425 мкм, более предпочтительно - 390-410 мкм, и наиболее предпочтительно - примерно 400 мкм.
24. Способ согласно любому одному из вариантов осуществления 1-23, в котором закрывающая часть (22) и нижняя часть (24) соединены друг с другом с помощью дополнительного запирающего механизма (34);
в частности, в котором запирающий механизм (34) содержит первую защелкивающуюся часть (36), которая выступает из второго участка стенки (32) нижней части (24) так, что она обращена и взаимодействует со второй защелкивающейся частью (38), которая выступает из второго участка стенки (28) закрывающей части (22);
более конкретно, в котором первая защелкивающаяся часть (36) содержит выступ (37), приспособленный для зацепления с соответствующим выступом (39), предусмотренным на второй защелкивающейся части (38), чтобы противодействовать разъединению первой защелкивающейся части (36) и второй защелкивающейся части (38) и, таким образом, разъединению закрывающей части (22) и нижней части (24);
еще более конкретно, в котором выступ (37), предусмотренный на первой защелкивающейся части (36), сужается в направлении свободного конца первой защелкивающейся части (36), чтобы образовать первую наклонную поверхность зацепления (45), приспособленную для сцепления со второй наклонной поверхностью зацепления (47), образованной на выступе (39), предусмотренном на второй защелкивающейся части (38), который сужается в направлении свободного конца второй защелкивающейся части (36);
наиболее предпочтительно, в котором одна из первой и второй защелкивающихся частей (36, 38) выступает из второго участка стенки (28, 32) закрывающей части (22) или нижней части (24) в области внутренней окружности второго участка стенки (28, 32), и в котором другая из первой и второй защелкивающихся частей (36, 38) выступает из второго участка стенки (28, 32) закрывающей части (22) или нижней части (24) в области внешней окружности второго участка стенки (28, 32).
25. Способ варианта осуществления 24, в котором запирающий механизм (34) дополнительно содержит внутреннее ребро (40), которое выступает из второго участка стенки (28) закрывающей части (22) или нижней части (24) в области внутренней окружности второго участка стенки (28, 32) на расстоянии от первой или второй защелкивающейся части (36, 38), которая выступает из второго участка стенки (28, 32) закрывающей части (22) или нижней части (24) в области внешней окружности второго участка стенки (28, 32);
в частности, в котором внутреннее ребро (40) сужается в направлении свободного конца внутреннего ребра (40), образуя третью наклонную поверхность (49) зацепления, обращенную к первой или второй защелкивающейся части (36, 38), которая выступает из второго участка стенки (28, 32) закрывающей части (22) или нижней части (24) в области внешней окружности второго участка стенки (28, 32).
26. Способ согласно любому одному из вариантов осуществления 1-25, в котором нижняя часть (24) снабжена идущим под углом буртом (50), который сформирован в области внешней поверхности второго участка стенки (32) нижней части ( 24), в частности, рядом с первой защелкивающейся частью (36), и который наклонен в радиальном направлении вовне, в частности от внешней окружности первой защелкивающейся части (36) к внешней поверхности второго участка стенки (32).
27. Применение способа согласно любому одному из вариантов осуществления 1-26 в непрерывном процессе.
28. Применение способа согласно любому одному из вариантов осуществления 1-26 в высокопроизводительном процессе производства фармацевтического продукта.
Далее настоящее изобретение, определенное в вариантах осуществления, дополнительно иллюстрируется следующими примерами, которые не предназначены для ограничения объема настоящего изобретения. Все ссылки, цитируемые в данном документе, в явной форме включены путем ссылки.
ПРИМЕРЫ
Для стандартного порошкового реометра FT4 существует как минимум 6 методов определения характеристик порошка (для каждого диаметра измерительного цилиндра). Для анализа выбраны следующие из них:
25mm_1C_Split_Rep+VFR_R01;
25mm_Shear_15kPa;
25mm_Compressibility_1-15kPa;
25mm_Wall Friction_30kPa.
Каждый метод определения характеристик дает несколько видов параметров отклика (по умолчанию, или которые выбирают вручную). Полный набор характеристик порошка (не менее 22 параметров отклика в каждом ряду) измеряли для более чем 350 различных порошков и более чем 60 различных соединений с использованием стандартного порошкового реометра FT4, который собран в базе данных. Различные параметры были соотнесены с соответствующим поведением при наполнении, чтобы определить набор параметров и их диапазоны, которые способны различать и предсказывать поведение порошков при наполнении. Была получена следующая 8-параметрическая модель:
|
где параметры представляют собой:
sBFE: основная удельная энергия потока (мДж/г): рассчитана как BFE (измеренная с помощью стандартной исследовательской платформы FT4), деленная на раздробленную массу образца
SI: Индекс стабильности, стандартная переменная, безразмерная
SE: Удельная энергия (мДж/г), стандартная переменная
MPS при 15 кПа: наибольшее главное напряжение, стандартная переменная
FF при 15 кПа: Функция тока (безразмерная), измерена в сдвиговой ячейке, стандартная переменная
CBD при 15 кПа: Уплотненная объемная плотность (г/мл), стандартная переменная (измерена в сдвиговой ячейке)
CPS: Сжимаемость (%), стандартная переменная
WFA: Угол трения у стенки (градус°), стандартная переменная.
Если четыре из этих параметров выходят за пределы указанных интервалов значений, то технологичность такого порошка сомнительна. Если более четырех параметров входят за пределы указанных интервалов значений, то порошок скорее всего практически не пригоден для любого автомата, описанного здесь, в случае неразбавленной АФС. Кроме того, было обнаружено, что если MPS очень высоко, а WFA также большой, хотя и в меньшей степени, то порошок имеет тенденцию накапливаться в дозировочно-наполнительном устройстве. Для технологии звукового/ультразвукового наполнения это является отрицательной характеристикой. С другой стороны, если SI слишком высокий, порошок со временем меняет свои характеристики, что делает его более чувствительным к сдвиговому усилию. Такой порошок менее пригоден для использования в стандартной вакуумной барабанной технологии заполнения, в которой используется мешалка.
Найденная «8-параметрическая модель» способна различать и предсказывать поведение при наполнении порошков, находящихся в базе данных, где также приведены экспериментальные данные об ответе/оценке в приложении к оборудованию для наполнения капсул для по меньшей мере 40% порошков. Следующие случаи демонстрируют способность 8-параметрической модели прогнозировать и стимулировать разработку порошков, подходящих для дозирования в качестве неразбавленной АФС. Числа, выделенные жирным шрифтом, выходят за пределы желаемого диапазона.
|
Большинство этих порошков обсуждаются в следующих примерах.
Пример 1
Производство фармацевтического лекарственного продукта, содержащего LEE011, в большом масштабе требовалось, начиная с ранней стадии жизненного цикла разработки этого соединения. Несколько партий АФС кристаллизовали, просеивали и заполняли в капсулу с использованием описанной здесь платформы оборудования на оборудовании обоих типов вакуумных барабанов - наполнителей Standard (стандартная технология) и Sonic (звуковая технология). Характеристики наполнения были достаточно хорошими для большинства используемых вариантов порошка, особенно с точки зрения однородности дозирования (диапазон доз от 10 до 250 мг), однако поведение/текучесть порошка в бункере машины и возникновение трения между движущимися частями были в среднем сложными аспектами, вызывающими некоторые проблемы и простои процесса в течение очень длительных периодов. В то время как стандартная технология наполнения, особенно после некоторых оптимизаций, может справиться с такими присущими ей трудностями, связанными с порошками LEE011 (несколько миллионов капсул успешно заполнены), технология наполнения Sonic продемонстрировала серьезные периоды простоя процесса и повреждение компонентов из-за скапливания порошка внутри желоба для порошка, особенно когда измеренные значения параметра MPS были особенно высокими. Рекомендации, полученные с помощью «8-параметрической модели», не советовали выбирать наполнение Sonic для порошков, имеющих одновременно высокие значения MPS и WF, даже несмотря на то, что в одном примере (6.) удалось выполнить наполнение даже при этих значениях.
Пример 2
Заполнение неразбавленной лекарственной субстанции с определенной производительностью, которая подходит для производства больших партий, в промышленности обычно не применяется. Для АФС LXS196 свойства частиц и процесс наполнения были разработаны интегрированным путем. Описанный способ позволил изготовить капсулы LXS196 для клинической поставки с пропускной способностью более 40000 капсул в течение 6 часов. Процент хороших капсул составил 98,8% от общего количества произведенных капсул. Был реализован упрощенный производственный процесс, при котором выполнялись только просеивание и капсулирование (включая 100% контроль веса с помощью емкостного датчика, очистку от пыли и металла) неразбавленного лекарственного вещества. Кроме того, дозы до 400 мг были наполнены в капсулу размера 0. Кроме того, применяя собственную технологию производства высоких доз (постукивающий механизм), на автоматическом барабанном наполняющем оборудовании были капсулированы дозы выше 450 мг.
Пример 3
Дозирование порошка в размере субмиллиграммовых количеств АФС является особенно трудным для наполнения капсулы. Чтобы преодолеть трудности, при разработке галенов стандартный процесс для составления низких доз описывает смешивание и разбавление АФС формообразующими на нескольких стадиях смешивания, что позволяет в конце концов дозировать несколько миллиграммов разбавленной смеси в капсулы. То же самое верно для машин, оснащенных емкостными датчиками для проверки массы, которые обычно используются для наполнения капсул, начиная с минимального количества в несколько миллиграммов и выше.
Описанный здесь способ позволяет обрабатывать неразбавленную АФС FTY720, которая содержит менее 1% добавки (АФС >99%), с оптимальными физическими свойствами, подходящими для точного наполнения капсулы при очень низкой дозировке, такой как 0,5 и 0,25 мг, с использованием технологии анализа процесса для подтверждения 100% массы наполнения, что соответствует проверке однородности содержания 100%, что впервые осуществлено в диапазоне менее миллиграмма.
Кроме того, способ настоящего изобретения представляет собой очень простой процесс по сравнению с существующим на рынке препаратом, где используется несколько стадий процесса (т.е. несколько стадий просеивания и смешивания для постепенного разбавления смеси).
Конечный фармацевтический продукт также показал более длительный срок хранения, чем соответствующий поступающий в продажу препарат, поскольку только два компонента находятся в прямом контакте с лекарственным веществом (диоксид кремния и желатин).
Пример 4
NBU928 - это фумаратная соль со сложным процессом кристаллизации. Получающиеся частицы обычно имеют соотношение размеров, характерное для удлиненных частиц, кристаллы имеют форму планки длиной до 400 мкм с сильной тенденцией к агломерации. Такой вид кристаллической формы дает объем порошка, который не может быть непосредственно переработан в любом оборудовании для наполнения капсул. Поэтому порошок АФС подвергали обработке Particle Engineering (модификации частиц) для избирательного выращивания короткой стороны кристалла, затем его измельчали с помощью штифтовой мельницы, получая довольно правильное дробление, приводящее к более мелким частицам с более устойчивым соотношением сторон, свободным от агломерации, со средним диаметром (Х50) около 25 мкм. Реологические характеристики нового измельченного порошка АФС (партия № NBU928-metzgch4-001-03) говорят о сложной технологичности при использовании стандартной технологии наполнения PDP (возникновение перемычек порошка в бункере под действием силы сдвига, создаваемой мешалкой, из-за ожидаемой определенной нестабильности уровня аэрации в объеме), но их перерабатываемость идеальна для оборудования с вакуумным барабаном Sonic Filler. На самом деле очень хорошие характеристики наполнения капсул были получены в требуемом диапазоне доз от 5 до 50 мг.
Пример 5
CDZ173 представляет собой соединение монофосфатной соли. Для него характерны игольчатые кристаллы с соотношением сторон >10, агломерированные/слежавшиеся вытянутые кристаллы, очень низкая насыпная плотность (всегда <0,2 г/мл, очень часто <0,12 г/мл). Здесь сообщается о двух разных вариантах (размолотый и неразмолотый). Материал в строке 6 был пограничным в смысле наполнения (при очень низкой скорости/пропускной способности), даже если его характеристики выходили за пределы параметров нашей модели (4/8 критериев удовлетворены), в то время как материал в строке 7 не был пригоден для заполнения способом обработки настоящего изобретения, если только не предпринимается важное изменение в процессе кристаллизации (не описано здесь).