Результат интеллектуальной деятельности: СПОСОБ ИЗГОТОВЛЕНИЯ БЕСКЛЕТОЧНОГО МАТРИКСА ИЗ ПУПОВИНЫ ЧЕЛОВЕКА ДЛЯ СОЗДАНИЯ ВЫСОКОРЕГЕНЕРАТИВНОГО РАНЕВОГО ПОКРЫТИЯ
Вид РИД
Изобретение
Изобретение относится к области удовлетворения жизненных потребностей человека, а именно к области медицины, биотехнологии, регенеративной медицины, фармакологии, в частности, к методам лечения травматических повреждений суставного хряща путем создания бесклеточного хранимого тканеинженерного продукта для замещения хрящевых дефектов с обеспечением их регенерации и может быть использовано, помимо травматологии, в восстановлении мягких тканей организма.
В настоящее время во всем мире существует проблема нехватки донорских органов и тканей для трансплантации. За 2020 год в России выполнено 1960 пересадок органов, из них более 250 детям, в то время как в листах ожидания трансплантации органов в медицинских организациях России за этот же год состояло более 10000 реципиентов [1]. Помимо тех, кто находится в листах ожидания, многие пациенты страдают от терминальной стадии заболевания органов, но не считаются кандидатами на трансплантацию в соответствии с текущими протоколами распределения по ряду причин. Острый дефицит подходящих для трансплантации органов и тканей является предпосылкой для развития тканевой инженерии, способствующей решению проблемы нехватки донорских органов и неизбежных последствий алло- и ксенногенной трансплантации.
Тканевая инженерия - технология создания вне организма тканеинженерных конструкций (ТИК) для последующей трансплантации пациенту. ТИК в зоне дефекта создают условия для стимуляции регенерации поврежденных тканей и способствуют не только устранению дефектов, но и восстановлению биологических функций. ТИК могут быть бесклеточными, созданными с применением биосовместимых материалов, или в сочетании с клетками и биологически активными молекулами. Биосовместимый материал должен быть структурно и функционально близким к нативной структуре заменяемого органа или ткани, а также способствовать адгезии, пролиферации и дифференцировке клеток, используемых при рецеллюляризации. Перспективными для тканевой инженерии считаются материалы на основе естественного внеклеточного матрикса (ВКМ). ВКМ представляет собой трехмерную макромолекулярную сеть, состоящую из коллагена, протеогликанов, гликозаминогликанов, эластина, фибронектина, ламининов и других биомолекул [2]. Компоненты ВКМ играют важную роль в мобилизации факторов роста, хемокинов, цитокинов и регулировании адгезии, миграции, дифференцировки и пролиферации клеток. ВКМ по своему биохимическому составу и структурной организации является уникальным для каждой ткани (тканеспецифическим) [3], и потому наиболее перспективным для тканевой инженерии. Однако ТИК также может быть создан из иного биоматериала с высокими потенциями к развитию в несколько типов тканей, если такой биоматериал имеет эмбриональный фенотип.
В идеале ТИК должен представлять собою пространственную структуру, заселенную клетками, способными выполнять тканеспецифическую функцию. По сути, это очень сложный в изготовлении продукт, требовательный к условиям поддержания жизнеспособности клеток, транспортировки, трансплантации, а потому весьма дорогой в изготовлении. Однако ТИК может быть и бесклеточным продуктом, по сути эквивалентным ВКМ, и способным к заселению пациент-специфическими клетками в самом организме реципиента. Это положение не относится к некоторым органам. Например, самостоятельно используемый бесклеточный графт кровеносного сосуда обречен на запуск гемостатических и коагуляционных событий раньше, чем его внутренняя поверхность будет репопулирована пациент-специфическими клетками, а потому непредсказуем в своем функционировании и деградации в организме реципиента [4]. Существуют публикации о том, что бесклеточная ТИК почки способна заселяться клетками реципиента in vivo [5]. Что касается покровных тканей организма, то предположение об эффективности бесклеточных конструкций для восполнения дефекта кожи основано на присутствии в такой ТИК регенеративных хемоаттрактивных молекул для привлечения клеток, способности потенцировать дифференцировку клеток и секрецию ими собственных компонентов внеклеточного матрикса на месте имплантации ТИК. В настоящее время все больше исследователей заинтересованы в использовании в качестве естественного биореактора самого организма реципиента, и повышении таким образом рентабельности биоинженерного органа. Известно, что стоимость трансплантации в Соединенном Королевстве тканеинженерных органов, заселенных стволовыми клетками in vitro, составляет от 174.420 до 740.500 $ [6]. Однако малая доступность столь дорогостоящих медицинских продуктов для населения, осложнения после трансплантации, а также затраты на последующее наблюдение ограничивают трансплантации клеткисодержащих конструкций. Следовательно, с устранением стадии культивирования клеток и имплантацией бесклеточных каркасов в организм единственной заботой о стратегии бесклеточной тканевой инженерии будет создание неиммуногенного нецитотоксического каркаса (матрикса) с сохранными регенеративными потенциями.
В настоящее время матрикс ткани гомологичного происхождения признан наиболее перспективным биоматериалом, поскольку это прямой способ обеспечить сложный состав нативной ткани, который трудно воспроизвести с использованием отдельных компонентов. В качестве подходящего источника для изготовления трансплантатов на основе тканеинженерных матриксов нами была выбрана пуповина человека, благодаря ее гомологичному происхождению и сохранности в ней регенеративных компонентов. Пуповина лишена этических ограничений и доступна в неограниченном количестве. Пристальный интерес к пуповине человека как биоматериалу для тканевой инженерии появился после публикации данных об отсутствии воспалительной реакции при повреждении кожных покровов и мягких тканей плода, а также об их способности полностью восстанавливаться без рубцевания или с формированием нежного эластичного рубца [7, 8]. Известны особенности архитектоники и состава внеклеточного матрикса тканей фетального фенотипа: количество факторов роста TGF-β3, ассоциированных с безрубцовым заживлением ран, намного превосходит количество профибротических факторов роста TGF-β1 и TGF-β2, свойственных постнатальным тканям [9]. Во внеклеточном матриксе присутствует фактор роста эндотелия сосудов VEGF, обеспечивающий на этапах гестации интенсивный рост сосудов пуповины; фетальный нежно-волокнистый коллаген III типа со слабой связью между волокнами доминирует над коллагеном I типа, присущим постнатальным ранам, а гиалуроновая кислота с высоким молекулярным весом - над низкомолекулярной. В фибробластах плода синтезируется в 2-4 раза больше рецепторов к гиалуроновой кислоте высокого молекулярного веса, чем в постнатальных фибробластах, что, вероятно, ускоряет их миграцию в очаг повреждения. Продукция специфических поверхностных рецепторов фибробластов семейства тирозинкиназы (discoid domain receptors, DDR-1), регулирующих пролиферацию, дифференцировку и синтез коллагена III типа фибробластами, способствует заживлению фетальных ран с образованием нежной соединительной ткани [8].
Пуповина относится к внеэмбриональным тканям с фетальным фенотипом, следовательно, во внеклеточном матриксе ее соединительной ткани присутствуют регенеративные молекулы. Постнатальные ткани подвергаются воздействию многих факторов (стрессов, перенесенных заболеваний, возрастных перестроек), что отражается на структуре и композиции внеклеточного матрикса, поэтому биоматериал аллогенных и кадаверных тканей априори не оптимален для тканевой биоинженерии. Внеэмбриональные структуры утрачивают свою значимость для плода после рождения, и, будучи сразу заморожены, не подвергнутся влиянию внешних и внутренних факторов, как это произойдет с постнатальными тканями. Есть основания полагать, что регенеративные компоненты в составе матрикса пуповины будут способствовать его заселению клетками реципиента, созданию благоприятных условий для их функционирования по ремоделированию матрикса и, в конечном итоге, регенерации тканей. В наших предыдущих экспериментах in vivo было показано положительное влияние бесклеточного гидрогеля, изготовленного из Вартонова студня пуповины человека, на регенерацию поврежденного гиалинового суставного хряща кролика [10]. Для выяснения механизмов, лежащих в основе этого эффекта, а также возможности использования тканеинженерного бесклеточного матрикса пуповины человека при создании ТИК для репарации не только хряща, но и других тканей, необходимы дополнительные исследования. Учитывая имеющиеся в литературе сведения о том, что нативная ткань пуповины и ее девитализированные дериваты практически неиммуногенны [11], применение биоматериала провизорных органов человека для изготовления ТИК наиболее оптимально. Таким образом, биологические каркасы, полученные из децеллюляризованных высокорегенеративных тканей фетального фенотипа, были рассмотрены в качестве наиболее подходящих альтернатив для применения в тканевой инженерии.
Удаление клеток из биоматериала (децеллюляризацию) осуществляют физическими, химическими и ферментативными (биологическими) методами [12]. Выбор наиболее оптимального и эффективного способа децеллюляризации органа или ткани зависит от многих факторов, включая тип органа, видовую специфичность ткани, ее структуру, клеточный состав и плотность. Поэтому был разработан собственный метод децеллюляризации, адаптированный к специфике твердой слизистой соединительной ткани пуповины, и обеспечивающий, помимо бесклеточности продукта, еще и сохранность компонентного состава биоматериала. Кроме того, еще одним важным критерием выбора метода децеллюляризации была оценка остаточных количеств реагентов в изготовленном продукте, поскольку изменения в составе ВКМ могут вызывать сами агенты децеллюляризации, в той или иной степени нарушая его структуру. Полнота удаления антигенов из биоматериала и в то же время сохранность в бесклеточной конструкции основных компонентов ВКМ пуповины представляются необычайно важными и сложными задачами, которые мы попытались решить в этом изобретении. В нашем предыдущем исследовании, выбранном за прототип, [13] мы показали, что эффективное удаление антигенного материала возможно при использовании 0,05% раствора додецилсульфата натрия (SDS, Биолот, Россия).
В основу изобретения положена задача минимизировать возможное токсическое влияние остаточных количеств SDS за счет удаления ядерных субстанций из Вартонова студня пуповины человека раствором детергента с меньшей концентрацией, а именно 0,01% раствора SDS.
Решение поставленной задачи обеспечивается тем, что в способе изготовления бесклеточного матрикса из пуповины человека для создания высокорегенеративного раневого покрытия, включающем получение нативной пуповины из родильного отделения, стерилизацию 10% раствором перекиси водорода, ее препарирование (удаление сосудов), фрагментирование и гомогенизацию, децеллюляризацию, отмывку от реагента и открепившихся клеток, лиофилизацию; для удаления клеток из матрикса в процессе децеллюляризации используют 0,01% раствор SDS.
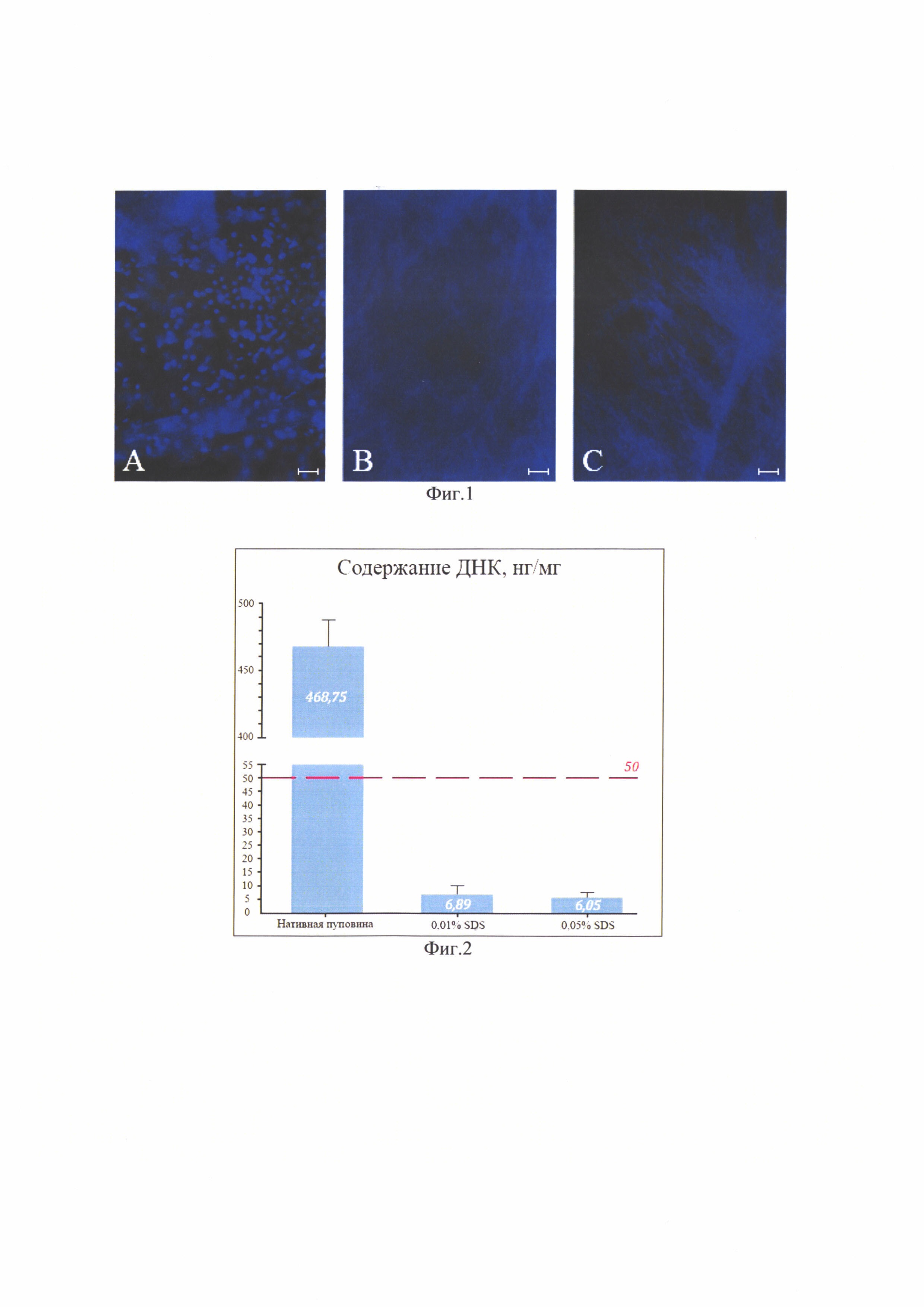
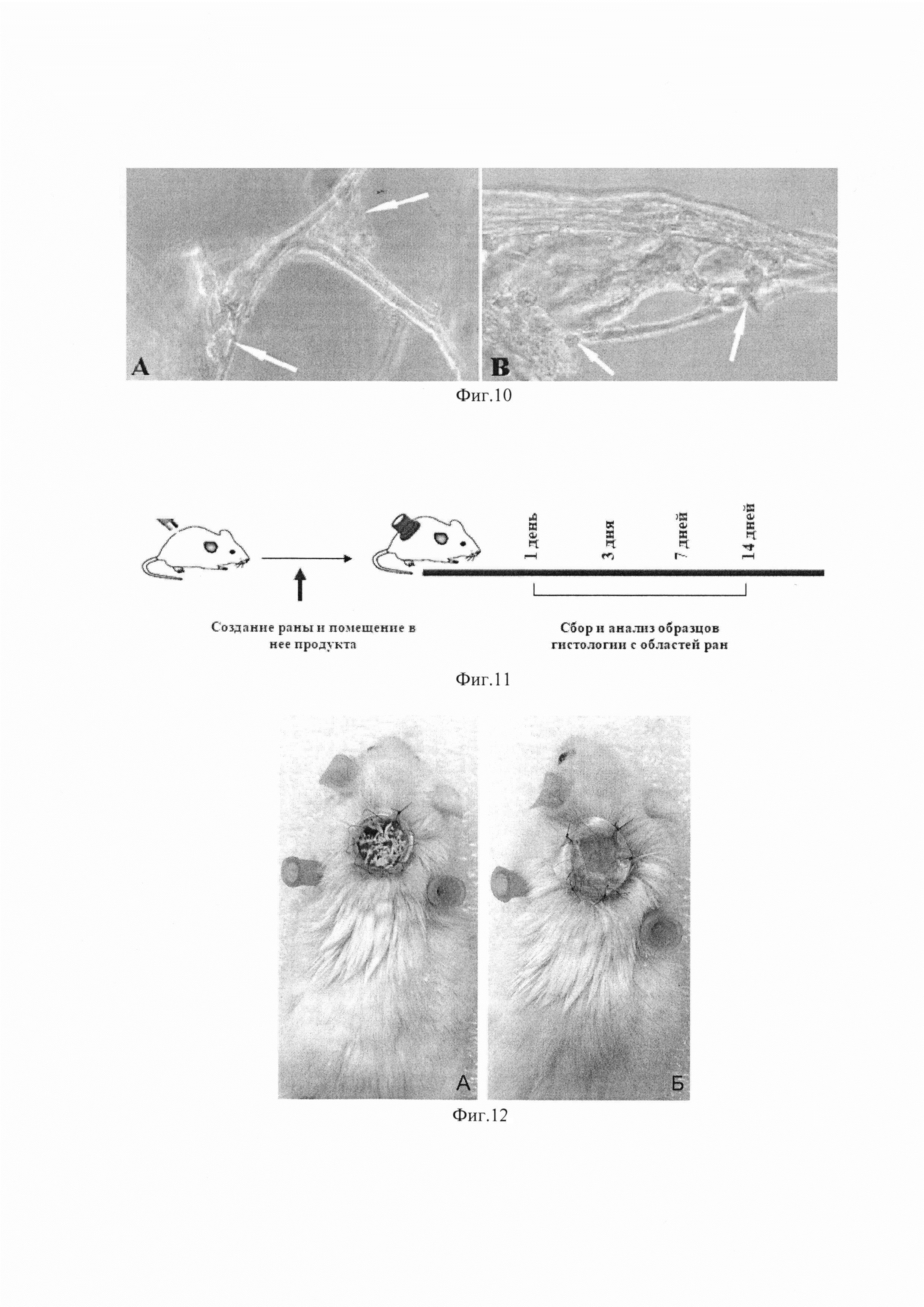
Изобретение поясняется фиг. 1, на которой показана световая микроскопия. Нативная пуповина (слева), обработка SDS 0,01% (в центре), обработка SDS 0,05% (справа). Окраска DAPI, шкала 100 мкм. На фиг. 2 приведено содержание ДНК в образцах нативной пуповины и бесклеточных продуктах, изготовленных при использовании разных концентраций детергента. На фиг. 3 показана сканирующая электронная микроскопия матрикса пуповины; А - шкала 50 мкм, Х350; В - шкала 10 мкм, X1000. На фиг. 4 показана визуализация волокон коллагена в составе тканеинженерных бесклеточных каркасов из пуповины человека методом просвечивающей электронной микроскопии (а) и аутофлуоресценция последовательно сканированных участков, воссоздающая трехмерную сетеподобную структуру поперечно исчерченных волокон (b). На фиг. 5 приведено иммуногистохимическое окрашивание бесклеточного тканеинженерного каркаса из пуповины человека антителами к ламинину (а) и коллагену IV типа (b). Визуализация гликозаминогликанов в бесклеточном тканеинженерном каркасе окрашиванием альциановым синим (с). На фиг. 6 приведены спектры нативной и децеллюляризированной пуповины (матрикса) после обработки различными концентрациями SDS. На фиг. 7 показано остаточное содержание детергента в конечном продукте, изготовленном с помощью 0,01% или 0,05% раствора SDS, определенное методом масс-спектрометрии. На фиг. 8 показана жизнеспособность дермальных фибробластов человека при культивировании в кондиционированных средах (М±σ), МТТ-тест. *-различия статистически значимы, р<0,05. На фиг. 9 приведены экспланты органов крысы: 1 - селезенка, 2 - кора головного мозга, 3 - кожа. Органотипическое культивирование: А - контроль, Б - в присутствии матрикса. Ув. ×70. На фиг. 10 показана адгезия клеток к волокнам матрикса (белые стрелки) на 21 сут. культивирования: А - клетки коры мозга вьетнамской вислобрюхой свиньи; Б - клетки селезенки морской свинки. Ув. ×400. На фиг. 11 приведен дизайн эксперимента. На фиг. 12 показан вид моделированного глубокого дефекта кожи мышей: вверху - схема эксперимента; внизу - А - полнослойная кожная рана с силиконовым ограничителем и лиофилизированным тканеинженерным продуктом; Б - дефект бесконтактно закрыт парафиновой пленкой. На фиг. 13 приведена морфология участков полнослойных кожных ран на 7-е сутки: визуализация тканеинженерного продукта у мышей в области дна раны, ×400. Окраска Н&Е. На фиг. 14 приведена морфология участков полнослойных кожных ран на 14-е сутки: фибробластоподобные клетки среди волокон матрикса, ×400. Окраска Н&Е. На фиг. 15 приведена морфология участков полнослойных кожных ран на 14-е сутки: адгезия клеток с фибробластоподобной морфологией к тканеинженерному продукту, ×400. Окраска Н&Е.
В настоящее время не существует единых стандартизированных критериев оценки качества децеллюляризации. Широко применяемым подходом к определению эффективности удаления антигенного материала является гистологическое исследование матрикса на наличие остаточных ядер и количественный анализ содержания ДНК, определение длины остаточных фрагментов ДНК. Общими критериями минимального приемлемого уровня ацеллюлярности могут считаться концентрация двухцепочечной ДНК в сухой массе внеклеточного матрикса <50 нг/мг; длина остаточных фрагментов ДНК менее 200 пар оснований [12]; отсутствие видимого ядерного материала в срезах тканей, окрашенных DAPI и/или гематоксилином и эозином.
Гистологическое исследование показало, что после децеллюляризации раствором 0,01% и раствором 0,05% SDS ядра в биоматериале отсутствовали (фиг. 1).
Снижение концентрации нуклеиновых кислот при использовании растворов обеих концентраций оказалось статистически значимым, р<0,001 (фиг. 2).
Таким образом, с помощью использованного в нашей работе метода децеллюляризации разными концентрациями SDS удалось за 24 часа практически полностью удалить клетки и ядерный материал из биоматериала пуповины и обеспечить неиммуногенность продукта даже раствором минимальной концентрации SDS (0,01%).
Структура лиофилизованного матрикса на изображениях SEM гетеропористая (фиг. 3).
Разработанный нами тканеинженерный каркас из пуповины человека обладает гетерогенной пористостью: наименьший диаметр составлял 45,53±3,36 мкм, средний диаметр 63,66±2,71 мкм, а больший диаметр варьировал в диапазоне 254,30-838,55 мкм. Известно, что структура сети взаимосвязанных пор диаметром от 20 до 125 мкм обеспечивает оптимальные условия для миграции в матрикс клеток и их последующей адгезии и дифференцировки. Известно, что миофибробласты появляются в ране в течение примерно одной недели после повреждения и исчезают полностью путем апоптоза спустя 3-4 недели [14]. В отсутствие пористой поверхности для адгезии миофибробласты соединяются друг с другом, образуя плотные тяжи и формируя грубый рубец. Оптимальный размер пор способствует большей удельной поверхности и плотности молекул клеточной адгезии для образования контактов между клетками и каркасом. В результате происходит формирование рассеянных клеточных сетей с дезориентацией их длинных осей, способствующих эластичному рубцеванию. Преобладание пор размером до 100 мкм в продукте из децеллюляризированной пуповины человека является одним из факторов, определяющим его регенеративные свойства. Наличие макропор (300-800 мкм), но в гораздо меньшем количестве, необходимо для образования структурированных тканей, васкулогенеза и диффузии внеклеточной жидкости.
Анализ изображений, полученных методом просвечивающей электронной микроскопии (ТЭМ) показал, что основу тканеинженерных бесклеточных каркасов из пуповины человека составляют структурные коллагены (фиг. 4).
Обилие молекул гликозаминогликанов выявлено окрашиванием альциановым синим, а присутствие ламинина и коллагена IV типа выявлено иммуногистохимическим маркированием соответствующими антителами (фиг. 5).
Состав бесклеточного продукта из пуповины был изучен так же с помощью инфракрасной микроспектроскопии (фиг. 6), используя инфракрасный спектрометр с преобразованием Фурье (FTIR) IR Prestige-21 (Shimadzu, Токио, Япония), в режиме пропускания в диапазоне 4000-600 см-1 и со спектральным разрешением 2 см-1.
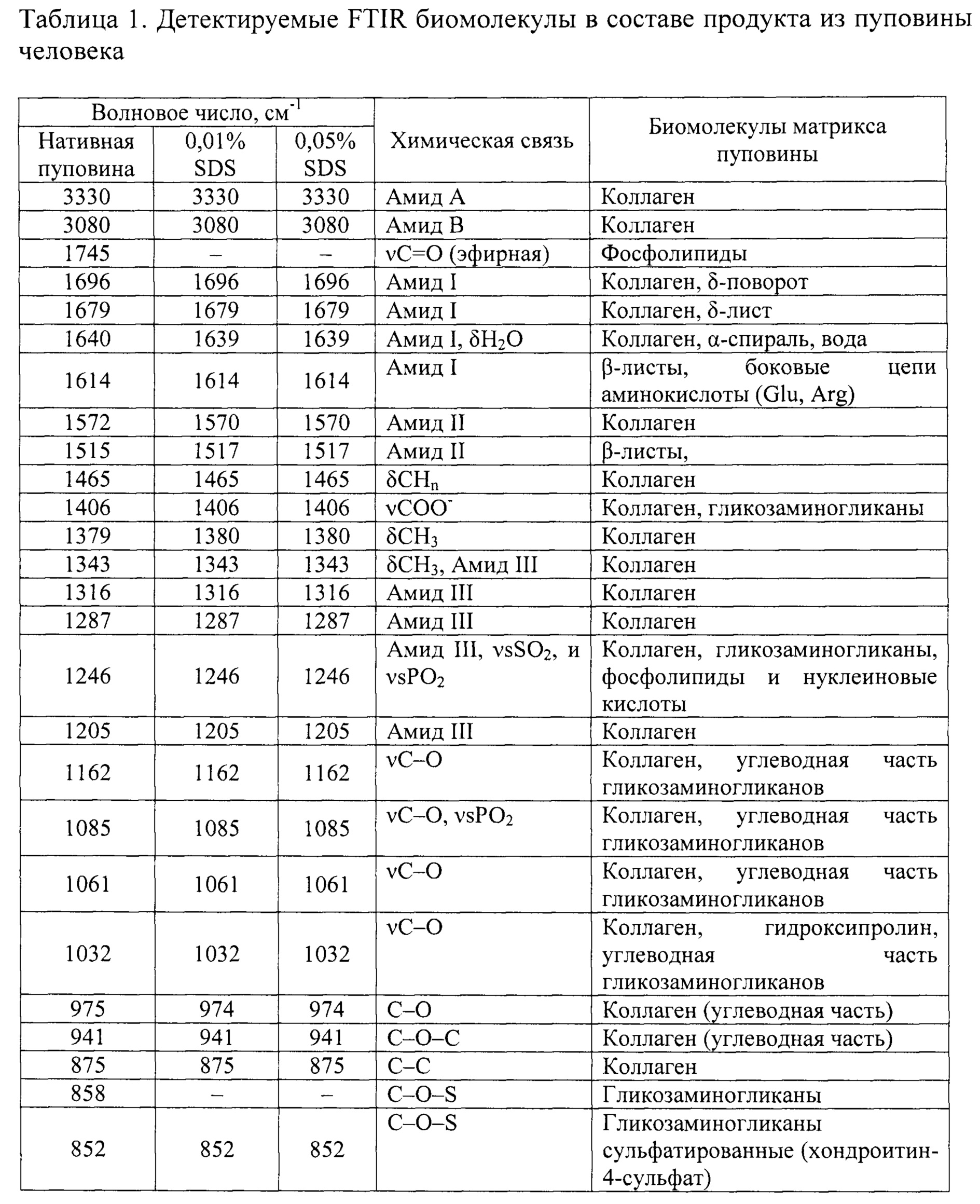
Отнесение пиков и полос спектров FTIR к определенным типам биомолекул было выполнено с помощью второй производной спектров и в соответствии с базами данных, приведенных в научных публикациях [15, 16, 17] (таблица 1).
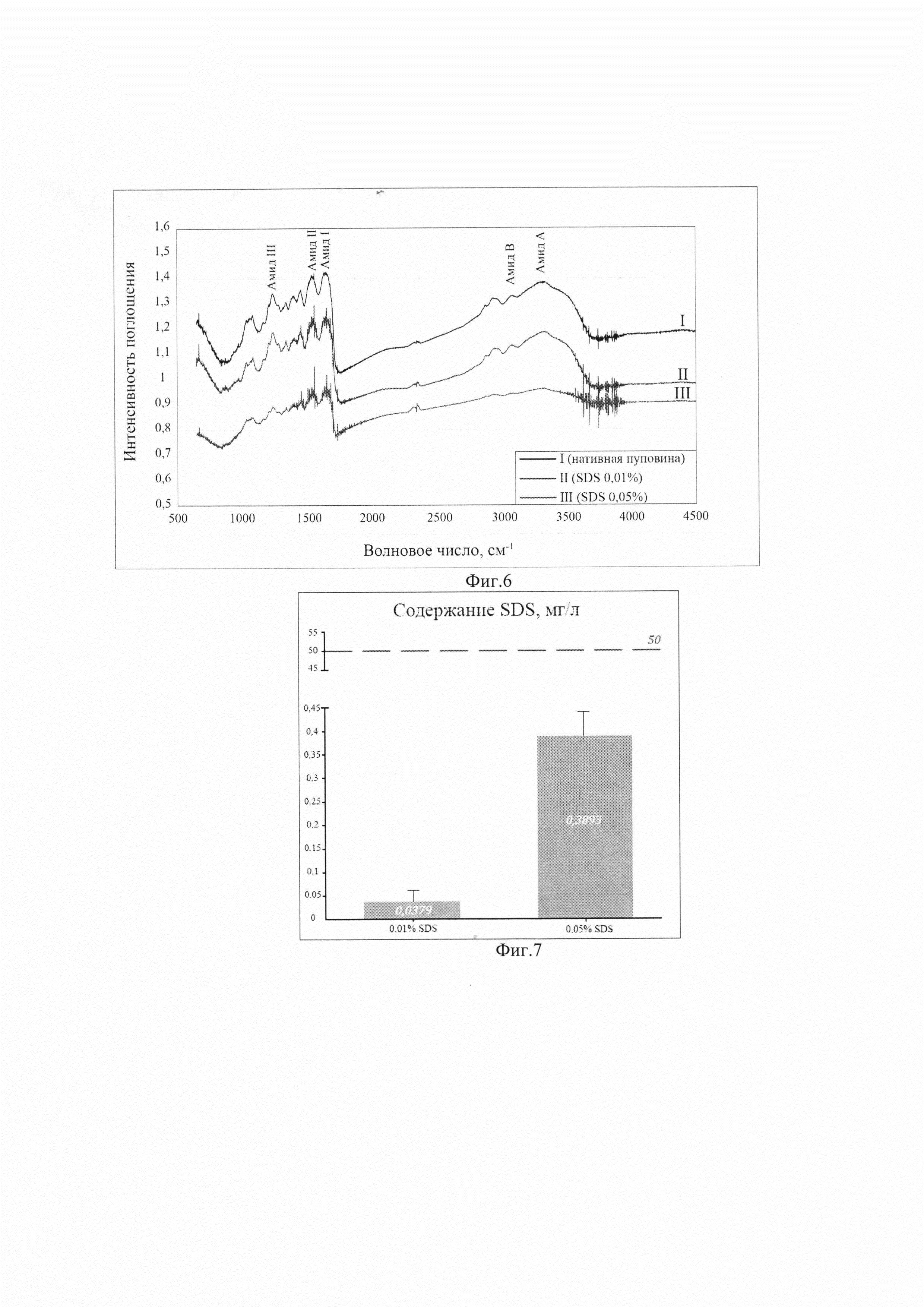
Мы использовали высокоинформативный метод инфракрасной микроскопии Фурье для того, чтобы еще раз подтвердить качественность децеллюляризации, итогом которой стало полное отсутствие не только цельной и фрагментированной ДНК, но и остатков фосфолипидов клеточный мембран. По сравнению с нативным Вартоновым студнем пуповины, спектры децеллюляризированного продукта выявили отсутствие фосфолипидного плеча (расположенного на 1745 см-1, что соответствует фосфолипидам клеточной мембраны) наряду со снижением интенсивности полос, близких к 1240 и 1085 см-1 (частично отнесенных к полосам растяжения РО2 из фосфолипидов и нуклеиновых кислот). Это подтверждает высокую эффективность децеллюляризации Вартонова студня пуповины растворами обеих концентраций SDS в наших экспериментах.
Также было исследовано влияние обработки ткани растворами разных концентраций детергентов на сохранность ЕСМ. Общий вид спектров был близок к уже описанным в литературе для коллагена [17]. Действительно, и бесклеточный продукт, и спектры нативного Вартонова студня показали основные полосы около 1685 и 1570 см-1, относящиеся в основном к полосам амида I и II, присущим коллагену. FTIR-спектры коллагеновых фибрилл демонстрируют отчетливые сигналы при 3330-3325 см-1 (амид А), 3080 см-1 (амид В), 1650 см-1 (амид I) и 1550 см-1 (амид II). Группа амида I очень чувствительна к вторичной структуре коллагена. Две основные полосы 1696 и 1679 см-1 относятся к β-спирали и β-слоям коллагена соответственно [18], обнаруживая очевидное различие в их относительной интенсивности после децеллюляризации. Действительно, отношение β-спирали к β-слоям уменьшалось от спектра нативной пуповины к спектру децеллюляризированной, что свидетельствует о потенциальной альтерации коллагена при децеллюляризации. Спектры также демонстрируют полосы поглощения между 1170 и 800 см-1, которые возникают в основном из-за поглощения (С-О) и (С-О-С) углеводных фрагментов коллагена и GAG. [17]. Спектры децеллюляризированных растворами разных концентраций продуктов показали более низкую интенсивность поглощения по сравнению со спектрами WJ, что указывает на некоторое снижение содержания GAG. Полоса при 852 см-1 специфична для хондроитин-4-сульфата [19].
Таким образом, изготовленный из природного биоматериала гомологичного происхождения бесклеточный продукт является потенциально неиммунногенным, гетеропористым, сохраняет основные структурные и функциональные компоненты, присущие нативной пуповине и важные для процессов регенерации глубоких повреждений кожи.
Децеллюляризованный ЕСМ как предполагаемый трансплантат может быть поврежден реактивами в процессе децеллюляризации; при нарушении условий хранения перед трансплантацией; после трансплантации в организм реципиента, если не обеспечена его неиммуногенность [20]. После удаления клеточных и ядерных компонентов в процессе децеллюляризации крайне важно удалить все детергенты, используемые в протоколе, чтобы избежать воспалительных реакций, утраты биологических свойств ЕСМ, и тем способствовать репопуляции матрикса. В противном случае на исход трансплантации повлияли бы остаточные молекулы детергента и длительность децеллюляризации. Сообщалось, что для разных типов клеток, используемых в схемах рецеллюляризации, остаточные допустимые концентрации детергентов могут быть разными [5]. Эндотелиальные клетки легких по сравнению с фибробластами, эпителиальными клетками и МСК более чувствительны к присутствию в каркасе 0,002% SDS [21]. МСК, полученные из жировой ткани, более чувствительны к SDS по сравнению с почечными клетками. Результаты также показали, что концентрации SDS, превышающие 0,003%, были токсичными для МСК, и их жизнеспособность при 0,003% составляла всего 49,4%. Однако жизнеспособность почечных клеток при концентрации SDS 0,003 и 0,001% составляла 87,4% и 85,4% [5]. Оценка цитотоксичности также показала, что порогом токсичности было 0,001% SDS для почечных клеток, однако МСК обладали большей чувствительностью к SDS, и остаточная концентрация 0,0001% приводила к токсическим эффектам. На сегодняшний день не существует широко используемых и общепринятых неинвазивных анализов для определения остаточного количества примененного детергента и его высвобождения после имплантации. В нашем исследовании детекцию остаточных количеств SDS осуществляли методом масс-спектрометрии и колориметрическим методом с помощью красителя метиленового синего [5] (фиг. 7).
Известно, что концентрация детергента менее 50 мг/л - приемлемый уровень для получения нетоксичного продукта (красная пунктирная линия на графике) [22]. Концентрации остатков детергента в изготовленных нами продуктах из пуповины показывают низкие значения как в случае использования раствора 0,05%, так и тем более при использовании раствора 0,01% SDS для децеллюляризации. Наши результаты согласуются с данными литературы, и изготовленные продукты прогностически нецитотоксичны для прикрепления и дифференцировки пациент-специфических клеток.
Таким образом, высокая эффективность удаления клеточного и генетического материала достигается воздействием обеих концентраций SDS; наиболее оптимальным способом децеллюляризации является использование раствора 0,01% SDS из-за его минимального остаточного содержания в полученном продукте. Снижение концентрации раствора детергента в пять раз позволяет достичь значимого снижения его остаточных количеств в продукте почти в 10 раз, что потенциально исключает их возможное токсическое действие на репопулирующие матрикс клетки реципиента.
Для оценки цитотоксичности и безопасности децеллюляризованного каркаса рекомендуют использовать анализ МТТ, и оценку жизнеспособности клеток в ткани.
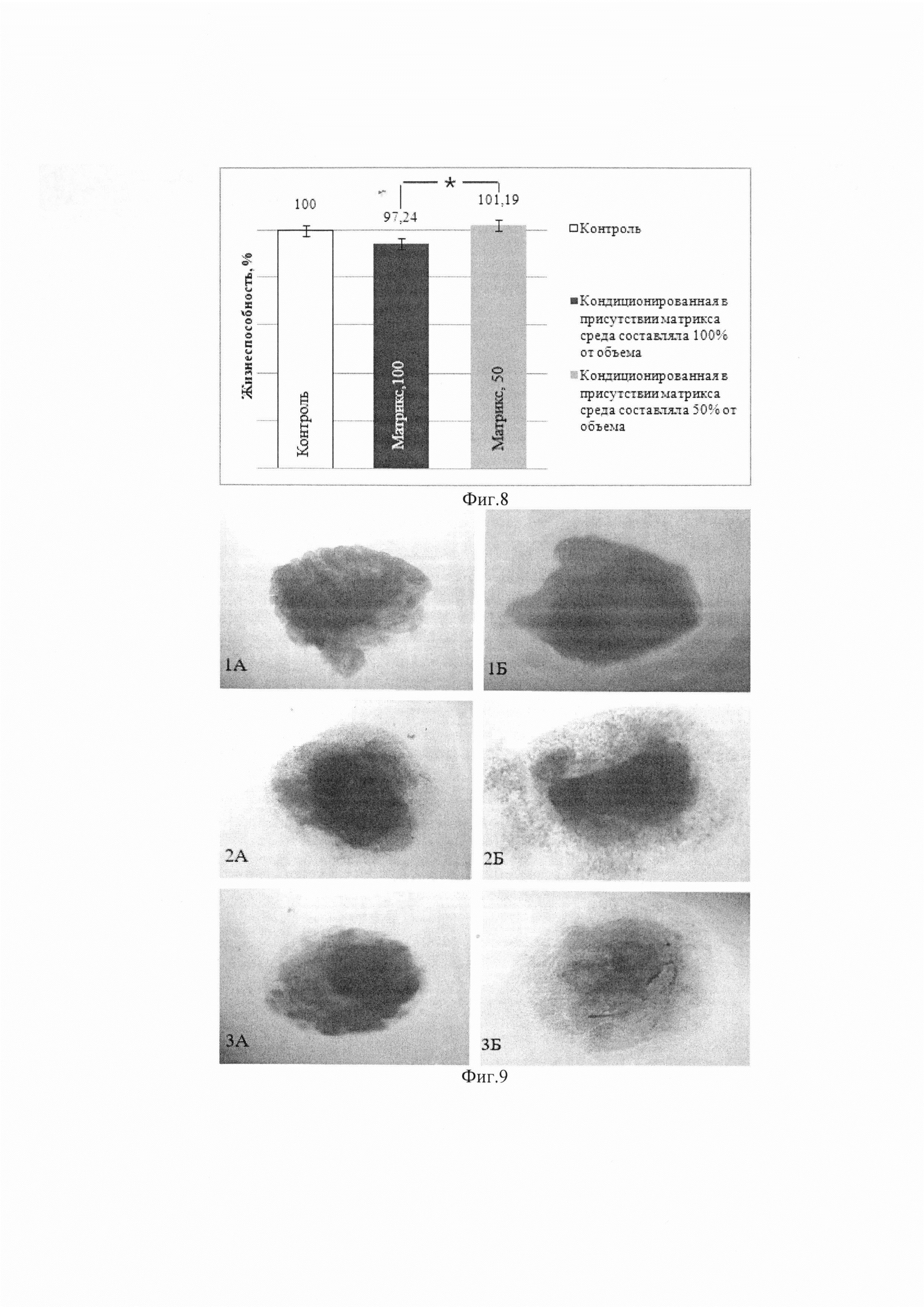
Влияние образцов бесклеточного лиофилизированного матрикса пуповины человека на жизнеспособность дермальных фибробластов человека (ДФ) оценивали с использованием кондиционированных питательных сред, полученных прединкубацией исследуемого матрикса в питательной среде. Для получения сред, кондиционированных матриксом, была выбрана концентрация лиофилизированного бесклеточного матрикса пуповины человека 1 мг на 1 мл питательной среды: 10 мг стерильного матрикса помещали в контейнеры с крышкой, в каждый контейнер добавляли 10 мл полной питательной среды DMEM/F12 и инкубировали в течение 1 суток при 4°С в холодильной камере. Жизнеспособность клеток оценивали с использованием МТТ-теста: митохондриальные ферменты жизнеспособных клеток изменяют исходный цвет реактива на пурпурный за счет образования формазана, оптическая плотность которого линейно зависит от количества живых клеток. Изменение оптической плотности опытных проб относительно контрольных свидетельствует о влиянии исследуемого агента на культивируемые клетки. Для МТТ-анализа ДФ человека высевали в лунки 96-луночных планшетов в концентрации 7×103 клеток на лунку в 200 мкл питательной среды. После адгезии клеток стандартную питательную среду заменяли на кондиционированную в 2 вариантах для каждого образца: в первом варианте кондиционированная среда составляла 50% от объема питательной среды; во втором варианте - 100%. Контролем служили ДФ, культивируемые в стандартных условиях. Клетки в кондиционированных и параллельно в стандартных средах культивировали в течение 72 ч., среды заменяли на среду с добавлением 200 мкл на лунку реагента МТТ в концентрации 0,5 мг/мл, инкубировали в течение 4 ч. в атмосфере 5% СО2, среду с МТТ удаляли, в каждую лунку добавляли 100 мкл диметилсульфоксида, инкубировали в течение 20 мин. при постоянном перемешивании и измеряли оптическую плотность экстрагированного формазана в диметилсульфоксиде на анализаторе Fluorofot «Charity» (Россия) при длине волны 570 нм и референсной длине волны 630 нм. Оптическую плотность в контрольных лунках со стандартной средой принимали за 100% жизнеспособность клеток [10]. Результаты МТТ-теста представлены на фиг. 8.
С помощью МТТ-теста было обнаружено, что тканеинженерный бесклеточный матрикс пуповины человека не токсичен для дермальных фибробластов человека и степень биосовместимости носит дозозависимый характер.
Цитотоксический и цитостатический эффекты матрикса из пуповины оценивали также при культивировании эксплантов разных органов разных видов животных в присутствии продукта. В серии экспериментов было обнаружено значимое увеличение площади эксплантов селезенки (на 15%), коры головного мозга (на 44%) и кожи (на 25%) крысы при их культивировании в присутствии матрикса (фиг. 9).
Рост популяций клеток может быть связан с влиянием матрикса пуповины человека как на миграцию клеток из эксплантов, так и на их пролиферацию. Использование разных технологий (культивирование эксплантов и первичной культуры клеток) позволило выявить общую тенденцию влияния матрикса из пуповины на увеличение количества жизнеспособных клеток различных животных. Влияние матрикса на динамику роста клеток хрящевой ткани было наиболее выражено у кролика, клеток кожи и коры головного мозга - у вьетнамской свиньи, клеток печени и сердца - у морской свинки. Количество жизнеспособных хрящевых клеток, культивированных в присутствии матрикса, было выше, чем в контроле, у всех видов животных. Кроме того, матрикс способствовал увеличению количества жизнеспособных клеток коры головного мозга и селезенки вьетнамской свиньи; коры головного мозга, печени и селезенки морской свинки. В эксперименте с хондроцитами кролика, а также вьетнамской вислобрюхой свиньи было обнаружено увеличение количества клеток в присутствии матрикса пуповины человека, их жизнеспособность была выше, чем в контроле. Наши данные согласуются с результатами других исследователей, изучавших рост клеток в присутствии бесклеточного продукта из пуповины человека. В экспериментальном исследовании Z. Koci с соавт.(2017) стволовые клетки нервной системы, выросшие в виде кластеров с нечеткими границами на фидере из продукта пуповины, через 7 дней синтезировали ранний нейрональный маркер NF70, а спустя 14 дней - пролиферировали и дифференцировались в нейрональные клетки, положительные на нейрональный маркер МАР2 [24]. Вероятно, пролиферативные и дифференцировочные возможности клеток определяются сохранностью в матриксе (или фидере на его основе) факторов регенерации.
Таким образом, матрикс пуповины человека ускоряет динамику роста клеток эксплантов разных органов разных лабораторных животных, и их выживаемость, что говорит о его митогенных и хемоаттрактивных свойствах. Есть основания предполагать, что эффекты матрикса из пуповины человека могут быть аналогичными для клеток разных видов млекопитающих.
На 21-е сутки органотипического культивирования эксплантов было выявлено прикрепление к матриксу пуповины клеток коры головного мозга вьетнамской вислобрюхой свиньи и селезенки морской свинки (фиг. 10), что выявляет способность матрикса пуповины рекрутировать клетки реципиента, обеспечивать их фиксацию к волокнам матрикса, стимулировать их пролиферацию и дифференцировку. Совокупность этих свойств в дальнейшем сможет обеспечить временное функционирование матрикса в месте трансплантации. Адгезии других типов клеток, используемых в настоящем исследовании, к этому сроку обнаружено не было. Это может быть связано с видовыми и гистологическими различиями тканей. Ограничением нашего исследования является непродолжительный срок наблюдения, не позволивший документировать прикрепление клеток других органов к структурам матрикса.
Таким образом, изготовленный бесклеточный матрикс пуповины человека способствует направленной миграции клеток эксплантов органов разных животных и прикреплению их к волокнам продукта.
Были проведены два этапа исследований на 44 белых беспородных мышах-самцах 3-4 месячного возраста и массой тела 20±5 г, полученных из питомника "Рапполово" Ленинградской области. Все манипуляции с животными были проведены в соответствии с этическими принципами, установленными Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и других научных целей [25].
В качестве наркоза использовали ксилазин (Ксила, Эстония) в дозировке 100 мг/кг. В асептических условиях на предварительно освобожденную от шерсти область холки наносили полнослойную кожную рану диаметром 1,2 см. Для предотвращения стягивания кожи силиконовые кольца диаметром 1,4 см хирургической нитью 6-0 Surgipro II (Medtronic, США) были пришиты к краям дефектов кожи. Выбранным случайным образом животным опытной группы на поверхность раны был помещен сухой лиофилизированный стерильный тканеинженерный продукт массой 0,0093±0,0004 г, смоченный 0,2 мл раствора Рингера рН 7,2 (Биосинтез, Россия). Для предотвращения высыхания загрязнения и высыхания дефект бесконтактно закрывали парафиновой пленкой (фиг. 11). Животным контрольной группы рану смачивали раствором Рингера и закрывали дефект парафиновой пленкой (фиг. 12).
Термометрию (термометр Harvard Apparatus, США) и оценку общего состояния животных проводили ежедневно. На 14-е сутки от начала эксперимента всех животных выводили передозировкой паров эфира. Ткани в области раны после извлечения фиксировали в 10% забуференном формалине в течение 24 часов. После стандартной гистологической обработки в изопропиловых спиртах образцы заливали в парафин. Изготавливали срезы толщиной 3-4 мкм и окрашивали гематоксилином и эозином.
При гистологическом исследовании тканей, взятых в области тканевого дефекта, были обнаружены морфологические признаки умеренной воспалительной реакции на ранних сроках после операций.
На 7-е сутки вблизи краев антиконтракционного кольца полость раны заполнена созревающей грануляционной тканью, содержащей большое количество фибробластов и новообразованных сосудов. Биотехнологический продукт визуализируется в области кожного дефекта (фиг. 13).
На 14-е сутки от операции при гистологическом исследовании препаратов с участков кожных ран животных опытной и контрольной групп были обнаружены морфологические признаки формирования незрелых сосудов капиллярного типа. Образцы ран мышей контрольной группы (с антиконтракционным кольцом, но без тканеинженерного продукта в ране) отличались менее динамичным образованием грануляционной ткани в дне дефекта, в то время как в образцах опытной группы в большом количестве в поле зрения наблюдались параллельно ориентированные юные формы фибробластов и фиброцитов (фиг. 14). Наличие мелкого базофильного ядра в популяции фибробластов в образцах опытной группы свидетельствует об их высоком пролиферативном потенциале.
Присутствие тканеинженерного продукта было обнаружено в тканях спустя 14 суток после его помещения в рану.
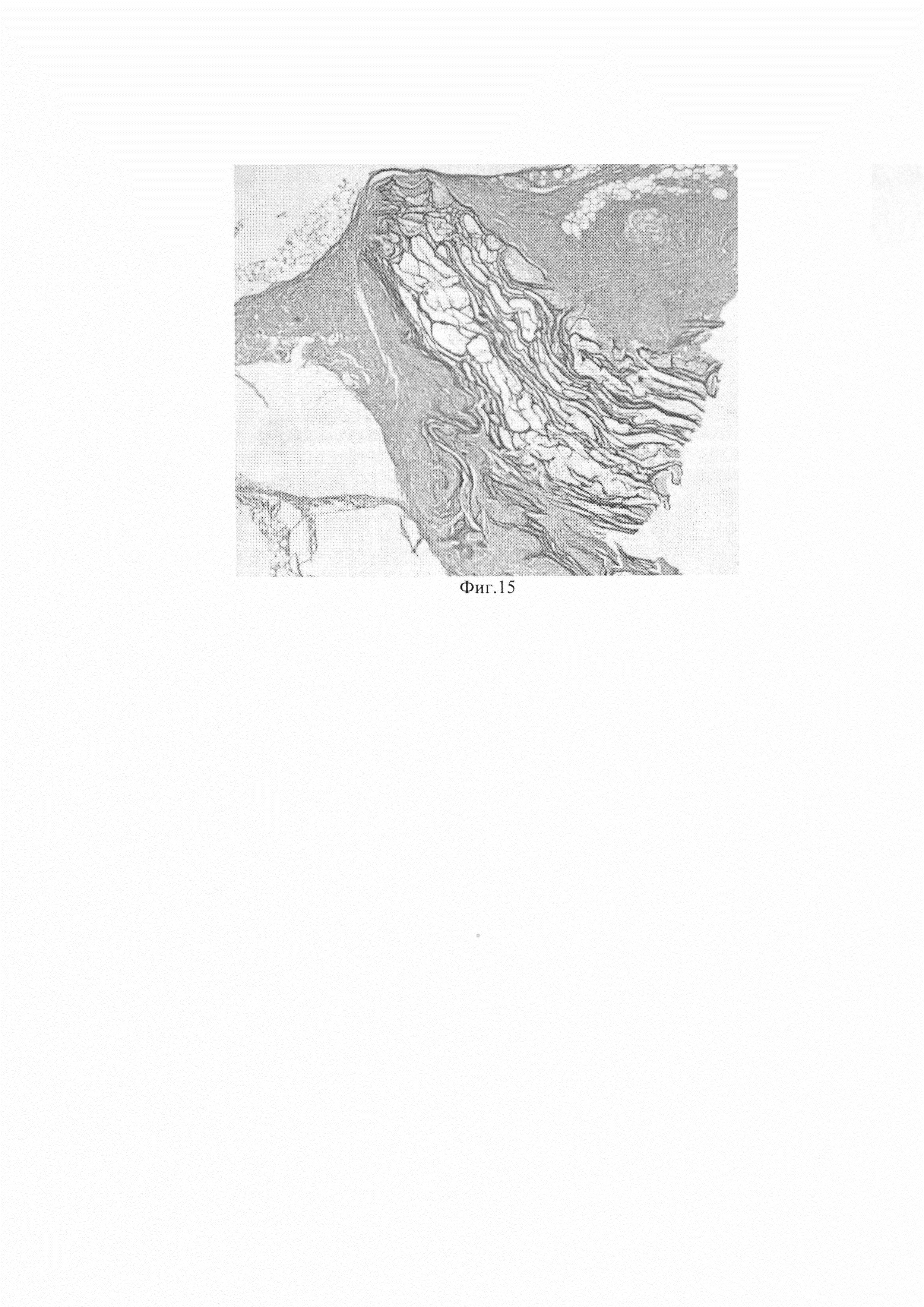
При этом массивной лейкоцитарной инфильтрации и отека в перифокальной области не выявлено (фиг. 15). По краю раны наблюдались крупные очаги молодого коллагена. Спустя 4 недели продукт не обнаруживали в тканях в месте имплантации, что позволяет предполагать практически полную деградацию в тканях без признаков перифокального воспаления.
Таким образом,
- матрикс пуповины человека ускоряет динамику роста клеток эксплантов разных органов разных лабораторных животных, и их выживаемость, что говорит о его митогенных и хемоаттрактивных свойствах;
- бесклеточный матрикс пуповины человека функционирует как структура для прикрепления рекрутированных фибробластоподобных клеток мыши-реципиента и клеток эксплантов органов нескольких видов животных;
- признаков воспалительной реакции (сосудистых реакций, выраженной инфильтрации нейтрофилами и макрофагами) в зоне имплантации матрикса не выявлено, так же как и общих признаков воспаления, что свидетельствует о неиммуногенности тканеинженерного продукта in vivo.
В области регенеративной медицины в последнее время наблюдается тенденция к использованию децеллюляризованного внеклеточного матрикса (ЕСМ) в качестве биологического каркаса для доставки стволовых клеток. Пуповина человека предоставляет ценную как с технической, так и с этической точки зрения возможность получить гомологичный неиммуногенный ЕСМ. Здесь мы установили протокол, позволяющий полностью удалить клеточные мембраны и фрагменты ядер из ткани Вартонова студня (WJ). Потерь структурных компонентов ЕСМ (т.е. коллагенов, гликозаминогликанов) и функциональных регенеративных молекул (ламинина, хондроитинсульфата, факторов роста), утраты пористости замечено не было. Кроме того, не наблюдалось негативного влияния обработки ткани на сохранность макромолекул и структурных компонентов, что обеспечивало, таким образом, подходящую биоактивную матрицу для поддержания клеток после рецеллюляризации.
Нецитотоксичный бесклеточный матрикс децеллюляризованного Вартонова студня пуповины человека может стать идеальным субстратом для адгезии и колонизации стромальных клеток при применении его в виде раневого покрытия при глубоких повреждениях кожи и мягких тканей. Использование матрикса для получения инъекционной формы гидрогеля показало эффективность в восстановлении внутрисуставных дефектов синовиального хряща в эксперименте [26] и, как предполагаем, в регенерации губчатой кости.
Здоровые провизорные органы и ткани являются многообещающими биологическими материалами для изготовления матриксов, поскольку они высокорегенеративны, незатратны и доступны. Среди этих тканей пуповина человека имеет выдающиеся преимущества для тканевой инженерии, выступая в качестве биоактивной платформы для поддержки адгезии, роста и дифференцировки эндогенных (пациент-специфических) клеток. Бесклеточность продукта гомологичного происхождения, подготовленного к хранению в лиофилизированной форме, создает предпосылки для изготовления неиммуногенного нецитотоксичного высокорегенеративного раневого покрытия для восстановления глубоких дефектов кожи и мягких тканей.
Комплекс исследований продукта из пуповины, изготовленного описанным способом, показал его регенеративные свойства и биологические характеристики:
неиммуногенность (благодаря эффективной и щадящей процедуре децеллюляризации и практически полному удалению ДНК) и отсутствие воспалительных реакций при подкожном введении мышам и крысам;
гетеропористость структуры, близкой к структуре внеклеточного матрикса мягких тканей, кожи, суставного хряща;
полнокомпонентность в природных пропорциях и составе: сохранность в бесклеточных продуктах из пуповины важнейших структурных молекул (коллагенов разных типов, гликозаминогликанов, протеогликанов) и функциональных неструктурных молекул (факторов роста эндотелия сосудов, трансформирующих факторов роста-β, многих иных митогенов и факторов дифференцировки);
способность имитировать благоприятную нишу для заселения клетками и быть заселенными пациент-специфическими клетками; установлено как in vitro, так и in vivo;
нецитотоксичность для дермальных фибробластов человека, хемоаттрактивные и пролиферативные свойства для клеток разных органов разных видов животных;
биоактивность в восстановлении синовиального хряща в эксперименте;
биодеградируемость как in vitro, так и in vivo;
продукт может быть заблаговременно изготовлен в сублимированной (лиофилизированной) форме и храним длительное время в условиях (-20°С), логистически незатратны;
продукт может быть эффективно стерилизован ультрафиолетом на финишном этапе изготовления и перед использованием;
потенциально матрикс из пуповины может быть заселен пациент-специфическими или аллогенными клетками в биореакторе перед трансплантацией/имплантацией, и таким образом, представлять собой полноценный клеточный тканеинженерный графт с высокими регенеративными потенциями. Однако при этом он потеряет важные экономические, логистические преимущества бесклеточных высокорегенеративных продуктов.
Сферой применения бесклеточных продуктов из пуповины являются лечение глубоких ран, дефектов суставного хряща и губчатой кости.
Список используемой литературы
1. Готье С.В. Донорство и трансплантация органов в Российской Федерации в 2020 году XIII сообщение регистра Российского трансплантологического общества / С.В. Готье, С.М. Хомяков - DOI 10.15825/1995-1191-2021-2-8-34 // Вестник трансплантологии и искусственных органов. - 2020. - Т. 22, №2. - С. 8-34.
2. Yi S., Ding F., Gong L., Gu X. Extracellular Matrix Scaffolds for Tissue Engineering and Regenerative Medicine. Curr Stem Cell Res Ther. 2017; 12(3): 233-246. https://doi.org/10.2174/1574888X11666160905092513.
3. Cesur N.P. Decellularization of tissues and organs / N.P. Cesur, V. Yalman, N.  - DOI 10.7197/cmj.vi.609592 // Cumhuriyet Medical Journal. - 2020. - Vol. 42, №2. - P. 192-197.
- DOI 10.7197/cmj.vi.609592 // Cumhuriyet Medical Journal. - 2020. - Vol. 42, №2. - P. 192-197.
4. В.H. Александров, А.В. Кривенцов, Г.Г. Хубулава, Л.И. Калюжная-Земляная, Д.В. Фирсанов, А.А. Кондратенко Тканевая инженерия в хирургии сосудов Вестник хирургии им. И.И. Грекова. 2015. Т. 174. №4. С. 108-112.
5. Ghorbani F., Ekhtiari М., Chaghervand В.М., Moradi L., Mohammadi В., Kajbafzadeh A.-M. Detection of the residual concentration of sodium dodecyl sulfate in the decellularized whole rabbit kidney extracellular matrix Cell Tissue Bank (2022) 23:119-128 https://doi.org/10.1007/s10561-021-09921-z.
6. Culme-Seymour EJ, Mason K, Vallejo-Torres L et al (2015) Cost of stem cell-based tissue-engineered airway transplants in the United Kingdom: case series. Tissue Eng Part A 22:208-213.
7. Leung A., Crombleholme T.M., Keswani S.G. Fetal wound healing: implications for minimal scar formation. Curr. Opin. Pediatr. 2015; 24(3): 371-8.
8. Rowlatt U. Intrauterine Wound Healing in a 20 Week Human Fetus.Virchows Arch. A Path. Anat. and Histol. 1979; 381: 353-61.
9. Lo D.D., Zimmermann A.S., Nauta A. et al. Scarless fetal skin wound healing update. Birth Defects Research 2012; 96(PtC): 237-47. или Leung.
10. Калюжная Л.И., Хоминец B.B., Чеботарев С. В. и соавт.Применение биоматериала из пуповины человека для восстановления повреждений суставного хряща. Профилактическая и клиническая медицина 2019; 4(73): 45-52. [Kalyuzhnaya L.I., Khominets V.V., Chebotarev S.V. et al. The use of biomaterial from the human umbilical cord for the restoration of articular cartilage damage. Preventive and clinical medicine 2019; 4(73): 45-52].
11. Dubus, M.; Scomazzon, L.; Chevrier, J.; Ledouble, C; Baldit, A.; Braux, J.; Gindraux, F.; Boulagnon, C; Audonnet, S.; Colin, M.; et al. Antibacterial and Immunomodulatory Properties of Acellular Wharton's Jelly Matrix. Biomedicines 2022, 10,227. https://doi.org/10.3390/biomedicines10020227.
12. Crapo P.M. An overview of tissue and whole organ decellularization processes // P.M. Crapo, T.W. Gilbert, S.F. Badylak https://doi.org/10.1016/j.biomaterials.2011.01.057 //Biomaterials. - 2011. - Vol. 32, №12. - P. 3233-3243.
13. Патент на изобретение №2745995 «Способ изготовления бесклеточного гидрогеля из Вартонова студня пуповины человека для внутрисуставного применения». Приоритет изобретения 16 сентября 2020 г. Калюжная-Земляная Л.И., Чернов В.Е., Чеботарев С.В., Земляной Д.А.
14. Yannas IV, Tzeranis DS, So PTC. Regeneration of injured skin and peripheral nerves requires control of wound contraction, not scar formation. WoundRepairRegen. 2017:25(2): 177-191. https://doi.org/10.1111/wrr.12516.
15. Antich C., Jimenez G., de Vicente J., Lopez-Ruiz E., Chocarro-Wrona C., Grinan-Lisyn C, Carrillo E., Montacez E., Marchal J.A. Development of a Biomimetic Hydrogel Based on Predifferentiated Mesenchymal Stem-Cell-Derived ECM for Cartilage Tissue Engineering Adv. Healthcare Mater. 2021, 2001847 P. 1-17. https://doi.org/10.1002/adhm.202001847.
16. Caputo, W. J., Vaquero, C., Monterosa, A., Monterosa, P., Johnson, E., Beggs, D., et al. (2016). A Retrospective Study of Cryopreserved Umbilical Cord as an Adjunctive Therapy to Promote the Healing of Chronic, Complex Foot Ulcers with Underlying Osteomyelitis. Wound Rep.Reg. 24, 885-893. https://doi.org/10.1111/wrr.12456.
17. Petibois C., Gouspillou G., Wehbe K., Delage J.P., Deleris G. Analysis of type I and IV collagens by FT-IR spectroscopy and imaging for a molecular investigation of skeletal muscle connective tissue Anal Bioanal Chem (2006) 386:1961-1966 https://doi.org/10.1007/s00216-006-0828-0.
18. Belbachir, K., Noreen, R., Gouspillou, G., and Petibois, С.(2009). Collagen Types Analysis and Differentiation by FTIR Spectroscopy. Anal. Bioanal. Chem. 395, 829-837. https://doi.org/10.1007/s00216-009-3019-y.
19. Foot, M., & Mulholland, M. (2005). Classification of chondroitin sulfate A, chondroitin sulfate C, glucosamine hydrochloride and glucosamine 6 sulfate using chemometric techniques. Journal of pharmaceutical and biomedical analysis, 38(3), 397-407. https://doi.org/10.1016/i.ipba.2005.01.026.
20. Keane, T. J., Swinehart, I. Т., and Badylak, S. F. (2015). Methods of Tissue Decellularization Used for Preparation of Biologic Scaffolds and In Vivo Relevance. Methods 84, 25-34. https://doi.org/10.1016/j.ymeth.2015.03.005.
21. Zvarova B, Uhl FE, Uriarte JJ et al (2016) Residual detergent detection method for nondestructive cytocompatibility evaluation of decellularized whole lung scaffolds. Tissue Eng Part С Methods 22:418-428. https://doi.org/10.1089/ten.tec.2015.0439.
22. Cebotari S., Tudorache I., Jaekel Т., Hilfiker A., Dorfman S., Ternes W., Haverich A., Lichtenberg A. Detergent Decellularization of Heart Valves for Tissue Engineering: Toxicological Effects of Residual Detergents on Human Endothelial Cells. Artif Organs, Vol.34, No. 3, 2010, 206-210. https://doi.org/10.1111/j.1525-1594.2009.00796.x.
23. Л.И. Калюжная, M.O. Соколова, B.E. Чернов, Д.А. Земляной, С. В. Чеботарев, Н.И. Чалисова, А.А. Кондратенко, Ю.С Гречаная, Н.В. Едоменко, Э.И. Александер-Синклер. Влияние бесклеточного матрикса пуповины человека на динамику роста и жизнеспособность культивируемых клеток человека и животных ex vivo. Гены & Клетки - 2021. - Т. XVI - №3. - С.72 - 79. https://doi.org/10.23868/202110010.
24. Koci, Z; Vyborny, K; Dubisova, J; Vackova, I; Jager, A; Lunov, Q; Jirakova, K; Kubinova, S. Extracellular Matrix Hydrogel Derived from Human Umbilical Cord as a Scaffold for Neural Tissue Repair and Its Comparison with Extracellular Matrix from Porcine Tissues TISSUE ENGINEERING PART C-METHODS 2017Том:23 Выпуск: 6 Стр.: 333-345 https://doi.org/10.1089/ten.tec.2017.0089.
25. Директива Европейского парламента и Совета Европейского Союза 2010/63/ЕС от 22 сент. 2010 г. о защите животных, использующихся для научных целей [Электронный ресурс] // Гарант: информационно-правовое обеспечение. - Режим доступа: http://base.garant.ru/70350564/ce210ed70e5daealed719396b4dabe87/ (дата обращения: 22.02.2022 г.
26. Чеботарев СВ., Калюжная Л.И., Хоминец В.В., Чернов В.Е., Фрумкина А.С, Земляной Д.А., Шайтор В.М., Товпеко Д.В., Малеков Д.А., Протасов О.В. Регенеративные эффекты гидрогеля из биоматериала пуповины человека в восстановлении повреждений суставного хряща // Клиническая и экспериментальная хирургия. Журнал имени академика Б.В. Петровского. 2020. Т. 8, №4. С 119-125. https://doi.org/10.33029/2308-1198-2020-8-4-119-125.