Результат интеллектуальной деятельности: БИОМАРКЕРЫ ИММУННОЙ ТОЛЕРАНТНОСТИ, ИНДУЦИРОВАННОЙ МЕТОТРЕКСАТОМ
Вид РИД
Изобретение
[1] Данная заявка заявляет приоритет предварительной заявки США № 62/609986, поданной 22 декабря 2017 года, которая включена в данный документ посредством ссылки во всей своей полноте.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[2] Настоящее изобретение в целом относится к иммунологии и, в частности, к способам лечения субъекта с помощью терапевтического средства и оценивания иммунной толерантности к терапевтическому средству, индуцированной метотрексатом, основанным на выявления биомаркеров эритропоэза.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
[3] Метотрексат имеет давнюю историю применения в лечении злокачественных и аутоиммунных заболеваний (см., например, Kremer 2004). Впервые он был описан для лечения рака в 1940-х годах, и высокодозовые курсы метотрексата продолжают использовать для лечения ряда неопластических состояний. При аутоиммунных состояниях среди прочего продолжительное еженедельное низкодозовое введение метотрексата используют для лечения таких заболеваний, как ревматоидный артрит и псориаз (рассматривается в Cronstein 2005; Taylor et al., 2008). Более поздние исследования, однако, выявили альтернативное применение метотрексата для индуцирования иммунной толерантности. Было показано, что схема низкодозового введения метотрексата кратковременным курсом для индуцирования иммунной толерантности (ITI) индуцирует иммунную толерантность к видам ферментозаместительной терапии (ERT), например с помощью рекомбинантной кислой α-глюкозидазы человека (rhGAA, алглюкозидаза альфа) (Garman, Munroe et al., 2004; Joseph, Munroe et al., 2008). Также было показано, что одновременное проведение низкодозового кратковременного лечения метотрексатом и терапевтическим биопрепаратом вызывает длительную иммунную толерантность к биопрепарату, что продемонстрировано на мышином антитимоцитарном глобулине, используемом для лечения отторжения трансплантата при аллогенной трансплантации сердца (Joseph, Neff et al., 2012). В клинических наблюдениях у пациентов с классической инфантильной формой болезни Помпе с высоким риском протокол иммунной толерантности, в котором метотрексат кратковременным курсом в низких дозах вводили совместно с ритуксимабом (моноклональным антителом, которое истощает В-клетки) и необязательно с внутривенным введением иммуноглобулина (IVIG), демонстрировал успех в обеспечении длительного снижения уровня антител к лекарственному средству (ADA) rhGAA (Mendelsohn, Messinger et al. 2009, Messinger, Mendelsohn et al. 2012, Banugaria, Prater et al. 2013). Поскольку ритуксимаб отдельно, как правило, был не способен воспроизводимо индуцировать долгосрочную иммунную толерантность, считается, что метотрексат способствует успешной иммунной толерантности в указанной клинической схеме (Franchini, Mengoli et al., 2008, Collins, Mathias et al. 2009).
[4] Болезнь Помпе вызывается дефицитом гена лизосомной кислой α-глюкозидазы (GAA). У пациентов с классической инфантильной формой болезни Помпе с высоким риском отсутствует эндогенная GAA, фермент, который расщепляет гликоген в лизосоме. Отсутствие функциональной GAA приводит к нервно-мышечной патологии, которая возникает вследствие чрезмерного накопления гликогена в мышечной ткани. В отсутствие лечения прогрессирование заболевания у этих пациентов происходит быстро, с повреждением мышц (миопатия), с возникновением респираторной слабости, что в конечном итоге требует инвазивной вентиляции, приводит к сердечной недостаточности и смерти, как правило, в течение первого года жизни. Ферментозаместительная терапия с применением rhGAA является эффективной в лечении болезни Помпе (Kishnani, Corzo et al., 2007). Однако монотерапия rhGAA у пациентов с классической инфантильной формой болезни Помпе с высоким риском обычно индуцирует высокие титры ADA к rhGAA, что влияет на эффективность лечения. До настоящего времени длительную иммунную толерантность к rhGAA успешно индуцировали в клинических исследованиях у нескольких пациентов с классической инфантильной формой болезни Помпе посредством совместного введения метотрексата кратковременным курсом в низких дозах с ритуксимабом и IVIG. В этих исследованиях пациенты характеризовались отсутствием ADA в течение более 35 месяцев при продолжающемся лечении (Mendelsohn, Messinger et al., 2009; Messinger, Mendelsohn et al., 2012; Banugaria, Prater et al., 2013). Тем не менее степень иммунной модуляции, необходимая для смягчения ADA-ответов, варьировала среди пациентов в зависимости от предшествующей ферментозаместительной терапии: пациентам, которые ранее получали ERT до лечения для обеспечения иммунной толерантности, требовалась дополнительная иммунная модуляция (Messinger, Mendelsohn et al., 2012). Несмотря на то, что количество клинических наблюдений по-прежнему ограничено, ясно, что успешная ERT у пациентов с инфантильной формой болезни Помпе с высоким риском будет тем успешней, чем раньше достигается иммунная толерантность при ERT для ограничения развития и потенциального нарушения ADA иммунного ответа в отношении rhGAA (Banugaria, Prater et al., 2013). Однако средства, доступные для мониторинга иммунной толерантности с целью управления иммуномодулирующей терапией, могут иметь ограниченную применимость для соответствующих пациентов: антитела к лекарственным средствам являются основными маркерами степени толерантности (или ее отсутствия), но такие антитела, как правило, не появляются в течение периода от нескольких недель до месяцев после начала лечения терапевтическим биопрепаратом. В этот момент, возможно, уже было потеряно критическое время для эффективного стимулирования и поддержания иммунной толерантности. Отсутствие маркеров иммунной толерантности, возникающих на ранних этапах терапии, вызывает особую обеспокоенность у таких пациентов, как пациенты с инфантильной формой болезни Помпе с высоким риском, которые характеризуются быстрым ухудшением при отсутствии эффективной терапии.
[5] Соответственно, существует потребность в улучшенных способах оценки иммунной толерантности (например, раннее индуцирование иммунной толерантности) для управления стратегиями снижения нежелательного иммунного ответа у пациентов, получающих терапевтические средства, способные вызывать иммунные ответы, в том числе терапевтические биопрепараты, такие как rhGAA, при болезни Помпе.
[6] Раскрытия всех публикаций, патентов, патентных заявок и опубликованных патентных заявок, упомянутых в настоящем документе, включены в настоящий документ посредством ссылки во всей их полноте.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[7] В настоящем изобретении предложены способы лечения и способы оценки уровня иммунной толерантности к терапевтическому средству на основе выявления биомаркера эритропоэза.
[8] Соответственно, в одном аспекте настоящей заявки представлен способ лечения субъекта, нуждающегося в лечении терапевтическим средством, предусматривающий: (a) введение субъекту эффективного количества метотрексата; (b) введение субъекту эффективного количества терапевтического средства; (c) выявление биомаркера эритропоэза в образце, полученном от субъекта в период времени от по меньшей мере одного дня до приблизительно 30 дней после введения метотрексата; и (d) продолжение дальнейшего лечения с помощью терапевтического средства с проведением или без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии исходя из уровня биомаркера эритропоэза по сравнению с таким уровнем в контроле. В некоторых вариантах осуществления изменение уровня биомаркера эритропоэза ассоциировано с индуцированием эритропоэза. В некоторых вариантах осуществления, где если уровень биомаркера эритропоэза примерно равен такому уровню в контроле или ниже его, то стадия (d) предусматривает проведение дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии одновременно с дальнейшим лечением с помощью терапевтического средства; или где если уровень биомаркера эритропоэза повышен по сравнению с таким уровнем в контроле, то стадия (d) предусматривает продолжение дальнейшего лечения с помощью терапевтического средства без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии. В некоторых вариантах осуществления, где если уровень биомаркера эритропоэза практически повышен по сравнению с таким уровнем в контроле, то стадия (d) предусматривает проведение дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии одновременно с дальнейшим лечением с помощью терапевтического средства; или где если уровень биомаркера эритропоэза равен такому уровню в контроле или ниже его, то стадия (d) предусматривает продолжение дальнейшего лечения с помощью терапевтического средства без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии.
[9] В некоторых вариантах осуществления представлен способ лечения субъекта, нуждающегося в лечении терапевтическим средством, предусматривающий: (a) введение субъекту эффективного количества метотрексата; (b) введение субъекту эффективного количества терапевтического средства; (c) выявление биомаркера эритропоэза в образце, полученном от субъекта в период времени от по меньшей мере одного дня до приблизительно 30 дней после введения метотрексата; (d) если уровень биомаркера эритропоэза примерно равен такому уровню в контроле или ниже его, проведение дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии одновременно с дальнейшим лечением с помощью терапевтического средства; или (e) если уровень биомаркера эритропоэза повышен по сравнению с таким уровнем в контроле, продолжение дальнейшего лечения с помощью терапевтического средства без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии. В некоторых вариантах осуществления биомаркер эритропоэза представляет собой уровень содержания незрелых ядерных форм эритроцитов, фракции незрелых ретикулоцитов или клеточных нуклеиновых кислот. В некоторых вариантах осуществления, если уровень незрелых ядерных форм эритроцитов исходно снижается до того, как уровень незрелых ядерных форм эритроцитов повысится, дальнейшее лечение с помощью терапевтического средства продолжают без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии. В некоторых вариантах осуществления, где метотрексат вводят в одном цикле, уровень незрелых ядерных форм эритроцитов при этом снижается за приблизительно один, приблизительно два, приблизительно три, приблизительно четыре, приблизительно пять, приблизительно шесть или приблизительно семь дней до того, как уровень незрелых ядерных форм эритроцитов становится повышенным. В некоторых вариантах осуществления, где метотрексат вводят в двух или более циклах, уровень незрелых ядерных форм эритроцитов при этом снижается за период времени от приблизительно одного до приблизительно 14 дней до того, как уровень незрелых ядерных форм эритроцитов становится повышенным. В некоторых вариантах осуществления, где метотрексат вводят в двух, трех, четырех, пяти или более циклах, уровень незрелых ядерных форм эритроцитов при этом снижается за период времени от приблизительно одного до приблизительно 14 дней до того, как уровень незрелых ядерных форм эритроцитов становится повышенным.
[10] В некоторых вариантах осуществления представлен способ лечения субъекта, нуждающегося в лечении терапевтическим средством, предусматривающий: (a) введение субъекту эффективного количества метотрексата; (b) введение субъекту эффективного количества терапевтического средства; (c) выявление биомаркера эритропоэза в образце, полученном от субъекта в период времени от по меньшей мере одного дня до приблизительно 30 дней после введения метотрексата; (d) если уровень биомаркера эритропоэза практически повышен по сравнению с таким уровнем в контроле, проведение дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии одновременно с дальнейшим лечением с помощью терапевтического средства; или (e) если уровень биомаркера эритропоэза равен такому уровню в контроле или ниже его, продолжение дальнейшего лечения с помощью терапевтического средства без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии. В некоторых вариантах осуществления биомаркером эритропоэза является гематокрит.
[11] В некоторых вариантах осуществления согласно любому из способов, описанных выше, выявление биомаркера эритропоэза представляет собой выявление экспрессии гена, ассоциированного с эритропоэзом, где ген, ассоциированный с эритропоэзом, представляет собой ген, ассоциированный с одним или несколькими из гемопоэза, гомеостаза ионов железа, регуляции дифференцировки эритроцитов и метаболизма гема. В некоторых вариантах осуществления ген, ассоциированный с эритропоэзом, представляет собой ген, кодирующий рецептор трансферрина, трансферрин, Ly76 (антиген для Ter-119), CD44, CD235a, ALAS2 или GATA-1. В некоторых вариантах осуществления рецептор трансферрина представляет собой рецептор трансферрина 1 (CD71). В некоторых вариантах осуществления выявление гена, ассоциированного с эритропоэзом, предусматривает выявление РНК-транскрипта гена, ассоциированного с эритропоэзом, или выявление белкового продукта гена, ассоциированного с эритропоэзом. В некоторых вариантах осуществления белковый продукт представляет собой гемоглобин.
[12] В некоторых вариантах осуществления в соответствии с любым из способов, описанных выше, биомаркер эритропоэза представляет собой кофактор, ассоциированный с эритропоэзом. В некоторых вариантах осуществления кофактором, ассоциированным с эритропоэзом, является порфирин, порфиринсодержащее соединение или тетрапиррол.
[13] В некоторых вариантах осуществления согласно любому из способов, описанных выше, терапевтическое средство представляет собой полипептид, нуклеиновую кислоту, вирус, средство генной терапии, липид, липосому или углевод. В некоторых вариантах осуществления терапевтическое средство является терапевтическим полипептидом. В некоторых вариантах осуществления терапевтический полипептид представляет собой антитело или его антигенсвязывающий фрагмент. В некоторых вариантах осуществления антитело является моноклональным антителом. В некоторых вариантах осуществления антитело представляет собой средство, истощающее лимфоциты. В некоторых вариантах осуществления антитело представляет собой алемтузумаб. В некоторых вариантах терапевтический полипептид является ферментом. В некоторых вариантах осуществления фермент представляет собой альфа-галактозидазу А человека. В некоторых вариантах осуществления фермент представляет собой кислую α-глюкозидазу человека.
[14] В некоторых вариантах осуществления согласно любому из способов, описанных выше, у субъекта имеется лизосомная болезнь накопления. В некоторых вариантах осуществления у субъекта имеется болезнь Помпе. В некоторых вариантах осуществления у субъекта имеется инфантильная форма болезни Помпе, например, классическая инфантильная форма болезни Помпе. В некоторых вариантах осуществления болезнь Помпе является отрицательной по перекрестно-реагирующему иммунологическому материалу (CRIM). В некоторых вариантах осуществления способ дополнительно предусматривает проведение начальной терапии для индуцирования иммунной толерантности одновременно с введением терапевтического средства, где терапевтическое средство представляет собой кислую α-глюкозидазу человека. В некоторых вариантах осуществления начальная терапия для индуцирования иммунной толерантности предусматривает введение одного или нескольких из ритуксимаба и IVIG.
[15] В некоторых вариантах осуществления представлен способ лечения болезни Помпе у нуждающегося в этом субъекта (например, у человека), предусматривающий: (a) введение субъекту эффективного количества метотрексата; (b) введение субъекту эффективного количества кислой α-глюкозидазы человека; (c) выявление биомаркера эритропоэза в образце, полученном от субъекта в период времени от по меньшей мере одного дня до приблизительно 30 дней после введения метотрексата; (d) если уровень биомаркера эритропоэза примерно равен такому уровню в контроле или ниже его, проведение дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии одновременно с дальнейшим лечением с помощью кислой α-глюкозидазы человека; или (e) если уровень биомаркера эритропоэза повышен по сравнению с таким уровнем в контроле, продолжение дальнейшего лечения с помощью кислой α-глюкозидазы человека без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии. В некоторых вариантах осуществления биомаркер эритропоэза представляет собой уровень содержания незрелых ядерных форм эритроцитов, фракции незрелых ретикулоцитов или клеточных нуклеиновых кислот. В некоторых вариантах осуществления, если уровень незрелых ядерных форм эритроцитов исходно снижается до того, как уровень незрелых ядерных форм эритроцитов повысится, дальнейшее лечение с помощью терапевтического средства продолжают без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии. В некоторых вариантах осуществления, где метотрексат вводят в одном цикле, уровень незрелых ядерных форм эритроцитов при этом снижается за приблизительно один, приблизительно два, приблизительно три, приблизительно четыре, приблизительно пять, приблизительно шесть или приблизительно семь дней до того, как уровень незрелых ядерных форм эритроцитов становится повышенным. В некоторых вариантах осуществления, где метотрексат вводят в двух или более циклах, уровень незрелых ядерных форм эритроцитов при этом снижается за период времени от приблизительно одного до приблизительно 14 дней до того, как уровень незрелых ядерных форм эритроцитов становится повышенным. В некоторых вариантах осуществления, где метотрексат вводят в двух, трех, четырех, пяти или более циклах, уровень незрелых ядерных форм эритроцитов при этом снижается за период времени от приблизительно одного до приблизительно 14 дней до того, как уровень незрелых ядерных форм эритроцитов становится повышенным.
[16] В некоторых вариантах осуществления представлен способ лечения болезни Помпе у нуждающегося в этом субъекта (например, у человека), предусматривающий: (a) введение субъекту эффективного количества метотрексата; (b) введение субъекту эффективного количества кислой α-глюкозидазы человека; (c) выявление биомаркера эритропоэза в образце, полученном от субъекта в период времени от по меньшей мере одного дня до приблизительно 30 дней после введения метотрексата; (d) если уровень биомаркера эритропоэза практически повышен по сравнению с таким уровнем в контроле, проведение дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии одновременно с дальнейшим лечением с помощью кислой α-глюкозидазы человека; или (e) если уровень биомаркера эритропоэза равен такому уровню в контроле или ниже его, продолжение дальнейшего лечения с помощью кислой α-глюкозидазы человека без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии. В некоторых вариантах осуществления биомаркером эритропоэза является гематокрит. В некоторых вариантах осуществления выявление биомаркера эритропоэза представляет собой выявление экспрессии гена, ассоциированного с эритропоэзом, где ген, ассоциированный с эритропоэзом, представляет собой ген, ассоциированный с одним или несколькими из гемопоэза, гомеостаза ионов железа, регуляции дифференцировки эритроцитов и метаболизма гема. В некоторых вариантах осуществления выявление гена, ассоциированного с эритропоэзом, предусматривает выявление РНК-транскрипта гена, ассоциированного с эритропоэзом, или выявление белкового продукта гена, ассоциированного с эритропоэзом. В некоторых вариантах осуществления белковый продукт представляет собой гемоглобин.
[17] В некоторых вариантах осуществления представлен способ лечения болезни Помпе у нуждающегося в этом субъекта (например, у человека), предусматривающий: (a) введение субъекту эффективного количества метотрексата; (b) введение субъекту эффективного количества кислой α-глюкозидазы человека; (c) выявление биомаркера эритропоэза в образце, полученном от субъекта в период времени от по меньшей мере одного дня до приблизительно 30 дней после введения метотрексата; (d) если уровень биомаркера эритропоэза примерно равен такому уровню в контроле или ниже его, проведение дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии одновременно с дальнейшим лечением с помощью кислой α-глюкозидазы человека; или (e) если уровень биомаркера эритропоэза повышен по сравнению с таким уровнем в контроле, продолжение дальнейшего лечения с помощью кислой α-глюкозидазы человека без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии. В некоторых вариантах осуществления выявление биомаркера эритропоэза представляет собой выявление экспрессии гена, ассоциированного с эритропоэзом, где ген, ассоциированный с эритропоэзом, представляет собой ген, ассоциированный с одним или несколькими из гемопоэза, гомеостаза ионов железа, регуляции дифференцировки эритроцитов и метаболизма гема. В некоторых вариантах осуществления ген, ассоциированный с эритропоэзом, представляет собой ген, кодирующий рецептор трансферрина, трансферрин, Ly76 (антиген для Ter-119), CD44, CD235a, ALAS2 или GATA-1. В некоторых вариантах осуществления рецептор трансферрина представляет собой рецептор трансферрина 1 (CD71). В некоторых вариантах осуществления выявление гена, ассоциированного с эритропоэзом, предусматривает выявление РНК-транскрипта гена, ассоциированного с эритропоэзом, или выявление белкового продукта гена, ассоциированного с эритропоэзом. В некоторых вариантах осуществления биомаркер эритропоэза представляет собой кофактор, ассоциированный с эритропоэзом. В некоторых вариантах осуществления кофактором, ассоциированным с эритропоэзом, является порфирин, порфиринсодержащее соединение или тетрапиррол.
[18] В некоторых вариантах осуществления в соответствии с любым из способов лечения болезни Помпе, описанных выше, болезнь Помпе представляет собой инфантильную форму болезни Помпе. В некоторых вариантах осуществления болезнь Помпе представляет собой классическую инфантильную форму болезни Помпе. В некоторых вариантах осуществления субъект является CRIM-отрицательным.
[19] В некоторых вариантах осуществления в соответствии с любым из способов лечения болезни Помпе способ дополнительно предусматривает проведение мониторинга относительно одного или нескольких из уровня антитела к кислой α-глюкозидазе человека, уровня CD19 или прогрессирования заболевания.
[20] В некоторых вариантах осуществления в соответствии с любым из способов, описанных выше, образец представляет собой образец крови. В некоторых вариантах осуществления образец крови представляет собой фракцию крови, содержащую мононуклеарные клетки периферической крови (РВМС). В некоторых вариантах осуществления образец крови представляет собой образец сыворотки крови или образец плазмы крови, и выявление биомаркера представляет собой выявление экспрессии гена, ассоциированного с эритропоэзом.
[21] В некоторых вариантах осуществления в соответствии с любым из способов, описанных выше, контроль представляет собой исторический контроль или плацебо-контроль.
[22] В некоторых вариантах осуществления в соответствии с любым из способов, описанных выше, субъект является человеком.
[23] В некоторых вариантах осуществления в соответствии с любым из способов, описанных выше, эффективное количество метотрексата вводят в одном цикле или в трех циклах. В некоторых вариантах осуществления метотрексат вводят в одном цикле. В некоторых вариантах осуществления метотрексат вводят в двух, трех, четырех, пяти или более циклов. В некоторых вариантах осуществления цикл метотрексата состоит из 1 дня введения метотрексата или 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 последовательных дней введения метотрексата.
[24] В некоторых вариантах осуществления в соответствии с любым из способов, описанных выше, метотрексат вводят субъекту в момент времени, выбранный из одного или нескольких из моментов до, в ходе и после введения терапевтического средства. В некоторых вариантах осуществления метотрексат вводят в период времени от 48 часов до проведения лечения терапевтическим средством до 48 часов после этого. В некоторых вариантах осуществления метотрексат вводят одновременно с введением терапевтического средства и через приблизительно 24 часа и приблизительно 48 часов после введения терапевтического средства.
[25] В некоторых вариантах осуществления в соответствии с любым из способов, описанных выше, метотрексат вводят в дозе, составляющей от приблизительно 0,1 мг/кг до приблизительно 5 мг/кг.
[26] В некоторых вариантах осуществления в соответствии с любым из способов, описанных выше, образец получают от субъекта в промежутке времени от по меньшей мере одного дня до приблизительно 30 дней после последнего введения метотрексата. В некоторых вариантах осуществления образец получают от субъекта в промежутке времени от приблизительно 7 дней до приблизительно 14 дней после последнего введения метотрексата. В некоторых вариантах осуществления образцы получают в течение нескольких дней после последнего введения метотрексата. В некоторых вариантах осуществления образец получают в один или несколько моментов времени из дня 1, дня 2, дня 3, дня 4, дня 5, дня 6, дня 7, дня 14, дня 21 или дня 28 после последнего введения метотрексата.
[27] В некоторых вариантах осуществления в соответствии с любым из способов, описанных выше, стадия (d) дополнительно предусматривают введение средства, которое истощает Т-клетки, В-клетки или плазматические клетки. В некоторых вариантах осуществления средством, которое истощает плазматические клетки, является бортезомиб. В некоторых вариантах осуществления стадия (d) предусматривает одно или несколько из следующего: (a) введение эффективного количества одного или нескольких из ритуксимаба, внутривенного иммуноглобулина (IVIG), циклофосфамида, бортезомиба, азатиоприна, циклоспорина, микофенолата и кортикостероида и (b) применение стратегии формирования антигенспецифической толерантности. В некоторых вариантах осуществления стратегия формирования антигенспецифической толерантности предусматривает более частое введение доз терапевтического средства или более высокую дозу терапевтического средства или как первое, так и второе. В некоторых вариантах осуществления более высокую дозу терапевтического средства вводят одновременно с IVIG.
[28] В одном аспекте настоящей заявки представлен способ оценивания уровня иммунной толерантности у субъекта с болезнью Помпе, предусматривающий: (a) получение образца от субъекта, где субъекту ранее проводили по меньшей мере один цикл лечения метотрексатом и по меньшей мере одной дозой терапевтического средства; и (b) выявление биомаркера эритропоэза в образце, где уровень биомаркера эритропоэза в образце по сравнению с таким уровнем в контроле свидетельствует об индуцировании иммунной толерантности. В некоторых вариантах осуществления стадия (b) предусматривает приведение в контакт образца со средством, которое связывается с биомаркером эритропоэза.
[29] В одном аспекте настоящей заявки представлен способ оценивания уровня иммунной толерантности к терапевтическому средству у субъекта, нуждающегося в терапевтическом средстве, предусматривающий: (a) введение субъекту эффективного количества метотрексата; (b) введение субъекту эффективного количества терапевтического средства; и (c) выявление биомаркера эритропоэза в образце, полученном от субъекта, где уровень биомаркера эритропоэза в образце по сравнению с таким уровнем в контроле свидетельствует об индуцировании иммунной толерантности у субъекта к терапевтическому средству.
[30] В одном аспекте настоящей заявки представлен способ оценивания уровня иммунной толерантности к терапевтическому средству у субъекта, нуждающегося в терапевтическом средстве, предусматривающий: (a) введение субъекту эффективного количества метотрексата; (b) введение субъекту эффективного количества терапевтического средства; (c) выявление биомаркера эритропоэза в образце, полученном от субъекта в период времени от по меньшей мере одного дня до приблизительно 30 дней после введения метотрексата; и (d) определение уровня иммунной толерантности к терапевтическому средству у субъекта исходя из уровня биомаркера, выявленного на стадии с).
[31] В некоторых вариантах осуществления в соответствии с любым из способов оценивания, описанных выше, изменение уровня биомаркера эритропоэза ассоциировано с индуцированием эритропоэза. В некоторых вариантах осуществления, если уровень биомаркера эритропоэза примерно равен такому уровню в контроле или ниже его, то субъект нуждается в дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии одновременно с дальнейшим лечением с помощью терапевтического средства; или если уровень биомаркера эритропоэза повышен по сравнению с таким уровнем в контроле, то субъект не нуждается в дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии. В некоторых вариантах осуществления, если уровень биомаркера эритропоэза практически повышен по сравнению с таким уровнем в контроле, то субъект нуждается в дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии одновременно с дальнейшим лечением с помощью терапевтического средства; или где если уровень биомаркера эритропоэза равен такому уровню в контроле или ниже его, то субъект не нуждается в дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии.
[32] Кроме того, представлены композиции, наборы и изделия для применения в любом из способов, описанных в данном документе.
[33] Эти и другие аспекты и преимущества настоящего изобретения станут очевидными из следующего подробного описания и прилагаемой формулы изобретения. Следует понимать, что один, несколько или все признаки различных вариантов осуществления, описанных в данном документе, можно комбинировать с получением других вариантов осуществления настоящего изобретения.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[34] Файл с данным патентом или данной заявкой содержит как минимум один графический материал, выполненный в цвете. Копии данного патента или публикации патентной заявки с цветным (цветными) графическим (графическими) материалом (материалами) будут представлены патентным ведомством по запросу и при оплате необходимого взноса.
[35] На фиг. 1А показана тепловая карта подмножества уровней экспрессии генов, ассоциированных с эритропоэзом, в образцах селезенки мышей в разных экспериментальных группах.
[36] На фиг. 1В показана тепловая карта подмножества уровней экспрессии генов, ассоциированных с эритропоэзом, в образцах крови мышей в разных экспериментальных группах. От четырех до девяти групп C57BL/6 мышей/группа подвергали обработке с помощью rhGAA с низкой дозой метотрексата и без нее, как это описано в примере 1. Включили экспериментальные контрольные группы мышей, которых подвергали обработке FB (буфером для составления) с метотрексатом и без него. В день 7 от начала введения rhGAA образцы селезенки (A) и крови (B) исследовали с помощью РНК-секвенирования на Illumina HISEQ2000® после РНК-амплификации. Показанные гены являются подмножеством общей совокупности генов, которые ассоциированы с эритропоэзом. Наборы данных РНК-секвенирования подвергали скринингу на дифференциальную экспрессию с кратностью изменения (FC) ≥2 и p-значением ≤0,05. Красным обозначены гены с высокой степенью повышающей регуляции, тогда как синим обозначены гены с понижающей регуляцией. Результаты демонстрируют, что иллюстративная схема низкодозового введения метотрексата кратковременным курсом усиливает транскрипционные сигнатуры при эритропоэзе в селезенке и крови.
[37] На фиг. 1C показана схема дизайна исследования, описанного в примерах 1-4.
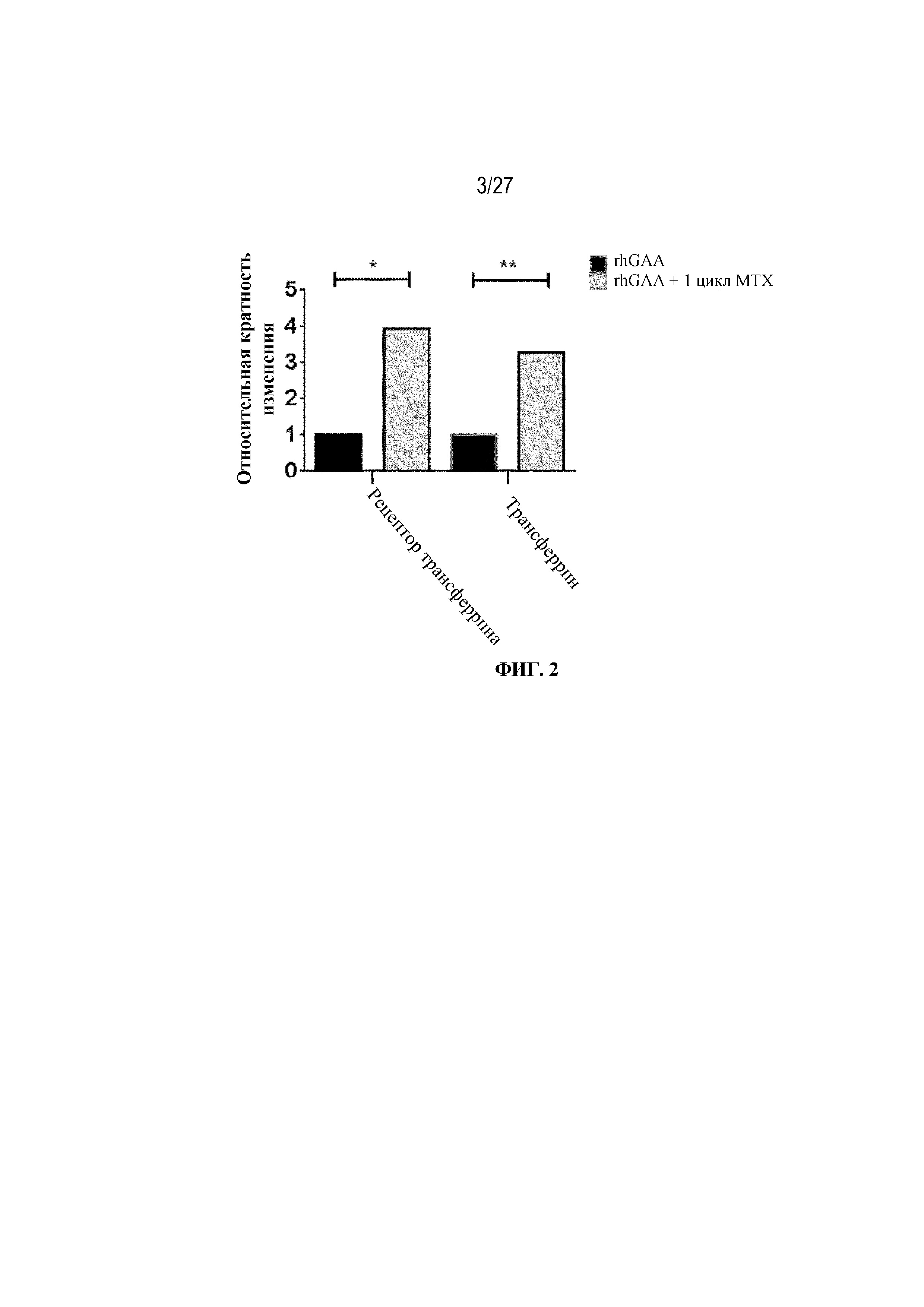
[38] На фиг. 2 показана повышающая регуляция трансферрина и рецептора трансферрина 1 в селезенке в ответ на иллюстративную схему низкодозового введения метотрексата кратковременным курсом. Восемь групп C57BL/6 мышей/группа подвергали обработке с помощью rhGAA в отсутствие или в присутствии иллюстративной схемы низкодозового введения метотрексата кратковременным курсом, как это описано в примере 1. В день 7 от начала введения rhGAA образцы селезенки и крови исследовали с помощью LC/масс-спектрометрического анализа белка. Дифференциально экспрессированные гены подвергали скринингу с FC ≥2 и р-значением ≤0,05.
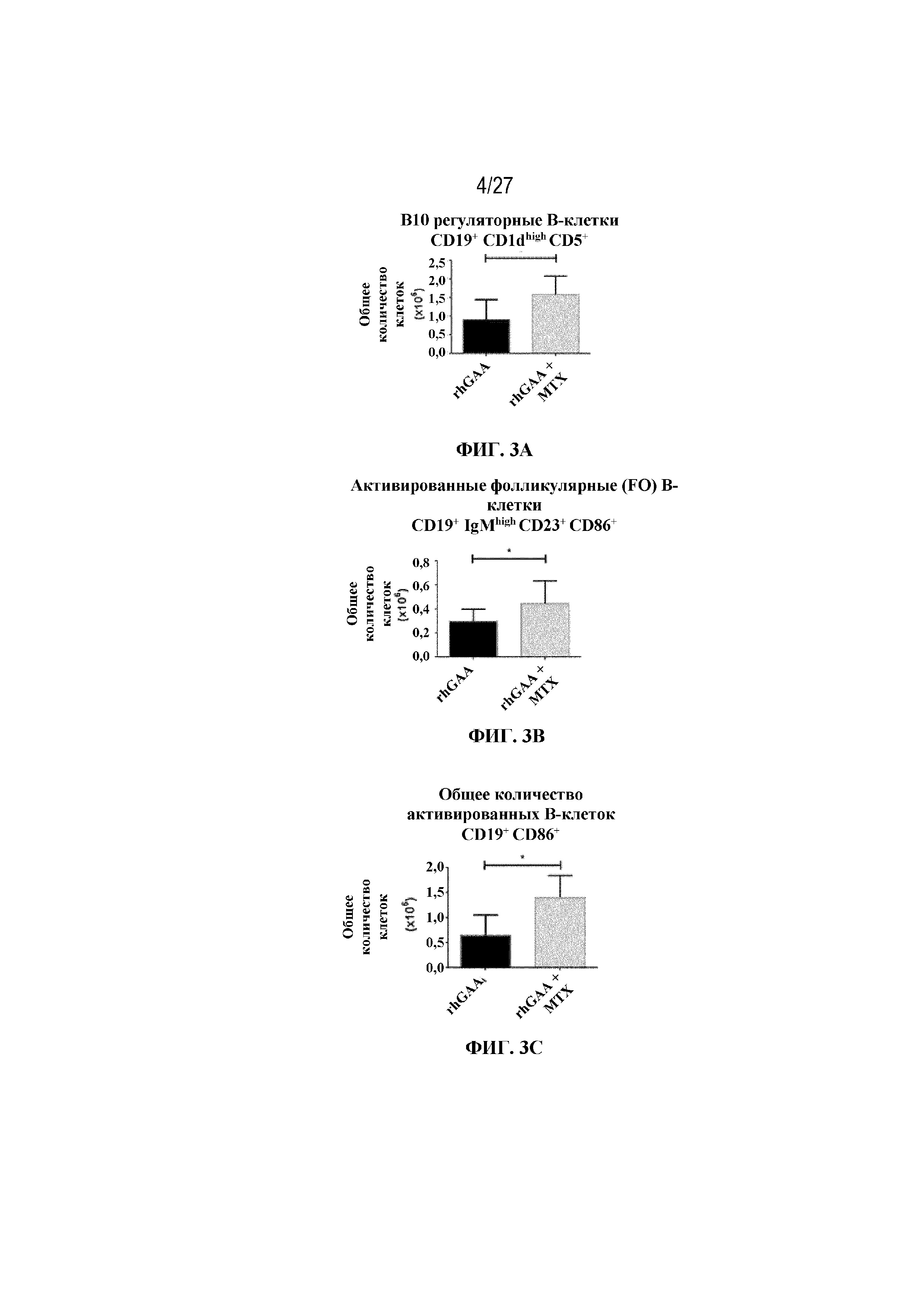
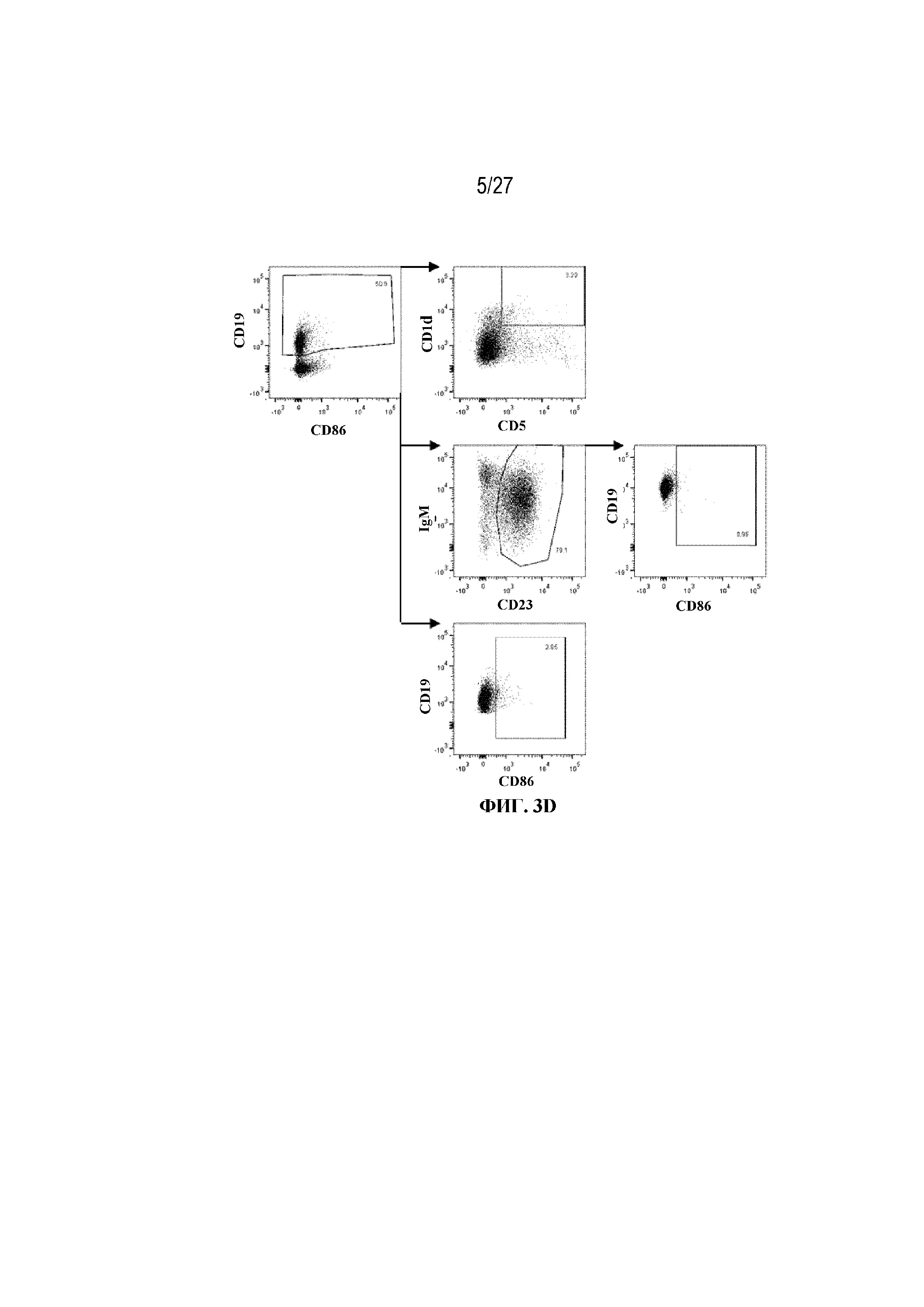
[39] На фиг. 3А показаны значительное накопление В10 регуляторных В-клеток в группе rhGAA+MTX. На фиг. 3B показано значительное накопление активированных фолликулярных (FO) B-клеток в группе rhGAA+MTX. На фиг. 3C показано значительное накопление общих активированных B-клеток в группе rhGAA+MTX. На фиг. 3D показана стратегия гейтирования в проточной цитометрии для отбора для живых CD19+. Отобранные последовательным гейтированием B10 регуляторные B-клетки (вверху: CD19+, CD1dhigh CD5+), активированные фолликулярные B-клетки (второй ряд: CD19+, IgMlow/high CD23+, CD86+), а также общие активированные B-клетки (внизу: CD19+ CD86+). От четырех до десяти C57BL/6 или C57BL/6NTac мышей/группа подвергали обработке с помощью только rhGAA или вместе с одним циклом введения метотрексата в низких дозах, как это описано в примере 1. Через семь дней от начала введения rhGAA селезенки извлекали посмертно, гомогенизировали в суспензии отдельных клеток, подвергали лизису RBC и исследовали проточной цитометрией, как это описано в примере 2. Эти данные получены в трех или более отдельных экспериментах. Анализы проводили с использованием t-критериев Стьюдента, и значимость приведена как * ≤0,05. Обогащенные субпопуляции В-клеток продемонстрировали паттерны иммунной толерантности после лечения обработки метотрексатом в низких дозах.
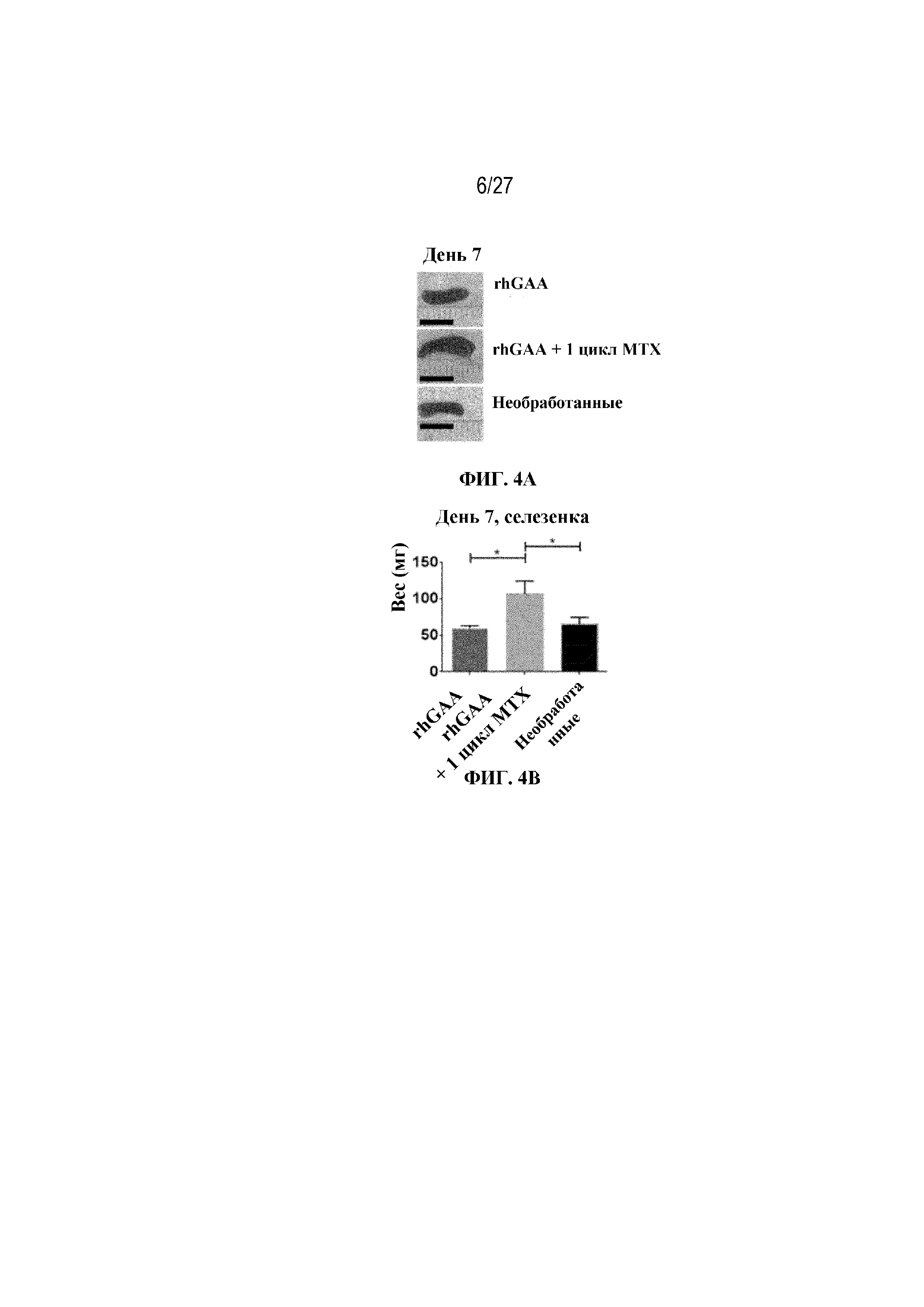
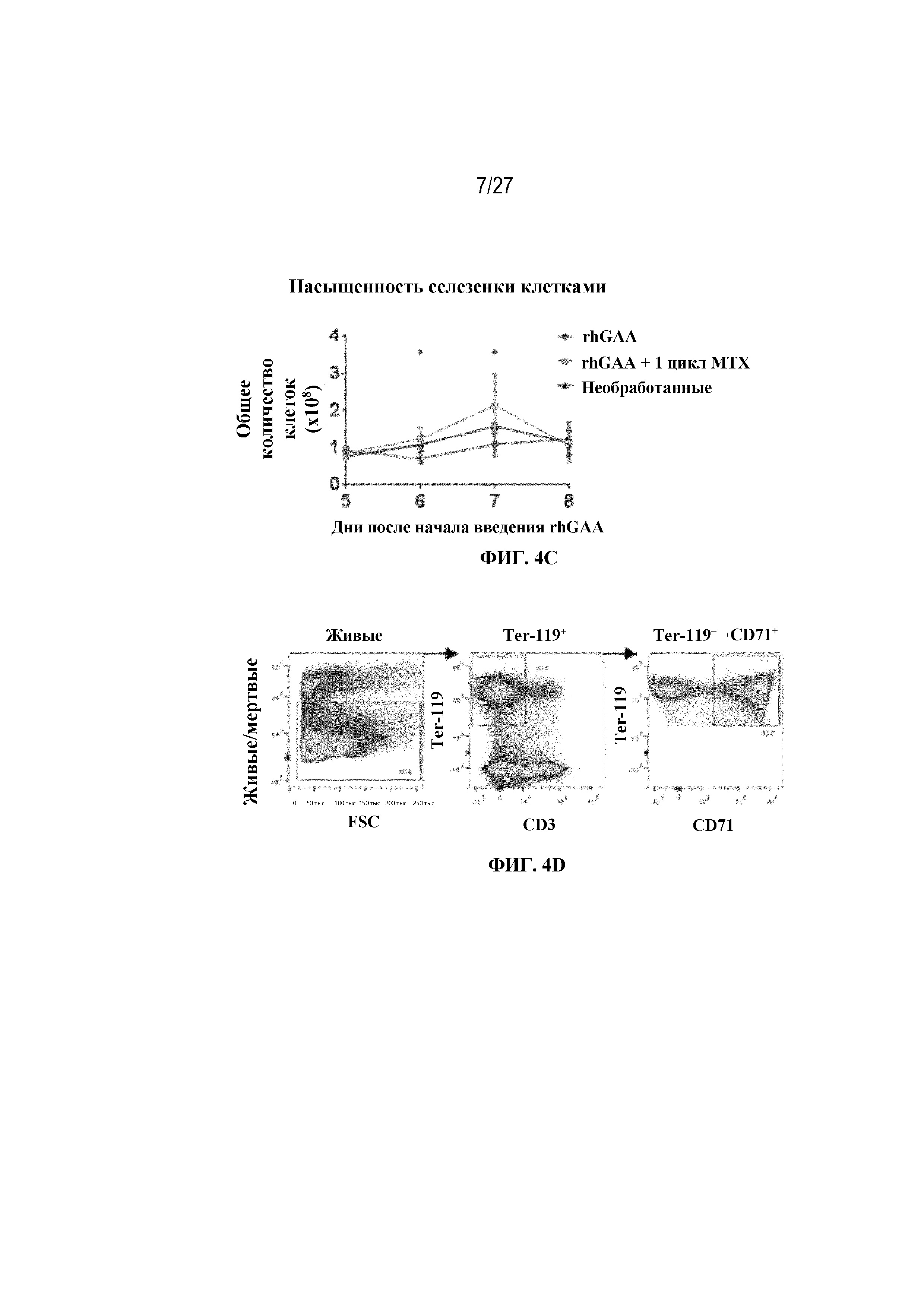
[40] На фиг. 4А показаны репрезентативные изображения образцов селезенки (черная полоса=1 см) от мышей в разных экспериментальных группах. На фиг. 4В показано графическое представление веса селезенки у мышей в день 7 от начала введения rhGAA. На фиг. 4C показано общее количество клеток в образцах селезенки, измеренное в дни 5, 6, 7 и 8 с помощью проточной цитометрии. От четырех до шести C57BL/6NTac мышей/группа подвергали обработке посредством введения 20 мг/кг внутривенно rhGAA отдельно или в комбинации с одним циклом введения метотрексата в низких дозах (три последовательных ежедневных и/п введения по 5 мг/кг в течение 15 минут после обработки посредством rhGAA). Селезенки гомогенизировали в суспензии отдельных клеток и исследовали с помощью проточной цитометрии, как это описано в примере 2.
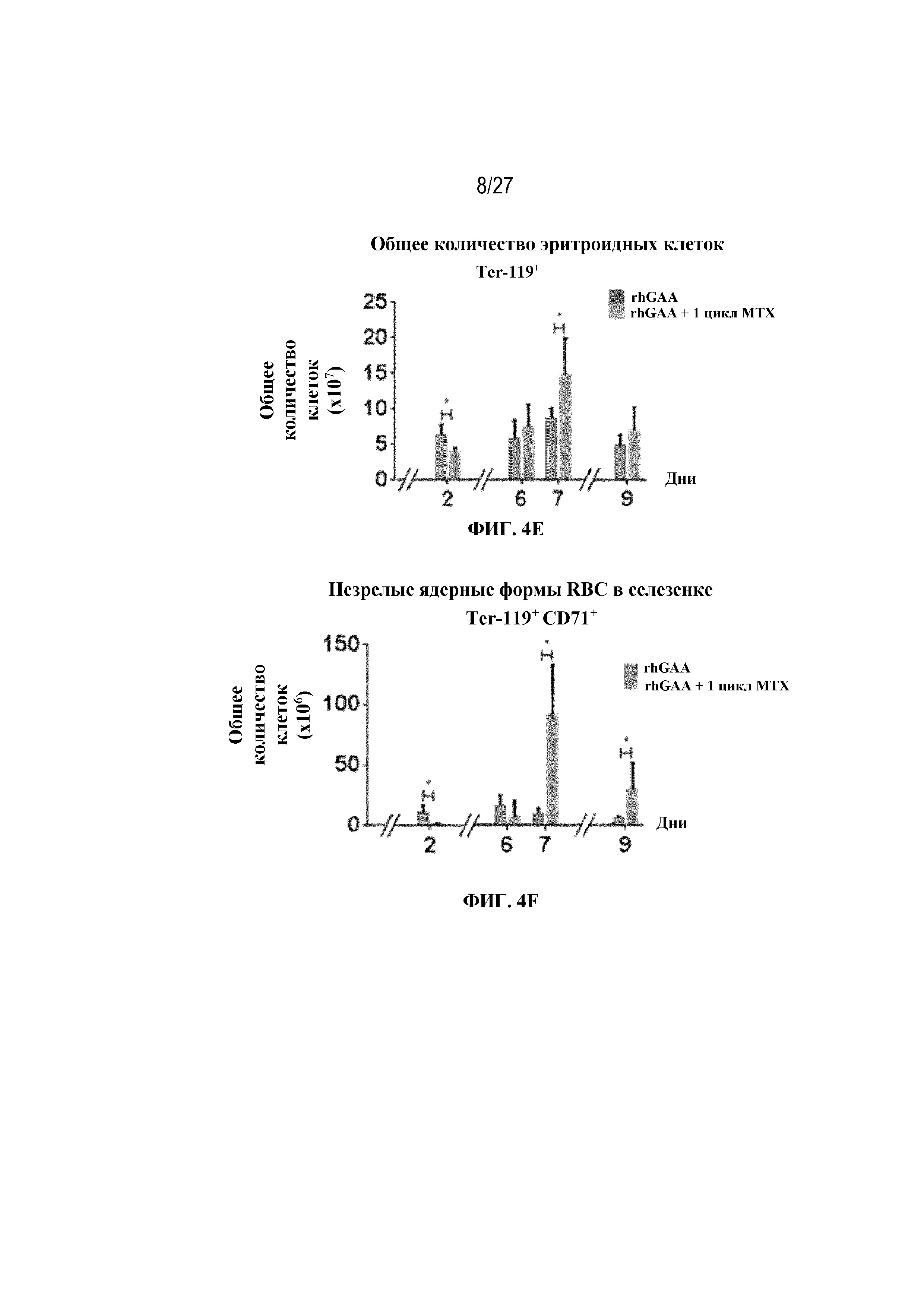
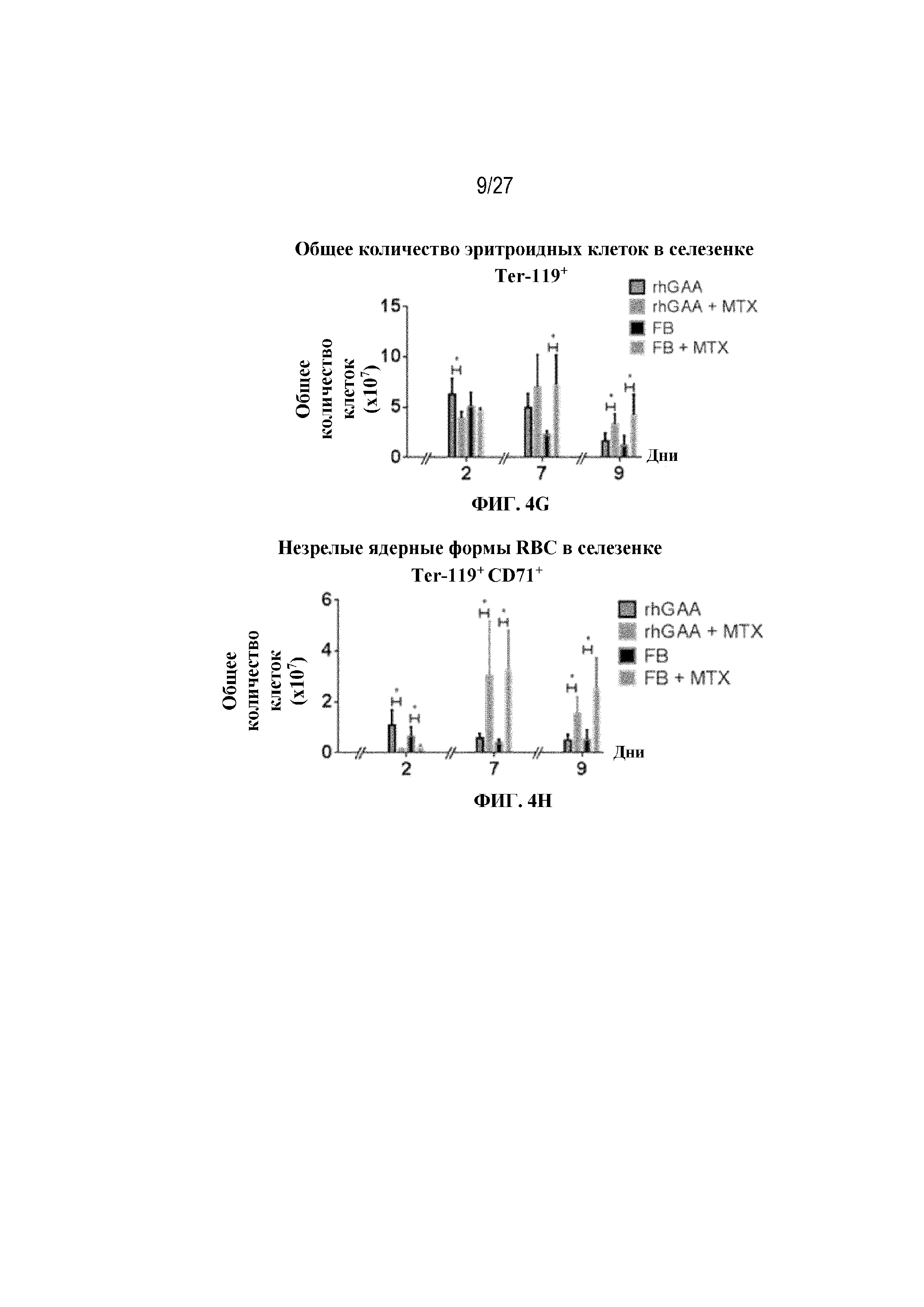
[41] На фиг. 4D показана стратегия гейтирования в проточной цитометрии образцов селезенки мышей. Отобрали субпопуляции живых общих RBC (Ter-119+) и ядерных форм RBC (Ter-119+ CD71+). На фиг. 4Е показано количество общих RBC в селезенках мышей в дни 2, 6, 7 и 9 от начала введения rhGAA. На фиг. 4F показаны количества незрелых ядерных форм RBC в селезенках мышей в дни 2, 6, 7 и 9 от начала введения rhGAA. Мышам вводили дозу либо только rhGAA (rhGAA), либо rhGAA в комбинации с одним циклом введения метотрексата в низких дозах (rhGAA+1 цикл MTX). На фиг. 4G показано количество общих RBC в селезенках мышей в дни 2, 7 и 9 от начала введения rhGAA. На фиг. 4H показаны количества незрелых ядерных форм RBC в селезенках мышей в дни 2, 7 и 9 от начала введения rhGAA. Включили экспериментальные контрольные группы мышей, которых подвергали обработке контролем-носителем FB (буфером для составления) с метотрексатом и без него. Эти данные получены в трех или более отдельных экспериментах. Анализы проводили с использованием t-критериев Стьюдента, и значимость приведена как * ≤0,05. Вертикальные полосы представляют стандартное отклонение. Результаты демонстрируют, что иллюстративная схема низкодозового введения метотрексата кратковременным курсом вызывала раннее кратковременное снижение с последующим накоплением общих и незрелых ядерных форм RBC и увеличением селезенки.
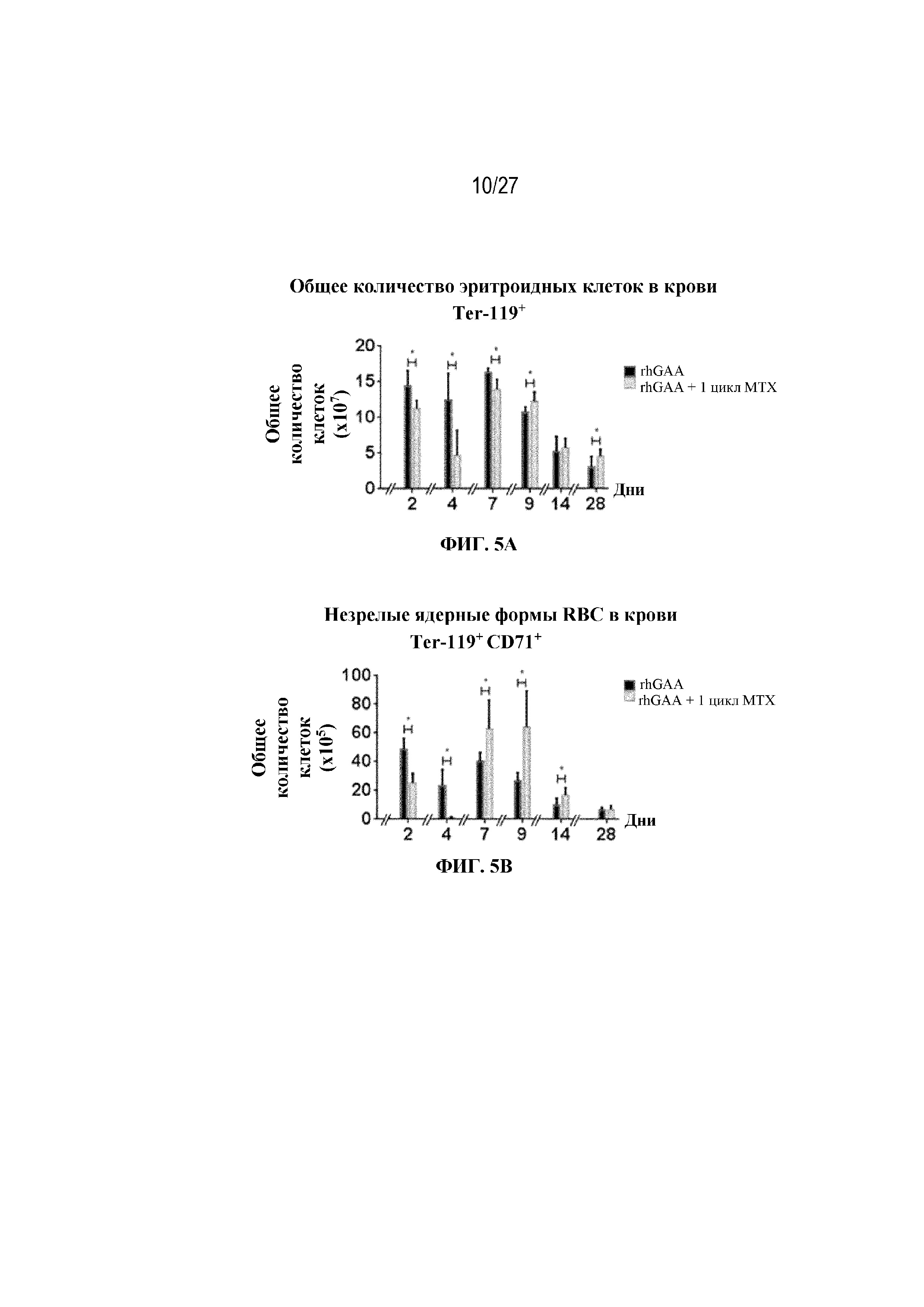
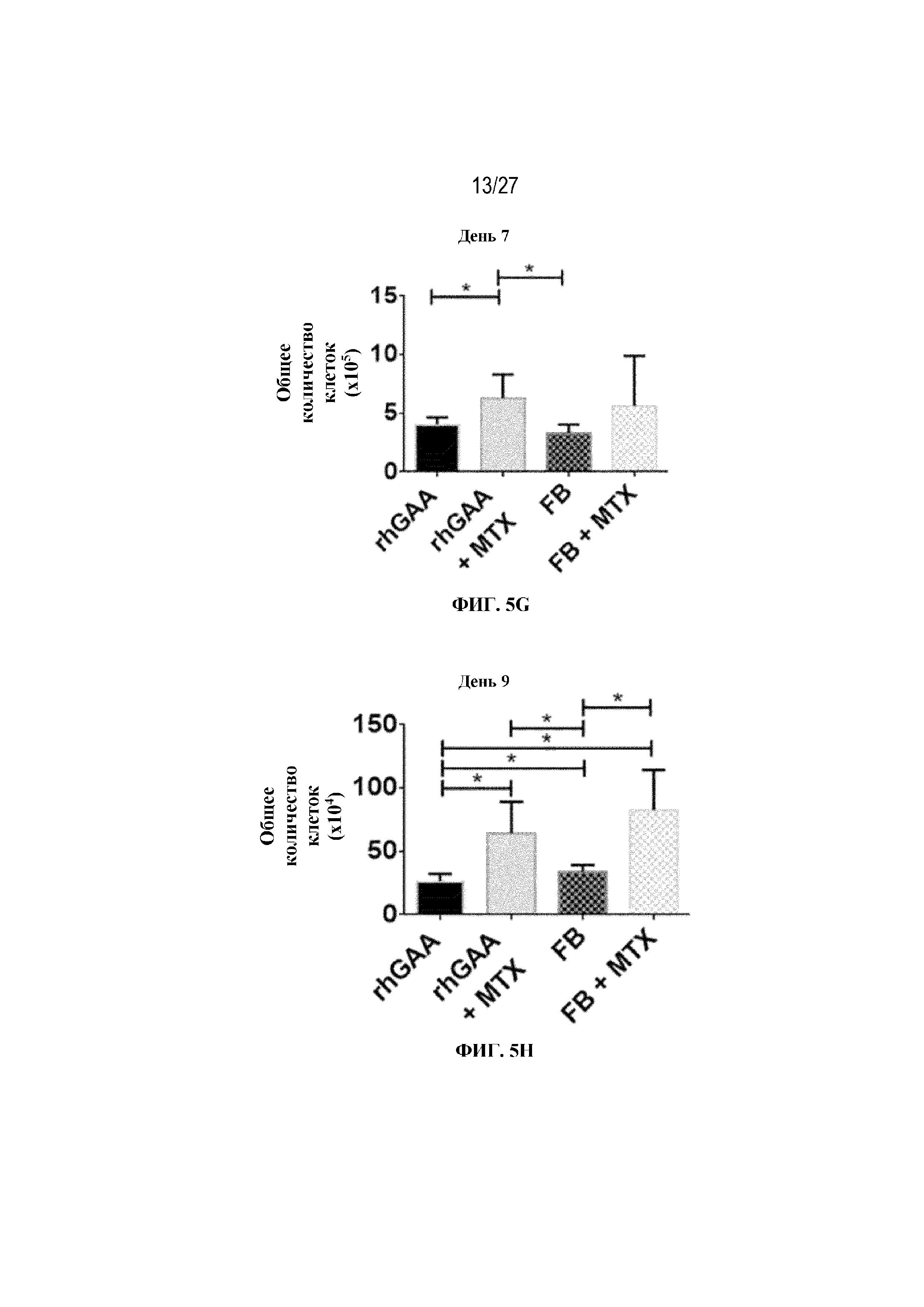
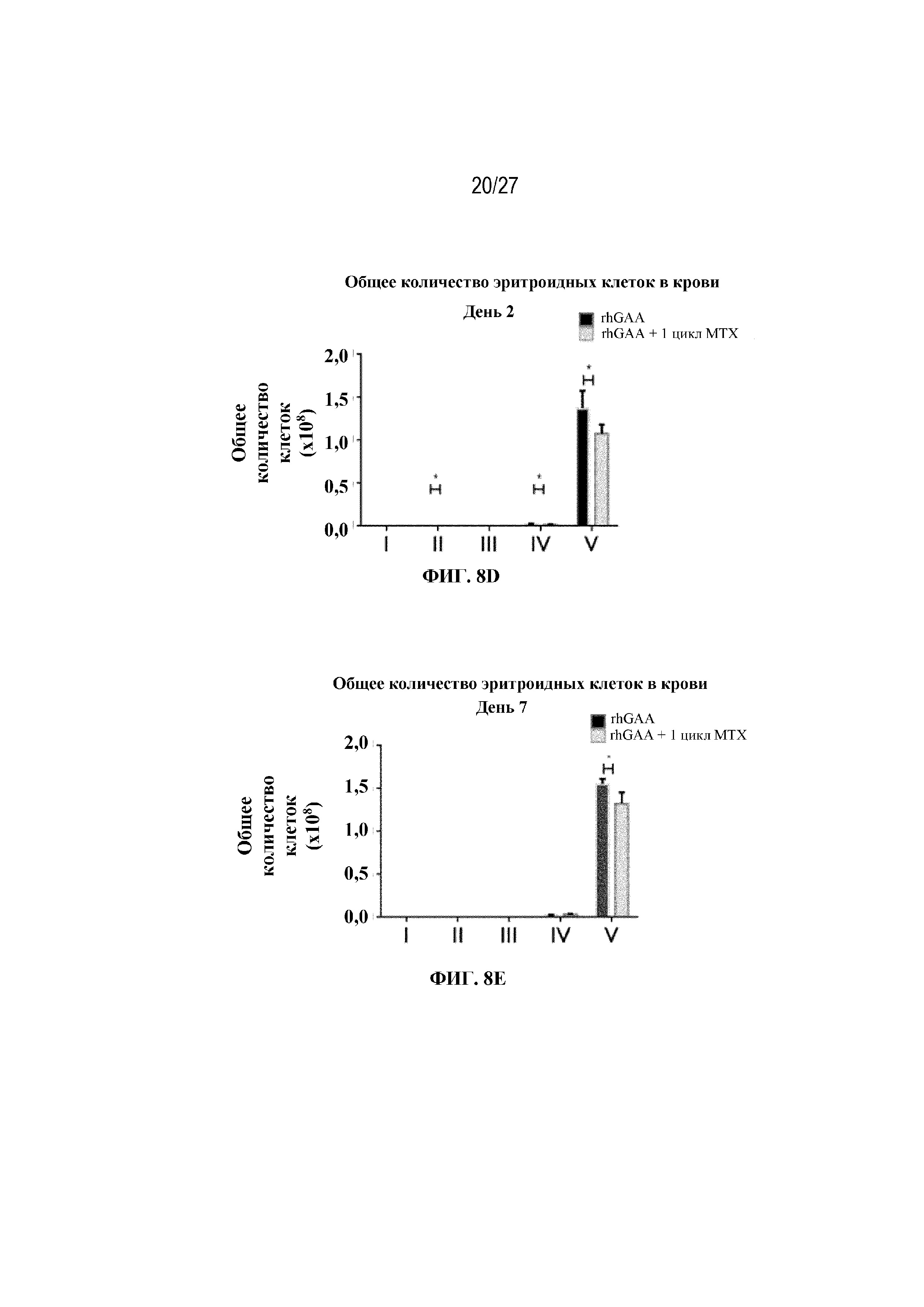
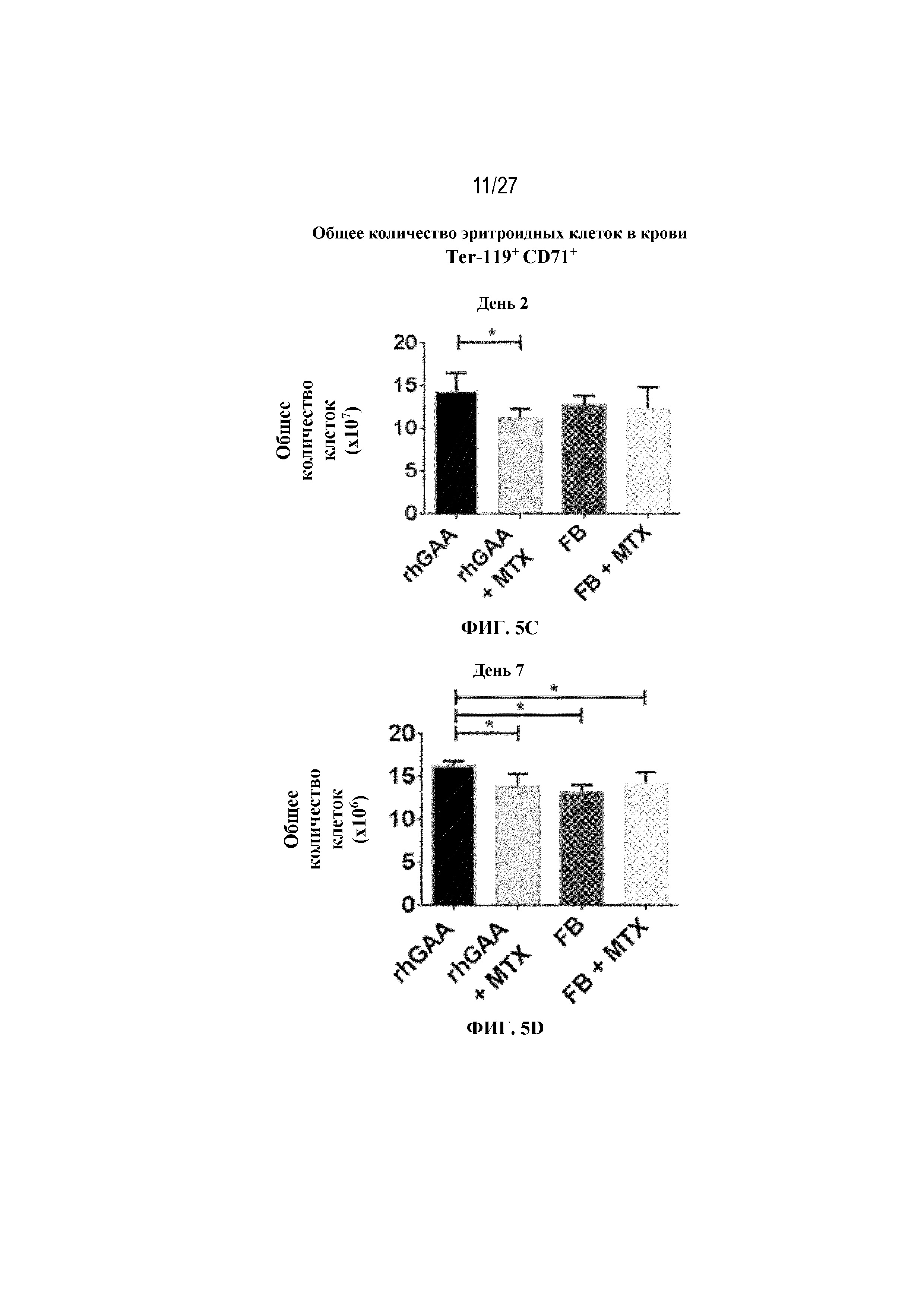
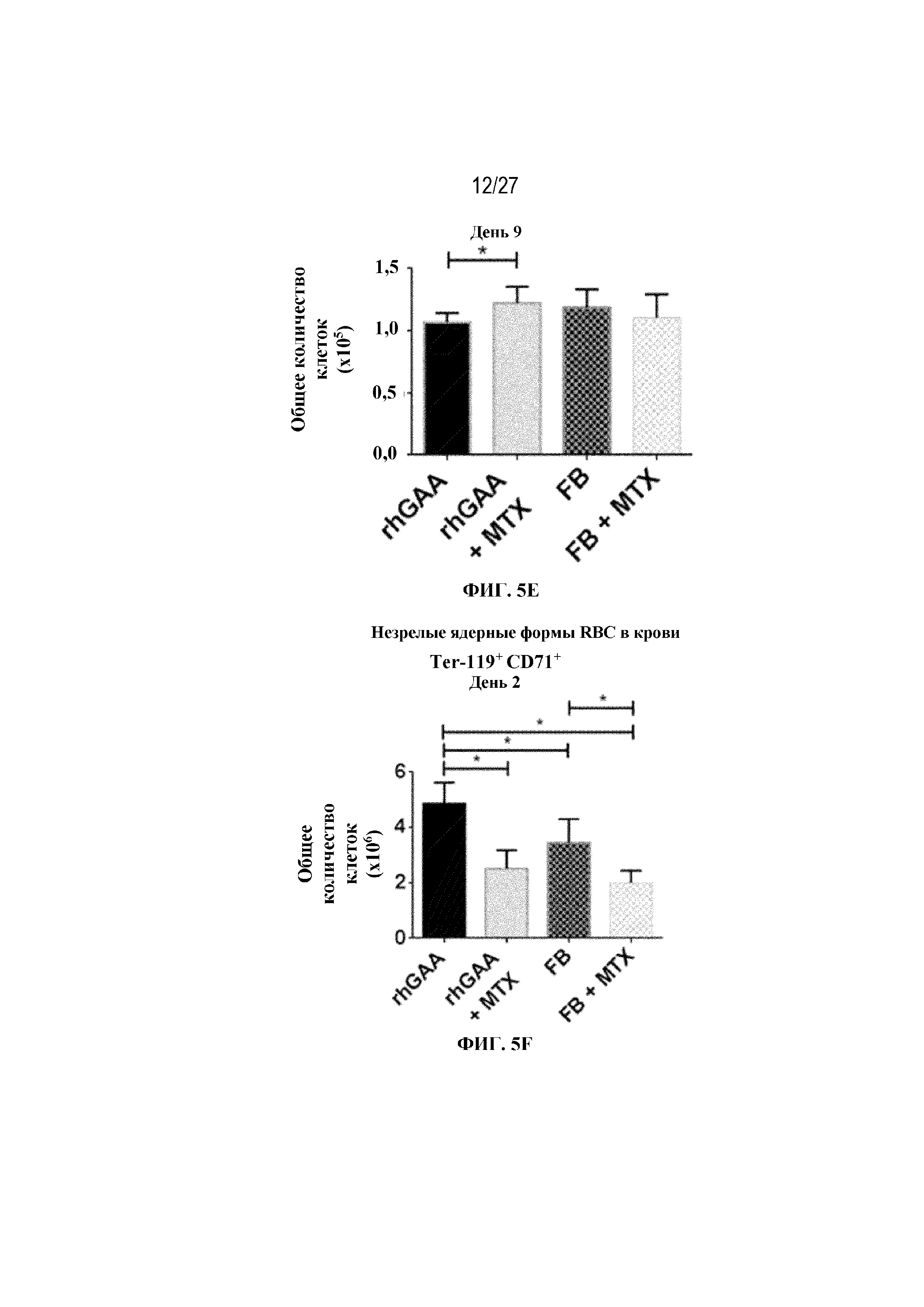
[42] На фиг. 5А показаны количества общих RBC в крови мышей в дни 2, 4, 7, 9, 14 и 28 от начала введения rhGAA согласно данным проточной цитометрии. На фиг. 5B показаны количества незрелых ядерных форм RBC в крови мышей в дни 2, 4, 7, 9, 14 и 28 от начала введения rhGAA. От пяти до десяти C57BL/6NTac мышей/группа подвергали обработке с помощью rhGAA с одним циклом введения метотрексата в низких дозах или без него. Общее количество эритроидных клеток получали из аликвоты крови объемом 25 мкл, собранной и исследованной при помощи проточной цитометрии, как это описано в примере 2. Мышам вводили дозу либо только rhGAA (rhGAA), либо rhGAA одновременно с одним циклом введения метотрексата в низких дозах (rhGAA+1 цикл MTX). На фиг. 5С показаны количества общих RBC в крови мышей в день 2. На фиг. 5D показаны количества суммарных RBC в крови мышей в день 7. На фиг. 5E показаны количества суммарных RBC в крови мышей в день 9. На фиг. 5F показаны количества незрелых ядерных форм RBC в крови мышей в день 2. На фиг. 5G показаны количества незрелых ядерных форм RBC в крови мышей в день 7. На фиг. 5H показаны количества незрелых ядерных форм RBC в крови мышей в день 9. Включили экспериментальные контрольные группы мышей, обрабатываемых FB с иллюстративной схемой низкодозового введения метотрексата кратковременным курсом и без нее. Эти данные получены в трех или более отдельных экспериментах. Анализы проводили с использованием t-критериев Стьюдента, и значимость приведена как * ≤0,05. Вертикальные полосы представляют стандартное отклонение. Результаты продемонстрировали, что иллюстративная схема низкодозового введения метотрексата кратковременным курсом вызывает аналогичный, но замедленный ответ RBC в компартменте системного кровотока по сравнению с таким в селезенке.
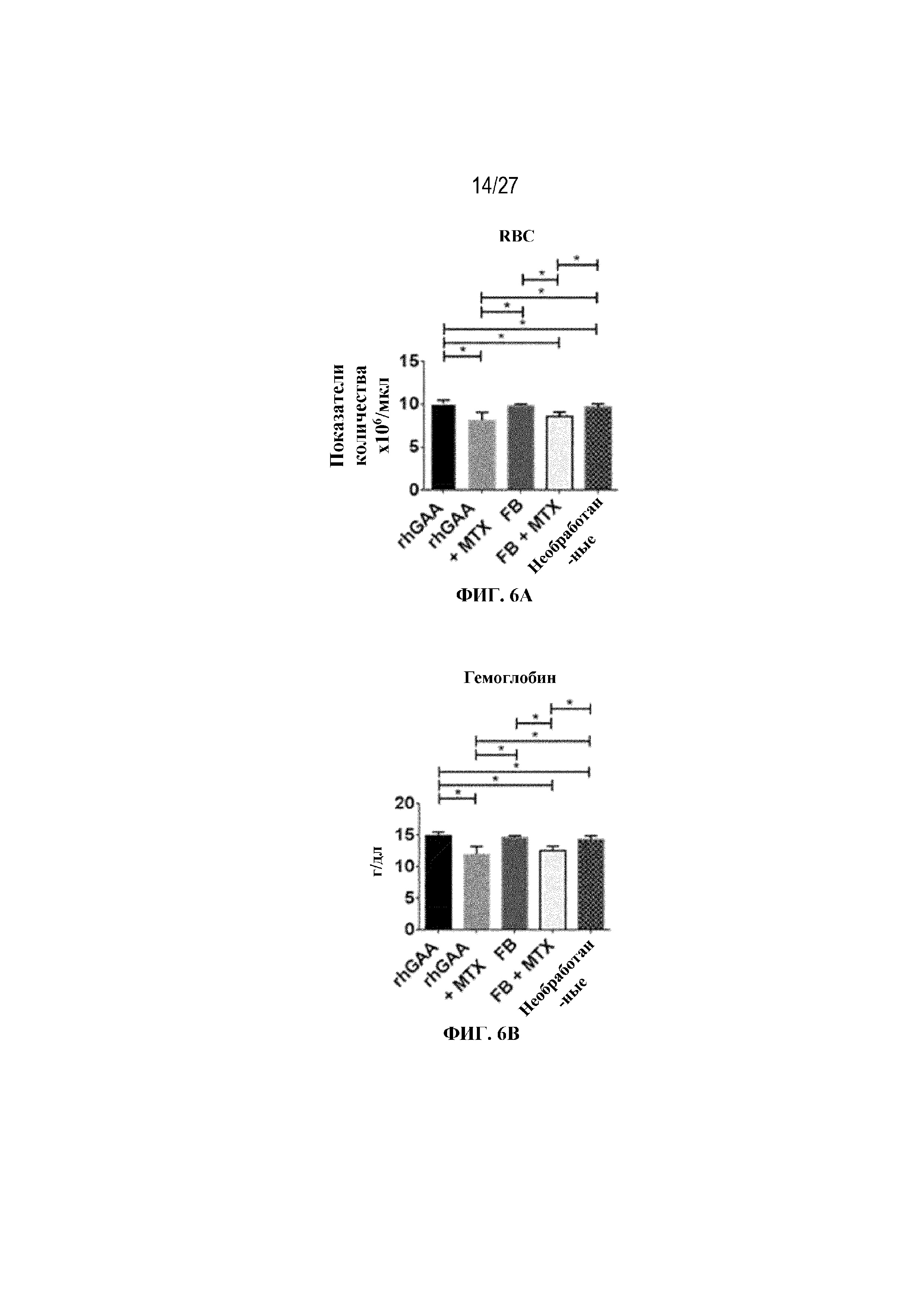
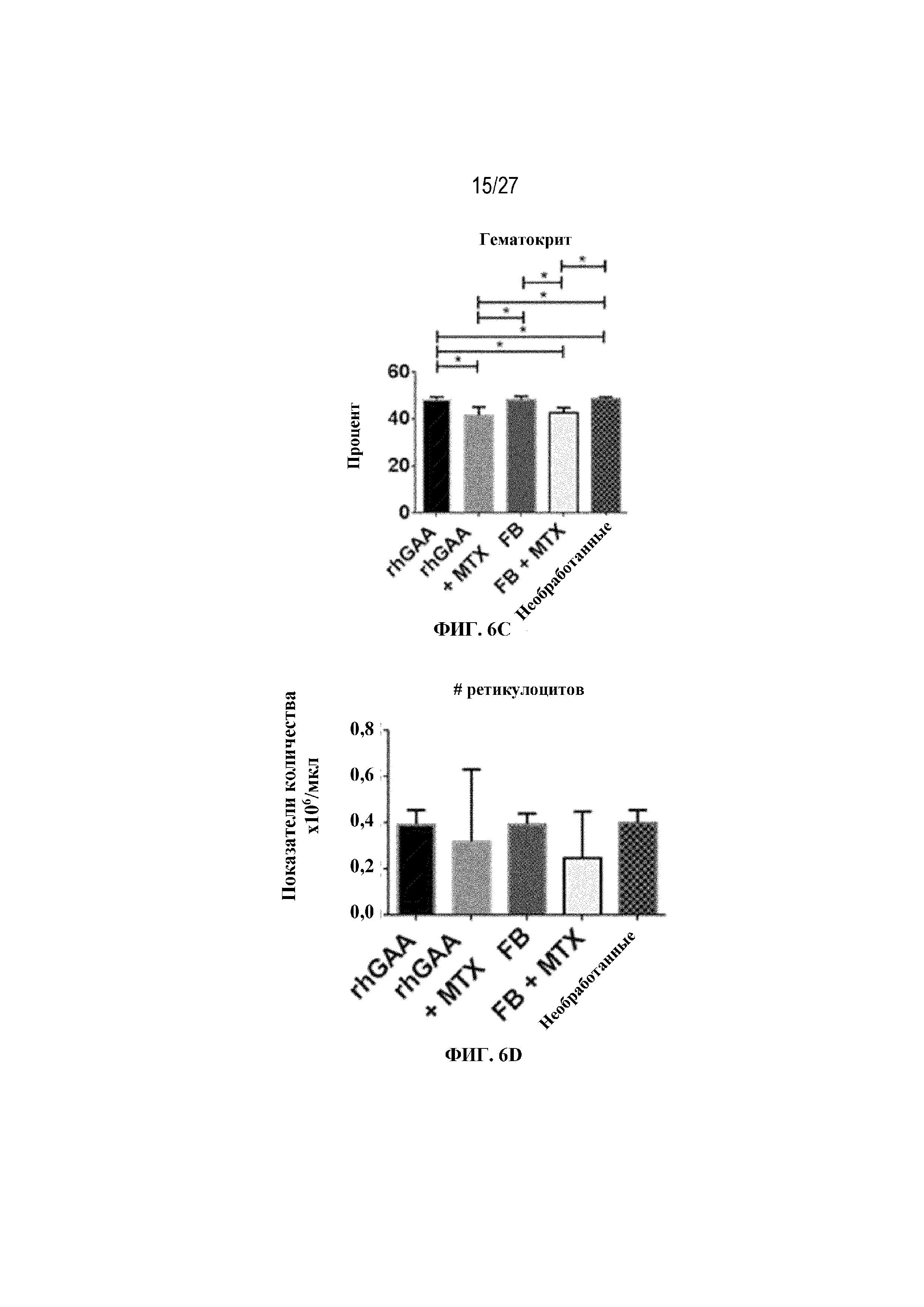
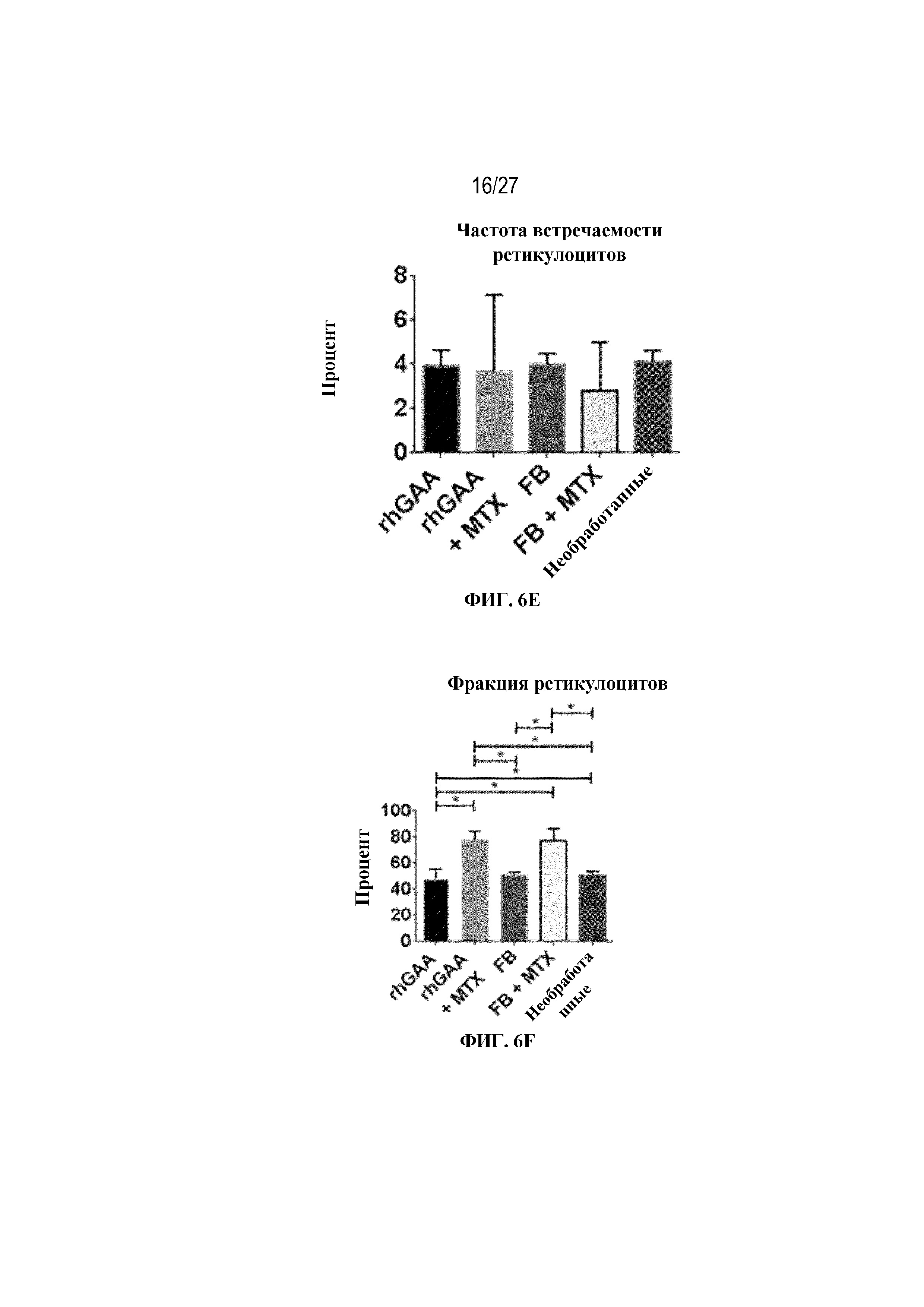
[43] На фиг. 6А показан подсчет общих RBC в компартменте системного кровотока мышей в день 7 от начала введения rhGAA. На фиг. 6B показан уровень гемоглобина в компартменте системного кровотока мышей в день 7 от начала введения rhGAA. На фиг. 6C показан процент гематокрита в компартменте системного кровотока мышей в день 7 от начала введения rhGAA. На фиг. 6D показано число зрелых ретикулоцитов в компартменте системного кровотока мышей в день 7 от начала введения rhGAA. На фиг. 6E показана частота выявления зрелых ретикулоцитов в компартменте системного кровотока мышей в день 7 от начала введения rhGAA. На фиг. 6F показана фракция незрелых ретикулоцитов в компартменте системного кровотока мышей в день 7 от начала введения rhGAA. Шесть C57BL/6NTac мышей/группа подвергали обработке с помощью rhGAA с одним циклом введения метотрексата в низких дозах или без него. Включили экспериментальные контрольные группы мышей, обрабатываемых FB с иллюстративной схемой низкодозового введения метотрексата кратковременным курсом и без нее. Образцы отбирали из ретроорбитального синуса в микропробирки для образцов с антикоагулянтом ЭДТА и хранили при 2-8°C не более 72 часов. Дифференциальный анализ CBC, WBC и подсчет ретикулоцитов проводили на Sysmex XT2000iV. Анализы проводили с использованием t-критериев Стьюдента, и значимость приведена как * ≤0,05. Вертикальные полосы представляют стандартное отклонение. Результаты демонстрируют, что иллюстративная схема низкодозового введения метотрексата кратковременным курсом обеспечивает регенеративный эритроидный ответ в день 7 в компартменте системного кровотока.
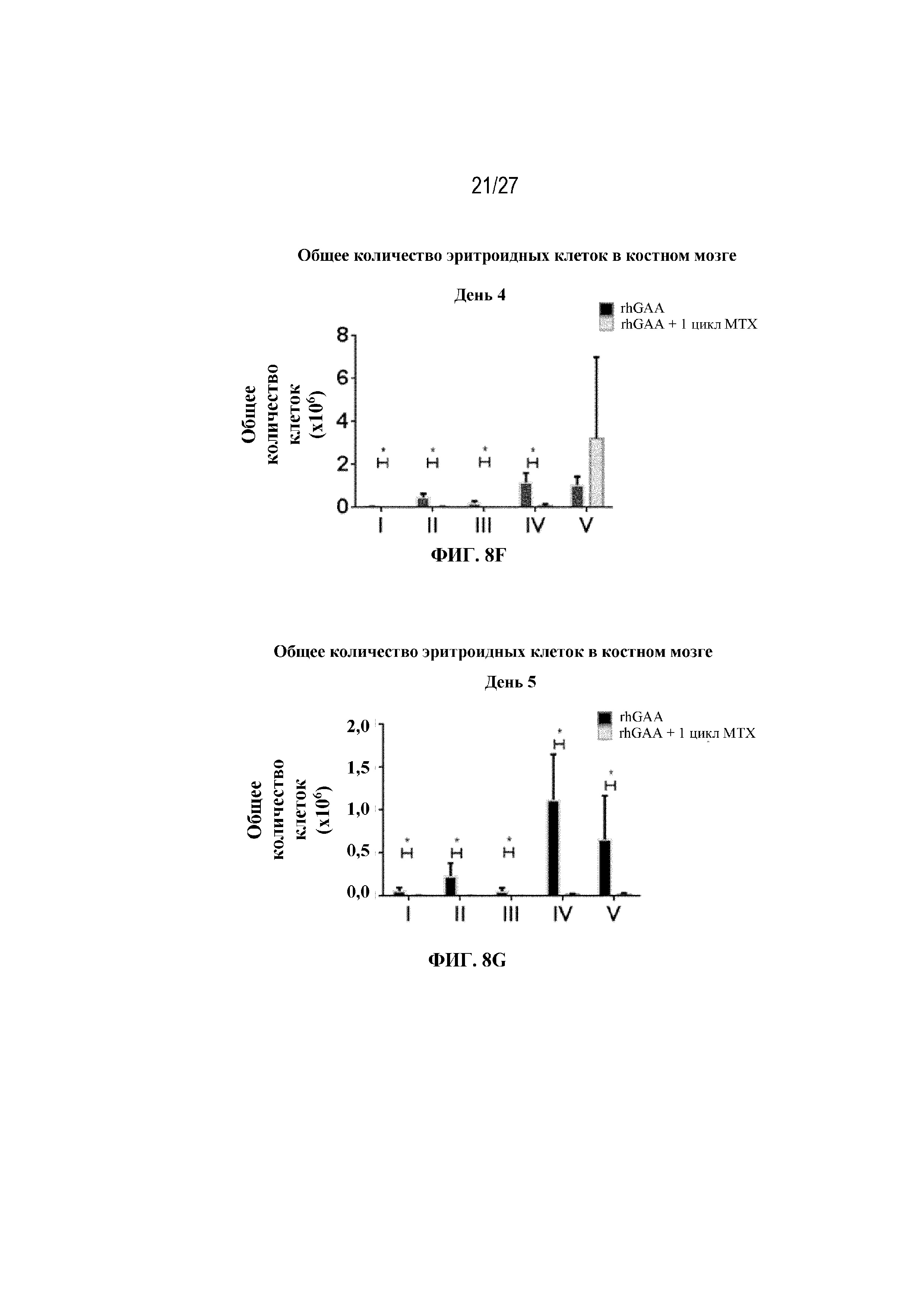
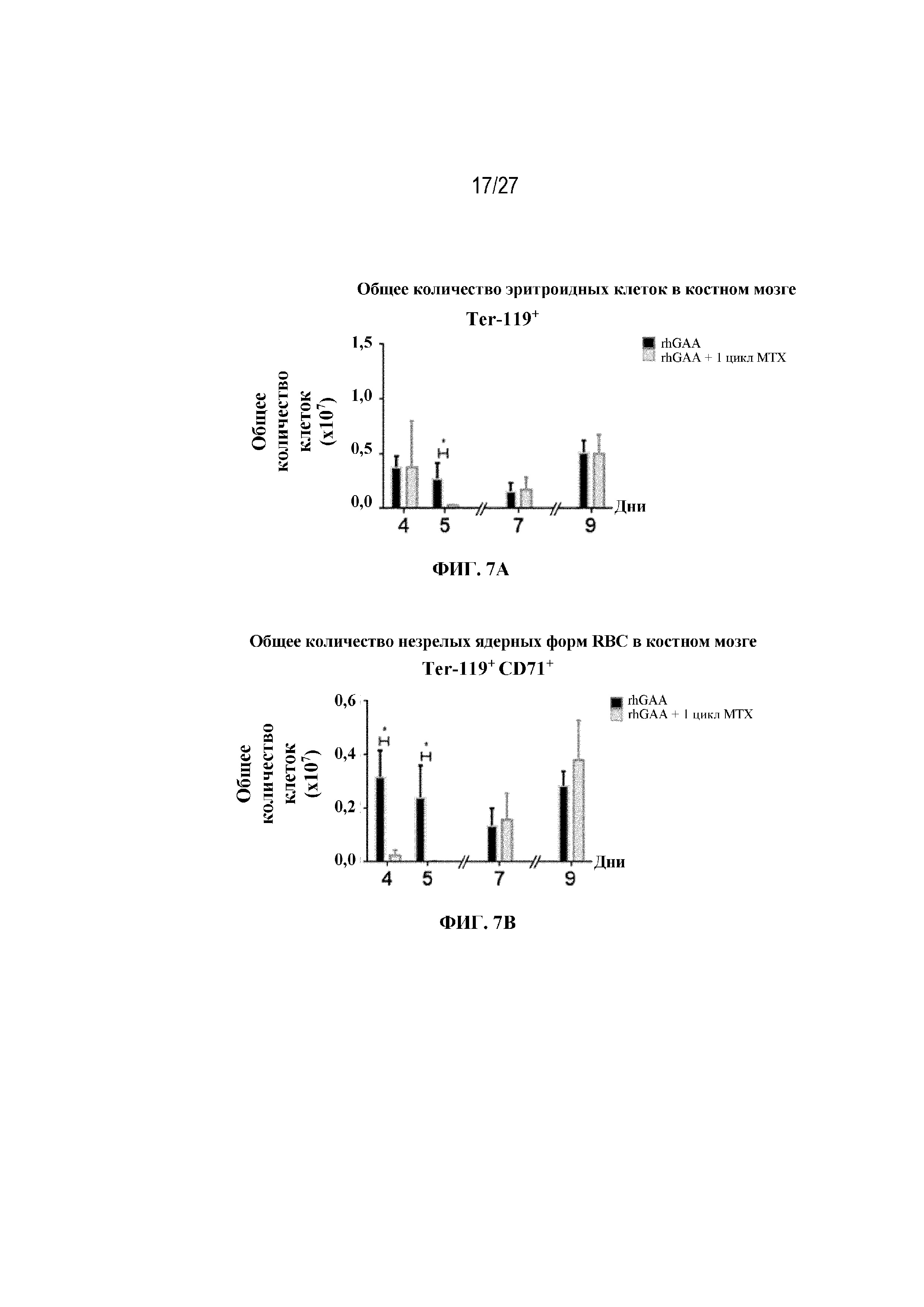
[44] На фиг. 7А показаны количества общих RBC в дни 4, 5, 7 и 9 в образцах костного мозга мышей от начала введения rhGAA согласно данным проточной цитометрии. На фиг. 7В показаны количества незрелых ядерных форм RBC в дни 4, 5, 7 и 9 в образцах костного мозга мышей от начала введения rhGAA согласно данным проточной цитометрии. Шесть C57BL/6NTac мышей/группа подвергали обработке с помощью rhGAA в присутствии или отсутствии одного цикла введения метотрексата в низких дозах. Общее количество эритроидных клеток получали из одной бедренной кости и исследовали при помощи проточной цитометрии, как это описано в примере 2. Мышам вводили дозу либо только rhGAA (rhGAA), либо rhGAA одновременно с одним циклом низкодозового введения метотрексата (rhGAA+1 цикл MTX). Эти данные получены в двух отдельных экспериментах. Анализы проводили с использованием t-критериев Стьюдента, и значимость приведена как * ≤0,05. Вертикальные полосы представляют стандартное отклонение. Результаты демонстрируют, что иллюстративная схема низкодозового введения метотрексата кратковременным курсом приводит к раннему кратковременному истощению общих и незрелых ядерных форм RBC, но RBC вскоре возвращаются к гомеостатическим уровням в костном мозге.
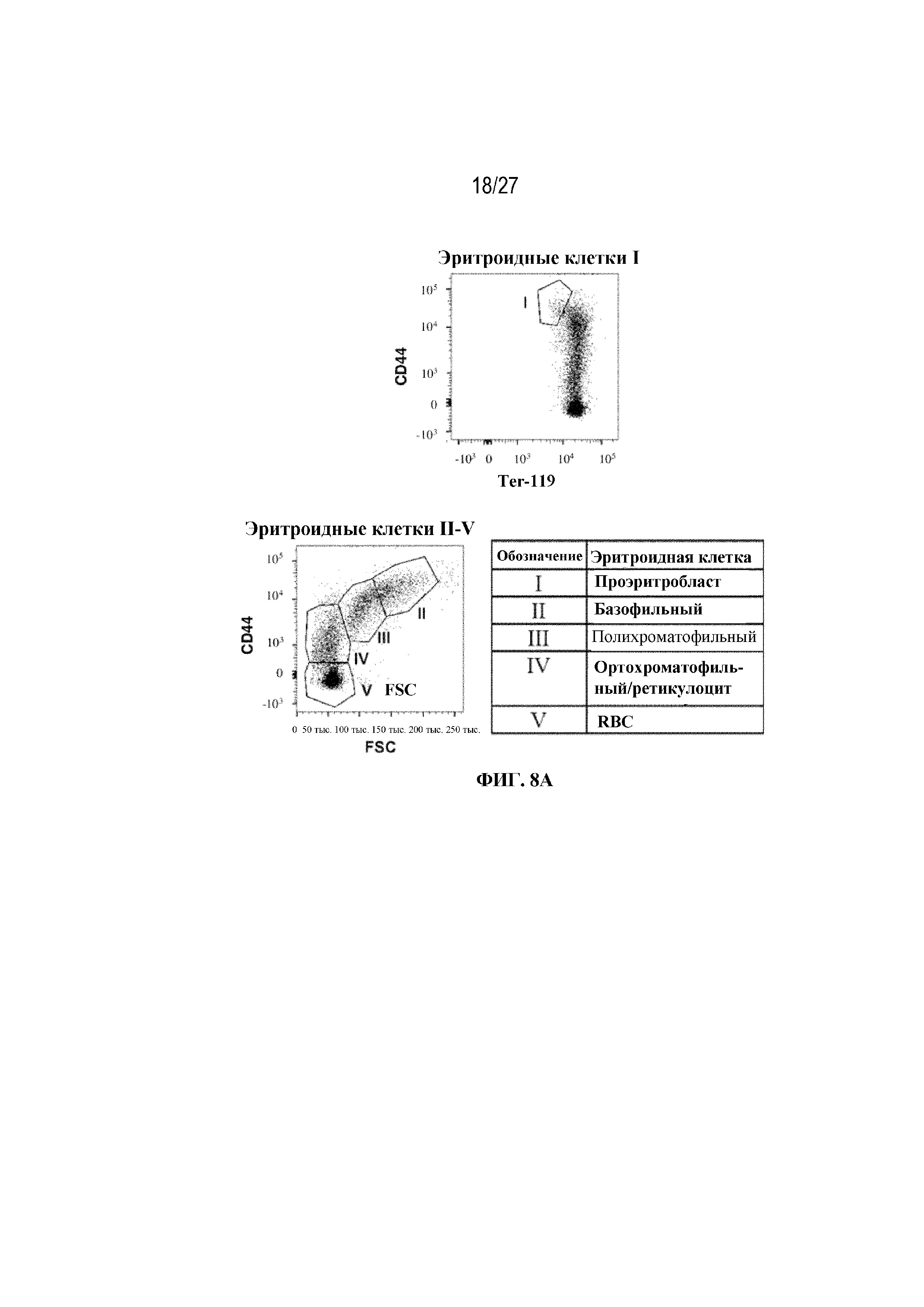
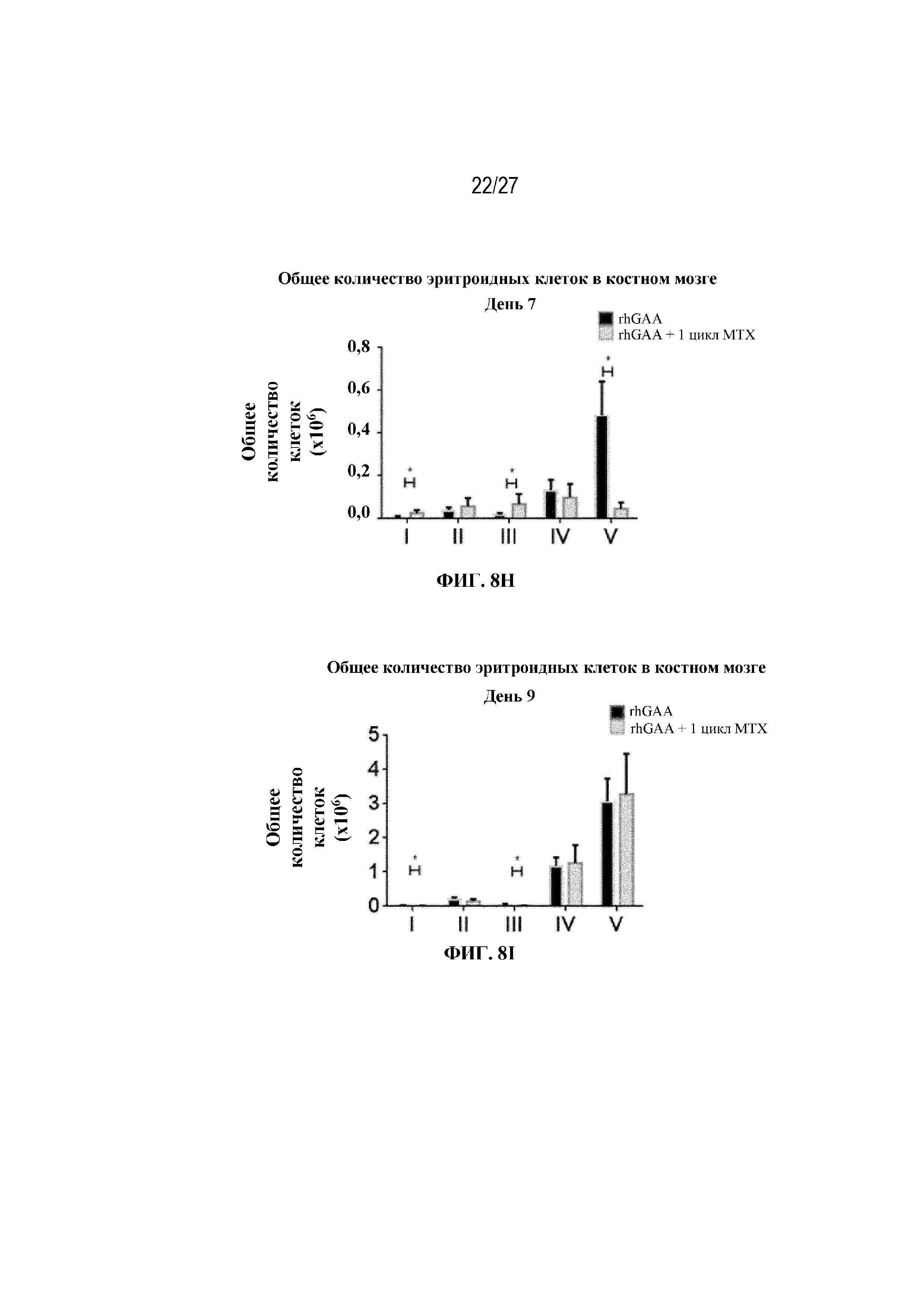
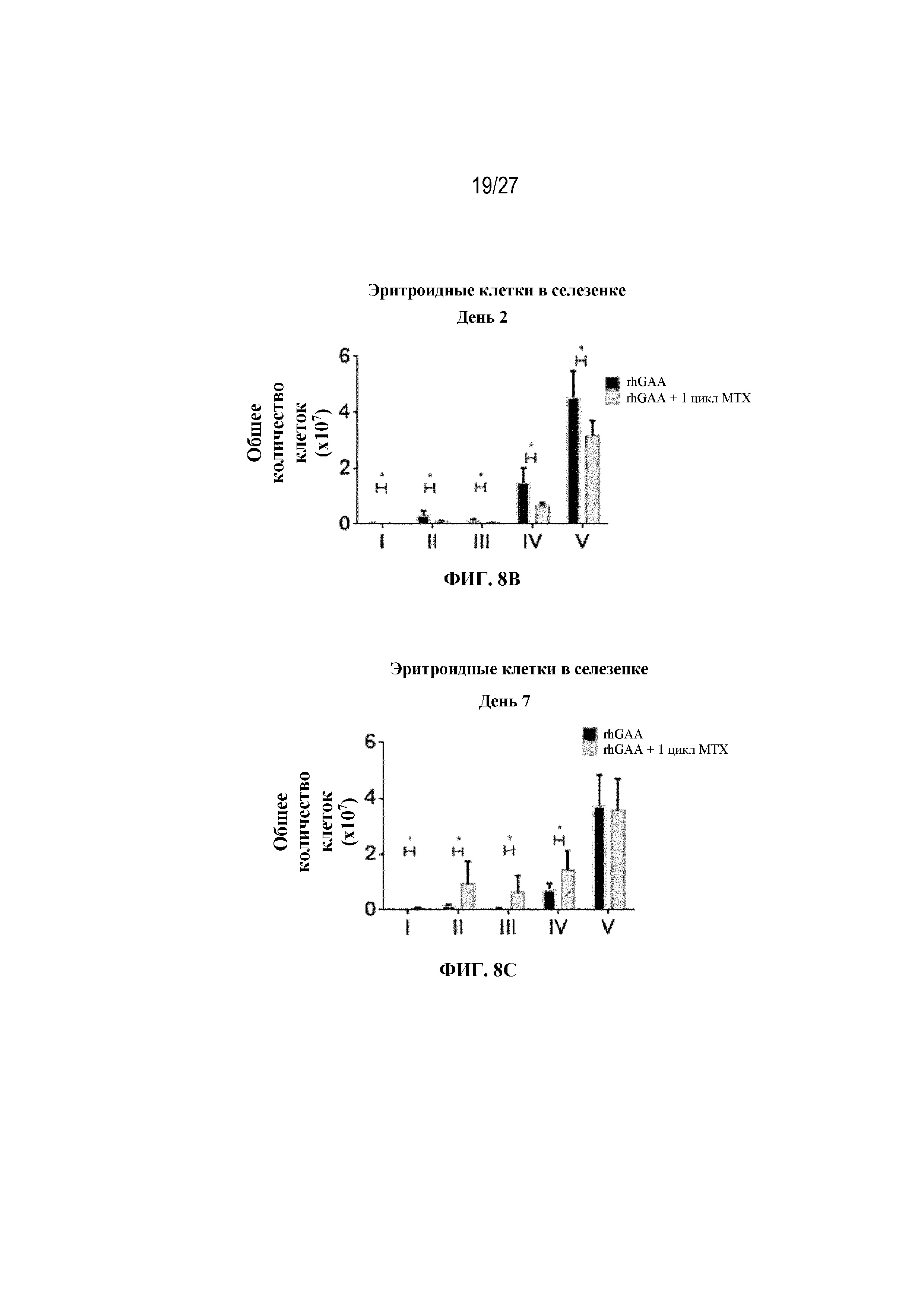
[45] На фиг. 8А показана стратегия гейтирования в проточной цитометрии для отбора эритроидных клеток на разных стадиях развития. По дифференциальной экспрессии CD44 и FSC (прямое рассеяние) в живых Ter-119+ идентифицировали: (I) проэритробласты (Ter-119intermediate, CD44high), (II) базофильные эритробласты (Ter-119+, CD44high FSChigh), (III) полихроматофильные эритробласты (Ter-119+, CD44intermediate FSCintermediate), (IV) ортохроматофильные эритробласты и ретикулоциты (Ter-119+, CD44intermediate FSClow) и (V) зрелые эритроциты (Ter-119+, CD44low FSClow). На фиг. 8B показаны количества эритроидных клеток в образцах селезенки мышей в день 2 от начала введения rhGAA. На фиг. 8C показаны количества эритроидных клеток в образцах селезенки мышей в день 7 от начала введения rhGAA. Каждый образец селезенки получали из одной гомогенизированной селезенки. На фиг. 8D показаны количества эритроидных клеток в образцах селезенки мышей в день 2 от начала введения rhGAA. На фиг. 8E показаны количества эритроидных клеток в образцах селезенки мышей в день 7 от начала введения rhGAA. Каждый образец крови получали из 25 мкл сбора из компартмента системного кровотока. На фиг. 8F показаны количества эритроидных клеток в образцах костного мозга мышей в день 4 от начала введения rhGAA. На фиг. 8G показаны количества эритроидных клеток в образцах костного мозга мышей в день 5 от начала введения rhGAA. На фиг. 8H показаны количества эритроидных клеток в образцах костного мозга мышей в день 7 от начала введения rhGAA. На фиг. 8I показаны количества эритроидных клеток в образцах костного мозга мышей в день 9 от начала введения rhGAA. Каждый образец костного мозга получали из одной бедренной кости. От пяти до десяти C57BL/6NTac мышей/группа подвергали обработке с помощью rhGAA не позднее пятнадцати минут до одного цикла введения метотрексата в низких дозах. Мышам вводили дозу либо только rhGAA (rhGAA), либо rhGAA вместе с одним циклом введения метотрексата в низких дозах (rhGAA+1 цикл MTX). Эти данные получены в двух или более отдельных экспериментах. Анализы проводили с использованием t-критериев Стьюдента, и значимость приведена как * ≤0,05. Вертикальные полосы представляют стандартное отклонение. Результаты показали, что эритропоэз, инициируемый посредством иллюстративной схемы низкодозового введения метотрексата кратковременным курсом, преимущественно происходит в селезенке мышей.
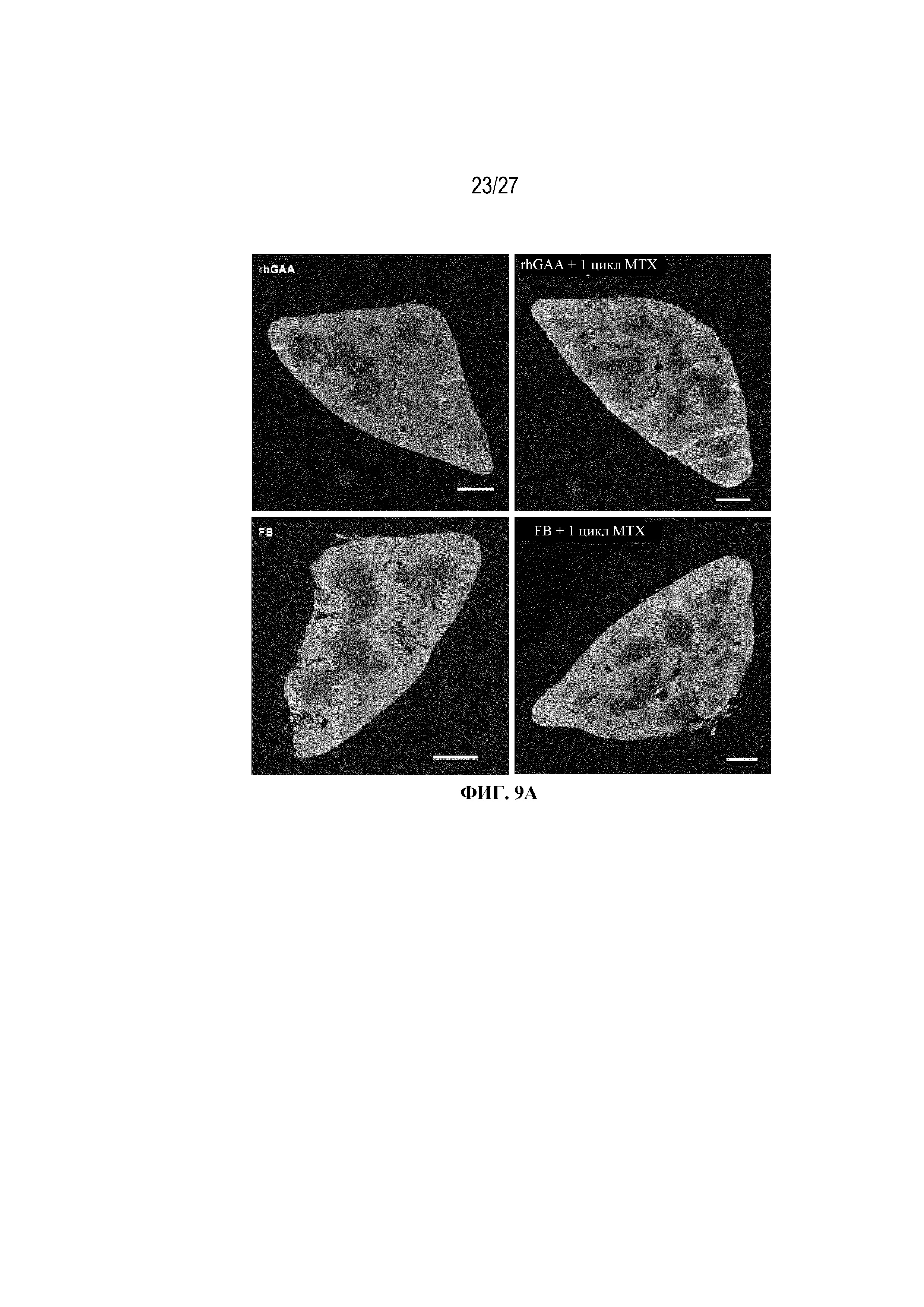
[46] На фиг. 9А показано, что иллюстративная схема низкодозового введения метотрексата кратковременным курсом повышает частоту появления ядерных форм клеток (в том числе гематопоэтических предшественников) в красной пульпе селезенки. От четырех до шести C57BL/6NTac мышей/группа подвергали обработке с помощью rhGAA с одним циклом введения метотрексата в низких дозах или без него. Включили экспериментальные контрольные группы мышей, обрабатываемых FB с иллюстративной схемой низкодозового введения метотрексата кратковременным курсом и без нее. Образцы селезенки отбирали через 7 дней от начала введения rhGAA и обрабатывали для иммунофлуоресценции. Образцы селезенки отбирали через 7 дней от начала введения rhGAA и из них получали криосрезы в среде OCT, проводили иммунофлуоресцентное окрашивание по CD71 и Ter-119 и анализ на сканере слайдов AxioScan (Carl Zeiss; Пибоди, Массачусетс), настроенном для многоканальной флуоресцентной визуализации и оснащенном объективом PlanApo 20x 0,8NA. (A) Показаны репрезентативные полные сканы слайдов, на которых иммунофлуоресцентное окрашивание CD71 показано красным (РЕ) и TER119 зеленым (FITC). Образцы также окрашивали DAPI (синий) для визуализации ядер. Области, в которых отсутствовало окрашивание по CD71 или Ter-119, представляют белую пульпу. Области, в которых отсутствовало окрашивание по CD71 и/или Ter-119, представляют белую пульпу. Масштабная метка представлена с размерностью 500 мкм.
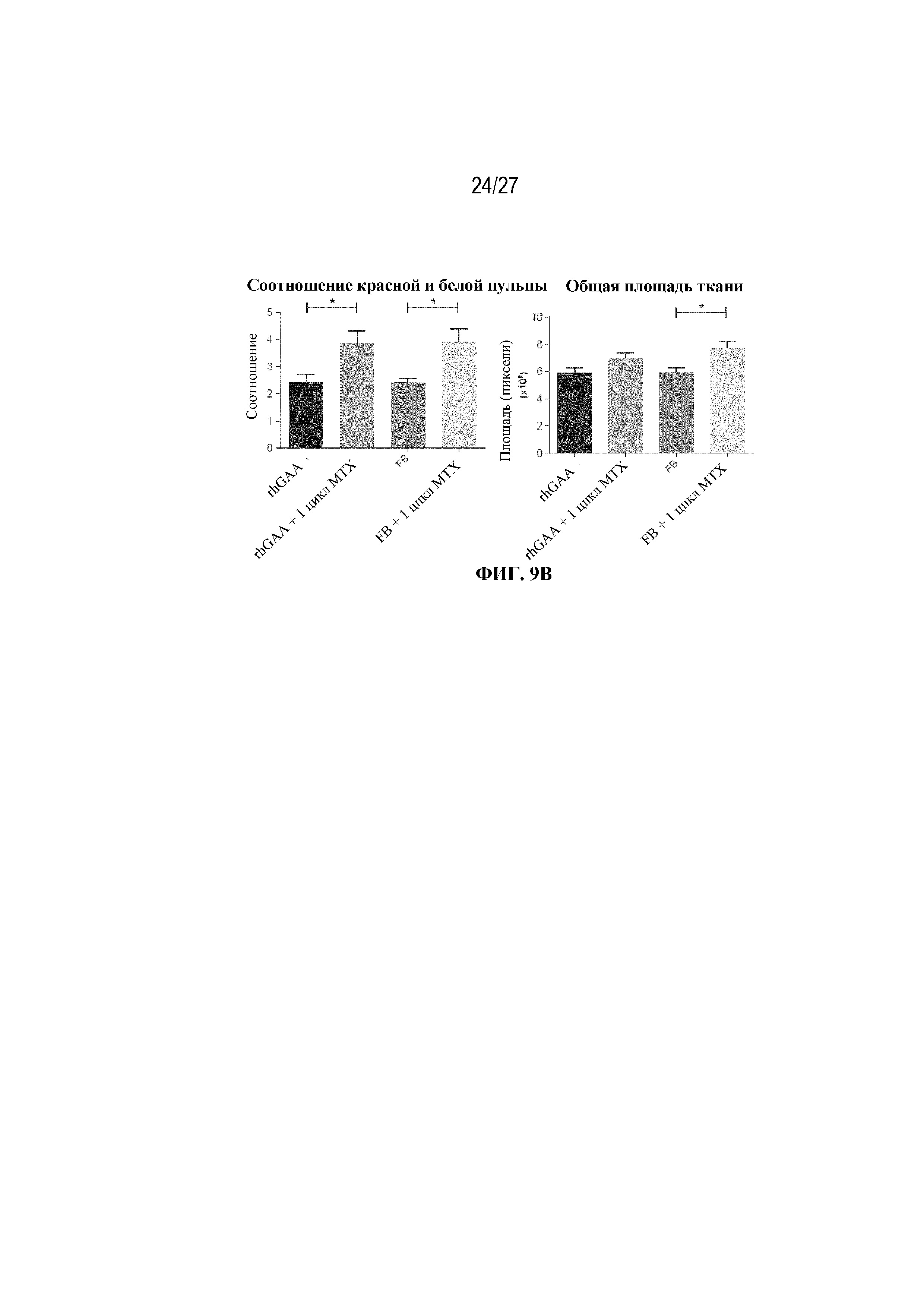
[47] На фиг. 9В показано графическое представление результатов морфометрического количественного определения соотношения площади красной и белой пульпы (вверху) и общей площади ткани (внизу). Вертикальные полосы представляют стандартную ошибку среднего (SEM) с p-значениями, скорректированными по Бонферрони, где * ≤0,05.
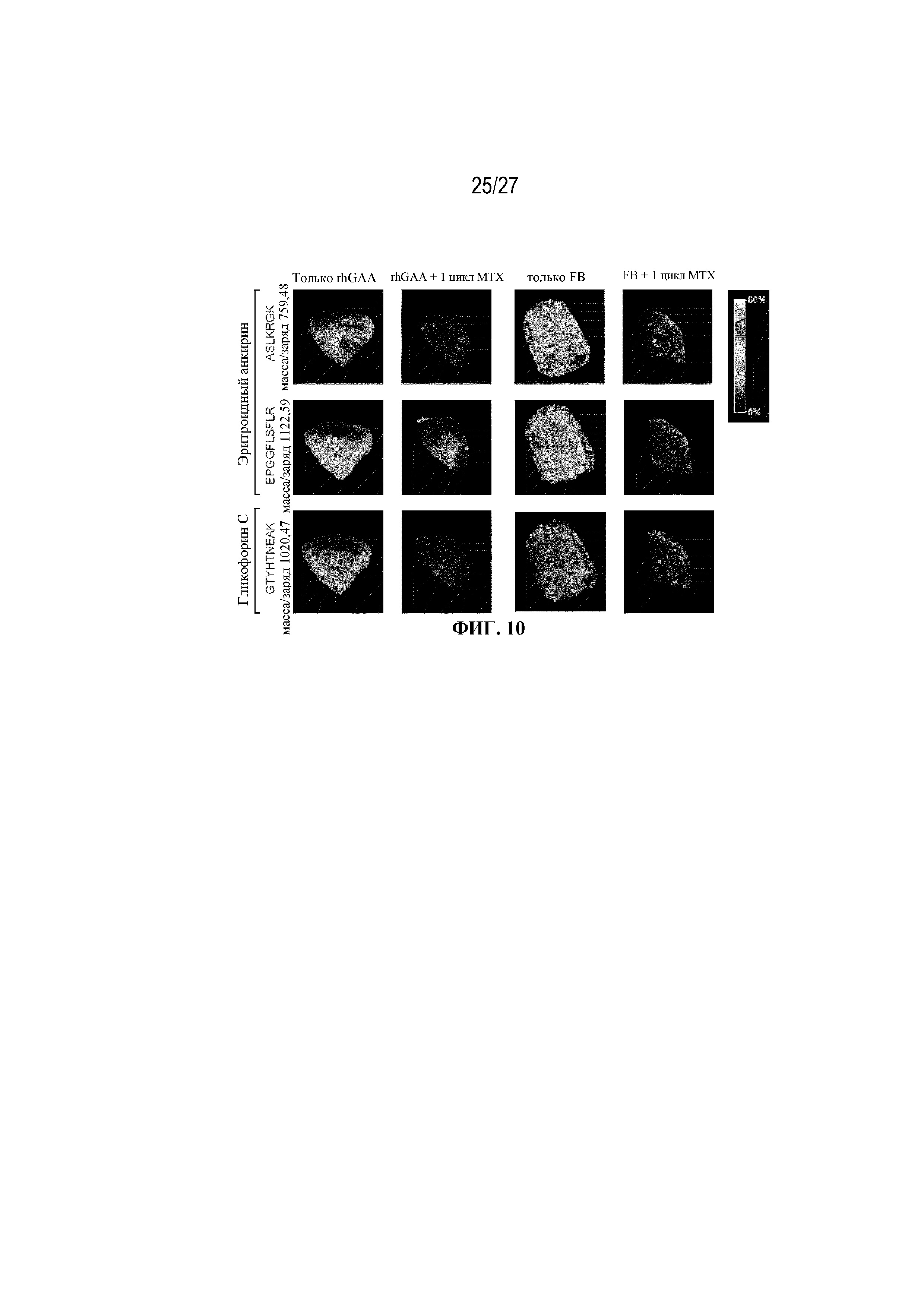
[48] На фиг. 10 показано, что уровни белков, эритроидного анкирина и гликофорина С, снижены в селезенке мышей, получавших иллюстративную схему низкодозового введения метотрексата кратковременным курсом. От четырех до шести C57BL/6NTac мышей/группа подвергали обработке с помощью rhGAA с одним циклом введения метотрексата в низких дозах или без него. Включили экспериментальные контрольные группы мышей, обрабатываемых FB с иллюстративной схемой низкодозового введения метотрексата кратковременным курсом и без нее. Образцы селезенки отбирали через 7 дней от начала введения rhGAA и обрабатывали для анализа масс-спектрометрической визуализации тканей. Показано, что срезы селезенки толщиной 10 мкм демонстрируют сигнал для эритроидного анкирина и гликофорина С. Пространственное разрешение составляет 30 мкм.
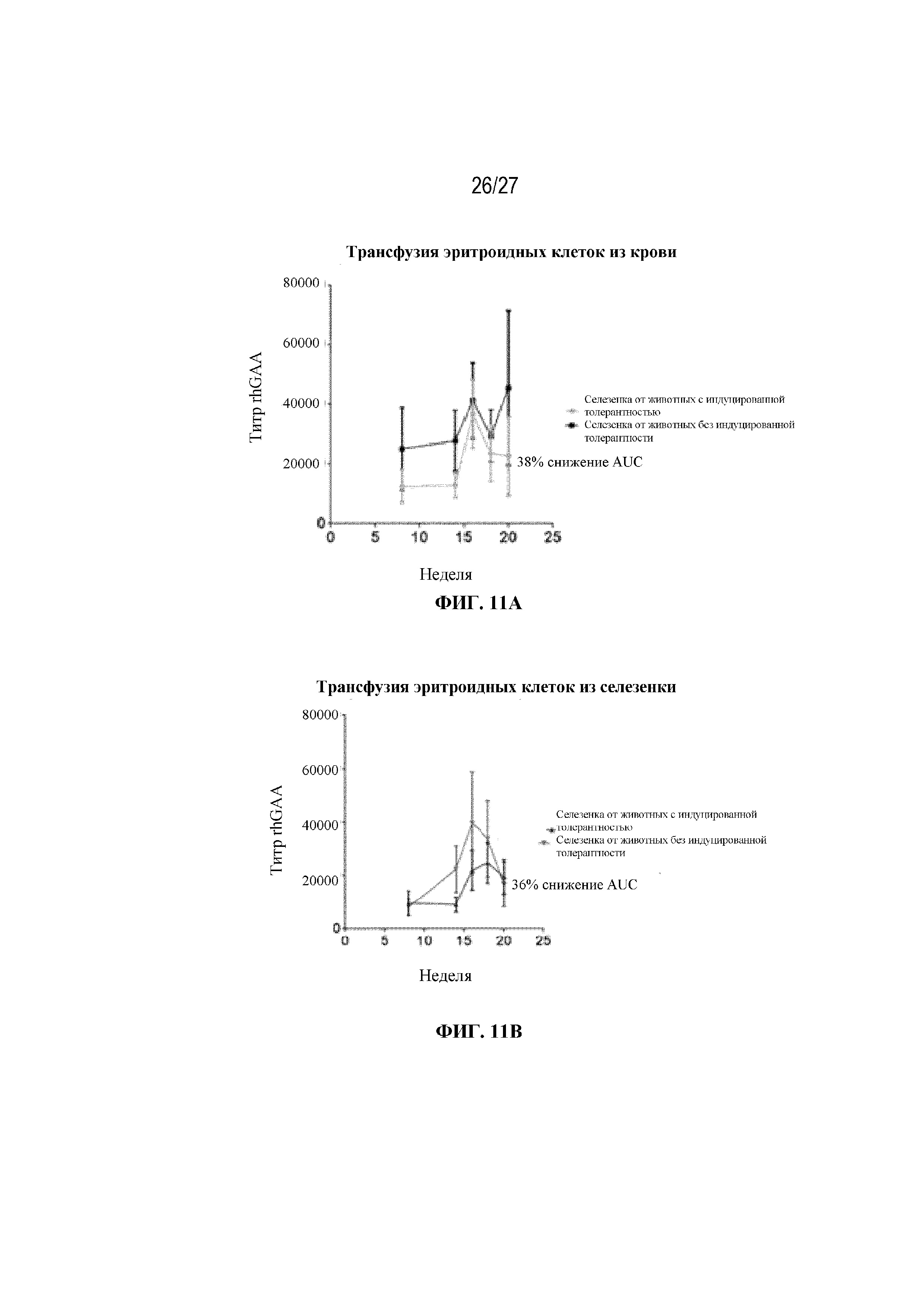
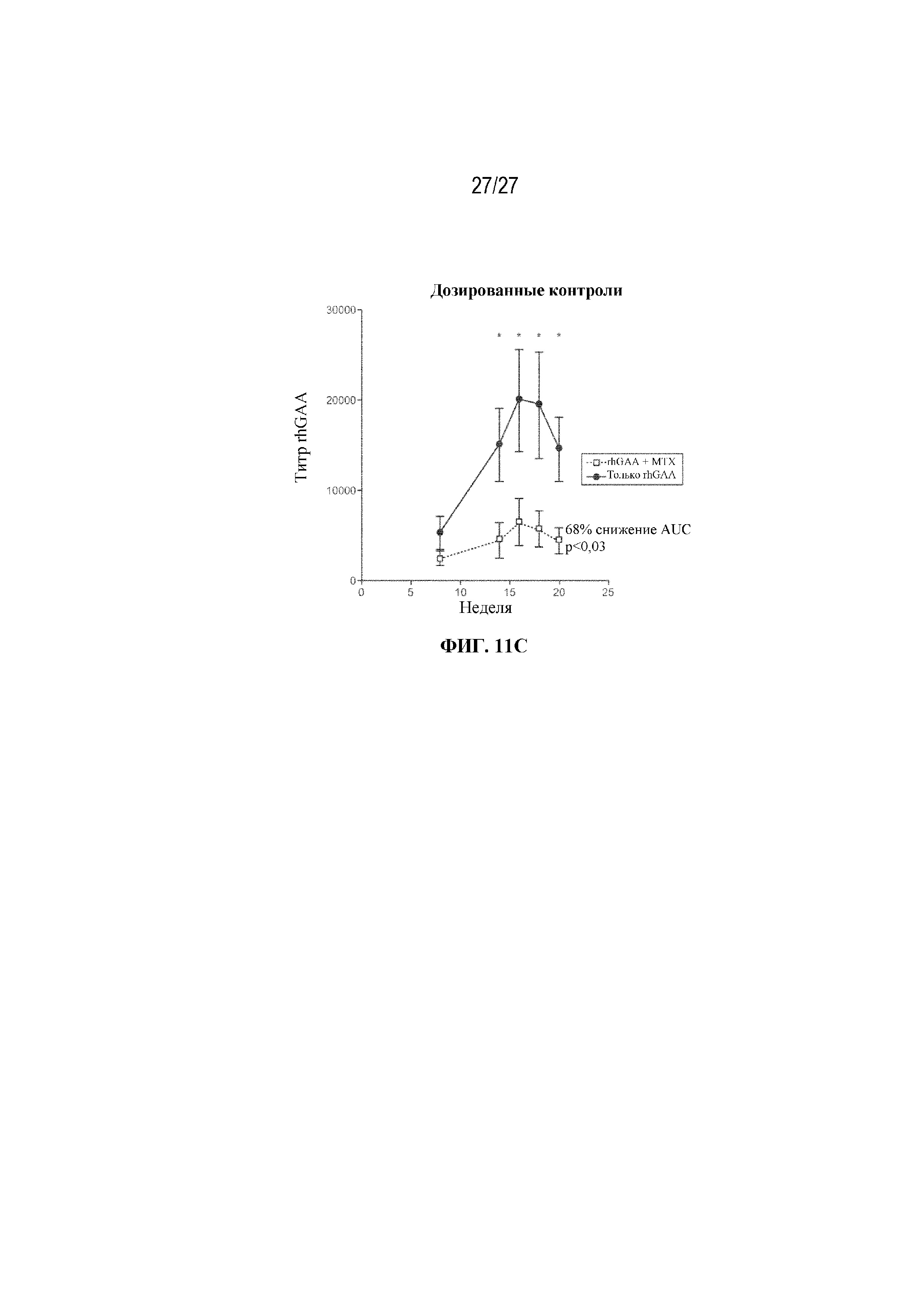
[49] На фиг. 11А - 11С показаны титры сывороточных антител к rhGAA у мышей, получающих 200 миллионов общих эритроцитов из крови мышей-доноров. Незрелые ядерные формы RBC селезенки, выделенные от мышей, которым проводили ITI схему низкодозового введения метотрексата кратковременным курсом через 7 дней от начала введения rhGAA, по-видимому, демонстрируют тенденцию к индуцированию иммунной толерантности у наивных мышей. Общие эритроидные клетки выделяли от мышей, обработанных с помощью rhGAA с (мыши с индуцированной толерантностью) и без (мыши без индуцированной толерантности) ITI схемой низкодозового введения метотрексата кратковременным курсом, и их вводили наивным мышам-реципиентам. После трансфузии и еженедельно после этого мышам-реципиентам в/в вводили rhGAA. Последующие дозы rhGAA сопровождались профилактическим введением дозы дифенгидрамина. Сыворотку крови отбирали для оценки титров антител к rhGAA с помощью ELISA. (фиг. 11А) 200 миллионов общих эритроцитов из крови мышей-доноров через 9 дней от начала введения rhGAA очищали путем лейкоредукции. Донорские эритроциты, выделенные из крови, имели чистоту ≥99,9%. (Фиг. 11В). 75 миллионов общих эритроцитов из селезенки мышей-доноров через 7 дней от начала введения rhGAA очищали с помощью положительного отбора с использованием микрогранул с антителом к Ter-119. Донорские эритроциты, выделенные от селезенки, имели чистоту ≥93,3%. (Фиг. 11C). Контрольные мыши, которым вводили rhGAA в присутствии и отсутствии ITI схемы низкодозового введения метотрексата кратковременным курсом. Наивысшее значение титра удалено. Указанные данные получены в одном эксперименте. Анализы проводили с использованием t-критериев Стьюдента, и значимость приведена как * ≤0,05. Вертикальные полосы представляют стандартную ошибку среднего. AUC: площадь под кривой.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[50] В настоящей заявке представлены способы лечения заболевания (такого как болезнь Помпе) у субъекта с помощью терапевтического средства и способы оценки уровня иммунной толерантности к терапевтическому средству у субъекта, предусматривающие выявление биомаркера эритропоэза после введения метотрексата и терапевтического средства.
[51] Иммунные ответы в виде образования антител к лекарственному средству (ADA) могут снизить эффективность лекарственного средства и негативно повлиять на безопасность для пациента. С целью уменьшения накопления ADA разработали схему индуцирования иммунной толерантности ("ITI"), которая предусматривает лечение с помощью схемы низкодозового введения метотрексата кратковременным курсом наряду с лечением с помощью терапевтического биопрепарата и в течение первой недели (Garman, Munroe et al., 2004; Joseph, Munroe et al., 2008). Длительная иммунная толерантность к видам ферментозаместительной терапии (например, с помощью алглюкозидазы альфа) и видам терапии антителами (например, с помощью антитимоцитарного глобулина) была продемонстрирована с помощью низкодозового введения метотрексата кратковременным курсом (Id; Joseph, Neff et al., 2012).
[52] Аспекты настоящего изобретения относятся к открытию того, что эритропоэз, инициированный посредством кратковременного низкодозового введения метотрексата, ассоциирован с индуцированием иммунной толерантности. Способы и наборы, описанные в данном документе, применимы для снижения нежелательных иммунных реакций у пациентов, получающих терапевтические препараты, например, виды ферментозаместительной терапии, которые приводят к выработке антител к лекарственному средству (ADA).
[53] В настоящем изобретении описаны молекулярные и клеточные ответы в селезенке, крови и костном мозге на кратковременное низкодозовое введение метотрексата (иллюстративная схема ITI) в контексте лечения терапевтическим биопрепаратом, то есть лечения рекомбинантной кислой α-глюкозидазой человека (rhGAA, алглюкозидаза альфа), ферментозаместительной терапии, используемой для лечения болезни Помпе. Транскрипционный и протеомный анализы, описанные в настоящем документе, выявили положительную регуляцию транскрипционных и белковых сигнатур в крови и селезенке, свидетельствующих об эритропоэзе после лечения посредством кратковременного низкодозового введения метотрексата (иллюстративная схема ITI). Клеточные исследования подтвердили значительное размножение Ter-119+ CD71+ незрелых ядерных форм эритроцитов (RBC) в селезенке и крови при обработке посредством кратковременного низкодозового введения метотрексата. Кроме того, иммунофлуоресцентный анализ подтвердил увеличение доли ядерных форм клеток, в том числе гематопоэтических предшественников, в красной пульпе селезенки. И наоборот, масс-спектрометрическая визуализация (tMSI) тканей показала сниженное выявление белков, связанных со зрелыми RBC в селезенке. Примечательно то, что время размножения таких RBC совпало со значительным накоплением регуляторных B-клеток, которые ранее продемонстрировали способность придавать иммунную толерантность наивным животным. Дальнейший анализ, описанный в настоящем документе, показывает, что трансфузия эритроидных клеток, полученных от животных, обработанных посредством кратковременного низкодозового введения метотрексата, обеспечило иммунную толерантность наивным реципиентам. Таким образом, биомаркеры эритропоэза, описанные в настоящем документе, можно использовать для оценки иммунной толерантности к терапевтическому средству и/или в качестве критериев для проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии в сочетании с дальнейшим введением терапевтического средства пациентам, которые получали метотрексат и терапевтическое средство.
[54] Соответственно, в одном аспекте настоящего изобретения представлен способ лечения субъекта, нуждающегося в лечении с помощью терапевтического средства (например, субъекта с болезнью Помпе, нуждающегося в лечении кислой α-глюкозидазой человека), предусматривающий: (a) введение субъекту эффективного количества метотрексата; (b) введение субъекту эффективного количества терапевтического средства; (c) выявление биомаркера эритропоэза в образце, полученном от субъекта в период времени от по меньшей мере одного дня до приблизительно 30 дней после введения метотрексата; и (d) продолжение дальнейшего лечения с помощью терапевтического средства с проведением или без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии исходя из уровня биомаркера эритропоэза по сравнению с таким уровнем в контроле. В некоторых вариантах осуществления изменение уровня биомаркера эритропоэза ассоциировано с индуцированием эритропоэза. В некоторых вариантах осуществления, если уровень биомаркера эритропоэза примерно равен такому уровню в контроле или ниже его, то стадия (d) предусматривает проведение дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии одновременно с дальнейшим лечением с помощью терапевтического средства; или если уровень биомаркера эритропоэза повышен по сравнению с таким уровнем в контроле, то стадия (d) предусматривает продолжение дальнейшего лечения с помощью терапевтического средства без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии. В некоторых вариантах осуществления, если уровень биомаркера эритропоэза практически повышен по сравнению с таким уровнем в контроле, то стадия (d) предусматривает проведение дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии одновременно с дальнейшим лечением с помощью терапевтического средства; или если уровень биомаркера эритропоэза равен такому уровню в контроле или ниже его, то стадия (d) предусматривает продолжение дальнейшего лечения с помощью терапевтического средства без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии.
[55] В другом аспекте настоящей заявки представлен способ оценивания уровня иммунной толерантности к терапевтическому средству у субъекта, нуждающегося в терапевтическом средстве (например, у субъекта с болезнью Помпе, нуждающегося в лечении кислой α-глюкозидазой человека), предусматривающий: (a) введение субъекту эффективного количества метотрексата; (b) введение субъекту терапевтически эффективного количества терапевтического средства; и (c) выявление биомаркера эритропоэза в образце, полученном от субъекта, где уровень биомаркера эритропоэза в образце по сравнению с таким уровнем в контроле свидетельствует об индуцировании иммунной толерантности у субъекта к терапевтическому средству.
[56] Также представлены наборы и изделия, применимые в способах, описанных в данном документе.
I. Определения
[57] Термин "выявление" используется в данном документе в самом широком смысле и включает как качественные, так и количественные измерения целевой молекулы. Выявление включает идентификацию лишь присутствия целевой молекулы в образце, а также определение того, присутствует ли целевая молекула в образце на уровнях, поддающихся выявлению.
[58] Термины "полипептид" и "белок" используются в данном документе взаимозаменяемо по отношению к полимерам из аминокислот любой длины. Полимер может быть линейным или разветвленным, он может содержать модифицированные аминокислоты, и он может быть разделен соединениями, не являющимися аминокислотами. Термины также охватывают полимер из аминокислот, который был модифицирован естественным путем или посредством вмешательства; например, посредством образования дисульфидной связи, гликозилирования, липидизации, ацетилирования, фосфорилирования или любой другой манипуляции или модификации, такой как конъюгирование с метящим компонентом. В объем данного определения также включены, например, полипептиды, содержащие один или несколько аналогов аминокислот (в том числе, например, неприродные аминокислоты и т.д.), а также другие модификации, известные в данной области техники. Используемые в данном документе термины "полипептид" и "белок" конкретно охватывают антитела. В некоторых примерах белок содержит множество полипептидов или полимерных цепей.
[59] Используемый в данном документе термин "биомаркер" относится к индикатору, например прогнозирующему, диагностическому и/или прогностическому, который можно выявить в образце. Биомаркер может служить индикатором конкретного подтипа заболевания, состояния или биологического ответа (например, нежелательного иммунного ответа на терапевтическое средство), характеризующегося определенными молекулярными, патологическими, гистологическими и/или клиническими признаками. В некоторых вариантах осуществления биомаркер представляет собой ген. В некоторых вариантах осуществления биомаркер представляет собой популяцию или субпопуляцию клеток. Биомаркеры включают без ограничения полинуклеотиды (например, ДНК и/или РНК), изменения числа копий полинуклеотидов (например, числа копий ДНК), полипептиды, модификации полипептидов и полинуклеотидов (например, посттрансляционные модификации), углеводороды, молекулярные маркеры на основе гликолипидов, клетки и/или популяции клеток.
[60] "Количество" или "уровень" биомаркера, ассоциированного с повышенным клиническим эффектом для индивидуума, представляет собой выявляемый уровень в биологическом образце. Их можно измерить с помощью способов, известных специалисту в данной области техники, а также раскрытых в данном документе. Уровень экспрессии или количество оцениваемого биомаркера можно использовать для определения ответа на лечение.
[61] Термин "биомаркер домашнего хозяйства" относится к биомаркеру или группе биомаркеров (например, полинуклеотидов и/или полипептидов), которые, как правило, в равной степени присутствуют во всех типах клеток. В некоторых вариантах осуществления биомаркер домашнего хозяйства представляет собой "ген домашнего хозяйства". Термин "ген домашнего хозяйства" в данном документе относится к гену или группе генов, которые кодируют белки, чья активность важна для поддержания клеточной функции и которые, как правило, в равной степени присутствуют во всех типах клеток.
[62] "Полинуклеотид" или "нуклеиновая кислота", используемые в данном документе взаимозаменяемо, относятся к полимерам из нуклеотидов любой длины и включают ДНК и РНК. Нуклеотиды могут представлять собой дезоксирибонуклеотиды, рибонуклеотиды, модифицированные нуклеотиды или основания, и/или их аналоги или любой субстрат, который можно встроить в полимер с помощью ДНК- или РНК-полимеразы или посредством синтетической реакции. Полинуклеотид может содержать модифицированные нуклеотиды, такие как метилированные нуклеотиды и их аналоги. В случае присутствия модификация нуклеотидной структуры может быть включена до или после сборки полимера. Последовательность нуклеотидов может прерываться компонентами, отличными от нуклеотидных. Полинуклеотид может быть дополнительно модифицирован после синтеза, например, путем конъюгации с меткой. Другие типы модификаций включают, например, "кэпы", замену одного или нескольких встречающихся в природе нуклеотидов аналогом, межнуклеотидные модификации, такие как, например, модификации с незаряженными связями (например, метилфосфонаты, сложные фосфотриэфиры, фосфоамидаты, карбаматы, и т.д.) и с заряженными связями (например, фосфоротиоат, фосфородитиоат и т.д.), содержащими боковые фрагменты, такие как, например, белки (например, нуклеазы, токсины, антитела, сигнальные пептиды, поли-L-лизин и т.д.), содержащие интеркаляторы (например, акридин, псорален и т.д.), содержащие хелаторы (например, металлы, радиоактивные металлы, бор, окислительные металлы и т. д.), содержащие алкилаторы, содержащие модифицированные связи (например, альфа-аномерные нуклеиновые кислоты и т.д.), а также немодифицированные формы полинуклеотида (полинуклеотидов). Кроме того, любая из гидроксильных групп, обычно присутствующих в сахаре, может быть заменена, например, фосфонатными группами, фосфатными группами, защищена стандартными защитными группами или активирована для получения дополнительных связей с дополнительными нуклеотидами, или может быть конъюгирована с твердой или полутвердой подложками. 5'- и 3'-концевой ОН может быть фосфорилирован или замещен аминами или фрагментами органической кэппирующей группы из 1-20 атомов углерода. Другие гидроксилы также могут быть дериватизированы до стандартных защитных групп. Полинуклеотиды могут также содержать аналогичные формы сахаров рибозы или дезоксирибозы, которые обычно известны в данной области техники, включая, например, 2'-O-метил-, 2'-O-аллил, 2'-фтор- или 2'-азидо-рибозу, аналоги карбоциклического сахара, α-аномерные сахара, эпимерные сахара, такие как арабиноза, ксилозы или ликсозы, пиранозные сахара, фуранозные сахара, седогептулозы, ациклические аналоги и аналоги нуклеозидов с удаленными азотистыми основаниями, например, метилрибозид. Одна или несколько сложных фосфодиэфирных связей могут быть заменены альтернативными связывающими группами. Эти альтернативные связывающие группы включают без ограничения варианты, в которых фосфат заменен P(O)S ("тиоат"), P(S)S ("дитиоат"), "(O)NR2 ("амидат"), P(O)R, P(O)OR', CO или CH2 ("формацеталь"), в котором каждый R или R' независимо представляет собой H или замещенный или незамещенный алкил (C1-20), необязательно содержащий простую эфирную (-О-) связь, арил, алкенил, циклоалкил, циклоалкенил или аралдил. Не все связи в полинуклеотиде должны быть идентичными. Предыдущее описание относится ко всем полинуклеотидам, указанным в данном документе, в том числе к РНК и ДНК.
[63] Используемый в данном документе термин "олигонуклеотид", как правило, относится к коротким однонитевым полинуклеотидам, длина которых составляет, но не обязательно, менее приблизительно 250 нуклеотидов. Олигонуклеотиды могут быть синтетическими. Термины "олигонуклеотид" и "полинуклеотид" не являются взаимоисключающими. Приведенное выше описание для полинуклеотидов в равной степени и полностью применимо к олигонуклеотидам.
[64] Термин "праймер" относится к однонитевому полинуклеотиду, который способен гибридизоваться с нуклеиновой кислотой и после этого способствует полимеризации комплементарной нуклеиновой кислоты, как правило, путем обеспечения свободной 3'-ОН-группы.
[65] Термин "малая молекула" относится к любой молекуле с молекулярной массой приблизительно 2000 дальтон или меньше, предпочтительно приблизительно 500 дальтон или меньше.
[66] Термин "образец", используемый в данном документе, относится к композиции, которая получена или происходит от субъекта и/или индивидуума, представляющего интерес, которая содержит клеточный и/или другой молекулярный объект, который должен быть охарактеризован и/или идентифицирован, например, на основании физических, биохимических, химических и/или физиологических характеристик. Образцы включают без ограничения первичные или культивируемые клетки или клеточные линии, клеточные супернатанты, клеточные лизаты, тромбоциты, сыворотку крови, плазму крови, стекловидное тело, лимфатическую жидкость, синовиальную жидкость, фолликулярную жидкость, семенную жидкость, амниотическую жидкость, молоко, цельную кровь, клетки крови, мочу, спинномозговую жидкость, слюну, мокроту, слезы, пот, слизь, опухолевые лизаты и культуральную среду, экстракты тканей, например, гомогенизированную ткань, опухолевую ткань, клеточные экстракты и их комбинации.
[67] Под "образцом ткани" или "образцом клеток" подразумевается набор сходных клеток, полученных из ткани или компартмента субъекта или индивидуума. Источником образца ткани или клетки может быть плотная ткань, например, из свежего, замороженного и/или фиксированного органа, образца ткани, биоптата и/или аспирата; кровь или любые компоненты крови, такие как плазма крови; физиологические жидкости, например, спинномозговая жидкость, амниотическая жидкость, перитонеальная жидкость или интерстициальная жидкость; клетки, отобранные в любое время в период гестации или развития субъекта. Образец ткани также может представлять собой первичные или культивируемые клетки или клеточные линии. Необязательно образец ткани или клетки получают из пораженных заболеванием ткани/органа. Образец ткани может содержать соединения, которые в природе не смешиваются с тканью, такие как консерванты, антикоагулянты, буферы, фиксаторы, питательные вещества, антибиотики или им подобные.
[68] Используемый в данном документе термин "эталонный образец", "эталонная клетка", "контрольная ткань", "контрольный образец", "контрольная клетка" или "контрольная ткань" относится к образцу, клетке, ткани, стандарту или уровню, которые используется для сравнения.
[69] Для целей настоящего изобретения "срез" образца ткани означает отдельную часть или кусок образца ткани, например, тонкий кусочек ткани или клеток, вырезанных из образца ткани. Понятно, что несколько срезов образцов ткани могут быть взяты и подвергнуты анализу при условии, что подразумевается, что один и тот же срез образца ткани может быть проанализирован как на морфологическом, так и на молекулярном уровнях или проанализирован как в отношении полипептидов, так и полинуклеотидов.
[70] Под "коррелировать" или "коррелирование" подразумевается сравнение любым способом выполнения и/или результатов первого анализа или протокола с выполнением и/или результатами второго анализа или протокола. Например, можно использовать результаты первого анализа или протокола при выполнении второго протокола и/или можно использовать результаты первого анализа или протокола, чтобы определить, следует ли выполнять второй анализ или протокол. Что касается варианта осуществления анализа или протокола полипептида, можно использовать результаты анализа или протокола экспрессии полипептида, чтобы определить, следует ли проводить конкретную схему лечения. Что касается варианта осуществления анализа или протокола полинуклеотида, можно использовать результаты анализа или протокола экспрессии полинуклеотида, чтобы определить, следует ли проводить конкретную схему лечения.
[71] Термин "по сути одинаковый", используемый в данном документе, обозначает достаточно высокую степень сходства между двумя числовыми значениями, поэтому специалист в данной области техники будет считать, что различие между этими двумя значениями является небольшим или не имеет биологической и/или статистической значимости в контексте биологической характеристики, измеряемой посредством указанных значений (например, значений Kd или экспрессии). Разница между указанными двумя значениями составляет, например, менее приблизительно 50%, менее приблизительно 40%, менее приблизительно 30%, менее приблизительно 20% и/или менее приблизительно 10% в зависимости от эталонного/сравниваемого значения.
[72] Фраза "существенно различающийся", используемая в данном документе, обозначает достаточно высокую степень различия между двумя числовыми значениями, так что специалист в данной области техники будет считать, что различие между этими двумя значениями имеет статистическую значимость в контексте биологической характеристики, измеряемой посредством указанных значений (например, значений Kd). Разница между указанными двумя значениями составляет, например, более приблизительно 10%, более приблизительно 20%, более приблизительно 30%, более приблизительно 40% и/или более приблизительно 50% в зависимости от значения для эталонной/сравниваемой молекулы.
[73] "Эффективное количество" относится к количеству средства, эффективному в дозах и в течение периодов времени, необходимых для достижения требуемого физиологического результата.
[74] "Терапевтически эффективное количество" относится к количеству терапевтического средства для лечения или профилактики заболевания или состояния у субъекта. В некоторых вариантах осуществления терапевтически эффективное количество терапевтического средства может продлить выживаемость (в том числе общую выживаемость и выживаемость без прогрессирования заболевания); привести к объективному ответу (в том числе полному ответу или частичному ответу); облегчить по меньшей мере частично один или несколько признаков или симптомов заболевания или состояния; и/или улучшить качество жизни субъекта.
[75] Термин "фармацевтическая композиция" относится к препарату, который представлен в такой форме, которая обеспечивает биологическую активность активного ингредиента, присутствующего в нем, и который не содержит дополнительных компонентов, обладающих неприемлемой токсичностью для субъекта, которому будут вводить состав.
[76] "Фармацевтически приемлемый носитель" относится к ингредиенту в фармацевтическом составе, отличному от активного ингредиента, который нетоксичен для субъекта. Фармацевтически приемлемый носитель включает без ограничения буфер, вспомогательное вещество, стабилизатор или консервант.
[77] Используемый в данном документе термин "лечение" (и его грамматические варианты, такие как "лечить" или "проведение лечения") относится к клиническому вмешательству в попытке изменить естественное течение заболевания у индивидуума, которого подвергают лечению, и может проводиться в ходе протекания клинически выраженной патологии. Требуемые эффекты лечения включают без ограничения предупреждение рецидива заболевания, ослабление симптомов, уменьшение любых прямых или косвенных патологических последствий заболевания, уменьшение скорости прогрессирования заболевания, улучшение или смягчение состояния заболевания и ремиссию или улучшенный прогноз.
[78] Используемое в данном документе выражение "профилактическое лечение" относится к лечению, при котором у индивидуума известно, или подозревается наличие, или имеется риск наличия нарушения, но не проявляются симптомы или проявляются минимальные симптомы нарушения. Индивидуума, подвергаемого профилактическому лечению, можно подвергать лечению до начала проявления симптомов.
[79] "Индивидуум" или "субъект" является млекопитающим. Млекопитающие включают без ограничения одомашненных животных (например, коров, овец, кошек, собак и лошадей), приматов (например, людей и нечеловекообразных приматов, таких как обезьяны), кроликов и грызунов (например, мышей и крыс). В некоторых вариантах осуществления индивидуум или субъект является человеком.
[80] Термин "одновременно" используется в данном документе для обозначения введения двух или более терапевтических средств, когда по меньшей мере часть введения перекрывается во времени или когда введение не строго перекрывается во времени, но когда одно средство остается на системном уровне, достаточном для продолжения оказания физиологического эффекта, тогда как второе средство вводят по меньшей мере частично. Соответственно, одновременное введение включает схему введения доз, согласно которой введение одного или нескольких средств продолжают после прекращения введения одного или нескольких других средств или согласно которой одно или несколько средств вводят после того, как вводили одно или несколько других средств, но остаются на системном уровне, достаточном для продолжения оказания физиологического эффекта.
[81] Под "уменьшением или ингибированием" подразумевается способность вызывать общее снижение на приблизительно любое значение в процентах из 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95% или больше.
[82] Под "увеличением или повышением" подразумевается способность вызывать общее увеличение приблизительно на приблизительно любое значение в процентах из 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 85%, 90%, 95% или больше.
[83] Термин "листок-вкладыш" используется для обозначения инструкций, обычно включаемых в коммерческие упаковки терапевтических продуктов, которые содержат информацию о показаниях, применении, дозировке, введении, комбинированной терапии, противопоказаниях и/или предупреждениях относительно применения таких терапевтических продуктов.
[84] "Готовое изделие" представляет собой любое изделие (например, упаковку или контейнер) или набор, содержащий по меньшей мере один реагент, например лекарственный препарат для лечения заболевания или состояния (например, рака), или зонд для специфического выявления биомаркера, описанного в данном документе. В определенных вариантах осуществления изделие или набор рекламируются, распространяются или продаются как единое целое для осуществления способов, описанных в данном документе.
[85] Фраза "исходя из" при использовании в данном документе означает, что информация об одном или нескольких биомаркерах используется для обоснования решения о лечении, для информации, представленной на листке-вкладыше, или руководства по маркетингу/рекламе и т.д.
[86] Антитело, "которое связывает" антиген, представляющий интерес, например белок клетки-хозяина, представляет собой белок, который связывает антиген с аффинностью, достаточной для того, чтобы антитело можно было применять в качестве реагента для анализа, например, в качестве захватывающего антитела или в качестве антитела для выявления. Как правило, такое антитело перекрестно реагирует с другими полипептидами (например, с другими антигенами) в незначительной степени.
[87] Что касается связывания полипептида с целевой молекулой, то термин "специфическое связывание" или "специфически связывается с" или "специфичен к" для конкретного полипептида или эпитопа на конкретном целевом полипептиде означает связывание, которое измеримо отличается от неспецифического взаимодействия. Специфическое связывание может быть измерено, например, путем определения связывания целевой молекулы по сравнению со связыванием контрольной молекулы, которая, как правило, представляет собой молекулу, состоящую из аналогичных структурных элементов, не обладающих связывающей активностью (например, контрольный белок, который не является идентичным целевому белку).
[88] "Аффинность", в целом, относится к силе общих нековалентных взаимодействий между одним сайтом связывания молекулы (например, антителом) и его партнером по связыванию (например, антигеном). Если не указано иное, как используется в данном документе, "аффинность связывания" относится к истинной аффинности связывания, которая отражает взаимодействие 1:1 между представителями связывающейся пары (например, антителом и антигеном). Аффинность молекулы X к ее партнеру Y в целом может быть представлена константой диссоциации (Kd). Аффинность можно измерить с помощью общепринятых способов, известных в данной области техники, в том числе способов, описанных в данном документе.
[89] Термин "антитело" в данном описании используется в самом широком смысле и конкретно охватывает моноклональные антитела, поликлональные антитела, полуантитела, полиспецифические антитела (например, биспецифические антитела), образованные по меньшей мере из двух интактных антител, и фрагменты антител до тех пор, пока они демонстрируют требуемую биологическую активность. Термин "иммуноглобулин" (Ig) используется в данном документе взаимозаменяемо с термином антитело.
[90] Понятно, что варианты осуществления настоящего изобретения, описанные в данном документе, включают варианты осуществления "содержащие", "состоящие из" и/или "состоящие по сути из".
[91] Ссылка на "приблизительно" в отношении значения или параметра в данном документе включает (и описывает) варианты, которые, собственно, направлены на данное значение или параметр. Например, описание, относящееся к "приблизительно X", включает описание "X".
[92] Используемая в данном документе ссылка на "не" в отношении значения или параметра, как правило, означает и описывает "отличное от" значение или параметр. Например, способ, не используемый для лечения рака типа X, означает, что способ используется для лечения рака, отличного от рака типа X.
[93] Используемый в данном документе термин "приблизительно X-Y" имеет то же значение, что и "от приблизительно X до приблизительно Y".
[94] Используемые в данном документе и в прилагаемой формуле изобретения формы единственного числа включают ссылки на множественное число, если контекст явно не указывает иное.
II. Способы лечения и оценки
[95] В настоящем документе представлены способы лечения субъекта, нуждающегося в лечении с помощью терапевтического средства, основанные на выявлении биомаркера эритропоэза в образце от субъекта после введения терапевтического средства и метотрексата.
[96] В некоторых вариантах осуществления представлен способ лечения субъекта (например, субъекта-человека), нуждающегося в лечении с помощью терапевтического средства, предусматривающий: (a) введение субъекту эффективного количества метотрексата; (b) введение субъекту эффективного количества терапевтического средства; (c) выявление биомаркера эритропоэза в образце, полученном от субъекта в период времени от по меньшей мере одного дня до приблизительно 30 дней (в частности, от приблизительно 7 дней до приблизительно 14 дней) после введения метотрексата; и (d) продолжение дальнейшего лечения с помощью терапевтического средства с проведением или без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии исходя из уровня биомаркера эритропоэза по сравнению с таким уровнем в контроле. В некоторых вариантах осуществления изменение уровня биомаркера эритропоэза ассоциировано с индуцированием эритропоэза. В некоторых вариантах осуществления, если уровень биомаркера эритропоэза примерно равен такому уровню в контроле или ниже его, то стадия (d) предусматривает проведение дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии одновременно с дальнейшим лечением с помощью терапевтического средства; или если уровень биомаркера эритропоэза повышен по сравнению с таким уровнем в контроле, то стадия (d) предусматривает продолжение дальнейшего лечения с помощью терапевтического средства без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии. В некоторых вариантах осуществления биомаркер эритропоэза представляет собой уровень содержания незрелых ядерных форм эритроцитов, фракции незрелых ретикулоцитов или клеточных нуклеиновых кислот. В некоторых вариантах осуществления, если уровень биомаркера эритропоэза практически повышен по сравнению с таким уровнем в контроле, то стадия (d) предусматривает проведение дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии одновременно с дальнейшим лечением с помощью терапевтического средства; или если уровень биомаркера эритропоэза равен такому уровню в контроле или ниже его, то стадия (d) предусматривает продолжение дальнейшего лечения с помощью терапевтического средства без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии. В некоторых вариантах осуществления биомаркером эритропоэза является гематокрит. В некоторых вариантах осуществления указанное выявление биомаркера эритропоэза предусматривает выявление экспрессии гена, ассоциированного с эритропоэзом, где ген ассоциирован с одним или несколькими из гемопоэза, гомеостаза ионов железа, регуляции дифференцировки эритроцитов и метаболизма гема. В некоторых вариантах осуществления ген, ассоциированный с эритропоэзом, представляет собой ген, кодирующий рецептор трансферрина (такой как CD71), трансферрин, Ly76, CD44, CD235a, ALAS2 или GATA-1. В некоторых вариантах осуществления биомаркер эритропоэза представляет собой кофактор, ассоциированный с эритропоэзом, как, например, порфирин, порфиринсодержащее соединение или тетрапиррол. В некоторых вариантах осуществления эффективное количество метотрексата вводят в одном цикле или в трех циклах. В некоторых вариантах осуществления эффективное количество метотрексата вводят в одном, двух, трех, четырех, пяти или более циклах. В некоторых вариантах осуществления метотрексат вводят в период времени от 48 часов до проведения лечения терапевтическим средством до 48 часов (в частности, в приблизительно 24 часа и приблизительно 48 часов) после этого. В некоторых вариантах осуществления метотрексат вводят в дозе, составляющей от 0,1 мг/кг до 5 мг/кг. В некоторых вариантах осуществления проведение дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии предусматривает введение одного или нескольких из ритуксимаба, внутривенного иммуноглобулина (IVIG), циклофосфамида, бортезомиба, азатиоприна, циклоспорина, микофенолата, кортикостероида и применение стратегии формирования антигенспецифической толерантности (например, более частое введение дозы и/или более высокая доза терапевтического препарата, необязательно с сопутствующим IVIG).
[97] В некоторых вариантах осуществления представлен способ лечения субъекта, нуждающегося в лечении с помощью терапевтического полипептида (например, моноклонального антитела или фермента), предусматривающий: (a) введение субъекту эффективного количества метотрексата; (b) введение субъекту эффективного количества терапевтического полипептида; (c) выявление биомаркера эритропоэза в образце, полученном от субъекта в период времени от по меньшей мере одного дня до приблизительно 30 дней (в частности, от приблизительно 7 дней до приблизительно 14 дней) после введения метотрексата; и (d) продолжение дальнейшего лечения с помощью терапевтического полипептида с проведением или без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии исходя из уровня биомаркера эритропоэза по сравнению с таким уровнем в контроле. В некоторых вариантах осуществления изменение уровня биомаркера эритропоэза ассоциировано с индуцированием эритропоэза. В некоторых вариантах осуществления, если уровень биомаркера эритропоэза примерно равен такому уровню в контроле или ниже его, то стадия (d) предусматривает проведение дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии одновременно с дальнейшим лечением с помощью терапевтического полипептида; или если уровень биомаркера эритропоэза повышен по сравнению с таким уровнем в контроле, то стадия (d) предусматривает продолжение дальнейшего лечения с помощью терапевтического полипептида без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии. В некоторых вариантах осуществления биомаркер эритропоэза представляет собой уровень содержания незрелых ядерных форм эритроцитов, фракции незрелых ретикулоцитов или клеточных нуклеиновых кислот. В некоторых вариантах осуществления, если уровень биомаркера эритропоэза практически повышен по сравнению с таким уровнем в контроле, то стадия (d) предусматривает проведение дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии одновременно с дальнейшим лечением с помощью терапевтического полипептида; или если уровень биомаркера эритропоэза равен такому уровню в контроле или ниже его, то стадия (d) предусматривает продолжение дальнейшего лечения с помощью терапевтического полипептида без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии. В некоторых вариантах осуществления биомаркером эритропоэза является гематокрит. В некоторых вариантах осуществления указанное выявление биомаркера эритропоэза предусматривает выявление экспрессии гена, ассоциированного с эритропоэзом, где ген ассоциирован с одним или несколькими из гемопоэза, гомеостаза ионов железа, регуляции дифференцировки эритроцитов и метаболизма гема. В некоторых вариантах осуществления ген, ассоциированный с эритропоэзом, представляет собой ген, кодирующий рецептор трансферрина (такой как CD71), трансферрин, Ly76, CD44, CD235a, ALAS2 или GATA-1. В некоторых вариантах осуществления биомаркер эритропоэза представляет собой кофактор, ассоциированный с эритропоэзом, как, например, порфирин, порфиринсодержащее соединение или тетрапиррол. В некоторых вариантах осуществления эффективное количество метотрексата вводят в одном цикле или в трех циклах. В некоторых вариантах осуществления эффективное количество метотрексата вводят в одном, двух, трех, четырех, пяти или более циклах. В некоторых вариантах осуществления метотрексат вводят в период времени от 48 часов до проведения и через 48 часов (в частности, в приблизительно 24 часа и приблизительно 48 часов) после проведения лечения терапевтическим полипептидом. В некоторых вариантах осуществления метотрексат вводят в дозе, составляющей от 0,1 мг/кг до 5 мг/кг. В некоторых вариантах осуществления проведение дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии предусматривает введение одного или нескольких из ритуксимаба, внутривенного иммуноглобулина (IVIG), циклофосфамида, бортезомиба, азатиоприна, циклоспорина, микофенолата, кортикостероида и применение стратегии формирования антигенспецифической толерантности (например, более частое введение дозы и/или более высокая доза терапевтического препарата, необязательно с сопутствующим IVIG). В некоторых вариантах осуществления терапевтический полипептид представляет собой средство, истощающее лимфоциты, например алемтузумаб. В некоторых вариантах осуществления терапевтический полипептид является ферментом, таким как альфа-галактозидаза А человека или кислая α-глюкозидаза человека.
[98] В некоторых вариантах осуществления представлен способ лечения субъекта (как, например, субъекта-человека), нуждающегося в лечении с помощью терапевтического полипептида (как, например, моноклонального антитела или фермента), предусматривающий: (а) введение субъекту эффективного количества метотрексата; (b) введение субъекту эффективного количества терапевтического полипептида; (c) выявление незрелых ядерных форм эритроцитов в образце, полученном от субъекта в период времени от по меньшей мере одного дня до приблизительно 30 дней после введения метотрексата; и (d) если уровень незрелых ядерных форм эритроцитов примерно равен такому уровню в контроле или ниже его, проведение дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии одновременно с дальнейшим лечением с помощью терапевтического полипептида; или если уровень незрелых ядерных форм эритроцитов повышен по сравнению с таким уровнем в контроле, продолжение дальнейшего лечения с помощью терапевтического полипептида без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии. В некоторых вариантах осуществления образец представляет собой образец крови или образец фракции крови, содержащей мононуклеарные клетки периферической крови. В некоторых вариантах осуществления образец представляет собой образец плазмы крови. В некоторых вариантах осуществления контроль представляет собой исторический контроль или плацебо-контроль. В некоторых вариантах осуществления эффективное количество метотрексата вводят в одном цикле или в трех циклах. В некоторых вариантах осуществления эффективное количество метотрексата вводят в одном, двух, трех, четырех, пяти или более циклах. В некоторых вариантах осуществления метотрексат вводят в период времени от 48 часов до проведения и через 48 часов (в частности, в приблизительно 24 часа и приблизительно 48 часов) после проведения лечения терапевтическим полипептидом. В некоторых вариантах осуществления метотрексат вводят в дозе, составляющей от 0,1 мг/кг до 5 мг/кг. В некоторых вариантах осуществления проведение дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии предусматривает введение одного или нескольких из ритуксимаба, внутривенного иммуноглобулина (IVIG), циклофосфамида, бортезомиба, азатиоприна, циклоспорина, микофенолата, кортикостероида и применение стратегии формирования антигенспецифической толерантности (например, более частое введение дозы и/или более высокая доза терапевтического препарата, необязательно с сопутствующим IVIG).
[99] В некоторых вариантах осуществления представлен способ лечения субъекта (как, например, субъекта-человека), нуждающегося в лечении с помощью терапевтического полипептида (как, например, моноклонального антитела или фермента), предусматривающий: (а) введение субъекту эффективного количества метотрексата; (b) введение субъекту эффективного количества терапевтического полипептида; (c) выявление гена (как, например, РНК-транскрипта или белка), ассоциированного с эритропоэзом, в образце, полученном от субъекта в период времени от по меньшей мере одного дня до приблизительно 30 дней после введения метотрексата; и (d) если уровень гена, ассоциированного с эритропоэзом, примерно равен такому уровню в контроле или ниже его, проведение дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии одновременно с дальнейшим лечением с помощью терапевтического полипептида; или если уровень гена, ассоциированного с эритропоэзом, повышен по сравнению с таким уровнем в контроле, продолжение дальнейшего лечения с помощью терапевтического полипептида без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии. В некоторых вариантах осуществления ген, ассоциированный с эритропоэзом, ассоциирован с одним или несколькими из гемопоэза, гомеостаза ионов железа, регуляции дифференцировки эритроцитов и метаболизма гема. В некоторых вариантах осуществления ген, ассоциированный с эритропоэзом, представляет собой ген, кодирующий рецептор трансферрина (такой как CD71), трансферрин, Ly76, CD44, CD235a, ALAS2 или GATA-1. В некоторых вариантах осуществления образец представляет собой образец крови или образец фракции крови, содержащей мононуклеарные клетки периферической крови. В некоторых вариантах осуществления образец представляет собой образец плазмы крови. В некоторых вариантах осуществления контроль представляет собой исторический контроль или плацебо-контроль. В некоторых вариантах осуществления эффективное количество метотрексата вводят в одном цикле или в трех циклах. В некоторых вариантах осуществления эффективное количество метотрексата вводят в одном, двух, трех, четырех, пяти или более циклах. В некоторых вариантах осуществления метотрексат вводят в период времени от 48 часов до проведения и через 48 часов (в частности, в приблизительно 24 часа и приблизительно 48 часов) после проведения лечения терапевтическим полипептидом. В некоторых вариантах осуществления метотрексат вводят в дозе, составляющей от 0,1 мг/кг до 5 мг/кг. В некоторых вариантах осуществления проведение дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии предусматривает введение одного или нескольких из ритуксимаба, внутривенного иммуноглобулина (IVIG), циклофосфамида, бортезомиба, азатиоприна, циклоспорина, микофенолата, кортикостероида и применение стратегии формирования антигенспецифической толерантности (например, более частое введение дозы и/или более высокая доза терапевтического препарата, необязательно с сопутствующим IVIG).
[100] В некоторых вариантах осуществления представлен способ лечения субъекта (как, например, субъекта-человека), нуждающегося в лечении с помощью терапевтического полипептида (как, например, моноклонального антитела или фермента), предусматривающий: (а) введение субъекту эффективного количества метотрексата; (b) введение субъекту эффективного количества терапевтического полипептида; (c) выявление кофактора, ассоциированного с эритропоэзом, в образце, полученном от субъекта в период времени от по меньшей мере одного дня до приблизительно 30 дней после введения метотрексата; и (d) если уровень кофактора, ассоциированного с эритропоэзом, примерно равен такому уровню в контроле или ниже его, проведение дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии одновременно с дальнейшим лечением с помощью терапевтического полипептида; или если уровень кофактора, ассоциированного с эритропоэзом, повышен по сравнению с таким уровнем в контроле, продолжение дальнейшего лечения с помощью терапевтического полипептида без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии. В некоторых вариантах осуществления кофактором, ассоциированным с эритропоэзом, является порфирин, порфиринсодержащее соединение или тетрапиррол. В некоторых вариантах осуществления образец представляет собой образец крови или образец фракции крови, содержащей мононуклеарные клетки периферической крови. В некоторых вариантах осуществления образец представляет собой образец плазмы крови. В некоторых вариантах осуществления контроль представляет собой исторический контроль или плацебо-контроль. В некоторых вариантах осуществления эффективное количество метотрексата вводят в одном цикле или в трех циклах. В некоторых вариантах осуществления эффективное количество метотрексата вводят в одном, двух, трех, четырех, пяти или более циклах. В некоторых вариантах осуществления метотрексат вводят в период времени от 48 часов до проведения и через 48 часов (в частности, в приблизительно 24 часа и приблизительно 48 часов) после проведения лечения терапевтическим полипептидом. В некоторых вариантах осуществления метотрексат вводят в дозе, составляющей от 0,1 мг/кг до 5 мг/кг. В некоторых вариантах осуществления проведение дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии предусматривает введение одного или нескольких из ритуксимаба, внутривенного иммуноглобулина (IVIG), циклофосфамида, бортезомиба, азатиоприна, циклоспорина, микофенолата, кортикостероида и применение стратегии формирования антигенспецифической толерантности (например, более частое введение дозы и/или более высокая доза терапевтического препарата, необязательно с сопутствующим IVIG).
[101] В некоторых вариантах осуществления представлен способ лечения субъекта с лизосомной болезнью накопления, нуждающегося в лечении терапевтическим средством (как, например, ферментом), предусматривающий: (a) введение субъекту эффективного количества метотрексата; (b) введение субъекту эффективного количества терапевтического средства; (c) выявление биомаркера эритропоэза в образце, полученном от субъекта в период времени от по меньшей мере одного дня до приблизительно 30 дней (в частности, от приблизительно 7 дней до приблизительно 14 дней) после введения метотрексата; и (d) продолжение дальнейшего лечения с помощью терапевтического средства с проведением или без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии исходя из уровня биомаркера эритропоэза по сравнению с таким уровнем в контроле. В некоторых вариантах осуществления изменение уровня биомаркера эритропоэза ассоциировано с индуцированием эритропоэза. В некоторых вариантах осуществления, если уровень биомаркера эритропоэза примерно равен такому уровню в контроле или ниже его, то стадия (d) предусматривает проведение дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии одновременно с дальнейшим лечением с помощью терапевтического средства; или если уровень биомаркера эритропоэза повышен по сравнению с таким уровнем в контроле, то стадия (d) предусматривает продолжение дальнейшего лечения с помощью терапевтического средства без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии. В некоторых вариантах осуществления биомаркер эритропоэза представляет собой уровень содержания незрелых ядерных форм эритроцитов, фракции незрелых ретикулоцитов или клеточных нуклеиновых кислот. В некоторых вариантах осуществления, если уровень биомаркера эритропоэза практически повышен по сравнению с таким уровнем в контроле, то стадия (d) предусматривает проведение дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии одновременно с дальнейшим лечением с помощью терапевтического средства; или если уровень биомаркера эритропоэза равен такому уровню в контроле или ниже его, то стадия (d) предусматривает продолжение дальнейшего лечения с помощью терапевтического средства без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии. В некоторых вариантах осуществления биомаркером эритропоэза является гематокрит. В некоторых вариантах осуществления указанное выявление биомаркера эритропоэза предусматривает выявление экспрессии гена, ассоциированного с эритропоэзом, где ген ассоциирован с одним или несколькими из гемопоэза, гомеостаза ионов железа, регуляции дифференцировки эритроцитов и метаболизма гема. В некоторых вариантах осуществления ген, ассоциированный с эритропоэзом, представляет собой ген, кодирующий рецептор трансферрина (такой как CD71), трансферрин, Ly76, CD44, CD235a, ALAS2 или GATA-1. В некоторых вариантах осуществления биомаркер эритропоэза представляет собой кофактор, ассоциированный с эритропоэзом, как, например, порфирин, порфиринсодержащее соединение или тетрапиррол. В некоторых вариантах осуществления образец представляет собой образец крови или образец фракции крови, содержащей мононуклеарные клетки периферической крови. В некоторых вариантах осуществления образец представляет собой образец плазмы крови. В некоторых вариантах осуществления контроль представляет собой исторический контроль или плацебо-контроль. В некоторых вариантах осуществления эффективное количество метотрексата вводят в одном цикле или в трех циклах. В некоторых вариантах осуществления эффективное количество метотрексата вводят в одном, двух, трех, четырех, пяти или более циклах. В некоторых вариантах осуществления метотрексат вводят в период времени от 48 часов до проведения лечения терапевтическим средством до 48 часов (в частности, в приблизительно 24 часа и приблизительно 48 часов) после этого. В некоторых вариантах осуществления метотрексат вводят в дозе, составляющей от 0,1 мг/кг до 5 мг/кг. В некоторых вариантах осуществления проведение дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии предусматривает введение одного или нескольких из ритуксимаба, внутривенного иммуноглобулина (IVIG), циклофосфамида, бортезомиба, азатиоприна, циклоспорина, микофенолата, кортикостероида и применение стратегии формирования антигенспецифической толерантности (например, более частое введение дозы и/или более высокая доза терапевтического препарата, необязательно с сопутствующим IVIG). В некоторых вариантах осуществления терапевтический полипептид представляет собой альфа-галактозидазу А человека или кислую α-глюкозидазу человека. В некоторых вариантах осуществления у субъекта имеется болезнь Гоше и он нуждается в лечении с помощью альфа-галактозидазы А человека.
[102] В некоторых вариантах осуществления представлен способ лечения болезни Помпе (например, инфантильной формы и/или CRIM-отрицательной формы болезни Помпе) у субъекта (как, например, у человека), предусматривающий: (a) введение субъекту эффективного количества метотрексата; (b) введение субъекту эффективного количества терапевтического средства (как, например, кислой α-глюкозидазы человека); (c) выявление биомаркера эритропоэза в образце, полученном от субъекта в период времени от по меньшей мере одного дня до приблизительно 30 дней (в частности, от приблизительно 7 дней до приблизительно 14 дней) после введения метотрексата; и (d) продолжение дальнейшего лечения с помощью терапевтического средства с проведением или без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии исходя из уровня биомаркера эритропоэза по сравнению с таким уровнем в контроле. В некоторых вариантах осуществления изменение уровня биомаркера эритропоэза ассоциировано с индуцированием эритропоэза. В некоторых вариантах осуществления, если уровень биомаркера эритропоэза примерно равен такому уровню в контроле или ниже его, то стадия (d) предусматривает проведение дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии одновременно с дальнейшим лечением с помощью терапевтического средства; или если уровень биомаркера эритропоэза повышен по сравнению с таким уровнем в контроле, то стадия (d) предусматривает продолжение дальнейшего лечения с помощью терапевтического средства без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии. В некоторых вариантах осуществления биомаркер эритропоэза представляет собой уровень содержания незрелых ядерных форм эритроцитов, фракции незрелых ретикулоцитов или клеточных нуклеиновых кислот. В некоторых вариантах осуществления, если уровень биомаркера эритропоэза практически повышен по сравнению с таким уровнем в контроле, то стадия (d) предусматривает проведение дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии одновременно с дальнейшим лечением с помощью терапевтического средства; или если уровень биомаркера эритропоэза равен такому уровню в контроле или ниже его, то стадия (d) предусматривает продолжение дальнейшего лечения с помощью терапевтического средства без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии. В некоторых вариантах осуществления биомаркером эритропоэза является гематокрит. В некоторых вариантах осуществления указанное выявление биомаркера эритропоэза предусматривает выявление экспрессии гена, ассоциированного с эритропоэзом, где ген ассоциирован с одним или несколькими из гемопоэза, гомеостаза ионов железа, регуляции дифференцировки эритроцитов и метаболизма гема. В некоторых вариантах осуществления ген, ассоциированный с эритропоэзом, представляет собой ген, кодирующий рецептор трансферрина (такой как CD71), трансферрин, Ly76, CD44, CD235a, ALAS2 или GATA-1. В некоторых вариантах осуществления биомаркер эритропоэза представляет собой кофактор, ассоциированный с эритропоэзом, как, например, порфирин, порфиринсодержащее соединение или тетрапиррол. В некоторых вариантах осуществления образец представляет собой образец крови или образец фракции крови, содержащей мононуклеарные клетки периферической крови. В некоторых вариантах осуществления образец представляет собой образец плазмы крови. В некоторых вариантах осуществления контроль представляет собой исторический контроль или плацебо-контроль. В некоторых вариантах осуществления эффективное количество метотрексата вводят в одном цикле или в трех циклах. В некоторых вариантах осуществления эффективное количество метотрексата вводят в одном, двух, трех, четырех, пяти или более циклах. В некоторых вариантах осуществления метотрексат вводят в период времени от 48 часов до проведения лечения терапевтическим средством до 48 часов (в частности, в приблизительно 24 часа и приблизительно 48 часов) после этого. В некоторых вариантах осуществления метотрексат вводят в дозе, составляющей от 0,1 мг/кг до 5 мг/кг. В некоторых вариантах осуществления проведение дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии предусматривает введение одного или нескольких из ритуксимаба, внутривенного иммуноглобулина (IVIG), циклофосфамида, бортезомиба, азатиоприна, циклоспорина, микофенолата, кортикостероида и применение стратегии формирования антигенспецифической толерантности (например, более частое введение дозы и/или более высокая доза терапевтического препарата, необязательно с сопутствующим IVIG). В некоторых вариантах осуществления стадия (d) дополнительно предусматривает введение средства, которое истощает Т-клетки, В-клетки или плазматические клетки, как, например, бортезомиба. В некоторых вариантах осуществления способ дополнительно предусматривает проведение мониторинга относительно одного или нескольких из уровней антител к терапевтическому средству, уровня CD19 и прогрессирования заболевания.
[103] В некоторых вариантах осуществления представлен способ лечения инфантильной формы болезни Помпе (как, например, классической инфантильной формы болезни Помпе) у субъекта (как, например, у человека), предусматривающий: (a) введение субъекту эффективного количества метотрексата; (b) введение субъекту эффективного количества кислой α-глюкозидазы человека одновременно с проведением начальной терапии для индуцирования иммунной толерантности (как, например, ритуксимабом и/или IVIG); (c) выявление биомаркера эритропоэза в образце, полученном от субъекта в период времени от по меньшей мере одного дня до приблизительно 30 дней (в частности, от приблизительно 7 дней до приблизительно 14 дней) после введения метотрексата; и (d) продолжение дальнейшего лечения с помощью кислой α-глюкозидазы человека с проведением или без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии исходя из уровня биомаркера эритропоэза по сравнению с контрольным уровнем. В некоторых вариантах осуществления изменение уровня биомаркера эритропоэза ассоциировано с индуцированием эритропоэза. В некоторых вариантах осуществления, если уровень биомаркера эритропоэза примерно равен такому уровню в контроле или ниже его, то стадия (d) предусматривает проведение дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии одновременно с дальнейшим лечением с помощью кислой α-глюкозидазы человека; или если уровень биомаркера эритропоэза повышен по сравнению с таким уровнем в контроле, то стадия (d) предусматривает продолжение дальнейшего лечения с помощью кислой α-глюкозидазы человека без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии. В некоторых вариантах осуществления биомаркер эритропоэза представляет собой уровень содержания незрелых ядерных форм эритроцитов, фракции незрелых ретикулоцитов или клеточных нуклеиновых кислот. В некоторых вариантах осуществления, если уровень биомаркера эритропоэза практически повышен по сравнению с таким уровнем в контроле, то стадия (d) предусматривает проведение дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии одновременно с дальнейшим лечением с помощью кислой α-глюкозидазы человека; или если уровень биомаркера эритропоэза равен такому уровню в контроле или ниже его, то стадия (d) предусматривает продолжение дальнейшего лечения с помощью кислой α-глюкозидазы человека без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии. В некоторых вариантах осуществления биомаркером эритропоэза является гематокрит. В некоторых вариантах осуществления указанное выявление биомаркера эритропоэза предусматривает выявление экспрессии гена, ассоциированного с эритропоэзом, где ген ассоциирован с одним или несколькими из гемопоэза, гомеостаза ионов железа, регуляции дифференцировки эритроцитов и метаболизма гема. В некоторых вариантах осуществления ген, ассоциированный с эритропоэзом, представляет собой ген, кодирующий рецептор трансферрина (такой как CD71), трансферрин, Ly76, CD44, CD235a, ALAS2 или GATA-1. В некоторых вариантах осуществления биомаркер эритропоэза представляет собой кофактор, ассоциированный с эритропоэзом, как, например, порфирин, порфиринсодержащее соединение или тетрапиррол. В некоторых вариантах осуществления образец представляет собой образец крови или образец фракции крови, содержащей мононуклеарные клетки периферической крови. В некоторых вариантах осуществления образец представляет собой образец плазмы крови. В некоторых вариантах осуществления контроль представляет собой исторический контроль или плацебо-контроль. В некоторых вариантах осуществления эффективное количество метотрексата вводят в одном цикле или в трех циклах. В некоторых вариантах осуществления эффективное количество метотрексата вводят в одном, двух, трех, четырех, пяти или более циклах. В некоторых вариантах осуществления метотрексат вводят в период времени от 48 часов до и через 48 часов (в частности, в приблизительно 24 часа и приблизительно 48 часов) после проведения лечения кислой α-глюкозидазой человека. В некоторых вариантах осуществления метотрексат вводят в дозе, составляющей от 0,1 мг/кг до 5 мг/кг. В некоторых вариантах осуществления проведение дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии предусматривает введение одного или нескольких из ритуксимаба, внутривенного иммуноглобулина (IVIG), циклофосфамида, бортезомиба, азатиоприна, циклоспорина, микофенолата, кортикостероида и применение стратегии формирования антигенспецифической толерантности (например, более частое введение дозы и/или более высокая доза терапевтического препарата, необязательно с сопутствующим IVIG). В некоторых вариантах осуществления стадия (d) дополнительно предусматривает введение средства, которое истощает Т-клетки, В-клетки или плазматические клетки, как, например, бортезомиба. В некоторых вариантах осуществления способ дополнительно предусматривает проведение мониторинга относительно одного или нескольких из уровня антитела к кислой α-глюкозидазе человека (например, антитела IgG к rhGAA) и уровня CD19, а также прогрессирования заболевания. В некоторых вариантах осуществления инфантильная форма болезни Помпе представляет собой CRIM-отрицательную форму болезни Помпе.
[104] В некоторых вариантах осуществления представлен способ лечения субъекта с болезнью Помпе (как, например, с инфантильной формой и/или CRIM-отрицательной формой болезни Помпе), предусматривающий: (a) получение образца от субъекта, где субъекту ранее проводили по меньшей мере один цикл введения метотрексата и вводили по меньшей мере одну дозу терапевтического средства (как, например, кислой α-глюкозидазы человека); (b) выявление биомаркера эритропоэза в образце в период времени от по меньшей мере одного дня до приблизительно 30 дней (в частности, от приблизительно 7 дней до приблизительно 14 дней) после введения метотрексата; и (с) продолжение дальнейшего лечения с помощью терапевтического средства с проведением или без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии исходя из уровня биомаркера эритропоэза по сравнению с контрольным уровнем. В некоторых вариантах осуществления изменение уровня биомаркера эритропоэза ассоциировано с индуцированием эритропоэза. В некоторых вариантах осуществления, если уровень биомаркера эритропоэза примерно равен такому уровню в контроле или ниже его, то стадия (c) предусматривает проведение дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии одновременно с дальнейшим лечением с помощью терапевтического средства; или если уровень биомаркера эритропоэза повышен по сравнению с таким уровнем в контроле, то стадия (c) предусматривает продолжение дальнейшего лечения с помощью терапевтического средства без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии. В некоторых вариантах осуществления биомаркер эритропоэза представляет собой уровень содержания незрелых ядерных форм эритроцитов, фракции незрелых ретикулоцитов или клеточных нуклеиновых кислот. В некоторых вариантах осуществления, если уровень биомаркера эритропоэза практически повышен по сравнению с таким уровнем в контроле, то стадия (c) предусматривает проведение дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии одновременно с дальнейшим лечением с помощью терапевтического средства; или если уровень биомаркера эритропоэза равен такому уровню в контроле или ниже его, продолжение дальнейшего лечения с помощью терапевтического средства без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии. В некоторых вариантах осуществления биомаркером эритропоэза является гематокрит. В некоторых вариантах осуществления указанное выявление биомаркера эритропоэза предусматривает выявление экспрессии гена, ассоциированного с эритропоэзом, где ген ассоциирован с одним или несколькими из гемопоэза, гомеостаза ионов железа, регуляции дифференцировки эритроцитов и метаболизма гема. В некоторых вариантах осуществления ген, ассоциированный с эритропоэзом, представляет собой ген, кодирующий рецептор трансферрина (такой как CD71), трансферрин, Ly76, CD44, CD235a, ALAS2 или GATA-1. В некоторых вариантах осуществления биомаркер эритропоэза представляет собой кофактор, ассоциированный с эритропоэзом, как, например, порфирин, порфиринсодержащее соединение или тетрапиррол. В некоторых вариантах осуществления образец представляет собой образец крови или образец фракции крови, содержащей мононуклеарные клетки периферической крови. В некоторых вариантах осуществления образец представляет собой образец плазмы крови. В некоторых вариантах осуществления контроль представляет собой исторический контроль или плацебо-контроль. В некоторых вариантах осуществления эффективное количество метотрексата вводят в одном цикле или в трех циклах. В некоторых вариантах осуществления эффективное количество метотрексата вводят в одном, двух, трех, четырех, пяти или более циклах. В некоторых вариантах осуществления метотрексат вводят в период времени от 48 часов до проведения лечения терапевтическим средством до 48 часов (в частности, в приблизительно 24 часа и приблизительно 48 часов) после этого. В некоторых вариантах осуществления метотрексат вводят в дозе, составляющей от 0,1 мг/кг до 5 мг/кг. В некоторых вариантах осуществления проведение дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии предусматривает введение одного или нескольких из ритуксимаба, внутривенного иммуноглобулина (IVIG), циклофосфамида, бортезомиба, азатиоприна, циклоспорина, микофенолата, кортикостероида и применение стратегии формирования антигенспецифической толерантности (например, более частое введение дозы и/или более высокая доза терапевтического препарата, необязательно с сопутствующим IVIG). В некоторых вариантах осуществления стадия (d) дополнительно предусматривает введение средства, которое истощает Т-клетки, В-клетки или плазматические клетки, как, например, бортезомиба. В некоторых вариантах осуществления способ дополнительно предусматривает проведение мониторинга относительно одного или нескольких из уровней антител к терапевтическому средству, уровня CD19 и прогрессирования заболевания.
[105] В одном аспекте настоящей заявки представлен способ оценивания уровня иммунной толерантности к терапевтическом средству у субъекта, нуждающегося в терапевтическом средстве, предусматривающий (a) введение субъекту эффективного количества метотрексата; (b) введение субъекту терапевтически эффективного количества терапевтического средства; и (c) выявление биомаркера эритропоэза в образце, полученном от субъекта, где уровень биомаркера эритропоэза в образце по сравнению с таким уровнем в контроле свидетельствует об индуцировании иммунной толерантности у субъекта к терапевтическому средству. В некоторых вариантах осуществления изменение уровня биомаркера эритропоэза ассоциировано с индуцированием эритропоэза. В некоторых вариантах осуществления, если уровень биомаркера эритропоэза примерно равен такому уровню в контроле или ниже его, то субъект нуждается в дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии одновременно с дальнейшим лечением с помощью терапевтического средства; или если уровень биомаркера эритропоэза повышен по сравнению с таким уровнем в контроле, то субъект не нуждается в дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии. В некоторых вариантах осуществления биомаркер эритропоэза представляет собой уровень содержания незрелых ядерных форм эритроцитов, фракции незрелых ретикулоцитов или клеточных нуклеиновых кислот. В некоторых вариантах осуществления биомаркер эритропоэза представляет собой ген, ассоциированный с эритропоэзом, где ген ассоциирован с одним или несколькими из гемопоэза, гомеостаза ионов железа, регуляции дифференцировки эритроцитов и метаболизма гема. В некоторых вариантах осуществления ген, ассоциированный с эритропоэзом, представляет собой ген, кодирующий рецептор трансферрина (такой как CD71), трансферрин, Ly76, CD44, CD235a, ALAS2 или GATA-1. В некоторых вариантах осуществления биомаркер эритропоэза представляет собой кофактор, ассоциированный с эритропоэзом, как, например, порфирин, порфиринсодержащее соединение или тетрапиррол. В некоторых вариантах осуществления, если уровень биомаркера эритропоэза практически повышен по сравнению с таким уровнем в контроле, то субъект нуждается в дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии одновременно с дальнейшим лечением с помощью терапевтического средства; или где если уровень биомаркера эритропоэза равен такому уровню в контроле или ниже его, то субъект не нуждается в дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии. В некоторых вариантах осуществления биомаркером эритропоэза является гематокрит. В некоторых вариантах осуществления образец представляет собой образец крови или образец фракции крови, содержащей мононуклеарные клетки периферической крови. В некоторых вариантах осуществления образец представляет собой образец плазмы крови. В некоторых вариантах осуществления контроль представляет собой исторический контроль или плацебо-контроль.
[106] В некоторых вариантах осуществления представлен способ оценивания уровня иммунной толерантности к терапевтическому средству у субъекта, нуждающегося в терапевтическом средстве, предусматривающий (а) введение субъекту эффективного количества метотрексата; (b) введение субъекту терапевтически эффективного количества терапевтического средства; и (c) выявление биомаркера эритропоэза в период времени от по меньшей мере одного дня до приблизительно 30 дней (например, от приблизительно 7 дней до приблизительно 14 дней) после введения метотрексата, где выявление повышенного уровня биомаркера эритропоэза указывает на индуцирование иммунной толерантности у субъекта к терапевтическому средству. В некоторых вариантах осуществления изменение уровня биомаркера эритропоэза ассоциировано с индуцированием эритропоэза. В некоторых вариантах осуществления, если уровень биомаркера эритропоэза примерно равен такому уровню в контроле или ниже его, то субъект нуждается в дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии одновременно с дальнейшим лечением с помощью терапевтического средства; или если уровень биомаркера эритропоэза повышен по сравнению с таким уровнем в контроле, то субъект не нуждается в дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии. В некоторых вариантах осуществления биомаркер эритропоэза представляет собой уровень содержания незрелых ядерных форм эритроцитов, фракции незрелых ретикулоцитов или клеточных нуклеиновых кислот. В некоторых вариантах осуществления биомаркер эритропоэза представляет собой ген, ассоциированный с эритропоэзом, где ген ассоциирован с одним или несколькими из гемопоэза, гомеостаза ионов железа, регуляции дифференцировки эритроцитов и метаболизма гема. В некоторых вариантах осуществления ген, ассоциированный с эритропоэзом, представляет собой ген, кодирующий рецептор трансферрина (такой как CD71), трансферрин, Ly76, CD44, CD235a, ALAS2 или GATA-1. В некоторых вариантах осуществления биомаркер эритропоэза представляет собой кофактор, ассоциированный с эритропоэзом, как, например, порфирин, порфиринсодержащее соединение или тетрапиррол. В некоторых вариантах осуществления, если уровень биомаркера эритропоэза практически повышен по сравнению с таким уровнем в контроле, то субъект нуждается в дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии одновременно с дальнейшим лечением с помощью терапевтического средства; или где если уровень биомаркера эритропоэза равен такому уровню в контроле или ниже его, то субъект не нуждается в дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии. В некоторых вариантах осуществления биомаркером эритропоэза является гематокрит. В некоторых вариантах осуществления образец представляет собой образец крови или образец фракции крови, содержащей мононуклеарные клетки периферической крови. В некоторых вариантах осуществления образец представляет собой образец плазмы крови. В некоторых вариантах осуществления контроль представляет собой исторический контроль или плацебо-контроль.
[107] В некоторых вариантах осуществления представлен способ оценивания иммунной толерантности у субъекта с болезнью Помпе, предусматривающий: (a) получение образца от субъекта, где субъекту ранее проводили по меньшей мере один цикл лечения метотрексатом и по меньшей мере одной дозой терапевтического средства; и (b) приведение в контакт образца со средством, которое связывается с биомаркером эритропоэза, где выявление повышенного уровня эритропоэза по сравнению с контролем свидетельствует об индуцировании иммунной толерантности. В некоторых вариантах осуществления изменение уровня биомаркера эритропоэза ассоциировано с индуцированием эритропоэза. В некоторых вариантах осуществления, если уровень биомаркера эритропоэза примерно равен такому уровню в контроле или ниже его, то субъект нуждается в дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии одновременно с дальнейшим лечением с помощью терапевтического средства; или если уровень биомаркера эритропоэза повышен по сравнению с таким уровнем в контроле, то субъект не нуждается в дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии. В некоторых вариантах осуществления биомаркер эритропоэза представляет собой уровень содержания незрелых ядерных форм эритроцитов, фракции незрелых ретикулоцитов или клеточных нуклеиновых кислот. В некоторых вариантах осуществления биомаркер эритропоэза представляет собой ген, ассоциированный с эритропоэзом, где ген ассоциирован с одним или несколькими из гемопоэза, гомеостаза ионов железа, регуляции дифференцировки эритроцитов и метаболизма гема. В некоторых вариантах осуществления ген, ассоциированный с эритропоэзом, представляет собой ген, кодирующий рецептор трансферрина (такой как CD71), трансферрин, Ly76, CD44, CD235a, ALAS2 или GATA-1. В некоторых вариантах осуществления биомаркер эритропоэза представляет собой кофактор, ассоциированный с эритропоэзом, как, например, порфирин, порфиринсодержащее соединение или тетрапиррол. В некоторых вариантах осуществления, если уровень биомаркера эритропоэза практически повышен по сравнению с таким уровнем в контроле, то субъект нуждается в дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии одновременно с дальнейшим лечением с помощью терапевтического средства; или где если уровень биомаркера эритропоэза равен такому уровню в контроле или ниже его, то субъект не нуждается в дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии. В некоторых вариантах осуществления биомаркером эритропоэза является гематокрит. В некоторых вариантах осуществления образец представляет собой образец крови или образец фракции крови, содержащей мононуклеарные клетки периферической крови. В некоторых вариантах осуществления образец представляет собой образец плазмы крови. В некоторых вариантах осуществления контроль представляет собой исторический контроль или плацебо-контроль.
A. Биомаркеры эритропоэза
[108] В настоящей заявке представлены способы выявления одного или нескольких биомаркеров эритропоэза в образце. Описанные в данном документе биомаркеры эритропоэза можно использовать по отдельности или в комбинации в любой подходящий момент в ходе лечения для проведения мониторинга индуцирования иммунной толерантности. В некоторых вариантах осуществления выявление биомаркера эритропоэза на уровне выше такого уровня в контроле свидетельствует об иммунной толерантности к терапевтическому средству, индуцированную введением метотрексата у субъекта. В некоторых вариантах осуществления субъект с большей вероятностью отвечает на дальнейшее лечение терапевтическим средством без одновременного проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии, если биомаркер эритропоэза выявлен на повышенном уровне. В некоторых вариантах осуществления субъект, вероятно, получит преимущество от одновременного проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии и дальнейшего лечения с помощью терапевтического средства, если биомаркер эритропоэза выявлен на уровне, равного такому в контроле или ниже его.
[109] В некоторых вариантах осуществления уровень биомаркера эритропоэза в контроле является предварительно определенным. В некоторых вариантах осуществления уровень биомаркера эритропоэза в контроле основан на усредненном или медианном уровне биомаркера эритропоэза у индивидуума до получения метотрексата и/или терапевтического средства. В некоторых вариантах осуществления уровень биомаркера эритропоэза в контроле основан на усредненном или медианном уровне биомаркера эритропоэза у одного или нескольких здоровых индивидуумов. В некоторых вариантах осуществления уровень биомаркера эритропоэза в контроле основан на усредненном или медианном уровне биомаркера эритропоэза у одного или нескольких индивидуумов, имеющих такое же заболевание или состояние (как, например, болезнь Помпе), являющихся индивидуумом, получающим терапевтическое средство. В некоторых вариантах осуществления уровень биомаркера эритропоэза в контроле основан на усредненном или медианном уровне биомаркера эритропоэза у одного или нескольких индивидуумов, нуждающихся в терапевтическом средстве до или в отсутствие получения метотрексата и/или терапевтического средства. В некоторых вариантах осуществления уровень биомаркера эритропоэза в контроле основан на усредненном или медианном уровне биомаркера эритропоэза у одного или нескольких индивидуумов, у которых индуцировали иммунную толерантность к терапевтическому средству путем лечения метотрексатом. В некоторых вариантах осуществления уровень биомаркера эритропоэза в контроле основан на усредненном или медианном уровне биомаркера эритропоэза у одного или нескольких индивидуумов, которые получали лечение с помощью терапевтического средства, но у которых отсутствовал иммунный ответ (например, ADA) на терапевтическое средство. В некоторых вариантах осуществления уровень биомаркера эритропоэза в контроле определяют на основе контрольного образца.
[110] В настоящей заявке частично раскрывается дальнейшая оценка механизма индуцированной метотрексатом иммунной толерантности путем транскрипционного, протеомного и клеточного анализа образцов, выделенных в момент времени день 7, когда иммунная толерантность может быть перенесена адоптивно. Посредством такой оценки идентифицировали разные гены, ассоциированные с эритропоэзом, в качестве биомаркеров для индуцирования иммунной толерантности. Настоящее раскрытие также относится к открытию того, что метотрексат временно истощает эритроциты (RBC), индуцируя тем самым эритропоэз, что продемонстрировано большей частотой выявления и появлением незрелых ядерных форм RBC в красной пульпе селезенки.
[111] В некоторых вариантах осуществления биомаркер эритропоэза выявляют в период времени от по меньшей мере одного дня до приблизительно 30 дней после введения метотрексата. В некоторых вариантах осуществления выявление биомаркера эритропоэза осуществляют несколько раз после введения метотрексата. В некоторых вариантах осуществления биомаркер эритропоэза выявляют в один или несколько из дней 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 после введения метотрексата. В некоторых вариантах осуществления метотрексат вводят в течение цикла. Например, один цикл метотрексата может состоять из одной дозы метотрексата или из приблизительно любой 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 последовательных ежедневных доз метотрексата. В некоторых вариантах осуществления биомаркер эритропоэза выявляют в период времени от одного дня до приблизительно 30 дней после последнего введения метотрексата в цикле. В некоторых вариантах осуществления биомаркер эритропоэза выявляют в период времени от одного дня до приблизительно 30 дней после первого введения метотрексата в цикле. В некоторых вариантах осуществления метотрексат вводят в одном цикле, двух циклах или трех циклах. В некоторых вариантах осуществления эффективное количество метотрексата вводят в одном, двух, трех, четырех, пяти или более циклах. В некоторых вариантах осуществления биомаркер эритропоэза выявляют в период времени от одного дня до приблизительно 30 дней после последнего введения метотрексата в одном цикле или в первом цикле из нескольких циклов. В некоторых вариантах осуществления биомаркер эритропоэза выявляют в период времени от одного дня до приблизительно 30 дней после первого введения метотрексата в одном цикле или в первом цикле из нескольких циклов. В некоторых вариантах осуществления биомаркер эритропоэза выявляют в период времени от одного дня до приблизительно 30 дней после последнего введения метотрексата в третьем цикле. В некоторых вариантах осуществления биомаркер эритропоэза выявляют в период времени от одного дня до приблизительно 30 дней после первого введения метотрексата в первом или третьем цикле.
[112] В некоторых вариантах осуществления биомаркером эритропоэза является уровень незрелых ядерных форм эритроцитов. В некоторых вариантах осуществления уровень незрелых ядерных форм эритроцитов уменьшается после введения метотрексата, но затем увеличивается со временем, поэтому уровень незрелых ядерных форм эритроцитов повышен по сравнению с эталонным образцом. В некоторых вариантах осуществления уровень незрелых эритроцитов снижается через приблизительно любое количество дней из одного, двух, трех, четырех, пяти, шести или семи дней или через любой период времени, составляющий от приблизительно одного до семи дней, после введения метотрексата. В некоторых вариантах осуществления уровень незрелых эритроцитов снижается через приблизительно любое количество дней из одного, двух, трех, четырех, пяти, шести или семи дней или в течение любого периода времени от приблизительно одного до семи дней после последнего введения метотрексата в цикле введения метотрексата. В некоторых вариантах осуществления уровень незрелых эритроцитов снижается через приблизительно любое количество дней из одного, двух, трех, четырех, пяти, шести или семи дней или в течение любого периода времени от приблизительно одного до семи дней после первого введения метотрексата в цикле введения метотрексата. В некоторых вариантах осуществления уровень незрелых эритроцитов повышается через более чем приблизительно любое количество из одного, двух, трех, четырех, пяти, шести, семи, 14, 21, 28 или 30 дней или в течение любого периода времени от приблизительно одного до 30 дней после введения метотрексата. В некоторых вариантах осуществления уровень незрелых эритроцитов повышается через более чем приблизительно любое количество из одного, двух, трех, четырех, пяти, шести, семи, 14, 21, 28 или 30 дней или в течение любого периода времени от приблизительно одного до 30 дней после последнего введения метотрексата в цикле введения метотрексата. В некоторых вариантах осуществления уровень незрелых эритроцитов повышается через более чем приблизительно любое количество из одного, двух, трех, четырех, пяти, шести, семи, 14, 21, 28 или 30 дней или в течение любого периода времени от приблизительно одного до 30 дней после первого введения метотрексата в цикле введения метотрексата.
[113] Эритропоэз представляет собой процесс, при котором незрелые ядерные эритроциты, также известные как предшественники RBC, развиваются в зрелые эритроциты, не имеющие ядра, в форме дискоидов (Nandakumar et al., 2016). Незрелые ядерные формы RBC могут быть идентифицированы по клеточному поверхностному рецептору трансферрина CD71 (Pan and Johnstone, 1983). Самой ранней незрелой ядерной формой RBC или эритробластом в гематопоэтической ткани является проэритробласт. За счет последовательных стадий митоза проэритробласты, которые в дальнейшем дифференцируются в морфологически различимые в нескольких стадиях митоза, постепенно превращаются в базофильные, полихромные, затем ортохроматические эритробласты, затем превращаются в ретикулоциты (с удаленными ядрами) и наконец, становятся зрелыми эритроцитами (Nandakumar et al., 2016). Эритроид-специфическое моноклональное антитело Ter-119 реагирует с эритроидными клетками на различных стадиях дифференцировки от ядерного проэритробласта до безъядерных зрелых эритроцитов (Kina et al., 2000). Рано образующие ядерные эритробласты и ретикулоциты, в отличие от зрелых эритроцитов или эритроцитов, экспрессируют рецептор трансферрина CD71 (Pan and Johnstone 1983). Проэритробласт и отдельные последовательные стадии эритропоэза могут быть однозначно идентифицированы по экспрессии CD71 или аналогичным образом по дифференциальной экспрессии адгезивной молекулы CD44 (Chen et al., 2009, Koulnis et al., 2011). У мышей зрелые эритроциты могут циркулировать в организме до 40 дней, после чего они стареют ввиду возрастных изменений и естественного ухудшения состояния (Van Putten, 1958). Старые RBC подвергаются характерной форме апоптоза, называемой эриптозом, и выводятся из кровотока (Daugas et al., 2001, Testa 2004). Важно отметить, что зрелые RBC и незрелые ядерные формы RBC обладают способностью к иммуномодуляции посредством независимых механизмов (Schakel et al., 2006; Cremel et al., 2013; Getts et al., 2013; Cremel et al., 2015; Grimm et al., 2015; Lorentz et al., 2015; Yi et al., 2015).
[114] Считается, что выведение зрелых RBC обеспечивает устойчивую и постоянную иммунную толерантность к аутоантигенам (Cremel et al., 2013; Getts et al., 2013). Теоретически выведение старых RBC, подвергающихся эриптозу, происходит толерогенно, за счет чего индуцируется толерантность к RBC и всей его антигенной нагрузке. Пользуясь преимуществом этого естественного явления, ряд групп смогли достичь иммунной толерантности к видам биологической терапии у мышей посредством инкапсуляции или связывания последовательности целевого белка со зрелыми эритроцитами (Kontos et al., 2013; Cremel et al., 2015; Grimm et al., 2015; Lorentz et al., 2015). Альтернативно было сделано предположение, что незрелые ядерные формы RBC, которые экспрессируют CD71, прямо опосредуют врожденную иммуносупрессию у новорожденных (Elahi et al., 2013). Кроме того, в новейших литературных источниках показано, что RBC могут подавлять способность дендритных клеток к стимуляции активации Т-клеток и ответы антител посредством взаимодействия CD47 на эритроцитах с сигнальным регуляторным белком α (SIRPα) на дендритных клетках (Schakel et al., 2006; Yi et al., 2015).
[115] Посредством обсуждаемых выше и/или других механизмов, не вдаваясь в какую-либо теорию, эритропоэз, индуцированный метотрексатом, как это описано в данном документе, может дополнительно стимулировать индуцирование иммунной толерантности к видам биологической терапии. Таким образом, биомаркеры эритропоэза, описанные в данном документе, могут обеспечить точную и удобную раннюю оценку уровня иммунной толерантности, индуцированной лечением в виде низкодозового введения метотрексата кратковременным курсом, которые могут быть использованы как критерии выбора видов терапии для индуцирования иммунной толерантности и/или иммуносупрессии с целью дополнения дальнейших циклов лечения терапевтическим средством.
[116] В некоторых вариантах осуществления биомаркер эритропоэза представляет собой общую популяцию эритроидных клеток или субпопуляцию эритроидных клеток. Уровень данной популяции эритроидных клеток может быть выражен несколькими способами, что будет понятно специалисту в данной области. Например, уровень популяции может быть выражен в виде сравнительного процента, доли или частоты выявления (например, от общего количества клеток крови или мононуклеарных клеток периферической крови), абсолютного числа или концентрации (например, клеток/мл). Эритроидные клетки обычно получают из цельной крови или клеточных фракций крови, хотя эритроидные клетки также можно получать из селезенки, костного мозга или других тканей. В некоторых вариантах осуществления биомаркером эритропоэза является гематокрит. Используемый в данном документе термин "гематокрит" относится к соотношению объема эритроцитов к общему объему крови. В некоторых вариантах осуществления биомаркером эритропоэза является уровень субпопуляции эритроидных клеток. Приводимые в данном документе термины "эритроидные клетки" и "эритроциты" (то есть "RBC") используются взаимозаменяемо для обозначения всех типов клеток в эритроидной линии, которые характеризуются экспрессией Ly76 (то есть антигена для антитела Ter-119) на клеточной поверхности мышиных RBC или CD235a на клеточной поверхности человеческих РВМС. Эритроидные клетки включают проэритробласты, базофильные эритробласты, полихроматофильные эритробласты, ортохроматофильные эритробласты, ретикулоциты, в том числе незрелые ретикулоциты и эритроциты (то есть зрелые эритроциты). В некоторых вариантах осуществления биомаркером эритропоэза является уровень эритроидных клеток-предшественников. В некоторых вариантах осуществления биомаркером эритропоэза является уровень незрелых ядерных форм эритроцитов (RBC). "Незрелая ядерная форма эритроцита" является предшественником эритроцита, имеющим ядро, характеризующимся экспрессией Ly76 (антигена для Ter-119) и рецептора трансферрина CD71 на поверхности клетки. Незрелые ядерные формы RBC включают предшественники RBC, которые включают ядро из проэритробластов и дифференцируются в незрелые ретикулоциты. В некоторых вариантах осуществления биомаркером эритропоэза является фракция незрелых ретикулоцитов (также известная как "IRF"). В некоторых вариантах осуществления биомаркером эритропоэза является уровень зрелых эритроцитов. Зрелые ретикулоциты представляют собой ретикулоциты, которые утрачивают ядра и превращаются в зрелые эритроциты.
[117] В некоторых вариантах осуществления биомаркером эритропоэза является содержание клеточных нуклеиновых кислот. В некоторых вариантах осуществления биомаркером эритропоэза является содержание клеточной РНК, как, например, содержание РНК в общем количестве клеток крови в образце крови. В некоторых вариантах осуществления биомаркером эритропоэза является содержание клеточной ДНК, как, например, содержание ДНК в общем количестве клеток крови в образце крови. Уровень ретикулоцитов в образце крови коррелирует с содержанием РНК и/или ДНК в клетках крови в образце крови.
[118] Разные уровни субпопуляций эритроидных клеток и содержание нуклеиновых кислот в общем количестве клеток крови могут быть измерены с использованием известных в данной области способов. Коммерческие системы для автоматического подсчета клеток, такие как гематологические анализаторы SYSMEX®, доступны для определения параметров крови, в том числе уровня незрелых зародышевых RBC, фракции незрелых ретикулоцитов, гематокрита и содержания РНК/ДНК в общем количестве клеток крови.
[119] Биомаркеры эритропоэза, идентифицированные в данном документе, включают гены, ассоциированные с эритропоэзом и/или одной или несколькими субпопуляциями эритроидных клеток, которые упоминаются в данном документе как "гены биомаркеров эритропоэза". В некоторых вариантах осуществления биомаркер эритропоэза представляет собой ген, ассоциированный с одним или несколькими биохимическими путями эритропоэза, включая, например, гемопоэз, гомеостаз ионов железа, регуляцию дифференцировки эритроцитов и метаболизм гема. В некоторых вариантах осуществления биомаркером эритропоэза является ген, выбранный из группы генов с повышающей регуляцией в группе rhGAA+MTX, показанной на фиг. 1A и 1B. Иллюстративные гены включают без ограничения гены рецептора трансферрина, трансферрина, Ly76, CD44, CD235a, ALAS2 и GATA-1. В некоторых вариантах осуществления биомаркер эритропоэза представляет собой ген, кодирующий маркер клеточной поверхности, экспрессируемый эритроидными клетками или субпопуляцией эритроидных клеток. В некоторых вариантах осуществления биомаркером эритропоэза является Ly76 (антиген для Ter-119) или CD235a. CD235a также известен как гликофорин A, GYPA, MN, MNS, GPSAT, PAS-2, GPErik, HgpMiv, HgpMiXI или HgpSta(C). В некоторых вариантах осуществления биомаркером эритропоэза является рецептор трансферрина. В некоторых вариантах осуществления биомаркером эритропоэза является рецептор трансферрина 1. Рецептор трансферрина 1 также известен как TfR1, кластер дифференцировки 71, CD71, T9, TR, TFR, p90, TRFR или IMD46. В некоторых вариантах осуществления биомаркером эритропоэза является трансферрин. Трансферрин также известен как TF, TFQTL1, PRO1557, PRO2086 или HEL-S-71p. В некоторых вариантах осуществления биомаркером эритропоэза является CD44. CD44 также известен как IN, LHR, MC56, MDU2, MDU3, MIC4, Pgp1, CDW44, CSPG8, HCELL, HUTCH-1 или ECMR-III. В некоторых вариантах осуществления биомаркером эритропоэза является ген, экспрессируемый эритроидными клетками или субпопуляцией эритроидных клеток. В некоторых вариантах осуществления биомаркером эритропоэза является гемоглобин. В некоторых вариантах осуществления биомаркером эритропоэза является ген, экспрессируемый зрелыми эритроцитами, например, эритроидный анкирин или гликофорин С.
[120] Уровни экспрессии одного или нескольких генов, ассоциированных с эритропоэзом или кодирующих маркеры клеточной поверхности эритроидных клеток, могут быть определены качественно и/или количественно на основании любого подходящего критерия, известного в данной области техники, в том числе без ограничения ДНК, мРНК, кДНК, белки, фрагменты белка и/или число копий гена. "Уровень экспрессии" и "количество" гена-биомаркера используются в данном документе взаимозаменяемо. В некоторых вариантах осуществления уровень экспрессии гена-биомаркера в первом образце увеличен или повышен по сравнению с таким уровнем экспрессии во втором образце. В некоторых вариантах осуществления уровень экспрессии гена-биомаркера в первом образце уменьшен или снижен по сравнению с таким уровнем экспрессии во втором образце. В некоторых вариантах осуществления второй образец является эталоном (например, эталонный образец, эталонная клетка или эталонная ткань) или контролем (например, контрольный образец, контрольная клетка или контрольная ткань). В некоторых вариантах осуществления контроль представляет собой исторический контроль или плацебо-контроль. "Исторический контроль" относится к контролю, полученному в одном или нескольких предыдущих экспериментах. В некоторых вариантах осуществления исторический контроль представляет собой контроль, основанный на одном или нескольких клинических испытаниях. Плацебо-контроль относится к контролю, полученному от субъекта, который не получает лечение метотрексатом или лечение терапевтическим средством, или который получает лечение терапевтическим средством без лечения метотрексатом. Выявление "повышенного" или "увеличенного" уровня экспрессии гена-биомаркера в первом образце по сравнению с таким уровнем экспрессии в контрольном образце может указывать на "присутствие" гена-биомаркера в первом образце. Выявление "сниженного" или "уменьшенного" уровня экспрессии гена-биомаркера в первом образце по сравнению с таким уровнем экспрессии в контрольном образце может указывать на "отсутствие" гена-биомаркера в первом образце. Дополнительные раскрытия для определения уровня экспрессии гена-биомаркера описаны в данном документе. В некоторых вариантах осуществления биомаркером эритропоэза является рецептор трансферрина (такой как CD71), трансферрин, Ly76, CD44, CD235a, ALAS2 и/или GATA-1. В некоторых вариантах осуществления биомаркером эритропоэза является гемоглобин, эритроидный анкирин и/или гликофорин С.
[121] В некоторых вариантах осуществления биомаркер эритропоэза представляет собой кофактор, ассоциированный с эритропоэзом. Иллюстративные кофакторы, ассоциированные с эритропоэзом, включают без ограничения порфирин, порфиринсодержащие соединения или тетрапирролы. Уровни кофактора могут быть измерены с использованием любых известных в данной области способов, включая, например, масс-спектроскопию и HPLC.
[122] В некоторых вариантах осуществления биомаркером эритропоэза является присутствие незрелых ядерных форм эритроцитов. В некоторых вариантах осуществления уровень незрелых ядерных форм эритроцитов уменьшается после введения метотрексата, но затем увеличивается со временем, поэтому уровень незрелых ядерных форм эритроцитов повышен по сравнению с эталонным образцом. В некоторых вариантах осуществления уровень незрелых эритроцитов снижается через приблизительно любое количество дней из одного, двух, трех, четырех, пяти, шести или семи дней или через любой период времени, составляющий от приблизительно одного до семи дней, после введения метотрексата. В некоторых вариантах осуществления уровень незрелых эритроцитов снижается через приблизительно любое количество дней из одного, двух, трех, четырех, пяти, шести или семи дней или в течение любого периода времени от приблизительно одного до семи дней после последнего введения метотрексата в цикле введения метотрексата. В некоторых вариантах осуществления уровень незрелых эритроцитов снижается через приблизительно любое количество дней из одного, двух, трех, четырех, пяти, шести или семи дней или в течение любого периода времени от приблизительно одного до семи дней после первого введения метотрексата в цикле введения метотрексата. В некоторых вариантах осуществления, где метотрексат вводят в одном цикле, уровень незрелых ядерных форм эритроцитов при этом снижается за приблизительно один, приблизительно два, приблизительно три, приблизительно четыре, приблизительно пять, приблизительно шесть или приблизительно семь дней до того, как уровень незрелых ядерных форм эритроцитов становится повышенным. В некоторых вариантах осуществления, где метотрексат вводят в двух или более циклах, уровень незрелых ядерных форм эритроцитов при этом снижается за период времени от приблизительно одного до приблизительно 14 дней до того, как уровень незрелых ядерных форм эритроцитов становится повышенным. В некоторых вариантах осуществления уровень незрелых эритроцитов повышается через более чем приблизительно любое количество из одного, двух, трех, четырех, пяти, шести, семи, 14, 21, 28 или 30 дней или в течение любого периода времени от приблизительно одного до 30 дней после введения метотрексата. В некоторых вариантах осуществления уровень незрелых эритроцитов повышается через более чем приблизительно любое количество из одного, двух, трех, четырех, пяти, шести, семи, 14, 21, 28 или 30 дней или в течение любого периода времени от приблизительно одного до 30 дней после последнего введения метотрексата в цикле введения метотрексата. В некоторых вариантах осуществления уровень незрелых эритроцитов повышается через более чем приблизительно любое количество из одного, двух, трех, четырех, пяти, шести, семи, 14, 21, 28 или 30 дней или в течение любого периода времени от приблизительно одного до 30 дней после первого введения метотрексата в цикле введения метотрексата.
[123] Уровни одной или нескольких субпопуляций эритроидных клеток могут быть определены качественно и/или количественно на основании любого подходящего критерия, известного в данной области техники, включая, например, экспрессию подходящих маркеров клеточной поверхности, гистологические маркеры и морфологию (например, объем клетки и наличие или отсутствие ядер). Используемый в данном документе термин "уровень" субпопуляции эритроидных клеток относится к числу клеток, фракции субпопуляции эритроидных клеток среди всех эритроидных клеток или частоте выявления эритроидных клеток в общем количестве клеток крови или РВМС. В некоторых вариантах осуществления уровень субпопуляции эритроидных клеток в первом образце увеличен или повышен по сравнению с таким уровнем во втором образце. В некоторых вариантах осуществления уровень субпопуляции эритроидных клеток в первом образце уменьшен или снижен по сравнению с таким уровнем во втором образце. В некоторых вариантах осуществления второй образец является эталоном (например, эталонный образец или эталонная ткань) или контролем (например, контрольный образец или контрольная ткань). В некоторых вариантах осуществления контрольный образец/ткань представляет собой исторический контроль или плацебо-контроль. Выявление "повышенного" или "увеличенного" уровня субпопуляции эритроидных клеток в первом образце по сравнению с таким уровнем в контрольном образце может указывать на "присутствие" субпопуляции эритроидных клеток в первом образце. Выявление "сниженного" или "уменьшенного" уровня субпопуляции эритроидных клеток в первом образце по сравнению с таким уровнем в контрольном образце может указывать на "отсутствие" субпопуляции эритроидных клеток в первом образце. Дополнительные раскрытия для определения уровня субпопуляции эритроидных клеток описаны в данном документе. В некоторых вариантах осуществления биомаркером эритропоэза является уровень (например, количество, фракция или частота встречаемости) незрелых ядерных форм RBC. В некоторых вариантах осуществления биомаркером эритропоэза является фракция незрелых ретикулоцитов. В некоторых вариантах осуществления биомаркером эритропоэза является гематокрит.
[124] В некоторых вариантах осуществления любого из способов повышенный уровень биомаркера эритропоэза означает общее увеличение на по меньшей мере приблизительно любое значение из 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99% или больше уровня биомаркера эритропоэза, как, например, уровня экспрессии (например, белка или мРНК) гена, ассоциированного с эритропоэзом, или гена, кодирующего маркер клеточной поверхности эритроидных клеток, или уровня (например, количества, фракции или частоты встречаемости) субпопуляции эритроидных клеток, что выявляют с помощью стандартных способов, известных в данной области техники, например, описанных в данном документе, по сравнению с эталоном или контролем. В некоторых вариантах осуществления повышенный уровень биомаркера эритропоэза означает увеличение уровня биомаркера эритропоэза в образце, где увеличение составляет по меньшей мере приблизительно любое из 1,5X, 1,75X, 2X, 3X, 4X, 5X, 6X, 7X, 8X, 9X, 10X, 25X, 50X, 75X или 100X по сравнению с таким уровнем соответствующего биомаркера эритропоэза в эталоне или контроле. В некоторых вариантах осуществления повышенный уровень биомаркера эритропоэза означает общее увеличение в более чем приблизительно 1,5 раза, приблизительно 1,75 раза, приблизительно 2 раза, приблизительно 2,25 раза, приблизительно 2,5 раза, приблизительно 2,75 раза, приблизительно 3,0 раза или приблизительно 3,25 раза по сравнению с эталоном или контролем. В некоторых вариантах осуществления уровень биомаркера эритропоэза приведен в сравнении с контролем, который представляет собой среднее значение уровня биомаркера в конкретном образце или группе образцов. Например, в некоторых вариантах осуществления контроль представляет собой средний уровень биомаркера эритропоэза в образце от субъекта, у которого иммунотолерантность к терапевтическому средству индуцирована лечением метотрексатом, таким как ITI схема низкодозового введения метотрексата кратковременным курсом. В некоторых вариантах осуществления средний уровень биомаркера эритропоэза получают из базы данных пациентов с конкретным заболеванием, при котором иммунотолерантность к терапевтическому средству была индуцирована лечением метотрексатом. В некоторых вариантах осуществления средний уровень биомаркера эритропоэза получают из базы данных пациентов, нуждающихся в лечении конкретным терапевтическим средством, у которых иммунная толерантность к терапевтическому средству была индуцирована метотрексатом. Например, уровень экспрессии гена-биомаркера эритропоэза у пациента с болезнью Помпе, нуждающегося в лечении rhGAA, можно сравнивать с медианным уровнем экспрессии гена-биомаркера эритропоэза, основываясь на данных в базе данных пациентов с болезнью Помпе, у которых развилась иммунная толерантность к rhGAA вследствие лечения метотрексатом или не развился иммунный ответ на rhGAA. В некоторых вариантах осуществления биомаркером эритропоэза является рецептор трансферрина (такой как CD71), трансферрин, Ly76, CD44, CD235a, ALAS2 или GATA-1. В некоторых вариантах осуществления биомаркером эритропоэза является уровень (например, количество, фракция или частота встречаемости) незрелых ядерных форм RBC.
[125] В некоторых вариантах осуществления любого из способов сниженный уровень биомаркера эритропоэза означает общее снижение на приблизительно любое значение из 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99% или больше уровня биомаркера эритропоэза, как, например, уровня экспрессии (например, белка или мРНК) гена, ассоциированного с эритропоэзом, или гена, кодирующего маркер клеточной поверхности эритроидных клеток, или уровня (например, количества, фракции или частоты встречаемости) субпопуляции эритроидных клеток, что выявляют с помощью стандартных способов, известных в данной области техники, например, описанных в данном документе, по сравнению с эталоном или контролем. В некоторых вариантах осуществления сниженный уровень биомаркера эритропоэза означает уменьшение уровня биомаркера эритропоэза в образце, где уменьшение составляет по меньшей мере приблизительно любое из 0,9X, 0,8X, 0,7X, 0,6X, 0,5X, 0,4X, 0,3X, 0,2X, 0,1X, 0,05X или 0,01X от уровня соответствующего биомаркера эритропоэза в эталоне или контроле. В некоторых вариантах осуществления биомаркером эритропоэза является гемоглобин, эритроидный анкирин или гликофорин С. В некоторых вариантах осуществления биомаркером эритропоэза является уровень общего количества эритроидных клеток или зрелых RBC. В некоторых вариантах осуществления биомаркером эритропоэза является фракция незрелых ретикулоцитов. В некоторых вариантах осуществления биомаркером эритропоэза является гематокрит.
[126] В некоторых вариантах осуществления биомаркер эритропоэза характеризуется повышенным уровнем в приблизительно любой из дней 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 14, 16, 18, 20, 24 или 28 после начального введения метотрексата и/или терапевтического средства. В некоторых вариантах осуществления биомаркер эритропоэза характеризуется сниженным уровнем в приблизительно любой из дней 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 14, 16, 18, 20, 24 или 28 после начального введения метотрексата и/или терапевтического средства. В некоторых вариантах осуществления биомаркер эритропоэза характеризуется повышенным уровнем в приблизительно любой из дней 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 14, 16, 18, 20, 24 или 28 после последнего введения метотрексата. В некоторых вариантах осуществления биомаркер эритропоэза характеризуется сниженным уровнем в приблизительно любой из дней 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 14, 16, 18, 20, 24 или 28 после последнего введения метотрексата. В некоторых вариантах осуществления метотрексат вводят в одном цикле. В некоторых вариантах осуществления метотрексат вводят в трех циклах. В некоторых вариантах осуществления эффективное количество метотрексата вводят в одном, двух, трех, четырех, пяти или более циклах. В некоторых вариантах осуществления биомаркер эритропоэза характеризуется повышенным уровнем в приблизительно любой из дней 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 14, 16, 18, 20, 24 или 28 после последнего введения метотрексата в первом цикле или третьем цикле. В некоторых вариантах осуществления биомаркер эритропоэза характеризуется повышенным уровнем в приблизительно любой из дней 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 14, 16, 18, 20, 24 или 28 после последнего введения метотрексата в первом, втором, третьем, четвертом или пятом цикле. В некоторых вариантах осуществления биомаркер эритропоэза характеризуется сниженным уровнем в приблизительно любой из дней 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 14, 16, 18, 20, 24 или 28 после последнего введения метотрексата в первом цикле или третьем цикле. В некоторых вариантах осуществления биомаркер эритропоэза характеризуется сниженным уровнем в приблизительно любой из дней 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 14, 16, 18, 20, 24 или 28 после последнего введения метотрексата в первом, втором, третьем, четвертом или пятом цикле. В некоторых вариантах осуществления уровень биомаркера эритропоэза сперва уменьшается, а затем увеличивается после начального введения метотрексата и/или терапевтического средства. В некоторых вариантах осуществления биомаркер эритропоэза, такой как уровни содержания незрелых ядерных форм RBC, фракции незрелых ретикулоцитов, клеточных нуклеиновых кислот, ген, выбранный из гена рецептора трансферрина, трансферрина, Ly76 (антигена для Ter-119), CD44, CD235a, ALAS2 и GATA-1, или кофактор, ассоциированный с эритропоэзом, характеризуется повышенным уровнем в образце крови (например, РВМС или образец плазмы крови) субъекта в период времени от дня 6 до дня 16 (например, в любой из дня 7, дня 8, дня 9, дня 10, дня 11, дня 12, дня 13 и дня 14) от начала лечения терапевтическим средством.
[127] Уровни экспрессии различных генов-биомаркеров эритропоэза в образце можно анализировать с помощью ряда методик, многие из которых известны в данной области техники и понятны специалисту в данной области техники, в том числе без ограничения с помощью иммуногистохимического анализа ("IHC"), вестерн-блот-анализа, иммунопреципитации, анализов молекулярного связывания, ELISA, ELIFA, сортировки клеток с активированной флуоресценцией ("FACS"), MASSARRAY®, протеомики, масс-спектрометрии, масс-спектрометрической визуализации тканей (tMSI), количественных анализов крови (как, например, сывороточного ELISA), биохимического анализа ферментативной активности, гибридизации in situ, саузерн-анализа, нозерн-анализа, полногеномного секвенирования, полимеразной цепной реакции ("ПЦР"), в том числе количественной ПЦР в режиме реального времени ("qRT-ПЦР"), и других типов способов выявления на основе амплификации, таких как, например, использование разветвленной ДНК, SISBA, TMA и им подобных), RNA-Seq, FISH, анализ на основе микрочипов, определение профиля экспрессии генов и/или последовательный анализ экспрессии генов ("SAGE"), а также любых из широкого спектра анализов, которые можно выполнить с помощью анализа панели белков, генов и/или тканей. Типичные протоколы для оценки статуса генов и генных продуктов можно найти, например, в Ausubel et al., eds., 1995, Current Protocols In Molecular Biology, разделы 2 (нозерн-блоттинг), 4 (саузерн-блоттинг), 15 (иммуноблоттинг) и 18 (ПЦР-анализ). Можно также использовать мультиплексные иммуноанализы, такие как те, которые доступны в Rules Based Medicine или в Meso Scale Discovery ("MSD").
[128] В некоторых вариантах осуществления уровни экспрессии одного или нескольких генов биомаркера эритропоэза определяют с использованием способа, предусматривающего: (a) проведение профилирования экспрессии генов, ПЦР (как, например, rtPCR или qRT-PCR), RNA-seq, анализа на основе микрочипов, методики SAGE, MASSARRAY® или FISH на образце (таком как РВМС или образец плазмы крови от субъекта) и b) определение уровней экспрессии продуктов одного или нескольких генов биомаркеров эритропоэза в образце. В некоторых вариантах осуществления способ на основе микрочипа включает использование микрочипа с одной или несколькими молекулами нуклеиновой кислоты, которые могут гибридизоваться в жестких условиях с молекулой нуклеиновой кислоты, кодирующей ген, упомянутый выше, или с одним или несколькими полипептидами (например, пептидами или антителами), которые могут связываться с одним или несколькими белками, кодируемыми генами, упомянутыми выше. В некоторых вариантах осуществления генную экспрессию измеряют с использованием микрочипа. В некоторых вариантах осуществления генную экспрессию измеряют с использованием qRT-PCR. В некоторых вариантах осуществления генную экспрессию измеряют с использованием мультиплексной ПЦР. В некоторых вариантах осуществления биомаркером эритропоэза является рецептор трансферрина (такой как CD71), трансферрин, Ly76, CD44, CD235a, ALAS2 или GATA-1.
[129] Способы оценивания мРНК в клетках хорошо известны и включают, например, гибридизационные анализы с использованием комплементарных ДНК-зондов (например, гибридизация in situ с использованием меченых рибопроб, специфичных для одного или нескольких генов, нозерн-блоттинг и сопутствующие методики) и различные анализы с использованием амплификации нуклеиновых кислот (как, например, RT-PCR с использованием комплементарных праймеров, специфичных для одного или нескольких генов, и другие типы способов выявления на основе амплификации, такие как, например, использование разветвленной ДНК, SISBA, TMA и им подобные). Для оценивания экспрессии соответствующего гена (генов) можно проводить количественную оценку генного продукта перед трансляцией (например, сплайсированной, не сплайсированной или частично сплайсированной мРНК) Такие способы могут включать одну или несколько стадий, которые обеспечивают определение уровней целевой мРНК в биологическом образце (например, путем одновременной оценки уровней сравнительной контрольной последовательности мРНК гена "домашнего хозяйства", например, представителя семейства актинов). Дополнительно можно определить последовательность амплифицированной целевой кДНК.
[130] Дополнительные способы включают протоколы, посредством которых исследуют или выявляют мРНК, например целевые мРНК, в образце ткани или клетки с помощью технологий на основе микрочипов. С использованием микрочипов на основе нуклеиновых кислот исследуемые и контрольные образцы мРНК из исследуемых и контрольных образцов ткани подвергают обратной транскрипции и метят для создания зондов кДНК. Затем зонды гибридизуют с чипом на основе нуклеиновых кислот, иммобилизованных на твердой подложке. Чип сконфигурирован так, что последовательность и положение каждого элемента на чипе известны. Например, набор генов, ассоциированных с эритропоэзом, может быть упорядочен на твердой подложке. Гибридизация меченого зонда с конкретным элементом чипа указывает, что в образце, из которого был получен зонд, экспрессируется данный ген.
[131] Уровень экспрессии одного или нескольких генов-биомаркеров эритропоэза также можно определить на уровне белка, используя преимущества иммуноагглютинации, иммунопреципитации (например, иммунодиффузии, иммуноэлектрофореза, иммунной фиксации), методов иммуноокрашивания и/или выявления иммуносвязывания (в том числе, например, вестерн-блоттинга, иммуногистохимии in situ, иммуноцитохимии in situ, иммунофлуоресценции, иммуноаффинной хроматографии, иммуноферментного анализ) и им подобные. Эти и другие способы количественного определения конкретного полипептида в смеси могут основываться на специфическом связывании, например антител, и могут выполняться количественным образом (например, путем количественной гистоморфометрии образцов ткани и/или клеток). Количества очищенного полипептида также можно определять с помощью физических способов, например, фотометрии или масс-спектрометрических способов (например, масс-спектрометрической визуализации тканей).
[132] В некоторых вариантах осуществления уровень экспрессии белка биомаркера эритропоэза в образце исследуют с использованием IHC и протоколов окрашивания. Было показано, что IHC-окрашивание срезов ткани является надежным способом определения или выявления присутствия белков в образце. В некоторых вариантах осуществления биомаркер эритропоэза выявляют посредством иммуногистохимического анализа. В некоторых вариантах осуществления повышенный уровень экспрессии биомаркера эритропоэза в образце от индивидуума представляет собой повышенный уровень экспрессии белка, а в дополнительных вариантах осуществления его определяют с использованием IHC. В некоторых вариантах осуществления уровень экспрессии биомаркера эритропоэза определяют с использованием способа, предусматривающего: (a) проведение IHC-анализа образца (например, РВМС или образца плазмы крови от субъекта) с антителом и b) определение уровня экспрессии гена-биомаркера эритропоэза в образце. В некоторых вариантах осуществления интенсивность IHC-окрашивания определяют по сравнению с эталоном. В некоторых вариантах осуществления эталон представляет собой эталонное значение (например, из базы данных полных респондеров и частичных респондеров на иммунотерапию). В некоторых вариантах осуществления биомаркером эритропоэза является рецептор трансферрина (такой как CD71), трансферрин, Ly76, CD44, CD235a, ALAS2 или GATA-1. В некоторых вариантах осуществления биомаркером эритропоэза является гемоглобин, эритроидный анкирин или гликофорин С.
[133] IHC можно проводить в комбинации с дополнительными методиками, например, морфологическим окрашиванием и/или флуоресцентной гибридизацией in-situ. Доступны два основных IHC-способа: прямые и непрямые анализы. Согласно первому анализу осуществляют непосредственное определение связывания антитела с целевым антигеном. В данном прямом анализе используют меченый реагент, такой как флуоресцентная метка или ферментативно меченное первичное антитело, которое можно анализировать визуально без дальнейшего взаимодействия антител. В типичном непрямом анализе неконъюгированное первичное антитело связывается с антигеном, а затем меченное вторичное антитело связывается с первичным антителом. Когда вторичное антитело конъюгировано с ферментативной меткой, для обеспечения визуализации антигена добавляют хромогенный или флуорогенный субстрат. Усиление сигнала происходит ввиду того, что несколько вторичных антител могут реагировать с разными эпитопами на первичном антителе.
[134] Для применения в способах выявления, описанных в данном документе, специалист в данной области техники способен провести мечение полипептидов или олигонуклеотидов, охватываемых настоящим изобретением. Как обычно практикуется в данной области техники, гибридизационные зонды для применения в выявлении уровней мРНК и/или антител или фрагментов антител для применения в IHC-способах можно метить и визуализировать в соответствии со стандартными способами, известными в данной области техники. Неограничивающие примеры традиционно используемых систем включают использование радиоактивных меток, ферментных меток, флуоресцентных меток, биотин-авидиновых комплексов, хемилюминесценции и им подобных.
[135] Первичные и/или вторичные антитела, используемые для IHC, как правило, будут мечены поддающимся выявлению фрагментом. Доступны многочисленные метки, которые, как правило, можно сгруппировать по следующим категориям: (а) радиоизотопы, такие как 35S, 14C, 125I, 3H и 131I; (b) частицы коллоидного золота; (c) флуоресцентные метки, в том числе без ограничения хелаты редкоземельных элементов (хелаты европия), TEXAS RED®, родамин, флуоресцеин, дансил, лиссамин, умбеллиферон, фикокритерин, фикоцианин или коммерчески доступные флуорофоры, например, SPECTRUM ORANGETM и SPECTRUM GREENTM или производные любого одного или нескольких из вышеперечисленных; (d) метки фермент-субстрат, в том числе без ограничения метки, описанные в патенте США № 4275149; и (e) ферментные метки, включающие, например, люциферазы (например, люциферазу светлячка и бактериальную люциферазу; см., например, патент США № 4737456), люциферин, 2,3-дигидрофталазиндионы, малатдегидрогеназу, уреазу, пероксидазу, как, например, пероксидазу хрена (HRPO), щелочную фосфатазу, β-галактозидазу, глюкоамилазу, лизоцим, сахаридоксидазы (например, глюкозооксидазу, галактозооксидазу и глюкозо-6-фосфатдегидрогеназу), гетероциклические оксидазы (например, уриказу и ксантиноксидазу), лактеропероксидазу, микропероксидазу и им подобные.
[136] Примеры комбинаций фермент-субстрат включают, например, пероксидазу хрена (HRPO) с гидрогенпероксидазой в качестве субстрата; щелочную фосфатазу (AP) с пара-нитрофенилфосфатом в качестве хромогенного субстрата и β-D-галактозидазу (β-D-Gal) с хромогенным субстратом (например, p-нитрофенил-D-галактозидазой) или флуорогенным субстратом (например, 4-метилумбеллиферил-D-галактозидазой). Общий обзор их см. в патентах США №№ 4275149 и 4318980.
[137] В некоторых вариантах осуществления любого из способов экспрессию одного или нескольких генов-биомаркеров эритропоэза выявляют с помощью иммуногистохимического анализа с использованием диагностического антитела (то есть первичного антитела) к продукту экспрессии гена-биомаркера эритропоэза. В некоторых вариантах осуществления диагностическое антитело специфически связывает продукт гена-биомаркера эритропоэза человека. В некоторых вариантах осуществления диагностическое антитело представляет собой антитело, отличное от человеческого. В некоторых вариантах осуществления диагностическое антитело представляет собой антитело крысы, мыши или кролика. В некоторых вариантах осуществления диагностическое антитело является моноклональным антителом. В некоторых вариантах осуществления диагностическое антитело является прямо меченым. В некоторых вариантах осуществления биомаркером эритропоэза является рецептор трансферрина (такой как CD71), трансферрин, Ly76, CD44, CD235a, ALAS2 или GATA-1. В некоторых вариантах осуществления диагностическое антитело представляет собой Ter-119.
[138] Образцы для IHC можно получать путем приведения в контакт образца с любым из диагностических антител, описанных выше, которые могут быть заключены в среду и нанесены под покровное стекло. Затем проводят оценивание на стекле, например, с использованием микроскопа, при этом могут быть использованы критерии интенсивности окрашивания, стандартно используемые в данной области. В некоторых вариантах осуществления присутствие биомаркера эритропоэза выявляют с помощью IHC в >0% образцов, в по меньшей мере 1% образцов, в по меньшей мере 5% образцов, в по меньшей мере 10% образцов.
[139] В альтернативных способах образец можно приводит в контакт с антителом, специфичным для указанного биомаркера, в условиях, достаточных для образования комплекса антитело-биомаркер, а затем подвергать выявлению указанный комплекс. Присутствие биомаркера можно выявить с помощью ряда способов, например, с помощью вестерн-блоттинга и процедур ELISA для анализа широкого спектра тканей и образцов, в том числе плазмы крови или сыворотки крови. Доступен широкий спектр методик для иммуноанализа с использованием такого формата анализа, см., например, патенты США. №№ 4016043; 4424279 и 4018653. Они включают как односайтовые, так и двухсайтовые или "сэндвич"-анализы неконкурентных типов, а также традиционные анализы конкурентного связывания. Эти анализы также включают прямое связывание меченого антитела с целевым биомаркером.
[140] Уровень экспрессии гена-биомаркера эритропоэза в образце ткани или клетки также можно исследовать с помощью функциональных или основанных на активности анализов. Например, если биомаркером является фермент, можно проводить анализы, известные в данной области техники, для определения или выявления присутствия данной ферментативной активности в образце ткани или клетки.
[141] В некоторых вариантах осуществления уровень субпопуляции эритроидных клеток или общих эритроидных клеток определяют с использованием проточной цитометрии (например, FACS), с применением известных в данной области техники способов или способов, описанных в данном документе. Каждая подгруппа эритроидных клеток характеризуется своей уникальной морфологией (например, объемом и морфологической сложностью клеток) и экспрессией специфических маркеров клеточной поверхности, таких как CD44 и CD71. Объем клетки можно измерять с использованием прямого рассеянного света (то есть "FSC") с использованием проточной цитометрии. Эритроидные клетки и их субпопуляции можно идентифицировать и выделять с помощью проточной цитометрии с использованием следующей стратегии гейтирования: общее количество RBC (Ter-119+ для мышей или CD235a+ для человека), незрелые ядерные формы RBC (Ter-119+, CD71+), зрелые RBC (Ter-119+/CD235a+, CD71- или Ter-119+/CD235a+, CD44low FSClow), проэритробласты (Ter-119intermediate/ CD235aintermediate, CD44high), базофильные эритробласты (Ter-119+/CD235a+, CD44high FSChigh), полихроматофильные эритробласты (Ter-119+/CD235a+, CD44intermediate FSCintermediate), ортохроматофильные эритробласты и ретикулоциты (Ter-119+/CD235a+, CD44intermediate FSClow). См., Chen, Liu et al., 2009 и Koulnis, Pop et al., 2011.
[142] В определенных вариантах осуществления образцы нормализуют как по отличиям в уровне анализируемого биомаркера эритропоэза, так и по вариабельности качества используемых образцов, а также по вариабельности между повторами анализа. Такая нормализация может быть достигнута путем выявления и встраивания определенных нормализующих биомаркеров, в том числе хорошо известных генов "домашнего хозяйства". Альтернативно нормализацию можно выполнять на основании среднего или медианного значения сигнала всех проанализированных генов или их большой субпопуляции (подход глобальной нормализации). На основе очередности для каждого из генов измеренное нормализованное количество мРНК или белка у субъекта сравнивают с количеством, определенным в эталонном наборе или историческом контроле. Нормализованные уровни экспрессии для каждой мРНК или белка на исследуемый образец на субъекта могут быть выражены в процентах от уровня экспрессии, измеренного в эталонном наборе или историческом контроле. Уровень, измеренный в конкретном исследуемом образце субъекта, будет падать на некоторый процентиль в данном диапазоне, что можно определить с помощью способов, хорошо известных в данной области техники.
[143] Уровень биомаркера эритропоэза выявляют в образце. Как правило, образец содержит клетку, или популяцию клеток, или некоторое количество ткани или жидкости от субъекта. Образцы, рассматриваемые в данном документе, включают срезы тканей, такие как образцы, полученные с помощью биопсии и при вскрытии, и замороженные срезы, отобранные для целей гистологического исследования. Биологические образцы также включают кровь и фракции или продукты крови (например, сыворотку крови, плазму крови, тромбоциты, эритроциты и им подобные). "Биопсия" относится к способу удаления образца ткани для диагностической или прогностической оценки и к самому образцу ткани. Любую методику биопсии, известную в данной области техники, можно использовать по отношению к диагностическим и прогностическим способам по настоящему изобретению. Используемая методика биопсии будет зависеть от типа ткани, подлежащей оценке (например, селезенка, костный мозг, клетка крови и т.д.) среди прочих факторов. Типичные методики биопсии включают без ограничения эксцизионную биопсию, инцизионную биопсию, игольчатую биопсию, хирургическую биопсию и биопсию костного мозга. Методики биопсии обсуждаются, например, в Harrison's Principles of Internal Medicine, Kasper, et al., eds., 16th ed., 2005, Chapter 70, а также по всей части V.
[144] В некоторых вариантах осуществления образец представляет собой клинический образец. В некоторых вариантах осуществления образец получают из селезенки субъекта. В некоторых вариантах осуществления образец получают из костного мозга субъекта. В некоторых вариантах осуществления образец ткани является фиксированным в формалине и залитым парафином, архивированным, свежим или замороженным. В некоторых вариантах осуществления образец представляет собой цельную кровь. В некоторых вариантах осуществления образец представляет собой фракцию крови, содержащую мононуклеарные клетки периферической крови (РВМС). В некоторых вариантах осуществления образец представляет собой образец плазмы крови или образец сыворотки крови.
[145] В некоторых вариантах осуществления эталонный образец, эталонная клетка, эталонная ткань, контрольный образец, контрольная клетка или контрольная ткань представляют собой отдельный образец или комбинированный образец от одного и того же субъекта или индивидуума, который получают в один или несколько моментов времени, отличных от момента получения исследуемого образца. Например, эталонный образец, эталонная клетка, эталонная ткань, контрольный образец, контрольная клетка или контрольная ткань представляет собой исторический контроль, полученный в более ранний момент времени, чем в момент получения исследуемого образца от того же субъекта или индивидуума. Такие эталонный образец, эталонная клетка, эталонная ткань, контрольный образец, контрольная клетка или контрольная ткань могут быть применимы в том случае, если эталонный образец получают перед введением метотрексата и терапевтического средства субъекту для обеспечения исходного уровня биомаркера у субъекта.
[146] В некоторых вариантах осуществления эталонный образец, эталонная клетка, эталонная ткань, контрольный образец, контрольная клетка или контрольная ткань представляет собой комбинированный образец от одного или нескольких здоровых людей, которые не являются субъектом или индивидуумом, подлежащим лечению. В некоторых вариантах осуществления эталонный образец, эталонная клетка, эталонная ткань, контрольный образец, контрольная клетка или контрольная ткань представляют собой комбинированный образец от одного или нескольких индивидуумов с заболеванием или состоянием (например, болезнью Помпе), которые не являются субъектом или индивидуумом, подлежащим лечению. В некоторых вариантах осуществления эталонный образец, эталонная клетка, эталонная ткань, контрольный образец, контрольная клетка или контрольная ткань представляют собой объединенные образцы (например, образцы РНК или белка) из объединенных PBMC или образцов плазмы крови от одного или нескольких индивидуумов, которые не являются субъектом или индивидуумом, подлежащим лечению. В некоторых вариантах осуществления эталонный образец, эталонная клетка, эталонная ткань, контрольный образец, контрольная клетка или контрольная ткань представляют собой комбинированный образец от одного или нескольких индивидуумов, которые не являются субъектом или индивидуумом, подлежащим лечению, но которые характеризуются индуцированной иммунной толерантностью к терапевтическому средству, достигнутой путем лечения метотрексатом. В некоторых вариантах осуществления эталонный образец, эталонная клетка, эталонная ткань, контрольный образец, контрольная клетка или контрольная ткань представляют собой объединенные образцы (например, образцы РНК или белка) из объединенных образцов плазмы или PBMC от одного или нескольких индивидуумов, которые не являются субъектом или индивидуумом, подлежащим лечению, но который характеризуется индуцированной иммунной толерантностью к терапевтическому средству, достигнутой путем лечения метотрексатом (например, положительный контроль). В некоторых вариантах осуществления эталонный образец, эталонная клетка, эталонная ткань, контрольный образец, контрольная клетка или контрольная ткань представляют собой объединенные образцы (например, образцы РНК или белка) из объединенных образцов плазмы крови или PBMC от одного или нескольких индивидуумов, которые не являются субъектом или индивидуумом и не проявляют иммунную толерантность к терапевтическому средству (например, отрицательный контроль). В некоторых вариантах осуществления эталонный образец, эталонная клетка, эталонная ткань, контрольный образец, контрольная клетка или контрольная ткань представляет собой комбинированный образец от одного или нескольких индивидуумов, которые не получают лечение терапевтическим средством и метотрексатом ("плацебо-контроль"). В определенных вариантах осуществления эталонный образец, эталонная клетка, эталонная ткань, контрольный образец, контрольная клетка или контрольная ткань представляют собой объединенные образцы (например, образцы РНК или белка) из объединенных PBMC или образцов плазмы крови от одного или нескольких индивидуумов, которые не получают лечение терапевтическим средством и метотрексатом ("плацебо-контролем"). В некоторых вариантах осуществления образцы плацебо-контроля от одного или нескольких индивидуумов характеризуются тем же заболеванием или нарушением (например, болезнью Помпе), что и субъект, подлежащий лечению.
[147] В некоторых вариантах осуществления образец получают от субъекта в период времени от по меньшей мере приблизительно одного дня до приблизительно 30 дней, в том числе в приблизительно любой из дней 1, 2, 4, 7, 9, 14 или 28 после последнего введения метотрексата. В некоторых вариантах осуществления образец получают от субъекта в период времени от приблизительно 7 дней до приблизительно 14 дней после последнего введения метотрексата. В некоторых вариантах осуществления образец получают от субъекта в период времени от по меньшей мере приблизительно одного дня до приблизительно 30 дней, в том числе в приблизительно любой из дней 1, 2, 4, 7, 9, 14 или 28 после начального введения терапевтического средства. В некоторых вариантах осуществления образец получают от субъекта в период времени от приблизительно 7 дней до приблизительно 14 дней от начала введения терапевтического средства. В некоторых вариантах осуществления образец получают от субъекта в период времени от по меньшей мере приблизительно одного дня до приблизительно 30 дней, как, например, в момент времени приблизительно 7, 9 и/или 14 дней после начального введения метотрексата и терапевтического средства. В некоторых вариантах осуществления образец получают от субъекта в период времени от приблизительно 7 дней до приблизительно 14 дней от начала введения метотрексата и терапевтического средства. В некоторых вариантах осуществления образец получают от субъекта более 1 раза (например, любое количество раз из 2, 3, 4 или больше раз). В некоторых вариантах осуществления образец получают в один или несколько из дня 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 после лечения метотрексатом (например, последнего введения метотрексата в цикле лечения метотрексатом). В некоторых вариантах осуществления образец получают от субъекта перед проведением у субъекта дополнительной терапии для индуцирования иммунной толерантности и/или иммуносупрессивной терапии.
B. Терапевтические средства
[148] Описанные в данном документе способы применимы для мониторинга, оценивания и/или контроля нежелательного иммунного ответа на терапевтическое средство у субъекта. Во многих случаях нежелательные иммунные ответы на терапевтическое средство могут оказывать различное влияние на исход у пациента. Такие ответы возникают в связи с тем, что биологические терапевтические средства, например, часто содержат последовательности и конформации, которые составляют эпитопы, являющиеся чужеродными для человека. Например, антитела к лекарственным средствам (ADA) могут отрицательно влиять на терапевтическую эффективность и/или увеличивать риски в отношении безопасности. ADA-ответ может вызвать реакции гиперчувствительности, анафилаксию, сывороточную болезнь, болезнь иммунных комплексов, острую почечную недостаточность. Врач может осуществлять мониторинг по ADA у пациентов, получающих белковую терапию, с применением хорошо известных способов, в том числе ELISA и иммуногистохимии.
[149] Известно, что различные терапевтические средства индуцируют нежелательные иммунные ответы, которые могут включать антитела к лекарственным средствам (ADA) и другие нежелательные иммунные ответы, опосредованные Т- и/или В-клетками. В некоторых вариантах осуществления терапевтическое средство представляет собой биологическое средство, такое как белок, нуклеиновая кислота, вирус, средство генной терапии, липид, липосома, углевод, метаболит или их комбинацию.
[150] В некоторых вариантах терапевтическое средство представляет собой белковую терапию. Белковая терапия относится к терапии, при которой терапевтическое средство представляет собой белковоподобное вещество, в том числе пептиды или белки. Белковая терапия может представлять собой, например, ферменты, цитокины, факторы роста, иммуномодуляторы, тромболитики, антитела (в том числе поликлональные и моноклональные антитела), фрагменты антител или модифицированные антитела (например, Fab, F(ab')2, Fv, Fd, scFv и dAb).
[151] В некоторых вариантах осуществления терапевтическое средство является терапевтическим полипептидом. В некоторых вариантах терапевтическое средство представляет собой фермент. Например, для пациентов с определенными генетическими заболеваниями было разработано множество ферментозаместительных терапевтических средств, в том числе FABRAZYME® (рекомбинантная альфа-галактозидаза человека) для болезни Фабри, CEREZYME® (имиглюцераза) для болезни Гоше, ALDURAZYME® (ларонидаза) для мукополисахаридоза I (MPS I) и MYOZYME® и LUMIZYME® (алглюкозидаза альфа) для болезни Помпе. В некоторых вариантах осуществления терапевтическое средство представляет собой альфа-галактозидазу А человека. В некоторых вариантах осуществления фермент представляет собой кислую α-глюкозидазу человека (по-разному называемую кислой мальтазой, альфа-глюкозидазой, альфа-1,4-глюкозидазой или кислой альфа-1,4-глюкозидазой). В некоторых вариантах осуществления фермент представляет собой конъюгат фермент-олигосахарид, в том числе конъюгат кислая альфа-глюкозидаза-олигосахарид или другой конъюгат фермент-олигосахарид, как это описано в патенте США № 7001994; патенте США № 7723296; патенте США № 7786277; патенте США № 8399657; патенте США № 8841427; патенте США № 9687531; патенте США № 8759501 и патенте США № 9469850.
[152] В некоторых вариантах осуществления терапевтическое средство представляет собой фермент, нейротрофическтй фактор, полипептид, дефицит или мутация которого имеются у индивидуума с нарушением, связанным с CNS, антиоксидант, антиапоптотический фактор, антиангиогенный фактор и противовоспалительный фактор, альфа-синуклеин, кислую бета-глюкозидазу (GBA), бета-галактозидазу-1 (GLB1), идуронат-2-сульфатазу (IDS), галактозилцерамидазу (GALC), маннозидазу, альфа-D-маннозидазу (MAN2B1), бета-маннозидазу (MANBA), псевдоарилсульфатазу A (ARSA), N-ацетилглюкозамин-1-фосфотрансферазу (GNPTAB), кислую сфингомиелиназу (ASM), белок, ассоциированный с болезнью Ниманна-Пика типа C (NPC1), кислую альфа-1,4-глюкозидазу (GAA), бета-субъединицу гексозаминидазы, HEXB, N-сульфоглюкозаминсульфогидролазу (MPS3A), N-альфа-ацетилглюкозаминидазу (NAGLU), гепарин-ацетил-CoA-альфа-глюкозаминид-N-ацетилтрансферазу (MPS3C), N-ацетилглюкозамин-6-сульфатазу (GNS), альфа-N-ацетилгалактозаминидазу (NAGA), бета-глюкуронидазу (GUSB), альфа-субъединицу гексозаминидазы (HEXA), хантингтин (HTT), лизосомную кислую липазу (LIPA), аспартилглюкозаминидазу, альфа-галактозидазу A, пальмитоилпротеинтиоэстеразу, трипептидилпептидазу, лизосомный трансмембранный белок, транспортер цистеина, кислую церамидазу, кислую альфа-L-фукозидазу, катепсин A, альфа-L-идуронидазу, арилсульфатазу B, арилсульфатазу A, N-ацетилгалактозамин-6-сульфат сульфатазу, кислую бета-галактозидазу или альфа-нейраминидазу. В некоторых вариантах осуществления терапевтическое средство представляет собой полипептид, выбранный из группы, состоящей из белка-ингибитора апоптоза нейронов (NAIP), фактора роста нервов (NGF), глиального фактора роста (GDNF), мозгового фактора роста (BDNF), цилиарного нейротрофического фактора (CNTF), тирозингидроксилазы (TH), GTP-циклогидролазы (GTPCH), декарбоксилазы аминокислот (AADC), антиоксиданта, антиангиогенного полипептида, противовоспалительного полипептида и аспартоацилазы (ASPA).
[153] В некоторых вариантах осуществления терапевтическое средство представляет собой фактор VIII (FVIII), фактор IX (FIX), дистрофин, дисферлин и трансмембранный регулятор проводимости при муковисцидозе (CFTR).
[154] В некоторых вариантах осуществления терапевтическое средство представляет собой антитело или его антигенсвязывающий фрагмент. Примеры терапевтических препаратов на основе антител включают CAMPATH® (алемтузумаб), THYMOGLOBULIN®, AVASTIN® (бевацизумаб), LUCENTIS® (ранибизумаб), REMICADE® (инфликсимаб), HUMIRA® (адалимумаб), RITUXAN® (ритуксимаб), TYSABRI® (натализумаб), SIMULECT® (базиликсимаб), ZENAPAX® (даклизумаб), OKT3® (муромонаб-CD3), ERBITUX® (цетуксимаб), MYLOTARG® (гемтузумаб), HERCEPTIN® (трастузумаб) и BENLYSTA® (белимумаб). Примеры других терапевтических препаратов на основе белков включают ENBREL® (этанерцепт) и другие слитые белки.
[155] В некоторых вариантах осуществления терапевтическое средство представляет собой средство, истощающее лимфоциты. Истощение лимфоцитов представляет собой тип иммуносупрессии путем сокращения числа циркулирующих лимфоцитов, например Т-клеток и/или В-клеток, что приводит к лимфопении. Средства, истощающие лимфоциты, включают, например, THYMOGLOBULIN®, гуманизированное моноклональное антитело к CD52 CAMPATH-1H® (алемтузумаб) и ритуксимаб. Истощение лимфоцитов желательно в лечении ряда аутоиммунных состояний, в том числе рассеянного склероза (Coles et al, Ann. Neurol. 46, 296-304 (1999); Coles et al, 2008), ревматоидного артрита, васкулита и волчанки. Терапия посредством истощения лимфоцитов может вызвать вторичный аутоиммунитет. Аутоиммунитет в данном документе называют "вторичным аутоиммунитетом", когда он возникает после возникновения первого ("основного") заболевания, например, "основного" аутоиммунного заболевания. Вторичный аутоиммунитет иногда возникает у пациентов с MS, имеющих или перенесших лимфопению после, например, терапии посредством истощения лимфоцитов. У некоторых людей вторичный аутоиммунитет возникает вскоре после терапии посредством истощения лимфоцитов (например, лечения алемтузумабом). У других индивидуумов вторичный аутоиммунитет может возникнуть только через месяцы или годы после терапии посредством истощения лимфоцитов; у некоторых из этих индивидуумов к тому времени, когда у них развивается вторичный иммунитет, может происходить значительное восстановление лимфоцитов (общего количества лимфоцитов), вследствие чего у них больше не наблюдают лимфопению. Истощение лимфоцитов может происходить в контексте лечения антителами или низкомолекулярными средствами.
[156] В некоторых случаях терапевтическое средство представляет собой вирусную терапию, где вирусный вектор используется для доставки терапевтического препарата на основе нуклеиновой кислоты. Иллюстративные вирусы, используемые в таких терапевтических препаратах, включают без ограничения аденовирусы, аденоассоциированные вирусы и ретровирусы. На капсидные белки вируса могут синтезироваться антитела, снижая эффективность и увеличивая риски в отношении безопасности таких терапевтических препаратов. Способы в настоящей заявке применимы для контроля нежелательных иммунных ответов (например, ADA-ответов и других нежелательных иммунных ответов, опосредованных Т- и/или В-клетками), а также при терапии вирусами. В некоторых вариантах осуществления вирусный вектор кодирует любое из терапевтических средств, описанных в данном документе. В некоторых вариантах осуществления вирусный вектор кодирует фермент, нейротрофический фактор, полипептид, дефицит или мутация которого имеются у индивидуума с нарушением, связанным с CNS, антиоксидант, антиапоптотический фактор, антиангиогенный фактор, противовоспалительный фактор, альфа-синуклеин, кислую бета-глюкозидазу (GBA), бета-галактозидазу-1 (GLB1), идуронат-2-сульфатазу (IDS), галактозилцерамидазу (GALC), маннозидазу, альфа-D-маннозидазу (MAN2B1), бета-маннозидазу (MANBA), псевдоарилсульфатазу A (ARSA), N-ацетилглюкозамин-1-фосфотрансферазу (GNPTAB), кислую сфингомиелиназу (ASM), белок, ассоциированный с болезнью Ниманна-Пика типа C (NPC1), кислую альфа-1,4-глюкозидазу (GAA, такую как алглюкозидазу альфа), бета-субъединицу гексозаминидазы, HEXB, N-сульфоглюкозаминсульфогидролазу (MPS3A), N-альфа-ацетилглюкозаминидазу (NAGLU), гепарин-ацетил-CoA-альфа-глюкозаминид-N-ацетилтрансферазу (MPS3C), N-ацетилглюкозамин-6-сульфатазу (GNS), альфа-N-ацетилгалактозаминидазу (NAGA), бета-глюкуронидазу (GUSB), альфа-субъединицу гексозаминидазы (HEXA), хантингтин (HTT), лизосомную кислую липазу (LIPA), аспартилглюкозаминидазу, альфа-галактозидазу A, пальмитоилпротеинтиоэстеразу, трипептидилпептидазу, лизосомный трансмембранный белок, транспортер цистеина, кислую церамидазу, кислую альфа-L-фукозидазу, катепсин A, альфа-L-идуронидазу, арилсульфатазу B, арилсульфатазу A, N-ацетилгалактозамин-6-сульфат, кислую бета-галактозидазу или альфа-нейраминидазу. В некоторых вариантах осуществления вирусный вектор кодирует полипептид, выбранный из группы, состоящей из белка-ингибитора апоптоза нейронов (NAIP), фактора роста нервов (NGF), глиального фактора роста (GDNF), мозгового фактора роста (BDNF), цилиарного нейротрофического фактора (CNTF), тирозингидроксилазы (TH), GTP-циклогидролазы (GTPCH), декарбоксилазы аминокислот (AADC), антиоксиданта, антиангиогенного полипептида, противовоспалительного полипептида и аспартоацилазы (ASPA). В некоторых вариантах осуществления вирусный вектор кодирует фактор VIII (FVIII), фактор IX (FIX), дистрофин, дисферлин или трансмембранный регулятор проводимости при муковисцидозе (CFTR). В некоторых вариантах осуществления вирусный вектор кодирует антитело или его антигенсвязывающий фрагмент. Примеры терапевтических препаратов на основе антител включают CAMPATH® (алемтузумаб), THYMOGLOBULIN®, AVASTIN® (бевацизумаб), LUCENTIS® (ранибизумаб), REMICADE® (инфликсимаб), HUMIRA® (адалимумаб), RITUXAN® (ритуксимаб), TYSABRI® (натализумаб), SIMULECT® (базиликсимаб), ZENAPAX® (даклизумаб), OKT3® (муромонаб-CD3), ERBITUX® (цетуксимаб), MYLOTARG® (гемтузумаб), HERCEPTIN® (трастузумаб) и BENLYSTA® (белимумаб). В некоторых вариантах осуществления вирусный вектор кодирует слитый белок; например, ENBREL® (этанерцепт).
[157] Способы в настоящей заявке также могут использоваться для контроля нежелательных иммунных ответов на виды биотерапии, отличной от белковой терапии. Иллюстративные виды биотерапии, отличные от белковой терапии, включают без ограничения виды терапии на основе нуклеиновых кислот (например, виды антисмысловой терапии, виды терапии на основе siRNA и виды терапии на основе miRNA).
C. Метотрексат, другие виды терапии для индуцирования иммунной толерантности и виды иммуносупрессивной терапии
[158] Способы, описанные в данном документе, включают введение субъекту эффективного количества метотрексата. В некоторых вариантах осуществления метотрексат используется для индуцирования иммунной толерантности к терапевтическому средству у субъекта. Любая из доступных схем введения доз может быть использована для индуцирования иммунной толерантности, в том числе продолжительная схема с еженедельным повторным введением доз (Garman et al. Clin Exp Immunol, 137(3):496-502 (2004); Joseph et al., Clin Exp Immunol, 152(1): 138-46 (2008); Mendelsohn et al., N Engl J Med, 360(2): 194-5 (2009)), а также кратковременные схемы с низкими дозами (см., публикацию патента США № 20140135337). В некоторых вариантах эффективное количество метотрексата вводят в трех циклах. В некоторых вариантах осуществления метотрексат вводят в одном цикле. В некоторых вариантах осуществления метотрексат вводят в одном, двух, трех, четырех, пяти или более циклах.
[159] Применение метотрексата посредством низкодозового введения кратковременным курсом для индуцирования иммунной толерантности является уникальным из-за его общепризнанной роли в качестве химиотерапевтического средства или иммуносупрессивного средства для длительного приема при ревматических заболеваниях (Kremer 2004). Впервые метотрексат был описан для лечения рака в 1940-х годах, но курсы метотрексата в высоких дозах все еще продолжают назначать для лечения ряда видов раковых и неопластических состояний. При аутоиммунных нарушениях среди прочего продолжительное еженедельное низкодозовое введение метотрексата используют для лечения ревматоидного артрита и псориаза (Cronstein 2005; Taylor et al., 2008). В схемах низкодозового введения метотрексата кратковременным курсом метотрексат в низких дозах вводят в одном цикле или трех циклах одновременно с началом проведения биологической терапии. В некоторых вариантах осуществления один цикл эквивалентен 3 последовательным ежедневным дозам метотрексата в низкой дозе, вводимых в моменты времени 0, 24 и 48 часов. Несмотря на то, что первоначально схему разработали как состоящую из трех циклов, у мышей было продемонстрировано, что один цикл введения метотрексата в низких дозах столь же эффективен в обеспечении долгосрочной иммунной толерантности (Joseph, Neff et al., 2012, Joly, Martin et al., 2014).
[160] Метотрексат действует как антагонист фолата, который конкурентно ингибирует дигидрофолатредуктазу, которая критически важна для синтеза de novo нуклеозида тимидина и биосинтеза пуринов и пиримидинов. Поскольку синтез ДНК критически необходим для клеточного цикла, считается, что высокие дозы метотрексата обеспечивают лечение рака посредством уничтожения клеток с высокой пролиферативной активностью. И напротив, считается, что механизм, с помощью которого продолжительное низкодозовое еженедельное введение метотрексата контролирует аутоиммунные нарушения, обусловлен влиянием на метаболизм пуринов, что приводит к истощению Т-клеток или подавлению антиген-зависимой пролиферации Т-клеток (Cronstein 2005). Также было показано, что метотрексат индуцирует накопление противовоспалительного медиатора аденозина, который может выступать медиатором Т-регуляторных клеток при воспалительных заболеваниях (Cronstein 2005, Ernst, Garrison et al., 2010, Han, Thomas et al., 2013).
[161] Механизм, с помощью которого достигается иммунная толерантность путем обработки низкодозовым введением метотрексата кратковременным курсом у мышей, по-видимому, отличается от механизма иммуносупрессии посредством продолжительного еженедельного повторного введения доз метотрексата. Еженедельное повторное введение доз метотрексата может приводить к различным иммунным последствия по сравнению со схемой с кратковременным введения доз.
[162] Используемый в данном документе термин "один цикл" относится к схеме лечения или единице лечения в виде последовательных или непоследовательных дней и начинается предпочтительно не более чем через пять (например, не более трех) дней после введения дозы терапевтического средства. Один цикл метотрексата может состоять из одной дозы метотрексата или из приблизительно любой 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 последовательных ежедневных доз метотрексата. Если терапевтическое средство вводят в несколько периодов, один цикл лечения метотрексатом предпочтительно не продолжают после первого периода введения дозы терапевтического средства. Например, при еженедельном, ежемесячном или ежегодном введении дозы терапевтического средства один цикл метотрексата состоит из трех последовательных дней приема метотрексата (например, перорально), начиная с дня 0, дня, когда терапевтическое средство вводят пациенту в первый раз. Затем пациент получает однократную дозу метотрексата в день 1 (приблизительно через 24 часа) и в день 2 (приблизительно через 48 часов). В некоторых вариантах один цикл метотрексата не длится дольше, чем приблизительно 8 дней.
[163] Метотрексат и терапевтическое средство можно вводить в любом порядке, который будет считаться целесообразным. Например, метотрексат можно вводить субъекту до, в ходе и/или после введения терапевтического средства. В некоторых вариантах осуществления метотрексат вводят в период времени от 48 часов до и 48 часов после проведения лечения терапевтическим средством. Например, метотрексат можно вводить в приблизительно один из следующих моментов времени: 48 часов до, 36 часов до, 24 часа до, за 12 часов до, одновременно с проведением, 12 часов после, 24 часа после, 36 часов после или 48 часов после проведения лечения терапевтическим средством. В некоторых вариантах осуществления метотрексат вводят одновременно с терапевтическим средством. В некоторых вариантах осуществления метотрексат вводят одновременно с введением терапевтического средства и через приблизительно 24 часа и приблизительно 48 часов после введения терапевтического средства. В некоторых вариантах осуществления терапевтическое средство представляет собой алглюкозидазу альфа, и при этом метотрексат вводят одновременно с введением терапевтического средства и через приблизительно 24 часа и приблизительно 48 часов после введения терапевтического средства.
[164] Метотрексат можно вводить в любой дозе, эффективной для снижения нежелательных иммунных ответов, например, гуморальных или клеточных ответов. Эффективное количество метотрексата у пациентов-людей может быть в диапазоне от приблизительно 0,05 мг/кг до приблизительно 10 мг/кг, например, не более приблизительно любого количества из 0,1 мг/кг, 0,2 мг/кг, 0,3 мг/кг, 0,4 мг/кг, 0,5 мг/кг, 1 мг/кг, 1,5 мг/кг, 2 мг/кг, 2,5 мг/кг, 3 мг/кг, 3,5 мг/кг, 4 мг/кг, 4,5 мг/кг, 5 мг/кг, 6 мг/кг, 7,5 мг/кг или 10 мг/кг. В некоторых вариантах осуществления эффективное количество составляет любое от приблизительно 0,1 мг/кг до приблизительно 1,5 мг/кг, от приблизительно 0,12 мг/кг до приблизительно 1,28 мг/кг, от приблизительно 1 мг/кг до приблизительно 2,5 мг/кг, или от приблизительно 2,5 мг/кг до приблизительно 5 мг/кг, или от приблизительно 0,1 мг/кг до приблизительно 5 мг/кг. В некоторых вариантах осуществления дозировка метотрексата может представлять минимальный риск в отношении безопасности, поскольку схема введения доз включает только короткий курс метотрексата при уровнях дозы, которые больше соответствуют дозам, которые используют при ревматоидном артрите, а не низким дозам, которые используют при неопластических состояниях. Пациенты с ревматоидным артритом могут получать до 25 мг метотрексата в неделю без выраженной токсичности. Низкой дозой метотрексата при неопластических состояниях считается 30 мг/м2.
[165] В некоторых вариантах осуществления метотрексат вводят в более чем одном цикле, но в низкой общей дозировке. Например, метотрексат можно вводить в двух или более (например, 3, 4, 5, 6 и т.д.) циклах, но с общей комбинированной дозой для пациента не более 5 мг/кг.
[166] Низкодозовые схемы введения метотрексата, очевидно, хорошо переносятся взрослыми. Точная доза и схема введения метотрексата должны быть определены врачом, принимая во внимание физическое состояние пациента, возраст, вес, пол, сопутствующие лекарственные препараты, которые он/она принимает, и их известные побочные эффекты, а также любые другие соответствующие факторы.
[167] В некоторых вариантах осуществления в дополнение к метотрексату субъекту проводят начальную терапию для индуцирования иммунной толерантности одновременно с введением терапевтического средства. Как указано в данном документе, "начальная терапия для индуцирования иммунной толерантности" относится к схеме индуцирования иммунной толерантности, проводимой у субъекта от момента начала введения терапевтического средства, в отличие от терапии для индуцирования иммунной толерантности, проводимой в последующих циклах лечения терапевтическим средством. В некоторых вариантах осуществления начальную терапию для индуцирования иммунной толерантности проводят одновременно с метотрексатом. В некоторых вариантах осуществления начальную терапию для индуцирования иммунной толерантности проводят после введения метотрексата, например, через 1, 2, 3, 4, 5, 6, 7 или более дней после введения метотрексата. В некоторых вариантах осуществления начальную терапию для индуцирования иммунной толерантности проводят до введения метотрексата, например, за 1, 2, 3, 4, 5, 6, 7 или более дней до введения метотрексата. В некоторых вариантах осуществления у субъекта имеется болезнь Помпе, например, CRIM-отрицательная форма болезни Помпе и/или инфантильная форма болезни Помпе (например, классическая инфантильная форма болезни Помпе). В некоторых вариантах осуществления метотрексат вводят перорально. В некоторых вариантах метотрексат вводят в дозе, составляющей приблизительно 0,5 мг/кг. В некоторых вариантах осуществления метотрексат вводят еженедельно. В некоторых вариантах осуществления метотрексат вводят подкожно. В некоторых вариантах метотрексат вводят в дозе, составляющей приблизительно 0,4 мг/кг. В некоторых вариантах осуществления метотрексат вводят в трех дозах в неделю в течение трех недель.
[168] В некоторых вариантах осуществления начальная терапия для индуцирования иммунной толерантности включает ритуксимаб, IVIG или их комбинацию. В некоторых вариантах осуществления начальная терапия для индуцирования иммунной толерантности включает введение ритуксимаба. В некоторых вариантах осуществления ритуксимаб вводят в дозе, составляющей приблизительно 375 мг/м2. В некоторых вариантах, например, если площадь поверхности тела (BSA) субъекта составляет менее 0,5 м2, ритуксимаб вводят в дозе, составляющей приблизительно 12,5 мг/кг. В некоторых вариантах осуществления ритуксимаб вводят внутривенно. В некоторых вариантах осуществления ритуксимаб вводят еженедельно. В некоторых вариантах осуществления начальная терапия для индуцирования иммунной толерантности включает введение IVIG. В некоторых вариантах IVIG вводят в дозе, составляющей приблизительно 0,5 мг/кг. В некоторых вариантах IVIG вводят в дозе, составляющей приблизительно 400-500 мг/кг. В некоторых вариантах осуществления IVIG вводят приблизительно каждые четыре недели. В некоторых вариантах осуществления IVIG вводят ежемесячно. В некоторых вариантах осуществления начальная терапия для индуцирования иммунной толерантности включает введение как ритуксимаба, так и IVIG.
[169] В некоторых вариантах субъекту проводят дальнейшее лечение терапевтическим средством исходя из уровня одного или нескольких биомаркеров эритропоэза. В некоторых вариантах осуществления, где уровни одного или нескольких биомаркеров эритропоэза повышены по сравнению с такими уровнями в контроле, субъекту проводят дальнейшее лечение терапевтическим средством без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии. В некоторых вариантах осуществления, где уровни одного или нескольких биомаркеров эритропоэза снижены по сравнению с такими уровнями в контроле, субъекту проводят дальнейшее лечение терапевтическим средством одновременно с проведением дополнительной терапии для индуцирования иммунной толерантности и/или иммуносупрессивной терапии. В некоторых вариантах осуществления один или несколько биомаркеров эритропоэза включают незрелые ядерные формы эритроциты. В некоторых вариантах осуществления один или несколько биомаркеров эритропоэза включают ген, ассоциированный с эритропоэзом, где ген ассоциирован с одним или несколькими из гемопоэза, гомеостаза ионов железа, регуляции дифференцировки эритроцитов и метаболизма гема. В некоторых вариантах один или несколько биомаркеров эритропоэза предусматривают ген, кодирующий рецептор трансферрина (такой как CD71), трансферрин, CD44, CD235a, ALAS2 или GATA-1. В некоторых вариантах осуществления выявление одного или нескольких биомаркеров эритропоэза проводят в образце, полученном от субъекта в период времени от приблизительно 7 дней до приблизительно 14 дней после последнего введения метотрексата. В некоторых вариантах осуществления образец представляет собой образец крови, образец РВМС или образец плазмы крови.
[170] В некоторых вариантах осуществления, где уровни одного или нескольких биомаркеров эритропоэза примерно равны (как, например, на по меньшей мере приблизительно одно из 90%, 95%, 98%, 99% или более) или меньше (то есть снижены по сравнению с) таких уровней в контроле, субъекту проводят дальнейшее лечение терапевтическим средством без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии. В некоторых вариантах осуществления, где уровни одного или нескольких биомаркеров эритропоэза повышены по сравнению с такими уровнями в контроле, субъекту проводят дальнейшее лечение терапевтическим средством одновременно с проведением дополнительной терапии для индуцирования иммунной толерантности и/или иммуносупрессивной терапии. В некоторых вариантах осуществления один или несколько биомаркеров эритропоэза включают зрелые эритроциты. В некоторых вариантах осуществления один или несколько биомаркеров эритропоэза включают общее число эритроидных клеток. В некоторых вариантах осуществления один или несколько биомаркеров эритропоэза включают гемоглобин, эритроидный анкирин или гликофорин С. В некоторых вариантах осуществления проводят выявление одного или нескольких биомаркеров эритропоэза в образце, полученном от субъекта в течение от приблизительно одного дня до 30 дней (от приблизительно 7 дней до приблизительно 14 дней) после последнего введения метотрексата. В некоторых вариантах осуществления образец представляет собой образец крови, образец РВМС или образец плазмы крови.
[171] Любая из известных в данной области видов терапии для индуцирования иммунной толерантности и/или иммуносупрессивной терапии может быть проведена субъекту в сочетании с дальнейшим лечением терапевтическим средством. В некоторых вариантах осуществления дополнительная терапия для индуцирования иммунной толерантности или иммуносупрессивная терапия предусматривает введение низкомолекулярного терапевтического средства, белкового терапевтического средства или их комбинации. Иллюстративные иммуносупрессивные средства включают без ограничения антитело к CD20 (например, ритуксимаб), антитело к BAFF (например, белимумаб), антитело к CD3 (например, муромонаб или отеликсизумаб), антитело к CD19, антитело к CD22, антитело к IgE (например, омализумаб), кортикостероид (например, преднизолон), рапамицин, метотрексат, WIG, циклофосфамид, циклоспорин А, азатиоприн, микофенолат мофетил и ингибитор протеасом (например, бортезомиб). Эти дополнительные иммуномодулирующие средства или их производные включают средства, целенаправленно воздействующие на антиген/изменяющие презентацию антигена и/или гуморальный или клеточный иммунный ответ. В некоторых вариантах дополнительная терапия для индуцирования иммунной толерантности или иммуносупрессивная терапия предусматривает введение внутривенного гамма-глобулина (IVIG). В некоторых вариантах осуществления иммуносупрессивная терапия включает средство, истощающее лимфоциты, которое истощает Т-клетки, В-клетки и/или плазматические клетки. В некоторых вариантах осуществления средством, которое истощает плазматические клетки, является бортезомиб.
[172] В некоторых вариантах дополнительная терапия для индуцирования иммунной толерантности или иммуносупрессивная терапия предусматривает применение стратегии формирования антигенспецифической толерантности. Были разработаны различные виды терапии для формирования антигенспецифической толерантности с использованием, например, антигенных пептидов, антиген- или пептид-связанных клеток, измененных пептидных лигандов (APL) и их производных. Виды терапии для формирования антиген-специфической толерантности описаны, например, в Miller et al. Nature Reviews Immunology 7.9 (2007): 665-677. В некоторых вариантах осуществления терапия для формирования антигенспецифической толерантности предусматривает более частое введение доз терапевтического средства или более высокую дозу терапевтического средства или как первое, так и второе. Например, терапевтическое средство можно вводить в дозе, которая составляет по меньшей мере приблизительно 1,5X, 2X, 3X, 5X, 10X или более начальной дозы. В некоторых вариантах осуществления терапевтическое средство вводят с частотой, которая составляет по меньшей мере приблизительно любое значение из 1,5X, 2X, 3X, 5X или выше от начальной частоты. В некоторых вариантах осуществления более высокую дозу терапевтического средства вводят одновременно с IVIG.
[173] В некоторых вариантах осуществления дополнительная терапия для индуцирования иммунной толерантности или иммуносупрессивная терапия предусматривает введение метротрексата. В некоторых вариантах осуществления дополнительная терапия для индуцирования иммунной толерантности или иммуносупрессивная терапия не предусматривает введение метротрексата. В некоторых вариантах осуществления дополнительная терапия для индуцирования иммунной толерантности или иммуносупрессивная терапия предусматривает одно или несколько из следующего: введение эффективного количества одного или нескольких из ритуксимаба, внутривенного иммуноглобулина (IVIG), циклофосфамида, бортезомиба, азатиоприна, циклоспорина, микофенолата и кортикостероида и применение стратегии формирования антигенспецифической толерантности.
[174] Дополнительную терапию для индуцирования иммунной толерантности или иммуносупрессивную терапию можно проводить субъекту перед дальнейшим введением терапевтического средства или одновременно с дальнейшим введением терапевтического средства. В некоторых вариантах осуществления дальнейшее лечение терапевтическим средством длится по меньшей мере приблизительно в течение любого из 1 месяца, 2 месяцев, 3 месяцев, 6 месяцев, 1 года, 2 лет, 3 лет или больше. Дополнительную терапию для индуцирования иммунной толерантности или иммуносупрессивную терапию можно проводить в течение всей продолжительности дальнейшего лечения терапевтическим средством или в течение части периода (например, только начало) дальнейшего лечения. Различные типы и/или схемы дополнительной терапии для индуцирования иммунной толерантности и/или иммуносупрессивной терапии можно проводить в каждом цикле лечения терапевтическим средством. Схема введения доз и продолжительность лечения посредством дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии могут быть выбраны врачом исходя из прогрессирования заболевания, уровней антител к лекарственному средству и/или уровней одного или нескольких биомаркеров эритропоэза.
[175] Влияние метотрексата и необязательно другой терапии для индуцирования иммунной толерантности и иммуносупрессивной терапии в отношении управления нежелательными гуморальными ответами у пациента можно контролировать с помощью хорошо известных способов, в том числе клинического обследования пациента, симптомов, анализов крови, определяющих титры антител к лекарственному средству, и иммуногистохимических анализов (например, анализов осаждения C4 и других твердофазных способов выявления антител, таких как иммуноферментный анализ (ELISA) и флуориметрические анализы на основе гранул). Также можно осуществлять мониторинг влияния путем измерения уровней биомаркеров, таких как MCP-1, IL-13, IL-6 и IL-12, уровни которых, как было показано, снижаются при лечении метотрексатом, и переходных 2 B-клеток, переходных 3 В-клеток, фолликулярных В-клеток, В-клеток маргинальной зоны, В10 В-клеток и В1 В-клеток, количество которых, как было показано, увеличивается при лечении метотрексатом. Кроме того, можно использовать TGF-бета, FoxP3, IL-5, IL-10, IL-15 и GM-CSF в качестве биомаркеров для мониторинга влияния метотрексата на нежелательные иммунные ответы по мере необходимости. Уровни биомаркеров также можно использовать для мониторинга влияния метотрексата на чувствительность Т-клеток к терапевтическому средству (например, терапевтическому полипептиду). Также можно проводить мониторинг по биомаркерам активации Т-клеток, например, IL-2, интерферону-γ и TNF-α, в качестве регистрируемых показателей для оценки влияния метотрексата на ответы Т-клеток. В некоторых вариантах осуществления дополнительно проводят определение уровня CD19 с целью мониторинга нежелательного иммунного ответа. В некоторых вариантах осуществления у субъекта проводят мониторинг на протяжении всего лечения на предмет присутствия одного или нескольких из уровня антител к лекарственному средству (например, уровень антител IgG к rhGAA), уровня CD19 и прогрессирования заболевания.
D. Заболевания и состояния
[176] Описанные в данном документе способы применимы для лечения субъектов, у которых имеется заболевание или состояние, которое можно подвергать лечению терапевтическим средством, например, белковым терапевтическим средством. Например, для лечения многих заболеваний и состояний разработали ферментозаместительную терапию, но у субъектов, получающих ферментозаместительную терапию, может развиться нежелательный иммунный ответ, например, появление антител к лекарственному средству.
[177] В некоторых вариантах осуществления у субъекта имеется лизосомная болезнь накопления. Под лизосомной болезнью накопления описывают класс из более чем 40 генетических нарушений (см., например, Holton, J. B., THE INHERITED METABOLIC DISEASES 205-242 (2nd ed. 1994); Scriver et al., 2 THE METABOLIC BASIS OF INHERITED DISEASE (7th ed. 1995)), каждое из которых является результатом дефицита определенного лизосомного фермента, как правило, возникающего в результате генетической мутации. Лизосомные ферменты необходимы для расщепления белковых, гликолипидных и углеводных метаболитов в лизосомах клеток. Когда один или несколько из данных ферментов являются дефектными у пораженных индивидуумов ввиду наследственных мутаций, лизосомы в клетках пораженных индивидуумов накапливают подмножество нерасщепленных субстратов, в основном липосахаридов и углеводов, в качестве запасных веществ, которые не могут быть расщеплены дефектными ферментами. Например, при болезни Гоше дефицит бета-глюкоцереброзидазы вызывает накопление глюкозилцерамида; при болезни Фабри дефектная альфа-галактозидаза А приводит к накоплению глоботриазилцеремида; при болезни Помпе недостаток кислой альфа-глюкозидазы вызывает накопление альфа-1-4-связанных олигосахаридов гликогена; и при болезни Тея-Сакса дефицит бета-N-ацетилгексозаминидазы приводит к накоплению ганглиозида GM2. Клинически у пациентов с данными синдромами проявляются различные симптомы, ассоциированные с накоплением указанных запасных веществ в лизосомах, которые в конечном итоге влияют на нормальную функцию клеток или тканей, что приводит к дисфункции органов в организме человека. Тяжесть заболевания зависит от остаточной активности фермента; в тяжелых случаях, когда активность фермента незначительна или отсутствует, смерть может наступить в раннем возрасте.
[178] В некоторых вариантах осуществления у субъекта имеется болезнь Гоше и он нуждается в лечении бета-глюкоцереброзидазой. В некоторых вариантах осуществления у субъекта имеется болезнь Фабри и он нуждается в лечении альфа-галактозидазой А. В некоторых вариантах осуществления у субъекта имеется болезнь Тея-Сакса и он нуждается в лечении бета-N-ацетилгексозаминидазой. В некоторых вариантах осуществления у субъекта имеется болезнь Помпе и он нуждается в лечении кислой α-глюкозидазой.
[179] В некоторых вариантах осуществления у субъекта имеется болезнь Помпе (по-разному известная как дефицит кислой мальтазы и болезнь накопления гликогена типа II). Способы, описанные в настоящем документе, эффективны для субъектов с ранней (инфантильной) и поздней (ювенильной и взрослой) формой болезни Помпе. В некоторых вариантах осуществления у субъекта имеется генетически наследуемая болезнь Помпе. В некоторых вариантах осуществления у субъекта имеется инфантильная форма болезни Помпе. В некоторых вариантах осуществления у субъекта имеется неклассическая инфантильная форма болезни Помпе. В некоторых вариантах осуществления у субъекта имеется болезнь Помпе с поздним началом, например, детская, ювенильная или взрослая форма болезни Помпе. В некоторых вариантах у субъекта имеется взрослая форма болезни Помпе.
[180] Классическая инфантильная форма болезни Помпе начинается в течение нескольких месяцев после рождения. У детей с данным нарушением, как правило, проявляются мышечная слабость (миопатия), слабый мышечный тонус (гипотония), увеличение печени (гепатомегалия) и пороки сердца, в том числе гипертрофия сердца, в связи с накоплением гликогена во всех органах. У пораженных детей также может отсутствовать набора веса и рост тела с ожидаемой скоростью (неспособность к развитию), и могут присутствовать проблемы с дыханием. При клиническом осмотре наблюдается генерализованная гипотония с истощением мышц, учащенное дыхание с западением грудины, умеренное увеличение печени и протрузия языка. Ультразвуковое исследование сердца показывает прогрессирующую гипертрофическую кардиомиопатию, что в конечном итоге приводит к недостаточности сердечного выброса. ЭКГ характеризуется выраженным отклонением левой оси, коротким интервалом PR, большими QRS комплексами, инвертированными зубцами Т и депрессией ST. Заболевание характеризуется быстро прогрессирующим течением, приводящим к кардиореспираторной недостаточности в течение первого года жизни. При гистологическом исследовании при вскрытии накопление лизосомного гликогена отмечают в различных тканях, и оно наиболее выражено в сердечной мышце и скелетных мышцах. При отсутствии лечения эта форма болезни Помпе обычно приводит к смерти от сердечной недостаточности в течение первого года жизни.
[181] Неклассическая инфантильная форма болезни Помпе, как правило, появляется в возрасте 1 года. Она характеризуется задержкой двигательных навыков (таких как переворачивание и сидение) и прогрессирующей мышечной слабостью. Сердце может быть аномально большим (кардиомегалия), но пораженные индивидуумы как правило не испытывают сердечной недостаточности. Мышечная слабость при данном нарушении приводит к серьезным проблемам с дыханием, а при отсутствии лечения большинство детей с неклассической инфантильной формой болезни Помпе доживают только до раннего детства.
[182] Болезнь Помпе с поздним началом может не проявляться явно позже детского возраста, подросткового или взрослого возраста. Болезнь Помпе с поздним началом, как правило, более легкая, чем инфантильные формы данного нарушения, и с меньшей вероятностью поражает сердце. Большинство людей с болезнью Помпе с поздним началом испытывают прогрессирующую мышечную слабость, особенно в ногах и туловище, включая мышцы, контролирующие дыхание. По мере развития нарушения проблемы с дыханием могут привести к дыхательной недостаточности.
[183] Лечение кислой альфа-глюкозидазой человека может продлить жизнь таких пациентов (например, до более чем 1, 2 или 5 лет до показателя нормальной продолжительности жизни). При помощи лечения также можно устранить или уменьшить клинические и биохимические проявления болезни Помпе, как это обсуждалось выше. Лечение назначают вскоре после рождения или в дородовом периоде, если известно, что родители несут вариантные аллели альфа-глюкозидазы, что подвергает риску их потомство.
[184] Пациенты с взрослой формой болезни Помпе с поздним началом могут не испытывать симптомов в течение первых двух десятилетий жизни. В этом клиническом подтипе преобладают воздействия на скелетные мышцы, в частности мышцы плечевого и тазового поясов, туловища и диафрагмы. Трудность в подъеме по лестнице часто является первоначальной жалобой. Дыхательное нарушение значительно варьирует. Оно может преобладать в клинической картине или пациент может не испытывать этой проблемы до позднего возраста. Большинство пациентов с поздним началом в конечном итоге умирают из-за дыхательной недостаточности. У пациентов с ювенильным подтипом симптомы обычно явно проявляются в первом десятилетии жизни. Как и при взрослой форме болезни Помпе, главной проблемой является слабость скелетных мышц; наблюдаются кардиомегалия, гепатомегалия и макроглоссия, но они встречаются редко. Во многих случаях в конечном итоге необходима ночная вспомогательная вентиляция легких. Легочные инфекции в комбинации с истощением дыхательных мышц являются опасными для жизни и, как правило, приводят к смертельному исходу до третьего десятилетия жизни. Лечение с помощью представленных способов продлевает жизнь пациентам с ювенильной или взрослой формой болезни Помпе с поздним началом до нормальных показателей продолжительности жизни. С помощью лечения также устраняют или значительно уменьшают клинические и биохимические симптомы заболевания.
[185] В некоторых вариантах осуществления субъект, страдающий болезнью Помпе, является CRIM-отрицательным. Используемый в данном документе в контексте болезни Помпе термин "CRIM" относится к иммунореактивности эндогенного белка GAA у пациента. Например, пациентов с двумя вредными мутациями и полным отсутствием GAA согласно оценке посредством вестерн-блоттинга с применением антитела к белку GAA человека дикого типа, классифицируют как отрицательные в отношении перекрестно-реактивного иммунологического материала (CRIM). Пациентов с белком GAA, определяемым с помощью вестерн-блоттинга, классифицируют как CRIM-положительные. В то время как большинство CRIM-положительных пациентов проявляют устойчивые терапевтические ответы в отношении ERT, CRIM-отрицательные пациенты практически одинаково плохо себя чувствуют, испытывая быстрое клиническое ухудшение ввиду продуцирования устойчивых антител к rhGAA с высоким титром. См., Kishnani PS, et al. Mol Genet Metab. 2010;99:26-33. Такой ADA также наблюдался у некоторых CRIM-положительных пациентов (Banugaria et al., 2011). В некоторых вариантах осуществления статус CRIM идентифицируют с помощью мутационного анализа GAA с подтверждением посредством вестерн-блот-анализа клеток фибробластов кожи или без него.
[186] В некоторых вариантах у субъекта имеется аутоиммунное заболевание, такое как рассеянный склероз (MS). В некоторых вариантах осуществления субъект нуждается в лечении антителом к CD52. В некоторых вариантах осуществления такое антитело представляет собой алемтузумаб.
[187] В некоторых вариантах у субъекта имеется генетическое заболевание. В некоторых вариантах осуществления у субъекта имеется заболевание или нарушение, которое подвергают лечению путем введения биопрепарата (например, полипептида, нуклеиновой кислоты и т.д.). В некоторых случаях у субъекта имеется заболевание или нарушение, которое подвергают лечению соединением (например, биопрепаратом), которое может индуцировать выработку антител к лекарственному средству (ADA) или иммунный ответ. В некоторых вариантах осуществления у субъекта имеется гемофилия A, гемофилия B, мышечная дистрофия, муковисцидоз, болезнь Хантингтона, болезнь Паркинсона или болезнь Альцгеймера. В некоторых вариантах у субъекта имеется заболевание или нарушение, которое подвергают лечению посредством вирусной терапии, где вирусный вектор используется для доставки нуклеиновой кислоты. В некоторых вариантах осуществления вирусный вектор получен из ретровируса, аденовируса, лентивируса, вируса простого герпеса, вируса осповакцины или аденоассоциированного вируса.
III. Наборы, анализы и изделия
[188] Кроме того, в данном документе представлены наборы, содержащие один или несколько реагентов для выявления биомаркера эритропоэза в образце, полученном от субъекта после введения метотрексата и терапевтического средства. В некоторых вариантах осуществления набор дополнительно содержит терапевтическое средство и/или метотрексат. В некоторых вариантах осуществления набор дополнительно содержит средство дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии. В некоторых вариантах осуществления набор дополнительно содержит инструкции по применению набора для выбора лекарственного препарата (например, для дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии) для лечения заболевания или нарушения, если у индивидуума снижен уровень биомаркера эритропоэза. В некоторых вариантах осуществления набор содержит реагенты для выявления двух или более биомаркеров эритропоэза.
[189] В некоторых вариантах осуществления представлен анализ для оценивания уровня иммунной толерантности к терапевтическому средству (например, кислой α-глюкозидазе человека) у субъекта с болезнью Помпе, при этом способ предусматривает получение образца от субъекта, где субъекту ранее проводили по меньшей мере один цикл лечения метотрексатом и по меньшей мере одной дозой терапевтического средства; и приведение в контакт образца со средством, которое связывается с биомаркером эритропоэза, где выявление повышенного уровня биомаркера эритропоэза по сравнению с контрольным уровнем свидетельствует об индуцировании иммунной толерантности.
[190] В некоторых вариантах осуществления представлен анализ для оценивания уровня иммунной толерантности к терапевтическому средству у субъекта, нуждающегося в терапевтическом препарате, предусматривающий: (a) введение субъекту эффективного количества метотрексата; (b) введение субъекту терапевтически эффективного количества терапевтического средства; и (c) выявление биомаркера эритропоэза в образце, полученном от субъекта, где уровень биомаркера эритропоэза в образце по сравнению с таким уровнем в контроле свидетельствует об индуцировании иммунной толерантности у субъекта к терапевтическому средству. В некоторых вариантах осуществления проводят выявление биомаркера эритропоэза в образце, полученном от субъекта в период времени от по меньшей мере одного дня до приблизительно 30 дней после введения метотрексата. В некоторых вариантах осуществления изменение уровня биомаркера эритропоэза ассоциировано с индуцированием эритропоэза, где изменение уровня биомаркера эритропоэза ассоциировано с индуцированием эритропоэза. В некоторых вариантах осуществления, если уровень биомаркера эритропоэза примерно равен такому уровню в контроле или ниже его, то субъект нуждается в дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии одновременно с дальнейшим лечением с помощью терапевтического средства; или если уровень биомаркера эритропоэза повышен по сравнению с таким уровнем в контроле, то субъект не нуждается в дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии. В некоторых вариантах осуществления, если уровень биомаркера эритропоэза практически повышен по сравнению с таким уровнем в контроле, то субъект нуждается в дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии одновременно с дальнейшим лечением с помощью терапевтического средства; или где если уровень биомаркера эритропоэза равен такому уровню в контроле или ниже его, то субъект не нуждается в дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии.
[191] В данном документе также представлены изделия, содержащие вместе упакованные фармацевтическую композицию, содержащую терапевтическое средство (например, кислую α-глюкозидазу человека), фармацевтическую композицию, содержащую метотрексат, и листок-вкладыш, указывающую на то, что терапевтическое средство предназначено для лечения пациента с заболеванием или состоянием исходя из уровня биомаркера эритропоэза после введения терапевтического средства и метотрексата. В некоторых вариантах осуществления изделие дополнительно содержит дополнительное средство терапии для индуцирования иммунной толерантности и/или средство иммуносупрессивной терапии. Способы лечения включают любой из способов лечения, раскрытых в данном документе.
[192] Изделие содержит контейнер и этикетку или листок-вкладыш на контейнере или вместе с ним. Подходящие контейнеры включают, например, бутылки, флаконы, шприцы и т. д. Контейнеры могут быть изготовлены из ряда материалов, таких как стекло или пластик. Контейнер удерживает или содержит композицию, содержащую терапевтическое средство в качестве активного средства, и он может иметь стерильное входное отверстие (например, контейнер может представлять собой мешок с раствором для внутривенного введения или флакон с пробкой, прокалываемой иглой для подкожных инъекций).
[193] Изделие может дополнительно содержать второй контейнер, содержащий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекций (BWFI), фосфатно-буферный солевой раствор, раствор Рингера и раствор декстрозы. Изделие может дополнительно включать другие вещества, необходимые с коммерческой точки зрения и с точки зрения потребителя, в том числе другие буферы, разбавители, наполнители, иглы и шприцы.
[194] Изделие по настоящему изобретению также включает информацию, например, в форме листка-вкладыша, указывающую на то, что композицию используют для лечения заболевания или состояния исходя из уровня одного или нескольких биомаркеров эритропоэза, описанных в данном документе. Вкладыш или этикетка могут иметь любую форму, например, бумажного или на электронного носителя, как, например, устройства хранения данных, которое включает флэш-память (например, флэш-накопитель USB или ему подобное), носитель с магнитной записью (например, дискету) или CD-ROM. Этикетка или вкладыш может также включать другую информацию, касающуюся фармацевтических композиций и лекарственных форм в наборе или изделии.
[195] Данное изобретение также касается способа изготовления изделия, содержащего объединенные в упаковке фармацевтическую композицию, содержащую терапевтическое средство (например, кислую α-глюкозидазу человека), фармацевтическую композицию, содержащую метотрексат, и листок-вкладыш, указывающую на то, что терапевтическое средство предназначено для лечения пациента с заболеванием или состоянием (например, болезнью Помпе) исходя из уровня биомаркера эритропоэза после введения терапевтического средства и метотрексата. В некоторых вариантах осуществления изделие дополнительно содержит дополнительное средство терапии для индуцирования иммунной толерантности и/или средство иммуносупрессивной терапии.
IV. Иллюстративные варианты осуществления
[196] В настоящем изобретении представлены следующие варианты осуществления:
[197] Вариант осуществления 1. Способ лечения субъекта, нуждающегося в лечении с помощью терапевтического средства, предусматривающий: (a) введение субъекту эффективного количества метотрексата; (b) введение субъекту эффективного количества терапевтического средства; (c) выявление биомаркера эритропоэза в образце, полученном от субъекта в период времени от по меньшей мере одного дня до приблизительно 30 дней после введения метотрексата; и (d) продолжение дальнейшего лечения с помощью терапевтического средства с проведением или без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии исходя из уровня биомаркера эритропоэза по сравнению с таким уровнем в контроле.
[198] Вариант осуществления 2. Способ по варианту осуществления 1, где изменение уровня биомаркера эритропоэза ассоциировано с индуцированием эритропоэза.
[199] Вариант осуществления 3. Способ по варианту осуществления 2, где если уровень биомаркера эритропоэза примерно равен такому уровню в контроле или ниже его, то стадия (d) предусматривает проведение дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии одновременно с дальнейшим лечением с помощью терапевтического средства; или где если уровень биомаркера эритропоэза повышен по сравнению с таким уровнем в контроле, то стадия (d) предусматривает продолжение дальнейшего лечения с помощью терапевтического средства без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии.
[200] Вариант осуществления 4. Способ по варианту осуществления 2, где если уровень биомаркера эритропоэза практически повышен по сравнению с таким уровнем в контроле, то стадия (d) предусматривает проведение дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии одновременно с дальнейшим лечением с помощью терапевтического средства; или где если уровень биомаркера эритропоэза равен такому уровню в контроле или ниже его, то стадия (d) предусматривает продолжение дальнейшего лечения с помощью терапевтического средства без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии.
[201] Вариант осуществления 5. Способ по варианту осуществления 3, где биомаркер эритропоэза представляет собой уровень содержания незрелых ядерных форм эритроцитов, фракции незрелых ретикулоцитов или клеточных нуклеиновых кислот.
[202] Вариант осуществления 6. Способ по варианту осуществления 4, где биомаркер эритропоэза представляет собой гематокрит.
[203] Вариант осуществления 7. Способ по варианту осуществления 5, где если уровень незрелых ядерных форм эритроцитов исходно снижается до того, как уровень незрелых ядерных форм эритроцитов повысится, дальнейшее лечение с помощью терапевтического средства продолжают без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии.
[204] Вариант осуществления 8. Способ по варианту осуществления 7, где метотрексат вводят в одном цикле, уровень незрелых ядерных форм эритроцитов при этом снижается за приблизительно один, приблизительно два, приблизительно три, приблизительно четыре, приблизительно пять, приблизительно шесть или приблизительно семь дней до того, как уровень незрелых ядерных форм эритроцитов становится повышенным.
[205] Вариант осуществления 9. Способ по варианту осуществления 7, где метотрексат вводят в двух или более циклах, уровень незрелых ядерных форм эритроцитов при этом снижается за период времени от приблизительно одного до приблизительно 14 дней до того, как уровень незрелых ядерных форм эритроцитов становится повышенным.
[206] Вариант осуществления 10. Способ по варианту осуществления 3 или 4, где выявление биомаркера эритропоэза представляет собой выявление экспрессии гена, ассоциированного с эритропоэзом, где ген, ассоциированный с эритропоэзом, представляет собой ген, ассоциированный с одним или несколькими из гемопоэза, гомеостаза ионов железа, регуляции дифференцировки эритроцитов и метаболизма гема.
[207] Вариант осуществления 11. Способ по варианту осуществления 10, где ген, ассоциированный с эритропоэзом, представляет собой ген, кодирующий рецептор трансферрина, трансферрин, Ly76 (антиген для Ter-119), CD44, CD235a, ALAS2 или GATA-1.
[208] Вариант осуществления 12. Способ по варианту осуществления 11, где рецептор трансферрина представляет собой рецептор трансферрина 1 (CD71).
[209] Вариант осуществления 13. Способ по любому из вариантов осуществления 10-12, где выявление гена, ассоциированного с эритропоэзом, предусматривает выявление РНК-транскрипта гена, ассоциированного с эритропоэзом, или выявление белкового продукта гена, ассоциированного с эритропоэзом.
[210] Вариант осуществления 14. Способ по варианту осуществления 13, где белковый продукт представляет собой гемоглобин.
[211] Вариант осуществления 15. Способ по варианту осуществления 3, где биомаркер эритропоэза представляет собой кофактор, ассоциированный с эритропоэзом.
[212] Вариант осуществления 16. Способ по варианту осуществления 15, где кофактором, ассоциированным с эритропоэзом, является порфирин, порфиринсодержащее соединение или тетрапиррол.
[213] Вариант осуществления 17. Способ по любому из вариантов осуществления 1-16, где образец представляет собой образец крови.
[214] Вариант осуществления 18. Способ по варианту осуществления 17, где образец крови представляет собой фракцию крови, содержащую мононуклеарные клетки периферической крови (РВМС).
[215] Вариант осуществления 19. Способ по варианту осуществления 18, где образец крови представляет собой образец сыворотки крови или образец плазмы крови, и при этом выявление биомаркера представляет собой выявление экспрессии гена, ассоциированного с эритропоэзом.
[216] Вариант осуществления 20. Способ по любому из вариантов осуществления 1-19, где контроль представляет собой исторический контроль или плацебо-контроль.
[217] Вариант осуществления 21. Способ по любому из вариантов осуществления 1-20, где субъектом является человек.
[218] Вариант осуществления 22. Способ по любому из вариантов осуществления 1-21, где эффективное количество метотрексата вводят в одном цикле или в трех циклах.
[219] Вариант осуществления 23. Способ по варианту осуществления 22, где метотрексат вводят в одном цикле.
[220] Вариант осуществления 24. Способ по варианту осуществления 22 или варианту осуществления 23, где цикл метотрексата состоит из 1 дня введения метотрексата или 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 последовательных дней введения метотрексата.
[221] Вариант осуществления 25. Способ по любому из вариантов осуществления 1-24, где метотрексат вводят субъекту в момент времени, выбранный из одного или нескольких из моментов времени до, в ходе и после введения терапевтического средства.
[222] Вариант осуществления 26. Способ по варианту осуществления 25, где метотрексат вводят в период времени от 48 часов до введения терапевтического средства до 48 часов после этого.
[223] Вариант осуществления 27. Способ по варианту осуществления 26, где метотрексат вводят одновременно с введением терапевтического средства и через приблизительно 24 часа и приблизительно 48 часов после введения терапевтического средства.
[224] Вариант осуществления 28. Способ по любому из пунктов 1-27, где метотрексат вводят в дозе, составляющей от приблизительно 0,1 мг/кг до приблизительно 5 мг/кг.
[225] Вариант осуществления 29. Способ по любому из вариантов осуществления 1-28, где образец получают от субъекта в период времени от по меньшей мере приблизительно одного дня до приблизительно 30 дней после последнего введения метотрексата.
[226] Вариант осуществления 30. Способ по любому из вариантов осуществления 1-29, где образец получают от субъекта в период времени от приблизительно 7 дней до приблизительно 14 дней после последнего введения метотрексата.
[227] Вариант осуществления 31. Способ по любому из вариантов осуществления 1-30, где образцы получают в течение нескольких дней после последнего введения метотрексата.
[228] Вариант осуществления 32. Способ по варианту осуществления 30, где образец получают в один или несколько моментов времени из дня 1, дня 2, дня 3, дня 4, дня 5, дня 6, дня 7, дня 14, дня 21 или дня 28 после последнего введения метотрексата.
[229] Вариант осуществления 33. Способ по любому из вариантов осуществления 1-32, где стадия (d) предусматривает введение средства, которое истощает Т-клетки, В-клетки или плазматические клетки.
[230] Вариант осуществления 34. Способ по любому из вариантов осуществления 1-33, где стадия (d) предусматривает одно или несколько из следующего: (a) введение эффективного количества одного или нескольких из ритуксимаба, внутривенного иммуноглобулина (IVIG), циклофосфамида, бортезомиба, азатиоприна, циклоспорина, микофенолата и кортикостероида и (b) применение стратегии формирования антигенспецифической толерантности.
[231] Вариант осуществления 35. Способ по варианту осуществления 34, где стратегия формирования антигенспецифической толерантности предусматривает более частое введение доз терапевтического средства или более высокую дозу терапевтического средства или как первое, так и второе.
[232] Вариант осуществления 36. Способ по варианту осуществления 35, где более высокую дозу терапевтического средства вводят одновременно с IVIG.
[233] Вариант осуществления 37. Способ по варианту осуществления 1-36, где терапевтическое средство представляет собой полипептид, нуклеиновую кислоту, вирус, средство генной терапии, липид, липосому или углевод.
[234] Вариант осуществления 38. Способ по любому из вариантов осуществления 1-37, где терапевтическое средство представляет собой терапевтический полипептид.
[235] Вариант осуществления 39. Способ по варианту осуществления 38, где терапевтический полипептид представляет собой антитело или его антигенсвязывающий фрагмент.
[236] Вариант осуществления 40. Способ по варианту осуществления 39, где антитело является моноклональным антителом.
[237] Вариант осуществления 41. Способ по варианту осуществления 39 или варианту осуществления 40, где антитело является средством, истощающим лимфоциты.
[238] Вариант осуществления 42. Способ по варианту осуществления 40 или варианту осуществления 41, где антитело представляет собой алемтузумаб.
[239] Вариант осуществления 43. Способ по варианту осуществления 38, где терапевтический полипептид является ферментом.
[240] Вариант осуществления 44. Способ по варианту осуществления 42, где фермент представляет собой альфа-галактозидазу А человека.
[241] Вариант осуществления 45. Способ по варианту осуществления 42, где фермент представляет собой кислую α-глюкозидазу человека.
[242] Вариант осуществления 46. Способ по любому из вариантов осуществления 1-38 и 43-45, где у субъекта имеется лизосомная болезнь накопления.
[243] Вариант осуществления 47. Способ по варианту осуществления 46, где у субъекта имеется болезнь Помпе.
[244] Вариант осуществления 48. Способ по варианту осуществления 47, где болезнь Помпе представляет собой инфантильную форму болезни Помпе.
[245] Вариант осуществления 49. Способ по варианту осуществления 46, где болезнь Помпе представляет собой классическую инфантильную форму болезни Помпе.
[246] Вариант осуществления 50. Способ по любому из вариантов осуществления 46-49, где субъект является отрицательным по перекрестно-реагирующему иммунологическому материалу (CRIM).
[247] Вариант осуществления 51. Способ по варианту осуществления 50, где способ дополнительно предусматривает проведение начальной терапии для индуцирования иммунной толерантности одновременно с введением терапевтического средства, где терапевтическое средство представляет собой кислую α-глюкозидазу человека.
[248] Вариант осуществления 52. Способ по варианту осуществления 51, где начальная терапия для индуцирования иммунной толерантности предусматривает введение одного или нескольких из ритуксимаба и IVIG.
[249] Вариант осуществления 53. Способ лечения болезни Помпе у нуждающегося в этом субъекта, предусматривающий: (a) введение субъекту эффективного количества метотрексата; (b) введение субъекту эффективного количества кислой α-глюкозидазы человека; (c) выявление биомаркера эритропоэза в образце, полученном от субъекта в период времени от по меньшей мере одного дня до приблизительно 30 дней после введения метотрексата; и (d) продолжение дальнейшего лечения с помощью кислой α-глюкозидазы человека с проведением или без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии исходя из уровня биомаркера эритропоэза по сравнению с таким уровнем в контроле.
[250] Вариант осуществления 54. Способ по варианту осуществления 53, где изменение уровня биомаркера эритропоэза ассоциировано с индуцированием эритропоэза.
[251] Вариант осуществления 55. Способ по варианту осуществления 54, где если уровень биомаркера эритропоэза примерно равен такому уровню в контроле или ниже его, то стадия (d) предусматривает проведение дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии одновременно с дальнейшим лечением с помощью кислой α-глюкозидазы человека; или если уровень биомаркера эритропоэза повышен по сравнению с таким уровнем в контроле, то стадия (d) предусматривает продолжение дальнейшего лечения с помощью кислой α-глюкозидазы человека без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии.
[252] Вариант осуществления 56. Способ по варианту осуществления 54, где если уровень биомаркера эритропоэза практически повышен по сравнению с таким уровнем в контроле, то стадия (d) предусматривает проведение дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии одновременно с дальнейшим лечением с помощью кислой α-глюкозидазы человека; или если уровень биомаркера эритропоэза равен такому уровню в контроле или ниже его, то стадия (d) предусматривает продолжение дальнейшего лечения с помощью кислой α-глюкозидазы человека без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии.
[253] Вариант осуществления 57. Способ по варианту осуществления 55, где биомаркер эритропоэза представляет собой уровень содержания незрелых ядерных форм эритроцитов, фракции незрелых ретикулоцитов или клеточных нуклеиновых кислот.
[254] Вариант осуществления 58. Способ по варианту осуществления 56, где биомаркер эритропоэза представляет собой гематокрит.
[255] Вариант осуществления 59. Способ по варианту осуществления 57, где если уровень незрелых ядерных форм эритроцитов исходно снижается до того, как уровень незрелых ядерных форм эритроцитов повысится, дальнейшее лечение с помощью терапевтического средства продолжают без проведения дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии.
[256] Вариант осуществления 60. Способ по варианту осуществления 59, где метотрексат вводят в одном цикле, уровень незрелых ядерных форм эритроцитов при этом снижается за приблизительно один, приблизительно два, приблизительно три, приблизительно четыре, приблизительно пять, приблизительно шесть или приблизительно семь дней до того, как уровень незрелых ядерных форм эритроцитов становится повышенным.
[257] Вариант осуществления 61. Способ по варианту осуществления 59, где метотрексат вводят в двух или более циклах, уровень незрелых ядерных форм эритроцитов при этом снижается за период времени от приблизительно одного до приблизительно 14 дней до того, как уровень незрелых ядерных форм эритроцитов становится повышенным.
[258] Вариант осуществления 62. Способ по варианту осуществления 55 или 56, где выявление биомаркера эритропоэза представляет собой выявление экспрессии гена, ассоциированного с эритропоэзом, где ген, ассоциированный с эритропоэзом, представляет собой ген, ассоциированный с одним или несколькими из гемопоэза, гомеостаза ионов железа, регуляции дифференцировки эритроцитов и метаболизма гема.
[259] Вариант осуществления 63. Способ по варианту осуществления 62, где ген, ассоциированный с эритропоэзом, представляет собой ген, кодирующий рецептор трансферрина, трансферрин, Ly76 (антиген для Ter-119), CD44, CD235a, ALAS2 или GATA-1.
[260] Вариант осуществления 64. Способ по варианту осуществления 63, где рецептор трансферрина представляет собой рецептор трансферрина 1 (CD71).
[261] Вариант осуществления 65. Способ по любому из вариантов осуществления 62-64, где выявление гена, ассоциированного с эритропоэзом, предусматривает выявление РНК-транскрипта гена, ассоциированного с эритропоэзом, или выявление белкового продукта гена, ассоциированного с эритропоэзом.
[262] Вариант осуществления 66. Способ по варианту осуществления 65, где белковый продукт представляет собой гемоглобин.
[263] Вариант осуществления 67. Способ по варианту осуществления 55, где биомаркер эритропоэза представляет собой кофактор, ассоциированный с эритропоэзом.
[264] Вариант осуществления 68. Способ по варианту осуществления 67, где кофактором, ассоциированным с эритропоэзом, является порфирин, порфиринсодержащее соединение или тетрапиррол.
[265] Вариант осуществления 69. Способ по любому из вариантов осуществления 53-68, где образец представляет собой образец крови.
[266] Вариант осуществления 70. Способ по варианту осуществления 69, где образец крови представляет собой фракцию крови, содержащую мононуклеарные клетки периферической крови (РВМС).
[267] Вариант осуществления 71. Способ по любому из вариантов осуществления 53-70, где субъектом является человек.
[268] Вариант осуществления 72. Способ по любому из вариантов осуществления 53-71, где болезнь Помпе представляет собой инфантильную форму болезни Помпе.
[269] Вариант осуществления 73. Способ по варианту осуществления 72, где болезнь Помпе представляет собой классическую инфантильную форму болезни Помпе.
[270] Вариант осуществления 74. Способ по варианту осуществления 72 или 73, где субъект является CRIM-отрицательным.
[271] Вариант осуществления 75. Способ по любому из вариантов осуществления 53-74, где контроль представляет собой исторический контроль или плацебо-контроль.
[272] Вариант осуществления 76. Способ по любому из вариантов осуществления 53-75, где эффективное количество метотрексата вводят в одном цикле или в трех циклах.
[273] Вариант осуществления 77. Способ по варианту осуществления 76, где эффективное количество метотрексата вводят в одном цикле.
[274] Вариант осуществления 78. Способ по варианту осуществления 76 или варианту осуществления 77, где цикл метотрексата состоит из 1 дня введения метотрексата или 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 последовательных дней введения метотрексата.
[275] Вариант осуществления 79. Способ по любому из вариантов осуществления 53-78, где эффективное количество метотрексата вводят субъекту в момент времени, выбранный из одного или нескольких из моментов времени до, в ходе и после введения терапевтического средства.
[276] Вариант осуществления 80. Способ по варианту осуществления 79, где эффективное количество метотрексата вводят в период времени от 48 часов до проведения лечения терапевтическим средством до 48 часов после этого.
[277] Вариант осуществления 81. Способ по варианту осуществления 80, где метотрексат вводят одновременно с введением терапевтического средства и через приблизительно 24 часа и приблизительно 48 часов после введения терапевтического средства.
[278] Вариант осуществления 82. Способ по любому из пунктов 53-81, где эффективное количество метотрексата составляет от приблизительно 0,1 мг/кг до приблизительно 5 мг/кг.
[279] Вариант осуществления 83. Способ по любому из вариантов осуществления 53-82, где выявление биомаркера эритропоэза в образце осуществляют в период времени от по меньшей мере приблизительно одного дня до приблизительно 30 дней после последнего введения метотрексата.
[280] Вариант осуществления 84. Способ по любому из вариантов осуществления 53-83, где выявление биомаркера эритропоэза в образце осуществляют в период времени от приблизительно 7 дней до приблизительно 14 дней после последнего введения метотрексата.
[281] Вариант осуществления 85. Способ по любому из вариантов осуществления 53-84, где образцы получают в течение нескольких дней после последнего введения метотрексата.
[282] Вариант осуществления 86. Способ по варианту осуществления 85, где образец получают в один или несколько моментов времени из дня 1, дня 2, дня 3, дня 4, дня 5, дня 6, дня 7, дня 14, дня 21 или дня 28 после последнего введения метотрексата.
[283] Вариант осуществления 87. Способ по любому из вариантов осуществления 53-86, где стадия (d) дополнительно предусматривает введение средства, которое истощает Т-клетки, В-клетки или плазматические клетки.
[284] Вариант осуществления 88. Способ по варианту осуществления 87, где средство, истощающее плазматические клетки, представляет собой бортезомиб.
[285] Вариант осуществления 89. Способ по любому из вариантов осуществления 53-88, где стадия (d) предусматривает одно или несколько из следующего: (a) введение эффективного количества одного или нескольких из ритуксимаба, внутривенного иммуноглобулина (IVIG), циклофосфамида, бортезомиба, азатиоприна, циклоспорина, микофенолата и кортикостероида и (b) применение стратегии формирования антигенспецифической толерантности.
[286] Вариант осуществления 90. Способ по варианту осуществления 89, где стратегия формирования антигенспецифической толерантности предусматривает более частое введение доз терапевтического средства или более высокую дозу терапевтического средства или как первое, так и второе.
[287] Вариант осуществления 91. Способ по варианту осуществления 90, где более высокую дозу терапевтического средства вводят одновременно с IVIG.
[288] Вариант осуществления 92. Способ по любому из вариантов осуществления 53-91, дополнительно предусматривающий проведение мониторинга относительно одного или нескольких из уровня антитела к кислой α-глюкозидазе человека, уровня CD19 или прогрессирования заболевания.
[289] Вариант осуществления 93. Способ оценивания уровня иммунной толерантности у субъекта с болезнью Помпе, предусматривающий: (a) получение образца от субъекта, где субъекту ранее проводили по меньшей мере один цикл лечения метотрексатом и вводили по меньшей мере одну дозу терапевтического средства; и (b) выявление биомаркера эритропоэза в образце, где уровень биомаркера эритропоэза в образце по сравнению с таким уровнем в контроле свидетельствует об индуцировании иммунной толерантности.
[290] Вариант осуществления 94. Способ по варианту осуществления 93, где стадия (b) предусматривает приведение в контакт образца со средством, которое связывается с биомаркером эритропоэза.
[291] Вариант осуществления 95. Способ оценивания уровня иммунной толерантности к терапевтическому средству у субъекта, нуждающегося в терапевтическом средстве, предусматривающий: (a) введение субъекту эффективного количества метотрексата; (b) введение субъекту эффективного количества терапевтического средства; и (c) выявление биомаркера эритропоэза в образце, полученном от субъекта, где уровень биомаркера эритропоэза в образце по сравнению с таким уровнем в контроле свидетельствует об индуцировании иммунной толерантности у субъекта к терапевтическому средству.
[292] Вариант осуществления 96. Способ оценивания уровня иммунной толерантности к терапевтическому средству у субъекта, нуждающегося в терапевтическом средстве, предусматривающий: (a) введение субъекту эффективного количества метотрексата; (b) введение субъекту эффективного количества терапевтического средства; (c) выявление биомаркера эритропоэза в образце, полученном от субъекта в период времени от по меньшей мере одного дня до приблизительно 30 дней после введения метотрексата; и (d) определение уровня иммунной толерантности к терапевтическому средству у субъекта исходя из уровня биомаркера, выявленного на стадии (с).
[293] Вариант осуществления 97. Способ по любому из вариантов осуществления 93-96, где изменение уровня биомаркера эритропоэза ассоциировано с индуцированием эритропоэза.
[294] Вариант осуществления 98. Способ по варианту осуществления 97, где если уровень биомаркера эритропоэза примерно равен такому уровню в контроле или ниже его, то субъект нуждается в дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии одновременно с дальнейшим лечением с помощью терапевтического средства; или если уровень биомаркера эритропоэза повышен по сравнению с таким уровнем в контроле, то субъект не нуждается в дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии.
[295] Вариант осуществления 99. Способ по варианту осуществления 97, где если уровень биомаркера эритропоэза практически повышен по сравнению с таким уровнем в контроле, то субъект нуждается в дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии одновременно с дальнейшим лечением с помощью терапевтического средства; или где если уровень биомаркера эритропоэза равен такому уровню в контроле или ниже его, то субъект не нуждается в дополнительной терапии для индуцирования иммунной толерантности или иммуносупрессивной терапии.
[296] Все признаки, раскрытые в данном подробном описании, могут быть объединены в любой комбинации. Каждый признак, раскрытый в данном подробном описании, может быть заменен альтернативным признаком, служащим той же, эквивалентной или аналогичной цели. Таким образом, если прямо не указано иное, каждый раскрытый признак является лишь примером общей последовательности эквивалентных или сходных признаков.
[297] Дополнительные подробности настоящего изобретения проиллюстрированы в следующих неограничивающих примерах. Раскрытие всех ссылок в данном подробном описании явным образом включено в данный документ посредством ссылки.
ПРИМЕРЫ
[298] Приведенные ниже примеры предназначены исключительно для иллюстрации настоящего изобретения и поэтому не должны рассматриваться как ограничивающие настоящее изобретение каким-либо образом. Следующие примеры и подробное описание представлены только с целью иллюстрирования, а не с целью ограничения.
Пример 1. Ответ на уровне транскрипции и белка в селезенке и крови мышей, обработанных согласно схеме низкодозового введения метотрексата кратковременным курсом для индуцирования иммунной толерантности
Введение
[299] Чтобы понять механизм действия индуцирования иммунной толерантности с помощью ITI схемы низкодозового введения метотрексата кратковременным курсом, проводили исследования с секвенированием следующего поколения и масс-спектрометрией белка для изучения клеток селезенки и мононуклеарных клеток периферической крови (РВМС) мышей, получавших rhGAA с метотрексатом в низких дозах или без него, и мышей из контрольных групп. Схема дизайна исследования показана на фиг. 1С.
Материалы и способы
Мыши, rhGAA и схема индуцирования низкими дозами метотрексата
[300] Самок мышей C57BL/6 (Jackson Laboratory) или C57BL/6NTac (Taconic Biosciences, Inc.) в возрасте от 8 до 12 недель содержали и поддерживали в соответствии с Руководством по уходу и использованию лабораторных животных Американской ассоциации по аккредитации содержания лабораторных животных. Институциональный комитет по уходу и использованию животных одобрил все процедуры в отношении животных. Мышей обрабатывали с помощью одного цикла по схеме низкодозового индуцирования метотрексатом одновременно с инъекцией rhGAA (Genzyme, компания Sanofi), как это описано ранее (Joly et al., 2014). Вкратце мышей подобранных по возрасту и полу обрабатывали посредством одного цикла (3 последовательных ежедневных дозы в 0, 24 и 48 часов) по схеме низкодозового индуцирования метотрексатом, 5 мг/кг, путем внутрибрюшинной инъекции в течение 15 минут до внутривенной инъекции в хвостовую вену rhGAA, 20 мг/кг. Последующие еженедельные дозы rhGAA (до 16 недель) вводили через 15 минут после профилактического внутрибрюшинного введения 30 мг/кг дифенгидрамина (West-Ward Pharmaceutical). Контрольный носитель или буфер для составления (FB) для rhGAA вводили аналогично восстановленной rhGAA. Кровь собирали путем отбора из ретроорбитального синуса у анестезированных мышей или с помощью терминальных кровопусканий в микропробирки CAPIJECT® для сбора образцов с антикоагулянтом ЭДТА (Terumo) на водном льду. Из селезенок получали суспензии отдельных клеток между предметными стеклами с лизисом RBC или без него. Костный мозг отбирали из одной бедренной кости на водном льду.
Транскрипционный анализ
[301] Подобранных по возрасту, подобранных по полу мышей подвергали обработке с использованием rhGAA или буфера для составления (FB) за 15 минут до инъекции по схеме низкодозового индуцирования метотрексатом в одном цикле или без нее, как это описано выше. Животных умерщвляли в день 7 от начала введения rhGAA. Терминальный отбор крови осуществляли из ретроорбитальных синусов, как это описано выше. Цельную кровь, разведенную 1 к 2 с PBS, наслаивали поверх фиколла для отделения мононуклеарных клеток периферической крови (РВМС). Из селезенок получали суспензии отдельных клеток между предметными стеклами. Образцы обрабатывали для лизиса RBC (BD Pharm Lyse). Образцы быстро замораживали в TRIZOLTM (раствор фенола, изотиоцианата гуанидина, ThermoFisher Scientific) и хранили при -80°C перед отправкой в BGI (всемирная сеть bgi.com/us/) для проведения анализа с секвенированием следующего поколения. Число целостности РНК (RIN) оценивали на биоанализаторе Agilent 2100 с использованием наборов RNA 6000 nano kit (Agilent) или RNA 6000 pico kit (Agilent). Амплификацию РНК выполняли с помощью набора для синтеза кДНК SMARTERTM PCR cDNA Synthesis Kit (Clonetech). Выявление фрагментов секвенирования проводили на Illumina HiSeq2000 с наборами для секвенирования Illumina. Наборы данных RNA-seq отфильтровали для удаления адаптеров и считываний низкого качества и оценивали по дифференциальной экспрессии с кратностью изменения 2 и p-значением ≤0,05. Дифференциально экспрессируемые гены аннотировали и исследовали с помощью программного обеспечения NextBio для сбора биологических данных (Illumina).
Масс-спектрометрия белка
[302] Подобранных по возрасту, подобранных по полу мышей подвергали обработке посредством одного цикла по схеме низкодозового индуцирования метотрексатом или без него одновременно с инъекцией rhGAA или FB, и животных умерщвляли через 7 дней от начала введения rhGAA, как это описано выше. Терминальный отбор крови осуществляли из ретроорбитальных синусов, как это описано выше, с последующим разделением плазмы крови и РВМС центрифугированием. Из селезенок получали суспензии отдельных клеток, как это описано выше. Образцы селезенки и крови быстро замораживали и отправляли в MS Bioworks (во всемирной сети msbioworks.com) для LC/MS масс-спектрометрии белка. В MS Bioworks плазму крови обедняли по альбумину, IgG и трансферрину с использованием полиаффинного спин-картриджа 3 для удаления белков из плазмы крови мыши (MARS3). Клетки лизировали в модифицированном буфере RIPA, содержащем ингибиторы протеаз и фосфатаз. С одним образцом расщепленного пептида проводили один анализ LC/MS/MS на тандемном масс-спектрометре Orbitrap (Velos Pro) (ThermoFisher), сопряженном с HPLC NanoAcquity (Waters). Данные анализировали с помощью Progenesis QI для протеомики (нелинейная динамика) для выявления пиков. Идентификацию и характеристику белка проводили с помощью базы данных Mascot (Matrix Science версии 2.4) с пороговым уровнем 10 ppm предшественника и 0,05 Да продуктов (Q-Exactive). Ложноотрицательные и ложноположительные результаты фильтровали через Scaffold (Proteome Software версии 4.0). Количественное определение белка проводили с помощью Progenesis QI для протеомики. Кратность изменения и p-значения рассчитывали на основе данных усредненного нормализованного содержания белка для каждой экспериментальной группы. Дифференциально экспрессированные белки определяли при кратности изменении 2 и p-значении ≤0,05. Данные анализировали для оценки накопления в процессах GO и других биологических категорий в MetaCore (Thomson Reuters).
Результаты
Схема низкодозового индуцирования метотрексатом положительно регулирует транскрипционные сигнатуры при эритропоэзе
[303] Мышей подвергали обработке rhGAA с метотрексатом в низких дозах или без него, как это описано выше. Включали экспериментальные контрольные группы, где мышам вводили контрольный носитель (буфер для составления, FB) в присутствии или в отсутствие метотрексата. Через семь дней после начала введения rhGAA селезенку и кровь отбирали и обрабатывали с получением спленоцитов и PBMC соответственно. Различия между группами обработки исследовали в указанных тканевых препаратах путем секвенирования следующего поколения (NGS). Данные РНК-секвенирования показали положительную регуляцию транскрипционных сигнатур эритропоэза в селезенке (фиг. 1A) и PBMC (фиг. 1B) у мышей, которых обрабатывали rhGAA в сочетании с низкими дозами метотрексата. На фиг. 1А и 1В показана репрезентативная подгруппа дифференциально экспрессируемых генов, которые ассоциированы с эритропоэзом из общего набора данных. Положительная регуляция экспрессии генов, ассоциированных с эритропоэзом, в селезенке и РВМС у мышей, получавших rhGAA и низкую дозу метотрексата, заметно отличается от других групп, даже от мышей, которых обрабатывали только метотрексатом.
[304] Анализ транскрипционных модулей показал пути клеточного цикла, затронутые в селезенке мышей, обработанных rhGAA и низкой дозой метотрексата, по сравнению с мышами, обработанными только rhGAA. Помимо изменений в клеточном цикле, анализ транскрипционных модулей показал усиление путей, связанных с пролиферацией эритроцитов, включая гемопоэз, гомеостаз ионов железа, регуляцию дифференцировки эритроцитов и метаболизм гема (таблица 1 ниже). И напротив, образцы крови показали признаки клеточного стрессового ответа (данные не показаны), но также показали усиление метаболизма гема (таблица 1). В целом транскрипционный анализ селезенки и крови показал положительную регуляцию путей, связанных с эритропоэзом, в группе, обработанной rhGAA и метотрексатом, через семь дней после начала введения rhGAA.
Схема низкодозового индуцирования метотрексатом положительно регулирует белковые сигнатуры при эритропоэзе
[305] Протеомный анализ также проводили для выявления путей на уровне белка, которые можно модулировать с помощью низкодозовой обработки метотрексатом. Дизайн исследования был аналогичен исследованию транскрипции, который описан выше, но исследование проводили с помощью масс-спектрометрии белка. Протеомный набор данных показал усиление путей гемопоэза и путей, связанных с гомеостазом ионов железа (таблица 1). Ассоциированные белки включают рецептор трансферрина 1 (TfR1, также называемый CD71, высоко экспрессируемый), маркер незрелых ядерных форм RBC [Dong et al., 2011]) и его лиганд трансферрина (фиг. 2) (TfR1 также демонстрирует активацию в наборе транскрипционных данных). Рецептор трансферрина 1 необходим для переноса железа от трансферрина в клетки. Данные белки обеспечивают усвоение железа, играют важную роль в биосинтезе гема в развивающихся эритроидных клетках. Положительная регуляция данных белков позволяет предположить, что активный биосинтез гемоглобина может происходить в развивающихся RBC. Повышение уровня генов и белков, участвующих в продуцировании и функционировании эритроцитов, как правило, наблюдали в каждом из экспериментальных наборов данных, отображающих дифференциальную экспрессию в селезенке, между группами, обработанными rhGAA и низкими дозами метотрексата, по сравнению с группами, обработанными только rhGAA. Следовательно, протеомный анализ селезенки показал положительную регуляцию путей, связанных с эритропоэзом, в группах, обработанных rhGAA и метотрексатом, через семь дней после начала приема rhGAA.
Таблица 1. Повышение уровня дифференциально-регулируемых объектов по функциональным категориям, связанным с гематологическими эффектами.
|
мРНК: дифференциально экспрессируемые виды мРНК из набора данных RNA-Seq (FC ≥2, p ≤0,01). Белок: дифференциально-экспрессируемые белки из набора данных MS Bioworks (FC ≥2, p ≤0,05). p: гипергеометрическое распределение p-значения для дифференциально-экспрессируемых объектов из каждого эксперимента. Соотношение: количество дифференциально-экспрессируемых объектов в пределах функциональной категории по отношению к количеству объектов категории, анализируемых в эксперименте. NS: не значимо.
Пример 2. Влияние на эритроидные клетки в селезенке, крови и костном мозге мышей, обработанных согласно схеме низкодозового введения метотрексата кратковременным курсом для индуцирования иммунной толерантности
Введение
[306] Чтобы оценить и понять влияние индуцирования иммунной толерантности с помощью ITI схемы низкодозового введения метотрексата кратковременным курсом в селезенке, крови и костном мозге, проводили исследования с помощью проточной цитометрии для оценки образцов селезенки, крови и костного мозга мышей, обработанных rhGAA с ITI схемой низкодозового введения метотрексата кратковременным курсом или без нее, или мышей из контрольных групп. Кроме того, для дальнейшей оценки эритропоэза в образцах селезенки мышей, обработанных rhGAA с ITI схемой низкодозового введения метотрексата кратковременным курсом или без нее и мышей из контрольных групп проводили иммуногистохимические исследования и масс-спектрометрическую визуализацию тканей.
Материалы и способы
Проточная цитометрия
[307] Мышиные антитела, используемые для проточной цитометрии, включают антитела BioLegend PE-Ter-119 (№ кат. 116208), PerCP-Cy5.5-CD71 (№ кат. 113816), PE-Cy7-IgM (№ кат. 406516), Pacific Blue (PB)-CD86 (№ кат. 105022) и аллофикоцианин-CD45 (№ кат. 103116). Антитела от BD Biosciences включают FITC-CD44 (№ кат. 553133), аллофикоцианин-CD5 (№ кат. 550035), аллофикоцианин-CD19 или аллофикоцианин-Cy7-CD19 (№ кат. 557655 и 550992), FITC-CD1d (№ кат. 553845), FITC-CD23 (№ кат. 553138) и аллофикоцианин-Cy7-CD3ε (№ кат. 557596). Дифференцировку живых/погибших проводили окрашиванием с помощью набора BioLegend Zombie Aqua Fixable Viability Kit. Образцы пропускали через BD FACS Canto II (BD Biosciences) и результаты получали с помощью программного обеспечения BD FACSDiva. Данные цитометрии анализировали с помощью программного обеспечения FlowJo версии 10 (FlowJo, LLC). Абсолютные количества клеточной популяции рассчитывали на основе CountBright Absolute Counting Beads (ThermoFisher Scientific). Оцениваемые типы клеток включают общие RBC (Ter-119+), незрелые ядерные формы RBC (Ter-119+, CD71+), зрелые RBC (Ter-119+, CD71-), проэритробласты (Ter-119intermediate, CD44high), базофильные эритробласты (Ter-119+, CD44high FSChigh), полихроматофильные эритробласты (Ter-119+, CD44intermediate FSCintermediate), ортохроматофильные эритробласты и ретикулоциты (Ter-119+, CD44intermediate FSClow), зрелые эритроциты (Ter-119+, CD44low FSClow), общее количество активированных B-клеток (CD19+ CD86+), активированные фолликулярные B-клетки (CD19+, IgMlow/high CD23+, CD86+), активированные B-клетки маргинальной зоны (CD19+, IgMhigh CD23-, CD86+) и B10 регуляторные B-клетки (CD19+, CD1dhigh CD5+) (Allman et al., 2004; Chen et al., 2009; Koulnis et al., 2011; Joly et al., 2014).
Гематологические исследования
[308] Образцы отбирали из ретроорбитального синуса в микропробирки CAPIJECT® для образцов с антикоагулянтом ЭДТА и хранили при 2-8°C не более 72 часов. Дифференциальный анализ CBC, WBC и подсчет ретикулоцитов проводили на Sysmex XT2000iV (Sysmex).
Гистологический, иммуногистохимический анализ (IHC)
[309] Образцы селезенки фиксировали в 4% параформальдегиде в PBS, пропитывали 30% сахарозой, помещали в среду с оптимальной температурой для резания (OCT) и быстро замораживали для иммунофлуоресценции или гистологического анализа. Альтернативно образцы обрабатывали в парафине для гистологии. Окрашивание гематоксилином и эозином проводили так, как это описано ранее, и исследовали с помощью световой микроскопии (Burrow, Sun et al. 2015). Для иммунофлуоресцентного анализа образцы инкубировали с моноклональным антителом крысы к мышиному Ter-119 (№ кат. 116202) или CD71 (№ кат. 113802) от BioLegend и выявляли с помощью биотинилированного антитела кролика к IgG крысы. Иммунофлуоресцентный анализ срезов, окрашенных антителом к Ter-119 или CD71, проводили на Discovery XT Staining Module на системе автоматизированного окрашивания слайдов IHC/ISH BenchMark XT (Ventana Medical System). Для выявления использовали Ventana IHC DAB Map Kit. Иммунофлуоресцентные слайды сканировали с использованием 20-кратного объектива в сканере Mirax (Carl Zeiss). Срезы тканей контрокрашивали гематоксилином и анализировали с помощью световой микроскопии. Репрезентативные 100-кратные цифровые изображения подвергали количественной гистоморфометрии в отношении Ter-119- или CD71-положительной области с использованием программного обеспечения для анализа изображений HALO (Indica Labs).
Масс-спектрометрическая визуализация тканей (tMSI)
[310] Свежие образцы селезенки для tMSI собирали в 10% желатине (Alfa Aesar, № кат. J62699), замораживали одним блоком, нарезали на 10 мкМ срезы и наносили на предметные стекла, покрытые оксидом индия-олова (ITO). Предметные стекла ITO покрывали матрицей с помощью матрично-активированной лазерной десорбции/ионизации (MALDI) (α-циано-4-гидроксикоричной кислотой) для tMSI. Масс-спектрометрическую визуализацию выполняли с помощью масс-спектрометров AB Sciex 4800 MALDI-TOF/TOF, Autoflex MALDI-TOF/TOF и 7T SolariX MALDI-FTICR. Наборы данных изображений анализировали с помощью TissueView, flexImaging или Multimaging 1.1 (ImaBiotech).
Результаты
Размножение субпопуляций активированных В-клеток в ответ на обработку низкодозовым введением метотрексата кратковременным курсом
[311] Ранее было показано, что регуляторные В-клетки важны для индуцирования иммунной толерантности с помощью обработки низкодозовым введением метотрексата кратковременным курсом (Joly et al., 2014). Во всех описанных в данном документе экспериментах, включая исследования транскрипции, описанные в примере 1, при проточной цитометрии демонстрировались паттерны индуцирования иммунной толерантности, в частности размножение субпопуляций активированных B-клеток, ранее связанных с индуцированием иммунной толерантности (фиг. 3A - 3D).
Обработка низкодозовым введением метотрексата кратковременным курсом приводит к краткосрочному истощению эритроидных клеток с последующим обогащением незрелыми ядерными формами RBC Ter-119+ CD71+ в селезенке
[312] У мышей, обработанных rhGAA одновременно с проведением одного цикла обработки метотрексатом в низких дозах, значительно увеличилась селезенка в массе (фиг. 4A - 4B) и наблюдали значительно большую насыщенность селезенки клетками согласно определению с помощью проточной цитометрии, в день 7 от начала введения rhGAA (фиг. 4C). Наблюдаемая спленомегалия вместе с положительной регуляцией в сигнатурах эритропоэза, показанные в данных протеомики, послужили причиной проведения клеточного исследования RBC в ходе индуцирующей обработки низкодозовым введением метотрексата кратковременным курсом.
[313] Подобранных по возрасту, подобранных по полу мышей подвергали обработке rhGAA с одним циклом по схеме низкодозового введения метотрексата и без него, и животных умерщвляли с течением времени для анализа проточной цитометрией. Эритроид-специфическое моноклональное антитело Ter-119 использовали для исследования общего количества живых RBC (фиг. 4D). Незрелые ядерные формы RBC дифференцировали от зрелых RBC по рецептору трансферрина CD71 (Pan and Johnstone 1983). В день 2 после начала введения rhGAA, но до второго введения метотрексата, наблюдали значительное уменьшение общего количества эритроидных клеток (Ter-119+) и практически полное уменьшение количества незрелых ядерных форм RBC (Ter-119+ CD71+) в селезенке мышей из группы, обработанных низкими дозами метотрексата (фиг. 4E). В день 6 отличий между группами не наблюдали. Большое и значительное накопление общих эритроидных клеток, которое наблюдали в день 7, также было отмечено одновременным и значительным увеличением количества незрелых ядерных форм RBC (фиг. 4F). Меньшее, но значительное накопление общих эритроидных клеток и незрелых ядерных форм RBC наблюдали в день 9. В группах, обработанных низкодозовым введением метотрексата кратковременным курсом, эритроидный ответ повторял реакцию группы, обработанной низкодозовым введением метотрексата кратковременным курсом вместе с rhGAA (фиг. 4G, 4H).
[314] Таким образом, в селезенке может наблюдаться временное, но значительное уменьшение количества незрелых ядерных форм RBC и зрелых RBC в течение 24 часов после первого введения метотрексата в низкой дозе. Это сопровождается ответной реакцией, когда происходило значительное накопление незрелых ядерных форм RBC в селезенке мышей с индуцированной толерантностью. Накопление незрелых ядерных форм RBC достигает пика в день 7, что может объяснять значительно увеличение селезенки, наблюдаемое в этот день. При сравнении групп, которым вводили rhGAA вместе с ITI схемой низкодозового введения метотрексата кратковременным курсом, и групп, обработанных только по ITI схеме низкодозового введения метотрексата кратковременным курсом, эритроидный ответ был сходным. Это свидетельствует о том, что ITI схема низкодозового введения метотрексата кратковременным курсом вносит основной вклад в наблюдаемый эритроидный ответ.
Поздний эритроидный ответ в кровотоке после схемы индуцирования низкодозовым введением метотрексата
[315] Исследование компартмента крови также показало значительное истощение общих (фиг. 5А) и незрелых ядерных форм RBC (фиг. 5В) в день 2 в группе, обработанной одним циклом низкодозового введения метотрексата. К дню 4 незрелые ядерные формы RBC практически отсутствовали в крови группы, обработанной одним циклом низкодозового введения метотрексата. К дню 7 общий уровень RBC значительно уменьшился, тогда как накопление незрелых ядерных форм RBC было значительно повышенным. В день 9 кровь была в значительной степени обогащена общими и незрелыми ядерными формами RBC. К дню 14 небольшое, но значительное накопление незрелых ядерных форм RBC наблюдали в крови группы, получавшей один цикл метотрексата в низких дозах, что исчезало к дню 28.
[316] Крови также исследовали в отношении влияния только низкодозового введения метотрексата кратковременным курсом. При исследовании общих RBC не наблюдали отличий между группой, обработанной только метотрексатом, и группой, обработанной контрольным носителем (фиг. 5C - 5E). Однако ответ за счет незрелых ядерных форм RBC у мышей, обработанных только одним циклом низкодозового введения метотрексата, был аналогичен ответу у мышей, обработанных одним циклом низкодозового введения метотрексата вместе с биопрепаратом rhGAA (фиг. 5F - 5H).
[317] Чтобы подтвердить полученные нами результаты, кровь от мышей через 7 дней от начала введения rhGAA исследовали на Sysmex XT2000iV для развернутого клинического анализа крови (CBC) и подсчета количества ретикулоцитов. Общее количество RBC было значительно снижено в группах, обработанных низкодозовым введением метотрексата кратковременным курсом (фиг. 6А). Уровень содержания гемоглобина (фиг. 6B) и гематокрит (фиг. 6C) также значительно снижались в группах, обработанных низкодозовым введением метотрексата кратковременным курсом. Не наблюдали отличий в частоте выявления и количестве зрелых ретикулоцитов (фиг. 6D - 6E). Однако частота выявления фракции незрелых ретикулоцитов (IRF) была значительно повышена в группах, обработанных низкодозовым введением метотрексата кратковременным курсом (фиг. 6F).
[318] Таким образом, эритроидный ответ в крови был сходным, хотя и с задержкой. Развернутый анализ крови в день 7 от начала введения rhGAA показал снижение общего числа RBC, гематокрита и содержания гемоглобина в сочетании с повышенной частотой выявления фракции незрелых ретикулоцитов. Эта картина согласуется с регенеративным эритроидным ответом после потери эритроцитов.
Эритроидные клетки истощаются, но возвращаются к гомеостатическим уровням в костном мозге после использования схемы низкодозового индуцирования метотрексатом
[319] Ответы за счет эритроидных клеток в костном мозге на один цикл низкодозовой обработки метотрексатом не показали различий в общем числе RBC в день 4 по сравнению с мышами, получавшими только rhGAA (фиг. 7А). Однако незрелые ядерные формы RBC были значительно снижены в день 4 в группе с индуцированной толерантностью (фиг. 7В). В день 5 как общее число RBC, так и число незрелых ядерных форм RBC было значительно снижено в группе с индуцированной толерантностью. К дню 7 и 9 общее число RBC и число незрелых ядерных форм RBC не показало отличий между мышами с индуцированной толерантностью и мышами, которым вводили только rhGAA. Таким образом, в костном мозге также наблюдается раннее значительное снижение числа RBC, но к дню 7 уровни эритроидов возвращаются к гомеостатическим уровням.
Низкодозовая обработка метотрексатом кратковременным курсом индуцирует эритропоэз в селезенке
[320] На фиг. 8А показано, что дифференциальную экспрессию молекулы адгезии CD44 использовали для оценки различных стадий эритропоэза, от проэритробластов до зрелых эритроцитов, в ходе ITI схемы низкодозового введения метотрексата кратковременным курсом. В день 2 от начала введения rhGAA уровни эритроидных клеток всех ранних стадий, включая уровни проэритробластов, базофильных эритробластов, полихроматофильных эритробластов, ортохроматофильных эритробластов и ретикулоцитов, значительно уменьшаются в селезенке в группе проведения одного цикла низкодозового введения метотрексата (фиг. 8B). Зрелые RBC также значительно снижены в группах с индуцированной толерантностью в день 2. В день 7 от начала введения rhGAA в группе проведения одного цикла низкодозового введения метотрексата можно наблюдать значительное накопление проэритробластов, базофильных, полихроматофильных и ортохроматофильных эритробластов, а также ретикулоцитов (фиг. 8C). В день 7 в селезенке отсутствовали отличия в уровнях зрелых RBC. Накопление незрелых ядерных форм RBC в селезенке в день 7 от начала введения rhGAA совпадает с накоплением множества популяций B-клеток, способных придавать иммунную толерантность наивным мышам-реципиентам, а именно B10 регуляторные B-клетки, фолликулярные B-клетки и B-клетки, которые экспрессируют Foxp3, TGF-β и IL-10 (Joly et al., 2014).
[321] В крови небольшое, но значительное уменьшение уровня базофильных эритробластов, ортохроматофильных эритробластов, ретикулоцитов и зрелых эритроцитов можно наблюдать в день 2 от начала введения rhGAA в группе проведения одного цикла низкодозового введения метотрексата (фиг. 8D). Однако каких-либо изменений в уровнях незрелых ядерных форм RBC в крови не наблюдали в день 7 от начала введения rhGAA (фиг. 8E). В день 7 в крови мышей с индуцированной толерантностью наблюдали значительное снижение уровня зрелых RBC.
[322] В костном мозге наблюдали значительное истощение эритроидных клеток всех ранних стадий, в том числе проэритробластов, базофильных эритробластов, полихроматофильных эритробластов, ортохроматофильных эритробластов и ретикулоцитов в день 4 от начала введения rhGAA в группе низкодозового введения метотрексата кратковременным курсом, но без статистически значимых отличий с уровнями зрелых RBC (фиг. 8F). Истощение эритроидных клеток всех стадий, в том числе ранних и зрелых RBC, можно было наблюдать в день 5 в группе с индуцированной толерантностью (фиг. 8G). К дню 7 в группе с индуцированной толерантностью можно было наблюдать небольшое, но существенное накопление проэритробластов и полихроматофильных эритробластов (фиг. 8H). Тем не менее, уровни зрелых RBC значительно снижались в группе с индуцированной толерантностью. В день 9 можно было наблюдать небольшое, но существенное накопление проэритробластов и полихроматофильных эритробластов в группе с индуцированной толерантностью, но без отличий в уровнях зрелых RBC в костном мозге среди групп (фиг. 8I).
Частота выявления ядерных форм клеток повышалась в красной пульпе селезенки у мышей с индуцированной толерантностью
[323] Увеличение селезенки у мышей, которым вводили метотрексат в низкой дозе кратковременным курсом, указывает на возможное изменение морфологии селезенки. Для оценки этого мышам вводили rhGAA с проведением низкодозового введения метотрексата кратковременным курсом (например, ITI схемы) и без него, и селезенки отбирали через 7 дней от начала введения rhGAA. Микроскопический анализ селезенки показал значительно увеличенную площадь красной пульпы относительно области белой пульпы у мышей, которым вводили метотрексат в низкой дозе кратковременным курсом, по сравнению с мышами, которым вводили только rhGAA (фиг. 9A - 9B). Мыши, которым вводили метотрексат в низкой дозе кратковременным курсом с FB, также демонстрировали значительно увеличенную площадь красной пульпы относительно области белой пульпы по сравнению с мышами, которым вводили только FB. Ядерные формы клеток, вероятно, являются гематопоэтическими предшественниками, о чем свидетельствуют клеточные исследования с использованием проточной цитометрии.
Появление белков, ассоциированных со зрелыми RBC, уменьшалось в селезенке мышей с индуцированной толерантностью
[324] Пространственное распределение белков в селезенке исследовали с помощью масс-спектрометрической визуализации тканей. Мышей обрабатывали с помощью rhGAA в присутствии и отсутствии метотрексата, как это описано выше. Включали экспериментальные контрольные группы мышей, которых подвергали обработке буфером FB с метотрексатом и без него. Селезенки отбирали через 7 дней от начала введения rhGAA и замораживали единым блоком. Анализ 10 мкМ срезов селезенки показал, что белок эритроидный анкирин и гликофорин C равномерно распределяются в селезенке в группах, обработанных только rhGAA или FB (фиг. 10). В группах, которым вводили rhGAA или FB вместе с ITI схемой низкодозового введения метотрексата кратковременным курсом, сигнал эритроидного анкирина и гликофорина С уменьшался. Эритроидный анкирин и гликофорин C являются эритроид-специфичными белками, которые высокоэкспрессируются в зрелых RBC (Chen et al., 2009). Уменьшение уровней данных белков согласуется с временной потерей зрелых RBC с последующим продуцированием новых RBC в селезенке, обусловленным использования ITI схемы низкодозового введения метотрексата кратковременным курсом.
Пример 3. Трансфузия эритроидных клеток от мышей с толерантностью наивным мышам
Введение
[325] Чтобы определить, могут ли общие эритроциты, которые включают незрелые ядерные формы RBC и зрелые RBC от мышей с толерантностью, обеспечивать иммунную толерантность, проводили исследования с трансфузией эритроцитов для переливания эритроцитов от мышей, обработанных rhGAA с и без низкодозового введения метотрексата кратковременным курсом, наивным мышам. Иммунную толерантность оценивали путем измерения титров антител к rhGAA в сыворотке крови наивных мышей, которым провели трансфузию эритроцитов.
Материалы и способы
Титры антител к rhGAA в сыворотке крови
[326] Количественный анализ титров антител к rhGAA в мышиной сыворотке крови измеряли с помощью ELISA, как это описано ранее (Joly, Martin et al., 2014). Вкратце 96-луночные планшеты (Corning № кат. 29442-322) покрывали в течение ночи (5 мг/мл rhGAA в натрий-ацетатном буфере, рН 5,0), обрабатывали блокирующим реагентом (0,1% BSA в PBS) и инкубировали с серийными разведениями мышиной сыворотки крови в двух параллелях (1 час при 37°C). После промывки образцы обрабатывали вторичным антителом козы к IgG мыши, конъюгированным с HRP (Southern Biotechnology Associates № кат. 1030-05), промывали и проявляли добавлением субстрата TMB (3,3',5,5'-тетраметилбензидина)(BioFX Laboratories № кат. TMBW-1000-01) в течение 15 минут при комнатной температуре. Реакцию останавливали добавлением 1 н. HCl, и сразу измеряли поглощение при 450/650 нм на SpectraMax M2 (Molecular Devices). Титры в конечных точках получали из обратной величины разведения образца, что дало значение поглощения 0,2.
Трансфузия эритроидных клеток
[327] Сбор эритроидных клеток у мышей, подобранных по возрасту, подобранных по полу, проводили в день 7 (выделение эритроидных клеток из селезенки) и в день 9 (выделение эритроидных клеток из крови) после обработки rhGAA с ITI схемой с одним циклом приема метотрексата кратковременным курсом в низких дозах или без нее, как это описано выше. Кровь и селезенку в асептических условиях собирали и обрабатывали так, как это описано выше. Кровь собирали в стерильные пробирки Monoject для сбора крови с ЭДТА (Covidien № кат. 8881311149). Объединенную кровь пропускали через 25-мм WBC-фильтр Acrodisk PSF, адаптированный для мышей, с лейкосорбирующей средой (Pall № кат. AP-4851) для лейкоредукции. Эритроидные клетки из объединенных образцов селезенки выделяли с помощью микрогранул с мышиным антителом к Ter-119 MicroBeads (Miltenyi Biotec, № кат. 130-049-901) путем положительного отбора в соответствии с инструкциями производителя. Очищенные эритроидные клетки из крови (≥99,9%, подтвержденные проточной цитометрией) и из селезенки (≥93,3%, подтвержденные проточной цитометрией) промывали в стерильном PBS. Очищенные эритроидные клетки в/в вводили мышам-реципиентам в хвостовую вену. Мыши получали еженедельные дозы rhGAA после профилактического введения дифенгидрамина, как это описано выше. Один раз в две недели проводили сбор крови из ретроорбитальных синусов в микропробирки Capiject для сбора образцов с антикоагулянтом ЭДТА, как это описано выше. Образцы сыворотки крови собирали для оценки титров антител к rhGAA с помощью ELISA.
Результаты
Незрелые ядерные формы RBC селезенки, выделенные от мышей с толерантностью к rhGAA, индуцированной метотрексатом, наделяли иммунной толерантностью наивных мышей
[328] Трансфузию эритроидных клеток от мышей, получавших rhGAA с ITI схемой с одним циклом приема метотрексата кратковременным курсом в низких дозах или без нее, проводили наивным мышам, чтобы определить, могут ли общие эритроидные клетки, которые включают незрелые ядерные формы RBC и зрелые RBC, наделять иммунной толерантностью. Наивным мышам-реципиентам доставляли 75 миллионов эритроидных клеток (≥93,3%) из селезенки мышей-доноров через 7 дней после начала ведения rhGAA или 200 миллионов донорских эритроцитов, выделенных из крови (≥99,9%), через 9 дней после начала введения rhGAA. После трансфузии и еженедельно после этого мышам-реципиентам в/в вводили rhGAA. Сыворотку крови собирали один раз в две недели на протяжении до двадцатой недели включительно для оценки титров IgG-антител к rhGAA с помощью ELISA (фиг. 11A - 11C). В дозированных контролях (фиг. 11C) титры в течение недель 14, 16, 18 и 20 и площадь под кривой (AUC; 38% снижение AUC) значительно снижались в группе, обработанной rhGAA с ITI схемой низкодозового введения метотрексата кратковременным курсом (rhGAA+MTX) по сравнению с группой, обработанной только rhGAA. Тенденцию к снижения титров в течение 14, 16, 18 и 20 недель и к снижению AUC наблюдали у мышей, которые получали общие эритроциты из крови (кровь с индуцированной толерантностью, 38% снижение AUC) (фиг. 11A) или селезенки (селезенка с индуцированной толерантностью, 36% снижение AUC) (фиг. 11B) от мышей-доноров, которых обрабатывали rhGAA в комбинации с ITI схемой низкодозового введения метотрексата кратковременным курсом. Статистическую значимость оценивали с удалением выпадающих значения (наибольшее значение титра rhGAA) из каждой группы и сравнением разницы AUC между соответствующими группами.
[329] Чтобы определить, могут ли общие эритроидные клетки от мышей, обработанных rhGAA в комбинации с ITI схемой низкодозового введения метотрексата кратковременным курсом, обеспечить иммунную толерантность, проводили исследования с использованием трансфузии наивным мышам-реципиентам. Исторические данные показали, что у групп, обработанных rhGAA с ITI схемой низкодозового введения метотрексата кратковременным курсом, значительно снижались титры rhGAA и AUC по сравнению с группами, обработанными только rhGAA. Тем не менее, отличий между группами в группах дозированного контроля выявлено не было, возможно, из-за больших выпадающих значений (данные не показаны). Значимые отличия между группами наблюдали при удалении выпадающих значений. Во избежание ошибки большие выпадающие значения удаляли из каждой группы. Исследования с использованием трансфузии свидетельствуют о том, что общие выделенные эритроидные клетки от мышей-доноров, обработанных rhGAA в комбинации с ITI схемой низкодозового введения метотрексата кратковременным курсом, очевидно, демонстрируют тенденцию к приданию иммунной толерантности наивным мышам-реципиентам независимо от того, выделены они из крови или из селезенки. Исследование с использованием трансфузии проводили однократно.
Литературные источники
[330] Allman, D., B. Srivastava and R. C. Lindsley (2004). "Alternative routes to maturity: branch points and pathways for generating follicular and marginal zone B cells." Immunol Rev 197: 147-160.
[331] Banugaria, S. G., S. N. Prater, T. T. Patel, S. M. Dearmey, C. Milleson, K. B. Sheets, D. S. Bali, C. W. Rehder, J. A. Raiman, R. A. Wang, F. Labarthe, J. Charrow, P. Harmatz, P. Chakraborty, A. S. Rosenberg and P. S. Kishnani (2013). "Algorithm for the early diagnosis and treatment of patients with cross reactive immunologic material-negative classic infantile Pompe disease: a step towards improving the efficacy of ERT." PLoS One 8(6): e67052.
[332] Burrow, T. A., Y. Sun, C. E. Prada, L. Bailey, W. Zhang, A. Brewer, S. W. Wu, K. D. Setchell, D. Witte, M. B. Cohen and G. A. Grabowski (2015). "CNS, lung, and lymph node involvement in Gaucher disease type 3 after 11 years of therapy: clinical, histopathologic, and biochemical findings." Mol Genet Metab 114(2): 233-241.
[333] Chen, K., J. Liu, S. Heck, J. A. Chasis, X. An and N. Mohandas (2009). "Resolving the distinct stages in erythroid differentiation based on dynamic changes in membrane protein expression during erythropoiesis." Proc Natl Acad Sci U S A 106(41): 17413-17418.
[334] Collins, P. W., M. Mathias, J. Hanley, D. Keeling, R. Keenan, M. Laffan, D. Perry, R. Liesner and U. K. H. C. D. Organisation (2009). "Rituximab and immune tolerance in severe hemophilia A: a consecutive national cohort." J Thromb Haemost 7(5): 787-794.
[335] Cremel, M., N. Guerin, G. Campello, Q. Barthe, W. Berlier, F. Horand and Y. Godfrin (2015). "Innovative approach in Pompe disease therapy: Induction of immune tolerance by antigen-encapsulated red blood cells." Int J Pharm 491(1-2): 69-77.
[336] Cremel, M., N. Guerin, F. Horand, A. Banz and Y. Godfrin (2013). "Red blood cells as innovative antigen carrier to induce specific immune tolerance." Int J Pharm 443(1-2): 39-49.
[337] Cronstein, B. N. (2005). "Low-dose methotrexate: a mainstay in the treatment of rheumatoid arthritis." Pharmacol Rev 57(2): 163-172.
[338] Daugas, E., C. Cande and G. Kroemer (2001). "Erythrocytes: death of a mummy." Cell Death Differ 8(12): 1131-1133.
[339] Dong, H. Y., S. Wilkes and H. Yang (2011). "CD71 is selectively and ubiquitously expressed at high levels in erythroid precursors of all maturation stages: a comparative immunochemical study with glycophorin A and hemoglobin A." Am J Surg Pathol 35(5): 723-732.
[340] Elahi, S., J. M. Ertelt, J. M. Kinder, T. T. Jiang, X. Zhang, L. Xin, V. Chaturvedi, B. S. Strong, J. E. Qualls, K. A. Steinbrecher, T. A. Kalfa, A. F. Shaaban and S. S. Way (2013). "Immunosuppressive CD71+ erythroid cells compromise neonatal host defence against infection." Nature 504(7478): 158-162.
[341] Ernst, P. B., J. C. Garrison and L. F. Thompson (2010). "Much ado about adenosine: adenosine synthesis and function in regulatory T cell biology." J Immunol 185(4): 1993-1998.
[342] Franchini, M., C. Mengoli, G. Lippi, G. Targher, M. Montagnana, G. L. Salvagno, M. Zaffanello and M. Cruciani (2008). "Immune tolerance with rituximab in congenital haemophilia with inhibitors: a systematic literature review based on individual patients' analysis." Haemophilia 14(5): 903-912.
[343] Garman, R. D., K. Munroe and S. M. Richards (2004). "Methotrexate reduces antibody responses to recombinant human alpha-galactosidase A therapy in a mouse model of Fabry disease." Clin Exp Immunol 137(3): 496-502.
[344] Getts, D. R., D. P. McCarthy and S. D. Miller (2013). "Exploiting apoptosis for therapeutic tolerance induction." J Immunol 191(11): 5341-5346.
[345] Grimm, A. J., S. Kontos, G. Diaceri, X. Quaglia-Thermes and J. A. Hubbell (2015). "Memory of tolerance and induction of regulatory T cells by erythrocyte-targeted antigens." Sci Rep 5: 15907.
[346] Han, K. L., S. V. Thomas, S. M. Koontz, C. M. Changpriroa, S. K. Ha, H. L. Malech and E. M. Kang (2013). "Adenosine A(2)A receptor agonist-mediated increase in donor-derived regulatory T cells suppresses development of graft-versus-host disease." J Immunol 190(1): 458-468.
[347] Joly, M. S., R. P. Martin, S. Mitra-Kaushik, L. Phillips, A. D'Angona, S. M. Richards and A. M. Joseph (2014). "Transient low-dose methotrexate generates B regulatory cells that mediate antigen-specific tolerance to alglucosidase alfa." J Immunol 193(8): 3947-3958.
[348] Joseph, A., K. Munroe, M. Housman, R. Garman and S. Richards (2008). "Immune tolerance induction to enzyme-replacement therapy by co-administration of short-term, low-dose methotrexate in a murine Pompe disease model." Clin Exp Immunol 152(1): 138-146.
[349] Joseph, A., K. Neff, J. Richard, L. Gao, D. Bangari, M. Joly, K. Culm-Merdek, R. Garman, J. Williams, S. Richards and M. Ruzek (2012). "Transient low-dose methotrexate induces tolerance to murine anti-thymocyte globulin and together they promote long-term allograft survival." J Immunol 189(2): 732-743.
[350] Kina, T., K. Ikuta, E. Takayama, K. Wada, A. S. Majumdar, I. L. Weissman and Y. Katsura (2000). "The monoclonal antibody TER-119 recognizes a molecule associated with glycophorin A and specifically marks the late stages of murine erythroid lineage." Br J Haematol 109(2): 280-287.
[351] Kishnani, P. S., D. Corzo, M. Nicolino, B. Byrne, H. Mandel, W. L. Hwu, N. Leslie, J. Levine, C. Spencer, M. McDonald, J. Li, J. Dumontier, M. Halberthal, Y. H. Chien, R. Hopkin, S. Vijayaraghavan, D. Gruskin, D. Bartholomew, A. van der Ploeg, J. P. Clancy, R. Parini, G. Morin, M. Beck, G. S. De la Gastine, M. Jokic, B. Thurberg, S. Richards, D. Bali, M. Davison, M. A. Worden, Y. T. Chen and J. E. Wraith (2007). "Recombinant human acid [alpha]-glucosidase: major clinical benefits in infantile-onset Pompe disease." Neurology 68(2): 99-109.
[352] Kontos, S., I. C. Kourtis, K. Y. Dane and J. A. Hubbell (2013). "Engineering antigens for in situ erythrocyte binding induces T-cell deletion." Proc Natl Acad Sci U S A 110(1): E60-68.
[353] Koulnis, M., R. Pop, E. Porpiglia, J. R. Shearstone, D. Hidalgo and M. Socolovsky (2011). "Identification and analysis of mouse erythroid progenitors using the CD71/TER119 flow-cytometric assay." J Vis Exp(54).
[354] Kremer, J. M. (2004). "Toward a better understanding of methotrexate." Arthritis Rheum 50(5): 1370-1382.
[355] Lorentz, K. M., S. Kontos, G. Diaceri, H. Henry and J. A. Hubbell (2015). "Engineered binding to erythrocytes induces immunological tolerance to E. coli asparaginase." Sci Adv 1(6): e1500112.
[356] Mendelsohn, N. J., Y. H. Messinger, A. S. Rosenberg and P. S. Kishnani (2009). "Elimination of antibodies to recombinant enzyme in Pompe disease." N Engl J Med 360(2): 194-195.
[357] Messinger, Y. H., N. J. Mendelsohn, W. Rhead, D. Dimmock, E. Hershkovitz, M. Champion, S. A. Jones, R. Olson, A. White, C. Wells, D. Bali, L. E. Case, S. P. Young, A. S. Rosenberg and P. S. Kishnani (2012). "Successful immune tolerance induction to enzyme replacement therapy in CRIM-negative infantile Pompe disease." Genet Med 14(1): 135-142.
[358] Nandakumar, S. K., J. C. Ulirsch and V. G. Sankaran (2016). "Advances in understanding erythropoiesis: evolving perspectives." Br J Haematol 173(2): 206-218.
[359] Pan, B. T. and R. M. Johnstone (1983). "Fate of the transferrin receptor during maturation of sheep reticulocytes in vitro: selective externalization of the receptor." Cell 33(3): 967-978.
[360] Schakel, K., M. von Kietzell, A. Hansel, A. Ebling, L. Schulze, M. Haase, C. Semmler, M. Sarfati, A. N. Barclay, G. J. Randolph, M. Meurer and E. P. Rieber (2006). "Human 6-sulfo LacNAc-expressing dendritic cells are principal producers of early interleukin-12 and are controlled by erythrocytes." Immunity 24(6): 767-777.
[361] Taylor, W. J., E. Korendowych, P. Nash, P. S. Helliwell, E. Choy, G. G. Krueger, E. R. Soriano, N. J. McHugh and C. F. Rosen (2008). "Drug use and toxicity in psoriatic disease: focus on methotrexate." J Rheumatol 35(7): 1454-1457.
[362] Testa, U. (2004). "Apoptotic mechanisms in the control of erythropoiesis." Leukemia 18(7): 1176-1199.
[363] Van Putten, L. M. (1958). "The life span of red cells in the rat and the mouse as determined by labeling with DFP32 in vivo." Blood 13(8): 789-794.
[364] Yi, T., J. Li, H. Chen, J. Wu, J. An, Y. Xu, Y. Hu, C. A. Lowell and J. G. Cyster (2015). "Splenic Dendritic Cells Survey Red Blood Cells for Missing Self-CD47 to Trigger Adaptive Immune Responses." Immunity 43(4): 764-775.