Результат интеллектуальной деятельности: УЛУЧШЕННЫЕ СПОСОБЫ ОЧИСТКИ ВЕКТОРОВ НА ОСНОВЕ РЕКОМБИНАНТНОГО AAV
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет предварительной заявки на выдачу патента США № 61/187601, поданной 16 июня 2009 года, включенной в настоящий документ в качестве ссылки в полном объеме.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение, в основном, относится к области очистки векторов на основе рекомбинантного аденоассоциированного вируса (rAAV), которые можно использовать для переноса генов и, конкретно, для генотерапии или вакцинации. Более конкретно, оно относится к способам очистки векторов на основе рекомбинантного rAAV, которые, по существу, не содержат компонентов, сопутствующих способу продукции, таких как клеточные нуклеиновые кислоты, клеточные белки, хелперный вирус и компоненты среды.
ПРЕДШЕСТВУЮЩИЙ ИЗОБРЕТЕНИЮ УРОВЕНЬ ТЕХНИКИ
Аденоассоциированные вирусы (AAV) характеризуются уникальными чертами, которые придают им привлекательности в качестве векторов для генотерапии и генных вакцин. Инфицирование AAV клеток в культуре не приводит к цитопатологии, а происходящая в природе инфекция людей и других животных является молчащей, бессимптомной и не вовлечена в этиологию какого-либо заболевания человека. Кроме того, AAV инфицирует разнообразные типы клеток, включая многие клетки млекопитающих, что предоставляет возможность направленного действия на многие различные ткани in vivo. AAV инфицирует медленно делящиеся и неделящиеся клетки и может персистировать, по сути, в течение всей жизни этих клеток в качестве транскрипционно активной ядерной эписомы (внехромосомного элемента). Интегрированные копии вектора rAAV в таких органах, как печень или мышца, крайне редки. Сообщалось об эффективном долгосрочном переносе генов в ряд клеточных типов, включая клетки глаза, ЦНС, и мышцы. См., например, X. Xiao et al., J. Virol. 70(11):8098-8108 (1996); R.R. Ali et al., Hum. Mol. Genet. 5(5):591-94 (1996). Текущие клинические исследования, главным образом, сфокусированы на применении векторов на основе rAAV серотипа 2, но некоторые сообщения демонстрируют, что другие серотипы AAV, включая rAAV-1, rAAV-4, rAAV-5 и rAAV-8, характеризуются уникальным био-распределением in vivo, что делает их привлекательными вирусными серотипами с точки зрения тестирования в клинических испытаниях.
Аденоассоциированный вирус (AAV) является парвовирусом с дефицитом репликации, геном которого из одноцепочечной ДНК составляет приблизительно 4,7 тыс. н. длиной, и включает в себя инвертированный концевой повтор (ITR) длиной 145 нуклеотидов. Нуклеотидная последовательность AAV серотипа 2 (AAV2) представлена в Srivastava et al., J. Virol., 45: 555-564 (1983), с поправками в Ruffing et al., J. Gen. Virol., 75: 3385-3392 (1994). Действующие в цис-положении последовательности, направляющие репликацию вирусной ДНК (rep), заключение в капсид/упаковку и интеграцию в хромосому клетки-хозяина содержатся внутри ITR. Три промотора AAV p5, p19 и p40 (названные по их относительному положению на карте) управляют экспрессией двух внутренних открытых рамок считывания AAV, кодирующих гены rep и cap. Два промотора rep (p5 и p19), сопряженные с дифференциальным сплайсингом единственного интрона AAV в нуклеотидах 2107 и 2227, приводят к продукции четырех белков rep (rep78, rep68, rep52 и rep40) с гена rep. Белки rep обладают множественными ферментативными свойствами, которые, в конечном счете, отвечают за репликацию вирусного генома. Ген cap экспрессируется с промотора p40, и он кодирует три белка капсида VP1, VP2, и VP3. Участки альтернативного сплайсинга и неконсенсусного старта трансляции отвечают за продукцию трех родственных белков капсида. Единственный консенсусный участок полиаденилирования расположен в положении 95 карты генома AAV. Обзор жизненного цикла и генетики AAV осуществлен в Muzyczka, Current Topics in Microbiology and Immunology, 158: 97-129 (1992).
Частицы AAV содержат белковый капсид, включающий в себя три белка капсида VP1, VP2 и VP3, внутри которого помещается геном из линейной одноцепочечной ДНК ~4,6 т.н. Индивидуальные частицы служат упаковкой только одной молекулярной цепи ДНК, но это может быть плюс- или минус-цепь. Частицы, содержащие любую из цепей, являются инфицирующими, и репликация происходит путем преобразования родительской единичной цепи в форму дуплекса и путем последующей амплификации, в результате которой единичные дочерние цепи вытесняются и упаковываются в капсиды. Дуплексные или одноцепочечные геномы AAV (иногда обозначаемые как «провирусная ДНК» или «провирус») могут встраиваться в бактериальные плазмиды или фагемиды и трансфицироваться в инфицированные аденовирусом клетки. См. Carter, Handbook of Parvoviruses, Vol. I, pp. 169-228 (1989), и Berns, Virology, pp. 1743-1764, Raven Press, (1990) для общего обзора по AAV.
Продукция вектора на основе rAAV, в основном, требует четырех обычных элементов: 1) пермиссивной клетки-хозяина для репликации; 2) функции хелперного вируса, которая может быть предоставлена подходящими хелперными вирусами, такими как аденовирус или вирус герпеса, или, альтернативно, плазмидными конструкциями, содержащими минимальные аденовирусные хелперные функции; 3) транс-упаковывающей конструкции rep-cap; и 4) подходящей среды для продукции.
Частицы рекомбинантного AAV можно получать из лизатов упаковывающих клеток. См., например, Chirico и Trempe (1998) J. Virol. Methods 76:31-41. Однако, лизат клеток содержит различные клеточные компоненты, такие как ДНК клетки-хозяина, белки клетки-хозяина, компоненты сред и хелперный вирус или плазмидную ДНК хелперного вируса, которые следует отделить от вектора на основе rAAV до того, как он станет подходящим для применения in vivo. Недавние успехи продукции rAAV включают в себя применение процессов с суспензией неадгезивных клеток в биореакторах с механическим перемешиванием и условий продукции, при которых векторы на основе rAAV высвобождаются в среду или супернатант, со снижением концентрации компонентов клеток-хозяев, присутствующих в материале продукции, но данная среда все же содержит заметные количества образующихся в ходе процесса примесей. См. патент США № 6566118 и PCT WO 99/11764. Таким образом, частицы rAAV могут собираться из среды и/или лизата клеток и дополнительно очищаться.
Способы, включающие центрифугирование в градиенте плотности, используемое для очистки векторов на основе rAAV и, в частности, rAAV-2, не поддаются масштабированию. Недавние сообщения о векторах на основе rAAV-2 описывают способы очистки, в которых используется ионообменная хроматография, включая противоположную ионообменную хроматографию (включая катионную и анионную хроматографию). См., например, патент США № 6566118 и PCT WO 99/11764, в которых описаны способы применения комбинации противоположной ионообменной хроматографии для очистки векторов на основе рекомбинантного аденоассоциированного вируса из культурального супернатанта и/или клеточного лизата. Дополнительные улучшения в получении концентрированного раствора rAAV включают применение обработки клеточного лизата дезоксихолатом, разделение в градиенте йодиксинола перед аффинной хроматографией, что приводит к получению высокого титра rAAV2 (Clark et al., Hum. Mol. Genet. 10(6):1031-39 (1999); Zolotukhin et al., Gene Therapy 6(6):973-985 (1999)). O'Riordan et al. (O'Riordan et al., J. Gene Med. 2:444-454 (2000); патент США № 7015026) также сообщают о масштабируемом способе хроматографической очистки векторов на основе рекомбинантного аденоассоциированного вируса и, как, в частности, показано на примерах, векторов на основе rAAV-2, с использованием ионообменной хроматографии, хроматографии на гидроксиапатите, аффинной хроматографии на сульфате Cellufine и металлохелатной хроматографии с использованием цинка.
Недавно полученные данные указывают на то, что серотипы капсида rAAV, такие как rAAV-1, 4, 5 и 8, слабо связываются с анионными смолами, в виде очищенного исходного раствора вируса или в присутствии примесей, полученных в процессе продукции, таких как ДНК клетки-хозяина, белки клетки-хозяина, сывороточный альбумин, компоненты среды и компоненты хелперного вируса. Таким образом, очистка данных серотипов капсида, как правило, включает анионообменную хроматографию в комбинации с другими способами очистки, такими как центрифугирование в градиенте плотности йодоксинола. См., например, Zolotukhin et al., Methods 28(2): 158-167 (2002) и Kaludov et al., Hum. Gene Therapy 13:1235-1243 (2002); и патентную публикацию США № 2004/0110266 A1. Однако, данные способы не могут легко масштабироваться до процессов промышленного масштаба.
Таким образом, при разработке векторов на основе рекомбинантного AAV, таких как те, которые применяются в генотерапии и генных вакцинах, существует необходимость в способах очистки векторов на основе rAAV от компонентов, образующихся в процессе продукции, включая хелперный вирус, а также белки хелперного вируса, клеточные белки, ДНК клетки-хозяина и компоненты среды, присутствующие в исходном растворе продукции rAAV. Такие способы должны эффективно использоваться в масштабе, который подходит для практического применения способов генотерапии. Кроме того, существует необходимость для разработки способов очистки векторов rAAV, которые масштабируются с получением высокоочищенных коммерческих исходных растворов с высоким титром, которые могут использоваться для генотерапии и генных вакцин с участием rAAV. Более конкретно, существует необходимость для разработки способов очистки векторов на основе rAAV, которые слабо связываются с хроматографическими смолами и, в частности, с анионными смолами.
Описания всех публикаций, патентных заявок и патентов, цитируемых в данной спецификации, включены в настоящий документ в качестве ссылки, как если бы по каждой индивидуальной публикации, патентной заявке, или патенту было бы конкретно и отдельно указано, что они включены в качестве ссылки. В частности, все публикации, цитируемые в настоящем документе, определенно включены в настоящий документ в качестве ссылки для цели описания и раскрытия композиций и способов, которые могут использоваться согласно изобретению. Хотя изобретение, предоставленное в настоящем документе, описано в некоторых подробностях путем иллюстрации и примера для цели ясности понимания, специалисты в данной области легко поймут в свете изложения настоящего изобретения, что определенные изменения и модификации могут осуществляться в отношении него без уклонения от сущности и объема прилагаемой формулы изобретения.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к способам отделения популяции частиц рекомбинантного аденоассоциированного вируса (rAAV) любого серотипа капсида от образующихся в процессе продукции примесей путем захвата частиц rAAV на среду для хроматографии на апатите в присутствии полиэтиленгликоля (PEG). Способы по изобретению содержат предшествующую обработку (такую как, например, центрифугирование, обработку Benzonase®, анионообменную фильтрацию и/или фильтрование тангенциальным потоком), а также последующую обработку (такую как, например, инактивацию нагреванием, фильтрацию, хроматографию на основе гидрофобных взаимодействий, гель-фильтрацию и/или анионообменную хроматографию). Предшествующие и последующие способы можно использовать отдельно или в различных сочетаниях.
Изобретение относится к способам отделения популяции частиц рекомбинантного аденоассоциированного вируса (rAAV) от образующихся в ходе процесса примесей в потоке исходных материалов, включающий стадии: (a) приведения потока исходных материалов, содержащего частицы rAAV, в контакт со средой хроматографии на апатите в присутствии полиэтиленгликоля (PEG), где частицы rAAV связываются со средой хроматографии на апатите; и (b) элюирования частиц rAAV, связанных со средой хроматографии на апатите, с помощью буфера для элюирования, содержащего менее 3% (масс./об.) PEG. В определенных вариантах осуществления среда хроматографии на апатите представляет собой керамический гидроксиапатит (CHT) или керамический фторапатит (CFT). В определенных вариантах осуществления частицы rAAV, связанные со средой хроматографии на апатите, элюируют буфером элюции, содержащим менее чем 3% (масс./об.) PEG. В определенных вариантах осуществления частицы rAAV, связанные со средой хроматографии на апатите, элюируют буфером элюции в отсутствие PEG.
В некоторых вариантах осуществления специфическое связывание среды хроматографии на апатите составляет от 106 до 1016 устойчивых к ДНКазе частиц (DRP) на миллилитр. В некоторых вариантах осуществления специфическое связывание среды хроматографии на апатите составляет от 108 до 1016 устойчивых к ДНКазе частиц (DRP) на миллилитр. В некоторых вариантах осуществления специфическое связывание среды хроматографии на апатите составляет от 1010 до 1016 устойчивых к ДНКазе частиц (DRP) на миллилитр. В некоторых вариантах осуществления специфическое связывание среды хроматографии на апатите составляет от 1012 до 1016 устойчивых к ДНКазе частиц (DRP) на миллилитр. В некоторых вариантах осуществления специфическое связывание среды хроматографии на апатите составляет от 1014 до 1016 устойчивых к ДНКазе частиц (DRP) на миллилитр.
В некоторых вариантах осуществления способ дополнительно включает до стадии хроматографии на апатите стадию анионообменной фильтрации, где частицы rAAV находятся в фильтрате анионообменной фильтрации. В некоторых вариантах осуществления способ дополнительно включает концентрирование частиц rAAV из фильтрата анионообменной фильтрации путем тангенциальной потоковой фильтрации перед стадией хроматографии на апатите. В некоторых вариантах осуществления способ дополнительно включает стадию связывания частиц rAAV в потоке исходных материалов, элюированных со среды хроматографии на апатите, с анионной средой хроматографии. В некоторых вариантах осуществления способ дополнительно содержит стадию инактивации нагреванием для инактивации хелперного вируса. В некоторых вариантах осуществления способ дополнительно содержит стадию связывания частиц rAAV в потоке исходных материалов со средой хроматографии на основе гидрофобных взаимодействий после хроматографии на апатите.
В некоторых вариантах осуществления поток исходных материалов, содержащий частицы rAAV, приводят в контакт со средой хроматографии на апатите в присутствии полиэтиленгликоля (PEG) и основного буфера. В некоторых вариантах осуществления основный буфер характеризуется pH между 7,2 и 10, pH между 7,4 и 10, pH между 7,6 и 10, pH между 7,8 и 10, pH между 8,0 и 10,0, pH между 8,2 и 10,0, pH между 8,4 и 10,0, pH между 8,6 и 10,0, pH между 8,8 и 10, pH между 9,0 и 10,0, pH между 9,2 и 10, pH между 9,4 и 10,0, pH между 9,6 и 10,0, или pH между 9,8 и 10,0. В некоторых вариантах осуществления основный буфер характеризуется значением pH, приблизительно равным любому из 7,2, 7,6, 7,8, 8,0, 8,2, 8,4, 8,6, 8,8, 9,0, 9,2, 9,4, 9,6, 9,8, и 10,0. Можно использовать любой основный буфер, известный в данной области. В некоторых вариантах осуществления основный буфер содержит борат. В некоторых вариантах осуществления основный буфер представляет собой борат.
В некоторых вариантах осуществления поток исходных материалов, содержащий частицы rAAV, приводят в контакт со средой хроматографии на апатите в присутствии полиэтиленгликоля (PEG). Например, можно использовать от приблизительно 3% (масс./об.) до приблизительно 10% (масс./об.) PEG. В некоторых вариантах осуществления поток исходных материалов, содержащий частицы rAAV, приводят в контакт со средой хроматографии на апатите в присутствии приблизительно 3% (масс./об.), приблизительно 3,5% (масс./об.), приблизительно 4% (масс./об.), приблизительно 4,5% (масс./об.), приблизительно 5% (масс./об.), приблизительно 5,5% (масс./об.), приблизительно 6% (масс./об.), приблизительно 6,5% (масс./об.), приблизительно 7% (масс./об.), приблизительно 7,5% (масс./об.), приблизительно 8% (масс./об.), приблизительно 8,5% (масс./об.), приблизительно 9% (масс./об.), приблизительно 9,5% (масс./об.), или приблизительно 10% (масс./об.) PEG.
В некоторых вариантах осуществления PEG характеризуется средней молекулярной массой между приблизительно 5000 (PEG5000) граммов на моль и приблизительно 15000 (PEG15000) граммов на моль, например, приблизительно 5000 граммов на моль (PEG5000), приблизительно 6000 (PEG6000) граммов на моль, приблизительно 7000 (PEG7000) граммов на моль, приблизительно 8000 (PEG8000) граммов на моль, приблизительно 9000 (PEG9000) граммов на моль, приблизительно 10000 (PEG10000) граммов на моль, приблизительно 11000 (PEG 11000) граммов на моль, приблизительно 12000 (PEG12000) граммов на моль, приблизительно 13000 (PEG 13000) граммов на моль, приблизительно 14000 (PEG14000) граммов на моль и приблизительно 15000 (PEG15000) граммов на моль. В определенных вариантах осуществления PEG характеризуется средней молекулярной массой, равной приблизительно 5000 (PEG5000) граммов на моль. В определенных вариантах осуществления PEG характеризуется средней молекулярной массой, равной приблизительно 6000 (PEG6000) граммов на моль. В определенных вариантах осуществления PEG характеризуется средней молекулярной массой, равной приблизительно 8000 (PEG8000) граммов на моль. В определенных вариантах осуществления PEG характеризуется средней молекулярной массой, равной приблизительно 10000 (PEG 10000) граммов на моль. В определенных вариантах осуществления PEG характеризуется средней молекулярной массой, равной приблизительно 15000 (PEG15000) граммов на моль.
В некоторых вариантах осуществления поток исходных материалов, содержащий частицы rAAV, приводят в контакт со средой хроматографии на апатите в присутствии от приблизительно 3% (масс./об.) до приблизительно 10% (масс./об.) PEG6000. В некоторых вариантах осуществления поток исходных материалов, содержащий частицы rAAV, приводят в контакт со средой хроматографии на апатите в присутствии приблизительно 3% (масс./об.) PEG6000. В некоторых вариантах осуществления поток исходных материалов, содержащий частицы rAAV, приводят в контакт со средой хроматографии на апатите в присутствии приблизительно 4% (масс./об.) PEG6000. В некоторых вариантах осуществления поток исходных материалов, содержащий частицы rAAV, приводят в контакт со средой хроматографии на апатите в присутствии приблизительно 5% (масс./об.) PEG6000. В некоторых вариантах осуществления поток исходных материалов, содержащий частицы rAAV, приводят в контакт со средой хроматографии на апатите в присутствии приблизительно 6% (масс./об.) PEG6000. В некоторых вариантах осуществления поток исходных материалов, содержащий частицы rAAV, приводят в контакт со средой хроматографии на апатите в присутствии приблизительно 7% (масс./об.) PEG6000. В некоторых вариантах осуществления поток исходных материалов, содержащий частицы rAAV, приводят в контакт со средой хроматографии на апатите в присутствии приблизительно 8% (масс./об.) PEG6000. В некоторых вариантах осуществления поток исходных материалов, содержащий частицы rAAV, приводят в контакт со средой хроматографии на апатите в присутствии приблизительно 9% (масс./об.) PEG6000. В некоторых вариантах осуществления поток исходных материалов, содержащий частицы rAAV, приводят в контакт со средой хроматографии на апатите в присутствии приблизительно 10% (масс./об.) PEG6000.
В некоторых вариантах осуществления поток исходных материалов, содержащий частицы rAAV, приводят в контакт со средой хроматографии на апатите в присутствии между приблизительно 3% (масс./об.) и приблизительно 10% (масс./об.) PEG8000. В некоторых вариантах осуществления поток исходных материалов, содержащий частицы rAAV, приводят в контакт со средой хроматографии на апатите в присутствии приблизительно 3% (масс./об.) PEG8000. В некоторых вариантах осуществления поток исходных материалов, содержащий частицы rAAV, приводят в контакт со средой хроматографии на апатите в присутствии приблизительно 4% (масс./об.) PEG8000. В некоторых вариантах осуществления поток исходных материалов, содержащий частицы rAAV, приводят в контакт со средой хроматографии на апатите в присутствии приблизительно 5% (масс./об.) PEG8000. В некоторых вариантах осуществления поток исходных материалов, содержащий частицы rAAV, приводят в контакт со средой хроматографии на апатите в присутствии приблизительно 6% (масс./об.) PEG8000. В некоторых вариантах осуществления поток исходных материалов, содержащий частицы rAAV, приводят в контакт со средой хроматографии на апатите в присутствии приблизительно 7% (масс./об.) PEG8000. В некоторых вариантах осуществления поток исходных материалов, содержащий частицы rAAV, приводят в контакт со средой хроматографии на апатите в присутствии приблизительно 8% (масс./об.) PEG8000. В некоторых вариантах осуществления поток исходных материалов, содержащий частицы rAAV, приводят в контакт со средой хроматографии на апатите в присутствии приблизительно 9% (масс./об.) PEG8000. В некоторых вариантах осуществления поток исходных материалов, содержащий частицы rAAV, приводят в контакт со средой хроматографии на апатите в присутствии приблизительно 10% (масс./об.) PEG8000.
В некоторых вариантах осуществления поток исходных материалов, содержащий частицы rAAV, приводят в контакт со средой хроматографии на апатите в присутствии между приблизительно 3% (масс./об.) и приблизительно 10% (масс./об.) PEG10000. В некоторых вариантах осуществления поток исходных материалов, содержащий частицы rAAV, приводят в контакт со средой хроматографии на апатите в присутствии приблизительно 3% (масс./об.) PEG10000. В некоторых вариантах осуществления поток исходных материалов, содержащий частицы rAAV, приводят в контакт со средой хроматографии на апатите в присутствии приблизительно 4% (масс./об.) PEG 10000. В некоторых вариантах осуществления поток исходных материалов, содержащий частицы rAAV, приводят в контакт со средой хроматографии на апатите в присутствии приблизительно 5% (масс./об.) PEG 10000. В некоторых вариантах осуществления поток исходных материалов, содержащий частицы rAAV, приводят в контакт со средой хроматографии на апатите в присутствии приблизительно 6% (масс./об.) PEG 10000. В некоторых вариантах осуществления поток исходных материалов, содержащий частицы rAAV, приводят в контакт со средой хроматографии на апатите в присутствии приблизительно 7% (масс./об.) PEG 10000. В некоторых вариантах осуществления поток исходных материалов, содержащий частицы rAAV, приводят в контакт со средой хроматографии на апатите в присутствии приблизительно 8% (масс./об.) PEG 10000. В некоторых вариантах осуществления поток исходных материалов, содержащий частицы rAAV, приводят в контакт со средой хроматографии на апатите в присутствии приблизительно 9% (масс./об.) PEG 10000. В некоторых вариантах осуществления поток исходных материалов, содержащий частицы rAAV, приводят в контакт со средой хроматографии на апатите в присутствии приблизительно 10% (масс./об.) PEG 10000.
В некоторых вариантах осуществления поток исходных материалов, содержащий частицы rAAV, приводят в контакт со средой хроматографии на апатите в присутствии между приблизительно 3% (масс./об.) и приблизительно 10% (масс./об.) PEG15000. В некоторых вариантах осуществления поток исходных материалов, содержащий частицы rAAV, приводят в контакт со средой хроматографии на апатите в присутствии приблизительно 3% (масс./об.) PEG15000. В некоторых вариантах осуществления поток исходных материалов, содержащий частицы rAAV, приводят в контакт со средой хроматографии на апатите в присутствии приблизительно 4% (масс./об.) PEG 15000. В некоторых вариантах осуществления поток исходных материалов, содержащий частицы rAAV, приводят в контакт со средой хроматографии на апатите в присутствии приблизительно 5% (масс./об.) PEG 15000. В некоторых вариантах осуществления поток исходных материалов, содержащий частицы rAAV, приводят в контакт со средой хроматографии на апатите в присутствии приблизительно 6% (масс./об.) PEG 15000. В некоторых вариантах осуществления поток исходных материалов, содержащий частицы rAAV, приводят в контакт со средой хроматографии на апатите в присутствии приблизительно 7% (масс./об.) PEG 15000. В некоторых вариантах осуществления поток исходных материалов, содержащий частицы rAAV, приводят в контакт со средой хроматографии на апатите в присутствии приблизительно 8% (масс./об.) PEG 15000. В некоторых вариантах осуществления поток исходных материалов, содержащий частицы rAAV, приводят в контакт со средой хроматографии на апатите в присутствии приблизительно 9% (масс./об.) PEG 15000. В некоторых вариантах осуществления поток исходных материалов, содержащий частицы rAAV, приводят в контакт со средой хроматографии на апатите в присутствии приблизительно 10% (масс./об.) PEG15000.
В некоторых вариантах осуществления поток исходных материалов, содержащий частицы rAAV, приводят в контакт со средой хроматографии на апатите в буфере, содержащем приблизительно 20 мМ борат с pH 9,0 и приблизительно 5% PEG (такого как PEG6000). В некоторых вариантах осуществления поток исходных материалов смешивают поточным путем с равным объемом буфера, содержащего приблизительно 40 мМ бората при pH 9,0 и приблизительно 10% PEG с получением конечной концентрации приблизительно 20 мМ бората при pH 9,0 и приблизительно 5% PEG.
В некоторых вариантах осуществления среду хроматографии на апатите со связанными с этой средой частицами rAAV отмывают для удаления полученных в процессе продукции примесей перед тем, как элюировать частицы rAAV. В некоторых вариантах осуществления среду хроматографии на апатите отмывают один или более раз промывочным буфером, содержащим снижающиеся концентрации PEG, для удаления полученных в процессе продукции примесей. В некоторых вариантах осуществления среду хроматографии на апатите отмывают один или более раз промывочным буфером, содержащим между приблизительно 3% (масс./об.) и приблизительно 10% (масс./об.) PEG. В некоторых вариантах осуществления промывочный буфер содержит приблизительно любую концентрацию из 10% (масс./об.), 9,5% (масс./об.), 9% (масс./об.), 8,5% (масс./об.), 8% (масс./об.), 7,5% (масс./об.), 7% (масс./об.), 6,5% (масс./об.), 6% (масс./об.), 5,5% (масс./об.), 5% (масс./об.), 4,5% (масс./об.), 4% (масс./об.), 3,5% (масс./об.), и 3% (масс./об.) PEG. В некоторых вариантах осуществления среду хроматографии на апатите отмывают один или более раз промывочным буфером, содержащим 7,5% (масс./об.) PEG6000. В некоторых вариантах осуществления среду хроматографии на апатите отмывают один или более раз промывочным буфером, содержащим 7,5% (масс./об.) PEG8000. В некоторых вариантах осуществления среду хроматографии на апатите отмывают один или более раз промывочным буфером, содержащим 7,5% (масс./об.) PEG10000. В некоторых вариантах осуществления среду хроматографии на апатите отмывают один или более раз промывочным буфером, содержащим 7,5% (масс./об.) PEG15000. В некоторых вариантах осуществления среду хроматографии на апатите отмывают один или более раз промывочным буфером, содержащим 5% (масс./об.) PEG6000. В некоторых вариантах осуществления среду хроматографии на апатите отмывают один или более раз промывочным буфером, содержащим приблизительно 5% (масс./об.) PEG8000. В некоторых вариантах осуществления среду хроматографии на апатите отмывают один или более раз промывочным буфером, содержащим приблизительно 5% (масс./об.) PEG 10000. В некоторых вариантах осуществления среду хроматографии на апатите отмывают один или более раз промывочным буфером, содержащим приблизительно 5% (масс./об.) PEG15000. В некоторых вариантах осуществления среду хроматографии на апатите отмывают один или более раз промывочным буфером, содержащим менее чем приблизительно 3% (масс./об.) PEG6000. В некоторых вариантах осуществления среду хроматографии на апатите отмывают один или более раз промывочным буфером, содержащим менее чем приблизительно 3% (масс./об.) PEG8000. В некоторых вариантах осуществления среду хроматографии на апатите отмывают один или более раз промывочным буфером, содержащим менее чем приблизительно 3% (масс./об.) PEG 10000. В некоторых вариантах осуществления среду хроматографии на апатите отмывают один или более раз промывочным буфером, содержащим менее чем приблизительно 3% (масс./об.) PEG15000. В некоторых вариантах осуществления среду хроматографии на апатите отмывают один или более раз промывочным буфером, не содержащим PEG.
В некоторых вариантах осуществления промывочный буфер содержит буферы, известные в данной области. В некоторых вариантах осуществления промывочный буфер содержит буфер, выбранный из группы, состоящей из бората, N-2-гидроксиэтилпиперазин-N'-2-этансульфоновой кислоты (HEPES) и Tris-HCl. В некоторых вариантах осуществления промывочный буфер содержит борат или является им. В некоторых вариантах осуществления промывочный буфер содержит HEPES или является ей. В некоторых вариантах осуществления промывочный буфер содержит Tris-HCl или является им. В некоторых вариантах осуществления промывочный буфер существует при основном pH. В некоторых вариантах осуществления промывочный буфер имеет pH между pH 7,0 и pH 10,0, между pH 7,2 и pH 10,0, между pH 7,4 и pH 10,0, между pH 7,6 и pH 10,0, между pH 7,8 и pH 10,0, между pH 8,0 и pH 10,0, между pH 8,2 и pH 10,0, между pH 8,4 и pH 10,0, между pH 8,6 и pH 10,0, между pH 8,8 и pH 10,0, между pH 9,0 и pH 10,0, между pH 9,2 и pH 10,0, между pH 9,4 и pH 10,0, между pH 9,6 и pH 10,0, или между pH 9,8 и pH 10,0. В некоторых вариантах осуществления промывочный буфер имеет pH, равный 7,0, 7,2, 7,4, 7,6, 7,8, 8,0, 8,2, 8,4, 8,6, 8,8, 9,0, 9,2, 9,4, 9,6, 9,8 или 10,0. В некоторых вариантах осуществления промывочный буфер содержит борат или является им при pH между 8,0 и 10,0. В некоторых вариантах осуществления промывочный буфер содержит борат или является им при pH 8,0. В некоторых вариантах осуществления промывочный буфер содержит борат или является им при pH 9,0. В некоторых вариантах осуществления промывочный буфер содержит борат или является им при pH 10,0. В некоторых вариантах осуществления промывочный буфер содержит HEPES или является ей при pH между 7,0 и 10,0. В некоторых вариантах осуществления промывочный буфер содержит HEPES или является ей при pH 7,0. В некоторых вариантах осуществления промывочный буфер содержит HEPES или является ей при pH 8,0. В некоторых вариантах осуществления промывочный буфер содержит HEPES или является ей при pH 9,0. В некоторых вариантах осуществления промывочный буфер содержит HEPES или является ей при pH 10,0. В некоторых вариантах осуществления промывочный буфер содержит Tris-HCl или является им при pH между 7,0 и 10,0. В некоторых вариантах осуществления промывочный буфер содержит Tris-HCl или является им при pH 7,0. В некоторых вариантах осуществления промывочный буфер содержит Tris-HCl или является им при pH 8,0. В некоторых вариантах осуществления промывочный буфер содержит Tris-HCl или является им при pH 9,0. В некоторых вариантах осуществления промывочный буфер содержит Tris-HCl или является им при pH 10,0. В некоторых вариантах осуществления промывочный буфер дополнительно содержит между 100 и 500 мМ фосфата. В некоторых вариантах осуществления промывочный буфер дополнительно содержит между 50 и 250 мМ NaCl.
В некоторых вариантах осуществления стадия промывки включает первую промывку промывочным буфером, содержащим приблизительно 30 мМ бората при pH приблизительно 9,0 и приблизительно 7,5% PEG; вторую промывку промывочным буфером, содержащим приблизительно 150 фосфата калия, приблизительно 20 мМ бората при pH приблизительно 9,0, и приблизительно 5% PEG; третью промывку промывочным буфером, содержащим приблизительно 20 мМ бората при pH приблизительно 9,0 и приблизительно 5% PEG; и четвертую промывку промывочным буфером, содержащим приблизительно 20 мМ HEPES при pH приблизительно 7,0 и 150 мМ NaCl.
В некоторых вариантах осуществления частицы rAAV, связанные со средой хроматографии на апатите, элюируют буфером для элюции, содержащим низкие концентрации PEG или не содержащим PEG. В некоторых вариантах осуществления буфер для элюции содержит менее чем приблизительно 3% (масс./об.) PEG, менее чем приблизительно 2% (масс./об.) PEG, или менее чем приблизительно 1% (масс./об.) PEG. В некоторых вариантах осуществления буфер для элюции содержит приблизительно 2,5% (масс./об.), приблизительно 2% (масс./об.), приблизительно 1,5% (масс./об.), приблизительно 1% (масс./об.) или приблизительно 0,5% (масс./об.) PEG, или не содержит PEG. В некоторых вариантах осуществления буфер для элюции содержит менее чем приблизительно 3% (масс./об.) PEG6000. В некоторых вариантах осуществления буфер для элюции содержит менее чем приблизительно 3% (масс./об.) PEG8000. В некоторых вариантах осуществления буфер для элюции менее чем приблизительно 3% (масс./об.) PEG10000. В некоторых вариантах осуществления буфер для элюции содержит менее чем приблизительно 3% (масс./об.) PEG15000. В некоторых вариантах осуществления частицы rAAV, связанные со средой хроматографии на апатите элюируют буфером для элюции в отсутствие PEG. В некоторых вариантах осуществления буфер для элюции содержит буфер, выбранный из группы, состоящей из бората, N-2-гидроксиэтилпиперазин-N'-2-этансульфоновой кислоты (HEPES) и Tris-HCl. В некоторых вариантах осуществления буфер для элюции содержит борат или является им. В некоторых вариантах осуществления буфер для элюции содержит HEPES или является ей. В некоторых вариантах осуществления буфер для элюции содержит Tris-HCl или является им. В некоторых вариантах осуществления буфер для элюции существует при нейтральном pH. В некоторых вариантах осуществления буфер для элюции содержит HEPES или является ей при нейтральном pH. В некоторых вариантах осуществления буфер для элюции содержит Tris-HCl или является им при нейтральном pH. В некоторых вариантах осуществления буфер для элюции дополнительно содержит менее чем 100 мМ фосфата. В некоторых вариантах осуществления буфер для элюции дополнительно содержит менее чем 50 мМ фосфата. В некоторых вариантах осуществления буфер для элюции дополнительно содержит между 50 и 250 мМ NaCl. В некоторых вариантах осуществления частицы rAAV, связанные со средой для хроматографии на апатите, элюируют буфером для элюции, содержащим приблизительно 50 мМ фосфата калия, приблизительно 20 мМ HEPES при pH, равном приблизительно 7,0, и приблизительно 150 мМ NaCl.
В некоторых вариантах осуществления способ отделения частиц rAAV от полученных в процессе продукции примесей в потоке исходных материалов включает стадии: (a) приведения потока исходных материалов, содержащего частицы rAAV, в контакт со средой хроматографии на апатите в присутствии приблизительно 5% (масс./об.) PEG в основном буфере при pH, приблизительно равном 9,0, где частицы rAAV связываются со средой хроматографии на апатите; (b) промывки среды хроматографии на апатите первым промывочным буфером, содержащим приблизительно 30 мМ бората при pH, приблизительно равном 9,0, и приблизительно 7,5% PEG; (c) промывки среды хроматографии на апатите вторым промывочным буфером, содержащим приблизительно 150 фосфата калия, приблизительно 20 мМ бората при pH, приблизительно равном 9,0, и приблизительно 5% PEG; (d) промывки среды хроматографии на апатите третьим промывочным буфером, содержащим приблизительно 20 мМ бората при pH, приблизительно равном 9,0, и приблизительно 5% PEG; (e) промывки среды хроматографии на апатите четвертым промывочным буфером, содержащим приблизительно 20 мМ HEPES при pH, приблизительно равном 7,0, и 150 мМ NaCl; и (f) элюирования частиц rAAV, связанных со средой хроматографии на апатите, буфером для элюции, содержащим приблизительно 50 мМ фосфата калия, приблизительно 20 мМ HEPES при pH, приблизительно равном 7,0, и приблизительно 150 мМ NaCl.
Также в настоящем документе предоставлены способы отделения популяции частиц рекомбинантного аденоассоциированного вируса (rAAV) от полученных в процессе продукции примесей в потоке исходных материалов, включающие стадии: (a) приведения потока исходных материалов, содержащих частицы rAAV, в контакт со средой хроматографии на основе гидрофобных взаимодействий (HIC) в буфере с высокой концентрацией солей, где частицы rAAV и примеси, полученные в процессе продукции, связываются со средой HIC; и (b) элюирования частиц rAAV, связанных со средой HIC, с помощью буфера со средней концентрацией солей. В некоторых вариантах осуществления среда HIC выбрана из группы, состоящей из смолы Tosoh Butyl 650M, Tosoh SuperButyl 650C, Tosoh Phenyl 650C, EMD Fractogel Phenyl и Tosoh Has(butyl). В некоторых вариантах осуществления буфер с высокой концентрацией солей содержит или представляет собой 0,5 M и 2,0 M цитрат (например, цитрат натрия). В некоторых вариантах осуществления буфер с высокой концентрацией солей содержит приблизительно любую концентрацию цитрата из 0,5 M, 0,75 M, 1,0 M, 1,25 M, 1,5 M, 1,75 M и 2,0 M. В некоторых вариантах осуществления буфер со средней концентрацией солей содержит менее чем 0,5 M цитрата (например, цитрата натрия) или представляет собой буфер с такой концентрацией. В некоторых вариантах осуществления буфер со средней концентрацией солей содержит от 0,5 M до приблизительно 0,3 M цитрата. В некоторых вариантах осуществления буфер со средней концентрацией солей содержит приблизительно любую концентрацию цитрата из 0,45 M, 0,4 M, 0,35 M, 0,3 M и 0,25 M. В некоторых вариантах осуществления буфер с высокой концентрацией солей дополнительно содержит от 1 до 100 мМ фосфата. В некоторых вариантах осуществления буфер со средней концентрацией солей дополнительно содержит между 1 и 100 мМ фосфата. В некоторых вариантах осуществления буфер со средней концентрацией солей элюирует частицы rAAV без элюции частиц rAAV с пустыми капсидами, частично денатурированными капсидами, менее инфекционными капсидами и/или частично пустыми капсидами.
В любом из вариантов осуществления, описываемых в настоящем документе, частицы rAAV имеют серотип капсида AAV, выбранный из группы, состоящей из AAV-1, AAV-2, AAV-3, AAV-4, AAV-5, AAV-6, AAV-7, AAV-8, AAV-9, AAV-10, AAV-11, AAV-12, AAV-13, AAV-14, AAV-15 и AAV-16. В некоторых вариантах осуществления частицы rAAV имеют серотип капсида AAV, выбранный из группы, состоящей из AAV-1, AAV-4, AAV-5 и AAV-8. В некоторых вариантах осуществления частицы rAAV имеют серотип капсида AAV-1. В некоторых вариантах осуществления частицы rAAV имеют серотип капсида AAV-4. В некоторых вариантах осуществления частицы rAAV имеют серотип капсида AAV-5. В некоторых вариантах осуществления частицы rAAV имеют серотип капсида AAV-8. В некоторых вариантах осуществления частицы rAAV содержат белок капсида AAV из серотипа AAV, выбранного из группы, состоящей из AAV-1, AAV-2, AAV-3, AAV-4, AAV-5, AAV-6, AAV-7, AAV-8, AAV-9, AAV-10, AAV-11, AAV-12, AAV-13, AAV-14, AAV-15 и AAV-16. В некоторых вариантах осуществления частицы rAAV имеют серотип капсида AAV, который представляет собой слабо связывающее анионное вещество. В некоторых вариантах осуществления серотип капсида AAV, который представляет собой слабо связывающее анионное вещество, выбран из группы, состоящей из AAV-1, AAV-4, AAV-5 и AAV-8. В некоторых вариантах осуществления композиция, включающая частицы rAAV, дополнительно содержит примеси, полученные при продукции в культуре. В некоторых вариантах осуществления примеси, полученные при продукции в культуре, включают поврежденные частицы rAAV, примеси из клетки-хозяина, примеси из хелперного вируса и/или примеси из клеточной культуры. В некоторых вариантах осуществления примеси из клетки-хозяина включают ДНК клетки-хозяина, плазмиды или белок клетки-хозяина. В некоторых вариантах осуществления примеси из хелперного вируса включают аденовирусные частицы, аденовирусную ДНК или аденовирусные белки. В некоторых вариантах осуществления примеси из клеточной культуры включают компоненты среды, сывороточный альбумин или другие сывороточные белки. В некоторых вариантах осуществления примеси из клеточной культуры включают компоненты среды. В некоторых вариантах осуществления примеси из клеточной культуры не включают сывороточный альбумин или другие сывороточные белки.
Следует понимать, что одно, некоторые или все свойства различных вариантов осуществления, описываемых в настоящем документе, можно комбинировать с образованием других вариантов осуществления настоящего изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фигуре 1 представлены результаты расщепления Benzonase® осветленного супернатанта сбора культуры продукции rAAV. Результаты демонстрируют, что после расщепления Benzonase® не присутствует высокомолекулярная ДНК.
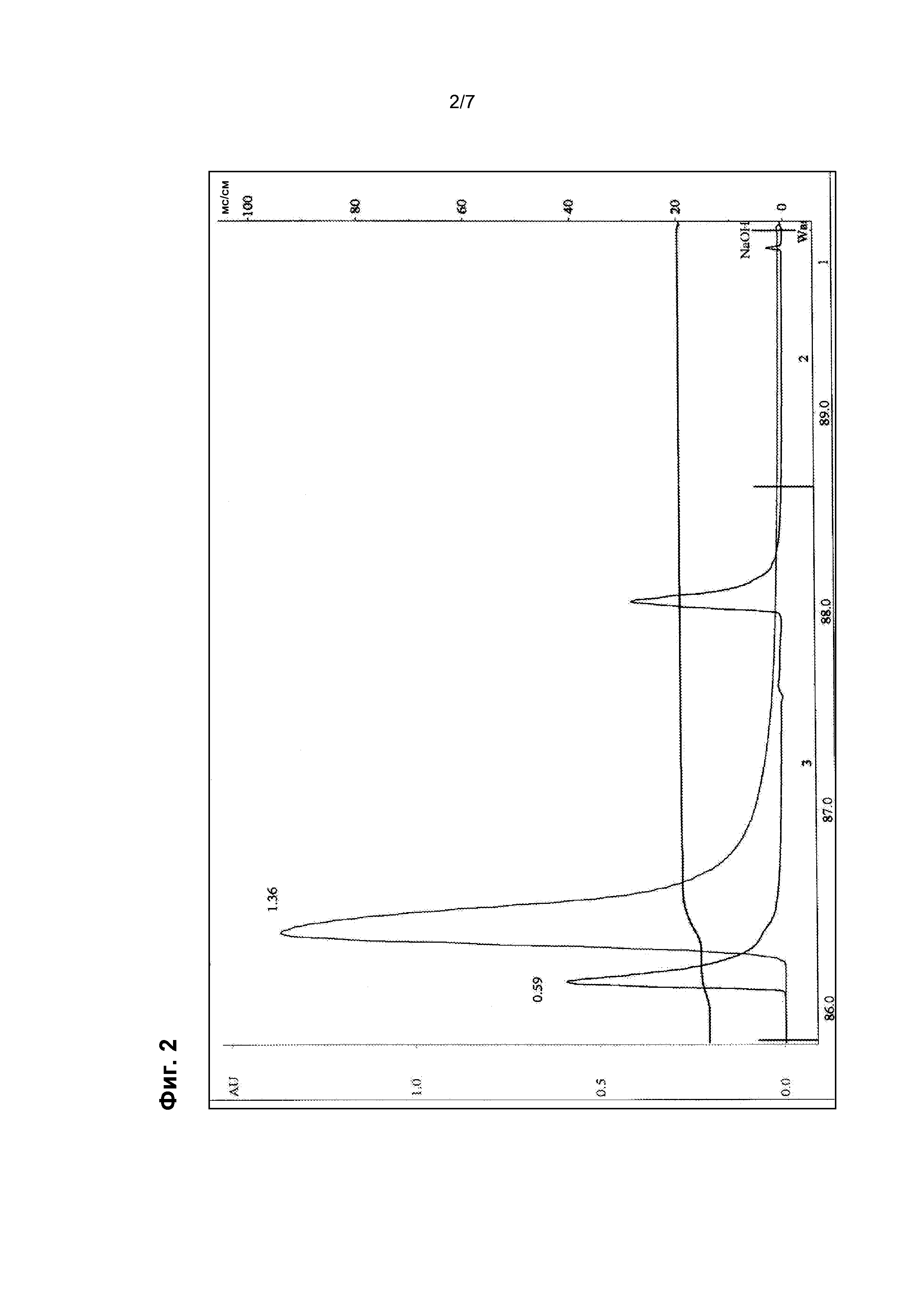
На фигуре 2 представлено типичное спектрофотометрическое прослеживание типичной смолы, подвергнутой скринингу на предмет аффинности связывания с rAAV, как описано в примере 4. Указаны оптическая плотность (AU) и проводимость (мСм/см).
На фигуре 3 представлен анализ прорыва в присутствии и в отсутствие PEG. Две модельных культуры продукции rAAV применяли для оценки емкости апатитной смолы (CFT типа I). Верхняя панель: прорыв во время загрузки содержащих сыворотку или бессывороточных потоков исходных материалов в присутствии или в отсутствие приблизительно 5% (масс./об.) PEG6000 в загружаемом материале. Объемы загрузки относятся к начальному потоку исходных материалов перед разбавлением 1:1 в процессе, и они нормализованы на мл объема смолы. Нижняя панель: объемы загрузки (мл), при которых наблюдали прорыв 1%, и восстановление в элюируемой фракции. Сборы TFF, использованные в эксперименте, были в концентрации приблизительно 1016 DRP/мл для rAAV векторов. В присутствии приблизительно 5% (масс./об.) PEG6000 150 мл сбора TFF загружали на 1,2 мл смолы CFT без прорыва, который определяли как присутствие >1% rAAV в смыве с колонки, что соответствовало загрузке 1,8·1014 общего DRP rAAV.
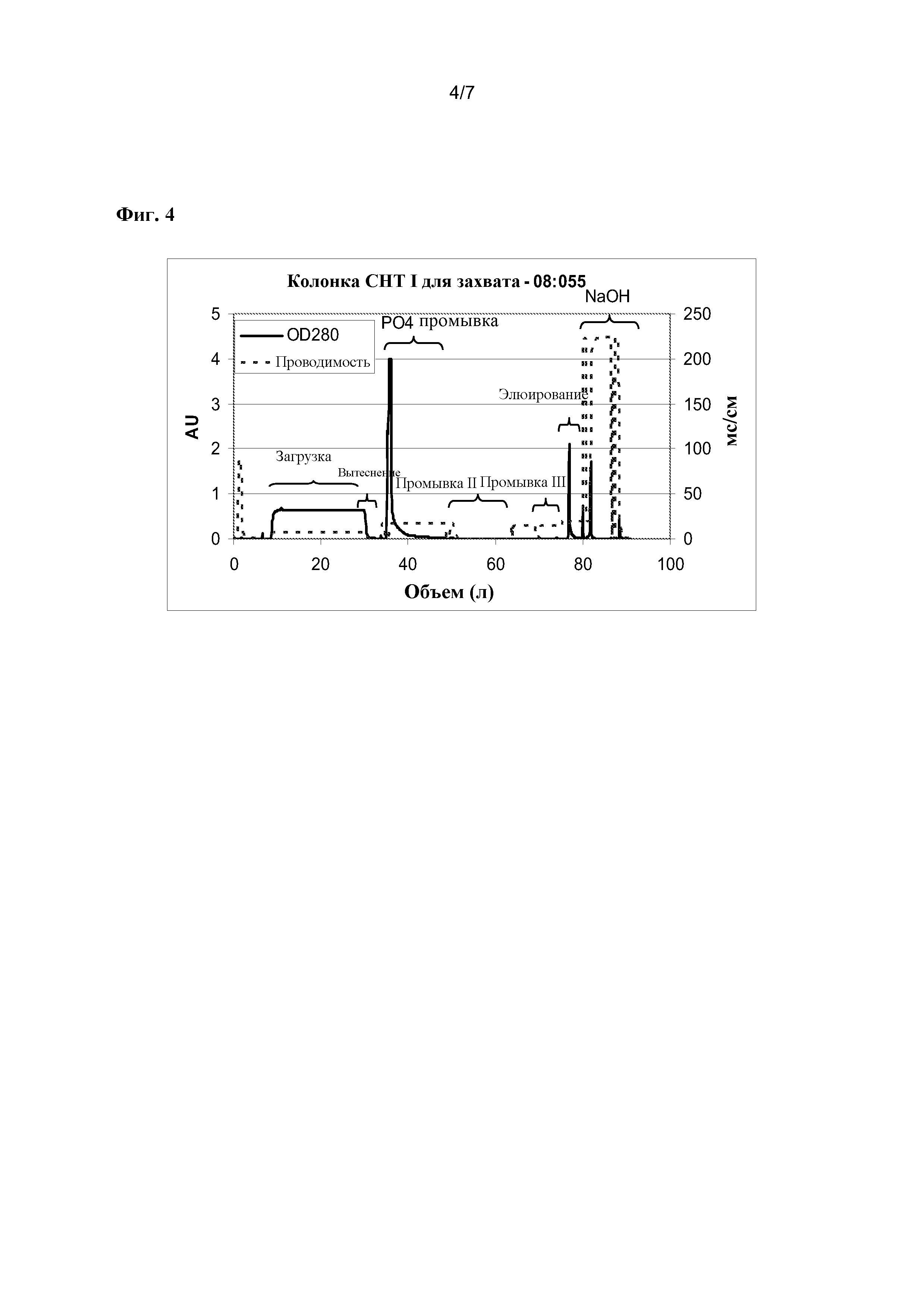
На фигуре 4 представлена типичная хроматограмма CHT I. Совместно показаны измерения оптической плотности УФ A280 (AU, единица оптической плотности) и проводимость (мСм/см) на 3 мм Amersham Skid. Скобки маркируют главные сегменты программы, описанной в примере 7. «NaOH» маркирует стадию деконтаминации колонки.
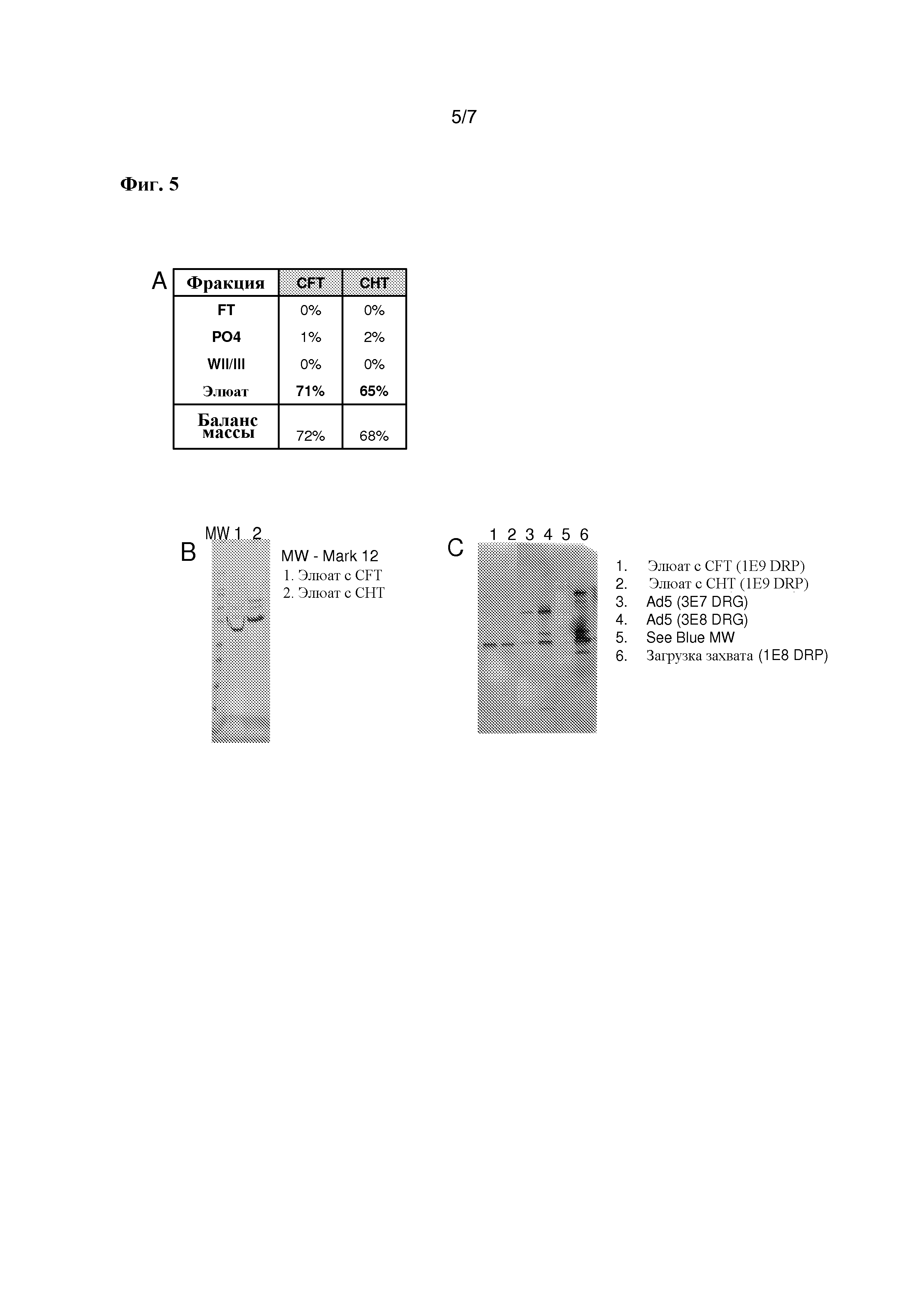
На фигуре 5 представлена относительная чистота векторов на основе rAAV, элюированные с апатитных смол. На панели A показано распределение вектора между потоком/проскоком (FT), промывкой с высокой концентрацией фосфата/5% (масс./об.) PEG6000 (PO4), промывками для удаления фосфата и PEG6000 (WII/WIII) и элюатом. Ни одно из отличий между прогонами не является значимым в пределах точности аналитической техники, и отсутствие материального баланса является типичным. На панели B показаны соответствующие дорожки с окрашенного Sypro оранжевым SDS-PAGE, на котором находились фракции, элюированные с апатитной колонки. Каждый образец загружали по 2·1011 DRP/дорожку; видимое различие по миграции между дорожками является связанным с солями артефактом вследствие необходимости концентрировать элюат с CFT путем упаривания до объема, который соответствует нанесению на гель. Единственные преобладающие полосы, как оказалось, соответствуют белкам капсида AAV. На панели C показаны релевантные дорожки вестерн-блоттинга Ad5, причем порядок дорожек изменен для ясности, что демонстрирует сравнимую чистоту белков Ad5.
На фигре 6 представлена оценка очистки в течение процесса посредством SDS-PAGE. Полученные в процессе образцы из репрезентативного сбора культуры продукции разделяли в денатурирующем/восстанавливающем 10%-ном полиакриламидном геле и окрашивали Sypro оранжевым. Все образцы после сбора загружали в количестве 1·1010 DRP/дорожку. Два полученных ранее образца до стадии концентрации TFF (исходная стадия осветления и проскок AEX) могут быть загружены только в количестве 1·109 DRP/дорожку вследствие объемных ограничений геля. Бета-галактозидазу (B-Gal) загружали в количестве 50 нг/дорожку для оценки чувствительности и однородности окраски по гелю. Указаны три капсидных белка AAV1 (VP1, 2 и 3).
На фигуре 7 представлен постадийный выход очистки rAAV, как описано в примерах 1-12. Общее число DRP, присутствующее в супернатанте перед сбором, определяли как 100%. Выход на каждой стадии представляет собой общее число DRP, полученное относительно общего числа DRP, обработанного на каждой стадии. Общий выход всего процесса составлял приблизительно 28%. D4 sup: культура продукции; AEX FT: проскок анионообменной колонки (Mustang® Q); захваченное: при хроматографии на апатите; нагревание: инактивация нагреванием или уничтожение нагреванием; HIC: хроматография на основе гидрофобных взаимодействий; SEC: гель-фильтрация; AEX: анионообменная.
ПОДРОБНОЕ ОПИСАНИЕ
Целью настоящего изобретения является предоставление способов отделения популяции частиц рекомбинантного аденоассоциированного вируса (rAAV) любого серотипа капсида AAV от примесей, связанных с культурой продукции, таких как поврежденные частицы rAAV, хелперный вирус, белки хелперного вируса, плазмиды, клеточные белки и ДНК, компоненты среды, сывороточные белки, и т.п. Кроме того, способы по настоящему изобретению предоставляют коммерчески масштабируемые, ортогональные процессы, согласующиеся с регуляторными требованиями к выделению популяции частиц rAAV со сборами или потоками культур продукции с высоким титром rAAV. Популяции частиц rAAV, выделенные способами по настоящему изобретению, по существу, лишены примесей, включая примеси, связанные с культурой продукции, и/или технологические примеси, такие как поврежденные частицы rAAV, хелперный вирус, белки хелперного вируса, плазмиды, клеточные белки и ДНК, компоненты среды, сывороточные белки и глюканы. Способы по настоящему изобретению особенно подходят для серотипов вектора на основе rAAV, которые слабо связываются с анионами, таких как, например, rAAV-1, rAAV-4, rAAV-5 и rAAV-8. Изобретение дополнительно относится к способу выделения популяции частиц rAAV с высоким титром, по существу, лишенной примесей, включающих примеси, связанные с культурой продукции, и/или технологические примеси, пригодной для использования в применениях генотерапии, без необходимости проведения центрифугирования в градиенте плотности.
Определения
Применяемый в настоящем документе термин «выделенный» или «очищенный» относится к получению частиц rAAV, свободных, по меньшей мере, от некоторых других компонентов, которые также могут присутствовать там, где частицы rAAV находятся в природе, или там, откуда частицы получены. Таким образом, например, выделенные частицы rAAV можно получать с использованием способа очистки для обогащения их из исходной смеси, такой как лизат культуры или супернатант культуры продукции. Обогащение можно измерять различными способами, например, путем оценки доли устойчивых к ДНКазе частиц (DRP), присутствующих в растворе, или путем оценки инфекционности, или его можно измерять по отношению ко второму, потенциально препятствующему веществу, присутствующему в исходной смеси, такому как примеси, включающие примеси, связанные с культурой продукции, и/или технологические примеси, такие как хелперный вирус, компоненты среды, и т.п., как определено ниже.
Препарат rAAV отмечается, как «по существу, лишенный» хелперного вируса, если отношение инфекционных частиц AAV к инфекционным частицам хелперного вируса составляет, по меньшей мере, приблизительно 102:1; предпочтительно, по меньшей мере, приблизительно 104:1, более предпочтительно, по меньшей мере, приблизительно 106:1; еще более предпочтительно, по меньшей мере, приблизительно 108:1. Препараты также являются, предпочтительно, лишенными эквивалентных количеств белков хелперного вируса (т.е., белков, которые могут иметь место в результате наличия такой же концентрации хелперного вируса, если примеси частиц хелперного вируса, указанные выше, присутствуют в разрушенном виде). Примесь вирусного и/или клеточного белка может, в основном, наблюдаться в виде наличия окрашенных Кумасси полос на SDS-гелях (например, в виде появления полос, отличных от соответствующих белкам капсида AAV VP1, VP2 и VP3).
Применяемый в настоящем документе термин «слабо связывающее анионное вещество» или «анионное вещество, связывающее с низкой аффинностью» взаимозаменяемо относится к частице rAAV, имеющей серотип капсида, который в присутствии примесей (включающих примеси, связанные с культурой продукции, и/или технологические примеси), не связывается с аффинностью, достаточной для того, чтобы обеспечить отделение частиц rAAV от других примесей, связанных с культурой продукции rAAV. Такие серотипы капсида известны в данной области и в качестве неограничивающих примеров включают AAV-1, AAV-5, AAV-8 и AAV-4. Как описано в данной области, такие слабо связывающие анионные вещества, в основном, очищают способами, которые включают, по меньшей мере, одну стадию центрифугирования в градиенте плотности, включающую центрифугирование в градиенте йодиксинола (в продаже под торговым наименованием Optiprep®) или хлорида цезия.
Применяемый в настоящем документе термин «хелперный вирус» или «контаминирующий хелперный вирус» относится к вирусу, используемому при продукции копий зависимого от хелперного вируса вирусного вектора, такого как аденоассоциированный вирус, который не способен реплицироваться сам по себе. Хелперный вирус применяется для совместной инфекции клеток вместе с вирусным вектором и предоставляет белки, необходимые для репликации генома вирусного вектора. Термин охватывает интактные вирусные частицы, пустые капсиды, вирусную ДНК и т.п. Хелперные вирусы, широко используемые для продукции частиц rAAV, включают аденовирус, вирус простого герпеса, цитомегаловирус, вирус Эпштейна-Барр и вирус коровьей оспы.
Применяемый в настоящем документе термин «культура продукции» относится к сосуду, содержащему компоненты, необходимые для продукции частиц вектора на основе rAAV. Культуры продукции в качестве неограничивающих примеров включают следующие компоненты: 1) подходящую клетку-хозяина; 2) функцию хелперного вируса; 3) гены AAV rep и cap и продукты данных генов; 4) терапевтический трансген, фланкированный последовательностями ITR AAV; и 5) подходящую среду, компоненты среды и добавки к среде, включая в качестве неограничивающих примеров сыворотку, белки сывороточного происхождения, витамины, незаменимые и неосновные аминокислоты и глюкозу, о которой известно, что она поддерживает продукцию rAAV.
Применяемые в настоящем документе термины «примеси», «примеси, связанные с культурой продукции», «технологические примеси», «примеси, полученные в процессе продукции», «примеси» или «контаминанты», которые взаимозаменяемо используют в настоящем документе, без ограничений относятся к известным в данной области составам сред, которые обеспечивают продукцию векторов rAAV; к добавкам к средам, таким как соли, сыворотка теленка, аминокислотные добавки, витаминные добавки, факторы роста, сывороточный альбумин и другие низкомолекулярные белки, присутствующие в составах сред, известных в данной области; к пермиссивным клеткам-хозяева, к белкам клетки-хозяина или ДНК клетки-хозяина; к хелперным вирусам, к белкам хелперных вирусов или ДНК хелперных вирусов, таким как белки аденовируса дикого типа или вируса герпеса; и к другим, не относящимся к rAAV, векторам или к материалам культуры продукции вектора на основе rAAV, вводимым в процессе очистки, например, к глюканам или хроматографическим буферам, используемым при очистке векторов на основе rAAV от потоков исходных материалов.
Применяемый в настоящем документе термин «сбор культуры продукции» определяется как раствор, содержащий частицы вектора на основе rAAV, продуцированные культурами продукции вектора на основе rAAV средствами, известными в данной области, включая в качестве неограничивающих примеров процессы трансфекции, продукцию стабильной клеточной линии, Ad-гибридные системы продукции или бакуловирусные системы продукции. Кроме того, применяемый в настоящем документе термин «сбор культуры продукции» относится к материалу, выделенному из сосуда для культуры продукции, и включает в себя материалы, выделенные путем лизиса клеток-продуцентов rAAV, средствами, известными в данной области, и материалы, выделенные из культур продукции rAAV, поддерживаемых в условиях культивирования, известных в данной области, с выходом частиц rAAV, высвобожденных в среду из интактных клеток. Сбор культуры продукции может содержать некоторые или все из следующих компонентов без ограничения: частицы вектора на основе rAAV, компоненты культуры продукции, такие как компоненты среды, белки клетки-хозяина, ДНК клетки-хозяина ДНК, клетки-хозяева, хелперный вирус, белки хелперного вируса, ДНК хелперного вируса, плазмидная ДНК, ДНК вируса-носителя, сыворотка, белки сывороточного происхождения и добавки из среды.
Применяемый в настоящем документе термин «поток исходных материалов» относится к источнику частиц вектора на основе rAAV, который загружается на хроматографическую фазу, пропускается через нее или наносится на нее. Потоки исходных материалов по настоящему изобретению включают в себя сборы культуры продукции и материалы, выделенные на предыдущих хроматографических стадиях изобретения, независимо от того, присутствует ли материал в проскоке от предыдущей стадии, был ли он связан или элюирован на предыдущей стадии, присутствовал ли он в мертвом объеме на предыдущей стадии, или присутствовал ли он в любой фракции, полученной во время очистки частиц rAAV. Такие потоки исходных материалов могут включать одну или более «примесей», «примесей, связанных с культурой продукции», «технологических примесей», «примесей, полученных в процессе продукции», или «примесей» или «контаминантов», как определено в настоящем документе.
Термины «захват», «связанный», «связывается» или «связывание», как их применяют в настоящем документе, взаимозаменяемо относятся к связыванию, адгезии или прилипанию компонента потока исходных материалов к хроматографической среде. Компоненты могут связываться с хроматографической средой посредством любых сил или химии, известных в данной области, включая в качестве неограничивающих примеров гидрофобные взаимодействия, ионные взаимодействия (включая анионные и катионные), аффинность, металлохелатные взаимодействия и хелатообразование. Компоненты могут связываться с хроматографической средой более чем по одному типу химии, например, с апатитной хроматографической средой.
Термины «апатитная смола», «апатитная хроматографическая среда», «апатитный матрикс» или «апатитная среда», как их взаимозаменяемо применяют в настоящем документе, относятся к хроматографической среде, состоящей из минерального фосфата кальция, и в качестве неограничивающих примеров включают хроматографические среды керамический гидроксиапатит (CHT) и керамический фторапатит (CFT).
Термины «смешанный режим» или «мультимодальный» относятся к хроматографическим средам, которые способны к связыванию более чем по одному виду химии. Хроматографические среды со смешанным режимом в качестве неограничивающих примеров включают апатитные хроматографические среды, которые способны осуществлять металлоаффинное связывание посредством атомов кальция, образование водородных связей посредством гидроксильных групп, присутствующих на остове, отталкивание положительного заряда и привлечение отрицательного заряда посредством атомов кальция и отталкивание отрицательного заряда и привлечение положительного заряда посредством фосфатных групп, присутствующих на среде.
Общая ссылка на «композицию» или «композиции» включает композиции по изобретению и применима к ним.
Применяемое в настоящем документе единственное число существительных включает в себя ссылки на множественное число, если не указано иначе. Например, выражение «вирусная частица» включает одну или более вирусных частиц.
Ссылка на «приблизительно» установленное число или параметр в настоящем документе включает в себя (и описывает) варианты осуществления, которые направлены на данное число или параметр, как таковые. Например, описание со ссылкой на «приблизительно X» включает описание «X».
Следует понимать, что аспекты и варианты осуществления изобретения, описываемые в настоящем документе, включают в себя аспекты и варианты, состоящие из аспектов и вариантов осуществления или, по существу, состоящие из них.
Продукция векторов rAAV
В данной области известны многочисленные способы продукции векторов на основе rAAV, включающие трансфекцию, продукцию стабильной клеточной линии и системы продукции инфекционного гибридного вируса, которые включают гибриды аденовирус-AAV, гибриды вирус герпеса-AAV и гибриды бакуловирус-AAV. Все культуры продукции rAAV для продукции вирусных частиц rAAV вирусные частицы требуют наличия: 1) подходящих клеток-хозяев, включая, например, клеточные линии человеческого происхождения, такие как клетки HeLa, A549 или 293, или клеточные линии, происходящие из насекомых, такие как SF-9, в случае бакуловирусных систем продукции; 2) подходящей функции хелперного вируса, предоставленной аденовирусом дикого типа или мутантным аденовирусом (таким как чувствительный к температуре аденовирус), вирусом герпеса, бакуловирусом или плазмидной конструкцией, предоставляющий хелперные функции; 3) генов AAV rep и cap и продуктов этих генов; 4) трансгена (такого как терапевтический трансген), фланкированного последовательностями ITR AAV; и 5) подходящей среды и компонентов среды для поддержания продукции rAAV. Подходящие среды, известные в данной области, можно использовать для продукции векторов на основе rAAV. Эти среды в качестве неограничивающих примеров включают среды, произведенные Hyclone Laboratories и JRH, включая модифицированную среду Игла (MEM), модифицированную по Дульбекко среду Игла (DMEM), изготовленные специально составы, такие как те, что описаны в патенте США № 6566118, и среду Sf-900 II SFM, описанную в патенте США № 6723551, причем каждый из патентов включен в настоящий документ в качестве ссылки в полном объеме, в частности, в отношении специально изготовленных составов среды для применения в продукции векторов на основе рекомбинантного AAV.
Подходящие культуральные среды для продукции rAAV по настоящему изобретению могут дополняться сывороткой или рекомбинантными белками сывороточного происхождения до концентрации 0,5-20% (об./об. или масс./об.). Альтернативно, как известно в данной области, векторы на основе rAAV можно получать в бессывороточных условиях, которые также могут обозначаться как среды без продуктов животного происхождения. Специалист в данной области может понять, что коммерческие или специально полученные среды, составленные для поддержки продукции векторов на основе rAAV, могут также дополняться одним или несколькими компонентами клеточных культур, известными в данной области, включая в качестве неограничивающих примеров глюкозу, витамины, аминокислоты и/или факторы роста, для увеличения титра rAAV в культурах продукции.
Культуры продукции rAAV можно выращивать в некоторых условиях (в широком интервале температур, в течение различных периодов времени, и т.п.), подходящих для конкретной используемой клетки-хозяина. Как известно в данной области, культуры продукции rAAV включают зависимые от прикрепления культуры, которые можно культивировать в подходящих сосудах для зависимых от прикрепления клеток, таких как, например, вращающиеся флаконы, фильтры из полых волокон, микроносители и в ферментерах со слоем носителя или с псевдоожиженным слоем. Культуры продукции вектора на основе rAAV также могут включать адаптированные к суспензии клетки-хозяева, такие как клетки HeLa, 293 и SF-9, которые можно культивировать различными способами, например, в роллерных колбах, в биореакторах с механическим перемешиванием и в одноразовых системах, таких как система Wave bag.
Частицы вектора на основе rAAV по изобретению могут собираться из культур продукции rAAV путем лизиса клеток-хозяев в культуре продукции или путем сбора от культуры продукции израсходованной среды, при обеспечении того, что клетки культивируют в условиях, известных в данной области, чтобы вызвать высвобождение частиц rAAV в среду из интактных клеток, как более полно описано в патенте США № 6566118. Подходящие способы лизиса клеток также известны в данной области и включают, например, множественные циклы замораживания/оттаивания, обработку ультразвуком, микрофлюидизацию и обработку химическими соединениями, такими как детергенты и/или протеазы.
Очистка векторов на основе rAAV
При сборе культуры продукции rAAV по настоящему изобретению могут содержать один или более следующих компонентов: (1) белки клетки-хозяина; (2) ДНК клетки-хозяина; (3) плазмидная ДНК; (4) хелперный вирус; (5) белки хелперного вируса; (6) ДНК хелперного вируса ДНК; и (7) компоненты среды, включая, например, белки сыворотки, аминокислоты, трансферрины и другие низкомолекулярные белки. Кроме того, культуры продукции rAAV дополнительно включают в себя частицы rAAV, содержащие серотип капсида AAV, выбранный из группы, состоящей из AAV-1, AAV-2, AAV-3, AAV-4, AAV-5, AAV-6, AAV-7, AAV-8, AAV-9, AAV-10, AAV-11, AAV-12, AAV-13, AAV-14, AAV-15 и AAV-16. В некоторых вариантах осуществления частицы rAAV имеют серотип капсида AAV, выбранный из группы, состоящей из AAV-1, AAV-4, AAV-5 и AAV-8.
В некоторых вариантах осуществления сбор культуры продукции rAAV осветляют для удаления дебриса клеток-хозяев. В некоторых вариантах осуществления сбор культуры продукции осветляют путем фильтрации через серию пористых фильтров, включающих, например, фильтр типа D0HC Millipore Millistak+ HC Pod, фильтр типа A1HC Millipore Millistak+ HC Pod и фильтр с гидрофильной мембраной и порами 0,2 мкм Opticap XL 10 Millipore Express SHC Hydrophilic Membrane. Осветление также может достигаться несколькими другими стандартными способами известными в данной области, такими как центрифугирование или фильтрация через фильтр из ацетата целлюлозы с порами 0,2 мкм или большего размера, известный в данной области.
В некоторых вариантах осуществления сбор культуры продукции rAAV дополнительно обрабатывают Benzonase® для расщепления любой ДНК с высокой молекулярной массой, присутствующей в культуре продукции. В некоторых вариантах осуществления расщепление Benzonase® проводят в стандартных условиях, известных в данной области, включающих, например, конечную концентрацию Benzonase® 1-2,5 единиц/мл при температуре в диапазоне от комнатной до 37°C в течение периода от 30 минут до нескольких часов.
Частицы rAAV могут выделяться или очищаться с использованием одной или нескольких из следующих стадий очистки: пропускная анионообменная фильтрация, фильтрация тангенциальным потоком (TFF) для концентрирования частиц rAAV, захват частиц rAAV путем хроматографии на апатите, инактивация нагреванием хелперного вируса, захват rAAV путем хроматографии на основе гидрофобных взаимодействий, смена буфера путем гель-фильтрации (SEC), нанофильтрация и захват rAAV путем анионообменной хроматографии. Эти стадии можно использовать отдельно, в различных сочетаниях или в разном порядке. В некоторых вариантах осуществления способ включает все стадии в описанном ниже порядке.
Анионообменная фильтрация
В некоторых вариантах осуществления осветленный и обработанный Benzonase® сбор культуры продукции необязательно подвергают анионообменной фильтрации в условиях, в которых вектор rAAV присутствует в проскоке, и контаминирующий хелперный вирус задерживается на заряженном фильтре. При ионной силе сбора культуры продукции rAAV частицы rAAV могут отделяться от хелперного вируса, например, аденовируса, путем прохода через анионный фильтр, такой как фильтр Mustang® Q (Pall Corp., East Hills, NY). Специалист в данной области может определить размер и число фильтров, необходимых для достижения оптимального порядка снижения уровня аденовируса (LRV) и аденовирусных белков, присутствующих в осветленной, обработанной Benzonase® и пропущенной через анионный фильтр культуре продукции. В некоторых вариантах осуществления LRV составляет, по меньшей мере, один порядок и более чем десять порядков. В предпочтительном варианте осуществления LRV составляет, по меньшей мере, два и более чем восемь порядков. В более предпочтительном варианте осуществления LRV составляет, по меньшей мере, шесть порядков.
Концентрирование путем фильтрации в тангенциальном потоке (TFF)
В некоторых вариантах осуществления проскок от анионной фильтрации осветленного обработанного Benzonase® потока исходных концентрируют путем фильтрации в тангенциальном потоке ("TFF") перед нанесением на среду хроматографии на апатите. Крупномасштабное концентрирование вирусов с использованием ультрафильтрации TFF описано R. Paul et al., Human Gene Therapy, 4:609-615 (1993). Концентрирование потока исходных материалов путем TFF обеспечивает технически управляемый объем потока исходных материалов, подвергаемых стадиям хроматографии по настоящему изобретению, и обеспечивает применение более обоснованных размеров колонок без необходимости длительных периодов рециркуляции. В некоторых вариантах осуществления поток исходных материалов rAAV концентрируют, по меньшей мере, в два раза и до концентрирования, по меньшей мере, в десять раз. В некоторых вариантах осуществления поток исходных материалов концентрируют, по меньшей мере, в десять раза и до концентрирования, по меньшей мере, в двенадцать раз. В некоторых вариантах осуществления поток исходных материалов концентрируют, по меньшей мере, в двенадцать раз и до концентрирования, по меньшей мере, в пятьдесят раз. Специалисту в данной области также будет понятно, что TFF также можно использовать на любой стадии процесса очистки, где требуется, чтобы менять буферы перед выполнением следующей стадии процесса очистки.
Захват rAAV посредством хроматографии на апатите в присутствии полиэтиленгликоля (PEG)
Одобренные FDA способы очистки белков и других биологических продуктов, пригодных для использования в клинических испытаниях на людях и в фармацевтических препаратах, основываются на ортогональных процессах коммерческого масштаба. Считается, что многостадийная схема очистки включает в себя ортогональный процесс, если в ней используются механизмы разделения, отличные один от другого, притом, что каждая стадия представляет собой ось декартова пространства. Например, двухстадийный процесс с использованием анионообменной хроматографии и хроматографии на основе гидрофобных взаимодействий (HIC) будет считаться ортогональным. Процессы удаления примесей, таких как примеси, связанные с культурой продукции, или технологические примеси, из сбора культуры продукции или из потока исходных материалов, описываемые в настоящем документе, представляют собой ортогональные процессы, включающие стадии захвата и проскока конечного продукта (т.е., вектора на основе rAAV) на ряде хроматографических сред. Векторы на основе rAAV (конкретно rAAV-2), как было продемонстрировано в данной области, связываются с анионными смолами. Векторы на основе rAAV, такие как rAAV-1, -5, и -8, как было продемонстрировано, связываются намного менее прочно, чем rAAV-2, с анионообменными средами в присутствии компонентов продукции, таких как сывороточный альбумин, компоненты хелперного вируса, компоненты среды продукции и ДНК клетки-хозяина, что приводит к менее эффективной схеме очистки с более низким качеством.
Предшествующие стратегии очистки, описанные в данной области для связывающих анионных веществ с низкой аффинностью, таких как AAV-1, включали стадию градиента йодиксинола, которая снижала относительную концентрацию примесей, таких как примеси, связанные с продукцией, и технологические примеси, для достижения более прочного связывания вектора на основе rAAV с анионообменниками. Стадии градиента йодиксинола трудно масштабировать до процессов коммерческого масштаба, описываемых в настоящем документе.
Авторами изобретения настоящей заявки открыто, что частицы вектора на основе rAAV могут отделяться от примесей, таких как таких как примеси, связанные с культурой продукции, и технологические примеси, путем захвата и элюции с апатитных смол. Таким образом, в дополнение к захвату продукта из необработанного потока исходных материалов, апатитная колонка удаляет ряд технологических примесей, включая белки клетки-хозяина и аденовируса, глюканы и сывороточные белки, а также предоставляет дополнительные факторы очистки для хелперного вируса (такого как хелперный вирус Ad5).
Апатитные смолы включают в себя хроматографические среды, содержащие минералы фосфата кальция, включая в качестве неограничивающих примеров, керамический гидроксиапатит (CHT) и керамический фторапатит (CFT). Среды хроматографии на апатите также обозначают как среды смешанного режима или мультимодальные среды, поскольку апатит имеет функциональные группы, которые предоставляют более одного вида связывающей химии. Без намерения связать это с теорией, апатитные среды предоставляют возможность для основанного на кальции металлоаффинного связывания, образования водородных связей, отталкивания положительного заряда, притягивания положительного заряда, отталкивания отрицательного заряда и притягивания отрицательного заряда посредством множества различных химических групп, включающих гидроксильные остатки, присутствующие на остове, положительно заряженные атомы кальция и отрицательно заряженные радикалы фосфата, присутствующие на смоле. Каждый вид связывающей химии вносит вклад в смешанный режим связывания точно так, как он участвует в хроматографии с одним режимом. Однако, в отличие от хроматографии с одним режимом, различные виды химии связывания и элюирования не являются независимыми и могут работать противоположными способами. Например, повышение ионной силы может управлять гидрофобным связыванием. (T. Kawasaki, M. Niikura, and Y. Kobayashi, J. Chrom. 515:125-148 (1990) и P.S. Gagnon, P. Ng, J. Zhen, C. Aberin, and J. He, BioProcess Int'l 4:50-60 (2006)). Конкретно, CHT и CFT представляют собой сферические макропористые формы гидроксиапатита (Ca5(PO4)3OH)2, спекшиеся при высокой температуре для преобразования минерала из кристаллической в керамическую форму. Это образует среду хроматографии с макропористой структурой, предоставляющей большую площадь поверхности, ограниченное сопротивление переносу массы, высокую прочность и сопротивление базы. Спекание при различных температурах и в течение различного времени приводит к образованию различных физических структур типа I и II, которые идентичны химически, но предоставляют различные емкости для разных классов молекул. CFT отличается от CHT тем, что он представляет собой композит фторапатита и гидроксиапатита, полученный химическим замещением гидроксильных групп группами фтора для повышения стабильности при кислых условиях. Смолы CFT и CHT коммерчески доступны (например, от Bio-Rad Laboratories, Inc.).
Авторами настоящего изобретения неожиданно обнаружено, что присутствие полиэтиленгликоля (PEG) в буфере загрузки существенно повышает емкость и воспроизводимость (путем снижения вариации выхода частиц rAAV в проскоке) связывания частиц вектора на основе rAAV с апатитными смолами. Без связи с теорией один из признаков векторов rAAV, который отличает их от большинства технологических примесей, представляет собой большой физический размер частиц. Это различие размера используется на стадиях захвата и промывки путем включения полиэтиленгликоля (PEG) в хроматографические буферы для связывания и промывки, чтобы предпочтительно повысить коэффициенты разделения более крупных молекул в связанном состоянии на основе принятия энергетически выгодной формы гидратированными оболочками. В то время как применение PEG в очистке векторов на основе вирусов и бактериофагов описано в данной области, в отличие от настоящего изобретения, его применяли преимущественно в качестве осаждающего средства для физической агрегации и удаления вирусных частиц из раствора. Поскольку о PEG в данной области известно, что он способствует агрегации и осаждению вирусных частиц, а о rAAV в данной области описано, что они образуют агрегаты при ионной силе ниже 200 мМ (Wright et al., Molecular Therapy 12:171-178 (2005)), воздействие PEG на связывания вектора на основе rAAV с апатитными смолами было непредсказуемым. PEG известен в данной области облегчением связывания молекул иммуноглобулина с ионообменными смолами, как описано, например, в Gagnon, J. Chromtogr. 743A:51-55 (1996), и с заряженными гидрофобными смолами со смешанным режимом, как описано, например, в Gagnon et al., 22nd International IBC Conference on Antibody Production and Development, March 4-6, 2009.
Авторы изобретения настоящей заявки определили, основываясь на экспериментировании с PEG6000 в интервале концентрации в потоке исходных материалов 3-10% (масс./об.), что оптимальной является относительная концентрация, равная приблизительно 5% (масс./об.) PEG6000. Специалисту в данной области понятно, что могут использоваться другие виды и молекулярные массы PEG, включая в качестве неограничивающих примеров PEG8000, PEG 10000 и PEG 15000, и что относительная концентрация PEG в конечной концентрации раствора вектора на основе rAAV может эмпирически определяться так, что при подходящей концентрации PEG частицы вектора на основе rAAV в растворе направляются на связывание с апатитной смолой, но не образуют агрегатов или не осаждаются физически.
В некоторых вариантах осуществления частицы вектора на основе rAAV отделяют от примесей, связанных с культурой продукции, путем захвата на апатитной смоле в присутствии PEG и элюирования связанной частицы rAAV с апатитной смолы в фосфатном буфере. В предпочтительных вариантах осуществления частицы вектора на основе rAAV отделены от примесей, связанных с культурой продукции, путем захвата на апатитной смоле в присутствии PEG и элюирования связанной частицы rAAV с апатитной смолы в буфере в отсутствие PEG. В некоторых вариантах осуществления частицы rAAV, содержащие капсиды, которые являются слабо связывающими анионными веществами, отделяют от культуры продукции от примесей, связанных с культурой продукции, путем захвата на апатитной смоле в присутствии PEG, и связанные частицы rAAV элюируют с апатитной смолы в буфере в отсутствие PEG. В более предпочтительных вариантах осуществления частицы rAAV, содержащие капсиды серотипа 1 (серотип rAAV-1) отделяют от примесей, связанных с культурой продукции, путем захвата на апатитной смоле в присутствии PEG, и частицы, содержащие капсид серотипа rAAV-1, связанные со смолой, элюируют в буфере в отсутствие PEG. В некоторых вариантах осуществления частицы вектора rAAV отделяют от примесей, связанных с культурой продукции, способом, включающим загрузку потока исходных материалов в буфере для загрузки, не содержащего фосфата, но в присутствии PEG, и элюирование связанного rAAV с апатитной смолы в буфере для элюирования, содержащем фосфат и не содержащем PEG.
Тогда как хроматография на апатите в присутствии PEG представляет эффективную стратегию захвата или связывания для очистки векторов на основе rAAV, многие технологические примеси также задерживаются на апатитной смоле при pH 7,0. Без связи с теорией, белки, присутствующие в потоке исходных материалов при основном pH (pH выше 7,0), более вероятно, имеют суммарный отрицательный заряд и отталкиваются отрицательно заряженными участками связывания фосфата, присутствующими на апатитной смоле, снижая, таким образом, общую катионообменную связывающую способность хроматографической смолы. Однако, благодаря мультимодальной природе апатитных смол, связывание посредством привлечения положительным зарядом и металлоаффинные свойства все рано будут иметь место.
Боратные буферы широко используются в данной области в качестве основных буферных систем по причине их предпочтительных производственных характеристик, включая в качестве неограничивающих примеров простоту получения, оптимальную растворимость, отличную буферную емкость и низкую стоимость. Таким образом, боратные буферы в качестве модельной буферной системы испытывали на предмет захвата rAAV на апатитных смолах. Специалисту в данной области ясно, что другие основные буферные системы можно оценивать для определения того, снижают ли они уровень связывания технологических примесей с апатитными смолами в присутствии PEG. Другие основные буферы могут тестироваться и применяться на захват rAAV. В некоторых вариантах осуществления буфер загрузки на апатит без PEG содержит боратный буфер. В предпочтительных вариантах осуществления боратный буфер формулируют при pH от приблизительно 8,0 до приблизительно pH 9,9. В предпочтительном варианте осуществления боратный буфер формулируют при pH, приблизительно равном 9,0. В некотором варианте осуществления боратный буфер находится в концентрации от приблизительно 5 мМ до приблизительно 500 мМ. В более предпочтительных вариантах осуществления боратный буфер формулируют приблизительно как 20 мМ борат, pH 9,0. В некоторых вариантах осуществления 20 мМ боратный буфер при pH 9,0 специфично снижает захват низкомолекулярных технологических примесей на апатитную смолу.
В некоторых вариантах осуществления поток исходных материалов загружают на апатитную смолу в буфере, содержащем фосфат в присутствии PEG путем смешивания потока исходных материалов с фосфатным буфером, содержащим PEG в концентрации в два раза больше конечной. В некоторых вариантах осуществления pH фосфатного буфера составляет между pH 6,5 и pH 7,0. В некоторых вариантах осуществления PEG представляет собой PEG6000. В некоторых вариантах осуществления концентрация PEG6000 в буфере загрузки составляет между приблизительно 3% (масс./об.) и приблизительно 10% (масс./об.). В более предпочтительных вариантах осуществления концентрация PEG6000 в буфере загрузки составляет приблизительно 5% (масс./об.). В некоторых вариантах осуществления концентрация фосфата в буфере загрузки на апатитную смолу составляет между 5 мМ и 500 мМ.
В некоторых вариантах осуществления связывающая способность апатитной смолы в присутствии PEG повышается относительно связывающей способности апатитной смолы в отсутствие PEG. В некоторых вариантах осуществления связывающая способность апатитной смолы в отношении частиц вектора на основе rAAV в потоке исходных материалов в присутствии PEG повышается от приблизительно половины порядка до приблизительно десяти порядков относительно связывающей способности апатитной смолы в отсутствие PEG. В предпочтительных вариантах осуществления связывающая способность апатитной смолы в отношении частиц вектора на основе rAAV, находящихся в потоке исходных материалов, в присутствии PEG повышается в восемь раз. В некоторых вариантах осуществления связывающая способность апатитной смолы в отношении частиц вектора на основе rAAV в потоке исходных материалов в присутствии PEG составляет, по меньшей мере, от приблизительно 106 частиц rAAV на мл смолы до приблизительно 1016 частиц на мл смолы (например, приблизительно любое количество из 106, 107, 108, 109, 1010, 1011, 1012, 1013, 1014, 1015, 1016 частиц на мл смолы). В некоторых вариантах осуществления связывающая способность апатитной смолы в присутствии PEG приблизительно равна 1014 частиц на мл смолы.
В то время как эта неожиданная связывающая способность приблизительно 1012-1014 DRP rAAV-1 на мл апатитной смолы в присутствии PEG обеспечивает высокоэффективное, экономичное масштабирование коммерческой очистки rAAV-1, специалисту в данной области понятно, что связывающая способность представляет собой максимальное число, или число rAAV-1, которое свяжется на мл смолы, и не предназначено для эксплуатационного ограничения объема изобретения. Фактически авторы изобретения понимают, что культуры сбора вектора на основе rAAV-1, которые содержат меньше 1014-1016 DRP rAAV-1/мл, можно очищать по настоящему изобретению.
В некоторых вариантах осуществления частицы rAAV, связанные с апатитной смолой, отмывают перед элюированием частиц rAAV со смолы. В некоторых вариантах осуществления среду хроматографии на апатите отмывают один или более раз буфером для промывки, содержащим снижающиеся концентрации PEG для удаления технологических примесей. В некоторых вариантах осуществления среду для хроматографии на апатите отмывают один или более раз буфером для промывки, содержащим между приблизительно 3% (масс./об.) и приблизительно 10% (масс./об.) PEG. В некоторых вариантах осуществления буфер для промывки содержит приблизительно любую концентрацию из 10% (масс./об.), 9,5% (масс./об.), 9% (масс./об.), 8,5% (масс./об.), 8% (масс./об.), 7,5% (масс./об.), 7% (масс./об.), 6,5% (масс./об.), 6% (масс./об.), 5,5% (масс./об.), 5% (масс./об.), 4,5% (масс./об.), 4% (масс./об.), 3,5% (масс./об.) и 3% (масс./об.) PEG. В некоторых вариантах осуществления апатитную среду отмывают буфером для промывки, содержащим PEG в концентрации выше концентрации PEG, используемой для обеспечения связывания частиц rAAV с апатитной средой. В некоторых вариантах осуществления апатитную среду дополнительно промывают снижающимися концентрациями PEG. В некоторых вариантах осуществления буфер для промывки содержит буферы, известные в данной области. В некотором варианте осуществления буфер для промывки содержит буфер, выбранный из группы, состоящей из бората, N-2-гидроксиэтилпиперазин-N'-2-этансульфоновой кислоты (HEPES) и Tris-HCl. В некоторых вариантах осуществления буфер для промывки характеризуется основным pH. В некоторых вариантах осуществления буфер для промывки характеризуется pH между pH 7,0 и pH 10,0, между pH 7,2 и pH 10,0, между pH 7,4 и pH 10,0, между pH 7,6 между pH 10,0, между pH 7,8 и pH 10,0, между pH 8,0 и pH 10,0, между pH 8,2 и pH 10,0, между pH 8,4 и pH 10,0, между pH 8,6 и pH 10,0, между pH 8,8 и pH 10,0, между pH 9,0 и pH 10,0, между pH 9,2 и pH 10,0, между pH 9,4 и pH 10,0, между pH 9,6 и pH 10,0 или между pH 9,8 и pH 10,0. В некоторых вариантах осуществления буфер для промывки характеризуется pH, равным 7,0, 7,2, 7,4, 7,6, 7,8, 8,0, 8,2, 8,4, 8,6, 8,8, 9,0, 9,2, 9,4, 9,6, 9,8 или 10,0. В некоторых вариантах осуществления буфер для промывки дополнительно содержит между 100 и 500 мМ фосфата. В некоторых вариантах осуществления буфер для промывки дополнительно содержит между 50 и 250 мМ NaCl.
В некоторых вариантах осуществления векторы на основе rAAV, выделенные из потока исходных материалов путем захвата на апатитную смолу в присутствии PEG, элюируют в буфер с низкими концентрациями PEG. В некоторых вариантах осуществления низкие концентрации PEG составляют между приблизительно 2,9% (масс./об.) и приблизительно 0,1% (масс./об.) PEG. В некоторых вариантах осуществления векторы на основе rAAV, выделенные из потока исходных материалов путем захвата на апатитную смолу в присутствии PEG, элюируют в буфер без PEG. В предпочтительных вариантах осуществления векторы на основе rAAV, выделенные из потока исходных материалов путем захвата на апатитную смолу в присутствии PEG, элюируют в буфер, содержащий фосфат без PEG.
В некоторых вариантах осуществления векторы на основе rAAV, выделенные из потока исходных материалов путем захвата на апатитную смолу в присутствии PEG, элюируют в буфер, содержащий фосфат. В некоторых вариантах осуществления векторы на основе rAAV, выделенные из потока исходных материалов путем захвата на апатитную смолу в присутствии PEG, элюируют в буфер, содержащий фосфат в концентрации между приблизительно 0,1 мМ и приблизительно 500 мМ (например, между приблизительно 1 мМ и приблизительно 250 мМ, между приблизительно 10 мМ и приблизительно 100 мМ). В предпочтительных вариантах осуществления векторы на основе rAAV векторы, выделенные из потока исходных материалов путем захвата на апатитную смолу в присутствии PEG, элюируют в 50 мМ фосфатный буфер.
Авторы изобретения настоящей заявки обнаружили, что векторы на основе rAAV, присутствующие в потоке исходных материалов, могут быть выделены путем захвата на апатитной смоле в присутствии PEG. Однако, если в потоке исходных материалов, нанесенных на апатитную смолу, присутствуют хелперные вирусы, используемые в культуре продукции (такие как аденовирус), они захватываются апатитной смолой в присутствии PEG. Частицы вектора на основе rAAV, захваченные апатитной смолой в присутствии PEG, могут легко отделяться от аденовируса по их профилю элюции в фосфатных буферах. Частицы вектора на основе rAAV, связанные с апатитной смолой в присутствии PEG, элюируют в отсутствие PEG в буферы, содержащие малое количество фосфата, такое как 0 мМ; в это время аденовирусные частицы хелперного вируса задерживаются на апатитных смолах при концентрациях фосфата, используемых для элюирования частиц вектора на основе rAAV. Экспериментально было обнаружено, что векторы на основе rAAV элюируются в виде единичного пика острой формы в малой концентрации фосфата, равной 50 мМ в отсутствие PEG, в то время как хелперные вирусы, такой как аденовирус, если он присутствует, задерживаются на смоле. В экспериментах с внутренним контролем, когда в потоки исходных материалов rAAV добавляли 89 устойчивых к ДНКазе частиц (DRP) инфекционного аденовируса и подвергали хроматографии на апатитных смолах в присутствии PEG, векторы на основе rAAV захватывали на апатитную смолу и элюировали в 50 мМ фосфатный буфер без PEG, в то время как приблизительно 4 порядка аденовирусных белков задерживалось на апатитной смоле. Таким образом, в некоторых вариантах осуществления векторы на основе rAAV, присутствующие в потоке исходных материалов, отделяли от контаминирующих хелперных вирусов путем захвата на апатитной смоле в присутствии PEG и элюирования в фосфатные буферы без PEG. В некоторых вариантах осуществления фосфатные буферы составляют в концентрациях, при которых контаминирующий хелперный вирус остается связанным с апатитной смолой. В некоторых вариантах осуществления от двух до восьми порядков аденовируса задерживаются на мл апатитной смолы. В некоторых вариантах осуществления векторы на основе rAAV, присутствующие в потоке исходных материалов, выделяют путем элюирования с апатитной смолы в 0-500 мМ фосфатный буфер (например, 0-400 мМ, 0-300 мМ, 0-200 мМ, 0-100 мМ, 0-50 мМ) в условиях, при которых хелперный вирус остается связанным с апатитной смолой.
Системы продукции, известные в данной области для продукции векторов на основе rAAV, могут включать в себя среды продукции, содержащие сыворотку в диапазоне 0,5-20% (об./об.), или могут быть совершенно лишены сыворотки. Кроме того, схемы очистки, описанные в данной области, могут включать одну или более стадий концентрирования, которые могут приводить к повышению уровня сывороточных белков и других компонентов сыворотки в потоке исходных материалов, наносимом на апатитную смолу. Например, супернатант культуры продукции, описанной в настоящем документе, который формулируют с 1% (об./об.) сывороткой, концентрировали приблизительно в двадцать раз на стадии TFF, так что поток исходных материалов, загруженный на апатитную смолу, содержал такое большое количество примеси сывороточного белка, как 20%, по сравнению с концентратом потока исходных материалов из культуры продукции, составленной без сыворотки. Авторы изобретения настоящей заявки тестировали способы захвата на апатит, предоставленные в настоящем документе, с концентратами потока исходных материалов из культур продукции, составленных в присутствии сыворотки или в ее отсутствие. Обнаружено, что присутствие белков сыворотки в потоке исходных материалов не оказывает действия на функциональность стадии хроматографии на апатите.
Инактивация хелперного вируса нагреванием (Уничтожение нагреванием)
Если инфекционный аденовирус применяют в качестве источника хелперного вируса в культурах продукции для продукции rAAV, может встраиваться необязательная стадия инактивации нагреванием (уничтожение нагреванием) для инактивации каких-либо оставшихся аденовирусных частиц, которые могут присутствовать в потоке исходных материалов. Стадия инактивации нагреванием использует преимущество одного из главных отличий между AAV и аденовирусом: аденовирусные частицы инактивируются при температурах приблизительно 54-56°C, тогда как вирусные частицы AAV и rAAV стабильны и не подвергаются влиянию данных температур. В настоящем изобретении авторы изобретения настроили стадию инактивации нагреванием так, чтобы она была адаптирована к более масштабной организации процесса, например, к культурам продукции масштаба 250 л, осуществленным, как описано в настоящем документе. В частности, элюат с апатита инактивировали нагреванием в стерильном одноразовом биотехнологическом контейнере объемом 5 л на качающейся платформе с контролем температуры, настроенной на температуру до 53°C при скорости качания 40 об/мин, с углом смешивания 12° (20 л водяная баня Wave). Элюат с апатита инкубировали на платформе до достижения температуры 52°C, а затем держали при такой температуре в течение дополнительных 10 мин. MgCl2 добавляли к апатитному элюату при конечной концентрации 2 мМ для стабилизации вектора rAAV во время нагревания. Специалист в данной области может понять, что масштаб, конечная температура нагревания и время нагревания могут тестироваться эмпирически для поиска оптимальных условий инактивации аденовирусных частиц при сохранении инфекционности и целостности частиц rAAV. Стадия инактивации нагреванием может быть пропущена при очистке частиц rAAV от культур продукции, в которых для обеспечения хелперной функции используются плазмидные конструкции.
Хроматография на основе гидрофобных взаимодействий
Хроматография на основе гидрофобных взаимодействий (HIC) является способом разделения биомолекул на основе различий гидрофобности их поверхности. Таким образом, HIC считается способом, ортогональным в отношении других стадий очистки в процессе продукции AAV. Хроматографические среды для HIC содержат гидрофобные лиганды, такие как углеводороды с линейной цепью (например, пропил (C3), бутил (C4), гексил (C6), или октил (C8)) или ароматические углеводороды (например, фенил). В чистой воде гидрофобный эффект слишком слаб для функционального взаимодействия между лигандом и белками, или между самими белками. Однако, лиотропные соли усиливают гидрофобные взаимодействия, и добавление соли направляет белки на захват средой HIC. По этой причине, смолы HIC, как правило, загружает при высокой концентрации соли и элюируют при низкой концентрации соли. Как понятно специалисту в данной области, сульфат аммония [(NH4)2SO4] является наиболее широко используемой солью для контроля захвата белков посредством хроматографии HIC по причине высокого лиотропного коэффициент ионов аммония и сульфата в ряду Гофмейстера и высокой растворимости соли. В настоящем изобретении, частицы rAAV, присутствующие в потоке исходных материалов, загружали на смолу HIC путем поточного смешивания в отношении 75:25 (объем:объем) 2 M сульфата аммония + 50 мМ бис-буфера Tris (pH 7,0): потока исходных материалов, соответственно. Поточное смешивание потока исходных материалов с буфером загрузки предотвращает риск любого осаждения вектора на основе rAAV высокой концентрацией сульфата аммония, присутствующего в буфере. Как понятно специалисту в данной области, концентрацией соли (сульфата аммония) можно управлять для достижения оптимальной концентрации для связывания rAAV. Таким образом, в некоторых вариантах осуществления концентрация сульфата аммония находится между 1 M и 3 M. В некоторых предпочтительных вариантах осуществления концентрация сульфата аммония в буфере загрузки составляет 2 мМ. Как понятно специалисту в данной области, поточное смешивание сульфата аммония и потока исходных материалов проводят для удобства и для управления потоковым устройством, но можно легко смешивать поток исходных материалов с подходящей концентрацией буфера для загрузки любыми способами, известными в данной области, а затем загружать раствор потока исходных материалов + буфера для загрузки на хроматографическую среду HIC.
Сорастворители также могут воздействовать на гидрофобное взаимодействие. Например, этилен или пропиленгликоль может ослаблять взаимодействие между белком и иммобилизованным лигандом, и, таким образом, может использоваться для улучшения профилей элюирования. Таким образом, колонку HIC отмывали буферной смесью смесью 75:25 (объем:объем) 2 M сульфата аммония + 50 мМ бис-буфера Tris (pH 7,0): 50 мМ бис-Tris (pH 7,0) + 10% пропиленгликоля (объем:объем) (EMD Biosciences), и rAAV элюировали буфером с низким содержанием соли и с пропиленгликолем (800 мМ сульфат аммония + 50 мМ бис-буфер Tris (pH 7,0) + 4% пропиленгликоль). При этих условиях элюирования любые оставшиеся хелперные вирусы и белки, присутствующие в потоке исходных материалов, загруженном на колонку, остаются связанными с колонкой. Пропиленгликоль в данном примере добавляли к буферам для получения более острого пика профиля элюирования по сравнению с широким профилем элюирования буфера без пропиленгликоля, но последний является не обязательным для процесса.
Неограничивающие примеры подходящих гидрофобных смол включают в себя Tosoh Butyl 650M, Tosoh SuperButyl 650C, Tosoh Phenyl 650C и EMD Fractogel Phenyl (Tosoh Bioscience LLC, PA).
Отходы от способов получения rAAV требуют жесткой дезинфекции перед утилизацией, по меньшей мере, по двум причинам: (1) продукт содержит вирусный вектор; и (2) в культурах продукции обычно применяется живой аденовирус типа 5 (Ad5) в качестве хелперного вируса для продукции rAAV. Жидкие отходы от хроматографических операций, как правило, вначале дезинфицируют хлорной известью в месте использования, а затем подвергают дальнейшей дезинфекции путем инкубации при высоком рН перед нейтрализацией и утилизацией.
Сульфат аммония, присутствующий в буферах HIC, взаимодействует с хлорной известью и гидроксидом натрия с высвобождением опасных газов хлора и аммиака, соответственно. Таким образом, исходное соображение для оптимизации стадии хроматографии HIC представляло собой разработку подходящей буферной системы, которую можно безопасно дезинфицировать известными в данной области способами.
Как понятно специалисту в данной области, буферы с высокой концентрацией соли, применяемые в хроматографии на основе гидрофобных взаимодействий, могут подвергаться дальнейшему скринингу на предмет вязкости, которая может приводить к высоким значениям обратного фильтрационного давления, способным ограничить скорости потока или вызывать проблемы перемешивания, повышая тем самым риск осаждения продукта за счет кристаллизации соли в буферах, происходящей при температурах, которые могут использоваться для хранения или функционирования. Основываясь на данных, приведенных ниже в таблице 6, и с учетом факторов, описанных выше, авторы изобретения выбрали 1 M цитрат натрия (pH 7,0) в качестве оптимального буфера для связывания векторов rAAV с хроматографической средой HIC, хотя цитратные буферы можно использовать в хроматографии на основе гидрофобных взаимодействий в концентрациях в диапазоне от 0,5 M до 2,0 M.
Смена буфера посредством гель-фильтрации (SEC)
В данной области известны многочисленные способы смены буфера, описываемого в настоящем документе, включая TFF и диализ. Применение гель-фильтрации имеет дополнительное преимущества предоставления дальнейшей очистки от белков, размеры которых позволяют им проходить через поры смол, и данный способ является относительно быстрым в плане времени, необходимого для обмена буферов. Обмен буферов проводили на данной стадии, чтобы убедиться в том, что элюат HIC на предыдущей стадии обменивали на подходящий буфер для связывания rAAV на конечной стадии процесса, анионообменной хроматографии.
Дополнительный агент (удаление вирусов)
Необязательно, в процесс может быть включена дальнейшая стадия удаления следовых примесей, таких как дополнительные вирусы, которые могут присутствовать в потоке исходных материалов, что дает, таким образом, разумный с точки зрения коммерции ортогональный процесс. Таким образом, в некоторых вариантах осуществления процесс далее включает фильтр очистки от вирусов. Примеры таких фильтров известны в данной области и включают в себя Millipore Viresolve NFR (50 нм), Pall Ultipore VF (50 нм) и Asahi 70 нм.
Анионообменная хроматография
Стадия анионообменного захвата вектора на основе rAAV, подвергнутого хроматографии на апатите, проводили в качестве стадии конечного концентрирования и доведения до готовности. Подходящие среды для анионообменной хроматографии известны в данной области и в качестве неограничивающих примеров включают Unosphere Q (Biorad, Hercules, California) и амино- или иминосмолы с зарядом на атоме N, такие как, например, POROS 50 PI, или любые основанные на DEAE, TMAE, третичном или четвертичном амине или на PEI смолы, известные в данной области (патент США № 6989264; N. Brument et al., Mol. Therapy 6(5):678-686 (2002); G. Gao et al., Hum. Gene Therapy 11:2079-2091 (2000)). Специалист в данной области может понять, что могут быть определены буферы для промывки с подходящей ионной силой, так что rAAV останется связанным со смолой, тогда как другие технологические примеси, включая в качестве неограничивающих примеров, глюканы, которые могут войти в продукт путем утечки из различные фильтров, используемых на стадиях очистки, будут смыты. В некоторых вариантах осуществления буфер для промывки представляет собой 60 мМ NaCl, и rAAV вектор элюируется с колонки в 130 мМ NaCl, так что какие-либо имеющиеся следовые остатки технологических примесей, таких как сывороточный альбумин или хелперный вирус, задерживаются на колонке.
ПРИМЕРЫ
Пример 1. Сбор rAAV-1 из среды для культивирования -осветление и расщепление Benzonase®
Отработанную среду продукции rAAV-1 (супернатант) из 250 л культуры вирусной продукции rAAV-1, произведенной любым известным в данной области способом, содержащую вектор на основе rAAV-1, осветляли для удаления любых клеток, содержащихся в супернатанте. Супернатант пропускали через серию фильтров, соединенных в виде серии, включающей: (1) фильтр Millipore Millistak+® HC Pod, марки D0HC (Millipore Corp., Bedford, MA)(4 times); (2) фильтр Millipore Millistak+® HC Pod, марки A1HC; и (3) фильтр с гидрофильной мембраной 0,2 мкм Opticap® XL10 Millipore Express SHC, при скорости 5 литров в минуту (LPM), причем скорость постадийно снижали до 4 LPM.
Все фильтры предварительно промывали в подвергнутой обратному осмосу/деионизованной («RO/DI») воде согласно спецификациям производителя. Проскок собирали в биотехнологический контейнер для расщепления Benzonase®. Конечную концентрацию Benzonase® 2 единицы/мл (EM Industries, каталожный номер 1,01695,0002) растворяли в среде продукции rAAV-1 и добавляли к осветленному вирусному супернатанту до достижения конечной концентрации 2,5 единицы/мл. Супернатант с Benzonase® инкубировали при температуре окружающей среды при постоянной рециркуляции при 4 LPM для обеспечения расщепления ДНК. Данные по расщеплению Benzonase® показаны на фигуре. 1, на которой продемонстрировано, что после расщепления Benzonase® отсутствовала высокомолекулярная ДНК.
Пример 2. Удаление примесей, связанных с продукцией, посредством обмена анионов
Осветленный и расщепленный Benzonase® супернатант rAAV-1 из примера 1 пропускали через серию фильтров размером два на двадцать два дюйма Pall Mustang® Q («MQ»), соединенных в серию (Pall Corp., каталожный номер NP6MSTGQP1). Перед загрузкой вирусного супернатанта rAAV-1 фильтры подвергали санитарной обработке 15 л 0,5 M NaOH при 0,5 LPM в течение времени инкубации, равного 15 мин, заряжали путем ополаскивания в 15 л TMEG + 2 M NaCl (TMEG: 0,05 M Tris-HCl, pH 7,5, 1 мМ 2-меркаптоэтанол, 1 мМ Na2EDTA, 10% (об./об.) глицерин) со скоростью 6 LPM и уравновешивали 15 среды продукции вектора при 6 LPM. Затем супернатант продавливали при скорости приблизительно 6 LPM через серию фильтров и собирали в биотехнологический контейнер. При ионной силе среды продукции анионообменный фильтр MQ, как было продемонстрировано, помимо других примесей удалял из супернатанта rAAV-1 хелперный вирус и оставшуюся ДНК путем связывания примесей с заряженной мембраной. Однако, при ионной силе культуры продукции вектор на основе rAAV-1, присутствующий в супернатанте, промывался сквозь анионообменную мембрану. Во время оптимизации процесса экспериментально определяли, что применение одного фильтра MQ приводило к проникновению примесей в поток процесса, включая хелперный вирус Ad5. Таким образом, в процесс добавляли второй фильтр в виде серии или тандема.
Пример 3. Концентрирование супернатанта вектора на основе rAAV-1
Весь супернатант продукции вектора на основе rAAV-1, обработанный в примерах 1 и 2, концентрировали приблизительно в 20 раз с использованием фильтрации в тангенциальном потоке («TFF») от исходного объема приблизительно 250 л до объема приблизительно 12,5 л. Фильтры-картриджи из простого полиэфирсульфона для тангенциального потока, с отсечением по молекулярной массе 100 кДа, C-экраном и общей площадью поверхности 5 м2 (Millipore Pellicon® 2 Biomax, каталожный № P2B100C05), ополаскивали 50 л RO/DI воды, обеззараживали 15 л 0,5 M NaOH в течение стадии выдерживания длительностью 15 мин, опять ополаскивали 100 л WIFI (очищенная вода HyPure™ WFI; HyClone, Logan, UT), ополаскивали 15 л TMEG + 2M NaCl, и в конце уравновешивали 15 л среды продукции rAAV-1. Супернатант пропускали через картридж для TFF при скорости потока приблизительно 3 LPM со скоростью рециркуляции 16 LPM. Материал TFF, оставшийся на фильтре («концентрат») концентрировали до приблизительно 10,5 л и переносили в резервуар. Фильтр ополаскивали примерно 2 л среды продукции. Затем промывку и концентрат объединяли с получением конечного объема приблизительно 12,5 л.
Концентрирование rAAV-1 до объема 12,5 л путем TFF также приводило к концентрированию в растворе оставшихся примесей, связанных с продукцией rAAV-1, приблизительно в 20 раз. Таким образом, после стадии TFF вводили производственную стадию удержания, во время которой концентрат TFF фильтровали через 4-дюймовую фильтровальную мембрану Opticap с порами 0,22 мкМ (Millipore Opticap® каталожный № KVSC04HB3). Эта стадия дополнительной фильтрации обеспечивает прохождение содержащего rAAV-1 концентрата TFF на следующую стадию процесса без применения диафильтрации и обмена буфера. Материал после TFF можно хранить при 2-8°C в течение любого периода времени, включая как минимум, от 24 часов до 3 месяцев или более, перед дальнейшей обработкой без потери стабильности, что измеряется по выходу или инфекционности вектора, оцениваемой анализами, известными в данной области. Альтернативно, TFF, проведенную, как описано в настоящем документе, можно использовать на любой стадии способа очистки для концентрирования вектора на основе rAAV-1 или обмена буфера.
Пример 4. Скрининг смол для связывания вектора на основе rAAV-1 по сравнению со связыванием примесей, полученных в процессе продукции
Коммерческие, одобренные FDA способы очистки белков и других биологических продуктов основываются на встроенных ортогональных процессах коммерческого масштаба. Ортогональные процессы представляют собой процессы, который включают более одной стадии или процесса для удаления технологических примесей, включая стадии захвата и проскока конечного продукта, такого как, например, вектор на основе rAAV-1. Векторы на основе rAAV (конкретно, rAAV-2), как было продемонстрировано в данной области, связываются с анионными смолами. Векторы на основе rAAV, такие как rAAV-1, -5, и -8, как было продемонстрировано, связываются намного менее прочно, чем rAAV-2, с анионообменниками в присутствии компонентов продукции, таких как сывороточный альбумин, компоненты хелперного вируса, компоненты среды и ДНК и клетки-хозяина, что приводит к появлению менее эффективной и менее качественной схемы очистки.
Предшествующие стратегии очистки, описанные в данной области для анионных веществ, связывающих с низкой аффинностью, таких как AAV-1, включают стадию градиента йодиксинола, который снижает относительную концентрацию компонентов продукции для достижения более прочного связывания вектора на основе rAAV с анионообменниками. Стадии с градиентом йодиксинола трудно расширить до коммерческого масштаба, такого как описываемый в настоящем документе. Таким образом, для оптимизации очистки вектора на основе rAAV для анионных связывающих веществ с низкой аффинностью, таких как rAAV-1, без необходимости проводить ультрацентрифугирование и постадийных градиентов, ряд смол подвергали скринингу на их способность связывать векторы на основе rAAV или исключать векторы на основе rAAV из проскока по сравнению со способностью связывать или пропускать обычно наблюдаемые технологические примеси, включающие ДНК клетки-хозяина, хелперный вирус, сывороточный альбумин, сывороточные белки (если сыворотка включена в среду продукции) и другие низкомолекулярные белки, находящиеся в культурах продукции, для разработки коммерчески масштабируемого, ортогонального и эффективного способа очистки rAAV.
Скрининг смолы проводили с использованием колонки объемом 1 мл (высота слоя носителя 5 см) с линейными скоростями потока, рекомендованными поставщиком для каждой смолы, с существенной перегрузкой по емкости относительно рекомендаций производителя. Отслеживание спектрофотометрического сигнала оптической плотности ультрафиолета при 280 нанометрах (A280) фиксировали для связывания и элюирования с каждой смолы. Пики анализировали путем подходящего анализа для вектора на основе rAAV-1 и типичных технологических примесей. Данные, представленные на фигуре 2, представляют собой типичное отслеживание спектрофотометрического сигнала за типичной смолой из списка. В таблице 2 перечислены некоторые из смол, подвергнутые скринингу, а также относительные значения аффинности связывания со смолами вектора на основе rAAV-1 и различных технологических примесей.
|
Пример 5. Разработка хроматографии на апатите в присутствии полиэтиленгликоля («PEG») для захвата rAAV-1
Основываясь на результатах скрининга смол, проведенного в примере 4, апатитную смолу или смолу из керамического апатита выбирали в качестве одной из смол для захвата rAAV-1. Исходные эксперименты проводили с использованием смолы CFT II, но для дальнейшей очистки смолу меняли на CHT I, как подробно обсуждается ниже. Данные показали, что обе хроматографические смолы функционировали эквивалентно. Проводили эксперименты для дальнейшего увеличения связывающей способности апатитной смолы в отношении rAAV-1 и улучшения способности смолы разделять частицы rAAV-1 и другие технологические примеси. Два ключевых улучшения функции апатитных смол разрабатывали далее, как описано в настоящем документе: 1) добавление PEG; и 2) разработка условий, связанных с буфером для загрузки.
Основываясь на переменном проскоке апатитной колонки из-за вопросов емкости при разумных с коммерческой точки зрения размерах колонки, PEG смешивали с концентратом после TFF (см. пример 3 выше) перед загрузкой на апатитную смолу для увеличения связывания вектора на основе rAAV-1 относительно других технологических примесей, таких как сывороточный альбумин, хелперный вирус и другие белковые примеси, которые конкурировали с вектором на основе rAAV-1 за связывание с колонкой в примере 4.
Хроматография на апатите в присутствии PEG представляет собой эффективную стратегию захвата или связывания для очистки векторов на основе rAAV-1, хотя многие технологические примеси также задерживаются апатитной смолой при pH 7,0.
Проводили эксперименты для определения того, может ли улучшить модификация буферных условий отделение rAAV-1 от других технологических примесей. Эксперименты в малом масштабе проводили с использованием системы для FPLC AKTAexplorer (GE Healthcare, Piscataway, NJ), укомплектованной колонками объемом 1,2 мл Tricorn 5 (GE Healthcare), упакованными смолой CFT с высотой слоя носителя 6 см, причем систему запускали при скорости потока, равной 150 см/ч. Данные колонки оценивали на предмет захвата вектора на основе rAAV-1 относительно связывания бычьего сывороточного альбумина («BSA»), модельной низкомолекулярного технологической примеси, в различных буферных системах в присутствии или в отсутствие 5% PEG6000.
rAAV-1 или BSA инъецировали в малых объемах (<5% от общего объема) на колонку CFT в тестируемой буферной системе, в присутствии или в отсутствие 5% (масс./об.) PEG6000. Малые объемы применяли для устранения необходимости обмена буфера в образцах. Продукты элюировали с использованием градиента 500 мМ PO4. 50 мМ 2-(N-морфолино)этансульфоновую кислоту («MES») применяли для забуферивания системы при pH 6,50, и 20 мМ борат применяли для забуферивания системы при pH 9,0.
Данные, представленные в таблице 3, демонстрируют, что связывание вектора на основе rAAV-1 с апатитной смолой, по существу, одинаково при pH 6,5 или pH 9,0 в присутствии 5% (масс./об.) PEG6000, тогда как связывание BSA, модельной низкомолекулярной технологической примеси существенно снижалось при pH 9,0 в присутствии или в отсутствие 5% (масс./об.) PEG6000, на что указывает спектрофотометрический мониторинг (данные не показаны). Дальнейший анализ сниженной способности BSA связываться с апатитной смолой при основных условиях буфера загрузки (т.е. pH 9,0) путем твердофазного иммуноферментного анализа («ELISA») продемонстрировал, что большая часть BSA (~78%) при буферных условиях pH 9,0 находилась в проскоке, тогда как дополнительный уровень освобождения или снижения связывания BSA мог достигаться во время последующих стадий промывки (~19%), так что из загруженного BSA только ~0,1% оставался на колонке, действительно связанный с апатитной смолой и элюирующийся совместно с вектором на основе rAAV-1. Частицы rAAV-1 были стабильны при pH 9,0, на что указывает отсутствие потери инфекционности или отсутствие снижения числа элюированных устойчивых к ДНКазе частиц («DRP»).
|
Пример 6. Воздействие сыворотки в культуре сбора rAAV-1 на захват rAAV-1 посредством хроматографии на апатите в присутствии PEG
Культуры продукции вектора на основе rAAV-1 или содержащие rAAV-1 потоки исходных материалов, подлежащие очистке способами, описываемыми в настоящем документе, могут содержать сыворотку и белки сыворотки, если культуры продукции выращивали в среде, содержащей сыворотку. В то время как описана продукция вектора на основе rAAV-1, в которой используются очень низкие концентрации сыворотки (т.е., 1% или менее)(см., например, патент США № 6995006), концентрирование культуры продукции или потока исходных материалов, как описано в примере 3, может приводит к образованию потока исходных материалов, эффективно содержащего 20% сыворотки и сывороточных белков в результате 20-кратного концентрирования сбора культуры продукции. Для оценки воздействия компонентов сыворотки на функциональность хроматографии на апатите проводили эксперименты на культурах продукции, произведенных в присутствии или в отсутствие сыворотки, в присутствии или в отсутствие PEG6000.
Две модельных культуры продукции rAAV-1 применяли для оценки функциональности апатитной смолы (CFT типа I) путем традиционного анализа проскока всего в четырех экспериментах по загрузке колонки. В одном из экспериментов культура продукции содержала сыворотку, а во втором эксперименте культура продукции не содержала сыворотку. Оба потока исходных материалов тестировали в присутствии 5% (масс./об.) PEG6000 или в отсутствие PEG. Потоки исходных материалов представляли процесс сбора и являлись осветленными культуральными супернатантами, которые пропускали через анионообменный фильтр и концентрировали в 20 раз путем фильтрации в тангенциальном потоке, как описано в настоящем документе. Колонки CFT типа I загружали путем перемешивания в ходе хроматографии 1:1 потока исходных материалов с боратным буфером при pH 9,0. Буфер содержал 0% или 10% (масс./об.) PEG6000 (до достижения конечной концентрации 5% (масс./об.) PEG6000). Как только колонки загружали, проскок собирали в серию фракций, которые анализировали на предмет продукта путем ПЦР DRP. Функциональную способность определяли как точку, в которой концентрация продукта в исходящем из колонки потоке достигала 1% от концентрации, введенной в колонку, после учета разбавления во время хроматографии. Для загрузок колонки, содержащих PEG, остальную часть процесса хроматографии запускали для оценки выхода вектора в элюированных фракциях.
Данные, представленные на фигре 3, демонстрируют, что добавление PEG6000 повышает способность апатитной смолы в отношении связывания вектора на основе rAAV-1 независимо от того, присутствует ли сыворотка в культуре продукции. Без намерения связать наблюдаемое с теорией, в супернатант после TFF в присутствии PEG rAAV-1 предпочтительно связывается с апатитной смолой по сравнению с другими технологическими примесями посредством анионного взаимодействия с составными группами фосфата, за которое может произойти конкуренция за счет присутствия фосфата в буфере для элюирования. Кроме того, связывание rAAV-1 с апатитной смолой далее отделяет его от технологических примесей за счет взаимодействия с металлами, за которое может произойти конкуренция в присутствии соли. Связывание rAAV-1 с составными группами фосфата не управляется, в первую очередь, гидрофобностью, поскольку буферы для захвата и элюирования формулируют так, чтобы они, главным образом, были ионными по природе (т.е. буфер для элюирования содержит 50 мМ фосфат, по сравнению с буферами для элюирования, содержащими 150 мМ и более фосфата, широко используемыми в композициях для элюирования при связывании главным образом за счет гидрофобных взаимодействий). При таких условиях с высоким содержанием соли, условия элюирования с низким содержанием фосфата, оставшийся хелперный вирус, ДНК клетки-хозяина и другие низкомолекулярные белки, содержащиеся в супернатанте культур продукции, если они присутствуют, будут оставаться на смоле. Неожиданно эти данные продемонстрировали, что в присутствии PEG6000 векторы на основе rAAV-1, продуцированные в содержащих сыворотку или бессывороточных средах характеризуются связывающей способностью в отношении апатитных смол, равной, по меньшей мере, от 1,2·1012 DRP/мл (загрузка 1 мл) до более 1,5·1014 DRP/мл смолы (150 мл). В отсутствии 5% (масс./об.) PEG6000 связывающая способность апатитной смолы в отношении сбора TFF составляла менее 2,4·1012 DRP/мл для векторов, продуцированных в содержащей сыворотку среде, и 7,2·1012 DRP/мл для векторов, продуцированных в бессывороточной среде, притом, что в элюате CFT не было получено векторов на основе rAAV-1.
Пример 7. Очистка rAAV-1 посредством хроматографии на апатите
Колонку CHT типа I заполняли 2 M NaCl и обеззараживали 1 M NaOH. Перед загрузкой уравновешивали 6 объемами колонки («CV») 20 мМ бората (pH 9)+5% (масс./об.) PEG6000. Концентрат потока исходных материалов после TFF загружали через 3 мм BioProcess Skid (GE Healthcare) на колонку CHT объемом 923 мл (диаметр 14 см × высота носителя 6 см), подготовленную, как описано ранее при скорости потока 96 см/ч. Концентрат потока исходных материалов после TFF смешивали в процессе хроматографии с равным объемом 40 мМ боратного буфера (pH 9)+10% (масс./об.) PEG6000 буфер с получением конечной концентрации 20 мМ бората (pH 9) + 5% (масс./об.) PEG6000.
Серию 4 последовательных промывок проводили для удаления технологических примесей при задержании вектора на основе rAAV-1 на колонке. Промывку 1 («вытеснение») проводили путем смешивания в процессе хроматографии 5 CV 50:50 (объем:объем) 20 мМ борат (pH 9,0)+5% (масс./об.) PEG6000: 40 мМ борат (pH 9,0)+10% (масс./об.) PEG6000 для вытеснения PEG6000 всех загруженных растворов. Далее обнаруживали, что данная стадия предпочтительно увеличивает аффинность связывания векторов на основе rAAV-1. Промывку 2 проводили 15 CV 150 мМ фосфата калия + 20 мМ бората (pH 9)+5% (масс./об.) PEG6000 для удаления большей части сывороточного альбумина и других низкомолекулярных белковых технологических примесей при задержании rAAV-1 на колонке. Промывку 3 («WII» на фигуре 5) проводили 15 CV 20 мМ бората (pH 9)+5% (масс./об.) PEG6000 для удаления любого оставшегося фосфата, так что rAAV-1 оставался связанным с колонкой, тогда как PEG6000 удаляли. Промывку 4 («WIII» на фигуре 5) проводили 5 CV 20 мМ буфера HEPES (pH 7,0)+150 мМ NaCl для удаления PEG6000 и для доведения концентрации соли, с обеспечением, таким образом, разделения rAAV-1 и любого оставшегося хелперного вируса или других технологических примесей, таких как белковые примеси, которые могут оставаться связанными с колонкой.
Вектор на основе rAAV-1 элюировали с колонки 6 CV 50 мМ фосфата калия + 20 мМ HEPES (pH 7,0)+150 мМ буфера NaCl. На фигуре 4 представлен типичный спектрофотометрический график оптической плотности UV при 280 нм (A280) и проводимость для хроматографической процедуры на CHT I. На фигуре 5 представлена относительная степень очистки векторов на основе rAAV, элюированных с апатитной смолы.
Удаление глюканов путем апатитной хроматографии
Глюканы представляют собой углеводы, сходные с целлюлозой, которые просачиваются в среду процесса с основанного на целлюлозе объемного фильтра, используемого для сбора частиц rAAV-1 из культур продукции. Глюканы при концентрациях выше ≈1 нг/мл могут препятствовать стандартным тестам на лизате амебоцитов Limulus («LAL») на загрязнение бактериальными эндотоксинами. Как продемонстрировано в таблице 4 ниже, колонка с апатитом CHT типа I удаляла ~2,5 порядка глюканов из культуры продукции. При буферных условиях, описываемых в настоящем документе, значительное большинство глюканов присутствовало в проскоке и не связывалось с колонкой.
|
Образцы анализировали на глюканы с использованием основанного на LAL кинетического хромогенного анализа, специфичного в отношении глюканов (Glucatell®, Cape Cod, MA).
Удаление хелперного вируса Ad5 посредством хроматографии на апатите
Для подтверждения того, что хроматография на CHT удаляет Ad5 из потока исходных материалов, предварительное исследование с введением внутреннего стандарта проводили с использованием потока исходных материалов из конечного предшествующего процесса. Уровни добавленного Ad5 устанавливали, основываясь на данных, полученных из исследования удаления вируса фазы I со смолами CFT II, и применяли три различных отношения загрузки потока исходных материалов: 6,6 мл; 13,5 мл; и 33 мл потока исходных материалов после TFF на мл смолы CHT.
Данные представлены в таблице 5, удаление Ad5 посредством CHT было сравнимо с удалением 4 LRV и продемонстрировало приблизительно удаление вируса Ad5 примерно на 4 порядка, и, как оказалось, не зависело от объема загруженного потока исходных материалов в пределах оцениваемых 5 порядков. Низкий выход Ad5 соответствует предшествующим данным, указывающим на то, что в используемых буферных условиях Ad5 связывается с апатитной смолой прочнее, чем rAAV-1.
|
Всего 8·109 инфекционных частиц Ad5 (т.е., общее число частиц с P:I ~10) вносили в различные объемы потока исходных материалов после TFF для запуска на колонках CHT объемом 1,2 мл. Хроматографию на колонках проводили при 100 см/ч, и собирали фракции для анализа DRP вектора и Ad5 путем анализа инфекционного титра. Применяли контролируемую внесением стандарта версию анализа инфекционности Ad5, поскольку высокие концентрации в образцах загрузки и элюирования с CHT, как известно, препятствуют проведению основанного на клетках анализа. Удаление Ad5 определяли как значение порядка снижения («LRV»), вычисляемое как логарифм общего количества загруженного Ad5, разделенного на общее количество Ad5, полученного во фракции элюирования (значение порядка снижения).
Пример 8. Инактивация оставшегося хелперного вируса нагреванием
Стадию инактивации нагреванием проводили для инактивации и удаления любого оставшегося хелперного вируса, присутствующего в элюате с CHT I. Для экспериментов в малом масштабе элюат CHT I разделяли между двумя бутылками PETG (Nalgene®) объемом 1 л, и добавляли MgCl2 до конечной концентрации 2 мМ, чтобы увеличить стабильность вектора на основе rAAV-1. Бутылки инкубировали на водяной бане при 53,5°C с перемешиванием, пока температура в бутылке не достигала приблизительно 52°C. Затем бутылки охлаждали путем переноса в водяную баню с температурой окружающей среды, и перемешивали, пока температура не достигала температуры на 5°C выше температуры окружающей среды. Обработанную нагреванием смесь фильтровали через 4-дюймовую фильтровальную мембрану Opticap® 0,22 мкМ (Millipore Opticap®, каталожный номер KVSC04HB3). Альтернативно, для экспериментов в большем масштабе элюат с CHT I инактивировали нагреванием в стерильном одноразовом биотехнологическом контейнере (контейнер Custom Hyclone объемом 5 л, пленка CX5-14) на качающейся платформе с контролем температуры, при установленной температуре 53°C, скорости качания 40 об/мин и угле смешивания 12° (поддон волнового нагревателя объемом 20 л). Элюат CHT I инкубировали на платформе до достижения температуры 52°C, а затем оставляли на дополнительные 10 мин. Для стабилизации rAAV-1 во время нагревания добавляли MgCl2 до конечной концентрации 2 мМ. После нагревания продукт фильтровали через фильтр с порами 0,2 мкм и инкубировали в течение ночи при температуре окружающей среды для минимизации возможных температурных эффектов в отношении применяемой впоследствии колонки с гидрофобным взаимодействием.
Пример 9. Захват rAAV-1 посредством хроматографии на основе гидрофобных взаимодействий («HIC»)
HIC представляет собой способ разделения биомолекул, основанный на отличиях в гидрофобности их поверхности. Как таковая, HIC считается способом, ортогональным по отношению к другим стадиям очистки rAAV-1 в процессе. Среды HIC содержат гидрофобные лиганды, такие как углеводороды с линейной цепью (например, пропил (C3), бутил (C4), гексил (C6), или октил (C8)) или ароматические углеводороды (например, фенил). В чистой воде гидрофобный эффект слишком слаб для функциональных взаимодействий между лигандом и белками, или между самими белками. Однако, лиотропные соли усиливают гидрофобные взаимодействия, и добавление таких солей направляет адсорбцию белков на среду HIC. По этой причине смолы HIC, как правило, загружают при высоких концентрациях солей, и элюируют с них при более низких концентрациях солей.
Хроматография HIC с буферами на основе сульфата аммония
В кратком изложении, колонку для HIC с бутилом объемом 170 мл (6 см диаметр × 6 см высота слоя носителя) (Toyopearl® Butyl 650M; Tosoh Biosciences, Montgomeryville, PA; каталожный номер 14702) обеззараживали несколькими объемами колонки 0,5 M NaOH и уравновешивали смесью 75:25 (объем:объем) 2 M сульфата аммония + 50 мМ Bis Tris (pH 7,0): 50 мМ Bis Tris (pH 7,0). Обработанный нагреванием элюат вектора на основе rAAV-1 с апатита загружали со скоростью 3,3 л/ч при смешивании в процессе хроматографии в отношении 75:25 (объем:объем) 2 M сульфат аммония + 50 мМ Bis Tris (pH 7,0): элюат rAAV-1 с апатита. Смешивание при хроматографии препятствует риску какого-либо осаждения вектора на основе rAAV-1 посредством сульфата аммония, присутствующего в буфере. Колонку отмывали одним или несколькими объемами колонки смеси 75: 25 (объем:объем) буфер 2 M сульфат аммония + 50 мМ Bis Tris (pH 7,0): буфер 50 мМ Bis Tris (pH=7,0)+10% пропиленгликоль (объем:объем) (EMD Biosciences). Пропиленгликоль в данном примере добавляли в буферы для сужения профиля элюирования по сравнению с широким профилем элюирования без пропиленгликоля, хотя в данном процессе это необязательно. Вектор на основе rAAV-1 элюировали с колонки буфером 800 мМ сульфат аммония + 50 мМ Bis Tris (pH 7,0)+4% пропиленгликоль. При используемых условиях элюирования любые оставшиеся хелперные вирусы и белки, присутствующие в растворе загрузки, останутся связанными с колонкой.
Множество способов получения rAAV-1 требует жесткой дезинфекции перед утилизацией вследствие того, что продуктом является вирусный вектор, и из-за применения при продукции живого аденовируса типа 5 (Ad5) в качестве хелперного вируса. Жидкие отходы от хроматографических операций, как правило, вначале дезинфицируют хлорной известью в месте использования, а затем подвергают дальнейшей дезинфекции путем инкубации при высоком рН перед нейтрализацией и утилизацией. Сульфат аммония, присутствующий в буферах HIC, взаимодействует с хлорной известью и гидроксидом натрия с высвобождением опасных газов хлора и аммиака, соответственно. Таким образом, исходное соображение для оптимизации стадии хроматографии HIC представляло собой разработку подходящей буферной системы, которую можно безопасно дезинфицировать известными в данной области способами.
Скрининг на предмет подходящих буферов для связывания rAAV-1 с колонкой HIC
Вектора на основе rAAV-1 загружали на колонки в ряде различных буферных условий, и определяли относительную эффективность связывания путем измерения количества вектора rAAV-1, присутствующего во фракции проскока (таблица 6). Оцениваемые буферы включали высокие концентрации лиотропных солей, традиционно используемых с хроматографическими процессами HIC и несколько буферов с низким pH, в которых может потенциально происходить взаимодействие в смешанном режиме (HIC/катионный обмен). Обе смолы Tosoh Butyl 650M и EMD Phenyl связывали векторы в некоторых из альтернативных буферов.
Буферы с высокой концентрацией соли, используемые в хроматографии на основе гидрофобных взаимодействий следует далее подвергать скринингу на предмет вязкости, которая может приводить к высоким значениям обратного фильтрационного давления, способным ограничить скорости потока или вызывать проблемы перемешивания, повышая тем самым риск осаждения продукта за счет кристаллизации соли в буферах, происходящей при температурах, которые могут использоваться для хранения или функционирования. Основываясь на данных, приведенных ниже в таблице 6, и после рассмотрения описанных выше факторов в качестве оптимального буфера для связывания векторов на основе rAAV-1 с хроматографической смолой HIC выбирали 1 M цитрат натрия, pH 7,0.
|
Эксперименты проводили при температуре окружающей среды на колонках Tricorn 5/50 (высота слоя носителя 6 см, объем колонки 1,2 мл) с использованием очищенного rAAV-1. Колонки уравновешивали перечисленными буферами, и ≈2·1011 DRP или rAAV-1 загружали на колонку. rAAV-1 элюировали в линейном градиенте объемом 20 CV от 145 мМ Bis Tris (pH 7,0), 10% (об./об.) пропиленгликоля. Проскок собирали и анализировали путем теста DRP для фракции rAAV-1, нанесенной на колонку, которая промывалась и не связывалась.
Дальнейшую характеристику осуществляли, исследуя удаление технологических примесей на колонке HIC в различных буферах, которые продемонстрировали хорошее связывание rAAV-1 в предшествующем эксперименте. Данные, приведенные ниже в таблице 7 для связывания модельных примесей, демонстрируют, что аденовирус и ДНК, если они присутствуют в потоке исходных материалов, эффективно разделяются на стадии хроматографии HIC.
|
Эксперименты проводили при температуре окружающей среды на колонках Tricorn 5/50 (высота слоя носителя 6 см, объем колонки 1,2 мл). Колонки уравновешивали перечисленными буферами, и указанные образцы загружали на колонку. Каждый образец элюировали в линейном градиенте объемом 20 CV. Образцы собирали и анализировали на предмет имеющего отношения к ним загруженного материала.
Хроматография HIC с буферами на основе цитрата натрия
Обработанный нагреванием элюат вектора на основе rAAV-1 с апатита затем загружали на бутиловую колонку для HIC для дальнейшего снижения уровня оставшихся технологических примесей и в качестве стадии концентрирования и обессоливания. Бутиловую колонку (6 см в диаметре × 8,9 см высота слоя носителя) для HIC объемом 373 мл (Tosoh Biosciences Toyopearl® Butyl 650M, каталожный номер 14702) обеззараживали несколькими различными объемами колонки 0,5 M NaOH и уравновешивали 5 CV смеси 75:25 (объем:объем) 1 M цитрат + 20 мМ фосфат натрия: 20 мМ фосфат натрия. Обработанный нагреванием элюат вектора на основе rAAV-1 с CHT I загружали на скорости 106 см/ч при смешивании в процессе хроматографии в отношении 75:25 (объем:объем) 1 M цитрат + 20 мМ фосфат натрия: элюат CHT I. Смешивание при хроматографии препятствует риску какого-либо осаждения вектора на основе rAAV-1 посредством сульфата аммония, присутствующего в буфере. Колонку отмывали 5 CV смеси буферов 75:25 (объем:объем) 1 M цитрат + 20 мМ фосфат натрия: 20 мМ фосфат натрия. Вектор на основе rAAV-1 элюировали с колонки с 6 CV 0,35 M цитрат + 20 мМ фосфат натрия. Колонку затем отмывали 3,5 CV 20 мМ натрий-фосфатного буфера. При данной промывке с низкой концентрацией соли (20 мМ натрий) элюируется фракция частиц вектора на основе rAAV-1, которая отличается по гидрофобности своего профиля элюции от частиц вектора на основе rAAV-1, которые элюируются в буфере с более высокой концентрацией соли. Фактически, если фракцию, элюированную низкой концентрацией соли, выделяли и заново наносили на колонку HIC при описанных условиях, эта популяция вектора также элюировалась только во фракции с низким уровнем соли, указывая на то, что данная фракция не является результатом прорыва емкости колонки. Анализ инфекционности позволяет предположить, что данная фракция rAAV-1, вероятно, представляет собой популяцию, содержащую пустые капсиды, частично денатурированные капсиды, менее инфекционный капсидный материал и частично полные капсиды. Таким образом, это наблюдение может привести к улучшениям, состоящим в отделении частиц rAAV-1, которые являются менее инфекционными и, таким образом, в меньшей степени требуются в качестве материала продукта. В использованных условиях элюирования любые хелперные вирусы и белки, присутствующие в загружаемом растворе, будут оставаться связанными с колонкой и, таким образом, должны присутствовать в полосе с низким уровнем соли.
Пример 10. Обмен буфера путем гель-фильтрации («SEC»)
Обмен буфера путем гель-фильтрации предоставляет дополнительное удаление белков, по размерам способных проходить через поры в смолах, и является относительно быстрым по времени, необходимому для обмена буферов. Обмен буфера, проводимый на данной стадии, должен гарантировать, что элюат HIC с предыдущей стадии сменил буфера на подходящий для связывания rAAV-1 в конечной стадии процесса, анионообменной хроматографии. 3,2 л (диаметр 14 см × высота слоя носителя 21 см) смолы Amersham Superdex® марки 200 prep (Amersham/GE Healthcare, Piscataway, NJ; каталожный номер 17-1043-04) упаковывали и подготавливали путем обеззараживания 2 M NaCl + 1 M NaOH, и уравновешивали 2,8 CV 20 мМ NaCl + 20 мМ Tris (pH 8,0). Элюат после HIC подразделяли для обработки путем SEC в виде трех последовательных циклов приблизительно по 400 мл в каждом, с загрузкой не более чем на 12,5% от объема колонки SEC для каждого цикла. Пики продукта (содержащиеся в объемах пустот) от трех циклов SEC собирали в один биотехнологический контейнер. Элюат после HIC наносили на колонку при скорости потока 49 см/ч. Из колонки вытесняли предшествующий растворитель и промывали ее 1,4 CV 20 мМ NaCl + 20 мМ Tris (pH 8,0), и вектор на основе rAAV-1, присутствовавший в элюате после HIC, находился в объеме пустот колонки. После сбора объема пустот, как описано, загружали вторую и третью фракции, и собирали с той же колонки последовательно, как описано ранее для первой фракции.
Пример 11. Дополнительный агент (удаление вирусов)
В качестве необязательного процесса удаления дополнительных вирусов, которые могут присутствовать в виде следовых примесей и, таким образом, вносить вклад в разумный с коммерческой точки зрения ортогональный процесс, в процесс вводят фильтр для удаления вирусов. Примеры таких фильтров известны в данной области и включают в себя Millipore Viresolve® NFR (50 нм), Pall Ultipore® VF (50 нм) и Asahi 70 нм. Фильтр для удаления вирусов Millipore Viresolve® NFR (фильтр Millipore 4" Virosolve NFR, каталожный номер KZRV 04T C3) подготавливали по инструкции производителя, ополаскивали 20 мМ NaCl + 20 мМ Tris (pH 8,0) и элюат после SEC фильтровали через мембрану. Фильтр ополаскивали несколькими объемами 20 мМ NaCl + 20 мМ Tris-HCl (pH 8,0) и объединяли этот раствор с отфильтрованным элюатом после SEC.
Пример 12. Анионообменная хроматография
Вторую стадию анионообменного захвата вектора на основе rAAV-1 вектор проводили в качестве конечной стадии концентрирования и и доведения до готовности на смоле Unosphere® Q (Biorad, Hercules, CA). Колонку объемом 373 мл (диаметр 8,9 см × высота носителя 6 см) обеззараживали несколькими объемами колонки 0,5 M NaOH и уравновешивали 7 CV 20 мМ NaCl + буфера 20 мМ Tris (pH 8,0). Фракцию объема пустот SEC или необязательно отфильтрованный от вирусов элюат загружали на скорости 309 см/ч. Колонку отмывали 10 CV 60 мМ NaCl. Ионную силу раствора для промывки выбирали для удержания rAAV-1 связанным со смолой, смывая при этом другие технологические примеси, такие как глюканы, которые могут быть внесены за счет утечки из различных фильтров, используемых в стадиях очистки. Вектор на основе rAAV-1 с колонки 6 CV 130 мМ NaCl. Ионная сила солевого элюата с 130 мМ NaCl смывает rAAV-1 с колонки, тогда как любые оставшиеся следовые технологические примеси, такие как сывороточный альбумин или хелперный вирус останутся связанными.
На фигуре 6 путем SDS-PAGE сравнивается степень очистки после различных стадий процесса. Связанные с процессом образцы из репрезентативного сбора культуры продукции разделяли на денатурирующем/восстанавливающем 10% полиакриламидном геле и окрашивали Sypro оранжевым. Все образцы после сбора загружали при 1·1010 DRP/дорожку. Два образца с ранних стадий, полученных перед стадией концентрирования путем TFF (стадия начального осветления и анионообменного («AEX») проскока) могли быть загружены только при 1·109 DRP/дорожку вследствие объемных ограничений геля. Бета-галактозидазу (B-Gal) загружали в количестве 50 нг/дорожку для оценки чувствительности и однородности окрашивания по гелю. Указаны три белка капсида AAV1 (VP1, 2 и 3).
Пример 13. Процентный выход rAAV во время очистки
Данные, показанные на фигуре 7, представляют процентный выход инфекционных частиц rAAV после каждой стадии процесса по схеме очистки из репрезентативной культуры продукции вектора на основе rAAV-1. Процентный выход рассчитывали на основе общего числа DRP вектора на основе rAAV-1, полученного на каждой стадии процесса, разделенного на общее число загруженных или подвергнутых данной стадии очистки DRP. Данные демонстрируют, что на каждой стадии процесса очистки достигался выход приблизительно равный 60% или выше. В многочисленных экспериментах интервал выхода от каждой стадии процесса составлял, по меньшей мере, от 60% до 90%. Особенно примечательно, что интервал выхода на стадии захвата (т.е., на стадии хроматографии на апатите) в отдельных экспериментах менялся от 57% более чем до 90%. Кроме того, интервал выхода стадии HIC изменялся от 60% до 80%.
Хотя приведенное выше изобретение описано в некоторых подробностях путем иллюстрации и примера для целей ясности понимания, специалистам в данной области понятно, что будут применяться некоторые мелкие изменения и модификации. Таким образом, описание и примеры не должны быть предназначены для ограничения объема изобретения.