Результат интеллектуальной деятельности: ИНЪЕЦИРУЕМАЯ КОНСЕРВИРУЮЩАЯ СРЕДА ДЛЯ КОНСЕРВАЦИИ КЛЕТОК ПЛАЦЕНТАРНОЙ КРОВИ, КОСТНОГО МОЗГА И ПЕРИФЕРИЧЕСКОЙ КРОВИ
Вид РИД
Изобретение
Область изобретения
Настоящее изобретение относится к области медицины, в частности, к средам для консервации клеток плацентарной крови, костного мозга и периферической крови.
Предшествующий уровень техники
Стволовые клетки плацентарной крови создают альтернативу по отношению к трансплантату костного мозга. Больные, не имеющие совместимого родственного донора или зарегистрированного в национальной картотеке донора костного мозга, могут теперь пользоваться трансплантатом из одной или нескольких единиц плацентарной крови. Польза такой альтернативы обусловлена тем, что такие клетки позволяют избавиться от необходимости наличия очень высокой степени совместимости антигена главного локуса (HLA) больного с клетками трансплантата.
Между этапами взятия плацентарной крови и их замораживания действующими рекомендациями предписывается срок, составляющий только 24 часа, так как жизнеспособность и функциональность стволовых клеток и клеток-предшественников снижаются при 4°С. Удлинение этого срока позволило бы отбирать плацентарную кровь в выходные дни, а также удлинить расстояние между местом взятия крови и местом её хранения.
Кроме того за последние 15 лет разработана амплификация ex vivo клеток CD34+, в частности, клеток плацентарной крови (Duchez и др. 2003, J. Hematother Stem Cell Res, 12, 587-9; Duchez и др. 2012, Cell Transplant, 21, 2517-21; Ivanovic и др., 2004, Stem Cells, 22, 716-24; Ivanovic и др., 2006, Transfusion, 46, 126-31; Ivanovic и др. 2011, Cell Transplant, 20, 1453-63; Polini и др., 1997, hematol Cell Ther, 39, 49-58; Boiron и др., 2006, Transfusion, 46, 1934-42; Milpied и др., 2009, ASH Meeting abstracts, Blood, 114, Abst 502, p 207). Амплификация позволяет получать гемопоэтические трансплантаты, обеспечивающие два преимущества: поддержание потенциала трансплантата в течение длительного времени и сокращение периода аплазии после кондиционирования.
Клиническая фаза протокола GRAPA (гомотрансплантация усиленных клеток-предшественников) об экспансии ex vivo клеток CD34+ плацентарной крови показала терапевтический эффект этой технологии, позволяющей регенерировать на длительный срок костномозговые клетки при сокращении длительности периода аплазии после трансплантации (Milpied и др., см. выше).
Однако для приготовления трансплантатов клетки, содержащиеся в консервирующей среде или в не инъецируемой культуре, промывают и повторно суспендируют в 4%-ом растворе человеческого альбумина для инъекции больным через 6 часов, что, однако, допускает перевозку только на короткое расстояние (менее 50 км). Более длительные периоды сопряжены со значительной потерей функциональности используемых клеток-предшественников и гемопоэтических стволовых клеток (Duchez и др., 2013, Cell Transplant, 22, 1501-6).
Исследования показали возможность надёжного сохранения клеток после культивирования в течение 48 часов при +4°С в консервирующей среде (среда НР02 фирмы Macopharma), не инъецируемой человеку (Duchez и др., см. выше). Насколько известно авторам изобретения, эта среда является единственной известной в настоящее время средой с такими свойствами. Однако эта среда не может быть инъецирована, и перед трансплантацией требуется промывание.
Большая часть растворов для консервации клеток человека или органов не являются инъецируемыми, поскольку в них содержатся не внесённые в фармакопею вещества. Последние не внесены, так как они не обладают терапевтическим эффектом, не интересуют фармацевтических поставщиков и кроме того являются токсичными для пациентов. Так, например, без претензии на полноту изложения, в этих средах содержатся полиэтиленгликоль, Тролокс (6-гидрокси-2,5,7,8-тетраметилхроман-2-карбоксиловая кислота), эриторбат натрия, глютатион, пероксиддисмутаза, каталаза, полиозид, выбранный из лактобионата, сахарозы, раффинозы и трегалозы, фосфатный буферный раствор (в частности, Na2PO4, K2PO4, NaHPO4 или KHPO4), буферный раствор HEPES и кетоглютарат.
Создание районных, национальных, тем более международных компетентных центров для такого вида продукции и/или хранения клеток делает необходимой возможность транспортировки на большие расстояния внутри Европы и даже на других континентах полностью сохраняющихся трансплантатов и их инъекции без необходимости их промывания. Действительно, промывание сопряжено с относительно длительными манипуляциями, требующими наличие оборудования и квалифицированного персонала.
При таких условиях необходимо располагать инъецируемой консервирующей средой.
Краткое изложение сущности изобретения
Настоящее изобретение позволяет получить консервирующий раствор, являющийся инъецируемым и обладающий положительными качествами консервации клеток и их функциональности, по меньшей мере, на протяжении 48 часов.
Таким образом, изобретение относится к инъецируемому раствору для консервации клеток плацентарной крови, костного мозга или периферической крови, причём раствор содержит физиологический раствор хлорида натрия, хлорида калия, сульфата магния, бикарбоната натрия, витамина Е и/или А и человеческого альбумина. Предпочтительно он содержит, по меньшей мере, 5 г/л человеческого альбумина и, по меньшей мере, 0,0000255 г/л витамина Е и/или, по меньшей мере, 0,0000026 г/л витамина А.
Факультативно в растворе могут дополнительно содержаться лактат и витамин С. Согласно этому варианту выполнения в нём содержится, по меньшей мере, 0,0003125 г/л витамина С.
Также раствор может дополнительно содержать один или несколько элементов, выбранных из аминокислот, в том числе глютамина, глюкозы, маннита и лимонной кислоты.
Согласно предпочтительному варианту выполнения инъецируемый раствор содержит или состоит преимущественно из физиологического раствора хлорида натрия, человеческого альбумина, витаминов Е, С и А, аминокислот, в том числе глютамина, ионов калия и магния, глюкозы, маннита, лактата, бикарбоната натрия и лимонной кислоты.
Также настоящее изобретение относится к набору, содержащему инъецируемый консервирующий раствор согласно изобретению и стерильный контейнер для размещения клеток плацентарной крови, костного мозга и периферической крови.
Кроме того изобретение относится к стерильному контейнеру для размещения клеток плацентарной крови, костного мозга и периферической крови, содержащему инъецируемый консервирующий раствор согласно изобретению. При необходимости контейнер может дополнительно содержать клетки плацентарной крови, костного мозга и периферической крови. Предпочтительно клетки содержат клетки CD34+.
Настоящее изобретение относится к применению инъецируемого раствора согласно изобретению, набора согласно изобретению или контейнера согласно изобретению для хранения клеток плацентарной крови, костного мозга и периферической крови предпочтительно при умеренной гипотермии, в частности, при 4°С. Предпочтительно клетки содержат клетки CD34+.
Наконец настоящее изобретение относится к способу консервации клеток плацентарной крови, костного мозга и периферической крови, предусматривающему приведение в контакт клеток плацентарной крови, костного мозга и периферической крови с инъецируемым раствором согласно настоящему изобретению. Предпочтительно клетки содержат клетки CD34+.
Подробное описание изобретения
Следовательно, настоящее изобретение относится к раствору для консервации клеток плацентарной крови, костного мозга и периферической крови, причём этот консервирующий раствор является инъецируемым. Клетки плацентарной крови, костного мозга и периферической крови могут быть нативными (после их отбора), размороженными или размноженными ex vivo. Таким образом, под «инъецируемым раствором для консервации клеток плацентарной крови, костного мозга и периферической крови» понимается раствор для инъекции и консервации названных клеток.
Под понятием «инъецируемый» подразумевается согласно настоящей заявке то, что консервирующий раствор предназначен для инъекции (например, внутривенной, внутримышечной, подкожной и пр.) человеку без предварительного промывания клеток. Следовательно, в растворе содержатся только допущенные и официально признанные элементы в качестве «инъецируемых» ведомствами, выдающими разрешение на медикаменты, такими, как Управление по контролю за продуктами и лекарствами (FDA), Европейское агентство по медикаментам (ЕМА) или Национальное агентство по лекарственной безопасности и продуктам для поддержания здоровья (ANSM). Таким образом, в нём не содержится никакого не инъецируемого, не допущенного или официально утверждённого элемента ведомствами по выдаче разрешений на медикаменты, например, Управлением по контролю за продуктами и лекарствами, Европейским агентством по медикаментам (ЕМА) или Национальным агентством по лекарственной безопасности и продуктам для поддержания здоровья (ANSM). В частности, можно обратиться к справочнику VIDAL® (издания 2015 года) для выяснения, утверждён или допущен ли элемент в качестве «инъецируемого».
Эталонной средой, используемой для приготовления инъецируемого консервирующего раствора согласно настоящему изобретению, служит среда НР02 фирмы Maco Pharma (называемая также МС01). Состав этой среды секретный. Однако в заявке на изобретение WO 2014/057220 описаны образующие её элементы (стр. 13, строка 25; стр. 14, строка 4). Эта среда является, несомненно, не инъецируемой. В частности, в ней содержатся буфер HEPES и пируват натрия, оба они официально не утверждены в качестве инъецируемых.
Консервирующая среда согласно настоящему изобретению обладает эффективностью консервации, эквивалентной эталонной среде НР02, но является совершенно инъецируемой. В частности, она обеспечивает консервацию в течение, по меньшей мере, 48 часов при 4°С и даже 72 часов, поддерживая жизнеспособность и функциональность стволовых клеток и клеток-предшественников, совместимых с терапевтическим применением.
Консервирующий раствор согласно настоящему изобретению содержит физиологический раствор (в частности, из хлорида натрия), человеческий альбумин и витамин Е. В качестве альтернативы консервирующий раствор согласно настоящему изобретению содержит физиологический раствор (в частности, из хлорида натрия), человеческий альбумин и витамин А, причём последний играет схожую с витамином Е роль.
Человеческий альбумин играет важную роль, обеспечивая стабилизацию среды, в частности, в условиях ускоренного старения при 37°С. Человеческий альбумин предлагается в торговле в инъецируемой форме, в частности, фирмой Baxter или под названиями Albunorm®, Flexbumin®, Vialebex® или Ydralbum®. В растворе содержится, по меньшей мере, 1 г/л альбумина, предпочтительно, по меньшей мере, 5, 10 или 15 г/л. Содержание человеческого альбумина в растворе может составлять от 1 до 100 г/л раствора, предпочтительно от 5 до 40 г/л раствора, более предпочтительно от 5 до 20 г/л, особо предпочтительно 15 г/л раствора. Другими словами, в растворе содержится от 0,1 до 10% человеческого альбумина, предпочтительно от 0,5 до 4%, более предпочтительно от 0,5 до 2%, особо предпочтительно 1,5%.
Также в растворе содержится витамин Е или витамин А. Предпочтительно в растворе содержится, по меньшей мере, витамин Е. Совершенно неожиданно авторы изобретения открыли, что витамин Е (альфа-токоферол) оказывает очень сильное влияние на сохранность клеток, в частности, на их функциональность. Авторы изобретения даже установили, что витамин Е является элементом, оказывающим наибольшее влияние. В растворе содержится, по меньшей мере, 0,0000255 г/л витамина Е. В частности, содержание витамина Е в растворе может составлять от 0,0001 до 0,01 г/л раствора, предпочтительно от 0,001 до 0,006 г/л раствора, особо предпочтительно 0,004 г/л раствора. Этот продукт присутствует в торговле в инъецируемой форме, в частности, предлагается фирмой Nepalm.
Предпочтительно в растворе дополнительно содержится витамин С. Тогда его содержание в растворе составляет, по меньшей мере, 0,000312 г/л. Содержание витамина С в растворе составляет от 0,0005 до 0,15 г/л раствора, предпочтительно от 0,001 до 0,1 г/л раствора, особо предпочтительно 0,05 г/л раствора. Данный продукт предлагается в торговле в инъецируемой форме, в частности, в виде витамина С Aguettant.
Предпочтительно раствор дополнительно содержит витамин А. Его количество в растворе составляет, по меньшей мере, 0,0000026 г/л. Содержание витамина А в растворе составляет от 0,0001 до 0,001 г/л раствора, предпочтительно от 0,0002 до 0,0008 г/л раствора, особо предпочтительно 0,0004 г/л раствора. Данный продукт предлагается в торговле в инъецируемой форме, в частности, фирмой Nepalm.
Согласно частному варианту выполнения в растворе содержатся витамины Е и С, витамины Е и А или витамины Е, С и А. В частности, витамины могут быть привнесены в раствор согласно изобретению путём добавки витаминной смеси, имеющейся в торговле и пригодной к инъекции. Например, но эти сведения не являются исчерпывающими, витаминной смесью могут служить Cervenit® фирмы Baxter, в которой содержатся пальмитат ретинола, холекальциферол, альфа-токоферол, аскорбиновая кислота, тиамин, рибофлавин, пиридоксин, цианокобаламин, фолиевая кислота, пантотеновая кислота, биотин и никотинамид; или Vitalipide® фирмы Fresenius Kabi, где содержатся пальмитат ретинола, альфа-токоферол, витамин D2 и витамин К1.
Физиологический раствор традиционно представляет собой раствор хлорида натрия, в частности, с концентрацией 0,9 %. Он присутствует в растворе в физиологически приемлемых количествах. Предпочтительно хлорид натрия может содержаться в количестве от 5 до 7 г/л, предпочтительно его содержание составляет около 6 г/л.
Предпочтительно раствор согласно изобретении дополнительно содержит ионы калия (К+) и магния (Mg2+), предпочтительно в физиологически приемлемом количестве. В частности, в растворе содержится хлорид калия, предпочтительно в физиологически приемлемом количестве (т. е. в количестве около 0,33 г/л). В нём содержится также сульфат магния, предпочтительно в количестве от 0,01 до 3 г/л, более предпочтительно от 0,05 до 2,4 г/л, в частности, около 0,1 г/л. Также раствор может дополнительно содержать ионы кальция.
В консервирующем растворе согласно изобретению может дополнительно содержаться бикарбонат натрия. Предпочтительно он содержится в растворе в количестве от 0,1 до 4,5 г/л, более предпочтительно от 0,25 до 4,15 г/л, в частности, в количестве около 0,52 г/л. Этот продукт присутствует в торговле в инъецируемой форме.
Консервирующий раствор согласно изобретению может дополнительно содержать лактат, в частности, лактат Ringer. Данный продукт имеется в торговле в инъецируемой форме, в частности, предлагается фирмами Macopharma, Fresenius Kabi или Baxter. Лактат Ringer содержится в растворе в таком количестве, что количество лактата натрия составляет от 0,1 до 3 г/л, предпочтительно от 0,2 до 2,7 г/л, в частности, около 0,7 г/л.
Консервирующий раствор согласно изобретению может дополнительно содержать лимонную кислоту, в частности, ACD A (лимонная кислота, цитрат, декстроза, раствор А).
Предпочтительно в растворе согласно изобретению дополнительно содержатся аминокислоты. Последние могут присутствовать в количествах от 1 до 4 г/л, предпочтительно от 1,3 до 3,3 г/л, в частности, в количестве 2 г/л. В торговле присутствует несколько смесей из аминокислот в инъецируемой форме, например, Vaminolact® фирмы Fresenius Kabi. В отношении аминокислот интересно отметить, что раствор содержит глютамин, в частности, в количестве от 0,2 до 0,8 г/л, предпочтительно от 0,3 до 0,7 г/л, в частности, около 0,7 г/л. Введение глютамина может производиться посредством содержащихся в торговле продуктов, предназначенных для инъекций, таких, как, Dipeptiven® фирмы Fresenius Kabi.
Консервирующий раствор согласно изобретению может кроме того содержать глюкозу. Традиционно она применяется в количестве около 1 г/л.
Консервирующий раствор согласно изобретению может дополнительно содержать маннит. Например, маннит может содержаться в количестве от 1 до 25 г/л, предпочтительно от 5 до 20 г/л, частности, в количестве около 5 г/л.
Следовательно, согласно альтернативным вариантам выполнения инъецируемый консервирующий раствор согласно изобретению может преимущественно содержать или состоять из:
- физиологического раствора из хлорида натрия, хлорида калия, сульфата магния, бикарбоната натрия, человеческого альбумина и витамина Е,
- физиологического раствора из хлорида натрия, хлорида калия, сульфата магния, бикарбоната натрия, человеческого альбумина и витамина А,
- физиологического раствора из хлорида натрия, хлорида калия, сульфата магния, бикарбоната натрия, человеческого альбумина и витаминов Е и С,
- физиологического раствора из хлорида натрия, хлорида калия, сульфата магния, бикарбоната натрия, человеческого альбумина и витаминов А и С,
- физиологического раствора из хлорида натрия, хлорида калия, сульфата магния, бикарбоната натрия, человеческого альбумина и витаминов Е и А,
- физиологического раствора из хлорида натрия, хлорида калия, сульфата магния, бикарбоната натрия, человеческого альбумина и витаминов Е, С и А,
- физиологического раствора из хлорида натрия, хлорида калия, сульфата магния, бикарбоната натрия, человеческого альбумина, витаминов Е и одного или нескольких компонентов, выбранных из группы, состоящей из лактата, аминокислот, в том числе глютамина, глюкозы, маннита, и лимонной кислоты,
- физиологического раствора из хлорида натрия, хлорида калия, сульфата магния, бикарбоната натрия, человеческого альбумина, витамина А и одного или нескольких компонентов, выбранных из группы, состоящей из лактата, аминокислот, в том числе глютамина, глюкозы, маннита, и лимонной кислоты,
- физиологического раствора из хлорида натрия, хлорида калия, сульфата магния, бикарбоната натрия, человеческого альбумина, витаминов Е и С и одного или нескольких компонентов, выбранных из группы, состоящей из лактата, аминокислот, в том числе глютамина, глюкозы, маннита, и лимонной кислоты,
- физиологического раствора из хлорида натрия, хлорида калия, сульфата магния, бикарбоната натрия, человеческого альбумина, витаминов А и С и одного или нескольких компонентов, выбранных из группы, состоящей из лактата, аминокислот, в том числе глютамина, глюкозы, маннита, и лимонной кислоты,
- физиологического раствора из хлорида натрия, хлорида калия, сульфата магния, бикарбоната натрия, человеческого альбумина, витаминов Е и А и одного или нескольких компонентов, выбранных из группы, состоящей из лактата, аминокислот, в том числе глютамина, глюкозы, маннита, и лимонной кислоты,
- физиологического раствора из хлорида натрия, хлорида калия, сульфата магния, бикарбоната натрия, человеческого альбумина, витаминов Е, С и А и одного или нескольких компонентов, выбранных из группы, состоящей из лактата, аминокислот, в том числе глютамина, глюкозы, маннита, и лимонной кислоты.
Предпочтительно каждый компонент содержится в количествах, приведённых в нижеследующей таблице.
Таблица 1
|
Под выражением «состоит преимущественно из» подразумевается, что в растворе могут содержаться компоненты иные, нежели перечисленные, но в количествах менее 10 вес.%, предпочтительно менее 5, 4, 3, 2 или 1%. Подразумевается, что иные компоненты приемлемы для инъекции.
Согласно особо предпочтительному варианту выполнения консервирующий раствор согласно изобретению содержит человеческий альбумин, аминокислоты, хлорид калия, глюкозу, глютамин, сульфат магния, витамины Е, С и А, маннит, лактат, предпочтительно лактат Ringer, хлорид натрия, бикарбонат натрия и лимонную кислоту, в частности, в виде ACD A (лимонная кислота, цитрат, декстроза, раствор А).
Под выражением «около» понимается, что более или менее 10%, предпочтительно более или менее 5%. Например, около 10% означает от 9 до 11, предпочтительно от 9,5 до 10,5.
Таким образом, в консервирующей среде согласно изобретении, предназначенной для инъекций, не содержится элементов, не разрешённых к применению ведомствами, выдающими разрешение на медикаменты, такими, как Управление по контролю за продуктами и лекарствами (FDA), Европейское агентство по медикаментам (ЕМА) или Национальное агентство по лекарственной безопасности и продуктам для поддержания здоровья (ANSM). В частности, консервирующий раствор согласно изобретению не содержит один или нескольких элементов, выбранных из группы, состоящей из полиэтиленгликоля, Тролокса (6-гидрокси-2,5,7,8-тетраметилхроман-2- карбоновая кислота), эриторбата натрия, глютатиона, пероксиддисмутазы, каталазы, полиоза, выбранного, в частности, из лактобионата, сахарозы, раффинозы и трегалозы, фосфатного буфера (в частности, Na2PO4, K2PO4, NaHPO4 или KHPO4) и цетоглютарата. Согласно предпочтительному варианту выполнения в растворе не содержатся элементы из приведённого перечня. Согласно предпочтительному варианту выполнения инъецируемый консервирующий раствор согласно изобретению не содержит фенолового красного, глюконата железа, человеческого инсулина и/или нуклеозидов. Согласно предпочтительном варианту выполнения консервирующая среда по изобретению не содержит в себе соединения ванадия, такие, как оксованадий, бис (мальтолато) оксованадий и ортованадий.
Настоящее изобретение относится к применению инъецируемого консервирующего раствора согласно изобретению для консервации клеток плацентарной крови, костного мозга и периферической крови, в частности клеток CD34+.
Также настоящее изобретение относится к набору, содержащему инъецируемый консервирующий раствор согласно изобретению и стерильный контейнер для размещения в нём клеток плацентарной крови, костного мозга и периферической крови, в частности, клеток CD34+. Оно относится также к стерильному контейнеру для размещения клеток плацентарной крови, костного мозга и периферической крови, содержащему инъецируемый консервирующий раствор согласно изобретению. Наконец изобретение относится к применению набора или контейнера, содержащему инъецируемый консервирующий раствор согласно изобретению для консервации клеток плацентарной крови, костного мозга и периферической крови, в частности клеток CD34+.
Стерильный контейнер выполнен из воздухонепроницаемой плёнки и/или размещён в упаковке из воздухонепроницаемой плёнки. Воздухонепроницаемая плёнка представляет собой плёнку, являющуюся непроницаемой для кислорода или для кислорода и двуокиси углерода. Плёнка может быть выполнена из ПВХ. В качестве альтернативы она может содержать сополимер этилен-винилового спирта (EVOН), сополимер винилиденхлорида, поливиниловый спирт, полиакрилнитрил, сополимер этиленвинилацетата (EVA) или полиамид. Согласно предпочтительному варианту выполнения контейнер выполнен из плёнки, содержащей этиленвинилацетат или ПВХ. В частности, воздухонепроницаемая плёнка обладает многослойной структурой, например, трёхслойной, центральный слой которой выполнен из воздухонепроницаемого материала. Центральный слой располагается, в форме сэндвича, между двумя слоями из другого материала, такого, как полиолефин, в частности, полиэтилен, полипропилен или сополимер этиленолефина. Например, плёнка является трёхслойной и выполнена из винилэтиленацетата/этилен-винилового спирта/винилэтиленацетата.
Также настоящее изобретение относится к способу консервации клеток плацентарной крови, костного мозга и периферической крови, включающему в себя приведение в контакт названных клеток с инъецируемым консервирующим раствором согласно изобретению. Предпочтительно такие клетки содержат клетки CD34+. Также изобретение относится к способу консервации клеток CD34+, включающему в себя приведение в контакт клеток с инъецируемым консервирующим раствором согласно изобретению.
Предпочтительно, консервирующий раствор приводится в контакт с клетками при объёмном соотношении от 1 : 0,5 до 1 : 2. Такое соотношение является подходящим, в частности, при отборах плацентарной крови, костного мозга и периферической крови. Напротив, что касается моноядерных клеток, свежих или размороженных клеток СВ34+, в частности, клеток, отобранных из проб плацентарной крови, костного мозга и периферической крови, а также клеток, полученных после амплификации ex vivo, то они суспендируются в консервирующем растворе при разных концентрациях клеток согласно протоколам и необходимости.
Предпочтительно клетки хранятся при температуре от 0 до 10°С, более предпочтительно при около 4°С.
Также настоящее изобретение относится к стерильному контейнеру для размещения клеток плацентарной крови, костного мозга и периферической крови, содержащему инъецируемый консервирующий раствор согласно изобретению и клетки плацентарной крови, костного мозга и периферической крови. Предпочтительно эти клетки содержат клетки CD34+. Также изобретение относится к стерильному контейнеру для размещения клеток CD34+, содержащему инъецируемый консервирующий раствор согласно изобретению и клетки CD34+. Таким образом, при необходимости можно считать, что контейнер содержит трансплантат, готовый к инъекции.
Предпочтительно клетки происходят от млекопитающих и, что особенно предпочтительно, от человека. В частности, такими клетками не являются эмбриональные клетки человека.
Консервируемыми клетками являются такие, которые были отобраны или, при необходимости, получены после размножения ex vivo. Особо полезными клетками являются клетки CD34+, более специфично - гемопоэтические стволовые клетки и клетки-предшественники.
Согласно предпочтительному варианту выполнения консервируемыми клетками являются клетки плацентарной крови.
Консервируемыми клетками могут быть непосредственно отобранные клетки, клетки, полученные амплификацией ex vivo, или замороженные клетки.
Согласно предпочтительному варианту выполнения клетки предназначены для трансплантации реципиенту и получены предпочтительно их отбором у донора. Донор и реципиент могут быть одним и тем же лицом (аутологичный трансплантат) или разными лицами (гомотрансплантат).
Также настоящее изобретение относится к трансплантату, содержащему предназначенные для трансплантации клетки и инъецируемый консервирующий раствор согласно изобретению. Предпочтительно предназначенные для трансплантации клетки представляют собой клетки плацентарной крови, костного мозга и периферической крови. В частности, клетки содержат клетки CD34+.
Настоящее изобретение относится кроме того к способу лечения больного, включающему в себя инъекцию трансплантата, такого, как описанный выше. Инъекция может быть внутривенной, подкожной, внутримышечной, в т. ч. внутрисердечной.
Все приведённые в этом описании ссылки включены в данную заявку. Другие признаки и преимущества изобретения станут более понятны при ознакомлении с примерами, приведёнными для иллюстрации и не являющимися ограничительными.
Описание фигур
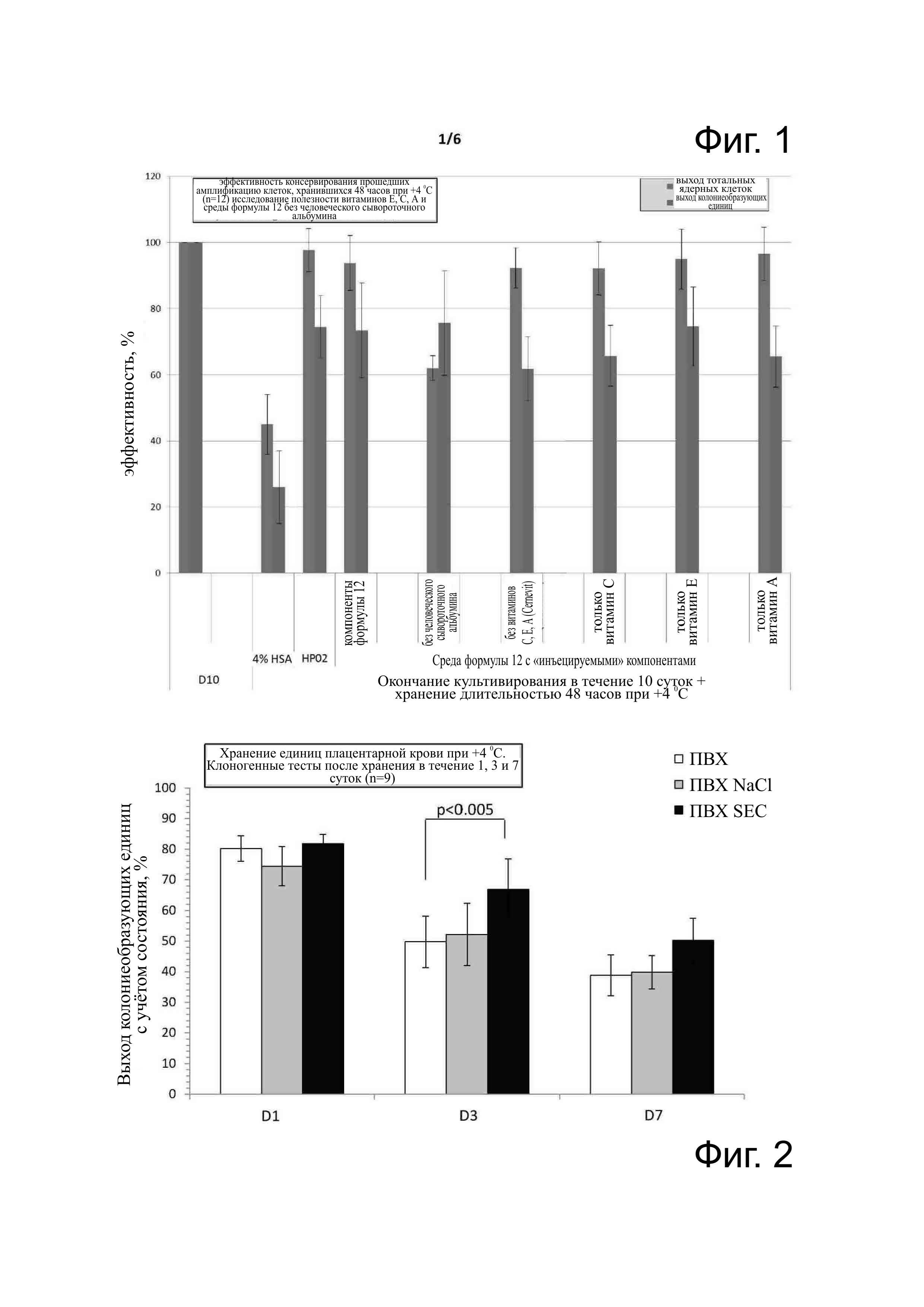
Фиг. 1 - эффективность консервации подвергшихся амплификации клеток CD34+ плацентарной крови, помещённых на хранение длительностью 48 часов при 4°С (n=12). По каждому условию, слева выход жизнеспособных ядерных клеток (CNT) и справа выход колониеобразующих единиц (CFU: colony forming unit), возможно оценить клоногенную функциональность. Условия тестирования были следующими: 10 суток (конец культивирования), HAS 4% (среда с содержанием 4% сывороточного человеческого альбумина), НР02 (эталонная среда фирмы Maco Pharma), компоненты формулы 12 (такой, как описана в примерах таблицы 2), без HAS (среды формулы 12, не содержащей сывороточный человеческий альбумин), без витаминов С, Е, А (Cernevit®) (среда формулы 12 без (Cernevit®), только витамин С (среда формулы 12 без Cernevit®, но с содержанием витамина С), только витамин Е (среда формулы 12 без Cernevit®, но с содержанием витамина Е) и только витамин А (среда формулы 12 без Cernevit®, но с содержанием витамина А). За пределами 10 суток производились другие измерения после консервации клеток длительностью 48 часов при 4°С. Тесты проводились в герметичных контейнерах (полипропиленовых пробирках объемом 2,5 мл клеточной суспензии для максимального предупреждения присутствия воздуха).
Фиг. 2 - консервация единиц плацентарной крови после отбора, CFU (n=9). J1, J3, J7 означают соответственно консервацию в течение 1, 3 и 7 суток при 4°С. ПХВ означает хранение в мешочке из ПХВ; PVC NaCl указывает на добавку 0,9 % хлорида натрия, PVC SEC указывает на добавку среды SEC, такой, как описана в примерах таблице 2.
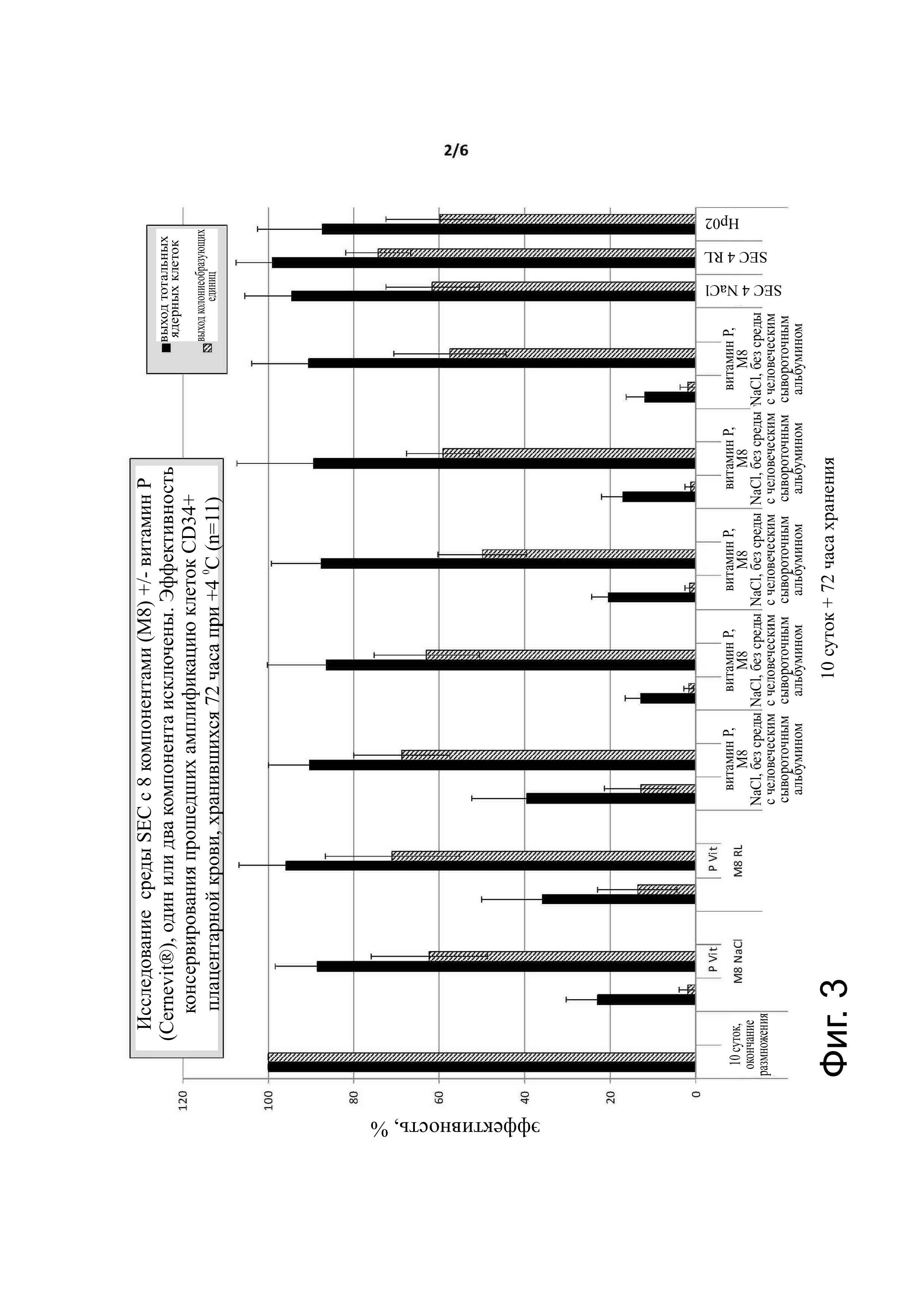
Фиг. 3 - эффективность консервации прошедших амплификацию клеток CD34+ плацентарной крови, помещённых на хранение сроком 72 часа при 4°С (n=11). По каждому условию, слева выход жизнеспособных ядерных клеток (CNT) и справа выход колониеобразующих единиц (CFU: colony forming unit), возможно оценить клоногенную функциональность. Условия тестирования были следующими: 10 суток (конец культивирования), М8 NaCl (среда с содержанием человеческого сывороточного альбумина, аминокислот, хлорида калия, глюкозы, глютамина, бикарбоната натрия, ACD A и NaCl 0,9%) с или без добавки Cernevit® , M8 RL ( среда с содержанием сывороточного человеческого альбумина, аминокислот, хлорида калия, глюкозы, глютамина, бикарбоната натрия ACD A и лактата R вместо NaCl 0,9%) без или с добавкой Cernevit®, M8 NaCl без HAS (М8 NaCl без содержания человеческого сывороточного альбумина) с или без добавки Cervenit®; М8 NaCl без AA (М8 NaCl без аминокислот) без или с добавкой Cervenit®; М8 NaCl без КСl (М8 NaCl без KCl) без или с добавкой Cervenit®; М8 NaCl без GG (М8 NaCl без глюкозы и глютамина) без или с добавкой Cervenit®; М8 NaCl без AAGG (М8 NaCl без аминокислот, глюкозы и глютамина) без или с добавкой Cervenit®; SEC 4 NaCl (среда формулы 12, компоненты без лактата Ringer; SEC 4 RL (среда формулы 12, компоненты без NaCl 0,9%); HP02 (эталонная среда фирмы Maco Pharma). Тесты проводились в герметичных контейнерах (полипропиленовых пробирках объемом 2,5 мл при содержании 2,5 мл клеточной суспензии для максимального предупреждения присутствия воздуха).
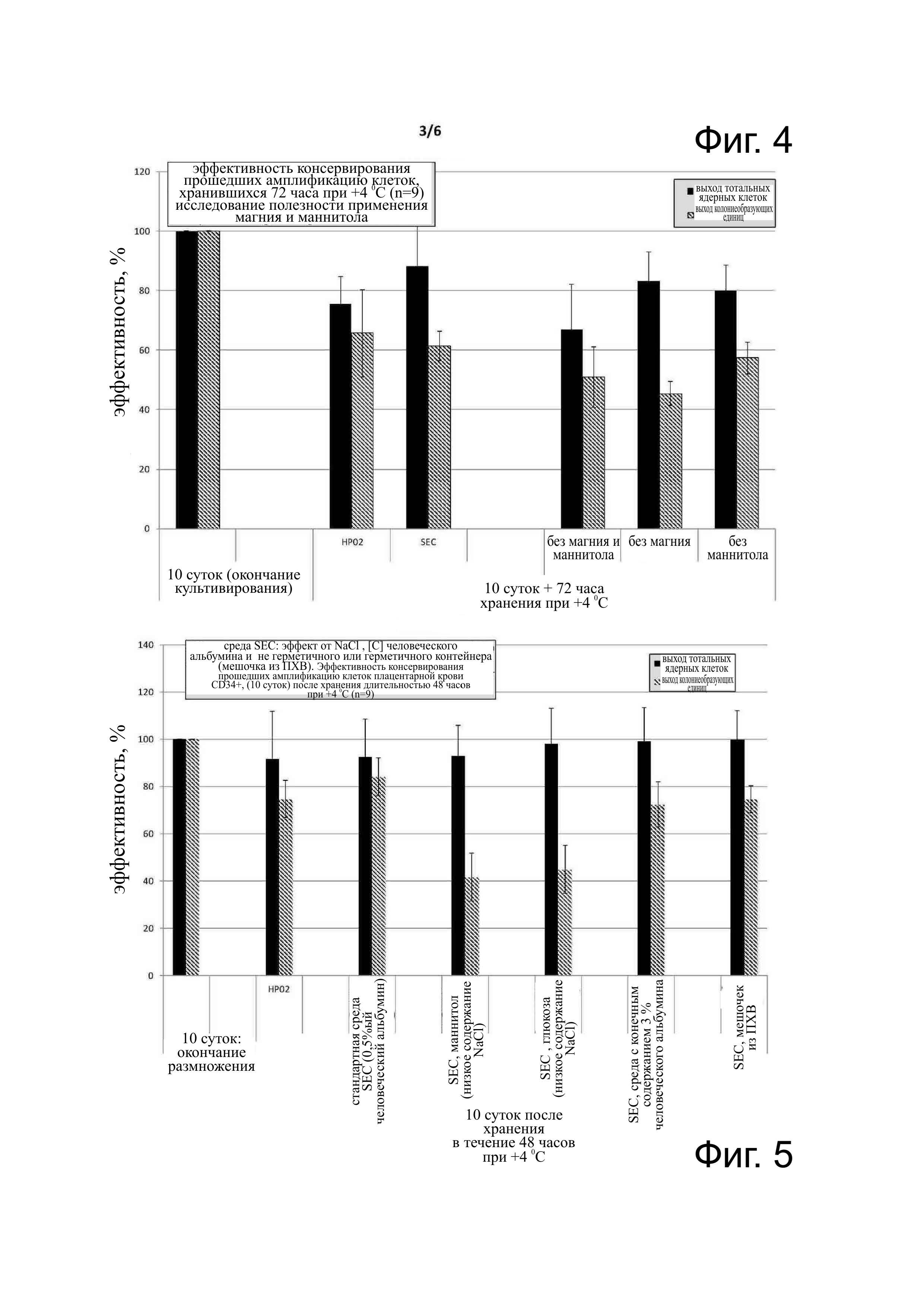
Фиг. 4 - эффективность консервации прошедших амплификацию клеток CD34+ плацентарной крови, хранившихся 72 часа при 4°С (n=9). По каждому состоянию, слева выход жизнеспособных ядерных клеток (CNT) и справа выход колониеобразующих единиц (CFU: colony forming unit), возможно оценить клоногенную функциональность. Условия тестирования были следующими: 10 суток (конец культивирования), НР02 (эталонная среда фирмы Maco Pharma); SEC (среда SEC, как описана в примерах таблицы 2), без магния и маннита (среда SEC без магния и маннита), без маннита (среда SEC без маннита). Тесты проводились в герметичных контейнерах (полипропиленовые пробирки объемом 2,5 мл при содержании 2,5 мл клеточной суспензии для максимального предупреждения присутствия воздуха).
Фиг. 5 - эффективность консервации прошедших амплификацию клеток CD34+ плацентарной крови, хранившихся 48 часов при 4°С (n=9). По каждому условию, слева выход CNT (жизнеспособных ядерных клеток) и справа выход колониеобразующих единиц (CFU), стало возможным оценить клоногенную функциональность. Условия тестирования были следующими: 10 суток (конец культивирования), НР02 (эталонная среда фирмы Maco Pharma); стандартная среда SEC (HSAO, 0,5%) (среда SEC, как описана в примерах таблицы 2), SEC маннит (обеднённая содержанием NaCl) ( среда формулы 12, компоненты без содержания NaCl 0,9%, замещённого идентичным объёмом маннита 4,55% [300 mos], SEC глюкоза (обеднена содержанием NaCl) ( среда формулы 12, компоненты без содержания NaCl 0,9%, замещённого одинаковым объёмом 5%-го раствора глюкозы), SEC HAS 3% (среда SEC, как описана в примерах таблицы 2, но с содержанием 3% человеческого сывороточного альбумина), SEC мешочек из ПХВ (в данном случае контейнером служит герметичный мешочек из ПВХ для проб объемом 20 мл). Тесты проводились в герметичных контейнерах (полипропиленовых пробирках объемом 2,5 мл при содержании 2,5 мл клеточной суспензии для максимального предупреждения присутствия воздуха), кроме мешочка из ПХВ.
Фиг. 6 - эффективность консервации прошедших амплификацию клеток CD34+ плацентарной крови, хранившихся 48 часов при 4°С (n=8) в ходе исследования серии объёмов CERVENIT® (а также диапазона молярности витамина Е), вводившихся в «базовую» среду SEC, образованную 11 другими компонентами. Условия тестирования были следующими: человеческий альбумин (HSA 4%), HP02 (эталонная среда MACOPHARMA), «базовая» среда SEC без CERNEVIT®, «базовая» среда SEC с добавкой CERNEVIT® в снижающихся количествах, а именно: 10 мл/л для 45 мкМ витамина Е, 5 мл/л для 22,5 мкМ витамина Е, 2 мл/л для 9 мкМ витамина Е, 1 мл/л для 4,5 мкМ витамина Е, 0,5 мл/л для 2,25 мкМ витамина Е, 0,2 мл/л для 0,9 мкМ витамина Е, 0,1 мл/л для 0,45 мкМ витамина Е, 0,05 мл/л для 0,225 мкМ витамина Е, 0,025 мл/л для 0,112 мкМ витамина Е. Тесты проводились в герметичных контейнерах (полипропиленовых пробирках объемом 2,5 мл с содержанием 2,5 мл клеточной суспензии для максимального предупреждения присутствия воздуха).
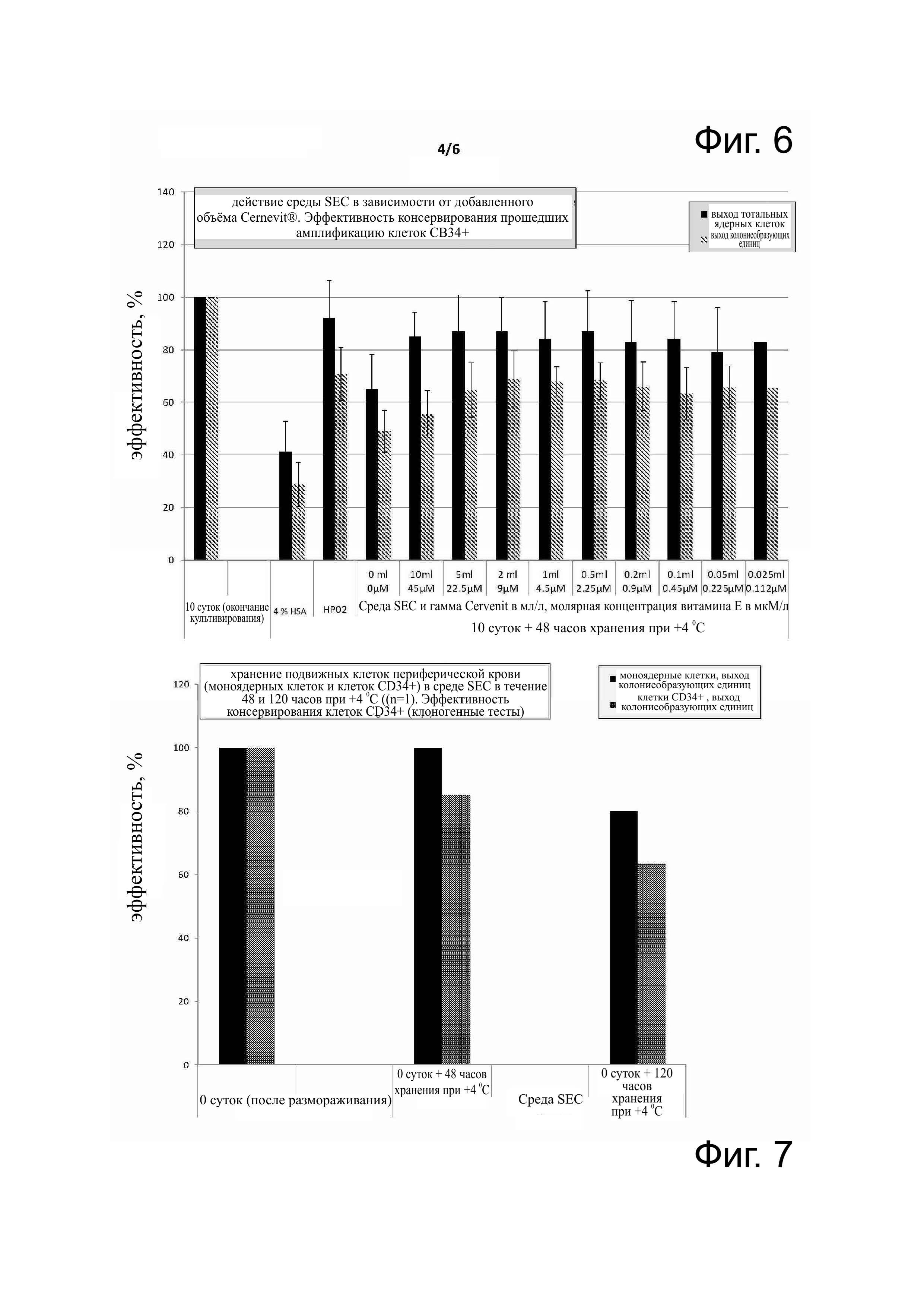
Фиг. 7 - эффективность сохранения клоногенности моноядерных клеток и клеток CD34+ периферической крови (после иммуномагнитного отбора), использованной после 48 и 120 часов хранения при 4°С (n=1). Моноядерные клетки, после их размораживания и удаления криозащитного агента, были разделены на две аликвотные части, одну из которых суспендировали в среде SEC (описанный состав из 12 компонентов), а другую подвергли иммуномагнитному отбору для получения клеток СD34+ со степенью чистоты более 80%, которые были суспендированы в той же среде SEC (описанная композиция из 12 компонентов). Тесты проводились в герметичных контейнерах (полипропиленовых пробирках объемом 2,5 мл с содержанием 2,5 мл клеточной суспензии для максимального предупреждения присутствия воздуха).
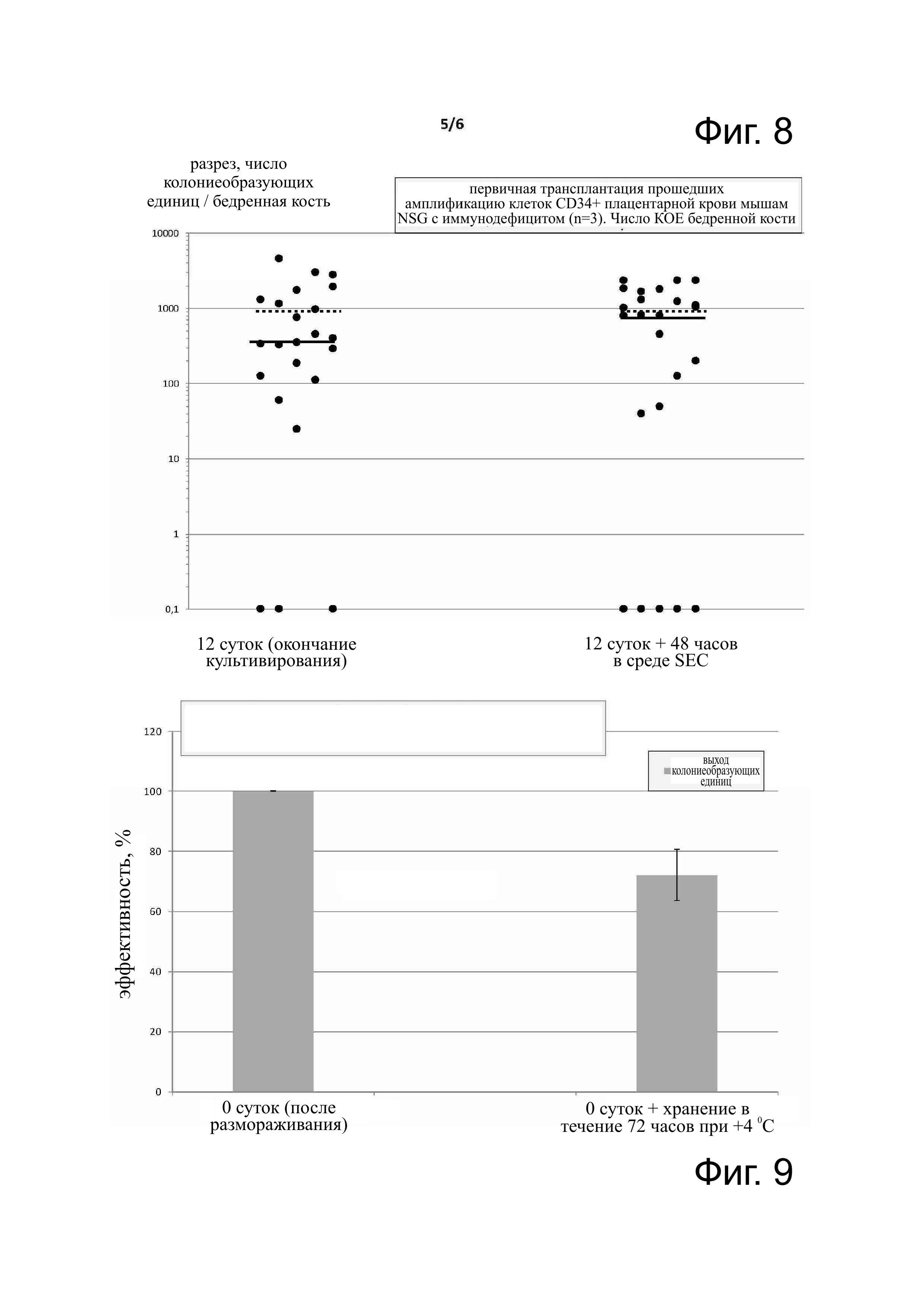
Фиг. 8 - эффективность сохранения клоногенности (колониеобразующих единиц) прошедших амплификацию клеток CD34+ после хранения в среде SEC при 4°С в течение 48 часов и первичная трансплантация на примере мыши NSHG с иммунодефицитом. Манипуляции при этом исследовании состояли из нескольких этапов: приготовление трансплантата: культивирование клеток CD34+ плацентарной крови (отобранных посредством иммуномагнитной сортировки) в среде с содержанием смеси соответствующих цитокинов в течение 12 суток. В конце этого культивирования прошедшие амплификацию клетки были собраны и разделены на две части, одну из которых трансплантировали одной партии мышей с иммунодефицитом, из которой каждая мышь получила количество прошедших амплификацию клеток, произведённых от 1000 клеток CD34+ в начале культивирования, другую часть поместили на хранение в среде SEC (мешочек из ПХВ) при +4°С в течение 48 часов, затем инъецировали другой партии мышей с иммунодефицитом при тех же количественных условиях. Через 8 недель после трансплантации мышей умертвили, проанализировали человеческие клоногенные клетки-предшественники в костном мозге мышей; эти клетки-предшественники были произведены стволовыми клетками (подпись под графиком: 1 точка соответствует мыши, на которой проводилась трансплантация и которую анализировали (колониеобразующие единицы/бедренная кость); пунктирная линия соответствует средней величине, сплошная линия - медиане).
Фиг. 9 - эффективность сохранения клоногенности клеток CD34+ (полезных клеток) костного мозга (n=5). Клетки CD34+ были помещены в банк в виде LN2 несколько лет назад (от 3 до 6 лет). После размораживания клеток СВ34+ их повторно суспендировали в среде SEC и сдали на хранение при 4°С. Через 72 часа хранения при 4°С были проведены клоногенные тесты. Тесты проводились в герметичных контейнерах (полипропиленовых пробирках объемом 2,5 мл с содержанием 2,5 мл клеточной суспензии для максимального предупреждения присутствия воздуха).
Фиг. 10 - эффективность сохранения жизнеспособности и клоногенного потенциала клеток CD34+ плацентарной крови. Клетки CD34+ плацентарной крови разморозили и разделили на три аликвотные части; клетки CD34+ суспендировали в среде SEC, среде НР02 и 4%-м человеческом альбумине и отправила на хранение при 4°С. Через 72 часа хранения при +4°С провели анализы (подсчёт жизнеспособных тотальных ядерных клеток и клоногенные функциональные тесты). Тесты проводились в герметичных контейнерах (полипропиленовых пробирках объемом 2,5 мл с содержанием 2,5 мл клеточной суспензии для максимального предупреждения присутствия воздуха).
Примеры
После выявления некоторого числа активных веществ в фармакопеи авторы изобретения подобрали инъецируемые фармацевтические препараты, которые ими были объединены и образовали базовую композицию, которую они затем тестировали путём сравнения в эталонной среде НР02 (Macopharma). Они получили результаты относительно консервации в течение 48 и 72 часов при 4°С, которые практически идентичны результатам обеих сред.
Авторы изобретения исследовали, таким образом, полезность каждого продукта и отыскали эффективную оптимальную концентрацию. Некоторые из компонентов были исключены из начальной композиции либо вследствие отсутствия общего действия (SeNa), либо вследствие возможной почечной токсичности, ставшей известной недавно (гидрокси-этил-крахмал, 6%).
Таким образом, авторами изобретения было выявлена значимость витамина Е (альфа-токоферол) и, в меньшей степени, витаминов А (ретиноевая кислота) и С ( аскорбиновая кислота), ионов К+, Mg++ и лактата, а также человеческого альбумина для поддержания жизнеспособности и, главным образом, функциональности (клоногенности) прошедших амплификацию клеток CD34+.
В конечном итоге компоненты 12 фармацевтических препаратов вошли в рецептуру биологической среды для консервации клеток. Консервирующая среда приготавливается стерильно в герметичном пластиковом мешочке (из этиленвинилацетата) таким образом, что атмосферные газы, в частности, молекулярный кислород (О2), не могут проникнуть внутрь и что главным образом диоксид углерода (СО2), растворившийся при регулировке показателя рН (воздействием лимонной кислоты на бикарбонат натрия), остаётся в среде (способствует сохранению клеток при низкой температуре), вследствие этого показатель рН среды сохраняется на требуемом уровне на протяжении нескольких лет. Такие мешочки используются в фармацевтической промышленности для упаковки инъецируемых препаратов, а также поставщиками биологических реактивов для сохранения, в числе прочего, культурных сред.
Авторы изобретения назвали эту консервирующую среду SEC.
Описание консервирующей среды
Используемые инъецируемые продукты
Продукт С1: 20%-ый раствор человеческого альбумина (композиция с содержанием человеческого альбумина в количестве 200 г; каприловая кислота в количестве, достаточном для 1 л): этот раствор обеспечивает защиту некоторым молекулам; в ходе проведения наших испытаний он очень чётко продемонстрировал свою способность поддерживать жизнеспособность тотальных ядерных клеток; он обеспечивает повышенную стойкость показателя рН среды, содержащейся в не герметичных контейнерах во время хранения прошедших амплификацию клеток при +4°С (см. фиг. 1).
Продукт С2: аминокислоты (Vaminolact® (фирма Fresenius Kabi) - композиция в количестве, достаточном для 100 мл: L-Alanine 630 мг; L-Arginine 410 мг; L-аспарагиновая кислота 410 мг; L-цистеин / L- цистин 410 мг; L-глютаминовая кислота 710 мг; глицин 210 мг; L-гистидин 210 мг; L-изолейцин 310 мг; L-лейцин 700 мг; L-лизин 560 мг; L-метионин 130 мг; L- фенилаланин 270 мг; L-пролин 560 мг; L-серин 380 мг; L-таурин 30 мг; L-треонин 360 мг; L- триптофан 140 мг; L-тирозин 50 мг; L-валин 360 мг). Аминокислоты не существенно способствуют функциональности прошедших амплификацию клеток, но представляют интерес в связи с тем, что некоторые из них способны играть защитную роль в отношении клеток (см. фиг. 3).
Продукт С3: KCl (10%-й водный препарат): в ходе наших тестов он оказал значительное влияние на сохранность функциональности прошедших амплификацию клеток (см. фиг. 3).
Продукт С4: глюкоза (30%-ый препарат): в ходе наших испытаний не было выявлено его существенного влияния, но представляет интерес (см. фиг. 3).
Продукт С5: аминокислота глютамин (композиция Dipeptiven (фирма Fresenius Rabi): аланил-глютамин 20 г/100 мл, т. е. 13,2 г глютамина / 100 мл; молекула устойчива в противоположность глютамину): аминокислота показала в ходе наших тестов не значительное, но интересное действие; она окажет защитное действие на митохондрии (см. фиг. 3).
Продукт С6: MgSO4 (15%-ый водный препарат). В ходе наших тестов он оказывал существенное влияние на сохранность и функциональность прошедших амплификацию клеток; он окажет воздействие на митохондрии (см. фиг. 4).
Продукты С7: антиоксиданты
либо С7 Cernevit® (фирма Baxter) (композиция на 5 мл: Rétinol (витамин А) 3500 международных единиц (МЕ) в виде ретинолпальматита ; холекальциферол (витамин D3) 220 МЕ; альфа-токоферол или (витамин Е) 11,2 МЕ (10,2 мг); аскорбиновая кислота (витамин С) 125 мг; тиамин (витамин В1) 3,51 мг; рибофлавин (витамин В2) 4,14 мг; пиродоксин (витамин В6) 4,53 мг; цианокобаламин (витамин В12) 0,006 мг; фоливая кислота (витамин В9); пантотеиновая кислота (витамин В5) 17,15 мг; биотин (витамин В8) 0,069 мг; никотинамид (витамин РР) 46 мг. В ходе наших исследований эта композиция обнаружила своё консервирующее действие на функциональность находившихся на хранении клеток при 4°С. Из подвергшихся отдельным испытаниям витаминов наибольший эффект обнаружил витамин Е. Витамины А и С обладали меньшей активностью, однако витамин С упомянут в связи с его защитной ролью в отношении витамина Е. Добавка среды Cernevit® в надосадочную жидкость культуры сопровождалась эффектом, одинаковым эффекту среды для сохранения прошедших амплификацию клеток при +4°С. Наконец, каждый витамин присутствовал в форме инъецируемого лекарства, и только витамины Е и С могут применяться в композиции;
либо С7а. Витамин Е (композиция для 2 мл: альфа-токоферол 100 мг),
либо С7b. Витамин С (композиция для 5 мл: аскорбиновая кислота 1000 мг),
либо С7с. Витамин А (композиция для 2 мл: ретинол 100000 МЕ).
Витамин Е может применяться либо самостоятельно, либо совместно с витамином С или А или же в сочетании с ними обоими с достижением эффекта, близкого или аналогичного в отношении сохранения прошедших амплификацию клеток эффекту средства Cernevit®. Витамин С оказывает защитное действие на витамин Е (см. фигуры 1, 3 и 6).
Продукт С8: маннит (20%-ый раствор): обладает противоокислительным действием (против гидроксильного радикала) и в ходе наших исследований показал незначительный эффект (см. фиг. 4).)
Продукт С9: лактат Ringer (состав: NaCl 6 г, КCl 0,4 г, CaCl2 2H2O 0,27 г, лактат натрия 5,16 г, количество, достаточное для 1 литра, т.е. Na+ 131 ммоля; К+ 5 ммолей, Са++, лактат 29 ммолей). Он проявил меньший противоокислительный эффект, незначительный эффект буфера (такой же, что и у иона СО3-) присутствовал в надосадочной жидкости культуры. В ходе наших исследований он оказал относительно большое влияние на сохранность функциональности прошедших амплификацию клеток (см. фиг. 3).
Продукт С10:NaCl (в виде 0,9%-ой физиологической сыворотки): является растворённым продуктом и позволяет поддерживать физиологическую осмотическую концентрацию. В ходе наших исследований было установлено его особое влияние на клоногенный потенциал, так как, если он будет замещён изотоническим растворённым веществом глюкоза или маннит, через 48 часов хранения при +4°С отмечалось очень существенное снижение клоногенной функциональности несмотря на поддержание жизнеспособности тотальных ядерных клеток (см. фиг 5).
Продукт С11: бикарбонат натрия (1,4%-ый препарат NaHCO3). Он позволяет создать псевдобуферную систему с помощью лимонной кислоты, входящей в состав ACD A (лимонная кислота, цитрат, декстроза, раствор А), для доведения среды до нужного значения рН и привнесения растворённого СО2 (защитное действие для соответствующих клеток при 4°С).
Продукт С12: ACD A (лимонная кислота, цитрат, декстроза, раствор А) (моногидратная декстроза 24,5 г, моногидратная лимонная кислота 8 г, двухводный цитрат натрия 22 г, количество, необходимое для 1 литра). Он позволяет задать показатель рН после добавки бикарбоната натрия. Ион цитрата описан как обладающий противоокислительным действием, и наконец, ион цитрата комплексует часть ионов кальция, вводимых в среду посредством лактата Ringer. ACD A является противосвёртывающим средством, применяемым традиционно в трансфузионной практике.
В нижеследующей таблице приведена современная рецептура с указанием больших и малых, полезных и активных значений компонентов, выявленных при проведении исследования оптимизации. Следующие компоненты не были исследованы на предмет оптимизации и во внимание приняты только физиологические показатели: KCl (0,33 г/л конечного продукта вместе с КCl 10% и KCl, содержащийся в лактате Ringer), глюкоза, NaCl, ACD A.
Показатель рН предпочтительного консервирующего раствора составлял 6,95±0,05.
Таблица 2
|
Тесты на действие компонентов консервирующей среды
1. Клетки CD 34+ плацентарной крови, отобранные и прошедшие амплификацию ex vivo.
После размножения еx vivo клетки становятся более хрупкими, чем исходные клетки CD34+, и их хранение при +4°С наиболее критично (Duchez и др., 2013, см. выше).
Если совокупность исследований привела к составу биологической консервирующей среды, то тесты проводились на клетках CD34+ плацентарной крови, полученных из банка, где они хранились при -196°С. Каждый опыт проводился на одном или нескольких образцах.
Клетки CD34+ плацентарной крови отделяли иммуномагнитной системой, затем заморозили и поместили в банк с температурой -196°С.
После размораживания клетки CD34+ плацентарной крови (20000/мл) культивировали в среде НР01 в присутствии фактора роста стволовых клеток (SCF ) 100 нг/мл, Flt3 (ингибитор тиразин киназы-3) 100 нг/мл, G-CSF (гранулоцит-колониестимулирующий фактор) 10 нг/мл и тромбопоэтин 20 нг/мл при 37°С, 5% СО2 и 85% влажности. К наполовину готовой культуре прибавили культурную среду НР01 вместе с цитокинами (степень разбавления: 1/5) и продолжили культивирование в течение 9 - 12 суток (в целом 10 суток).
В конце периода культивирования 2,5 мл клеточной суспензии вносили в пропиленовые пробирки объемом 2,5 мл и центрифугировали при ускорении 430 в течение 10 минут при 18°С. Надосадочную жидкость полностью извлекли (оставалось около 50 мкл надосадочной жидкости культуры на осадке из клеток). Затем 2,5 мл подлежащей тестированию консервирующей среды (при комнатной температуре) ввели в пробирку, которую закрыли пробкой и клетки суспендировали последовательными переворачиваниями. После этого образцы хранили при комнатной температуре в течение от 1 до 3 часов. Наконец пробирки помещали горизонтально и хранили при +4°С в течение от 48 до 72 часа. Опыты проводились также в герметичных мешочках из ПХВ.
Таким образом, анализы проводились на прошедших амплификацию клетках: подсчёт, определение жизнеспособности тотальных ядерных клеток и клоногенные тесты, перемежавшиеся иногда подсчётом и определением жизнеспособности клеток CD34+. После хранения при +4°С в течение определённого времени (48 ч и 72 ч) тестировали образцы клеток: производили подсчёт и определяли жизнеспособность тотальных ядерных клеток и проводили клоногенные тесты (иногда также подсчитывали и определяли жизнеспособность клеток СD34+).
Количество тотальных, оставшихся после хранения при +4°С жизнеспособных ядерных клеток сравнивали с количеством тотальных жизнеспособных ядерных клеток в конце культивирования, что позволило определить эффективность восстановления жизнеспособных клеток. Также проводился подсчёт выхода колониеобразующих единиц. Полученные данные позволили оценить полезность одного или нескольких компонентов в рецептуре и отыскать оптимальную концентрацию соединений. Эти данные сравнили с данными, полученными с использованием консервирующей среды НР02 (Duchez и др., 2013, см. выше).
Результаты приведены на фиг. 1.
Клетки CD34+ плацентарной крови, прошедшие амплификацию еx vivo, были трансплантированы иммунодепрессивным мышам NSG для исследования сохранности клоногенности клеток СВ34+, прошедших амплификацию после хранения в среде SEC при +4°С в течение 48 часов. Манипуляции при этом исследовании проводились на разных этапах: приготовление трансплантата с культивированием клеток CD34+ плацентарной крови (отобранных иммуномагнитной сортировкой) в среде, содержащей смесь соответствующих цитокинов, в течение 12 суток. В конце этого культивирования были собраны прошедшие амплификацию клетки и разделены на две части, из которых одну часть трансплантировали одной партии мышей с иммунодефицитом, каждая мышь которой получила некоторое количество прошедших амплификацию клеток, произведённых 1000 клетками CD34+ в начале культивирования, вторую часть хранили в среде SEC (мешочек из ПХВ) при +4°С 48 часов и затем инъецировали её второй партии мышей с иммунодефицитом при тех же количественных показателях. Через 8 недель после трансплантации мышей умерщвляли и анализировали человеческие клоногенные клетки-предшественники в костном мозге мышей: эти клетки-предшественники были образованы стволовыми клетками (надпись под графиком: 1 точка соответствует мыши, подвергшейся трансплантации, и анализированной (колониеобразующие единицы/ бедренная кость); пунктирная линия соответствует среднему значению; сплошная линия - медиана). Результаты свидетельствуют о том, что хранение в среде SEC в течение 48 часов при +4°С не уменьшало количество клоногенных клеток-предшественников, образованных стволовыми клетками, которые были трансплантированы мышам.
Результаты показаны на фиг. 8.
2.Клетки плацентарной крови после отбора
Плацентарная кровь отбиралась из пластикового мешочка (из ПВХ), содержавшей 23 мл противосвёртывающего агента CPD (Citrat phosphate dextrose). Затем образец плацентарной крови хранили при +4°С в ожидании её обработки для помещения в банк (криосохранение при -196°С). Протоколом предусмотрено, чтобы помещение в банк проводилось через 36 часов для предупреждения порчи клеток в связи со способом консервации (+4°С) и отсутствия консервирующей среды. Для обеспечения возможности очень отдалённых отборов, способных соответствовать терапевтическим эффектам (тканевая совместимость, редкие фенотипы антигена главного локуса, население заморских территорий и районов пр.) и требующих проведения доставки в течение не более 36 часов, была осуществлена начальная работа по усовершенствованию хранения плацентарной крови после её отбора. Она состояла в объединении герметичного мешочка и добавлении неинъецируемой среды (НР02 фирмы Macopharma) к плацентарной крови. Это позволяло существенно удлинить срок до момента помещения в банк (до 72 часов) при полном сохранении жизнеспособности и функциональности, сравнимой с эффективной трансплантацией (WO 2014/057220, Chevaleyre и др., 2014, Stem Cell Dev, 23, 1820-30).
Поскольку среда НР02 не является инъецируемой, то применялась среда SEC (согласно изобретению) для консервации плацентарной крови. Через 72 часа хранения при +4°С добавка среды SEC обеспечила поддержание функциональности, которая была значительно лучше и более совместима с последующим помещением в банк (Rodriguez, дипломная работа на звание магистра, защищённая в Университете г. Бордо 11 июня 2014 г.). Полученные результаты приведены на фиг. 2.
3. Клетки CD34+, отобранные от плацентарной крови после размораживания
Замороженные при -196°С клетки CD34+ плацентарной крови размораживали, промывали и разделяли на три аликвотные части; клетки СD34 суспендировали в среде SEC, в среде НР02 и в среде 4%-го человеческого альбумина, затем хранили при +4°С. Через 72 часа хранения при +4°С были произведены анализы (подсчёт тотальных жизнеспособных ядерных клеток и клоногенные функциональные тесты). Испытания проводились в герметичных контейнерах (полипропиленовые пробирки объемом 2,5 мл, заполненные клеточной суспензией в количестве 2,5 мл для максимального предупреждения присутствия воздуха). Результаты показали очень хорошую сохранность клеток CD34+ в количественном (количество жизнеспособных клеток) и качественном (клоногенная функциональность) отношениях после хранения в течение 72 часов при +4°С в среде SEC, сопоставимой со средой НР02. Полученные результаты приведены на фиг. 10.
4. Клетки СD34 костного мозга после размораживания (n=5)
Костномозговые клетки CD34+, помещённые в банк (замораживание при -196°С и хранение от 3 до 6 лет), размораживали, промывали и суспендировали в 2,5 мл среды SEC в полипропиленовой герметичной пробирке объемом 2,5 мл; клетки хранили при +4°С 72 часа. Клоногенные тесты, проводившиеся после размораживания и хранения в течение 72 часов при +4°С, показали хорошую сохранность функциональности костномозговых полезных клеток (эффективность сохранности функциональности > 70%). Полученные результаты приведены на фиг. 9.
5. Клетки периферической крови, подвижной после размораживания (n=1)
Клетки периферической крови после очистки в градиенте фиколла (Ficoll) (моноядерные клетки) были заморожены при -196°С. После размораживания и промывания их разделили на 2 аликвотные части, из которых первую часть оставили в прежнем виде, а вторую подвергли иммуномагнитному отделению, которое должно было обеспечить получение суспензии клеток CD34+. Моноядерные клетки и клетки СD34+ суспендировали в среде SEC (2,5 мл) в герметичных полипропиленовых пробирках объемом 2,5 мл и хранили при +4°С от 48 до 120 часов. Клоногенные тесты, проведённые после размораживания моноядерных клеток и/или очистки клеток CD34+ и хранения при +4°С, показали хорошую сохранность функциональности полезных клеток: эффективность сохранности функциональности составила от 85% (очищенные клетки CD34+) до 100% (моноядерные клетки) после хранения в течение 48 часов при +4°С и от 60% (очищенные клетки CD34+) до 80% (моноядерные клетки) после хранения длительностью 120 часов при 4°С. Полученные результаты приведены на фиг. 7.