Результат интеллектуальной деятельности: СПОСОБ КОНСЕРВАЦИИ КЛЕТОК, ТКАНЕЙ ИЛИ ОРГАНОВ ПОСРЕДСТВОМ ГИПОТЕРМИИ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение относится к новому способу средне- и долгосрочной консервации клеток, тканей или органов. Данный способ предназначен, в частности, для консервации трансплантатов до их пересадки реципиенту.
Уровень техники
До настоящего времени криоконсервация является единственно возможным методом средне- и долгосрочного хранения трансплантатов в виде гемопоэтических клеток. Действительно без охлаждения до температуры 4°С отмечено, что количество и функциональная способность клеток-предшественников в трансплантатах резко снижаются уже через трое суток хранения (Hechler и др., 1996 г.).
Однако криоконсервации присущи значительные недостатки, в частности, способность к агглюцинации при размораживании или опасность анафилактической реакции, вызываемой присутствием криопротекторов. Также этот метод не может применяться для всех типов клеток.
Предшествующие исследования доказали, что краткосрочное хранение при 4°С стволовых гемопоэтических клеток CD34+ улучшается при изменении атмосферных условий содержания культур, в частности, при понижении содержания кислорода и повышении содержания диоксида углерода (Vlaski и др., 2014 г.). И хотя эти улучшения значительны, однако они остаются недостаточными для обеспечения выживания и поддержания функциональной способности клеток, в частности, клеток-предшественников, при долгосрочном хранении при 4°С.
Оптимальный способ позволил бы хранить долгосрочно трансплантаты в состоянии гипотермии без замораживания и таким образом упростил бы обеспеченность и процессы пересадки при улучшении результатов, достигаемых у реципиентов.
Раскрытие изобретения
Авторы изобретения доказали, что предварительная инкубация клеток в состоянии умеренной гипотермии в гипоксической и/или гиперкапнической атмосфере до момента хранения при глубокой гипотермии позволяет существенно повысить выживаемость и способность к пролиферации отмеченных клеток, в частности, стволовых клеток.
Следовательно согласно первому аспекту настоящее изобретение относится к способу консервации in vitro или ex vivo клеток животных, предпочтительно клеток человека, при глубокой гипотермии, включающему этап выдержки упомянутых клеток при умеренной гипотермии в гипоксической и/или гиперкапнической атмосфере в течение от около 12 до около 72 часов до их хранения при глубокой гипотермии.
Клетки могут храниться при глубокой гипотермии при температуре от около 1 до около 12°С, предпочтительно около 4°С.
Клетки могут выдерживаться при умеренной гипотермии при температуре от около 20 до около 35°С, предпочтительно около 30°С.
Клетки могут выдерживаться при умеренной гипотермии в гипоксической и/или гиперкапнической атмосфере в течение от около 24 до около 48 часов, предпочтительно в течение около 48 часов.
В гипоксической атмосфере может содержаться от около 0,5 до около 10% молекулярного кислорода, предпочтительно около 5%.
В гиперкапнической атмосфере может содержаться от около 5 до около 20% диоксида углерода, предпочтительно около 9%.
Предпочтительно клетки выдерживаются при умеренной гипотермии в гипоксической и/или гиперкапнической атмосфере.
Сохраняемые способом согласно изобретению клетки могут быть клетками кожи, клетками хряща, костными клетками, эндотелиальными клетками, мышечными клетками, невральными клетками, ретинальными клетками, панкреатическими клетками, кровяными клетками или стволовыми клетками или клетками-предшественниками, способными дифференцироваться на перечисленные клетки.
Указанные клетки могут быть объединены, в частности, в виде ткани, предпочтительно отобранной из группы, состоящей из кожи, роговицы, сухожилия, костной ткани, кровеносного сосуда, нерва, сердечного клапана, амниотической мембраны, хрящевой ткани, панкреатического островка и мышечной ткани, или объединены в виде цельного или частичного органа, предпочтительно отобранного из группы, состоящей из почки, печени, сердца, пуповины, плаценты, кишечника, лёгкого и поджелудочной железы.
Предпочтительно сохраняемыми клетками являются гемопоэтические стволовые клетки, мезенхимальные стволовые клетки или их комбинация, предпочтительно гемопоэтические стволовые клетки.
Согласно другому аспекту настоящее изобретение относится к набору, содержащему среду для консервации клеток, первый стерильный контейнер для размещения клеток, тканей или органов и среды для консервации клеток, и устройство для создания гипоксической и/или гиперкапнической атмосферы в первом контейнере, содержащем клетки, ткани или органы, а также факультативно второй контейнер для выдержки первого контейнера и/или клеток, тканей или органов при контролируемой температуре.
В качестве альтернативы набор может содержать стерильный контейнер для размещения клеток, тканей или органов и среды для консервации клеток, содержащей гипоксическую и/или гиперкапническую атмосферу, при этом стерильный контейнер факультативно может предварительно заполняться средой для консервации клеток.
Согласно ещё одному аспекту настоящее изобретение относится к применению набора по изобретению для осуществления способа согласно изобретению, т.е. для консервации клеток животных при глубокой гипотермии.
Краткое описание чертежей
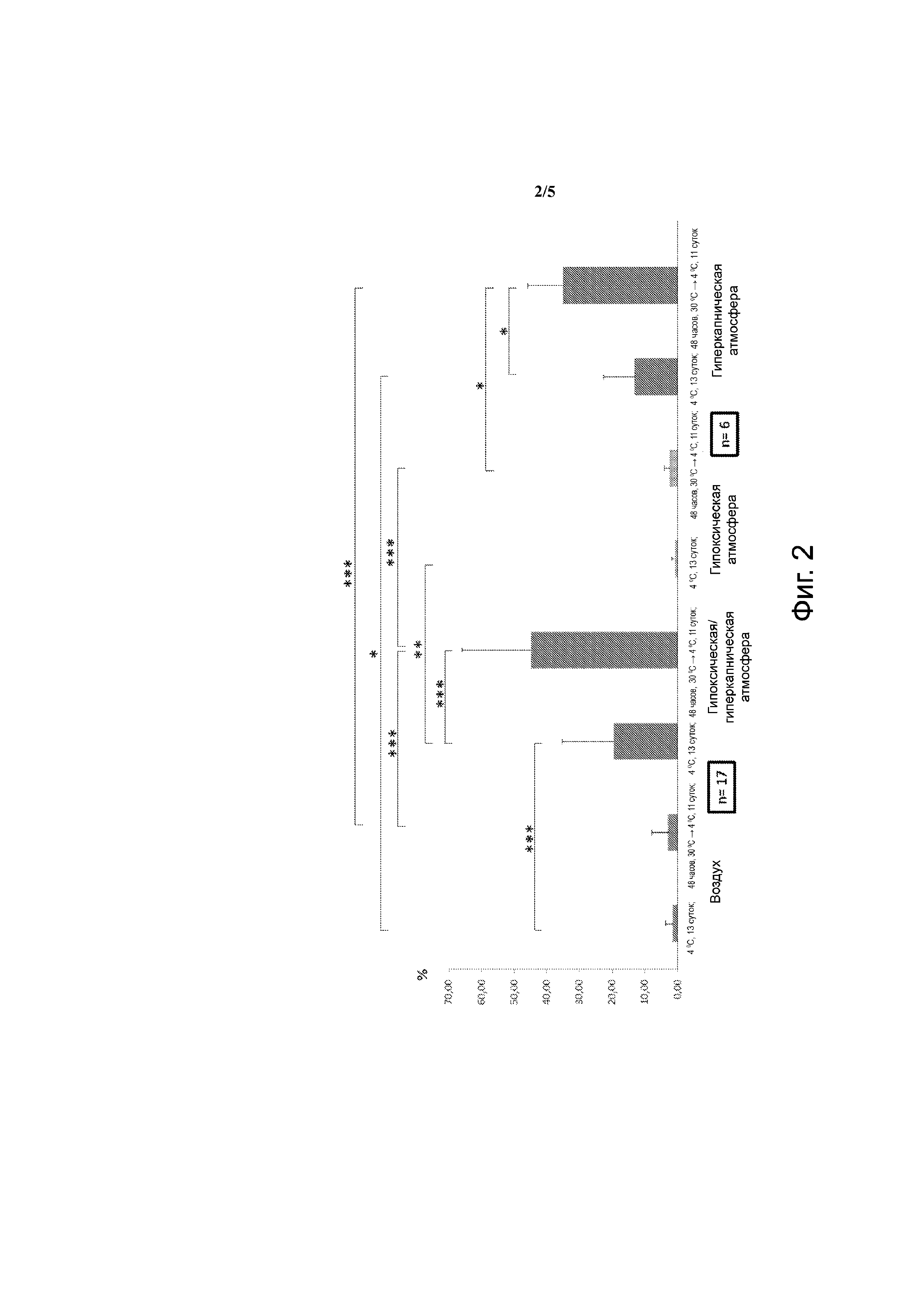
Фиг. 1 – клетки CD34+ плацентарной крови. Выход жизнеспособных клеток по сравнению с t=0. Воздух: 21% О2, 0,01% СО2; гипоксическая и/или гиперкапническая атмосфера: 9% СО2, 5% О2; гипоксическая атмосфера: 5% О2, 0,001 СО2; гиперкапническая атмосфера: 20% О2, 20% СО2. *: р < 0,5; **: р < 0,01; ***: р < 0,001.
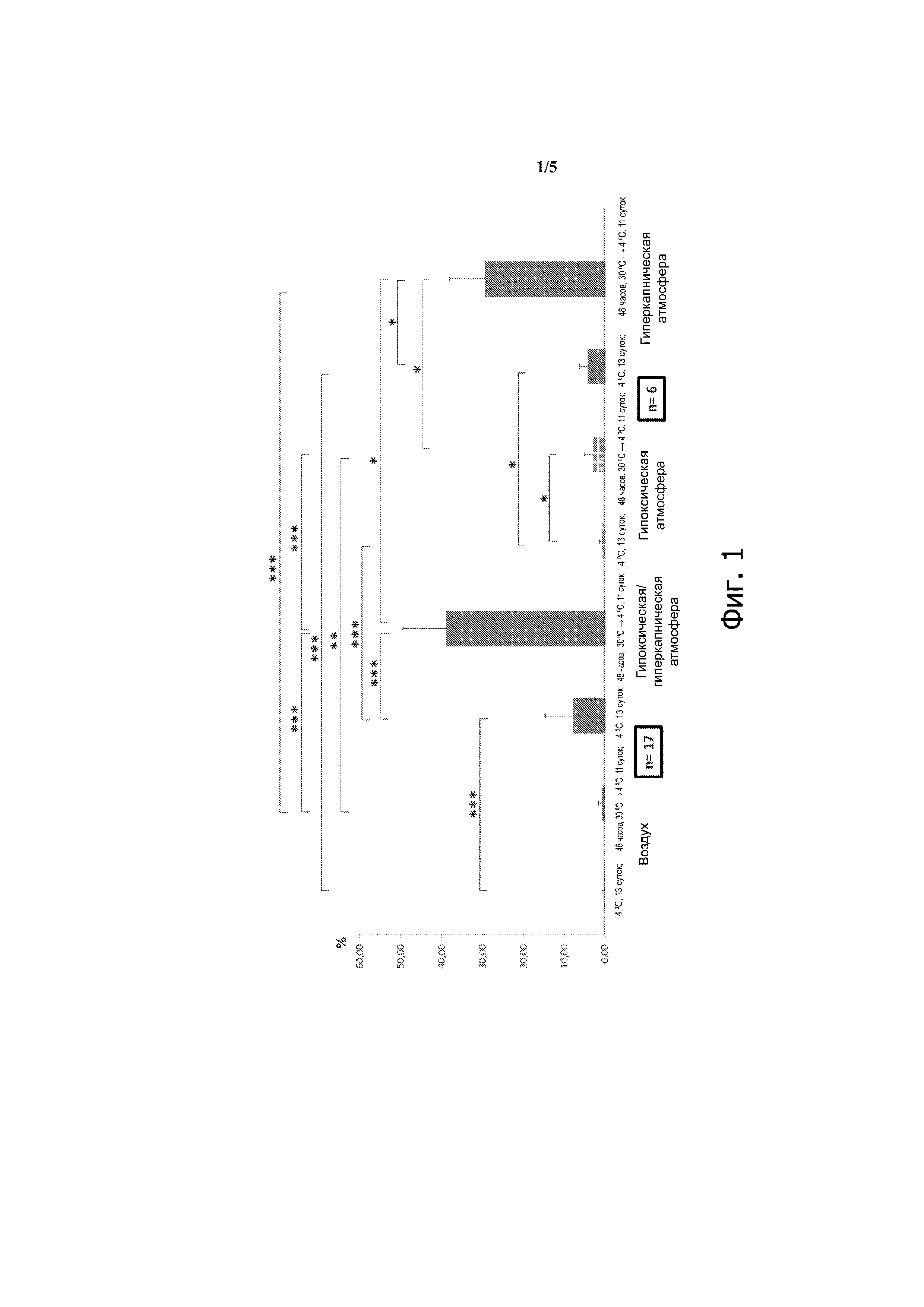
Фиг. 2 – клетки CD34+ плацентарной крови. Выход клеток-предшественников клонального происхождения по сравнению с t=0. Воздух: 21% О2, 0,01% СО2; гипоксическая и/или гиперкапническая атмосфера: 9% СО2, 5% О2; гипоксическая атмосфера: 5% О2, 0,001 СО2; гиперкапническая атмосфера: 20% О2, 20% СО2. *: р < 0,5; **: р < 0,01; ***: р < 0,001.
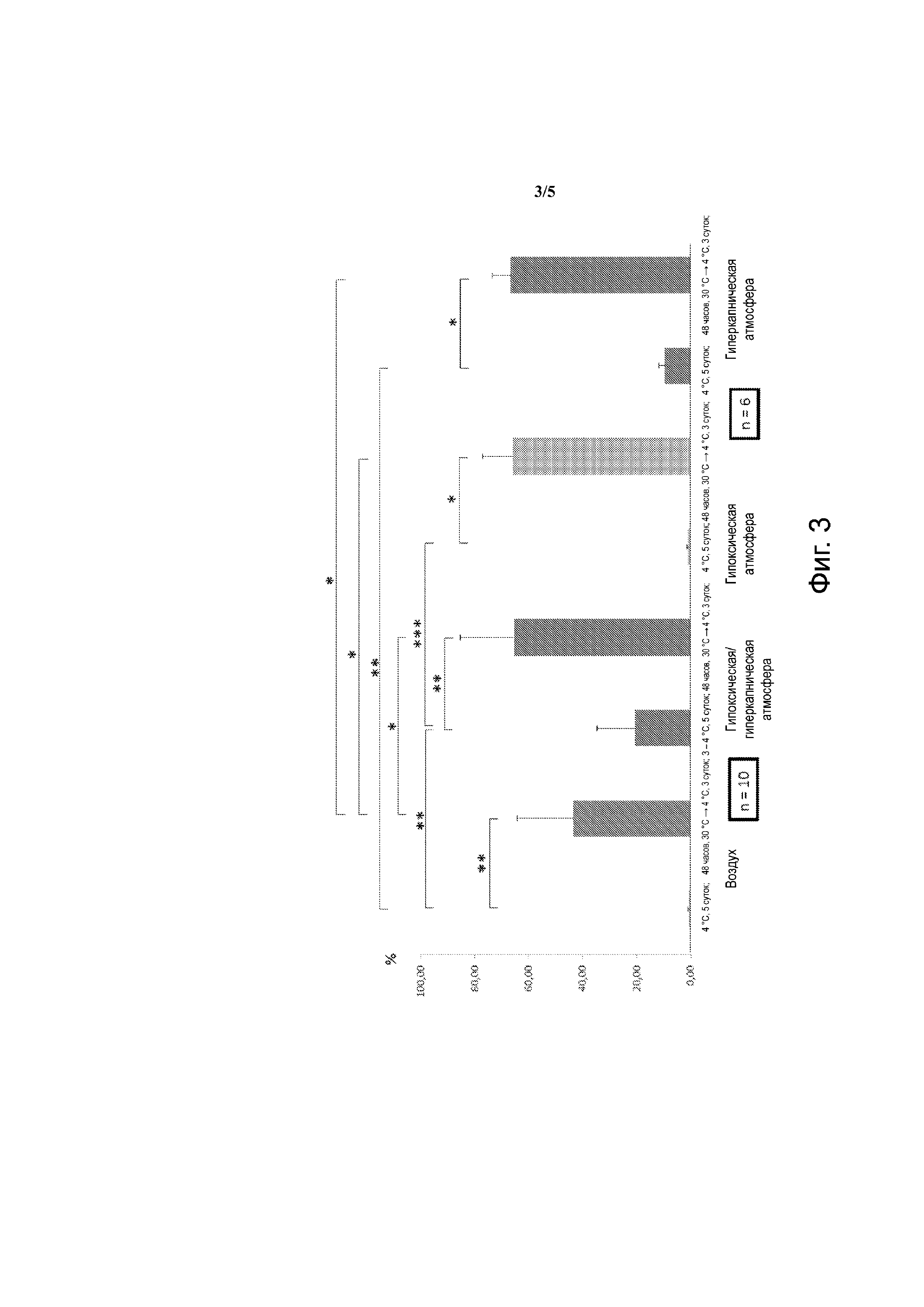
Фиг. 3 – мезенхимальные клетки человека. Выход жизнеспособных клеток по сравнению с t=0. Воздух: 21% О2, 0,01% СО2; гипоксическая и/или гиперкапническая атмосфера: 9% СО2, 5% О2; гипоксическая атмосфера: 5% О2, 0,001 СО2; гиперкапническая атмосфера: 20% О2, 20% СО2. *: р < 0,5; **: р < 0,01; ***: р < 0,001.
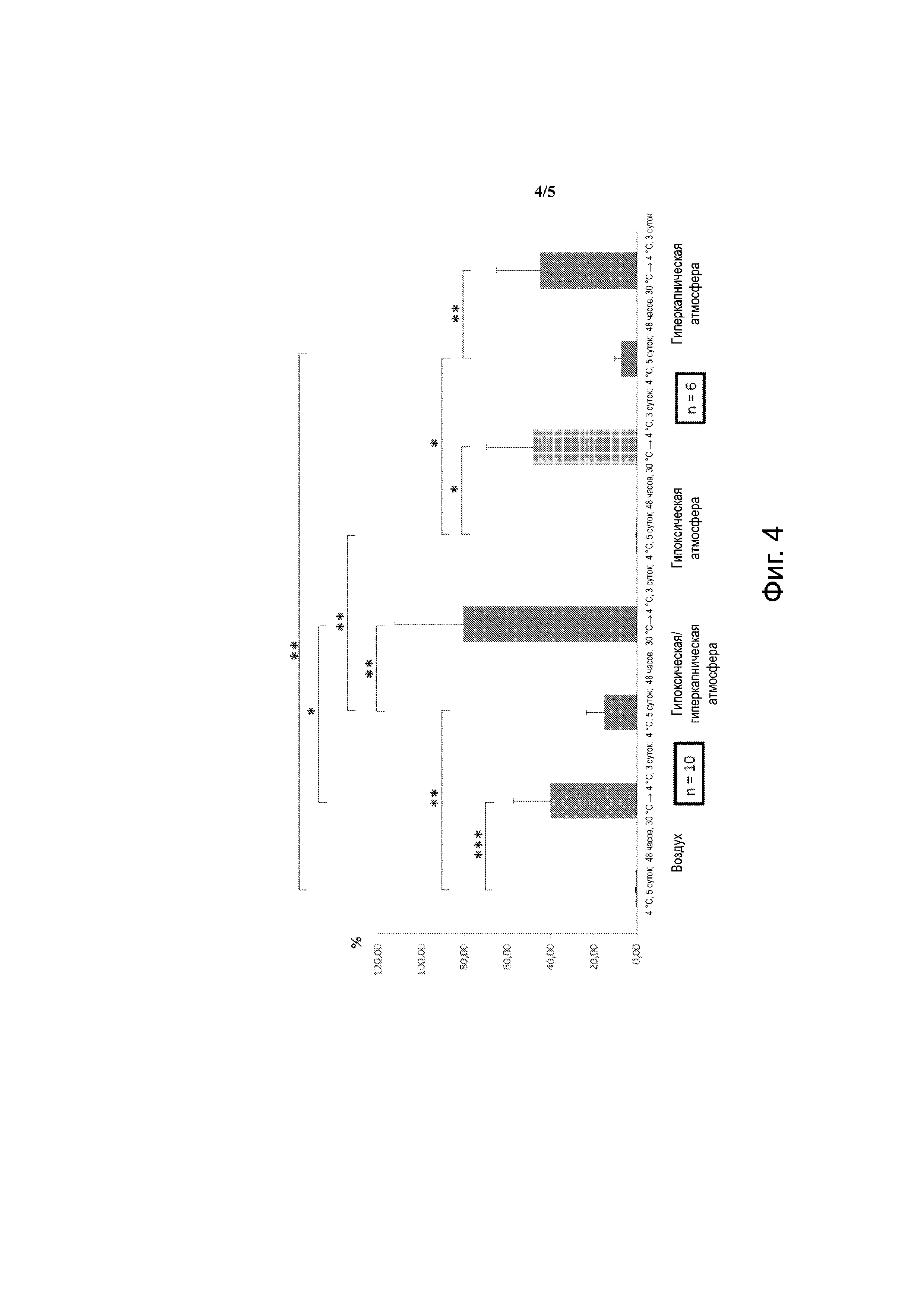
Фиг. 4 - мезенхимальные клетки человека. Выход клеток-предшественников клонального происхождения по сравнению с t=0. Воздух: 21% О2, 0,01% СО2; гипоксическая и/или гиперкапническая атмосфера: 9% СО2, 5% О2; гипоксическая атмосфера: 5% О2, 0,001 СО2; гиперкапническая атмосфера: 20% О2, 20% СО2. *: р < 0,5; **: р < 0,01; ***: р < 0,001.
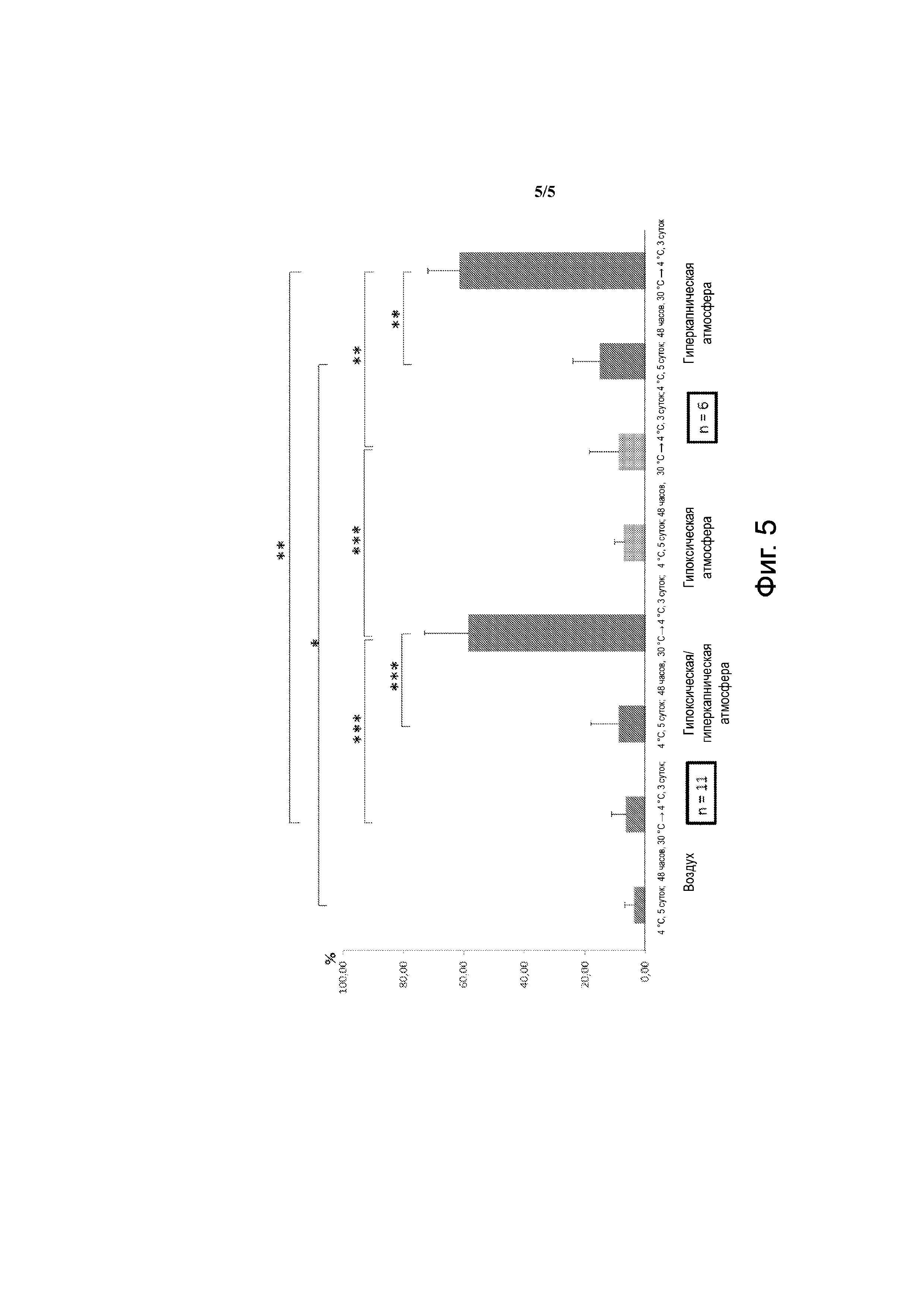
Фиг. 5 - клетки FDCPmix. Выход жизнеспособных клеток по сравнению с t=0. Воздух: 21% О2, 0,01% СО2; гипоксическая и/или гиперкапническая атмосфера: 9% СО2, 5% О2; гипоксическая атмосфера: 5% О2, 0,001 СО2; гиперкапническая атмосфера: 20% О2, 20% СО2. *: р < 0,5; **: р < 0,01; ***: р < 0,001.
Осуществление изобретения
Во время предыдущих исследований авторами данного изобретения было отмечено, что гипоксия и гиперкапния способствуют консервации гемопоэтических стволовых клеток по сравнению с выдержкой их на воздухе (Jeanne и др., 2009 г.; Ivanovic и др., 2010 г., Vlaski и др. 2014 г.).
В экспериментальной части данной заявки авторы изобретения доказали, что предварительная инкубация стволовых клеток в течение двух суток при умеренной гипертермии (30°С) до момента их перевода на хранения при 4°С очень заметно повышает выживание данных клеток и функциональную способность клеток-предшественников по сравнению с непосредственным хранением при 4°С. Полученные результаты тем более примечательны в том случае, когда предварительная инкубация проводится в сочетании с гипоксической и/или гиперкапнической атмосферой. Эти результаты, подтверждённые на трёх разных типах клеток, а именно гемопоэтических клетках CD34+, мезенхимальных клетках и клетках линии FDCPmix, указывают на то, что данный способ может использоваться для улучшения консервации клеток, тканей или органов при гипотермии, в частности, предназначенных для трансплантации.
Таким образом согласно первому аспекту данная заявка касается способа консервации in vitro или ex vivo клеток животных при глубокой гипотермии, включающего в себя этап содержания клеток при умеренной гипотермии в течение короткого периода до их консервации глубокой гипотермией.
Целью способа согласно изобретению является усовершенствование консервации клеток животных при их хранении при глубокой гипотермии без замораживания. Термин «глубокая гипотермия» в том виде, как он здесь применяется, предполагает температуры выше 0°С и ниже 15°С. Предпочтительно этот термин предполагает температуры от около 1°С до около 12°С, а именно около 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12°С, предпочтительно от около 1 до около 8°С, в частности, от около 2 до около 8°С. Более предпочтительно состояние глубокой гипотермии соответствуют температуре от около 1 до около 6°С, предпочтительно около 4°С.
В том виде, как применяется здесь выражение «около», оно означает диапазон значений ± 5% от номинального значения, предпочтительно ± 2% от номинального значения. Так, например, «около 20» содержит в себе ± 5% от 20 или от 19 до 21. Само собой разумеется, что приведённые выше показатели с выражением «около» должны также считаться специфически описанными в рамках настоящей заявки. Например, выражение «температура от около 1 до около 12°С» должна считаться температурой, означающей «температуру от 1 до 12°С». Таким же образом выражение «температура около 4°С» должна также считаться «температурой 4°С».
До приведения в состояние глубокой гипотермии клетки выдерживаются при умеренной гипотермии в течении короткого периода. В том виде, как использован термин «умеренная гипотермия» в данном случае, он указывает на температуры от около 20 до около 35°С, а именно около 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34 или 35°С, предпочтительно от около 25 до около 32°С, более предпочтительно от около 27 до около 32°С. Ещё более предпочтительно умеренная гипотермия соответствует температуре около 30°С.
При осуществлении способа согласно изобретению клетки подвергают умеренной гипотермии в течение от около 12 до около 72 часов, предпочтительно от около 24 до около 60 часов или от около 36 до около 60 часов, до их приведения в состояние глубокой гипотермии с целью консервации на более длительный срок. Предпочтительно фаза умеренной гипотермии длится от около 24 до около 48 часов, совершенно предпочтительно около 48 часов.
Согласно предпочтительному варианту выполнения клетки приводят в состояние глубокой гипотермии непосредственно после этапа умеренной гипотермии.
При осуществлении способа согласно изобретению клетки могут храниться при глубокой гипотермии в течение длительного периода, например, в течение от нескольких суток до нескольких месяцев, до момента своего применения. В частности, клетки могут храниться при глубокой гипотермии в течении более 24 часов, в частности, от 1 до 120 суток, предпочтительно от 1 суток до 1 месяца, более предпочтительно в течение от 1 до 15 суток, особо предпочтительно от 5 до 10 суток.
Клетками, хранящимися способом согласно изобретению, являются предпочтительно клетки, которые были отобраны у животного или донора, предпочтительно млекопитающего, особо предпочтительно, человека. В частности, такие клетки позднее могут быть введены реципиенту в рамках трансплантации.
Согласно предпочтительному варианту выполнения клетки не подвергаются ни замораживанию, ни хранению в состоянии глубокой гипотермии, сопровождаемой умеренной гипотермией. Предпочтительно клетки подвергаются умеренной гипотермии в течение не более 4 часов после отбора у донора. Совершенно предпочтительно клетки приводятся в состояние умеренной гипотермии сразу после их отбора, т.е. во время после отбора.
Перед консервацией клетки могут подвергаться разным анализам, таким, как серология, типирование антигена главного локуса (HLA), фенотипические, морфологические (в частности, для клеток, объединённых в виде тканей или органов) или бактериологические исследования.
Как показано в экспериментальной части, предварительный этап в виде умеренной гипотермии является достаточным для улучшения консервации клеток. Однако согласно некоторым предпочтительным вариантам выполнения данный этап комбинируется с упорядочением атмосферных условий культуры для создания гипоксической и/или гиперкапнической или гипоксической/гиперкапнической атмосферы, предпочтительно гипоксической/гиперкапнической атмосферы.
Гипоксической атмосферой служит атмосфера с пониженным содержанием молекулярного кислорода по сравнению с его содержанием в воздухе, составляющим обычно от 20 до 21%. В том виде, как употреблён здесь термин «гипоксическая атмосфера», он предполагает атмосферу с содержанием менее 10% О2. Следовательно гипоксическая атмосфера может содержать, например, от около 0,5 до около 10% О2, т.е. около 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10%. Согласно отдельным предпочтительным способам выполнения в гипоксической атмосфере содержится кислород в количестве от около 1 до около 5%. Совершенно предпочтительно в гипоксической атмосфере содержится около 5% О2. В гипоксической атмосфере концентрация диоксида углерода предпочтительно соответствует его концентрации в окружающем воздухе, а именно составляет около 0,05%. Дополнением к газовой смеси служит, как правило, диоксид азота.
Гиперкапнической атмосферой является атмосфера с содержанием диоксида углерода, превышающим его содержание в воздухе, составляющее обычно менее 0,05%. И том виде, как термин «гиперкапническая атмосфера» употреблён здесь, он означает предпочтительно атмосферу с содержанием свыше 5% СО2. Таким образом в гиперкапнической атмосфере может содержаться СО2, например, в количестве от около 5 до около 20%, т.е. около 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20%. Согласно некоторым предпочтительным вариантам выполнения в гиперкапнической атмосфере содержится от около 5 до около 10% СО2, предпочтительно от около 6 или 7 до около 10% СО2. Согласно другим предпочтительным вариантам выполнения в гиперкапнической атмосфере содержится от около 6 до около 20% СО2, предпочтительно от около 9 до около 20% СО2. Совершенно предпочтительно в гиперкапнической атмосфере содержится около 9% СО2. В гиперкапнической атмосфере концентрация молекулярного кислорода соответствует предпочтительно его концентрации в окружающем воздухе, а именно 20 – 21%. Дополнением к газовой смеси служит, как правило, диоксид азота.
Гипоксической/гиперкапнической атмосферой служит атмосфера с пониженным содержанием молекулярного кислорода и повышенным содержанием диоксида углерода по сравнению с их обычным содержанием в окружающем воздухе. Более специфично, как это употреблено здесь, термин гипоксическая/гиперкапническая атмосфера означает атмосферу с содержанием менее 10% О2 и более 5% СО2. Предпочтительными диапазонами значений О2 и СО2 являются такие, как они охарактеризованы выше для гипоксических и гиперкапнических условий. Особо предпочтительно гипоксическая/гиперкапническая атмосфера содержит в себе около 5% О2 и около 9% СО2. Дополнением к газовой смеси служит, как правило, диоксид азота.
Каждая из этих специальных газовых смесей может быть получена способами, которые хорошо известны специалисту, в частности, в инкубационных камерах с контролируемой атмосферой, предлагаемых многочисленными торговцами.
Клетки, законсервированные способом согласно изобретению, могут быть любой клеткой животного, для которой требуется консервация посредством глубокой гипотермии.
Предпочтительно клетками являются клетки млекопитающих, особо предпочтительно человека.
Согласно предпочтительному варианту выполнения клетками являются клетки для трансплантации реципиенту, которые предпочтительно отобраны у донора. Донор и реципиент могут быть одним лицом (аутогенная трансплантация) или же разными лицами (гомотрансплантация).
Клетки могут быть отдельно взятыми или объединёнными в виде тканей или органов.
Согласно варианта выполнения сохраняемые клетки являются отдельными. Эти клетки могут быть отобраны, например, из группы, состоящей из клеток кожи, клеток хряща, костных клеток, эндотелиальных клеток, мышечных клеток, невральных клеток, клеток сетчатки, панкреатических клеток, кровяных клеток или стволовых клеток или клеток-предшественников, способных дифференцироваться на названные клетки.
Стволовыми клетками могут быть стволовые плюрипотентные клетки (способные дифференцироваться на любые типы клеток организма), стволовые мультипотентные клетки (способные дифференцироваться на любые типы клеток разных тканей) или унипотентные клетки (способные дифференцироваться на типы клеток одной ткани). Клетками-предшественниками являются клетки, способные дифференцироваться на разные типы клеток одной ткани. Они могут быть олигопотентными (способными дифференцироваться на небольшое число типов клеток, например, клетки-предшественники CFU-GEMM), бипотентными (способными дифференцироваться на два типа клеток, например, клетки-предшественники CFU-GM) или унипотентными (способными дифференцироваться на один тип клеток, например, клетки-предшественники CFU-G, CFU-M, CFU-MK, BFU-E, CFU-E). В отличие от клеток-предшественников стволовые клетки обладают реальной способностью к самообновлению и способностью к значительно более высокой пролиферации.
Согласно варианта выполнения стволовыми клетками являются плюрипотентные стволовые клетки, выбранные из эмбриональных стволовых клеток, взрослых мультипотентных клеток-предшественников (или MAPC) или индуктированных плюрипотентных стволовых клеток.
Эмбриональные стволовые клетки происходят из внутренней клеточной массы бластоцисты и обладают способностью образовывать любые ткани организма (мезодерму, эндодерму, эктодерму), в т.ч. клетки зародышевой линии. Плюрипотенцию эмбриональных стволовых клеток можно определить по присутствию маркеров, таких, как факторы транскрипции ОСТ4 и NANOG, и поверхностных маркеров, таких, как SSEA3/4, Tra-1-60 и Tra-1-81. Эмбриональные стволовые клетки могут быть получены без разрушения эмбриона, из которого они извлекаются, например, с помощью приёма, описанного Chung и др. (2008 г.). Согласно частному варианту выполнения эмбриональные стволовые клетки, по правовым или этическим нормам, не являются эмбриональными клетками человека. В целом согласно частному варианту выполнения клетки, сохраняемые способом по изобретению, не являются эмбриональными стволовыми клетками человека.
Взрослые мультипотентные клетки-предшественники могут дифференцироваться, подобно эмбриональным стволовым клеткам, на клетки, происходящие из любого из трёх зародышевых листков, и выражают факторы транскрипции ОСЕ4 и NANOG. Эти клетки могут быть выделены из разных органов, в частности, из костного мозга (Schwartz и др. 2002 г.).
Индуктированными плюрипотентными стволовыми клетками являются плюрипотентные клетки, полученные генетическим перепрограммированием дифференцированных соматических клеток. Помимо их морфологии, потенциала самообновления и плюрипотенции, которые схожи с этими же показателями эмбриональных стволовых клеток, плюрипотентные стволовые клетки обладают также эпигенетическим перепрограммированием с общим профилем метилирования гистонов и экспрессии генов, очень близким профилю эмбриональных стволовых клеток. В частности, эти клетки являются положительными для маркеров плюрипотенции, в частности, окрашивание в щелочную фосфатазу и экспрессия протеинов NANOG, SOX2, OCT4, SSEA3/4. Способы, позволяющие получать индуктированные плюрипотентные стволовые клетки, среднему специалисту хорошо известны и описаны, в частности, в статьях Yu и др. (2007 г.), Takahashi и др. (2007) и Nakagawa и др. (2008 г.).
Согласно другому варианту выполнения стволовыми клетками выступают мультипотентные стволовые клетки. Не ограничивающие примеры на мультипотентные стволовые клетки включают в себя гемопоэтические клетки, способные дифференцироваться на кровяные и иммунные клетки, которыми являются лейкоциты, эритроциты и тромбоциты, в частности, гемопоэтические стволовые клетки, выражающие антиген CD34, или мезенхимальные стволовые клетки, способные дифференцироваться на хрящевые клетки (хондроциты), костные клетки (остеобласты) и жировые клетки (адипоциты). Гемопоэтические стволовые клетки CD34+ и мезенхимальные стволовые клетки могут быть выделены из костного мозга любым приёмом, известным среднему специалисту, например, с помощью иммуно-магнитной системы или фильтрационной системы.
Согласно другому варианту выполнения стволовыми клетками являются унипотентные стволовые клетки. Не ограничивающие примеры на унипотентные стволовые клетки включают в себя стволовые клетки кожи, печени и слизистой оболочки кишечника.
Согласно предпочтительному варианту выполнения сохраняемые клетки являются стволовыми клетками или содержат их, предпочтительно гемопоэтическими или мезенхимальными стволовыми клетками или их комбинацией. Особо предпочтительно сохраняемые клетки являются гемопоэтическими стволовыми клетками.
Согласно некоторым вариантам выполнения сохраняемые клетки могут быть объединены в виде тканей или органов.
Не ограничивающие примеры на ткани, способные храниться способом согласно изобретению, включают в себя кожу, роговицу, сухожилие, костную ткань, кровеносный сосуд, нерв, сердечный клапан, амниотическую мембрану, хрящевую ткань, панкреатический островок и мышечную ткань.
Сохраняемые органы способом согласно изобретению могут быть цельными, например, цельная почка или печень, или частичными, например, часть печени. Не ограничивающие примеры на органы, которые могут храниться способом согласно изобретению, включают в себя почку, печень, сердце, пуповину, плаценту, кишечник, лёгкое и поджелудочную железу.
Согласно способу по изобретению клетки, ткани или органы могут храниться в любой пригодной для этого среде, предпочтительно жидкой. Существует множество сред, пригодных для консервации клеток, тканей или органов. Средний специалист может легко выбрать соответствующую среду с учётом консервируемого типа клеток, тканей или органов. Такие среды описаны, например, в международных заявках на патент WO 2014/057220, WO 2014/120014, WO 2012/129538, WO 2011/159359, WO 06/052133, WO 97/33978, WO 00/02572. Также многочисленные коммерсанты предлагают соответствующие среды, такие, как, например, среды HP01 и HP02 Macopharma, среды Stem alpha A и Stem alpha S3 Stemcell или среда Viaspan (или “University of Wisconsin solution”).
Предпочтительно среда обеспечивает выживание клеток без стимуляции их пролиферации.
Одним из преимуществ способа согласно изобретению является то, что он не требует применения криопротекторов в среде для консервации. Она может вводиться непосредственно, в частности, при трансплантации гемопоэтических стволовых клеток или требуется лаваж трансплантата перед применением.
В случае применения органов или тканей они могут быть погружены в объём среды с полным покрытием.
Перед применением клеток, в частности, при трансплантации могут быть проведены разные тесты для проверки качества трансплантата, например, замер апоптоза или тест на клональное происхождение клеток-предшественников CFU-GM (Colony Forming Unit – Granulocyte Macrophage) или CFC-GM (Colony Forming Cells-Granuloсyte Macrophage), проводимый в рамках контроля за качеством гемопоэтических трансплантатов.
Согласно другому аспекту настоящая заявка относится также к набору.
По первому варианту выполнения в него входят:
- среда для консервации клеток,
- первый стерильный контейнер для размещения клеток, тканей или органов и среды для консервации клеток,
- устройство для создания гипоксической/гиперкапнической атмосферы в первом контейнере, содержащем клетки, ткани или органы.
Факультативно первый стерильный контейнер может предварительно заполняться средой для консервации клеток.
Гипоксическая и/или гиперкапническая атмосфера может создаваться в первом контейнере после размещения в нём клеток, тканей или органов.
Согласно частному варианту выполнения упомянутый контейнер имеет вход и выход, обеспечивающие газовые обмены, при этом устройство, позволяющее создавать гипоксическую и/или гиперкапническую атмосферу, используется для впуска требуемой атмосферы в этот контейнер. Эти вход и выход затем закрываются для выдержки клеток, тканей или органов в указанной атмосфере. Устройство, позволяющее создавать гипоксическую и/или гиперкапническую атмосферу, является преимущественно устройством под давлением, таким, как сменный газовый баллон.
Согласно другому частному варианту выполнения стерильный контейнер, содержащий клетки, ткани или органы, может быть помещён в инкубационную камеру с контролируемой атмосферой, позволяющую создать гипоксическую и/или гиперкапническую атмосферу.
Согласно второму способу выполнения набор может содержать стерильный контейнер для размещения клеток, тканей или органов и среды для консервации клеток, содержащую гипоксическую и/или гиперкапническую атмосферу. Факультативно этот стерильный контейнер может быть предварительно заполнен средой для консервации клеток.
Набор согласно изобретению может содержать дополнительно второй контейнер для выдержки первого контейнера и/или клеток, тканей или органов при контролируемой температуре.
Этот второй контейнер позволяет выдерживать клетки, ткани или органы при умеренной гипотермии предпочтительно сразу после их отбора. Этот же контейнер может затем использоваться для размещения клеток, тканей или органов при глубокой гипотермии. В качестве альтернативы для клеток, тканей или органов контейнер может быть заменён при размещении на хранение при глубокой гипотермии.
Средой для консервации клеток может служить любая среда для консервации, например, как описанная ниже, и адаптирована к подлежащим консервации клеткам, тканям или органам.
Набор согласно изобретению приспособлен особенно для транспортировки и консервации клеток, тканей или органов донора для реципиента при трансплантации.
Факультативно набор может также содержать другие ёмкости, такие, как ёмкость для размещения пробы крови донора с целью определения её группы или ёмкость для размещения пробы селезёнки или ганглия для типирования антигена главного локуса.
Также настоящее изобретение относится к применению набора, описанного выше и предназначенного для осуществления способа согласно изобретению.
Все приведённые в данном описании ссылки указаны в библиографии к настоящей заявке. Другие признаки и преимущества изобретения подробнее поясняются примерами, приведёнными в качестве иллюстрации и не являющимися ограничивающими.
Примеры
Пример 1. Клетки CD34+ плацентарной крови
Технические средства и методы
После отделения клеток CD34+ посредством иммуно-магнитной системы их инкубировали в течение ночи в культуре при 37°С в среде НР01 (Macopharma) в присутствии SCF (Stem Cell Factor – ген стволовой клетки) (100 нг/мл), тромбопоэтина (20 нгг/мл) и IL 3 (1 нг/мл) при концентрации около 105 клеток на 1 мл. Эта среда обеспечила выживание клеток CD34+ без стимуляции их пролиферации. Данную культуру распределили между 8 герметичными колбами (в 2 из них с учётом атмосферного состояния: i) воздух (21% О2, 0,01% СО2), ii) гипоксическая/гиперкапническая атмосфера (9% СО2, 5% О2), iii) гипоксическая атмосфера (5% О2, 0,001% СО2), iv) гиперкапническая атмосфера (20% О2, 20 СО2)). Все колбы выдержали в течение ночи (около 16 ч.) при 37°С, затем в течение 1 ч. в изменённой атмосфере согласно приведённым состояниям при 37°С. Одну колбу с учётом состояния выдерживали непосредственно при +4°С в течение 13 суток, другую – при 30°С в течение 2 суток и затем при +4°С в течение 11 суток (всего в течение 13 суток). В конце этого периода клетки подогревали до 37°С в течение 2 ч. и оценивали с точки зрения жизнеспособности/апоптоза путём анализа экспрессии аннексина V и фиксации йодида пропидия, а также посредством функционального теста на способность образовывать колонии полутвёрдой культуры (Duchez и др., 2013 г.).
Результаты
На фиг. 1 показан выход жизнеспособных и не поражённых апоптозом клеток. Представленные на этой фигуре результаты говорят о том, что непосредственное нахождение в состоянии глубокой гипотермии при +4°С и хранение клеток в течение 13 суток на воздухе привели к потере всего количества жизнеспособных клеток.
Если суспензии непосредственно подверглись действию температуры +4°С в гипоксической/гиперкапнической атмосфере, то после 13 суток выжило около 10% клеток. Этот положительный эффект гипоксии/гиперкапнии возрастает в 4 раза в том случае, когда клетки были предварительно инкубированы в течение 2 суток при умеренной гипотермии (30°С).
Только одна гипоксия в сочетании с предварительной инкубацией при 30°С увеличивает выживание клеток умеренно, в то время как без такой предварительной инкубации она вообще не имеет положительного эффекта.
Только одна гиперкапния проявила себя благоприятной с или без предварительной инкубации, однако эффект с применением предварительной инкубации в состоянии умеренной гипотермии возрастает в 6 раз.
Совершенно схожие результаты получены в отношении клеток-предшественников клонального происхождения в исследованных условиях (фиг. 2). Следовательно эти данные отчётливо показывают, что сочетание гиперкапнии и гипоксии с предварительной инкубацией при умеренной гипотермии существенно повышает выживаемость клеток CD34+, а также клеток-предшественников плацентарной крови, имеющих клональное происхождение. Период наблюдения (13 суток) был чрезвычайно длительным, но уровень выживания клеток и клеток-предшественников (40 – 65%) превзошёл все ожидания.
Пример 2. Мезенхимальные клетки
Технические средства и методы
Для большей ясности в данном примере рассмотрены только мезенхимальные клетки, способные образовывать колонии слипшихся фибробластоидных клеток (CFU-F).
Мезенхимальные клетки, произведённые из предварительно замороженного костного мозга человека (клетки, задержанные фильтрами при фильтрации костного мозга перед трансплантацией), были разморожены и обработаны (α МЕМ, 10% SVF, β FGF (1 нг/мл), глютамин L (2 мМ), 0,5% пенициллин-стрептомицина) при 37°С и 5% СО2 в 9 колбах и подвергнуты амплификации до слияния. Затем колбы аэрировали при 37°С следующим образом: i) воздух (21% О2, 0,01% СО2), ii) гипоксия/гиперкапния (9% СО2, 5% О2), iii) гипоксия (5% О2, 0,001% СО2), iv) гиперкапния (20% О2, 20% СО2) (две колбы с учётом состояния; 9-я колба использовалась для анализа на жизнеспособность/апоптоз и для тестирование на клональное происхождение перед консервацией гипотермией). По каждому состоянию первую колбу подвергли непосредственно воздействию температуры +4°С и хранили при ней 5 суток, вторую колбу выдержали в течение 48 часов при 30°С, затем в течение 3 суток при 4°С. Через 5 суток клетки подогрели в течение 2 часов до 37°С и анализировали (на жизнеспособность/апоптоз и способность к клональному происхождению под действием культур CFU-F, см. пример 1).
Результаты
Как показано на фиг. 3, пребывание в течение 48 часов в состоянии умеренной гипотермии резко увеличило выживание мезенхимальных клеток, даже на воздухе, где смертность клеток является полной, если они были инкубированы в течение 5 суток при +4°С.
Гипоксия/гиперкапния повышают выживание мезенхимальных клеток, подвергнутых непосредственно воздействию температуры +4°С, этот эффект возрастает в три раза при прохождении через температуру 30°С.
При прохождении через умеренную гипотермию, гипоксию и гиперкапнию каждая из них обеспечивает максимальное сохранение мезенхимальных клеток (в районе 70%). Совершенно схожие результаты получены для мултипотентных стволовых клеток (CFU-F) (фиг. 4).
Пример 3. Клетки линии FDCPmix
Технические средства и методы
Клетки FDCPmix были подвергнуты амплификации при 37°С и 5% СО2 в среде RPMI c добавкой 20% конской сыворотки и 8% кондиционированной среды WEHI – источник интерлейкина 3. Затем клетки распределили по двум колбам с учётом состояния при следующих условиях: i) воздух (21% О2, 0,01% СО2), ii) гипоксия/гиперкапния (9% СО2, 5% О2), iii) гипоксия (5% О2, 0,001% СО2), iv) гиперкапния (20% О2, 20% СО2). Последующий протокол был тот же, что и для мезенхимальных клеток в примере 2.
Результаты
Сохранность клеток FDCPmix оказалась посредственной на воздухе и в состоянии гипоксии/гиперкапнии (непосредственно при +4°С) без прохождения через умеренную гипотермию.
Зато сочетание гипоксии/гиперкапнии или только гиперкапнии с прохождением через умеренную гипотермию обеспечивает очень хорошую сохранность, составляющую около 60% клеток FDCPmix (фиг. 5).
Библиография
Chung и др. Сell Stem Cell., 7 февраля 2008 г., 2(2) :113-7
Duchez и др. Transfusion. Cентябрь 2013 г., 53(9):2012-9
Hechler и др. Ann Hematol, 1996 г., 72 : 303-6
Ivanovic и др. Transfusion. Январь 2010 г., 50(1):120-7
Jeanne и др. Transfusion. Август 2009 г., 49(8):1738-46
Nakagawa и др. Nat Biotechnol. Январь 2008 г., 26(1):101-6
Schwartz и др. J. Clin Invest. Май 2002 г.; 109(10):1291-302
Takahashi и др. 2007 г., Cell 131 (5):861-872
Vlaski и др. J Cell Physiol., 2014 г., 229: 2153-2165
Yu и др., 2007 г.Science 318 (5858): 1917-1920.