Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ АЛЛЕРГЕНА ТУБЕРКУЛЕЗНОГО ДЛЯ ДИАГНОСТИКИ ЗАБОЛЕВАНИЯ И ПИТАТЕЛЬНАЯ СРЕДА, ПРЕДНАЗНАЧЕННАЯ ДЛЯ ЭТОГО
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Изобретение относится к биотехнологии и медицинской промышленности, к способам получения аллергенов, в частности к получению туберкулина для диагностики туберкулеза у человека, в том числе у детей (для массового скрининга и эпидемиологических обследований).
Уровень техники
Туберкулез остается одной из острых медико-социальных проблем России. Туберкулез является хронической прогрессирующей микобактериальной инфекцией, чаще всего поражающей легкие, имеющей латентный период после начального инфицирования. Россия входит в число 22 стран мира с высоким бременем туберкулеза (GlobalTuberculosisReport2018. Geneva: WorldHealthOrganization; 2018, 265 p.).Для предотвращения тяжелых форм заболевания, успешного и своевременного лечения сохраняет актуальность расширение охвата диагностических процедур и повышения их качества. Кожные тесты с туберкулином являются традиционным методом исследования напряженности иммунитета к возбудителю туберкулеза для массовой диагностики. Реакция на туберкулин является классическим примером реакции гиперчувствительности замедленного типа.
Все очищенные туберкулины готовят по одной общей схеме: выращивают микобактерии на плотных, затем жидких средах, инактивируют посевы, выделяют осаждением белок – туберкулопротеин, и проводят его очистку. Количество пересевов штаммов–продуцентов регламентировано требованиями ВОЗ и Государственной фармакопеей Российской Федерации (Серия технических докладов ВОЗ № 745 /Всемирная организация здравоохранения & Комитет экспертов ВОЗ по стандартизации биологических препаратов: тридцать шестой доклад [на совещании, состоявшемся в Женеве с 12 по 18 ноября 1985] // Выпущено издательством "Медицина" по поручению Министерства здравоохранения Союза Советских Социалистических Республик, которому ВОЗ вверила публикацию данного издания на русском языке.- 1988. – 137 с.; Государственная фармакопея Российской Федерации. Министерство здравоохранения Российской Федерации. – 14 издание. – в 4-х т. – 7020 с.).Однако технология приготовления очищенных туберкулопротеинов варьирует: используются разные туберкулиновые штаммы, различный состав питательных сред (плотные, жидкие, синтетические), сроки и способ выращивания микобактерий (глубинное или поверхностное), реактивы для осаждения белка, влияющие на его состав, способы последующей очистки туберкулопротеина.
В силу этого в ряду полученных туберкулинов их показатели достаточно разнородны, как по показателям очищенности, так и по эффективности действия.
Кроме того, в процессе приготовления получаемого туберкулина значительная роль отводится среде, на которой выращивают штаммы.
Использование специальной среды обеспечивает равномерность слоя выращенных бактерий, оптимальное количество пассажей,оптимальное или ускоренное время роста бактерий.
Ранее основой для производства аллергена туберкулезного являлась«классическая» среда Линниковой и Могилевского, описанная в авторском свидетельстве SU 1069783 A «Способ получения туберкулезного диагностикума»:
|
Гликокол служит источником азота, глицерин - источником углеводов и энергетических ресурсов, калий фосфорнокислый, магний сернокислый, натрий хлористый и натрий углекислый, железо и аммоний лимоннокислый - источником микроэлементов.Среда обеспечивает хорошие показатели, а именно: показывает активный рост туберкулезной культуры и высокое туберкулинообразование.Однако, туберкулин, полученный на данный среде, имеет трудности в выделении и очистке, т.к. компоненты среды сложно отделить от культуры микобактерий, что приводит к дополнительной контаминации получаемого аллергена и повышению аллергических реакций.
Это послужило основанием для разработки новых способов производства туберкулина и новых синтетических сред для культивирования микобактерий, участвующих в процессе создания аллергена.
Известен способ получения очищенного туберкулина по Ф.Зейберту (Коровкин В.С. 125 лет туберкулину: страницы истории / Здравоохранение. Healthcare. – 2016. - № 11. – с. 55-61): после выращивания культуры на синтетической среде, удаления микробных тел и ультрафильтрации культуральной жидкости производили осаждение белка трихлоруксусной кислотой, удаление кислоты эфиром, замораживание и высушивание полученного вещества. Препарат высушивали методом лиофилизации.В окончательном виде диагностический препарат представляет собой желтовато-коричневый порошок, требующий растворения перед использованием в физиологическом растворе с прибавлением щелочи.Данная среда также не обеспечивает оптимальный рост микобактерий и высокое туберкулинообразование.
Способ получения сухого очищенного протеин-деривата на синтетической безбелковой среде М.А.Линниковой позволил получить туберкулин в жидком виде (Линникова М.А. Очищенный протеин дериват туберкулина // Проблемы туберкулеза. – 1939. - № 12. – 3-12 с.).При анализе выяснилось, что полученный туберкулин имеет ограниченный срок активности, что является существенным недостатком при производстве, хранении и использовании диагностических препаратов.
Улучшения способов очистки субстанции туберкулинов (осаждение трихлоруксусной кислотой, обработка этиловым спиртом и наркозным эфиром) после культивирования на «синтетической среде Линниковой» позволили наладить производство очищенного туберкулина в порошке (Линникова М.А., Лянда-Геллер Б.А., Шумахер А.Ф., Кичагова О.И. Алкогольное фракционирование очищенного сухого туберкулина, химические и биологические характеристики. // Вопросы прикладной химии. – Москва. – 1960. – с. 221-42.).Описанная технология производства позволила увеличить срок годности полученного туберкулина, однако, туберкулин обладал невысокой активностью.
Ближайшими аналогами являются способы, описанный в патенте
RU 2538624 С1 от 04.09.2013 «Способ получения туберкулина для массовой диагностики и профилактики туберкулеза» и китайской заявке CN109182167 от 11.01.2019.
Способ, описанный в заявке CN109182167, включает проведение 1-2 пассажей на яичной среде и 3-4 пассажей на среде Сотона, при этом последний пассаж проводят в течение 8-10 недель, рабочим штаммом Mycobacteriumtuberculosis является штамм CMCC93009 (H37Rv). При этом, были получены фракции с молекулярной массой менее 15 кДа. Данные фракции характеризуются низкой активностью и специфичностью. Ранее в литературе было показано, что фракции с большой молекулярной массой обладают низкой активностью и специфичностью, а фракции молекулярной массой 10 000-20 000 Да более активны в кожном тесте (Леви Д.Т., Александрова Н.В., Лебединская Е.В. Туберкулодиагностика: история и перспективы. // Иммунология. – 2018. - № 39. – с.5-6.). Кроме того, данный способ производства опробован только на одном штамме микобактерий, что накладывает определенные ограничения на производство. Таким образом, способ получения туберкулопротеина согласно CN109182167A имеет свои недостатки и требует улучшения.
Наиболее близким аналогом является изобретение, раскрытое в патенте RU 2538624 С1 от 04.09.2013 «Способ получения туберкулина для массовой диагностики и профилактики туберкулеза», где состав по сравнению с «классической» средой Линниковой и Могилевского содержит на 10% меньше компонентов питательной среды. Вследствие этого культивирование микобактерий туберкулеза невозможно более 8 недель. При этом, также используют только по 1 штамму двух видов туберкулезной культуры: человеческого вида - штамм «ДТ/St» и бычьего вида - штамма «Vallee», что также накладывает ограничения на производство.
Также в описанном способе используется синтетическая питательная среда следующего состава:
|
Способ согласно RU 2538624 позволяет получить туберкулопротеин с более высокой специфической активностью и продукт на основе него при использовании сравнительно меньшей дозы-навески аллергена-туберкулопротеина.Однако, согласно способу данная среда также не является оптимальной, т.к. не наблюдается равномерного роста бактерий, а также среда не выдерживает более 3 пассажейв течение 6-8 недель и применима только для человеческого вида штамма «ДТ/St» и бычьего вида штамма «Vallee».При этом, согласно способу, описанному в патенте RU 2538624, стерилизация микобактерий туберкулеза в автоклаве паром под давлением при температуре 100-102°C, давлении 0,05-0,15 кгс/см2 в течение 55-65 мин губительно действует на микобактерии и активность туберкулопротеина, т.к. в процессе нагревания происходит как частичная денатурация находящегося в культуральной среде туберкулопротеина, так и дезинтеграция его крупных мицелл с образованием высокомолекулярных туберкулополипептидов. Это способствует утрате туберкулином его антигенных свойств, то есть способности образовывать специфические антитела и вызывать сенсибилизацию здорового организма. Таким образом, если получаемый аллерген туберкулезный изначально имеет низкую активность, то при выделении возможна потеря активности ниже предельного уровня. При этом, выделение туберкулопротеина и получение аллергена туберкулезного представляет собой трудоемкий и длительный производственный процесс, и снижение специфической активности ниже предельных уровней может быть достаточно критичной.
Таким образом, актуальной является разработка способа получения аллергена туберкулезного (туберкулопротеина), позволяющего получить субстанцию туберкулопротеинов, сохраняющих свои свойства: высокую специфичную активность и низкую аллергенность, при общем высоком выходе туберкулопротеина.
Краткое описание фигур
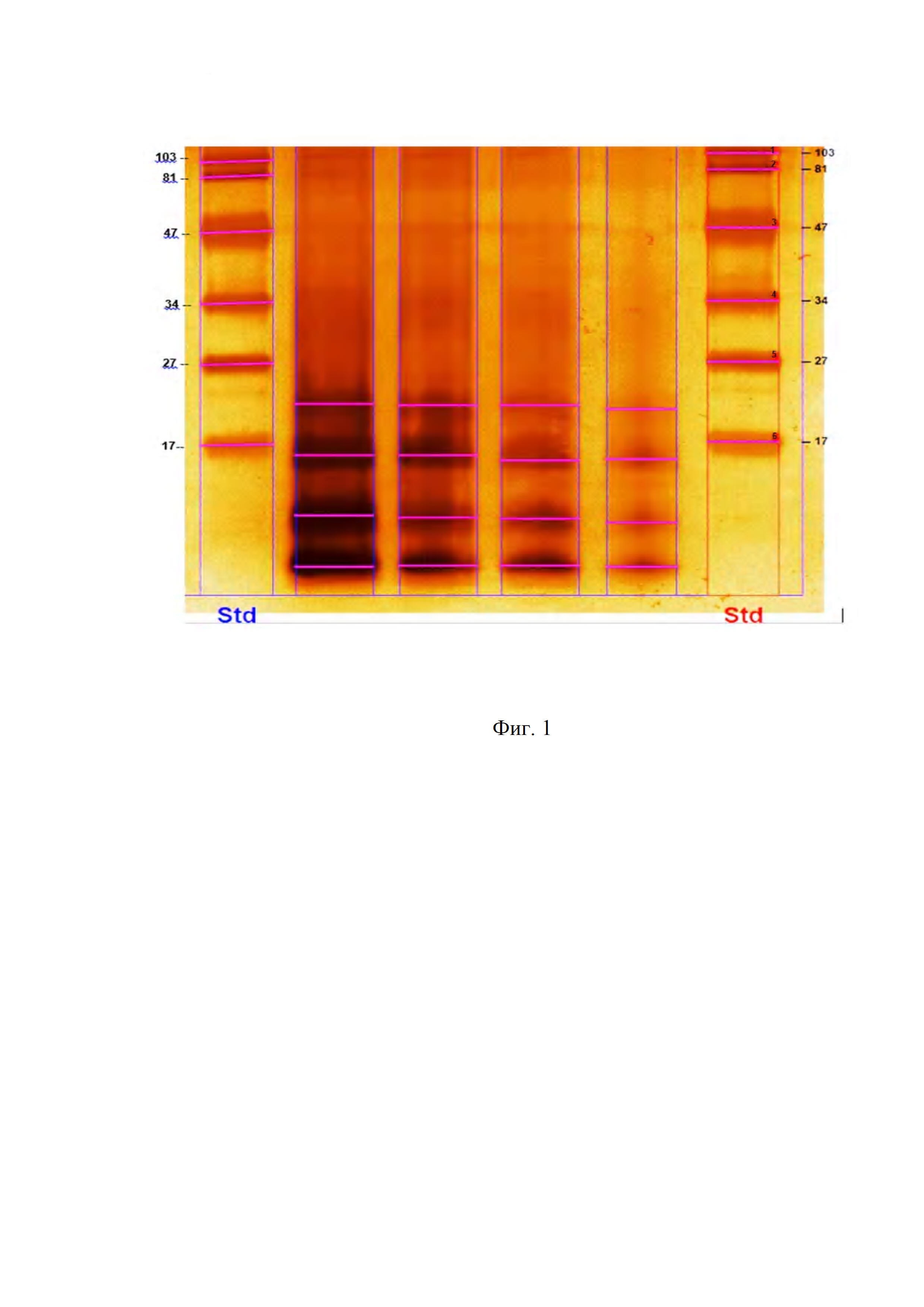
Фиг. 1. Гель-хроматограммафракции туберкулопротеина, полученного способом согласно изобретению (на примере растворенного порошка субстанции туберкулопротеинов из смеси штаммов «Dt/Strain» и «Vallee»).
Обозначения:
1,6. - Белковые маркеры.
2-5. - Белки из свежеприготовленного сухого туберкулина, полученного способом согласно изобретению.
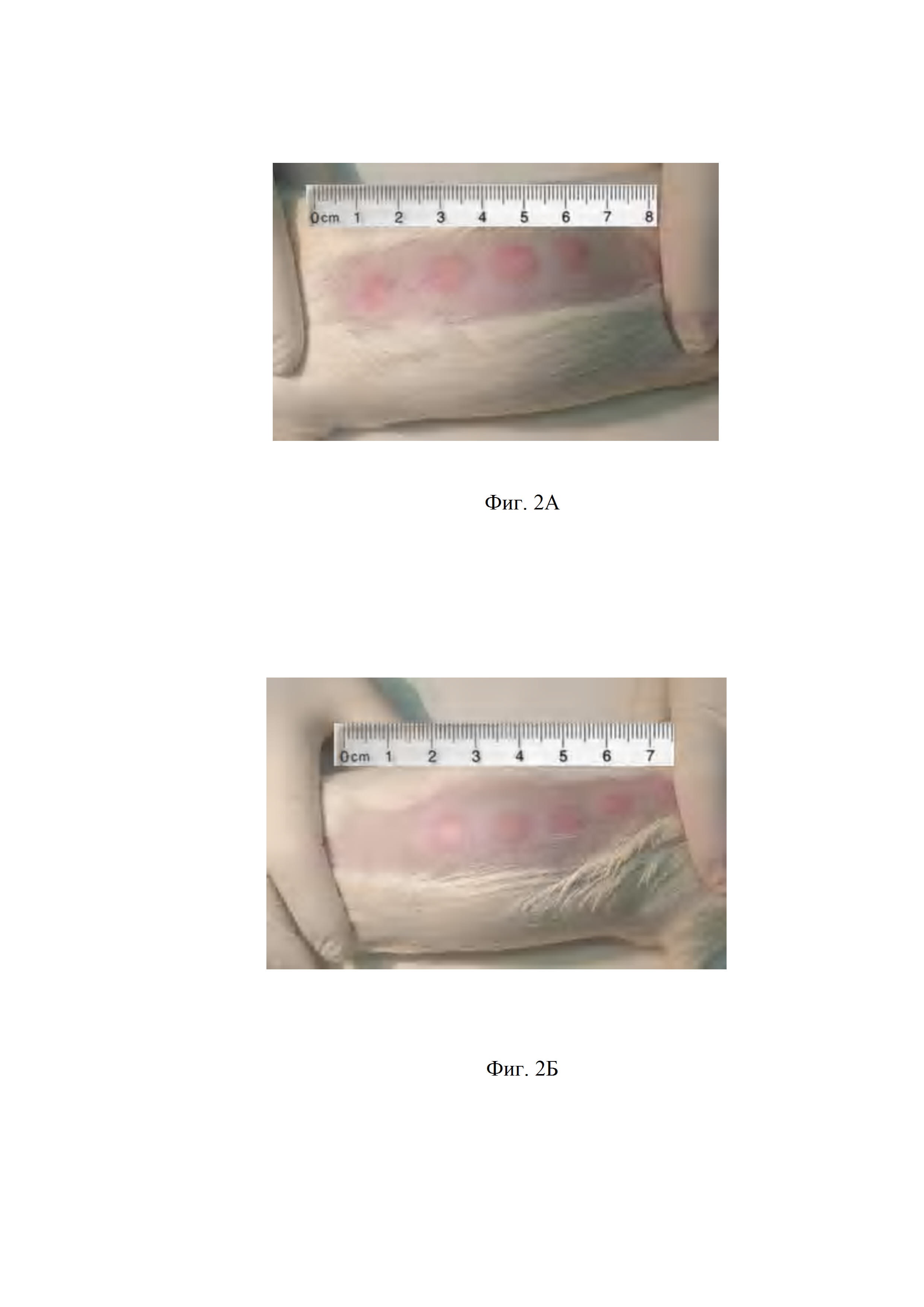
Фиг. 2А.Определение специфической активности субстанции смеси штаммов «Dt/Strain» и «Vallee», полученной согласно изобретению, при введении в количестве 2 ТЕ.
Фиг. 2Б.Определение специфической активности стандарта аллергена туберкулезного, используемого в РФ, при введении в количестве 2 ТЕ.
Описание изобретения
Согласно настоящему изобретению, предложена синтетическая питательная среда для культивирования микобактерий для получения аллергена туберкулезного, содержащая в г/л:
|
Также предложен способ получениятуберкулопротеина, включающий выращивание штаммов микобактерий на питательной среде, стерилизацию, осаждение белка с последующей его очисткой,при этом в качестве питательной среды используют синтетическую питательную средусогласно настоящему изобретению.При этом, в способе согласно изобретению в качестве штаммов микобактерий используют комбинацию штаммов туберкулезной культуры человеческого вида Mycobacteriumtuberculosis «Dt/Strain» и/или «Т-3480» и бычьего вида Mycobacteriumbovis «Vallee».
Туберкулопротеин, получаемый согласно способу по изобретению, содержитфракции с молекулярной массой примерно 21 кДа и не менее 79% общего белка.
Также предложен состав для диагностики заболевания туберкулезом, содержащий туберкулопротеин согласно изобретению, и вспомогательные вещества.
Дополнительно, согласно изобретению, предложено применение применениетуберкулопротеина, полученного согласно способу по изобретению, или состава, его содержащего, для проведения диагностики заболевания туберкулезом.
Подробное описание изобретения
Настоящее изобретение относится к аллергену туберкулезному очищенному ППД (PPD - purifiedproteinderivative), который представляет собой туберкулопротеин, полученный путем осаждения трихлоруксусной кислотой (ТХУ) очищенных ультрафильтрацией или другим адекватным методом, инактивированных нагреванием фильтратов культур микобактерий туберкулеза (МБТ) человеческого и бычьего видов. Внутрикожное введение туберкулина выявляет наличие гиперчувствительности замедленного типа, которая является следствием сенсибилизации организма при вакцинации БЦЖ или заражении микобактериями туберкулеза. Препарат предназначен для диагностики туберкулеза, определения инфицированности населения микобактериями туберкулеза, отбора контингентов для прививок БЦЖ.
В контексте данного изобретения аллерген туберкулезный, туберкулопротеин и туберкулин являются взаимозаменяемыми терминами. Также в данном документекультура микобактерий может быть указана как туберкулезная культура и может, в частности, означать штаммы туберкулезной культуры человеческого вида Mycobacteriumtuberculosis «Dt/Strain» и/или «Т-3480» и бычьего вида Mycobacteriumbovis «Vallee», отдельно или в комбинации.
Согласно настоящему изобретению, предложена синтетическая питательная среда для культивирования микобактерий для получения туберкулопротеина, имеющая следующий состав(в г/л):
|
Данная среда пригодна выращивания всех 3 видов микобактерий: M. tuberculosis «Dt/Strain», «Т-3480» и бычьего вида M. bovis «Vallee».
Также заявлен способ производства аллергена туберкулопротеина, включающий, выращивание штаммов микобактерий на питательных средах, стерилизацию, осаждение белка с последующей его очисткой, при этом в качестве штаммов используют комбинацию штаммов туберкулезной культуры человеческого вида M. tuberculosis «Dt/Strain», «Т-3480» и/или бычьего вида M. bovis «Vallee», а в качестве одной из питательных сред используют питательную среду, раскрытую выше.
Таким образом, технический результат данного изобретения заключается в том, что удалось существенно повысить общий выход туберкулопротеина(более 70%) и содержание в нем общего белка (до 79-91%) с повышением специфической активности получаемого туберкулопротеина. Применениемодифицированной синтетической среды способствовало созданию условий для культивирования 2-3 штаммов без аутолизаза счет избытка фосфора и азота, позволило наращивать 1-3 штамма в течение 8-10 недель, вырабатывать продукты жизнедеятельности – туберкулопротеины. При этом стерилизация при таком способе получения позволяет денатурировать большие неактивные молекулы, снижая сенсибилизирующие свойства получаемого аллергена туберкулезного без потери специфической активности. Полученные фракции туберкулопротеина имели молекулярную массудо 21 кДа.
Способ осуществляют следующим образом.
Лиофилизированные рабочие штаммыпосле растворения в стерильном растворе 0,9% хлорида натриязасевают в пробирки с питательной средой Павловского, инкубируют в термостате при температуре 37,0±1 °С в течение 20±1 суток.Проводят не более 2 пассажей на плотной питательной среде.
В колбы, содержащие жидкую картофельную среду, вносят штаммы микобактерии M. tuberculosis «Dt/Strain», «Т-3480» или бычьего вида M. bovis «Vallee» (каждый – в свою отдельную колбу), инкубируют в термостате при температуре 37,0±1 °С в течение 16±1 суток. После этого проводят не более 2 пассажей на жидкой картофельной среде.
На синтетической питательной среде согласно изобретению проводят не более 8 пассажей. В культуральные флаконы помещают синтетическуюсредусогласно изобретению не более чем наполовину объема.Первый пассаж служит накоплением маточной культуры,культуру микробактерий инкубируют при температуре 37,0±1°С в течение 7±2 суток. Затем засевают культуральные флаконы снова штаммами микобактерий(каждый – в свою отдельную колбу), инкубируют при температуре 37,0±1°С в течении
8-10 недель.
Состав питательной среды, описанный в данном изобретении, позволяет наращивать штаммы в избытке фосфора и азота, что позволяет вырабатывать продукты жизнедеятельности – туберкулопротеины с повышенной специфической активностью и высоким общим выходом. После культивирования проводят инактивациюавтоклавированием при температуре 101±1°С, под давлением 9,8±2,0кПав течении 60±5 мин. Инактивирование при данных условиях микроорганизмов обеспечивает дальнейшую безопасность препарата, снижениесенсибилизирующих свойств и позволяет максимально сохранить фракции с небольшой молекулярной массой, активные в кожном тесте.
После инактивации культуры микобактерий смешивают в равных объемах. Полученную смесь культур микобактерий (2-3 штамма) фильтруют через префильтры, задерживающие на своей поверхности микроорганизмы.
Далее, проводят ультрафильтрацию, перед ней смесь пропускают через мембранный фильтр для механической очистки раствора.Ультрафильтрацию проводят на мембранах с размером пор 10 кДа, пока объем не уменьшится в 8-10 раз. После чего добавляют водный раствор фенола до первоначального объема. Далее повторяют процесс ультрафильтрации еще раз.
Из полученного концентрата активный белок туберкулопротеин осаждают раствором трихлоруксусной кислоты и трижды промывают с понижением концентрации. Для полного осаждения раствор с осадком выдерживают при 2-8°C не менее 3 часов. Полученный осадок центрифугируют при 7000±500 g. Данный способ позволяет очистить осадок, содержащий активный туберкулопротеин, от полисахаридов, липидов, пигментов и др.
Полученный осадок обрабатывают концентрированным этанолом, не более 3 раз до обесцвечивания надосадочной жидкости. Тщательно перемешивают и центрифугируют при 7000±500 g,при 0-5°C.
После этанола осадок обрабатывают диэтиловым эфиром, не более 7 раз. Раствор перемешивают и центрифигируют при 7000±500 g при 0-5°C, не менее трехраз.
Полученную субстанцию высушивают, осадок собирают, взвешивают, выход составляет не менее 70%.
Контроль качества субстанции проводят в соответствии с требованиями Промышленного регламента на производство субстанции Аллергена туберкулезного очищенного в стандартном разведении по показателям:растворимость,стерильность, содержание белка, специфическую безвредность (отсутствие живых микобактерий туберкулеза),установление дозы-навески, относительная специфическая активность (R), сенсибилизирующие свойства. Каждые 5 лет смесь подлежит контролю по показателям стерильность, растворимость и относительная специфическая активность (R).
В результате реализации способа по изобретениюиз 2-3 штаммов микобактерий, выращенных на модифицированной синтетической питательной среде, после осаждения белка и очистки можно получить субстанцию туберкулина, содержащую фракции с низкой молекулярной массой до 21 кДа (наиболее активные в кожном тесте) и не менее 79±3% общего белка.
Далее, из субстанции получают состав, используемый для диагностики заболевания туберкулезом, из расчета: 1 доза составляет 2 туберкулиновые единицы, растворенные в 0,1 мл воды очищенной. Дополнительные вспомогательные вещества, которые могут быть использованы для получения стабильного состава, содержащего аллерген туберкулезный, включают растворители, стабилизаторы, регуляторы рН, и другие вспомогательные вещества, необходимые для получения стабильных инъекционных форм для внутрикожного и подкожного введения. Эти вещества могут включать хлорид натрия, дигидрофосфат калия, гидрофосфат натрия, в т.ч. в форме дигидрата, полисорбат и его производные, фенольные соединения (фенол, крезол), воду очищенную, и другие вещества, традиционно используемые для получения инъекционных форм для внутрикожного и подкожного введения.
В частности, состав включает субстанцию туберкулин в количестве 2 туберкулиновые единицы (ТЕ), натрия гидрофосфатадодекагидрата – 0,783 мг, натрия хлорид – 0,457 мг, калия дигидрофосфат – 0,063 мг, полисорбат-80 – 0,005 мг, фенол – 0,25 мг, вода очищенная – до 0,1 мл.
Отличием данного изобретения является то, что для производства аллергена туберкулопротеина в качестве рабочих штаммов используют 2-3 штамма культуры микобактерий: микобактерии человеческого вида (штаммы M. tuberculosis «Dt/Strain» и/или «Т-3480») и микобактерии бычьего вида (M. bovis - «Vallee»). Модифицированная синтетическая среда отличается большим содержанием фосфора и азота, что позволяет выращивать штаммы в течение 8-10 недель. После стерилизации, осаждения белка и очистки, полученные смеси туберкулопротеина содержат фракции с низкой молекулярной массой до 21 кДа (наиболее активные в кожном тесте) и не менее 79% общего белка. Субстанция является стабильной в течение не менее 5 лет, проверку проводили по показателям стерильности, содержания белка, специфической активности, аномальной токсичности и отсутствии сенсибилизирующих свойств.
Изобретение иллюстрируется следующими примерами осуществления. Данные примеры ни в коей мере не предназначены для ограничения объема изобретения.
Пример 1
Получение модифицированной синтетической питательной среды
Синтетическую питательную среду для культивирования готовили следующим образом.
Среда имела следующий состав:
Таблица 1.
|
Расчет компонентов питательной среды производили в расчете на объем среды 50 л. Все компоненты, кроме ортофосфорной кислоты, смешивали и растворяли в соответствующем объеме воды. Полученный раствор нагревали, доводили рН до 7±0,1 с помощью ортофосфорной кислоты, и полученную питательную среду разливали по 0,6 л. в матрацы вместимостью 1,5 л. и стерилизовали в автоклаве паром под давлением при температуре (120±1)°C, давлении (1,0±0,1) кгс/см2 в течение (60±5) мин.
Для получения субстанции туберкулопротеина использовали 3 вида культур: M. tuberculosis «Dt/Strain», «Т-3480» и M. bovis «Vallee». Каждый штамм культивировали отдельно от других. Данная среда являлась пригодной для выращивания всех указанных штаммов микобактерий.
При культивировании на данной среде микобактерийная культура позволяла наращивать каждый применяемый штамм, в течение 8-10 недель. Культура росла ровным слоем, без посторонних примесей, в течение 8-10 недель без какого-либо разрушения и аутолиза.
Далее, после инактивированиямикокультуры смешивали для получения аллергена туберкулезного.
Пример 2
Сравнение свойств питательной среды согласно изобретению с питательной средой прототипа
При сравнении питательной среды согласно RU 2538624 и среды согласно изобретению были получены следующие данные.
Дляроста (M. tuberculosis «Dt/Strain» и M. bovis «Vallee»)* использовали среду согласно RU 2538624. Для остальных штаммов использовали среду согласно изобретению.
Таблица 2. Показатели микокультур в зависимости от используемой среды.
|
Как видно, культуры микобактерий, выращенные на питательной среде согласно изобретению, имеют улучшенные показатели, чем культура микобактерий, выращенная на среде-прототипе.
Пример 3
Получение субстанции туберкулопротеинов
Получали субстанциютуберкулопротеинов из смеси штаммов «Dt/Strain»и «Vallee», смеси штаммов «Т-3480» и «Vallee», и смеси штаммов «Dt/Strain» и «Т-3480», а также из смеси всех 3 указанных штаммов. Были получены 13 серий на основании каждой смеси штаммов, выход составил 6±1,35 г, содержание общего белка 80-93%.
Лиофилизированные рабочие штаммы (1 пробирка) после растворения в стерильном растворе 0,9% хлорида натрия (1 мл) засевали в пробирки с питательной средой Павловского, инкубировали в термостате при температуре 37,0±1°С в течение 20±1 суток, каждый штамм отдельно. Для каждого штамма проводили не более 2 пассажей на плотной питательной среде.
После этого проводили не более 2 пассажей для каждого штамма на жидкой картофельной среде. В колбы объемом 500 мл, содержащие 250 мл жидкой картофельной среды, вносили микобактерии, инкубировали в термостате при температуре 37,0±1°С в течение 16±1 суток.
Каждую из культур вносили вотдельный культуральный флакон объемом 1,5 л, содержащий 600 мл модифицированной синтетической среды согласно изобретению. Первый пассаж служил накоплением маточной культуры, инкубировали при температуре 37±1°С в течение 7±2 суток. Затем засевали 20 культуральных флаконов, инкубировали при температуре 37±1°С в течении 8-10 недель. На синтетической питательной среде проводили не более 8 пассажей.
После культивирования проводилиинактивациюавтоклавированием при температуре 101±1°С, под давлением 9,8±2,0 кПа в течении 60±5 мин. Инактивирование при данных условиях микроорганизмов обеспечивало дальнейшую безопасность препарата, утрату сенсибилизирующих свойств и позволяло максимально сохранить фракции с небольшой молекулярной массой, активные в кожном тесте.
После инактивации культуры микобактерий смешивали в равных объемах. Полученную смесь, состоящую из 2 штаммов или 3 штаммов культур, фильтровали через префильтры для мембран с порами 0,8-8 мкм, состоящие из слоя боросиликатных волокон с акриловыми связующими, задерживающими на своей поверхности микроорганизмы.
Перед ультрафильтрацией смесь пропускали через мембранный фильтр из полисульфона с диаметром пор 0,45 мкм, для механической очистки раствора. Ультрафильтрацию проводили на мембранах из полисульфона с размером пор 10 кДа, пока объем не уменьшался в 8-10 раз (до 1-1,2 л). После чего добавляли 0,25% раствор фенола до первоначального объема. Далее повторяли процесс ультрафильтрации еще раз, до получения объема 1-1,2 л.
Из полученного концентрата активный белок туберкулопротеин осаждали 5% раствором трихлоруксусной кислоты и трижды промывали с понижением концентрации до 3%. Для полного осаждения раствор с осадком выдерживали при 2-8°C не менее 3 часов. Полученный осадок центрифугировали при 7000±500 g 15±2 мин. Данный способ позволял очистить осадок, активный туберкулопротеин, от полисахаридов, липидов, пигментов и др.
Полученный осадок обрабатывали 96% этанолом, в конечной концентрации 16±2% не более 3 раз, до обесцвечивания надосадочной жидкости. Тщательно перемешивали стеклянной лопаткой и центрифугировали при 7000±500 g, 15±2 мин при 0-5°C.
После этанола осадок обрабатывалидиэтиловым эфиром, в конечной концентрации 7,6% не более 7 раз. Раствор перемешивали стеклянной лопаткой и центрифугировали при 7000±500g 15±2 мин при 0-5°C, три последние обработки 23±2 мин.
Полученную субстанцию высушивали, осадок собирали, взвешивали. Выход субстанции составлял, в зависимости от использованных штаммов,6±1,5 г. Таким способом получали субстанцию из штаммов «Dt/Strain» и «Vallee», смеси штаммов «Т-3480» и «Vallee», смеси штаммов «Dt/Strain» и «Т-3480», а также из смеси всех 3 указанных штаммов.
Контроль качества субстанции проводили в соответствии с требованиями Промышленного регламента на производство субстанции Аллергена туберкулезного очищенного в стандартном разведении по показателям стерильность», содержание белка, специфическая активность, сенсибилизирующие свойства каждые 12 месяцев.
Пример 4
Характеристика полученной субстанции туберкулопротеина
Полученную субстанциютуберкулопротеина исследовали с помощью гель-хроматографии, в окрашенном16% SDS ПААГ без меркаптоэтанола, с использованиемТрис-HCl, при рН 8,3, время 1,3 часа.
Полученная гель-хроматограмма представлена на Фиг. 1.
Таким образом, видно, что был получен туберкулопротеин с молекулярной массой около 21 кДа.
Определение содержание белка проводят колориметрическим методом в соответствии с ОФС «Определение общего азота с реактивом Несслера».
Содержание белка составило не менее 79-91%, в зависимости от использованных штаммов. Самый высокий выход наблюдали для смеси штаммов «Dt/Strain» и «Vallee».
Пример 5
Определение специфической активности полученной субстанции туберкулопротеина
Определение специфической активности полученного туберкулопротеина проводили согласно стандартной методике.
Установление дозы-навески субстанции ППД, содержащей 50000ТЕ. Определение проводили на 18 сенсибилизированных морских свинках путем сопоставления активности разведений навесок порошка (субстанции) с активностью ОСО ППД–L–2 42-28-49Б. Сенсибилизировали животных внутрикожным введением в область живота (в 2места) вакцины БЦЖ, растворенной в стерильном 0,9% растворе натрия хлорида.
Три навески исследуемой субстанции ППД, массой не менее 50 мг каждая, растворяют в фосфатном буферном растворе рН 7,4± 0,05 из расчета содержания в 1 мл количества порошка равного, на 20% ниже и выше дозы навески ОСО ППД–L–2 42-28-49Б (получают три основных раствора). Каждый основной раствор сопоставляют с ОСО ППД–L–2 42-28-49Б на 6 сенсибилизированных морских свинках. Для этого из основного раствора готовят разведения 1:40, 1:200 и 1:1000 и титруют относительно 5ТЕ, 25ТЕ и 125 ТЕ ОСО ППД–L–2 42-28-49Б, вводя внутрикожно по 0,1 мл каждого сенсибилизированным морским свинкам по методу случайной выборки (например, метод латинских квадратов). Ответные реакции учитывают через 24 часа.
Статистический анализ основан на том, что зависимость lg дозы-эффект имеет линейный характер. Вычисляют средний угол наклона линий и подсчитывают логарифм относительной активности (lgR) - расстояние между параллельными линиями зависимости доза-эффект. Относительная активность (R) должна быть равна 1,0±0,2 при доверительных границах в пределах от 75 до 130% (Р=0,95). За доверительные границы принимают ±2 стандартные ошибки логарифма относительной активности. Если большая испытуемая навеска имеет по сравнению с ОСО ППД–L–2 42-28-49Бменьшую величину, следует увеличить навески и провести титрование. Если на меньшую навеску реакции будут больше, чем наОСО ППД–L–2 42-28-49Б, то следует провести титрование, используя уменьшенные навески порошка испытуемой субстанции.
Результаты определения специфической активностипредставлены в таблице 3.
Таблица 3. - Сравнения специфической активности образцов (R)
|
Способом согласно изобретению из субстанции смеси штаммов «Dt/Strain»и «Vallee» получали препарат аллерген туберкулезный очищенный 2 ТЕ,и исследовали на активность на морских свинках в сравнении со стандартным образцом РФ ОСО ППД-Л 42-28-49А.Индекс специфической активности составил I=1,00±0,05 (0,95-1,05). Результаты представлены в таблице 4 и на Фиг. 2А и Фиг.2Б.
Размер папул измеряли спустя 24 ч. после введения.
Таблица 4. – Размер папул у морских свинок, сравнительные исследования экспериментального препарата и национального стандарта
|
* - аллерген туберкулезный, полученный из штаммов «Dt/Strain» и «Vallee» способом согласно изобретению.
Как видно из данных,размер папул, полученных при введении туберкулопротеина согласно изобретению, соответствует размеру папул, полученных при введении национального стандарта туберкулопротеина.
Таким образом, полученный туберкулопротеин полностью соответствовал предъявляемым требованиям по специфической активности к аллергену туберкулина как диагностическому средству на основании национальных стандартов.
Аналогичные результаты по специфической активности наблюдали и для остальных вариантов смесей штаммов: смесь штаммов «Т-3480» и «Vallee», смесь штаммов «Dt/Strain» и «Т-3480», а также из смеси всех 3 указанных штаммов. Индекс специфической активности для этих вариантов составил I=1,00±0,05 (0,95-1,05).
Пример 6
Определение стабильности полученного туберкулопротеина
Показатели, характеризующие стабильность, определяли по методике, описанной в ФС Туберкулин очищенный (ППД) (аллерген туберкулезный очищенный).
Каждые 3 месяца субстанцию из архивных образцов проверяли по показателямстерильности, растворимости, специфической активности. Субстанцию растворяли в соотношении 2 ТЕ на 0,1 мл. 0,9% физиологического раствора и анализировали.
Отмечали отсутствие потери стерильности, растворимости, специфической активности в течение 12 месяцев.
Пример 7
Определение аллергенности (сенсибилизирующих свойств)
Определение сенсибилизирующих свойств проводили согласно стандартной методике.
Трем морским свинкам массой 300-350 г внутрикожно трехкратно с интервалом 5 сут.вводили туберкулопротеин, полученный согласно изобретению, в дозе по 125 ТЕ в 0,1 мл разведения. Спустя 15 суток этим и трем интактным морским свинкам внутрикожновводилитуберкулопротеин, полученный согласно изобретению, в дозе по 500 ТЕ в 0,1 мл. Разведения 125 и 500 ТЕ готовили из туберкулопротеина, используя 0,9 % раствор натрия хлорида. Животных содержали в условиях, исключающих контаминацию микобактериями.
Ответную реакцию учитывали через 24 ч, измеряя 2 взаимно перпендикулярных диаметра эритемы (воспалительного пятна). Реакции у первых трех свинок не отличались от реакций у контрольных животных (p>05) и составляли не более 5 мм в диаметре. Таким методом проверяли наличие сенсибилизирующих свойств у типов субстанции, полученной на основе штаммов смеси штаммов «Dt/Strain» и «Vallee», смеси «Т-3480» и «Vallee», смеси штаммов «Dt/Strain» и «Т-3480», а также из смеси всех 3 указанных штаммов.
Таким образом, полученный туберкулопротеин не обладает сенсибилизирующими свойствами и соответствует национальным стандартам по аллергену туберкулезному (очищенному туберкулину).
Пример 8
Получение состава для диагностики туберкулеза
Состав для диагностики туберкулеза готовили следующим образом.
Субстанцию, полученную в примере 3, в количестве 2 туберкулиновые единицы, смешивали с натриемгидрофосфатомдодекагидрата – 0,783 мг, натрием хлоридом – 0,457 мг, калиемдигидрофосфатом – 0,063 мг, полисорбатом-80 – 0,005 мг, фенолом – 0,25 мг и добавляют воду очищенную – до 0,1 мл.
В качестве субстанции использовали субстанцию, полученную на основе штаммов «Dt/Strain» и «Vallee», смеси «Т-3480» и «Vallee», смеси штаммов «Dt/Strain» и «Т-3480», а также из смеси всех 3 указанных штаммов.
Полученный раствор для всех вариантов субстанции был прозрачным и стабильным в течение 2 лет, при проверке каждые 3 мес.
Полученный состав вводили подкожно морским свинкам для определения специфической активности и сенсибилизирующей активности (как описано в примере 5 и 7). Наблюдали специфическую активность в соответствии с национальными стандартами и отсутствие аллергических реакций. Индекс специфической активности составил I=1,00±0,05 (0,95-1,05) для всех вариантов субстанции и состава.