Результат интеллектуальной деятельности: СПОСОБ ИНГИБИРОВАНИЯ ВСАСЫВАНИЯ И/ИЛИ ПОВЫШЕНИЯ ВЫВЕДЕНИЯ ЛИПИДОВ С ИСПОЛЬЗОВАНИЕМ D-ПСИКОЗЫ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к способу ингибирования всасывания липидов и/или повышения выведения липидов с использованием D-псикозы.
УРОВЕНЬ ТЕХНИКИ
D-псикоза, C-3 эпимер D-фруктозы, представляет собой природный сахар, присутствующий в следовых количествах в серийно производимых смесях D-глюкозы и D-фруктозы, полученных при гидролизе сахарозы или изомеризации D-глюкозы. D-псикоза представляет собой моносахарид со сладостью 70% относительно сахара. Сообщалось, что D-псикоза является подсластителем, который содержит мало или не содержит калорий, так как он не метаболизируется в организме, и который незначительно влияет на увеличение массы тела, так как он выполняет функцию ингибирования образования жировых отложений. Согласно недавно опубликованному отчету D-псикоза обладает некариогенными и антикариогенными свойствами. В этих обстоятельствах D-псикоза находится в стадии активного развития в качестве подсластителя, который имеет возможность заменить сахар, в то же время, способствуя здоровому состоянию зубов. Таким образом, D-псикоза привлекла внимание в качестве подсластителя с целью предотвращения прироста массы в пищевой промышленности за счет ее свойств и функциональных возможностей.
Министерство сельского хозяйства США (USDA) признает D-псикозу в общем безопасной (GRAS). В некоторых исследованиях сообщалось, что D-псикоза влияет на метаболизм липидов (Yasuo nagata et al., J. Agric, Food Chem., 2015, 63, 3168-3176), но, насколько нам известно, никакого отчета о применении D-псикозы для снижения всасывания липидов и повышения выведения липидов до настоящего времени не опубликовано.
Авторы настоящего изобретения обнаружили, что D-псикоза выполняет функции ингибирования всасывания липидов в тонком кишечнике и значительно увеличивает уровни липидов в фекалиях, снижает массу тела, жировую массу тела и уровни липидов в плазме (включающих свободные жирные кислоты, триглицериды, общий холестерин, холестерин не липопротеинов высокой плотности и аполипопротеин B), в результате чего нормализуются масса тела, жировая масса тела и липидные профили плазмы, и является эффективной для снижении активности синтазы жирных кислот (СЖК). Настоящее изобретение было выполнено на основе этого вывода.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
ТЕХНИЧЕСКАЯ ПРОБЛЕМА
Аспект настоящего изобретения заключается в том, чтобы предложить способ ингибирования всасывания липидов, потребляемых субъектом, и/или повышения выведения потребляемых липидов, включающий введение D-псикозы субъекту, применение композиции, содержащей D-псикозу для снижения всасывания пищевых липидов, ингибиторы синтазы жирных кислот (СЖК), содержащие D-псикозу, способ ингибирования активности синтазы жирных кислот субъекта, включающий введение D-псикозы субъекту, способ профилактики, уменьшения интенсивности или лечения гиперлипидемии, артериосклероза или жирового гепатоза, включающий введение фармацевтически эффективного количества D-псикозы субъекту, нуждающемуся в этом, и композицию для профилактики, уменьшения интенсивности или лечения гиперлипидемии, артериосклероза или жирового гепатоза, содержащую D-псикозу.
Настоящее изобретение будет теперь описано более подробно. Раскрытия, которые не включены в настоящее описание, будут легко признаны и поняты специалистами в данной области, и поэтому их описание опущено.
ТЕХНИЧЕСКОЕ РЕШЕНИЕ
Один аспект настоящего изобретения предлагает способ ингибирования всасывания липидов, потребляемых субъектом, и/или повышения выведения потребляемых липидов, включающий введение D-псикозы субъекту.
Субъект включает млекопитающих, включая людей и млекопитающих, отличных от людей. Примеры млекопитающих, отличных от людей, включают, но не ограничиваются ими, мышей, крыс, собак, кошек, лошадей, коров, овец, коз, свиней и кроликов.
Липиды включают липиды животного происхождения и липиды растительного происхождения, но не ограничиваются ими. В частности, липиды могут представлять собой липиды животного происхождения, липиды растительного происхождения или их комбинации. Более конкретно, липиды могут быть такими, которые присутствуют в пищевом продукте или корме.
Введение может быть пероральным или парентеральным введением (например, внутривенное введение, подкожное введение, внутрибрюшинное введение или местное применение). В частности, введение может быть пероральным введением.
D-псикозу можно вводить в количестве от 10 до 50 весовых частей относительно 100 весовых частей липидов, потребляемых субъектом. Более конкретно, D-псикозу можно вводить в количестве 10-40, 10-30, 10-25, 15-50, 15-40, 15-30, 15-25, 20-50, 20-40, 20-30, 20-25 или 25 весовых частей относительно 100 весовых частей липидов, потребляемых субъектом.
В одном варианте осуществления настоящего изобретения всасывание может быть всасыванием в тонком кишечнике. В частности, при введении мышам, получавшим рацион с высоким содержанием жиров и страдающим ожирением, D-псикоза снижает экспрессию мРНК генов (CD36, FATP4 и ApoB48), участвующих во всасывании липидов в тонком кишечнике. В частности, D-псикоза снижает экспрессию мРНК генов (ABCG5 и ABCG8), участвующих в выведении липидов.
Дополнительный аспект настоящего изобретения относится к применению композиции, содержащей D-псикозу, для ингибирования всасывания пищевых липидов и/или повышения выведения пищевых липидов.
Насколько нам известно, это первый отчет о механизме, посредством которого D-псикоза, широко используемая в качестве подсластителя, ингибирует всасывание пищевых липидов и повышает выведение пищевых липидов. Детали механизма являются такими же, как описанные выше.
Еще один аспект настоящего изобретения относится к способу ингибирования активности синтазы жирных кислот (СЖК) субъекта, включающему введение ингибитора синтазы жирных кислот, содержащего D-псикозу, или D-псикозы субъекту.
В одном варианте осуществления настоящего изобретения D-псикоза снижает активность β-окисления жирных кислот в печени. Альтернативно, D-псикоза может индуцировать активность β-окисления жирных кислот в жировой ткани.
Еще один аспект настоящего изобретения относится к способу профилактики, уменьшения интенсивности или лечения гиперлипидемии, артериосклероза или жирового гепатоза, включающему введение фармацевтически эффективного количества D-псикозы субъекту, нуждающемуся в такой профилактике, уменьшении интенсивности или лечении.
Еще один аспект настоящего изобретения относится к композиции для профилактики, уменьшения интенсивности или лечения гиперлипидемии, артериосклероза или жирового гепатоза, содержащей D-псикозу.
Используемый здесь термин «гиперлипидемия» относится к заболеванию, вызванному аномально высокими уровнями жиров в крови в результате неполного метаболизма жиров, таких как триглицериды и холестерин. Более конкретно, гиперлипидемия характеризуется повышенными уровнями липидов (включающих триглицериды, холестерин ЛПНП, фосфолипиды и свободные жирные кислоты) в крови, и гиперлипидемия включает гиперхолестеринемию или гипертриглицеридемию, которая часто возникает в результате повышенных уровней липидов.
Используемый здесь термин «артериосклероз» относится к заболеванию, при котором холестерин откладывается на внутренних стенках артерий, или эндотелиальные клетки сосудов размножаются, и в результате сужаются или закупориваются артерии, вызывая плохое кровообращение на периферии.
Используемый здесь термин «жировой гепатоз» относится к патологическому состоянию, при котором жир чрезмерно накапливается в клетках печени в результате нарушения метаболизма жиров в печени. Жировой гепатоз является причиной различных заболеваний, таких как стенокардия, инфаркт миокарда, инсульт, артериосклероз, жировой гепатоз печени и панкреатит.
Используемый здесь термин «предупреждение» или «профилактика» означает любые действия, которые предотвращают или замедляют развитие поражения органов-мишеней. В частности, данный термин означает введение D-псикозы для предотвращения или замедления развития симптомов гиперлипидемии, артериосклероза и жирового гепатоза (например, повышенные уровни свободных жирных кислот, триглицеридов, общего холестерина, холестерина не-ЛПВП и Aпo B в плазме, высокий атеросклеротический индекс (AI), повышенные уровни жирных кислот, триглицеридов и холестерина в тканях печени и увеличение размера адипоцитов).
Используемый здесь термин «улучшение состояния» или «уменьшение интенсивности» означает любые действия, которые облегчают или ослабляют симптомы и побочные эффекты заболеваний. Используемый здесь термин «терапия» или «лечение» относится к любым действиям, которые облегчают или благотворно влияют на симптомы и побочные эффекты заболеваний. В частности, данные термины означают введение D-псикозы для облегчения, смягчения или ослабления симптомов гиперлипидемии, артериосклероза или жирового гепатоза, что приводит к пониженному уровню свободных жирных кислот, триглицеридов, общего холестерина, холестерина не-ЛПВП или Aпo B в плазме, низкому атеросклеротическому индексу (AI), пониженному уровню жирных кислот, триглицеридов или холестерина или уменьшению размера адипоцитов в тканях печени.
Как показано в следующем разделе Примеры, было обнаружено, что D-псикоза значительно снижает уровни свободных жирных кислот, триглицеридов, общего холестерина, холестерина ЛПНП, Aпo B, лептина, резистина и соотношение лептина:адипонектина в плазме мышей, страдающих ожирением, вызванным рационом с высоким содержанием жиров, в результате чего уровни и соотношение сохраняются такими же, как у группы, получавшей стандартный рацион, повышает уровни холестерина ЛПВП и Апо А1 в плазме до более высоких значений, чем у группы, получавшей стандартный рацион, и снижает атеросклеротический индекс (AI), таким образом, являясь эффективной при профилактике, уменьшении интенсивности или лечении гиперлипидемии или артериосклероза. Также было обнаружено, что D-псикоза снижает активность синтазы жирных кислот (СЖК), уровни жирных кислот, триглицеридов, холестерина и размер адипоцитов в тканях печени мышей, страдающих ожирением, вызванным рационом с высоким содержанием жиров, и в результате предотвращает развитие жирового гепатоза под влиянием рациона с высоким содержанием жиров. Кроме того, было подтверждено, что D-псикоза снижает экспрессию мРНК генов, участвующих в синтезе жирных кислот, в печени мышей, страдающих ожирением, вызванным рационом с высоким содержанием жиров, таким образом, являясь эффективной при профилактике или лечении жирового гепатоза.
На основании этих данных можно сделать вывод, что D-псикоза выполняет функции ингибирования всасывания липидов в тонком кишечнике и значительно повышает уровни липидов в фекалиях и является эффективной для снижения уровня липидов в плазме с целью нормализации липидных профилей плазмы. Таким образом, D-псикоза может найти применение в фармацевтических препаратах и пищевых продуктах (в частности, полезных для здоровья функциональных пищевых продуктах) для профилактики, уменьшения интенсивности или лечения гиперлипидемии, артериосклероза или жирового гепатоза.
Композицию по настоящему изобретению можно вводить перорально или парентерально (например, внутривенно, подкожно, внутрибрюшинно или местно) в зависимости от предполагаемого использования. В частности, композицию по настоящему изобретению можно вводить перорально.
Композицию по настоящему изобретению можно использовать в качестве фармацевтической композиции. В этом случае композиция по настоящему изобретению может дополнительно содержать, по меньшей мере, один фармацевтически приемлемый носитель, подходящий для введения. Фармацевтически приемлемый носитель можно использовать в смеси с одним или более компонентами, выбранными из солевого раствора, стерилизованной воды, раствора Рингера, забуференного раствора, раствора декстрозы, раствора мальтодекстрина, глицерина и этанола. При необходимости можно добавить одну или более общепринятых добавок, таких как антиоксиданты, буферные растворы и бактериостатические вещества. Композиция по настоящему изобретению может быть приготовлена в виде инъекционных препаратов (таких как водные растворы, суспензии или эмульсии), пилюль, капсул, гранул или таблеток. В этом случае композиция по настоящему изобретению может дополнительно содержать одну или более добавок, выбранных из разбавителей, диспергаторов, поверхностно-активных веществ, связующих веществ и смазочных материалов. Композиция по настоящему изобретению может быть приготовлена в виде различных лекарственных форм в зависимости от типа заболевания или вида компонентов в соответствии с любым подходящим способом, известным в данной области, или любым из традиционных методов, описанных в Remington's Pharmaceutical Science (новейшая редакция), Mack Publishing Company, Easton PA.
Дозу фармацевтической композиции по настоящему изобретению можно определить с учетом различных факторов, включающих массу тела, возраст, пол, состояние здоровья, рацион, время и способ введения, а также интенсивности экскреции и тяжести заболевания. Суточная доза D-псикозы может находиться в диапазоне от около 0,0001 до около 600 мг/кг, предпочтительно от около 0,001 до около 500 мг/кг, и может вводиться в виде разовой или разделенных доз в день.
Фармацевтическую композицию по настоящему изобретению можно использовать отдельно или в сочетании с хирургической операцией, гормональной терапией, лекарственной терапией и биологическими регуляторами.
Композицию по настоящему изобретению можно использовать в качестве пищевого продукта или полезной для здоровья пищевой композиции. В этом случае D-псикозу можно добавлять как таковую или в комбинации с другими пищевыми продуктами или пищевыми компонентами, и можно использовать соответствующим образом согласно любому общепринятому способу, известному в данной области. Количество действующего вещества может быть определено в зависимости от цели применения (профилактический, оздоровительный или терапевтический режим). Пищевую композицию может использовать без ограничений в любом пищевом продукте или полезном для здоровья пищевом продукте, содержащем липиды. Примеры подходящих пищевых продуктов включают мясо, колбасы, хлеб, пирожные, конфеты, леденцы, закуски, крекеры, печенье, пиццу, мучные изделия (например, лапшу быстрого приготовления), жевательные резинки, молочные продукты (включая мороженое), супы, кетчупы, соусы, подливы, заправки, напитки, чаи, питьевые продукты, алкогольные напитки и витаминные комплексы.
Пищевой продукт или полезная для здоровья пищевая композиция по настоящему изобретению может дополнительно содержать различные ароматизаторы или природные углеводы, как и обычные напитки. Природные углеводы включают моносахариды, такие как глюкоза и фруктоза, дисахариды, такие как мальтоза и сахароза, полисахариды, такие как декстрин и циклодекстрин, и сахарные спирты, такие как ксилит, сорбит и эритрит. Пищевой продукт или полезная для здоровья пищевая композиция по настоящему изобретению может дополнительно содержать натуральные или синтетические подсластители. Натуральные подсластители включают экстракты тауматина и стевии. Синтетические подсластители включают сахарин и аспартам. Природный углевод обычно используют в количестве от около 0,01 до около 0,20 г, в частности от 0,04 до 0,10 г, на 100 мл пищевого продукта или полезной для здоровья пищевой композиции.
Пищевой продукт или полезная для здоровья пищевая композиция по настоящему изобретению может дополнительно содержать различные питательные вещества, витамины, электролиты, ароматизаторы, красители, пектиновую кислоту и ее соли, альгиновую кислоту и ее соли, органические кислоты, защитные коллоидные загустители, регуляторы рН, стабилизаторы, консерванты, глицерин, спирты и карбонизирующее вещество для газированных напитков. Пищевой продукт или полезная для здоровья пищевая композиция по настоящему изобретению может дополнительно содержать фруктовую мякоть для производства натуральных фруктовых соков, фруктовых сокосодержащих напитков и/или овощных напитков. Эти компоненты можно использовать отдельно или в комбинации. Общее количество добавляемых компонентов может находиться в диапазоне от 0,01 до 0,20 весовых частей относительно 100 весовых частей пищевого продукта или полезной для здоровья пищевой композиции.
Применение снижения всасывания пищевых липидов, ингибитора активности синтазы жирных кислот, способа ингибирования активности синтазы жирных кислот, способа профилактики, уменьшения интенсивности или лечения гиперлипидемии, артериосклероза или жирового гепатоза и композиции по настоящему изобретению используется совместно с D-псикозой, липидом, введением и субъектом наряду со способом ингибирования всасывания липидов и/или повышения выведения липидов, и поэтому их описание исключается с целью предотвращения чрезмерной сложности описание изобретения.
ПРЕИМУЩЕСТВЕННЫЕ ЭФФЕКТЫ
Авторы настоящего изобретения попытались раскрыть физиологическую активность D-псикозы посредством назначения изокалорических рационов каждой группе, получавшей рацион, с целью исключения влияние D-псикозы на снижение калорий и в результате обнаружили, что D-псикоза выполняет функции ингибирования всасывания липидов в тонком кишечнике и значительно повышает уровни липидов в фекалиях в целях предотвращения выработки жира и снижения массы тела, жировой массы тела и уровней липидов в плазме, вследствие чего в течение короткого времени нормализуется масса тела, жировая масса тела и липидные профили плазмы. Благодаря этим преимуществам ожидается, что D-псикоза будет использоваться для профилактики и/или лечения заболеваний, связанных с нарушением метаболизма липидов.
ОПИСАНИЕ ФИГУР
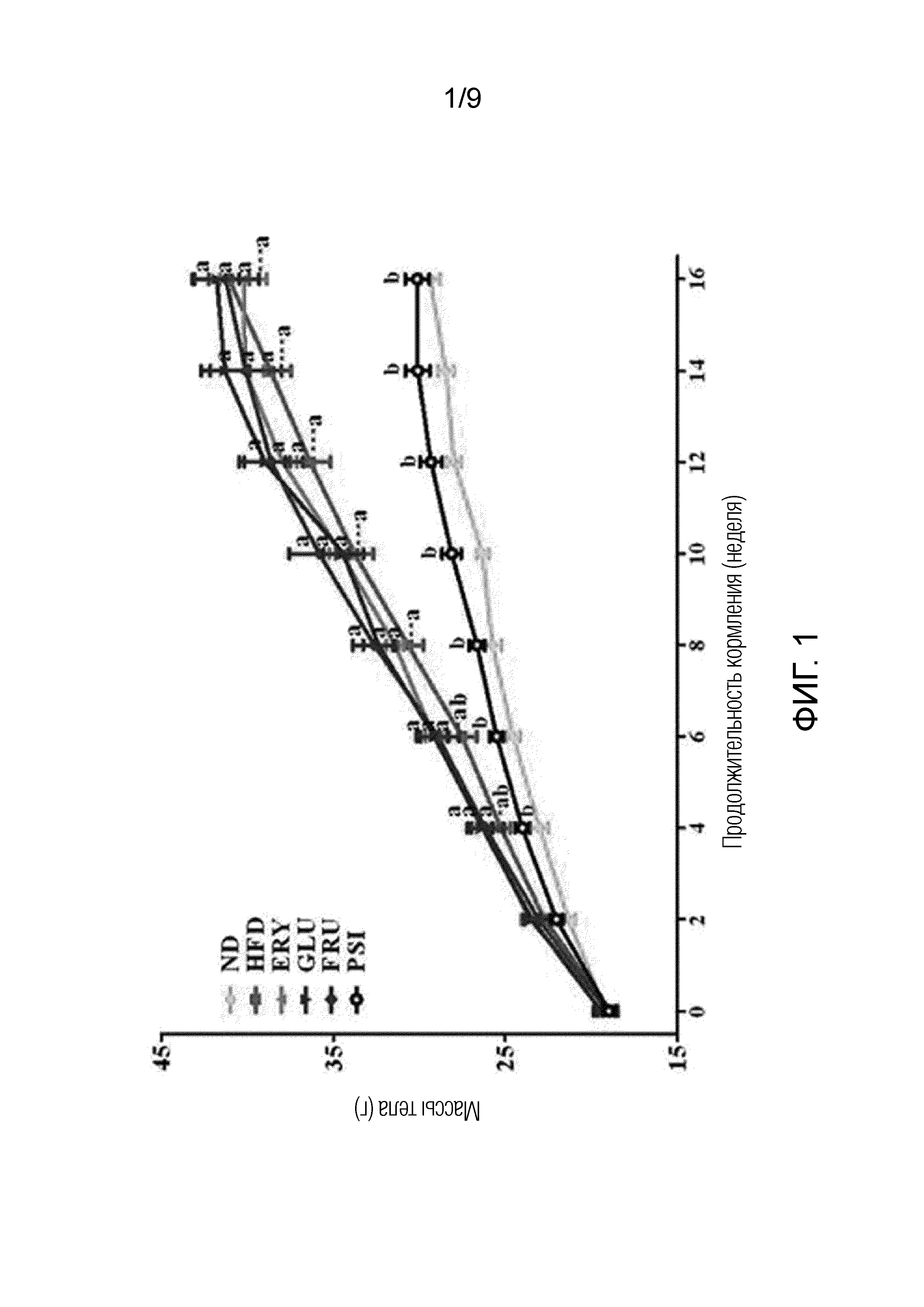
На фиг.1 показаны изменения массы тела мышей линии C57BL/6J, которым скармливали и D-псикозу и рацион с высоким содержанием жиров в течение 16 недель [группа, получавшая стандартный рацион (ND), группа, получавшая рацион с высоким содержанием жиров (HFD), группа, получавшая рацион PSI (HFD+5% D-псикозы, вес./вес.), группа, получавшая рацион ERY (HFD+5% эритрита, вес./вес.), группа, получавшая рацион GLU (HFD+5% D-глюкозы, вес./вес.) и группа, получавшая рацион FRU (HFD+5% D-фруктозы, вес./вес.)].
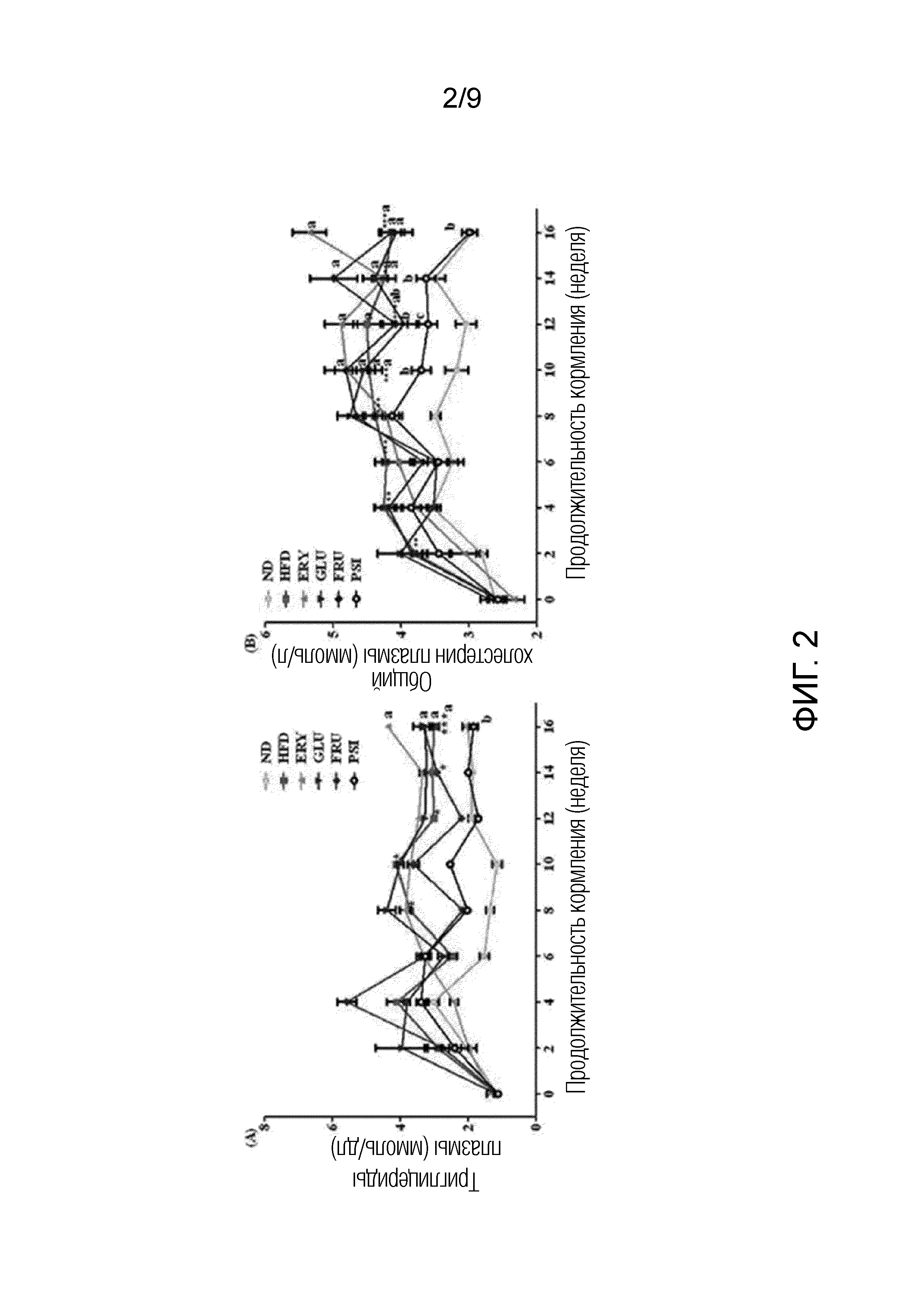
На фиг.2 показаны изменения уровней триглицеридов и общего холестерина в плазме у мышей линии C57BL/6J, которым скармливали и D-псикозу и рацион с высоким содержанием жиров в течение 16 недель [группа, получавшая стандартный рацион (ND), группа, получавшая рацион с высоким содержанием жиров (HFD), группа, получавшая рацион PSI (HFD+5% D-псикозы, вес./вес.), группа, получавшая рацион ERY (HFD+5% эритрита, вес./вес.), группа, получавшая рацион GLU (HFD+5% D-глюкозы, вес./вес.) и группа, получавшая рацион FRU (HFD+5% D-фруктозы, вес./вес.)].
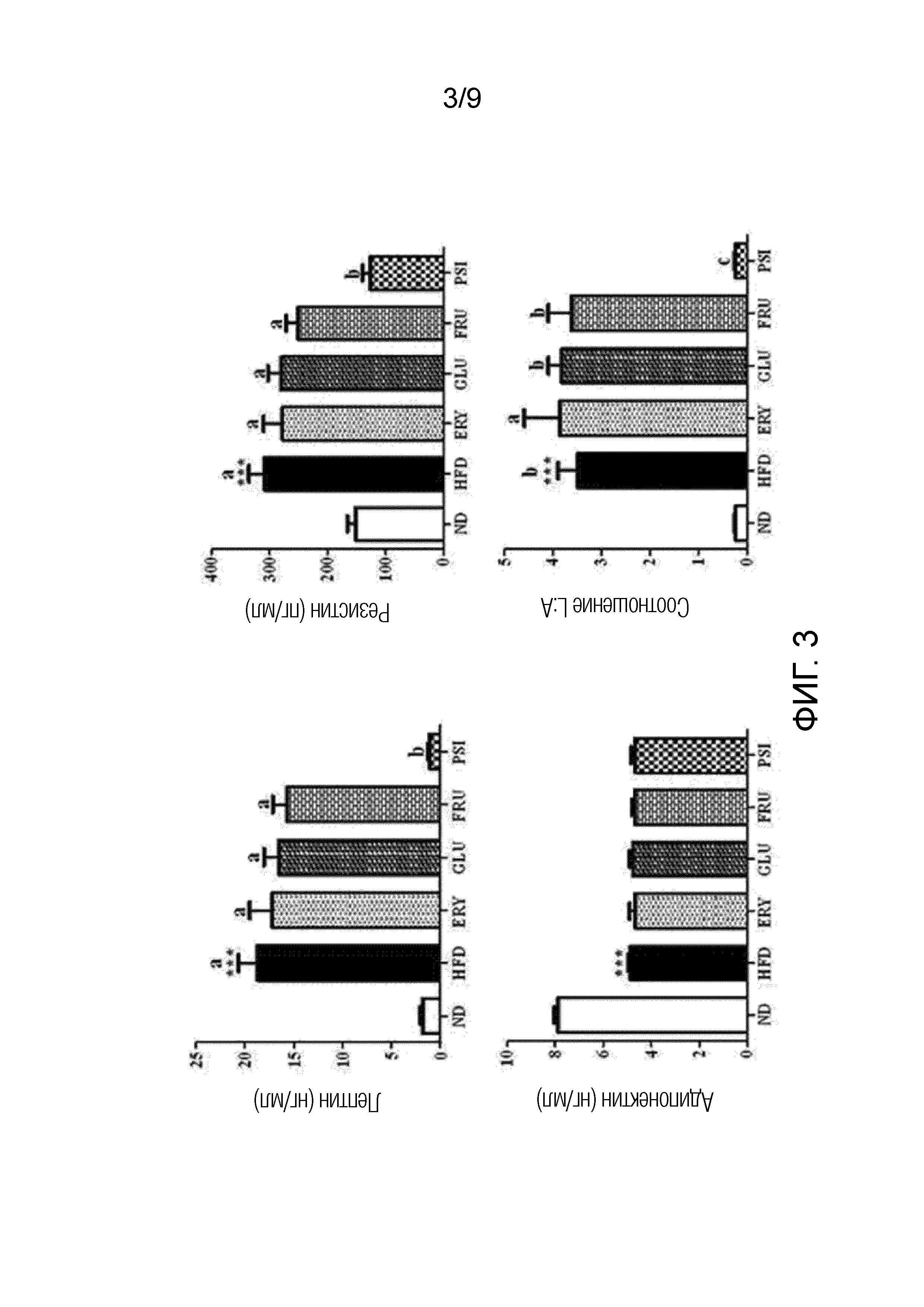
На фиг.3 показано влияние D-псикозы на уровни лептина, резистина и адипонектина в плазме и соотношение лептина:адипонектина (соотношение L:A) у мышей, страдающих ожирением, вызванным рационом с высоким содержанием жиров [группа, получавшая стандартный рацион (ND), группа, получавшая рацион с высоким содержанием жиров (HFD), группа, получавшая рацион PSI (HFD+5% D-псикозы, вес./вес.), группа, получавшая рацион ERY (HFD+5% эритрита, вес./вес.), группа, получавшая рацион GLU (HFD+5% D-глюкозы, вес./вес.) и группа, получавшая рацион FRU (HFD+5% D-фруктозы, вес./вес.)].
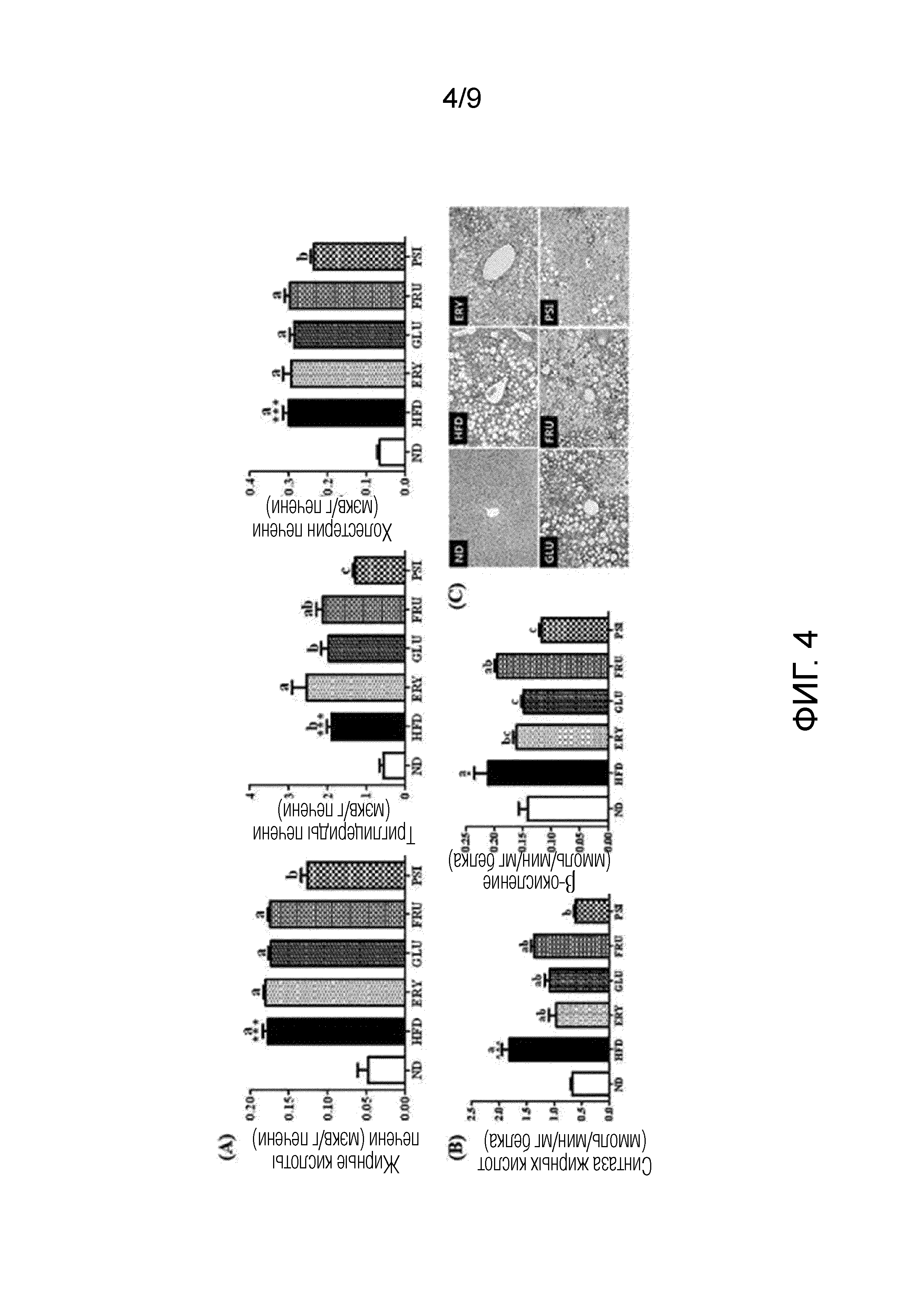
На фиг.4 показано влияние D-псикозы на (A) липидные профили печени, (B) активности регулирующих липиды ферментов печени и (C) морфологию ткани печени у мышей, страдающих ожирением, вызванным рационом с высоким содержанием жиров [группа, получавшая стандартный рацион (ND), группа, получавшая рацион с высоким содержанием жиров (HFD), группа, получавшая рацион PSI (HFD+5% D-псикозы, вес./вес.), группа, получавшая рацион ERY (HFD+5% эритрита, вес./вес.), группа, получавшая рацион GLU (HFD+5% D-глюкозы, вес./вес.) и группа, получавшая рацион FRU (HFD+5% D-фруктозы, вес./вес.)].
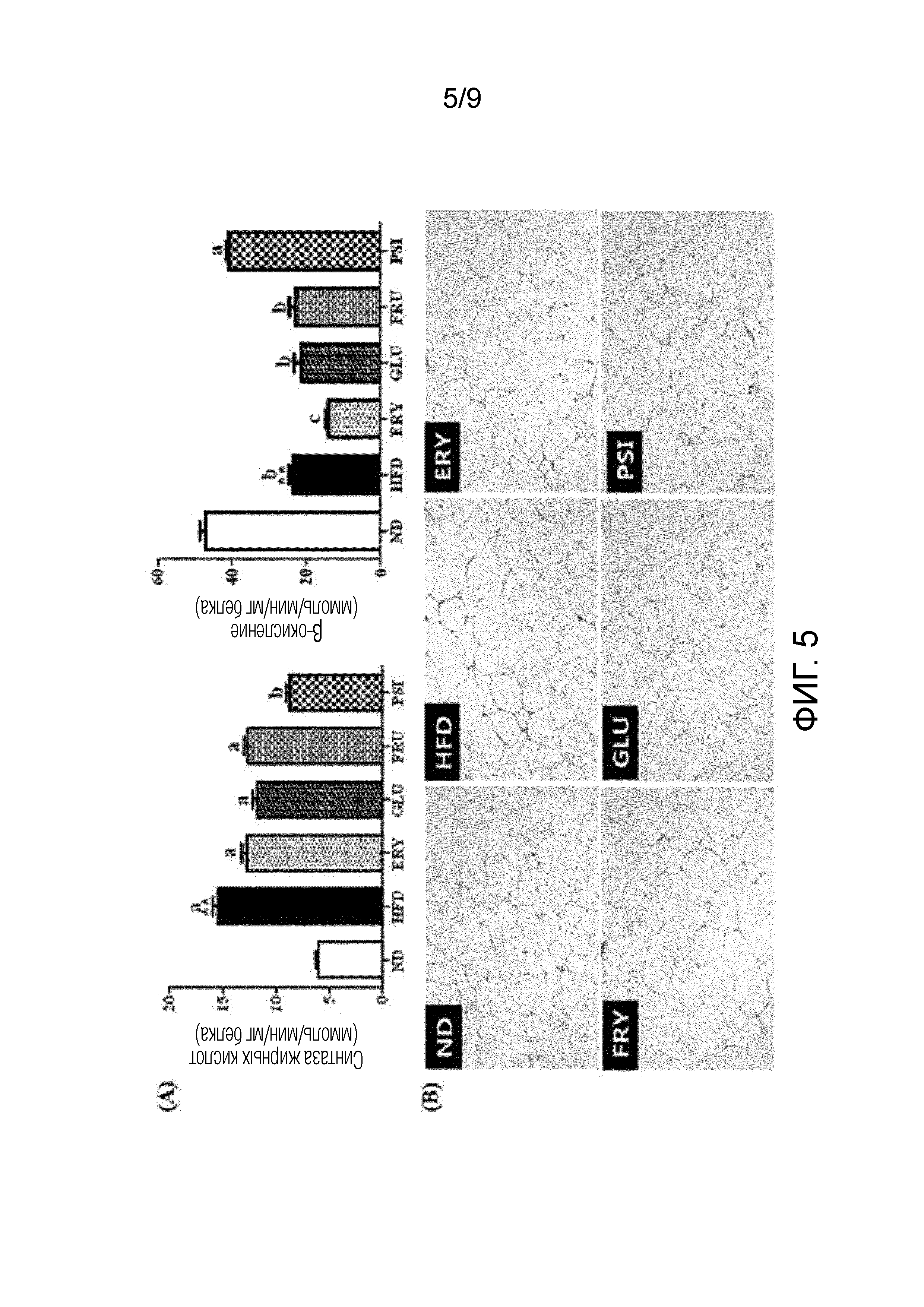
На фиг.5 показано влияние D-псикозы на (A) активности регулирующих липиды ферментов печени и (B) морфологию ткани печени у мышей, страдающих ожирением, вызванным рационом с высоким содержанием жиров [группа, получавшая стандартный рацион (ND), группа, получавшая рацион с высоким содержанием жиров (HFD), группа, получавшая рацион PSI (HFD+5% D-псикозы, вес./вес.), группа, получавшая рацион ERY (HFD+5% эритрита, вес./вес.), группа, получавшая рацион GLU (HFD+5% D-глюкозы, вес./вес.) и группа, получавшая рацион FRU (HFD+5% D-фруктозы, вес./вес.)].
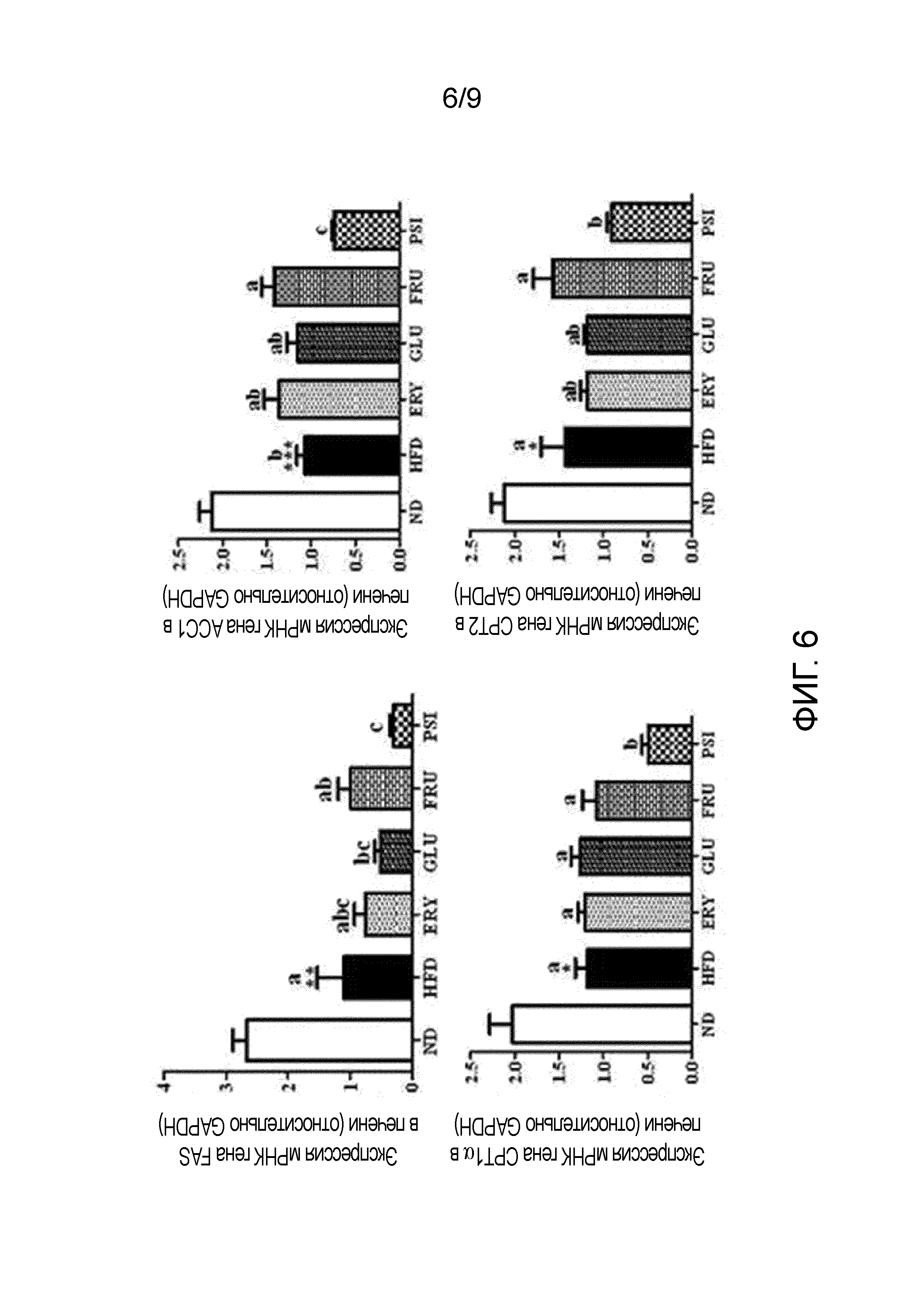
На фиг.6 показано влияние D-псикозы на экспрессию мРНК генов (FAS, ACC1, CPT1α и CPT2), участвующих в синтезе и окислении жирных кислот в печени мышей, страдающих ожирением, вызванным рационом с высоким содержанием жиров [группа, получавшая стандартный рацион (ND), группа, получавшая рацион с высоким содержанием жиров (HFD), группа, получавшая рацион PSI (HFD+5% D-псикозы, вес./вес.), группа, получавшая рацион ERY (HFD+5% эритрита, вес./вес.), группа, получавшая рацион GLU (HFD+5% D-глюкозы, вес./вес.) и группа, получавшая рацион FRU (HFD+5% D-фруктозы, вес./вес.)].
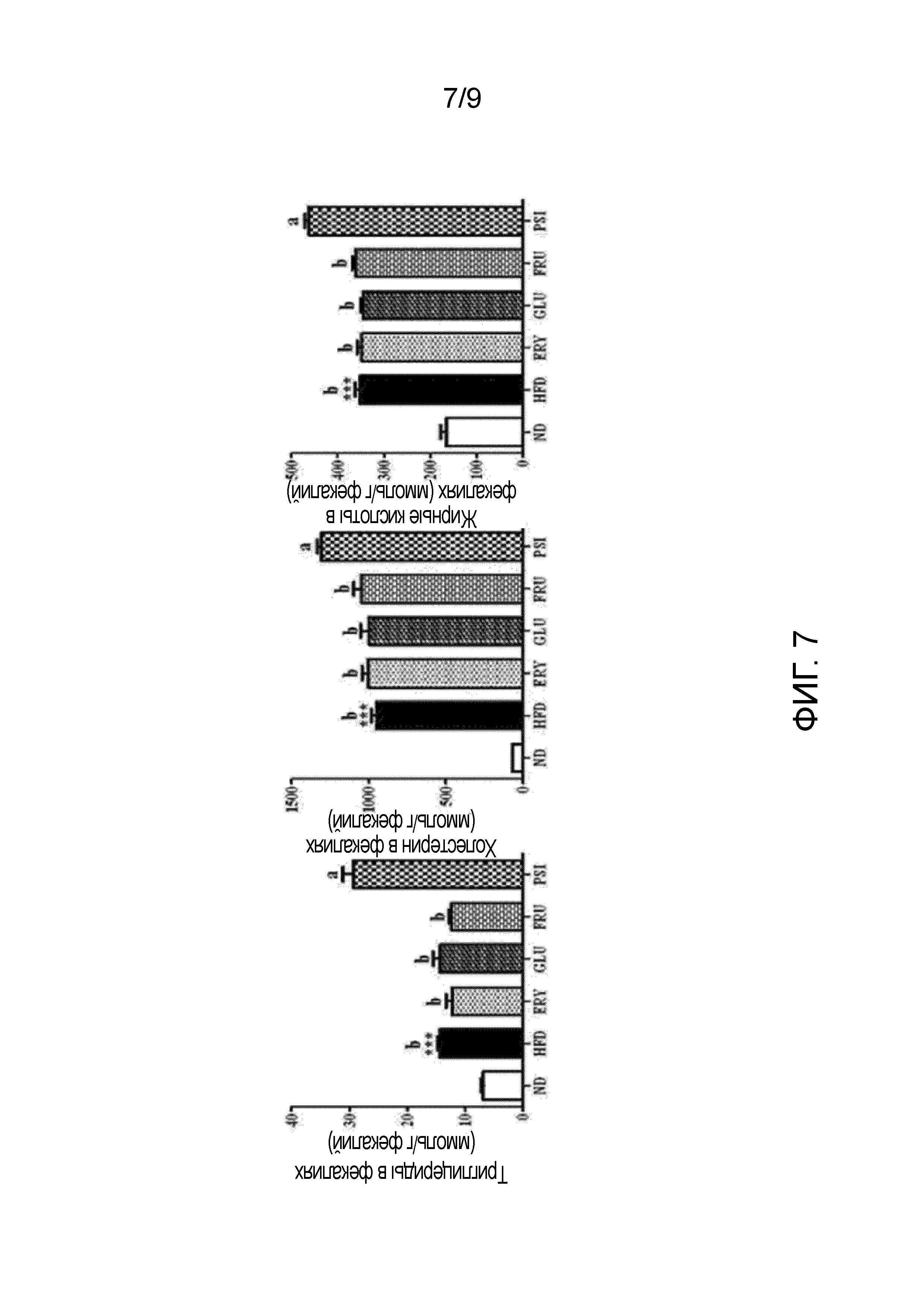
На фиг.7 показано влияние D-псикозы на уровни липидов в фекалиях мышей, страдающих ожирением, вызванным рационом с высоким содержанием жиров [группа, получавшая стандартный рацион (ND), группа, получавшая рацион с высоким содержанием жиров (HFD), группа, получавшая рацион PSI (HFD+5% D-псикозы, вес./вес.), группа, получавшая рацион ERY (HFD+5% эритрита, вес./вес.), группа, получавшая рацион GLU (HFD+5% D-глюкозы, вес./вес.) и группа, получавшая рацион FRU (HFD+5% D-фруктозы, вес./вес.)].
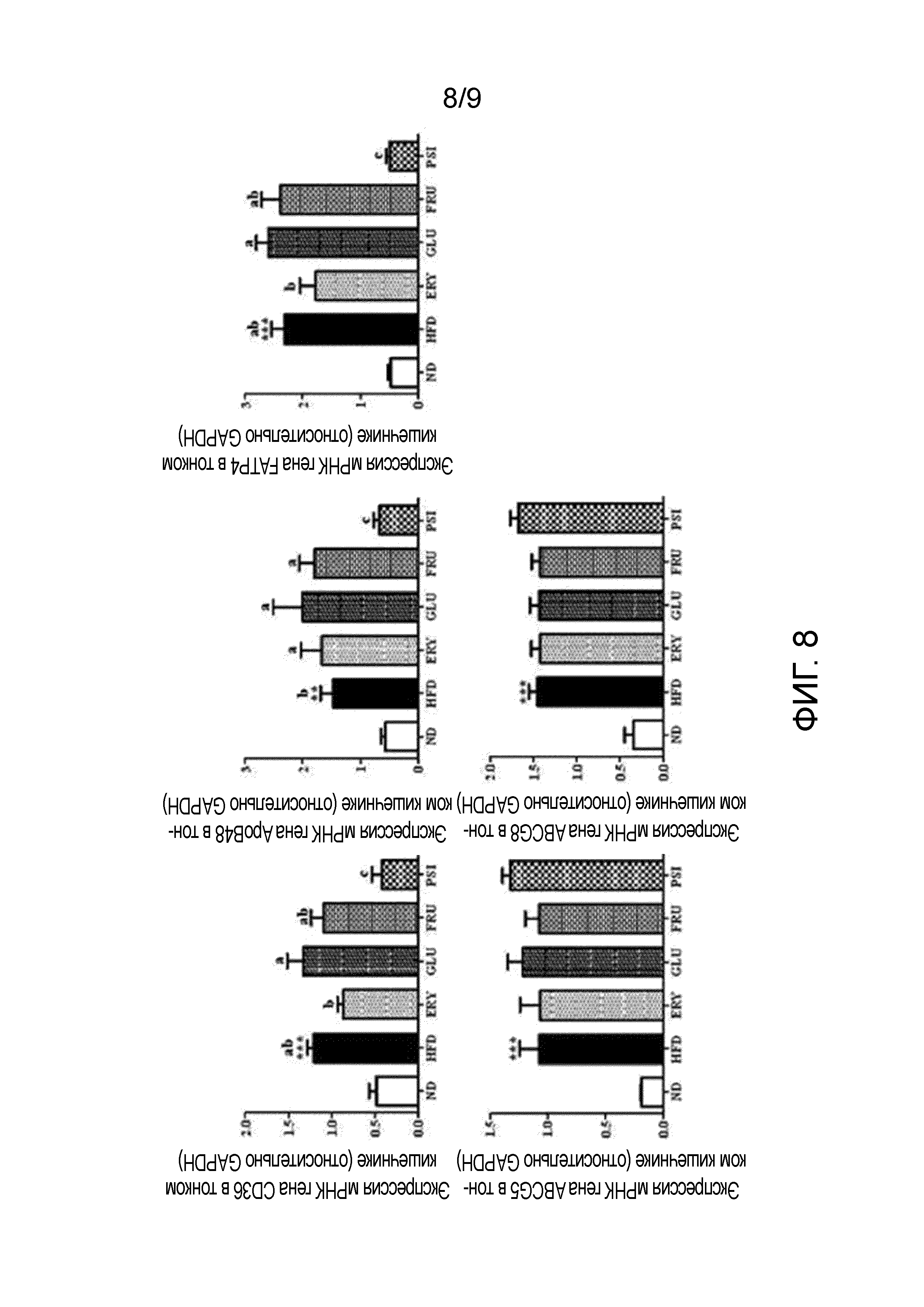
На фиг.8 показано влияние D-псикозы на экспрессию мРНК генов (CD36, FATP4, ApoB48, ABCG5 и ABCG8), участвующих во всасывании и выведении липидов в тонком кишечнике мышей, страдающих ожирением, вызванным рационом с высоким содержанием жиров [группа, получавшая стандартный рацион (ND), группа, получавшая рацион с высоким содержанием жиров (HFD), группа, получавшая рацион PSI (HFD+5% D-псикозы, вес./вес.), группа, получавшая рацион ERY (HFD+5% эритрита, вес./вес.), группа, получавшая рацион GLU (HFD+5% D-глюкозы, вес./вес.) и группа, получавшая рацион FRU (HFD+5% D-фруктозы, вес./вес.)].
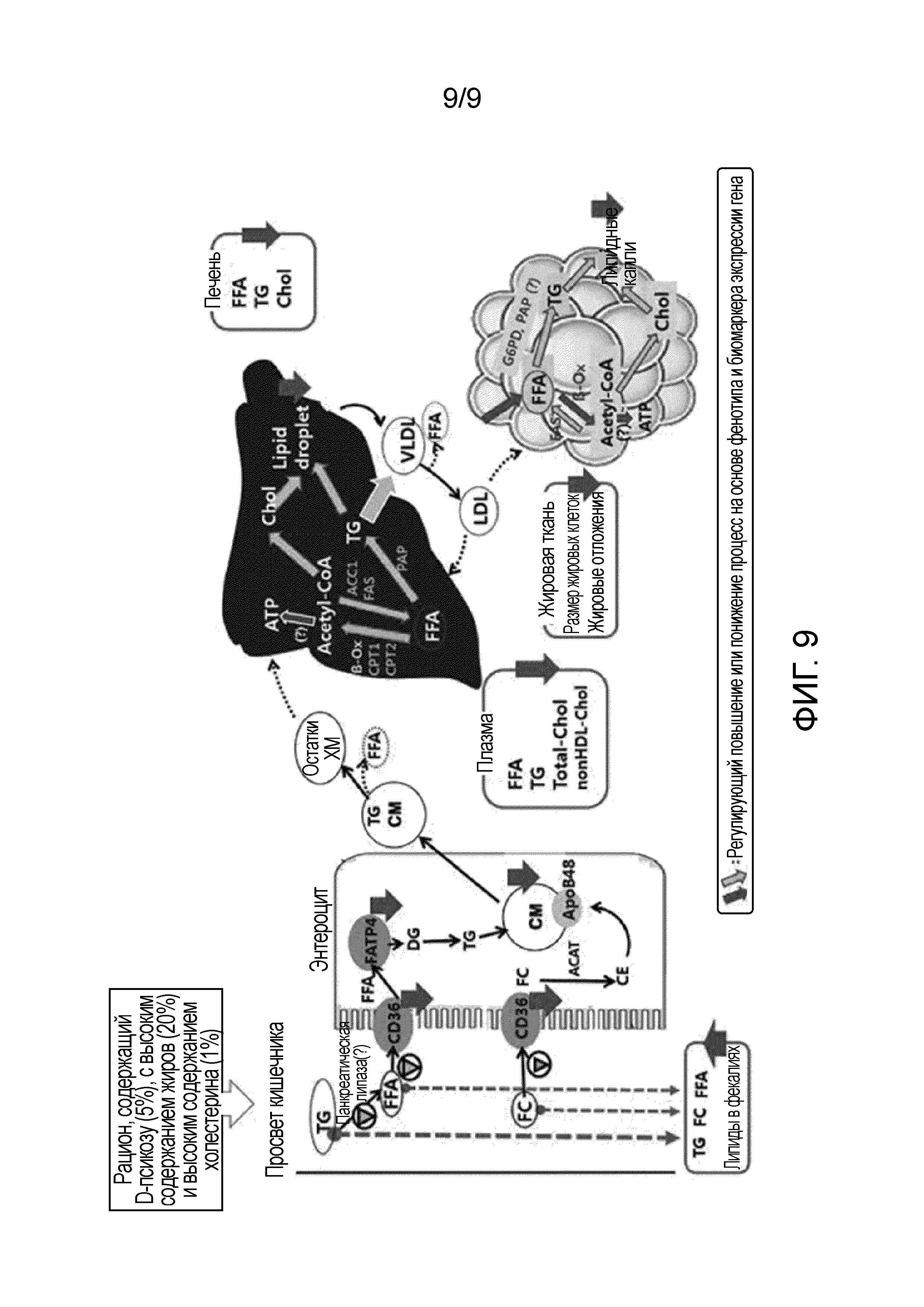
На фиг.9 представлена диаграмма, схематически отображающая роли D-псикозы в метаболизме липидов в тонком кишечнике, печени и жировых тканях мышей, страдающих ожирением, вызванным рационом с высоким содержанием жиров, на основе результатов, показанных на фиг.1-8.
ЛУЧШИЙ ВАРИАНТ
Настоящее изобретение относится к способу ингибирования всасывания липидов и активности синтазы жирных кислот (СЖК) у субъекта, включающему введение D-псикозы субъекту, ингибитору синтазы жирных кислот, содержащему D-псикозу, способу профилактики или лечения гиперлипидемии, артериосклероза или жирового гепатоза, включающему введение фармацевтически эффективного количества D-псикозы субъекту, нуждающемуся в этом, и композиции для профилактики или лечения гиперлипидемии, артериосклероза или жирового гепатоза, содержащей D-псикозу.
Композиция предназначена для включения в состав фармацевтической композиции и пищевой композиции.
Ниже представлены предпочтительные варианты осуществления, помогающие понять изобретение. Следующие примеры приведены для лучшего понимания изобретения и не предназначены для ограничения объема изобретения.
ПРИМЕР 1. ВЛИЯНИЕ D-ПСИКОЗЫ НА МАССУ ТЕЛА, МАССУ ОРГАНОВ И МАССУ ЖИРОВОЙ ТКАНИ МЫШЕЙ, СТРАДАЮЩИХ ОЖИРЕНИЕМ, ВЫЗВАННЫМ РАЦИОНОМ С ВЫСОКИМ СОДЕРЖАНИЕМ ЖИРОВ
Проводили следующий эксперимент для изучения влияния D-псикозы на массу тела, массу органов и массу жировой ткани мышей, страдающих ожирением, вызванным рационом с высоким содержанием жиров.
Сначала закупали 4-недельных мышей самцов линии C57BL/6J (всего 60) в Jackson Laboratory. Животных акклиматизировали в виварии в термогигростате (20-23°C, 45-65%) при 12-часовом цикле света-темноты и скармливали им гранулированный серийно выпускаемый несинтетический рацион в течение 1 недели после поступления. Затем мышей случайным образом делили на 6 групп (n=10) и скармливали им соответствующие экспериментальные рационы в течение 16 недель: группа, получавшая стандартный рацион (ND, разработанный Американским институтом питания (AIN)-76 полусинтетический рацион), группа, получавшая рацион с высоким содержанием жиров (HFD, 20% жира+1% холестерина на основе рациона AIN-76), группа, получавшая рацион PSI (HFD+5% D-псикозы, вес./вес., Sigma Chemical Company), группа, получавшая рацион ERY (HFD+5% эритрита, вес./вес., Sigma Chemical Company), группа, получавшая рацион GLU (HFD+5% D-глюкозы, вес./вес., Sigma Chemical Company) и группа, получавшая рацион FRU (HFD+5% D-фруктозы, вес./вес., Sigma Chemical Company). Всем группам, получавшим рационы с высоким содержанием жиров, позволяли потреблять то же самое количество калорий посредством одинакового кормления на основе группы, получавшей рацион PSI. В течение экспериментального периода мыши имели неограниченный доступ к дистиллированной воде. Поедание ими корма и массу их тела измеряли ежедневно и два раза в неделю, соответственно. Массы органов и массы жировой ткани мышей измеряли после умерщвления животных.
Этот протокол исследования на животных был одобрен Комитетом по этике исследований на животных Kyungpook National University, Корея (утвержден № KNU 2013-18).
Изменения массы тела мышей линии C57BL/6J, которым скармливали и D-псикозу и рацион с высоким содержанием жиров в течение 16 недель, приведены на фиг.1 и в таблице 2. Массы органов и массы жировой ткани мышей приведены в таблице 2.
Таблица 1
Составы экспериментальных рационов (% от рациона, вес./вес.)
|
*Минеральная смесь (AIN-76): фосфат кальция 500 г/кг, NaCl 74 г/кг, цитрат калия 2220 г/кг, сульфат калия 52 г/кг, оксид магния 24 г/кг, карбонат марганца 3,5 г/кг, цитрат трехвалентного железа 6 г/кг, карбонат цинка 1,6 г/кг, карбонат меди 0,3 г/кг, йодат калия 0,01 г/кг, селенит натрия 0,01 г/кг, сульфата хрома(III)-калия 0,55 г/кг, сахароза - 118,03 г/кг.
**Витаминная смесь (AIN-76): тиамин HCl 0,6 г/кг, рибофлавин 0,6 г/кг, пиридоксин HCl 0,7 г/кг, ниацин 3 г/кг, пантотенат кальция 1,6 г/кг, фолиевая кислота 0,2 г/кг, биотин 0,02 г/кг, витамин B12 1 г/кг, витамин А (500000 МЕ/г) 0,8 г/кг, витамин D3 (400000 МЕ/г) 0,25 г/кг, ацетат витамина Е (500 МЕ/г) 10 г/кг, менадиона натрия бисульфат 0,04 г/кг, сахароза 981,15 г/кг.
Таблица 2
|
Статистический уровень значимости между группами ND и HFD: *p<0,05, **p<0,01, ***p<0,001.
Статистический уровень значимости между группами HFD, ERY, GLU, FRU и PSI (p<0,05); Среднее значениеa,b,c.
ПМТ, прирост массы: КЭК, коэффициент эффективности корма=прирост массы/потребление рациона, эффективность рациона.
Как показано на фиг.1 и в таблице 2, исходные массы тела мышей во всех экспериментальных группах были почти одинаковыми, но массы тела мышей, страдающих ожирением, вызванным рационом с высоким содержанием жиров, значительно увеличились по сравнению с массами тела мышей в группе, получавшей стандартный рацион (ND), через 4 недели скармливания. Однако увеличение массы тела мышей, страдающих ожирением и получавших рацион PSI, в значительной степени предотвращалось через 4 недели скармливания рациона, и в результате массы их тела поддерживались почти на тех же уровнях, что и у мышей в группе, получавшей рацион ND. То есть эффективность рациона группы, получавшей рацион PSI, была значительно ниже, чем эффективность рациона других групп, получавших рационы с высоким содержанием жиров (HFD, ERY, GLU и FRU), и поддерживалась почти на том же уровне, что и у группы, получавшей рацион ND.
Кроме того, проводили исследование относительно того, вызвана ли потеря массы тела в группе, получавшей рацион PSI, снижением массы органов. С этой целью измеряли массы органов (мышц, печени и почек) и жировых тканей (перинефральный жир, эпидидиальный жир, забрюшинная жировая клетчатка, подкожный жир, брыжеечный жир, висцеральный жир, межлапаточная БелЖТ, межлапаточная БурЖТ и общая БелЖТ). Как показано в таблице 2, массы мышц и почек на единицу массы тела мыши в группах, получавших рационы с высоким содержанием жиров (HFD, ERY, GLU и FRU), за исключением группы, получавшей рацион PSI, значительно снизились по сравнению с массами в группе, получавшей рацион ND, а массы печени на единицу массы тела мыши в группах, получавших рационы с высоким содержанием жиров, значительно увеличились по сравнению с массами в группе, получавшей рацион ND. Однако массы мышц и почек на единицу массы тела мыши в группе, получавшей рацион PSI, оказались аналогичными массам в группе, получавшей рацион ND. Массы перинефрального жира, эпидидиального жира, забрюшинной жировой клетчатки, подкожного жира, брыжеечного жира, висцерального жира, межлапаточной БелЖТ, межлапаточной БурЖТ и общей БелЖТ на единицу массы тела мыши в группах, получавших рационы с высоким содержанием жиров (HFD, ERY, GLU и FRU), за исключением группы, получавшей рацион PSI, значительно увеличились, в то время как массы всех видов жиров в группе, получавшей рацион PSI, значительно снизились и поддерживались почти на тех же уровнях, что и массы в группе, получавшей ND.
Из этих результатов можно видеть, что D-псикоза предотвращала прирост массы мышей, страдающих ожирением, вызванным рационом с высоким содержанием жиров, и снижала эффективности рационов и массы печени и жировой ткани на единицу массы тела мыши у мышей, страдающих ожирением, вызванным рационом с высоким содержанием жиров, до уровней, аналогичных уровням группы, получавшей рацион ND. В заключение, D-псикоза является эффективной для нормализации массы тела и жировой массы тела.
ПРИМЕР 2. ВЛИЯНИЕ D-ПСИКОЗЫ НА ЛИПИДНЫЕ ПРОФИЛИ ПЛАЗМЫ МЫШЕЙ, СТРАДАЮЩИХ ОЖИРЕНИЕМ, ВЫЗВАННЫМ РАЦИОНОМ С ВЫСОКИМ СОДЕРЖАНИЕМ ЖИРОВ
Проводили следующий эксперимент для изучения влияния D-псикозы на липидные профили плазмы мышей, страдающих ожирением, вызванным рационом с высоким содержанием жиров.
Уровни свободных жирных кислот, фосфолипида, аполипопротеина А1 (Апо А1) и аполипопротеина B (Aпo B) в плазме измеряли с использованием набора ферментов Nittobo (Nittobo medical Co., Tokyo, Япония). Уровни холестерина ЛПНП, триглицеридов (ТГ) и общего холестерина (ОХС) в плазме измеряли с использованием набора ферментов Asan (Asan, Seoul, Южная Корея).
Результаты представлены на фиг.2 и в таблице 3.
Таблица 3.
|
Статистический уровень значимости между группами ND и HFD: *p<0,05, **p<0,01, ***p<0,001.
Статистический уровень значимости между группами HFD, ERY, GLU, FRU и PSI (p<0,05); Среднее значениеa,b,c.
ТГ, триглицерид; ХС, холестерин; ФЛ, фосфолипид; ХС ЛПВП, холестерин липопротеинов высокой плотности; Апо А1, аполипопротеин A1; Aпo B, аполипопротеин B; ИА, индекс атерогенности, [(ОХС)-ХС ЛПВП]/ХС ЛПВП; НТР, (ХС ЛПВП/ОХС)×100
Как показано на фиг.2 и в таблице 3, уровни свободных жирных кислот, триглицеридов, фосфолипида, общего холестерина, холестерина ЛПВП, холестерина не-ЛПВП, аполипопротеина A1 (Апо А1) и аполипопротеина B (Aпo B) в плазме в группах, получавших рационы с высоким содержанием жиров (HFD, ERY, GLU и FRU), за исключением группы, получавшей рацион PSI, значительно увеличились по сравнению с уровнями в группе, получавшей рацион ND, зато уровни свободных жирных кислот, триглицерида, общего холестерина, холестерина не-ЛПВП и Aпo B в плазме в группе, получавшей рацион PSI, оказались аналогичными уровням в группе, получавшей стандартный рацион. В частности, уровни холестерина ЛПВП и Апо А1 в группе, получавшей рацион PSI, были выше, чем уровни в группе, получавшей рацион ND, а атеросклеротический индекс (AI) группы, получавшей рацион PSI, оказался ниже, чем у группы, получавшей ND.
Из этих результатов можно видеть, что D-псикоза снижала уровни свободных жирных кислот, триглицерида, общего холестерина, холестерина не-ЛПВП и Aпo B в плазме мышей, страдающих ожирением, вызванным рационом с высоким содержанием жиров, до значений, аналогичных уровням в группе, получавшей рацион ND, таким образом, являясь эффективной для нормализации липидных профилей плазмы. Кроме того, D-псикоза повышала уровень холестерина ЛПВП и уровень Апо А1 в плазме мышей, страдающих ожирением, вызванным рационом с высоким содержанием жиров, до более высоких значений, чем уровни в группе, получавшей рацион ND, и снижала атеросклеротический индекс у мышей, страдающих ожирением, вызванным рационом с высоким содержанием жиров, до более низких значений, чем уровни в группе, получавшей рацион ND. Таким образом, предполагается, что D-псикоза будет использоваться для профилактики артериосклероза.
ПРИМЕР 3. ВЛИЯНИЕ D-ПСИКОЗЫ НА УРОВНИ ЛЕПТИНА, РЕЗИСТИНА И АДИПОНЕКТИНА В ПЛАЗМЕ И СООТНОШЕНИЕ ЛЕПТИНА:АДИПОНЕКТИНА (СООТНОШЕНИЕ L:A) У МЫШЕЙ, СТРАДАЮЩИХ ОЖИРЕНИЕМ, ВЫЗВАННЫМ РАЦИОНОМ С ВЫСОКИМ СОДЕРЖАНИЕМ ЖИРОВ
Проводили следующий эксперимент для изучения влияния D-псикозы на уровни лептина, резистина и адипонектина в плазме и соотношение лептина:адипонектина (соотношение L:A) у мышей, страдающих ожирением, вызванным рационом с высоким содержанием жиров.
Уровни лептина, резистина и адипонектина в плазме измеряли с использованием наборов для мультиплексного анализа Bio-Rad (Hercules, CA, США). Все образцы тестировали в двух повторностях и анализировали с использованием системы Luminex 200 Labmap (Luminex, Austin, TX, США). Анализ данных проводили с использованием программного обеспечения Bio-Plex Manager версии 4.1.1 (Bio-Rad, Hercules, CA, США).
Результаты представлены на фиг.3.
Как показано на фиг.3, уровни лептина и резистина в плазме и соотношения лептина:адипонектина в группах, получавших рационы с высоким содержанием жиров (HFD, ERY, GLU и FRU), за исключением группы, получавшей рацион PSI, значительно увеличились по сравнению с теми, что в группе, получавшей рацион ND, зато уровни лептина и резистина в плазме и соотношение лептина:адипонектина в группе, получавшей рацион PSI, значительно снизились до уровней, аналогичных тем, что в группе, получавшей рацион ND.
Из этих результатов можно видеть, что D-псикоза снижала уровни лептина и резистина в плазме и соотношения лептина:адипонектина у мышей, страдающих ожирением, вызванным рационом с высоким содержанием жиров, до нормальных значений.
ПРИМЕР 4. ВЛИЯНИЕ D-ПСИКОЗЫ НА ЛИПИДНЫЕ ПРОФИЛИ ПЕЧЕНИ, АКТИВНОСТИ РЕГУЛИРУЮЩИХ ЛИПИДЫ ФЕРМЕНТОВ ПЕЧЕНИ И МОРФОЛОГИЮ ТКАНИ ПЕЧЕНИ МЫШЕЙ, СТРАДАЮЩИХ ОЖИРЕНИЕМ, ВЫЗВАННЫМ РАЦИОНОМ С ВЫСОКИМ СОДЕРЖАНИЕМ ЖИРОВ
Проводили следующий эксперимент для изучения влияния D-псикозы на липидные профили печени, активности регулирующих липиды ферментов печени и морфологию ткани печени мышей, страдающих ожирением, вызванным рационом с высоким содержанием жиров.
ПРИМЕР 4-1. ЛИПИДНЫЕ ПРОФИЛИ ПЕЧЕНИ
Липиды экстрагировали из печени мышей из группы, получавшей стандартный рацион (ND), и групп, получавших рационы с высоким содержанием жиров (HFD, ERY, GLU, FRU и PSI), и высушивали. Затем каждый из высушенных экстрактов липидов печени растворяли в 1 мл этанола. 200 мкл раствора липидов эмульгировали в растворе Triton X-100 и холата натрия в дистиллированной воде. Уровни жирных кислот, триглицеридов и холестерина в печени анализировали с использованием тех же наборов ферментов, которые использовали в примере 2.
Результаты представлены на фиг.4 (А).
Как показано на фиг.4 (А), уровни жирных кислот, триглицеридов и холестерина в печени в группах, получавших рационы с высоким содержанием жиров (HFD, ERY, GLU, FRU и PSI), оказались значительно выше, чем уровни в группе, получавшей рацион ND, зато уровни жирных кислот, триглицеридов и холестерина в печени в группе, получавшей рацион PSI, значительно снизились по сравнению с уровнями в других группах, получавших рационы с высоким содержанием жиров (HFD, ERY, GLU и FRU).
ПРИМЕР 4-2. АКТИВНОСТЬ РЕГУЛИРУЮЩИХ ЛИПИДЫ ФЕРМЕНТОВ ПЕЧЕНИ
Образцы готовили и анализировали в соответствии с методом, разработанным Hulcher и Oleson. В частности, активность синтазы жирных кислот (СЖК) в качестве регулирующего липиды фермента печени измеряли спектрофотометрическим анализом в соответствии с методом, описанным Nepokroeff и др. Каждый образец смешивали с 100 мкл цитоплазматической фракции, и давали смеси прореагировать при 30°С в течение 2 мин. Измеряли снижение абсорбции при 340 нм. Единицы активности синтазы жирных кислот (СЖК) выражали в виде наномолей (нмоль) НАДФH, окисленного в течение 1 мин на мг цитоплазматической фракции. Активность β-окисления жирных кислот измеряли мониторингом восстановления НАД+ до НАДН в присутствии пальмитоил-КоА, как описано Lazarow. Единицы активности β-окисления выражали в виде наномолей (нмоль) НАДН, полученного в течение 1 мин на мг белка митохондрий.
Результаты представлены на фиг.4 (В).
Как показано на фиг.4 (B), активности СЖК и активности β-окисления жирных кислот в группах, получавших рационы с высоким содержанием жиров (HFD, ERY, GLU и FRU), за исключением группы, получавшей рацион PSI, значительно увеличились по сравнению с активностями в группе, получавшей рацион ND, зато активности СЖК и активности β-окисления жирных кислот в группе, получавшей рацион PSI, значительно снизились по сравнению с активностями в других группах, получавших рационы с высоким содержанием жиров, и оказались аналогичными активностям в группе, получавшей рацион ND.
ПРИМЕР 4-3. МОРФОЛОГИЯ ТКАНИ ПЕЧЕНИ
Ткани печени отбирали у мышей из группы, получавшей стандартный рацион (ND), и групп, получавших рационы с высоким содержанием жиров (HFD, ERY, GLU, FRU и PSI), и фиксировали в буферном растворе 10% формалина. Фиксированные ткани печени заливали в парафин. Готовили срезы тканей печени толщиной 4 мм, а их поперечные срезы окрашивали гематоксилином и эозином. Окрашенные участки изучали с использованием оптического микроскопа с увеличением 200× (Nikon, Tokyo, Япония).
Результаты представлены на фиг.4 (С).
Как показано на фиг.4 (C), накопление адипоцитов в тканях печени в группах, получавших рационы с высоким содержанием жиров (HFD, ERY, GLU и FRU), за исключением группы, получавшей рацион PSI, наблюдалось более отчетливо, чем в тканях печени в группе, получавшей рацион ND, а размер адипоцитов тканей печени в группе, получавшей рацион PSI, был меньше, чем тканей печени в других группах, получавших рационы с высоким содержанием жиров.
Эти результаты показывают, что D-псикоза снижала уровни жирных кислот, триглицеридов и холестерина, активности СЖК и размеры адипоцитов в печени мышей, страдающих ожирением, вызванным рационом с высоким содержанием жиров. В заключение, D-псикоза является эффективной для предотвращения жирового гепатоза. Кроме того, D-псикоза снижала активности β-окисления жирных кислот в печени, которые была увеличены рационами с высоким содержанием жиров, до уровней, аналогичных активностям в группе, получавшей стандартный рацион. В заключение, D-псикоза является эффективной для поддержания гомеостаза метаболизма липидов печени на нормальном уровне.
ПРИМЕР 5. ВЛИЯНИЕ D-ПСИКОЗЫ НА АКТИВНОСТИ РЕГУЛИРУЮЩИХ ЛИПИДЫ ФЕРМЕНТОВ И МОРФОЛОГИЮ ТКАНИ В ЖИРОВЫХ ТКАНЯХ МЫШЕЙ, СТРАДАЮЩИХ ОЖИРЕНИЕМ, ВЫЗВАННЫМ РАЦИОНОМ С ВЫСОКИМ СОДЕРЖАНИЕМ ЖИРОВ
Проводили следующий эксперимент для изучения влияния D-псикозы на активности регулирующих липиды ферментов и морфологию ткани в жировых тканях мышей, страдающих ожирением, вызванным рационом с высоким содержанием жиров.
ПРИМЕР 5-1. АКТИВНОСТИ РЕГУЛИРУЮЩИХ ЛИПИДЫ ФЕРМЕНТОВ В ЖИРОВЫХ ТКАНЯХ
Образцы готовили и анализировали в соответствии с методом, разработанным Hulcher и Oleson. В частности, активность синтазы жирных кислот (СЖК) в качестве регулирующего липиды фермента в эпидидимальной белой жировой ткани, измеряли спектрофотометрическим анализом в соответствии с методом, описанным Nepokroeff и др. Каждый образец смешивали со 100 мкл цитоплазматической фракции, и давали смеси прореагировать при 30°С в течение 2 мин. Измеряли снижение абсорбции при 340 нм. Единицы активности СЖК выражали в виде наномолей (нмоль) НАДФH, окисленного в течение 1 мин на мг цитоплазматической фракции. Активность β-окисления жирных кислот измеряли мониторингом восстановления НАД+ до НАДН в присутствии пальмитоил-КоА, как описано Lazarow. Единицы активности β-окисления выражали в виде наномолей (нмоль) НАДН, полученного в течение 1 мин на мг белка митохондрий.
Результаты представлены на фиг.5 (А).
Как показано на фиг.5 (A), активности СЖК в группах, получавших рационы с высоким содержанием жиров (HFD, ERY, GLU и FRU), за исключением группы, получавшей рацион PSI, значительно увеличились по сравнению с активностями в группе, получавшей рацион ND, и активности β-окисления жирных кислот в группах, получавших рационы с высоким содержанием жиров (HFD, ERY, GLU и FRU), за исключением группы, получавшей рацион PSI, значительно снизились по сравнению с активностями в группе, получавшей рацион ND. Активности СЖК в группе, получавшей рацион PSI, значительно снизились по сравнению с активностями в других группах, получавших рационы с высоким содержанием жиров, в то время как активности β-окисления жирных кислот в группе, получавшей рацион PSI, значительно увеличились по сравнению с активностями в других группах, получавших рационы с высоким содержанием жиров, и оказались аналогичными активностям в группе, получавшей стандартный рацион. Из этих результатов можно видеть, что D-псикоза снижала синтез жирных кислот и повышала окисление жирных кислот в жировых тканях мышей, страдающих ожирением, вызванным рационом с высоким содержанием жиров. В заключение, D-псикоза является эффективной для снижения массы тела.
ПРИМЕР 5-2. МОРФОЛОГИЯ ЖИРОВОЙ ТКАНИ
Эпидидимальные БелЖТ отбирали у мышей из группы, получавшей стандартный рацион (ND), и групп, получавших рационы с высоким содержанием жиров (HFD, ERY, GLU, FRU и PSI), и фиксировали в буферном растворе 10% формалина. Фиксированные эпидидимальные БелЖТ заливали в парафин. Готовили срезы эпидидимальных БелЖТ толщиной 4 мм, а их поперечные срезы окрашивали гематоксилином и эозином. Окрашенные участки изучали с использованием оптического микроскопа с увеличением 200× (Nikon, Tokyo, Япония).
Результаты представлены на фиг.5 (В).
Как показано на фиг.5 (B), увеличение размера адипоцитов эпидидимальных БелЖТ в группах, получавших рационы с высоким содержанием жиров (HFD, ERY, GLU и FRU), за исключением группы, получавшей рацион PSI, отчетливо наблюдалось в сравнении с эпидидимальными БелЖТ в группе, получавшей рацион ND. Установили, что размер адипоцитов в группе, получавшей рацион PSI, был относительно небольшим по сравнению с размером в других группах, получавших рационы с высоким содержанием жиров.
Из этих результатов можно видеть, что D-псикоза снижала синтез жирных кислот и повышала окисление жирных кислот в жировых тканях мышей, страдающих ожирением, вызванным рационом с высоким содержанием жиров, что привело к уменьшению размера адипоцитов и предотвращению накопления липидов. В заключение, D-псикоза является эффективной для нормализации жировой массы тела до нормального уровня.
ПРИМЕР 6. ВЛИЯНИЕ D-ПСИКОЗЫ НА ЭКСПРЕССИЮ мРНК ГЕНОВ, УЧАСТВУЮЩИХ В СИНТЕЗЕ И ОКИСЛЕНИИ ЖИРНЫХ КИСЛОТ В ПЕЧЕНИ МЫШЕЙ, СТРАДАЮЩИХ ОЖИРЕНИЕМ, ВЫЗВАННЫМ РАЦИОНОМ С ВЫСОКИМ СОДЕРЖАНИЕМ ЖИРОВ
Проводили следующий эксперимент для изучения влияния D-псикозы на экспрессию мРНК генов (FAS, ACC1, CPT1α и CPT2), участвующих в синтезе и окислении жирных кислот в печени мышей, страдающих ожирением, вызванным рационом с высоким содержанием жиров.
Образцы готовили и анализировали, как описано выше. В частности, тотальную РНК синтезировали в кДНК с использованием набора для обратной транскрипции QuantiTect (QIAGEN Gmblh, Hilden, Германия). Экспрессию РНК количественно определяли посредством количественной ПЦР в реальном времени с использованием набора QuantiTect SYBR Green PCR (QIAGEN Gmblh, Hilden, Германия). Праймеры были разработаны для обнаружения генов FAS (синтаза жирных кислот, 14101), ACC1 (ацетил-КоА-карбоксилаза 1, 107476), CPT1α (карнитин-пальмитоилтрансфераза 1α, 12894) и CPT2 (карнитин-пальмитоилтрансфераза 2, 12896). GAPDH использовался в качестве внутреннего транскрипционного маркера. Реакцию проводили в общей сложности 40 циклов (каждый из которых составлял 15 с при 94°С, 30 с при 58°С, 30 с при 72°С и 15 с при 65°С). Флуоресцентные сигналы регистрировали на каждом цикле и анализировали полученные пороговые циклы (Ct). Экспрессию мРНК в каждой экспериментальной группе количественно определяли с использованием системы ПЦР в реальном времени CFX96 (Bio-rad, США).
Результаты представлены на фиг.6.
Как показано на фиг.6, уровни экспрессии мРНК генов (FAS и ACC1), участвующих в синтезе жирных кислот в печени, и генов (CPT1α и CPT2), участвующих в окислении жирных кислот, во всех группах, получавших рационы с высоким содержанием жиров (HFD, ERY, GLU, FRU, PSI) были значительно ниже, чем в группе, получавшей рацион ND. В частности, уровни экспрессии мРНК генов (FAS и ACC1), участвующих в синтезе жирных кислот печени, и генов (CPT1α и CPT2), участвующих в окислении жирных кислот, в группе, получавшей рацион PSI, были значительно ниже, чем в группе, получавшей рацион ND.
Из этих результатов можно видеть, что D-псикоза снижала экспрессию мРНК генов, участвующих в синтезе жирных кислот в печени мышей, страдающих ожирением, вызванным рационом с высоким содержанием жиров, в целях предотвращения выработки жира в печени.
ПРИМЕР 7. ВЛИЯНИЕ D-ПСИКОЗЫ НА ВЫВЕДЕНИЕ ЛИПИДОВ С ФЕКАЛИЯМИ У МЫШЕЙ, СТРАДАЮЩИХ ОЖИРЕНИЕМ, ВЫЗВАННЫМ РАЦИОНОМ С ВЫСОКИМ СОДЕРЖАНИЕМ ЖИРОВ
Проводили следующий эксперимент для изучения влияния D-псикозы на выведение липидов с фекалиями у мышей, страдающих ожирением, вызванным рационом с высоким содержанием жиров.
Липиды экстрагировали из фекалий мышей из группы, получавшей стандартный рацион (ND), и групп, получавших рационы с высоким содержанием жиров (HFD, ERY, GLU, FRU и PSI), и высушивали. Затем каждый из высушенных экстрактов липидов растворяли в 1 мл этанола. 200 мкл раствора липида эмульгировали в растворе Triton X-100 и холата натрия в дистиллированной воде. Уровни триглицеридов, холестерина и жирных кислот в фекалиях анализировали с использованием тех же наборов ферментов, которые использовали в примере 2.
Результаты представлены на фиг.7.
Как показано на фиг.7, уровни триглицеридов, холестерина и жирных кислот в фекалиях из групп, получавших рационы с высоким содержанием жиров (HFD, ERY, GLU, FRU и PSI), оказались значительно выше, чем уровни из группы, получавшей стандартный рацион. В частности, было подтверждено, что уровни триглицеридов, холестерина и жирных кислот в фекалиях из группы, получавшей рацион PSI, значительно выше, чем уровни из других групп, получавших рационы с высоким содержанием жиров (HFD, ERY, GLU и FRU).
Из этих результатов можно видеть, что D-псикоза повышала выведение липидов с фекалиями у мышей, страдающих ожирением, вызванным рационом с высоким содержанием жиров, что связано с ингибирующим действием D-псикозы на всасывания жиров в кишечнике.
ПРИМЕР 8. ВЛИЯНИЕ D-ПСИКОЗЫ НА ЭКСПРЕССИЮ мРНК ГЕНОВ, УЧАСТВУЮЩИХ ВО ВСАСЫВАНИИ ЛИПИДОВ В ТОНКОМ КИШЕЧНИКЕ МЫШЕЙ, СТРАДАЮЩИХ ОЖИРЕНИЕМ, ВЫЗВАННЫМ РАЦИОНОМ С ВЫСОКИМ СОДЕРЖАНИЕМ ЖИРОВ
Проводили следующий эксперимент для изучения влияния D-псикозы на экспрессию мРНК генов (CD36, FATP4 и ApoB48), участвующих во всасывании липидов, и генов (ABCG5 и ABCG8), участвующих в выведение из тонкого кишечника мышей, страдающих ожирением, вызванным рационом с высоким содержанием жиров.
Образцы готовили и анализировали, как описано выше. В частности, тотальную РНК синтезировали в кДНК с использованием набора для обратной транскрипции QuantiTect (QIAGEN Gmblh, Hilden, Германия). Экспрессию РНК количественно определяли посредством количественной ПЦР в реальном времени с использованием набора QuantiTect SYBR Green PCR (QIAGEN Gmblh, Hilden, Германия). Праймеры были разработаны для обнаружения генов CD36 (кластер дифференцировки 36, 12491), ApoB48 (аполипопротеин B 48, 238055), FATP4 (транспортер жирных кислот 4, 26569), ABCG5 (АТФ-связывающая кассета, член 5 подсемейства G, 27409) и ABCG8 (АТФ-связывающая кассета, член 8 подсемейства G). GAPDH использовался в качестве внутреннего транскрипционного маркера. Реакцию проводили в общей сложности 40 циклов (каждый из которых составлял 15 с при 94°С, 30 с при 58°С, 30 с при 72°С и 15 с при 65°С). Флуоресцентные сигналы регистрировали на каждом цикле и анализировали полученные пороговые циклы (Ct). Экспрессию мРНК в каждой экспериментальной группе количественно определяли с использованием системы ПЦР в реальном времени CFX96 (Bio-rad, США).
Результаты представлены на фиг.8.
Как показано на фиг.8, уровни экспрессии мРНК генов (CD36, FATP4 и ApoB48), участвующих во всасывании липидов в тонком кишечнике, были значительно выше в группах, получавших рационы с высоким содержанием жиров (HFD, ERY, GLU и FRU), за исключением группы, получавшей рацион PSI, чем в группе, получавшей рацион ND. Уровни экспрессии мРНК генов (CD36, FATP4 и ApoB48), участвующих во всасывании липидов в тонком кишечнике, были значительно ниже в группе, получавшей рацион PSI, чем в других группах, получавших рационы с высоким содержанием жиров (HFD, ERY, GLU и FRU), и поддерживались на тех же уровнях, что и в группе, получавшей стандартный рацион.
Из этих результатов можно видеть, что D-псикоза снижала экспрессию мРНК генов, участвующих во всасывании липидов в тонком кишечнике мышей, страдающих ожирением, вызванным рационом с высоким содержанием жиров. В заключение, D-псикоза оказывает ингибирующее действие на усвояемость липидов за счет ее способности ингибировать всасывание липидов в тонком кишечнике.
На основании результатов, полученных в примерах 1-8, роли D-псикозы в метаболизме липидов в тонком кишечнике, тканях печени и жировых тканях мышей, страдающих ожирением, вызванным рационом с высоким содержанием жиров, кратко представлены на фиг.9.
Композицию по настоящему изобретению готовили по следующим рецептурам.
Пример получения 1: Получение фармацевтических композиций
1. Получение порошков
D-псикоза 200 мг
Лактоза 100 мг
Компоненты смешивали вместе и фасовали в воздухонепроницаемые пакеты для получения порошков.
2. Получение таблеток
D-псикоза 200 мг
Кукурузный крахмал 100 мг
Лактоза 100 мг
Стеарат магния 2 мг
Компоненты смешивали вместе и прессовали для получения таблеток согласно подходящему способу, известному в данной области.
3. Получение капсул
D-псикоза 200 мг
Кукурузный крахмал 100 мг
Лактоза 100 мг
Стеарат магния 2 мг
Компоненты смешивали вместе и заполняли ими желатиновые капсулы для получения капсул согласно подходящему способу, известному в данной области.
4. Получение инъекционного препарата
D-псикоза 200 мг
Маннитол 100 мг
Na2HPO4⋅12H2O 2 мг
Стерилизованная дистиллированная вода для инъекций достаточное количество
Компоненты смешивали вместе в ампулах (по 2 мл каждая) для получения инъекционных препаратов согласно подходящему способу, известному в данной области.
Пример получения 2: Получение пищевых продуктов
Продукты, содержащие D-псикозу, получали согласно следующим процедурам:
1. Получение подвергнутых тепловой обработке соусов
Получали полезные для здоровья подвергнутые тепловой обработке соусы, содержащие 20-95 вес.% D-псикозы.
2. Получение томатных кетчупов и соусов
Получали полезные для здоровья томатные кетчупы и соусы, содержащие 0,2-1,0 вес.% D-псикозы.
3. Получение мучных продуктов
В муку добавляли 0,5-5,0 вес.% D-псикозы. Смесь использовали для получения хлеба, пирожных, печенья, крекеров и полезных для здоровья мучных продуктов.
4. Получение супов и подлив
0,1-5,0 вес.% D-псикозы добавляли в супы и подливы для полезных для здоровья мясных обработанных продуктов и мучных продуктов.
5. Получение говяжьего фарша
Получали полезный для здоровья говяжий фарш, содержащий 10 вес.% D-псикозы.
6. Получение молочных продуктов
В молоко добавляли 5-10 вес.% D-псикозы. Смесь использовали для получения молочных продуктов, таких как масло и мороженое.
Пример получения 3: Получение напитков
1. Получение газированных напитков
10-15% D-псикозы, 5-10% сахара, 0,05-0,3% лимонной кислоты, 0,005-0,02% карамели и 0,1-1% витамина смешивали вместе. Смесь смешивали с 75-80% очищенной воды для получения сиропа. Сироп стерилизовали при 85-98°С в течение 20-180 с и смешивали с охлаждающей водой в соотношении 1:4. В смесь вводили 0,5-0,82% углекислого газа для получения газированного напитка, содержащего D-псикозу.
2. Получение полезных для здоровья напитков
D-псикозу (содержание сухих веществ: 2,5%, 97,16%), экстракт ююбы (65 брикс, 2,67%), экстракт комплекса фруктовых напитков (содержание сухих веществ: 70%, 0,12%), витамин С (0,02%), пантотенат кальция (0,02%) и экстракт солодки (содержание сухих веществ: 65%, 0,01%) смешивали вместе. Смесь гомогенизировали, подвергали мгновенной стерилизации и упаковывали в небольшие упаковочные контейнеры, такие как стеклянные бутылки и ПЭТ-бутылки, с получением полезных для здоровья напитков.
3. Получение овощных соков
0,5 г D-псикозы добавляли в 1000 мл томатного или морковного сока для получения полезного для здоровья овощного сока.
4. Получение фруктовых соков
0,1 г D-псикозы добавляли в яблочный или виноградный сок для получения полезного для здоровья фруктового сока.
Несмотря на то, что настоящее изобретение описано здесь со ссылкой на вышеприведенные варианты осуществления, специалистам в данной области техники будет понятно, что изобретение может быть реализовано в других конкретных формах без изменения сущности или существенных признаков изобретения. В связи с этим следует отметить, что вышеприведенные варианты осуществления являются просто иллюстративными во всех аспектах и не должны рассматриваться как ограничивающие изобретение.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
В настоящем изобретении физиологическая активность D-псикозы была раскрыта назначением изокалорических рационов группам, получавшим рационы, с целью исключения влияние D-псикозы на снижение калорий. В результате было обнаружено, что D-псикоза выполняет функции ингибирования всасывания липидов в тонком кишечнике и значительно повышает уровни липидов в фекалиях для предотвращения выработки жира и снижения массы тела, жировой массы тела и уровней липидов в плазме, вследствие чего в течение короткого времени нормализуется масса тела, жировая масса тела и липидные профили плазмы. Благодаря этим преимуществам ожидается, что D-псикоза будет использоваться для профилактики и/или лечения заболеваний, связанных с нарушением метаболизма липидов.