Результат интеллектуальной деятельности: НОВАЯ О-АЦЕТИЛГОМОСЕРИН-СУЛЬФГИДРИЛАЗА ИЛИ ЕЕ МУТАНТНЫЙ БЕЛОК И СПОСОБ ПРЕОБРАЗОВАНИЯ В МЕТИОНИН С ИСПОЛЬЗОВАНИЕМ ТАКОВОЙ
Вид РИД
Изобретение
Область техники
Настоящее изобретение относится к новому белку, обладающему активностью О-ацетилгомосерин-сульфгидрилазы, его мутантному белку, полинуклеотиду, кодирующему таковой, рекомбинантному вектору, включающему полинуклеотид, микроорганизму, трансформированному рекомбинантным вектором, и способу для получения метионина или уксусной кислоты с использованием указанного белка.
Предшествующий уровень техники
L-метионин, который является одной из незаменимых аминокислот, in vivo содержится в большинстве белков и присутствует в свободном состоянии в соевом соусе, который является одной из приправ. Его широко используют в пище и пищевых добавках, и также используют в качестве инфузионного раствора для медицинского применения или исходного материала для синтеза лекарственных препаратов. Метионин является важной аминокислотой, вовлеченной in vivo в реакцию переноса метила. Во-первых, при реакции с АТФ метионин преобразуется в δ-аденозилметионин, который затем отдает метильную группу различным акцепторам; и затем преобразуется в цистеин через гомоцистеин и цистатионин. Красная хлебная плесень синтезирует метионин из цистеина. Запах ферментированной пищи, такой как соевый соус или сыр, часто обусловлен альдегидом, спиртом и/или сложным эфиром, полученным из метионина.
Также метионин действует как предшественник соединений, таких как холин, лецитин и креатин, и используется в качестве исходного материала для синтеза цистеина и таурина, и служит в качестве донора серы. Кроме того, метионин ассоциирован с синтезом различных нейротрансмиттеров в головном мозге. Метионин и/или S-аденозил-L-метионин (SAM) in vivo ингибируют накопление жира в печени и артериях и играют различные роли, такие как уменьшение депрессии, воспаления, заболеваний печени, и боли в мышцах. Более того, метионин и/или S-аденозил-L-метионин обеспечивают различные функции, такие как ингибирование отложения жира в печени, что запускает метаболизм жира, и артериях, увеличивая циркуляцию кровотока в головном мозге, сердце и почках, стимулируют пищеварение, обеспечивая детоксикацию и экскрецию токсических веществ, и обеспечивают экскреции тяжелых металлов, таких как тетраэтилсвинец. Сообщают, что ежедневное потребление 800-1600 мг метионина дает превосходный антидепрессантный эффект, улучшение функции печени у пациентов с заболеваниями печени, особенно заболеваниями печени, вызванными алкоголем, превосходный противовоспалительный эффект при заболеваниях суставов костей, и стимуляцию восстановления суставов у них же. Также известно, что в качестве незаменимого питательного вещества для волос, метионин обеспечивает питание ломким волосам, предотвращая потерю волос.
Для химического синтеза метионина наиболее часто L-метионин получают посредством гидролиза 5-(β-метилмеркаптоэтил)гидантоина. Однако когда метионин получают путем такого синтетического процесса, существует недостаток получения смешанных форм L-типа и D-типа. В этом отношении существует патент, описывающий методику, которая позволяет селективно получать L-метионин с использованием биологического подхода (WO2008/013432). Указанный метод, называемый просто двухстадийным методом, включает процесс получения предшественника L-метионина путем ферментации и способ преобразования предшественника L-метионина в L-метионин с использованием ферментов. Тип предшественника L-метионина предпочтительно включает О-ацетилгомосерин и О-сукцинилгомосерин. Разработка двухстадийного метода решает все существующие проблемы, такие как токсичность и субстратная специфичность к сульфиду, регуляция штамма метионином и SAM с обратной связью и разложение промежуточного продукта, специфичного для цистатионин гамма-синтазы, О-сукцинилгомосерин-сульфгидрилазы и О-ацетилгомосерин-сульфгидрилазы. Более того, указанный способ, который дает селективно только L-метионин, превосходит обычные процессы химического синтеза, которые дают и D-метионин и L-метионин одновременно, и указанный способ может дополнительно давать органическую кислоту, точнее, янтарную кислоту и уксусную кислоту, в качестве побочного продукта той же реакции.
Процесс ферментативного превращения в двухстадийном методе использует ферменты, обладающие активностью цистатионин гамма-синтазы, активностью О-сукцинилгомосерин-сульфгидрилазы или О-ацетилгомосерин-сульфгидрилазы, и дает L-метионин и органические кислоты вследствие ферментативных реакций О-ацетилгомосерина или О-сукцинилгомосерина, которые являются предшественниками L-метионина, с метилмеркаптаном.
В реакции ферментативного превращения для получения L-метионина из О-ацетилгомосерина, который является предшественником L-метионина, могут быть использованы различные О-ацетилгомосерин-сульфгидрилазы микробного происхождения. Однако с целью использования в качестве промышленной конвертазы фермент должен соответствовать нескольким требованиям для максимального повышения экономической эффективности. Во-первых, фермент должен обладать характеристиками высокой активности и высокой скорости превращения, и его повышенная экспрессия должна быть возможна в E. coli. В общем, для реакций, которые используют очищенный фермент, необходимыми являются активность фермента, скорость реакции и высокая афинность к субстрату. Но, если гомогенат фермента добавляют непосредственно в реакционную смесь, в добавление к наличию высокой активности должна быть возможна повышенная экспрессия фермента в каждой клетке, с целью запуска реакции минимальным количеством гомогената. Во-вторых, фермент должен поддерживать высокую скорость реакции с О-ацетилгомосерином в высокой концентрации и ингибирование его активности должно быть низким даже при накоплении конечных продуктов L-метионина и уксусной кислоты до высокой концентрации. Наконец, фермент должен обладать термической стабильностью для поддержания его активности в течение 1-5 часовой реакции. Рассматривая вышеуказанные требования, ранее описанная О-ацетилгомосерин-сульфгидрилаза, полученная от Hyphomonas neptunium, является превосходным ферментом, однако с целью максимального увеличения коммерческой ценности двухстадийного метода для получения метионина, необходимым является поиск фермента с усилением трех характеристик.
ОПИСАНИЕ
Техническая проблема
Авторы настоящего изобретения получили гены О-ацетилгомосерин-сульфгидрилазы из различных микробных источников и окончательно посредством экспериментов выбрали ген О-ацетилгомосерин-сульфгидрилазы от Rhodobacter sphaeroides. Затем после использования фермента в реакции превращения авторы изобретения обнаружили, что О-ацетилгомосерин-сульфгидрилаза от Rhodobacter sphaeroides является экономически конкурентной конвертазой для применения в двухстадийном методе для получения метионина, и также подтвердили, что экономическая конкурентоспособность конвертазы может быть усилена путем улучшения фермента при помощи внесения мутаций, посредством чего осуществили настоящее изобретение.
Техническое решение
Одной задачей настоящего изобретения является обеспечение нового белка, обладающего активностью О-ацетилгомосерин-сульфгидрилазы.
Другой задачей настоящего изобретения является обеспечение полинуклеотида, кодирующего новый белок.
Другой задачей настоящего изобретения является обеспечение мутантного белка, обладающего улучшенной активностью О-ацетилгомосерин-сульфгидрилазы.
Другой задачей настоящего изобретения является обеспечение полинуклеотида, кодирующего мутантный белок.
Другой задачей настоящего изобретения является обеспечение рекомбинантного вектора, включающего полинуклеотид.
Другой задачей настоящего изобретения является обеспечение микроорганизма, трансформированного рекомбинантным вектором.
Другой задачей настоящего изобретения является обеспечение метода для получения метионина или уксусной кислоты из предшественников О-ацетилгомосерина и метилмеркаптана с использованием белка или микроорганизма, продуцирующего таковой.
Преимущественные эффекты
Настоящее изобретение обеспечивает белок, обладающий активностью О-ацетилгомосерин-сульфгидрилазы, полученный от Rhodobacter sphaeroides, который требуется для получения L-метионина и уксусной кислоты из субстрата метилмеркаптана (CH3SH). Если используют белок, он имеет экономические преимущества получения L-метионина и уксусной кислоты, обладая более высокой скоростью превращения и меньшим временем реакции по сравнению с существующими методами, которые используют белок, обладающий активностью О-ацетилгомосерин-сульфгидрилазы, от Hyphomonas neptunium. Кроме того, если используют мутантный белок с улучшенной активностью О-ацетилгомосерин-сульфгидрилазы по настоящему изобретению, это может минимизировать количество добавляемого гомогената фермента, таким образом, легко давая L-метионин и уксусную кислоту с высоким выходом.
Описание чертежей
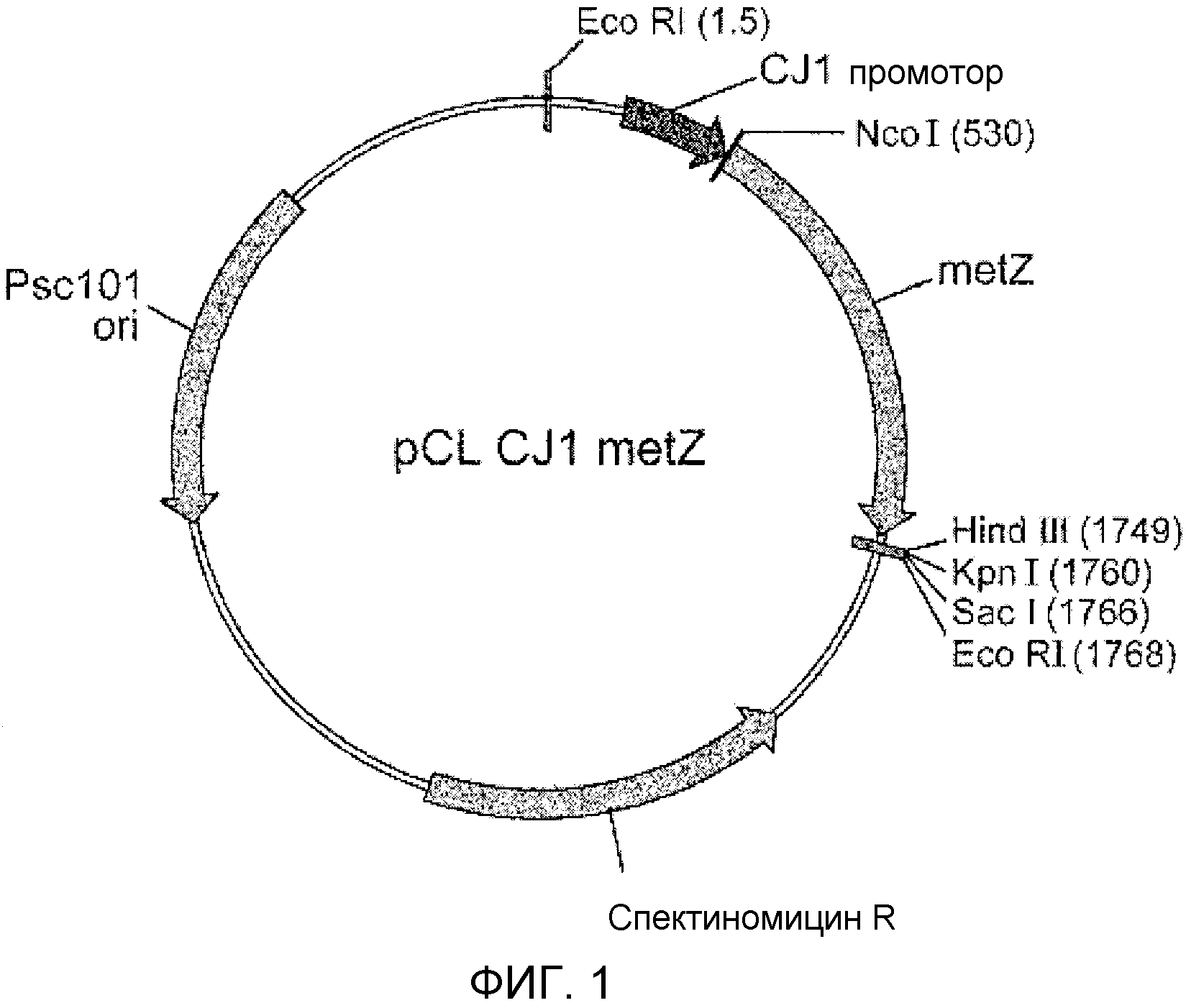
Фиг. 1 представляет собой схематическую диаграмму вектора pCL-PCJ1-MetZhne.
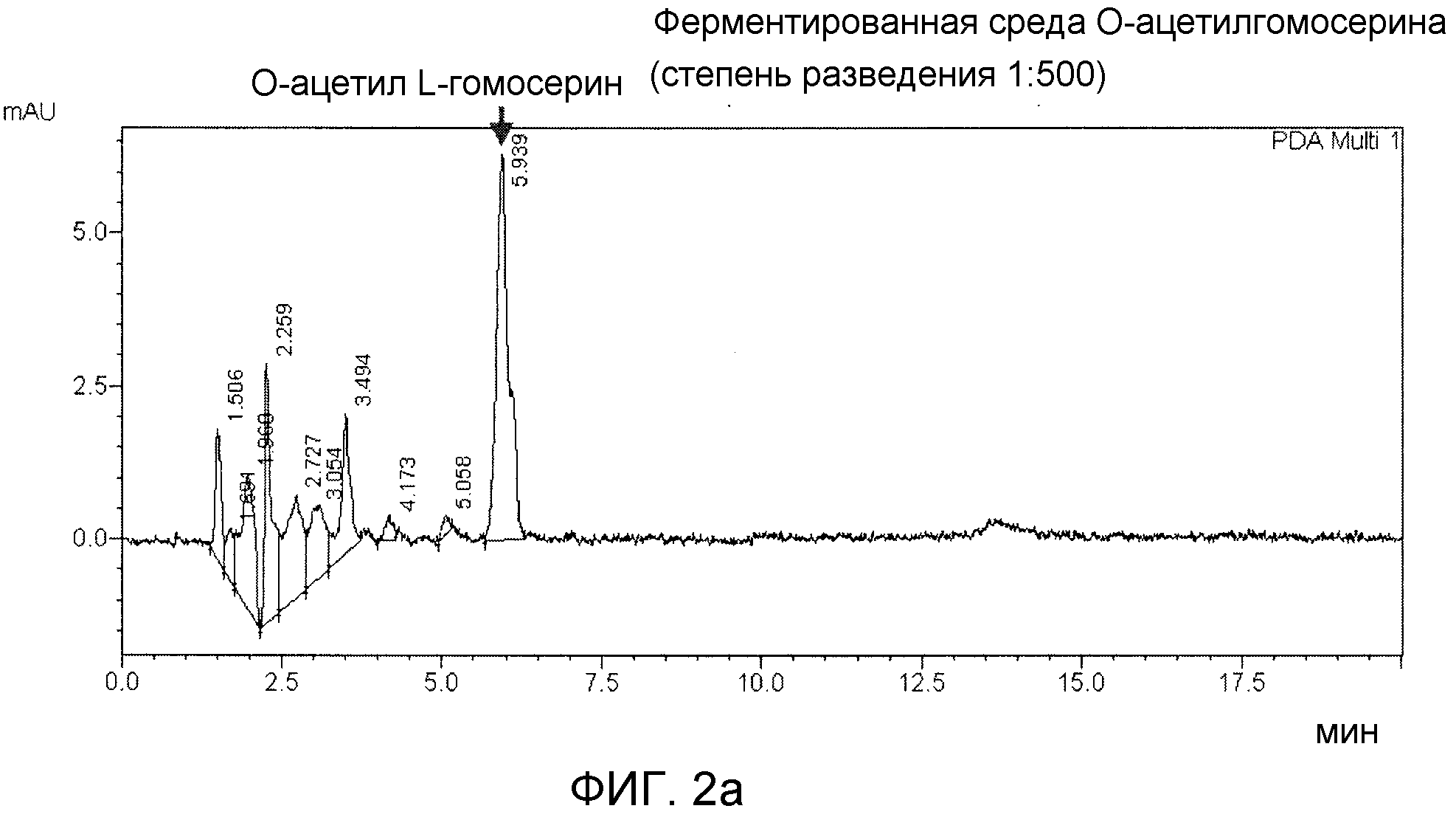
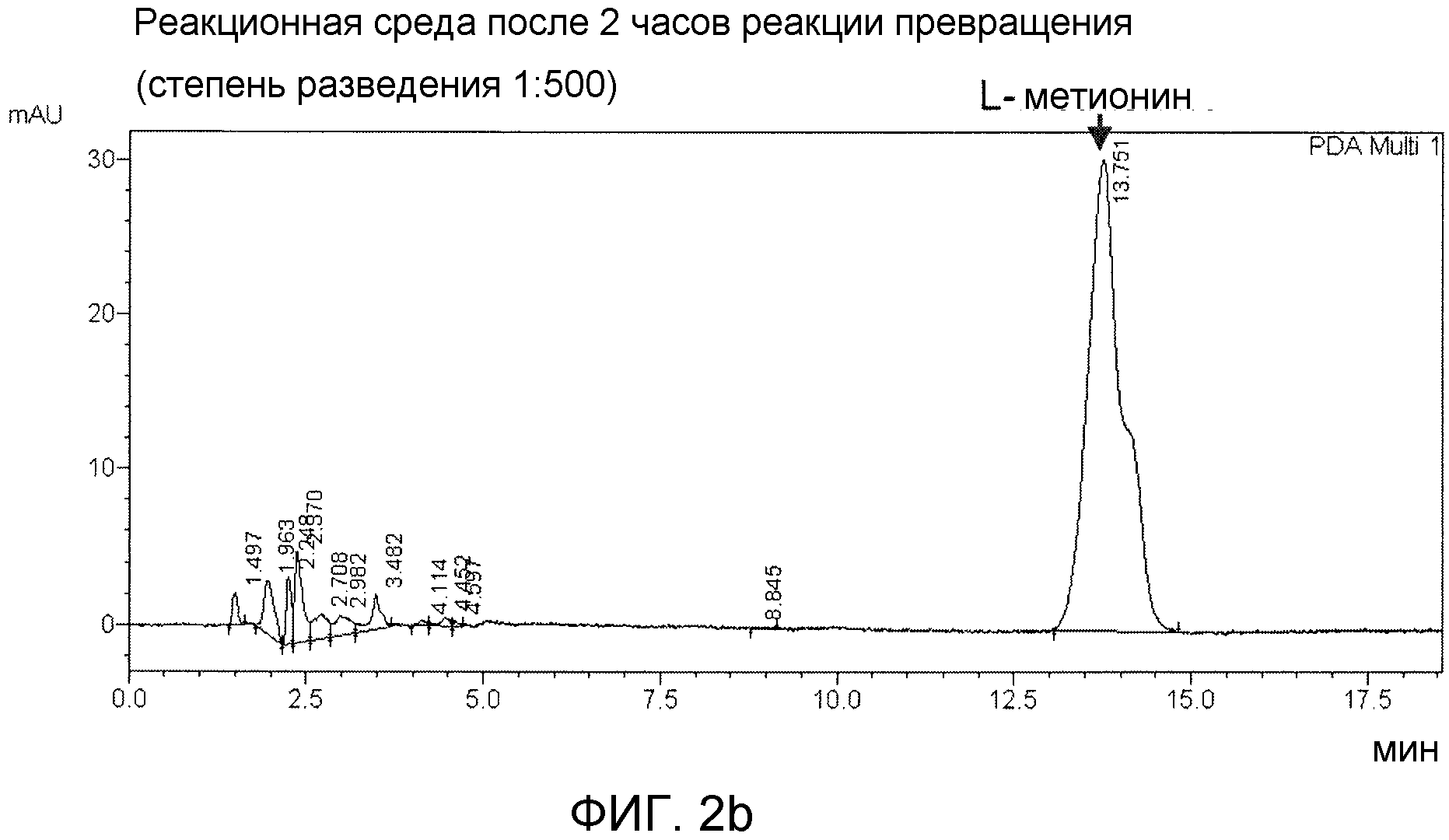
Фиг. 2а и 2b показывают результаты ВЭЖХ, демонстрирующие продукцию метионина. Во-первых, 5-10% гомогената микроорганизмов (общего реакционного объема), включающие белок, добавляли к ферментационному бульону О-ацетилгомосерина, и реакцию начинали путем добавления 15% Na-метилмеркаптана при рН 6-8. Через 2 часа собирали ферментационный бульон, и затем из него удаляли клетки для анализа продукции метионина.
На фиг. 3 показано сравнение уровня экспрессии конвертазы в 2,5 мкл, 5 мкл, 10 мкл клеточного гомогената О-ацетилгомосерин-сульфгидрилазы от вида hyphomonas (MetZ-hne) и О-ацетилгомосерин-сульфгидрилазы от вида rhodobacter (MetZ-rsp).
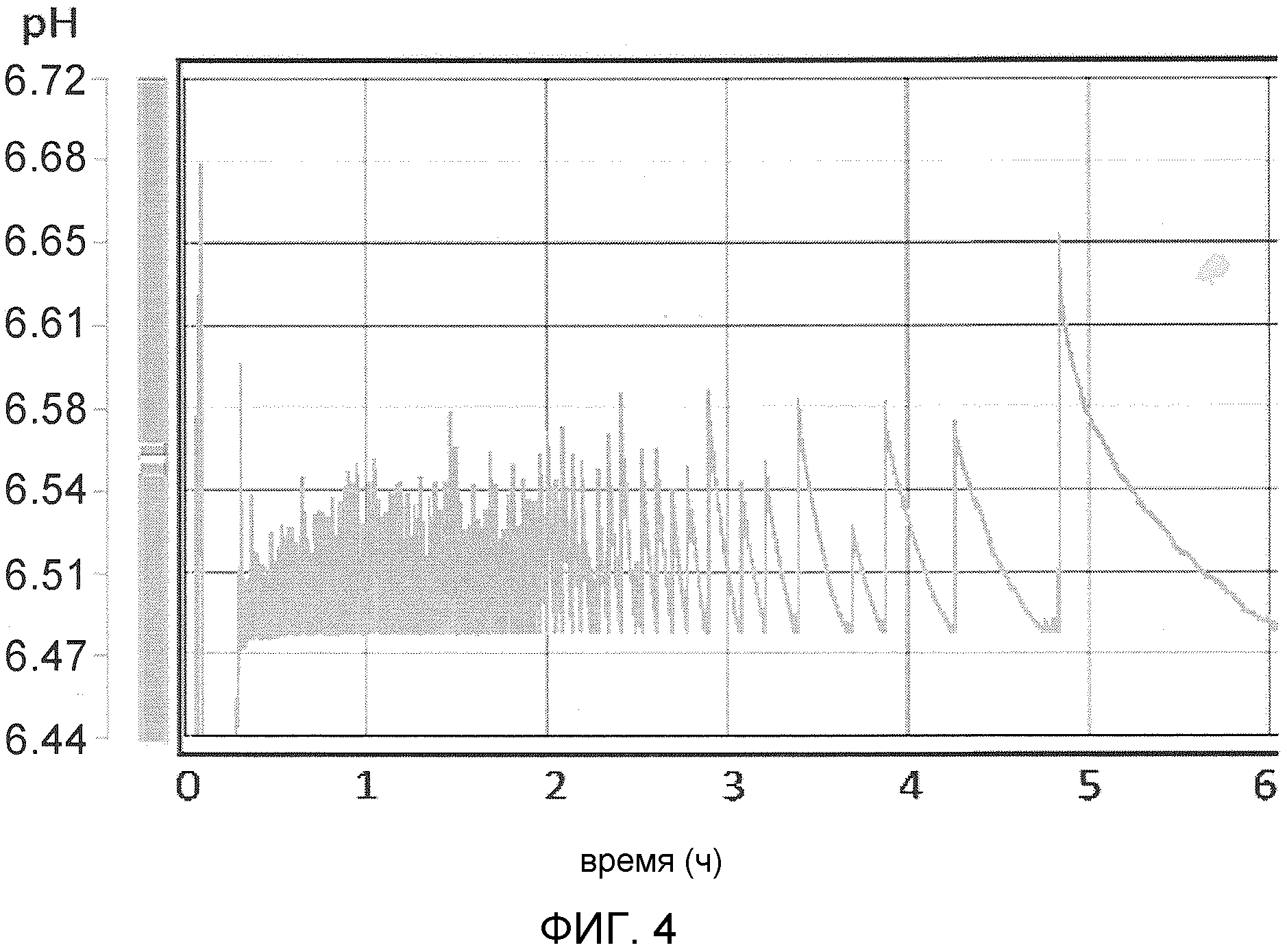
На фиг. 4 продемонстрированы изменения рН во время реакции превращения в 30 л периодическом реакторе.
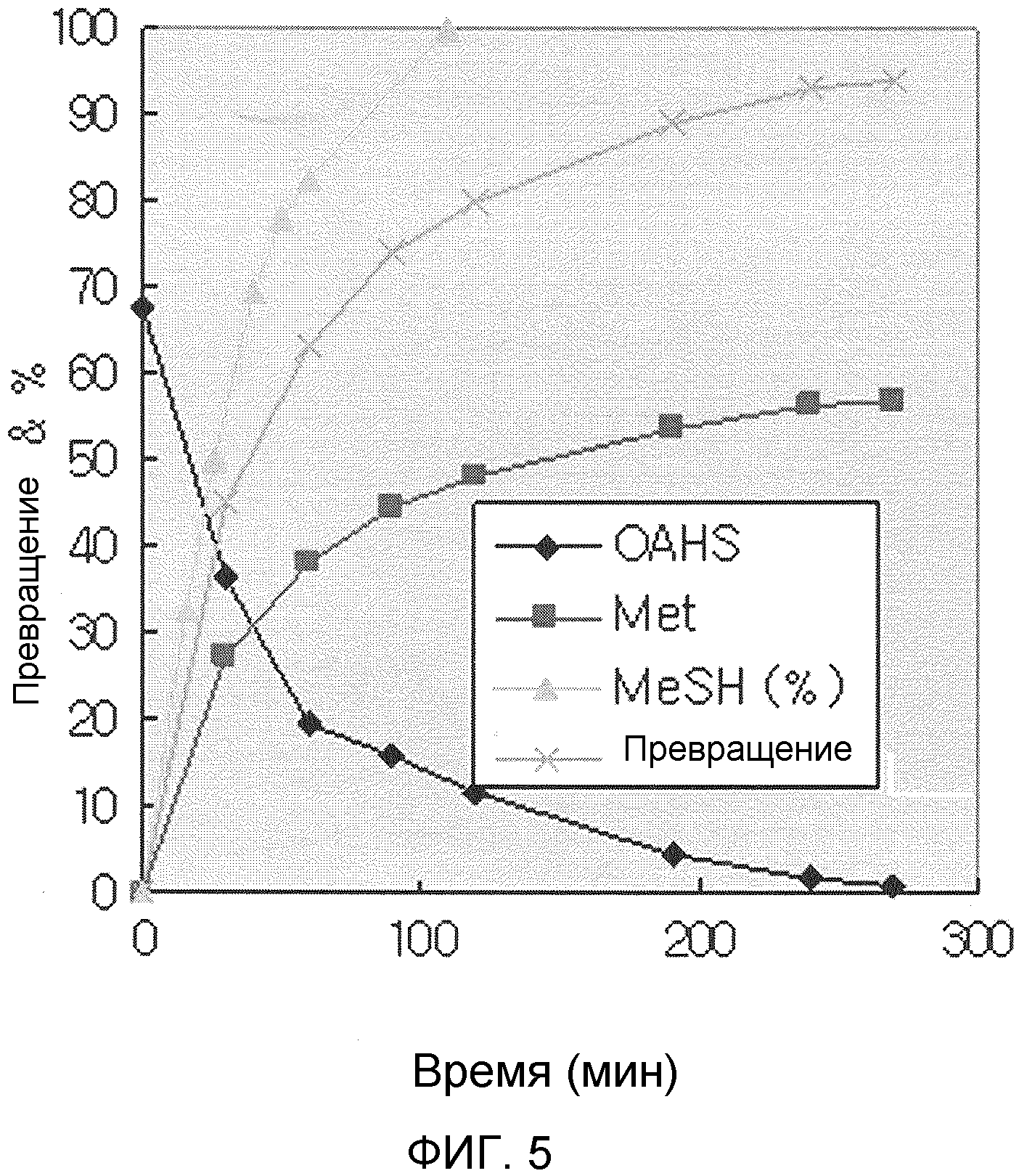
На фиг. 5 показаны изменения концентрации О-ацетилгомосерина (OAHS) и L-метионина (Met) в течение реакции превращения в 30 литровом периодическом реакторе, соотношение метилмеркаптана (MeSH), добавленного в каждый момент времени, устанавливая общее требуемое количество метилмеркаптана как 100%, и скорость превращения метионина в каждый момент времени. Скорость превращения метионина представляет собой (г/г)%, рассчитанная путем деления общего количества метионина, образующегося в каждый момент времени, на общее количество добавленного О-ацетилгомосерина (*скорость превращения метионина, 92,59% = скорость превращения метионина в моль, 100%).
Наилучший способ осуществления
В качестве одного аспекта настоящее изобретение обеспечивает новый белок, обладающий активностью О-ацетилгомосерин-сульфгидрилазы.
В настоящем изобретении белок, обладающий активностью О-ацетилгомосерин-сульфгидрилазы, относится к новому белку, способному синтезировать L-метионин с использованием О-ацетилгомосерина, который является предшественником L-метионина, и метилмеркаптана. Новый белок предпочтительно представляет собой белок, обладающий активностью О-ацетилгомосерин-сульфгидрилазы, от Rhodobacter sphaeroides. Для целей настоящего изобретения новый белок включает любой белок, обладающий активностью О-ацетилгомосерин-сульфгидрилазы, без ограничения, но предпочтительно он может быть белком SEQ ID No.13.
Как используется в настоящем описании термин «О-ацетилгомосерин» представляет собой вещество с молекулярной массой 161,16 и является первым специфическим промежуточным продуктом биосинтеза метионина в микроорганизмах. В кишечных бактериях в качестве промежуточного продукта используется О-сукцинилгомосерин вместо О-ацетилгомосерина, и у высших растений в качестве промежуточного продукта используется О-фосфогомосерин. О-ацетилгомосерин образуется из L-гомосерина и ацетил-СоА путем катализа гомосерин-ацетилтрансферазой в бифуркации с биосинтезом треонина.
В патентной публикации WO2008/013432 описан процесс получения L-метионина с использованием двухстадийного метода и в указанном процессе О-сукцинилгомосерин и О-ацетилгомосерин представляют собой два типа О-ацилгомосерина, который является предшественником, используемым для получения L-метионина.
Как используется в настоящем описании термин «предшественник» относится к веществу, получаемому на стадии, предшествующей конечному продукту, в метаболизме или биосинтетической реакции. Для целей настоящего изобретения предшественник относится к метаболиту, продуцируемому штаммом, продуцирующим предшественник L-метионина, как часть метионин-специфического метаболического пути, или его производных. Специфически предшественник L-метионина по настоящему изобретению относится к О-сукцинилгомосерину или О-ацетилгомосерину.
Ферменты, способные продуцировать метионин из О-сукцинилгомосерина среди предшественников L-метионина посредством ферментативного превращения, включают цистатионин гамма-синтазу и О-сукцинилгомосерин-сульфгидрилазу. В общем, ген, кодирующий цистатионин гамма-синтазу, обычно обозначают как metB, и ген, кодирующий О-сукцинилгомосерин-сульфгидрилазу, обычно обозначают как metZ. Указанные ферменты обладают следующими тремя действиями.
L-цистеин + О-сукцинилгомосерин => янтарная кислота + цистатионин
Сульфид (HS-) + О-сукцинилгомосерин => янтарная кислота + гомоцистеин
Метилмеркаптан + О-сукцинилгомосерин => янтарная кислота + L-метионин
О-ацетилгомосерин-сульфгидрилаза представляет собой фермент, способный продуцировать L-метионин с использованием О-ацетилгомосерина, который является другим предшественником L-метионина. В общем, ген, кодирующий О-ацетилгомосерин-сульфгидрилазу, обычно обозначают как metY. Указанный фермент обладает следующими тремя активностями.
L-цистеин + О-ацетилгомосерин => уксусная кислота + цистатионин
Сульфид (HS-) + О-ацетилгомосерин => уксусная кислота гомосерин
Метилмеркаптан + О-ацетилгомосерин => уксусная кислота + L-метионин
Использование О-ацетилгомосерина, который для получения двух предшественников L-метионина требует меньше источников углерода, таких как глюкоза и сырые сахара, является наиболее экономически эффективным в продукции L-метионина. Однако, тогда как фермент MetZ, который является О-сукцинилгомосерин-сульфгидрилазой, не получает обратного ингибирования своим конечным продуктом L-метионином, фермент MetY, который является О-ацетилгомосерин-сульфгидрилазой, ингибируется своим продуктом L-метионином и, следовательно, MetY трудно использовать в ферментативной реакции.
В одном примере настоящего изобретения посредством тестирования различных генов metZ в отношении их активности, был идентифицирован ген metZ, полученный от Rhodobacter sphaeroides, обладающий активностью О-ацетилгомосерин-сульфгидрилазы, хотя ранее ожидали, что он является О-сукцинилгомосерин-сульфгидрилазой. Более того, было подтверждено, что metZ, полученный от Rhodobacter sphaeroides, не получает обратного ингибирования L-метионином. Выбранный белок, обладающий активностью О-ацетилгомосерин-сульфгидрилазы, может иметь последовательность аминокислот SEQ ID No. 13.
В одном примере настоящего изобретения субстратную специфичность, уровень экспрессии конвертазы, и активность конвертазы сравнивали между белком, обладающим активностью О-ацетилгомосерин-сульфгидрилазы, полученным от вида Hyphomonas, и О-ацетилгомосерин-сульфгидрилазой, полученной от вида Rhodobacter. В результате было обнаружено, что когда L-метионин получают с использованием мутантного белка О-ацетилгомосерин-сульфгидрилазы, полученного от вида Rhodobacter, мутантный белок проявляет более высокую субстратную специфичность в отношении О-ацетилгомосерина, чем О-сукцинилгомосерина (таблица 1), и также демонстрирует улучшенную ферментативную активность во время ранней фазы реакции, улучшенную скорость реакции и скорость превращения L-метионина (таблица 2). Кроме того, когда уровень ингибирования конечными продуктами сравнивали между рекомбинантными мутантными белками, полученными от двух штаммов, О-ацетилгомосерин-сульфгидрилаза, полученная от вида Rhodobacter, сохраняла высокую активность в продукции L-метионина даже с обратным ингибированием его конечным продуктом (таблица 3). Более того, когда сравнивали термическую стабильность фермента относительно температуры реакции, мутантный белок О-ацетилгомосерин-сульфгидрилаза, полученная от вида Rhodobacter, показала лучшую термическую стабильность по сравнению с мутантным белком О-ацетилгомосерин-сульфгидрилазой, полученной от вида Hyphomonas (таблица 4).
Следовательно, белок по настоящему изобретению, обладающий активностью О-ацетилгомосерин-сульфгидрилазы, удовлетворяет всем требованиям для использования в качестве промышленной конвертазы, включая высокую активность, высокую скорость превращения, повышенную экспрессию в E. coli, низкое ингибирование ферментативной активности конечным продуктом и способность поддержания термической стабильности в момент накопления конечного продукта, и следовательно, путем использования фермента по настоящему изобретению, L-метионин и уксусная кислота могут быть получены с высокой скоростью и высокой эффективностью.
В качестве другого аспекта настоящее изобретение обеспечивает мутантный белок, обладающий усиленной активностью О-ацетилгомосерин-сульфгидрилазы по сравнению с диким типом.
Как используется в настоящем описании термин «мутация» или «мутантный белок» относится к культуре или индивиду, демонстрирующим единственное стабильное генетическое или негенетическое фенотипическое изменение. В настоящем изобретении мутантный белок предпочтительно относится к белку, чья активность увеличивается по сравнению с диким типом из-за мутации в одном или более генах, кодирующих О-ацетилгомосерин-сульфгидрилазу, полученных от Rhodobacter sphaeroides. Последовательность мутантного белка может включать последовательность белка, имеющего гомологию, по меньшей мере, с 80%, 90%, 95%, 96%, 97%, 98% или 99% последовательности дикого типа. Предпочтительно, белком может быть мутантный белок, обладающий усиленной активностью О-ацетилгомосерин-сульфгидрилазы вследствие мутации, где 3-я аминокислота с N-конца белка, представленного последовательностью аминокислот SEQ ID No.13, заменена аминокислотой, иной, чем изолейцин, 65-я аминокислота с того же конца заменена аминокислотой, иной, чем фенилаланин, и 104-я аминокислота с того же конца заменена аминокислотой иной, чем валин, или имеет место комбинация одного или более из трех типов мутаций аминокислот. Более предпочтительно могут быть скомбинированы две или более или даже более предпочтительно, три вида мутаций. Еще более предпочтительно белком может быть мутантный белок, где 3-я аминокислота с N-конца, изолейцин, заменена аспарагином, и 65-я аминокислота, фенилаланин, заменена тирозином, и 104-я аминокислот, валин, заменена аланином. Последовательностью аминокислот мутантного белка может быть предпочтительно мутантный белок, имеющий последовательность аминокислот SEQ ID NO: 15, 16, 17 или 18.
Специфически мутантный белок, представленный последовательностью аминокислот SEQ ID NO: 15, представляет собой вариант белка, представленный последовательностью аминокислот SEQ ID NO: 13, где 3-я аминокислота с N-конца, изолейцин, заменена аспарагином.
Мутантный белок, представленный последовательностью аминокислот SEQ ID NO: 16, имеет замену фенилаланина, который является 65-й аминокислотой с N-конца белка, представленного последовательностью аминокислот SEQ ID NO: 13, тирозином.
Мутантный белок, представленный последовательностью аминокислот SEQ ID NO: 17, имеет замену валина, который является 104-й аминокислотой с N-конца белка, представленного последовательностью аминокислот SEQ ID NO: 13, аланином.
Кроме того, мутантный белок, представленный последовательностью аминокислот SEQ ID NO: 18, имеет замену изолейцина, который является 3-й аминокислотой с N-конца белка, представленного последовательностью аминокислот SEQ ID NO: 13, аспарагином, замену фенилаланина, 65-й аминокислоты, тирозином, и замену валина, 104-й аминокислоты, аланином.
В одном примере настоящего изобретения на основании вышеуказанных открытий создавали четыре мутантных белка, такие как I3N, F65Y, V104A и E182G с улучшенной ферментативной активностью мутантного белка О-ацетилгомосерин-сульфгидрилазы от вида Rhodobacter. Затем три значимых мутантных белка, такие как I3N, F65Y и V104A, выбирали путем оценки активности мутантных белков (таблица 9). Вектор, включающий комбинацию трех значимых мутантных белков, получали и переносили в E. coli. После измерения активности каждого мутантного белка было обнаружено, что мутантные белки имели в 1,75 раз повышенную активность, чем таковая дикого типа О-ацетилгомосерин-сульфгидрилазы (таблица 10).
В качестве другого аспекта настоящее изобретение обеспечивает полинуклеотид, кодирующий новый белок, обладающий активностью О-ацетилгомосерин-сульфгидрилазы, или мутантный белок, обладающий усиленной активностью О-ацетилгомосерин сульфгидрилазы, по сравнению с диким типом.
Как используется в настоящем описании термин «полинуклеотид» относится к полимеру нуклеотидов, имеющему мономеры нуклеотидов, связанные в длинную цепь ковалентными связями, и обычно он обозначает цепь деоксирибонуклеиновой кислоты (ДНК) или рибонуклеиновой кислоты (РНК), более длинную, чем определенная длина. Для целей настоящего изобретения полинуклеотидом может быть фрагмент полинуклеотида, кодирующий белок. Указанный фрагмент полинуклеотида включает фрагменты полинуклеотида, имеющие гомологию, по меньшей мере, с 80%, 90%, 95%, 96%, 97%, 98% или 99% последовательности фрагмента полинуклеотида, обладающего активностью О-ацетилгомосерин-сульфгидрилазы.
Предпочтительно, полинуклеотидом может быть полинуклеотид, представленный последовательностью нуклеотидов SEQ ID NO: 14. Полинуклеотид, представленный последовательностью полинуклеотидов SEQ ID NO: 14, представляет собой полинуклеотид, кодирующий белок дикого типа, имеющий последовательность аминокислот SEQ ID NO: 13.
Кроме того, полинуклеотид, кодирующий мутантный белок, может иметь последовательность нуклеотидов SEQ ID NO: 19, 20, 21 или 22. Полинуклеотиды, имеющие последовательность нуклеотидов SEQ ID NO: 19, 20, 21 и 22, представляют собой полинуклеотиды, кодирующие белки, имеющие последовательности аминокислот SEQ ID NO: 15, 16, 17 и 18 соответственно.
Как используется в настоящем описании термин «гомология» относится к проценту идентичности между двумя полинуклеотидными компонентами. Соответствие последовательности одного компонента другому может быть определено известной методикой в области техники. Например, гомология может быть определена путем выравнивания последовательности двух молекул полинуклеотидов непосредственно с использованием компьютерной программы, которая является легко доступной и способной выравнивать последовательности. Кроме того, гомологию можно определить путем гибридизации полинуклеотидов в условиях образования стабильной двойной цепи в гомологичных участках и переваривания гибридизованного штамма нуклеазой, специфичной к одиночной цепи, для определения размера переваренного фрагмента.
Как используется в настоящем описании, термин «гомологичный» относится к корреляции между белками, где все грамматические формы и варианты произношения включают белки суперсемейства (например, суперсемейства иммуноглобулинов) и гомологичные белки других видов (например, легких цепей миозина и др.), имеющие «общее эволюционное происхождение». Такие белки (и кодирующие их гены) имеют гомологию последовательности, отражающую высокую степень сходства последовательности. Однако, в общем применении и в настоящем изобретении, когда термин «гомогенез» модифицируется прилагательным, таким как «очень высокий», он относится к сходству последовательности, но не к общему эволюционному происхождению.
Как используется в настоящем описании термин «сходство последовательности» относится к степени идентичности или гомологии между последовательностями нуклеотидов или последовательностями аминокислот белков, которые могут разделять, или не разделять общее эволюционное происхождение. В одном специфическом примере, когда полипептидное соответствие между двумя последовательностями аминокислот составляет, по меньшей мере, 21% для фиксированной длины последовательности аминокислот (предпочтительно, по меньшей мере, около 50% и наиболее предпочтительно около 75%, 90%, 95%, 96%, 97% или 99%), такие две последовательности являются «по существу гомологичными» или «по существу сходными». По существу гомологичные последовательности могут быть идентифицированы путем сравнения последовательностей с использованием стандартного программного обеспечения, используемого в банке данных или, например, путем проведения эксперимента Саузерн гибридизации в строгих условиях, определенных для конкретных систем. Определенные условия, подходящие для гибридизации, находятся в рамках обычной методики в области техники (например, Sambrook et al., 1989, см ниже).
В качестве другого аспекта настоящее изобретение обеспечивает рекомбинантный вектор, включающий полинуклеотид, кодирующий О-ацетилгомосерин-сульфгидрилазу дикого типа или ее мутантный белок.
Как используется в настоящем описании термин «вектор» относится к любому носителю для клонирования и/или переноса нуклеотидов в клетку-хозяин. Вектором может быть репликон для возможности репликации фрагментов, комбинированных с другими фрагментами ДНК. «Репликон» относится к любой генетической единице, действующей как самореплицирующая единица для репликации ДНК in vivo, то есть, реплицирующейся посредством саморегуляции (например, плазмида, фаг, космида, хромосома и вирус). Вектор может включать вирусный и невирусный носитель для внесения нуклеотидов в клетку-хозяин in vitro, ex vivo или in vivo, и также может включать мини-сферическую ДНК. Например, вектором может быть плазмида без бактериальной последовательности ДНК. Удаление последовательности бактериальной ДНК, которая является обогащенной в области CpG, проводили для уменьшения отключения трансгенной экспрессии и для обеспечения более непрерывной экспрессии плазмидной ДНК из вектора (Ehrhardt A. Et al. (2003) Hum Gene Ther 10: 215-35; Yet, N.S. (2002) Mol Ther 5: 31-38; Chen, Z.Y. et al. (2004) Gene Ther 11: 856-64). Кроме того, вектор может включать транспозон, такой как Спящая красавица (Izsvzk et al. J. Mol. Biol. 302:93-102 (2000)), или искусственную хромосому. Предпочтительно могут быть использованы векторы, такие как pACYC177, pACYC184, pCL1920, pECCG117, pUC19, pBR322 и pMW118 и более предпочтительно pCL-PCJ1, который является вектором pCL1920, с вставленным промотором CJ1 (KR20060068505).
В настоящем изобретении полинуклеотид может быть эффективно связан с рекомбинантным вектором. Термин «эффективно связанный» относится к эффективной связи регуляторной последовательности экспрессии нуклеотида с последовательностью нуклеотидов, кодирующей целевой белок, для осуществления его общей функции, таким образом влияя на экспрессию кодирующей последовательности нуклеотидов. Эффективное связывание с рекомбинантным вектором может быть осуществлено с использованием методики рекомбинантных генов, известной в области техники, и сайт-специфическое отщепление и связывание ДНК может быть произведено с использованием рестриктазы и лигазы, известных в области техники.
Кроме того, рекомбинантный вектор может дополнительно включать один или более генов устойчивости к антибиотикам, выбираемых из группы, состоящей из генов устойчивости к ампициллину, генов устойчивости к канамицину и генов хлорамфеникол ацетилтрансферазы.
Как используется в настоящем описании термин «ген устойчивости к антибиотикам» относится к гену, обладающему устойчивостью к антибиотикам, и клетки, включающие такие гены, выживают даже в окружении, обрабатываемом соответствующим антибиотиком. Следовательно, ген устойчивости к антибиотикам эффективно используется в качестве маркера селекции для масштабной продукции плазмид в E.coli. В настоящем изобретении, поскольку гены устойчивости к антибиотикам не являются фактором, который существенно влияет на эффективность экспрессии, которую получают оптимальной комбинацией компонентов вектора, которая является ключевой характеристикой настоящего изобретения, любой обычный ген устойчивости к антибиотикам без ограничения может быть использован в качестве маркера селекции. Специфически могут быть использованы гены устойчивости к ампицилину, тетрациклину, канамицину, хлорамфениколу, стрептомицину или неомицину и предпочтительно могут быть использованы гены устойчивости к спектиномицину.
В качестве другого аспекта настоящее изобретение обеспечивает микроорганизм, трансформированный рекомбинантным вектором для получения О-ацетилгомосерин-сульфгидрилазы.
Как используется в настоящем описании термин «трансформация» относится к введению генов в клетку хозяин для их экспрессии. Способ трансформации вектора по настоящему изобретению в клетки может включать любой способ для введения нуклеотидов в клетки, и он может быть проведен путем выбора соответствующей стандартной методики, известной в области техники. Могут быть использованы методы, такие как электропорирование, ко-преципитация фосфата кальция, ретровирусная инфекция, микроинъекция, DEAE-декстран и катионные липосомы, но ими не ограничиваются.
Трансформированный ген может быть вставлен в хромосому клетки-хозяина и расположен вне хромосомы, пока он может быть экспрессирован в клетке-хозяине. Кроме того, ген включает ДНК и РНК в качестве полинуклеотида, кодирующего полипептид, и любой ген, который может быть введен и экспрессирован в клетке-хозяине, может быть использован без ограничения. Например, ген может быть введен в клетку-хозяина в форме кассеты экспрессии, которая представляет собой полинуклеотидный конструкт, включающий все элементы, требуемые для самоэкспрессии. Экспрессионная кассета обычно включает промотор, эффективно связанный с геном, сигнал терминирования транскрипции, сайты связывания рибосом, и сигнал терминирования трансляции. Экспрессионная кассета может находиться в форме самореплицирующегося вектора экспрессии. Кроме того, геном может быть таковой, вводимый в клетку хозяина сам по себе или в форме полинуклеотидного конструкта, и эффективно связанный с последовательностями, требуемыми для экспрессии в клетке-хозяине.
Как используется в настоящем описании термин «микроорганизм, трансформированный рекомбинатным вектором», относится к клетке, трансфицированной вектором, включающим ген, кодирующий, по меньшей мере, один целевой белок. В настоящем изобретении, если микроорганизм включает белок дикого типа или мутантный белок, способный продуцировать О-ацетилгомосерин-сульфгидрилазу посредством трансформации рекомбинантным вектором, может быть использован любой прокариоитический и эукариотический микроорганизм. Например, могут быть использованы микробные штаммы, принадлежащие к Escherichia sp., Erwinia sp., Serratia sp., Providencia sp., Corynebacteria sp., Pseudomonas sp., Leptospira sp., Salmonellar sp., Brevibacteria sp., Hypomononas sp., Chromobacterium sp., и Norcardia sp. или грибы или дрожжи. Предпочтительно могут быть использованы микробные штаммы, принадлежащие к Escherichia sp., Corynebacteria sp., и Leptospira sp., и дрожжи и более предпочтительно микробные штаммы Escherichia sp., и наиболее предпочтительно E. coli.
В качестве другого аспекта настоящее изобретение обеспечивает способ для получения метионина или уксусной кислоты, включающий добавление белка дикого типа, мутантного белка или микроорганизма, продуцирующего таковой, к смеси О-ацетилгомосерина и метилмеркаптана для реакции полученной смеси.
О-ацетилгомосерин относится к очищенной форме О-ацетилгомосерина или ферментационному бульону, содержащему О-ацетилгомосерин. Также метилмеркаптан относится ко всем следующим формам, сжиженной форме метилмеркаптана натрия (CH3S-Na), и газообразной или сжиженной форме метилмеркаптана (CH3SH), а также метилмеркаптану, включающему диметилсульфоксид (DMS), который описан в патентной публикации WO2010/098629. В одном примере настоящего изобретения для реакции превращения L-метионина, 5-10% гомогената микроорганизмов (общего объема реакционной смеси), включающей полипептид, добавляли к ферментационному бульону О-ацетилгомосерина, и реакцию начинали путем добавления 15% Na-метилмеркаптана к смеси при рН 6-8. Затем через 2 часа ферментационный бульон собирали и из него удаляли клетки, которые затем анализировали ВЭЖХ для идентификации продукции метионина. Как показано на фиг. 2b, когда для получения метионина использовали мутантный белок по настоящему изобретению, ферментативная реакция превращения и активность были выше таковой в существующих продуцирующих штаммах. Также было минимизировано ингибирование реакции продуктом реакции, и термическая стабильность мутантного белка была превосходной, таким образом, предполагая, что мутантный белок по настоящему изобретению может быть эффективно использован для промышленных целей.
В качестве другого аспекта настоящее изобретение обеспечивает применение белка в качестве О-ацетилгомосерин-сульфгидрилазы.
Как описано выше, белок по настоящему изобретению может быть белком дикого типа, обладающим активностью О-ацетилгомосерин-сульфгидрилазы, полученным от Rhodobacter sphaeroides, и его мутантным белком, и предпочтительно он может быть белком, имеющим последовательность аминокислот SEQ ID NO: 13 и 15-18. Белок по настоящему изобретению имеет высокую субстратную специфичность в отношении О-ацетилгомосерина, таким образом обладая активностью О-ацетилгомосерин-сульфгидрилазы и ее повышенной активностью, и, следовательно, он может быть использован для получения метионина или уксусной кислоты.
Способ осуществления изобретения
В настоящем описании далее состав и эффект настоящего изобретения описаны более подробно посредством представленных ниже примеров. Однако, указанные примеры являются только иллюстративными для настоящего изобретения, но никак не ограничивают рамки настоящего изобретения.
Пример 1: Получение метионин-конвертазы
1-1. О-ацетилгомосерин-сульфгидрилаза от вида Hyphomonas
Праймеры создавали путем получения последовательности гена О-ацетилгомосерин-сульфгидрилазы от Hyphomonas neptunium, который конвертирует О-ацетилгомосерин в метионин, с интернет сайта KEGG (www.kegg.com). Хромосомы Hyphomonas neptunium покупали у АТСС (USA). ПЦР реакцию проводили с 30 циклами стадии денатурации при 94°С в течение 30 секунд, стадии обжига при 55°С в течение 30 секунд, и стадии удлинения при 72°С в течение 2 минут, с использованием хромосомы в качестве матрицы и праймеров SEQ ID NO: 1 и 2. Для реакции ПЦР использовали премикс набор HL PCR (Boineer, Korea).
ДНК фрагменты, полученные реакцией ПЦР, отщепляли Ncol/HindIII и клонировали в векторе pCL-PCJ1, расщепляемом теми же ферментами. Окончательно полученный вектор называли pCL- PCJ1-MetZhne и его схематическая диаграмма показана на фиг. 1. Клонированные векторы трансформировали в клетки Escherichia coli K12 и культивировали в планшете со средой LB с добавлением 50 мкг/л спектиномицина, и выбирали колонию. Выбранную колонию инокулировали в 3 мл LB среды, содержащей 50 мкг/л спектиномицина, и культивировали при 37°С, 200 об/мин в течение 16 часов. Культуру клеток повторно инокулировали в 25 мл новой жидкой среды LB (в 250 мл колбе) и культивировали до того как ОП 600 достигнет 0,5-0,6 (в течение 2-3 часов) в тех же условиях культивирования, и непосредственно после этого ее культивировали в 500 мл LB среды (в 1 л баке) с добавлением 4% глюкозы до исчерпывания глюкозы. 1 мл ферментационной культуральной среды собирали, надосадочную жидкость удаляли центрифугированием и осадок клеток промывали 0,1 М буфером фосфата калия (рН 7,5). Клетки ресуспендировали в 1 мл буфера фосфата калия и измельчали пять раз с 30 секундными интервалами с использованием ультразвука. Измельченный гомогенат клеток собирали, и общее количество белка оценивали количественно с использованием количественной оценки белка BIO-Rad (BIO-Rad, USA). Кроме того, экспрессию белка подтверждали SDS-PAGE. Впоследствии собранный гомогенат клеток использовали для ферментативной реакции превращения.
1-2. О-ацетилгомосерин-сульфгидрилаза от вида Rhodobacter
Ген metZ, кодирующий О-ацетилгомосерин-сульфгидрилазу от Rhodobacter sphaeroides, который конвертирует О-ацетилгомосерин в метионин, клонировали в настоящем эксперименте.
ПЦР реакцию проводили с 30 циклами стадии денатурации при 94°С в течение 30 секунд, стадии отжига при 55°С в течение 30 секунд и стадии удлинения при 72°С в течение 2 минут с использованием хромосомы Rhodobacter sphaeroides в качестве матрицы и праймеров SEQ ID NO: 3 и 4.
Фрагменты ДНК, полученные в реакции ПЦР, отщепляли Ncol/HindIII и клонировали в векторе pCL-PCJ1 (Korea, CJ), расщепляемом теми же ферментами. Гомогенат клеток получали с использованием клонированных векторов таким же образом, как описано в примере 1-1, и его использовали в реакции ферментативного превращения.
Пример 2: Сравнение уровня экспрессии конвертазы, субстратной специфичности и активности конвертазы
Уровень экспрессии и ферментативную активность сравнивали между О-ацетилгомосерин-сульфгидрилазой, полученной от вида Hyphomonas, и О-ацетилгомосерин-сульфгидрилазой, полученной от вида Rhodobacter c использованием каждого из гомогенатов клеток, полученных в методах примеров 1-1 и 1-2.
В общем, количество белка оценивали количественно с использованием количественного анализа белка от BIO-Rad, как упомянуто в примере 1-1, однако, при анализе смеси белка с белками E. Coli, такими как гомогенат фермента, трудно сравнить уровень экспрессии определенных ферментов с использованием метода количественной оценки белка. Следовательно, в указанном эксперименте SDS-PAGE использовали для сравнения уровня экспрессии конвертазы в гомогенате клеток, полученном в примерах 1-1 и 1-2. В результате сравнения О-ацетилгомосерин-сульфгидрилазы, полученной от вида Hyphomonas (Metz-hne) и О-ацетилгомосерин-сульфгидрилазы, полученной от вида Rhodobacter (MetZ-rsp) с использованием 10 мкл, 5 мкл и 2,5 мкл двух гомогенатов клеток наблюдали, что MetZ-rsp показала уровень экспрессии почти в 4 раза больший, чем Metz-hne (фиг. 3).
С целью определения субстратной специфичности двух ферментов, О-ацетилгомосерин растворяли в 0,1М буфере фосфата калия (рН 7,5) до конечной концентрации 3 мМ. Кроме того, пиридоксаль 5'-фосфат (Sigma, USA), который использовали как кофактор, добавляли к реакционной смеси до конечной концентрации 10 мкМ. Другой субстрат метилмеркаптан (Japan Tokyo Chemical Industry Ltd.) добавляли к реакционной смеси до конечной концентрации 2 мМ. 1 мл реакционной смеси помещали при 37°С и затем 10 мкл экстракта каждого фермента добавляли для получения конечной концентрации белка 5 мг/мл. Прогрессирование реакции подтверждали путем измерения поглощения при 415 нм путем получения 100 мкл реакционной смеси после начала реакции и добавления их к 900 мкл 4 мг/мл раствора DTNB (5,5-дитиобис(2-нитробензойная кислота), Sigma, USA).
DTNB реагирует с -SH группой метилмеркаптана, остающегося в реакционной смеси, и синтезируется желтое вещество. Следовательно, прогрессирование реакции можно отслеживать путем наблюдения за исчезновением желтой окраски в реакционной смеси, когда метилмеркаптан в реакционной смеси преобразуется в метионин. Также, если различие в поглощении DTNB до и после реакции (ΔОП415) является высоким, предполагают, что активность фермента является высокой.
В результате реакции реакционной смеси О-ацетилгомосерина и раствора фермента наблюдали, что и О-ацетилгомосерин-сульфгидрилаза, полученная от Hyphomonas neptunium, и О-ацетилгомосерин-сульфгидрилаза, полученная от Rhodobacter shaeroides, показали более высокую субстратную специфичность в отношении О-ацетилгомосерина, по сравнению с О-сукцинилгомосерином. Субстратная специфичность каждого фермента показана просто как количество «+» в таблице 1. В общем, было идентифицировано, что оба штамма имеют более высокую субстратную специфичность в отношении О-ацетилгомосерина, по сравнению с О-сукцинилгомосерином.
|
Пример 3: Сравнение реакций MetZ-hne и MetZ-rsp в ранней фазе в среде О-ацетилгомосерина в высокой концентрации
С целью сравнения скорости превращения ферментов MetZ-hne и MetZ-rsp в высокой концентрации О-ацетилгомосерина проводили эксперимент превращения метионина при концентрации О-ацетилгомосерина 80 г/л. Относительную скорость продукции метионина сравнивали между О-ацетилгомосерин-сульфгидрилазой, полученной от Hyphomonas neptunium, и О-ацетилгомосерин-сульфгидрилазой, полученной от Rhodobacter shaeroides, при ферментативном превращении 80 г/л О-ацетилгомосерина в масштабе 1 мл пробирки в течение времени. Скорости реакций О-ацетилгомосерин-сульфгидрилазы можно было сравнить путем измерения концентрации метионина, полученного в реакции. В частности, реакцию ферментативного превращения проводили при 33°С путем добавления 0,01 мл метилмеркаптана натрия (15%, масс/об), который является другим субстратом, требуемым для получения метионина, 0,01 мл О-ацетилгомосерин-сульфгидрилазы и 0,1 мМ кофактора фермента пиридоксаль 5'-фосфата к 1 мл 80 г/л О-ацетилгомосерина, и перемешивания при 800 об/мин. Каждый из экстрактов ферментов добавляли до окончательной концентрации белка 5 мг/мл. Концентрацию метионина и О-ацетилгомосерина анализировали ВЭЖХ. Скорость превращения метионина рассчитывали как количество молей метионина, образующихся из 1 моль метилмеркаптана, добавленного в реакционную смесь.
Как показано в таблице 2, О-ацетилгомосерин-сульфгидрилаза, полученная от Rhodobacter shaeroides, показала более высокую скорость реакции в течение ранней фазы и более высокую скорость превращения, чем О-ацетилгомосерин-сульфгидрилаза, полученная от Hyphomonas neptunium, даже при высокой концентрации О-ацетилгомосерина.
|
Пример 4: Сравнение степени ингибирования реакции продуктами реакции метионином и уксусной кислотой
В двухстадийном методе L-метионин и уксусную кислоту получают в ферментативной реакции. Однако, известно, что высокая концентрация L-метионина снижает скорость ферментативной реакции и уксусная кислота ингибирует ферментативную активность вследствие изменения белка.
Для ферментативного превращения О-ацетилгомосерина в L-метионин и уксусную кислоту для промышленных целей, фермент должен сохранять высокую активность даже при вышеуказанном ингибировании активности фермента. Сравнивали активности MetZ-hne и MetZ-rsp в присутствии L-метионина и уксусной кислоты в высокой концентрации. В частности, в присутствии 0,3 М L-метионина (около 45 г/л) и 0,3 М уксусной кислоты, активности сравнивали с использованием метода DTNB, описанного в примере 2. 25 мкл 5 мг/мл гомогената клеток использовали в указанной реакции. Результаты показывают, что остаточная активность MetZ-hne и MetZ-rsp была 42% и 50% соответственно, и, следовательно, было подтверждено, что MetZ-rsp имеет меньшую степень ингибирования активности фермента даже в присутствии L-метионина и уксусной кислоты в высокой концентрации (таблица 3.)
|
Кроме того анализировали реакции превращения двумя ферментами в присутствии 0,3 М L-метионина и 0,3 М уксусной кислоты и результаты показаны в таблице 4.
|
Пример 5: Сравнение термической стабильности ферментов MetZ-hne и MetZ-rsp
В процессе ферментативного превращения в промышленных масштабах реакция протекает в течение от около 1 до 6 часов при температуре от 33 до 37°С. В добавление к обратному ингибированию продуктами реакции фермент с низкой термической стабильностью обладает более низкой ферментативной активностью при прогрессировании реакции превращения. Следовательно, термическая стабильность фермента является важным фактором промышленной применимости и экономической эффективности. С целью сравнения термической стабильности ферментов каждый из гомогенатов клеток, полученных методами примеров 1-1 и 1-2, обрабатывали нагреванием при 50°С в течение 10, 30, 60, 120 и 240 минут, и затем сравнивали остаточную активность ферментов с использованием метода DTNB примера 2.
Как показано в таблице 5, О-ацетилгомосерин-сульфгидрилаза, полученная от Rhodobacter sphaeroides, показала остаточную активность 95% после 240 минутной обработки нагреванием при 45ºС по сравнению с ее активностью до обработки нагреванием. С другой стороны, MetZ-hne показала остаточную активность 75%, таким образом предполагая, что MetZ-rsp имеет лучшую термическую стабильность.
|
Пример 6: Ферментативное превращение среды О-ацетилгомосерина в L-метионин с использованием MetZ-rsp в периодическом реакторе
В настоящем примере для оценки активности конверсии О-ацетилгомосерин-сульфгидрилазы (metZ-rsp), определенной в лабораторном масштабе, теперь в системе реактора, использовали периодический реактор, имеющий оптимальный объем 1 л. О-ацетилгомосерин, который является субстратом, требуемым для реакции ферментативного превращения, получали путем ферментации микробного штамма, описанного в предшествующей области техники, и клетки удаляли из культивированного ферментированного бульона с использованием центрифуги. Использовали 500 мл около 70 г/л культуральной среды (WO2008/013432). Так как метилмеркаптан при комнатной температуре существует в газообразной форме, эксперимент проводили с использованием раствора метилмеркаптана натрия в жидкой форме (CH3-Na, 4,7 М, 33%, Arkema France), который создавали путем добавления метилмеркаптана к раствору каустической соды. Около 50 мл метилмеркаптана натрия использовали в реакции ферментативного превращения. В качестве раствора фермента 50 мл гомогената клеток MetZ-rsp, полученного методом примера 1, добавляли к реакционной смеси вместе с 0,1 мМ пиридоксаль 5'-фосфата (Sigma, USA). Реакцию ферментативного превращения проводили при рН 7,0 и при 33°С с перемешиванием при 700 об/мин. Реакцию проводили в течение 3 часов при добавлении метилмеркаптана натрия. Концентрации О-ацетилгомосерина и L-метионина, образующиеся с течением времени, анализировали ВЭЖХ и результаты показаны в таблице 6.
|
В общем наблюдали, что реакции ферментативного превращения среды О-ацетилгомосерина в L-метионин с использованием раствора фермента MetZ-rsp в 1 л периодическом реакторе была быстрой и показала высокую скорость превращения (97 моль% скорость конверсии).
Пример 7: Увеличение масштаба реакции ферментативного превращения среды О-ацетилгомосерина в L-метионин с использованием MetZ-rsp в периодическом реакторе
В настоящем примере для оценки увеличения масштаба реакции ферментативного превращения метионина в результате конвертирующей активности О-ацетилгомосерин-сульфгидрилазы (MetZ-rsp), идентифицированной в 1 л периодическом реакторе, реакцию превращения метионина проводили с использованием 30 л периодического реактора (Korea fermenter, Korea). О-ацетилгомосерин, который является субстратом, требуемым в реакции ферментативного превращения, получали, как в примере 6, путем ферментации микробных штаммов, описанных в предшествующей области техники (WO2008/013432), и микробный штамм выделяли из культивированной ферментированной среды с использованием центрифуги. Надосадочную жидкость разводили путем добавления воды для получения концентрации О-ацетилгомосерина 66 г/л и использовали в реакции.
После того как 23 л разведенной ферментированной надосадочной жидкости помещали в ферментер, туда же добавляли 500 мл гомогената фермента MetZ-rsp, полученного способом, описанным в примере 1, и затем кофактор пиридоксаль 5'-фосфат (Sigma, USA) добавляли до конечной концентрации 0,1 мМ. Впоследствии рН реакционной смеси доводили до 6,5 путем добавления газообразного аммония, и температуру и перемешивание устанавливали как 37°С и 300 об/мин, соответственно.
Использовали метилмеркаптан (CH3SH, 99,5%, UK, Intergas) в газообразной форме и его помещали непосредственно в реакционную смесь, контролируя количество добавленного газа с использованием контроллера массового потока. Так как некоторое количество метилмеркаптана испарялось в реакционной смеси и увеличивало давление внутри реактора, скорость введения метилмеркаптана регулировали для поддержания давления менее чем 0,5 бар. Около 220 л (470 г) метилмеркаптана добавляли к реакционной смеси в течение всего 120 минут, контролируя скорость введения от 3 до 5 л/мин в течение первых 30 минут быстрого периода реакции и затем от 1 до 2 л/мин в течение оставшихся 90 минут медленного периода реакции. Общее количество добавленного метилмеркаптана равнялось количеству О-ацетилгомосерина, присутствующему в реакционной смеси в течение реакции ферментативного превращения, которое все потребляется во время синтеза метионина. После завершения реакции остаточное количество метилмеркаптана составляло менее чем 0,1 г/л.
Так как во время реакции каждый раз 1 моль метионина давал 1 моль уксусной кислоты, понижая рН, рН реакционной смеси поддерживали на уровне 6,5 путем добавления газообразного аммония для повышения рН, при снижении до 6,48. Скорость реакции можно определить путем измерения наклона снижения рН и завершение реакции может быть определено при медленном снижении рН.
Реакцию проводили в течение 6 часов при добавлении метилмеркаптана к реакционной смеси. Изменения концентрации О-ацетилгомосерина и L-метионина с течением времени анализировали ВЭЖХ и результаты показаны на фиг. 5.
Профиль изменения рН во время реакции показан на фиг. 4 и график превращения метионина в реакции продемонстрирован на фиг. 5.
В общем было подтверждено, что даже когда газообразный метилмеркаптан используют в реакции ферментативного превращения среды О-ацетилгомосерина в L-метионин с использованием раствора фермента MetZ-rsp в 30 л периодическом реакторе, может быть достигнуто превращение метионина с 98% молярной скоростью превращения в течение 6 часов.
Пример 8: Улучшение ферментативной активности metZ-rsp посредством применения мутации
В настоящем примере проводили ПЦР с внесением ошибок для индукции случайного мутагенеза в MetZ-rsp дикого типа, и для указанного эксперимента использовали разнообразные ПЦР наборы случайного мутагенеза (CLONTECH, USA). С целью обнаружения оптимальных условий для установления целевой скорости мутаций, проводили ПЦР с внесением ошибок в двух следующих условиях при различных концентрациях MnSO4 и dGTP. pCL-PCJ1:metZ-rsp, клонированный в примере 1-2, использовали в качестве матрицы ДНК, куда необходимо вводить мутации.
|
Продукты ПЦР с внесением ошибок, проводимой в условиях таблицы 7, отщепляли Ncol/HindIII и клонировали в векторе pCL-PCJ1, который расщепляли теми же ферментами. Клонированную мутантную библиотеку трансформировали в клетки Escherichia coli K12, которые затем культивировали в планшете со средой LB, содержащей 50 мкг/л спектиномицина. После культивирования выбирали 50 колоний и затем проводили секвенирующий анализ для определения степени мутаций и проверки возникновения мутаций в различных положениях. Результаты секвенирующего анализа продемонстрировали, что частота мутаций была 2,4 нп-1 в условиях 1 и 2,9 нп-1 в условиях 2. На основании полученных результатов было определено, что и условия 1 и условия 2 могут давать подходящую частоту мутаций для получения мутантной библиотеки, и таким образом был проведен скрининг значимых мутаций с использованием библиотек, полученных в вышеуказанных условиях.
Полученные клетки культивировали в первом планшете с 96 глубокими лунками и обрабатывали раствором BugBuster в соотношении 1:1 (MERCK, USA) для получения гомогената клеток. Затем 50 мкл гомогената клеток собирали и смешивали с 50 мкл реакционной смеси, включающей 300 мМ О-ацетилгомосерина и 1 мМ субстрата L-цистеина. Полученная реакционная смесь реагировала в течение 60 минут при комнатной температуре при добавлении 50 мкл раствора DTNB в обозначенные моменты времени. Значения ОП измеряли при 415 нм после образования цвета и результаты показаны в таблице 8.
|
В графике уровня окраски DTNB с течением времени значения ОП остаточного L-цистеина были 1,19 и 0,65 через 5 минут и 10 минут после реакции, соответственно. В настоящем скрининге выбирали мутанты с уровнем окраски DTNB остаточного цистеина менее чем 1,0 после 5 минут ферментативной реакции.
Мутанты кандидаты, которые показали существенно повышенную активность, выбирали с использованием вышеуказанного метода скрининга. Впоследствии проводили выравнивание последовательности нуклеотидов для поиска значимых мутаций в мутантах кандидатах. Затем, наконец, выбирали мутанты, включающие 4 вида мутаций, такие как I3N (SEQ ID NO: 15), F65Y (SEQ ID NO: 16), V104A (SEQ ID NO:17) и E182G. Наконец выбранные мутации вводили в качестве мутаций кандидатов, и путем введения каждого типа мутаций кандидатов отдельно в стандартный вектор pCL-PCJ1:metZ-rsp, подтверждали повышенную активность. Для получения векторов, в которые введен каждый тип мутаций кандидатов, вектор экспрессии metZ-rsp c каждой введенной мутацией кандидатом получали с использованием праймеров SEQ ID NO: 5 и 6 для мутации I3N, праймеров SEQ ID NO: 7 и 8 для F65Y мутации, праймеров SEQ ID NO: 9 и 10 для мутации 104А и праймеров SEQ ID NO: 11 и 12 для мутации E182G. Успешное введение мутации подтверждали секвенирующим анализом (Macrogen, Korea). Полученный мутантный вектор трансформировали в E.coli K12 и культивировали в колбе со средой LB при 33°С и 200 об/мин в течение 15 часов. Затем культивируемые образцы анализировали для подтверждения каждой мутации кандидата. Результаты показаны в таблице 9.
|
Оценка колбы после внесения каждой мутации кандидата продемонстрировала, что I3N (SEQ ID NO: 15), F65Y (SEQ ID NO: 16) и V104A (SEQ ID NO: 17) являются значимыми мутациями, проявляющими повышенную активность по сравнению с контрольной группой metZ-rsp. С другой стороны мутацию E182G определили как не имеющую повышенной активности и, следовательно, она была исключена из последующего эксперимента.
Все три типа значимых мутаций, включая I3N, F65Y и V104A, подтвержденные как имеющие повышенную активность, вводили в вектор pCL-PCJ1:metZ-rsp (называемый как pCL-PCJ1:metZ-rspM3) для получения вектора с еще более высокой активностью. Три типа мутаций вводили одну за одной в вектор с использованием вышеперечисленных праймеров. Полученный вектор экспрессии с тремя типами мутаций трансформировали в E.coli K12 и культивировали в колбе. Затем культуру клеток анализировали для оценки активности вектора экспрессии и результаты показаны в таблице 10.
|
Как показано в таблице 10, было подтверждено, что pCL-PCJ1:metZ-rspM3 с внесенными тремя типами значимых мутаций имел в 1,75 раз большую активность, чем pCL-PCJ1: metZ-rsp.