Результат интеллектуальной деятельности: 1,1'-(Гексан-1,6-диил)бис(3-(((1R,4aS,10aR)-7-изопропил-1,4а-диметил-1,2,3,4,4а,9,10,10а-октагидрофенантрен-1-ил)метил)мочевина, проявляющая ингибирующее действие в отношении фермента тирозил-ДНК-фосфодиэстеразы 1 человека и увеличивающая активность темозоломида в отношении клеток глиобластомы
Вид РИД
Изобретение
Изобретение относится к молекулярной биологии, биохимии, медицине и фармакологии, конкретно к соединению, являющемуся производным дегидроабиетиламина формулы I, у которого выявлена способность ингибировать фермент тирозил-ДНК-фосфодиэстеразу 1 человека (Tdp1) и способность усиливать действие алкилирующего химиопрепарата темозоломида на перевиваемых клеточных линиях глиобластомы U-87MG и SNB-19.
Традиционная химиотерапия онкологических заболеваний направлена на повреждение ДНК злокачественных клеток, и ее результат часто зависит от эффективности систем репарации ДНК. Во многих раковых клетках нарушен уровень экспрессии отдельных ферментов и факторов репарации ДНК, что в сочетании с ускоренной клеточной пролиферацией может приводить к резистентности таких опухолей к лекарственным препаратам. Развитие молекулярной биологии позволило принципиально изменить подходы к созданию новых противоопухолевых препаратов. Важным стратегическим направлением лечения онкологических заболеваний является избирательное подавление активности ряда ферментов, вовлеченных в регуляцию жизнедеятельности клеток. В последнее время проводятся интенсивные исследования ингибиторов репарации ДНК как потенциальных лекарств [Hosoya N., Miyagawa K., Targeting DNA damage response in cancer therapy. // Cancer Sci. 2014, 105, 370-388]. При ограничении способности раковой клетки к восстановлению поврежденной ДНК, существенно возрастает эффективность традиционных методов лечения. Поиск ингибиторов ключевых ферментов репарации ДНК относится к перспективным направлениям медицинской химии и является одним из путей создания эффективной терапии сердечно-сосудистых, нейродегенеративных и онкологических заболеваний [Laev S.S., Salakhutdinov N.F., Lavrik О.I., Tyrosyl-DNA phosphodiesterase inhibitors: Progress and potential // Bioorg. Med. Chem. 2016, 24, 5017-5027].
Имеющим особую значимость примером заболеваний, для которых поиск новых терапевтических подходов является необходимым, может служить злокачественная глиома - наиболее распространенная среди взрослого населения первичная опухоль центральной нервной системы (ЦНС). Современный стандарт терапии для пациентов с недавно диагностированной мультиформной глиобластомой (ГБМ, глиома IV степени) включает хирургическую резекцию опухоли, лучевую терапию и адъювантную химиотерапию темозоломидом (ТМЗ). Однако, несмотря на мультимодальный подход к терапии данного заболевания, медиана выживаемости с момента постановки диагноза составляет около 12-15 месяцев. Важно отметить, что медиана выживаемости при использовании полного комплекса терапевтических мер составляет 14,6 месяцев по сравнению с 12,2 месяцами для пациентов, при лечении которых химиотерапия не применялась.
С учетом низкой эффективности терапии, в настоящее время активно изучаются стратегии, направленные на преодоление резистентности и усиления ответа на ТМЗ. Резистентность к химиотерапии может быть обусловлена различными факторами, например, способностью опухолевых клеток к активному выведению химиотерапевтических препаратов, экспрессией антиапоптотических белков, а также изменением активности систем репарации ДНК. Известно, что эффективность ТМЗ (алкилирующего агента, который осуществляет перенос метальной группы на пуриновые основания ДНК (O6-гуанин, N7-гуанин и N3-аденин)), зависит от работы системы репарации ДНК. Так, 06-метилгуанин (О6-MeG), может удаляться метилгуанин метилтрансферазой (MGMT, прямая репарация). Кроме того, в опухолях с дефектом в системе репарации неправильно спаренных оснований (MMR-) О6-MeG может не оказать повреждающего действия [Zhang, J., Stevens, M.F.G., Bradshaw, T.D. Temozolomide: mechanisms of action, repair and resistance. // Curr. Molecular Pharm. 2012, 5, 102-114]
В связи с этим, ключевые ферменты систем репарации являются важнейшими мишенями для создания химиотерапевтических препаратов. К числу перспективных мишеней относится фермент тирозил-ДНК-фосфодиэстераза1 (Tdp1). Этот фермент является важной мишенью в случае противоопухолевой терапии, основанной на применении ингибиторов топоизомеразы 1 (Top1) [Negrini S., Gorgoulis V.G., Halazonetis T.D., Genomic instability-an evolving hallmark of cancer. // Nat. Rev. Mol. Cell. Biol. 2010, 11, 220-228]. Tdp1 играет ключевую роль в удалении аддуктов Top1-ДНК, стабилизированных ингибиторами Top1, такими как камптотецин и его клинические производные. Мутация в гене Tdp1 делает клетки гиперчувствительными к камптотецину - каноническому ингибитору Top1 [El-Khamisy S.F., Masutani М., Suzuki Н., Caldecott K.W., A requirement for PARP-1 for the assembly or stability of XRCC1 nuclear foci at sites of oxidative DNA damage. // Nucleic Acids Res., 2003, 31, 5526-5533]. Мыши, нокаутные по Tdp1, гиперчувствительны к камптотецину и его производным. При подавлении экспрессии Tdp1 с помощью миноциклина усиливается антиметастатический эффект иринотекана - ингибитора Tdp1 и увеличивается продолжительность жизни экспериментальных животных [Huang Н. -С., Liu J., Baglo Y., Rizvi I., Anbil S., Pigula M., Hasan Т., Mechanism-informed Repurposing of Minocycline Overcomes Resistance to Topoisomerase Inhibition for Peritoneal Carcinomatosis. // Mol. Cancer Ther., 2018, 17, 508-520]. И, наоборот, гиперэкспрессия Tdp1 приводит к защите клеток от повреждений ДНК, вызванных камптотецином [Nivens М.С., Pouliot J.J., Felder Т., Pena М.М.О., Spencer Н.Т., Galloway, А.Н., Engineered resistance to camptothecin and antifolates by retroviral coexpression of tyrosyl DNA phosphodiesterase-I and thymidylate synthase. // Cancer Chemother. Pharmacol., 2004, 53, 107-115; Alagoz M., Gilbert D.C., El-Khamisy S., Chalmers A.J., DNA Repair and Resistance to Topoisomerase I Inhibitors: Mechanisms, Biomarkers and Therapeutic Targets. // Curr. Med. Chem., 2012, 19, 3874-3885]. Более того, в опухолях кишечника с гиперэкспрессией Tdp1 снижен ответ на терапию иринотеканом [Meisenberg С, Gilbert D.C., Chalmers A., Haley V., Gollins S., Ward S.E., El-Khamisy, S.F., Clinical and Cellular Roles for TDP1 and TOP1 in Modulating Colorectal Cancer Response to Irinotecan. // Mol. Cancer Ther. 2015, 14, 575-585]. Следовательно, подавление активности Tdp1 может значительно усилить терапевтический эффект ингибиторов Top1.
Помимо способности удалять ковалентные аддукты Top1 и ДНК, Tdp1 может гидролизовать в ДНК АР-сайты и индуцировать их репарацию [Речкунова Н.И., Лебедева Н.А., Лаврик О.И.. Тирозил-ДНК-фосфодиэстераза 1 - новый участник репарации апуриновых/апиримидиновых сайтов в ДНК. // Биоорг. химия 2015, 41 (5), 531-538]. Эта активность особенно актуальна для репарации повреждений ДНК, инициированных монофункциональными алкилирующими агентами, включая метилметансульфонат и темозоломид, а также ионизирующим излучением. Таким образом, подавление активности Tdp1, может повышать чувствительность опухолевых клеток к препаратам, входящим в стандарт терапии онкологических заболеваний, в том числе глиобластомы [Pommier Y., Huang S.N., Gao R., Das B.B., Murai J., Marchand, C., Tyrosyl-DNA-phosphodiesterases (TDP1 and TDP2). // DNA Repair 2014, 19, 114-29].
В литературе имеются данные о некоторых ингибиторах Tdp1, эффективных при различных концентрациях в диапазоне значений IC50 0.15-100 мкМ. Известны ингибиторы производные гликозидов: неомицина, нетилмицина, спектиномицина [Liao Z., Thibaut L., Jobson A., Pommier Y., Inhibition of Human Tyrosyl-DNA Phosphodiesterase by Aminoglycoside Antibiotics and Ribosome Inhibitors // Mol. Pharmacol. 2006, 70, 366-372]. Однако для ингибирования необходимы достаточно высокие концентрации, кроме того, селективность ингибирования данного фермента очень низкая. В том же диапазоне концентраций ингибируют тирозил-ДНК-фосфодиэстеразу 1 диамидины [Huang S.N., Pommier Y., Marchand С., Tyrosyl-DNA Phosphodiesterase 1 (Tdp1) inhibitors // Expert Opin. Ther. Pat. 2011, 9, 1285-1292]. Активно изучается способность ингибировать Tdp1 производных инденоизохинолина [Elsayed M.S.A., Su Y., Wang P., Sethi Т., Agama K., Ravji A., Redon C.E., Kiselev E., Horzmann K.A., Freeman J.L., Yves Pommier Y., Cushman M., Design and Synthesis of Chlorinated and Fluorinated 7 Azaindenoisoquinolines as Potent Cytotoxic Anticancer Agents That Inhibit Topoisomerase I // J. Med. Chem. 2017, 60, 5364-5376]. Исследована ингибирующая активность в отношении Tdp1 производных 2-циано-3-фенилпроп-2-ентиоамида. Соединения ингибируют фермент со значениями IC50=0.9-100 мкМ [Sirivolu V.R., Vernekar S.K., Marchand С., Naumova A., Chergui A., Renaud А., Stephen A.G., Chen F., Sham Y.Y., Pommier Y., Wang Z., 5-Arylidenethioxothiazolidinones as inhibitors of tyrosyl-DNA phosphodiesterase I // J. Med. Chem. 2012, 55, 8671-8684]. Были обнаружены такие новые классы ингибиторов как аналоги бензопентатиепина [Zakharenko A., Khomenko Т., Zhukova S., Koval О., Zakharova О., Anarbaev R., Lebedeva N., Korchagina D., Komarova N., Vasiliev V., Reynisson J., Volcho K., Salakhutdinov N., Lavrik O. // Bioorg. Med. Chem. 2015, 23, 2044-2052], производные кумаринов [Khomenko Т., Zakharenko A., Odarchenko Т., Arabshahi H.J., Sannikova V., Zakharova O., Korchagina D., Reynisson J., Volcho K., Salakhutdinov N., Lavrik O. // Bioorg. Med. Chem. 2016, 24, 5573-5581] и производные усниновой кислоты [Zakharenko A., Luzina О., Koval О., Nilov D., Gushchina I., Dyrkheeva N., Svedas V., Salakhutdinov N., Lavrik O. // J. Nat. Prod. 2016, 79, 2961-2967].
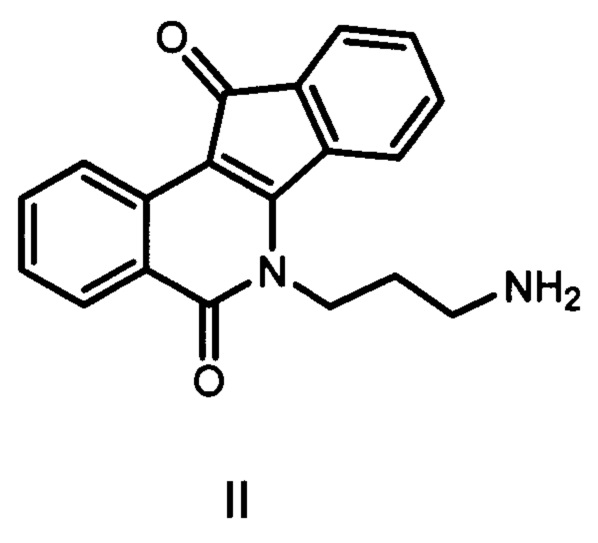
Наиболее близким к заявляемым соединениям - прототипом, является инденоизохинолины, представляющие собой полициклическую структуру формулы II [Nguyen TX, Morrell A, Conda-Sheridan M, Marchand C, Agama K, Bermingham A, Stephen AG, Chergui A, Naumova A, Fisher R, O'Keefe BR, Pommier Y, Cushman M. // J Med Chem. 2012, 23, 55, 7297].
Недостатками известного соединения являются невысокая активность в отношении очищенного фермента Tdp1 (IC50 29.5 мкмоль) и значительная цитотоксичность.
Задачей изобретения является выявление нового эффективного ингибитора фермента Tdp1, обладающего высокой активностью и низкой токсичностью и проявляющего синергетический эффект с темозоломидом в отношении клеток глиобластомы.
Технический результат: повышение эффективности ингибирования фермента Tdp1, расширение ассортимента ингибиторов фермента Tdp1 и усиление цитотоксического действия алкилирующего химиопрепарата темозоломида на культуры клеток глиобластомы человека.
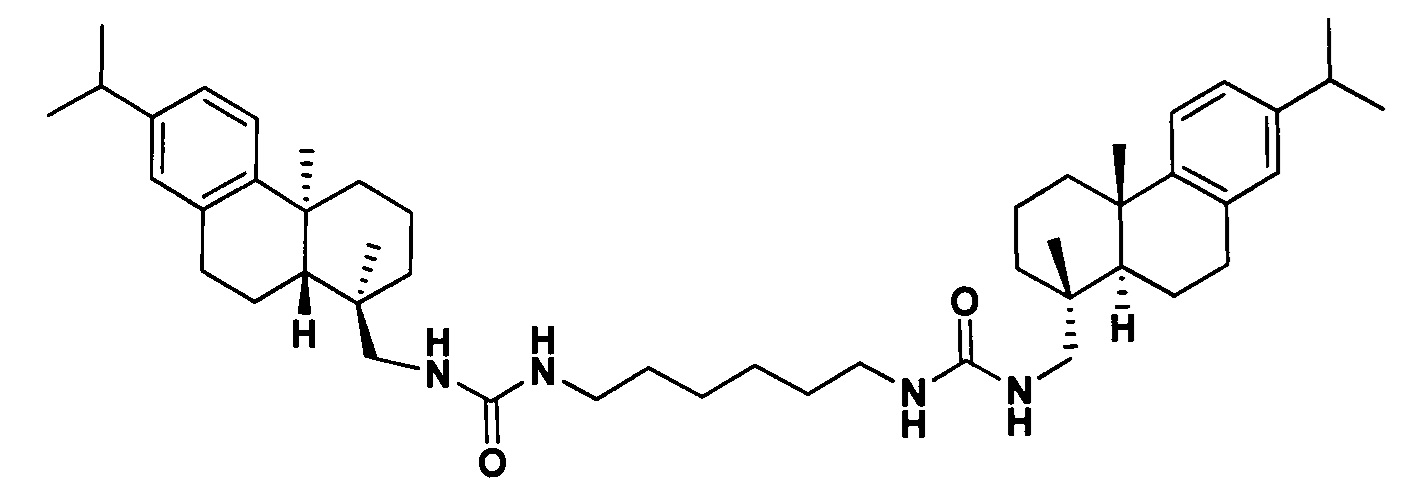
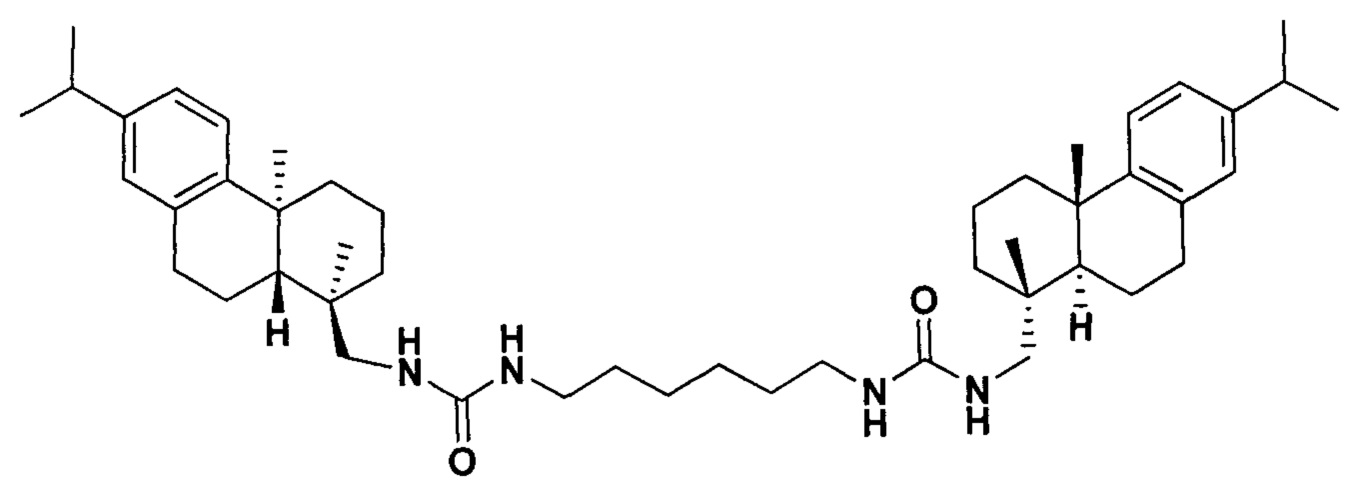
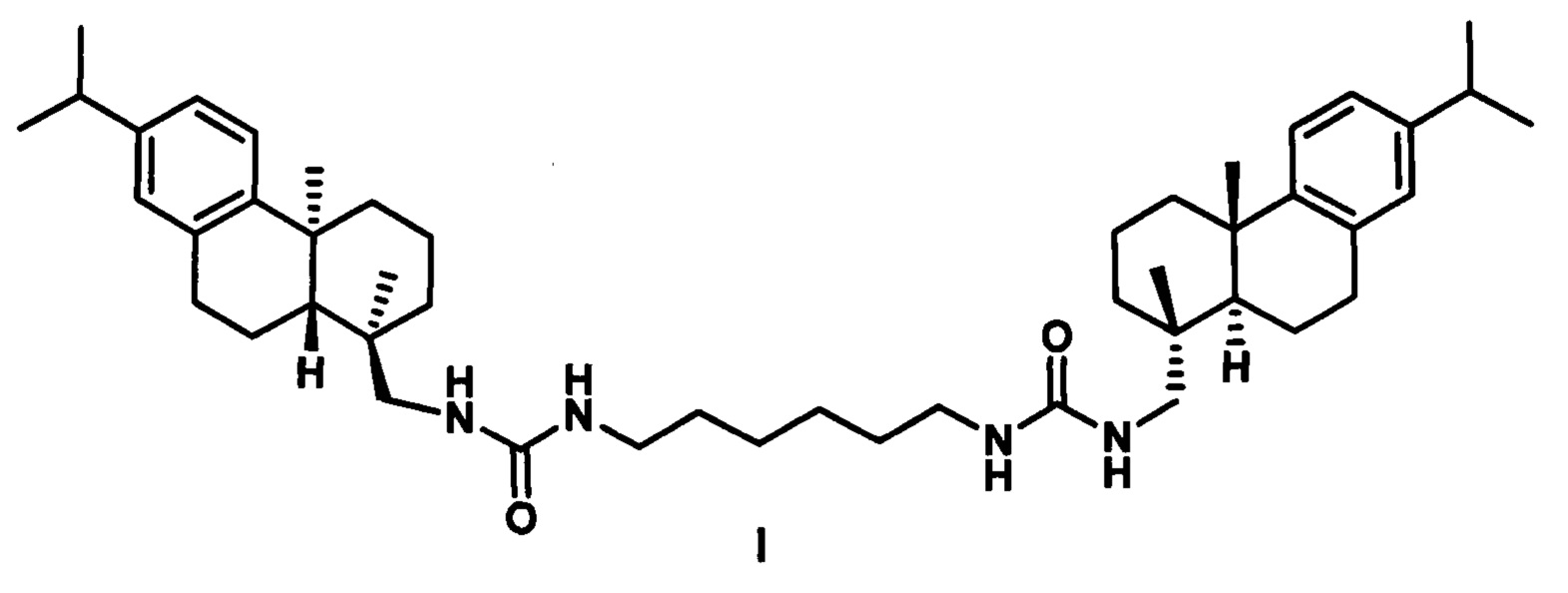
Поставленная задача решается применением производного дегидроабиетиламина формулы I:
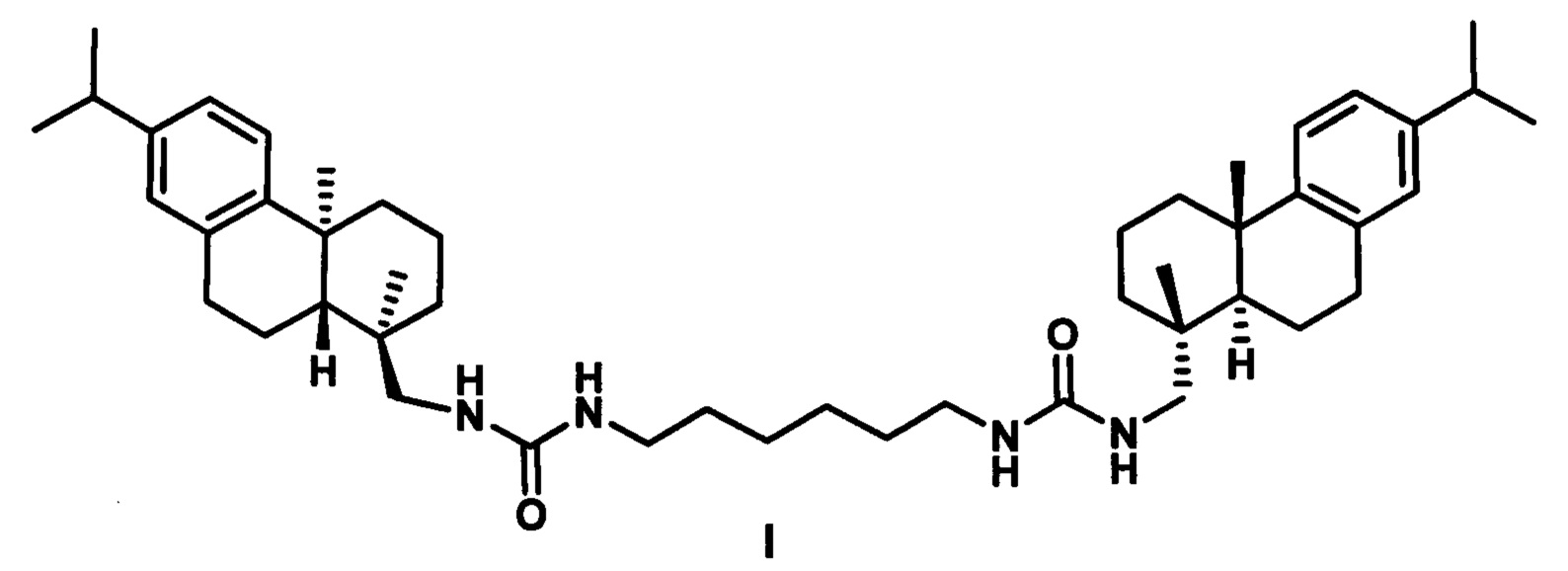
у которого выявлена высокая ингибирующая активность в отношении фермента репарации Tdp1 (IC50 0.19 мкмоль), низкая токсичность в отношении ряда опухолевых клеток и усиление эффективности действия темозоломида в отношении перевиваемых клеточных линий глиобластомы.
Нами был синтезирован ряд производных природного сексвитерпеноида дегидроабиетиламина, содержащих в остове структурные блоки мочевины и тиомочевины, и различные заместители. В том числе были получены соединения с двумя фрагментами дегидроабиетиламина и двумя уреидными группировками, соединенные различными линкерами. [Kovaleva K., Oleshko О., Mamontova Е., Yarovaya О., Zakharova О., Zakharenko A., Kononova A., Dyrkheeva N., Cheresiz S., Pokrovsky A., Lavrik O., Salakhutdinov N. Dehydroabietylamine Ureas and Thioureas as Tyrosyl-DNA Phosphodiesterase 1 Inhibitors That Enhance the Antitumor Effect of Temozolomide on Glioblastoma Cells // J Nat Prod. 2019, 82, 9, 2443-2450]
Преимущество поиска новых ингибиторов среди природных соединений и их производных заключается как в значительной вариативности структур исходных молекул, так и в присущей многим природным соединениям комплементарности к биологическим мишеням [Bermingham A., Price Е., Marchand С., Chergui A., Naumova A., Whitson Е. L., Krumpe L. R. Н., Goncharova Е. I., Evans J. R., McKee Т.С., Henrich C.J., Pommier Y., Identification of Natural Products That Inhibit the Catalytic Function of Human Tyrosyl-DNA Phosphodiesterase (TDP1) // SLAS disc. 2017, 22, 9, 1093-1105]. Кроме того, важным фактором является коммерческая доступность смоляных кислот. Исходным соединением является дегидроабиетиламин - дитерпеновый первичный амин, получаемый в промышленности из дегидроабиетиновой кислоты, содержащейся в живице хвойных деревьев. Важно отметить, что дегидроабиетиламин можно получать непосредственно из доступной живичной канифоли восстановлением нитрила дегидроабиетиновой кислоты.
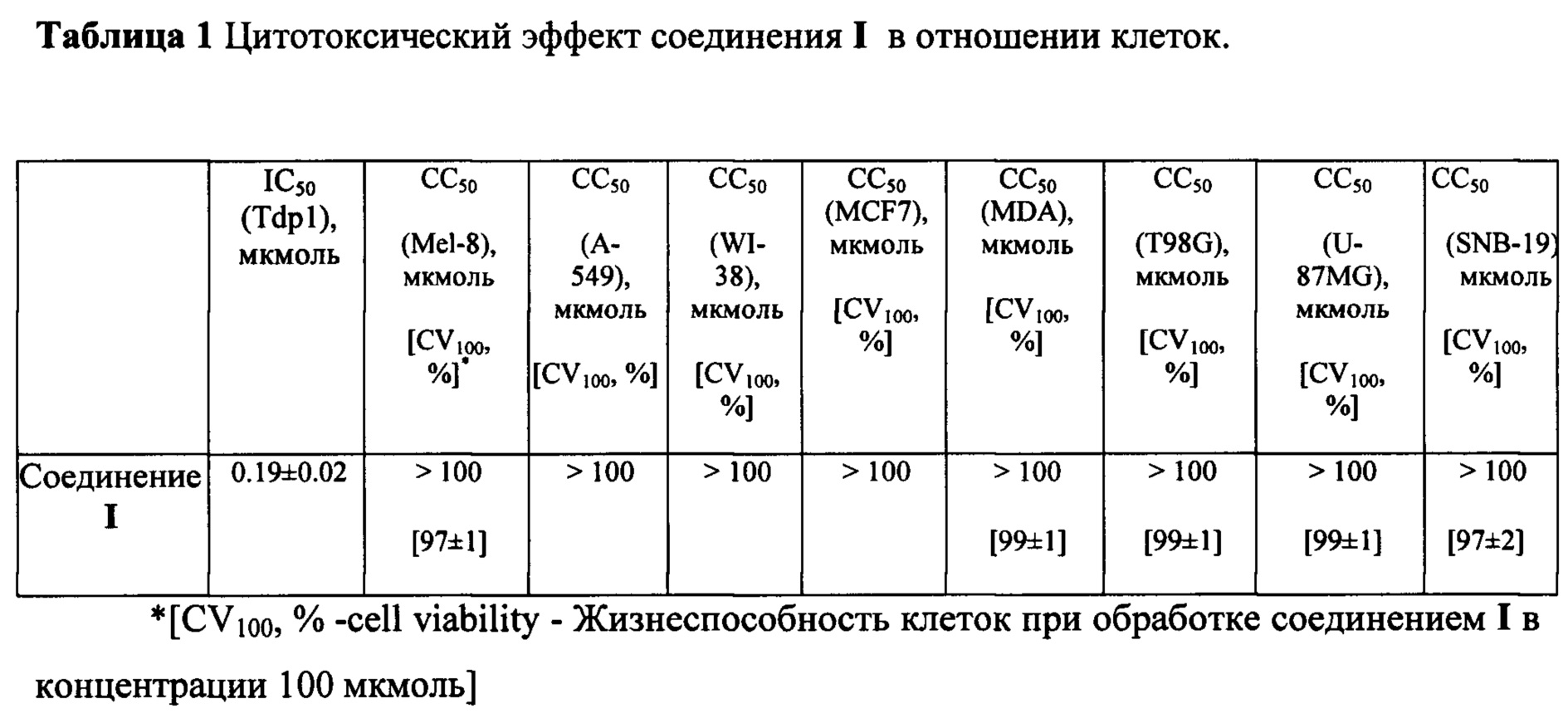
Поскольку ингибиторы ферментов репарации ДНК предполагается использовать в "коктейлях" с известными противоопухолевыми препаратами, обладающими высокой токсичностью, важно, чтобы применение новых соединений в лекарственных формах не приводило бы к дополнительной токсической нагрузке на организм. В связи с этим был выполнен анализ цитотоксичности предлагаемого соединения на широком спектре перевиваемых клеточных линий. Использовали культуры клеток человека, имеющие как опухолевое, так и не опухолевое происхождение. К числу первых относятся такие перевиваемые клеточные линии, как культуры клеток аденокарциномы молочной железы человека (MCF-7, MDA-MB-231), меланомы (Mel-8), линия карциномы легких (А-549) и глиобластома человека (U-87MG, SNB-19, T98G). Неопухолевые клеточные культуры были представлены линией клеток фибробластов легких человека WI-38.
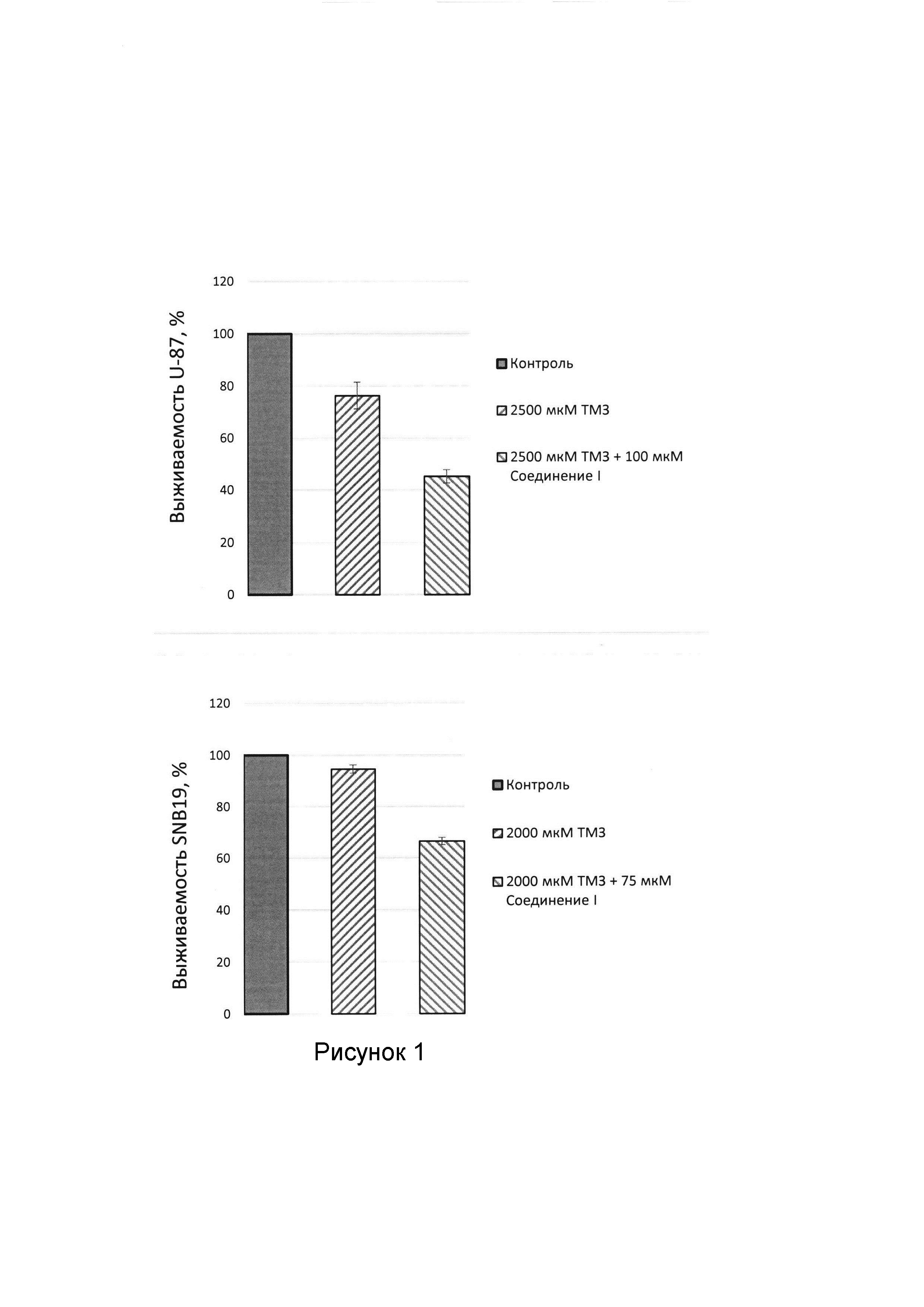
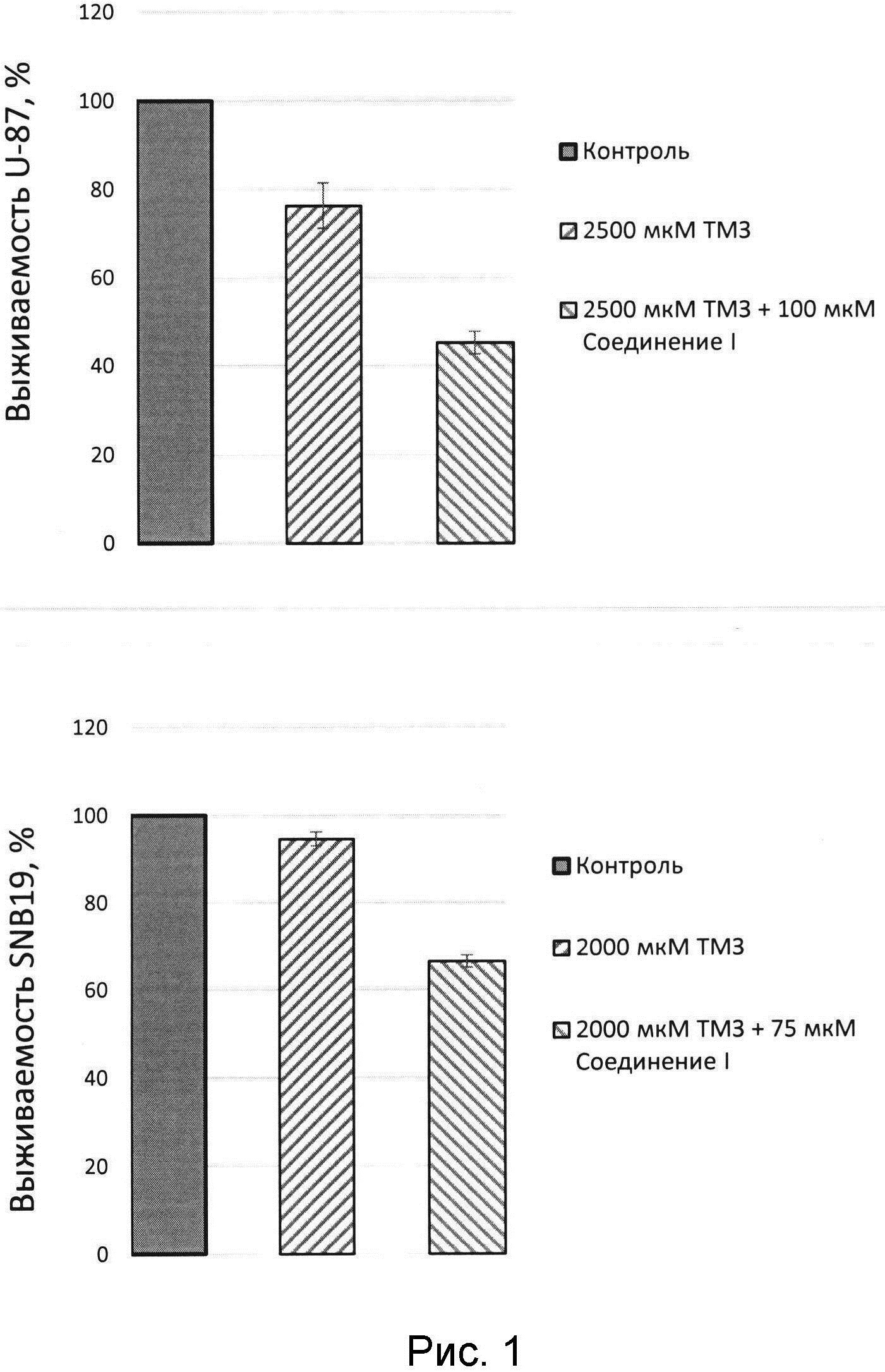
На втором этапе, также с помощью стандартного МТТ-теста, цитотоксическая активность темозоломида (ТМЗ) и его комбинации с предлагаемым соединением оценивалась на клеточных линиях глиобластомы человека U-87MG и SNB-19. На линии U-87MG цитотоксичность ТМЗ оценивали при концентрации 2500 мкмоль, а на SNB-19 при концентрациях 2000 мкмоль. Ингибитор Tdp1 использовали в концентрации 100 мкмоль для клеточной линии U-87MG, для экспериментов с SNB-19 концентрации ингибитора Tdp1 75 мкмоль. В результате было показано, что комбинация ТМЗ с соединением I в указанных концентрациях приводила к снижению жизнеспособности клеточной линии U-87MG до 40% по сравнению с монотерапией ТМЗ, а линии SNB-19 - до 30%. Таким образом, можно говорить о потенцировании ТМЗ предлагаемым соединением I (рисунок).
Изобретение иллюстрируется следующими примерами:
Пример 1. Методика синтеза соединения I.
В круглодонной колбе 50 мл в хлороформе смешали 0,5 г (0.00175 моль) дегидроабиетиламина с 0,147 г (0.000875 моль) гексаметилендиизоцианата. Кипятили с обратным холодильником в течение 3 часов. Контроль реакции проводили методом тонкослойной хроматографии, по окончании реакции охладили до комнатной температуры. Реакционную смесь промыли дважды водой (2×15 мл). Органический слой сушили над прокаленным Na2SO4, после чего упарили на ротационном испарителе. Очищали методом колоночной хроматографии на 10 г силикагеля, элюент хлороформ/метанол. Вещество выделено в виде желтовато-белого порошка с выходом 90% (0,58 г). Спектральные исследования выполнены в Химическом Сервисном Центре коллективного пользования СО РАН. Спектры ЯМР 1Н и 13С регистрировали на спектрометрах Bruker DRX-500 (1Н: 500.13 МГц, 13С: 125.76 МГц). В качестве внутреннего стандарта использовали остаточные сигналы растворителя - хлороформа (1H 7.24, 13С 76.90 м.д.). Отнесение сигналов в спектрах ЯМР проводилось с привлечение стандартных одномерных и двумерных экспериментов (COSY, HETCOR, COLOC, НМВС, HSQC). Нумерация атомов в соединениях дана для отнесения сигналов в спектрах ЯМР и не совпадает с нумерацией атомов в номенклатурном названии. Масс-спектры высокого разрешения записывали на спектрометре DFS ThermoScientific в режиме полного сканирования в диапазоне m/z 0-500, ионизация электронным ударом 70 эВ при прямом вводе образца. Разделение продуктов реакций проводили с помощью колоночной хроматографии на силикагеле (60-200 μ, Masherey-Nagel).
1,1'-(Гексан-1,6-диил)бис(3-(((1R,4aS,10aR)-7-изопропил-1,4а-диметил-1,2,3,4,4а,9,10,10а-октагидрофенантрен-1-ил)метил)мочевина
ЯМР 1Н (500 МГц, CDCl3, δ, м.д., J/Гц): 6.84 (2Н, с, Н-14, Н-14'), 6.95 (2Н, д, J11, 12=8.2, Н-12, Н-12'), 7.13 (2Н, д, J11, 12=8.2 Н-11, Н-11'), 0.85 (6Н, с, Ме-19, Ме-19'), 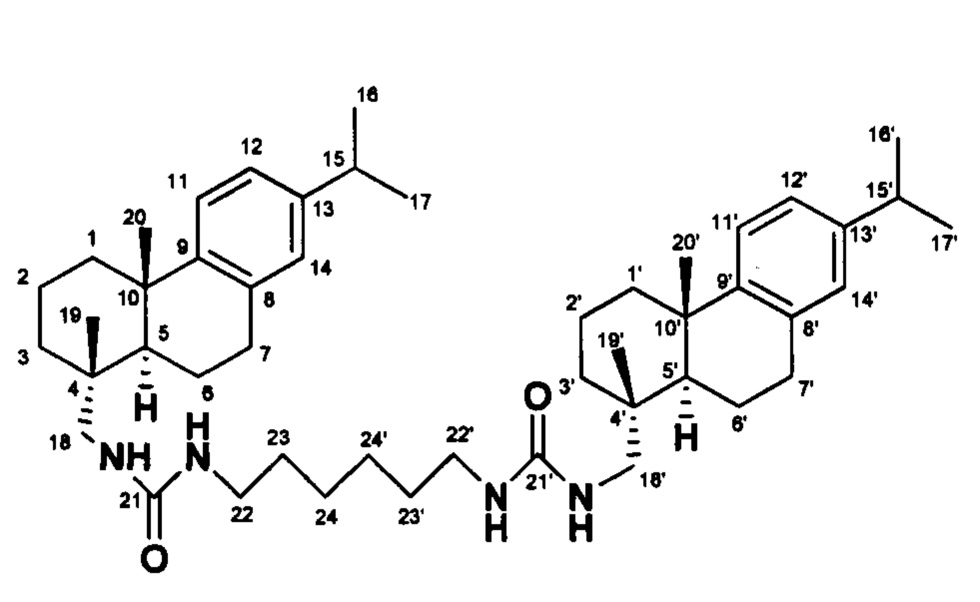
1.19 (12Н, д, J16, 15=6.9, Ме-16, Ме-17, Ме-16', Ме-17'), 1.17 (6Н, с, Ме-20, Ме-20'), 2.79 (2Н, септ, J15, 16=6.9, Н-15, Н-15'), 2.23 (2Н, д, 2J=12.4, H-1e, 1e'), 1.45 (2Н, д, 2J=12.4, Н-1а, Н-1а'), 2.98-3.12 (4Н, м, Н-22, Н-22'), 2.79-2.84 (4Н, м, Н-7, Н-7'), 2.89-2.99 (4Н, м, Н-18, Н-18'), 1.78-1.87 (4Н, м, Н-23, Н-23'), 1.26-1.39 (4Н, м, Н-24, Н-24'), 1.45-1.53 (6Н, м, Н-3, Н-5a, Н-3', Н-5а'), 1.65-1.74 (8Н, м, Н-2, Н-6, Н-2', Н-6'). ЯМР 13С (125 МГц, CDCl3, δ, м.д 159.26 (С-21, С-21'), 147.25 (С-9, С-9'), 145.31 (С-13, С-13'), 134.85 (С-8, С-8'), 126.71 (С-14, С-14'), 124.07 (С-11, С-11'), 123.58 (С-12, С-12'), 50.55 (С-18, С-18'), 18.49 (Ме-19, Ме-19'), 23.91 (Ме-17, Ме-17', Ме-16, Ме-16'), 25.23 (Ме-20, Ме-20'), 33.31 (С-15, С-15'), 44.82 (С-5, С-5'), 18.62 (С-2, С-2'), 18.81 (С-6, С-6'), 30.11 (С-7, С-7'), 25.66 (С-24, С-24') 29.73 (С-23, С-23'), 39.94 (С-4, С-4'), 38.28 (С-1, С-1'), 37.37 (С-10, С-10'), 35.94 (С-3, С-3'), 37.27 (С-22, С-22'). MS m/z 738.5789 [М]+ (calcd for C48H74O2N4, 738.5806).
Пример 2. Исследование влияния соединения I на активность Tdp1.
Рекомбинантная тирозил-ДНК-фосфодиэстераза 1 человека (КФ 3.1.4.) экспрессированная в системе Escherichia coli (плазмида рЕТ 16B-Tdp1 предоставлена доктором Кальдекотт К.У., Университет Сассекса, Великобритания) и выделена как описано [Interthal Н., Pouliot J.J., Champoux J.J., The tyrosyl-DNA phosphodiesterase Tdp1 is a member of the phospholipase D superfamily. // Proc. Natl. Acad. Sci. U.S.A. 2001, 98, 12009-12014; Lebedeva N.A., Rechkunova N.I., Lavrik O.I., AP-site cleavage activity of tyrosyl-DNA phosphodiesterase 1. // FEBS Lett., 2011, 585, 683-686.].
В качестве тест-системы для определения ингибирующих свойств исследуемых соединений использована реакция удаления тушителя флуоресценции Black Hole Quencher 1 (BHQ1) с 3'-конца олигонуклеотида, катализируемая Tdp1. На 5'-конце олигонуклеотида находится (5,6)-FAM - флуорофор, интенсивность флуоресценции которого возрастает при удалении тушителя. Для измерения флуоресценции использовался флуориметр POLARstar OPTIMA производства BMG LABTECH.
Реакционные смеси объемом 200 мкл содержали буфер (50 мМ Tris-HCl, рН 8,0; 50 мМ NaCl; 7 мМ меркаптоэтанол), 50 нМ олигонуклеотид и различные концентрации ингибиторов. Реакция запускалась добавлением Tdp1 до конечной концентрации 1,3 нМ. Измерения проводились в линейном диапазоне зависимости скорости реакции от времени (до 8 минут) через каждые 55 секунд. Влияние предлагаемых соединений оценивали по величине IC50 (концентрация ингибитора, при которой активность фермента снижена наполовину). Обсчет значений IC50 проводили с помощью программы MARS Data Analisys 2.0 (BMG LABTECH).
Величина IC50 для соединения I составляет 0.1 мкМ, что в 300 раз ниже, чем у соединения-прототипа II (29.5 мкМ).
Пример 3. Цитотоксичность изучаемого соединения. Индуцированную соединением клеточную гибель оценивали с помощью стандартного МТТ-теста [Mosmann Т. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. // J. Immunol. Meth., 1983, 65, 55-63.] путем колориметрического измерения количества формазана, конвертированного из 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-2Н-тетразолия бромида (МТТ) клетками, подвергшимися воздействию соединения. Клетки культивировали в среде IMDM, с 40 мкг/мл гентамицина, 100 ед/мл пенициллина, 0,1 мг/мл стрептомицина и 0,25 мкг/мл амфотерицина и в присутствии 10% эмбриональной бычьей сыворотки производства фирмы "Биолот" в атмосфере с 5% СО2. После формирования 50% монослоя в культуральную среду добавляли исследуемый препарат и контролировали пролиферацию клеточной культуры в течение 72 часов. В качестве контроля использовали клетки, культивируемые при соответствующей концентрации DMSO.
Токсичность соединения отсутствовала во всем диапазоне изученных концентраций (до 100 мкмоль).
Важно отметить, что ТМЗ обладал субоптимальной цитотоксичностью, в то время как ингибитор Tdp1 не проявил цитотоксической активности. Как показано в Таблице 2 и на Рисунке 1, комбинация ТМЗ с соединением в указанных концентрациях приводила к снижению жизнеспособности обеих клеточных линий: до 40% для линии U-87MG и до 30% на линии SNB-19 по сравнению с монотерапией ТМЗ. Таким образом, можно говорить о потенцировании ТМЗ предлагаемым соединением.

Таким образом, предложено соединение, представляющее собой производное дегидроабиетиламина формулы I, у которого выявлена биологическая активность, заключающаяся в способности ингибировать действие фермента тирозил-ДНК-фосфодиэстеразы 1 человека (Tdp1). Предлагаемое соединение, являющееся низкотоксичным эффективным ингибитором тирозил-ДНК-фосфодиэстеразы 1, возможно рассматривать как перспективный агент для комбинированной химиотерапии онкологических заболеваний.