Результат интеллектуальной деятельности: Способ радиосенсибилизации опухолевых клеток
Вид РИД
Изобретение
Изобретение относится к области молекулярной биологии, исследующей новые возможности для увеличения эффективности и направленной селективности воздействия на опухолевые клетки (гибели опухолевых клеток) с применением радиационного воздействия.
Настоящее изобретение относится также к области радиосенсибилизации опухолевых клеток для усиления повреждающего действия ионизирующих излучений на опухолевые клетки.
Способ может найти применение в области лечения злокачественных образований, т.е. химиотерапевтическое лечение и лечение облучением. Характерными недостатками радио- и химиотерапии являются: токсичность, значительные побочные действия, низкая опухолевая специфичность. Эффективность действия радиосенсибилизации может быть достигнута: либо уменьшением собственных радиозащитных возможностей клеток (снижение внутриклеточного уровня глютатиона), либо подавлением репарации от лучевых повреждений (ингибиторами репарации), либо созданием для облученных объектов неблагоприятных условий культивирования.
В качестве радиосенсибилизаторов часто используются антиметаболиты - вещества, структурно близкие к физиологическим метаболитам и вследствие этого способные конкурировать с ними в различных биохимических процессах. Важным фактором радиосенсибилизации является регуляция клеточной пролиферации. Клетки, находящиеся в различных фазах клеточного цикла, проявляют различную радиочувствительность. Меньшую радиочувствительность проявляют клетки в S-фазе, большую - в G2/М фазах и G1фазе.
В медицинской практике широко используется в качестве радиосенсибилизатора опухолевых клеток 5-фторурацил, который влияет на процессы синтеза ДНК и блокирует клетки в S-фазе. Показано, что 5-фторурацил действует преимущественно на клетки пролиферативного пула: П.Ю. Поляков и др. Вопросы онкологии, 1997, №5, том 43, с. 487-49 [1].
Известен способ радиосенсибилизации опухолевых клеток с использованием цисплатины после проведения лучевой терапии: патент РФ 2211716 [2]. Цисплатин относится к платиносодержащим препаратам, блокируют клетки в S-фазе синтеза ДНК. Согласно описанию патента способ позволяет снизить частоту общих и местных лучевых реакций, лучевых повреждений здоровых тканей.
Известно сочетанное использование 5-фторурацила и платиносодержащих препаратов (цисплатин, платидиам, платан) в качестве радиосенсибилизатора опухолевых клеток. Здесь радиосенсибилизация опухолевых клеток осуществляется за счет блокировки клеток в S-фазе синтеза ДНК. Патент RU №2088288 [3].
Недостатком этих способов радиосенсибилизации, которые влияют на процессы синтеза ДНК и блокирует клетки в S-фазе, является слабая избирательность действия в отношении опухолевых клеток поскольку одновременно с ними сенсибилизируются и делящиеся клетки нормальных тканей.
Известно также, что повышенная зависимость опухолевых клеток от глюкозы (в силу их метаболической особенности) предполагает, что нгибиторы гликолизы обладают противоопухолевой активностью: Dalirfardouei R. et al. Life Science, 2016; 152: 21-29 [4]. Показано, что 2-DG значительно усиливает радиационные повреждения в клетках с высокой скоростью включения глюкозы и гликолиза: Mesbahi A, et al. Breast. 2017; 33:97-103 [5]. Известно, что 2-deoxy-D-glucose (2-DG) селективно усиливает радиационно-индуцированные повреждения в опухолевых клетках, не повреждая нормальные клетки: Farooque A1 et al., J. Cancer Res Ther. 2009 Sep; 5 Suppl 1:S32-5 [6].
Известен способ радиосенсибилизации опухолевых клеток с комбинацией 2DG (как ингибитора гликолиза) и ионизирующего излучения в большей степени ингибирует рост опухоли и выживаемость мышей, чем раздельное воздействие этих агентов: Coleman MC1, Asbury CR, et al. Free Radic Biol Med. 2008 .44(3):322-31, [7].
Известно также, что 2-DG блокирует пролиферации клеток в фазе G2/M: Гильяно Н.Я. Бондарев и др. Патологическая физиология и экспериментальная терапия. 2014. т. 58. №4, с. 78-85 [8].
Известен способ радиосенсибилизации опухолевых клеток, содержащий обработку клеток доксорубицином (антибиотиком, обладающим противоопухолевой активностью), и 2DG - ингибитором гликолиза, который блокирует клеточную пролиферацию в фазе G2/M, в комбинации с ионизирующим излучением. В работе показано усиление действия облучения в 1.14 и 1.16 раза: Islamian JP., Asian Рас J Cancer Prev. 2015; 16(18):8431-8. [9].
Таким образом, выше приведенные способы основаны на одинаковом механизме воздействия на клетки: блокирование пролиферации в радиочувствительной G2/M фазе клеточного цикла и применение ингибиторов гликолиза. Однако эффективность радиосенсибилизации несущественна и находится в пределах статистической погрешности при дозиметрической оценке дозы облучения и может объясняться вариабельностью в чувствительности опухолевых клеточных линий. Возможно, это объясняется тем, что и ионизирующее излучение и 2DG блокируют пролиферацию в G2/M фазах клеточного цикла, и что цитостатический эффект от 2DG нивелируется большим цитостатическим эффектом гамма излучения.
Технический эффект заявляемого изобретения заключается в повышении радиосенсибилизации и направленной селективности воздействия на опухолевые клетки без влияния на неопухолевые клетки.
Задача заключается в том, чтобы найти способ, обеспечивающий радиосенсибилизацию за счет направленного ингибирования клеточного метаболизма опухолевых клеток и блокирования клеточной пролиферации в фазе клеточного цикла, не совпадающей с радиационным блокированием пролиферации гамма излучением.
Технический эффект достигается тем, что предложен способ радиосенсибилизации опухолевых клеток, заключающийся в воздействии на опухолевую клетку веществом, являющимся ингибитором гликолиза и одновременно блокирующий клеточную пролиферацию, где новым является то, что в качестве вещества, блокирующего клеточную пролиферацию, использован в нетоксичных концентрациях глюкозамин D гидрохлорид, который блокирует клеточную пролиферацию в радиочувствительной G1 фазе клеточного цикла, не совпадающей с радиационным блокированием пролиферации гамма излучением.
Известно, что глюкозамин D также как и 2DG, ингибирует гликолиз, снижая активность гексокиназы. Известно, что D-глюкозамин токсичен для нескольких малигнантных клеточных линий и in vivo опухолей при концентрациях, имеющих малый эффект на нормальные клетки: Zhang L, Liu W-S, Han B-Q, et al. Antitumor activities of D-glucosamine and its derivatives. Journal of Zhejiang University SCIENCE B. 2006; 7:608-614 [10]. Исследования молекулярных механизмов противоопухолевой активности низких концентраций глюкозамина D выявили изменения в активности генов, ответственных за выживаемость и пролиферацию опухолевых клеток, в частности, подавление гена STAT3 стимулирующего пролиферацию и выживаемость опухолевых клеток: Chesnokov V1, Sun С, Itakura K. Glucosamine suppresses proliferation of human prostate carcinoma DU145 cells through inhibition of STAT3 signaling. Cancer Cell Int. 2009 Sep 10; 9:25 [11].
Однако влияние нетоксичных концентраций глюкозамина D гидрохлорида на повышение радиосенсибилизации опухолевых клеток и направленной селективности воздействия его (глюкозамина) на опухолевые клетки не известно.
Авторы изобретения экспериментально обнаружили, направленное повышение селективной радиосенсибилизации опухолевых клеток без повреждения неопухолевых клеток нетоксичными концентрациями ингибитора гликолиза глюкозамином D гидрохлоридом.
Суть изобретения основана на том, что глюкозамин D гидрохлорид, который ингибирует гликолиз - основной энергетический путь получения АТФ опухолевыми клетками, что влияет на энергозависимые репарационные процессы радиационно-индуцированных повреждений и приводит к апоптотической гибели опухолевых клеток. Поскольку неопухолевые клетки получают АТФ через окислительное форфорилирование, то обработка их ингибиторами гликолиза практически не меняет уровень радиационно-индуцированной клеточной гибели. В результате возникает возможность повышения эффекта ионизирующих излучений без увеличения дозы облучения.
Для пояснения сущности изобретения представлены следующие графические материалы.
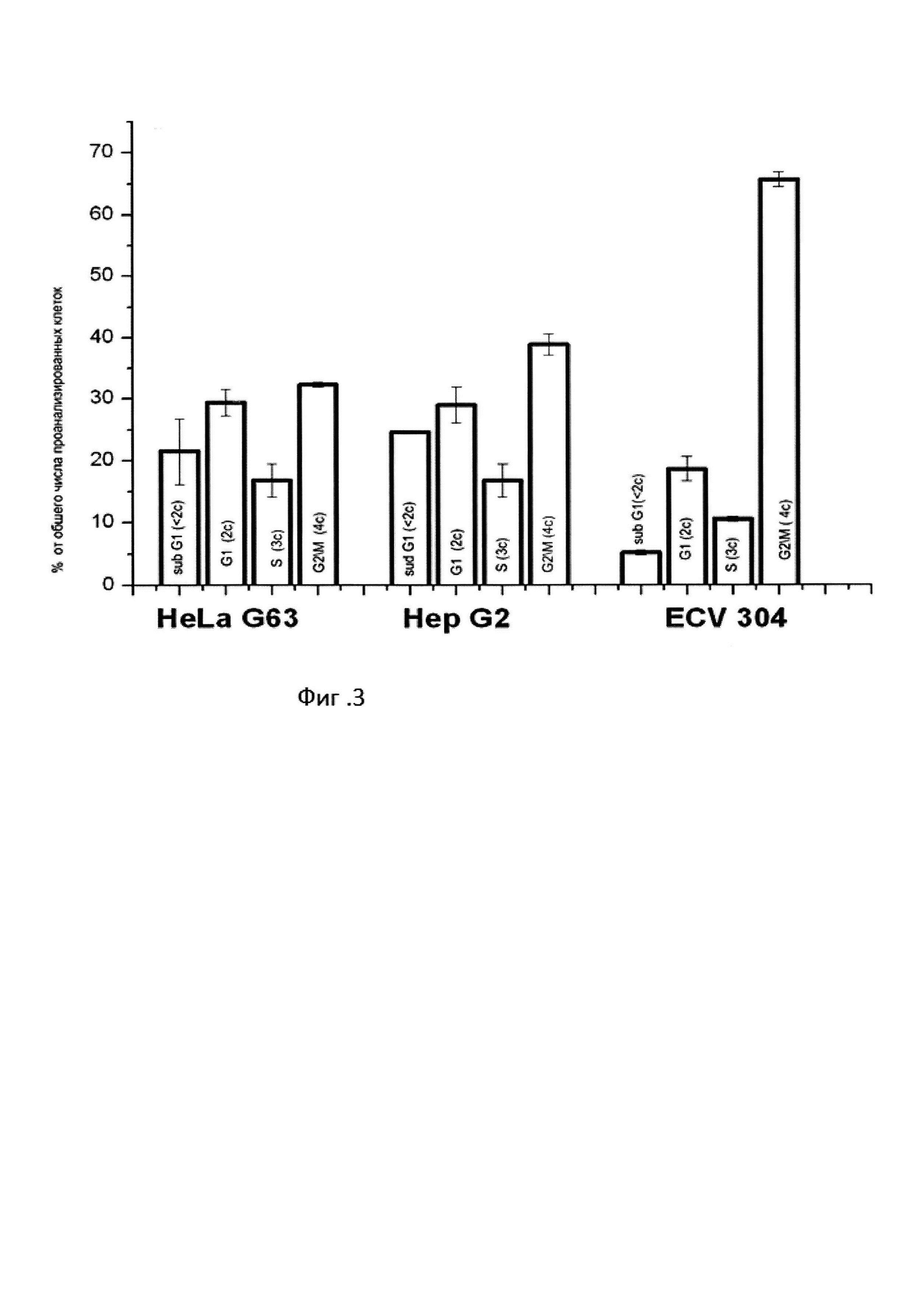
На фиг. 1 представлены результаты экспериментов по исследованию влияния 24 часовой обработки клеток глюкозамином D на прогрессию клеток по циклу (распределение клеток по фазам клеточного цикла).
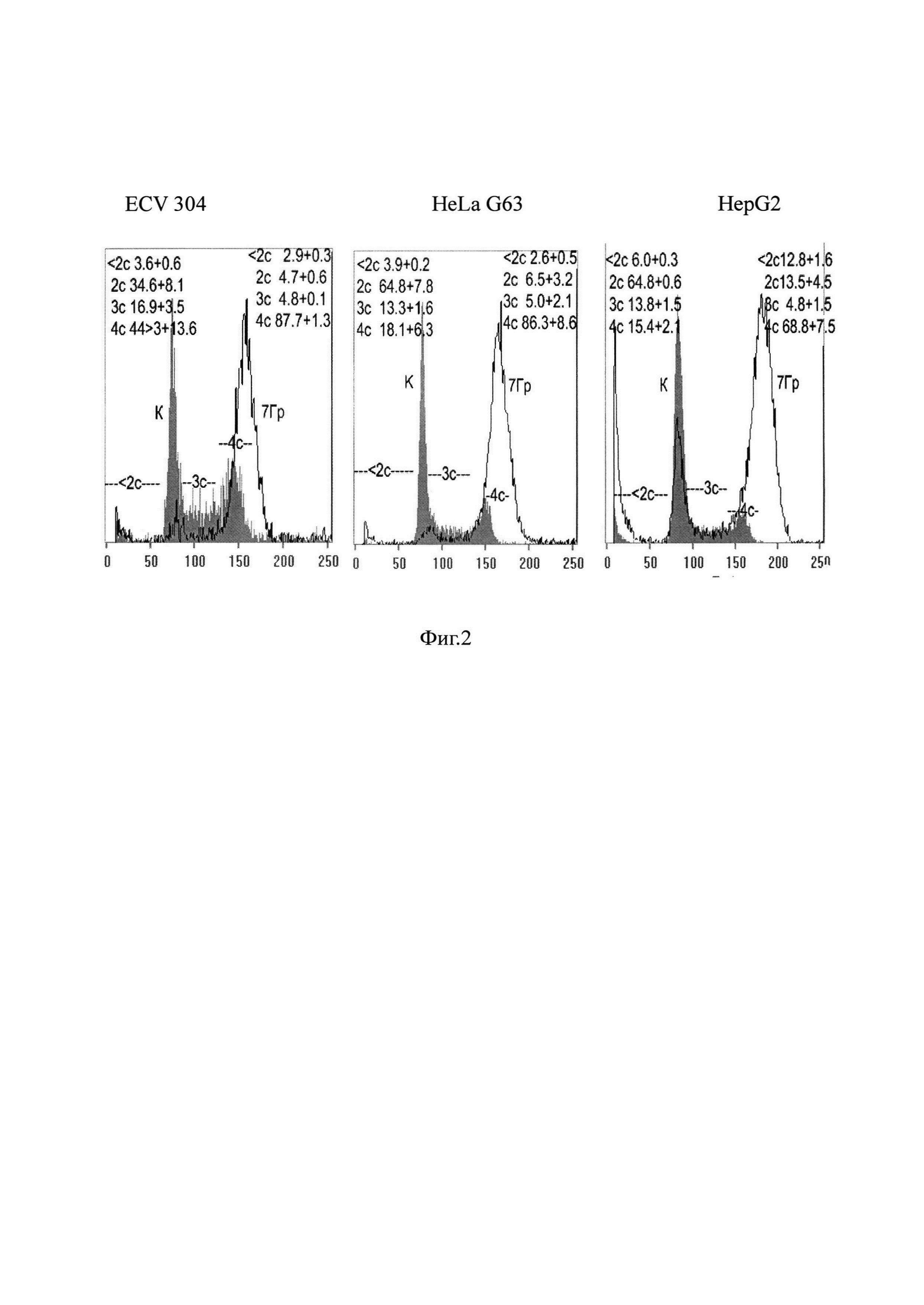
На фиг. 2 представлены гистограммы одного из трех экспериментов по оценке влияния гамма лучей, испускаемых при распаде кобальта 60 на изменения в распределении клеток по содержанию ДНК (по фазам клеточного цикла) в исследуемых клеточных линиях через 24 часа после облучения.
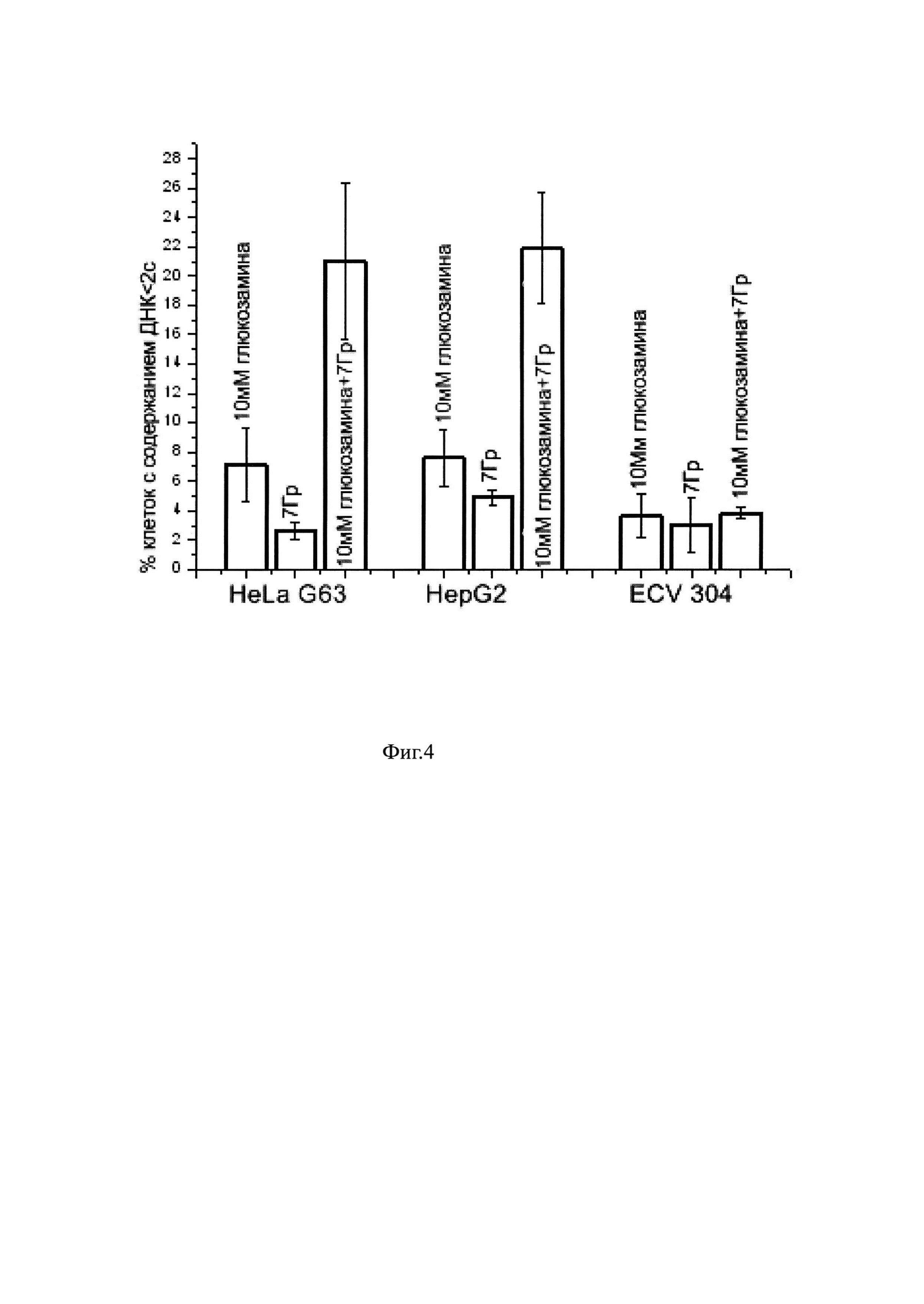
На фиг. 3 представлены результаты цитометрического анализа состава клеточной популяции через 48 часов после облучения в опухолевых клетках HeLa G63, Hep G2 и эндотелиальных клетках ECV 304
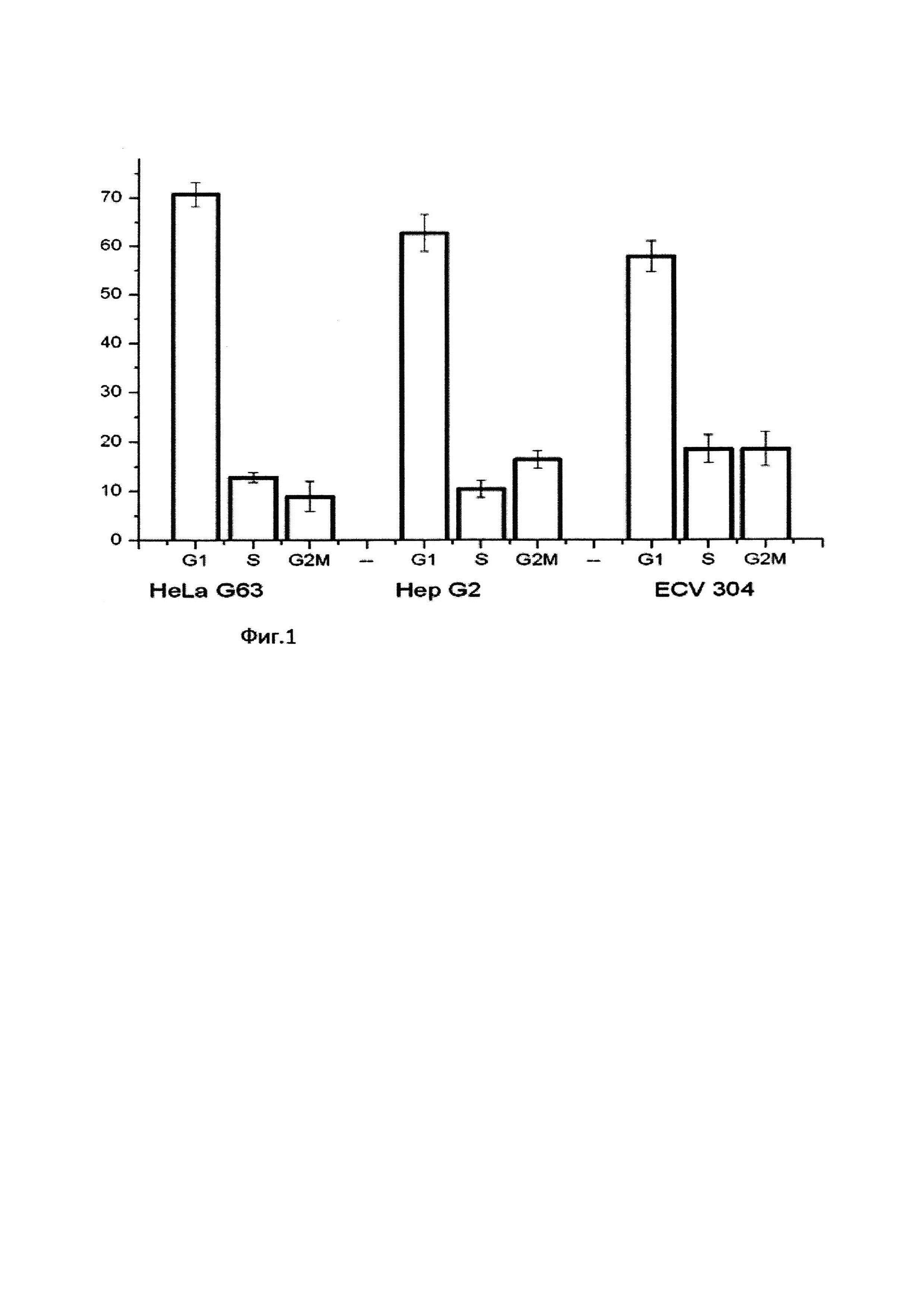
На фиг. 4 представлены результаты экспериментов по оценке уровня клеток с содержанием ДНК <2с (апоптотически гибнущих клеток) после раздельной и сочетанной обработки клеток 10mM глюкозамина D и 7Гр гамма-лучами Со60.
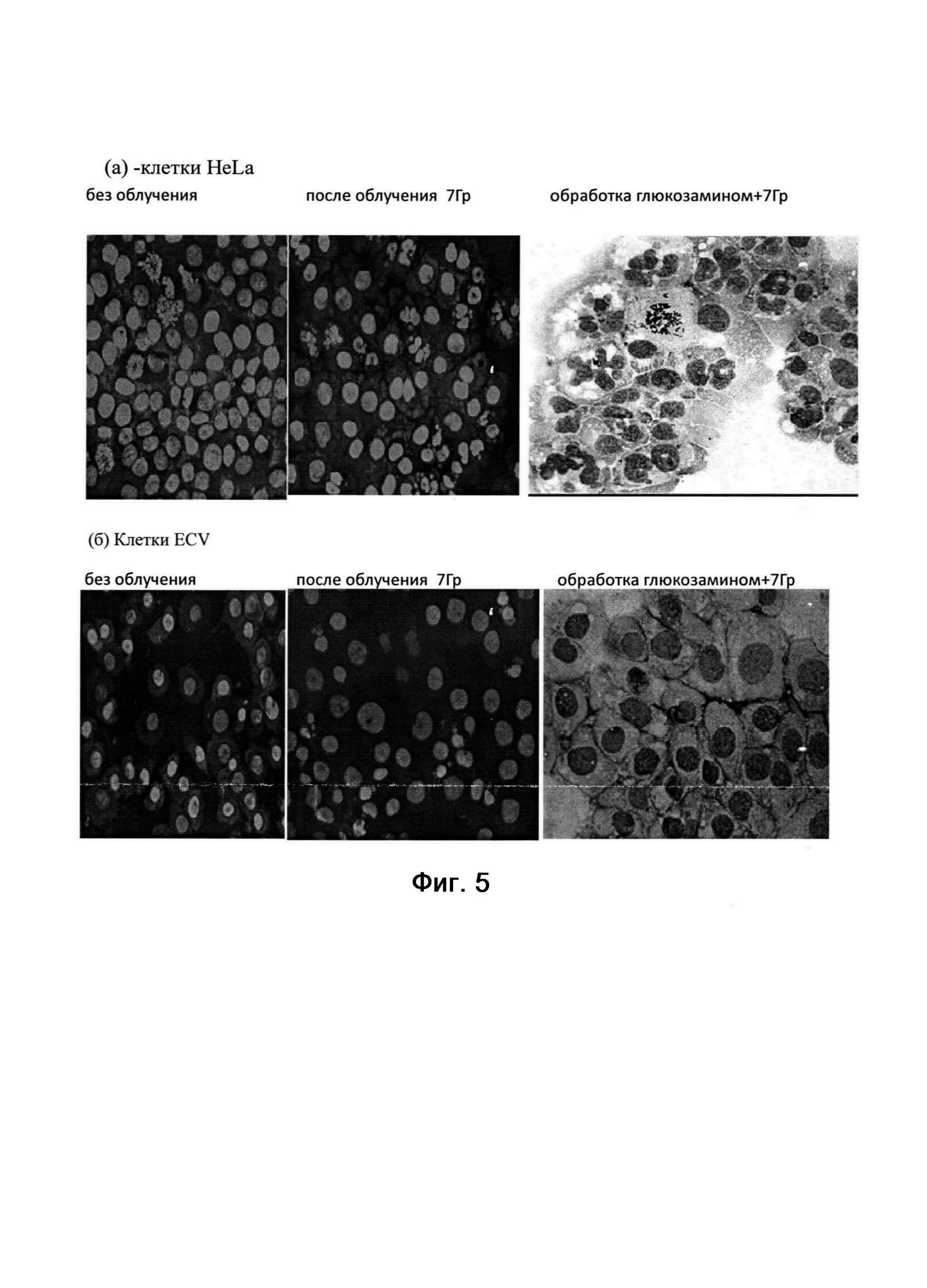
На фиг. 5 (а, б) представлен морфологический анализ состава клеточной популяции через 48 часов после облучения в опухолевых клетках HeLa G63 (5, а); в эндотелиальных клетках ECV 304(5, б).
Примеры конкретной реализации способа
Способ был проверен на клетках эпителиоидной карциномы шейки матки линия HeLa G 63, гепатокарциномы линия Hep G2 и эндотелиальные клетки человека линия ECV 304. Данные клетки обрабатывались ингибитором гликолиза глюкозамином D в нетоксических концентрациях 3 и 10 мМ гидрохлоридом и затем облучали гамма лучами кобальта-60 в дозе 7Гр и через 24 и/или 48 часов проводили цитометрический и морфологический анализ состава клеточной популяции.
Клеточные линии культивируются в среде Игла (фирма «Биолот») с дополнением 10% сыворотки крупного рогатого скота (фирма «Биолот») и 100 ед./мл пенициллина-стрептомицина (Gibco BRL) при 37°С. Клетки выращивали в пенициллиновых флаконах с покровными стеклами, что позволило одновременно проводить морфологический и цитометрический анализ одной и той же популяции клеток.
В качестве радиосенсибилизатора использован глюкозамин гидрохлорид (глюкозамин HCl), который нетоксичен, стабилен, обладает высокой гидрофильностью.
Облучение клеток гамма-лучами Со 60 проводили на установке «Исследователь» ПИЯФ им. Б.П. Константинова. Мощность дозы 7Гр/мин.
Из представленных результатов (фиг. 1) 24 часовая обработка клеток глюкозамином D приводит к блокированию прогрессии по циклу и аккумуляции клеток в G1 фазе клеточного цикла вне зависимости от типа клеток.
Последующее облучение гамма лучами проводилось на синхронизированной в G1 фазе популяции клеток, что позволяет снизить вариации в клеточном ответе, обусловленные различной радиочувствительностью фаз клеточного цикла.
На фиг. 2 представлены гистограммы одного из трех экспериментов по оценке влияния гамма лучей, испускаемых при распаде кобальта 60 на изменения в распределении клеток по содержанию ДНК через 24 часа после облучения. На гистограммах, также, приведены средние значения этого распределения по 3 независимым экспериментам для клеток линии Hep G2, и по 5-ти независимым экспериментам для клеток HeLa G63 и ECV 304. Из гистограмм видно, что облучение клеток гамма-лучами 60 Go в дозе 7 Гр приводило к аккумуляции клеток в G2/M (4с = 75-88%) клеточного цикла вне зависимости от типа клеток. При этом доля клеток с содержанием ДНК меньше чем 2с (апоптотически гибнущих) увеличивалась незначительно при фиксации клеток через 24 часов после облучения, что может свидетельствовать о том, что этого времени недостаточно для реализации программы радиационно-индуцированного апоптоза. Очевидно, селективная направленность в отношении опухолевых клеток (HeLa, и Hep G2) отсутствует при раздельной обработке глюкозамином (в нетоксичной концентрации) и гамма-облучением при фиксации через 24 часа после обработки. При увеличение временного интервала до 48 часов реализация радиационно-индуцированных повреждений в опухолевых клетках HeLa G63 и в эндотелиальных клетках ECV 304 идет по-разному, На клетках карциномы мы видим фрагментирование ядерного материала, характерное для апоптотической гибели, а в клетках ECV 304 регистрируется образование микроядер, которые, как правило, образуются из-за потери генетического материала во время митоза (фиг. 3 и фиг. 5а, 5б).
На фиг. 4 представлены результаты экспериментов по оценке уровня клеток с содержанием ДНК <2с (апоптотически гибнущих клеток) после раздельной и сочетанной обработки клеток глюкозамином и 7Гр гамма-лучами Со60. Из диаграмм видно, что чувствительность клеток исследуемых линий к ионизирующему излучению не сильно различается, находится в пределах доверительных интервалов. К данной (10 мМ) концентрации глюкозамина чувствительность клеток карциномы (и HeLa, и Hep G2) выше, чем чувствительность эндотелиальных клеток ECV 304, но не столь значительно как при сочетанном воздействии. Сочетанное воздействие глюкозамина и гамма-лучей демонстрирует существенные различия между клетками карциномы и эндотелиоцитами. Предрадиационная инкубация клеток HeLa G63 с глюкозамином приводила к существенному увеличению доли клеток с содержанием ДНК <2с (в 7 раз по сравнению с облучением без глюкозамина и в 3 раза по сравнению с глюкозамином без облучения).
Для клеток линии Hep G2 предрадиационная инкубация с глюкозамином привела к увеличению доли клеток с содержанием ДНК <2с вдвое (24.6+3.8%) по сравнению с глюкозамином (10.3+1.9%) и втрое по сравнению облучением (7.6+0.5%).
В отличие от клеток HeLa G63 и Hep G2 предрадиационная инкубация клеток ECV 304 (неопухолевых клеток) с глюкозамином существенно не изменила распределения клеток по фазам цикла. Популяция клеток с содержанием ДНК <2с отличалось от необработанного контроля (1.4+0.9%) и 5.2+0.4% (облучение с глюкозамином), но практически не отличалось от раздельной обработки глюкозамином (5,0+3.2%) и облучением (4.4+1.9%).
Доказано, что индуцированная глюкозамином радиосенсибилизации имеет селективную направленность в отношении опухолевых клеточных линий гепатокарциномы (Hep G2) и карциномы шейки матки(HeLa G63), и не влияет на чувствительность неопухолевых клеток линии ECV 304. Поскольку проявление эффекта регистрируется не сразу, а через 48 часов и позже, по очевидно, что глюкозамин D ингибирует энергетически (АТФ) зависимые пострадиационные процессы репарации ДНК, избирательно усиливает радиационное повреждение только опухолевых клеток.
Приведенные данные подтверждены экспериментами на клетках эпителиоидной карциномы шейки матки линия HeLa G 63, гепатокарциномы линия Hep G2 и эндотелиальные клетки человека линия ECV 304. Показано, что обработка клеток нетоксичными концентрациями ингибитором гликолиза глюкозамином D гидрохлоридом, нарушает прогрессию по циклу, синхронизируя клетки в радиочувствительной точке клеточного цикла в G1 фазе, что приводит к увеличению апоптотической гибели опухолевых клеток. Значительное увеличение апоптоза регистрируется в клетках HeLa G 63 и Hep G2 при сочетанном воздействии глюкозамином и гамма-лучами по сравнению с раздельным воздействием каждого из них, в отличие от ECV 304 клеток.
Литература
1. П.Ю. Поляков и др. Нетрадиционные подходы к лучевому лечению онкологических больных. Вопросы онкологии, 1997, №5, том 43, с. 487-49.
2. Патент РФ №2211716.
3. Патент RU №2088288.
4. Dalirfardouei R., Rfrimi G., Jamialahmadi K. Molecular mechanisms and biomedical applications of glucosamine as a potential multifunctional therapeutic agent. Life Science, 2016; 152: 21-29.
5. Rashidi MR, Mesbahi A, Mohammadzadeh M et al. Targeted superparamagnetic nanoparticles coated with 2-deoxy-d-gloucose and doxorubicin more sensitize breast cancer cells to ionizing radiation Breast. 2017; 33:97-103.
6. Farooque A1, Afrin F, Adhikari JS, Dwarakanath BS. Protection of normal cells and tissues during radio- and chemosensitization of tumors by 2-deoxy-D-glucose. J Cancer Res Ther. 2009 Sep; 5 Suppl 1: S32-5.
7. Coleman MC1, Asbury CR, Daniels D, et al. 2-deoxy-D-glucose causes cytotoxicity, oxidative stress, and radiosensitization in pancreatic cancer. Free Radic Biol Med. 2008. 44(3):322-31.
8. Гильяно Н.Я., Бондарев Г.Н., Коневега Л.В., Носкин Л.А., Журишкина У.В., Алчинова И.Б. Возможные механизмы селективного действия ингибиторов гликолиза на эндотелиоциты и клетки карциномы человека. Патологическая физиология и экспериментальная терапия. 2014. т. 58. №4, с. 78-85.
9. Islamian JP, Aghaee F, Farajollahi A, et al. Combined Treatment with 2-Deoxy-D-Glucose and Doxorubicin Enhances the in Vitro Efficiency of Breast Cancer Radiotherapy. Asian Рас J Cancer Prev. 2015; 16(18):8431-8.
10. Zhang L, Liu W-S, Han B-Q, et al. Antitumor activities of D-glucosamine and its derivatives. Journal of Zhejiang University SCIENCE B. 2006; 7:608-614.
11. Chesnokov V1, Sun C, Itakura K. Glucosamine suppresses proliferation of human prostate carcinoma DU145 cells through inhibition of STAT3 signaling. Cancer Cell Int. 2009, Sep 10; 9:25.
Способ радиосенсибилизации опухолевых клеток, заключающийся в воздействии на опухолевую клетку веществом, являющимся ингибитором гликолиза и одновременно, блокирующем клеточную пролиферацию, отличающийся тем, что в качестве вещества, блокирующего клеточную пролиферацию, использован глюкозамин D гидрохлорид в концентрации 10 мМ.