Результат интеллектуальной деятельности: Способ получения биологически активных компонентов из клеток дрожжей Saccharomyces cerevisiae и лечебное средство на их основе
Вид РИД
Изобретение
Изобретение относится к способу получения биологически активных компонентов в виде одно- и двуспиральной рибонуклеиновой кислоты и полисахарида зимозана из дрожжей Saccharomyces cerevisiae для создания лечебной композиции, и может быть использовано в фармацевтической промышленности и ветеринарии для производства противоинфекционных препаратов.
Известен способ получения дсРНК из киллерных штаммов дрожжей Saccharomyces cerevisiae, включающий разрушение клеток, осаждение суммарных нуклеиновых кислот из клеточного экстракта этанолом, фракционирование и осаждение дсРНК в растворах хлористого лития, очистку дсРНК в водном растворе с помощью хлороформа или смеси хлороформа с изоамиловым спиртом и выделение целевого продукта этанолом (ж. «Антибиотики и медицинская биотехнология». - 1985 янв., 30(1), с. 19-21) [1].
Для более полной очистки дсРНК авторы рекомендуют многократное фракционирование хлоридом лития, что приводит к технологическим потерям и снижению выхода целевого продукта. Кроме того, при коцентрациях LiCl 2 Моль/л белки не осаждаются, а при концентрациях выше 3,5 Моль/л осаждаются вместе с дсРНК. А примеси белков и липидов вызывают пирогенные и аллергенные эффекты при применении препаратов в медицине и ветеринарии. Предусматриваемый известной технологией значительный расход этанола, особенно на стадии осаждения нуклеиновых кислот из клеточного экстракта, обуславливает необходимость принятия специальных мер для обеспечения пожаробезопасности производства, что ведет к увеличению себестоимости продукта.
Известен способ получения дсРНК из киллерных штаммов дрожжей Saccharomyces cerevisiae (Патент РФ №2302464 «Способ получения двуспиральной рибонуклеиновой кислоты», дата публикации 10.07.2007) [2]. Способ предусматривает обработку клеток дрожжей культуральной жидкостью Arthrobacter luteus ATSS 21606 при температуре 30-40°С в течение 15-20 ч, депротоинизацию термообработкой при температуре 75-90°С в течение 5-20 мин, диафильтрацию на разделительном аппарате с полыми волокнами АР-2 с пределом отсечения 100 кДа, фракционирование растворами LiCl (2 и 4 Моль/л), обработку хлороформом, осаждение дсРНК в 65%-ом растворе этанола и промывку 96%-ным раствором этанола. В этом случае такие жесткие условия как прогревание при температуре 75-90°С (приводит к «расплетанию» цепей РНК), механические воздействия при диафильтрации (контакт с большой поверхностью и продавливание через поры под давлением), приводят к деформации структуры дсРНК и нестабильности ее при хранении. Кроме того, прогревание больших объемов до 75-90°С в течение 5-20 мин может приводить к значительным локальным перепадам температур и трудновоспроизводимости процесса. А также, использование фермента зимолиазы из Arthrobacter luteus приводит к разрушению полисахарида зимозана. Фермент обладает бета-1,3-глбканазной и бета-1,3-глюкан ламинарипентагидролазной активностями, которые вызывают гидролиз полимеров глюкозы в положении бета-1,3-глюкана. От действия фермента, происходит разрушение зимозана.
Известен способ получения полисахарида зимозана (Авт. С-во №138334 «Способ получения зимозана», Карманова П., МПК С12Р 19/04, опубликовано 01.01.1961 г.) [3]. Биомассу дрожжей разрушают в растворе трихлоруксусной кислоты, затем осадок отмывают водой и спиртом. Недостаток способа в том, что под воздействием трихлоруксусной кислоты белки и нуклеиновые кислоты денатурируют и выпадают в осадок. И вымывание их из осадка довольно трудоемкий и длительный процесс.
Известен способ получения зимозана (Авт.свидетельство СССР №141990 «Способ получения зимозана», Шадхан Х.Ф., МПК С12Р 19/04, опубликовано 01.01.1961 г.) [4]. Биомассу дрожжей длительно суспендируют с трипсином или панкреатином, в результате происходит «самопереваривание» и разрушение белков и нуклеиновых кислот.
Недостаток способа в том, что под воздействием гидролитических ферментов разрушаются и белки и нуклеиновые кислоты.
Известен способ получения зимозана (Авт.свидетельство СССР №1490156 «Способ получения зимозана», МПК С12Р 19/04, опубликовано 30.06.1989 г.) [5]. Водную суспензию дрожжей инкубируют при температуре от +35 до 55°С в течение 1-7 сут. После инкубации суспензию пропускают через колонку с сульфокатионитом, центрифугируют. Полученный осадок обезвоживают спиртом и вакуумной сушкой.
Недостаток способа в том, что под воздействием гидролитических ферментов разрушаются и белки и нуклеиновые кислоты.
Наиболее близким аналогом (прототипом) является способ получения дсРНК из киллерных штаммов дрожжей Saccharomyces cerevisiae (Патент РФ №2558256. Способ получения двуспиральной рибонуклеиновой кислоты (дсРНК) из клеток дрожжей Saccharomyces cerevisiae, опубл. 27.07.2015) [6]. Способ предусматривает разрушение клеток дрожжей в буфере (10 мМ Трис, 20 мМ ЭДТА, 0,5 М NaCl, рН 7,4) последовательной обработкой додецилсульфатом натрия (до 0,5%, 20-25 мин при 20-25°С) и хлороформом (до 25%, 20-25 мин при 20-25°С). Обработку экстракта дополнительно додецилсульфатом натрия (до 0,5%, 20-25 мин при 4-6°С). Концентрирование дсРНК в 8%-ом растворе ПЭГ 6000, растворение в воде, фракционирование 2 Моль/л раствором LiCl и осаждение в 3,5 Моль/л растворе LiCl. Растворение осадка в воде и осаждение дсРНК из раствора 50-55%-ым этанолом.
Недостаток способа состоит в том, что в нем не предусмотрена комплексная переработка сырья вследствие чего утилизируется осадок, содержащий полисахарид зимозан, обладающий иммуностимулирующей активностью.
Наиболее близким лечебным препаратом (прототипом) является средство на основе индуктора интерферона для наружного применения (патент РФ №2123339, МПК А61К 31/70, опубл. 20.12.1998 г.) [7]. Средство содержит эмульсионную основу, включающую вазелиновое масло, твин-80, эмульгатор Т-2, хлоргексидина биглюконат и дистиллированную воду, а в качестве индуктора интерферона - комплекс натриевых солей одно- и двуспиральных рибонуклеиновых кислот из Saccharomyces cerevisial. Указанный комплекс заключен в водную фазу основы при следующем содержании компонентов, мас. %: комплекс натриевых солей одно- и двуспиральных РНК из Saccharomyces cerevisial - 0,15 - 0,5; вазелиновое масло - 20; твин-80 - 17; эмульгатор Т-2 - 13; хлоргексидина биглюконат - 0,04; дистиллированная вода - до 100%.
Однако средство обладает недостаточным иммуностимулирующим действием.
Техническим результатом является создание комплексного способа получения суммарной РНК и полисахарида зимозана в одном технологическом процессе из биомассы клеток дрожжей и получение лечебного средства на основе РНК и зимозана, обладающего интерферон-индуцирующими и фагоцитоз-стимулирующими активностями, т.е. одновременно противовирусными и противобактериальными свойствами.
Указанный технический результат достигается тем, что способ получения суммарной РНК и полисахарида зимозана из клеток дрожжей Saccharomyces cerevisiae штамм ВКПМ Y-448, согласно изобретения, включает разрушение клеток дрожжей в буфере с рН 7,4, содержащим 10 мМ Трис, 20 мМ ЭДТА и 0,5 М NaCl, обработкой додецилсульфатом натрия (SDS) в концентрации 1,0% при 20-30°C в течение 20-50 мин и хлороформом в концентрации до 25% в течение 20-30 мин при 20-30°C; полученную смесь центрифугируют в течение 20 мин с последующим отделением надосадочной жидкости, содержащей водный экстракт суммарной РНК от осадка - отмытого от основной массы липидов сгусток белков и полисахаридов, содержащих зимозан; к полученному водному экстракту из клеток, содержащему суммарную РНК добавляют раствор SDS до конечной концентрации 2% и выдерживают 60-90 мин при 0°C до выпадения в осадок комплекса SDS с денатурированными белками, который удаляют центрифугированием при 8000g, 20 мин, 0°C, а суммарную РНК получают осаждением из надосадочной жидкости раствором хлористого лития с концентрацией соли 3,5 М с удалением основного пула примесных белков вместе с оставшимся раствором при промывке; полученный осадок дважды промывают 3,5 М раствором соли хлористого лития и растворяют в воде; раствор осветляют центрифугированием при 8000g, 20 мин, 4°C и пропускают через фильтр с диаметром пор 0,22 мкм, после чего РНК осаждают, добавляя этанол до концентрации 50-55%, а сформировавшийся осадок отделяют центрифугированием при 8000g, 20 мин, 4°C, промывают 60%-ным этанолом и растворяют в изотоническом растворе при выходе препарата суммарной РНК 200-240 мг из 100 г биомассы дрожжей, кроме того, полученный белково-полисахаридный сгусток, содержащий зимозан суспендируют в 1%-ном растворе додецилсульфата натрия, суспензию перемешивают при 50-60°C в течение 20-30 мин и полисахарид зимозан отделяют от раствора белков центрифугированием при 8000g, 15 мин, 20°C, полученный осадок промывают, очищенный полисахарид зимозан высушивают при температуре +40-45°C в течение суток и переводят в состояние мелкодисперсного порошка.
Указанный технический результат достигается также тем, что в противовирусном и антибактериальном средстве, согласно изобретения, оно содержит суммарную РНК и полисахарид зимозан, полученные по п. 1 и имеющие соотношение от 1:2,5 до 1:10, а также растворитель или мазевую основу с целевыми добавками при следующем количественном содержании компонентов, масс. %:
|
Средство может быть приготовлено в виде суспензии, а в качестве растворителя оно содержит изотонический раствор при следующем количественном содержании компонентов, масс. %:
|
Средство может быть приготовлено в виде мази, а в качестве мазевой основы с целевыми добавками оно содержит изотонический раствор, масло вазелиновое, эмульгатор Т-2, твин - 60, хлоргексидина биглюконат, димексид при следующем количественном содержании компонентов, масс. %:
|
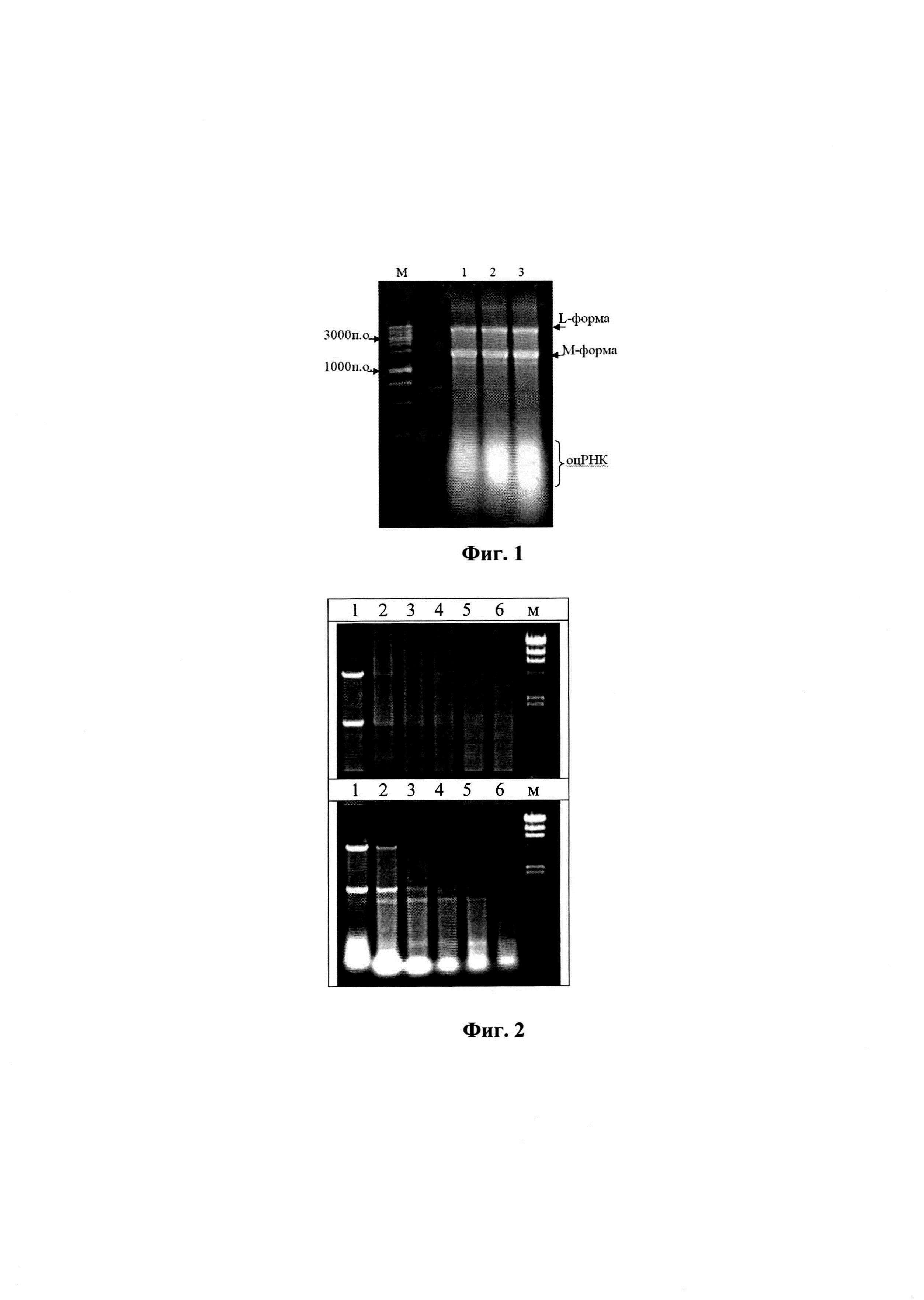
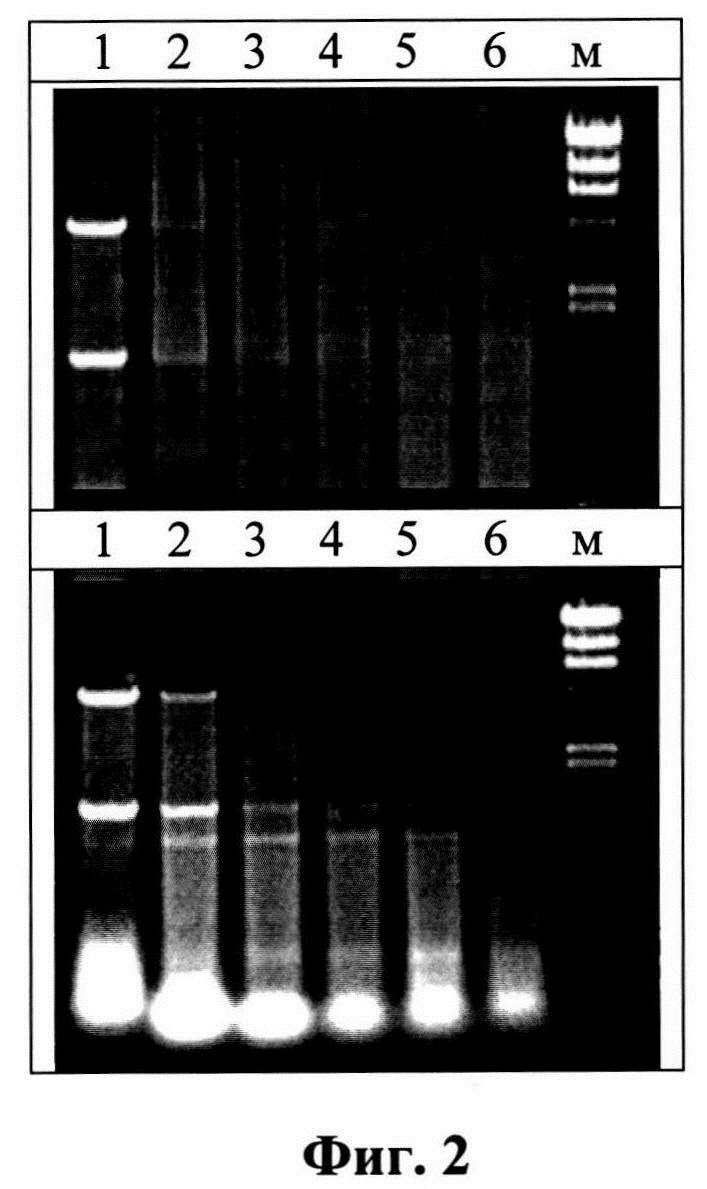
Изобретение поясняется следующими графическими материалами. На фиг. 1 представлена электрофореграмма образцов РНК, дорожки: 1 - исходный препарат; 2-е зимозаном в соотношении 2 мг РНК/5 мг; 3-2 мг РНК/20 мг полисахарида. 1% агароза (окрашивание бромистым этидием). На фиг. 2 приведены электрофореграммы для анализа устойчивости дсРНК к РНКазе электрофорезом в 0,8%-ном геле агарозы (верхний гель - дсРНК, полученная по способу-прототипу, нижний - препарат РНК, полученный по предлагаемому способу).
Ниже приведены примеры практического осуществления предлагаемого способа.
Пример 1. Лизис клеток. Клетки суспендировали в буфере, содержащем 10 мМ Трис, 20 мМ ЭДТА, 1% SDS, 0,5 М NaCl, рН 7,4, в течение 40-50 при температуре 25-30°С. Затем вносили в суспензию хлороформ до 25% и дополнительно перемешивали на качалке в течение 20-30 мин. После центрифугирования (8000g - 30 мин при 25°С) получали раствор, содержащий РНК и отмытый от основной массы липидов сгусток белков и полисахаридов.
Пример 2. Очистка РНК. К полученному экстракту из клеток, содержащему РНК добавляли раствор SDS до конечной концентрации 2% и выдерживали 60-90 мин при 0°С (во льду). Выпавший в осадок комплекс SDS с денатурированными белками удаляли центрифугированием (8000g - 20 мин при 0°С).
Для получения препарата суммарной РНК проводили осаждение в растворе хлористого лития с концентрацией соли 3,5 М. Основной пул примесных белков при этом оставался в растворе и удалялся при промывках. Полученный осадок дважды промывали раствором соли (3,5 М) и растворяли в воде. Раствор осветляли центрифугированием (8000g - 20 мин при 4°С) и пропускали через фильтр с диаметром пор 0,22 мкм, после чего РНК осаждали, добавляя этанол до концентрации 50-55%. Сформировавшийся осадок отделяли центрифугированием (8000g - 20 мин при 4°С), промывали 60%-ным этанолом и растворяли в изотоническом растворе. Выход препарата РНК составлял 200-240 мг из 100 г биомассы дрожжей с содержанием по дсРНК (L-форма, 4500 п.о. и М-форма, 1500 п.о.) до 30-35% от суммарного препарата РНК (фиг. 1, дорожка 1).
Пример 3. Исследование относительной устойчивости полученной РНК к действию нуклеаз.
Проводили обработку дсРНК, полученной по способу-прототипу и препарата РНК, полученному по предлагаемому способу. Исследовали степень деградации 10 мкг дсРНК под действием 0,1 ед.акт РНКазы в объеме 100 мкл при температуре 20°С. Через 1, 5, 10, 20, 40 и 60 мин из реакционной смеси отбирали аликвоты по 15 мкл и переносили в 100 мкл охлажденного этанола. Выдерживали при минус 20°С и осадки собирали центрифугированием (12000g - 10 мин при 4°С), подсушивали их на воздухе, растворяли в 10 мкл, наносили в лунки 1%-ного геля агарозы и проводили электрофорез.
На фиг.2 приведен анализ устойчивости дсРНК к РНКазе электрофорезом в 0,8% -ном геле агарозы. Верхний гель - дсРНК, полученная по способу-прототипу, нижний - препарат РНК, полученный по предлагаемому способу. Интервал инкубации (дорожки): 1-1 мин, 2-5, 3-10, 4-20, 5-40, и 6-60 мин. М - маркер лямбда ДНК/Hind(от 23130 до 125 пн). На электрофореграмме (фиг. 2) видно, что дсРНК, полученная по способу-прототипу полностью гидролизуется уже через 10 мин инкубации, тогда как фрагменты двуспиральной РНК препарата, полученного по предлагаемому способу, наблюдаются через 20-40 мин гидролиза.
Пример 4. Определение интерферон-индуцирующей активности препарата РНК
Определение интерферониндуцирующей активности проводили на самцах белых беспородных мышей с массой тела 18-22 г по 5 голов в каждой группе, полученных из питомника ФБУН ГНЦ ВБ «Вектор». Свежеприготовленный раствор препарата на основе РНК вводили внутрибрюшинно в дозе 0,5 мг на кг массы тела в объеме 200 мкл/мышь. Контрольной группе животных вводили изотонический раствор в том же объеме. Через 6, 24 и 48 ч после введения препарата у мышей забирали кровь на анализ. Содержание интерферона определяли микрометодом (Ершов Ф.И., Сайиткулов A.M. Микрометод для изучения индукторов интерферона in vitro/Вопр. Вирусол. - 1984. - Т. 29, №6. - С. 756-757) [8.] по подавлению цитопатогенного действия тест-вируса (вируса энцефаломиокардита, (ЕМС), штамм «Колумбия») в дозе 100 ЦПД50 в перевиваемой культуре клеток мышиных фибробластов L-929, выращенных в 96-луночных культуральных панелях (полистироловых планшетах с плоским дном). За титр сывороточного интерферона принимали обратную величину его большего разведения, при котором наблюдается 50% защита клеток от цитопатогенного действия тест-вируса.
Результаты исследования интерферон-индуцирующей активности представлены в таблице 1.

Из таблицы 1 видно, что при введении мышам препарата РНК в дозе (10±2) мкг/животное титр интерферона в сыворотке через 6 ч достигал 512 UE, через 24 ч - 640 UE, снижаясь к до исходных значений к концу вторых суток после введения. Эти показатели в два раза ниже, чем в способе прототипе (920 и 1280 UE), но и вводимая доза по содержанию индуктора интерферона дсРНК в 10 мкг составляет 30-35%,
Пример 5. Очистка полисахарида зимозана. Для этого извлекали белково-полисахаридный сгусток и суспендировали его в 100 мл 1%-ого раствора додецилсульфата натрия. Суспензию перемешивали при 50-60°С в течение 20-30 мин и полисахарид отделяли от раствора белков центрифугированием (8000g - 15 мин при 20°С). Полученный осадок последовательно промывали десятью объемами дистиллированной теплой (50-60°С) воды, двадцатью - холодной и тремя объемами этанола. Очищенный полисахарид высушивали при температуре 40-45°С в течение суток и переводили в состояние мелкодисперсного порошка при помощи электрокофемолки. Выход составлял 5-6 г сухого порошка из 100 г биомассы дрожжей.
Пример 6. Для выбора соотношений компонентов при разработке композиции были исследованы пропорции: на 2 мг препарата РНК: 1-5 мг, 2-10 мг и 3-20 мг полисахарида. Объем образцов по 1 мл. При их анализе методом электрофореза в геле агарозы было установлено, что молекулы полисахарида зимозана в отличие от хитозана не оказывают значимого влияния на подвижность РНК (фиг. 1).
Для проверки стимуляции фагоцитарной активности в пробирки помещали 0,2 мл раствора Хенкса и 0,1 мл плазмы крови. В опытные пробы вносили по 30 мкл препарата РНК и варианты композиции до концентраций, указанных в таблице 2. Пробирки инкубировали в термостатируемом шейкере 20-30 мин при 37°С и вносили по 0,05 мл суспензии однородных зернышек кармина (туши). Пробы продолжали инкубировать 30 мин, затем готовили мазки, которые фиксировали 5 минут метиловым спиртом, красили по Романовскому и микроскопировали. Определяли процент лейкоцитов (нейтрофилы), поглотивших частицы (% ФК) и фагоцитарный индекс (таблица 2).

* - отличия статистически значимы, по сравнению с контролем, р≤0,05.
Из таблицы 2 видно, что на ранних стадиях эффект от РНК незначителен, тогда как при внесении полисахарида в дозах 50-200 мкг/мл фагоцитирующая активность значительно повышается уже после 20-30 мин инкубации.
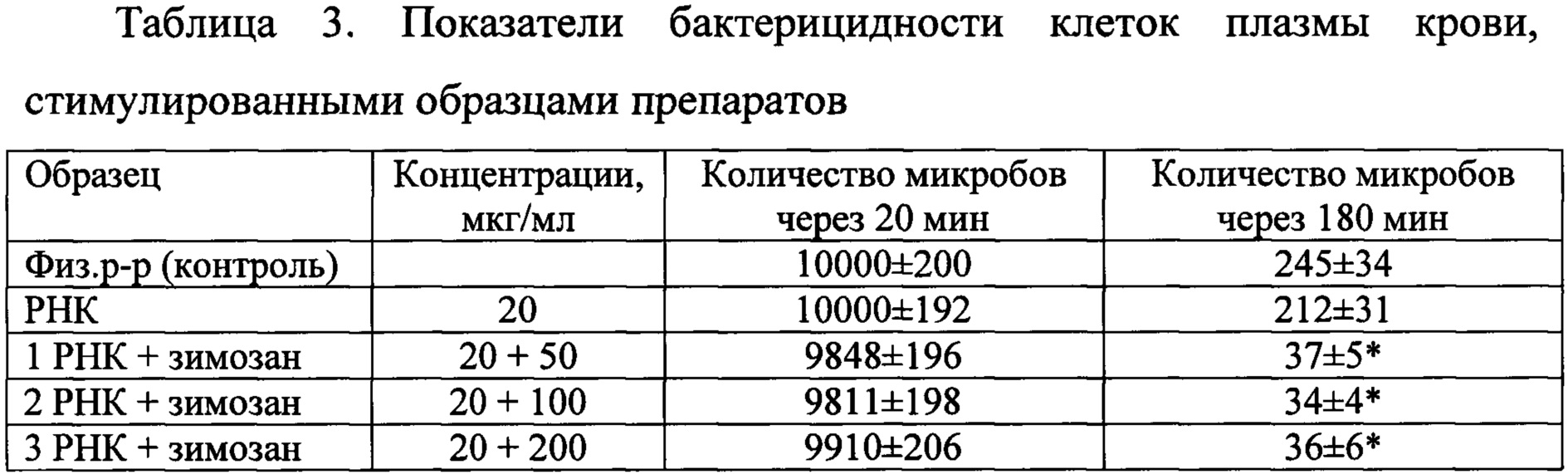
Эксперименты по исследованию бактерицидности проводили как описано в (Иммунологические методы / Под ред. Г. Фримеля. - М.: Медицина, 1987, 472 с.) [9] с модификацией. В пробирки помещали 0,2 мл раствора Хенкса и 0,1 мл плазмы крови. В опытные пробы вносили по 30 мкл препарата РНК и варианты композиции до концентраций, указанных в таблице 2. Пробирки инкубировали в термостатируемом шейкере 20-30 мин при 37°С и вносили по 0,1 мл свежеприготовленной суспензии клеток Staphylococcus aureus, отмытых физиологическим раствором, с концентрацией 105 кл./мл. Пробы продолжали инкубировать и через 20 и 180 мин определяли число микробов. Для этого отбирали по 0,1 мл из каждой пробы, разводили отобранные аликвоты раствором Хенкса в 10, 100 и 1000 раз и по 0,1 мл растирали шпателем на подогретую агаризованную среду в чашках Петри. Чашки помещали в термостат, учет выросших колоний проводили через сутки и пересчитывали их количество на исходный объем (таблица 3).
* - отличия статистически значимы, по сравнению с контролем, р≤0,05.
Из таблицы 3 видно, что стимуляция лейкоцитов зимозаном приводит к повышению их бактерицидности и снижению количества выживших клеток Staphylococcus aureus через 180 мин инкубации. Это можно объяснить тем, что полисахарид, взаимодействуя со специфическим рецептором на поверхности клеток, (TLR4) вызывает повышение концентрации пероксида водорода в фагосомах, что приводит к «окислительному взрыву» и завершенности фагоцитоза.
Пример 7. Составы композиций в суспензионной и мазевой формах.
Состав 1. Суспензия.
|
Состав 2. Суспензия.
|
Состав 3. Суспензия.
|
Ориентируясь на экспериментальные данные для изготовления суспензионной формы выбрали оптимальное соотношения компонентов: на 2 мг препарата РНК - 5 мг зимозана. Для этого 200 мг РНК растворяли в 10 мл изотонического раствора и вносили 500 мг порошка полисахарида. Суспензию тщательно перемешивали.
Для изготовления мазевой формы были разработаны составы 4-6, представленные в таблице 4.

Ориентируясь на экспериментальные данные для изготовления мазевой формы выбрали оптимальное соотношения биологически активных компонентов: на 0,2 мг препарата РНК - 0,5 мг зимозана.
Пример 8. Противовирусные свойства изготовленной мази были исследованы при лечении «простуды» на губах, заболевания, вызываемого вирусом простого герпеса 1-ого типа. Участвовало пять человек в возрасте 35-65 лет. Мазь наносили на пораженные участки (0,04-0,06 г на см2) 2-3 раза в сутки в течение нескольких суток. При этом к началу вторых суток пораженные герпесом участки приобретали здоровый вид.
Таким образом, предложен способ получения комплекса из одно- и двухцепочечной РНК, и полисахарида зимозана стимулятора иммунного ответа из биомассы клеток дрожжей Saccharomyces cerevisiae Y-448 в одном технологическом процессе и получение лечебного средства на их основе (РНК и полисахарид зимозан), обладающего высокими интерферон-индуцирующими и фагоцитоз-стимулирующими активностями, т.е. противовирусными и противобактериальными свойствами, его суспензионной и мазевой формы. Способ менее трудоемок, чем описанный в прототипе (исключено фракционирование 2М хлористым литием), при этом РНК в препарате получается более устойчивой к действию деградирующих факторов, в том числе нуклеаз. Предлагаемый способ позволяет практически безотходно использовать исходное сырье - биомассу клеток Saccharomyces cerevisiae.