Результат интеллектуальной деятельности: Рекомбинантная плазмидная ДНК p280_2GM, кодирующая полипептид со свойствами гранулоцитарно-макрофагального колониестимулирующего фактора человека, штамм E.COLI SG 20050/ p280_2GM - продуцент полипептида со свойствами гранулоцитарно-макрофагального колониестимулирующего фактора человека и способ получения указанного полипептида
Вид РИД
Изобретение
Изобретение относится к биотехнологии, в частности к генетической инженерии, и представляет собой сконструированную in vitro рекомбинантную плазмидную ДНК, содержащую две копии синтетического гена гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ) человека, штамм E. coli SG20050/p280_2GM - продуцент указанного полипептида и способ получения полипептида со свойствами ГМ-КСФ.
ГМ-КСФ - гликопротеин, зрелая форма которого образуется путем отщепления от белка-предшественника (144 а.о.) сигнального пептида (17 а.о.) и последующего гликозилирования. Его источниками в организме человека являются Т-лимфоциты, эндотелиальные клетки и фибробласты. ГМ-КСФ стимулирует in vitro пролиферацию и дифференциацию стволовых клеток с образованием колоний нейтрофильных и эозинофильных лейкоцитов и макрофагов, а также он вовлечен во многие другие биологические и иммунологические процессы, такие как изменение морфологии эффекторных клеток, их подвижности, цитотоксической активности и фагоцитоза. Способность ГМ-КСФ стимулировать рост гранулоцитов и макрофагов делает возможным его клиническое использование для снижения побочных эффектов луче- и химиотерапии, усиления устойчивости к действию инфекций, терапии побочных эффектов при трансплантации костного мозга. Использование рекомбинантного ГМ-КСФ перспективно для ускорения восстановления кроветворения после проведения химиотерапии, оказывающей выраженное повреждающее действие на костный мозг. Также показано, что введение рекомбинантного ГМ-КСФ онкологическим больным приводит к активации эндогенных моноцитов и макрофагов.
Известны способы получения ГМ-КСФ человека, основанные на экспрессии в трансформированных клетках млекопитающих [1] и в дрожжах [2]. Недостатком первого метода является крайне низкий выход целевого продукта (50 мкг белка из 1 л среды). Дрожжевые клетки обеспечивают более высокий уровень синтеза (0.5 мг из 1 л среды), однако в этом случае препятствием для использования препарата является видоспецифическое посттрансляционное гликозилирование.
Микробиологический синтез представляет собой перспективный способ получения ГМ-КСФ человека. Известен способ, описанный в работе [3] Рекомбинантная плазмидная ДНК содержит ген искусственного предшественника ГМ-КСФ человека, который состоит из последовательности, кодирующей сигнальный пептид OmpA E. coli и кДНК зрелого ГМ-КСФ человека под контролем гибридного промотора Ipp-lac. Синтез белка осуществляют при добавлении индуктора, изопропил-β-D-тиогалактопиранозида (ИПТГ), до конечной концентрации 2 мМ. Синтезируемый целевой белок после отщепления сигнальной последовательности оказывается в нерастворимом состоянии. Полученный белок очищают с помощью ионообменной и гидрофобной хроматографии в денатурирующих условиях, после чего проводят его ренатурацию. В результате получают зрелый ГМ-КСФ человека с общим выходом 2,5 мг/л культуральной жидкости. Недостатком способа является относительно низкий уровень синтеза ГМ-КСФ и использование больших количеств ИПТГ для индукции.
Известен cпособ получения ГМ-КСФ в [клетках E. coli SG963 [4]. Трансформированные клетки E. coli SG963 выращивают в объемах 3 - 5 л при температуре 28°C на LB-среде с антибиотиками (50 мкг/мл ампициллина,. 20 мкг/мл канамицина) до оптической плотности Д650 = 3.0. После температурного (42°) и введения дополнительного объема питательной среды клетки выращивают еще в течение трех часов. Накопление целевого продукта по данному способу составляет 8-9% от общего клеточного белка. Недостатками этого способа являются использование термо-индуцируемого промотора, включение дополнительной операции в виде внесения питательной среды после термошока, невысокий выход целевого белка. Известен cпособ получения ГМ-КСФ в клетках Escherichia coli BL21(DE3), трансформированных рекомбинантной ДНК pfgm17 [5], кодирующей полипептид ГМ-КСФ человека. Штамм Е. coli BL21(DE3)/pFGM17 обеспечивает конститутивный синтез полипептида со свойствами ГМ-КСФ человека в количестве не менее 15% от суммарного клеточного белка. Недостатками данных изобретений является невысокий выход целевого белка.
Наиболее близким аналогом (прототипом) настоящего изобретения является рекомбинантная плазмидная ДНК p280GM, кодирующая полипептид со свойствами ГМ-КСФ человека [6] и обеспечивающая конститутивный синтез целевого продукта. Она содержит PstI/BamHI фрагмент ДНК плазмиды pDS280 (1083 п.о.), включающий часть гена β-лактамазы и тандем промоторов триптофанового оперона E. coli, и NcoI/PstI фрагмент ДНК плазмиды pGMtrp (2083 п.о.), включающий синтетический ген ГМ-КСФ человека и кодирующий полипептид зрелого ГМ-КСФ человека (127 а.о.), часть гена β-лактамазы и терминатор транскрипции фага λ. Ген β-лактамазы, детерминирует устойчивость трансформированных плазмидой p280GM клеток E. coli к пенициллиновым антибиотикам;
Другим наиболее близким аналогом изобретения является штамм Escherichia coli SG20050/p280GM ВКПМ B-6613 - продуцент полипептида со свойствами ГМ-КСФ человека [6].
Выход целевого продукта составляет около 15% от суммарного клеточного белка. По принципу конструирования, технической сущности и достигаемому результату данные плазмида и бактериальный штамм являются наиболее близкими к заявляемому техническому решению и выбраны в качестве прототипа.
Недостатком указанных аналогов (прототипов) является недостаточный выход целевого продукта.
Техническим результатом изобретения является создание такой рекомбинантной плазмиды, кодирующей синтез ГМ-КСФ, штамма E. coli - продуцента полипептида со свойствами ГМ-КСФ и способа получения указанного полипептида, которые обеспечили бы значительное повышение выхода целевого продукта.
Указанный технический результат достигается конструированием рекомбинантной плазмидной ДНК р280_2GM, кодирующей полипептид со свойствами гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ) человека и обеспечивающей конститутивный синтез целевого продуекта. Рекомбинантная плазмида р280_2GM характеризуется следущими признаками:
- кодирует аминокислотную последовательность зрелого ГМ-КСФ человека;
- имеет молекулярную массу 2.95 МДа (4422 п.о.)
- состоит из:
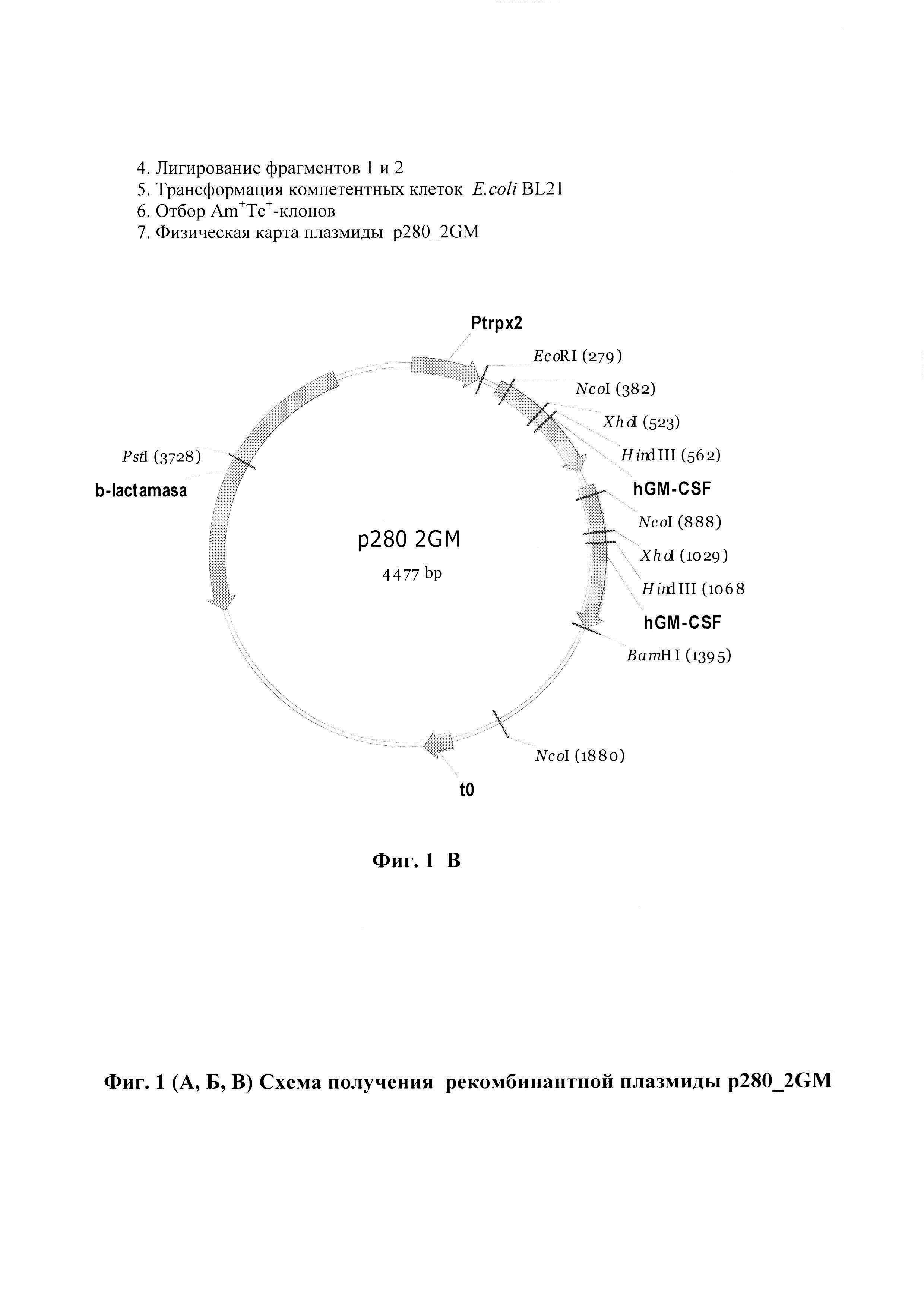
- PstI/BamHI(pol)-фрагмента ДНК плазмиды p280GM (1484 п.о.), содержащего С-концевую часть гена β-лактамазы, тандема промоторов триптофанового оперона E. coli и синтетического ген GM-CSF человека; EcoRI(pol)/PstI (2938 п.о.) - фрагмента той же плазмиды, содержащего синтетический ген GM-CSF человека и N- концевую часть гена β-лактамазы.
-содержит:
- тандем промоторов триптофанового оперона E. coli;
- две копии синтетического гена ГМ-КСФ человека;
- терминатор транскрипции t0 фага лямбда;
- в качестве генетического маркера ген β-лактамазы, детерминирующий устойчивость трансформированных плазмидой р280_2GM клеток E. coli к ампициллиновым антибиотикам;
- уникальные сайты узнавания рестрикционными эндонуклеазами, расположенными на следующих расстояниях вправо от сайта EcoRI (279 п.о.) - BamHI - 912 нуклеотидов; PstI - 3396 нуклеотидов.
Указанный технический результат достигается также получением штамма Esherichia coli SG20050/p280_2GM - продуцента полипептида со свойствами гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ) человека, депонированного в коллекции бактерий, бактериофагов и грибов ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора и имеющий регистрационный номер В-1369 (справка о депонировании прилагается).
Указанный технический результат достигается также способом получения рекомбинантного полипептида со свойствами ГМ-КСФ человека, характеризующимся тем, что он включает суспензионное культивирование на LB-бульоне с ампициллином, поддерживаемом в концентрации 100 мкг/мл, посевного материала рекомбинантного штамма Esherichia coli SG20050/p280_2GM, содержащегося в количестве 5% от объема питательной среды до наступления логарифмической фазы роста клеток, сбор клеток центрифугированием, их разрушение ультразвуком, повторное центрифугирование при 10000g с получением осадка в виде телец включения, содержащих денатурированный белок ГМ-КСФ человека и обломки клеточных стенок, отмывку телец включения растворами, содержащими ЭДТА и ионный детергент дезоксихалат натрия; экстракцию целевого полипептида раствором, содержащим мочевину и 2-меркаптоэтанол; последовательную хроматографическую очистку на ДЭАЭ-сефарозе, KM-сефарозе и Q-сефарозе с получением целевого белка рекомбинантного ГМ-КСФ человека.
Существенным отличием предложенной плазмидной конструкции от прототипа является дупликация синтетических генов ГМ-КСФ человека. Плазмида p280-2GМ депонирована в Коллекции бактерий, бактериофагов и грибов ФБУН ГНЦ ВБ ВЕКТОР Роспотребнадзора и имеет Коллекционный номер Р-166.
Для получения бактериального штамма-продуцента полипептида с биологической активностью ГМ-КСФ человека компетентные клетки E. coli SG20050 трансформируют полученной плазмидой p280_2GМ. Полученный таким образом штамм E. coli SG20050/p280_2GМ характеризуется следующими признаками:
Морфологические признаки. Клетки мелкие, утолщенной палочковидной формы, грамотрицательные, неспороносные.
Культуральные признаки. Клетки хорошо растут на простых питательных средах. При росте на агаре "Дифко" колонии круглые, гладкие, прижаты, мутные, блестящие серые, край ровный. При росте в жидких средах (на минимальной среде с глюкозой или LB-бульоне) образуют интенсивную ровную муть.
Физико-биологические признаки. Клетки растут при температуре от 4 до 40°C при оптимуме pH от 6,8 до 7,0. В качестве источника азота используют как минеральные соли в аммонийной форме, так и органические соединения в виде пептона, триптона, дрожжевого экстракта, аминокислот и т.д. В качестве источника углерода используют аминокислоты, глицерин, углеводы.
Устойчивость к антибиотикам. Клетки проявляют устойчивость к ампициллину (до 300 мкг/мл), обусловленную наличием плазмиды, а также к тетрациклину (до 50 мкг/мл), благодаря наличию транспозона в геноме штамма-реципиента. Существенными отличиями штамма E. coli SG20050/p280_2GМ является то, что на стадии получения трансформантов проводят отбор высокопродуктивных клонов; заявляемый штамм обусловливает конститутивный синтез полипептида со свойствами ГМ-КСФ человека, с уровнем синтеза 25-30% от суммарного клеточного белка, что более чем в 2 раза превосходит прототип.
Метод выделения целевого продукта состоит из дезинтеграции клеток, отмывки телец включения буферными растворами, солюбилизации целевого продукта из телец включения раствором 6М мочевины, денатурации с последующей ренатурацией целевого белка и его очистки при помощи хроматографий на ДЕАЕ-сефарозе и совмещенной хроматографией на КМ- и Q-сефарозе с последующим диализом высокоочищенного белка.
Предложенный способ позволяет обеспечить уровень синтеза ГМ-КСФ человека около 25 - 30% от суммарного белка при плотности 109 клеток/мл, и выход до 10 мг высокоочищенного целевого белка из 1 г влажных клеток, что в 1,5 - 2 раза выше, чем в способе-прототипе.
Перечень графических материалов.
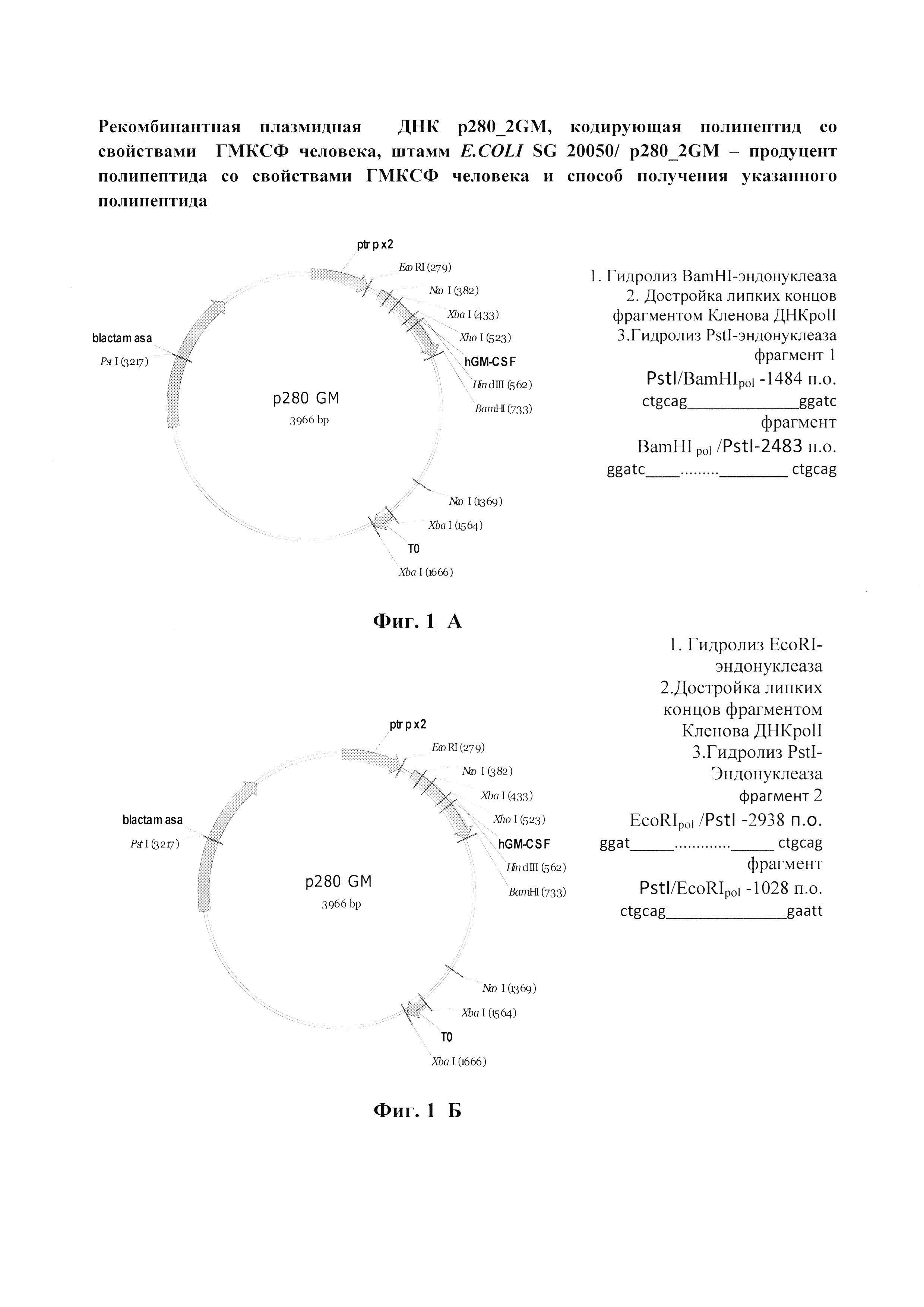
Фиг.1 (А, Б, В). Схема получения (фиг. 1, А и Б) и физическая карта (фиг. 1, В) рекомбинантной плазмиды p280_2GМ.
Фиг. 2. Первичная структура EcoRI/BamHI-фрагмента плазмиды p280_2GМ и кодируемая им аминокислотная последовательность.
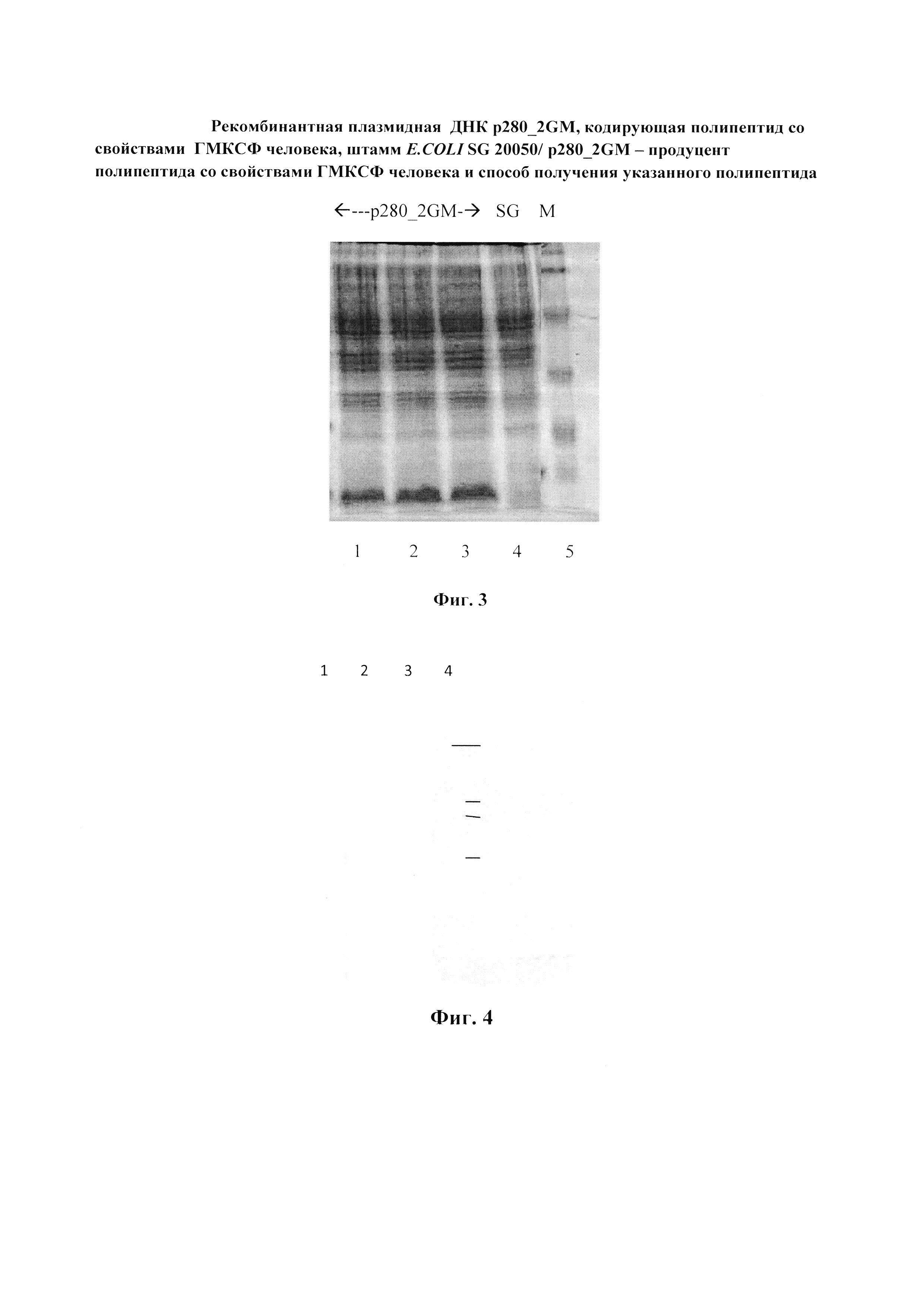
Фиг. 3. Электрофореграмма лизатов клеток E. coli SG20050/p280_2GМ в 15% ПААГ. Фракционирование в 15% ПААГ лизатов клеток E.coli SG20050, трансфецированных плазмидами: 1 - pIL2/6 (дегидрофолатредуктаза, 28 кДа и интерлейкин человека,17 кДа); 2-4 - p280_2GM (ГМ-КСФ человека, 16 кДа); 5 - E.coli SG20050; 6 - pmuTNF (TNF мыши, 18 кДа); 7 - маркер молекулярных масс белков (20, 25, 37, 50 кДа).
Фиг. 4. Вестерн-блот анализ рекомбинантного ГМ-КСФ (дорожки 1 - 3, 800, 80 и 8 нг). Окрашивание - 4-хлор-1нафтол. Дорожка 4 - маркер молекулярных масс белков Prestained SDS-PAGE Standarts (BIORAD). Обозначено положения маркеров 18.8, 27.8, 35.8, и 52.7 кДа.
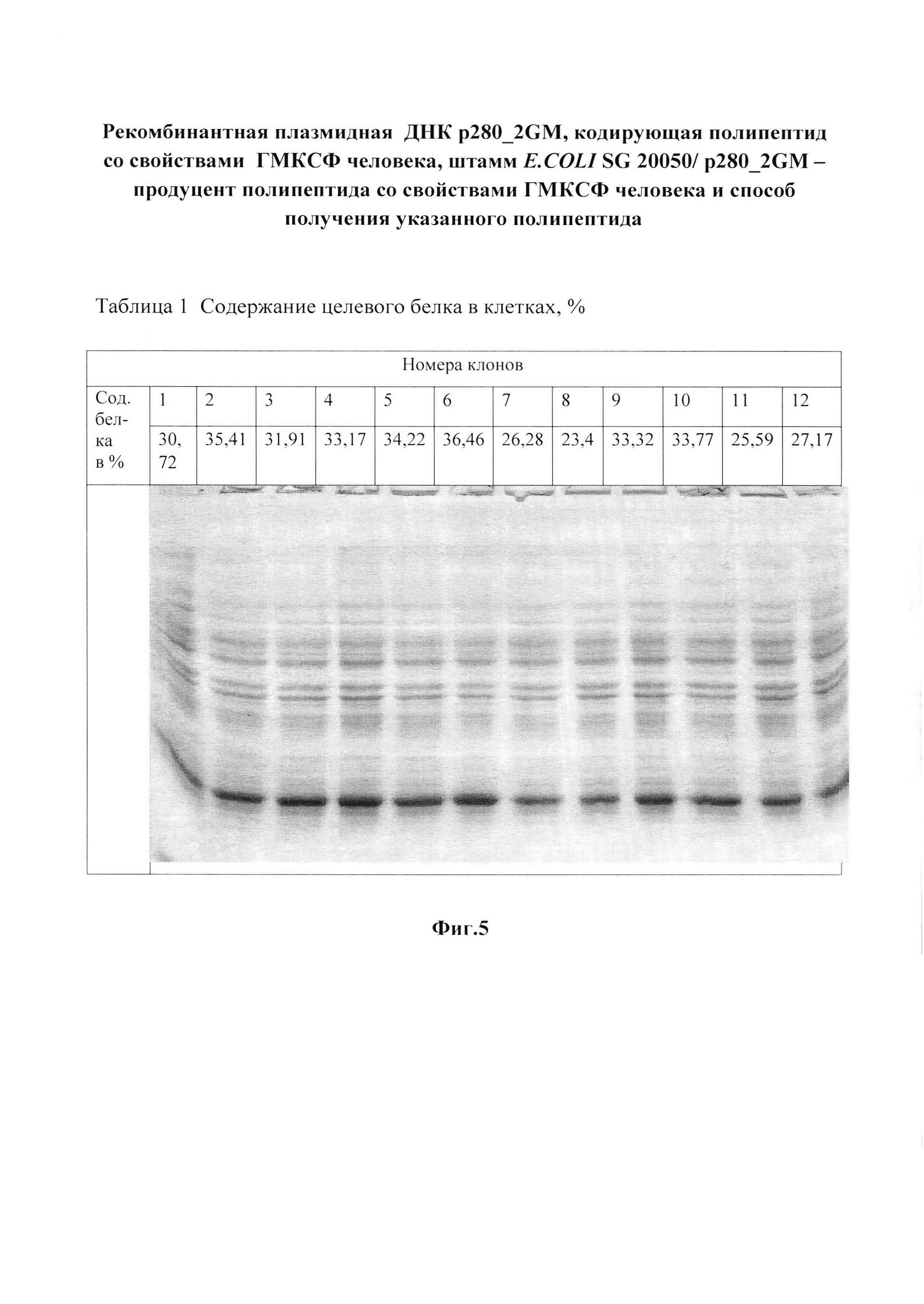
Фиг. 5 и таблица 1. Выбор наиболее продуктивных клонов трансформированных клеток и электрофореграмма лизатов этих клонов в 15%-ном ПААГ.
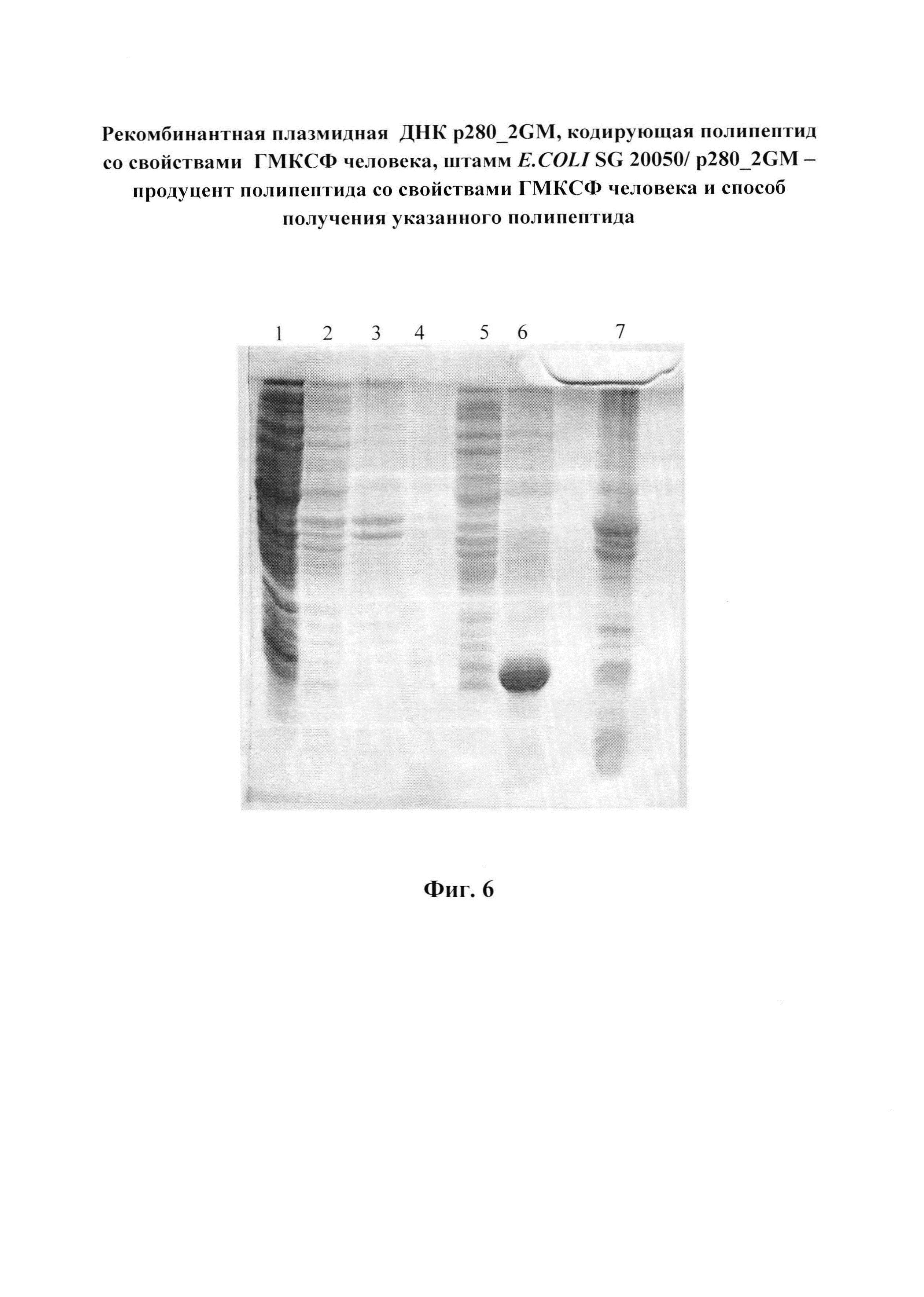
Фиг. 6. Электрофореграмма фракций получения телец включения в 15%-ом ПААГ. Дорожки: 1 - раствор после разрушения клеток; 2 - раствор отмывки №1; 3 - раствор отмывки №2; 4 - раствор отмывки №3; 5 - суммарный раствор отмывок; 6 - экстракт целевого белка из телец включения; 7 - состав конечного осадка после экстракции целевого белка.
Фиг. 7. Электрофореграмма образцов очищенного рекомбинантного белка ГМ-КСФ человека в 15%-ом ПААГ в денатурирующих условиях, с окрашиванием Кумасси R-250.
Фиг. 8. Электрофореграмма очищенного рекомбинантного белка ГМ-КСФ человека в 15%-ом ПААГ, дорожки: слева от маркеров - пробы без 2-меркаптоэтанола (нередуцирующие условия, 10 и 30 мкг на дорожку геля), справа - обработанные 2-меркаптоэтанолом (редуцирующие условия, 10 и 30 мкг на дорожку геля).
Ниже представлены примеры конкретного выполнения изобретения.
Пример 1. Конструирование рекомбинантной плазмиды p280-2GМ.
Клетки бактерий E. coli BL21, содержащие плазмидную ДНК p280GM [6], выращивают при 37°C в LB-бульоне, содержащем 100 мкг/мл ампициллина до стационарной фазы. Плазмидную ДНК выделяют в соответствии с процедурой, описанной в работе [7]. Полученный препарат плазмидной ДНК используют для конструирования плазмиды p280_2GM (фиг. 1, А, Б).
Составляют две реакционные смеси, каждая из которых содержит 10 мкг плазмидной ДНК p280GM в 30 мкл буфера Tango (Thermo Fisher Scientific), содержащего 33 мМ трис-ацетатpH 7.9 при 37°C, 10мМ ацетата магния, 66 мМ ацетата калия, 0.1 мг/мл БСА.
В реакционную смесь 1 добавляют 10 ед BamHI- эндонуклеазы, в реакционную смесь 2 добавляют о 10 ед EcoRI- эндонуклеазы, инкубируют в течение 1 ч при 37°C. После инкубации реакции останавливают двукратной экстракцией смесью фенол/хлороформ (1:1), ДНК осаждают 70% этанолом. Осадки растворяют в 24 мкл H2O. Анализ полноты гидролиза проводят при помощи электрофореза в 1%-ном геле агарозы (Sigma, США). Достройку «липких концов» фрагментов p280GM/BamHI и p280GM/EcoRI проводят в 30 мкл буфера, содержащего 50 mM Tris-HCl pH 7.6, 10 mM MgCl2, 5 mM DTT, в реакционную смесь добавляют 0,2 мл 25 мМ dNTP и 1 мкл фрагмента Кленова DNA-pol I (Thermo Fisher Scientific). Реакционные смеси инкубируют при комнатной температуре 15 мин. Реакции останавливают прогреванием при 87°С и двукратной экстракцией смесью фенол/флороформ (1:1). ДНК осаждают 70% этанолом. Растворяют в 30 мкл буфера Tango (Thermo Fisher Scientific). В реакционные смеси 1 и 2 добавляют по 10 ед. PstI- эндонуклеазы и инкубируют в течение 1 ч при 37°C и разделение фрагментов PstI /BamHIpol (1484) и BamHI pol /PstI(2483), а также EcoRIpol /PstI (2938) и PstI/EcoRIpol (1028) проводят электрофорезом в 1%-ном геле агарозы (Sigma, США). Фрагменты PstI/BamHIpol (1484) (фрагмент 1) и EcoRIpol /PstI (2938) (фрагмент 2) вырезают из агарозного геля и ДНК экстрагируют с помощью набора QIAquick Mini Columns (Qiagen, Германия). Фрагмент 1 (1мкг) и фрагмент 2 (0,4 мкг) лигируют с помощью 30 ед. ДНК лигазы фага Т4 в 50 мкл буфера L (200 мМ трисHCl, pH7.6, 50мМ MgCL2, 50 мМ ДТТ в течение 15 ч при 15°C и реакционную смесь используют для трансформации компетентных клеток E. coli BL21. Трансформанты высевают на агаризованную среду, содержащую ампициллин (100 мкг/мл) и полученные таким образом отдельные колонии выращивают при 37°C в LB-бульоне, содержащем 100 мкг/мл ампициллина, до стационарной фазы. Затем плазмидную ДНК выделяют в соответствии с процедурой, описанной в работе [7] и анализируют с помощью эндонуклеазы рестрикции HaeIII. Из клонов, содержащий встроенный фрагмент, выделяют плазмидную ДНК, строение которой (фиг. 1, Б) подтверждают прямым определением нуклеотидной последовательности ДНК в районе встройки с помощью метода терминации синтезируемой цепи на автоматическом секвенаторе ABM PRISM™ (Perkin Elmer, США). На фиг. 2 представлена первичная структура EcoRI/BamHI-фрагмента плазмиды p280-2GМ и кодируемая им аминокислотная последовательность.
Пример 2. Получение штамма-продуцента полипептида со свойствами ГМ-КСФ человека. Плазмидой p280_2GM трансформируют компетентные клетки E. coli SG20050 и высевают в питательную среду, содержащую ампициллин в концентрации 100 мкг/мл и тетрациклин в концентрации 25 мкг/мл. Amr- и Tcr- трансформанты представляют клетки штамма E. coli SG20050/p280-2GМ - продуцента полипептида со свойствами ГМ-КСФ человека.
Пример 3. Вестернблот-анализ. Клетки E. coli SG20050 и SG20050/p280_2GМ выращивают при 37°C в 20 мл LB-бульона в течение 20 ч на качалке при скорости вращения 120 об/мин, отбирают пробу объемом 1 мл и клетки центрифугируют 10 мин при 10000 об/мин. Клетки суспендируют в 100 мкл буфера, содержащего 125 мМ Трис-NCl, pH 6.8, 20% глицерин, 3% SDS, 3% меркаптоэтанол, 0.005% бромфеноловый синий, нагревают 10 мин на кипящей водяной бане и охлаждают во льду. 10 мкл образцов подвергают электрофорезу в 15,0% SDS-ПААГ (фиг. 3). По окончании электрофореза белки переносят на нитроцеллюлозные фильтры (Schleicher @ Schuel HAWP 293 23 HA 0,45 mm) с помощью прибора для переноса белков на нитроцеллюлозные мембраны (BioRAD, США). После окончания переноса фильтр инкубируют в течение ночи в буфере PBS (10 мМ калийфосфатный буфер, pH 7.2, 150 мМ NaCl), содержащем 3% (весовая концентрация) БСА при 4°C. После блокировки неспецифических сайтов связывания раствором БСА, фильтры инкубируют в течение 2-3 ч с поликлональными антителами к ГМ-КСФ (Sigma, США), разведенными PBS до концентрации 5 мкг/мл. После инкубации фильтры тщательно промываются в PBS, содержащем 0,1% твин-20, и добавляют коньюгат пероксидазы хрена с антителами второго порядка (BioRad, США), инкубируют не менее 1 ч при комнатной температуре. Для окраски фильтра 50 мг 4-хлор-1-нафтол, растворенного в 1 мл этанола, разводят 1:100 PBS и добавляют 30%-ный пероксид водорода до концентрации 0.006%. После появления окрашивания фильтр промывают PBS, высушивают и хранят в темноте. По данным вестерн-блот-анализа (фиг. 4) единственный полипептид, реагирующий с антителами к человеческому ГМ-КСФ (Sigma, США), это полипептид с молекулярной массой около 16 кД, детерминируемый плазмидой p280_2GМ.
Пример 4. Определение биологической активности.
Клетки E. coli SG20050/p280-2GМ получают как в примере 2. Их суспендируют в 20 мл буфера (10% сахароза, 0.1 М трис-HCl, pH 7.5, 5 мМ Na2EDTA) и разрушают ультразвуком на установке Soniprep 150 (MSE). Полученный лизат стерилизуют ультрафильтрацией через фильтры 0.45 мкм CA/CN (Sigma, США). Активность ГМ-КСФ определяют, используя метод клонирования гемопоетических предшественников в полутвердых агаровых культурах [8]. Мононуклеары получают из крови гематологически здоровых доноров разделением в градиенте плотности фикол-верографина (Sigma, США). Клетки в концентрации 5⋅105 на лунку планшета культивируют в метил-целлюлозной культуре (MethoCult H 4230, Stem Cell Technology, Канада) в планшетах для культур тканей (Sigma, США; 24 wells/plate) с добавлением стерильных лизатов клеток E. coli SG20050/p280_2GМ и исходного штамма E. coli SG20050. Подсчет количества колоний проводят на 7-е сутки. По данным определения биологической активности лизат клеток E. coli SG20050/p280GM стимулирует образование колоний клеток- предшественников макрофагов и гранулоцитов; спонтанного колониеобразования (при добавлении лизатов клеток E. coli SG20050) не происходит.
Пример 5. Получение трансформированных клеток, отбор высокопродуктивных клонов и выращивание их в жидкой селективной среде.
Трансформацию компетентных клеток E. coli SG20050 плазмидной ДНК p280_2GМ проводят кальциевым методом [9]. Суспензию клеток высевают на агаризованную питательную среду, содержащую ампициллин в концентрации 100 мкг/мл. Выросшие колонии трансформированных клеток засевают отдельными секторами на агаризованную среду. Содержание рекомбинантного ГМ-КСФ определяют по отношению к суммарному клеточному белку. Клетки суспендируют в 200 мкл буфера, содержащего 125 мМ Трис-HCl, pH 6,8; 20% глицерин; 3% SDS; 3% меркаптоэтанол; 0,005% бромфеноловый синий, нагревают 10 мин на кипящей водяной бане и охлаждают во льду. Образцы (2, 5 и 10 мкл) подвергают электрофорезу в 12% SDS-ПААГ. По окончании электрофореза гель промывают 10%-ным раствором трихлоруксусной кислоты и прокрашивают при помощи кумасси R-250. После отмывки избытка красителя гель сканируют при 550 нм, используя лазерный сканиметр UltroScan XL (LKB, Швеция). Отбор высокопродуктивных клонов проводят, анализируя аликвоты электрофорезом в ПААГ с последующим сканированием и обработкой данных в программе GelPro3.1.
Клоны с наибольшим содержанием целевого белка (клоны №2, 5, 6, фиг. 5 и таблица 1) используют для получения инокулята. Как видно из таблицы 1, процентное содержание Apr клеток в посевном материале колеблется от 60 до 85%.
Пример 6. Получение посевного материала и ферментация.
Наиболее высокопродуктивные клоны клеток подращивают в L-бульоне, содержащем 100 мкг/мл ампициллина при 36°C до середины логарифмической фазы роста (Д550 = 0.5-0.6), затем вносят антибиотик до концентрации 500 мкг/мл и продолжают инкубацию 2-3 часа.
Для анализа влияния повышенных концентраций ампициллина одинаковые аликвоты культуры высевали на чашки с агаризованной средой с ампициллином и без него. Через 18 ч роста при 36°C подсчитывали выросшие колонии. Процент плазмидсодержащих клеток рассчитывали делением числа колоний, выросших на среде с антибиотиком на число колоний, выросших без селективного давления (без ампициллина). Полученные данные представлены в таблице 2.
Таблица 2. Содержание Ap - резистентных клеток в посевном материале до и после обработки его ампициллином.
|
Как видно из таблицы 2, инкубация клеток с добавлением в среду ампициллина до концентрации 500 мкг/мл позволяет повышать процентное содержание Apr клеток в посевном материале до 90-96%.
Ферментацию проводят в лабораторных ферментерах вместимостью 15 л с объемом питательной среды 10 л, оснащенных системами измерения и регулирования температуры, скорости вращения мешалки и подачи воздуха для аэрации. Скорость вращения мешалки в ферментере от 100 до 200 об/мин, подача воздуха 1.0 л/мин на 1 л среды. Для засева используют посевной материал, полученный, как описано в примере 3. В ферментер со стерильной питательной средой LB, содержащей ампициллин в концентрации 100 мкг/мл, вносят посевной материал в количестве, составляющем 5% от объема питательной среды. Время ферментации 11-12 ч. В процессе ферментации в питательную среду дробно добавляют ампициллин (до 100 мкг/мл). Эффект добавления демонстрируется результатами таблицы 3.
Таблица 3. Содержание плазмидсодержащих клеток (Apr) популяции в ходе ферментации E. coli 20050/p280_2GM.
|
Заканчивают ферментацию в конце логарифмической фазы роста. Культуральную жидкость охлаждают до 5-10°C, клетки собирают центрифугированием и хранят при температуре -70°C.
Содержание целевого белка в образцах биомасс составляло 30 %. Накопление полипептида ГМ-КСФ составляет при этом 90-120 мг на 1 литр питательной среды.
Пример 7. Разрушение клеток E. coli SG20050/p280_2GM и получение телец включения.
10 г влажных клеток штамма-продуцента E. coli SG20050/p280_2GM
суспендируют в 100 мл буферного раствора: 10 мМ трис-HCl, рН 8.0, содержащего 1 мМ фенилметилсульфонилфторид (ингибитор протеиназ). Суспензию помещают в ледяную баню и стенки клеток разрушают при помощи ультразвука до снижения оптической плотности при длине волны 550 нм на 40-45% от ее исходного значения. Затем центрифугируют при 10000g в течение 30 мин при температуре 4°С. Осадок представляет собой тельца включения, содержащие денатурированный рекомбинантный ГМ-КСФ человека и обломки клеточных стенок. Надосадочная жидкость, полученная после центрифугирования разрушенных клеток, не содержит целевого белка (фиг. 6, дорожка 1).
Пример 8. Отмывка телец включения
Тела включения, полученные в примере 7, ресуспендируют в 50 мл буфера, содержащего 10 мМ трис-HCl, рН 8.0 и 5 мМ ЭДТА и повторно центрифугируют при 10000g в течение 30 мин при температуре 4°С.
Полученный осадок ресуспендируют в 50 мл буфера, содержащего 10 мМ трис-HCl, рН 8.0 и 0.1 - 0.5%-ый детергент тритон Х-100 в течение 15-20 мин и центрифугируют при 10000g в течение 30 мин при температуре 4°С.
Полученный осадок вновь ресуспендируют в 50 мл буфера, содержащего 10 мМ трис-HCl, рН 8.0 в течение 15-20 мин и центрифугируют при 10000g в течение 30 мин при температуре 4°С.
Как видно на электрофореграмме (фиг. 6), растворы, используемые для отмывки телец включения, целевого белка не содержат (дорожки 1-4),
Пример 9. Экстракция рекомбинантного ГМ-КСФ человека из телец включения в буферный раствор, содержащий 6М мочевину.
Осадок телец включения, полученный в примере 8, суспендируют в 50 мл буфера, содержащего 10 мМ трис-HCl, рН 8.0 и 6 М мочевину до гомогенности и перемешивают в течение 2ч. Затем центрифугируют при 20000g в течение 50 мин при температуре 4°С. Собирают надосадочный раствор, содержащий целевой белок (фиг. 6, дорожка 5), который практически полностью экстрагируется в буферный раствор, содержащий 6М мочевину, при значении рН 8,0 (фиг. 6, дорожка 7). Чистота белка достигает 70 -75 %.
Пример 10. Денатурация рекомбинантного ГМ-КСФ человека.
В полученный экстракт добавляют буферный раствор, содержащий 10 мМ трис-HCl, рН 8.0 и 6 М мочевину до конечной концентрации белка 1-2 мг/мл. Для разрыва неправильных дисульфидных связей к раствору добавляют 2-меркаптоэтанол до конечной концентрации 20 мМ. Инкубируют в течение 18-20 ч при комнатной температуре 18-20°С.
Пример 11. Ренатурация рекомбинантного ГМ-КСФ человека.
К раствору денатурированного (восстановленного) белка, полученному в примере 10, добавляют 9 объемов 10 мМ раствора трис-HCl, рН 8.0, содержащего 5 мМ ЭДТА, охлажденного до (6±2)°С. Полученную смесь выдерживают при температуре (6±2)°С в течение (24±2) часов.
Пример 12. Хроматография рекомбинантного ГМ-КСФ человека на анионообменном сорбенте ДЭАЭ-сефароза при значении.
Раствор ренатурированного белка, полученный в примере 11, центрифугируют (10000g в течение 30 мин при температуре 4°C). Надосадочную жидкость разбавляют в два раза 10 мМ трис-HCl, рН 8.0, и наносят на колонку (50 мл) с анионообменным сорбентом (ДЭАЭ-сефароза), уравновешенную тем же буфером. После нанесения раствора ренатурированного белка колонку промывают буфером, содержащим 10 мМ трис-HCl, рН 8.0. Белки, связавшиеся с сорбентом, элюируют градиентом концентрации хлористого натрия от 0 до 1 М NaCI в 10 мМ трис-HCl, рН 8.0. Целевой продукт (ГМ-КСФ) сорбируется и элюируется с колонки при достижении концентрации соли в буфере 0.2 - 0.3 М. Фракции с Д280 > 0.25 о.е. анализируют электрофорезом в денатурирующих условиях в 15% ПААГ. Фракции, содержащие целевой белок, объединяют и диализуют против 1 л буфера 10 мМ трис-HCl, рН 8.0.
Пример 13. Хроматография рекомбинантного ГМ-КСФ человека на сорбентах КМ-сефароза и Q-сефароза.
Раствор белка, полученный в примере 12, наносят на соединенные последовательно колонки с катиоонообменным (КМ-сефароза, 25 мл) и анионообменным (Q-сефароза, 10 мл) сорбентами, уравновешенными 10 мМ трис-HCl, рН 8.0. После нанесения колонки промывают буфером 10 мМ трис-HCl, рН 8.0. Затем отсоединяют колонку с сорбентом КМ-сефароза а белки, связавшиеся с сорбентом Q-сефароза, элюируют линейном градиентом 0→1 М NaCI в буфере 10 мМ трис-HCl, рН 8.0. Фракции с Д280 > 0.25 о.е. анализируют электрофорезо в денатурирующих условиях в 15% ПААГ и содержащие рекомбинантный белок ГМ-КСФ человека объединяют и диализуют. Диализ ведут против буфера, содержащего 10 мМ трис-HCl, рН 8.0 и 50 мМ NaCl. Полученный раствор белка подвергают стерилизующей фильтрации через фильтры с размером пор 0.22 мкм и хранят при - (18-20)°C. Суммарные данные по очистке и выходу целевого продукта из 10 г биомассы приведены в таблице 4.
Таблица 4. Материальный баланс и выход белка (субстанции) рекомбинантного ГМ-КСФ человека в процессе очистки из 10 г клеток E. coli 20050/p280_2GM.
|
Выход целевого высокоочищенного белка составляет около 10 мг из 1 г влажных клеток.
Пример 14. Определение чистоты и гомогенности препарата субстанции.
Чистоту и гомогенность субстанции ГМ-КСФ человека определяли методом электрофореза в полиакриламидном геле. По данными электрофореза при нагрузке белка 10 или 40 мкг на дорожку при окрашивании геля красителем Кумасси R-250 на электрофореграмме (фиг.7) выявляется одна основная полоса с молекулярной массой 14.7-15.7 кДа. Содержание мономерной формы субстанции ГМ-КСФ с молекулярной массой (15.2±0.5) кДа в редуцирующих условиях при окрашивании красителем Кумасси R-250 составляло не менее 97-98%.
Пример 15. Определение правильности образования внутримолекулярных S-S связей в молекулах субстанции рекомбинантного ГМ-КСФ человека.
Перед проведением электрофорез в 15%-ом ПААГ образцы субстанции обрабатывали додецилсульфатом натрия или додецилсульфатом натрия совместно с 2-меркаптоэтанолом. На фиг. 8 представлены результаты электрофоретического разделения в 15%-ом ПААГ полученных таким образом образцов, где на дорожки слева от маркеров нанесены пробы без обработки 2-меркаптоэтанолом (10 и 30 мкг), справа - обработанные перед нанесением на гель 2-меркаптоэтанолом (10 и 30 мкг). Электрофоретическая подвижность образцов субстанции, обработанных 2-меркаптоэтанолом, снижается за счет «расплетения» молекул, тогда как без обработки 2-меркаптоэтанолом молекулы имеют замкнутые внутримолекулярные дисульфидные связи, обеспечивающие большую электрофоретическую подвижность. Гомогенность полос субстанции электрофореграммы свидетельствует, что все молекулы белка в процессе ренатурации образуют правильно замкнутые дисульфидные связи.
Источники патентной и научно-технической информации
1. Wong G.G., Witek J.S., Temple P.A., et al. Human GM-CSF: Molecular cloning of the complementary DNA and purification of the natural and recombinant proteins (1985). Science. V. 228 (4701). P. 810-815.
2. Miyajima A., Otsu К., Schreurs J., et al. Expression of murine and human GM-CSF in S. cerevisiae: mutagenesis of the potential glycosvlation sites (1986). EMBO J. V. 5(6). P. 1193-1197.
3. Libby R.T., Braedt G., Kronheim S.R., et al. Expression and purification of native human granulocyte-macrophage colony-stimulating factor from an e. coli secretion vector (1987). DNA. V. 6(3). P. 221-229.
4. Международная заявка №WO87/02060 "Human granulocyte-macrophage colony stimulating factor-like polypeptides and process for producing them in high yields in microbial cells", C12N 15/00, опубликовано РЖ ИСМ N 1, 88.2)
5. Патент РФ № 2271392, МПК C12N15/27, опубл. 10.03.2006 г.
6. Патент РФ №2091488, МПК С12N1/21, опубл. 10.02.1996 г. (прототип).
7. Birnboim H.C. and Doly J. (1979) A rapid alkaline extraction procedure for screening recombinant plasmid DNA. Nucleic. Acids. Res. V. 7. P. 1513 -1523.
8. Топоркова Л.Б.. Орловская И.А., Сенников С.В. и др. (2009). Иммунология. №4. С. 203-205.
9. Mandel M., HigaA. Calcium-dependent bacteriophage DNA infection (1970) J. Mol. Biol. V. 53. P/159-162.