Результат интеллектуальной деятельности: Способ прогнозирования скорости роста культуры по количеству альдегиддегидрогеназа-положительных мезенхимальных клеток костного мозга доноров
Вид РИД
Изобретение
Способ экспансии мезенхимальных клеток костного мозга донора, отличающийся тем, что определяют количество альдегиддегидрогеназа-положительных мезенхимальных клеток и проводят нормирование плотности их пересева на единицу площади культуральных флаконов, где плотность посева составляет более 500 альдегиддегидрогеназа-положительных клеток на см2. Указанная плотность посева позволят сократить время удвоения культуры до 59,3±12,1 ч, а время достижения конфлюэнтного монослоя - до 9,3±1,0 суток.
Изобретение относится к области медицины и биотехнологии и касается оптимизации скорости роста культур мезенхимальных клеток стромы донорского костного мозга. Устанавливаются значимые количественные величины, характеризующие время удвоения культуры МСК на протяжении первых трех пассажей.
С учетом увеличения областей применения стволовых клеток перед исследователями достаточно остро стоит проблема получения в короткий временной период требуемого количества мезенхимальных клеток с низкой гетерогенностью и высокой жизнеспособностью, поскольку именно такие клетки необходимы для решения практических задач регенеративной медицины. Мезенхимальные стромальные клетки (МСК) могут быть выделены из различных тканей. Они представляют собой малочисленную популяцию клеток, характеризующихся большим пролиферативным потенциалом, способных к самоподдержанию с сохранением недифференцированного состояния, а также обладающих возможностью дифференцироваться в различные клеточные типы под действием определенных стимулов.
Изобретение обеспечивает повышение точности процесса экспансии МСК за счет использования экспериментально установленных контрольных количественных параметров - количества клеток, имеющих активность альдегиддегидрогеназы (АЛДГ). Изобретение относится к медицине, в частности к лабораторной технологии, и может быть использовано в процессе получения биомедицинских клеточных продуктов (БМКП).
Биомедицинский клеточный продукт (БМКП) представляет собой клеточную линию в сочетании со вспомогательными веществами либо фармацевтическими субстанциями и (или) медицинскими изделиями. Клеточная линия представляет собой популяцию однородных клеток с воспроизводимым составом, полученную путем изоляции из организма человека биологического материала с последующим культивированием ex vivo и предназначенную для использования при разработке БМКП, а также доклинических исследованиях или производстве [1]. В зависимости от индивидуальных особенностей доноров, костный мозг которых был использован в качестве источника МСК, ростовые свойства культуры (скорость роста, время удвоения числа клеток) существенно различаются. Единых методических подходов к прогнозированию скорости роста культуры МСК и сроков получения БКМП, в настоящее время в мире и РФ не разработано.
Известен способ оценки пролиферативного потенциала МСК, основанный на определении их клоногенной способности, т.е. определения количества клеток, способных образовывать клон [2]. Клоногенный потенциал культивируемой клеточной культуры зависит от возраста и пола донора костного мозга, а также значительно снижается с увеличением количества пассажей. Недостатками данного способа являются невозможность прогнозирования скорости роста полученной культуры клеток, стандартизации, трудность воспроизведения в серийной постановке.
Вторым аналогом заявляемого способа оптимизации скорости роста культур МСК является способ, основанный на регистрации уровня теломеразной активности в клетках [3]. Известно, что чем больше делений проходит клетка в культуре, тем сильнее укорочение теломер ее хромосом [4, 5]. Известно, что в быстро делящихся клетках процесс укорочения теломер компенсируется увеличением уровня экспрессии и активности данного фермента. Чем выше способность клетки к делению (что характерно для клеток с высокой скоростью деления), тем больше уровень экспрессии и активности теломеразы [6]. Способ-прототип основан на сравнении теломеразной активности в клетках «нулевого» пассажа и клетках в составе БМКП и (или) подлежащих к включению в состав БМКП. Недостатками данного способа являются отсутствие количественных критериев, позволяющих точно судить об уровне теломеразной активности, отсутствие стандартов активности и как следствие - низкая стандартизация данного метода лабораторного анализа, низкая воспроизводимость и высокая трудоемкость исследования.
В качестве прототипа нами использована работа М. Najar et al. [7]. Существенным недостатком прототипа является то, что не показана взаимозависимость между количеством АЛДГ-положительных клеток, вносимых в культуру, и динамикой роста клеток.
Предлагаемое изобретение направлено на разработку способа экспансии мезенхимальных клеток костного мозга донора, отличающегося определением количества вносимых в культуру (взятых на посев) клеток, обладающих активностью фермента АЛДГ. Экспрессия указанного фермента высока в жизнеспособных стволовых клетках различных линий, включая мезенхимальные. Характерной особенностью стволовых клеток является способность к самоподдержанию их популяции. Чем большее количество стволовых элементов вносится в культуру, тем быстрее происходит прирост числа клеток, т.е. тем выше скорость роста культуры. Установлена взаимосвязь между количеством МСК, положительных по активности АЛДГ, и временем удвоения культуры.
ПРИМЕР ИСПОЛЬЗОВАНИЯ СРЕДСТВА
Способ осуществляют следующим образом. Объектом исследования являются мезенхимальные клетки стромы костного мозга, полученные в результате культивирования. МСК выделяли из костного мозга доноров, эксфузированного при стандартной операции миелоэксфузии. Выделение ядерных клеток костного мозга осуществляли путем фракционирования на градиенте плотности «Lympholyte» (ρ=1,077 при температуре 22°С, производство Cedarlane Laboratories Limited). МСК культивировали в полной питательной среде, включавшей в себя следующие компоненты: среду αМЕМ (StemCells), богатую тромбоцитами плазму (4%), гепарин (Sigma, 2 Ед/мл), L-глутамин 2 мМ (StemCells). МСК культивировали в CO2-инкубаторе Sanyo-5АС при содержании 5% углекислого газа при температуре 37°С. Полную замену среды производили каждые 4-5 сут. После формирования конфлюэнтного монослоя клетки обрабатывали раствором «Трипсин-ЭДТА», затем ингибировали действие фермента, добавляя избыток полной питательной среды. Жизнеспособные клетки подсчитывали в камере Горяева с использованием красителя трипанового синего и рассаживали по флаконам из расчета 1500 мезенхимальных клеток на см2. Определяли время достижения культурой конфлюэнтного монослоя (степень покрытия флакона 90-95%) и время удвоения клеток. Время удвоения рассчитывали по формуле:
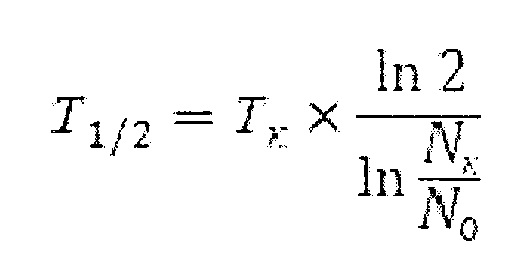
где T1/2 - время удвоения;
Тк - длительность культивирования (в часах);
Nк - количество полученных клеток;
N0 - количество посеянных клеток.
Количество клеток, положительных по активности АЛДГ, определяли путем лазерной проточной цитометрии с использованием набора реагентов AldefluorTM Kit (Stemcell Technologies) согласно протоколу производителя. Рассчитывали количество клеток, обладающих активностью АЛДГ, вносимых в культуру (абсолютное и нормированное на единицу площади культурального флакона).
ЭКСПЕРИМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
Экспериментальные исследования выполнены на базе лабораторий клеточных технологий и клеточной и молекулярной иммунологии ФГБУН КНИИГиПК ФМБА России. Исследованы 12 образцов мезенхимальных клеток, полученных из костного мозга 5 доноров. Результаты представлены в таблице 1.
Рассчитывали статистический показатель - коэффициент корреляции Пирсона между количеством АЛДГ-положительных клеток, внесенных в культуру, и временем удвоения клеток на данном пассаже (r=-0,67), коэффициент корреляции между количеством АЛДГ-положительных клеток, нормированным на единицу площади культурального флакона и временем удвоения культуры (r=-0,44), а также коэффициент корреляции между количеством АЛДГ-положительных клеток, нормированным на единицу площади культурального флакона и временем достижения клетками конфлюэнтного монослоя (r=-0,61).
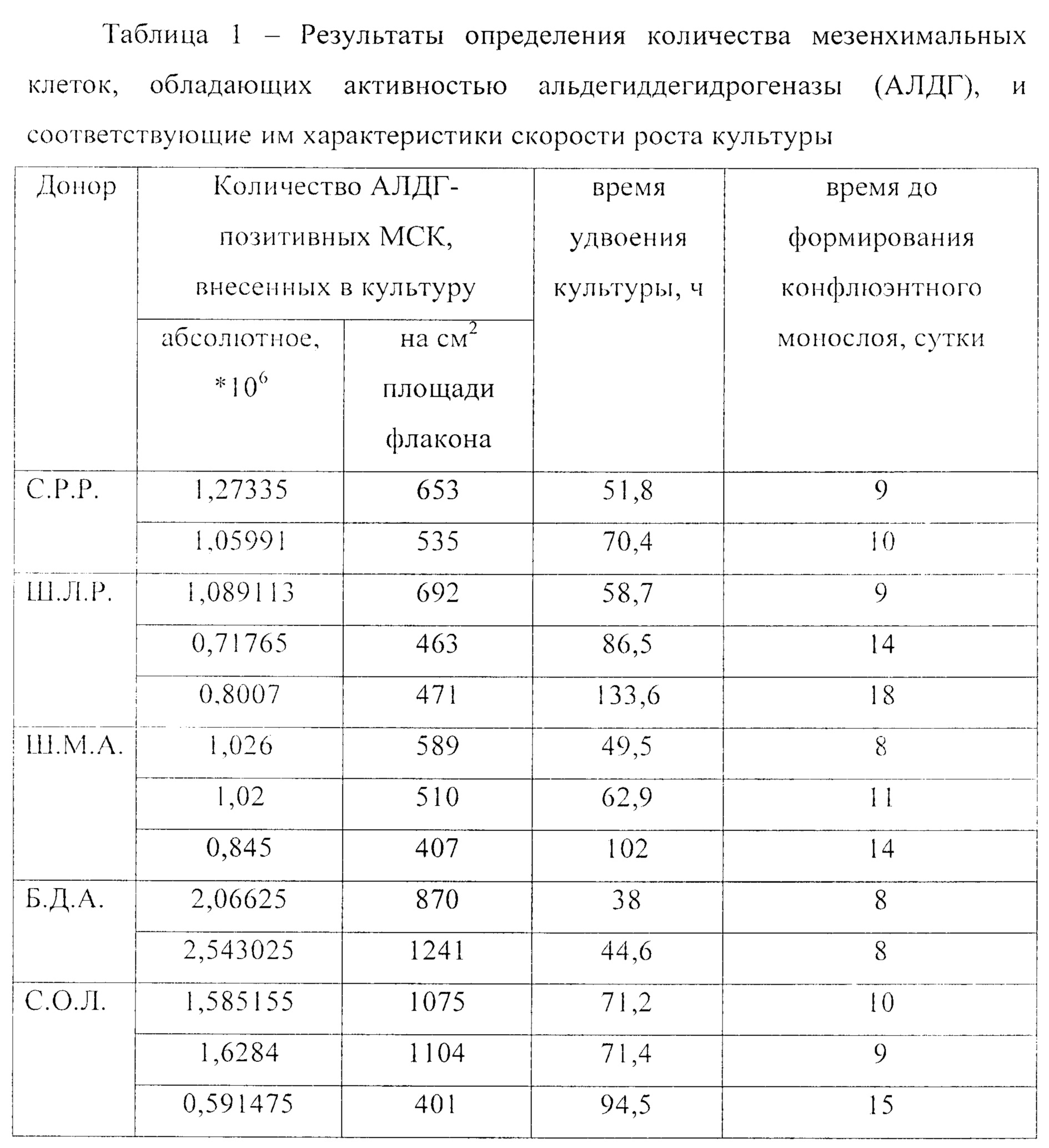
Сделан вывод, что чем большее количество АЛДГ-положительных клеток вносят в культуру, тем меньше время удвоения (т.е. выше скорость роста), и культура быстрее достигает стадии 90-95% покрытия культуральной поверхности.
Результаты определения параметров скорости роста культур МСК (время удвоения клеток и сроки достижения конфлуэнтного монослоя) в зависимости от плотности посева, нормированной по количеству АЛДГ-позитивных клеток, приведены в таблице 2.

Из данных, приведенных в таблице 2, следует, что расчет плотности посева по количеству мезенхимальных клеток, позитивных по АЛДГ, позволяет достичь технического результата - повышения точности производства БМКП. Рекомендуемая плотность посева АЛДГ-положительных мезенхимальных клеток - более 500 в расчете на квадратный сантиметр площади флакона, что позволяет сократить время удвоения культуры со 104,2±20,6 до 59,2±12,1 часов, а сроки сроки достижения 90-95% конфлюэнтности - с 15,3±1,9 до 9,1±1,1 суток. Указанные различия статистически достоверны (p<0,05).
Новизна данного технического решения заключается в использовании количественных величин, характеризующих число клеток с активностью АЛДГ, и сопоставление их с показателем скорости роста культуры - временем удвоения числа клеток и временем достижения клетками конфлюэнтного монослоя.
Литература
1. Федеральный закон "О биомедицинских клеточных продуктах" от 23.06.2016 N 180-ФЗ
2. Жиронкина О.А. Пролиферативный потенциал мультипотентных мезенхимальных стромальных клеток, выделенных из костного мозга человека / Жиронкина О.А., Шипунова И.Н., Бигильдеев А.Е., [с соавт.] // Клеточные технологии в биологии и медицине. - 2011. - №4. - С. 230-235.
3. Telomere and telomerase biology / Giardini M.A., Segatto M., daSilva M.S. [et al.] II Progress in molecular biology and translational science. - 2014. - Vol. 125. - PP. 1-40.
4. Production of mesenchymal stromal stem cells according to good manufacturing practices: a review / Sensebe L. [et al.] // Stem Cell Research and Therapy. - 2013. - Vol. 4. - PP. 66-71.
5. Development and characterization of a clinically compliant xenofree culture medium in good manufacturing practice for human mutipotent mesenchymal stem cells / Chase L.G. [et al.] // Stem cells translational medicine. - 2012. - Vol. 1. - PP. 750-758.
6. Теломераза: методы определения активности / Скворцов Д.А., Зверева М.Э., Шпапченко О.В., Донцова О.А. // Acta Naturae - 2011. - Т. 3, №1. - С. 51-73.
7. Aldehyde dehydrogenase activity in adipose tissue: isolation and gene expression profile of distinct sub-population of mesenchymal stromal cells / M. Najar, E. Crompot, L. Л. van Grunsven [et al.] // Stem cell reviews and reports. - 2018. - Vol. 14. - PP. 599-611.
Способ экспансии мезенхимальных клеток костного мозга донора, отличающийся тем, что определяют количество альдегиддегидрогеназа-положительных мезенхимальных клеток и проводят нормирование плотности их пересева на единицу площади культуральных флаконов, где плотность посева составляет более 500 альдегиддегидрогеназа-положительных клеток на см.
