Результат интеллектуальной деятельности: ПЕПТИД НИКОМИЦИН ИЗ МОРСКОГО КОЛЬЧАТОГО ЧЕРВЯ NICOMACHE MINOR, ОБЛАДАЮЩИЙ АНТИМИКРОБНЫМ И ПРОТИВООПУХОЛЕВЫМ ДЕЙСТВИЕМ.
Вид РИД
Изобретение
Изобретение относится к области биотехнологии и может быть использовано в медицине и ветеринарии. Пептид никомицин, обладающий антимикробным действием, имеет следующую аминокислотную последовательность: Gly1-Phe2-Trp3-Ser4-Ser5-Val6-Trp7-Asp8-Gly9-Ala10-Lys11-Asn12-Val13-Gly14-Thr15-Ala16-
Ile17-Ile18-Lys19-Asn20-Ala21-Lys22-Val23-Cys24-Val25-Tyr26-Ala27-Val28-Cys29-Val30-Ser31-His32-Lys33.
Антимикробные пептиды (АМП) являются одними из главных молекулярных компонентов системы врожденного иммунитета и защиты от патогенов. Чаще всего АМП обладают мембранотропным механизмом действия, что позволяет им быстро уничтожать патогенные организмы и препятствует формированию резистентности к антибиотикам. Кроме того, некоторые АМП способны ингибировать ряд метаболических процессов путём взаимодействия с внутриклеточными мишенями [Graf M. et al. Proline-rich antimicrobial peptides targeting protein synthesis // Natural Product Reports. 2017. V. 34. No. 7. P. 702-711.]. Это позволяет рассматривать данные вещества в качестве основы для конструирования антимикробных препаратов с принципиально новыми механизмами действия в рамках борьбы с проблемами мульти- и кросс-резистентности бактериальных штаммов к конвенциальным антибиотикам.
Морские беспозвоночные животные не имеют системы приобретенного иммунитета, основанного на образовании антител. Эти организмы живут в насыщенной микробами среде, и их основная система защиты от патогенов основана на АМП. Одним из наиболее интересных, но при этом слабо изученных классов в отношении АМП являются морские кольчатые многощетинковые черви - полихеты. К настоящему времени АМП были идентифицированы в нескольких видах полихет: β-шпилечные ареницины из Arenicola marina [Ovchinnikova T.V. et al. Purification and primary structure of two isoforms of arenicin, a novel antimicrobial peptide from marine polychaeta Arenicola marina / FEBS Letters. 2004. V. 577. No. 1-2. P. 209-214.], перинерин из Perinereis aibuhitensis [Pan W. Perinerin, a novel antimicrobial peptide purified from the clamworm Perinereis aibuhitensis grube and its partial characterization / Journal of Biochemistry. 2004. V. 135. No. 3. P. 297-304.], α-спиральный гедистин из Nereis diversicolor [Tasiemski A. et al. Hedistin: a novel antimicrobial peptide containing bromotryptophan constitutively expressed in the NK cells-like of the marine annelid, Nereis diversicolor / Developmental & Comparative Immunology. 2007. V. 31. No. 8. P. 749-762.] и β-шпилечный альвинеллацин из Alvinella pompejana [Tasiemski A. et al. Characterization and function of the first antibiotic isolated from a vent organism: the extremophile metazoan Alvinella pompejana / PloS One. 2014. V. 9. No. 4. P. e95737.]. Эти АМП преимущественно экспрессируются в целомоцитах и активно участвуют в формировании иммунного ответа.
Последовательность, кодирующая пептид никомицин, была установлена методом секвенирования амплифицированных по технологии RACE молекул кДНК, выделенных из природного источника - морского кольчатого червя (Nicomache minor), принадлежащего к семейству Maldanidae, классу Polychaeta, типу Annelida. Поисковые работы описаны в публикации [Panteleev P.V. et al. Novel antimicrobial peptides from the Arctic polychaeta Nicomache minor provide new molecular insight into biological role of the BRICHOS domain / Marine Drugs. 2018. V. 16. No. 11. P. 401.]. Заявляемый пептид никомицин обладает уникальной среди АМП полихет пространственной структурой, включающей α-спиральную N-концевую часть и неструктурированную С-концевую часть, несущую петлю из 6 аминокислотных остатков, стабилизированную дисульфидным мостиком. Такая структура напоминает характерную для защитных пептидов амфибий структуру с мотивом «Rana-box», но в отличие от этих пептидов в петле никомицина нет положительно заряженных остатков. [Haney E.F., Hunter H.N., Matsuzaki K., Vogel H.J. Solution NMR studies of amphibian antimicrobial peptides: linking structure to function? / / Biochimica et Biophysica Acta (BBA) - Biomembranes. 2009. V. 1788. No. 8. P. 1639-1655.]. Пептид состоит из 33 аминокислотных остатков, включая 2 остатка цистеина, образующих одну дисульфидную связь, и имеет молекулярную массу 3539,13 Да.
Изобретение решает задачу расширения арсенала пептидов, обладающих антимикробным действием и способных служить основой для создания новых антибиотических соединений. Поставленная задача решается за счет структуры пептида никомицина из морского кольчатого червя Nicomache minor, имеющего аминокислотную последовательность SEQ ID No. 1. Заявляемый пептид проявляет антибактериальную активность в отношении ряда грамположительных (в том числе Staphylococcus aureus, Bacillus subtilis, Micrococcus luteus) и грамотрицательных (Escherichia coli, Pseudomonas aeruginosa) бактерий, причем бактерицидный эффект in vitro достигается при действии в микромолярных концентрациях. Заявляемый пептид характеризуется невысоким уровнем гемолитической активности (HC50>64 мкМ). Техническим результатом изобретения является высокая антибактериальная активность заявляемого пептида в отношении грамположительных и грамотрицательных бактерий, а также противоопухолевая активность in vitro. Заявляемый пептид не требует осуществления посттрансляционных модификаций (за исключением образования дисульфидной связи), что делает предпочтительным его биотехнологическое получение в бактериальной системе. Заявляемый пептид может быть получен путём гетерологической экспрессии в бактериальной системе на основе Е. coli, а также с помощью химического синтеза.
Изобретение иллюстрируют графические материалы:
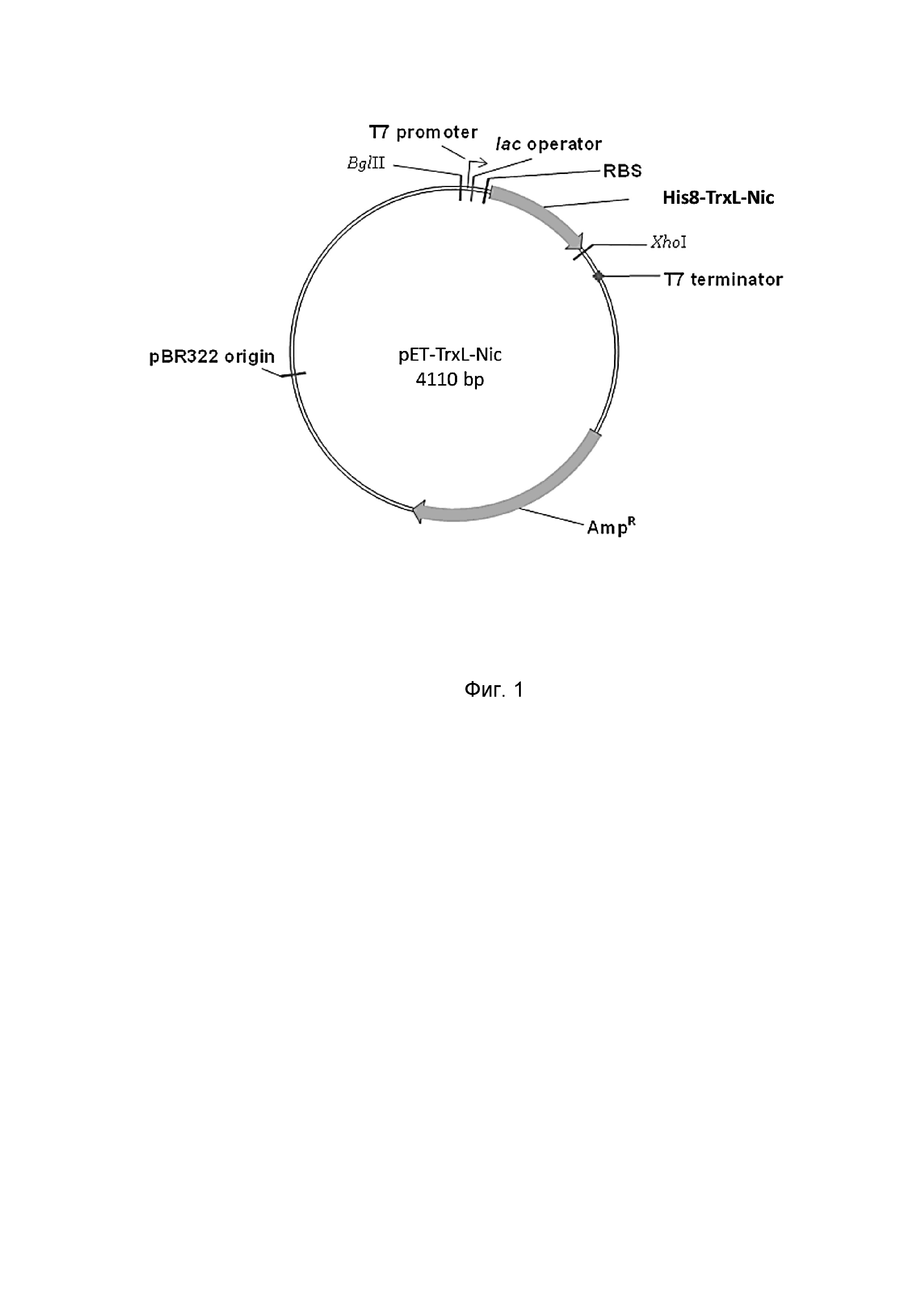
Фиг. 1. Физическая карта плазмидного вектора для экспрессии никомицина: BglII, XhoI - сайты рестрикции с указанием координат; pBR322 origin - участок инициации репликации; T7 terminator - терминатор транскрипции; AmpR - ген устойчивости к β-лактамным антибиотикам; RBS - сайт связывания рибосомы; T7 promoter - промотор транскрипции; lac operator - сайт связывания lac-репрессора; His8-TrxL-Nic - последовательность, кодирующая гибридный белок, содержащий целевой пептид.
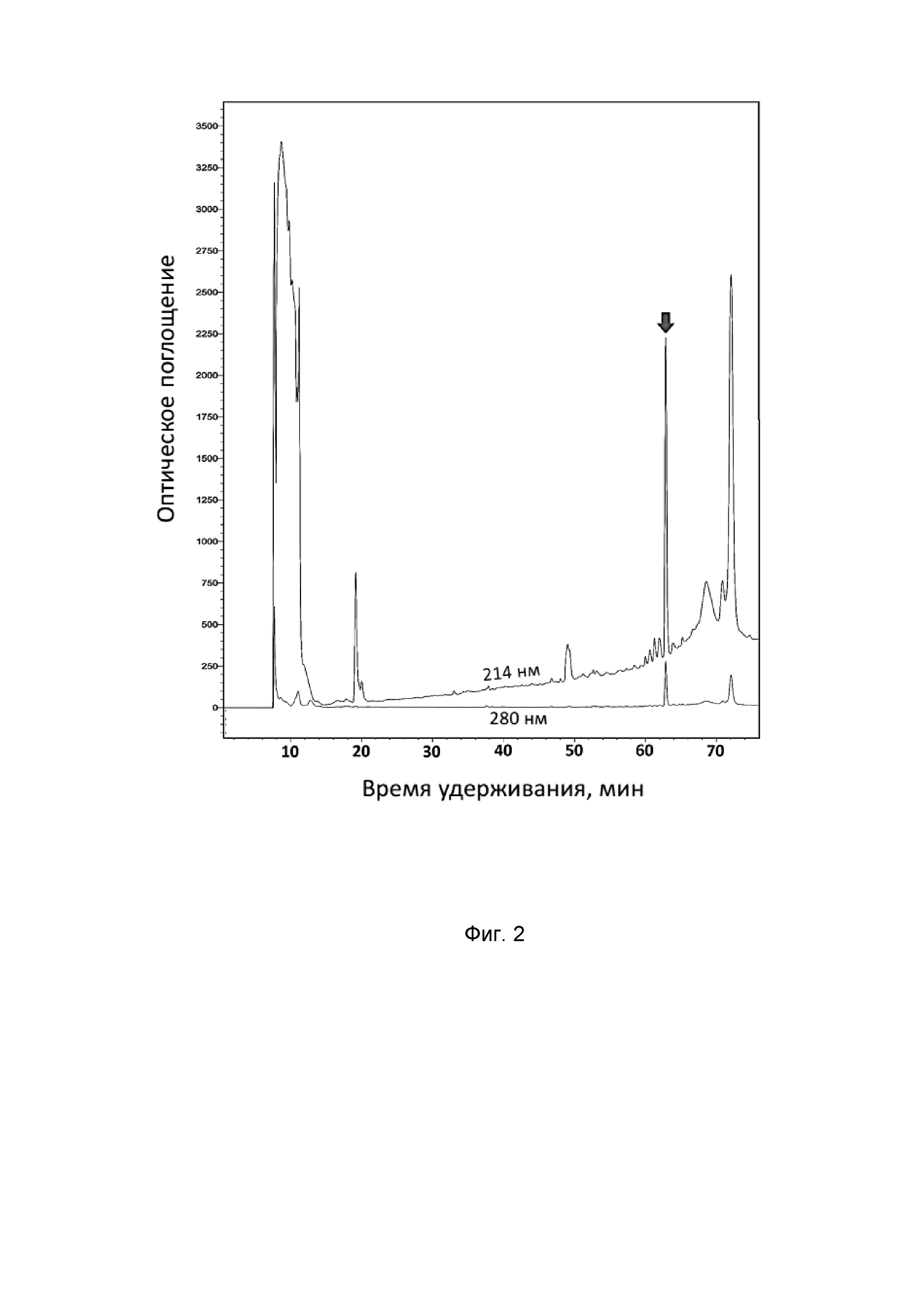
Фиг. 2. Хроматограмма очистки рекомбинантного никомицина (SEQ ID No. 1) методом обращенно-фазовой ВЭЖХ. Пик, соответствующий целевому пептиду, отмечен стрелкой.
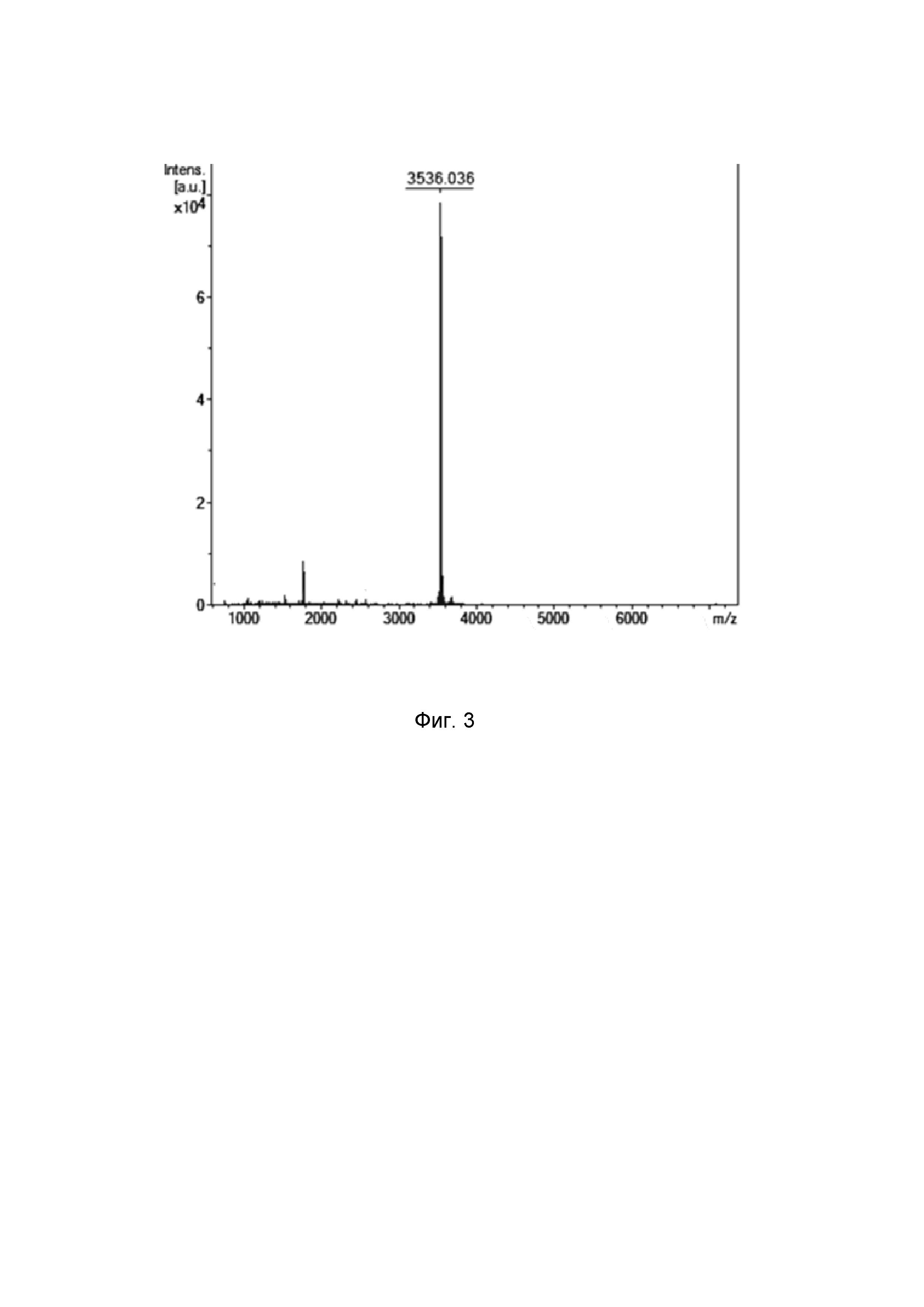
Фиг. 3. МАЛДИ масс-спектр рекомбинантного никомицина (SEQ ID No. 1), полученного генно-инженерным способом.
Фиг. 4. Спектры кругового дихроизма никомицина (SEQ ID No. 1).
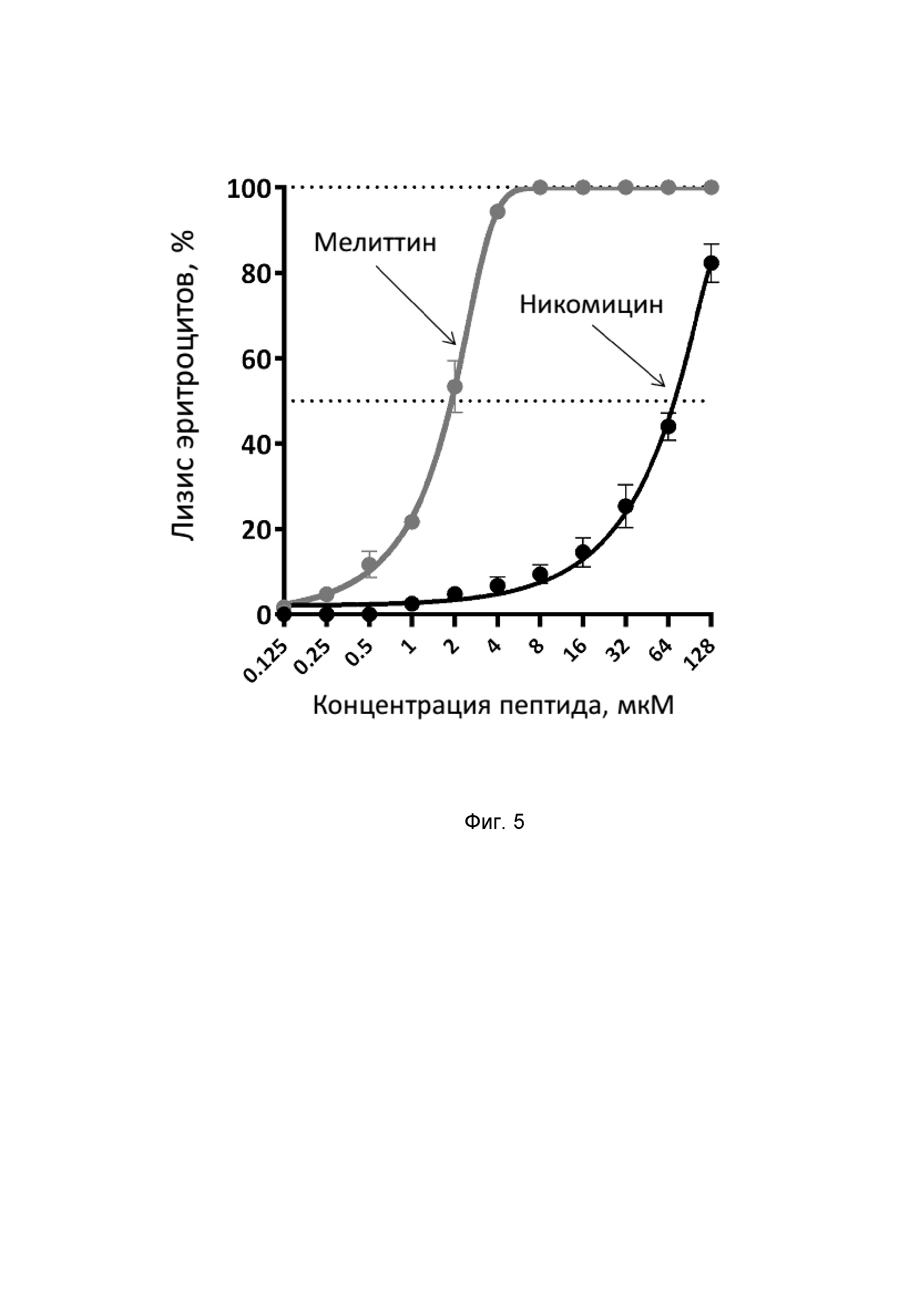
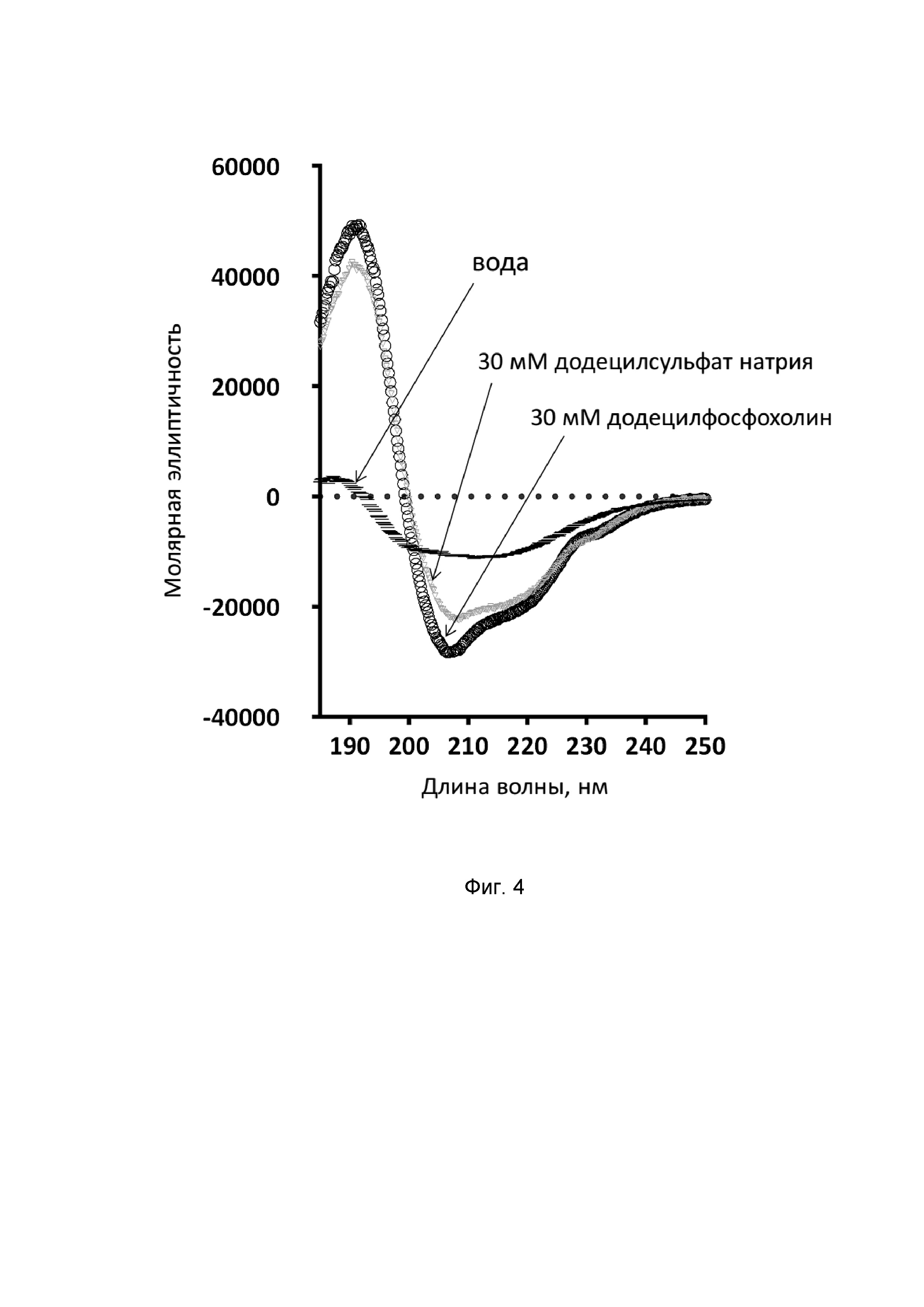
Фиг. 5. Гемолитическая активность никомицина (SEQ ID No. 1) и мелиттина (SEQ ID No. 4) в отношении человеческих эритроцитов.
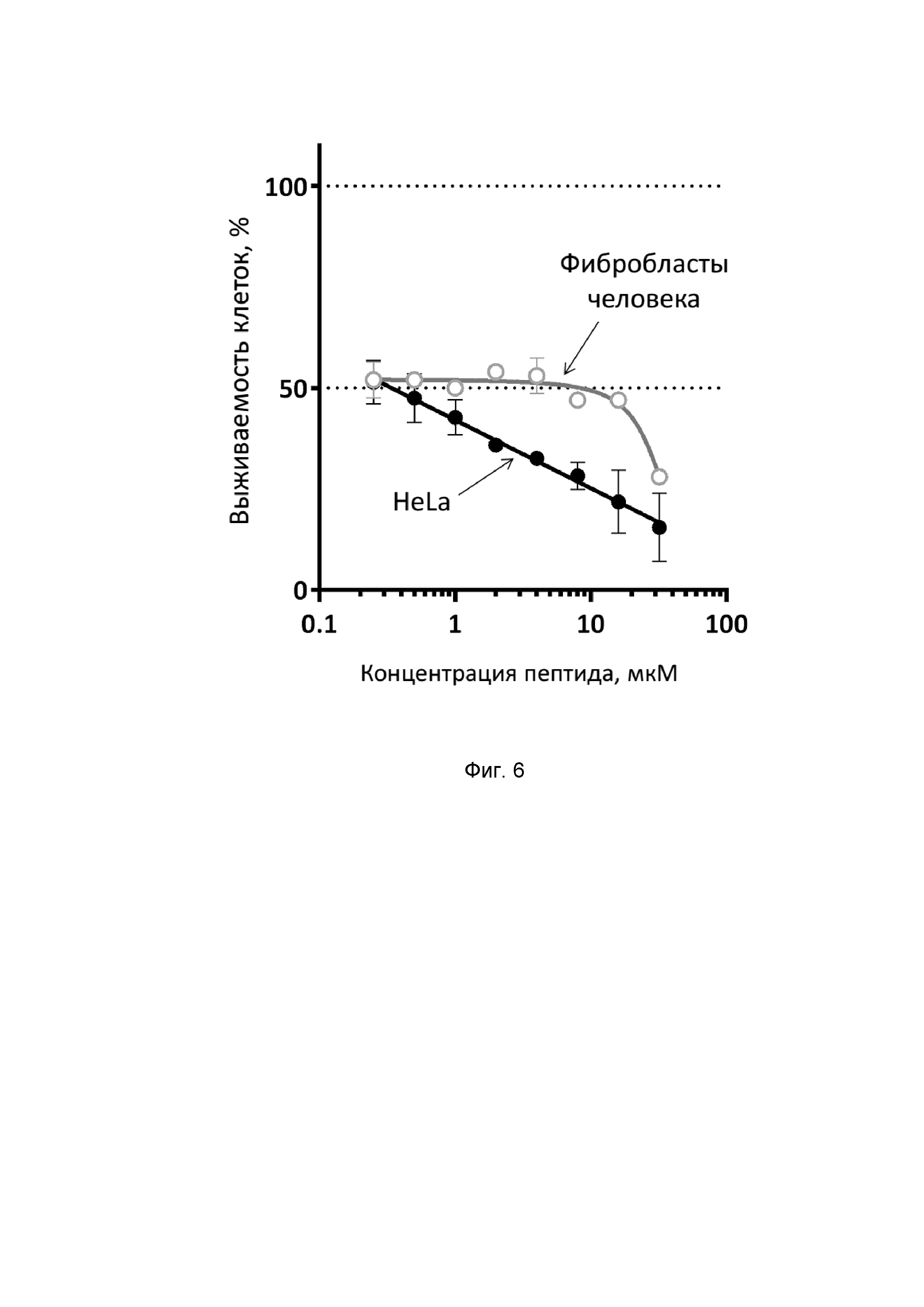
Фиг. 6. Цитотоксическая активность никомицина (SEQ ID No. 1) в отношении адгезионных клеточных линий человека.
Изобретение иллюстрируют примеры
Пример 1.
Получение плазмидной конструкции для гетерологической экспрессии никомицина в составе гибридного белка
Нуклеотидную последовательность SEQ ID No. 2, содержащую промотор транскрипции Т7 РНК-полимеразы, lac оператор, участок связывания рибосомы и участок, кодирующий гибридный полипептид (последовательно связанные гистидиновый октамер, тиоредоксин с заменой M37L, сайт расщепления бромцианом и аминокислотную последовательность никомицина), получают химико-ферментативным синтезом с помощью ПЦР. Олигонуклеотиды, используемые в ПЦР, синтезируют твердофазным фосфорамидитным методом с наращиванием олигонуклеотидной цепи в направлении от 3'-конца к 5'-концу с помощью защищенных фосфорамидитов - 5'-диметокситритил-N-ацил-2'-дезоксинуклеозид-3'-O-(β-цианэтилдиизопропиламино)-фосфитов, активированных тетразолом. Фрагмент ДНК, кодирующий белок-носитель тиоредоксин (M37L), получают методом ПЦР-амплификации и направленного мутагенеза с помощью ген-специфических праймеров, используя в качестве исходной матрицы плазмиду pET32a(+), содержащую ген тиоредоксина. Фрагмент ДНК, кодирующий никомицин, получают с помощью ПЦР с использованием в качестве матрицы кДНК морского кольчатого червя Nicomache minor. Остальные участки последовательности pET-TrxL-Nic получают путем последовательного отжига и элонгации взаимно перекрывающихся олигонуклеотидов. На завершающей стадии синтеза последовательность амплифицируют с помощью праймеров, несущих на 5'-концах сайты узнавания рестриктаз BglII и XhoI. Продукт амплификации гидролизуют указанными рестриктазами, очищают электрофорезом в 1% агарозном геле, целевую полосу ДНК выделяют из геля с помощью колонки с силикагелем и лигируют с фрагментом ДНК размером 3,5 тыс. п.н., полученным в результате обработки плазмиды pET-20b(+) рестриктазами BglII и XhoI. В результате лигазной реакции получают кольцевую ковалентно замкнутую ДНК размером 4110 п.н. (Фиг. 1). Продуктами лигазной реакции трансформируют компетентные клетки E. coli DH10B, приготовленные с помощью 0,1 М хлорида кальция. После трансформации суспензию бактерий смешивают с питательной средой LB, растят 60 мин при 37°C и высевают на чашки Петри с LB-агаром, содержащим 100 мкг/мл ампициллина.
Первичный отбор клонов, содержащих нужную плазмиду, осуществляют методом «ПЦР с клонов». Отобранные клоны подращивают в жидкой питательной среде и выделяют плазмидную ДНК, которую анализируют на наличие вставки с помощью секвенирования по Сэнгеру. По данным секвенирования отбирают плазмиду со вставкой, нуклеотидная последовательность которой полностью соответствует запланированной (SEQ ID No. 2).
Пример 2.
Получение рекомбинантного никомицина
Проводят трансформацию компетентных клеток E. coli BL21(DE3), приготовленных с помощью 0,1 М хлорида кальция, плазмидным вектором, сборка которого описана в примере 1. После трансформации суспензию бактерий смешивают с питательной средой LB, растят 1 ч при 37°C и высевают на чашки Петри с LB-агаром, содержащим 100 мкг/мл ампициллина и 0,02 М глюкозы. Чашки инкубируют при 37°C в течение 18 ч.
Бактериологической петлей переносят выросшие колонии в 10 мл жидкой среды LB, содержащей 100 мкг/мл ампициллина, растят в течение 18 ч на термостатируемой качалке со скоростью вращения 220 об•мин-1 при температуре 37°C. Полученную культуру засевают в жидкую питательную среду LB, содержащую 0,02 М глюкозы, 100 мкг/мл ампициллина, 1 мМ MgSO4 и 0,1 мМ CaCl2. При этом начальная OD600 составляет 0,05. Индукцию биосинтеза гибридного белка осуществляют путем добавления изопропилтио-β-D-галактопиранозида (IPTG) к культуре клеток с оптической плотностью 1,0 до конечной концентрации 0,3 мМ. Культуру растят в течение 5 ч при температуре 32°С на термостатируемой качалке со скоростью вращения 220 об•мин-1. После экспрессии клетки осаждают центрифугированием, ресуспендируют в фосфатном буфере (pH 7,8) с добавлением 6М гуанидина гидрохлорида и 20 мМ имидазола при помощи стеклянного гомогенизатора Поттера и разрушают путем ультразвуковой обработки. Лизат клеток центрифугируют при 25000 g в течение 40 мин. Все работы по получению осветленного лизата проводят при температуре 4°С. Очистку гибридного белка, содержащего в качестве аффинной метки октагистидиновую последовательность, осуществляют с помощью металлохелатной хроматографии на препаративной колонке с Ni-NTA агарозой в денатурирующих условиях. Элюцию проводят повышением концентрации имидазола в буфере до 0,5 М. Собранную после очистки с помощью металлохелатной хроматографии фракцию, содержащую гибридный белок, титруют концентрированной соляной кислотой до значения pH 1,0, после чего добавляют бромциан (1 г бромциана на 1 г белка) и выдерживают при температуре 25°С в защищенном от света месте в течение 20 ч. Реакцию останавливают добавлением пятикратного объема деионизированной воды, после чего упаривают образцы на вакуумной центрифуге до исходного объёма раствора и титруют до нейтральных значений pH. Финальную стадию очистки пептида проводят методом обращенно-фазовой ВЭЖХ (ОФ-ВЭЖХ) на колонке Reprosil-Pur C18-AQ в системе водных буферов, содержащих ацетонитрил и 0,1% ТФУ. Разделение происходит в линейном градиенте ацетонитрила от 5% до 80% за 60 мин. Выход полипептидов детектируют по изменению оптического поглощения при двух длинах волн: 214 и 280 нм (Фиг. 2). Концентрацию водного раствора очищенного рекомбинантного никомицина определяют методом спектрофотометрии по поглощению при 280 нм на основе расчётных коэффициентов экстинкции.
Пример 3.
Определение молекулярной массы никомицина
Соответствие относительной молекулярной массы полученного рекомбинантного пептида расчетному значению, а также индивидуальность очищенного вещества подтверждают с помощью масс-спектрометрического анализа на приборе Reflex III (Bruker Daltonics), оснащенном УФ-лазером с длиной волны 336 нм, с регистрацией положительных ионов в рефлекторном режиме. В качестве матрицы используют 2,5- дигидроксибензойную кислоту в смеси, содержащей 20% ацетонитрил и 0,1% трифторуксусную кислоту. Расчётная [M+H]+ моноизотопная молекулярная масса, соответствующая аминокислотной последовательности никомицина-1 (3537,8 Да), превышает измеренное значение m/z 3536,0 (Фиг. 3) на ~2 Да, что указывает на образование дисульфидной связи между остатками Cys24 и Cys29 и отсутствие каких-либо других модификаций.
Пример 4.
Получение спектров кругового дихроизма пептида
Спектры кругового дихроизма (КД) измеряют с помощью спектрополяриметра J-810 (Jasco) в кювете с длиной оптического пути 0,01 см в диапазоне длин волн 190-250 нм с шагом 1 нм. Конформацию пептида исследуют в тридистиллированной воде, а также в мицеллах детергентов - 30 мМ додецилсульфата натрия и 30 мМ додецилфосфохолина. Анализ полученных спектров (Фиг. 4) показывает, что в водной среде никомицин не склонен к образованию упорядоченной структуры, а в мембраноимитирующей среде пептид имеет преимущественно α-спиральную конформацию, что подтверждается наличием характерного спектра (макс. 190 нм, мин. 205 и 220 нм) и в целом распространено среди мембраноактивных катионных АМП.
Пример 5.
Установление антибактериальных свойств
Антибактериальную активность никомицина определяют методом двукратных серийных разведений в 96-луночных планшетах в жидкой питательной среде LB с добавлением NaCl или без него и инкубации с грамположительными (Staphylococcus aureus 209P, Staphylococcus aureus ATCC 29213, Bacillus subtilis B-886, Bacillus licheniformis VK21, Micrococcus luteus B-1314, Rhodococcus sp. SS1) или грамотрицательными (Escherichia coli BL21 (DE3), Escherichia coli ML35, Escherichia coli C600, Pseudomonas aeruginosa PAO1) бактериальными тестовыми культурами. В качестве антибактериального соединения сравнения используют α-спиральный антимикробный пептид мелиттин. Тест-культуры высевают из консерва в 10 мл жидкой среды LB без антибиотика и растят в течение 18 ч при 37°С и 220 об⋅мин-1. После этого аликвоту культуры объёмом 300 мкл добавляют к 6 мл среды LB и инкубируют в термостатируемой качалке при 37°С до достижения культурой оптической плотности OD600 1,0. Далее методом последовательных разведений в бессолевой питательной среде LB титруют тестовые культуры до концентрации 2×105 КОЕ/мл. Аликвоты тест-культуры объемом 50 мкл добавляют к 50 мкл растворов пептидов, предварительно разведенных от 32 до 0,0156 мкМ в пересчёте на конечную концентрацию в лунке. После добавления культуры планшет инкубируют в течение 24 ч при 37°С и интенсивном перемешивании (1000 об•мин-1). Значения минимальных ингибирующих концентраций (МИК) определяются визуально и спектрофотометрически как минимальные концентрации пептидов, при которых отсутствует рост культуры. Эксперименты проводятся трижды в трехкратной повторности, причем итоговый МИК рассчитывается как медиана девяти полученных значений. Полученные данные представлены в Таблице 1. Никомицин (SEQ ID No. 1) проявлял высокую антимикробную активность в отношении грамположительных бактерий, сходную с таковой у α-спирального катионного пептида мелиттина (SEQ ID No. 4). В то же время, активность никомицина против грамотрицательных бактерий менее выражена и, по крайней мере, в 2 ÷ 4 раза ниже, чем у мелиттина.
Таблица 1. Антибактериальная активность никомицина (SEQ ID No. 1) и мелиттина (SEQ ID No. 4).
|
Пример 6.
Тестирование гемолитической активности
Для тестирования гемолитической активности пептида используют свежевыделенные человеческие эритроциты. Для предотвращения свертывания к цельной крови добавляют цитратный буфер (pH 5,6). Кровь центрифугируют в растворе фиколла и урографина плотностью 1,077 г/мл в течение 15 мин при 1500 об•мин-1. Фракцию эритроцитов отбирают со дна и трижды промывают двадцатью объемами изотонического натрий-фосфатного буфера (pH 7,4), последовательно осаждая эритроциты путем центрифугирования при 2000 об•мин-1 в течение 10 мин. После отмывки готовят 8% суспензию эритроцитов в изотоническом натрий-фосфатном буфере.
Для теста в 96-луночном планшете готовят серии двойных разведений исследуемого пептида от 128 до 0,125 мкМ (в пересчете на конечную концентрацию) объёмом 50 мкл. После этого к раствору пептида добавляют по 50 мкл 8% суспензии эритроцитов. Планшет инкубируют в течение 1,5 ч при 37°С и перемешивании при 1000 об•мин-1. После инкубации планшеты центрифугируют в течение 15 мин при 3000 об•мин-1 для осаждения интактных эритроцитов. Далее аликвоты супернатанта переносят в другой планшет для измерения количества свободного гемоглобина. Определение количества гемоглобина в растворе осуществляют по поглощению раствора при 405 нм. В качестве отрицательного контроля (K-) используют супернатант, полученный после центрифугирования эритроцитов, инкубировавшихся в растворе натрий-фосфатного буфера без добавления пептидов. В качестве положительного контроля (K+) используют супернатант, полученный после центрифугирования эритроцитов, инкубировавшихся в 0,1% водном растворе неионогенного детергента Triton X-100, вызывающего их полный лизис. Эксперименты проводят дважды с кровью одного и того же человека в трехкратной повторности. Процент гемолиза рассчитывают по формуле:
Гемолиз (%) = (OD405 пробы - OD405 «K-»)×100%/(OD405 «K+» - OD405 «K-»)
В отличие от контрольного пептида мелиттина (SEQ ID No. 4), который является сильным цитолитиком, пептид никомицин (SEQ ID No. 1) обладает умеренной гемолитической активностью и вызывает лизис 50% эритроцитов лишь при концентрации около 64 мкМ (Фиг. 5).
Пример 7.
Тестирование цитотоксического действия никомицина
Тестирование цитотоксического действия никомицина в отношении адгезионных клеточных линий проводят с помощью МТТ-теста. Методика основана на способности дегидрогеназ живых клеток восстанавливать 3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-2H-тетразолий бромид (МТТ-реагент) до нерастворимого в воде фиолетового кристаллического формазана. Для оценки цитотоксического эффекта никомицина используют нормальную клеточную линию эмбриональных фибробластов человека (HEF) и опухолевую клеточную линию аденокарциномы шейки матки (HeLa). Клеточные линии высаживают в 96-луночные планшеты (по 10000 клеток в каждую лунку) и растят в среде DMEM/F-12 в течение 24 ч при 37°С в CO2-инкубаторе (5% CO2 в воздухе). Далее культуральную жидкость заменяют свежей средой, в которой предварительно растворяют тестируемый пептид. После инкубации в течение 24 ч в приведенных выше условиях в каждую лунку добавляют по 20 мкл раствора МТТ в забуференном физиологическом растворе (5 г/л), после чего продолжают инкубацию в течение 4 ч. Аккуратно удаляют среду, добавляют в лунки по 100 мкл смеси диметилсульфоксида и этилового спирта (1:1) для растворения кристаллов формазана и измеряют оптическую плотность растворов при 570 нм с помощью планшетного спектрофотометра. Долю живых клеток определяют по формуле:
Выживаемость (%) = [(OD570 пробы - OD570 «K-»)×100%/(OD570 клетки без пептида - OD570 «K- »)],
где «K-» - фоновое поглощение лунки с растворителем. Эксперименты проводят дважды в трехкратной повторности. С помощью математической модели нелинейной регрессии строят графики сглаживающих кривых для экспериментальных значений выживаемости клеток (Фиг. 6). Анализ данных показал, что никомицин (SEQ ID No. 1) проявляет выраженный дозозависимый цитотоксический эффект в отношении опухолевой клеточной линии HeLa (гибель 85% клеток при концентрации пептида 32 мкм) и оказывает меньшее влияние на нормальные клетки HEF, что свидетельствует о наличии селективности цитотоксического действия.
Перечень аминокислотных и нуклеотидных последовательностей
SEQ ID No. 1
GlyPheTrpSerSerValTrpAspGlyAlaLysAsnValGlyThrAlaIleIleLysAsnAlaLysVal
CysValTyrAlaValCysValSerHisLys
SEQ ID No. 2
AGATCTGCGGGATCTCGATCCCGCGAAATTAATACGACTCACTATAGGGGAATTGTGAGCGGATAACAATTCCCCTCTAGAGTCGACGGATCTTACTTTAAGAAGGAGATATACATATGAGCCATCACCACCACCATCACCATCACGGATCTAGCGATAAAATTATTCACCTGACTGACGACAGTTTTGACACGGATGTACTCAAAGCGGACGGGGCGATCCTCGTCGATTTCTGGGCAGAGTGGTGCGGTCCGTGCAAACTGATCGCCCCGATTCTGGATGAAATCGCTGACGAATATCAGGGCAAACTGACCGTTGCAAAACTGAACATCGATCAAAACCCTGGCACTGCGCCGAAATATGGCATCCGTGGTATCCCGACTCTGCTGCTGTTCAAAAACGGTGAAGTGGCGGCAACCAAAGTGGGTGCACTGTCTAAAGGTCAGTTGAAAGAGTTCCTCGACGCTAACCTGGCCGGATCTATGGGTTTTTGGAGCAGTGTTTGGGACGGGGCGAAGAATGTGGGGACGGCAATCATCAAAAATGCCAAAGTTTGCGTATACGCGGTATGCGTCAGCCACAAGTAAGAATTCTCTCGAG
SEQ ID No. 3
MetSerHisHisHisHisHisHisHisHisGlySerSerAspLysIleIleHisLeuThrAspAspSer
PheAspThrAspValLeuLysAlaAspGlyAlaIleLeuValAspPheTrpAlaGluTrpCysGlyPro
CysLysLeuIleAlaProIleLeuAspGluIleAlaAspGluTyrGlnGlyLysLeuThrValAlaLys
LeuAsnIleAspGlnAsnProGlyThrAlaProLysTyrGlyIleArgGlyIleProThrLeuLeuLeu
PheLysAsnGlyGluValAlaAlaThrLysValGlyAlaLeuSerLysGlyGlnLeuLysGluPheLeu
AspAlaAsnLeuAlaGlySerMetGlyPheTrpSerSerValTrpAspGlyAlaLysAsnValGlyThr
AlaIleIleLysAsnAlaLysValCysValTyrAlaValCysValSerHisLys
SEQ ID No. 4
GlyIleGlyAlaValLeuLysValLeuThrThrGlyLeuProAlaLeuIleSerTrpIleLysArgLys
ArgGlnGln