Результат интеллектуальной деятельности: СЕЛЕКТИВНОЕ ВОССТАНОВЛЕНИЕ ЦИСТЕИНОВЫХ ОСТАТКОВ В АНТИТЕЛАХ ПРОТИВ IL-17
Вид РИД
Изобретение
Родственные заявки
Данная заявка испрашивает приоритет предварительной патентной заявки США № 62/095361, поданной 22 декабря 2014 года, которая включена в данный документ посредством ссылки во всей своей полноте.
Область техники, к которой относится изобретение
Настоящее раскрытие относится к способам селективного восстановления CysL97 в препарате антител против IL-17 или их антигенсвязывающих фрагментов, напр., препарате секукинумаб, которые рекомбинантно продуцированы клетками млекопитающих.
Уровень техники раскрытия
Классические антитела состоят из двух легких цепей (L) с молекулярной массой, составляющей приблизительно 25 кДа каждая, и двух тяжелых цепей (H) с молекулярной массой, составляющей приблизительно 50 кДа каждая. Легкие и тяжелые цепи соединены посредством дисульфидной связи (L-S-S-H), и две LH-единицы дополнительно связаны между тяжелыми цепями посредством двух дисульфидных связей. Общая формула классического антитела представляет собой L-SS-H(-SS-)2H-SS-L или просто H2L2 (HHLL). Помимо данных консервативных межцепочечных дисульфидных связей, имеется также консервативный внутрицепочечный дисульфид. Оба типа дисульфидных связей являются важными для стабильности и поведения (напр., аффинности) антитела. В целом, дисульфидная связь образуется двумя цистеиновыми остатками (Cys-SH), находящимися в консервативных положениях в цепях антитела, которые спонтанно образуют дисульфидную связь (Cys-S-S-Cys). Формирование дисульфидных связей определяется редокс-потенциалом окружающей среды и присутствием ферментов, специализированных на тиол-дисульфидном обмене. Внутренние дисульфидные связи (Cys-S-S-Cys) стабилизируют трехмерную структуру антитела.
Существуют необычные антитела, которые содержат добавочный свободный цистеин (цистеины) (т.е. неспаренный цистеин), который участвует в распознавании и связывании антигена. Для данных антител модификация свободного цистеина может иметь отрицательное действие на активность и стабильность молекулы, и может приводить к повышенной иммуногенности. В результате процессинг данных антител может быть затруднен, поскольку конечный продукт может содержать значительное количество неактивного, неправильно свернутого и бесполезного антительного материала. US20090280131, который включен в данный документ посредством ссылки во всей своей полноте, предоставляет антитела против IL-17, напр., секукинумаб (т.е. AIN457) со свободным цистеиновым остатком после цис-пролина в петле участка 3, определяющего комплементарность (CDR) легкой цепи (L-CDR3) (т.е. аминокислота восемь L-CDR3, как представлено в SEQ ID NO:6, которая соответствует аминокислоте 97 вариабельной области легкой цепи, как представлено в SEQ ID NO:10, в дальнейшем в данной заявке именуемой «CysL97»). С целью сохранения полной активности, неспаренный цистеиновый остаток секукинумаба не может быть замаскирован посредством окислительного дисульфидного спаривания с другими цистеиновыми остатками или посредством окисления экзогенными соединениями (напр., посредством образования смешанных дисульфидов с другими белками, дериватизации с помощью клеточных метаболитов [напр., цистеина или глутатиона] и образования сульфоксидов посредством кислорода). К сожалению, поскольку секукинумаб производят с применением клеток млекопитающих, возникают нежелательные клеточные модификации CysL97.
В литературе описан рефолдинг белков млекопитающих, экспрессируемых в бактериальных клетках, которые продуцируют белки млекопитающих в виде развернутых нерастворимых агрегатов, имеющих смешанные дисульфиды (тельца включения). Чтобы получить белки млекопитающих из бактерий, белки телец включения выделяют, растворяют и денатурируют сильными хаотропными реагентами и восстанавливающими агентами. Для правильного рефолдинга растительных белков, полученных из коммерческих источников или рекомбинантно полученных в дрожжах (US 4766205), также применяют полную денатурацию и восстановление дисульфидных связей с применением денатурирующего агента, восстанавливающего агента, образующего дисульфидный аддукт агента и умеренной окислительной/восстановительной среды (pH 7-9). Данные способы, в которых задействуют полную денатурацию и рефолдинг белков, являются дорогостоящими, разрушающими, трудоемкими и ненужными для белка, продуцируемого в клетках млекопитающих.
Известно применение окислительно-восстановительных связующих реагентов для исправления неправильного слияния не встречающихся в природе белков, слитых с Fc (WO02/68455). Белки, слитые с Fc, WO02/68455, предположительно содержат межцепочечные дисульфиды в Fc-области, которые восстанавливаются и реоксигенируются посредством раскрытого способа, но в нем нет никакой идеи о том, как получить молекулу, имеющую селективно восстановленный остаток цистеина. Более того, белок, слитый с Fc, является не просто антителом, а очень сложным иммуноглобулином, который зависит от множества должным образом связанных межцепочечных и внутрицепочечных дисульфидов для структуры и активности.
US20050123532 предоставляет способы получения антитела, имеющего свободный цистеин, посредством активации антитела восстанавливающим агентом, или посредством культивирования антителопродуцирующих клеток в бессывороточной среде, обогащенной L-цистеином. При применении данного способа культивирования клеток более поздние стадии процессинга, напр., фильтрация, вирусная инактивация и хроматография, могут приводить к окислению свободного цистеина, полученного посредством способов культивирования клеток. В данных случаях, свободный цистеин идеально защищен во время более поздних стадий посредством модифицирования свободной тиольной группы окисляющим агентом, который сам позднее удаляют с применением различных методик, напр., фильтрации (US20060257393). Для производства в промышленных масштабах данные способы требуют больших количеств восстанавливающего агента в исходной среде для культивирования, больших количеств окисляющего агента во время более позднего процессинга и дополнительных способов фильтрации для удаления окисляющего агента, дополнительного времени и расходов на издержки производства.
В Патенте США № 7928205 описано предпочтительное применение редокс-пар для рефолдинга антител IgG2, полученных из клеточных культур млекопитающих, а также способы децистеинилирования свободного цистеина в вариабельной области антитела 146B7 (IgG1). Соответствующая исследовательская публикация, Banks et al. (2008) J. Pharmaceutical Sci. 97:764-779, описывает децистеинилирование неспаренного сульфгидрила в вариабельной области рекомбинантного моноклонального антитела IgG1 (MAB007). Banks с соавторами исследовал, требовалось ли при децистеинилирования MAB007 применение сильного денатурирующего агента (GdnHCL) и восстанавливающего агента (цистеин) или происходило ли селективное восстановление в присутствии одного лишь цистеина. Авторы изобретения определили, что из MAB007 эффективно исключали цистеинилирование в присутствии и отсутствии денатурирующего агента.
Ни в одной из приведенных выше ссылок не показано, возможно ли селективное восстановление CysL97 в секукинумабе. В приведенных выше ссылках не описаны реагенты и условия, необходимые для селективного восстановления CysL97 в секукинумабе, которые зависят, помимо прочего, от первичной, вторичной и третичной структуры секукинумаба; положения и локализации окисленного CysL97 в секукинумабе (напр., доступного или недоступного для растворителя); и относительной прочности консервативных дисульфидных связей в антителе (например, реагирует ли CysL97 с данным восстанавливающим агентом сначала или только после того, как консервативные цистеины были восстановлены). Более того, ни в одной из данных ссылок не описано, приведет ли селективное восстановление окисленного CysL97 в секукинумабе к изменениям в структуре антитела (напр., в укладке), в химическом составе (напр., к дезаминированию) или в свойствах (связывающей активности, склонности к агрегации или деградации), каждое из которых может сделать его технически нецелесообразным/непрактичным для селективного восстановления секукинумаба в коммерческих масштабах.
СУЩНОСТЬ РАСКРЫТИЯ
С целью сохранения максимальной антигенсвязывающей активности секукинумаба авторы изобретения определили, что во время процессинга секукинумаба необходимо превратить CysL97 из замаскированной (1) в свободную (2) форму (см. I, ниже) без значительного восстановления консервативных дисульфидных связей; в противном случае более низкая активность и неактивные варианты с более низкой молекулярной массой будут образовываться путем разрыва цепи (H2L2 → H2L, HL2, HL, H и L).
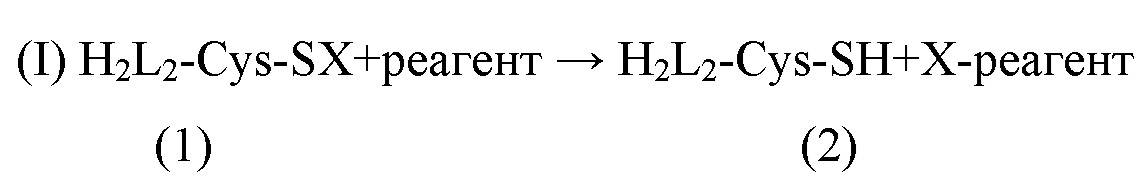
Введение условий восстановления при получении антител в коммерческом масштабе является противоречивым (см., напр., Trexler-Schmidt et al. 2010 Biotech и Bioengineering 106:452-61, в котором используются различные реагенты и способы для предотвращения восстановления дисульфидной связи антитела во время получения антител в культуре клеток). Тем не менее авторы изобретения определили, что селективное восстановление CysL97 в секукинумабе во время крупномасштабного промышленного производства в клетках млекопитающих возможно без значительной денатурации антитела. В данной заявке раскрыты способы селективного восстановления CysL97 в антигенсвязывающих участках антител против IL-17 (и их фрагментах), раскрытых в US20090280131, в частности секукинумаб. Данные способы способствуют восстановлению связывающей активности данных антител и, таким образом, увеличивают биологическую активность их препаратов. Более того, данные способы способствуют повышению уровня интактных антител и увеличению однородности препаратов данных антител. Раскрытые способы зависят от комбинированного действия конкретных соотношений антитело:восстановитель и регулируемых скоростей переноса кислорода в системе во время инкубации.
Соответственно, в данной заявке раскрыты способы селективного восстановления CysL97 в препарате антител против IL-17, которые были рекомбинантно продуцированы клетками млекопитающих, включающие:
а) приведение препарата в контакт по меньшей мере с одним восстанавливающим агентом в системе для образования восстанавливающей смеси; и
b) инкубацию восстанавливающей смеси при сохранении объемного коэффициента массопереноса кислорода (kLa*) в системе, составляющем приблизительно ≤0,37 ч-1, где указанный kLa* вычисляют посредством адаптации кривой растворенного кислорода к кривой насыщения;
где каждое антитело против IL-17 содержит вариабельный домен тяжелой цепи (VH) иммуноглобулина, содержащий три участка, определяющих комплементарность (CDR) VH, изложенный в SEQ ID NO:8, и вариабельный домен легкой цепи (VL) иммуноглобулина, содержащий три CDR VL, изложенный в SEQ ID NO:10, и дополнительно где перед стадией a) начальный процент насыщения кислородом в препарате составляет по меньшей мере приблизительно 60%, как измерено с применением кислородного зонда, откалиброванного при 25°C.
Также в данной заявке раскрыты способы селективного восстановления CysL97 в препарате антител против IL-17, которые были рекомбинантно продуцированы клетками млекопитающих, включающие:
a) приведение препарата в контакт с набором окислительно-восстановительных реагентов, выбранных из цистеина/цистина и цистеина/цистамина для образования восстанавливающей смеси; и
b) инкубацию восстанавливающей смеси при температуре приблизительно 37°C в анаэробных условиях в течение по меньшей мере приблизительно 4 часов, или инкубацию восстанавливающей смеси при температуре приблизительно 18-24°C в течение приблизительно 16-24 часов;
в которых каждое антитело против IL-17 содержит вариабельный домен тяжелой цепи (VH) иммуноглобулина, содержащий три участка, определяющих комплементарность (CDR) VH, изложенный в SEQ ID NO:8, и вариабельный домен легкой цепи (VL) иммуноглобулина, содержащий три CDR VL, изложенный в SEQ ID NO:10.
Также в данной заявке раскрыты очищенные препараты секукинумаба, в которых уровень интактного секукинумаба в препарате составляет по меньшей мере приблизительно 90%, как измерено посредством капиллярного электрофореза с додецилсульфатом натрия (CE-SDS), и в которых уровень активности секукинумаба в препарате составляет по меньшей мере приблизительно 90%, как измерено посредством катионообменной хроматографии с цистамином.
КРАТКОЕ ОПИСАНИЕ ФИГУР
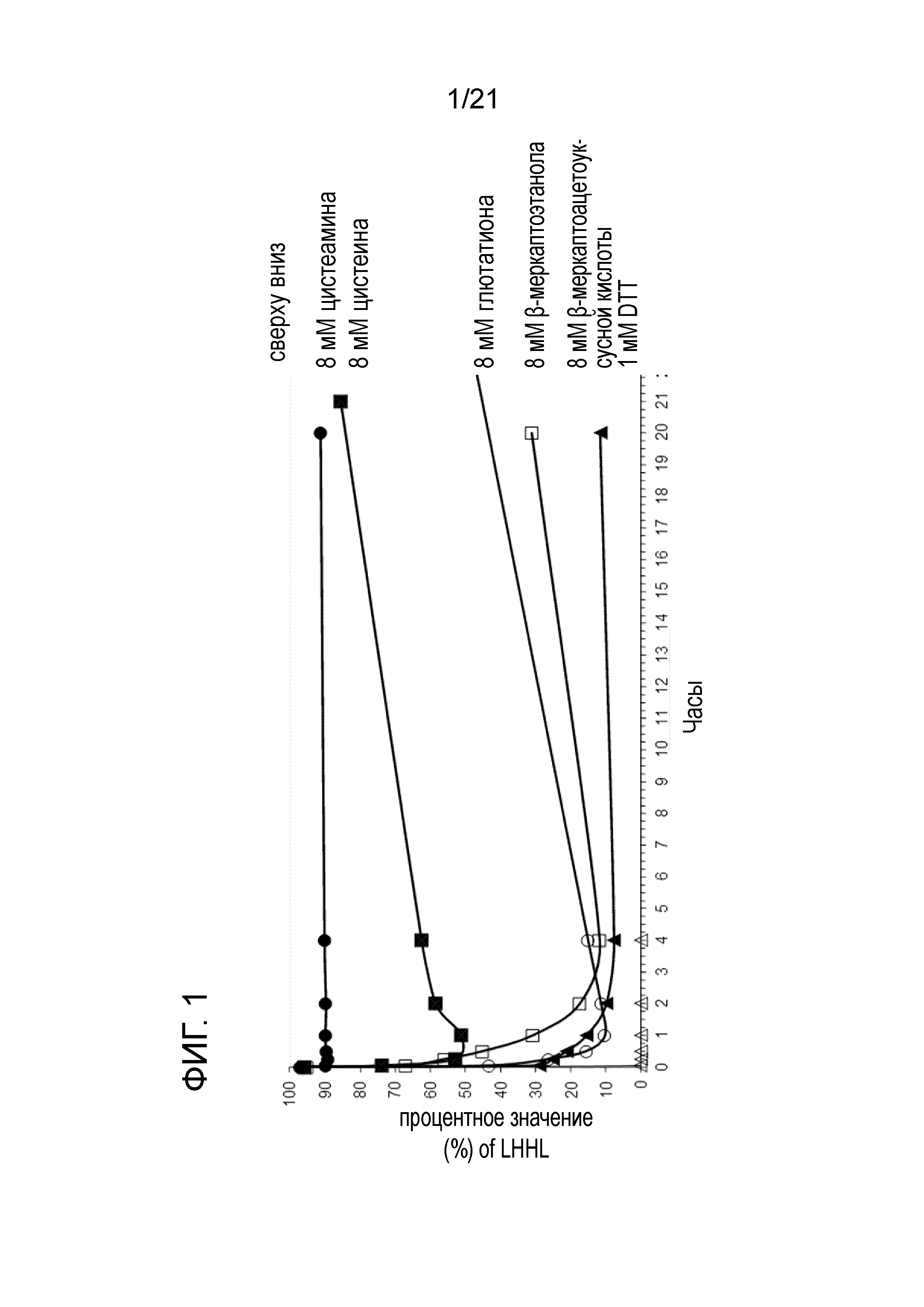
Фигура 1 демонстрирует процентное содержание интактного антитела (LHHL) с течением времени после воздействия различных восстанавливающих агентов.
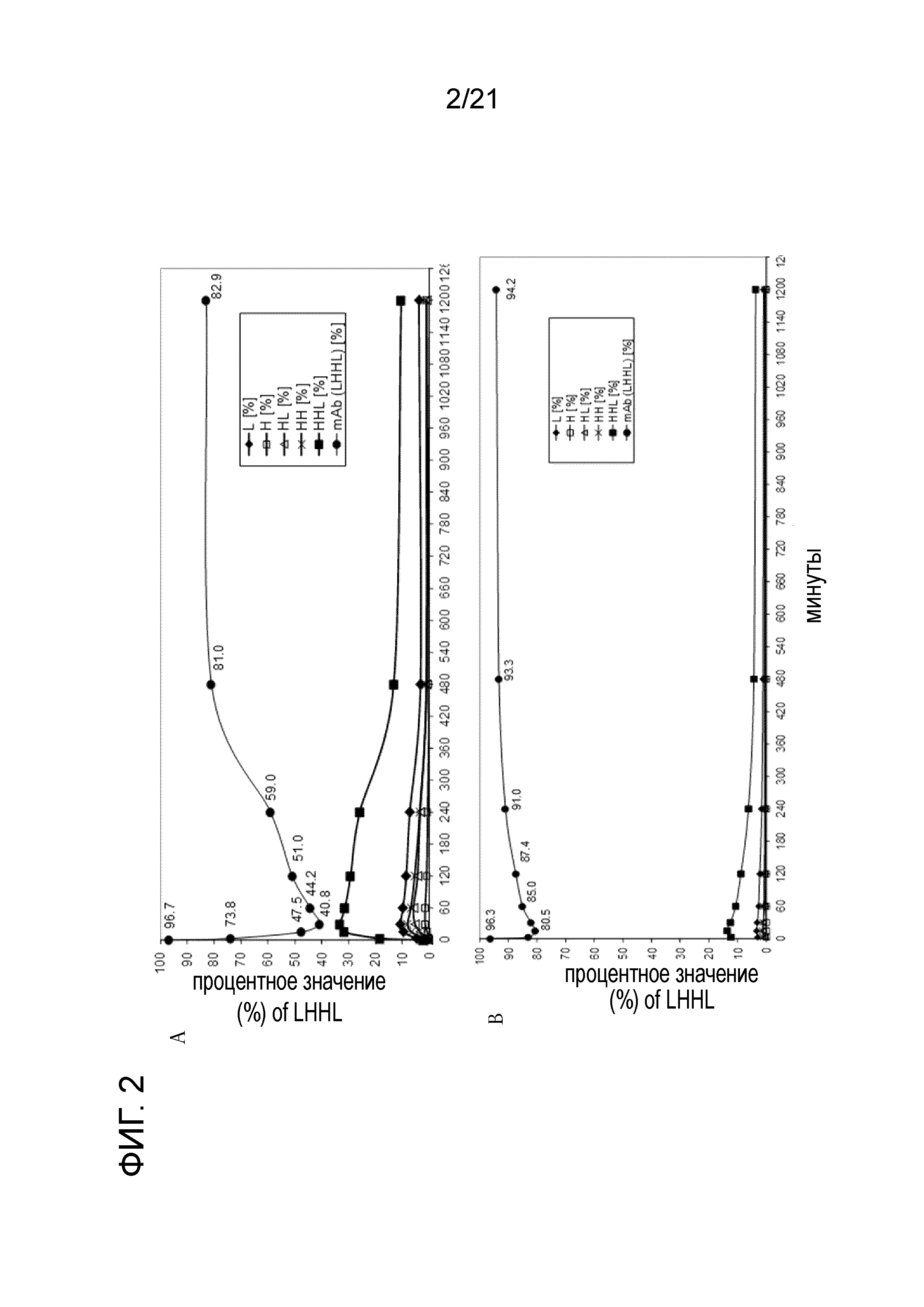
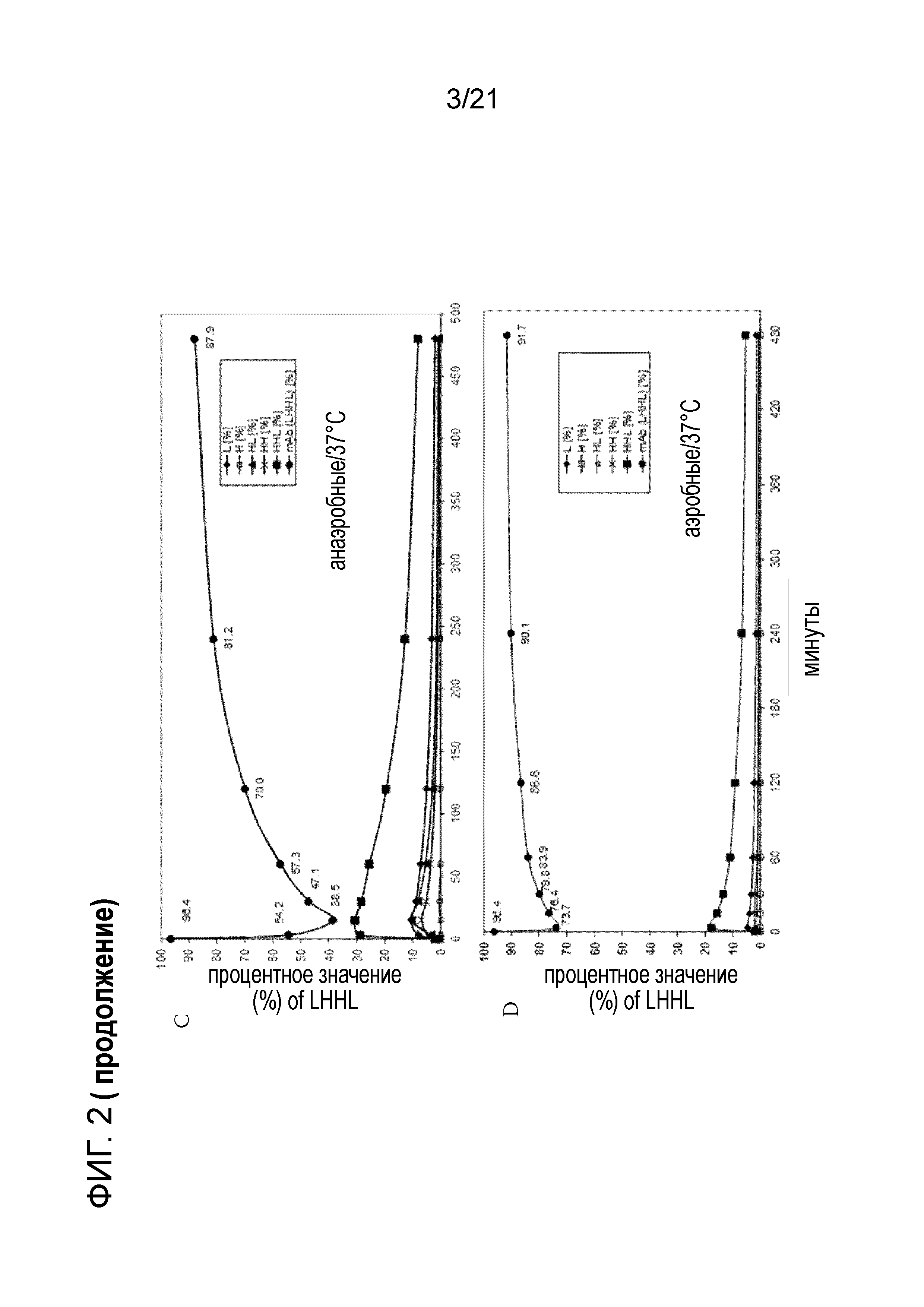
Фигура 2A демонстрирует процентное содержание интактного антитела (LHHL) с течением времени при комнатной температуре после воздействия селективного восстановления посредством 8 мМ цистеина в анаэробных условиях. Фигура 2B демонстрирует процентное содержание интактного антитела (LHHL) с течением времени при комнатной температуре после воздействия селективного восстановления посредством 8 мМ цистеина в аэробных условиях. Фигура 2C демонстрирует процентное содержание интактного антитела (LHHL) с течением времени при 37°C после воздействия селективного восстановления посредством 8 мМ цистеина в анаэробных условиях. Фигура 2D демонстрирует процентное содержание интактного антитела (LHHL) с течением времени при 37°C после воздействия селективного восстановления посредством 8 мМ цистеина в аэробных условиях.
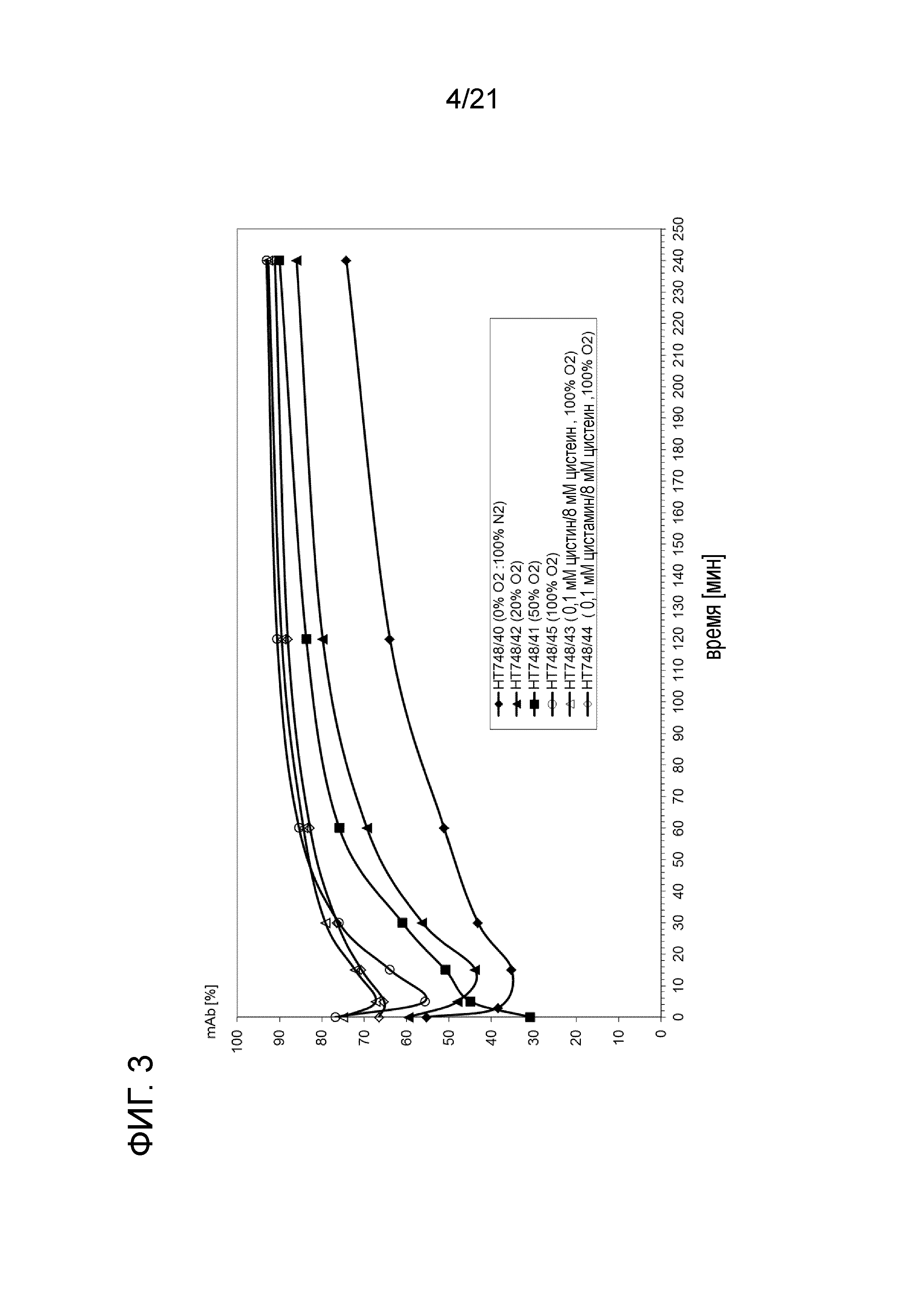
Фигура 3 демонстрирует процентное содержание интактного антитела с течением времени при температуре 37°C после воздействия селективного восстановления посредством 8 мМ цистеина при различных концентрациях растворенного кислорода.
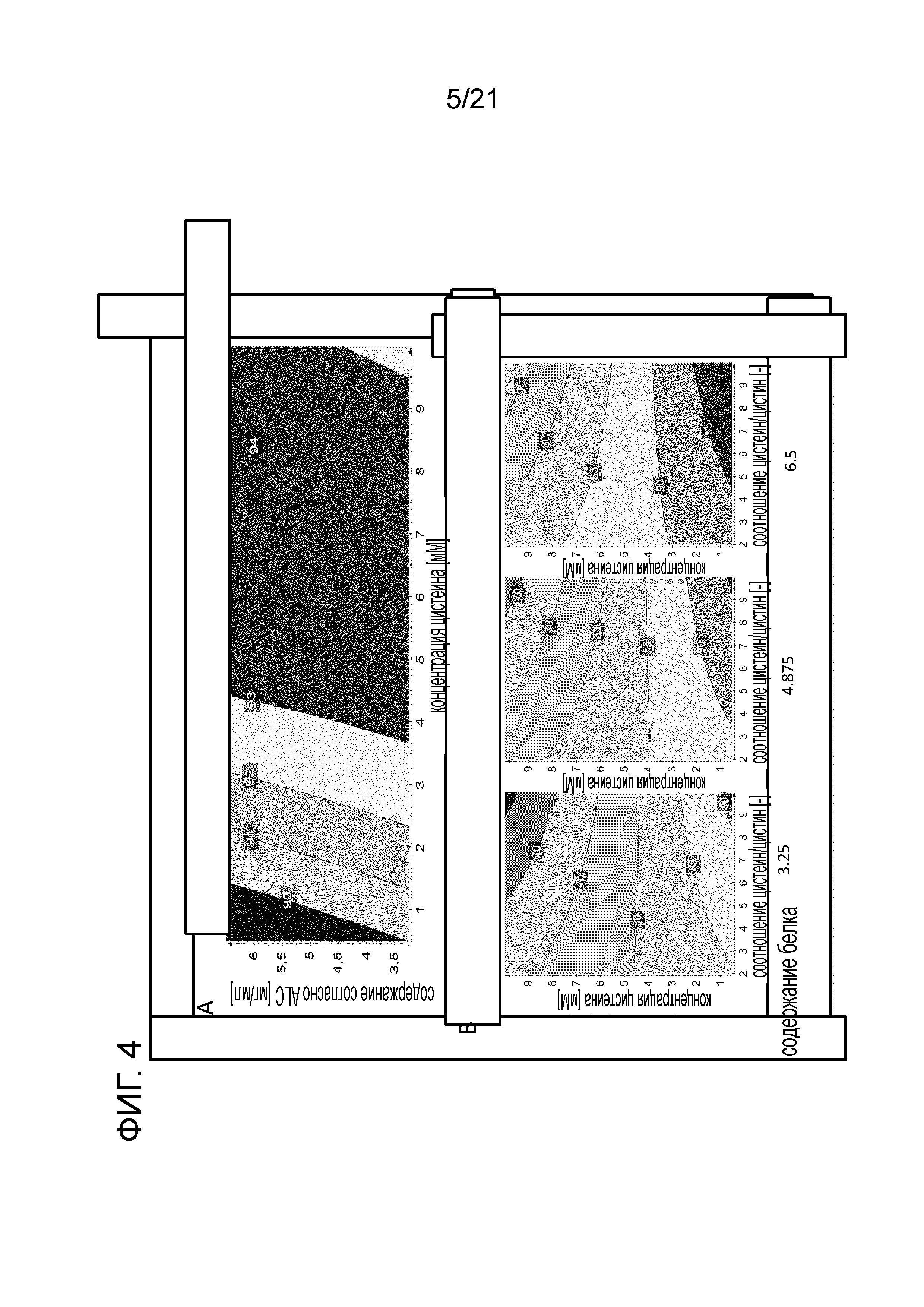
Фигура 4A демонстрирует контурную диаграмму 4D активности посредством катионообменной хроматографии. Фигура 4B демонстрирует контурную диаграмму 4D чистоты согласно CE-SDS. Диаграммы фигуры 4 анализируют влияние и взаимодействие концентрации цистеина, содержания белка и соотношения цистеин:цистин на выходные параметры активность согласно CEX и чистоту согласно CE-SDS.
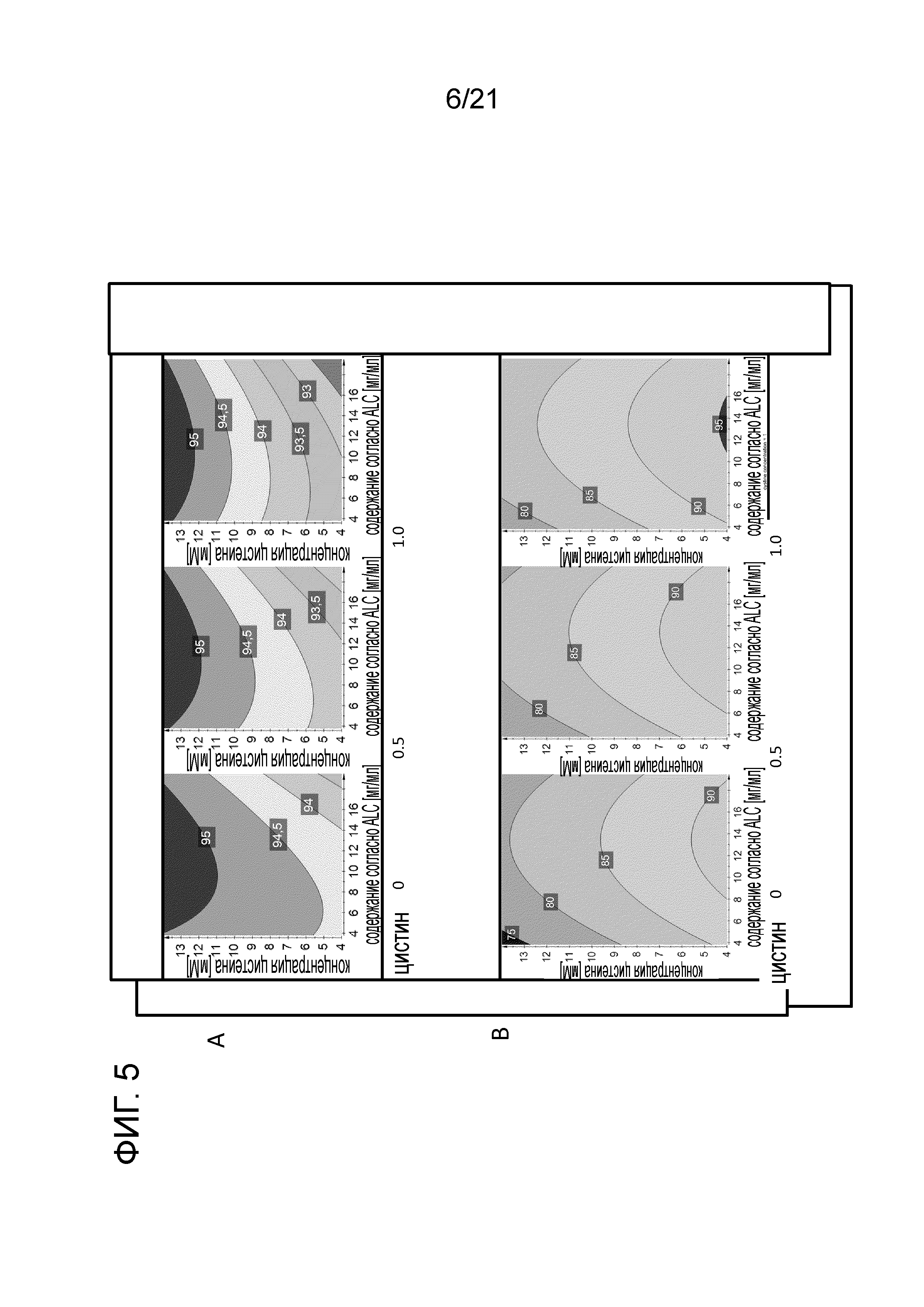
Фигура 5A демонстрирует контурную диаграмму 4D активности согласно CEX. Фигура 5B демонстрирует контурную диаграмму 4D чистоты согласно CE-SDS. Диаграммы фигуры 5 анализируют влияние и взаимодействие концентрации цистеина, содержания белка и концентрации цистина на выходные параметры активность согласно CEX и чистоту согласно CE-SDS.
Фигура 6 демонстрирует контурную диаграмму 4D активности согласно CEX с учетом влияния и взаимодействия pH, времени, температуры и концентрации цистеина.
Фигура 7 демонстрирует контурную диаграмму 4D чистоты согласно CE-SDS с учетом влияния и взаимодействия pH, времени, температуры и концентрации цистеина.
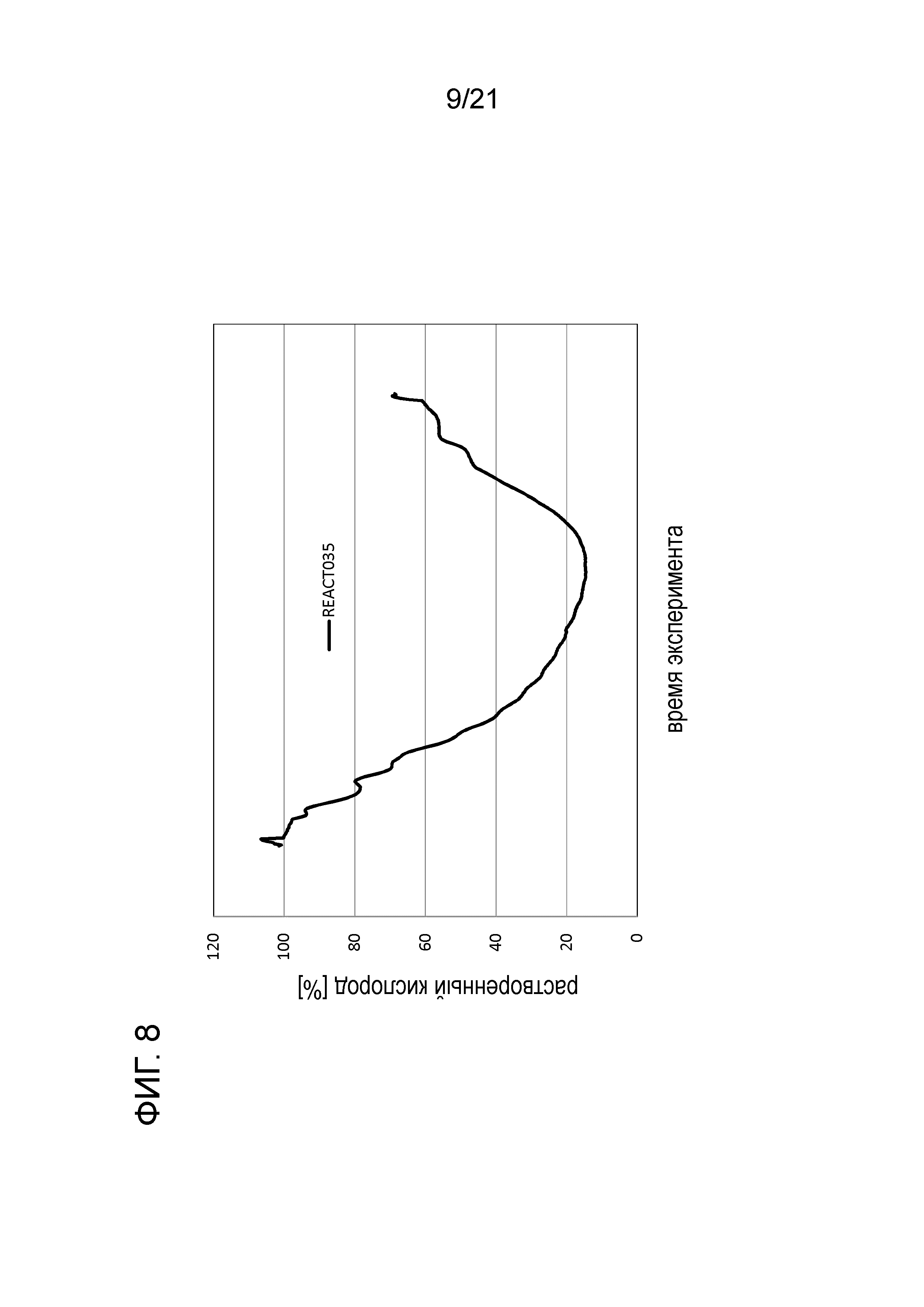
Фигура 8 демонстрирует график растворенного кислорода при обработке цистеином в опыте 1 подтверждения.
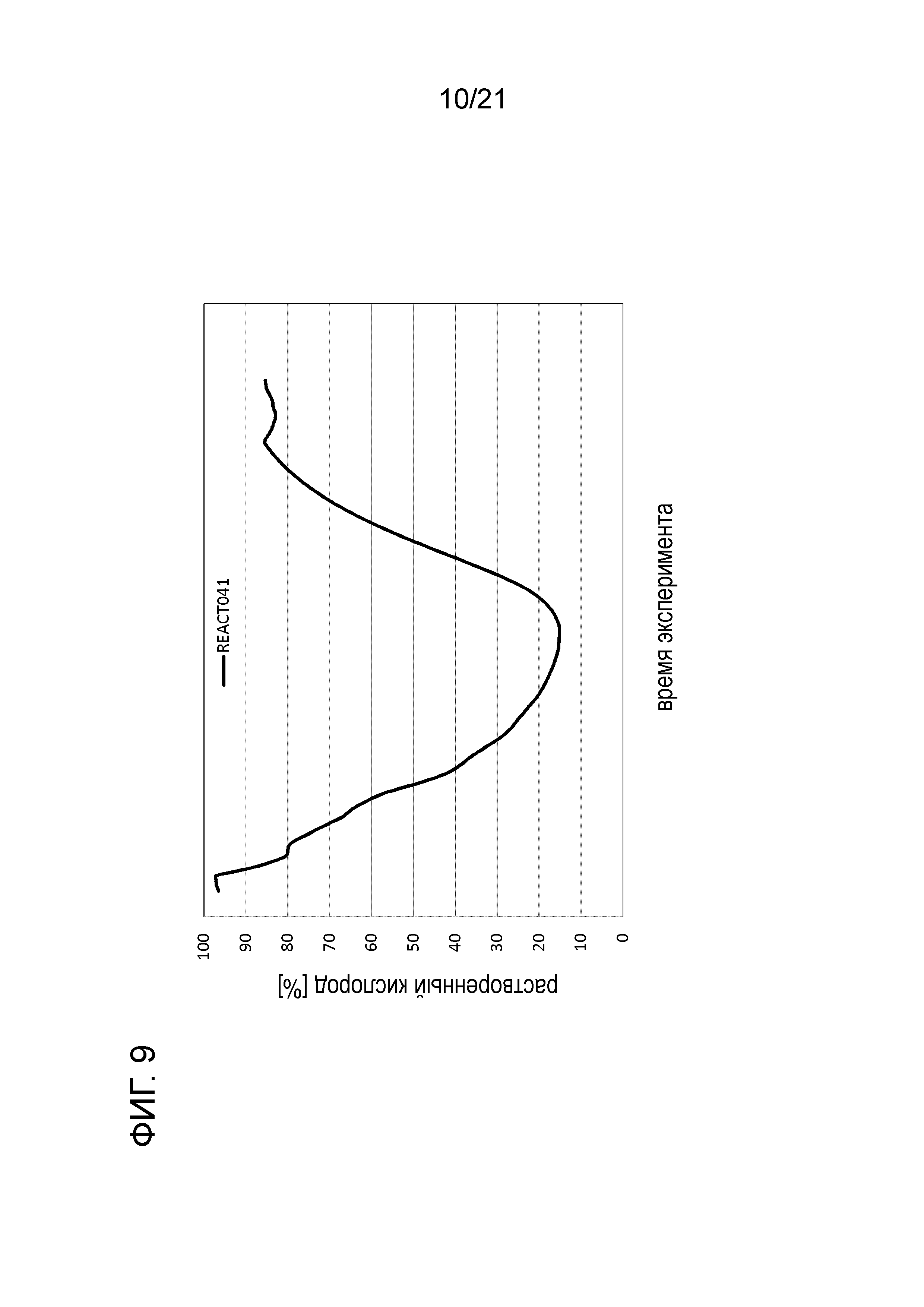
Фигура 9 демонстрирует график растворенного кислорода при обработке цистеином в опыте 2 подтверждения.
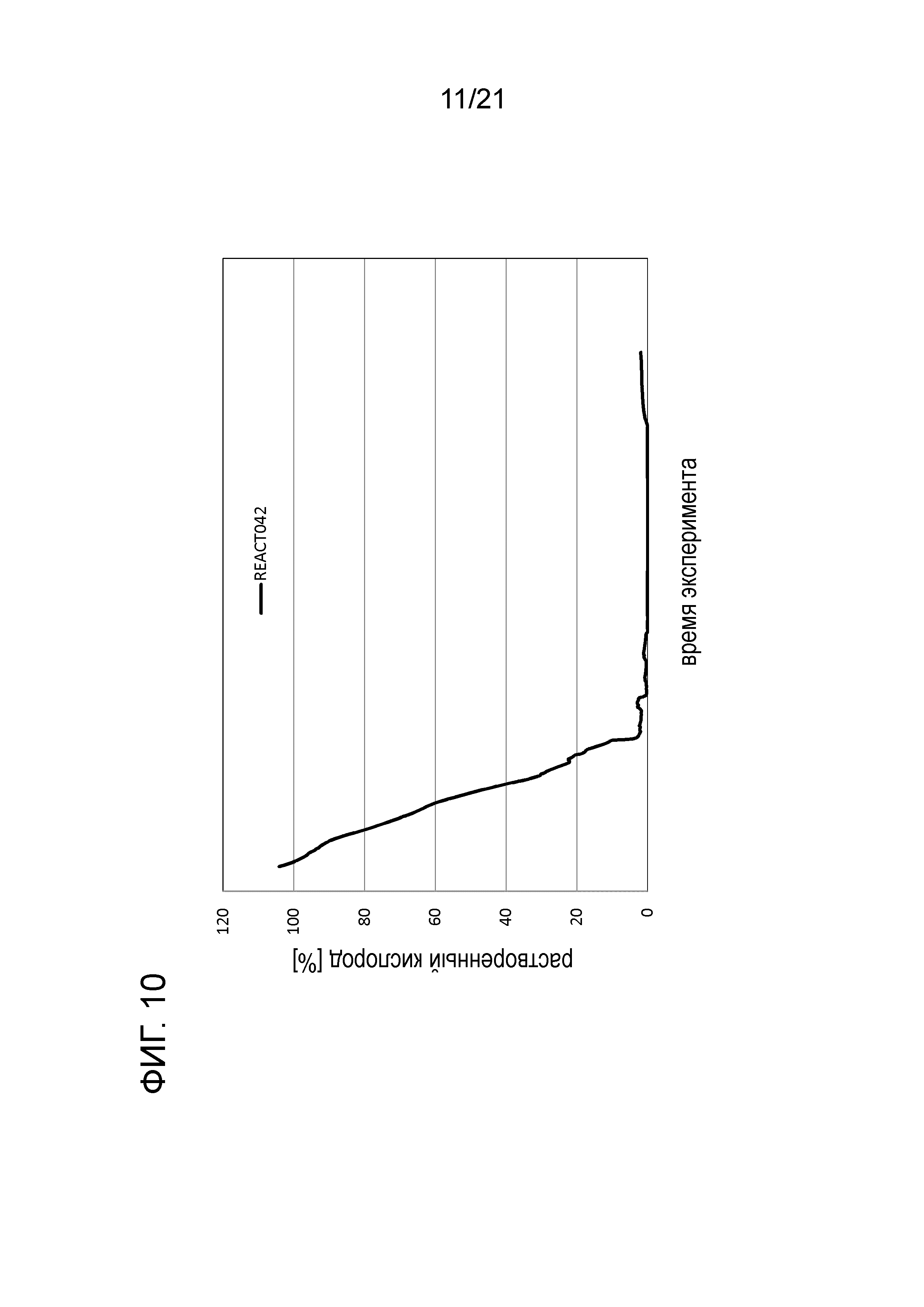
Фигура 10 демонстрирует график растворенного кислорода при обработке цистеином в опыте 3 подтверждения.
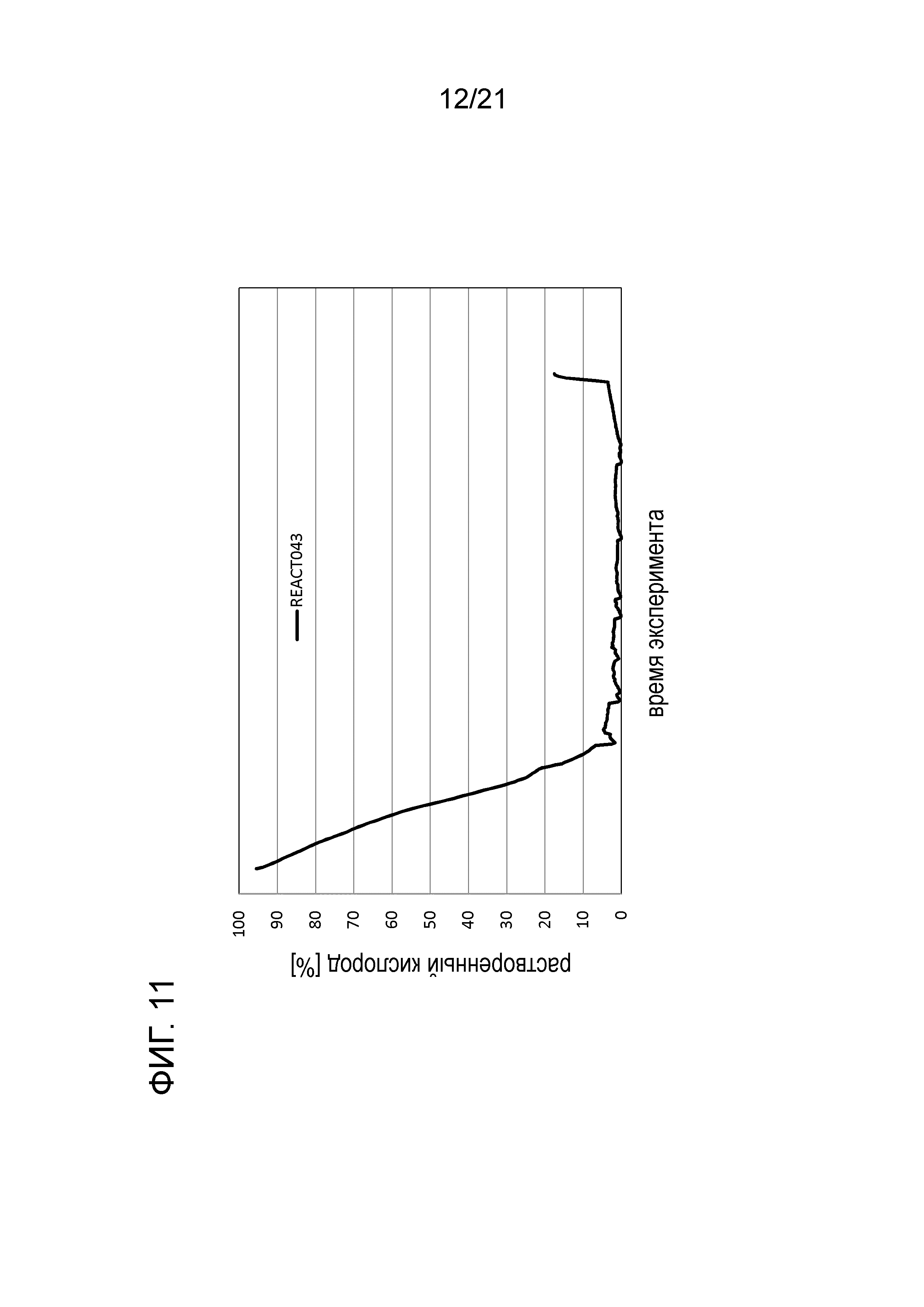
Фигура 11 демонстрирует график растворенного кислорода при обработке цистеином в опыте 4 подтверждения.
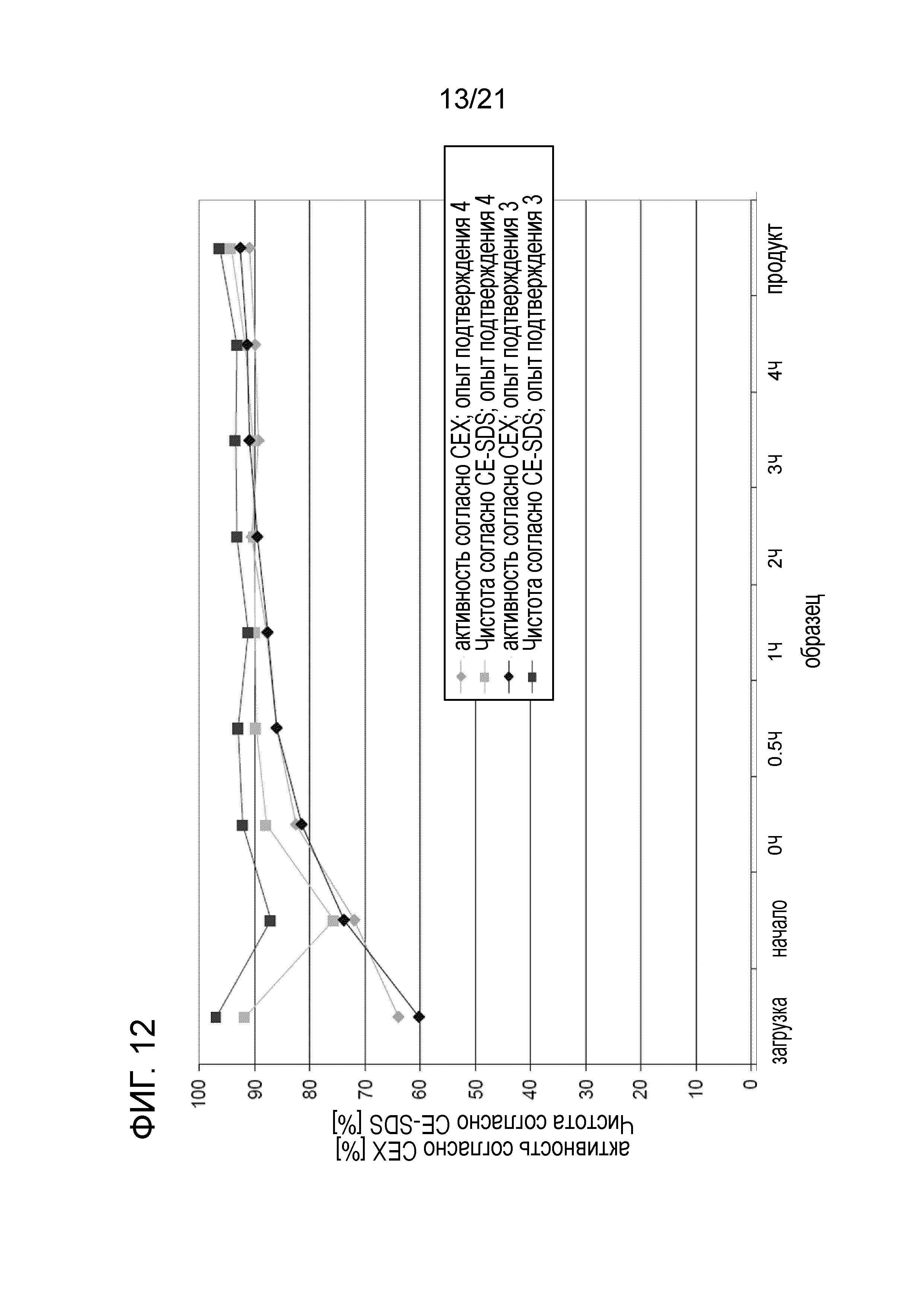
Фигура 12 сравнивает кинетику реакций опыта 3 подтверждения и опыта 4 подтверждения в отношении активности согласно CEX и чистоты согласно CE-SDS.
Фигура 13A демонстрирует масштабированную и центрированную диаграмму коэффициентов для активности согласно CEX в REACT.P.
Фигура 13B демонстрирует контурную диаграмму 4D активности согласно CEX REACT.P. Диаграммы фигуры 13 анализируют влияние и взаимодействие концентрации цистеина, содержания белка и скорости мешалки на выходные параметры активность согласно CEX и чистоту согласно CE-SDS.
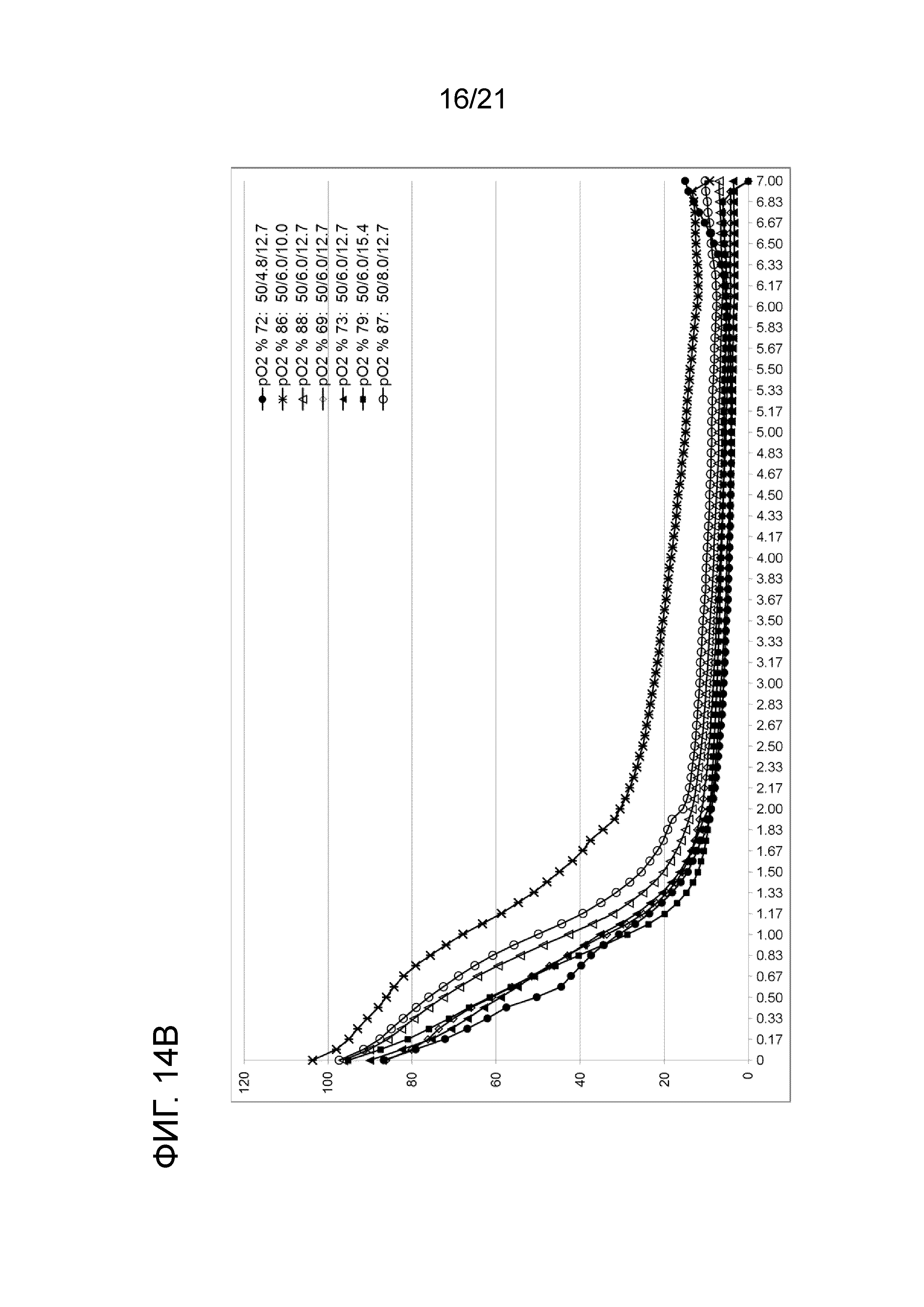
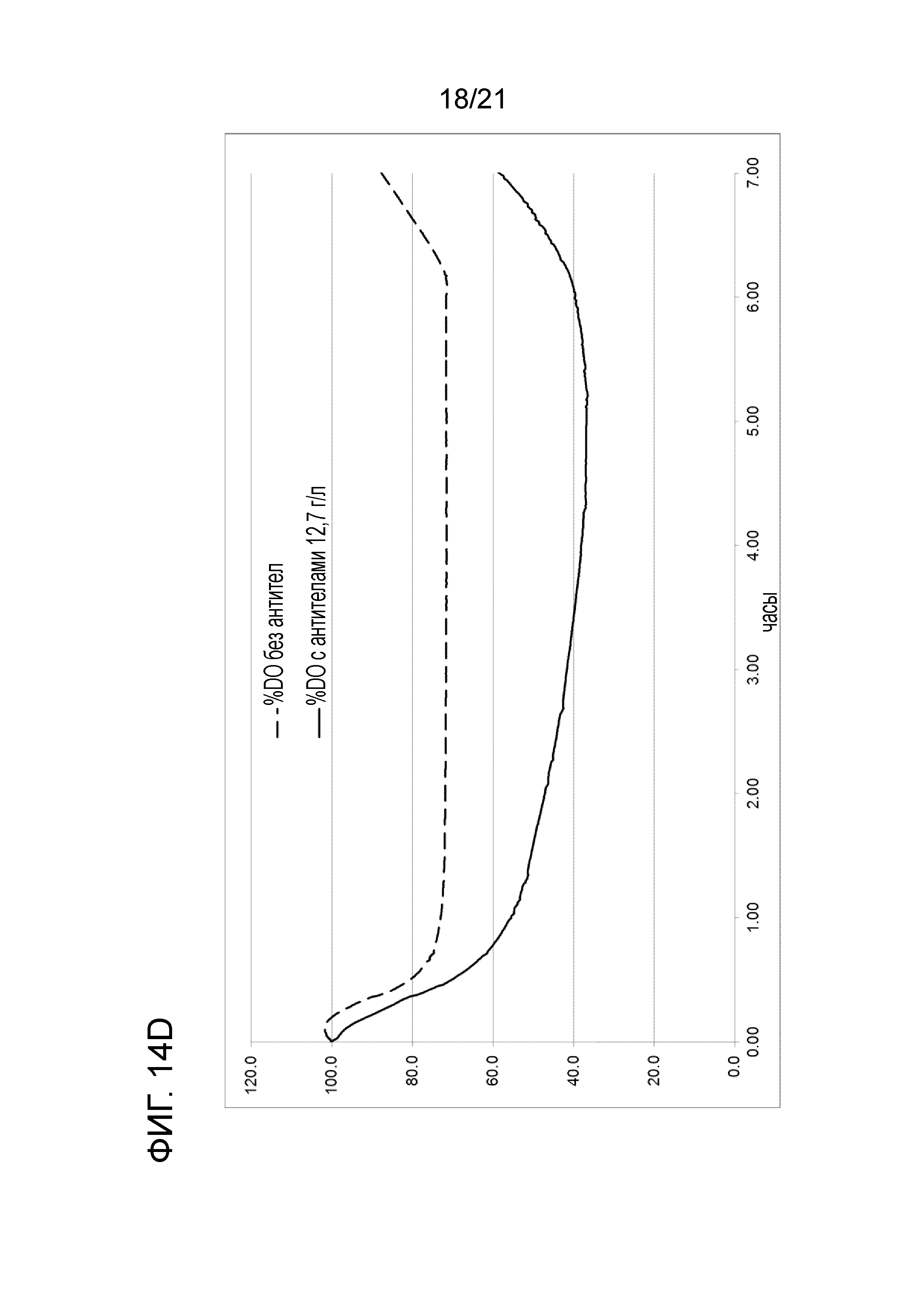
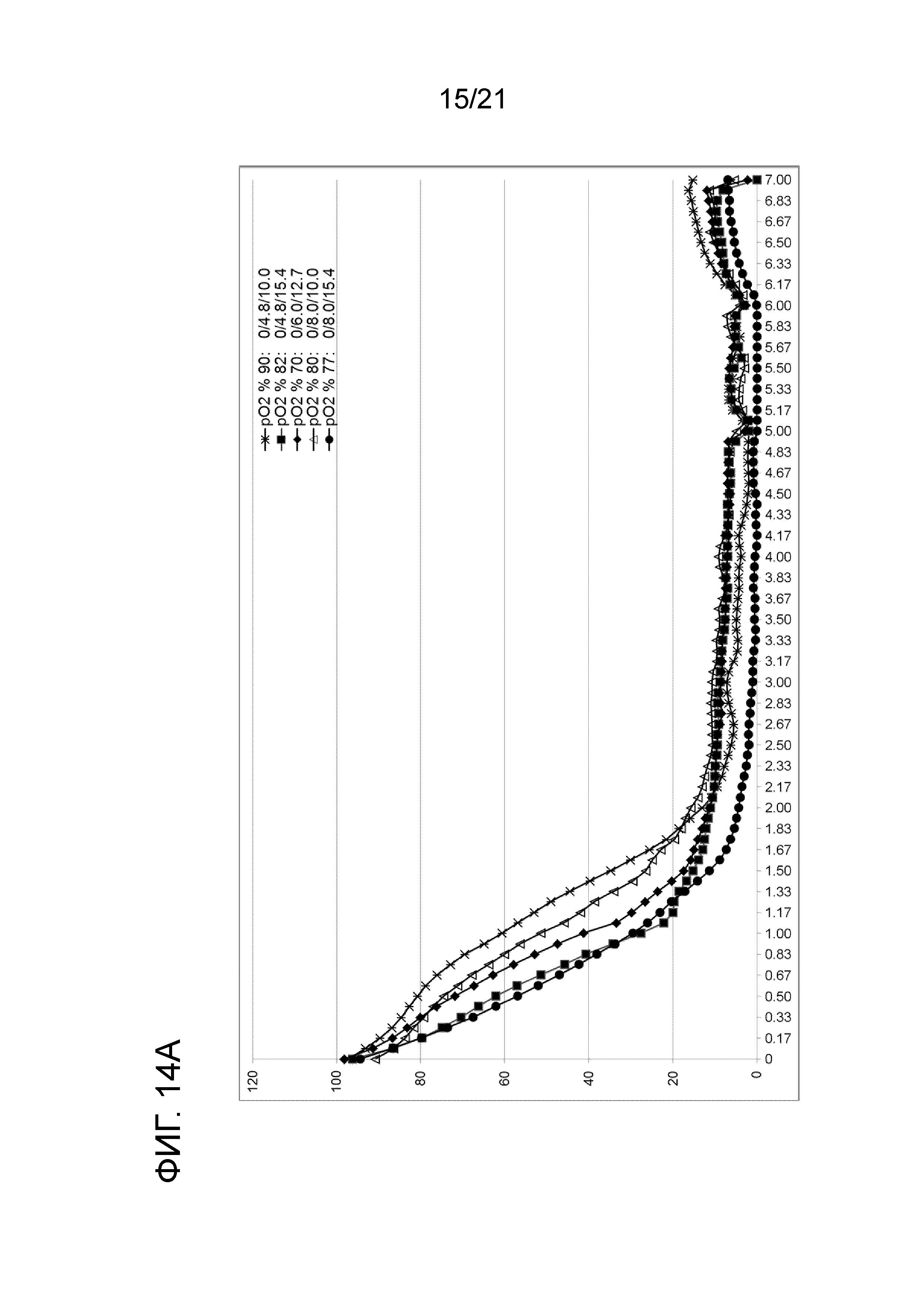
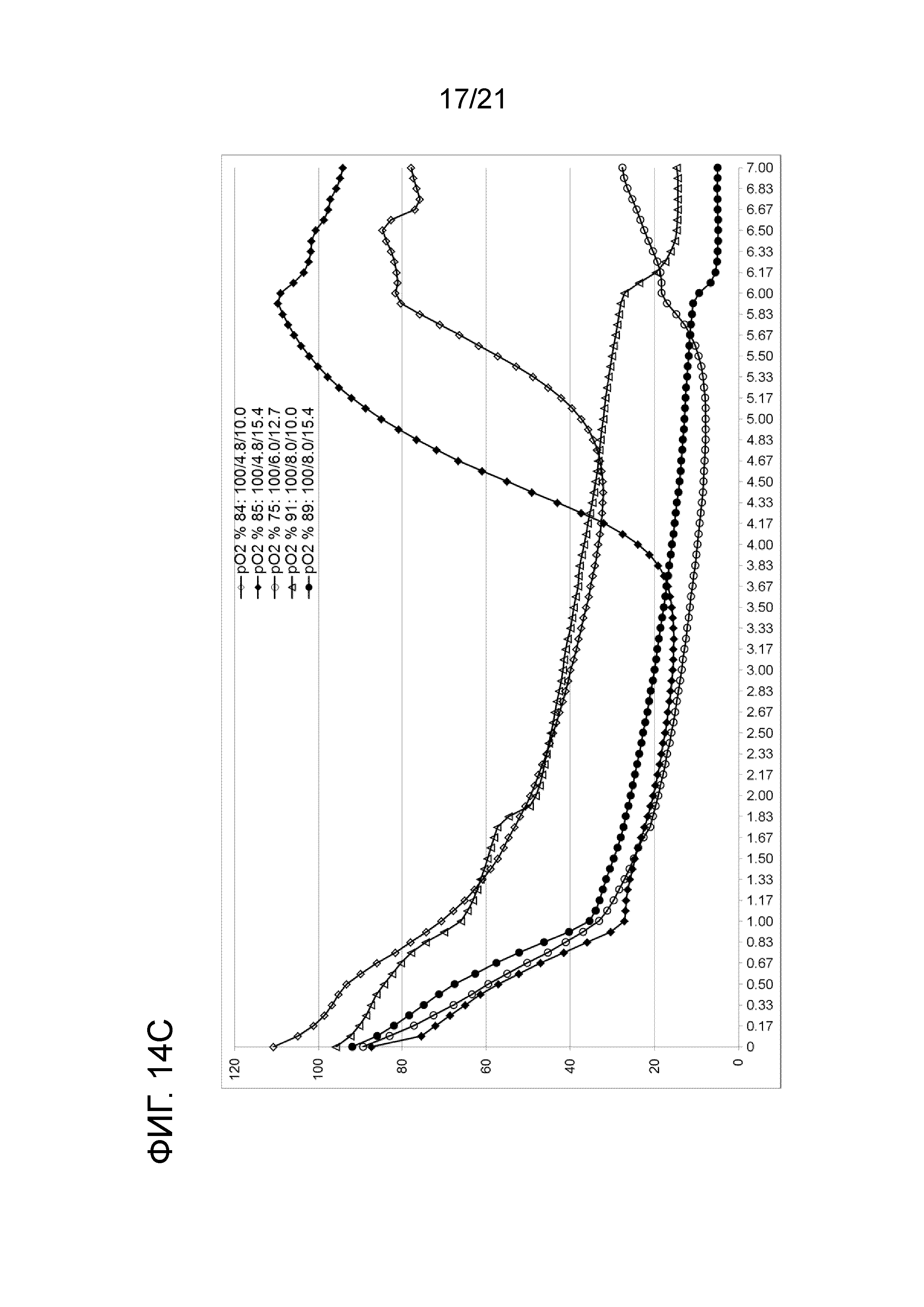
Фигура 14A демонстрирует профили растворенного кислорода в опытах по созданию характеристики способа при 0 об/мин (числа в легенде указывают номер опыта, скорость мешалки и концентрацию цистеина и антитела). Фигура 14B демонстрирует профили растворенного кислорода в опытах по созданию характеристики способа при 50 об/мин (числа в легенде указывают номер опыта, скорость мешалки и концентрацию цистеина и антитела). Фигура 14C демонстрирует профили растворенного кислорода в опытах по созданию характеристики способа при 100 об/мин (числа в легенде указывают номер опыта, скорость мешалки и концентрацию цистеина и антитела). Фигура 14D сравнивает профили растворенного кислорода двух опытов, выполненных в масштабе 50 мл при 50 об/мин и 6,0 мМ цистеина, один без антитела, а другой с 12,7 г/л антитела.
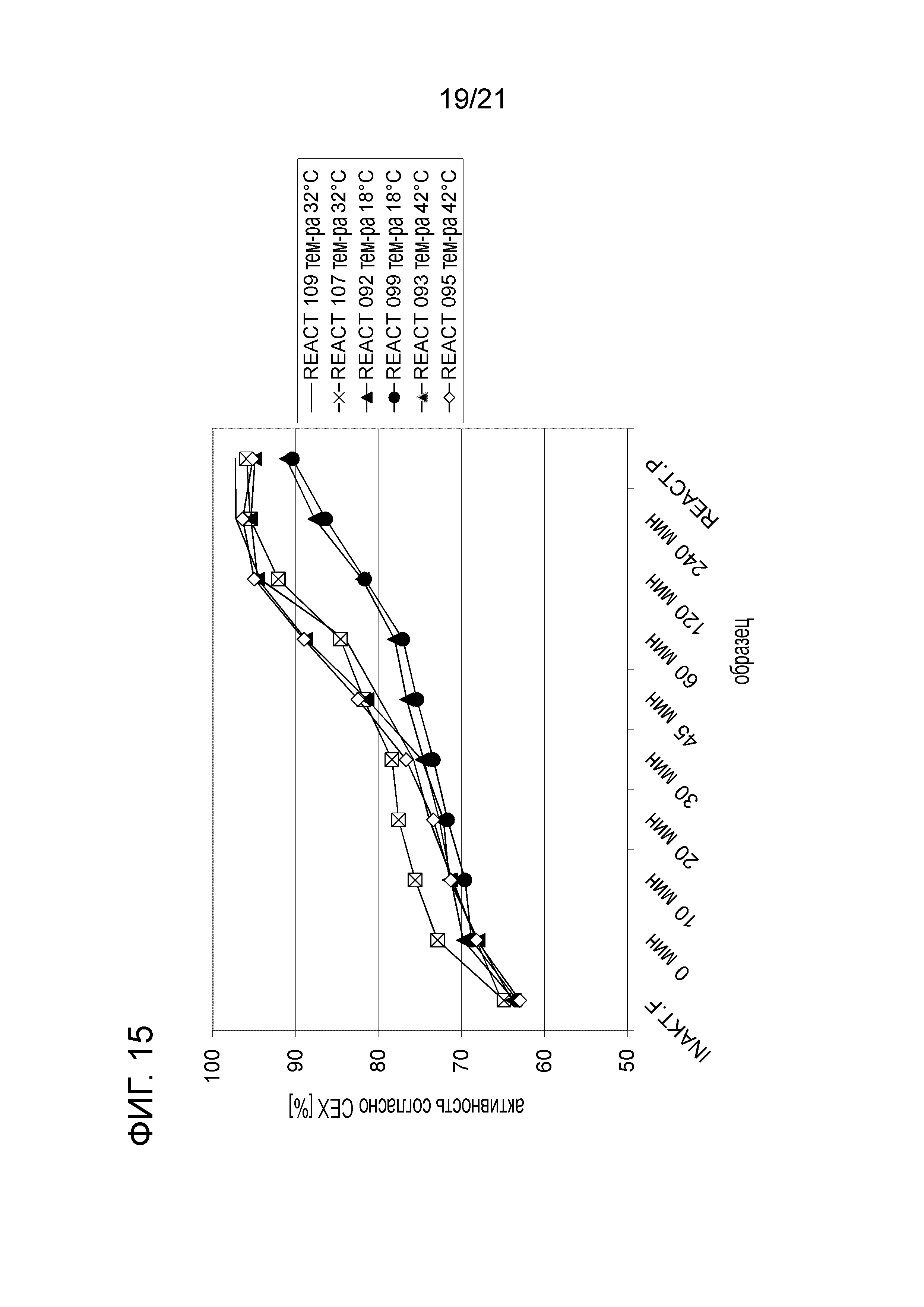
Фигура 15 демонстрирует кинетику селективного восстановления активности согласно CEX при различных температурах инкубации.
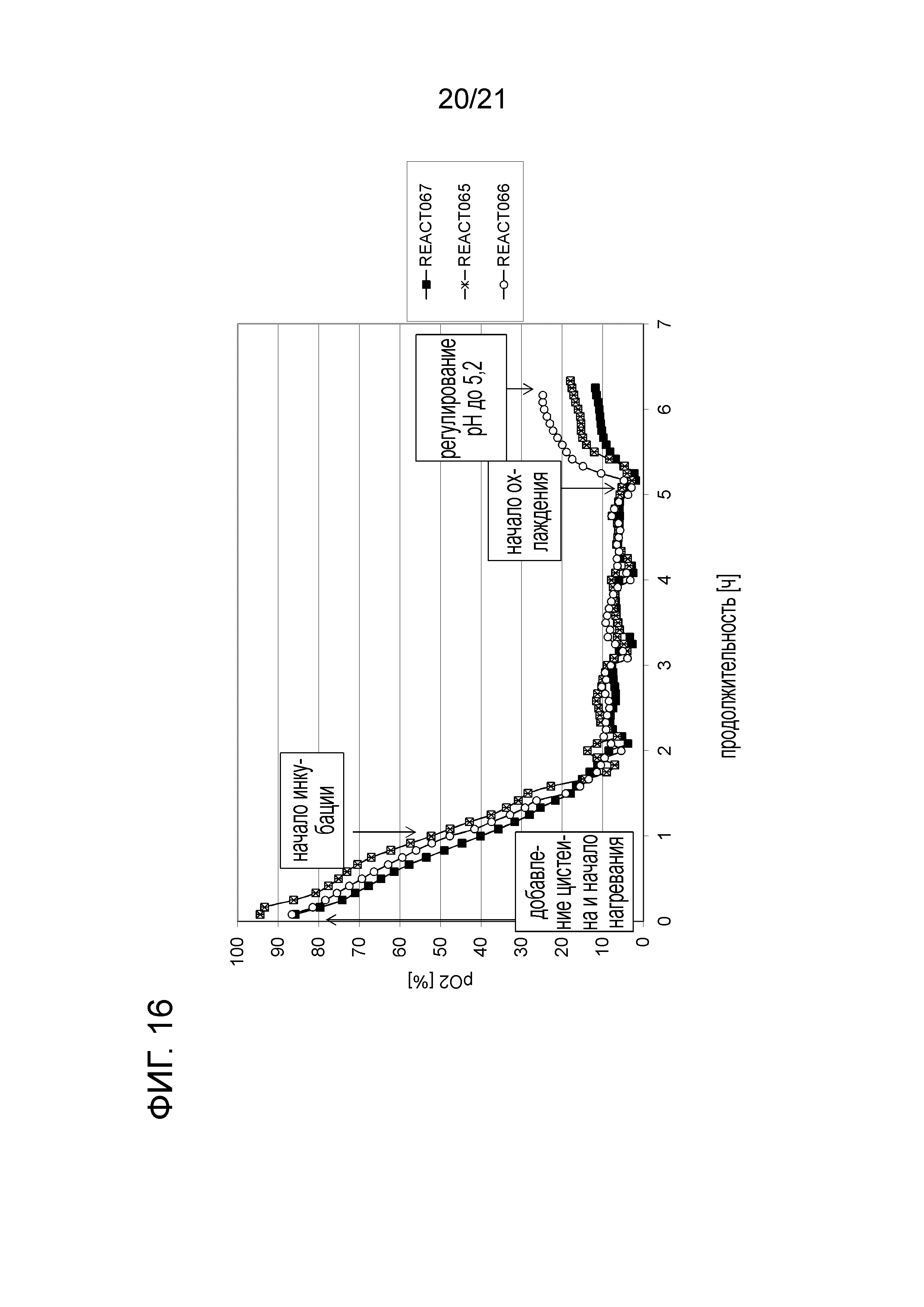
Фигура 16 демонстрирует наложение графиков растворенного кислорода из квалификационных опытов с моделью в уменьшенном масштабе с указанием на продолжительность различных этапов способа (добавления цистеина, нагревания, инкубации, охлаждения и регулирования pH).
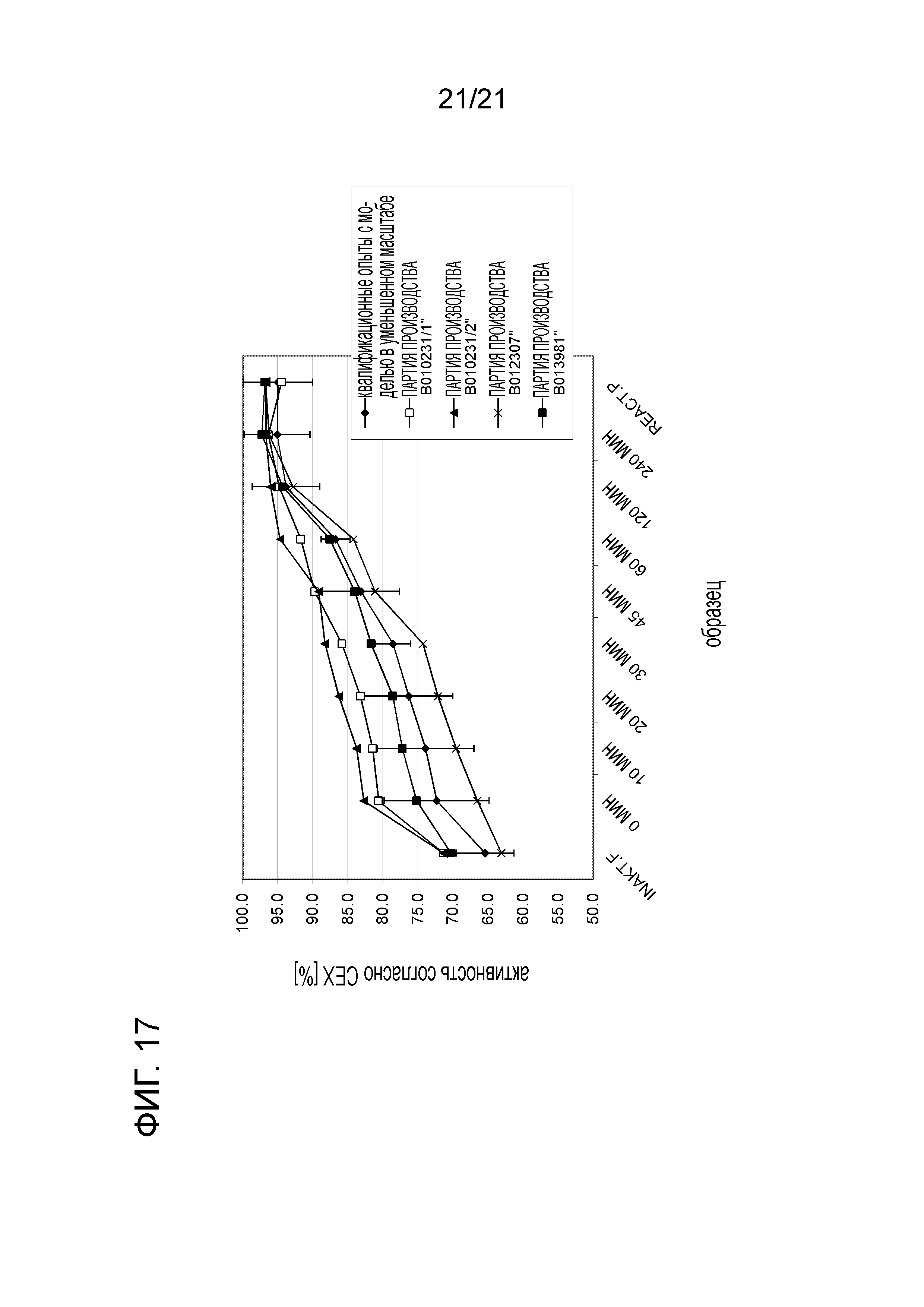
Фигура 17 демонстрирует кинетику активности согласно CEX в опытах в промышленном масштабе и опытов с моделью в уменьшенном масштабе во время селективного восстановления.
ПОДРОБНОЕ ОПИСАНИЕ РАСКРЫТИЯ
Целью раскрытия является предоставление способов селективного восстановления CysL97 в антигенсвязывающих участках определенных антител против IL-17 или их антигенсвязывающих фрагментов, таких как секукинумаб. Посредством «селективного восстановления» обозначают, что CysL97 в раскрытых антителах против IL-17 или их антигенсвязывающих фрагментах восстанавливается до окисленной формы без восстановления консервативных цистеиновых остатков данных антител. Консервативные цистеиновые остатки, в случае классического антитела IgG1, представляют собой: два дисульфидных мостика в шарнирной области, два межцепочечных дисульфидных мостика (один из каждого Fab), четыре внутрицепочечных дисульфидных мостика в Fc-области и восемь внутрицепочечных дисульфидных мостиков в Fab-участке антитела. Во время процесса селективного восстановления может происходить временное восстановление консервативных цистеинов некоторых антител в конкретном препарате. Однако по завершении реакции подавляющее большинство консервативных цистеинов, которые были временно восстановлены, будут повторно окисляться с образованием консервативных дисульфидных связей, обнаруженных в типичных антителах, приводя к высокой чистоте и активности в селективно восстановленном препарате (то есть очищенном препарате) антител. Понятно, что не ожидается, что после завершения реакции селективного восстановления селективно восстановленный препарат (то есть очищенный препарат) не должен содержать 100% интактных антител; вместо этого селективно восстановленный препарат в идеале должен содержать по меньшей мере приблизительно 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93 94, 95, 96, 97, 98, 99 или приблизительно 100% (относительно теоретического максимума) интактных антител, как измерено согласно CE-SDS.
Термин «содержащий» охватывает «включающий», а также «состоящий», напр., композиция, «содержащая» X, может состоять исключительно из X или может включать что-либо дополнительно, напр., X+Y.
Термин «приблизительно» по отношению к численному значению x обозначает, например, +/-10%. При использовании перед числовым диапазоном или рядом чисел термин «приблизительно» применяется к каждому числу в последовательности, напр., фразу «приблизительно 1-5» следует интерпретировать как «приблизительно 1 - приблизительно 5» или, напр., фразу «приблизительно 1, 2, 3, 4» следует интерпретировать как «приблизительно 1, приблизительно 2, приблизительно 3, приблизительно 4» и т.д.
Относительная молекулярная масса секукинумаба на основании посттрансляционной аминокислотной последовательности составляет 147944 Дальтон. Данную молекулярную массу (т.е., 147944 Дальтон) применяют при подсчете значений моляльности секукинумаба и молярных соотношений на протяжении всего настоящего раскрытия. Однако во время образования в клетках CHO С-концевой лизин обычно удаляют из каждой тяжелой цепи. Относительная молекулярная масса секукинумаба с отсутствующим С-концевым лизином из каждой тяжелой цепи составляет 147688 Дальтон. Препарат секукинумаба содержит смесь молекул с остатками С-концевого лизина и без них в тяжелой цепи. Значения моляльности секукинумаба (и соотношения, использующие данные значения моляльности), применяемые в настоящем раскрытии, являются, таким образом, оценками, а термин «около», «приблизительно» и тому подобное в отношении к данным числовым значениям охватывает по меньшей мере данные колебания в относительной молекулярной массе и полученные в результате этого расчеты.
Слово «по существу» не исключает «полностью», напр., композиция, которая «по существу не содержит» Y, может полностью не содержать Y. При необходимости слово «по существу» может быть удалено из определения раскрытия.
Термин «антитело», как упоминается в данной заявке, включает антитела в целом и любой антигенсвязывающей участок или его одиночные цепи. Встречающееся в природе «антитело» представляет собой гликопротеин, содержащий по меньшей мере две тяжелые (H) цепи и две легкие (L) цепи, взаимосвязанные дисульфидными связями. Каждая тяжелая цепь содержит вариабельную область тяжелой цепи (сокращенную в данной заявке как VH) и константную область тяжелой цепи. Константная область тяжелой цепи содержит три домена, CH1, CH2 и CH3. Каждая легкая цепь содержит вариабельную область легкой цепи (сокращенную в данной заявке как VL) и константную область легкой цепи. Константная область легкой цепи содержит один домен, CL. VH и VL области могут быть дополнительно подразделены на области гипервариабельности, обозначенные термином гипервариабельные области или участки, определяющие комплементарность (CDR), чередующиеся с областями, которые являются более консервативными, обозначенными термином каркасные области (FR). Каждая из VH и VL состоит из трех CDR и четырех FR, расположенных от аминоконца к карбоксиконцу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области тяжелых и легких цепей содержат связывающий домен, который взаимодействует с антигеном. Константные области антител могут опосредовать связывание иммуноглобулина с тканями или факторами хозяина, включая различные клетки иммунной системы (напр., эффекторные клетки) и первый компонент (C1q) классической системы комплемента.
Термин «антигенсвязывающий фрагмент» антитела, как используется в данной заявке, относится к фрагментам антитела, которые сохраняют способность специфически связываться с антигеном (напр., IL-17). Было показано, что антигенсвязывающая функция антитела может выполняться на фрагментах полноразмерного антитела. Примеры связывающих фрагментов, охваченные термином «антигенсвязывающий участок» антитела, включают Fab-фрагмент, моновалентный фрагмент, состоящий из VL, VH, CL и CH1 домена; F(ab)2 фрагмент, бивалентный фрагмент, содержащий два Fab-фрагмента, связанных дисульфидным мостиком в шарнирной области; Fd-фрагмент, состоящий VH и CH1 домена; Fv-фрагмент, состоящий из VL и VH домена одного плеча антитела; dAb-фрагмент (Ward et al., 1989 Nature 341:544-546), который состоит из VH домена; и выделенный CDR. Иллюстративные антигенсвязывающие участки включают CDR секукинумаба, как изложено в SEQ ID NO:1-6 и 11-13 (Таблица 1), предпочтительно CDR3 тяжелой цепи. Более того, хотя два домена Fv-фрагмента, VL и VH, кодируются отдельными генами, они могут быть соединены с применением рекомбинантных способов, посредством синтетического линкера, который позволяет им составлять единую белковую цепь, в которой пары VL- и VH-областей образуют моновалентные молекулы (известные как одноцепочечная цепь Fv (scFv); см., напр., Bird et al., 1988 Science 242:423-426; и Huston et al., 1988 Proc. Natl. Acad. Sci. 85:5879-5883). Данные одноцепочечные антитела также предназначены для охвата термином «антитело». Одноцепочечные антитела и антигенсвязывающие участки получают с применением общепринятых методик, известных квалифицированным специалистам в данной области.
«Выделенное антитело», как используется в данной заявке, относится к антителам, которые по существу не содержат других антител, имеющих иную антигеномную специфичность (напр., выделенные антитела, которые специфически связывают IL-17, по существу не содержат антител, которые специфически связывают антигеномы, не являющиеся IL-17). Термин «моноклональное антитело» или «композиция моноклональных антител», как используется в данной заявке, относится к препарату молекул антител одномолекулярной композиции. Термин «человеческое антитело», как используется в данной заявке, предназначено для включения антител, имеющих вариабельные области, в которых и каркасные, и CDR области получены из последовательностей человеческого происхождения. Нет необходимости, чтобы «человеческое антитело» вырабатывалось человеком, тканями человека или клетками человека. Человеческие антитела раскрытия могут включать аминокислотные остатки, не кодируемые последовательностями человека (напр., мутации, вносимые случайным или сайтспецифическим мутагенезом in vitro, путем добавления N-нуклеотида в соединениях in vivo при рекомбинации генов антитела или соматической мутации in vivo). В некоторых вариантах осуществления раскрытых способов и композиций антитело против IL-17 представляет собой человеческое антитело, выделенное антитело и/или моноклонального антитело.
Термин «IL-17» относится к IL-17A, ранее известному как CTLA8, и включает IL-17A дикого типа от различных видов (напр., человека, мыши и обезьяны), полиморфные варианты IL-17A и функциональные эквиваленты IL-17A. Функциональные эквиваленты IL-17A в соответствии с настоящим раскрытием предпочтительно имеют по меньшей мере приблизительно 65%, 75%, 85%, 95%, 96%, 97%, 98% или даже 99% общую идентичность последовательностей с IL-17A дикого типа (напр., IL-17A человека), и по существу сохраняют способность индуцировать выработку IL-6 фибробластами дермы человека.
Термин «KD» предназначен для обозначения скорости диссоциации конкретного взаимодействия антитело-антиген. Термин «KD», как используется в данной заявке, предназначен для обозначения постоянной диссоциации, которая получается из отношения Kd к Ka (т.е. Kd/Ka) и выражается в виде молярной концентрации (M). Значения KD для антител могут быть определены с использованием методов, хорошо известных в данной области. В способе определения KD антитела используется поверхностный плазмонный резонанс или используется биосенсорная система, например, система Biacore®. В некоторых вариантах осуществления антитело против IL-17 или антигенсвязывающий фрагмент, напр., секукинумаб, имеет KD, составляющий приблизительно 100-250 пМ для IL-17 человека.
Термин «аффинность» относится к силе взаимодействия между антителом и антигеном в единых иммунодоминантных сайтах. В каждом иммунодоминантном сайте вариабельная область антитела, «плечо», взаимодействует посредством слабых нековалентных сил с антигеном в ряде сайтов; чем больше взаимодействий, тем сильнее аффинность. В данной области известны стандартные анализы для оценки аффинности связывания антител к IL-17 различных видов, включая, например, ELISA, вестерн-блоты и RIA. Кинетика связывания (например, аффинность связывания) антител также может быть оценена с помощью стандартных анализов, известных в данной области, таких как анализ Biacore.
Антитело, которое «ингибирует» одно или более функциональных свойств (напр., биохимическую, иммунохимическую, клеточную, физиологическую или другие виды биологической активности и тому подобное) данных IL-17, как определено в соответствии с методологиями, известными в данной области и описанными в данной заявке, как будет понятно, относится к статистически значимому снижению конкретной активности по отношению к активности, наблюдаемой в отсутствии антитела (или когда присутствует контрольное антитело неактуальной специфичности). Антитело, которое ингибирует активность IL-17, влияет на статистически значимое снижение, например, по меньшей мере на 10% от измеренного параметра, по меньшей мере на 50, 80 или 90%, а в некоторых вариантах осуществления раскрытых способов и композиций используемое антитело против IL-17 может ингибировать более 95%, 98% или 99% функциональной активности IL-17.
«Ингибируют IL-6», как используется в данной заявке, относится к способности антитела против IL-17 или его антигенсвязывающего фрагмента (напр., секукинумаба) снижать выработку IL-6 из первичных фибробластов дермы человека. Выработка IL-6 в первичных (дермальных) фибробластах человека зависит от IL-17 (Hwang et al., (2004) Arthritis Res Ther; 6:R120-128). Кратко, фибробласты дермы человека стимулируются рекомбинантными IL-17 в присутствии различных концентраций молекул, связывающих IL-17, или рецептора к IL-17 человека с Fc-частью. В качестве негативного контроля можно успешно использовать химерное анти-CD25 антитело Simulect® (базиликсимаб). Супернатант берут после 16 ч стимуляции и анализируют на IL-6 посредством ELISA. Антитело против IL-17 или его антигенсвязывающий фрагмент, напр., секукинумаб, как правило, имеет IC50 для ингибирования выработки IL-6 (в присутствии 1 нМ IL-17 человека), составляющей приблизительно 50 нМ или менее (напр., от приблизительно 0,01 до приблизительно 50 нМ) при тестировании, как указано выше, т.е. указанную ингибирующую активность измеряют по выработке IL-6, индуцированной hu-IL-17 в фибробластах дермы человека. В некоторых вариантах осуществления раскрытых способов и композиций антитела против IL-17 или их антигенсвязывающие фрагменты, напр., секукинумаб, и их функциональные производные имеют IC50 для ингибирования выработки IL-6, как определено выше, составляющей приблизительно 20 нМ или менее, более предпочтительно составляющей приблизительно 10 нМ или менее, более предпочтительно составляющей приблизительно 5 нМ или менее, более предпочтительно составляющей приблизительно 2 нМ или менее, более предпочтительно составляющей приблизительно 1 нМ или менее.
Термин «производное», если не указано иное, используют для определения вариантов аминокислотной последовательности и ковалентных модификаций (напр., пегилирования, дезаминирования, гидроксилирования, фосфорилирования, метилирования и т.д.) антитела против IL-17 или его антигенсвязывающего фрагмента, напр., секукинумаба, в соответствии с настоящим раскрытием, напр., специфической последовательности (напр., вариабельного домена). «Функциональное производное» включает молекулу, имеющую качественную биологическую активность, общую с раскрытыми антителами против IL-17. Функциональное производное включает фрагменты и аналоги пептидов антитела против IL-17, как раскрыто в данной заявке. Фрагменты содержат области в последовательности полипептида в соответствии с настоящим раскрытием, напр., специфической последовательности. Функциональные производные антител против IL-17, раскрытые в данной заявке (напр., функциональные производные секукинумаба), предпочтительно включают VH- и/или VL-домен, имеющий по меньшей мере приблизительно 65%, 75%, 85%, 95%, 96%, 97%, 98%, или 99% общую идентичность последовательностей с последовательностями VH и/или VL антител против IL-17 и их антигенсвязывающих фрагментов, раскрытых в данной заявке (напр., последовательностями VH- и/или VL- Таблицы 1), и по существу сохраняет способность связывать IL-17 человека или, напр., ингибируют выработку IL-6 IL-17-индуцированными фибробластами дермы человека.
Фраза «по существу идентичный» обозначает, что релевантная аминокислотная или нуклеотидная последовательность (напр., VH или VL домен) будет идентичной или иметь несущественные отличия (напр., за счет замещения консервативной аминокислоты) при сравнении с конкретной ссылочной последовательностью. Несущественные отличия включают небольшие изменения аминокислот, такие как 1 или 2 замещения в 5 аминокислотной последовательности конкретной области (напр., VH или VL домена). В случае антител второе антитело имеет такую же специфичность и имеет по меньшей мере 50% аффинности к этому антителу. Последовательности, по существу идентичные (например, последовательности с по меньшей мере приблизительно 85% идентичностью) с последовательностями, раскрытыми в данной заявке, также являются частью данной заявки. В некоторых вариантах осуществления идентичность последовательностей производного антитела против IL-17 (напр., производного секукинумаба, напр., биоподобного антитела секукинумаб) может составлять приблизительно 90% или более, напр., 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или выше по отношению к раскрытым последовательностям.
«Идентичность» в отношении нативного полипептида и его функционального производного определяется в данной заявке, как процентное содержание аминокислотных остатков в кандидатной последовательности, которые являются идентичными остаткам соответствующего нативного полипептида, после выравнивания последовательностей и введения гэпов, при необходимости, чтобы достичь максимального процента идентичности, и не рассматривая любые консервативные замещения как часть идентичности последовательностей. Ни N- или С-терминальные расширения, ни вставки не должны истолковываться как уменьшающие идентичности. Хорошо известны методы и компьютерные программы для выравнивания. Процент идентичности может быть определен с помощью стандартных алгоритмов выравнивания, например, Basic Local Alignment Search Tool (BLAST), описанного Altshul et al. ((1990) J. Mol. Biol., 215: 403 410); алгоритма Needleman et al. ((1970) J. Mol. Biol., 48: 444 453); или алгоритма Meyers et al. ((1988) Comput. Appl. Biosci., 4: 11 17). Набор параметров может являться матрицей замен Blosum 62 со штрафом за пропуск в последовательности, составляющим 12, штрафом за продолжение гэпа, составляющим 4, и штрафом за пробел в рамке, составляющим 5. Процент идентичности между двумя аминокислотными или нуклеотидными последовательностями также можно определить с применением алгоритма E. Meyers и W. Miller ((1989) CABIOS, 4:11-17) который включен в программу ALIGN (версия 2.0), с применением таблицы весов замен остатков PAM120, штрафа за продление гэпа, составляющим 12, и штрафа за пропуск в последовательности, составляющим 4.
«Аминокислота (аминокислоты)» относится, напр., ко всем встречающимся в природе L-α-аминокислотам и включает D-аминокислоты. Фраза «варианты аминокислотной последовательности» относится к молекулам с некоторыми различиями в их аминокислотных последовательностях в сравнении с последовательностями в соответствии с настоящим раскрытием. Варианты аминокислотной последовательности антитела в соответствии с настоящим раскрытием, напр., специфической последовательности, все еще имеют способность связывать IL-17 человека или, напр., ингибировать выработку IL-6 IL-17-индуцированными фибробластами дермы человека. Варианты аминокислотной последовательности включают замещающие варианты (варианты, которые имеют по меньшей мере один удаленный аминокислотный остаток и другую аминокислоту, вставленную на ее место в том же положении в полипептиде в соответствии с настоящим раскрытием), инсерционные варианты (варианты с одной или более аминокислотами, вставленными непосредственно вблизи аминокислоты в конкретном положении в полипептиде в соответствии с настоящим раскрытием) и делеционные варианты (варианты с одной или более аминокислотами, удаленными в полипептиде в соответствии с настоящим раскрытием).
Фразы «свободный цистеин», «нетрадиционный цистеин» и «неспаренный цистеин» взаимозаменяемо относятся к цистеину, который не участвует в консервативных дисульфидных связях антител. Свободный цистеин может присутствовать в каркасной области или вариабельной области (напр., в пределах CDR) антитела. В секукинумабе аминокислота восемь L-CDR3, как изложено в SEQ ID NO:6, которая соответствует аминокислоте 97 вариабельной области легкой цепи, как изложено в SEQ ID NO:10 (в данной заявке именуемая далее CysL97) представляет собой свободный цистеин. Каждая молекула секукинумаба содержит два данных свободных цистеиновых остатка - по одному в каждом VL домене. Раскрытые способы способны селективно восстанавливать оба свободных цистеиновых остатка в секукинумабе. В некоторых вариантах осуществления, напр., вследствие делеций и/или замещений в легкой цепи раскрытого антитела против IL-17 или его антигенсвязывающего фрагмента, свободный цистеин не будет присутствовать в положении CysL97. В данном случае соответствующий свободный цистеин является мишенью реакции селективного восстановления и включен в термин «CysL97».
Антитела против IL-17 и их антигенсвязывающие фрагменты
Различные раскрытые способы относятся к селективному восстановлению определенных антител против IL-17 или их антигенсвязывающих фрагментов (например, секукинумаба). В одном варианте осуществления антитело против IL-17 или его антигенсвязывающий фрагмент содержит по меньшей мере один вариабельный домен тяжелой цепи иммуноглобулина (VH), содержащий гипервариабельные области CDR1, CDR2 и CDR3, где указанный CDR1 имеет аминокислотную последовательность SEQ ID NO:1, указанный CDR2 имеет аминокислотную последовательность SEQ ID NO:2, а указанный CDR3 имеет аминокислотную последовательность SEQ ID NO:3. В одном варианте осуществления антитело против IL-17 или его антигенсвязывающий фрагмент содержит по меньшей мере один вариабельный домен легкой цепи иммуноглобулина (VL), содержащий гипервариабельные участки CDR1', CDR2' и CDR3', причем указанный CDR1' имеет аминокислотную последовательность SEQ ID NO: 4, CDR2' имеет аминокислотную последовательность SEQ ID NO: 5, а указанный CDR3' имеет аминокислотную последовательность SEQ ID NO: 6. В одном варианте осуществления антитело против IL-17 или его антигенсвязывающий фрагмент содержит по меньшей мере один вариабельный домен тяжелой цепи иммуноглобулина (VH), содержащий гипервариабельные области CDR1-x, CDR2-x и CDR3-x, где указанная CDR1-x имеет аминокислотную последовательность SEQ ID NO:11, указанная CDR2-x имеет аминокислотную последовательность SEQ ID NO:12, а указанная CDR3-x имеет аминокислотную последовательность SEQ ID NO:13.
В одном варианте осуществления антитело против IL-17 или его антигенсвязывающий фрагмент содержит по меньшей мере один VH домен иммуноглобулина и по меньшей мере один VL домен иммуноглобулина, где: a) VH домен содержит (напр., в последовательности): i) гипервариабельные области CDR1, CDR2 и CDR3, где указанная CDR1 имеет аминокислотную последовательность SEQ ID NO:1, указанная CDR2 имеет аминокислотную последовательность SEQ ID NO:2, а указанная CDR3 имеет аминокислотную последовательность SEQ ID NO:3; или ii) гипервариабельные области CDR1-x, CDR2-x и CDR3-x, где указанная CDR1-x имеет аминокислотную последовательность SEQ ID NO:11, указанная CDR2-x имеет аминокислотную последовательность SEQ ID NO:12, а указанная CDR3-x имеет аминокислотную последовательность SEQ ID NO:13; и b) VL домен содержит (напр., в последовательности) гипервариабельные области CDR1', CDR2' и CDR3', где указанная CDR1' имеет аминокислотную последовательность SEQ ID NO:4, указанная CDR2' имеет аминокислотную последовательность SEQ ID NO:5, а указанная CDR3' имеет аминокислотную последовательность SEQ ID NO:6.
В одном варианте осуществления антитело против IL-17 или его антигенсвязывающий фрагмент содержит: a) вариабельный домен тяжелой цепи иммуноглобулина (VH), содержащий аминокислотную последовательность, как изложено в виде SEQ ID NO:8; b) вариабельный домен легкой цепи (VL) иммуноглобулина, содержащий аминокислотную последовательность, как изложено в виде SEQ ID NO:10; c) VH домен иммуноглобулина, содержащий аминокислотную последовательность, как изложено в виде SEQ ID NO:8 и VL домен иммуноглобулина содержащий аминокислотную последовательность, как изложено в виде SEQ ID NO:10; d) VH домен иммуноглобулина содержащий гипервариабельные области, как изложено в виде SEQ ID NO:1, SEQ ID NO:2, и SEQ ID NO:3; e) VL домен иммуноглобулина, содержащий гипервариабельные области, как изложено в виде SEQ ID NO:4, SEQ ID NO:5 и SEQ ID NO:6; f) VH домен иммуноглобулина, содержащий гипервариабельные области, как изложено в виде SEQ ID NO:11, SEQ ID NO:12 и SEQ ID NO:13; g) VH домен иммуноглобулина, содержащий гипервариабельные области, как изложено в виде SEQ ID NO:1, SEQ ID NO:2, и SEQ ID NO:3 и VL домен иммуноглобулина, содержащий гипервариабельные области, как изложено в виде SEQ ID NO:4, SEQ ID NO:5 и SEQ ID NO:6; или h) VH домен иммуноглобулина, содержащий гипервариабельные области, как изложено в виде SEQ ID NO:11, SEQ ID NO:12 и SEQ ID NO:13 и VL домен иммуноглобулина, содержащий гипервариабельные области, как изложено в виде SEQ ID NO:4, SEQ ID NO:5 и SEQ ID NO:6.
Для удобства ссылок аминокислотные последовательности гипервариабельных областей моноклонального антитела секукинумаб, основанные на определении Кабата и определенные рентгенографическим анализом и с использованием подхода Chothia и его коллег, представлены в таблице 1 ниже.
|
Таблица 1: Аминокислотные последовательности гипервариабельных областей моноклональных антител секукинумаба.
В предпочтительных вариантах осуществления домены константной области предпочтительно также включают подходящие домены константной области человека, например, как описано в «Sequences of Proteins of Immunological Interest», Kabat E.A. et al., Департамент здравоохранения и социальных служб США, Служба общественного здравоохранения, Национальный институт здравоохранения. ДНК, кодирующая VL секукинумаба, изложена в SEQ ID NO:9. ДНК, кодирующая VH секукинумаба, изложена в SEQ ID NO:7.
В некоторых вариантах осуществления антитело против IL-17 или его антигенсвязывающий фрагмент (напр., секукинумаб) содержит три CDR SEQ ID NO:10. В других вариантах осуществления антитело против IL-17 или его антигенсвязывающий фрагмент содержит три CDR SEQ ID NO:8. В других вариантах осуществления антитело против IL-17 или его антигенсвязывающий фрагмент содержит три CDR SEQ ID NO:10 и три CDR SEQ ID NO:8. CDR SEQ ID NO:8 и SEQ ID NO:10 можно найти в Таблице 1. Свободный цистеин в легкой цепи (CysL97) можно увидеть в SEQ ID NO:6.
В некоторых вариантах осуществления антитело против IL-17 или его антигенсвязывающий фрагмент содержит легкую цепь SEQ ID NO:14. В других вариантах осуществления антитело против IL-17 или его антигенсвязывающий фрагмент содержит тяжелую цепь SEQ ID NO:15 (с С-концевым лизином или без него). В других вариантах осуществления антитело против IL-17 или его антигенсвязывающий фрагмент содержит легкую цепь SEQ ID NO:14 и тяжелую цепь SEQ ID NO:15 (с С-концевым лизином или без него). В некоторых вариантах осуществления, антитело против IL-17 или его антигенсвязывающий фрагмент содержит три CDR SEQ ID NO:14. В других вариантах осуществления антитело против IL-17 или его антигенсвязывающий фрагмент содержит три CDR SEQ ID NO:15. В других вариантах осуществления антитело против IL-17 или его антигенсвязывающий фрагмент содержит три CDR SEQ ID NO:14 и три CDR SEQ ID NO:15. CDR SEQ ID NO:14 и SEQ ID NO:15 можно найти в Таблице 1.
Гипервариабельные области могут быть связаны с любыми видами каркасных областей, хотя предпочтительно они имеют человеческое происхождение. Подходящие каркасные области описаны у Kabat E.A. et al., ibid. Предпочтительный каркас тяжелой цепи представляет собой каркас тяжелой цепи человека, например каркас антитела секукинумаб. Он состоит в последовательности, например, из областей FR1 (аминокислота 1-30 SEQ ID NO: 8), FR2 (аминокислота 36-49 SEQ ID NO: 8), FR3 (аминокислота 67-98 SEQ ID NO: 8) и FR4 (аминокислота 117-127 из SEQ ID NO: 8). Принимая во внимание определенные с помощью рентгеновского анализа гипервариабельные участки секукинумаба, другой предпочтительный каркас тяжелой цепи состоит из последовательности FR1-x (аминокислота 1-25 из SEQ ID NO: 8), FR2-x (аминокислота 36-49 SEQ ID NO: 8), FR3-x (аминокислоты от 61 до 95 SEQ ID NO: 8) и FR4 (аминокислоты от 119 до 127 из SEQ ID NO: 8) областей. Таким же образом каркас легкой цепи состоит из последовательностей FR1'(аминокислоты 1-23 из SEQ ID NO: 10), FR2' (аминокислота 36-50 из SEQ ID NO: 10), FR3'(аминокислоты от 58 до 89 SEQ ID NO: 10) и FR4 '(аминокислота от 99 до 109 SEQ ID NO: 10) областей.
В одном варианте осуществления антитело против IL-17 или его антигенсвязывающий фрагмент (напр., секукинумаб) выбирают из антител против IL-17 человека, которые содержат по меньшей мере: a) тяжелую цепь иммуноглобулина или ее фрагмент, содержащий вариабельный домен, содержащий, в последовательности, гипервариабельные области CDR1, CDR2 и CDR3 и константную часть или ее фрагмент тяжелой цепи человека; где указанная CDR1 имеет аминокислотную последовательность SEQ ID NO:1, указанная CDR2 имеет аминокислотную последовательность SEQ ID NO:2, а указанная CDR3 имеет аминокислотную последовательность SEQ ID NO:3; и b) легкую цепь иммуноглобулина или ее фрагмент, содержащий вариабельный домен, содержащий, в последовательности, гипервариабельные области CDR1', CDR2', и CDR3' и константную часть или ее фрагмент легкой цепи человека, где указанная CDR1' имеет аминокислотную последовательность SEQ ID NO: 4, указанная CDR2' имеет аминокислотную последовательность SEQ ID NO:5, а указанная CDR3' имеет аминокислотную последовательность SEQ ID NO:6.
В одном варианте осуществления антитело против IL-17 или его антигенсвязывающий фрагмент выбирают из одноцепочечного антитела или его антигенсвязывающего фрагмента, который содержит антигенсвязывающий сайт, содержащий: a) первый домен, содержащий, в последовательности, гипервариабельные области CDR1, CDR2 и CDR3, где указанная CDR1 имеет аминокислотную последовательность SEQ ID NO:1, указанная CDR2 имеет аминокислотную последовательность SEQ ID NO:2, а указанная CDR3 имеет аминокислотную последовательность SEQ ID NO:3; и b) второй домен, содержащий, в последовательности, гипервариабельные области CDR1', CDR2' и CDR3', где указанная CDR1' имеет аминокислотную последовательность SEQ ID NO:4, указанная CDR2' имеет аминокислотную последовательность SEQ ID NO:5, а указанная CDR3' имеет аминокислотную последовательность SEQ ID NO:6; и c) пептидный линкер, который связан либо с N-концевой частью первого домена и с C-концевой частью второго домена, либо или с C-концевой частью первого домена и с N-концевой частью второго домена.
В качестве альтернативы, антитело против IL-17 или его антигенсвязывающий фрагмент, как применяется в раскрытых способах, может включать производное антител против IL-17, изложенное в данной заявке посредством последовательности (напр., пегилированная версия секукинумаба). В качестве альтернативы, VH или VL домен антитела против IL-17 или его антигенсвязывающего фрагмента, применяемые в раскрытых способах, могут иметь VH или VL домены, которые являются по существу идентичными VH или VL доменам, изложенным в данной заявке (напр., домены, изложенные в SEQ ID NO:8 и 10). Антитело против IL-17 человека, раскрытое в данной заявке, может включать тяжелую цепь, которая по существу идентична тяжелой цепи, изложенной в виде SEQ ID NO:15 (с С-концевым лизином или без него) и/или легкую цепь, которая по существу идентична легкой цепи, изложенной в виде SEQ ID NO:14. Антитело против IL-17 человека, раскрытое в данной заявке, может содержать тяжелую цепь, которая содержит SEQ ID NO:15 (с С-концевым лизином или без него) и легкую цепь, которая содержит SEQ ID NO:14. Антитело человека против IL-17, раскрытое в данной заявке, может включать: a) одну тяжелую цепь, которая содержит вариабельный домен, имеющий аминокислотную последовательность, по существу идентичную аминокислотной последовательности, показанной в SEQ ID NO:8, и константную часть тяжелой цепи человека; и b) одну легкую цепь, которая содержит вариабельный домен, имеющий аминокислотную последовательность, по существу идентичную аминокислотной последовательности, показанной в SEQ ID NO:10, и константную часть легкой цепи человека.
В качестве альтернативы, антитело против IL-17 или его антигенсвязывающий фрагмент, применяемое в раскрытых способах, может представлять собой вариант аминокислотной последовательности ссылочных антител против IL-17, изложенных в данной заявке, поскольку оно содержит CysL97. Раскрытие также включает антитела против IL-17 или их антигенсвязывающие фрагменты (напр., секукинумаб), в которых один или более аминокислотных остатков VH или VL доменов секукинумаба (но не CysL97), как правило, лишь немногие (напр., 1-10) изменены; например, посредством мутации, напр., сайт-направленного мутагенеза соответствующих последовательностей ДНК. Во всех таких случаях производных и вариантов антитело IL-17 или его антигенсвязывающий фрагмент способны ингибировать активность приблизительно 1 нМ (= 30 нг/мл) человеческого IL-17 в концентрации приблизительно 50 нМ или менее, приблизительно 20 нМ или менее, приблизительно 10 нМ или менее, приблизительно 5 нМ или менее, приблизительно 2 нМ или менее или более предпочтительно приблизительно 1 нМ или менее указанной молекулы на 50%, где указанную ингибирующую активность измеряют на выработку IL-6, индуцированную hu-IL-17 в фибробластах дермы человека, как описано в Примере 1 WO 2006/013107.
В некоторых вариантах осуществления антитела против IL-17 или их антигенсвязывающие фрагменты, напр., секукинумаб, связываются с эпитопом зрелого IL-17 человека, содержащим Leu74, Tyr85, His86, Met87, Asn88, Val124, Thr125, Pro126, Ile127, Val128, His129. В некоторых вариантах осуществления антитело против IL-17, напр., секукинумаб, связывается с эпитопом зрелого IL-17 человека, содержащим Tyr43, Tyr44, Arg46, Ala79, Asp80. В некоторых вариантах осуществления антитело против IL-17, напр., секукинумаб связывается с эпитопом гомодимера IL-17, имеющим две цепи зрелого IL-17 человека, где указанный эпитоп содержит Leu74, Tyr85, His86, Met87, Asn88, Val124, Thr125, Pro126, Ile127, Val128, His129 на одной цепь и Tyr43, Tyr44, Arg46, Ala79, Asp80 на другой цепи. Схема нумерации остатков, используемая для определения данных эпитопов, основана на том, что остаток один является первой аминокислотой зрелого белка (т.е., IL-17A, не содержащего N-концевого сигнального пептида из 23 аминокислот и начинающегося с глицина). Последовательность для незрелого IL-17A изложена в записи Swiss-Prot Q16552. В некоторых вариантах осуществления антитело против IL-17 имеет KD, составляющий приблизительно 100-200 pM. В некоторых вариантах осуществления антитело против IL-17 имеет IC50, составляющую приблизительно 0,4 нМ для нейтрализации биологической активности in vitro, составляющей приблизительно 0,67 нМ IL-17A человека. В некоторых вариантах осуществления абсолютная биодоступность (подкожно) вводимого антитела против IL-17 имеет диапазон приблизительно 60 - приблизительно 80%, напр., приблизительно 76%. В некоторых вариантах осуществления антитело против IL-17, такое как секукинумаб, имеет период полуэлиминации, составляющий приблизительно 4 недели (напр., от приблизительно 23 до приблизительно 35 дней, от приблизительно 23 до приблизительно 30 дней, напр., приблизительно 30 дней). В некоторых вариантах осуществления антитело против IL-17 (такое как секукинумаб) имеет Tmax, составляющее приблизительно 7-8 дней.
Особенно предпочтительными антителами против IL-17 или их антигенсвязывающими фрагментами, применяемыми в раскрытых способах, являются человеческие антитела, особенно секукинумаб, как описано в примерах 1 и 2 WO 2006/013107. Секукинумаб представляет собой рекомбинантное высокоаффинное полностью человеческое моноклональное антитело против человеческого интерлейкина-17А (IL-17A, IL-17) изотипа IgG1/каппа, который в настоящее время находится в клинических испытаниях для лечения иммуноопосредованных воспалительных состояний. Секукинумаб (см., напр., WO2006/013107 и WO2007/117749) обладает весьма высокой аффинностью для IL-17, т.е. KD, составляющим приблизительно 100-200 пМ, и IC50 для нейтрализации биологической активности in vitro приблизительно 0,67 нМ IL-17A человека, составляющей приблизительно 0,4 нМ. Таким образом, секукинумаб ингибирует антиген в молярном соотношении, составляющем приблизительно 1:1. Данная высокая связывающая аффинность делает антитело секукинумаб особенно подходящим для терапевтического использования. Более того, было определено, что секукинумаб имеет очень длительный период полужизни, т.е. приблизительно 4 недели, что делает возможным продолжительные периоды между введением, исключительное свойство при лечении хронических пожизненных расстройств, таких как ревматоидный артрит.
В данной заявке раскрыты способы селективного восстановления CysL97 в препаратах указанных выше антител против IL-17 и их антигенсвязывающих фрагментов (напр., секукинумаб). Раскрытые способы обычно могут выполняться на препаратах антител (напр., антител против IL-17, напр., секукинумабе), чтобы снизить стоимость. «Препарат» антител относится к композиции (напр., раствору), имеющей множество молекул антител. «Препарат» содержит любую жидкую композицию, содержащую антитело против IL-17 или его антигенсвязывающий фрагмент. Как таковой, препарат может содержать, напр., антитело против IL-17 или его антигенсвязывающий фрагмент, напр., секукинумаб, в воде или буфере, в элюате колонки, в диализном буфере и т.д. В некоторых вариантах осуществления первичный препарат антител содержит пул антител против IL-17 или их антигенсвязывающих фрагментов, напр., секукинумаб, в буфере (напр., Трис, напр., 1 мМ - 1 M Трис, pH 6,0-8,0) или в воде для инъекций. Перед добавлением восстанавливающего агента к антителу, препарат может быть отрегулирован посредством изменения уровней растворенного кислорода, раствора pH, концентрации антител и т.д. В некоторых вариантах осуществления перед добавлением восстанавливающего агента концентрацию антител (напр., секукинумаба) в препарате доводят до между приблизительно 4 мг/мл - приблизительно 19,4 мг/мл, напр., приблизительно 10 мг/мл - приблизительно 19,4 мг/мл, приблизительно 10 мг/мл - приблизительно 15,4 мг/мл, приблизительно 12 мг/мл - приблизительно 15 мг/мл или приблизительно 13,5 мг/мл. В некоторых вариантах осуществления перед добавлением восстанавливающего агента процентное насыщение кислорода в препарате доводят по меньшей мере до приблизительно 60% (как измерено с применением кислородного зонда, откалиброванного при 25°C), напр., по меньшей мере до приблизительно 80%. В некоторых вариантах осуществления перед добавлением восстанавливающего агента pH препарата доводят до приблизительно 7,3 - приблизительно 8,5, напр., приблизительно 7,8 - приблизительно 8,2, напр., приблизительно 7,9 - приблизительно 8,1, напр., приблизительно 8,0. Концентрацию антител, pH и уровень кислорода также можно регулировать тотчас после (или даже во время) добавления восстановителя, и таким образом, следует интерпретировать как эквивалентные.
Препараты антител против IL-17 или их антигенсвязывающих фрагментов для применения в раскрытых способах могут быть рекомбинантно продуцированы любыми клетками млекопитающих с применением любой клеточной линии млекопитающих, напр., клеток яичника китайского хомячка (CHO), клеток миеломы мыши NS0, клеток почки новорожденного хомяка (BHK), эмбриональной клеточной линии почки человека HEK-293, клеточной линии сетчатки человека Per.C6 (Crucell, NL), клона клеток HKB11 (полученных от слияния гибридных клеток HEK 293S с лимфомой Беркитта линии 2B8) и т.д. «Рекомбинантно продуцированы клетками млекопитающих» означает, что выработка антител в клетках млекопитающих достигается с применением технологии рекомбинантной ДНК. Препарат антител против IL-17, подвергаемый селективному восстановлению, может представлять собой пул антител, собранных из клеток млекопитающих посредством центрифугирования (с последующим очищением или без него). В качестве альтернативы, препарат антител против IL-17, подвергаемых селективному восстановлению, может представлять собой пул антител из дополнительной стадии нисходящей хроматографии, напр., элюат из колонки для аффинной хроматографии (напр., колонки белка А), анионообменной колонны, анионообменной колонны и т.д. В качестве альтернативы, препарат антител против IL-17, подвергаемых селективному восстановлению, может представлять собой пул антител из стадии нисходящей фильтрации, напр., глубинной фильтрации, нанофильтрации, ультрафильтрации и т.д. В качестве альтернативы, препарат антител против IL-17, подвергаемых селективному восстановлению, может представлять собой пул антител стадии нисходящей фильтрации, где пул обработали для удаления белков клетки-хозяина и/или для инактивации вирусов. В одном варианте осуществления препарат антител против IL-17, подвергаемых селективному восстановлению, представляет собой пул антител элюата белка А.
В зависимости от выбранных условий способа, напр., температуры, продолжительности реакции, рН и т. д., концентрация антител в исходном препарате будет варьировать. В некоторых вариантах осуществления концентрация антител против IL-17, применяемая в исходном препарате составляет от приблизительно 2 мг/мл до приблизительно 20 мг/мл, от приблизительно 3,8 мг/мл до приблизительно 19,5 мг/мл, от приблизительно 4 мг/мл до приблизительно 19,5 мг/мл, от приблизительно 10 мг/мл до приблизительно 19,4 мг/мл, напр., от приблизительно 10 мг/мл до приблизительно 15,4 мг/мл, напр., от приблизительно 12 мг/мл до приблизительно 15 мг/мл, напр., от приблизительно 13,5 мг/мл антител против IL-17 или их антигенсвязывающих фрагментов. Перед селективным восстановлением концентрация антител в первичном препарате антитела может быть отрегулирована при необходимости с применением воды для инъекций (WFI) или наиболее подходящего буфера.
Способы селективного восстановления, описанные в данной заявке, могут быть выполнены в сосуде любого размера. В некоторых вариантах осуществления сосуд имеет лабораторную шкалу (напр., 1 л - 2 л). В других вариантах осуществления сосуд имеет экспериментальный масштаб (напр., 12 л - 20 л). В дополнительных вариантах осуществления сосуд является коммерческого масштаба (напр., более чем 10000 л, напр., 14000 л, 15000 л, 16000 л и т.д.).
Восстанавливающие агенты
Восстанавливающие агенты представляют собой вещества, способные к донорству электронов в редокс (окислительно-восстановительной) реакции. Конкретно, данные агенты применяют для доставки водорода замаскированному (или блокированному) цистеину, присутствующему в антителе против IL-17 или его антигенсвязывающем фрагменте (напр., антителе секукинумаб). В способе, раскрытом в данной заявке, используются восстанавливающие агенты для селективного восстановления антитела против IL-17. Каждый восстанавливающий агент, относящийся к данной заявке, включает его производные (напр., соли, сложные эфиры и амиды). Таким образом, напр., ссылка на «цистеин» включает цистеин и цистеин-HCL, ссылка на «TCEP» включает TCEP и TCEP-HCL, ссылка на тиогликолевую кислоту включает тиогликолят натрия, и т.д. Восстанавливающие агенты для применения в раскрытых способах включают бисульфат натрия, аммиак, триэтилсилан, глицилцистеин, цианоборгидрид натрия, тиогликолят аммония, тиогликолят кальция, тиогликолят натрия, аскорбиновую кислоту, гидрохинон, аминометансульфокислоту, цистеиновую кислоту, цистеинсульфиновую кислоту, этандисульфоновую кислоту, этансульфоновую кислоту, гомотаурин, гипотаурин, изетионовую кислоту, меркаптоэтансульфокислоту, N-метилтаурин (MTAU), TCEP (трис(2-карбоксиэтил)фосфин гидрохлорид), N-N-диметил-N-N бис(меркаптоацетил)гидразин (DMH), дитиотреитол (DTT), 2-меркаптоэтанол (бета-меркаптоэтанол), 2-меркаптоуксусную кислоту (тиогликолевую кислоту, TGA), цистеин (L-цистеин), цистеамин (бета-меркаптоэтиламин, или MEA), глутатион и их комбинации. В некоторых вариантах осуществления восстанавливающий агент для применения в раскрытом способе представляет собой тиолсодержащий восстанавливающий агент (т.е. соединение, имеющее R-SH группу), напр., сероорганическое соединение. В некоторых вариантах осуществления восстанавливающий агент для применения в раскрытом способе представляет собой, напр., дитиотреитол (DTT), 2-меркаптоэтанол, 2-меркаптоуксусную кислоту, цистеин, цистеамин, глутатион и комбинации.
На силу восстанавливающего агента указывает его окислительно-восстановительный потенциал (редокс-потенциал), E°, который дается в вольтах (В) и традиционно определяется при pH 7,25°C. Например, стандартный окислительно-восстановительный потенциал, E°, для CSH/CSSC приводится в виде приблизительно от -0,20 В до приблизительно -0,23 В (pH 7,25°C) (P. C. Jocelyn (1967) Eu. J. Biochem 2:327-31; Liu «The role of Sulfur in Proteins», in The Proteins, 3rd Ed. (ed. Neurath) p. 250-252 Academic Press 1977). Стандартный окислительно-восстановительный потенциал, E°, DTT приводится в виде приблизительно -0,33 В (pH 7,25°C) (M.J.O'Neil, ed. by (2001). Merck Index: an encyclopedia of chemicals, drugs, & biologicals: 13th ed. (13. ed. ed.) United States: MERCK & CO INC.; Liu, supra). Стандартный окислительно-восстановительный потенциал, E°, глутатиона приводится в виде приблизительно -0,24 В или приблизительно -0,26 В (pH 7, 25°C) (Rost and Rapoport (1964) Nature 201:185; Gilbert (1990) Adv. Enzymol. Relat. Areas Mol. Biol. 63:69-172; Giles (2002) Gen. Physiol Biophys 21:65-72; Liu, supra). Стандартный окислительно-восстановительный потенциал, E°, 2-меркаптоэтанола приводится в виде приблизительно -0,26 В (Lee and Whitesides (1990) J. Org. Chem 58:642-647). В некоторых вариантах осуществления восстанавливающий агент имеет стандартный окислительно-восстановительный потенциал, E°, аналогичный цистеину (напр., от приблизительно -0,20 В до приблизительно -0,23 В, от приблизительно -0,20 В до приблизительно -0,22 В, от приблизительно -0,20 В до приблизительно -0,21 В, от приблизительно -0,21 В до приблизительно -0,23 В, от приблизительно -0,21 В до -0,22 В, от приблизительно -0,22 В до приблизительно -0,23 В, приблизительно -0,20 В, приблизительно -0,21 В, приблизительно -0,22 В, приблизительно -0,23 В).
Стандартный окислительно-восстановительный потенциал E° тиол-содержащих соединений можно измерять посредством термического анализа, восстановления NAD+, полярографии, реакции с Fe++ или исследований тиол-дисульфидного обмена (Jocelyn, supra; Borsook et al. (1937) J. Biol. Chem 117:281; Ghosh et al. (1932) J. Indian Chem. Soc. 9:43; Kolthoff et al. (1955) J. Am. Chem. Soc. 77:4739; Tanaka et al. (1955) J. Am. Chem. Soc. 77:2004; Kolthoff et al. (1955) J. Am. Chem. Soc. 77:4733; Eldjarn (1957) J. Am. Chem. Soc. 79:4589). В некоторых вариантах осуществления стандартный окислительно-восстановительный потенциал E° определяется посредством термического анализа, полярографии, реакции с Fe++ или исследований тиол-дисульфидного обмена, напр., предпочтительно посредством исследований тиол-дисульфидного обмена. В некоторых вариантах осуществления стандартный окислительно-восстановительный потенциал E° определяли при pH 7,25°C.
Восстанавливающий агент, в комбинации с препаратом антитела, образует «восстанавливающую смесь». Восстанавливающая смесь в дополнение к восстанавливающему агенту и антителу против IL-17 может содержать эксципиенты. Например, в определенных вариантах осуществления небольшая молярная доля окисленной формы (напр., цистина, цистамина) восстанавливающего агента может быть добавлена к восстанавливающей смеси либо одновременно с восстанавливающим агентом, либо последовательно, напр., через 10-30 минут или более после начала инкубации. Например, если восстанавливающим агентом является цистеин, то небольшое количество цистина может быть добавлено к восстанавливающей смеси, напр., одновременно с цистеином или, напр., через 15, 20, 30 минут после того, как цистеин скомбинировали с антителом против IL-17 или его антигенсвязывающим фрагментом. Таким образом, в некоторых вариантах осуществления восстанавливающая смесь содержит набор окислительно-восстановительных реагентов. Посредством «набора окислительно-восстановительных реагентов» обозначают редокс-пару или редокс-двойку, т.е., окисляющий и восстанавливающий агент, которые возникают на противоположных сторонах полууравнения (напр., восстанавливающий вид и его соответствующая окисленная форма, напр., Fe2+/Fe3+, цистеин:цистин, цистеамин/цистамин).
В зависимости от условий реакции (температуры, продолжительности реакции, количества антитела против IL-17 или его антигенсвязывающего фрагмента, pH и т.д.), концентрация восстанавливающего агента, применяемого в конкретной восстанавливающей смеси и реакции селективного восстановления, будет варьировать. В некоторых вариантах осуществления количество восстанавливающего агента, применяемого в восстанавливающей смеси, будет варьировать от приблизительно 1 до приблизительно 20 мМ. В некоторых вариантах осуществления концентрация восстанавливающего агента, задействованного в восстанавливающей смеси, составляет приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или 16 мМ. В одном варианте осуществления количество восстанавливающего агента (напр., цистеина) составляет между приблизительно 4 мМ и приблизительно 8 мМ, напр., 5,9 мМ, 6 мМ, 7,7 мМ, 7,9 мМ, 8 мМ.
В одном варианте осуществления восстанавливающий агент представляет собой бета-меркаптоэтанол. В определенных вариантах осуществления бета-меркаптоэтанол используют в концентрации, составляющей от приблизительно 2,0 мМ до приблизительно 8,0 мМ.
В одном варианте осуществления восстанавливающий агент представляет собой глутатион. В определенных вариантах осуществления глутатион используют в концентрации, составляющей от приблизительно 2,0 мМ до приблизительно 5,0 мМ.
В одном варианте осуществления восстанавливающий агент представляет собой цистеамин. В определенных вариантах осуществления цистеамин используют в концентрации, составляющей от приблизительно 1,0 мМ до 20 мМ, от приблизительно 4,0 мМ до приблизительно 19 мМ, от приблизительно 2,0 мМ до приблизительно 8,0 мМ, от приблизительно 4,0 мМ до приблизительно 8,0 мМ, от приблизительно 4,8 мМ до приблизительно 8,0 мМ, от приблизительно 5,5 мМ до приблизительно 6,7 мМ или приблизительно 6,0 мМ.
В одном варианте осуществления восстанавливающий агент представляет цистеин. В определенных вариантах осуществления концентрация цистеина в восстанавливающей смеси составляет от приблизительно 1,0 мМ до 20 мМ, от приблизительно 4,0 мМ до приблизительно 19 мМ, от приблизительно 2,0 мМ до приблизительно 8,0 мМ, от приблизительно 4,0 мМ до приблизительно 8,0 мМ, от приблизительно 4,8 мМ до приблизительно 8,0 мМ, от приблизительно 5,5 мМ до приблизительно 6,7 мМ, или приблизительно 6,0 мМ. Концентрация цистеина может быть отрегулирована с применением базового раствора, напр., 120 мМ цистеин-HCL.
Каждое антитело против IL-17 имеет два остатка CysL97, нуждающихся в селективном восстановлении. Вследствие этого, количество задействованного восстанавливающего агента должно быть достаточным для селективного восстановления обоих остатков CysL97 у существенной части антител против IL-17 в препарате антител, без одновременного избыточного восстановления антител посредством необратимого восстановления традиционных дисульфидных связей. В зависимости от условий реакции (присутствия окисляющего агента, температуры, продолжительности реакции, pH и т.д.) молярное соотношение восстанавливающий агент:антитело против IL-17, используемое в конкретной восстанавливающей смеси и реакции селективного восстановления, будет варьировать. Авторы изобретения обнаружили, что молярное соотношение восстанавливающий агент (напр., цистеин):антитело (напр., секукинумаб) может находиться в диапазоне от приблизительно 11:1 (Пример 5.2) до приблизительно 546:1 (Пример 6.2). В некоторых вариантах осуществления раскрытых способов молярное соотношение восстанавливающий агент (напр., цистеин):антитело (напр., секукинумаб) составляет между приблизительно 11:1 и приблизительно 462:1 (напр., приблизительно 21:1), от приблизительно 31:1 до приблизительно 545:1 (напр., от приблизительно 31:1 до приблизительно 156:1), от приблизительно 21:1 до приблизительно 296:1 или от приблизительно 46:1 до приблизительно 91:1. В других вариантах осуществления молярное соотношение восстанавливающий агент (напр., цистеин):антитело (напр., секукинумаб) составляет между приблизительно 23:1 и приблизительно 91:1 (напр., от приблизительно 23:1 до приблизительно 57:1), от приблизительно 44:1 до приблизительно 275:1 (напр., приблизительно 44:1), от приблизительно 44:1 до приблизительно 66:1 (напр., от приблизительно 44:1 до приблизительно 66:1), предпочтительно от приблизительно 46:1 до приблизительно 118:1 (напр., от приблизительно 56:1 до приблизительно 118:1), более предпочтительно от приблизительно 54:1 до приблизительно 82:1. В одном варианте осуществления молярное соотношение восстанавливающий агент (напр., цистеин):антитело (напр., секукинумаб) составляет приблизительно 66:1.
Если используется более высокое молярное соотношение восстанавливающий агент (напр., цистеин):антитело (напр., секукинумаб) (представляющее избыточный восстанавливающий агент по сравнению с антителом), то добавление небольшого количества соответствующего окисляющего агента (напр., цистина или цистамина) может быть полезным для смягчения восстановительной силы восстанавливающего агента (напр., цистеина или цистеамина). Это является особенно полезным в анаэробной среде. Таким образом, в некоторых вариантах осуществления селективное восстановление выполняется с применением набора окислительно-восстановительных реагентов (напр., в аэробной или анаэробной среде, предпочтительно анаэробной среде). В некоторых вариантах осуществления селективное восстановление выполняется с применением молярного соотношения восстанавливающий агент (напр., цистеин):окисляющий агент (напр., цистин), составляющего от приблизительно 2:1 до приблизительно 80:1, от приблизительно 4:1 до приблизительно 80:1, от приблизительно 26:1 до приблизительно 80:1, от приблизительно 2:1 до приблизительно 10:1 (напр., от приблизительно 6:1 до приблизительно 10:1), от приблизительно 4:1 до приблизительно 28:1 (от приблизительно 4:1 до приблизительно 18:1), от приблизительно 27:1 до приблизительно 53:1 (напр., приблизительно 27:1) в восстанавливающей смеси. В определенных вариантах осуществления цистеин применяют в восстанавливающей смеси в комбинации с окисляющим агентом цистином или цистамином (предпочтительно цистином). В некоторых вариантах осуществления селективное восстановление выполняется в условиях с применением приблизительно 4 мМ-14 мМ цистеина (напр., от приблизительно 7,7 мМ до приблизительно 8,0 мМ цистеина) и от приблизительно 0,1 до приблизительно 1 мМ цистина (напр., приблизительно 0,1 до приблизительно 0,3 мМ цистина) в восстанавливающей смеси. В определенных вариантах осуществления восстанавливающая смесь содержит приблизительно 8,0 мМ цистеина и приблизительно 0,1 мМ цистина, приблизительно 7,9 мМ цистеина и приблизительно 0,1 мМ цистина или приблизительно 7,7 мМ цистеина и приблизительно 0,3 мМ цистина. Должно быть понятно, что если окисляющий агент, напр., цистин, используют в комбинации с восстанавливающим агентом, напр., цистеином, в раскрытом способе, окисляющий агент, напр., цистин, может быть добавлен в момент после того, как восстанавливающий агент, напр., цистеин, скомбинировали с антителом против IL-17 или его антигенсвязывающим фрагментом. Например, антитело против IL-17 или его антигенсвязывающий фрагмент могут быть скомбинированы с цистеином для образования восстанавливающей смеси, которую затем инкубируют в течение, напр., 15-30 минут; в дальнейшем в реакцию может быть добавлен цистин.
Растворенный кислород
Как используется в данной заявке, «растворенный кислород», «dO2» и «DO» относится к количеству кислорода, которое растворено или содержится в заданной среде. Его можно измерить кислородным зондом, таким как кислородный датчик или оптод в жидких средах. О DO сообщается либо в виде концентрации (миллиграммы на литр (мг/л)), либо в виде «процента насыщения». Миллиграммы на литр представляют собой количество кислорода в литре растворителя, а также являются эквивалентным частям на миллион=ч./млн. Процент насыщения кислорода представляет собой количество кислорода в растворе по отношению к общему количеству кислорода, которое раствор может содержать при конкретной температуре.
Как используется в данной заявке, «начальный процент насыщения кислорода» относится к количеству растворенного кислорода в препарате антител против IL-17 (напр., секукинумабе) перед введением препарата в контакт с восстанавливающим агентом в сосуде для образования восстанавливающей смеси. Начальный процент насыщения кислородом можно регулировать непосредственно (напр., посредством разбрызгивания) или опосредованно (напр., с помощью перемешивания), чтобы достичь желаемого уровня кислорода перед началом способа селективного восстановления. Например, в некоторых вариантах осуществления начальный процент насыщения кислородом в препарате антител против IL-17 перед контактом с восстанавливающим агентом регулируют по меньшей мере до 40%, 50%, 60%, 70%, 80%, 90% или даже до величины 100%. Это можно сделать с целью изначально смягчить силу восстанавливающего агента, как только агент добавляют в препарат антител против IL-17 для образования восстанавливающей смеси, что предупреждает частичное или полное восстановление традиционных дисульфидов антитела, что в ином случае могло бы привести к потере активности и чистоты. В предпочтительных вариантах осуществления начальный процент насыщения кислородом в препарате антител против IL-17 регулируют по меньшей мере до 60% (как измерено с применением кислородного зонда, откалиброванного при 25°C). В предпочтительных вариантах осуществления начальный процент насыщения кислородом в препарате антител против IL-17 регулируют по меньшей мере до 80% (как измерено с применением кислородного зонда, откалиброванного при 25°C).
Авторы изобретения определили, что повышенные уровни кислорода во время стадии обработки цистеином оказывают вредное воздействие на активность антител, что, вероятно, связано с кислородом, прекращающим действие восстановительной силы цистеина, что приводит к недостаточному восстановлению C97 секукинумаба. Эту проблему поглощения кислорода из атмосферы можно регулировать посредством варьирования количества восстанавливающего агента, варьирования молярного соотношения восстанавливающий агент:антитело с применением определенных скоростей перемешивания или даже использования прерываний при перемешивании, особенно при работе в масштабе производства. Должно быть понятно, что более высокие количества восстанавливающего агента (напр., цистеина) способны к переработке более высоких уровней кислорода в восстанавливающей смеси. В некоторых вариантах осуществления во время стадии инкубации способа селективного восстановления, насыщение кислородом в восстанавливающей смеси в целом сохраняется при низком процентом содержании (напр., менее чем приблизительно 40%, менее чем приблизительно 30%, менее чем приблизительно 20%, менее чем приблизительно 15%, менее чем приблизительно 10%, менее чем приблизительно 5%).
Потеря восстановительной силы восстанавливающего агента (напр., цистеина), вероятно, приводит к неполному разблокированию CysL97-SH в более ранних моментах времени во время стадии инкубации, а в отсутствии остаточного восстанавливающего агента (напр., цистеина), способного к защите разблокированного Cys97L на более поздних частях стадии инкубации (либо во время стадии охлаждения), может возникнуть повторное окисление разблокированного Cys97L-SH. Вследствие этого, в идеале, низкий процент насыщения кислородом будет сохраняться в течение по меньшей мере от приблизительно 60 минут до приблизительно 330 минут, напр., по меньшей мере приблизительно 60 минут, по меньшей мере приблизительно 90 минут, по меньшей мере приблизительно 120 минут, по меньшей мере приблизительно 150 минут, по меньшей мере приблизительно 180 минут, по меньшей мере приблизительно 210 минут, по меньшей мере приблизительно 240 минут, по меньшей мере приблизительно 270 минут, по меньшей мере приблизительно 300 минут, или по меньшей мере приблизительно 330 минут. В некоторых вариантах осуществления данный низкий процент насыщения кислородом будет сохраняться в течение всей стадии инкубации, а также части стадии охлаждения.
Процент насыщения кислородом можно регулировать непосредственно (напр., посредством разбрызгивания) или опосредованно (напр., посредством перемешивания), чтобы достичь желаемого уровня кислорода во время инкубации восстанавливающей смеси. В аэробной среде низкий процент насыщения кислородом можно достичь посредством применения периодического (а не непрерывного) перемешивания восстанавливающего раствора, напр., <15 мин/ч, напр., <2 мин/ч, или посредством применения непрерывного перемешивания с низкой скоростью вращения. В анаэробной среде кислород не присутствует (либо присутствует небольшое количество), что может приводить к расходу восстанавливающего агента.
Объемный коэффициент массопереноса кислорода (kLa*)
Когда селективное восстановление проводят в аэробных условиях, уровень кислорода в реакции регулируют не непосредственно, а через другие технологические параметры, напр., скорость перемешивания. Физическая настройка каждой реакции также влияет на уровень кислорода, присутствующего в реакционной смеси. Вследствие этого, важно определить переменную, которую можно применять для сравнения кислорода, перенесенного в раствор между физическими настройками и во время конкретных этапов процессинга антитела - данной переменной является «kLa*» (см., напр., Garcia-Ochoa and Gomez (2009) Biotechnology Advances 27:153-176; Bandino et al. (2001) Biochem. Engineering J. 8:111-119; Juarez and Orejas (2001) Latin Am. Appl. Res. 31:433-439; Yange and Wang (1992) Biotechnol. Prog. 8:244-61). KLa* представляет количество кислорода, перенесенного в раствор с течением времени через пространство над продуктом без разбрызгивания. Данное значение является специфическим для каждой настройки и масштаба, и зависит от типа мешалки, скорости мешалки, объема наполнения и площади поверхности раствора в контакте со свободным пространством над продуктом, которое зависит от индивидуальной геометрии каждого сосуда. Несмотря на то, что kLa* каждой физической настройки отличается, поскольку уровень кислорода в растворе во время способа селективного восстановления действует на активность и целостность секукинумаба, авторы изобретения ожидают, что способ селективного восстановления при выполнении в системах, демонстрирующий сходные диапазоны kLa*, будет приводить к препаратам секукинумаба, имеющим схожее качество.
Как используется в данной заявке, термин «система» охватывает как физическую настройку (сосуд, тип перемешивания и т.д.), так и технологические условия (объем наполнения, скорость вращения и т.д.), которые влияют на перенос кислорода в раствор с течением времени через пространство над продуктом без разбрызгивания, т.е. масштаб, скорость мешалки, объем наполнения, площадь поверхности раствора в контакте с пространством над продуктом, на которое влияет индивидуальная геометрия каждого сосуда, и т.д.
Как используется в данной заявке, термин «сосуд» обозначает любой контейнер, в котором имеет место реакция селективного восстановления. Сосуды включают, без ограничения, биореакторы (напр., стальной смесительный бак одноразового или многоразового использования и т.д.), применяемые в экспериментальных и промышленных масштабах производства антител, а также обычные лабораторные контейнеры, такие как колбы, пробирки и т.д. В некоторых вариантах осуществления сосуд представляет собой биореактор, способный поддерживать объем, составляющий по меньшей мере приблизительно 2 литра, по меньшей мере приблизительно 100 литров, по меньшей мере приблизительно 500 литров, по меньшей мере приблизительно 1000 литров, по меньшей мере приблизительно 2000 литров, по меньшей мере приблизительно 5000 литров, по меньшей мере приблизительно 10000 литров, по меньшей мере приблизительно 15000 литров или более.
KLa* не может быть определен непосредственно в экспериментах по переносу кислорода. Вместо этого dO2 в тестируемом растворе заменяют азотом, а увеличение dO2 во времени отслеживают с помощью калиброванного зонда dO2, что позволяет создать экспериментальную кривую dO2. В дальнейшем значения kLa*, применяемые в данной заявке, рассчитывают для конкретных систем посредством адаптации экспериментальной кривой dO2 к кривой насыщения (напр., с применением Mathcad®), в соответствии с уравнением, показанным ниже:
DO=C×(1-e-kLa*×(t-t0)), где DO=измеренное значение растворенного кислорода, C представляет собой значение насыщения кислородом (означает 100% при бесконечном перемешивании и достижении насыщения), число Эйлера e=2,718281…., t=временная точка, соответствующая значению DO, а t0=начальная временная точка.
Уравнение представляет интегральную форму эмпирической формулы, установленной для определения переноса кислорода в растворы (значение kLa*). Формула была подтверждена разными авторами в различных экспериментах (Doran, P. M. 1995. Bioprocess Engineering Principles, Academic Press, San Diego, California).
Авторы изобретения определили, что стадии нагревания и охлаждения способа селективного восстановления в целом более переносимы с более высоким kLa*, чем стадия инкубации. Это связано с тем, что повышенные уровни кислорода во время стадии инкубации могут оказывать вредное воздействие на активность антитела, что, вероятно, обусловлено увеличенным переносом кислорода, прекращающего действие восстановительной силы восстанавливающего агента (напр., цистеина), приводя к недостаточному восстановлению C97 секукинумаба. В аэробной среде повышение скорости перемешивания (или времени перемешивания) в восстанавливающей смеси во время способа селективного восстановления повышает kLa*. Непрерывное перемешивание восстанавливающей смеси, которое приводит к более высоким значениям kLa*, может выдерживаться во время стадий нагревания и охлаждения. В некоторых вариантах осуществления kLa* во время стадий нагревания и охлаждения (раздельно) может составлять от приблизительно 0,12 ч-1 до приблизительно 1,69 ч-1, от приблизительно 0,08 ч-1 до приблизительно 0,69 ч-1, от приблизительно 0,24 ч-1 до приблизительно 0,44 ч-1, от приблизительно 0,39 ч-1 до приблизительно 0,69 ч-1. В некоторых вариантах осуществления kLa* в системе во время стадии нагревания или охлаждения составляет ≤ приблизительно 0,69 ч-1, где указанный kLa* вычисляют посредством адаптации кривой насыщения к кривой растворенного кислорода.
Предпочтительно сохранять kLa* более низким во время стадии инкубации с применением, напр., непрерывного перемешивания с низкими скоростями вращения, или, предпочтительно, прерывистого перемешивания. В некоторых вариантах осуществления восстанавливающую смесь инкубируют при сохранении объемного коэффициента массопереноса кислорода (kLa*) в системе, составляющего ≤ приблизительно 0,37 ч-1, ≤ приблизительно 0,27 ч-1 или ≤ приблизительно 0,18 ч-1, где указанный kLa* вычисляют посредством адаптации кривой растворенного кислорода к кривой насыщения. Если kLa* в системе во время стадии инкубации реакции селективного восстановления составляет менее чем (<) 0,37 ч-1, то молярное соотношение восстанавливающий агент (напр., цистеин):антитело может варьировать между 46,11:1 (приблизительно 46:1) и 118,36:1 (приблизительно 118:1) (и для более короткого, и для более длинного времени инкубации, напр., от приблизительно 210 до приблизительно 330 минут). kLa* в системе во время стадии инкубации реакции селективного восстановления может составлять до (≤) 0,37 ч-1, если молярное соотношение восстанавливающий агент (напр., цистеин):белок составляет между 69,89:1 (приблизительно 70:1) и 118,36:1 (приблизительно 118:1) (для более короткого времени инкубации, напр., вплоть до приблизительно 240 минут культивирования) или между 76,85 (приблизительно 77:1) и 118,36:1 (приблизительно 118:1) (для более длительного времени инкубации, напр., вплоть до приблизительно 300 минут инкубации).
Способ селективного восстановления целиком (т.е. стадия нагревания, стадия инкубации и стадия охлаждения) обычно может выполняться с применением kLa*, составляющего < 0,37 ч-1, который включает время инкубации от приблизительно 210 до приблизительно 330 минут (напр., время инкубации от приблизительно 240 минут до 300 минут), если молярное соотношение восстанавливающий агент (напр., цистеин):антитело составляет между приблизительно 46:1 и приблизительно 118:1. Способ селективного восстановления целиком (т.е. стадия нагревания, стадия инкубации и стадия охлаждения) обычно может выполняться с применением kLa*, составляющего < 0,37 ч-1, если молярное соотношение восстанавливающий агент (напр., цистеин):антитело составляет между приблизительно 70:1 и приблизительно 118:1, а инкубация занимает до приблизительно 240 минут; или если молярное соотношение восстанавливающий агент (напр., цистеин):антитело составляет между приблизительно 77:1 и приблизительно 118:1, а инкубация занимает до приблизительно 300 минут.
Дополнительные Компоненты Способа
Настоящее раскрытие предоставляет способ селективного восстановления CysL97 в определенных антителах против IL-17, таких как секукинумаб, включающий приведение антитела в контакт с восстанавливающим агентом для образования восстанавливающей смеси. Должно быть понятно, что восстанавливающая смесь может содержать компоненты в дополнение к антителу против IL-17 или его антигенсвязывающему фрагменту и восстанавливающему агенту. Восстанавливающая смесь может содержать водный компонент (напр., буфер, такой как Трис-буфер), а также реагенты, применяемые для увеличения или уменьшения pH восстанавливающей смеси, соль, ЭДТА и т.д. Таким образом, при том, что восстанавливающая смесь обязательно будет содержать антитело против IL-17 (напр., секукинумаб) и восстанавливающий агент, восстанавливающая смесь может содержать или не содержать дополнительные компоненты. В некоторых вариантах осуществления восстанавливающая смесь содержит металлохелатор (напр., ЭДТА, DMSA, DMPS). В некоторых вариантах осуществления восстанавливающая смесь содержит от 1,3 мМ до приблизительно 0,8 мМ, от приблизительно 1,1 до приблизительно 0,9 мМ или приблизительно 1,0 мМ ЭДТА (напр., ди-Na-ЭДТА).
В зависимости от условий реакции (температуры, продолжительности реакции, количества антитела против IL-17, концентрации восстанавливающего агента, соотношения восстанавливающий агент:антитело и т.д.), pH конкретного препарата антитела может варьировать. Однако признано, что в зависимости от условий реакции, описанных в данной заявке, данные условия могут варьировать с целью достижения желаемого селективного восстановления. В некоторых вариантах осуществления pH препарата антитела перед контактом с восстанавливающим агентом будет варьировать от приблизительно 6,5 до приблизительно 9,5, напр., от приблизительно 7 до приблизительно 9. В других вариантах осуществления pH препарата антитела будет составлять от приблизительно 7,4 до приблизительно 8,5, от приблизительно 7,8 до приблизительно 8,2, от приблизительно 7,9 до приблизительно 8,1 или приблизительно 8,0. В некоторых вариантах осуществления pH препарата антитела может быть отрегулирован (напр., после газирования для регулирования начального процента насыщения кислородом) с применением буфера, напр., 1M Трис-буфера (напр., 1M Трис-буфера с pH 10,8).
После введения препарата, содержащего антитело против IL-17 или его антигенсвязывающий фрагмент (напр., секукинумаб), в контакт с восстанавливающим агентом может иметь место начальное восстановление уровня интактного антитела против IL-17 или его антигенсвязывающего фрагмента (HLLH). Термин «интактное» относится к антителу, имеющему все консервативные дисульфидные мостики (напр., 14 консервативных дисульфидных мостиков в случае классического антитела IgG1). Образование различных фрагментов антитела против IL-17, т.е., H2L, HL2, HL, H и L полос, а также интактных полос H2L2 (HHLL) можно определить с применением различных инструментов для анализа, известных в данной области (таких как ДСН-ПААГ-электрофорез, катионообменная ВЭЖХ). Предпочтительно, уровень интактного антитела против IL-17 или его антигенсвязывающего фрагмента в смеси измеряют посредством капиллярного электрофореза с додецилсульфатом натрия (CE-SDS). CE-SDS разделяет белки в соответствии с их молекулярными размерами в электрическом поле. CE-SDS при невосстанавливающих условиях можно применять для оценки вариантов размеров в препарате антител. В некоторых вариантах осуществления уровень интактного антитела против IL-17 или его антигенсвязывающего фрагмента в смеси снижается по меньшей мере до приблизительно 80%, как измерено согласно CE-SDS, в пределах приблизительно 1-30 минут (напр., приблизительно 15 минут) после добавления восстанавливающего агента к препарату антитела. В некоторых вариантах осуществления уровень интактного антитела против IL-17 или его антигенсвязывающего фрагмента в смеси снижается по меньшей мере до приблизительно 83%, как измерено согласно CE-SDS. В некоторых вариантах осуществления уровень интактного антитела против IL-17 или его антигенсвязывающего фрагмента в смеси снижается до между приблизительно 75% и приблизительно 87%. В некоторых вариантах осуществления уровень интактного антитела против IL-17 или его антигенсвязывающего фрагмента в смеси снижается по меньшей мере до приблизительно 38, 39, 40, 41, 45, 50, 55, 60, 65, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86 или 87%, как измерено согласно CE-SDS.
Анализы CE-SDS могут быть выполнены с применением системы капиллярного электрофореза Beckman Coulter PA-800. Для анализов используются непокрытые капилляры из плавленого кварца с внутренним диаметром, составляющим 50 мкм и длиной, составляющей 30 см (с 20 см и 10 см диапазонами разделения для анализов CE-SDS в восстанавливающих условиях и CE-SDS в невосстанавливающих условиях, соответственно). Разделение контролируется УФ-детектором при 214 нм. Для анализа CE-SDS в невосстанавливающих условиях образцы антител разводят до 6,0 мг/мл водой, тщательно смешивают с буфером для образца CE-SDS в невосстанавливающих условиях (0,1 M Трис/1,0% SDS, pH 7,0) и 250 мМ иодацетамидом, в соотношении, составляющем 20/75/5 (о/о/о), и нагревают при 70°C в течение 10 минут для предотвращения перестановки дисульфидных мостиков. Температуру капилляров устанавливают при 25°C для разделения. Электрофорез проводят при постоянном напряжении 15 кВ в режиме нормальной полярности в течение 20 минут.
В некоторых вариантах осуществления восстанавливающую смесь нагревают. В некоторых вариантах осуществления нагревание происходит перед стадией инкубации. В некоторых вариантах осуществления восстанавливающую смесь нагревают до температуры между приблизительно 32°C и приблизительно 42°C, до между приблизительно 35°C и приблизительно 39°C, до приблизительно 37°C. В некоторых вариантах осуществления нагревание происходит в течение от приблизительно 30 до приблизительно 120 минут, от приблизительно 45 до приблизительно 90 минут, от приблизительно 45 до приблизительно 75 минут, приблизительно 60 минут. Во время нагревания восстанавливающую смесь можно перемешивать, напр., постоянно или с перерывами, с применением любых средств для перемешивания. Перемешивание может быть осевым (напр., с применением крыльчатки с наклонными лопастями) или радиальным (напр., с применением турбинной мешалки Раштона). В некоторых вариантах осуществления во время нагревания восстанавливающую смесь постоянно перемешивают при 65-200 об/мин (напр., 50 об/мин, 65 об/мин, 75 об/мин, 85 об/мин, 100 об/мин или 200 об/мин).
Во время стадии инкубации, восстанавливающую смесь будут, как правило, инкубировать в течение предварительно заданного времени, чтобы сделать возможным селективное восстановление свободного цистеина (напр., свободного цистеина секукинумаба). В некоторых вариантах осуществления культивирование происходит после нагревания восстанавливающей смеси. В зависимости от условий реакции (восстанавливающего агента, температуры, количества антител против IL-17 или его антигенсвязывающего фрагмента, pH и т.д.) предварительно заданное времени для культивирования восстанавливающей смеси будет варьировать. В некоторых вариантах осуществления время будет варьировать между приблизительно 1 и 24 часами (напр., 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 16, 18, 20 или 24 часа). В некоторых вариантах осуществления инкубацию проводят в течение от приблизительно 200 до приблизительно 500 минут, от приблизительно 210 до приблизительно 420 мин, от приблизительно 210 до приблизительно 330 минут, от приблизительно 240 до приблизительно 300 минут, приблизительно 250 минут.
Во время стадии инкубации инкубация будет проводиться при предварительно заданной температуре, чтобы сделать возможным селективное восстановление намеченного свободного цистеина (напр., CysL97 в антигенсвязывающих участках секукинумаба). В зависимости от условий реакции (восстанавливающего агента, времени, количества антитела против IL-17 или его антигенсвязывающего фрагмента, pH и т.д.) температура инкубации будет варьировать. В некоторых вариантах осуществления предварительно заданная температура будет варьировать между приблизительно 20 и приблизительно 42°C. В некоторых вариантах осуществления предварительно заданная температура будет составлять приблизительно 32°C - приблизительно 42°C, между приблизительно 35°C - приблизительно 39°C или приблизительно 37°C.
Во время стадии инкубации восстанавливающую смесь можно будет перемешивать для обеспечения однородности продукта в то время как восстановитель инкубируют с препаратом антител против IL-17, напр., секукинумабом. Однако во время данной части реакции селективного восстановления уровень кислорода в сосуде должен оставаться низким, чтобы позволить восстанавливающему агенту эффективно избирательно восстанавливать CysL97 в антителах против IL-17. В аэробных условиях низкий кислород может быть достигнут посредством избегания непрерывного перемешивания, напр., посредством применения прерывистого перемешивания, напр., ≤15 мин/ч, напр., ≤2 мин/ч. В анаэробных условиях перенос кислорода ограничен и поэтому перемешивание может продолжаться в течение более длительных периодов времени или может быть непрерывным. Более того, в анаэробных условиях строгий контроль переноса кислорода (напр., посредством регулируемого разбрызгивания) также позволил бы использовать более длительные периоды времени перемешивания (включая непрерывное перемешивание).
В некоторых вариантах осуществления смесь охлаждают после стадии инкубации. В некоторых вариантах осуществления смесь охлаждают до комнатной температуры (напр., температуры между приблизительно 16°C и приблизительно 28°C). В некоторых вариантах осуществления охлаждение происходит в течение от приблизительно 30 до приблизительно 120 минут, от приблизительно 45 до приблизительно 90 минут, от приблизительно 45 до приблизительно 75 минут, приблизительно 60 минут. Во время охлаждения восстанавливающую смесь можно перемешивать, напр., постоянно или прерывисто с применением любых средств в течение перемешивания. Перемешивание может быть осевым (напр., с применением крыльчатки с наклонными лопастями) или радиальным (напр., с применением турбинной мешалки Раштона). В некоторых вариантах осуществления во время охлаждение восстанавливающую смесь постоянно перемешивают при 65-200 об/мин (напр., 50 об/мин, 65 об/мин, 75 об/мин, 85 об/мин, 100 об/мин или 200 об/мин).
Реакция селективного восстановления может быть остановлена, напр., с применением йодоацетамида или О-фосфорной кислоты (напр., с применением базового раствора 0,3 M О-фосфорной кислоты). В некоторых вариантах осуществления остановка происходит после стадии охлаждения. В некоторых вариантах осуществления реакцию селективного восстановления останавливают посредством регулирования рН смеси до между приблизительно 5,0 и приблизительно 5,5, приблизительно 5,1 и приблизительно 5,3, приблизительно 5,2. Регулирование pH можно достичь с применением О-фосфорной кислоты.
Фраза «очищенный препарат» относится к смеси антител против IL-17 или их антигенсвязывающих фрагментов, которые подвергли селективному восстановлению. После завершения селективного восстановления будет происходить повышение уровня интактных антител против IL-17 в очищенном препарате. Уровень интактных антител в очищенном препарате после селективного восстановления может быть измерен посредством различных хорошо известных методик (напр., SDS PAGE в невосстанавливающих условиях, капиллярный электрофорез в присутствии додецилсульфата натрия, эксклюзионная хроматография (SEC), ВЭЖХ). В некоторых вариантах осуществления уровень интактного антитела измеряют согласно CE-SDS. В некоторых вариантах осуществления после завершения селективного восстановления (напр., после стадии охлаждения) уровень интактного антитела против IL-17 или его антигенсвязывающего фрагмента в очищенном препарате составляет по меньшей мере приблизительно 80%, как измерено согласно CE-SDS. В некоторых вариантах осуществления после селективного восстановления уровень интактного антитела против IL-17 или его антигенсвязывающего фрагмента в очищенном препарате составляет по меньшей мере приблизительно 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93 94, 95, 96, 97, 98, 99 или приблизительно 100%, как измерено согласно CE-SDS. В некоторых вариантах осуществления после селективного восстановления уровень интактного антитела против IL-17 или его антигенсвязывающего фрагмента в очищенном препарате составляет по меньшей мере приблизительно 90%, как измерено согласно CE-SDS.
Активность (напр., аффинность, биологическая активность и т.д.) антител в препарате перед селективным восстановлением, во время селективного восстановления или после селективного восстановления (т.е. в очищенном препарате) может быть измерена посредством различных хорошо известных методик (см., напр., WO2006/013107; WO2007/117749; Shen and Gaffen (2008) Cytokine. 41(2): 92-104). В определенных вариантах осуществления активность измеряют с применением анализа на основе ELISA или клеточного анализа (напр., ингибирование IL-17-IL-6 или GRO-альфа из, напр., хондоцитов C-20/A4 или клеточной линии BJ). В некоторых вариантах осуществления активность измеряют посредством способа катионообменной хроматографии с цистамином (катионообменной хроматографии). Способ катионообменной хроматографии с цистамином включает дериватизацию антитела цистамином (2,2'-дитиобис (этиламин)) с последующим аналитическим разделением с использованием катионообменной хроматографии (CEX). Поскольку активность антител, раскрытых в данной заявке (напр., секукинумаба), снижается, если CysL97 находится в окисленной форме, дериватизация CysL97 цистамином служит в качестве прокси для измерения активности антител, т.е. если селективное восстановление достигает успеха, тогда восстановленный CysL97 может быть дериватизирован цистамином, тогда как если селективное восстановление не удается, тогда окисленный CysL97 не может быть дериватизирован цистамином. Дериватизация цистамином приводит к добавлению одного положительного заряда на свободный Cys97 остаток. Полученные дериватизированные формы секукинумаба (например, заряд +2, +1) затем могут быть отделены от недериватизированной формы и количественно определены посредством катионообменной хроматографии. В теории дериватизированная цистамином молекула секукинумаба с двумя связями цистамина с неспаренным Cys97 на обеих легких цепях может считаться 100% биологически активной. Дериватизированная цистамином молекула секукинумаба с добавлением одной связи цистамина с неспаренным Cys97 в одной из легких цепей может считаться биологически активной на 50%. Дериватизированная цистамином молекула секукинумаба без какой-либо связи цистамина с молекулой может считаться биологическая неактивной. Уровень дериватизации цистамином в препарате антител (напр., препарата антител секукинумаба), при сравнении с теоретически максимальным уровнем дериватизации цистамином в таком препарате (напр., выражаемого в виде процентной доли теоретического максимума) тогда можно применять в качестве меры активности препарата.
Кратко катионообменная хроматография с цистамином может быть выполнена следующим образом. Образцы антитела (50 мкг) сначала обрабатывают карбоксипептидазой B (1:40, о:о) для удаления С-концевого лизина в тяжелой цепи, а затем дериватизируют с 4 мМ цистамина в 5 мМ ацетате натрия, 0,5 мМ ЭДТА, pH 4,7 при комнатной температуре в течение 2 часов. Дериватизацию останавливают посредством добавления 2 мкл 1 M ортофосфорной кислоты. Катионообменную хроматографию проводят на образцах дериватизированного цистамином антитела с применением аналитической колонки ProPac™ WCX-10 (4 мМ x 250 мМ, Dionex). Для разделения применяют градиент от 12,5 мМ до 92,5 мМ хлорида натрия в 25 мМ фосфате натрия, pH 6,0 при скорости потока, составляющей 1,0 мл/мин. Абсорбцию при 220 нМ регистрировали посредством UV-детектора (Agilent HPLC 1200).
Некоторые первичные препараты антитела против IL-17 с окисленным свободным цистеином имеют уровни активности до 45%. В некоторых вариантах осуществления перед инициированием способа селективного восстановления уровень активности антител против IL-17 или их антигенсвязывающих фрагментов в препарате составляет менее чем приблизительно 80%, менее чем приблизительно 75%, менее чем приблизительно 70%, менее чем приблизительно 65%, менее чем приблизительно 60%, менее чем приблизительно 55%, менее чем приблизительно 50% или менее чем приблизительно 45% (напр., как измерено посредством способа катионообменной хроматографии с цистамином). Во время селективного восстановления уровень активности антител против IL-17 в очищенном препарате будет повышаться. В некоторых вариантах осуществления уровень активности антител против IL-17 или их антигенсвязывающих фрагментов в препарате антитела повышается по меньшей мере приблизительно на 15 процентных пунктов (напр., от приблизительно 60% до по меньшей мере приблизительно 75%), по меньшей мере приблизительно на 20 процентных пунктов (напр., от приблизительно 60% до по меньшей мере приблизительно 80%), по меньшей мере приблизительно на 25 процентных пунктов (напр., от приблизительно 60% до по меньшей мере приблизительно 85%) или по меньшей мере приблизительно на 30 процентных пунктов (напр., от приблизительно 60% до по меньшей мере приблизительно 90%) в течение приблизительно 60 минут после введения препарата антитела в контакт с восстанавливающим агентом для образования восстанавливающей смеси (напр., как измерено посредством способа катионообменной хроматографии с цистамином).
После селективного восстановления очищенный препарат будет обогащен антителами против IL-17, имеющими восстановленную форму CysL97, и будет демонстрировать увеличенный уровень активности по отношению к первоначальному препарату. В некоторых вариантах осуществления после завершения селективного восстановления уровень активности антител против IL-17 или их антигенсвязывающих фрагментов в очищенном препарате составляет по меньшей мере приблизительно 80% (по отношению к теоретическому максимуму), как измерено посредством катионообменной хроматографии с цистамином, ELISA или клеточного анализа (напр., анализа катионообменной хроматографии с цистамином). В некоторых вариантах осуществления после завершения селективного восстановления уровень активности антител против IL-17 или их антигенсвязывающих фрагментов в очищенном препарате составляет по меньшей мере приблизительно 80, 81 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93 94, 95, 96, 97, 98, 99 или приблизительно 100%, как измерено посредством катионообменной хроматографии, ELISA или клеточного анализа (напр., анализа катионообменной хроматографии с цистамином). В некоторых вариантах осуществления после завершения селективного восстановления уровень активности антител против IL-17 или их антигенсвязывающих фрагментов в очищенном препарате составляет по меньшей мере приблизительно 93%, как измерено посредством катионообменной хроматографии с цистамином, ELISA или клеточного анализа (напр., анализа катионообменной хроматографии с цистамином).
Соответственно, в данной заявке раскрыты способы селективного восстановления CysL97 в препарате антител против IL-17, которые были рекомбинантно продуцированы клетками млекопитающих, включающие:
а) приведение препарата в контакт по меньшей сере с одним восстанавливающим агентом в системе для образования восстанавливающей смеси; и
b) инкубацию восстанавливающей смеси при сохранении объемного коэффициента массопереноса кислорода (kLa*) в системе, составляющего ≤ приблизительно 0,37 ч-1, где указанный kLa* вычисляют посредством адаптации кривой растворенного кислорода к кривой насыщения;
где каждое антитело против IL-17 содержит вариабельный домен тяжелой цепи иммуноглобулина (VH), содержащий три участка, определяющих комплементарность (CDR) VH, как изложено в виде SEQ ID NO:8, и вариабельный домен легкой цепи (VL) иммуноглобулина, содержащий три CDR VL, как изложено в виде SEQ ID NO:10, и кроме того где перед стадией a) начальный процент насыщения кислородом в препарате составляет по меньшей мере приблизительно 60%, как измерено с применением кислородного зонда, откалиброванного при 25°C.
Также в данной заявке раскрыты способы селективного восстановления CysL97 в препарате антител против IL-17, которые были рекомбинантно продуцированы клетками млекопитающих, включающие:
a) приведение препарата в контакт с набором окислительно-восстановительных реагентов, выбранных из цистеина/цистина и цистеина/цистамина для образования восстанавливающей смеси; и
b) инкубацию восстанавливающей смеси при температуре приблизительно 37°C в анаэробных условиях в течение по меньшей мере приблизительно 4 часов, или инкубацию восстанавливающей смеси при температуре приблизительно 18-24°C в течение приблизительно 16-24 часов;
где каждое антитело против IL-17 содержит вариабельный домен тяжелой цепи иммуноглобулина (VH), содержащий три участка, определяющие комплементарность (CDR) VH, как изложено в виде SEQ ID NO:8, и вариабельный домен легкой цепи (VL) иммуноглобулина, содержащий три CDR VL, как изложено в виде SEQ ID NO:10.
Также в данной заявке раскрыты способы селективного восстановления CysL97 в препарате антитела секукинумаба, которые были рекомбинантно продуцированы клетками млекопитающих, включающие:
а) регулирование концентрации секукинумаба в препарате до между приблизительно 4 мг/мл - приблизительно 19,4 мг/мл, напр., приблизительно 10 мг/мл - приблизительно 19,4 мг/мл, напр., приблизительно 10 - приблизительно 15,4, напр., приблизительно 12 мг/мл - приблизительно 15 мг/мл, напр., приблизительно 13,5 мг/мл;
b) регулирование процентного насыщения кислорода в препарате до по меньшей мере приблизительно 60%, напр., по меньшей мере приблизительно 80%;
с) регулирование рН препарата до приблизительно 7,4 - приблизительно 8,5, напр., приблизительно 7,8 - приблизительно 8,2, напр., приблизительно 7,9 - приблизительно 8,1, напр., приблизительно 8,0;
d) приведение препарата в контакт с цистеином в сосуде для образования восстанавливающей смеси, где концентрация цистеина в восстанавливающей смеси составляет приблизительно 4,0 мМ - приблизительно 8,0 мМ, напр., приблизительно 4,8 мМ - приблизительно 8,0 мМ, напр., приблизительно 5,5 мМ - приблизительно 6,7 мМ, напр., приблизительно 6,0 мМ;
е) нагревание восстанавливающей смеси до температуры между приблизительно 32°C - приблизительно 42°C, напр., до между приблизительно 35°C - приблизительно 39°C, напр., до приблизительно 37°C, где указанное нагревание происходит в течение приблизительно 45 - приблизительно 90 минут, напр., приблизительно 45 - приблизительно 75 минут, напр., приблизительно 60 минут;
f) культивирование восстанавливающей смеси из стадии e) при температуре между приблизительно 20°C - приблизительно 42°C, напр., 32°C - приблизительно 42°C, напр., до между приблизительно 35°C - приблизительно 39°C, напр., до приблизительно 37°C, где указанное культивирование происходит в течение приблизительно 210 - приблизительно 420 минут, напр., приблизительно 210 - приблизительно 330 минут, напр., приблизительно 240 - приблизительно 300 минут, напр., приблизительно 250 минут при сохранении объемного коэффициента массопереноса кислорода (kLa*) в сосуде, составляющем ≤ 0,37 ч-1, где указанный kLa* вычисляют посредством адаптации кривой насыщения к кривой растворенного кислорода,
g) охлаждение смеси, полученной после стадии f), до температуры между приблизительно 16°C - приблизительно 28°C, где указанное охлаждение происходит в течение приблизительно 45 - приблизительно 90 минут, напр., приблизительно 45 - приблизительно 75 минут, напр., приблизительно 60 минут; и
h) регулирование рН смеси, полученной после стадии g), до между приблизительно 5,1 - приблизительно 5,3, напр., приблизительно 5,2.
Также в данной заявке раскрыты также очищенные препараты секукинумаба, где уровень интактного секукинумаба в препарате составляет по меньшей мере приблизительно 90%, как измерено посредством капиллярного электрофореза с додецилсульфатом натрия (CE-SDS), и где уровень активности секукинумаба в препарате составляет по меньшей мере приблизительно 90%, как измерено посредством катионообменной хроматографии с цистамином.
Общая часть
В некоторых вариантах осуществления указанных выше способов антитело против IL-17 или его антигенсвязывающий фрагмент содержит: i) вариабельный домен тяжелой цепи (VH) иммуноглобулина, содержащий аминокислотную последовательность, как изложено в виде SEQ ID NO:8; ii) вариабельный домен легкой цепи (VL) иммуноглобулина, содержащий аминокислотную последовательность, как изложено в виде SEQ ID NO:10; iii) VH домен иммуноглобулина, содержащий аминокислотную последовательность, как изложено в виде SEQ ID NO:8 и VL домен иммуноглобулина, содержащий аминокислотную последовательность, как изложено в виде SEQ ID NO:10; iv) VL домен иммуноглобулина, содержащий, в последовательности, гипервариабельные области, как изложено в виде SEQ ID NO:1, SEQ ID NO:2 и SEQ ID NO:3; v) VL домен иммуноглобулина, содержащий, в последовательности, гипервариабельные области, как изложено в виде SEQ ID NO:4, SEQ ID NO:5 и SEQ ID NO:6; vi) VL домен иммуноглобулина, содержащий, в последовательности, гипервариабельные области, как изложено в виде SEQ ID NO:11, SEQ ID NO:12 и SEQ ID NO:13; vii) VL домен иммуноглобулина, содержащий, в последовательности, гипервариабельные области, как изложено в виде SEQ ID NO:1, SEQ ID NO:2 и SEQ ID NO:3 и VL домен иммуноглобулина, содержащий, в последовательности, гипервариабельные области, как изложено в виде SEQ ID NO:4, SEQ ID NO:5 и SEQ ID NO:6; и viii) VL домен иммуноглобулина, содержащий, в последовательности, гипервариабельные области, как изложено в виде SEQ ID NO:11, SEQ ID NO:12 и SEQ ID NO:13 и VL домен иммуноглобулина, содержащий, в последовательности, гипервариабельные области, как изложено в виде SEQ ID NO:4, SEQ ID NO:5 и SEQ ID NO:6. В некоторых вариантах осуществления раскрытых способов антитело против IL-17 или его антигенсвязывающий фрагмент представляет собой человеческое антитело изотипа IgG1. В некоторых вариантах осуществления раскрытых способов антитело представляет собой секукинумаб.
Подробности одного или более вариантов осуществления раскрытия изложены в сопровождающем описании выше. Хотя на практике или для тестирования настоящего раскрытия можно применять любые способы и материалы, сходные или эквивалентные способам и материалам, описанным в данной заявке, далее будут описаны предпочтительные способы и материалы. Из описания и из формулы изобретения будут понятны другие признаки, цели и преимущества раскрытия. В описании и приложенной формуле изобретения единственные формы включают множественные ссылки, если в контексте ясно не описано иное. Если не определено иное, все технические и научные термины, применяемые в данной заявке, имеют такое же значение, которое обычно понимается квалифицированным специалистом в области, к которой относится данное раскрытие. Все патенты и публикации, перечисленные в данном описании, включены посредством ссылки. Следующие примеры представлены с целью более полного иллюстрирования предпочтительных вариантов осуществления раскрытия. Данные примеры никоим образом не должны истолковываться как ограничивающие объем раскрытого вопроса о пациенте, как определено прилагаемой формулой изобретения.
ПРИМЕРЫ
Пример 1: Восстановление промежуточного продукта Белка A секукинумаба посредством различных сульфгидрильных агентов
Пример 1.1
Ряд восстанавливающих агентов, содержащих сульфгидрильную группу (напр., дитиотреитол (DTT), 2-меркаптоэтанол, 2-меркаптоуксусную кислоту, цистеин, цистеамин, глутатион) подвергали скринингу для их использования в селективном восстановлении окисленного Cys97 в легкой цепи секукинумаба. В первом наборе экспериментов порции 1 мл неактивного исходного материала, полученного из более раннего способа ферментации, после стадии захвата Белка A инкубировали при 37°C при различных pH с различными концентрациями β-меркаптоэтанола, цистеина и глутатиона. После определенных моментов времени образцы обессоливали посредством гель-фильтрации в 20 мМ ацетатном буфере с pH 6, и возобновление активности определяли ELISA. Также, содержание свободных сульфгидрильных групп определяли тестом Эллмана (разблокирование сульфгидрильной группы должно приводить к значению 2 моль свободных SH на моль антитела). Результаты приведены в таблице 2 ниже.
|
Таблица 2: Активность и свободные SH образцов после реакции при заданных условиях.
°: 2-Меркаптоэтанол (2-ME),
*:% по отношению к стандарту.
В результате данных исследований меркаптоэтанол и цистеин в диапазоне pH 7-9 с концентрацией, составляющей от 1 до 20 мМ, и температурах, составляющих 20-40°C, как было обнаружено, являются наиболее подходящими.
В ходе дальнейших исследований было обнаружено, что во время воздействия восстанавливающих агентов антитело может чрезмерно восстанавливаться с образованием антитела, имеющего частично восстановленные межцепочечные дисульфидные мостики. Данное чрезмерное восстановление является обратимым при атмосферных условиях, когда антитело выделяют из реакционной смеси, напр., посредством диафильтрации, как описано выше, или посредством хроматографии, поскольку растворенный кислород, присутствующий в буферах, приводит к спонтанному повторному окислению с повторным образованием интактного антитела.
L-SS-HH-SS-L (интактное антитело) → L-SH+HS-HH-SS-L (восстановленный межцепочечный дисульфидный мостик) → L-SS-HH-SS-L (интактное антитело)
Пример 1.2 (анаэробные условия)
Во втором наборе экспериментов обработку антитела секукинумаба, полученного после стадии захвата Белка A, выполняли в анаэробных условиях посредством применения деаэрированных растворов и атмосферы аргона или азота для исключения действия растворенного кислорода на результат восстановления. Кратко, раствор секукинумаба из стадии захвата Белка A отрегулировали до pH 8,0 посредством добавления базового раствора трис-основания. Затем раствор доводили до концентрации, составляющей 8 мМ цистеина и 1 мМ ЭДТА, посредством добавления базового раствора цистеин/ЭДТА (напр., 200 мМ/12,5 мМ ЭДТА при рН 8). Концентрация секукинумаба в восстанавливающем растворе составила 4 мг/мл (молярное соотношение цистеин:антитело приблизительно 296:1). Смесь инкубировали при комнатной температуре в течение периода, составляющего 24 часа. В различные моменты времени брали образцы и наполняли избытком иодацетамида, который останавливает реакцию путем гашения сульгидрильных групп восстанавливающего агента и антитела.
Такая же установка использовалась для экспериментов с 2-меркаптоэтанолом, 2-меркаптоуксусной кислотой, цистеином, цистеамином и глутатионом. Для DTT использовали концентрацию 1 мМ.
Гашеные образцы анализировали посредством капиллярного электрофореза в присутствии додецилсульфата натрия в невосстанавливающих условиях (CE-SDS). Данный аналитический способ отделяет различные продукты восстановления антитела (HHL, HH, HL, H и L видов) от интактного антитела (LHHL) и подсчитывает их посредством УФ-детектирования on-line и объединения областей полученных сигналов.
На фигуре 1 данные для интактного антитела (LHHL) из восстанавливающей обработки 0, 3, 15 мин, 1 ч, 2 ч, 4 ч и 20-24 ч демонстрируют, что DTT и β-меркаптоацетоуксусная кислота восстанавливают антитело полностью без повторного уравновешивания до интактного антитела. Глутатион и β-меркаптоэтанол также демонстрируют оговоренное восстановление, но не были способны индуцировать повторное уравновешивание до интактного антитела (LHHL). Цистеин восстанавливает антитело приблизительно до 50%, за которым следует прямолинейное повторное уравновешивание до интактного антитела. Данные для цистеамина демонстрируют, что данный реагент либо вызывает малое восстановление, либо очень быстро (в пределах времени, составляющего менее чем 3 мин) приводит к повторному уравновешиванию.
Обнаруженный порядок восстановления (т.е. DTT > β-меркаптоацетоуксусная кислота > β-меркаптоэтанол > глутатион) коррелирует с опубликованными данными для окислительно-восстановительных потенциалов или дисульфидного обмена. См. T. Liu in «The Proteins, 3rd Edition, Volume 3 (1977) p. 239, который приводит следующие комментарии и данные:
Редокс потенциал E=E0+0,059 x log [R-SS-R]/[R-SH]
Стандартный редокс-потенциал (E0 в Вольтах) не измеряют непосредственно, поскольку электрод уравновешивают серой. Вследствие этого, редокс-потенциал должен был быть установлен из косвенных измерений:
Дитиотреитол DTT/DTTox: E0 ~ -0,33 В (pH 7, 25°C)
Глутатион GSH/GSSG: E0 ~ -0,24 В (pH 7, 25°C)
Цистеин CSH/CSSC: E0 ~ -0,22 В (pH 7, 25°C)
Пример 2: Цистеин селективно восстанавливает секукинумаб в аэробных и анаэробных условиях.
Дополнительные эксперименты были проведены при комнатной температуре (RT) (приблизительно 25°C) или 37°C с применением 8 мМ цистеина, 4 мг/мл секукинумаба, pH 8 (молярное соотношение цистеин:антитело приблизительно 295,88:1). Реакции проводили либо в аэробных (т.е. приготовление растворов и обработка выполнялись в воздухе нормального состава), либо в анаэробных (т.е. приготовление растворов и обработка выполнялись при исключении или восстановлении кислорода путем деаэрации и последующей обработки в атмосфере аргона или азота) условиях.
В анаэробных условиях (напр., атмосфера аргона или азота с 0% растворенного кислорода) на ранней фазе обработки происходит значительная деградация антитела с образованием фрагментов антитела - признак избыточного восстановления. Максимальное уменьшение интактного антитела (LHHL) до приблизительно 40% происходит приблизительно через 15 минут для экспериментов, проводимых либо при RT (Фигура 2A), либо при 37°C (Фигура 2C). Повторное уравновешиваниу до интактного антитела через 20 часов демонстрирует приблизительно 17,1% избыточно восстановленных вариантов, остающихся в образцах RT, и 12,1% избыточно восстановленных вариантов, остающихся в образцах 37°C.
В аэробных условиях, т.е. в присутствии растворенного кислорода, наблюдается более умеренная реакция. Максимальное уменьшение интактного антитела (LHHL) до приблизительно 80% остаточного уровня возникает приблизительно через 15 минут для экспериментов, проведенных при RT (Фигура 2B), и до приблизительно 73% для экспериментов, проведенных при 37°C (Фигура 2D). Повторное уравновешивание до интактного антитела демонстрируют только 5,8% избыточно восстановленных вариантов, остающихся в образцах RT после 20 часов, и только 9,3% избыточно восстановленных вариантов, остающихся в образцах 37°C после 8 часов.
Таким образом, в анаэробных условиях изначальное восстановление является более высоким, и повторное уравновешивание до интактного антитела не является таким же полным, как в аэробных условиях.
Пример 3: Воздействие растворенного кислорода и цистина на селективное восстановление
Поскольку цистеин (Cys-SH) окисляется в присутствии воздуха до цистина (Cys-SS-Cys), различие, наблюдаемое в аэробных и анаэробных условиях, может быть вызвано малыми количествами цистина, образующегося во время приготовления растворов цистеина в аэробных условиях, а также во время фактической обработки секукинумаба цистеином. С целью оценки воздействия уровня dO2 и цистина (или цистамина) на селективное восстановление секукинумаба, авторы изобретения провели несколько дополнительных подготовительных экспериментов с выделением антитела.
Для некоторых образцов селективное восстановление 4 мг/мл секукинумаба проводили с 8 мМ цистеина (молярное соотношение цистеин:антитело 295,88:1) в растворе, имеющем pH 8,0, при 37°C в аэробных условиях при 100% dO2 (отсутствие фумигации азотом), 50% и 20% dO2 (перемешивание в окружающей атмосфере с фумигацией азотом таким образом, чтобы растворенный кислород оставался на целевом уровне в течение всего эксперимента) и анаэробных (0% dO2) условиях (дегазированные растворы, полная азотная атмосфера) без цистина, а также при 100% dO2 в присутствии приблизительно 0,1 мМ цистина (отношение цистеин:цистин=80:1). В одном эксперименте добавляли 0,3 мМ цистина после начальной 30-минутной инкубации с 8 мМ цистеина в анаэробных условиях. В другом эксперименте селективное восстановление проводили в анаэробных условиях с применением 7,7 мМ цистеина и 0,3 мМ цистина [соотношение цистеин:цистин=25,66:1]. В другом образце вместо цистина добавляли 0,1 мМ цистамина.
Во всех этих примерах образцы отбирали в различные моменты времени. В конце обработки (240 мин при 37°C) антитело выделяли посредством регулирования рН основного объема раствора до 5,0 и загрузки в катионообменную колонну, которая связывает антитело. После промывания для удаления восстанавливающего агента антитело элюировали посредством солевого и/или pH-градиента и анализировали согласно CE-SDS, SE-HPLC и катионообменной хроматографии.
Фигура 3 демонстрирует анализ CE-SDS гашенных иодацетамидом образцов, отбираемых в различное время обработки. Меньший dO2 приводит к большему восстановлению на ранней фазе и более медленному уравновешиванию на более поздней фазе селективного восстановления. Уровень интактного антитела был по существу более низким (70%) в конце обработки при общих анаэробных условиях (0% dO2). Уровень интактного антитела был улучшен до уровня выше 90%, когда реакцию проводили в условиях 50% или более растворенного кислорода. Добавление небольшого количество цистина (или цистеамина) снижало начальное восстановления антитела.
Таблица 3 демонстрирует активность и чистоту антител, полученных после того, как образцы из различных реактивирующих обработок (анаэробные и аэробные условия) были очищены с применением последующей хроматографии на SP Сефарозе FF.
|
Таблица 3: Активность и чистота антитела после различных реактивирующих обработок.
В отношении биоактивности, во всех случаях был получен полностью активный материал (86-108% теоретического максимума) в противовес исходному материалу неселективно восстановленного секукинумаба, который имел только 45% активность. В отношении чистоты CE-SDS, была обнаружена нарушенная чистота (82,3%) в антителе, полученном при полностью анаэробной обработке в отсутствие цистина, что, вероятно, связано с избыточным восстановлением в данных условиях (примечание: добавление цистина в анаэробные реакции повышает чистоту образцов, которую измеряют согласно CE-SDS, поскольку восстановительный потенциал является меньшим и посредством него избыточное восстановления менее вероятно). Однако все другие селективно восстановливающие обработки приводили к сходному и высокому качеству и активности антител. Авторы изобретения также заметили, что некоторые значения чистоты CE-SDS перед стадией хроматографии на SP сефарозе были немного более низкими, чем значения, полученные после стадии хроматографии (напр., 65% перед по сравнению с 82% после) (данные не показаны), что предполагает, что во время стадии хроматографии может произойти дополнительное повторное окисление. Активность CEX была в целом более низкой в различных аэробных условиях, поскольку для смягчения восстановительной силы цистеина имелось больше кислорода. Добавление окислительных агентов цистина и цистамина в аэробных условиях дополнительно снижало активность CEX.
Резюме и выводы, выведенные из Примеров 1-3
Авторы изобретения определили, что CysL97 секукинумаба способен к восстановлению в растворе без необходимости частичного раскрытия полной структуры антитела, например, с использованием гуанидина HCl. Более того, секукинумаб в целом поддается селективному восстановлению, которое в регулируемых условиях может сделать возможным активацию антитела без существенной деградации.
Как было обнаружено, цистеин являлся особенно оптимальным для селективного восстановления секукинумаба, поскольку он проявляет только умеренное избыточное восстановление в сочетании с быстрым уравновешиванием. Антитело преимущественно восстанавливается в первый час селективного восстановления с применением цистеина, напр., вплоть до 60% в анаэробных условиях и вплоть до приблизительно 30% в полностью аэробных условиях. В последующем секукинумаб медленно повторно окисляется до интактного антитела. Повторное окисление образцов, подвергаемых селективному восстановлению цистеином, протекает гораздо медленнее при комнатной температуре, чем реакции, проводимые при 37°C (в отличие от 21 часа для повторного равновесия при комнатной температуре по сравнению с 8 ч для уравновешивания при 37°C). Образцы комнатной температуры также в целом демонстрировали меньшее максимальное снижение в интактном антителе по сравнению с реакциями селективного восстановления, проведенными при 37°C.
Авторы изобретения заметили, что в анаэробных условиях изначальное восстановление антитела является более высоким, а повторное уравновешивание до интактного секукинумаба не является таким же полным, как в аэробных условиях. Однако добавление небольшого количества цистина в анаэробные реакции приводило к улучшенным чистоте и активности по отношению к анаэробным реакциям, проведенным в отсутствие цистина. Таким образом, ход аэробных реакций можно моделировать в анаэробных условиях, когда присутствует небольшое молярное соотношение окисленного восстановительного реагента (например, цистина в случае цистеина в качестве восстановителя). Более того, авторы изобретения заметили, что добавление цистина ускоряло равновесие интактного антитела - даже когда цистин не присутствовал в течение первых 30 минут инкубации. Таким образом, селективное восстановление может быть проведено в присутствии воздуха, а также в отсутствие растворенного кислорода посредством применения атмосферы инертного газа (напр., азота или аргона). При проведении в полностью анаэробных условиях полезным является добавление небольшого молярного соотношения окисленной формы восстанавливающего реагента.
Пример 4: Исследование с целью разработки стадии селективного восстановления цистеина: доказательство концепции (DoE1)
Пример 4.1 - Дизайн и способы исследования
Основной целью стадии обработки цистеином является восстановление полной биологической активности антитела секукинумаб путем маскирования -SH-группы цистеина в положении 97 легкой цепи, которое может иметь место во время инкубации клеток, сбора и/или хроматографии белка A. В следующем примере чистоту антитела анализировали посредством способа CE-SDS в невосстанавливающих условиях, который контролирует целостность антитела (называемого «чистота согласно CE-SDS»), а биологическую активность антитела анализировали посредством способа хроматографии CEX с цистамином (называемого «активность посредством CEX»). При хроматографии CEX с цистамином цистамин добавляют в образец антитела и позволяют дериватизировать любой свободный цистеин в секукинумабе. Затем образец подвергают аналитическому разделению посредством катионообменной хроматографии, в результате чего виды антитела, дериватизированные цистамином, элюируют после видов недериватизированного антитела, поскольку они несут дополнительный положительный заряд. Затем хроматограмму сравнивают с хроматограммой необработанного образца. Часть видов на хроматограмме обработанного образца, имеющих сдвинутое положение элюции, является прямым мерилом распространенности свободного CysL97-SH в исходном образце и может использоваться в качестве суррогатного маркера активности.
Основная цель доказательства концепции исследования (DoE1) заключалась в проверке применимости дизайна экспериментов исследований для улучшения стадии обработки цистеином для тестирования первого набора диапазонов параметров для определения основных влияющих факторов и поддержки определения рабочих диапазонов. Дополнительно, DoE1 провели для оценки, является ли экспериментальная настройка применимой для определения влияния входных параметров на выходные параметры. Концептуальное исследование было проанализировано с использованием программного обеспечения Modde 9.0 (Umetrics).
Входные параметры показаны в Таблице 4. Добавление цистина (окисленной формы) тестировали в качестве дополнительного входного параметра, поскольку на редокс-потенциал влияет соотношение восстановленная форма/окисленная форма, в данном случае соотношение цистеин:цистин. Соотношение цистеин:цистин и концентрацию цистеина исследовали на каждом из 3 уровней, а концентрацию антител («содержание согласно ALC») на 2 уровнях. Для выходных параметров качества продукта, активность определяли посредством CEC, а чистоту согласно CE-SDS.
|
Таблица 4: Входные параметры.
Дизайн представляет собой многоуровневый факториальный дизайн 32×2 без опытов с центральными точками. Дизайн был выбран для получения данных и понимания способа для улучшения стадии обработки цистеином. Данный тип дизайна поддерживает расчет математических моделей с линейными, взаимодействующими и квадратичными членами для входных параметров соотношения цистеин:цистин и концентрации цистеина. План дизайна эксперимента приведен в таблице 5.
|
Таблица 5: План дизайна эксперимента. Относительная молекулярная масса секукинумаба, исходя из аминокислотной последовательности, составляет 147944 Дальтон, которую применяют для подсчета молярного соотношения цистеина и белка.
Реакции селективного восстановления проводили в 15 мл закрытых полипропиленовых пробирках, которые помещали на водяную баню и нагревали до 37°C. Белковый раствор разводили WFI до намеченной концентрации, а pH доводили до pH 8,0 с помощью 1 M Триса. После добавления раствора цистеина и цистина пробирки термически обрабатывали и инкубировали на водяной бане в течение 4 ч. Затем образцы убирали для определения содержания ALC. CE-SDS проводили с образцами, которые отбирали непосредственно после культивирования, и реакцию останавливали посредством добавления 10-кратного избытка (по отношению к концентрации цистеина) иодоацетамида. Оставшийся раствор охлаждали до температуры окружающей среды, доводили рН до 5,0-5,5, и отбирали образцы для анализа CEX и SEC.
Дизайн был выполнен в соответствии с фактическим дизайном эксперимента в Таблице 6.
|
Таблица 6: Фактический дизайн эксперимента. Относительная молекулярная масса секукинумаба, исходя из аминокислотной последовательности, составляет 147944 Дальтон, что используют для подсчета молярного соотношения цистеина и белка.
Пример 4.2 - Результаты доказательства концепции исследования
Значения для выходных параметров перечислены в таблице 7 вместе с входными параметрами. Опыты перечислены с повышающимися значениями активности согласно CEX. Можно видеть, что все опыты с концентрацией цистеина, составляющей 0,5 мМ, имеют более низкую активность - вероятно, потому, что данная концентрация цистеина является слишком низкой для достижения полной демаскировки Cys97. В данном наборе отмечалось небольшое улучшение активности согласно CEX, когда соотношение цистеин:антитело увеличивалось с приблизительно 11:1 до 21:1 (REACT00_17, _14 и _12). Из этих трех опытов опыты с немного более высоким соотношением цистеин:цистин (REACT007_14 и _12) (вероятно, представляющие незначительное ослабление восстановительной силы цистеина) также имели хорошую чистоту по параметру CE-SDS. Затем имеется серия опытов, где разница в выходном параметре активности является небольшой (от 92,4 до 93,1%) и, вероятно, в пределах аналитической точности, что затрудняет интерпретацию данной группы. Наконец, есть набор из 4 опытов, где активность была наиболее высокой (от 93,7 до 95,1%). Примечательно, что данные опыты не содержали наиболее высокого соотношения цистеин/белок (462,33).
|
Таблица 7: Значения входных и выходных параметров, перечисленные с восходящими значениями активности согласно CEX.
Из-за хорошей подгонки модели возможно было применение контурных диаграмм, чтобы понять основные влияющие параметры системы. Качество моделей представлено 4 инструментами, а именно R2, Q2, пригодностью модели и стандартным отклонением (SD) параллельных анализов. Модель, которая находится в удовлетворительном совпадении с данными, будет иметь R2 и Q2, близкие к 1,0 и пригодность модели выше 0,25. Модели с более низкой статистической значимостью имеют более низкие значения R2 и Q2. Диагностика модели на выходные параметры качества указывает, что модели активности согласно CEX и чистоты согласно CE-SDS имеют высокую статистическую значимость (R2=0,88 и Q2=0,73 для активности согласно CEX, и R2=0,84 и Q2=0,63 для чистоты согласно CE-SDS). Контурная диаграмма активности согласно CEX (Фигура 4A) описала, что достигнуты значения активности согласно CEX, равные или более высокие, чем 93,0%, если входной параметр концентрация цистеина составлял между 4,0 мМ и 9,0 мМ. Более того, входной фактор содержание согласно ALC может варьировать от низкого уровня (3,25 мг/мл) до высокого уровня (6,5 мг/мл), когда входной фактор соотношение цистеин:цистин установлено в его центральной точке 6. Для улучшения активности согласно CEX модель показывает, что входной параметр содержание согласно ALC должно быть более высоким, чем изучаемый верхний уровень, составляющий 6,5 мг/мл.
В таблице 8 опыты перечислены в соответствии с повышением чистоты согласно CE-SDS. Можно наблюдать три группы: опыты с более низкой чистотой (</=70%), к которым относятся опыты с высоким молярным соотношением, составившим 462 моль/моль; опыты со средней чистотой (70-83%); и опыты с более высокой чистотой (>83%). Из-за хорошей подгонки модели также возможно применение контурных диаграмм, чтобы понять, как входной параметр влияет на значения чистоты согласно CE-SDS, показанные в таблице 8. В соответствии с контурной диаграммой для CE-SDS на фигуре 4B, область, которая наиболее близко подходит к теоретическому оптимуму, лежит в правой нижней стороне. Это означает, что соотношение цистеин:цистин должно быть установлено на более высоком уровне, а концентрация цистеина должна быть установлена на более низком уровне. Дополнительно, для увеличения чистоты согласно CE-SDS следует применять более высокое содержание согласно ALC.
|
Таблица 8: Входные и выходные параметры, перечисленные в соответствии с увеличением чистоты согласно CE-SDS.
Пример 4.3 - Резюме доказательства концептуального исследования
Доказательство концептуального исследования подтвердило применимость экспериментальной настройки для оценки и уточнения входных параметров стадии обработки цистеином. Авторы изобретения отметили, что высокое молярное отношение цистеина к белку может привести к низким значениям чистоты согласно CE-SDS. Модели также предположили, что увеличение концентрации белка и цистеина может улучшить чистоту согласно CE-SDS и активность согласно CEX. Таким образом, концентрация цистеина и влияние увеличенного диапазона параметров для содержания согласно ALC на атрибуты качества продукции активность согласно CEX и чистоту согласно CE-SDS было оценено более подробно в следующем исследовании (План на поверхности отклика 1).
Пример 5: Исследование с целью разработки стадии селективного восстановления цистеином: План на поверхности отклика 1
Пример 5.1 - Дизайн и способы исследования
Исходя из данных примера 4, были отрегулированы входные параметры стадии селективного восстановления. Исследование с целью разработки проанализировано с использованием программного обеспечения Modde 9.0 (Umetrics). Входные параметры перечислены в таблице 9. Факторы изучали на каждом из трех уровней. Дизайн представлял собой скорректированную версию доказательства концептуального исследования с откорректированными уровнями входных параметров содержания согласно ALC и концентрации цистеина. Для упрощения экспериментальной настройки и дополнительной оценки данных входной параметр «соотношение цистеин:цистин» был заменен на параметр «концентрация цистина».
|
Таблица 9: Входные параметры.
Дизайн представляет собой 23 центральный композиционный гранецентрированный (CCF) план с 4 центральными опытами в условиях центральной точки. Данный тип дизайна поддерживает расчет математических моделей с линейными, взаимодействующими и квадратичными членами. План дизайна эксперимента приведен в таблице 10.
|
Таблица 10: План дизайна эксперимента. 1) Центральные точки. Относительная молекулярная масса секукинумаба, исходя из аминокислотной последовательности, составляет 147944 Дальтон, которую применяют для подсчета молярного соотношения цистеина и белка.
Реакции селективного восстановления проводили в 15 мл закрытых полипропиленовых пробирках, которые помещали на водяную баню и нагревали до 37°C. Дизайн был выполнен в соответствии с фактическим экспериментальным дизайном в таблице 11.
|
Таблица 11: Фактический дизайн эксперимента. 1) Центральная точка; 2) Данный эксперимент не рассматривается в качестве центральной точки используемого программного обеспечения DoE из-за отклонения более чем на 10% концентрации белка от первоначально запланированной центральной точки. Относительная молекулярная масса секукинумаба, исходя из аминокислотной последовательности, составляет 147944 Дальтон, которую применяют для подсчета молярного соотношения цистеина и белка.
Пример 5.2 - Результаты плана на поверхности отклика 1
Входные параметры и значения для выходных параметров перечислены в таблице 12. Опыты перечислены в соответствии с повышением активности согласно CEX. Можно наблюдать, что в опытах с высокой активностью согласно CEX применяли более высокую концентрацию цистеина. Единственный опыт с более низкой активностью (React016_13) имел высокую концентрацию белка, низкую концентрацию цистеина и высокую концентрацию цистина.
Диагностика модели на выходной параметр качество продукта составила R2=0,95, Q2=0,76, SD=0,20, и пригодность модели=0,78 для активности согласно CEX, и R2 =0,79, Q2 =0,53, SD= 2,91, и пригодность модели=0,83 для чистоты согласно CE-SDS, что указывает на значимые модели для обоих выходных параметров. Контурные диаграммы были рассчитаны (Фигура 5), чтобы лучше понять влияние установок входных параметров и влияние на активность согласно CEX.
|
Таблица 12: Входные и выходные параметры, перечисленные в соответствии с повышением активности согласно CEX. 1) Центральные точки; 2) Данный эксперимент не рассматривается в качестве центральной точки используемого программного обеспечения DoE из-за отклонения более чем на 10% концентрации белка от первоначально запланированной центральной точки.
Как показано на контурном графике на фигуре 5, чтобы достичь высокой активности согласно CEX, наиболее важным входным параметром является концентрация цистеина, которая должна быть установлена на ее высокий уровень. Но даже при низком уровне концентрации цистеина достигается высокая активность согласно CEX (> 93%), если содержание цистина согласно ALC и его концентрация не находятся на верхнем пределе. Входные параметры содержание согласно ALC и концентрация цистина также влияют на выходной параметр активность согласно CEX, но в меньшей степени.
В таблице 13 опыты перечислены в соответствии с восходящей чистотой согласно CE-SDS. Опыты можно разделить на три группы. Проходила серия из шести опытов (главным образом опыты 14 мМ с низкой чистотой (<80%), серия опытов со средней чистотой (85-91%), и серия опытов с более высокой чистотой (>91%), вся последняя представляет собой опыты с 4 мМ цистеина.
|
Таблица 13: Входные и выходные параметры, перечисленные в соответствии с восходящей чистотой согласно CE-SDS. 1) Центральные точки; 2) Данный эксперимент не рассматривается в качестве центральной точки используемого программного обеспечения DoE из-за отклонения более чем на 10% концентрации белка от первоначально запланированной центральной точки.
Исходя из результатов, концентрация цистеина должна быть низкой, а содержание согласно ALC и концентрация цистина должна быть высокой, чтобы достичь более высоких значений чистоты согласно CE-SDS.
Эксперименты React016_6, React016_7, React016_8 и React016_11 имеют высокие значения для обоих двух качественных выходных параметров. Для оценки риска безуспешности стадии обработки цистеином на основании модели, установленной данным DoE, была проведена оценка пространства конструкционных параметров с применением моделирования методом Монте-Карло. Оценка пространства конструкционных параметров предоставляет диапазон, в пределах которого могут изменяться факторы, при том, что выходные параметры не превышают целевой диапазон для выходного параметра качества продукции и производительности способа. Предполагается, что содержание согласно ALC должно быть установлено на 12 мг/мл, как идеальное. В данном конкретном эксперименте концентрация цистеина является идеальной при 4,0 мМ. Для концентрации цистина идеальной является 0,32 мМ.
В соответствии с результатами данного исследования, на стадию обработки цистеином главным образом влияет концентрация цистеина. Высокая концентрация цистеина способствует высокой активности согласно CEX, но одновременно приводит к низкой чистоте согласно CE-SDS. В соответствии с оценкой пространства конструкционных параметров, концентрация цистеина должна сохраняться при 4 мМ, а содержание согласно ALC должно быть установлено на 12 мг/мл (соотношение цистеина и белка составляет приблизительно 49).
Для проверки результатов статистических расчетов целевые опыты проводили в перемешиваемых 2 л биореакторах с воздушной накладкой и открытым свободным пространством над продуктом. Во время инкубации перемешивание не использовали. Технологические параметры перечислены в таблице 14, а аналитические данные показаны в таблице 15.
|
Таблица 14: Технологические параметры целевых опытов. Относительная молекулярная масса секукинумаба, исходя из аминокислотной последовательности, составляет 147944 Дальтон, которую применяют для подсчета молярного соотношения цистеина и белка.
|
Таблица 15: Аналитические данные целевых опытов.
Все три опыта приводят к аналогичным результатам в отношении активности согласно CEX. Это соответствует результатам предыдущего исследования DoE, показавшего, что 4,0 мМ цистеина является достаточно для восстановления активности антитела. В 3-ем целевом опыте (REACT021) цистин не был включен, что привело к сопоставимым результатам по чистоте согласно CE-SDS с опытом 1 (REACT019) и продемонстрировало, что в условиях испытаний цистин оказывает лишь незначительное влияние на производительность стадии обработки цистеином. Повышение концентрации цистеина до 8,0 мМ (соотношение цистеина и белка составляет приблизительно 91) привело не к более высоким значениям активности согласно CEX, но к более низкой чистоте согласно CE-SDS в пуле, опускаясь ниже целевого показателя разработки, составляющего 90%. Хотя цистин продемонстрировал значимость в статистическом плане, положительный эффект в целевых опытах не был обнаружен. Дополнительно, влияние в статистическом плане на активность согласно CEX является незначительным (см. фигуру 5), а приготовление содержащего цистин буфера затруднено из-за низкой растворимости цистина в неосновных буферах. Следовательно, цистин можно не включать в буфер для обработки цистеином.
Пример 6: Исследование с целью разработки стадии селективного восстановления цистеином: План на поверхности отклика 2
Пример 6.1 - Дизайн и Способы Исследования
Главной целью плана на поверхности отклика 2 (DoE3) было исследование технологических параметров температуры, времени и pH на этапе обработки цистеином в дополнение к концентрации цистеина. Данные также используются для определения рабочих диапазонов и определения основных влияющих факторов. Исследование с целью разработки анализировали с использованием программного обеспечения Modde 9.0 (Umetrics). Входные параметры находятся в таблице 16.
|
Таблица 16: Входные параметры.
Дизайн представляет собой центральный композиционный гранецентрированный (CCF) план с 3 опытами центральных точек. План дизайна эксперимента приведен в таблице 17. Дизайн был выбран для оценки влияния дополнительных технологических параметров, поскольку раствор для обработки цистеином был улучшен в прошлых экспериментах. Концентрацию цистеина анализировали вновь, поскольку она являлась наиболее влияющим входным параметром на стадии обработки цистеином, и ожидалось взаимодействие с входными параметрами. Данный тип дизайна поддерживает расчет математических моделей с линейными, взаимодействующими и квадратичными членами.
|
Таблица 17: План дизайна эксперимента. 1) Центральные точки. Относительная молекулярная масса секукинумаба, исходя из аминокислотной последовательности, составляет 147944 Дальтон, которую применяют для подсчета молярного соотношения цистеина и белка.
Реакции селективного восстановления проводили в 15 мл закрытых полипропиленовых пробирках, которые помещали на водяную баню и нагревали до 37°C.
Пример 6.2 - Результаты плана на поверхности отклика 2
Исследование было выполнено в соответствии с фактическим дизайном эксперимента в таблице 18.
|
Таблица 18: Фактический план дизайна эксперимента. 1) Центральные точки. 2) Не считается центральной точкой используемого программного обеспечения. Относительная молекулярная масса секукинумаба, исходя из аминокислотной последовательности, составляет 147944 Дальтон, которую применяют для подсчета молярного соотношения цистеина и белка.
Значения для выходных параметров качества продукта перечислены в таблице 19 в возрастающем порядке в отношении результатов активности согласно CEX. Диагностика модели на выходной параметр качество продукта представляет собой R2=0,93, Q2=0,80, пригодность модели=0,79 и SD=0,42 для активности согласно CEX; R2=0,96, Q2=0,89, пригодность модели=0,67 и SD=0,00 для чистоты согласно CE-SDS.
|
Таблица 19: Значения входных и выходных параметров, перечисленные в соответствии с возрастающей активностью согласно CEX. 1) Центральная точка. 2) Не считается центральной точкой используемого программного обеспечения.
Таблица 19 демонстрирует, что опыты можно разделить главным образом на три группы: с низкой активностью (<93%), со средней активностью (93-95%) и с высокой активностью (>95%). Из-за хорошей подгонки модели также возможно применение контурной диаграммы (фигура 6), чтобы идентифицировать основные влияющие параметры системы. Фигура 6 демонстрирует, что время инкубации от среднего до высокого (напр., от 4 до 7 часов) и высокая концентрация цистеина являются предпочтительными для повышения активности согласно CEX. Температура инкубации и pH способа имеют меньшее влияние на выходной параметр активность согласно CEX. Тем не менее, области чистоты, составляющие 95% и выше, являются самыми большими в графиках для pH 8,0 и 8,5 при 37°C, предполагая, что это является оптимальным рабочим диапазоном.
В таблице 20 опыты перечислены по повышению чистоты согласно CE-SDS. Опыты можно разделить на три группы: опыты с низкой чистотой (<82%), опыты со средней чистотой и опыты с высокой чистотой (>90%). Во всех опытах с высокой чистотой согласно CD-SDS используют 2 мМ цистеина.
|
Таблица 20: Входные и выходные параметры, перечисленные с повышением чистоты согласно CE-SDS. 1) Центральная точка. 2) Не считается центральной точкой используемого программного обеспечения.
Из-за хорошей подгонки модели можно применить контурный график (фигура 7) для понимания способа и основных влияющих входных параметров. Фигура 7 демонстрирует, что время инкубации от среднего до высокого и низкая концентрация цистеина увеличивает чистоту согласно CE-SDS. Входные параметры температура инкубации и рН способа имеют небольшое влияние на чистоту согласно CE-SDS.
Резюме и выводы, сделанные из примера 6
Цели разработки достигаются, когда концентрация цистеина удерживается на низком уровне, в то время как температура может варьировать от средней к высокой, рН может варьировать от среднего к высокому, а время может варьировать от среднего до высокого. Чтобы помочь оценить диапазоны входных параметров, которые приводят к высокому качеству продукта, задействовали алгоритм оценки пространства конструкционных параметров с применением имитационного моделирования методом Монте-Карло. Для данного имитационного моделирования устанавливали цель, составляющую >93% для активности согласно CEX и >90% для чистоты согласно CE-SDS. Имитационное моделирование методом Монте-Карло спрогнозировало, что данные целевые показатели качества достигаются, когда температура в идеале равна 39,1°C, но температура может варьировать между 38,6°C и 39,7°C. Время инкубации имеет оптимум, составляющий 5,0 ч, но может варьировать между 4,0 ч и 6,0 ч. Для pH оптимум составляет 8,2 и он может варьировать от 8,15 до 8,25. Для последнего входного параметра, концентрации цистеина, спрогнозирован оптимум 2,4 мМ и может варьировать между 2,2 мМ и 2,5 мМ. В пределах данных диапазонов алгоритм оценки пространства конструкционных параметров обнаружил, что для выходного параметра качество продукта активность согласно CEX оцененное значение DPMO (число дефектов на миллион операций) будет составлять 110, значение чистоты согласно CE-SDS DPMO будет составлять 20. Это означает, что в 110 случаях из одного миллиона целевое ограничение для активности согласно CEX не будет соответствовать, и в 20 случаях из миллиона целевое ограничение для чистоты согласно CE-SDS.
В соответствии с результатами контурных графиков и принимая в расчет результаты предыдущих исследований разработки (DoE1 и DoE2), целевая температура для инкубации была установлена на 37°C. Целевое время инкубации было установлено на 4 часа (240 минут), поскольку в настоящей экспериментальной установке не было включено время нагревания и охлаждения, которое будет рассматриваться для применения в промышленном масштабе. В комбинации с временем нагревания и охлаждения общее время способа будет составлять приблизительно 6 часов. Влияние pH на чистоту согласно CE-SDS не определяется, а влияние на активность согласно CEX минимальное. Вследствие этого, был установлен целевой рН 8,0, так как он находится в пределах тестируемого диапазона, разрабатываемая цель для активности согласно CEX может надежно достигаться, а риск образования кислотных вариантов согласно CEX (усиленных основными условиями) будет уменьшен. Результаты для входного параметра концентрация цистеина указывает на низкий оптимальный уровень, составляющий 2,4 мМ; однако, большинство экспериментов, использующих 2 мМ цистеин, приводило к более низкой активности согласно CEX, чем желаемая. Это, в комбинации с результатами целевых опытов, предполагает, что целевая концентрация цистеина должна быть более высокой, т.е., 4 мМ, во время подтверждающих опытов.
Пример 7: Сравнение способа и анализ непрерывного перемешивания
Пример 7.1 - Сравнение способа B2 и способа C
Обсуждения, описанные в примере 6, предполагают, что селективное восстановление предпочтительно может быть проведено при более высокой концентрации белка и более низкой концентрации цистеина (4-6 мМ), чем до настоящего времени в промышленном масштабе (в данной заявке способ B2). Таблица 21 сравнивает входные параметры для более раннего способа B2 и предложенного способа C. Сравнительные опыты были проведены в двух повторах в полипропиленовых пробирках 50 мл масштаба, которые помещали на водяную баню и нагревали до 37°C. Результаты показаны в таблице 22.
|
Таблица 21: Входные технологические параметры B2 и предложенного способа C. 1) перед регулированием pH и добавлением цистеина. Относительная молекулярная масса секукинумаба, исходя из аминокислотной последовательности, составляет 147944 Дальтон, которую применяют для подсчета молярного соотношения цистеина и белка.
|
Таблица 22: Выходные технологические параметры B2 и предложенного способа C.
Таблица 22 демонстрирует, что модифицированный способ C стадии обработки цистеином приводит к значительному повышению чистоты согласно CE-SDS лишь с очень легким снижением активности согласно CEX. Более высокие значения чистоты согласно CE-SDS достигаются посредством повышенной концентрации белка и пониженной концентрации цистеина во время стадии селективного восстановления (т.е., меньшее молярное соотношение цистеина и белка). Это приводит к более низкой восстановительной силе, которая, тем не менее, все еще является достаточной для обеспечения адекватной активности секукинумаба.
Пример 7.2 - Тестирование непрерывного перемешивания во время инкубации
Во время клинического производства в соответствии со способом B2 применяли прерывистое смешивание (2 минуты каждый час), чтобы избежать неоднородности во время фазы инкубации при 37°C. Возможность применения непрерывного перемешивания для обеспечения однородности на протяжении всей инкубации исследовали в 2 л биореакторе (опыт REACT029). Экспериментальная настройка и технологические условия показаны в таблице 23.
|
Таблица 23: Входные параметры тестирования непрерывного перемешивания во время реакции. 1) Перед регулированием pH и добавлением цистеина. Относительная молекулярная масса секукинумаба, исходя из аминокислотной последовательности, составляет 147944 Дальтон, которую применяют для подсчета молярного соотношения цистеина и белка.
Для REACT029 чистота согласно CE-SDS составила 96%, а активность согласно CEX составила 92,7%, которая являлась более низкой активностью согласно CEX, чем показано посредством опытов REACT030 и REACT 031 (предложенный способ C), проведенными в малом масштабе без перемешивания. Таким образом, увеличенный перенос кислорода в раствор для обработки цистеином, обусловленный непрерывным смешиванием, может нейтрализовать восстановительную силу цистеина. Тем не менее, активность согласно CEX в пуле обработки цистеином была близка целевому показателю качества. Поскольку перенос кислорода и соотношение поверхность/объем снижается с увеличением масштаба до масштаба производства, данный эксперимент считался наихудшим случаем в отношении переноса кислорода. Вследствие этого непрерывное смешивание применялось для опытов экспериментального масштаба («Способ C») с целью обеспечения однородности рабочего раствора.
Резюме и выводы, сделанные из примеров 5-7
Авторы изобретения определили, что концентрация белка во время обработки цистеином может быть увеличена в три раза, что значительно снижает объемы способа. Авторы изобретения также продемонстрировали, что более низкие концентрации цистеина предоставляют аналогичную активность продукта и повышенную чистоту продукта согласно CE-SDS после обработки цистеином. Таким образом, более низкие соотношения цистеин:белок способны обеспечить качество продукта.
Данные также демонстрируют, что температура и pH имеют незначительное влияние на стадию обработки цистеином, и что добавление окисленной формы цистеина - цистина - не является необходимым для получения качественного продукта. Хотя идеальное время инкубации показано 5 часов, авторы изобретения установили целевое 4 часа, поскольку при наличии экспериментальной настройки время нагревания и охлаждения не было включено, что должно приниматься во внимание во время применения в промышленном масштабе. Было показано, что непрерывное перемешивание в открытых условиях без активной аэрации возможно для использования в способе селективного восстановления; однако, как продемонстрируют авторы изобретения в примерах позднее, перенос кислорода в раствор должен быть ограничен (напр., с применением слабого/медленного перемешивания).
Пример 8: Подтверждающий способ в экспериментальном масштабе
Предложенные условия очистки после улучшения способа были протестированы посредством подтверждающего способа в экспериментальном масштабе 7 л с целью проведения первого увеличения масштаба и получения первого впечатления о воспроизводимости и надежности способа. Стадию селективного восстановления в соответствии со способом C (таблица 21) применяли в экспериментах экспериментального масштаба (REACT035). Использовали непрерывное перемешивание. Концентрацию растворенного кислорода измеряли посредством pO2-зонда.
Активность согласно CEX REACT035 после стадии селективного восстановления в соответствии с подтверждающим опытом 1 составила лишь 90,4%. Анализ кривой растворенного кислорода (см. фигуру 8) выявил, что имеется устойчивое снижение pO2 в первые три часа обработки, указывая на то, что в растворе имеет место более быстрый расход кислорода, чем перенос кислорода в раствор, инициированный посредством перемешивания. Авторы изобретения предполагают, что расход кислорода обусловлен окислением цистеинового реагента (Cys-SH) до цистина или цистеиновой кислоты (Cys-SO3). Увеличение уровня кислорода в последний час реакции будет указывать на то, что цистеиновый реагент был израсходован, и кислород, поглощенный раствором, что вызвано перемешиванием, становится заметным. Это означает, что восстановительная сила цистеина является неэффективной в последний период обработки, что могло бы объяснить ослабленную активность, полученную в данном опыте.
Пример 8.1 - Исследование стадии цистеина во время опыта 1 подтверждения
Для исследования ключевой причины низкой активности (90,4%), определенной посредством CEX в первом опыте REACT035 экспериментального масштаба, были оценены возможные влияющие факторы. Как указано выше, низкая концентрация цистеина, введение кислорода посредством продолжительного перемешивания во время реакции и изменение масштаба (увеличенный объем реакции) может приводить к недостаточной восстановительной силе. Следовательно, были оценены скорость мешалки во время инкубации и концентрация цистеина.
Экспериментальный план и выходной параметр активность согласно CEX показаны в таблице 24. В данном эксперименте концентрация растворенного кислорода была измерена посредством pO2-зонда.
|
Таблица 24: Исследование перемешивания и концентрации цистеина на этапе обработки цистеином. 1) опыт 1 подтверждения, проведенный в биореакторе 20 л с объемом наполнения 7 л. 2) эксперимент, проведенный в биореакторе 2 л с объемом наполнения 1,7 л. 3) смешивание каждый час в течение 2 минут с 50 об/мин. Относительная молекулярная масса секукинумаба, исходя из аминокислотной последовательности, составляет 147944 Дальтон, которую применяют для подсчета молярного соотношения цистеина и белка.
Все три реакции в более мелком масштабе (REACT038, REACT039 и REACT040) показали улучшенную активность согласно CEX при сравнении с подтверждающим опытом 1 (REACT035) (таблица 24). Однако соответствующая активность согласно CEX не была увеличена в эксперименте с повышенной концентрацией цистеина (REACT040) или в эксперименте без непрерывного смешивания во время инкубации (REACT038) при сравнении с REACT039. Следовательно, ни концентрация цистеина, ни перемешивание во время инкубации нельзя идентифицировать в данной точке как основной влияющий фактор. Тем не менее, профиль растворенного кислорода (dO2) опыта 1 подтверждения экспериментального масштаба (REACT035) (фигура 8) показал повышенный dO2 после приблизительно 3 часов инкубации, указывая на то, что восстановительная сила цистеина исчерпана. График dO2 двух экспериментов меньшего масштаба REACT039 и REACT040, в которых проводилось непрерывное перемешивание, не показал увеличения dO2 к концу обработки (данные не показаны), что свидетельствует о том, что восстановительная способность цистеина не была исчерпана в данных экспериментах меньшего масштаба.
Пример 8.2 - Исследование стадии цистеина во время опыта 2 подтверждения
Объем наполнения составил 14 л вместо 7 л, как в опыте 1 подтверждения, а для перемешивания применяли две мешалки (радиальная мешалка внизу и дополнительно осевая вверху). Концентрация цистеина (4 мМ) и скорость мешалки (100 об/мин) были такими же, как в опыте 1 подтверждения, REACT 035. После селективного восстановления активность раствора антител составила лишь 85,5% при измерении посредством CEX. В соответствии с графиком dO2, показанным на фигуре 9, восстановительная сила цистеина была исчерпана даже раньше, чем во время опыта 1 подтверждения (фигура 8), предполагая, что перенос кислорода в раствор посредством непрерывного перемешивания был более предсказуем в данном опыте.
Направленность кривой dO2 (фигура 8-9) предполагает, что перенос кислорода через свободное пространство над продуктом посредством непрерывного перемешивания является основной причиной более низкой активности после стадии селективного восстановления во время подтверждающих опытов 1 и 2. На этапе обработки цистеином с объемом наполнения 7 л в опыте 1 подтверждения в рабочий раствор была погружена только одна мешалка (радиальная мешалка внизу). С объемом наполнения 14 л в опыте 2 подтверждения в рабочий раствор были погружены две мешалки (радиальная мешалка внизу и осевая вверху), приводя даже к дополнительному увеличенному переносу кислорода в раствор. Следовательно, даже более слабый результат опыта 2 подтверждения, наиболее вероятно, обусловлен повышенным переносом кислорода в рабочий раствор, заметный на кривой dO2 (фигура 9). Вследствие большего переноса кислорода в раствор для опыта 2 подтверждения, восстановительная сила цистеина исчерпана раньше, приводя к меньшей активности согласно CEX. Вследствие этого перенос кислорода в промежуточное вещество должен быть ограничен, напр., посредством корректировки смешивания (скорости, продолжительности, частоты) во время инкубации.
Пример 8.3 - Исследование стадии цистеина во время опыта 3 подтверждения
Объем наполнения составил 16 л вместо 14 л, как в опыте 2 подтверждения, и адаптирован профиль перемешивания. Вместо непрерывного перемешивания во время обработки цистеином применяли смешивание только в течение 2 минут каждый час, в соответствии с более ранним способом B2. Активность раствора антитела, измеренная посредством CEX после стадии селективного восстановления, составила 92,5%.
Вследствие исключения непрерывного смешивания из стадии обработки цистеином перенос кислорода был ограничен, обеспечивая достаточную восстановительную силу и приводя к высокой активности согласно CEX. График dO2, показанный на фигуре 10, демонстрирует резкое уменьшение уровня кислорода - почти до нуля % в начале обработки. Данный эксперимент демонстрирует, что регулирующее количество кислорода, вводимого во время обработки цистеином, обеспечивает надлежащие условия реакции и, следовательно, высокую активность согласно CEX.
Пример 8.4 - исследование стадии цистеина во время опыта 4 подтверждения
Основываясь на результатах опыта 3 подтверждения, был проведен 4-ый опыт подтверждения (REACT040) в экспериментальном масштабе с настройками и условиями способа, идентичными подтверждающему опыту 3. Однако обработку цистеином в пуле увеличили с 4 мМ до 6 мМ, так что способ опыта 4 подтверждения оказался способным к сохранению более высокого переноса кислорода в раствор. Данная повышенная восстановительная сила должна быть сбалансирована с возможным избыточным восстановлением антитела. Тем не менее, исходя из результатов REACT040 (см. таблицу 24), данная адаптация представляет изменение с низким риском неудачи. Активность согласно CEX REACT040 после стадии селективного восстановления составила 91,9%.
На фигуре 11 показан график dO2 опыта 4 подтверждения. Как и в опыте 3 подтверждения, dO2 снижался после добавления цистеина и оставался на низких уровнях, указывая на то, что восстановительная сила цистеина в данном эксперименте не исчерпана, при том, что требование к чистоте продукта, определяемой посредством CE-SDS, выполнено.
На фигуре 12 сравнивается кинетика реакций опыта 3 подтверждения и опыта 4 подтверждения в отношении активности согласно CEX и чистоты согласно CE-SDS. Кинетика активности согласно CEX является сравнимой в обоих экспериментах; плато достигалось приблизительно через 2 ч, и в дальнейшем повышение активности было небольшим через 2 часа после обработки. Кривые чистоты согласно CE-SDS немного различаются в ранней фазе реакции, так как понижение чистоты более выражено в опыте с более высокой концентрацией цистеина (6 мМ). Однако, поскольку обе процедуры приводят к сравнимому качеству продукта в конце обработки цистеином, обе являются подходящими для обеспечения надлежащего качества продукции. Тем не менее, учитывая влияние повышенных уровней кислорода в рабочий раствор, ожидается, что способ с увеличенной концентрацией цистеина, применяемый в опыте 4 подтверждения, будет более устойчивым по отношению к колебаниям переноса кислорода в рабочий раствор во время обработки цистеином. Окончательно концентрация цистеина, составляющая 6 мМ (молярное соотношение цистеин:антитело с 13,5 мг антитела=65,75:1 [т.е., приблизительно 66:1]) была выбрана из стадии обработки цистеином в промышленном масштабе идентично условиям опыта 4 подтверждения. Авторы изобретения также заметили более быструю кинетику для активности согласно CEX (плато в 1 час) в опыте, проведенном с молярным соотношением, составляющим приблизительно 275:1 (цистеин:белок) (данные не показаны).
Резюме и выводы, сделанные из примера 8
Авторы изобретения определили, что повышенные уровни кислорода во время стадии обработки цистеином могут оказывать вредное воздействие на активность согласно CEX, которое, вероятно, обусловлено останавливающим действием кислорода на восстановительную силу цистеина, приводя к недостаточному восстановлению C97 секукинумаба. Поглощением кислорода из атмосферы можно управлять посредством варьирования соотношения цистеин/белок, применяя определенные скорости перемешивания, или даже задействуя прерывания в перемешивании при работе в промышленном масштабе.
Основываясь на результатах подтверждающих опытов, концентрация цистеина была увеличена с 4 мМ (молярное соотношение цистеина и белка составляет 43,84) до 6 мМ (молярное соотношение цистеина и белка составляет 65,75), что должно уравновешивать кислород, присутствующий в реакционном растворе. Более того, для восстановления уровня растворенного кислорода, присутствующего во время фазы инкубации реакции селективного восстановления, непрерывное смешивание был заменено на смешивание 2 минуты каждый час во время инкубации. Хотя процедура селективного восстановления была изменена во время подтверждающего способа, была идентифицирована явная основная причина (уровень кислорода, перенесенного в раствор во время селективного восстановления), обеспечивающая должную активность согласно CEX в лекарственном веществе посредством корректировки стадии обработки цистеином.
Пример 9: Характеристика стадии селективного восстановления
Влияние входных параметров концентрации белка, концентрации цистеина и скорости мешалки на стадию селективного восстановления было оценено при статистическом расчете. Выходные параметры активность согласно CEX и чистоту согласно CE-SDS применяли для оценки качества продукта после стадии селективного восстановления и для определения достоверных допустимых диапазонов для входных параметров. Диапазоны для выходных параметров определяли в соответствии со способами более ранних дизайнов. Данные ограничения применяли для определения диапазонов входных параметров.
Дополнительно, результаты квалификационных опытов трех моделей в уменьшенном масштабе и семи циклов селективного восстановления, проведенных в промышленном масштабе, применяли для оценки качества продукта после селективного восстановления для худших/лучших исследуемых случаев в отношении восстановительной силы и опытов, посвященных времени инкубации и температуре инкубации.
Пример 9.1 - Характеристика способа: План на поверхности отклика
Пример 9.1.1 -Дизайн Эксперимента и способы.
Для плана на поверхности отклика в качестве входных параметров были выбраны содержание белка, концентрация цистеина и способ перемешивания во время инкубации (без перемешивания, непрерывное перемешивание при 50 или 100 об/мин), см. таблицу 25.
|
Таблица 25: Входные параметры. 1) соответствует определенной концентрации цистеина во время селективного восстановления. «Содержание согласно ALC» относится к концентрации антитела.
Были использованы различные концентрации цистеина, выраженные как «кратность разведения посредством добавления TITR3», которые отражают технологические условия и возможные варианты, напр., вызванные неточностью взвешивания, неточностью добавления раствора и т.д. Концентрация антител вносит вклад в соотношение цистеина и белка, и также тестировалась в пределах настоящего дизайна с целью определения возможных взаимодействий. Дополнительно в качестве входного параметра тестировали скорость мешалки во время инкубации, поскольку, как показано в примерах 8, кислород, перенесенный из свободного пространства над продуктом в раствор, влияет на стадию селективного восстановления.
Применяли центральный композиционный гранецентрированный план с 3 опытами центральных точек. Данный тип дизайна поддерживает расчет математических моделей с линейными, взаимодействующими и квадратичными членами. Применяли секукинумаб, INAKT.F (хранящийся ниже -60°C), полученный при опыте B012307 в промышленном масштабе. Буферами, применяемыми для характеристики способа, были буфер для титрования AIN457-TITR1 (1M Трис-основание, pH 10,8 [диапазон pH ≥10,0, проводимость 0,10-0,30 мс/см]), буфер для титрования AIN457-TITR2 (0,3 M О-фосфорная кислота, pH 1,4 [диапазон pH ≤2,0; диапазон проводимости 19,5-22,7 мс/см]); буфер для титрования AIN457-TITR3 (120 мМ цистеин-HCL+20 мМ Di-Na-ЭДТА, pH 8,0 [диапазон pH 7,8-8,2; диапазон проводимости 14,7-18,3 мс/см]).
Эксперименты проводили на квалификационной модели в уменьшенном масштабе (подробно описанной в примере 10) в биореакторе (максимальный объем 2 л) с перемешиванием в окружающей атмосфере со свободным воздухообменом и мониторингом pH, растворенного кислорода, скорости мешалки и температуры. План дизайна эксперимента показан в таблице 26. Все входные параметры, не входящие в отдельные исследования, сохраняли постоянными на соответствующем целевом уровне в соответствии с таблицей 27.
|
Таблица 26: План дизайна эксперимента. 1) Центральная точка.
|
Таблица 27: Технологические параметры стадии селективного восстановления. 1) перемешивание в течение каждого часа в течение 2 минут со скоростью 50 об/мин.
INAKT.F оттаивали на водяной бане температуры тела и разводили WFI до целевой концентрации. После регулирования pH 1 л раствора переносили в подходящий 2 л биореактор, снабженный dO2-зондом и мешалкой. Селективное восстановление начинали посредством добавления рассчитанного объема базового раствора цистеина (буфер TITR3), чтобы достичь целевую концентрацию цистеина, указанную в таблице 28. Раствор нагревали до температуры инкубации, составляющей 37°C, в течение 60 минут при перемешивании при 50 об/мин. Затем раствор инкубировали при 37°C в течение 300 мин либо с непрерывным перемешиванием при 50 или 100 об/мин, или без перемешивания (0 об/мин) в соответствии с планом дизайна эксперимента. После времени реакции 300 минут (60 минут нагревания и 240 минут инкубации) образец отбирали (REACT.PT300). После дополнительных 60 минут инкубации при 37°C (60 минут нагревания и 300 минут инкубации) раствор охлаждали до окружающей температуры в течение 60 минут со скоростью мешалки, составляющей 50 об/мин, и отбирали другой образец (REACT.P, общее время реакции 420 мин). Данная процедура позволяет оценить дизайн в двух временных точках (именуемых «REACT.PT300» и «REACT.P») и оценить возможное влияние времени инкубации.
Пример 9.1.2 - Выходные параметры плана на поверхности отклика
Значения для выходных параметров качества продукта для образцов REACT.PT300 и REACT.P перечислены в таблице 28 (в порядке восходящей активности согласно CEX в образцах REACT PT300) и таблице 29 (в порядке восходящей активности согласно CEX в образцах REACT P). В целом данные демонстрируют, что чистота согласно CE-SDS была высокой (>90%) во всех опытах, однако некоторые опыты имели более низкую активность согласно CEX (<90%). В отношении активности согласно CEX в образцах REACT.PT300 (таблица 28) был один опыт с низкой активностью (89,4%). В данном опыте (REACT085) концентрация цистеина находилась на нижнем пределе, концентрация антител была высокой (следовательно, молярное соотношение цистеина и белка было наиболее низким), а скорость перемешивания была наиболее высокой (наиболее высокая скорость переноса кислорода). Также наблюдали, что была группа из восьми опытов с высокой активностью (более 96%), которая включала все опыты, в которых не было перемешивания.
|
Таблица 28: Значения входных параметров и качественных выходных параметров REACT.PT300 и REACT.P, рассортированных по повышающейся CEX для образцов REACT.PT300. 1) Центральная точка.
Как показано в таблице 29, в отношении активности согласно CEX в образцах REACT.P была группа из шести опытов, приведших к более низкой активности (<94%), где группа включает все опыты, имеющие высокую скорость мешалки. Примечательно, что все опыты без перемешивания приводили к наиболее высокой активности согласно CEX (более 96%). Также из таблицы 29 видно, что активность согласно CEX снижена в образцах REACT.P (по сравнению с активностью согласно CEX в образцах REACT.PT300) в опытах, проведенных при 100 об/мин и (менее выражено) в опытах, проведенных при 50 об/мин. Наибольшее снижение в данных опытах наблюдалось, когда молярное соотношение цистеина было на нижней границе (напр., снижение с 89,4 до 84,0% в REACT085, в котором молярное соотношение составило приблизительно 46:1 и сходное с REACT075, REACT084 и REACT072).
|
Таблица 29: Значения входных параметров и качественных выходных параметров REACT.PT300 и REACT.P, рассортированных по восходящей CEX для образцов REACT.P. 1) Центральная точка.
Статистическая диагностика (таблица 30) показывает статистически значимые модели для чистоты согласно CE-SDS для обоих моментов времени и для активности согласно CEX для REACT.P в конце селективного восстановления. Модель для активности согласно CEX для REACT.PT300 демонстрирует более низкую статистическую значимость (Q2 составляет 0,15).
|
Таблица 30: Диагностика модели для выходных параметров качества продукта REACT.PT300 и REACT.P. Модель, которая находится в должном соответствии с данными, будет иметь R2 и Q2, близкие к 1,0, и пригодность модели выше 0,25. Модели с низкой статистической значимостью имеют низкие значения R2 и Q2.
Пример 9.1.2.1 - Оценка моделирования выходных параметров качества продукта в момент времени 1 (REACT.PT300)
График коэффициентов и контурный график активности согласно CEX в момент времени REACT.PT300 демонстрирует, что входной параметр скорость мешалки (перемешивание) во время инкубации влияет на активность согласно CEX (данные не показаны). Параметры концентрация белка (contA) и концентрация цистеина (dil-c) не показывают статистически значимого действия на активность согласно CEX в пределах изучаемого диапазона. С целью достижения высокой активности согласно CEX скорость мешалки во время инкубации должна быть низкой.
Как показано в таблице 29, все эксперименты в момент времени REACT.PT300 имели по меньшей мере 90% чистоту согласно CE-SDS. График коэффициентов (данные не показаны) демонстрирует, что все три входных параметра влияют на чистоту согласно CE-SDS. Существуют также квадратичные члены для содержания согласно ALC (contA) и скорости мешалки (перемешивание). Существуют члены, характеризующие взаимодействие кратности разведения посредством добавления TITR3 (dil-c, представляющий концентрацию цистеина) и скорости мешалки, а также член, характеризующий взаимодействие кратности разведения посредством добавления TITR3 и содержания согласно ALC. В контурном графике (данные не показаны) визуализированные модельные коэффициенты показывают, что высокая скорость мешалки, высокая кратность разведения посредством добавления TITR3 (соответственно низкая концентрация цистеина), и содержание согласно ALC от среднего до высокого положительно влияет на чистоту согласно CE-SDS. Все эти настройки снижают восстановительную силу цистеина и положительно влияют на целостность антител. Тем не менее, поскольку все опыты имеют высокую чистоту согласно CE-SDS, то весь диапазон изучаемых входных параметров является подходящим для обеспечения должной чистоты согласно CE-SDS после селективного восстановления.
Пример 9.1.2.2 - Моделирование выходных параметров качества продукции в момент времени 2 (REACT.P)
Диаграмма коэффициентов на фигуре 13A и контурная диаграмма на фигуре 13B активности согласно CEX в момент времени REACT.P подтверждает, что на активность согласно CEX особенно влияет входной параметр скорость мешалки (помешивания). Таким образом, с целью достижения высокой активности согласно CEX, во время инкубации должно выполняться минимальное перемешивание для ограничения переноса кислорода в раствор. Также низкая кратность разведения посредством добавления TITR3 (dil-c, соответственно высокой концентрации цистеина) является полезной для активности согласно CEX после селективного восстановления. В дополнение, взаимодействие скорости мешалки и разведения посредством добавления TITR3 имеет значительное - хотя и небольшое - влияние на активность согласно CEX, тогда как взаимодействие содержания согласно ALC и кратности разведения посредством добавления TITR3 является пограничным. Влияние содержания согласно ALC является незначительным. Результаты ясно показывают, что условия, которые увеличивают восстановительную силу, напр., ограничивают перенос кислорода посредством минимальной скорости и более высокую концентрацию цистеина за счет меньшего разведения, приводят к более высокой активности согласно CEX.
Как показано в таблице 29, все эксперименты в момент времени REACT.P имели по меньшей мере 90% чистоту согласно CE-SDS. Коэффициентная и контурная диаграммы (данные не показаны) чистоты согласно CE-SDS демонстрируют, что входной параметр содержание согласно ALC (представляющий концентрацию белка), кратность разведения посредством добавления TITR3 (dil-c, представляющий концентрацию цистеина), и скорости мешалки (перемешивание, представляющий перенос кислорода) обладают лишь небольшим действием на чистоту согласно CE-SDS. Скорость мешалки демонстрирует квадратичный эффект и что взаимодействие кратности разведения с помощью TITR3 со скоростью мешалки является статистически значимым. Чистоту согласно CE-SDS улучшают посредством скорости мешалки от средней до высокой и высокой кратности разведения посредством добавления TITR3. Данные настройки снижают восстановительную силу цистеина и положительно влияют на целостность антител. Тем не менее, поскольку все опыты соответствуют специфическому диапазону чистоты согласно CE-SDS, весь диапазон изучаемых входных параметров является подходящим для обеспечения должной чистоты согласно CE-SDS после стадии селективного восстановления.
Пример 9.1.2.1 - Связь уровней растворенного кислорода с выходными параметрами
Профили кислорода реакций, показанные в таблице 26, анализировали для определения влияния входных параметров скорость перемешивания, содержание антител и концентрация цистеина на уровни кислорода. Графики данных профилей кислорода предоставлены на фигуре 14 (примечание: от 0 до 1,00 по оси х соответствует фазе 1 ч нагревания, когда перемешивание составляло 50 об/мин во всех опытах; от 1,00 до 6,00 соответствует 5 ч фазе инкубации, в которой перемешивание проходило либо при 0 об/мин [т.е., без перемешивания] 50 или 100 об/мин; и от 6,00 до 7,00 соответствует 1 ч фазе охлаждения, в которой перемешивание проходило при 50 об/мин во всех опытах). Все опыты показывают уменьшение растворенного кислорода до низких уровней в ранней фазе. В особенности, данное уменьшение было менее выражено в опытах с низким содержанием антител (см. опыты REACT090 и REACT080 в серии с 0 об/мин (фигура 14A), REACT086 в серии с 50 об/мин (фигура 14B) и REACT084 и REACT091 в серии с 100 об/мин (фигура 14C)), а наиболее выражено в опытах, имеющих высокое содержание антител (см. профили опытов с графиками 15,4 мг/мл фигуры 14).
Во всех опытах без перемешивания во время инкубации (фигура 14A) уровень dO2 оставался ниже приблизительно на 20% во время фаз инкубации и охлаждения. Также, за исключением REACT086, в опытах с применением перемешивания при 50 об/мин во время инкубации (фигура 14B), уровень dO2 оставался ниже приблизительно на 20% во время стадий инкубации и охлаждения несмотря на то, что перенос кислорода был возможен в фазе инкубации при перемешивании с 50 об/мин. Однако в опыте REACT072, в котором концентрация цистеина была низкой (4,8 мМ), можно было наблюдать легкое повышение уровня кислорода в заключительной фазе охлаждения. Опыты с перемешиванием при 100 об/мин во время инкубации (фигура 14C) показывали очень разные профили. Во-первых, как указано выше, опыты, имеющие низкое содержание антител (10 мг/мл), (REACT084 и REACT091), показали более замедленное снижение dO2, которое продолжалось во время фазы инкубации. Однако в опыте REACT084, в котором концентрация цистеина была низкой (4,8 мМ), уровень dO2 затем увеличивался во время часов 5.00 и 6.00, в последний час инкубации, почти до насыщенных уровней. Данное увеличение также наблюдалось в опыте REACT085 даже в более раннее время (час 4.00). В REACT085 также применяли низкий уровень цистеина, но высокое содержание антител (15,4 мг/мл). Повышение уровня dO2 также наблюдалось в опыте REACT075 во время фазы охлаждения (часы 6.00-7.00). В опыте REACT075 концентрация цистеина была на среднем уровне (6,0 мМ).
Данные профили ясно указывают на то, что кислород расходовался в реакционной смеси со скоростью более высокой, чем он переносится в смесь из свободного пространства над продуктом, и что расход кислорода происходит быстрее в опытах, имеющих более высокую концентрацию антител. Это, в свою очередь, предполагает, что само по себе антитело может инициировать потребление dO2. Увеличение кислорода в более поздние фазы селективного восстановления в опытах, имеющих низкие уровни цистеина, показывает, что расход кислорода связан с реакцией с цистеином (Cys-SH), вероятно, следующим образом: 4Cys-SH+O2 → 2Cys-SS-Cys +2H2O и/или 2Cys-SH+3O2 → 2Cys-SO3H. Действительно, скорость была достаточно высокой, чтобы израсходовать весь цистеин после приблизительно 4 ч в опыте REACT085, и после 5 ч в опыте REACT084 (фигура 14C). После израсходования цистеина уровни dO2 затем вернулись к насыщенным уровням (100% dO2).
Для исследования воздействия антитела на расход кислорода авторы изобретения провели два дополнительных опыта с масштабом 50 мл с применением 6 мМ цистеина и скорости мешалки, составляющей 50 об/мин В одном опыте концентрация антител составила 12,7 мг/мл (молярное соотношение цистеин:антитело=69,89:1, т.е. приблизительно 70:1); в другом опыте концентрация антител составила ноль. Как показано на фигуре 14D, в опыте без антитела имелось уменьшение dO2 приблизительно до 75% в первый час, в течение которого температура реакции была повышена с 20°C до 37°C. Данное 75% уменьшение dO2 хорошо соответствует зарегистрированному уменьшению концентрации насыщения dO2 с 8,9 мг/л при 20°C до 6,6 мг/л при 37°C (U.S. Geological Survey TWRI Book 9, April, 98). Уровень dO2 остается постоянным в течение оставшейся части фазы инкубации. Как только начинается фаза охлаждения (через 6 часов), происходит повышение уровня dO2 вследствие понижения температуры с 37°C до 20°C. Таким образом, в отсутствие антител расход кислорода в растворе не происходит, или расход кислорода цистеином происходит с низкой скоростью, так что перенос кислорода из свободного пространства над продуктом, вызываемый перемешиванием, немедленно компенсирует это потребление. В противоположность, в опыте с антителом имеется стойкое снижение уровня dO2 вплоть до приблизительно 5,5 часов. В последние 0,5 часа фазы инкубации происходит легкое уменьшение уровня dO2, за которым следует более сильное повышение уровня dO2 во время фазы охлаждения (т.е. с 6 до 7 часов). В связи с этим в данном содержащем антитело опыте, вероятно, основная часть, если не весь цистеин был израсходован после 5,5 часов. Фактически, аминокислотный анализ данного опыта (данные не показаны) продемонстрировал повышенный уровень цистина, соответствующий почти полному расходу цистеина.
С помощью этой информации можно сопоставить низкую активность согласно CEX, обнаруженную в некоторых опытах с их профилями dO2. Опыт REACT085 (фигура 14C) (молярное соотношение цистеин:антитело приблизительно 46:1) имел активность 89,4% согласно CEX при REACT.PT300 (образец из временной точки 5.00 часов) (см. таблицу 28), поскольку цистеин был израсходован после временной точки 4.00, приводя к неполному восстановлению антитела. REACT085 (фигура 14C) в более позднюю временную точку REACT.P (образец из временной точки 7.00 часов) имел даже меньшую активность согласно CEX (84,0%, см. таблицу 29) поскольку высокий уровень кислорода в поздней фазе реакции, в отсутствие цистеина, приводил к окислительной деградации антитела. опыты REACT084 (фигура 14C) (молярное соотношение цистеин:антитело приблизительно 71:1) и REACT075 (фигура 14C) (молярное соотношение цистеин:антитело приблизительно 71:1) были двумя другими опыты с относительно низкой активность в более позднюю временную точку REACT.P (оба 88,9%), хотя активность была высокой в более раннюю временную точку REACT.PT300. В данных опытах восстановление антитела, казалось, будет полным во временную точку 5.00 часов (временная точка REACT.PT300); однако, деградация произошла в более позднюю временную точку REACT.P вследствие увеличенного уровня dO2 и отсутствия цистеина. Аналогичным образом, относительно низкая активность, обнаруженная в более позднюю временную точку REACT.P для опыта REACT072 (фигура 14B) (90,2%) (молярное соотношение цистеин:антитело приблизительно 56:1) объясняется повышением уровня кислорода во время фазы охлаждения реакции. Высокая активность, полученная в опытах при 0 об/мин (даже в опыте REACT082, в котором содержание антител было высоким, а концентрация цистеина была низкой [молярное соотношение цистеин:антитело приблизительно 46:1]) возникала, поскольку скорость переноса кислорода была низкой, и расход цистеина вследствие этого был номинальным, обеспечивая полное восстановление (а также защиту) против окислительной деградации во время более поздней фазы охлаждения восстановления.
В заключение, в системе восстановления перенос кислорода необходимо сохранять низким, поскольку кислород расходует восстановитель (цистеин), расход которого опосредуется (или ускоряется) самим антителом. Вследствие этого имеет место двойное воздействие данного расхода цистеина: 1) потеря восстановительной силы цистеина приводит к неполному разблокированию CysL97-SH в более ранней временной точке REACT.PT 300; и 2) при отсутствии остаточного цистеина, способного к защите разблокированного Cys97L-SH в период времени между REACT.P300 и REACT.P, может произойти повторное окисление разблокированного Cys97L-SH.
Пример 9.2 - Характеристика способа: наихудшие/наилучшие сценарии событий
Главной целью исследований наихудших/наилучших случаев была характеристика входных факторов стадии селективного восстановления, которые не были протестированы во время планирования экспериментального исследования (DOE), но были оценены как возможно важные при анализе производственных рисков. Данные также применяли для определения достоверных допустимых диапазонов и поддержки классификации входных параметров на основе влияния их действия на характеристику продукта.
Пример 9.2.1 -Дизайн и способы эксперимента.
Увеличенное время нагревания оценивали как возможно важное, поскольку оно повышает перенос кислорода в раствор для селективного восстановления вследствие увеличенной продолжительности перемешивания, что может приводить к пониженной восстановительной силе за счет превращения цистеина в цистин и, следовательно, менее селективному восстановлению антитела. По этой же причине повышенный начальный уровень dO2 оценивали как возможный важный входной параметр.
Окисление сульфгидрильной группы цистеина является pH-зависимым. Вследствие этого, влияние pH оценивали как возможный важный входной параметр.
Высокая восстановительная сила может приводить к избыточному восстановлению антитела, а протяженное время охлаждения может способствовать повторной сборке антитела. Таким образом, протяженное время охлаждения также было оценено как возможный важный входной параметр.
Хотя температуру уже тестировали во время более ранней разработки способа (32-42°C), она была оценена как возможно значительная. Как правило, скорость химической реакции снижается с более низкой температурой. Вследствие этого, в специализированных опытах кинетику определяли на верхней и низкой границе.
Также изучали время инкубации. Малое время инкубации могло приводить к более высоким уровням избыточно восстановленного продукта в пуле селективного восстановления. И напротив, протяженное время инкубации могло приводить к более низкой активности согласно CEX, как показано в результатах плана на поверхности отклика (см. таблицу 29, сравнить с активностью согласно образцам CEX REACT.PT300 и REACT.P).
Для оценки влияния описанных выше параметров на стадии селективного восстановления определяли три наихудших/наилучших случая последовательностей. Входные параметры для оценки восстановительной силы в последовательности наихудших/наилучших случаев показаны в таблице 30. Вторая последовательность наихудших/наилучших случаев была создана для оценки влияния температуры на стадии селективного восстановления (таблица 31). Влияние времени инкубации было оценено в третьем исследовании наихудших/наилучших случаев в соответствии с входными параметрами, перечисленными в таблице 32. Выходные параметры качества продукта, применяемые для оценки результатов исследований наихудших/наилучших случаев, представляют собой активность согласно CEX и чистоту согласно CE-SDS.
|
Таблица 30: Входные параметры для оценки влияния на восстановительную силу.
|
Таблица 31: Входные параметры для оценки влияния на температуру культивирования. 1) тестировали 32°C, поскольку скорость реакции селективного восстановления при 18°C была недостаточной, приводя к неполной реактивации.
|
Таблица 32: Входные параметры для оценки влияния на время инкубации.
Для оценки влияния дополнительных возможно важных параметров были проведены специализированные опыты. Применяли секукинумаб, INAKT.F (хранился ниже -60°C), полученный в опыте B008530 в промышленном масштабе. Буферы AIN457-TITR1, AIN457-TITR2 и AIN457-TITR3 являются такими, как описано в примере 10. Эксперименты проводили на квалификационной модели в уменьшенном масштабе (подробно описанной в примере 10) в открытом биореакторе с перемешиванием (максимальный объем 2 л) с мониторингом pH, растворенного кислорода, скорости мешалки и температуры. Для всех опытов применяли технологические параметры из таблицы 27. Все входные параметры, которые не являлись частью отдельных исследований, сохраняли постоянными с целевым значением в таблице 27 в пределах рабочего диапазона стандартной последовательности.
Пример 9.2.2 - Результаты наихудших/наилучших сценариев
План дизайна эксперимента и выходные параметры (чистота согласно CE-SDS и активность согласно CEX) для исследования влияния времени нагревания, времени охлаждения, dO2 в начале и рН способа показаны в таблице 33. План дизайна эксперимента и выходные параметры (чистота согласно CE-SDS и активность согласно CEX) для исследования влияния температуры инкубации показаны в таблице 34. План дизайна эксперимента и выходные параметры (чистота согласно CE-SDS и активность согласно CEX) для исследования времени инкубации продемонстрированы в таблице 35.
Как показано в таблице 33, дублированные опыты с низкой восстановительной силой, а также высокой восстановительной силой давали высокую активность согласно CEX, а также чистоту согласно CE-SDS. Следовательно, способ может охватывать изменения входных параметров времени нагревания и времени охлаждения (включая перемешивание), уровень dO2 в начале и рН способа в пределах тестируемых диапазонов.
|
Таблица 33: План дизайна эксперимента и выходные параметры для исследования влияния времени нагревания, времени охлаждения, dO2 в начале и рН способа. 1) дублированные опыты проходят с более низкой восстановительной силой вследствие более низкого pH, более высокого начального уровня dO2 и более длительного времени нагревания и охлаждения. 2) дублированные опыты с более высокой восстановительной силой вследствие более высокого pH, более низкого начального уровня dO2 и более короткого времени нагревания и охлаждения.
Результаты экспериментов для оценки влияния температуры инкубации показаны в таблице 34. Можно наблюдать, что чистота согласно CE-SDS всегда была высокой, тогда как высокая активность согласно CEX была получена только в опытах при 32°C и выше.
|
Таблица 34: План дизайна эксперимента и выходные параметры для исследования влияния температуры инкубации. 1) Опыт с дополнительной центральной точкой.
Дополнительно кинетику активности согласно CEX определяли при различных температурах инкубации. Данные результаты показаны на фигуре 15. Можно наблюдать, что кинетика при 42°C является более быстрой, чем при 32°C, особенно на более поздней фазе (60 мин и более). Однако, при обеих температурах достигалось одинаковое плато при 240 мин и REACT.P. При 18°C скорость реакции является более медленной, приводя к более низкому повышению активности согласно CEX в пределах продолжительности тестируемой стадии.
Результаты экспериментов для оценки влияния времени инкубации показаны в таблице 35. Во всех случаях была получена высокая активность и чистота.
|
Таблица 35: План дизайна эксперимента и выходные параметры для исследования влияния времени инкубации. 1) Низкое время инкубации. 2) Высокое время инкубации.
Пример 9.3 - Классификация и обоснование технологических параметров
Пример 9.3.1 - Исследование план на поверхности отклика: Приемлемые диапазоны
Чистота согласно CE-SDS составила по меньшей мере 90% во всех экспериментах в момент времени 1 (REACT.PT300) и в конце селективного восстановления (REACT.P). Чтобы достичь высоких уровней чистоты согласно CE-SDS, входной параметр кратность разведения посредством добавления TITR3 должен быть установлен высоким, а скорость мешалки должна быть установлена от средней до высокой. Данные условия соответствуют низкой восстановительной силе вследствие более низкой концентрации цистеина и увеличенного переноса кислорода через свободное пространство над продуктом. Входной параметр содержание согласно ALC, т.е. концентрация антител, имеет значительное влияние в момент времени 1 (REACT.PT300) во время стадии селективного восстановления и является оптимальным вокруг центральной точки. Влияние концентрации антител (содержание согласно ALC) на абсолютное значение чистоты согласно CE-SDS является незначительным в пределах изучаемых диапазонов. Тем не менее, указанное значение чистоты было соблюдено во всех экспериментах, и весь диапазон, исследованный для параметров содержание согласно ALC (концентрация антител), кратность разведения посредством добавления TITR3 (концентрация цистеина) и скорость мешалки (перенос кислорода) является подходящим для обеспечения должной чистоты согласно CE-SDS после селективного восстановления.
Активность согласно CEX составила по меньшей мере 90% для всех, кроме REACT085 (см. таблицу 28) в момент времени 1 (REACT.PT300). Данный эксперимент был проведен со скоростью мешалки на самом высоком уровне, представляющем более высокий перенос кислорода. Несмотря на ожидания, более долгое время инкубации (т.е. дополнительные 60 минут, временная точка REACT.P) не была особо выгодной для выходного параметра активность согласно CEX, поскольку два дополнительных эксперимента (REACT075 и REACT084, см. таблицу 29) продемонстрировали активность согласно CEX ниже 93%. Данные эксперименты имеют либо высокую скорость мешалки, либо высокий уровень кратности разведения посредством добавления TITR3, представляя низкую концентрацию цистеина и увеличенный перенос кислорода через свободное пространство над продуктом. Данные результаты предполагают, что для достижения наиболее высокой активности согласно CEX входной параметр скорость мешалки должен быть настроен на низкий уровень, подразумевая низкий перенос кислорода, а кратность разведения посредством добавления TITR3 должна быть настроена на центральную точку или низкий уровень, подразумевая более высокую концентрацию цистеина. Входной параметр содержание согласно ALC, представляющий концентрацию антител, не оказывал значительного влияния на активность согласно CEX в данных экспериментах.
Входной параметр скорость мешалки, который опосредует перенос кислорода из свободного пространства над продуктом в раствор, является важным для стадии селективного восстановления и должен быть настроен на свой низкий уровень для обеспечения должной активности согласно CEX. В соответствии с дополнительным опытом в промышленном масштабе (B018838, данные не показаны), тестировали максимально 15 минут перемешивания в час, что приводит к приемлемому качеству продукта после стадии селективного восстановления. Однако результаты примера 8 выявили, что перенос кислорода в раствор посредством перемешивания является индивидуальным для каждого масштаба и настройки и регулируется опосредованно. Вследствие этого, условия перемешивания во время инкубации должны быть оценены в случае, напр., изменений способа или увеличения масштаба. Перемешивание во время инкубации, которое косвенно отражает уровень переноса dO2 в реакционный раствор, классифицируется как важный входной параметр с точки зрения способа.
Входные параметры содержание согласно ALC, а именно концентрация антител, и кратность разведения посредством добавления TITR3, а именно концентрация цистеина, показывают статистически значимое действие, но являются хорошо регулируемыми и имеют незначительное влияние на стадию селективного восстановления. Следовательно, их классифицируют как неключевые с точки зрения способа. Пока время смешивания во время инкубации находится в приемлемом диапазоне, изменения в пределах исследуемых диапазонов концентрации цистеина и концентрации антител будут приводить к адекватным характеристикам способа и качеству продукта после стадии селективного восстановления. Список достоверных допустимых диапазонов для данных входных параметров показан в таблице 36.
|
Таблица 36: Приемлемые диапазоны для скорости мешалки во время инкубации, содержания согласно ALC и кратность разведения посредством добавления TITR3 (концентрация цистеина). 1) В соответствии с опытом получения характеристик в промышленном масштабе, партия B018838, Сайт A, при времени инкубации 4 ч.
Пример 9.3.2 - Исследования наихудших/наилучших случаев: Приемлемые диапазоны
Входные параметры время нагревания и время охлаждения (включая перемешивание), уровень dO2 в начале и рН способа не оказывают значительного влияния в отношении характеристик качества продукта активность согласно CEX и чистота согласно CE-SDS в пределах изучаемого диапазона, продемонстрированного в таблице 37. Однако вследствие испытания плана на поверхности отклика следует избегать слишком большого переноса кислорода в раствор для селективного восстановления, поскольку это снижает восстановительную силу. Перенос кислорода является специфическим для каждого масштаба и настройки, но в аэробном способе регулируется опосредованно другими условиями способа, такими как перемешивание и воздушный поток в свободное пространство над продуктом. Вследствие этого, необходимо внимательно оценивать перемешивание во время нагревание и охлаждение, которое воздействует на перенос кислорода, особенно в случае, напр., изменений способа, переноса способа или увеличения масштаба. Соответственно, время нагревания и охлаждения (включая перемешивание) классифицируют как важные параметры с точки зрения способа. Хотя тестировали диапазон для времени нагревания и охлаждения (включая перемешивание), составляющий 45-90 минут, приемлемый диапазон был настроен на ≤90 минут, поскольку время нагревания и охлаждения (включая перемешивание) 90 минут отражает худший случай в отношении переноса кислорода, приводящего к подходящей активности согласно CEX и чистоте согласно CE-SDS.
|
Таблица 37: Тестируемые диапазоны времени нагревания, времени охлаждения, растворенного кислорода в начале и рН способа.
Результаты экспериментов, изучающих входной параметр температуру культивирования, демонстрируют, что температура инкубации, составляющая 18°C, приводит к медленной кинетике реакции, приводящей к недостаточной реактивации. Низкая температура является недостаточной для повышения активности согласно CEX в пределах времени инкубации, составляющего 240 мин, до более высоких уровней, чем 93,0%. Вследствие этого, тестируемый диапазон, составляющий 18-42°C, сужается до 32-42°C с целью обеспечения должной активности согласно CEX после стадии селективного восстановления, хотя свойство качества продукта чистота согласно CE-SDS можно достичь в пределах диапазона температуры инкубации, составляющего 18-42°C. Вследствие этого приемлемый диапазон для температуры инкубации имеет нижний предел 32°C и верхний предел 42°C.
В итоге, тестируемый диапазон времени инкубации, составляющий 210-330 мин, обеспечивает должную активность согласно CEX и чистоту согласно CE-SDS после стадии селективного восстановления.
Резюме и выводы из примера 9
На основании результатов исследования характеристик способа были определены приемлемые диапазоны входных параметров изучаемого способа. Стадия селективного восстановления характеризуется двумя выходными параметрами качества продукта чистота согласно CE-SDS и активность согласно CEX. Классификация параметров и приемлемые диапазоны суммированы в таблице 38. Соотношение цистеин:антитело для PAR составляет от приблизительно 46:1 до приблизительно 118:1. Соотношение цистеин:антитело для SOR составляет от приблизительно 54:1 до приблизительно 83:1.
|
Таблица 38: Входные параметры стадии селективного восстановления, включая классификацию. 1) После разведения WFI перед регулированием pH и добавлением TITR3, 2) перед нагреванием. 3) Во время инкубации. 4) В соответствии с опытом получения характеристик в промышленном масштабе, партия B018838, время инкубации 4 ч. 5) в отношении промежуточного объема после добавления WFI и регулирования pH с помощью TITR1.
В начале стадии селективного восстановления кислород сдерживает восстановительную силу цистеина, тогда как непрерывный перенос кислорода в раствор приводит к увеличенному уровню кислорода и меньшей активности антитела согласно CEX. Однако, в конце стадии селективного восстановления, введение кислорода может усилить образование дисульфидных связей в антителах, которые были разъединены в начале реакции, когда восстановительная сила была высокой, и, вследствие этого, кислород является важным для обеспечения должной чистоты согласно CE-SDS в невосстанавливающих условиях. Важность переноса кислорода для активности антитела продемонстрирована результатами исследования плана на поверхности отклика, в котором наблюдалось значительное воздействие скорости мешалки на перенос кислорода и, следовательно, активность продукта согласно CEX (см. таблицы 28 и 29). Однако скорость мешалки имела различное воздействие на уровень dO2 в зависимости от размера сосуда, размера мешалки, типа мешалки и т.д. Таким образом, важно идентифицировать переменную, которую можно применять для сравнения кислорода, перенесенного в раствор между физическими настройками.
Пример 10: Скорость Переноса кислорода (kLa*) в модели в уменьшенном масштабе
В предыдущем примере авторы изобретения продемонстрировали, что, среди прочего, количество dO2, присутствующего во время селективного восстановления, в частности во время стадии инкубации, имеет сильное влияние на качество и активность секукинумаба. Когда селективное восстановление проводят в аэробных условиях, уровень кислорода в реакции регулируется не напрямую, а через другие рабочие условия, напр., скорость перемешивания и воздушный поток в свободное пространство над продуктом. Физическая настройка каждой реакции также влияет на уровень кислорода, присутствующий в реакционной смеси (оборудование и рабочие условия вместе образуют «систему»). «KLa*» можно применять для сравнения кислорода, перенесенного в раствор между физическими настройками и во время конкретных стадий процессинга антител (см., напр., Garcia-Ochoa and Gomez (2009) Biotechnology Advances 27:153-176; Bandino et al. (2001) Biochem. Engineering J. 8:111-119; Juarez and Orejas (2001) Latin Am. Appl. Res. 31:433-439; Yange and Wang (1992) Biotechnol. Prog. 8:244-61). KLa* представляет количество кислорода, перенесенного в раствор с течением времени через свободное пространство над продуктом без разбрызгивания. Данное значение является конкретным для каждой настройки и масштаба и зависит от типа мешалки, скорости мешалки, объема наполнения и площади поверхности раствора в контакте со свободным пространством над продуктом, на которое влияет индивидуальная геометрия каждого сосуда. При том, что kLa* каждой физической настройки отличается, поскольку уровень кислорода в растворе во время стадии селективного восстановления значительно влияет на активность и целостность секукинумаба, авторы изобретения ожидают, что стадия селективного восстановления, при проведении в системах, демонстрирующих сходные диапазоны kLa*, будет приводить к препаратам секукинумаба, имеющим сходное качество.
KLa* невозможно определять непосредственно в экспериментах по переносу кислорода. Вместо этого dO2 в тестируемом растворе заменяют на азот и проводят мониторинг dO2 с течением времени с применением откалиброванного dO2-зонда, что позволяет создать экспериментальную кривую dO2. В дальнейшем значение kLa* рассчитывают для конкретной системы посредством адаптации экспериментальной кривой dO2 к кривой насыщения (напр., с применением Mathcad®) в соответствии с уравнением, показанным ниже:
DO=C×(1-e-kLa*×(t-t0)), где DO=измеренное значение растворенного кислорода, C представляет собой значение насыщения кислорода (обозначая 100% при непрерывном перемешивании и при достижении насыщения), e=2,718281…., t=временная точка, соответствующая значению DO, и t0=начальная временная точка.
Уравнение представляет интегрированную форму эмпирической формулы, установленной для определения переноса кислорода в растворы (значение kLa*). Формула была подтверждена различными авторами в различных экспериментах (Doran, P. M. 1995. Bioprocess Engineering Principles, Academic Press, San Diego, California, chapter 9.10.2, p. 210-213).
Пример 10.1 - Экспериментальные и Статистические Методы Расчета
Поскольку уровень растворенного кислорода является важным влияющим фактором для окислительно-восстановительных реакций, перенос кислорода оценивали для квалификации модели в уменьшенном масштабе и для сравнения с моделью промышленного масштаба.
Статистический расчет применяли для определения зависимости значения kLa* и входных параметров объема, воздушного потока в свободное пространство над продуктом, скорости мешалки и типа мешалки. Входные параметры перечислены в таблице 39. Факторы изучали на 3 уровнях, каждый в соответствии со статистическим расчетом. Выходным параметром является значение kLa*.
|
Таблица 39 - Входные параметры для определения значения kLa* модели в уменьшенном масштабе.
Для определения значения kLa* для каждого образца 2 л биореактор заполняли водой и нагревали до 37°C. Воздушный поток регулировали посредством массового расходомера и подавали в свободное пространство над продуктом. В дальнейшем раствор барботировали газообразным азотом для удаления dO2 из воды. Затем применяли постоянное перемешивание с применением турбинной мешалки Раштона (радиальной). На протяжении периода времени уровень dO2 в воде регистрировали с применением кислородного зонда (откалиброванного при комнатной температуре, приблизительно 18-25°C) до тех пор, пока dO2 не достигал 90%. В дальнейшем значение kLa* рассчитывали посредством адаптации экспериментальной кривой dO2 к кривой насыщения, как описано выше.
Применяли центральный композиционный гранецентрированный дизайн (CCF) с 3 опытами центральных точек. Дизайн был выбран для определения корреляции между наиболее важными параметрами способа и их влияния на kLa*. Данный тип дизайна поддерживает расчет математических моделей с линейными, взаимодействующими и квадратичными членами.
Пример 10.3 - Значения выходного параметра (kLa*)
Значения для экспериментальных условий и выходной параметр kLa* производительности способа перечислены в таблице 40.
|
Таблица 40: Статистический расчет - выполненная последовательность и экспериментальные условия.
Пример 10.4 - Статистическая диагностика для выходного параметра kLa*
Качество моделей отображено посредством 4 инструментов, а именно R2, Q2, пригодность модели и стандартное отклонение (SD) в параллельных опытах. Модель, которая хорошо объясняет данные, будет иметь R2 и Q2, близкие к 1,0, и пригодность модели выше 0,25. В анализе модели признано, что оценка результатов kLa* без трансформации приводит к модели, в которой остатки не отвечают требованиям нормального распределения. Это показывает, что трансформация значения kLa* является необходимой для описания должным образом результатов, которые иногда наблюдаются для общих измерений kLa* в биореакторах. Диагностика модели для выходного параметра производительности способа представляет собой R2=0,98; Q2=0,91 (после трансформации по силе, составляющей -0,5); пригодность модели=0,56 и стандартное отклонение параллельных анализов=0,06, указывая на модель с высокой статистической значимостью.
Пример 10.5 - Описание математической модели
На N-участке остатков нормированные остатки (остатки ответов, деленные на стандартное отклонение) нанесены на горизонтальную ось, а нормальное распределение на вертикальную ось. Выбросы могут быть графически идентифицированы, когда они лежат вне ± 4 нормированных остатков. Также нелинейные графики могут указывать модель, которая нуждается в трансформации выходных параметров («Design of Experiments - Principles and Applications» (1999-2008) MKS Umetrics AB, ed. Eriksson et al.). N-учасок остатков выходного параметра kLa* способа (данные не показаны) указывает на точное совпадение экспериментального результата с моделью. Значения вплотную приближаются к линии регрессии, что означает, что трансформация модели является адекватной (нормированные остатки соответствуют требованиям нормального распределения). Дополнительно, все экспериментальные значения находятся внутри диапазона ± 3 нормированных остатка, показывая, что измеренные значения не включают какие-либо выбросы.
График коэффициентов для выходных технологических параметров (данные не показаны) показывает, что входные параметры, воздушный поток, объем и скорость мешалки оказывают значительное влияние на параметр kLa* способа. Контурный график (данные не показаны) иллюстрирует действие воздушного потока, объема и скорости мешалки на kLa* - чем больше воздушный поток, тем меньше объем (т.е. тем больше свободное пространство над продуктом), и чем выше скорость мешалки, тем больше перенос кислорода через свободное пространство над продуктом, выраженный в виде kLa*.
С применением контурных и коэффициентных графиков, соответствующие значения kLa* экспериментальных условий спрогнозировали с помощью MODDE 8.02 посредством применения статистической модели. Результаты показаны в таблице 41, которая демонстрирует диапазон kLa*, который тестировали во время получения характеристики способа (см. пример 9) с применением модели в уменьшенном масштабе.
|
Таблица 41: Настройки параметров и соответствующие значения kLa*, применяемые во время исследований с получением характеристик способа.
Пример 11: Скорость переноса кислорода (kLa*) в производственном масштабе
Определили KLa* во время непрерывного перемешивания (т.е. типа перемешивания, применяемого в фазе нагревания и охлаждения способа селективного восстановления) в производственном масштабе (сосуд 1800 л).
Пример 11.1 - Определение значения kLa* в промышленном масштабе в Сайте A
Пример 11.1.1 - Способы экспериментального и статистического расчета
Статистический расчет применяли для определения зависимости значения kLa* в пределах тестируемых диапазонов входных параметров. Входные параметры перечислены ниже в таблице 42. Факторы изучали на 3 уровнях каждый в соответствии с планом статистического расчета. Выходным параметром является значение kLa*.
|
Таблица 42: Входные параметры для определения значения kLa* в Сайте A в промышленном масштабе.
Данные эксперименты в Сайте A проводили в сосуде из нержавеющей стали с максимальным рабочим объемом 1800 л, высотой 2,7 м и диаметром 1,0 м. Для определения значения kLa* для каждого образца сосуд заполняли водой и нагревали до указанной температуры. В дальнейшем для удаления dO2 из воды в свободное пространство над продуктом запускали газообразный азот. Затем использовали непрерывное перемешивание (с применением винтовой мешалки на дне). На протяжении периода времени уровень dO2 в воде регистрировали с применением кислородного зонда (откалиброванного при комнатной температуре, напр., 18-25°C) до тех пор, пока dO2 не достигал 90%. В дальнейшем значение kLa* рассчитывали посредством адаптации экспериментальной кривой dO2 к кривой насыщения, как описано выше. Входные параметры и соответствующие результаты показаны в таблице 43.
Применяли центральный композиционный гранецентрированный (CCF) дизайн с 4 центральными точками. Дизайн выбрали для определения корреляции между наиболее важными входными параметрами и их влиянием на перенос кислорода. Данный тип дизайна поддерживает расчет математических моделей с линейными, взаимодействующими и квадратичными членами.
Пример 11.1.2 - Значения выходного параметра (kLa*)
Значения для экспериментальных условий и выходного параметра kLa* производительности способа перечислены в таблице 43.
|
Таблица 43: Статистический расчет - выполненная последовательность и экспериментальные условия.
Пример 11.1.3 - Статистическая диагностика выходного параметра kLa*
Качество моделей отображено посредством 4 инструментов, а именно R2, Q2, пригодность модели и стандартное отклонение (SD) параллельных анализов. Модель, которая хорошо объясняет данные, будет иметь R2 и Q2, близкие к 1,0, и пригодность модели выше 0,25. Модели с низкой статистической значимостью будут иметь низкие значения R2 и Q2. Было признано, что оценка результатов kLa* без трансформации приводит к модели, в которой остатки не отвечают требованиям нормального распределения. Это показывает, что трансформация значения kLa* является необходимой для описания результатов должным образом. Для получения надежной модели выходной параметр трансформировали по силе, составляющей -0,5. Диагностика модели на производительность способа составила R2=0,95, Q2=0,88, пригодность модели=0,82, SD=0,15, что указывает на модель с высокой статистической значимостью.
Пример 11.1.4 - Описание математической модели
N-участок остатков для выходного параметра способа значения kLa* (данные не показаны) указывает на точное совпадение экспериментального результата с моделью. Значения вплотную приближаются к линии регрессии, что означает, что трансформация модели является адекватной (нормированные остатки соответствуют требованиям нормального распределения). Дополнительно, все экспериментальные значения находятся внутри диапазона ± 3 нормированных остатка, показывая, что измеренные значения не включают какие-либо выбросы.
График коэффициентов (данные не показаны) показывает, что входные параметры, а именно скорость мешалки, объем и температура, имеют значительное влияние на параметр kLa* способа, поскольку планки погрешностей не режут ось x. Дополнительно, выраженным является взаимодействие скорости мешалки и объема. Контурная диаграмма значения kLa* (данные не показаны) иллюстрирует действие температуры, объема и скорости мешалки на kLa* - чем больше воздушный поток, т.е. чем выше температура, тем меньше объем, а чем больше скорости мешалки, тем больше перенос кислорода через свободное пространство над продуктом, выраженный в виде kLa*.
Пример 11.1.5 - Результаты специализированного опыта в промышленном масштабе
Значение kLa* определяли в специализированном эксперименте и сравнивали с прогнозом модели, рассчитанным посредством MODDE 8.02. Результаты прогноза и специализированный опыт показаны в таблице 44. В соответствии с данными результатами, математическая модель способна спрогнозировать значение kLa* должным способом.
|
Таблица 44: Значения kLa* (прогнозируемое и измеренное) стандартных условий способа в промышленном масштабе (Сайт A).
Пример 11.1.6 - Прогнозируемый kLa* для условий способа в Сайте A
KLa* для условий способа, применяемых во время мероприятия AT493021 в Сайте A, были спрогнозированы с помощью модели, рассчитанной посредством MODDE 8.02. Результаты показаны в таблице 45 с прогнозируемыми значениями kLa*, составляющими от 0,05 ч-1 до 0,69 ч-1 при применении непрерывного перемешивания. Значения указывают на то, что стадия способа является надежной при широком диапазоне значений kLa*, полученных при различных объемах способа. Параметры, оказывающие влияние на kLa* (и, следовательно, на перенос кислорода) должны учитываться при итоговой оценке способа надежности, напр., общее время перемешивания имеет значительное влияние на перенос кислорода.
|
Таблица 45: Значения kLa* условий способа в промышленном масштабе (Сайт A). 1) Объем превышает оцененный диапазон. Экстраполяция может приводить к неточным значениям.
Пример 12 - Квалификационные опыты и сравнение модели в уменьшенном масштабе с моделью в промышленном масштабе в Сайте A
Пример 12.1 - Способы
Три квалификационных опыта модели в уменьшенном масштабе (REACT065, REACT066 и REACT067), проведенные в стандартных условиях, сравнили с семью репрезентативными опытами в промышленном масштабе. Для квалификационных опытов модели в уменьшенном масштабе, применяли секукинумаб, INAKT.F (хранился ниже -60°C), полученный в опыте B008530 в промышленном масштабе (мероприятие AT493021, САЙТ A). Перед применением загрузку (INAKT.F) оттаивали на водяной бане при температуре тела (15-35°C). Стадии полной процедуры селективного восстановления продемонстрированы в таблице 46.
|
Таблица 46: Описание процедуры селективного восстановления. *подсчет для добавления WFI:Vol (WFI)=(Vol(INAKT.F)*c(INAKT.F)/13,5 мг/мл)- Vol(INAKT.F); **подсчет для добавления TITR3: Vol(TITR3)=(Vol(INAKT.F)+Vol(WFI)+Vol(TITR1))*фактор (TITR3), где фактор (TITR3)=0,05/0,95=0,05263 (6 мМ цистеина в реактивирующем растворе).
Технологические параметры, перечисленные в таблице 47, применяли для квалификационных опытов модели в уменьшенном масштабе. Параметры соответствовали условиям способа в промышленном масштабе (САЙТ A) и были соответствующим образом уменьшены.
|
Таблица 47: Технологические параметры стадии селективного восстановления. 1 перемешивание в течение 2 минут каждый час при 50 об/мин.
Отбирали образцы, pH регулировали с помощью 0,3 M ортофосфорной кислоты, от pH 1,4 (AIN457-TITR2) до 5,2 (приемлемый диапазон 5,0-5,4) в течение 5 минут, а затем образцы переносили в аналитическую лабораторию. Все сохраненные образцы замораживали и хранили при ≤-60°C. Квалификационную модель в уменьшенном масштабе оценивали посредством сравнения характеристик качества продукта активность согласно CEX и чистота согласно CE-SDS, как описано ранее. Тестировали следующие временные интервалы: 0, 10, 20, 30, 45, 60, 120, 240 мин.
Пример 12.2 - Результаты
Графики растворенного кислорода из трех репрезентативных опытов в промышленном масштабе (данные не показаны) и квалификационных опытов модели в уменьшенном масштабе (фигура 16) показывают характерную форму стадии селективного восстановления. Кривые показывают, что растворенный кислород удаляется из системы посредством окисления цистеина. Согласно опыту разработки, продолжительное перемешивание приводит к более высокому переносу кислорода и приводит к недостаточной активности согласно CEX. Следовательно, раствор для селективного восстановления перемешивают только в течение 2-15 минут в час во время инкубации, ограничивая тем самым перенос кислорода в раствор и сохраняя уровень растворенного кислорода низким до тех пор, пока селективное восстановление не остановится. Во время фазы охлаждения уровень кислорода незначительно повышается вследствие переноса кислорода в раствор посредством непрерывного смешивания, тогда как определенное количество цистеина окисляется, делая его недоступным в качестве восстановителя для растворенного кислорода.
Для опытов 3-6 в промышленном масштабе мероприятия AT493021 в САЙТЕ A активность согласно CEX в среднем составила 96,3% со стандартным отклонением, составившим 0,8%, тогда как чистота согласно CE-SDS в среднем составила 92% со стандартным отклонением, составившим 1%. Результаты каждого опыте продемонстрированы в таблице 48 наряду с прогнозируемыми значениями kLa*, полученных из таблицы 45.
|
Таблица 48: Экспериментальные результаты опытов в промышленном масштабе.
Для квалификационных опытов модели в уменьшенном масштабе активность согласно CEX имела среднее значение 95,0% со стандартным отклонением, составлявшим 1,6%, тогда как чистота согласно CE-SDS в среднем составила 94% со стандартным отклонением 1% (таблица 49).
|
Таблица 49: Экспериментальные результаты квалификационных опытов модели в уменьшенном масштабе.
В дополнение к оценке качества продукта в конце стадии селективного восстановления, также провели мониторинг кинетики активности согласно CEX и сравнили результаты опытов с моделями в уменьшенном масштабе (среднего REACT065, 66 и 67) и в промышленном масштабе в САЙТЕ A. Результаты показаны на фигуре 17. Данные, полученные в модели с уменьшением масштаба, находятся в пределах изменения производственной шкалы, демонстрируя, что кинетика в крупном масштабе (участок А) и мелком масштабе сопоставима.
Пример 13 - комбинированный анализ значений kLa* из примеров 9-12
Из-за важности уровня растворенного кислорода в растворе во время реакции селективного восстановления контролируемый перенос кислорода из свободного пространства сосуда является важным для стадии селективного восстановления. Для каждой системы эти переменные могут быть зафиксированы как значения kLa*. KLa* зависит от скорости мешалки, типа мешалки, объема наполнения, температуры и площади поверхности раствора в контакте со свободным пространством над продуктом, на которое влияет индивидуальная геометрия каждого сосуда. При том, что kLa* будет меняться в зависимости от каждой настройки, в указанных выше экспериментах можно наблюдать, что диапазон значений kLa* является приемлемым для обеспечения качества и активность секукинумаба во время способа селективного восстановления.
Прогнозируемый диапазон kLa*, составляющий 0,18 ч-1-0,37 ч-1 для экспериментальных условий исследований в уменьшенном масштабе, был определен с использованием статистической модели (таблица 41). Значение kLa* уменьшалось, поскольку уменьшалась скорость перемешивания, с учетом установленного объема. Поскольку план на поверхности отклика экспериментальной условия и настройки в примере 9 являются такими же, как и применяемые с моделью в уменьшенном масштабе в примере 10, прогнозируемые значения kLa* таблицы 41 могут коррелировать с условиями и результатами в таблице 28. Данный анализ присутствует в таблице 50.
|
Таблица 50: анализ kla* для значений выходных параметров REACT.PT300 и REACT.P. Молярные соотношения округляются до ближайшего целого числа. Относительная молекулярная масса секукинумаба, исходя из аминокислотной последовательности, составляет 147944 Дальтон, которую применяют для расчета молярного соотношения цистеина и белка в колонке 4.
Для экспериментов, имеющих период культивирования 240 минут (REACT.PT300), все реакции, кроме REACT085, приводили к очень высокой производительности селективного восстановления с должным качеством продукта, как измерено посредством CEX и CE-SDS (таблица 50). REACT085 имел скорость перемешивания, составляющую 100 об/мин, значение kLa*, составляющее 0,37 ч-1 во время инкубации, и очень низкое молярное соотношение цистеина и антитела (приблизительно 46:1). Низкое молярное соотношение цистеина и антитела в сочетании с высоким переносом кислорода в сосуд (отображенным высоким значение kLa*), вероятно, приводило к недостаточной реактивации.
Для экспериментов, имеющих период культивирования 300 минут (REACT.P), все реакции, кроме REACT085, REACT075 и REACT084 приводили к очень высокой производительности селективного восстановления с должным качеством продукта, как измерено посредством CEX и CE-SDS (таблица 50). REACT085, REACT075 и REACT084 имели скорость перемешивания, составляющую 100 об/мин, значение kLa*, составляющее 0,37 ч-1 во время инкубации, и средне-низкое молярное соотношение цистеина и антитела (приблизительно 46:1 и приблизительно 71:1). Средне-низкое молярное соотношение цистеина и антитела в сочетании с высоким переносом кислорода в сосуд (отображенным высоким значение kLa*), вероятно, приводило к недостаточной реактивации. Увеличенное время инкубации (по отношению к образцам REACT.PT300), по-видимому, способствовало более низким значениям CEX в некоторых опыты REACT.P.
Как можно наблюдать в таблице 50, реакции с активностью согласно CEX более чем 90% имеют следующие характеристики в отношении kLa * в системе во время отрезка культивирования реакции селективного восстановления:
1) если kLa* в системе во время стадии инкубации реакции селективного восстановления составляет <0,37 ч-1, то молярное соотношение цистеин:антитело может варьировать между приблизительно 46:1 и приблизительно 118:1 (как для более короткого, так и более продолжительного времени инкубации, напр., от приблизительно 210 до приблизительно 330 минут, напр., 240-300 минут); и
2) kLa* в системе во время стадии инкубации реакции селективного восстановления может составлять до 0,37 ч-1, если молярное соотношение цистеин:белок составляет между приблизительно 56:1 и приблизительно 118:1 (в течение более короткого времени инкубации, напр., вплоть до приблизительно 240 минут инкубации) или между приблизительно 77:1 и приблизительно 118:1 (в течение более длительного времени инкубации, напр., вплоть до приблизительно 300 минут инкубации).
Конечно, kLa* во время фазы нагревания и охлаждения может быть гораздо более высоким, чем kLa* во время фазы инкубации, напр., таблица 54 демонстрирует, что во время фазы нагревания/охлаждения можно применять высокий kLa*, такой как 0,69 ч-1, и где производить высококачественный продукт.
В примере 9 (исследования характеристик способа) рассматривались выходные параметры активность согласно CEX и чистота согласно CE-SDS с применением модели в уменьшенном масштабе, которая использовала постоянное перемешивание во время фазы инкубации. В примере 10 рассматривались значения kLa* модели в уменьшенном масштабе, которая также использовала постоянное перемешивание. В примере 11 рассматривались значения kLa* с применением непрерывного перемешивания в промышленном масштабе. Во время фактического производства непрерывное перемешивание применяется только во время фаз нагревания и охлаждения реакции селективного восстановления, в то время как прерывистое перемешивание (например, 2-15 минут в час) применяется во время фаз культивирования реакции селективного восстановления. Вследствие этого, во время производства kLa* системы во время фаз инкубации реакции стадии селективного восстановления будет гораздо более низким, чем значения kLa*, наблюдаемые в примерах 10 и 11. Тем не менее из комбинированных результатов примеров 9-11 можно наблюдать, что все стадии селективного восстановления (т.е. фаза нагревания, фаза культивирования и фаза охлаждения) могут в целом проводиться с применением kLa*, составляющим <0,37 ч-1, включая от приблизительно 240 до приблизительно 300 минут фазы инкубации, если молярное соотношение цистеин:антитело составляет между приблизительно 46:1 и приблизительно 118:1.
Эксперименты с худшими/лучшими случаями примера 9 были проведены с применением такой же квалификационной модели в уменьшенном масштабе, с применением молярного соотношения цистеин:антитело, составляющего приблизительно 66:1, с незначительным перемешиванием (т.е. 2 минуты в час) во время фазы инкубации (kLa* составляет <0,18 ч-1). Поскольку реакции с инкубированием в течение от 210 до 330 минут в экспериментах с худшими/лучшими случаями примера 9 все давали высококачественный продукт, ожидалось, что время инкубации может растянуться до приблизительно 210-приблизительно 330 минут, если kLa* является низким, а молярное соотношение цистеин:антитело является средним (напр., приблизительно 66:1).
Пример 14 - Предпочтительные параметры и процедуры способа селективного восстановления
Предпочтительные технологические параметры стадии селективного восстановления перечислены в таблице 51. Молярное соотношение цистеин:антитело для заданной величины составило приблизительно 66:1 с предположительным рабочим диапазоном, составляющим от приблизительно 54:1 до приблизительно 83:1, и достоверным допустимым диапазоном, составляющим от приблизительно 46:1 до приблизительно 118:1.
|
Таблица 51: Селективное восстановление - список технологических параметров.
Отдельные стадии процедуры селективного восстановления продемонстрированы в таблице 52. Во-первых, концентрацию белка первичного материала регулировали посредством добавления WFI до целевой концентрации, составляющей 13,5 мг/мл. Далее, pH доводили до 8,0 посредством добавления 1 M Триса. dO2 проверяли и регулировали (напр., до ≥ 60%), напр., посредством дополнительного перемешивания, погружной аэрации и т.д. при несоответствии рабочему диапазону. Реакцию начинали посредством добавления цистеина до 6 мМ, и в дальнейшем раствор нагревали (на протяжении приблизительно часа) до температуры инкубации (приблизительно 37°C). Раствор культивировали в течение приблизительно 250 минут с перемешиванием приблизительно 2 минут в час для ограничения переноса кислорода из свободного пространства над продуктом в раствор во время инкубации. В заключение раствор охлаждали до комнатной температуры (на протяжении приблизительно часа), и pH корректировали до приблизительно 5,2, напр., 0,3 M ортофосфорной кислотой для остановки реакции.
|
Таблица 52: Описание процедуры селективного восстановления. *Подсчет для добавления WFI:Vol (WFI)=(Vol (INAKT.F)*c (INAKT.F)/13,5 мг/мл) -Vol(INAKT.F); **подсчет для добавления TITR3: Vol(TITR3)=(Vol(INAKT.F)+Vol(WFI)+Vol(TITR1))*фактор (TITR3), где фактор (TITR3)=0,05/0,95=0,05263 (6 мМ цистеина в реактивирующем растворе).
--->
Список последовательностей
<110> Novartis AG
Heitzmann, Markus
Winkler, Johann
<120> СЕЛЕКТИВНОЕ ВОССТАНОВЛЕНИЕ ЦИСТЕИНОВЫХ ОСТАТКОВ В АНТИТЕЛАХ ПРОТИВ IL-17
<130> 56418 FF
<140> Herewith
<141> Herewith
<150> 62/095361
<151> 2014-12-22
<160> 15
<170> PatentIn version 3.5
<210> 1
<211> 5
<212> Белок
<213> искусственная
<220>
<223> CDR1 = гипервариабельная область 1 тяжелой цепи AIN457
<400> 1
Asn Tyr Trp Met Asn
1 5
<210> 2
<211> 17
<212> Белок
<213> искусственная
<220>
<223> CDR2 = гипервариабельная область 2 тяжелой цепи AIN457
<400> 2
Ala Ile Asn Gln Asp Gly Ser Glu Lys Tyr Tyr Val Gly Ser Val Lys
1 5 10 15
Gly
<210> 3
<211> 18
<212> Белок
<213> искусственная
<220>
<223> CDR3 = гипервариабельная область 3 тяжелой цепи AIN457
<400> 3
Asp Tyr Tyr Asp Ile Leu Thr Asp Tyr Tyr Ile His Tyr Trp Tyr Phe
1 5 10 15
Asp Leu
<210> 4
<211> 12
<212> Белок
<213> искусственная
<220>
<223> CDR1' = гипервариабельная область 1 легкой цепи AIN457
<400> 4
Arg Ala Ser Gln Ser Val Ser Ser Ser Tyr Leu Ala
1 5 10
<210> 5
<211> 7
<212> Белок
<213> искусственная
<220>
<223> CDR2' = гипервариабельная область 2 легкой цепи AIN457
<400> 5
Gly Ala Ser Ser Arg Ala Thr
1 5
<210> 6
<211> 9
<212> Белок
<213> искусственная
<220>
<223> CDR3' = гипервариабельная область 3 легкой цепи AIN457
<400> 6
Gln Gln Tyr Gly Ser Ser Pro Cys Thr
1 5
<210> 7
<211> 381
<212> DNA
<213> HOMO SAPIENS
<220>
<221> CDS
<222> (1)..(381)
<400> 7
gag gtg cag ttg gtg gag tct ggg gga ggc ttg gtc cag cct ggg ggg 48
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
tcc ctg aga ctc tcc tgt gca gcc tct gga ttc acc ttt agt aac tat 96
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
tgg atg aac tgg gtc cgc cag gct cca ggg aaa ggg ctg gag tgg gtg 144
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
gcc gcc ata aac caa gat gga agt gag aaa tac tat gtg ggc tct gtg 192
Ala Ala Ile Asn Gln Asp Gly Ser Glu Lys Tyr Tyr Val Gly Ser Val
50 55 60
aag ggc cga ttc acc atc tcc aga gac aac gcc aag aac tca ctg tat 240
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
ctg caa atg aac agc ctg aga gtc gag gac acg gct gtg tat tac tgt 288
Leu Gln Met Asn Ser Leu Arg Val Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
gtg agg gac tat tac gat att ttg acc gat tat tac atc cac tat tgg 336
Val Arg Asp Tyr Tyr Asp Ile Leu Thr Asp Tyr Tyr Ile His Tyr Trp
100 105 110
tac ttc gat ctc tgg ggc cgt ggc acc ctg gtc act gtc tcc tca 381
Tyr Phe Asp Leu Trp Gly Arg Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 8
<211> 127
<212> Белок
<213> HOMO SAPIENS
<400> 8
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ala Ile Asn Gln Asp Gly Ser Glu Lys Tyr Tyr Val Gly Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Val Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Arg Asp Tyr Tyr Asp Ile Leu Thr Asp Tyr Tyr Ile His Tyr Trp
100 105 110
Tyr Phe Asp Leu Trp Gly Arg Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 9
<211> 327
<212> DNA
<213> HOMO SAPIENS
<220>
<221> CDS
<222> (1)..(327)
<400> 9
gaa att gtg ttg acg cag tct cca ggc acc ctg tct ttg tct cca ggg 48
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
gaa aga gcc acc ctc tcc tgc agg gcc agt cag agt gtt agc agc agc 96
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
tac tta gcc tgg tac cag cag aaa cct ggc cag gct ccc agg ctc ctc 144
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
atc tat ggt gca tcc agc agg gcc act ggc atc cca gac agg ttc agt 192
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
ggc agt ggg tct ggg aca gac ttc act ctc acc atc agc aga ctg gag 240
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
cct gaa gat ttt gca gtg tat tac tgt cag cag tat ggt agc tca ccg 288
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Pro
85 90 95
tgc acc ttc ggc caa ggg aca cga ctg gag att aaa cga 327
Cys Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys Arg
100 105
<210> 10
<211> 109
<212> Белок
<213> HOMO SAPIENS
<400> 10
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Pro
85 90 95
Cys Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys Arg
100 105
<210> 11
<211> 10
<212> Белок
<213> искусственная
<220>
<223> CDR1-x = гипервариабельный домен x тяжелой цепи AIN457
<400> 11
Gly Phe Thr Phe Ser Asn Tyr Trp Met Asn
1 5 10
<210> 12
<211> 11
<212> Белок
<213> искусственная
<220>
<223> CDR2-x = гипервариабельный домен тяжелой цепи x of AIN457
<400> 12
Ala Ile Asn Gln Asp Gly Ser Glu Lys Tyr Tyr
1 5 10
<210> 13
<211> 23
<212> Белок
<213> искусственная
<220>
<223> CDR3-x = гипервариабельный домен x тяжелой цепи AIN457
<400> 13
Cys Val Arg Asp Tyr Tyr Asp Ile Leu Thr Asp Tyr Tyr Ile His Tyr
1 5 10 15
Trp Tyr Phe Asp Leu Trp Gly
20
<210> 14
<211> 215
<212> Белок
<213> homo sapiens
<400> 14
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Pro
85 90 95
Cys Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys Arg Thr Val Ala
100 105 110
Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser
115 120 125
Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu
130 135 140
Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser
145 150 155 160
Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu
165 170 175
Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val
180 185 190
Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys
195 200 205
Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 15
<211> 457
<212> Белок
<213> homo sapiens
<400> 15
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ala Ile Asn Gln Asp Gly Ser Glu Lys Tyr Tyr Val Gly Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Val Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Arg Asp Tyr Tyr Asp Ile Leu Thr Asp Tyr Tyr Ile His Tyr Trp
100 105 110
Tyr Phe Asp Leu Trp Gly Arg Gly Thr Leu Val Thr Val Ser Ser Ala
115 120 125
Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser
130 135 140
Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe
145 150 155 160
Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly
165 170 175
Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu
180 185 190
Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr
195 200 205
Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg
210 215 220
Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro
225 230 235 240
Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
245 250 255
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
260 265 270
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
275 280 285
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
290 295 300
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
305 310 315 320
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
325 330 335
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
340 345 350
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met
355 360 365
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
370 375 380
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
385 390 395 400
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
405 410 415
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
420 425 430
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
435 440 445
Lys Ser Leu Ser Leu Ser Pro Gly Lys
450 455
<---