Результат интеллектуальной деятельности: ПРОТИВООПУХОЛЕВОЕ ТЕРАПЕВТИЧЕСКОЕ СРЕДСТВО
Вид РИД
Изобретение
Область техники
[1] Настоящее изобретение относится к противоопухолевому терапевтическому средству, применяемому для комбинированной терапии на основе ленватиниба, ифосфамида и этопозида.
Уровень техники
[2]
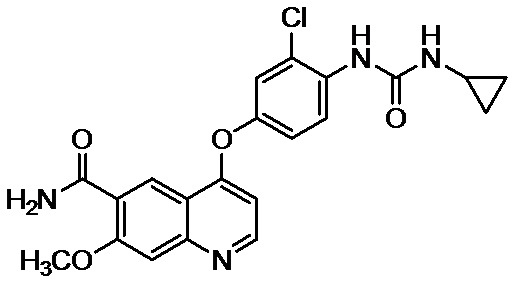
[3] Ленватиниб обладает эффектом ингибирования ангиогенеза (патентный литературный источник 1) и ингибирующим эффектом (патентные литературные источники 2-5) против тирозинкиназы, которая, как считается, причастна к злокачественной трансформации опухолей (непатентные литературные источники 1-5); и ленватиниб известен как терапевтическое средство для различных опухолей, таких как рак щитовидной железы, рак легких, меланома, рак эндометрия, рак желудка, рак мочевого пузыря, рак почки, глиома, рак печени и рак яичников.
[4]
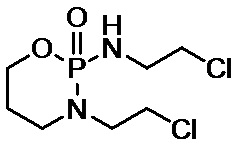
[5] Ифосфамид известен как терапевтическое средство для многих злокачественных опухолей, таких как мелкоклеточный рак легких, рак предстательной железы, рак шейки матки и остеосаркома.
[6]
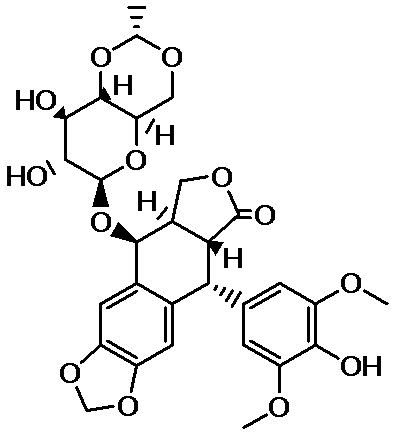
[7] Этопозид известен как терапевтическое средство для злокачественных опухолей, таких как мелкоклеточный рак легких, злокачественная лимфома и острый лейкоз.
[8] В общем, противоопухолевые терапевтические средства часто являются неэффективными для всех пациентов, когда их применяют по отдельности. Соответственно, предпринимаются попытки повысить эффективность лечения путем применения множества противоопухолевых терапевтических средств в комбинации, для усиления противоопухолевых эффектов и снижения нежелательных эффектов (патентный литературный источник 6 и патентный литературный источник 7).
[9] Комбинированное введение ифосфамида и этопозида применяется для злокачественных опухолей, таких как остеосаркома и саркома Юинга (непатентные литературные источники 6-8).
Список использованной литературы
Патентная литература
[10]
Патентный литературный источник 1: публикация заявки на патент США № 2004-053908
Патентный литературный источник 2: публикация заявки на патент США № 2004-253205
Патентный литературный источник 3: публикация заявки на патент США № 2010-105031
Патентный литературный источник 4: публикация заявки на патент США № 2009-209580
Патентный литературный источник 5: публикация заявки на патент США № 2009-264464
Патентный литературный источник 6: публикация заявки на патент США № 2011-104161
Патентный литературный источник 7: публикация заявки на патент США № 2004-259834
Непатентная литература
[11]
Непатентный литературный источник 1: Lasota et al., "Mutations in Exons 9 and 13 of KIT Gene Are Rare Events in Gastrointestinal Stromal Tumors," American Journal of Pathology, vol. 157, pp. 1091-1095, 2000
Непатентный литературный источник 2: Berdel et al., "Recombinant Human Stem Cell Factor Stimulates Growth of a Human Glioblastoma Cell Line Expressing c-kit Protooncogene1," Cancer Research, vol. 52, pp. 3498-3502, 1992
Непатентный литературный источник 3: Lennartsson et al., "The stem cell factor receptor/c-Kit as a drug target in cancer," Current Cancer Drug Targets, vol. 6, pp. 65-75, 2006
Непатентный литературный источник 4: Turner et al., "Fibroblast growth factor signalling: from development to cancer," Nature Reviews Cancer, vol. 10, pp. 116-129, 2010
Непатентный литературный источник 5: Wells et al, "Targeting the RET Pathway in Thyroid Cancer," Clinical Cancer Research, vol. 15, pp. 7119-7123, 2009
Непатентный литературный источник 6: The ESMO/European Sarcoma Network Working Group, "Bone sarcomas: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up," Annals of Oncology, vol. 23, supplement 7, vii100-vii109, 2012
Непатентный литературный источник 7: Gentet et al., "Ifosfamide and etoposide in childhood osteosarcoma. A phase II study of the French Society of Paediatric Oncology," European Journal of Cancer, vol. 33, pp. 232-237, 1997
Непатентный литературный источник 8: Grier et al., "Addition of Ifosfamide and Etoposide to Standard Chemotherapy for Ewing's Sarcoma and Primitive Neuroectodermal Tumor of Bone," The New England Journal of Medicine, vol. 348, pp. 694-701, 2003
Сущность изобретения
Техническая задача
[12] Однако терапевтические эффекты комбинированного применения противоопухолевых терапевтических средств, о которых когда-либо сообщалось, недостаточны, и ожидается развитие комбинированной терапии с применением дополнительных противоопухолевых терапевтических средств.
Решение задачи
[13] В свете вышеуказанных обстоятельств, авторы настоящего изобретения провели обширное исследование и в результате обнаружили, что комбинированное введение ленватиниба, ифосфамида и этопозида неожиданно продемонстрировало противоопухолевый эффект больше, чем ожидалось; таким образом было совершено настоящее изобретение.
[14] Таким образом, настоящее изобретение предусматривает следующее:
[1] Терапевтическое средство для лечения опухоли, содержащее ленватиниб или его фармакологически приемлемую соль, где ленватиниб или его фармакологически приемлемую соль вводят в комбинации с ифосфамидом и этопозидом или его фармакологически приемлемой солью.
[2] Фармацевтическую композицию, содержащую ленватиниб или его фармакологически приемлемую соль, где ленватиниб или его фармакологически приемлемую соль вводят в комбинации с ифосфамидом и этопозидом или его фармакологически приемлемой солью.
[3] Фармацевтическую композицию для лечения опухоли, содержащую ленватиниб или его фармакологически приемлемую соль, где ленватиниб или его фармакологически приемлемую соль вводят в комбинации с ифосфамидом и этопозидом или его фармакологически приемлемой солью.
[4] Способ лечения опухоли, включающий введение ленватиниба или его фармакологически приемлемой соли, ифосфамида и этопозида или его фармакологически приемлемой соли пациенту, нуждающемуся в этом.
[5] Ленватиниб или его фармакологически приемлемую соль, где ленватиниб или его фармакологически приемлемую соль вводят в комбинации с ифосфамидом и этопозидом или его фармакологически приемлемой солью.
[6] Ленватиниб или его фармакологически приемлемую соль для лечения опухоли, где ленватиниб или его фармакологически приемлемую соль вводят в комбинации с ифосфамидом и этопозидом или его фармакологически приемлемой солью.
[7] Фармацевтическую композицию, содержащую ленватиниб или его фармакологически приемлемую соль для лечения опухоли, где ленватиниб или его фармакологически приемлемую соль вводят в комбинации с ифосфамидом и этопозидом или его фармакологически приемлемой солью.
[8] Применение ленватиниба или его фармакологически приемлемой соли для получения фармацевтической композиции для лечения опухоли, где ленватиниб или его фармакологически приемлемую соль вводят в комбинации с ифосфамидом и этопозидом или его фармакологически приемлемой солью.
[9] Применение ленватиниба или его фармакологически приемлемой соли для лечения опухоли, где ленватиниб или его фармакологически приемлемую соль вводят в комбинации с ифосфамидом и этопозидом или его фармакологически приемлемой солью.
[10] Набор, содержащий состав, содержащий ленватиниб или его фармакологически приемлемую соль, состав, содержащий ифосфамид, и состав, содержащий этопозид или его фармакологически приемлемую соль.
[11] Набор в соответствии с [10], где набор представляет собой набор для лечения опухоли.
[12] Терапевтическое средство для лечения опухоли, содержащее ленватиниб или его фармакологически приемлемую соль, ифосфамид и этопозид или его фармакологически приемлемую соль.
[13] Фармацевтическую композицию, содержащую ленватиниб или его фармакологически приемлемую соль, ифосфамид и этопозид или его фармакологически приемлемую соль.
[14] Фармацевтическую композицию для лечения опухоли, фармацевтическую композицию, содержащую ленватиниб или его фармакологически приемлемую соль, ифосфамид и этопозид или его фармакологически приемлемую соль.
[15] Ленватиниб или его фармакологически приемлемую соль, ифосфамид и этопозид или его фармакологически приемлемую соль для лечения опухоли.
[16] Применение ленватиниба или его фармакологически приемлемой соли, ифосфамида и этопозида для получения терапевтического средства для лечения опухоли.
[17] Вышеуказанное терапевтическое средство для лечения опухоли или фармацевтическую композицию, дополнительно содержащую вспомогательное вещество.
[18] Вышеуказанное терапевтическое средство для лечения опухоли, фармацевтическую композицию, способ лечения, применение, соединение или набор, где ленватиниб или его фармакологически приемлемая соль представляет собой ленватиниба мезилат.
[19] Вышеуказанное терапевтическое средство для лечения опухоли, фармацевтическую композицию, способ лечения, применение, соединение или набор, где этопозид или его фармакологически приемлемая соль представляет собой этопозида фосфат.
[20] Вышеуказанное терапевтическое средство для лечения опухоли, фармацевтическую композицию, способ лечения, применение, соединение или набор, где ленватиниб или его фармакологически приемлемую соль, ифосфамид и этопозид или его фармакологически приемлемую соль вводят одновременно, по отдельности, непрерывно или через временные интервалы.
[21] Вышеуказанное терапевтическое средство для лечения опухоли, фармацевтическую композицию, способ лечения, применение, соединение или набор, где опухоль представляет собой остеосаркому, саркому Юинга, рабдомиосаркому, нейробластому, ретинобластому, гепатобластому или нефробластому.
[22] Терапевтическое средство для лечения опухоли, фармацевтическую композицию, способ лечения, применение, соединение или набор в соответствии с [21], где опухоль представляет собой остеосаркому.
[23] Терапевтическое средство для лечения опухоли, фармацевтическую композицию, способ лечения, применение, соединение или набор в соответствии с [22], где остеосаркома рецидивная или рефрактерная.
Полезные результаты изобретения
[15] Настоящее изобретение предусматривает терапевтическое средство для лечения опухоли, применяемое для комбинированной терапии на основе ленватиниба, ифосфамида и этопозида. Данное терапевтическое средство для лечения опухоли демонстрирует неожиданные противоопухолевые эффекты для пациентов, нуждающихся в этом.
Описание вариантов осуществления
[16] Варианты осуществления настоящего изобретения описаны ниже. Следующие варианты осуществления являются только примерами для описания настоящего изобретения и не предполагается ограничение настоящего изобретения только данными вариантами осуществления. Настоящее изобретение можно осуществить в различных видах, без отступления от сущности настоящего изобретения.
Необходимо отметить, что документы, публикации, патентные публикации и другие патентные литературные источники, процитированные в настоящем описании, включены в настоящий документ посредством ссылок. Настоящее описание включает содержание предварительной заявки на патент США № 62/207546 (поданной 20 августа 2015 г.), которая является основанием для испрашивания приоритета настоящей заявки.
[17] Ленватиниб относится к 4-(3-хлор-4-(циклопропиламинокарбонил)аминофенокси)-7-метокси-6-хинолинкарбоксамиду, и его структурная формула показана в следлующей формуле:
 .
.
Ленватиниб или его фармакологически приемлемую соль можно получить способом, описанным в патентном литературном источнике 1. Примером фармакологически приемлемых солей ленватиниба является ленватиниба мезилат. Ленватиниба мезилат также упоминается как E7080.
[18] Ленватиниб относится к 3-(2-хлорэтил)-2-[(2-хлорэтил)амино]тетрагидро-2Н-1,3,2-оксазафосфорин-2-оксиду, и его структурная формула показана в следующей формуле:
 .
.
Ифосфамид можно получить известным способом и можно получить, например, способом, описанным в патенте США № 3732340. Кроме того, ифосфамид можно получить путем покупки препарата Ifex (зарегистрированный товарный знак) у компании Bristol-Myers Squibb, или путем покупки препарата Ifomide (зарегистрированный товарный знак) у компании Shionogi & Co., Ltd.
[19] Этопозид относится к (5R,5aR,8aR,9S)-9-{[4,6-O-(1R)-этилиден-β-D-глюкопираносил]окси}-5-(4-гидрокси-3,5-диметоксифенил)-5,8,8a,9-тетрагидрофуро[3',4':6,7]нафто[2,3-d][1,3]диоксол-6(5aH)-ону, и его структурная формула показана в следующей формуле:
 .
.
Этопозид можно получить известным способом и можно получить, например, способом, описанным в патенте США № 3524844. Кроме того, этопозид можно получить путем покупки препарата VePesid (зарегистрированный товарный знак) у компании Bristol-Myers Squibb. Примером фармакологически приемлемых солей этопозида является этопозида фосфат.
[20] Хотя термин "фармакологически приемлемая соль" не ограничивается каким-либо конкретным типом солей, их примеры включают соли неорганических кислот, соли органических кислот, соли неорганических оснований, соли органических оснований и соли кислых или основных аминокислот.
[21] Примеры солей неорганических кислот включают соли хлористоводородной кислоты, бромистоводородной кислоты, серной кислоты, азотной кислоты и фосфорной кислоты. Примеры солей органических кислот включают соли уксусной кислоты, янтарной кислоты, фумаровой кислоты, малеиновой кислоты, винной кислоты, лимонной кислоты, молочной кислоты, стеариновой кислоты, бензойной кислоты, метансульфоновой кислоты (мезиловой кислоты), этансульфоновой кислоты и п-толуолсульфоновой кислоты.
[22] Примеры солей неорганических оснований включают соли щелочных металлов, такие как соль натрия и соль калия; соли щелочноземельных металлов, такие как соль кальция и соль магния; соль алюминия; и соль аммония. Примеры солей органических оснований, включают соли диэтиламина, диэтаноламина, меглюмина и N,N-дибензилэтилендиамина.
[23] Примеры солей кислых аминокислот включают соли аспарагиновой кислоты и глутаминовой кислоты. Примеры солей основных аминокислот включают соли аргинина, лизина и орнитина.
[24] Примеры фармакологически приемлемых солей ленватиниба включают соли органических кислот и одним из вариантов их осуществления является метансульфонат (мезилат).
[25] Примеры фармакологически приемлемых солей этопозида включают соли неорганических кислот и одним из вариантов их осуществления является фосфат.
[26] Когда присутствуют сольваты и оптические изомеры ленватиниба, ифосфамида или этопозида согласно настоящему изобретению, данные сольваты и оптические изомеры включены. Примеры сольватов включают гидрат и ангидрат. Примеры растворителей включают воду, спирты (например метанол, этанол и н-пропанол) и диметилформамид.
[27] Кроме того, ленватиниб, ифосфамид или этопозид согласно настоящему изобретению могут быть кристаллическими или аморфными. Когда присутствуют полиморфные модификации кристаллов, может применяться единственная кристаллическая форма или смесь любых из этих кристаллических форм.
[28] Дозу ленватиниба или его фармакологически приемлемой соли можно надлежащим образом подобрать в зависимости от интенсивности симптомов, развития нежелательных эффектов, возраста, пола, веса тела и различий в чувствительности пациента, пути введения, продолжительности введения, интервала между введениями, типа фармацевтического состава, и т. п.
[29] Доза ленватиниба или его фармакологически приемлемой соли не имеет конкретных ограничений, но обычно составляет при пероральном введении взрослому человеку (вес тела: 60 кг) или ребенку 0,1-500 мг, 0,5-300 мг или 1-100 мг в день, или составляет 0,1-500 мг/м2 (площадь поверхности тела, здесь и далее то же самое), 0,5-300 мг/м2 или 1,0-100 мг/м2 в день. Эту дозу обычно можно вводить один раз в день или два - три раза в день. Если пациент подвергся избыточному токсическому воздействию, то необходимо снизить дозу. Дозу и схему применения можно изменять в случае применения одного или нескольких дополнительных химиотерапевтических средств в дополнение к комбинированной терапии согласно настоящему изобретению. Схема применения может определяться врачом, который проводит лечение конкретного пациента.
[30] Ифосфамид можно вводить в соответствии с известной клинической практикой. Дозу и схему применения можно изменять в соответствии с конкретными симптомами заболевания и совокупностью всех симптомов пациента. Дозу можно надлежащим образом снизить в зависимости от возраста, пола, симптомов, развития нежелательных эффектов и т. п.
[31] Доза ифосфамида не имеет конкретных ограничений, но обычно составляет при введении взрослому человеку (вес тела: 60 кг) или ребенку перорально, внутривенно или путем внутривенной капельной инфузии 0,01-100 г/м2, 0,05-30 г/м2 или 0,1-10 г/м2 в день, или 0,01-100 г, 0,05-30 г или 0,1-10 г в день. Одним вариантом осуществления дозы ифосфамида является приблизительно 1,5-3 г/м2 в день. Данную дозу обычно можно вводить в течение первых 3-5 дней одного цикла, состоящего из 3-4 недель. Ифосфамид можно повторно вводить пациенту путем повторения данного цикла. В одном варианте осуществления, приблизительно 3 г/м2 в день ифосфамида вводят от дня 1 до дня 3 одного цикла, состоящего из 21 дня, и этот цикл надлежащим образом повторяют. Если пациент подвергся избыточному токсическому воздействию, то необходимо снизить дозу. Дозу и схему применения можно изменять в случае применения одного или нескольких дополнительных химиотерапевтических средств Схема применения может определяться врачом, который проводит лечение конкретного пациента.
[32] Этопозид или его фармакологически приемлемую соль можно вводить в соответствии с известной клинической практикой. Дозу и схему применения можно изменять в соответствии с конкретными симптомами заболевания и совокупностью всех симптомов пациента. Дозу можно надлежащим образом снизить в зависимости от возраста, пола, симптомов, развития нежелательных эффектов и т. п.
[33] Доза этопозида или его фармакологически приемлемой соли не имеет конкретных ограничений, но обычно составляет при введении взрослому человеку (вес тела: 60 кг) или ребенку перорально, внутривенно или путем внутривенной капельной инфузии 1,0-5000 мг/м2, 5,0-3000 мг/м2 или 10-1000 мг/м2 в день. Одним вариантом осуществления дозы этопозида или его фармакологически приемлемой соли является приблизительно 60-120 мг/м2 в день в пересчете на этопозид. Данную дозу обычно можно вводить в течение первых 3-5 дней одного цикла, состоящего из 3-4 недель. Этопозид или его фармакологически приемлемую соль можно повторно вводить пациенту путем повторения данного цикла. Если пациент подвергся избыточному токсическому воздействию, то необходимо снизить дозу. В одном варианте осуществления приблизительно 100 мг/м2, в пересчете на этопозид, этопозида или его фармакологически приемлемой соли вводят со дня 1 до дня 3 одного цикла, состоящего из 21 дня, и этот цикл надлежащим образом повторяют. Дозу и схему применения можно изменять в случае применения одного или нескольких дополнительных химиотерапевтических средств Схема применения может определяться врачом, который проводит лечение конкретного пациента.
[34] Дозу ленватиниба, ифосфамида или этопозида при комбинированном введении согласно настоящему изобретению обычно можно задать равной или ниже дозы в случае их введения по отдельности. Конкретную дозу, путь введения, частоту введения, цикл введения и т. п. можно надлежащим образом определить с учетом возраста, пола и симптомов пациента, развития нежелательных эффектов и т. п.
[35] Лекарственная форма ленватиниба, ифосфамида и этопозида в настоящем изобретении не имеет конкретных ограничений и необходимо только вводить ленватиниб, ифосфамид и этопозид в комбинации при введении. Например, ленватиниб, ифосфамид, этопозид вводят пациенту одновременно, по отдельности, непрерывно или через временные интервалы. Здесь термин "одновременно" означает, что все ингредиенты вводят в один и тот же период или точно в одно и то же время, или вводят одним и тем же путем. Термин "по отдельности" означает, что все ингредиенты вводят в различных интервалах или с различной частотой, или вводят различными путями. Термин "непрерывно" означает, что все ингредиенты вводят одним и тем же или различными путями в произвольном порядке в течение заданного периода. Термин "через временные интервалы" означает, что все ингредиенты вводят одним и тем же или различными путями с интервалами для соответствующих ингредиентов. При комбинированном введении ленватиниба и ифосфамида, когда ленватиниб вводят в течение одного цикла введения ифосфамида, описанного выше, или в течение периода, в котором этот цикл повторяют, считается, что ленватиниб и ифосфамид вводят в комбинации. При комбинированном введении ленватиниба и этопозида или его фармакологически приемлемой соли, когда ленватиниб вводят в течение одного цикла введения этопозида или его фармакологически приемлемой соли, описанного выше, или в течение периода, в котором этот цикл повторяют, считается, что ленватиниб и этопозид или его фармакологически приемлемую соль вводят в комбинации. В одной лекарственной форме при комбинированном введении согласно настоящему изобретению, ленватиниб вводят перорально, а ифосфамид и этопозид вводят внутривенно или путем внутривенной инфузии. Кроме того, комбинированное введение согласно настоящему изобретению можно осуществлять одновременно, по отдельности, непрерывно или через временные интервалы, вместе с введением терапевтического средства для лечения опухоли, отличного от ленватиниба, ифосфамида и этопозида.
[36] Терапевтическое средство для лечения опухоли согласно настоящему изобретению можно составить, например, способом, описанным в 16 пересмотренном издании Японской Фармакопеи (JP), фармакопее США (USP) или Европейской Фармакопее (EP).
[37] Противоопухолевое терапевтическое средство согласно настоящему изобретению можно вводить перорально в виде твердого состава, такого как таблетка, гранула, мелкая гранула, порошок или капсула, или в виде жидкого состава, геля или сиропа и т. п.
[38] Кроме того, противоопухолевое средство согласно настоящему изобретению можно вводить парентерально в виде инъекции, суппозитория, мази, компресса или т. п.
[39] При получении твердого состава для перорального применения вспомогательное вещество и дополнительно связывающее вещество, разрыхлитель, смазывающее вещество, краситель, ароматизатор, поверхностно-активное вещество и т. п. можно добавлять, при необходимости, в качестве добавок к ленватинибу или его фармакологически приемлемой соли, ифосфамиду или этопозиду или его фармакологически приемлемой соли, образуя таким образом таблетку, гранулу, мелкую гранулу, порошок, капсулу и т. п. общепринятым способом. Вышеуказанные добавки можно надлежащим образом комбинировать для составления. Кроме того, на данные таблетки, гранулы и т. п. может быть нанесено покрытие, при необходимости.
[40] При получении инъекционного раствора регулятор рН, буферный раствор, суспендирующее средство, солюбилизирующее средство, стабилизатор, изотонизирующее средство, консервант и т. п. можно добавлять при необходимости к ленватинибу или его фармакологически приемлемой соли, ифосфамиду или этопозиду или его фармакологически приемлемой соли, образуя таким образом инъекционный раствор для внутривенного, подкожного или внутримышечного введения, или раствор для внутривенной инфузии общепринятым способом. В данном случае инъекционные растворы можно получить, при необходимости, как лиофилизированные продукты общепринятым способом.
[41] Опухоли, охваченные настоящим изобретением, не имеют конкретных ограничений и примеры опухолей включают опухоли головного мозга (включая гипофизарную аденому и глиому), рак головы и шеи, рак шейки матки, рак челюсти, рак верхней челюсти, рак подчелюстной слюнной железы, рак ротовой полости (включая рак языка, рак дна ротовой полости, рак десен, рак слизистой оболочки щеки и рак твердого неба), рак слюнных желез, рак подъязычной железы, рак околоушной слюнной железы, рак носовой полости, рак околоносовых пазух (включая рак верхнечелюстных пазух, рак лобных пазух, рак решетчатого лабиринта, рак клиновидной пазухи), рак гортани (включая рак преддверия гортани, рак голосовой щели и рак подсвязочного отдела гортани), рак пищевода, рак легких (включая бронхогенный рак, немелкоклеточный рак легких, (включая аденокарциному легких, плоскоклеточную карциному и крупноклеточную карциному легких), мелкоклеточный рак легких (включая овсяноклеточный (лимфоидный) и промежуточноклеточный типы) и смешанный мелкоклеточный/немелкоклеточный рак легких), рак молочной железы, рак поджелудочной железы (включая рак главного протока поджелудочной железы), рак желудка (включая фиброзный рак желудка и недифференцированный рак желудка (включая недифференцированную аденокарциному, рак перстневидных клеток и слизеобразующую карциному)), рак желчных протоков (включая рак желчных путей и рак желчного пузыря), рак тонкой кишки или рак двенадцатиперстной кишки, колоректальный рак (включая рак толстой кишки, рак прямой кишки, рак слепой кишки, рак сигмовидной кишки, рак восходящей ободочной кишки, рак поперечной ободочной кишки и рак нисходящей ободочной кишки), рак мочевого пузыря, рак почки (включая почечно-клеточный рак), рак печени (включая печеночно-клеточный рак и рак внутрипеченочных желчных протоков), рак предстательной железы, рак матки (включая рак шейки матки и рак эндометрия), рак яичников, рак щитовидной железы, фарингеальный рак (включая рак носоглотки, рак ротоглотки и гипофарингиальный рак), виды саркомы (например остеосаркому, саркому Юинга, радомиосаркому, хондросаркому, саркому Капоши, ангиосаркому, фибросаркому и т. п.), нейробластому, ретинобластому, гепатобластому, нефробластому. злокачественные лимфомы (включая лимфому Ходжкина и неходжкинскую лимфому), лейкоз (включая, например, хронический миелоцитарный лейкоз (CML), острый миелоцитарный лейкоз (AML), хронический лимфоцитарный лейкоз (CLL) и острый лимфоцитарный лейкоз (ALL); лимфому, множественную миелому (MM), миелодиспластический синдром и т. п.), рак кожи (включая базальноклеточный рак, плоскоклеточный рак, злокачественную меланому, фунгоидный микоз, синдром Сезари, солнечный кератоз, болезнь Боуэна и болезнь Педжета) и меланому и их смешанные опухоли. В одном варианте осуществления настоящего изобретения целевой опухолью является остеосаркома, саркома Юинга, рабдомиосаркома, нейробластома, ретинобластома, гепатобластома или нефробластома. В другом варианте осуществления настоящего изобретения целевой опухолью является остеосаркома. Кроме того, опухоли, охватываемые настоящим изобретением, включают рецидивные или рефрактерные опухоли.
Примеры
[42] Конкретные примеры настоящего изобретения предусмотрены ниже, однако настоящее изобретение не ограничено данными примерами.
[43] [Пример 1] Ингибирующая активность роста опухоли при комбинированном применении ленватиниба, ифосфамида и этопозида в отношении моделей подкожной трансплантации клеточной линии (143B) остеосаркомы человека.
С применением мышей 6 NOD SCID (NOD.CB17-Prkdcscid/J, самки мышей, производства компании Charles River Laboratories Japan, Inc.) в каждой группе противоопухолевые эффекты оценивались при введении отдельно ленватиниба; комбинации двух средств, а именно ифосфамида и этопозида, или комбинации трех средств, а именно ленватиниба, ифосфамида и этопозида. Клетки клеточной линии 143B (ATCC CRL-8303) остеосаркомы, полученные из клеточного материала человека, суспендировали при концентрации 1×107 клеток/мл и 0,1 мл данной суспензии пересаживали в правый бок каждой мыши.
Максимальный диаметр и малую ось опухоли измеряли электронным цифровым штангенциркулем (штангенциркуль Digimatic (товарный знак) производства компании Mitutoyo Corporation) через 9 дней после пересадки. Мышей разделяли на группы таким образом, что среднее значение объема опухоли в каждой группе было практически равным (день 1). Объем опухоли рассчитывали в соответствии со следующим уравнением:
Объем опухоли=максимальный диаметр (мм) х малая ось (мм) малая ось (мм)/2
[44] Ленватиниба мезилат растворяли в очищенной воде до концентрации 0,3 мг/мл. Ифосфамид (производства компании Sigma Aldrich) растворяли в физиологическом растворе до концентрации 25 мг/мл. Кроме того, инъекционный раствор этопозида (раствор с концентрацией 20 мг/мл, производства компании Bristol-Myers Squibb) разбавляли физиологическим раствором до концентрации 0,8 мг/мл.
Очищенную воду и физиологический раствор вводили контрольной группе. Раствор ленватиниба и физиологический раствор вводили группе ленватиниба. Раствор ифосфамида, раствор этопозида и очищенную воду вводили группе комбинации ифосфамид+этопозид. Раствор ленватиниба, раствор ифосфамида и раствор этопозида вводили группе комбинации 3-х средств.
Дозу введения ленватиниба мезилата, которая составляла 3 мг/кг и 10 мл/кг, вводили перорально один раз в день в течение 7 дней (день 1 - день 7). Дозу введения ифосфамида, которая составляла 250 мг/кг и 10 мл/кг, вводили интраперитонально один раз (день 1). Дозу введения этопозида, которая составляла 8 мг/кг и 10 мл/кг, вводили интраперитонально один раз в день в течение 3 дней (день 2 - день 4). Очищенную воду вводили перорально в количестве 10 мл/кг один раз в день в течение 7 дней (день 1 - день 7). Физиологический раствор вводили интраперитонально в количестве 10 мл/кг один раз в день в течение 4 дней (день 1 - день 4).
[45] Объем опухоли каждой мыши измеряли через 8 дней (день 8) после начала введения. Результаты приведены в таблице 1. Выяснено, что комбинированное применение трех средств, а именно ленватиниба, ифосфамида и этопозида оказывало превосходные противоопухолевые эффекты в отношении моделей подкожной трансплантации клеточной линии (143B) остеосаркомы человека.
[46] [Таблица 1]
|
[47] [Пример 2] Ингибирующая активность роста опухоли при комбинированном применении ленватиниба, ифосфамида и этопозида в отношении моделей подкожной трансплантации клеточной линии (G-292 клон A141B1) остеосаркомы человека.
С применением мышей 6 NOD SCID (NOD.CB17-Prkdcscid/J, самки мышей, производства компании Charles River Laboratories Japan, Inc.) в каждой группе противоопухолевые эффекты оценивались при введении отдельно ленватиниба; комбинации двух средств, а именно ифосфамида и этопозида, или комбинации трех средств, а именно ленватиниба, ифосфамида и этопозида. Клетки клеточной линии G-292 клон A141B1 (JCRB Cell Bank, IFO50107) остеосаркомы, полученные из клеточного материала человека, суспендировали при концентрации 1×108 клеток/мл и 0,1 мл данной суспензии пересаживали в правый бок каждой мыши.
Максимальный диаметр и малую ось опухоли измеряли электронным цифровым штангенциркулем (штангенциркуль Digimatic (товарный знак) производства компании Mitutoyo Corporation) через 29 дней после пересадки. Мышей разделяли на группы таким образом, что среднее значение объема опухоли в каждой группе было практически равным (день 1). Объем опухоли рассчитывали в соответствии со следующим уравнением:
Объем опухоли=максимальный диаметр (мм) х малая ось (мм) малая ось (мм)/2
[48] Ленватиниба мезилат растворяли в очищенной воде до концентрации 0,3 мг/мл. Ифосфамид (производства компании Sigma Aldrich) растворяли в физиологическом растворе до концентрации 25 мг/мл. Кроме того, инъекционный раствор этопозида (раствор с концентрацией 20 мг/мл, производства компании Bristol-Myers Squibb) разбавляли физиологическим раствором до концентрации 0,8 мг/мл.
Очищенную воду и физиологический раствор вводили контрольной группе. Раствор ленватиниба и физиологический раствор вводили группе ленватиниба. Раствор ифосфамида, раствор этопозида и очищенную воду вводили группе комбинации ифосфамид+этопозид. Раствор ленватиниба, раствор ифосфамида и раствор этопозида вводили группе комбинации 3-х средств.
Дозу введения ленватиниба мезилата, которая составляла 3 мг/кг и 10 мл/кг, вводили перорально один раз в день в течение 7 дней (день 1 - день 7). Дозу введения ифосфамида, которая составляла 250 мг/кг и 10 мл/кг, вводили интраперитонально один раз (день 1). Дозу введения этопозида, которая составляла 8 мг/кг и 10 мл/кг, вводили интраперитонально один раз в день в течение 3 дней (день 2 - день 4). Очищенную воду вводили перорально в количестве 10 мл/кг один раз в день в течение 7 дней (день 1 - день 7). Физиологический раствор вводили интраперитонально в количестве 10 мл/кг один раз в день в течение 4 дней (день 1 - день 4).
[49] Объем опухоли каждой мыши измеряли через 8 дней (день 8) после начала введения. Результаты приведены в таблице 2. Выяснено, что комбинированное применение трех средств, а именно ленватиниба, ифосфамида и этопозида, оказывало превосходные противоопухолевые эффекты в отношении моделей подкожной трансплантации клеточной линии (G-292 клон A141B1) остеосаркомы человека.
[50] [Таблица 2]
|
[51] [Пример 3] Ингибирующая активность роста опухоли при комбинированном применении ленватиниба, ифосфамида и этопозида в отношении моделей подкожной трансплантации клеточной линии (HOS) остеосаркомы человека.
С применением мышей 6 NOD SCID (NOD.CB17-Prkdcscid/J, самки мышей, производства компании Charles River Laboratories Japan, Inc.) в каждой группе противоопухолевые эффекты оценивались при введении отдельно ленватиниба; комбинации двух средств, а именно ифосфамида и этопозида, или комбинации трех средств, а именно ленватиниба, ифосфамида и этопозида. Клетки клеточной линии HOS (Human Science Research Resources Bank, IFO50106) остеосаркомы, полученные из клеточного материала человека, суспендировали при концентрации 1×108 клеток/мл и 0,1 мл данной суспензии пересаживали в правый каждой мыши.
Максимальный диаметр и малую ось опухоли измеряли электронным цифровым штангенциркулем (штангенциркуль Digimatic (товарный знак) производства компании Mitutoyo Corporation) через 18 дней после пересадки. Мышей разделяли на группы таким образом, что среднее значение объема опухоли в каждой группе было практически равным (день 1). Объем опухоли рассчитывали в соответствии со следующим уравнением:
Объем опухоли=максимальный диаметр (мм) х малая ось (мм) малая ось (мм)/2
[52] Ленватиниба мезилат растворяли в очищенной воде до концентрации 0,3 мг/мл. Ифосфамид (производства компании Sigma Aldrich) растворяли в физиологическом растворе до концентрации 25 мг/мл. Кроме того, инъекционный раствор этопозида (раствор с концентрацией 20 мг/мл, производства компании Bristol-Myers Squibb) разбавляли физиологическим раствором до концентрации 0,8 мг/мл.
Очищенную воду и физиологический раствор вводили контрольной группе. Раствор ленватиниба и физиологический раствор вводили группе ленватиниба. Раствор ифосфамида, раствор этопозида и очищенную воду вводили группе комбинации ифосфамид+этопозид. Раствор ленватиниба, раствор ифосфамида и раствор этопозида вводили группе комбинации 3-х средств.
Дозу введения ленватиниба мезилата, которая составляла 3 мг/кг и 10 мл/кг, вводили перорально один раз в день в течение 7 дней (день 1 - день 7). Дозу введения ифосфамида, которая составляла 250 мг/кг и 10 мл/кг, вводили интраперитонально один раз (день 1). Дозу введения этопозида, которая составляла 8 мг/кг и 10 мл/кг, вводили интраперитонально один раз в день в течение 3 дней (день 2 - день 4). Очищенную воду вводили перорально в количестве 10 мл/кг один раз в день в течение 7 дней (день 1 - день 7). Физиологический раствор вводили интраперитонально в количестве 10 мл/кг один раз в день в течение 4 дней (день 1 - день 4).
[53] Объем опухоли каждой мыши измеряли через 8 дней (день 8) после начала введения. Результаты приведены в таблице 3. Выяснено, что комбинированное применение трех средств, а именно ленватиниба, ифосфамида и этопозида, оказывало превосходные противоопухолевые эффекты в отношении моделей подкожной трансплантации клеточной линии (HOS) остеосаркомы человека.
[54] [Таблица 3]
|
[55] [Пример 4] Фаза 1/2 клинического исследования ленватиниба для детей и взрослых с рецидивными или рефрактерными солидными злокачественными опухолями.
Настоящее клиническое исследование представляет собой фазу 1/2 клинического исследования для оценки безопасности, переносимости и эффективности ленватиниба у детей и взрослых, которые имеют рецидивные или рефрактерные солидные злокачественные опухоли.
[56] Настоящее клиническое исследование включает 5 когорт (когорты 1, 2А, 2В, 3А и 3В) и первичной целью каждой когорты является следующее:
Определить рекомендуемую дозу (RD) ленватиниба у детей и взрослых, которые имеют рецидивные или рефрактерные солидные злокачественные опухоли, с применением непрерывного метода перерасчета время/событие (TiTE-CRM) [когорта 1]. В настоящем клиническом исследовании RD определяют как дозу, при которой доля дозолимитирующей токсичности (DLT) максимально близка к целевому уровню, а именно 20%.
Оценить частоту объективного ответа (ORR) ленватиниба у детей и взрослых, которые имеют йод-131 рефрактерный дифференцированный рак щитовидной железы (DTC) [когорта 2А]. Частоту объективного ответа определяют как полный ответ (CR)+частичный ответ (PR) на основании критерия оценки ответа в солидных опухолях (RECIST 1.1).
Оценить выживаемость без прогрессирования (PFS) через 4 месяца после введения отдельно ленватиниба у детей и взрослых, которые имеют рецидивную или рефрактерную остеосаркому [когорта 2В]. Выживаемость без прогрессирования (PFS) через 4 месяца представляет собой долю пациентов, которые выжили в течение 4 месяцев после начала введения отдельно ленватиниба и у которых заболевание не прогрессирует (на основании RECIST 1.1).
Задать RD ленватиниба в случае применения в комбинации с ифосфамидом и этопозидом у детей и взрослых, которые имеют рецидивные или рефрактерные солидные злокачественные опухоли [когорта 3А]. Доза комбинации ленватиниба, ифосфамида и этопозида, при которой DLT происходит в одном или менее из 6 случаев принимается к сведению как RD комбинированной терапии.
Оценить выживаемость без прогрессирования (PFS) через 4 месяца после введения ленватиниба, ифосфамида и этопозида у детей и взрослых, которые имеют рецидивную или рефрактерную остеосаркому [когорта 3В]. Выживаемость без прогрессирования (PFS) через 4 месяца представляет собой долю пациентов, которые выжили в течение 4 месяцев после начала комбинированного введения ленватиниба, ифосфамида и этопозида и у которых заболевание не прогрессирует (на основании RECIST 1.1).
[57] Вторичные цели настоящего клинического исследования следующие:
Наилучший общий ответ (BOR) [все когорты]
Частота объективного ответа (ORR) [когорты 1, 2B, 3A и 3B]
Продолжительность ответа (DOR) [все когорты]
Частота контроля заболевания (DCR) [все когорты]
Частота клинической эффективности (CBR) [все когорты]
Время до прогрессирования заболевания (TTP) [все когорты]
Общая выживаемость (OS) [все когорты]
Количество участников, которые перенесли нежелательные явления (AEs)/серьезные нежелательные явления (SAEs), как оценка безопасности и переносимости.
Концентрация ленватиниба в плазме крови: площадь под кривой зависимости концентрации от времени (AUC) [все когорты]
Фармакодинамические (PD) биомаркеры: VEGFR и FGFR [все когорты]
[58] Настоящее клиническое исследование включает 5 когорт.
В когорте 1 (задание дозы отдельного средства), чтобы задать рекомендуемую дозу (RD) ленватиниба у детей и взрослых, которые имеют рецидивные или рефрактерные солидные злокачественные опухоли, дозу постепенно повышают с применением непрерывного метода перерасчета время/событие (TiTE-CRM). Как только RD задана, начинают параллельное исследование когорт 2A, 2B и 3A.
В когорте 2 (расширенная когорта отдельного средства) оценивают эффективность ленватиниба при RD у детей и взрослых, которые имеют йод-131 рефрактерный дифференцированный рак щитовидной железы [когорта 2А] или рецидивную или рефрактерную остеосаркому [когорта 2В].
В когорте 3А (задание дозы при комбинированном применении) определяют RD ленватиниба в случае применения в комбинации с ифосфамидом и этопозидом у участников, которые имеют рецидивную или рефрактерную остеосаркому.
В когорте 3В (расширенная когорта комбинированного применения) оценивается эффективность комбинированного применения ленватиниба, ифосфамида и этопозида при RD, полученной в когорте 3A у участников, которые имеют рецидивную или рефрактерную остеосаркому. Участники с остеосаркомой, которые зарегистрированы в когортах 1 или 2В и у которых заболевание прогрессировало после введения ленватиниба, становятся кандидатами в когорту 3В, как и участники с рецидивной или рефрактерной остеосаркомой, ккоторым не вводили ленватиниб.
[59] В настоящем клиническом исследовании ленватиниб представлен как твердая капсула, содержащая 1,225 мг, 4,9 мг или 12,25 мг ленватиниба мезилата (1 мг, 4 мг или 10 мг в пересчете на ленватиниб). Для детей, которые не могут проглатывать капсулы, капсулу ленватиниба растворяют в воде.
[60] В когорте 1 ленватиниб вводят перорально один раз в день при начальной дозе 11 мг/м2 со дня 1 до дня 28 28-дневного цикла. Дозу можно снизить до 9 мг/м2 или повысить до 14 и 17 мг/м2.
В когорте 2А ленватиниб вводят перорально один раз в день при RD, определенной в когорте 1, со дня 1 до дня 28 28-дневного цикла.
В когорте 2В ленватиниб вводят перорально один раз в день при RD, определенной в когорте 1, со дня 1 до дня 28 28-дневного цикла.
В когорте 3А ленватиниб вводят перорально один раз в день при дозе (начальной дозе) на 20% ниже, чем RD, определенная в когорте 1, со дня 1 до дня 21 21-дневного цикла. Ифосфамид вводят при дозе 3000 мг/м2/день (начальная доза) со дня 1 до дня 3 21-дневного цикла в течение 5 циклов в совокупности. Этопозид вводят при дозе 100 мг/м2/день (начальная доза) со дня 1 до дня 3 21-дневного цикла в течение 5 циклов в совокупности.
В когорте 3B ленватиниб вводят перорально один раз в день при RD, определенной в когорте 3A, со дня 1 до дня 21 21-дневного цикла. Ифосфамид вводят при дозе, заданной в когорте 3A, со дня 1 до дня 3 21-дневного цикла в течение 5 циклов в совокупности. Этопозид вводят при дозе, заданной в когорте 3A, со дня 1 до дня 3 21-дневного цикла в течение 5 циклов в совокупности.
[61] Из результатов настоящего клинического исследования можно подтвердить эффективность, безопасность и переносимость отдельно ленватиниба для йод-131 рефрактерного дифференцированного рака щитовидной железы, те же показатели отдельно ленватиниба для рецидивной или рефрактерной остеосаркомы и те же показатели комбинированного применения 3-х средств: ленватиниба, ифосфамида и этопозида для рецидивной или рефрактерной остеосаркомы.

