Результат интеллектуальной деятельности: ЛЕКАРСТВЕННАЯ ФОРМА С УЛУЧШЕННЫМИ ХАРАКТЕРИСТИКАМИ pH-ЗАВИСИМОГО ВЫСВОБОЖДЕНИЯ ПРЕПАРАТА, СОДЕРЖАЩАЯ ЭЗОМЕПРАЗОЛ ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМУЮ СОЛЬ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение касается новой лекарственной формы с улучшенными характеристиками pH-зависимого высвобождения препарата, содержащей эзомепразол или его фармацевтически приемлемую соль, а также способа её получения.
Уровень техники
Эзомепразол [(S)-5-метокси-2-[(4-метокси-3,5-диметилпиридин-2-ил)метилсульфинил]-3H-бензимидазол)] является одним из ингибиторов протонного насоса (PPI) со структурой, представленной формулой 2 в виде (S)-энантиомера, среди двух оптических изомеров омепразола со структурой, представленной формулой 1. Из двух оптических изомеров омепразола (R)-энантиомер быстрее метаболизируется в неактивный метаболит (не обладающий активностью) и имеет большое отличие в скорости метаболизма между ними по сравнению с (S)-энантиомером. Таким образом, (R)-энантиомер проявляет больше побочных эффектов, более слабые эффекты лечения и менее равномерные показатели лечения, чем (S)-энантиомер, тогда как (S)-энантиомер, то есть эзомепразол, имеет преимущество в меньшем воздействии на метаболизм в печени по сравнению с (R)-энантиомером, а также с рацематом омепразола.
Таблица 1. Структуры омепразола и эзомепразола
|
Ингибиторы протонного насоса, к которым принадлежит эзомепразол, обладают свойством ингибирования секреции желудочной кислоты у млекопитающих, включая человека, путем регуляции секреции желудочной кислоты на последней стадии пути секреции кислоты. Таким образом, ингибиторы протонного насоса можно использовать для профилактики и лечения желудочных и рефлюксных заболеваний пищевода типа рефлюкс-эзофагита и заболеваний, связанных с гиперпролиферацией желудка, включая гастрит, дуоденит, язвы желудка, язвы двенадцатиперстной кишки и пептические язвы.
С другой стороны, эзомепразол легко разлагается или трансформируется в кислых условиях. Поэтому пероральные препараты, содержащие эзомепразол, не должны контактировать с кислым желудочным соком и должны доставляться в область желудочно-кишечного тракта, где рН почти нейтрален и может происходить быстрое всасывание. По этой причине активно разрабатывались лекарственные формы с использованием такого способа, как формирование энтеросолюбильных покрытий.
Однако исследования лекарственных форм эзомепразола до настоящего времени были сосредоточены только на разработке энтеросолюбильных покрытий для всасывания в кишечнике при одновременном предотвращении воздействия желудочной кислоты в желудке. Разработка таких форм, которые начинают высвобождаться после заданного времени задержки после перорального введения, продолжают высвобождаться в течение требуемого периода времени и заканчивают высвобождение через определенное время, исходя из исследования характеристик рН-зависимого высвобождения, была недостаточной и неудовлетворительной. В этом контексте существует безотлагательная и все возрастающая потребность в новых формах, содержащих эзомепразол и его фармацевтически приемлемые соли, с такими улучшенными характеристиками рН-зависимого высвобождения.
На этом техническом фоне авторы настоящего изобретения обнаружили, что характеристики рН-зависимого высвобождения эзомепразола или его фармацевтически приемлемой соли можно значительно улучшить, если на ядрах, содержащих эзомепразол или его фармацевтически приемлемую соль, формируется слой эндотелиального покрытия, на котором находится слой контролирующего высвобождение покрытия, содержащий полимер, состоящий из сополимера метакриловой кислоты S и сополимера метакриловой кислоты L, смешанных в определенном соотношении, причем сополимер метакриловой кислоты S и сополимер метакриловой кислоты L, содержащиеся в слое контролирующего высвобождение покрытия, присутствуют в определенном соотношении по отношению к весу таблетки с эндотелиальным покрытием или слоя эндотелиального покрытия, и тем самым совершили настоящее изобретение.
Раскрытие изобретения
Итак, объектом настоящего изобретения является получение новой лекарственной формы с улучшенными характеристиками рН-зависимого высвобождения препарата, содержащего эзомепразол или его фармацевтически приемлемую соль, а также способ её получения.
В соответствии с настоящим изобретением, вышеуказанные и другие цели могут быть достигнуты путем получения лекарственной формы, включающей: (a) ядро, содержащее эзомепразол или его фармацевтически приемлемую соль в качестве активного ингредиента, (b) слой эндотелиального покрытия, сформированный на ядре, и (c) слой контролирующего высвобождение покрытия, сформированный на слое эндотелиального покрытия, причем материал эндотелиального покрытия, содержащийся в слое эндотелиального покрытия, и сополимер метакриловой кислоты S и сополимер метакриловой кислоты L, содержащиеся в качестве материала основы контролирующего высвобождение покрытия в слое контролирующего высвобождение покрытия, присутствуют в определенном соотношении.
Лекарственная форма может быть выбрана из группы, состоящей из гранул, минитаблеток (MUST), таблеток, смеси гранул и минитаблеток и капсул, но настоящее изобретение не ограничивается этим. Гранулы и/или минитаблетки могут быть заключены в капсулы.
В соответствии с другим аспектом настоящего изобретения, предусмотрен способ получения лекарственной формы, содержащей эзомепразол или его фармацевтически приемлемую соль, включающий: (a) смешивание эзомепразола или его фармацевтически приемлемой соли с разбавителем, (b) добавление в смесь из стадии (a) разрыхлителя, связующего и смазывающего вещества с последующим смешиванием, (c) гранулирование смеси из стадии (b) и затем таблетированиe с получением минитаблеток (MUST) или таблеток, (d) нанесение на таблетированные минитаблетки или таблетки, полученные на стадии (c), эндотелиального покрытия с помощью сушилки с псевдоожиженным слоем (FBG) и устройства для нанесения покрытия, и (e) формирование у минитаблеток или таблеток с эндотелиальным покрытием, полученных на стадии (d), слоя контролирующего высвобождение покрытия с использованием смеси, содержащей сополимер метакриловой кислоты S и сополимер метакриловой кислоты L.
Краткое описание фигур
Вышеуказанные и другие цели, признаки и другие преимущества настоящего изобретения станут более понятными из следующего подробного описания в сочетании с прилагаемыми чертежами.
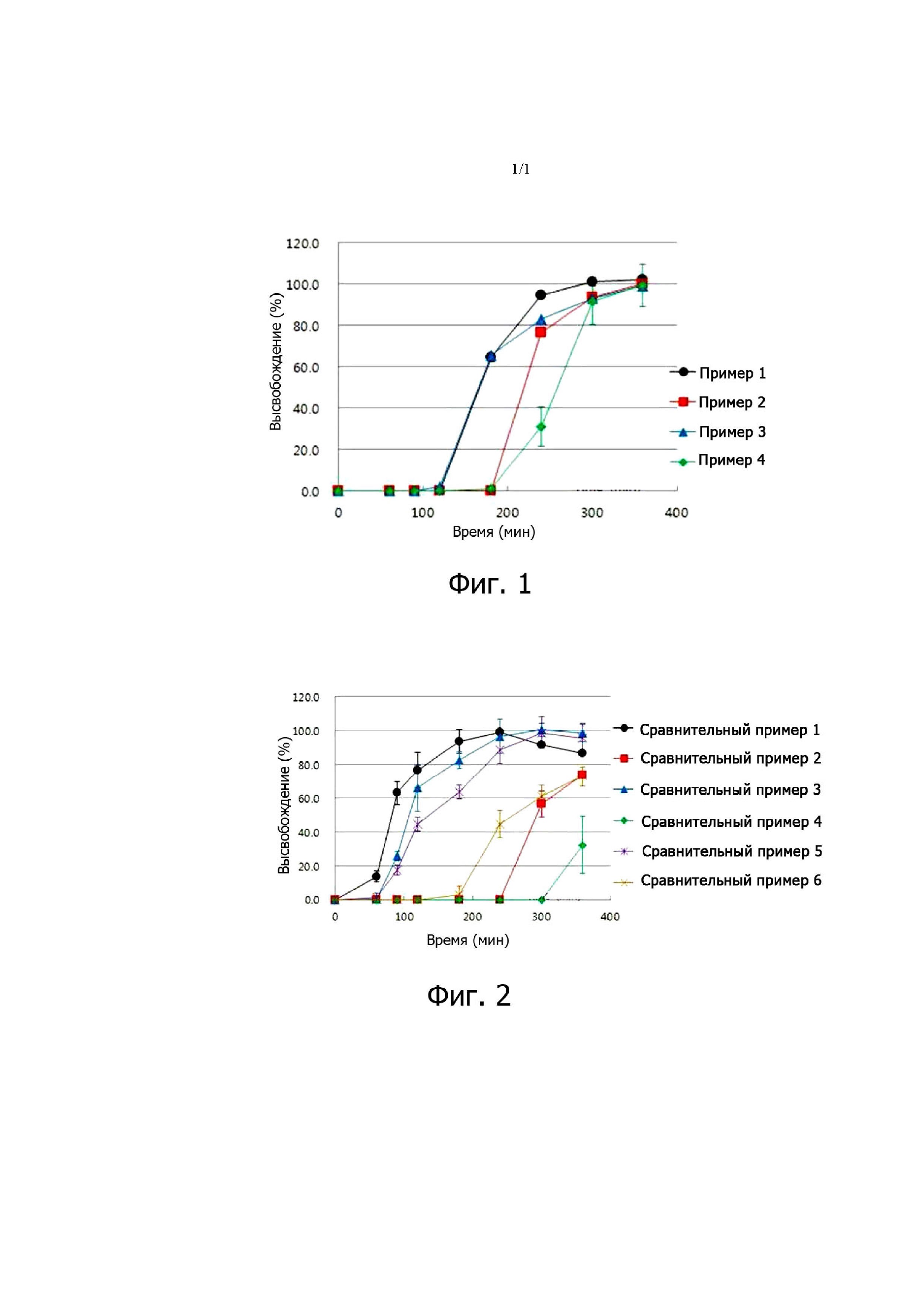
На фиг. 1 представлены результаты испытания на характеристики высвобождения в отношении лекарственной формы по настоящему изобретению, в которой соотношение в смеси между сополимером S метакриловой кислоты и сополимером L метакриловой кислоты, присутствующими в качестве материала основы контролирующего высвобождение покрытия в слое контролирующего высвобождение покрытия, составляет от 2:1 до 3:1 (вес/вес), а вес сополимера S метакриловой кислоты и сополимера L метакриловой кислоты, присутствующих в качестве материала основы контролирующего высвобождение покрытия в слое контролирующего высвобождение покрытия, составляет от 20 до 35% (вес/вес) относительно веса таблетки с эндотелиальным покрытием.
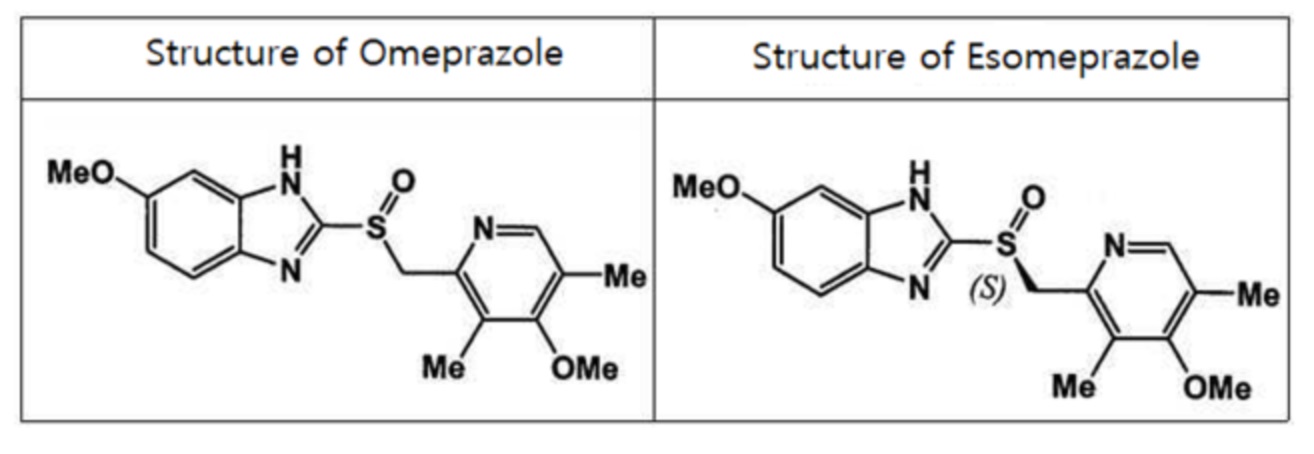
На фиг. 2 представлены результаты испытания на характеристики высвобождения в отношении сравнительной лекарственной формы, в которой соотношение в смеси между сополимером S метакриловой кислоты и сополимером L метакриловой кислоты, присутствующими в качестве материала основы контролирующего высвобождение покрытия в слое контролирующего высвобождение покрытия, составляет 6:1 (вес/вес), а вес сополимера S метакриловой кислоты и сополимера L метакриловой кислоты, присутствующих в качестве материала основы контролирующего высвобождение покрытия в слое контролирующего высвобождение покрытия, составляет от 10 до 40% (вес/вес) относительно веса таблетки с эндотелиальным покрытием.
Осуществление изобретения
Если не указано иначе, все используемые здесь технические и научные термины имеют те же значения, которые известны специалистам в той области, к которой относится настоящее изобретение. В общем, используемая здесь номенклатура хорошо известна в данной области, она же обычно и применяется.
В одном аспекте настоящего изобретения предусмотрены фармацевтические композиции, содержащие эзомепразол или его фармацевтически приемлемую соль, которые включают:
(a) ядро, содержащее эзомепразол или его фармацевтически приемлемую соль в качестве активного ингредиента;
(b) слой эндотелиального покрытия, сформированный на ядре; и
(c) слой контролирующего высвобождение покрытия, сформированный на слое эндотелиального покрытия и содержащий полимер, состоящий из сополимера метакриловой кислоты S и сополимера метакриловой кислоты L, смешанных в определенном соотношении;
причем слой эндотелиального покрытия содержит по меньшей мере одно, выбранное из группы, состоящей из гидроксипропилметилцеллюлозы (HPMC), поливинилпирролидона (PVP), низкозамещенной гидроксипропилцеллюлозы (HPC-L), крахмала, желатина и этилцеллюлозы (ЕС),
слой контролирующего высвобождение покрытия содержит смесь из сополимера S метакриловой кислоты и сополимера L метакриловой кислоты в соотношении от 1,5:1 до 3,5:1 (вес/вес), предпочтительно от 2:1 до 3:1, а
вес сополимера S метакриловой кислоты и сополимера L метакриловой кислоты в качестве материала основы контролирующего высвобождение покрытия составляет от 15 до 40% (вес/вес), предпочтительно от 20 до 35% (вес/вес) относительно веса таблетки с эндотелиальным покрытием.
Лекарственная форма по настоящему изобретению предпочтительно представлена в виде гранул, минитаблеток (MUST), таблеток, смеси гранул и минитаблеток или капсул, но настоящее изобретение не ограничивается этим, а данные гранулы или минитаблетки могут быть заключены в капсулы.
Лекарственная форма по настоящему изобретению практически не разлагается в желудке и начинает выделять эзомепразол или его фармацевтически приемлемую соль в желудочно-кишечном тракте в диапазоне рН от 6,5 до 7,0. В частности, лекарственная форма начинает выделять эзомепразол или его фармацевтически приемлемую соль при рН от 6,7 до 6,9 после задержки в 2 часа, а заканчивает выделять через 6 часов, что дает преимущества большого удобства для пациента и получения отличного терапевтического эффекта.
В лекарственных формах по настоящему изобретению можно использовать любые фармацевтически приемлемые соли эзомепразола без ограничений, если только они обычно применяются в данной области, а предпочтительные примеры фармацевтически приемлемых солей эзомепразола включают, без ограничения, соли металлов типа магниевых солей (Mg), стронциевых солей (Sr), литиевых солей, натриевых солей, калиевых солей или кальциевых солей эзомепразола и аммониевые соли эзомепразола. Наиболее предпочтительно используются магниевые соли или стронциевые соли эзомепразола.
Кроме того, в лекарственных формах по настоящему изобретению можно использовать эзомепразол или его фармацевтически приемлемую соль в виде ангидрида или гидрата.
У лекарственной формы по настоящему изобретению ядро, содержащее эзомепразол или его фармацевтически приемлемую соль, также может содержать надлежащее количество обычных приемлемых эксципиентов, наряду с эзомепразолом или его фармацевтически приемлемой солью в качестве активного ингредиента. Предпочтительно ядро может содержать один или несколько эксципиентов из числа разбавителей, связующих веществ, разрыхлителей, смазывающих веществ, поверхностно-активных веществ, антиоксидантов, консервантов и стабилизаторов, без ограничения.
Разбавитель, который может содержаться в ядрах лекарственной формы по настоящему изобретению, может включать по меньшей мере одно, выбранное из группы, состоящей из маннита, микрокристаллической целлюлозы, лактозы, целлюлозы и их производных, двухосновного или трехосновного фосфата кальция, эритрита, низкозамещенной гидроксипропилцеллюлозы, желатинизированного крахмала, сорбита и ксилита. Однако предпочтительно используется маннит и/или микрокристаллическая целлюлоза.
Связующее может быть выбрано из группы, состоящей из гидроксипропилцеллюлозы (HPC), соповидона (сополимера винилпирролидона с другими винильными производными), гидроксипропилметилцеллюлозы (HPMC), поливинилпирролидона (повидона), желатинизированного крахмала и низкозамещенной гидроксипропилцеллюлозы (HPC-L), но не ограничивается этим. Предпочтительно используется гидроксипропилцеллюлоза.
Разрыхлитель может включать по меньшей мере одно, выбранное из группы, состоящей из натриевой кроскармеллозы, кукурузного крахмала, кросповидона, низкозамещенной гидроксипропилцеллюлозы (HPC-L) или желатинизированного крахмала, но не ограничивается этим. Предпочтительно используется натриевая кроскармеллоза.
Смазывающее вещество может включать по меньшей мере одно, выбранное из группы, состоящей из стеарилфумарата натрия, стеарата магния, талька, полиэтиленгликоля, бегената кальция, стеарата кальция и гидрогенизированного касторового масла, но не ограничивается этим. Предпочтительно используется стеарилфумарат натрия.
У лекарственной формы по настоящему изобретению слой эндотелиального покрытия, сформированный на ядре, содержащем эзомепразол или его фармацевтически приемлемую соль, включает по меньшей мере одно вещество, выбранное из группы, состоящей из гидроксипропилметилцеллюлозы (HPMC), поливинилпирролидона (PVP), низкозамещенной гидроксипропилцеллюлозы (HPC-L), крахмала, желатина и этилцеллюлозы (EC). Предпочтительно используется гидроксипропилметилцеллюлоза (HPMC).
В настоящем изобретении термин “таблетки с эндотелиальным покрытием” означает минитаблетки (MUST), содержащие слой эндотелиального покрытия, сформированный на ядре, содержащем эзомепразол или его фармацевтически приемлемую соль в качестве активного ингредиента.
По меньшей мере одно вещество, выбранное из группы, состоящей из гидроксипропилметилцеллюлозы (HPMC), поливинилпирролидона (PVP), низкозамещенной гидроксипропилцеллюлозы (HPC-L), крахмала, желатина и этилцеллюлозы (EC), которое содержится в слое эндотелиального покрытия, предпочтительно присутствует в количестве от 4,4 до 5,2% (вес/вес), предпочтительно от 4,7 до 4,9% (вес/вес) относительно веса таблетки с эндотелиальным покрытием.
У лекарственной формы по настоящему изобретению слой контролирующего высвобождение покрытия, сформированный на слое эндотелиального покрытия (которое здесь может использоваться взаимозаменяемо со “слоем энтеросолюбильного покрытия”), содержит смесь сополимера S метакриловой кислоты и сополимера L метакриловой кислоты в качестве материала основы контролирующего высвобождение покрытия в соотношении от 1,5:1 до 3,5:1 (вес/вес), предпочтительно от 2:1 до 3:1 (вес/вес).
Сополимер S метакриловой кислоты представляет собой анионный сополимер, содержащий метакриловую кислоту и метилметакрилат в соотношении примерно 1:2, который продается под торговым названием “Eudragit S-100”, а сополимер L метакриловой кислоты – анионный сополимер, содержащий метакриловую кислоту и метилметакрилат в соотношении около 1:1, который продается под торговым названием “Eudragit L-100”.
В настоящем изобретении термин “таблетки с контролирующим высвобождение покрытием” означает минитаблетки (MUST) или таблетки, содержащие слой контролирующего высвобождение покрытия, сформированный на слое эндотелиального покрытия.
У лекарственной формы по настоящему изобретению материалы основы контролирующего высвобождение покрытия, содержащиеся в слое контролирующего высвобождение покрытия, а именно сополимер S метакриловой кислоты и сополимер L метакриловой кислоты, присутствуют в количестве от 15 до 40% (вес/вес), предпочтительно от 20 до 35% (вес/вес) относительно веса таблетки с эндотелиальным покрытием.
Содержание по меньшей мере одного вещества, выбранного из группы, состоящей из гидроксипропилметилцеллюлозы (HPMC), поливинилпирролидона (PVP), низкозамещенной гидроксипропилцеллюлозы (HPC-L), крахмала, желатина и этилцеллюлозы (EC), которое содержится в слое эндотелиального покрытия, относительно веса сополимера S метакриловой кислоты и сополимера L метакриловой кислоты составляет от 3,5 до 8,0 (вес/вес), предпочтительно от 4,2 до 7,4 (вес/вес).
Кроме того, лекарственная форма по настоящему изобретению отличается тем,
что при испытании на высвобождение (растворение) с использованием искусственной кишечной жидкости (среды) со значением рН от 6,7 до 6,9 при 75 об/мин и 37°C в соответствии с лопастным методом USP через 2 часа элюируется 5% или меньше, предпочтительно 2% или меньше эзомепразола или его фармацевтически приемлемой соли, а через 6 часов элюируется 90% или больше, предпочтительно 98% или больше эзомепразола или его фармацевтически приемлемой соли.
Если содержание по меньшей мере одного вещества, выбранного из группы, состоящей из гидроксипропилметилцеллюлозы (HPMC), поливинилпирролидона (PVP), низкозамещенной гидроксипропилцеллюлозы (HPC-L), крахмала, желатина и этилцеллюлозы (EC), которое содержится в слое эндотелиального покрытия, относительно веса сополимера S метакриловой кислоты и сополимера L метакриловой кислоты в качестве материала основы контролирующего высвобождение покрытия по настоящему изобретению составляет менее 3,5 (вес/вес) или более 8,0 (вес/вес), то эзомепразол или его фармацевтически приемлемая соль начинает элюироваться еще до требуемого времени задержки по настоящему изобретению либо эзомепразол или его фармацевтически приемлемая соль не элюируется в достаточной степени по достижении требуемого времени растворения.
Если содержание по меньшей мере одного вещества, выбранного из группы, состоящей из гидроксипропилметилцеллюлозы (HPMC), поливинилпирролидона (PVP), низкозамещенной гидроксипропилцеллюлозы (HPC-L), крахмала, желатина и этилцеллюлозы (EC), относительно веса таблетки с эндотелиальным покрытием составляет менее 4,4 (вес/вес) или более 5,2 (вес/вес), то эзомепразол или его фармацевтически приемлемая соль начинает элюироваться еще до требуемого времени задержки по настоящему изобретению либо эзомепразол или его фармацевтически приемлемая соль не элюируется в достаточной степени по достижении требуемого времени растворения.
В другом аспекте настоящего изобретения предусмотрен способ получения лекарственной формы, содержащей эзомепразол или его фармацевтически приемлемую соль в качестве активного ингредиента.
В частности, способ получения лекарственной формы, содержащей эзомепразол или его фармацевтически приемлемую соль в качестве активного ингредиента, будет описан в виде примера, в котором форма представляет собой минитаблетки (MUST) или таблетки. В частности, лекарственная форма может быть получена способом, включающим, без ограничения:
(a) смешивание эзомепразола или его фармацевтически приемлемой соли с разбавителем;
(b) добавление разрыхлителя, связующего и смазывающего вещества в смесь из стадии (a) с последующим перемешиванием;
(c) сухое гранулирование смеси из стадии (b), а затем таблетирование с получением минитаблеток или таблеток;
(d) нанесение эндотелиального покрытия на таблетированные минитаблетки или таблетки, полученные на стадии (c), с помощью сушилки с псевдоожиженным слоем (FBG) и устройства для нанесения покрытия; и
(e) формирование у минитаблеток или таблеток с эндотелиальным покрытием, полученных на стадии (d), слоя контролирующего высвобождение покрытия, используя смесь, содержащую сополимер S метакриловой кислоты и сополимер L метакриловой кислоты.
В следующем аспекте настоящего изобретения предусмотрено применение лекарственной формы, содержащей эзомепразол или его фармацевтически приемлемую соль в качестве активного ингредиента, для профилактики и лечения желудочных и рефлюксных заболеваний пищевода типа рефлюкс-эзофагита и заболеваний, связанных с гиперпролиферацией желудка, включая гастрит, дуоденит, язвы желудка, язвы двенадцатиперстной кишки и пептические язвы, а также способ профилактики и лечения с помощью лекарственной формы, содержащей эзомепразол или его фармацевтически приемлемую соль в качестве активного ингредиента, для профилактики и лечения желудочных и рефлюксных заболеваний пищевода типа рефлюкс-эзофагита и заболеваний, связанных с гиперпролиферацией желудка, включая гастрит, дуоденит, язвы желудка, язвы двенадцатиперстной кишки и пептические язвы, который включает введение лекарственной формы по настоящему изобретению нуждающимся в лечении пациентам.
Примеры
Далее настоящее изобретение будет описано более подробно со ссылкой на примеры. Однако специалистам в данной области должно быть ясно, что эти примеры приводятся только для иллюстрации настоящего изобретения и не должны рассматриваться как ограничивающие объем настоящего изобретения.
Примеры 1-4. Получение таблеток, содержащих магниевую соль эзомепразола
Смешивали магниевую соль эзомепразола и маннит и гранулировали через кольцевое сито на 30 меш. Полученную смесь смешивали с микрокристаллической целлюлозой, натриевой кроскармеллозой, гидроксипропилцеллюлозой и стеарилфумаратом натрия в пустом блендере в течение 15 мин, получая конечную смесь. Конечную смесь подвергали сухой грануляции в роликовом уплотнителе, а полученные гранулы гранулировали через кольцевое сито на 20 меш.
Затем получали минитаблетки (MUST) с твердостью от 1 до 2 кПа и заданным весом в 7,5 мг путем таблетирования с пуансоном MUST диаметром 2,0 мм в таблеточной машине.
Состав конечного ядра, содержащего магниевую соль эзомепразола, представлен в табл. 2.
Таблица 2. Состав ядра, содержащего магниевую соль эзомепразола
|
Затем наносили покрытие в соответствии с составом из табл. 3 в устройстве для нанесения покрытий с псевдоожиженным слоем, получая таблетки с эндотелиальным покрытием весом 7,88 мг.
В таблетках с эндотелиальным покрытием присутствовал HPMC в соотношении 4,82 (вес/вес) относительно веса таблетки с эндотелиальным покрытием.
Таблица 3. Состав таблеток с эндотелиальным покрытием
|
После этого на вышеприведенные таблетки с эндотелиальным покрытием наносили покрытие в соответствии с составом из табл. 4 в устройстве для нанесения покрытий с псевдоожиженным слоем, получая таблетки, покрытые (таблетки с контролирующим высвобождение покрытием) слоями контролирующего высвобождение покрытия (слоями энтеросолюбильного покрытия), как показано в Примерах 1-4.
Таблица 4. Состав слоя контролирующего высвобождение покрытия в соответствии с примерами из настоящего изобретения
|
В примерах 1 и 2 из табл. 4 представлены таблетки, в которых Eudragit S-100 и L-100 в качестве материалов основы контролирующего высвобождение покрытия смешаны в соотношении 2:1, а слой контролирующего высвобождение покрытия составляет от 25 до 35% (вес/вес) относительно веса таблетки с эндотелиальным покрытием. В примерах 3 и 4 представлены таблетки, в которых Eudragit S-100 и L-100 в качестве материалов основы контролирующего высвобождение покрытия смешаны в соотношении 3:1, а слой контролирующего высвобождение покрытия составляет от 20 до 30% (вес/вес) относительно веса таблетки с эндотелиальным покрытием. Кроме того, соотношение между содержанием HPMC в слое эндотелиального покрытия и общим весом материалов основы контролирующего высвобождение покрытия, то есть сополимера S метакриловой кислоты и сополимера L метакриловой кислоты, содержащихся в слое контролирующего высвобождение покрытия, составляет от 4,21 до 7,37 (вес/вес).
В общем, в табл. 5 приведено содержание и соотношения соответствующих ингредиентов у лекарственных форм в соответствии с примерами из настоящего изобретения.
Таблица 5. Составы и соотношения у лекарственных форм в соответствии с примерами из настоящего изобретения
|
Сравнительные примеры 1-6. Получение таблеток с магниевой солью эзомепразола
В сравнительных примерах 1-6 получали таблетки, у которых минитаблетки с эндотелиальным покрытием в соответствии со способами получения из примеров 1-4 снабжены слоем контролирующего высвобождение покрытия, сформированным в соответствии с составами из табл. 6.
В сравнительных примерах 1 и 2 из табл. 6 представлены композиции, в которых Eudragit S-100 и Eudragit L-100 смешаны в соотношении 2:1, а материал основы контролирующего высвобождение покрытия составляет от 10 до 40% (вес/вес) относительно веса таблетки с эндотелиальным покрытием. Кроме того, в сравнительных примерах 3 и 4 представлены таблетки, в которых Eudragit S-100 и Eudragit L-100 смешаны в соотношении 3:1, а материал основы контролирующего высвобождение покрытия составляет от 10 до 40% (вес/вес) относительно веса таблетки с эндотелиальным покрытием.
В сравнительных примерах 5 и 6 представлены таблетки, в которых Eudragit S-100 и Eudragit L-100 смешаны в соотношении 6:1, а материал основы контролирующего высвобождение покрытия составляет от 10 до 20% (вес/вес) относительно веса таблетки с эндотелиальным покрытием.
Таблица 6. Состав слоя контролирующего высвобождение покрытия в соответствии со сравнительными примерами из настоящего изобретения
|
В общем, содержание и соотношения соответствующих ингредиентов у лекарственных форм в соответствии с примерами из настоящего изобретения приведены в табл. 7.
Таблица 7. Составы и соотношения у лекарственных форм в соответствии со сравнительными примерами из настоящего изобретения
|
Тест-пример 1.
Измеряли скорость растворения магниевой соли эзомепразола по времени в условиях, приведенных в табл. 8, используя лекарственные формы из примеров 1-4 и из сравнительных примеров 1-6.
Таблица 8. Условия при измерении скорости растворения магниевых солей эзомепразола
|
Результаты измерения скорости растворения представлены в табл. 9 и 10 и на фиг. 1 и 2. Как видно из табл. 9 и фиг. 1, в примерах 1-4 возможна задержка высвобождения препарата на 2 часа или больше в искусственной кишечной жидкости, а высвобождение ускоряется после начала высвобождения.
А именно, видно, что, когда слой контролирующего высвобождение покрытия содержит полимер, состоящий из сополимера S метакриловой кислоты и сополимера L метакриловой кислоты, смешанных в качестве материалов основы контролирующего высвобождение покрытия в соотношении от 1,5:1 до 3,5:1 (вес/вес), предпочтительно от 2:1 до 3:1 (вес/вес), а вес материала основы контролирующего высвобождение покрытия составляет от 15 до 40% (вес/вес), предпочтительно от 20 до 35% (вес/вес) относительно веса таблетки, содержащей слой эндотелиального покрытия, и соотношение между весом материала основы контролирующего высвобождение покрытия и HPMC в слое эндотелиального покрытия составляет от 3,5 до 8,0 (вес/вес), предпочтительно от 4,2 до 7,4 (вес/вес), а вес HPMC в слое эндотелиального покрытия составляет от 4,4 до 5,2% (вес/вес), предпочтительно от 4,7 до 4,9% (вес/вес) относительно веса таблетки с эндотелиальным покрытием, то магниевая соль эзомепразола почти не высвобождается в течение 2 часов и начинает быстро высвобождаться через 2 часа, а через 6 часов высвобождается 99% её или больше, что означает отличные характеристики высвобождения.
При сравнении примера 1 и примера 3 видно, что при повышении доли Eudragit
S-100, который сравнительно нерастворим в искусственной кишечной жидкости, возможна достаточная задержка высвобождения препарата, несмотря на использование сравнительно небольшого количества материала основы контролирующего высвобождение покрытия.
С другой стороны, как видно из сравнительного примера 1 и сравнительного примера 3, при использовании меньшего количества вещества контролирующего высвобождение покрытия, чем в примерах (при этом материал основы контролирующего высвобождение покрытия составлял 10% или меньше относительно таблетки с эндотелиальным покрытием ядра), эффект замедления высвобождения препарата в искусственной кишечной жидкости был слабым, а из сравнительного примера 2 и сравнительного примера 4 видно, что при использовании большего количества вещества контролирующего высвобождение покрытия, чем в примерах (при этом материал основы контролирующего высвобождение покрытия составлял 40% или больше относительно таблетки с эндотелиальным покрытием ядра), затрудняется быстрое высвобождение препарата, которое не завершается даже через 6 часов, так что препарат может подвергаться экскреции еще до всасывания in vivo.
Кроме того, учитывая сравнительный пример 5 и сравнительный пример 6 с высокой долей сравнительно нерастворимого Eudragit S-100 в искусственной кишечной жидкости, при использовании материала основы контролирующего высвобождение покрытия в количестве 10% или меньше относительно таблетки с эндотелиальным покрытием ядра эффект замедления высвобождения был слабым, а при использовании материала основы контролирующего высвобождение покрытия в количестве 20% или больше препарат высвобождался медленно в течение длительного времени после задержки высвобождения, что неблагоприятно, причем конечная степень растворения тоже была ниже 100%.
Таблица 9. Скорость растворения магниевой соли эзомепразола (в примерах)
|
Таблица 10. Скорость растворения магниевой соли эзомепразола (в сравнительных примерах)
|
Настоящее изобретение было описано на основе его предпочтительных воплощений. Специалистам в той области техники, к которой относится настоящее изобретение, должно быть ясно, что настоящее изобретение может быть реализовано в модифицированном виде без отклонения от сущности и объема изобретения.
Итак, воплощения, раскрытые выше, следует рассматривать в иллюстративном, а не в ограничительном смысле. Объем настоящего изобретения определяется прилагаемой формулой изобретения, а не предшествующим изложением, а все отличия, которые попадают в сферу его эквивалентов, должны рассматриваться как включенные в настоящее изобретение.
Промышленная применимость
Настоящее изобретение касается лекарственной формы, содержащей эзомепразол или его фармацевтически приемлемую соль. Лекарственная форма по настоящему изобретению, исходя из значительно улучшенных характеристик pH-зависимого высвобождения препарата, начинает высвобождать эзомепразол или его фармацевтически приемлемую соль после заданного времени задержки при пероральном введении, продолжает высвобождение в течение заданного времени и заканчивает высвобождение через заранее определенное время, обеспечивая тем самым большое удобство для пациента и превосходные терапевтические эффекты по сравнению с другими обычными формами.
Хотя конкретные конфигурации настоящего изобретения были описаны подробно, однако специалистам в данной области должно быть ясно, что это описание приводится
в качестве предпочтительных воплощений для иллюстративных целей и не должно рассматриваться как ограничивающее объем настоящего изобретения. Таким образом, существенный объем настоящего изобретения определяется прилагаемой формулой изобретения и её эквивалентами.