Результат интеллектуальной деятельности: Аморфная твердая дисперсия, содержащая таксан, таблетка, содержащая такую дисперсию, и способ их получения
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к аморфной твердой дисперсии, содержащей таксан или его фармацевтически приемлемую соль, поливинилпирролидон, полисорбат и лаурилсульфат натрия; таблетке, содержащей таковую; и способам получения твердой дисперсии и таблетки.
УРОВЕНЬ ТЕХНИКИ
Таксаны представляют собой дитерпены, вырабатываемые растениями рода Taxus, и они широко используются в качестве химиотерапевтических средств. Примеры таксанов включают паклитаксел (Taxol®), доцетаксел (Taxotere® или Docecad), кабазитаксел, ларотаксел, ортатаксел, тезетаксел и т.п.
Среди них паклитаксел является одним из наиболее эффективных противоопухолевых средств, которое часто назначали для лечения опухолей, в том числе карциномы яичника, рака молочной железы, видов рака головы и шеи, немелкоклеточного рака легких, рака предстательной железы и прогрессирующих форм саркомы Капоши. Одним из основных ограничений, связанных с этим сильнодействующим средством, является низкая растворимость в воде, обусловленная его исключительно гидрофобной природой.
Растворимость в воде паклитаксела составляет ~10 мг/мл, а недостаток функциональных групп в его химической структуре исключает любое возможное образование соли для улучшения его растворимости. Поэтому в течение более десяти лет были осуществлены различные попытки повышения растворимости паклитаксела, при этом одной из наиболее успешных является Taxol® (Bristol-Myers Squibb), коммерчески доступный состав для внутривенного введения, который представляет собой 6 мг/мл паклитаксела в 50:50% об./об. смеси кремофор EL® и дегидратированного этанола.
Однако при применении Taxol® в медицинской практике столкнулись с большим количеством проблем, в том числе тяжелыми или даже смертельными случаями гиперчувствительности, обусловленными индукцией гистаминов, опосредованной кремофор EL® и возможно выпадением в осадок после разбавления и выщелачивания диэтилгексилфталата (DEHP) из инфузионных пакетов из поливинилхлорида (PVC), что влечет за собой необходимость применения контейнеров, не содержащих пластификаторов, или пакетов, а также проблемы, связанные с неудобством для медицинского персонала и болевыми ощущениями у пациентов. Кроме того, с целью облегчения тяжелых побочных эффектов состава Taxol® пациенты зачастую нуждаются в приеме лекарственного средства для премедикации и/или в продолжительном режиме инфузионного введения (до 24 часов), что влечет за собой либо неподходящее продолжительное время инфузионного введения для пациентов или повышение стоимости госпитализации пациентов в случае полного 6-24-часового инфузионного введения. Кроме того, такие меры, как правило, не полностью будут устранять побочные эффекты.
Следовательно, было предпринято множество попыток в отношении получения состава, такие как сокращение времени инфузионного введения, повышение стабильности состава, получение нетоксичных составов без кремофора или со сниженным количеством кремофора и т.д., при этом они раскрыты в патентах США №№6,569,459 (Способ введения состава на основе паклитаксела-белка плазмы крови), 5,681,846 (Составы для паклитаксела с пролонгированной стабильностью), 6,919,370 (Фармацевтические составы, содержащие паклитаксел, его производные и фармацевтически приемлемые соли), 6,107,333 (Паклитаксел для парентерального применения в виде стабильного нетоксичного состава) и т.д.
Тем не менее, в целом состав для перорального применения является предпочтительным в связи с несколькими преимуществами по сравнению с другими способами введения, в частности, внутривенным введением. В дополнение к гибкости в отношении осуществления лечения составы для перорального применения являются недорогими, удобными и характеризуются более высоким уровнем соблюдения предписанного режима терапии.
Следовательно, существует явная потребность в композициях на основе таксана для перорального применения, в том числе паклитаксела, которые легко получать и которые характеризуются повышенной растворимостью и биодоступностью.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к аморфной твердой дисперсии, содержащей таксан (например, паклитаксел или доцетаксел), с повышенной растворимостью, стабильностью и/или биодоступностью.
Настоящее изобретение также относится к составу для перорального применения (например, таблетке), содержащему таксан, с необходимой растворимостью, биодоступностью и/или стабильностью, где таксан находится в аморфной твердой дисперсии.
Настоящее изобретение также относится к способу получения аморфной твердой дисперсии.
Настоящее изобретение также относится к способу получения состава для перорального применения (например, таблетки).
Настоящее изобретение также относится к способу лечения заболевания, связанного с клеточной пролиферацией (например, рака), предусматривающему введение терапевтически эффективного количества твердой дисперсии или состава для перорального применения по настоящему изобретению нуждающемуся в этом субъекту.
Настоящее изобретение также относится к применению твердой дисперсии или состава для перорального применения по настоящему изобретению для лечения заболевания, связанного с клеточной пролиферацией (например, рака).
Настоящее изобретение также относится к применению твердой дисперсии или состава для перорального применения по настоящему изобретению в изготовлении лекарственного препарата для лечения заболевания, связанного с клеточной пролиферацией (например, рака).
В соответствии с одним аспектом настоящего изобретения аморфная твердая дисперсия содержит таксан или его фармацевтически приемлемую соль, фармацевтически приемлемый полимер и фармацевтически приемлемое поверхностно-активное вещество.
В соответствии с другим аспектом настоящего изобретения состав для перорального применения (например, таблетка) содержит аморфную твердую дисперсию, внутригранулярное вспомогательное вещество и внегранулярное вспомогательное вещество.
В соответствии с другим аспектом настоящего изобретения способ получения аморфной твердой дисперсии предусматривает стадии:
(a) растворения таксана или его фармацевтически приемлемой соли, фармацевтически приемлемого полимера и фармацевтически приемлемого поверхностно-активного вещества в растворителе с получением раствора и
(b) высушивания раствора, полученного на стадии (а).
Согласно некоторым вариантам осуществления высушивание на стадии (b) осуществляют с помощью высушивания распылением. Согласно дополнительным вариантам осуществления высушивание распылением осуществляют в псевдоожиженном слое. Согласно дополнительным вариантам осуществления псевдоожиженный слой содержит внутригранулярное вспомогательное вещество.
В соответствии с еще одним аспектом настоящего изобретения способ получения состава для перорального применения (например, таблетки) предусматривает стадии:
(a) растворения таксана или его фармацевтически приемлемой соли, фармацевтически приемлемого полимера и фармацевтически приемлемого поверхностно-активного вещества в растворителе с получением раствора;
(b) высушивания раствора, полученного на стадии (а), с получением твердой дисперсии;
(c) смешивания твердой дисперсии из стадии (b) вместе с внегранулярным вспомогательным веществом и
(d) прессования смеси из стадии (с).
Согласно некоторым вариантам осуществления высушивание на стадии (b) осуществляют с помощью высушивания распылением. Согласно дополнительным вариантам осуществления высушивание распылением осуществляют в псевдоожиженном слое. Согласно дополнительным вариантам осуществления псевдоожиженный слой содержит внутригранулярное вспомогательное вещество.
Другие признаки и варианты осуществления настоящего изобретения будут очевидны из следующего описания и прилагаемой формулы изобретения.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
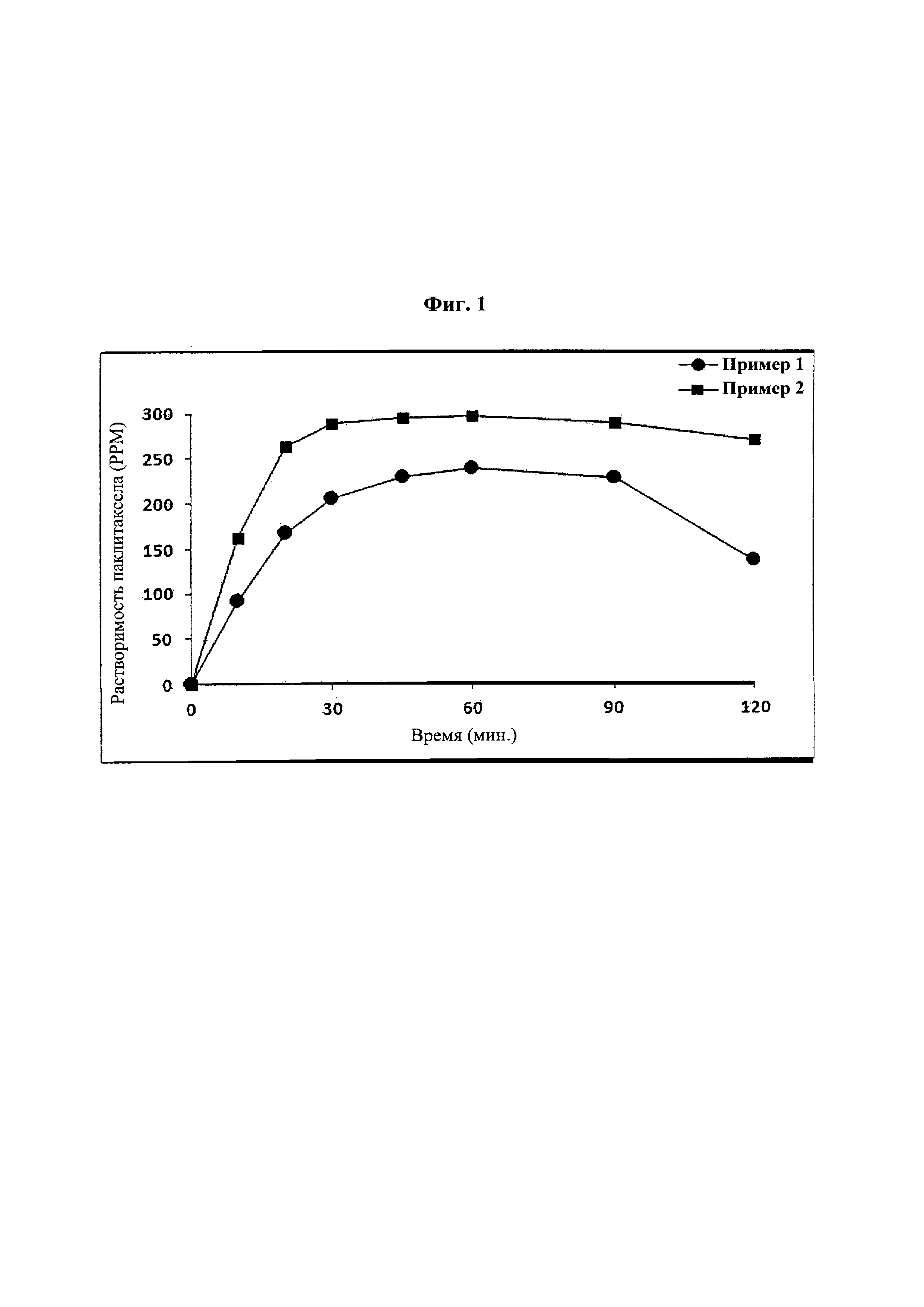
Фиг. 1 представляет собой график, демонстрирующий показатели растворимости твердых дисперсий из примеров 1 и 2.
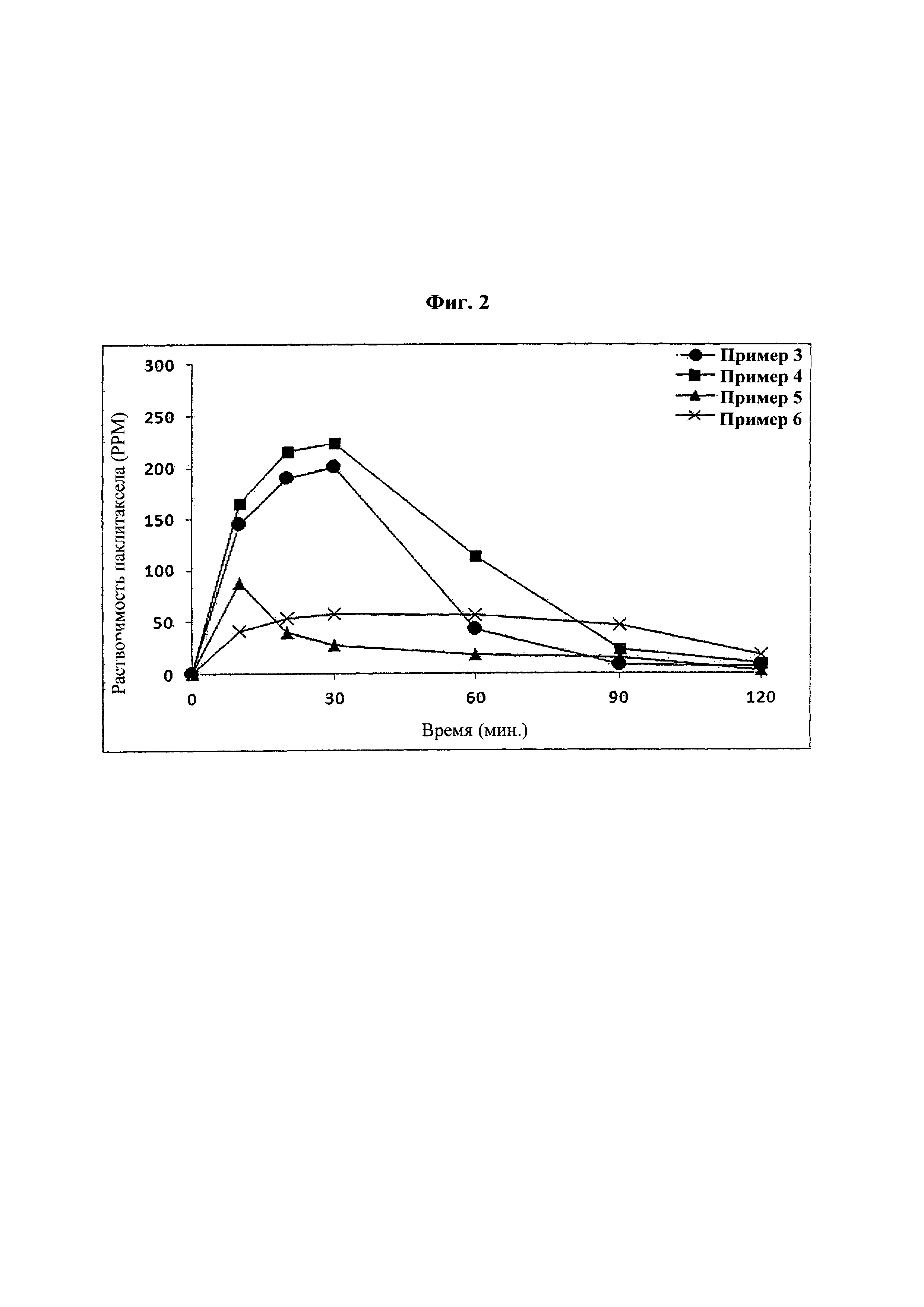
Фиг. 2 представляет собой график, демонстрирующий показатели растворимости твердых дисперсий из примеров 3-6.
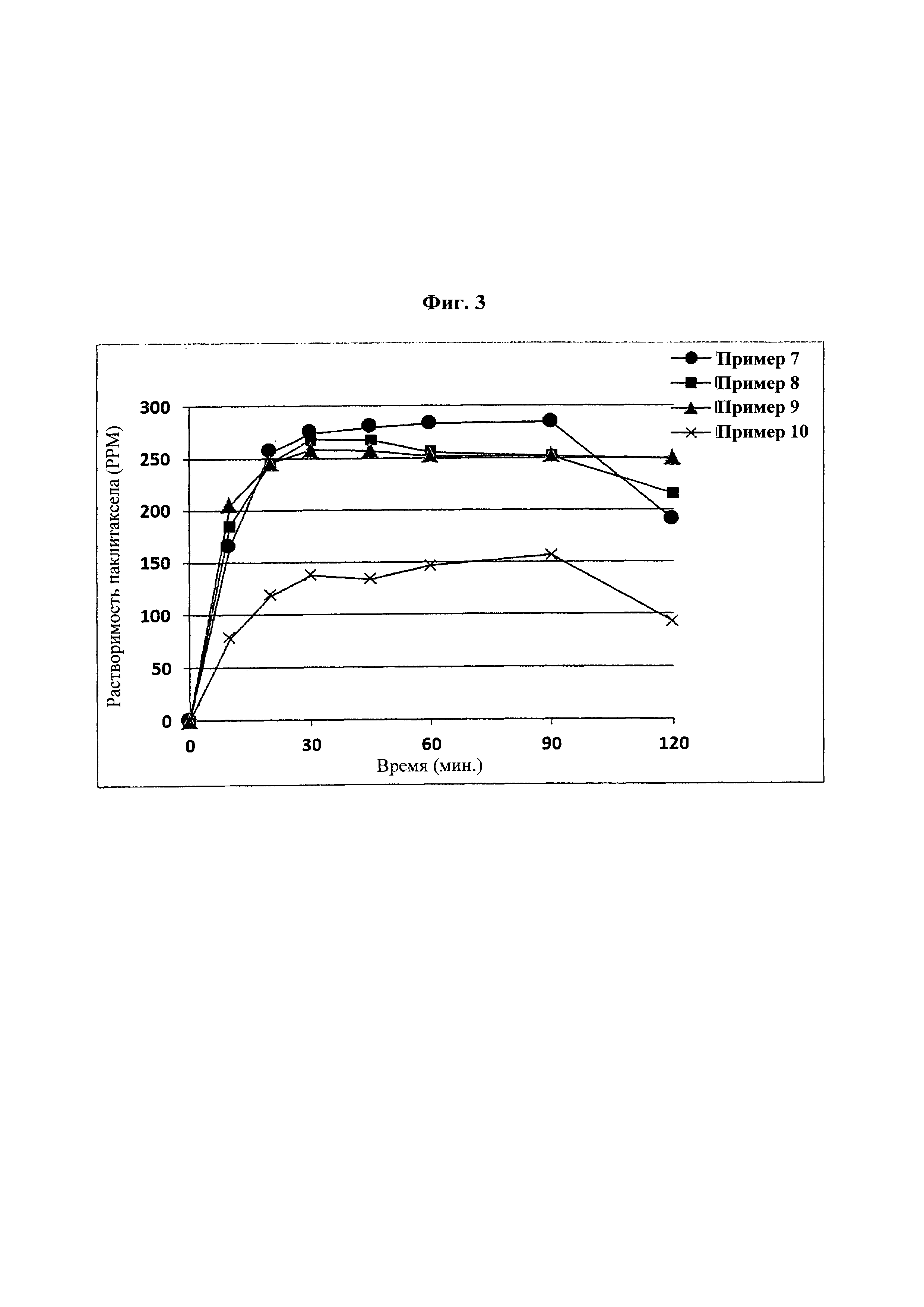
Фиг. 3 представляет собой график, демонстрирующий показатели растворимости твердых дисперсий из примеров 7-10.
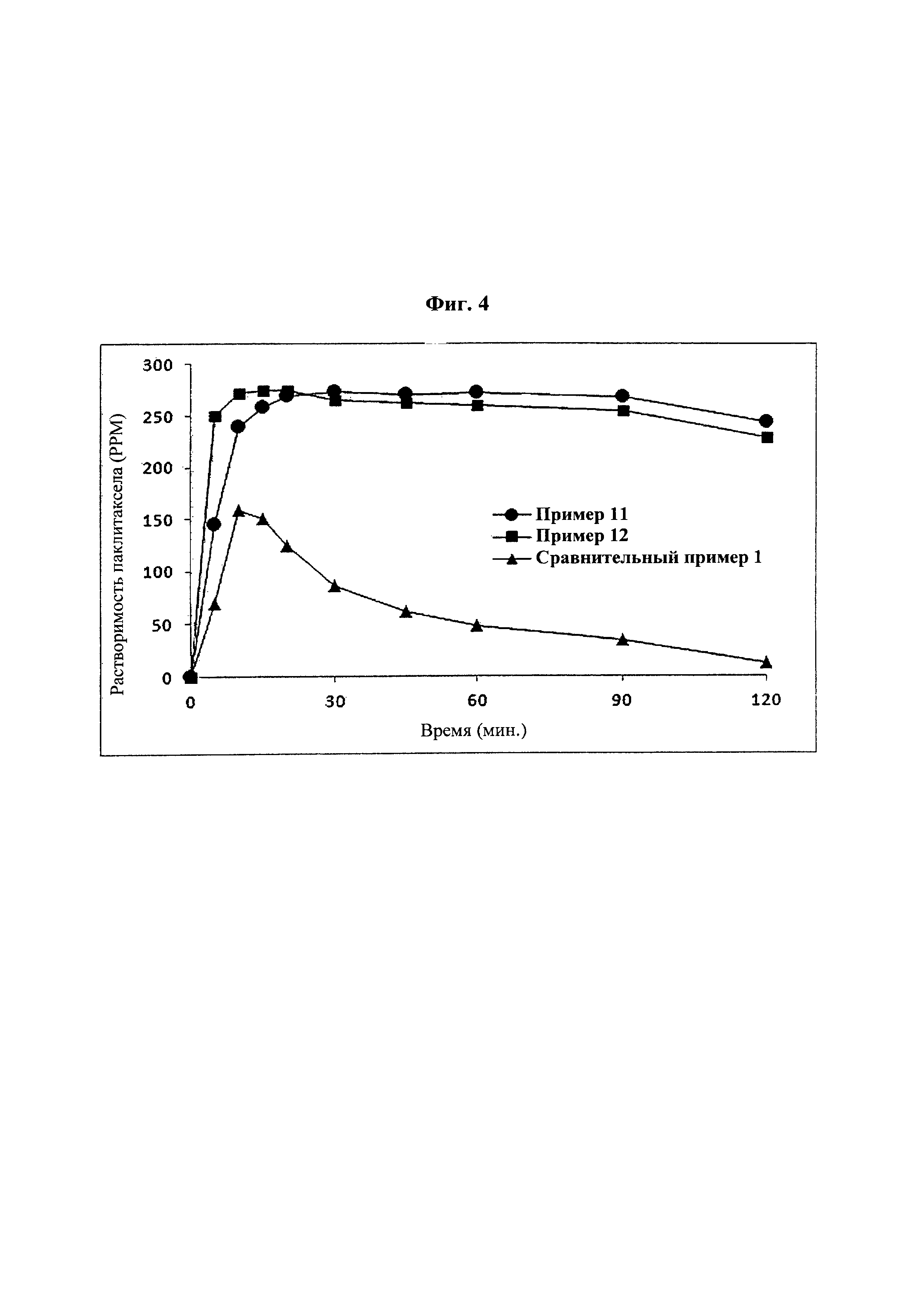
Фиг. 4 представляет собой график, демонстрирующий показатели растворимости твердых дисперсий из примеров 11 и 12-1 и жидкого состава из сравнительного примера 1.
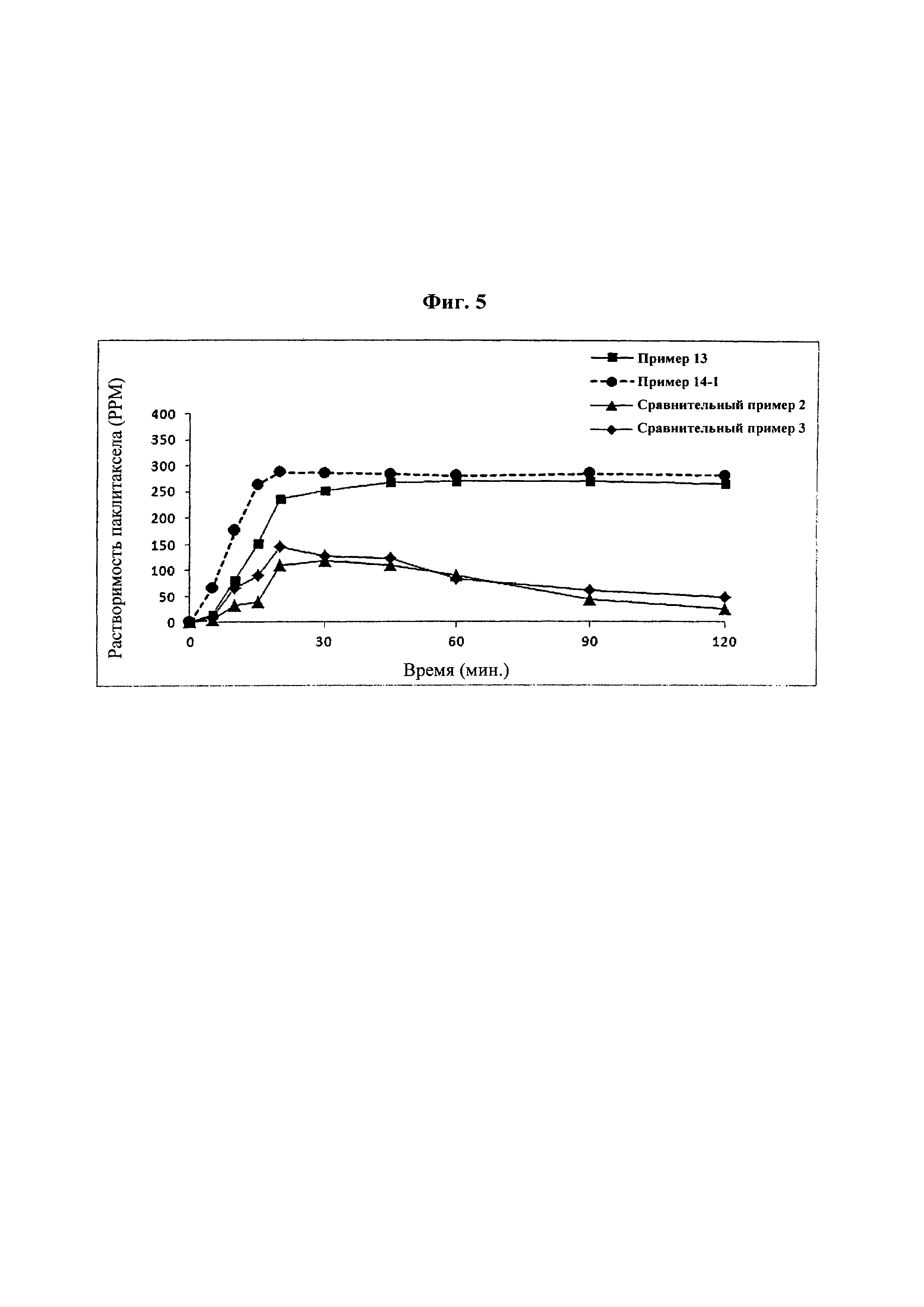
Фиг. 5 представляет собой график, демонстрирующий распадаемость таблеток из примеров 13 и 14-1 и сравнительных примеров 2 и 3.
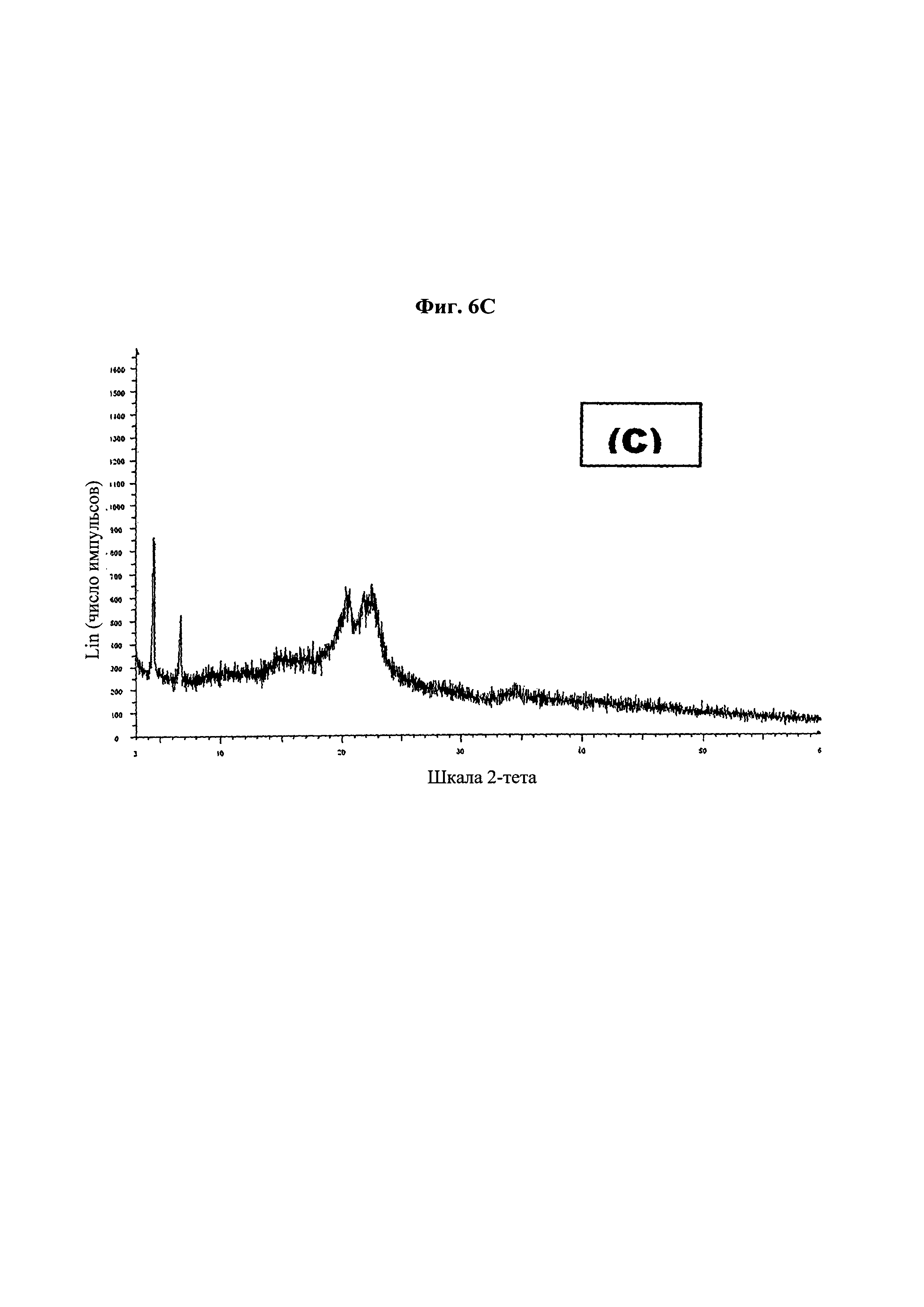
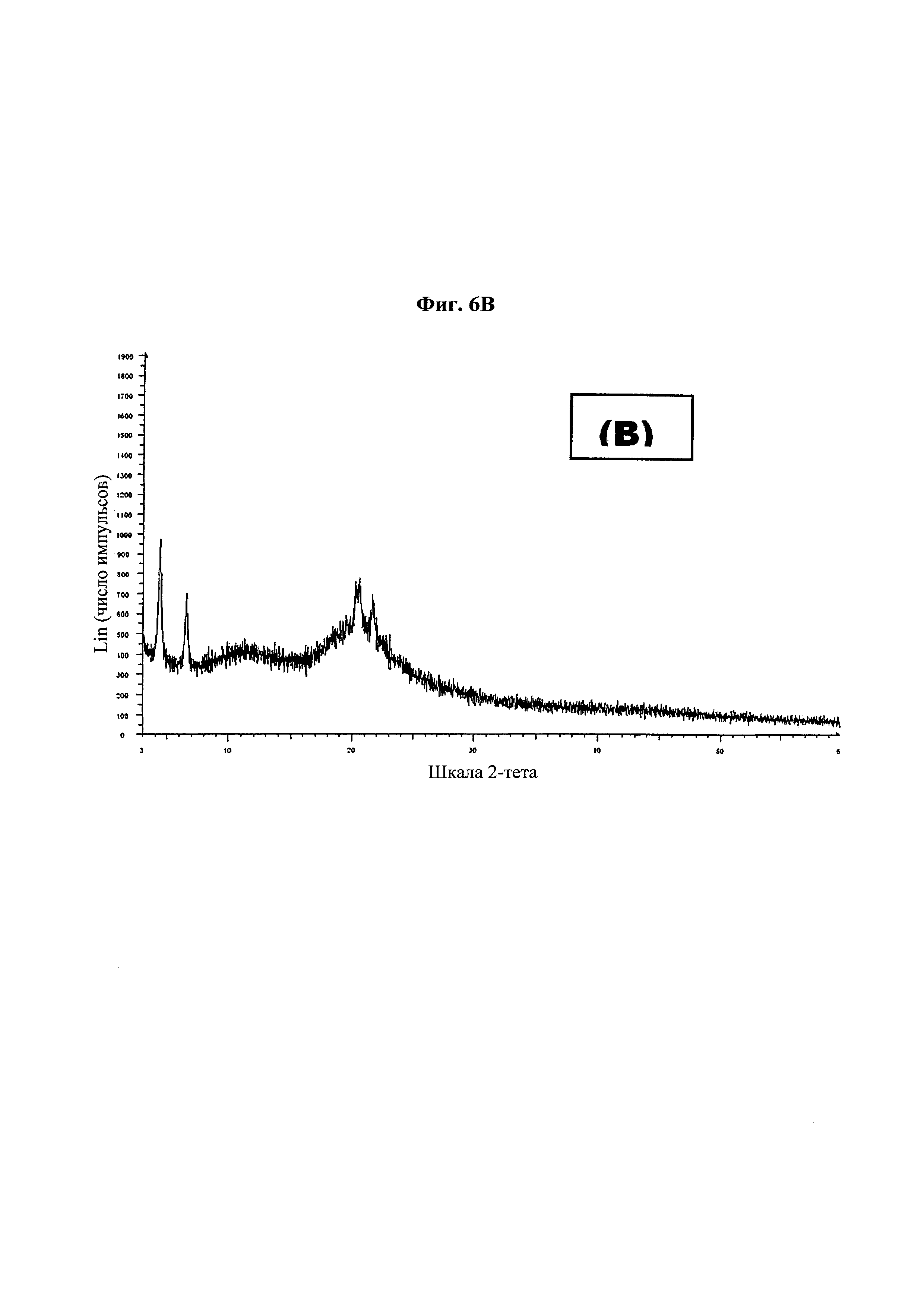
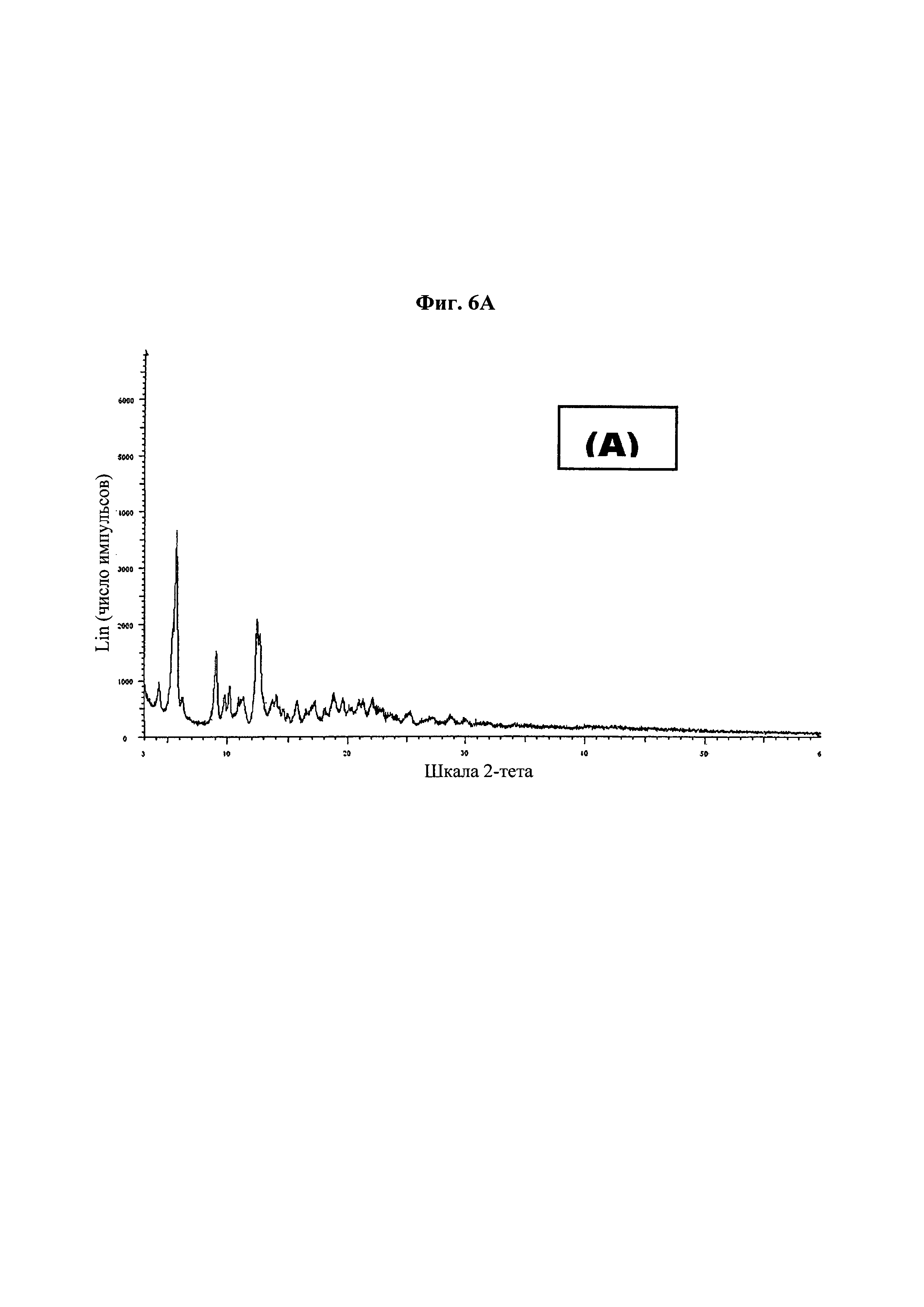
На фиг. 6 представлена дифракционная рентгенограмма для (А) паклитаксела в качестве API; (В) таблетки из примера 13; и (С) таблетки из примера 14-1.
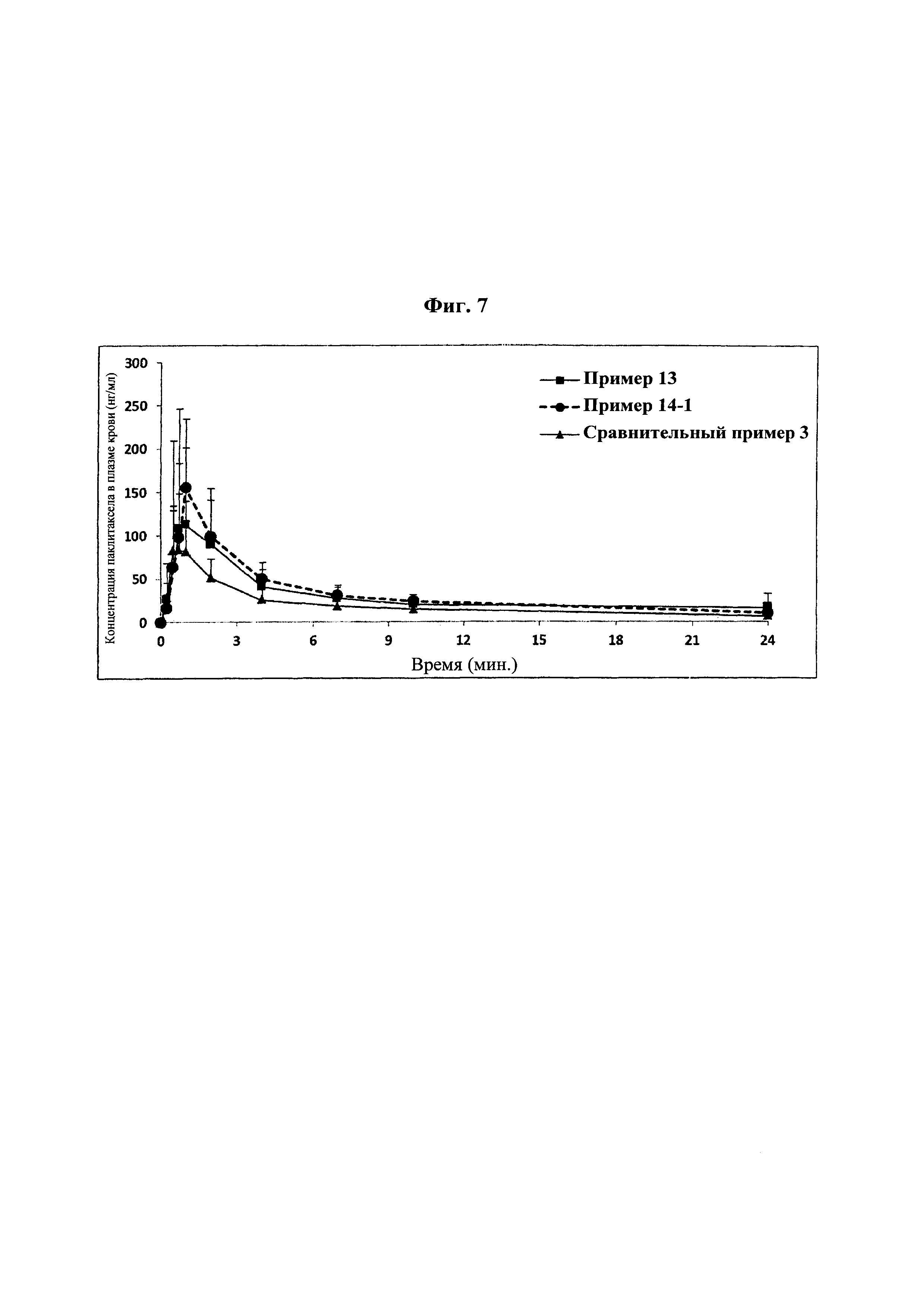
На фиг. 7 представлен фармакокинетический профиль таблеток из примеров 13 и 14-1 и сравнительного примера 3 у собак породы бигль.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение предусматривает аморфную твердую дисперсию, содержащую таксан или его фармацевтически приемлемую соль, фармацевтически приемлемый полимер и фармацевтически приемлемое поверхностно-активное вещество, а также способ получения аморфной твердой дисперсии. Также настоящее изобретение предусматривает состав для перорального применения, содержащий аморфную твердую дисперсию, внутригранулярное вспомогательное вещество и внегранулярное вспомогательное вещество, а также способ получения состава для перорального применения. Аморфная твердая дисперсия, таблетка, содержащая таковую, и способы получения твердой дисперсии и состава для перорального применения описываются более подробно ниже.
1. ТВЕРДАЯ ДИСПЕРСИЯ В СООТВЕТСТВИИ С НАСТОЯЩИМ ИЗОБРЕТЕНИЕМ
В настоящем изобретении предусматривается твердая дисперсия, применяемая для доставки таксана in vivo. Согласно одному варианту осуществления твердая дисперсия содержит таксан или его фармацевтически приемлемую соль, фармацевтически приемлемый полимер и фармацевтически приемлемое поверхностно-активное вещество.
(1) Таксан или его фармацевтически приемлемая соль
Таксан, используемый в твердой дисперсии по настоящему изобретению, включает без ограничения паклитаксел (Taxol), доцетаксел (Taxotere), кабазитаксел, ларотаксел, ортатаксел, тезетаксел и их комбинацию. Согласно некоторым вариантам осуществления таксан представляет собой паклитаксел или доцетаксел. Согласно дополнительным вариантам осуществления таксан представляет собой паклитаксел.
Фармацевтически приемлемые соли таксана, подходящие для применения в твердой дисперсии по настоящему изобретению, представляют собой традиционные нетоксичные соли и могут включать соль присоединения основания или соль присоединения кислоты, такую как соль на неорганической основе, например, соль щелочного металла (например, соль лития, соль натрия, соль калия и т.д.), соль щелочно-земельного металла (например, соль кальция, соль магния и т.д.), соль алюминия; соль на органической основе, например, органическая соль амина (например, соль триэтиламина, соль пиридина, соль пиколина, соль этаноламина, соль триэтаноламина, соль дициклогексиламина, соль N,N'-дибензилэтилендиамина и т.д.); соль присоединения неорганической кислоты (например, гидрохлорид, гидробромид, сульфат, фосфат и т.д.); соль присоединения органических карбоновой или сульфоновой кислоты (например, формиат, ацетат, трифторацетат, малеат, тартрат, метансульфонат, бензолсульфонат, п-толуолсульфонат и т.д.); соль присоединения основной или кислой аминокислоты (например, аргинина, аспарагиновой кислоты, глутаминовой кислоты к т.д.) и т.п.
Согласно некоторым вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 25-35 мг, 28-32 мг или 29-31 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит приблизительно 30 мг (например, 29,5-30,5 мг) таксана.
(2) Фармацевтически приемлемый полимер
Фармацевтически приемлемый полимер, используемый в качестве добавки в твердой дисперсии, может представлять собой гидрофильный полимер-носитель, который включает без ограничения полимеры на основе целлюлозы (например, гидроксипропил метилцеллюлозу (НРМС, гипромеллозу), этилцеллюлозу, гидроксиэтилцеллюлозу, гидроксиэтил метилцеллюлозу, гидроксипропилцеллюлозу, гипромеллозы фталат, ацетилцеллюлозу, ацетатфталат целлюлозы, метилцеллюлозу, этилцеллюлозу, целлюлозу, карбоксиметилцеллюлозу, микрокристаллическую целлюлозу, силикатизированную микрокристаллическую целлюлозу и т.д.), полимеры на основе крахмала (например, гидроксипропилкрахмал, виды крахмала (в том числе виды крахмала из любого источника, такого как кукуруза, картофель, рис, пшеница, которые могут быть полностью предварительно желатинизированы или частично желатинизированы)), полиэтиленгликоль, полиакриловую кислоту, полиакриламид, полиэтиленоксид, поливинилпирролидон, поливиниловый спирт, полигликолизированные глицериды, полиметакрилаты, гидроколлоиды (например, каррагинан, хитозан, альгиновую кислоту, гиалуроновую кислоту, пектиновую кислоту и т.д.).
Согласно некоторым вариантам осуществления в качестве типичного фармацевтически приемлемого полимера в твердой дисперсии по настоящему изобретению можно использовать поливинилпирролидон. Поливинилпирролидон может представлять собой растворимый в воде поливинилпирролидон со средней молекулярной массой 2000 или больше, предпочтительно 20000 или больше. Примеры поливинилпирролидона, применяемого в настоящем изобретении, включают Kollidon 12 PF (BASF, молекулярная масса 2000~3000), PVP K-15 (Ashland, молекулярная масса 6000~15000), Kollidon 25 (молекулярная масса 28000~34000), Kollidon 25 (молекулярная масса 44000~54000), PVP K-30 (молекулярная масса 40000~80000), PVP K-60 (молекулярная масса 240000~450000), Kollidon 90F (молекулярная масса 1000000~1500000), PVP K-90 (молекулярная масса 900000~1500000), PVP K-120 (молекулярная масса 2000000-3000000) и т.п. Согласно некоторым вариантам осуществления поливинилпирролидон представляет собой Kollidon 25, Kollidon 25 или поливинилпирролидон K-30 (PVP K-30), в частности, PVP K-30, который можно получить коммерческим путем.
Весовое соотношение фармацевтически приемлемого полимера (например, поливинилпирролидона) и таксана (например, паклитаксела) может находиться в диапазоне 2:1-9:1, 2:1-5:1, 2:1-4:1, 2,5:1-3,5:1, 2,6:1-3,4:1, 2,7:1-3,3:1, 2,8:1-3,2:1 или 2,9:1-3,1:1. Согласно дополнительным вариантам осуществления весовое соотношение составляет 2,8:1-3,2:1 или 2,9:1-3,1:1. Согласно дополнительным вариантам осуществления весовое соотношение составляет приблизительно 3:1.
Фармацевтически приемлемый полимер (например, поливинилпирролидон) можно применять в количестве 10-80% по весу, исходя из общего количества твердой дисперсии. Согласно дополнительным вариантам осуществления поливинилпирролидон используют в количестве 40-60% по весу, исходя из общего количества твердой дисперсии. Согласно дополнительным вариантам осуществления поливинилпирролидон используют в количестве приблизительно 50% (например, 45-55%) по весу, исходя из общего количества твердой дисперсии.
Согласно некоторым вариантам осуществления твердая дисперсия содержит фармацевтически приемлемый полимер (например, поливинилпирролидон) в количестве 60-180 мг, 70-150 мг, 80-120 мг, или 85-100 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит приблизительно 90 мг (например, 85-95 мг) фармацевтически приемлемого полимера.
(3) Фармацевтически приемлемое поверхностно-активное вещество
Фармацевтически приемлемое поверхностно-активное вещество, используемое в качестве добавки в твердой дисперсии, включает без ограничения полисорбат (например, полисорбат 20, полисорбат 40, полисорбат 80, полисорбат 85, полисорбат 60 и т.д.), полиоксил 20 стеарат, полиоксил 35 касторового масла, полоксамер, полиоксиэтиленсорбитан моноизостеарат, полиэтиленгликоль 40 сорбитандиизостеарат, полиоксил 40 гидрогенизированного касторового масла, полоксамер 331, полиоксиэтиленовые эфиры жирной кислоты, полиоксил 40 касторового масла, полоксамер 188, блок-сополимер полиоксиэтилена и полиоксипропилена 1800, олеиновую кислоту, дезоксихолат натрия, лаурилсульфат натрия, сорбитанмонолаурат, сорбитанмоноолеат, сорбитанмонопальмитат, сорбитан триолеат, N-карбамоил-метоксиполиэтиленгликоль 2000-1,2-дистеарол, миристиновую кислоту, стеарет, стеариновую кислоту, полиоксил 40 стеарат, полиоксил 60 стеарат, сахарозы стеарат, токоферол, полиоксил касторового масла, синтетический триглицерид, тримиристин, тристеарин, стеарат магния, лецитин, лаурилсульфат, витамин E, фосфатиды яичного желтка, докузат натрия, димиристоилфосфатидилглицерин, димиристоиллецитин, Capryol 90 (пропиленгликоля монокаприлат), Capryol PGMC (пропиленгликоля монокаприлат), дезоксихолат, холестерин, кремофор EL, альгинат пропиленгликоля, Croval А-10 (PEG 60 глицериды миндаля), Labrafil 1944 (олеил-макрогол-6-глицериды), Labrafil 2125 (линолеил-макрогол-6-глицериды), Labrasol (каприлокапроил-макрогол-8-глицериды), Lauroglycol 90 (монолаурат пропиленгликоля), Lauroglycol FCC (лаурат пропиленгликоля), стеарат кальция, лецитин Centromix E, лецитин Centrophase 152, лецитин Central 3F21B, РОЕ 26 глицерин, Olepal isosteariques (PEG-6 изостеарат), Plurol diisostearique (полиглицерил-3-диизостеарат), Plurol Oleique CC, РОЕ 20 сорбитан триолеат, Tagat TO (полиоксиэтиленглицеринтриолеат) или Solutol (макрогол-15 гидроксистеарат) или их смеси.
Согласно некоторым вариантам осуществления фармацевтически приемлемое поверхностно-активное вещество представляет собой Labrasol, полисорбат 20, полисорбат 80, PEG-витамин E, лаурилсульфат натрия, или кремофор, или их смесь. Согласно дополнительным вариантам осуществления фармацевтически приемлемое поверхностно-активное вещество представляет собой полисорбат, или лаурилсульфат натрия, или их смесь. Согласно дополнительным вариантам осуществления фармацевтически приемлемое поверхностно-активное вещество представляет собой полисорбат 80, или лаурилсульфат натрия, или их смесь. Согласно дополнительным вариантам осуществления фармацевтически приемлемое поверхностно-активное вещество представляет собой смесь на основе полисорбата, например, полисорбата 80 и лаурилсульфата натрия.
Весовое соотношение полисорбата и лаурилсульфата натрия может находиться в диапазоне 5:1-1:5, 4:1-1:4, 3:1-1:3, 2,5:1-1:2,5, 2:1-1:2, 1,8:1-1:1,8, 1,5:1-1:1,5, 1,2:1-1:1,2 или 1,1:1-1:1,1. Согласно некоторым вариантам осуществления весовое соотношение составляет 1,5:1-1:1,5, 1,2:1-1:1,2 или 1,1:1-1:1,1. Согласно дополнительным вариантам осуществления весовое соотношение составляет 1,1:1-1:1,1. Согласно дополнительным вариантам осуществления весовое соотношение составляет приблизительно 1:1.
Весовое соотношение таксана и фармацевтически приемлемого поверхностно-активного вещества может находиться в диапазоне 1:1-1:3, 1:1,5-1:2,5, 1:1,8-1:2,2 или 1:1,9-1:2,1. Согласно дополнительным вариантам осуществления весовое соотношение составляет 1:1,8-1:2,2 или 1:1,9-1:2,1. Согласно дополнительным вариантам осуществления весовое соотношение составляет приблизительно 1:2.
Вес фармацевтически приемлемого поверхностно-активного вещества (например, общий вес полисорбата и лаурилсульфата натрия) может составлять 10-50%, исходя из общего количества твердой дисперсии. Согласно некоторым вариантам осуществления вес фармацевтически приемлемого поверхностно-активного вещества (например, общий вес полисорбата и лаурилсульфата натрия) составляет 20-40%, исходя из общего количества твердой дисперсии. Согласно дополнительным вариантам осуществления вес фармацевтически приемлемого поверхностно-активного вещества (например, общий вес полисорбата и лаурилсульфата натрия) составляет 30-40%, исходя из общего количества твердой дисперсии. Согласно дополнительным вариантам осуществления вес фармацевтически приемлемого поверхностно-активного вещества (например, общий вес полисорбата и лаурилсульфата натрия) составляет приблизительно 33% (например, 30-36%), исходя из общего количества твердой дисперсии.
Согласно некоторым вариантам осуществления весовое соотношение в ряду таксан, полисорбат (например, полисорбат 80) и лаурилсульфат натрия составляет 1:1:1-1:1:3, 1:2:1-1:2:3, 1:3:1-1:3:3, 1:1:1-1:3:1, 1:1:2-1:3:2 или 1:1:3-1:3:3. Согласно дополнительным вариантам осуществления весовое соотношение составляет 1:1:1-1:1:2, 1:1:1-1:1:1,5, 1:1:1-1:1:1,2 или 1:1:1-1:1:1,1. Согласно другим вариантам осуществления весовое соотношение составляет 1:2:1-1:2:2, 1:2:1-1:2:1,5, 1:2:1-1:2:1,2 или 1:2:1-1:2:1,1. Согласно другим вариантам осуществления весовое соотношение составляет 1:3:1-1:3:2, 1:3:1-1:3:1,5, 1:3:1-1:3:1,2 или 1:3:1-1:3:1,1. Согласно другим вариантам осуществления весовое соотношение составляет 1:1:1-1:2:1, 1:1:1-1:1,5:1, 1:1:1-1:1,2:1 или 1:1:1-1:1,1:1. Согласно другим вариантам осуществления весовое соотношение составляет 1:1:2-1:2:2, 1:1:2-1:1,5:2, 1:1:2-1:1,2:2 или 1:1:2-1:1,1:2. Согласно другим вариантам осуществления весовое соотношение составляет 1:1:3-1:2:3, 1:1:3-1:1,5:3, 1:1:3-1:1,2:3 или 1:1:3-1:1,1:3. Согласно дополнительным вариантам осуществления весовое соотношение составляет приблизительно 1:1:1.
Согласно некоторым вариантам осуществления твердая дисперсия содержит фармацевтически приемлемое поверхностно-активное вещество в количестве 30-90 мг, 45-75 мг, 50-70 мг или 55-65 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит приблизительно 60 мг (например, 58-62 мг) фармацевтически приемлемого поверхностно-активного вещества.
Согласно некоторым вариантам осуществления твердая дисперсия содержит полисорбат (например, полисорбат 80) в количестве 0-60 мг, 15-45 мг, 20-40 мг или 25-35 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит приблизительно 30 мг (например, 28-32 мг) полисорбата (например, полисорбата 80).
Согласно некоторым вариантам осуществления твердая дисперсия содержит лаурилсульфат натрия в количестве 0-60 мг, 15-45 мг, 20-40 мг или 25-35 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит приблизительно 30 мг (например, 28-32 мг) лаурилсульфата натрия.
Согласно некоторым вариантам осуществления твердая дисперсия содержит таксан или его фармацевтически приемлемую соль, фармацевтически приемлемый полимер и фармацевтически приемлемое поверхностно-активное вещество, где весовое соотношение фармацевтически приемлемого полимера и таксана находится в диапазоне 2:1-9:1, а весовое соотношение таксана и фармацевтически приемлемого поверхностно-активного вещества находится в диапазоне 1:1-1:3, 1:1,5-1:2,5, 1:1,8-1:2,2 или 1:1,9-1:2,1. Согласно дополнительным вариантам осуществления весовое соотношение фармацевтически приемлемого полимера и таксана находится в диапазоне 2:1-5:1. Согласно дополнительным вариантам осуществления весовое соотношение фармацевтически приемлемого полимера и таксана находится в диапазоне 2:1-4:1. Согласно дополнительным вариантам осуществления весовое соотношение фармацевтически приемлемого полимера и таксана находится в диапазоне 2,5:1-3,5:1. Согласно дополнительным вариантам осуществления весовое соотношение фармацевтически приемлемого полимера и таксана находится в диапазоне 2,6:1-3,4:1. Согласно дополнительным вариантам осуществления весовое соотношение фармацевтически приемлемого полимера и таксана находится в диапазоне 2,7:1-3,3:1. Согласно дополнительным вариантам осуществления весовое соотношение фармацевтически приемлемого полимера и таксана находится в диапазоне 2,8:1-3,2:1. Согласно дополнительным вариантам осуществления весовое соотношение фармацевтически приемлемого полимера и таксана находится в диапазоне 2,9:1-3,1:1. Согласно дополнительным вариантам осуществления весовое соотношение фармацевтически приемлемого полимера и таксана составляет приблизительно 3:1.
Согласно некоторым вариантам осуществления твердая дисперсия содержит таксан или его фармацевтически приемлемую соль, фармацевтически приемлемый полимер и фармацевтически приемлемое поверхностно-активное вещество, где весовое соотношение фармацевтически приемлемого полимера и таксана находится в диапазоне 2:1-9:1, 2:1-5:1, 2:1-4:1, 2,5:1-3,5:1, 2,6:1-3,4:1, 2,7:1-3,3:1, 2,8:1-3,2:1 или 2,9:1-3,1:1, а весовое соотношение таксана и фармацевтически приемлемого поверхностно-активного вещества находится в диапазоне 1:1-1:3. Согласно дополнительным вариантам осуществления весовое соотношение таксана и фармацевтически приемлемого поверхностно-активного вещества составляет 1:1,5-1:2,5. Согласно дополнительным вариантам осуществления весовое соотношение таксана и фармацевтически приемлемого поверхностно-активного вещества составляет 1:1,8-1:2,2. Согласно дополнительным вариантам осуществления весовое соотношение таксана и фармацевтически приемлемого поверхностно-активного вещества составляет 1:1,9-1:2,1. Согласно дополнительным вариантам осуществления весовое соотношение таксана и фармацевтически приемлемого поверхностно-активного вещества составляет приблизительно 1:2.
Согласно некоторым вариантам осуществления твердая дисперсия содержит таксан или его фармацевтически приемлемую соль, фармацевтически приемлемый полимер и фармацевтически приемлемое поверхностно-активное вещество, где весовое соотношение фармацевтически приемлемого полимера и таксана составляет приблизительно 3:1 и весовое соотношение таксана и фармацевтически приемлемого поверхностно-активного вещества составляет приблизительно 1:2.
Согласно некоторым вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 25-35 мг, фармацевтически приемлемый полимер (например, поливинилпирролидон) в количестве 60-180 мг, полисорбат (например, полисорбат 80) в количестве 0-60 мг и лаурилсульфат натрия в количестве 0-60 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 28-32 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 29-31 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит приблизительно 30 мг (например, 29,5-30,5 мг) таксана.
Согласно некоторым вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 25-35 мг, фармацевтически приемлемый полимер (например, поливинилпирролидон) в количестве 70-150 мг, полисорбат (например, полисорбат 80) в количестве 0-60 мг и лаурилсульфат натрия в количестве 0-60 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 28-32 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 29-31 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит приблизительно 30 мг (например, 29,5-30,5 мг) таксана.
Согласно некоторым вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 25-35 мг, фармацевтически приемлемый полимер (например, поливинилпирролидон) в количестве 80-120 мг, полисорбат (например, полисорбат 80) в количестве 0-60 мг и лаурилсульфат натрия в количестве 0-60 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 28-32 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 29-31 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит приблизительно 30 мг (например, 29,5-30,5 мг) таксана.
Согласно некоторым вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 25-35 мг, фармацевтически приемлемый полимер (например, поливинилпирролидон) в количестве 85-100 мг, полисорбат (например, полисорбат 80) в количестве 0-60 мг и лаурилсульфат натрия в количестве 0-60 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 28-32 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 29-31 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит приблизительно 30 мг (например, 29,5-30,5 мг) таксана.
Согласно некоторым вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 25-35 мг, фармацевтически приемлемый полимер (например, поливинилпирролидон) в количестве приблизительно 90 мг (например, 85-95 мг), полисорбат (например, полисорбат 80) в количестве 0-60 мг и лаурилсульфат натрия в количестве 0-60 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 28-32 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 29-31 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит приблизительно 30 мг (например, 29,5-30,5 мг) таксана.
Согласно некоторым вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 25-35 мг, фармацевтически приемлемый полимер (например, поливинилпирролидон) в количестве 60-180 мг, полисорбат (например, полисорбат 80) в количестве 15-45 мг и лаурилсульфат натрия в количестве 0-60 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 28-32 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 29-31 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит приблизительно 30 мг (например, 29,5-30,5 мг) таксана.
Согласно некоторым вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 25-35 мг, фармацевтически приемлемый полимер (например, поливинилпирролидон) в количестве 60-180 мг, полисорбат (например, полисорбат 80) в количестве 20-40 мг и лаурилсульфат натрия в количестве 0-60 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 28-32 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 29-31 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит приблизительно 30 мг (например, 29,5-30,5 мг) таксана.
Согласно некоторым вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 25-35 мг, фармацевтически приемлемый полимер (например, поливинилпирролидон) в количестве 60-180 мг, полисорбат (например, полисорбат 80) в количестве 25-35 мг и лаурилсульфат натрия в количестве 0-60 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 28-32 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 29-31 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит приблизительно 30 мг (например, 29,5-30,5 мг) таксана.
Согласно некоторым вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 25-35 мг, фармацевтически приемлемый полимер (например, поливинилпирролидон) в количестве 60-180 мг, полисорбат (например, полисорбат 80) в количестве приблизительно 30 мг (например, 28-32 мг) и лаурилсульфат натрия в количестве 0-60 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 28-32 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 29-31 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит приблизительно 30 мг (например, 29,5-30,5 мг) таксана.
Согласно некоторым вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 25-35 мг, фармацевтически приемлемый полимер (например, поливинилпирролидон) в количестве 60-180 мг, полисорбат (например, полисорбат 80) в количестве 0-60 мг и лаурилсульфат натрия в количестве 15-45 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 28-32 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 29-31 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит приблизительно 30 мг (например, 29,5-30,5 мг) таксана.
Согласно некоторым вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 25-35 мг, фармацевтически приемлемый полимер (например, поливинилпирролидон) в количестве 60-180 мг, полисорбат (например, полисорбат 80) в количестве 0-60 мг и лаурилсульфат натрия в количестве 20-40 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 28-32 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 29-31 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит приблизительно 30 мг (например, 29,5-30,5 мг) таксана.
Согласно некоторым вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 25-35 мг, фармацевтически приемлемый полимер (например, поливинилпирролидон) в количестве 60-180 мг, полисорбат (например, полисорбат 80) в количестве 0-60 мг и лаурилсульфат натрия в количестве 25-35 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 28-32 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 29-31 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит приблизительно 30 мг (например, 29,5-30,5 мг) таксана.
Согласно некоторым вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 25-35 мг, фармацевтически приемлемый полимер (например, поливинилпирролидон) в количестве 60-180 мг, полисорбат (например, полисорбат 80) в количестве 0-60 мг и лаурилсульфат натрия в количестве приблизительно 30 мг (например, 28-32 мг). Согласно дополнительным вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 28-32 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 29-31 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит приблизительно 30 мг (например, 29,5-30,5 мг) таксана.
Согласно некоторым вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 25-35 мг, фармацевтически приемлемый полимер (например, поливинилпирролидон) в количестве 85-100 мг, полисорбат (например, полисорбат 80) в количестве 25-35 мг и лаурилсульфат натрия в количестве 25-35 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 28-32 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 29-31 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит приблизительно 30 мг (например, 29,5-30,5 мг) таксана.
Согласно некоторым вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 25-35 мг, фармацевтически приемлемый полимер (например, поливинилпирролидон) в количестве приблизительно 90 мг (например, 85-95 мг), полисорбат (например, полисорбат 80) в количестве приблизительно 30 мг (например, 28-32 мг) и лаурилсульфат натрия в количестве приблизительно 30 мг (например, 28-32 мг). Согласно дополнительным вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 28-32 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 29-31 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит приблизительно 30 мг (например, 29,5-30,5 мг) таксана.
Согласно некоторым вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 25-35 мг, фармацевтически приемлемый полимер (например, поливинилпирролидон) в количестве 90 мг, полисорбат (например, полисорбат 80) в количестве 30 мг и лаурилсульфат натрия в количестве 30 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 28-32 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит таксан (например, паклитаксел или доцетаксел) в количестве 29-31 мг. Согласно дополнительным вариантам осуществления твердая дисперсия содержит приблизительно 30 мг (например, 29,5-30,5 мг) таксана. Согласно дополнительным вариантам осуществления твердая дисперсия содержит 30 мг таксана.
Согласно некоторым вариантам осуществления твердая дисперсия характеризуется общим весом 150-210 мг, 160-200 мг или 170-190 мг. Согласно дополнительным вариантам осуществления твердая дисперсия характеризуется общим весом приблизительно 180 мг (например, 175-185 мг).
Твердая дисперсия по настоящему изобретению обладает различными преимущественными свойствами. Согласно некоторым вариантам осуществления твердая дисперсия по настоящему изобретению характеризуется улучшенной стабильностью при хранении (например, при 60°C). Согласно некоторым вариантам осуществления твердая дисперсия по настоящему изобретению содержит менее чем 1%, 0,7%, 0,6% или 0,5% примесей спустя 4 недели хранения при 60°C. Согласно некоторым вариантам осуществления твердая дисперсия по настоящему изобретению содержит менее чем 0,2% баккатина III спустя 4 недели хранения при 60°C. Согласно некоторым вариантам осуществления твердая дисперсия по настоящему изобретению содержит менее чем 0,05%, 0,02% или 0,01% 10-деацетилпаклитаксела спустя 4 недели хранения при 60°C. Согласно некоторым вариантам осуществления твердая дисперсия по настоящему изобретению содержит менее чем 0,2%, 0,15% или 0,1% 2-дебензоил-доцетаксел-2-пентеноата спустя 4 недели хранения при 60°C. Согласно некоторым вариантам осуществления твердая дисперсия по настоящему изобретению содержит менее чем 0,005%, 0,002% или 0,001% 2-дебензоилпаклитаксел-2-пентеноата спустя 4 недели хранения при 60°C. Согласно некоторым вариантам осуществления твердая дисперсия по настоящему изобретению содержит менее чем 0,005%, 0,002% или 0,001% 10-деацетил-7-эпипаклитаксела спустя 4 недели хранения при 60°C. Согласно некоторым вариантам осуществления твердая дисперсия по настоящему изобретению содержит менее чем 0,4% 7-эпипаклитаксела спустя 4 недели хранения при 60°C.
(4) Способ получения твердой дисперсии
Согласно настоящей заявке способ получения аморфной твердой дисперсии таксана предусматривает растворение таксана в достаточном количестве органического растворителя и смешивание полученного раствора с раствором, содержащим фармацевтически приемлемый полимер и фармацевтически приемлемое поверхностно-активное вещество, с получением тем самым раствора для распыления. Растворитель затем можно выпаривать, в результате чего остается лекарственное средство, диспергированное/растворенное в матрице. Твердая матрица содержит таксан, тонкодиспергированный (молекулярная дисперсия) таким образом, что растворение таксана является максимальным, с улучшением тем самым биодоступности таксана.
Согласно некоторым вариантам осуществления способ предусматривает стадии:
(a) растворения таксана или его фармацевтически приемлемой соли, фармацевтически приемлемого полимера и фармацевтически приемлемого поверхностно-активного вещества в растворителе и
(b) высушивания раствора, полученного на стадии (а).
Согласно некоторым вариантам осуществления стадия (а) включает: растворение таксана в достаточном количестве органического растворителя; растворение фармацевтически приемлемого полимера и фармацевтически приемлемого поверхностно-активного вещества в растворителе и смешивание двух растворов.
Согласно некоторым вариантам осуществления стадия (b) включает высушивание распылением. Согласно дополнительным вариантам осуществления стадия (b) включает высушивание распылением вместе с псевдоожиженным слоем.
Согласно некоторым вариантам осуществления способ может дополнительно включать стадию высушивания твердой дисперсии.
В частности, способ получения аморфной твердой дисперсии таксана с помощью методики высушивания распылением согласно настоящему изобретению предусматривает следующие стадии:
1. получения раствора для распыления, содержащего таксан, фармацевтически приемлемый полимер и фармацевтически приемлемое поверхностно-активное вещество;
2. образования твердой дисперсии путем распыления раствора из стадии 1) с помощью форсунки с получением твердой дисперсии;
3. собирания твердой дисперсии, полученной таким образом, и, при необходимости, высушивания.
Каждая из вышеупомянутых стадий способа по настоящему изобретению подробно описана ниже.
Стадия 1. Получение раствора для распыления, содержащего таксан, фармацевтически приемлемый полимер и фармацевтически приемлемое поверхностно-активное вещество
На стадии 1) раствор для распыления для получения твердой дисперсии получают путем смешивания раствора A: раствора органического растворителя, содержащего таксан, и раствора B: раствора водно-органического растворителя, содержащего фармацевтически приемлемый полимер и фармацевтически приемлемое поверхностно-активное вещество.
В соответствии с настоящим изобретением органический растворитель для растворения таксана в растворе A включает без ограничения спирт, галогеналкан, этилацетат, N,N-диметилформамид, DMSO, тетрагидрофуран или их смесь. Предпочтительно спиртом является C1-C3-спирт, такой как метанол, этанол, пропанол или изопропанол. Более предпочтительно спирт представляет собой этанол. Предпочтительно галогеналкан представляет собой C1-C3-алкан (например, метан, этан или пропан), замещенный 1, 2, 3 или 4 атомами галогена. Более предпочтительно галогеналкан представляет собой C1-C3-алкан (например, метан, этан или пропан), замещенный 1, 2, 3 или 4 атомами хлора. Более предпочтительно галогеналкан представляет собой дихлорметан, хлороформ или тетрахлорметан.
Кроме того, органический растворитель, применяемый в водно-органическом растворителе для растворения фармацевтически приемлемого полимера и фармацевтически приемлемого поверхностно-активного вещества в растворе B, включает без ограничения спирт, галогеналкан, этилацетат, N,N-диметилформамид, DMSO или тетрагидрофуран или их смесь. Согласно некоторым вариантам осуществления органический растворитель в растворе B является тем же органическим растворителем, что и в растворе A. Согласно другим вариантам осуществления органический растворитель в растворе B отличается от органического растворителя в растворе А. Предпочтительно органический растворитель в растворе B представляет собой спирт. Предпочтительно спиртом является C1-C3-спирт, такой как метанол, этанол, пропанол или изопропанол. Более предпочтительно спирт представляет собой этанол. Следовательно, водно-органический раствор в растворе B включает без ограничения этанол/воду, метанол/воду или изопропанол/воду, предпочтительно этанол/воду. Поскольку вышеупомянутые две системы растворителей можно легко смешивать друг с другом, их смесь образует гомогенный раствор.
Соотношение вес/вес органического растворителя и воды составляет 20:1-1:20, 10:1-1:10, 9:1-1:9, 8:1-1:8, 7:1-1:7, 6:1-1:6, 5:1-1:5, 4:1-1:4, 3:1-1:3, 2:1-1:2, 1,5:1-1:1,5, 1,3:1-1:1,3, 1,2/1-1:1,2 или 1,1:1-1:1,1. Согласно некоторым вариантам осуществления соотношение вес/вес составляет 5:1-1:5, 4:1-1:4, 3:1-1:3, 2:1-1:2, 1,5:1-1:1,5, 1,3:1-1:1,3, 1,2/1-1:1,2 или 1,1:1-1:1,1. Согласно дополнительным вариантам осуществления соотношение вес/вес составляет 2:1-1:2, 1,5:1-1:1,5, 1.3:1-1:1,3, 1,2/1-1:1,2 или 1,1:1-1:1,1. Согласно дополнительным вариантам осуществления соотношение вес/вес составляет 1,3:1-1:1,3, 1,2/1-1:1,2 или 1,1:1-1:1,1. Согласно дополнительным вариантам осуществления соотношение вес/вес составляет 1,1:1-1:1,1. Согласно дополнительным вариантам осуществления соотношение вес/вес составляет 1:05:1-1:1,05. Согласно дополнительным вариантам осуществления соотношение вес/вес составляет приблизительно 1:1.
Соотношение вес/вес органического растворителя в растворе A и водно-органического растворителя в растворе B составляет 9:1-1:9, 8:2-2:8, 7:3-3:7 или 6:4-4:6. Согласно некоторым вариантам осуществления соотношение вес/вес составляет 8:2-2:8, 7:3-3:7 или 6:4-4:6. Согласно дополнительным вариантам осуществления соотношение вес/вес составляет 7:3-3:7 или 6:4-4:6. Согласно дополнительным вариантам осуществления соотношение вес/вес составляет приблизительно 4:6.
Раствор A и раствор B можно смешивать путем добавления раствора A к раствору B или путем добавления раствора B к раствору А. Согласно некоторым вариантам осуществления раствор А медленно добавляют к раствору B. Согласно другим вариантам осуществления раствор B медленно добавляют к раствору A.
Стадия 2. Образование твердой дисперсии путем распыления раствора, полученного на стадии 1
На этой стадии растворитель можно удалять выпариванием с помощью методики высушивания распылением. Обычно используемый термин "высушивание распылением" в широком смысле относится к способам, включающим расщепление жидких смесей на мелкие капли (разбрызгивание) и незамедлительное удаление растворителя из смеси в установке для высушивания распылением, где присутствует мощная движущая сила для выпаривания растворителя из капель. В обычном способе высушивания распылением подаваемая жидкость может представлять собой раствор, суспензию, эмульсию, гель или пасту, при условии, что она поддается прокачиванию и может быть подвергнута разбрызгиванию.
Согласно одному варианту осуществления способ в соответствии с настоящим изобретением, как правило, осуществляется посредством обычной методики высушивания распылением. Способы высушивания распылением и оборудование для высушивания распылением в общем описаны в Perry's Chemical Engineers' Handbook, стр. 20-54 и 20-57 (Sixth Edition 1984). Более подробная информация о способах и оборудовании для высушивания распылением рассматриваются у Marshall "Atomization and Spray-Drying," 50 Chem. Eng. Prog. Monogr. Series 2 (1954) и Masters, Spray Drying Handbook (Fourth Edition 1985). Движущая сила для удаления или выпаривания растворителя обычно обеспечивается путем поддержания парциального давления растворителя в устройстве для высушивания распылением, значительно более низкого, чем давление пара растворителя при температуре высушивания капель.
В другом варианте осуществления в соответствии с настоящим изобретением способ получения твердой дисперсии представляет собой сочетание технологии псевдоожиженного слоя и технологии высушивания распылением.
Согласно технологии псевдоожиженного слоя, порошки, содержащие активный ингредиент, как правило суспендируют в восходящем потоке воздуха, при этом одновременно контролируемое и определенное количество жидкости вводят в поток порошка с получением смоченной формы или "агломерата" порошка; затем применяют умеренный нагрев для высушивания агломерированного порошка. После этой агломерации порошок обладает измененными характеристиками, в отличие от исходного порошка.
Согласно некоторым вариантам осуществления посредством сочетания технологии псевдоожиженного слоя и высушивания распылением частицы твердой дисперсии слаборастворимого в воде или практически нерастворимого в воде соединения получают путем тонкого распыления неводного раствора соединения (например, таксана) в нагретом и псевдоожиженном слое вспомогательных веществ-носителей. Полученный продукт представляет собой твердую дисперсию, состоящую из свободно-текучей смеси относительно крупных частиц гранул вспомогательных веществ-носителей и аморфного соединения (например, таксана).
Согласно некоторым вариантам осуществления этот способ предусматривает а) внесение вспомогательных веществ-носителей в сушилку с псевдоожиженным слоем; b) распыление раствора, полученного на стадии 1), по псевдоожиженному слою вспомогательных веществ. Согласно некоторым вариантам осуществления вспомогательные вещества-носители находятся в форме сухого порошка при внесении в псевдоожиженный слой. Согласно некоторым вариантам осуществления псевдоожиженный слой поддерживают при температуре от приблизительно 20°C до приблизительно 80°C, предпочтительно от приблизительно 25°C до приблизительно 50°C, в частности, от приблизительно 27°C до приблизительно 45°C.
Сушилка с псевдоожиженным слоем может содержать фармацевтические вспомогательные вещества в ходе процесса высушивания распылением. Это обеспечивает высушивание и образование твердых дисперсий на фармацевтических вспомогательных веществах внутри сушилки с псевдоожиженным слоем. Фармацевтические вспомогательные вещества в соответствии с настоящим изобретением включают без ограничения наполнители, разрыхлители, поверхностно-активные вещества, адсорбенты и смазывающие вещества.
Наполнители, применимые в соответствии с настоящим изобретением, включают без ограничения лактозу (безводную), моногидрат лактозы, высушенную распылением лактозу; прессуемый сахар, декстрозу, декстраты; виды крахмала (в том числе виды крахмала из любого источника, такого как кукуруза, картофель, рис, пшеница, которые могут быть полностью предварительно желатинизированы или частично желатинизированы); целлюлозу; неорганические соли, такие как фосфат кальция, трикальцийфосфат и сульфат кальция; и полиолы, такие как маннит, сорбит и ксилит.
Согласно некоторым вариантам осуществления микрокристаллическую целлюлозу применяют в псевдоожиженном слое сушилки с псевдоожиженным слоем при распылении раствора твердой дисперсии, содержащей таксан или его соль, на псевдоожиженный слой.
Согласно некоторым вариантам осуществления весовое соотношение твердой дисперсии и наполнителя в псевдоожиженном слое может составлять 1:1-1:10. Согласно дополнительным вариантам осуществления весовое соотношение может составлять 1:1-1:5.
Разрыхлители, применимые в соответствии с настоящим изобретением, включают без ограничения кроскармеллозу натрия, крахмалгликолят натрия, виды крахмала (в том числе виды крахмала из любого источника, такого как кукуруза, картофель, рис, пшеница, которые могут быть полностью предварительно желатинизированы или частично желатинизированы), кросповидон, альгинаты, такие как альгинат кальция и альгинат натрия, альгиновую кислоту и алюмосиликат магния.
Согласно некоторым вариантам осуществления кроскармеллозу натрия можно применять в псевдоожиженном слое сушилки с псевдоожиженным слоем при распылении раствора твердой дисперсии, содержащей таксан или его соль, на псевдоожиженный слой.
Согласно некоторым вариантам осуществления весовое соотношение твердой дисперсии и разрыхлителя в псевдоожиженном слое может составлять 1:1-1:10. Согласно дополнительным вариантам осуществления весовое соотношение может составлять 1:1-1:5. Согласно дополнительным вариантам осуществления весовое соотношение может составлять 1:1-1:2, 1:1,5-1:1,8 или 1:1,7-1:1,8. Согласно дополнительным вариантам осуществления весовое соотношение может составлять 1:1,7-1:1,8.
Согласно некоторым вариантам осуществления количество разрыхлителя в псевдоожиженном слое может составлять 250-350 мг, 280-330 мг или 290-320 мг. Согласно дополнительным вариантам осуществления количество разрыхлителя в псевдоожиженном слое может составлять приблизительно 310 мг (например, 300-320 мг).
Согласно некоторым вариантам осуществления комбинацию микрокристаллической целлюлозы и кроскармеллозы натрия применяют в псевдоожиженном слое сушилки с псевдоожиженным слоем при распылении раствора твердой дисперсии, содержащей таксан или его соль, на псевдоожиженный слой.
Согласно некоторым вариантам осуществления весовое соотношение наполнителя и разрыхлителя в псевдоожиженном слое может составлять 1:1-1:10. Согласно дополнительным вариантам осуществления весовое соотношение может составлять 1:2-1:5.
Поверхностно-активные вещества, используемые в соответствии с настоящим изобретением, включают без ограничения полисорбаты, полоксамеры, полиэтиленгликоли, соли желчных кислот, дезоксихолат натрия, лаурилсульфат натрия, токоферол, полиоксил касторового масла, лецитин, лаурилсульфат, витамин E, фосфатиды яичного желтка, докузат натрия, Capryol 90 (пропиленгликоля монокаприлат), Capryol PGMC (пропиленгликоля монокаприлат), дезоксихолат и холестерин. Согласно некоторым вариантам осуществления поверхностно-активное вещество представляет собой лаурилсульфат натрия, Labrasol, полисорбат 20, полисорбат 80, PEG-витамин E или их смеси. Согласно дополнительным вариантам осуществления поверхностно-активное вещество представляет собой лаурилсульфат натрия.
Согласно некоторым вариантам осуществления весовое соотношение твердой дисперсии и поверхностно-активного вещества в псевдоожиженном слое может составлять 20:1-1:10. Согласно дополнительным вариантам осуществления весовое соотношение может составлять 20:1-1:5. Согласно дополнительным вариантам осуществления весовое соотношение может составлять 20:1-1:1. Согласно дополнительным вариантам осуществления весовое соотношение может составлять 20:1-5:1. Согласно дополнительным вариантам осуществления весовое соотношение может составлять 15:1-5:1. Согласно дополнительным вариантам осуществления весовое соотношение может составлять 15:1-10:1. Согласно дополнительным вариантам осуществления весовое соотношение может составлять 15:1-12:1. Согласно дополнительным вариантам осуществления весовое соотношение может составлять приблизительно 12:1 (например, 13:1-11:1).
Согласно некоторым вариантам осуществления количество поверхностно-активного вещества в псевдоожиженном слое может составлять 1-100 мг, 2-80 мг, 3-50 мг, 4-40 мг, 5-30 мг, 6-20 мг или 8-15 мг. Согласно дополнительным вариантам осуществления количество поверхностно-активного вещества в псевдоожиженном слое может составлять приблизительно 14 мг (например, 13-15 мг).
Стадия 3. Собирание высушенной распылением твердой дисперсии
Как только распыление заканчивается, подачу и разбрызгивание останавливают, и полученную твердую дисперсию собирают, и, при необходимости, дополнительно высушивают в сушильном шкафу при 40~60°C, более предпочтительно при 40~50°C.
Результат анализа термохимических свойств твердой дисперсии по настоящему изобретению с помощью дифференциального сканирующего калориметра (DSC) показывает, что хотя для таксана в виде порошка был показан четкий эндотермический пик при температуре около 220°C, твердая дисперсия таксана по настоящему изобретению не продемонстрировала эндотермический пик. Следовательно, было подтверждено, что состав собранного таксана в виде порошка по настоящему изобретению представляет собой твердую дисперсию с измененным расположением молекул (аморфное или некристаллическое состояние). Полученная твердая дисперсия может быть составлена в виде фармацевтических композиций, характеризующихся высокой биодоступностью.
2. ФАРМАЦЕВТИЧЕСКИЙ СОСТАВ В СООТВЕТСТВИИ С НАСТОЯЩИМ ИЗОБРЕТЕНИЕМ
Составы для перорального применения по настоящему изобретению предпочтительно находятся в форме капсул, таблеток, пилюль, дисперсий, растворов или суспензий. Терапевтически эффективную пероральную дозу для составов по настоящему изобретению определяют с помощью стандартных клинических методик в соответствии с заключением практикующего врача. Например, помимо информации, представленной в медицинских справочных изданиях и фармацевтической литературе, для установления оптимальных доз можно применять хорошо известные анализы in vitro или in vivo.
Согласно некоторым вариантам осуществления настоящее изобретение предусматривает таблетку, содержащую аморфную твердую дисперсию по настоящему изобретению, внутригранулярное вспомогательное вещество и внегранулярное вспомогательное вещество.
Таблетку, содержащую аморфную твердую дисперсию по настоящему изобретению, можно получать путем смешивания аморфной твердой дисперсии с внутригранулярным вспомогательным веществом и внегранулярным вспомогательным веществом, а затем путем прессования полученной смеси с образованием таблетки. В таблетке аморфную твердую дисперсию можно использовать в количестве 15-50% по весу, исходя из общего веса таблетки. Согласно некоторым вариантам осуществления аморфную твердую дисперсию используют в количестве 20-30% по весу, исходя из общего веса таблетки. Согласно дополнительным вариантам осуществления аморфную твердую дисперсию используют в количестве приблизительно 25% (например, 24-28%) по весу, исходя из общего веса таблетки.
В дополнение к твердой дисперсии таблетка по настоящему изобретению может дополнительно содержать наполнители, разрыхлители, смазывающие вещества, поверхностно-активные вещества или их комбинацию. Согласно некоторым вариантам осуществления внегранулярное вспомогательное вещество включает наполнители, разрыхлители, смазывающие вещества, поверхностно-активные вещества или их комбинации. Согласно некоторым вариантам осуществления внегранулярное вспомогательное вещество включает наполнители, смазывающие вещества или их комбинации. Согласно некоторым вариантам осуществления внутригранулярное вспомогательное вещество включает наполнители, разрыхлители, смазывающие вещества, поверхностно-активные вещества или их комбинации. Согласно некоторым вариантам осуществления внутригранулярное вспомогательное вещество включает разрыхлители, поверхностно-активные вещества или их комбинации.
Наполнители, применимые в соответствии с настоящим изобретением, включают без ограничения лактозу (безводную), моногидрат лактозы, высушенную распылением лактозу; прессуемый сахар, декстрозу, декстраты; виды крахмала (в том числе виды крахмала из любого источника, такого как кукуруза, картофель, рис, пшеница, которые могут быть полностью предварительно желатинизированы или частично желатинизированы); целлюлозу; неорганические соли, такие как фосфат кальция, трикальцийфосфат и сульфат кальция; и полиолы, такие как маннит, сорбит и ксилит. Согласно некоторым вариантам осуществления наполнитель представляет собой микрокристаллическую целлюлозу. Согласно некоторым вариантам осуществления внегранулярное вспомогательное вещество включает микрокристаллическую целлюлозу.
Согласно некоторым вариантам осуществления наполнитель может находиться в количестве 10-40% по весу, исходя из общего веса таблетки. Согласно дополнительным вариантам осуществления наполнитель может находиться в количестве 15-35%. Согласно дополнительным вариантам осуществления наполнитель может находиться в количестве 20-30%. Согласно дополнительным вариантам осуществления наполнитель может находиться в количестве приблизительно 28% (например, 26-30%).
Согласно некоторым вариантам осуществления наполнитель может находиться в количестве 70-300 мг. Согласно дополнительным вариантам осуществления наполнитель может находиться в количестве 100-250 мг. Согласно дополнительным вариантам осуществления наполнитель может находиться в количестве 150-230 мг. Согласно дополнительным вариантам осуществления наполнитель может находиться в количестве приблизительно 210 мг (например, 200-220 мг).
Смазывающие вещества, применимые в соответствии с настоящим изобретением, включают без ограничения стеарат магния, стеарат кальция, стеарат цинка, стеариновую кислоту, стеарилфумарат натрия, гидрогенизированные растительные масла, минеральное масло, полиэтиленгликоли, тальк, глицерил бегенат, глицерил моностеарат, глицерил пальмитостеарат, лейцин и лаурилсульфат магния. Согласно некоторым вариантам осуществления смазывающее вещество представляет собой стеарилфумарат натрия. Согласно некоторым вариантам осуществления внегранулярное вспомогательное вещество содержит стеарилфумарат натрия.
Согласно некоторым вариантам осуществления смазывающее вещество может находиться в количестве 0,5-2% по весу, исходя из общего веса таблетки. Согласно дополнительным вариантам осуществления смазывающее вещество может находиться в количестве 0,75-1%. Согласно дополнительным вариантам осуществления смазывающее вещество может находиться в количестве приблизительно 0,8% (например, 0,72-0,88% или 0,77-0,84%).
Согласно некоторым вариантам осуществления смазывающее вещество может находиться в количестве 3-15 мг. Согласно дополнительным вариантам осуществления смазывающее вещество может находиться в количестве 5-7 мг. Согласно дополнительным вариантам осуществления смазывающее вещество может находиться в количестве приблизительно 6 мг (например, 5,5-6,5 мг).
Разрыхлители, применимые в соответствии с настоящим изобретением, включают без ограничения кроскармеллозу натрия, крахмалгликолят натрия, виды крахмала (в том числе виды крахмала из любого источника, такого как кукуруза, картофель, рис, пшеница, полностью предварительно желатинизированные или частично желатинизированные), кросповидон, альгинаты, такие как альгинат кальция и альгинат натрия, альгиновую кислоту и алюмосиликат магния. Согласно некоторым вариантам осуществления разрыхлитель представляет собой кроскармеллозу натрия. Согласно некоторым вариантам осуществления внутригранулярное вспомогательное вещество содержит кроскармеллозу натрия.
Согласно некоторым вариантам осуществления разрыхлитель может находиться в количестве 30-60% по весу, исходя из общего веса таблетки. Согласно дополнительным вариантам осуществления разрыхлитель может находиться в количестве 35-50%. Согласно дополнительным вариантам осуществления разрыхлитель может находиться в количестве приблизительно 40% (например, 38-44%).
Согласно некоторым вариантам осуществления разрыхлитель может находиться в количестве 250-350 мг. Согласно дополнительным вариантам осуществления разрыхлитель может находиться в количестве 280-330 мг. Согласно дополнительным вариантам осуществления разрыхлитель может находиться в количестве 290-320 мг. Согласно дополнительным вариантам осуществления разрыхлитель может находиться в количестве приблизительно 310 мг (например, 300-320 мг).
Поверхностно-активные вещества, используемые в качестве добавки в настоящем изобретении, включают без ограничения полисорбат, полоксамер, лаурилсульфат натрия, токоферол, лецитин, лаурилсульфат, витамин E, фосфатиды яичного желтка, докузат натрия, Capryol, Labrafil, Labrasol, Lauroglycol, Solutol (макрогол-15 гидроксистеарат) и их смеси. Согласно некоторым вариантам осуществления поверхностно-активные вещества включают полисорбаты, лаурилсульфат натрия, Labrasol и лецитин. Согласно дополнительным вариантам осуществления поверхностно-активное вещество представляет собой лаурилсульфат натрия. Согласно некоторым вариантам осуществления внутригранулярное вспомогательное вещество содержит лаурилсульфат натрия.
Согласно некоторым вариантам осуществления поверхностно-активное вещество может находиться в количестве 1-3%. Согласно дополнительным вариантам осуществления поверхностно-активное вещество может находиться в количестве 1,5-2,5%. Согласно дополнительным вариантам осуществления поверхностно-активное вещество может находиться в количестве приблизительно 1,8% (например, 1,7-1,9%).
Согласно некоторым вариантам осуществления поверхностно-активное вещество может находиться в количестве 4-40 мг. Согласно дополнительным вариантам осуществления поверхностно-активное вещество может находиться в количестве 5-30 мг. Согласно дополнительным вариантам осуществления поверхностно-активное вещество может находиться в количестве 6-20 мг. Согласно дополнительным вариантам осуществления поверхностно-активное вещество может находиться в количестве 8-15 мг. Согласно дополнительным вариантам осуществления поверхностно-активное вещество может находиться в количестве приблизительно 14 мг (например, 13-15 мг).
Согласно способу по настоящему изобретению внутригранулярное вспомогательное вещество может быть выбрано из группы, состоящей из микрокристаллической целлюлозы, кроскармеллозы натрия, лаурилсульфата натрия и их смеси, и внегранулярное вспомогательное вещество может быть выбрано из группы, состоящей из микрокристаллической целлюлозы, кроскармеллозы натрия, стеарилфумарата натрия и их смеси. Согласно способу по настоящему изобретению внутригранулярное вспомогательное вещество может быть выбрано из группы, состоящей из кроскармеллозы натрия, лаурилсульфата натрия и их смеси, и внегранулярное вспомогательное вещество может быть выбрано из группы, состоящей из микрокристаллической целлюлозы, стеарилфумарата натрия и их смеси.
Согласно некоторым вариантам осуществления внегранулярное вспомогательное вещество содержит микрокристаллическую целлюлозу и стеарилфумарат натрия. Согласно дополнительным вариантам осуществления внегранулярное вспомогательное вещество содержит микрокристаллическую целлюлозу в количестве 10-40% и стеарилфумарат натрия в количестве 0,5-2% по весу, исходя из общего веса таблетки. Согласно дополнительным вариантам осуществления внегранулярное вспомогательное вещество содержит микрокристаллическую целлюлозу в количестве 15-35% и стеарилфумарат натрия в количестве 0,75-1% по весу, исходя из общего веса таблетки. Согласно дополнительным вариантам осуществления внегранулярное вспомогательное вещество содержит микрокристаллическую целлюлозу в количестве приблизительно 25% и стеарилфумарат натрия в количестве приблизительно 0,8%» по весу, исходя из общего веса таблетки.
Согласно некоторым вариантам осуществления аморфная твердая дисперсия находится в количестве 15-50% по весу, исходя из общего веса таблетки. Согласно дополнительным вариантам осуществления аморфная твердая дисперсия находится в количестве 18-40% по весу, исходя из общего веса таблетки. Согласно дополнительным вариантам осуществления аморфная твердая дисперсия находится в количестве 20-30% по весу, исходя из общего веса таблетки. Согласно дополнительным вариантам осуществления аморфная твердая дисперсия находится в количестве приблизительно 25% (например, 23-27%) по весу, исходя из общего веса таблетки.
Согласно некоторым вариантам осуществления аморфная твердая дисперсия в таблетке имеет общий вес 150-210 мг, 160-200 мг или 170-190 мг. Согласно дополнительным вариантам осуществления твердая дисперсия имеет общий вес приблизительно 180 мг (например, 175-185 мг).
Согласно некоторым вариантам осуществления внегранулярное вспомогательное вещество содержит микрокристаллическую целлюлозу и стеарилфумарат натрия. Согласно дополнительным вариантам осуществления внегранулярное вспомогательное вещество содержит микрокристаллическую целлюлозу в количестве 70-300 мг и стеарилфумарат натрия в количестве 3-15 мг. Согласно дополнительным вариантам осуществления внегранулярное вспомогательное вещество содержит микрокристаллическую целлюлозу в количестве 100-250 мг и стеарилфумарат натрия в количестве 5-7 мг. Согласно дополнительным вариантам осуществления внегранулярное вспомогательное вещество содержит микрокристаллическую целлюлозу в количестве 150-230 мг и стеарилфумарат натрия в количестве 5-7 мг. Согласно дополнительным вариантам осуществления внегранулярное вспомогательное вещество содержит микрокристаллическую целлюлозу в количестве приблизительно 210 мг и стеарилфумарат натрия в количестве приблизительно 6 мг.
Согласно некоторым вариантам осуществления внутригранулярное вспомогательное вещество содержит кроскармеллозу натрия и лаурилсульфат натрия. Согласно дополнительным вариантам осуществления внутригранулярное вспомогательное вещество содержит кроскармеллозу натрия в количестве 30-60% и лаурилсульфат натрия в количестве 1-3% по весу, исходя из общего веса таблетки. Согласно дополнительным вариантам осуществления внутригранулярное вспомогательное вещество содержит кроскармеллозу натрия в количестве 35-50% и лаурилсульфат натрия в количестве 1,5-2,5% по весу, исходя из общего веса таблетки. Согласно дополнительным вариантам осуществления внутригранулярное вспомогательное вещество содержит кроскармеллозу натрия в количестве приблизительно 40% и лаурилсульфат натрия в количестве приблизительно 1,8% по весу, исходя из общего веса таблетки.
Согласно некоторым вариантам осуществления внутригранулярное вспомогательное вещество содержит кроскармеллозу натрия и лаурилсульфат натрия. Согласно дополнительным вариантам осуществления внутригранулярное вспомогательное вещество содержит кроскармеллозу натрия в количестве 250-350 мг и лаурилсульфат натрия в количестве 4-40 мг. Согласно дополнительным вариантам осуществления внутригранулярное вспомогательное вещество содержит кроскармеллозу натрия в количестве 280-330 мг и лаурилсульфат натрия в количестве 5-30 мг. Согласно дополнительным вариантам осуществления внутригранулярное вспомогательное вещество содержит кроскармеллозу натрия в количестве 290-320 мг и лаурилсульфат натрия в количестве 6-20 мг. Согласно дополнительным вариантам осуществления внутригранулярное вспомогательное вещество содержит кроскармеллозу натрия в количестве приблизительно 310 мг и лаурилсульфат натрия в количестве приблизительно 14 мг.
Согласно некоторым вариантам осуществления таблетка по настоящему изобретению может дополнительно содержать слабую кислоту. Слабые кислоты, используемые в качестве добавки в таблетке, включают без ограничения лимонную кислоту, аскорбиновую кислоту, уксусную кислоту и молочную кислоту. Согласно некоторым вариантам осуществления слабая кислота представляет собой лимонную кислоту или аскорбиновую кислоту или их смесь. Согласно некоторым вариантам осуществления слабая кислота представляет собой смесь лимонной кислоты и аскорбиновой кислоты. Согласно дополнительным вариантам осуществления соотношение лимонной кислоты и аскорбиновой кислоты составляет 0:1-1:0. Согласно дополнительным вариантам осуществления соотношение составляет приблизительно 1:1.
Согласно некоторым вариантам осуществления состав для перорального применения по настоящему изобретению может дополнительно содержать покрывающее средство, такое как покрывающие средства на основе сахара, растворимые в воде пленкообразователи, кишечнорастворимые покрывающие средства и покрывающие средства для таблеток с отсроченным высвобождением, или покрывающую композицию, содержащую любую их комбинацию. Согласно некоторым вариантам осуществления покрывающее средство может представлять собой любое покрывающее средство, известное из уровня техники. Примеры покрывающих средств включают без ограничения сахарозу, применяемую отдельно или вместе с любым из средств, таких как тальк, карбонат кальция, фосфат кальция, сульфат кальция, желатин, гуммиарабик, поливинилпирролидон и пуллулан, или любую их комбинацию; производные целлюлозы, такие как гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза, гидроксиэтилметилцеллюлоза и карбоксиметилцеллюлоза натрия; синтетические полимеры, такие как поливинилацетата диэтиламиноацетат, сополимеры аминоалкилметакрилата и поливинилпирролидон; полисахариды, такие как пуллулан; фталат гидроксипропилметилцеллюлозы; гидроксипропилметилцеллюлозы ацетата сукцинат; карбоксиметил(этил)целлюлоза; ацетатфталат целлюлозы; производные акриловой кислоты, такие как сополимер метакриловой кислоты L, сополимер метакриловой кислоты LD и сополимер метакриловой кислоты S; природные вещества, такие как шеллак; диоксид титана; поливиниловый спирт (например, Opadry®); полиэтиленгликоль; тальк; лецитин; и/или их комбинации. Согласно одному варианту осуществления покрывающее средство выбрано из гидроксипропилцеллюлозы, гидроксипропилметилцеллюлозы, гидроксиэтилцеллюлозы, гидроксиэтилметилцеллюлозы, карбоксиметилцеллюлозы натрия, поливинилацетата, диэтиламиноацетата, поливинилового спирта, полиэтиленгликоля и лецитина или их комбинации. Согласно дополнительным вариантам осуществления покрывающее средство представляет собой Opadry®.
Согласно некоторым вариантам осуществления покрывающее средство может находиться в количестве 1-5%. Согласно дополнительным вариантам осуществления покрывающее средство может находиться в количестве 1,5-3,5% по весу, исходя из общего веса таблетки. Согласно дополнительным вариантам осуществления покрывающее средство может находиться в количестве приблизительно 2,8% (например, 2,6-3,0%).
Согласно некоторым вариантам осуществления покрывающее средство может находиться в количестве 10-50 мг. Согласно дополнительным вариантам осуществления покрывающее средство может находиться в количестве 15-40 мг. Согласно дополнительным вариантам осуществления покрывающее средство может находиться в количестве 18-30 мг. Согласно дополнительным вариантам осуществления покрывающее средство может находиться в количестве 18-25 мг. Согласно дополнительным вариантам осуществления покрывающее средство может находиться в количестве приблизительно 21 мг (например, 19-23 мг).
Согласно некоторым вариантам осуществления таблетка по настоящему изобретению содержит твердую дисперсию таксана, раскрытую в данном документе, внутригранулярное вспомогательное вещество, раскрытое в данном документе, и внегранулярное вспомогательное вещество, раскрытое в данном документе.
Согласно некоторым вариантам осуществления таблетка по настоящему изобретению содержит (1) твердую дисперсию таксана, содержащую таксан (например, паклитаксел или доцетаксел) в количестве приблизительно 30 мг, фармацевтически приемлемый полимер (например, поливинилпирролидон) в количестве приблизительно 90 мг, полисорбат (например, полисорбат 80) в количестве приблизительно 30 мг и лаурилсульфат натрия в количестве приблизительно 30 мг, (2) внутригранулярное вспомогательное вещество, содержащее кроскармеллозу натрия в количестве приблизительно 310 мг и лаурилсульфат натрия в количестве приблизительно 14 мг, и (3) внегранулярное вспомогательное вещество, содержащее микрокристаллическую целлюлозу в количестве приблизительно 210 мг и стеарилфумарат натрия в количестве приблизительно 6 мг.
Согласно некоторым вариантам осуществления таблетку, содержащую аморфную твердую дисперсию таксана по настоящему изобретению, можно получать с помощью способа, который предусматривает стадии:
(a) растворения таксана или его фармацевтически приемлемой соли, фармацевтически приемлемого полимера и фармацевтически приемлемого поверхностно-активного вещества в растворителе с получением раствора и затем удаления растворителя из раствора с получением твердой дисперсии;
(b) смешивания вместе твердой дисперсии из стадии (а) внутригранулярного вспомогательного вещества и внегранулярного вспомогательного вещества и
(c) прессования смеси из стадии (b) с образованием таблетки.
Согласно некоторым вариантам осуществления стадия (а) включает: растворение таксана в достаточном количестве органического растворителя; растворение фармацевтически приемлемого полимера и фармацевтически приемлемого поверхностно-активного вещества в растворителе и смешивание двух растворов.
Согласно некоторым вариантам осуществления стадия (а) включает высушивание распылением. Согласно дополнительным вариантам осуществления стадия (а) включает высушивание распылением в комбинации с псевдоожиженным слоем. Согласно дополнительным вариантам осуществления псевдоожиженный слой содержит внутригранулярное вспомогательное вещество.
Согласно некоторым вариантам осуществления таблетку, содержащую аморфную твердую дисперсию таксана по настоящему изобретению, можно получать с помощью способа, который предусматривает стадии:
(a) растворения таксана или его фармацевтически приемлемой соли, фармацевтически приемлемого полимера и фармацевтически приемлемого поверхностно-активного вещества в растворителе с получением раствора и затем удаления растворителя из раствора с получением твердой дисперсии;
(b) смешивания твердой дисперсии из стадии (а) вместе с внутригранулярным вспомогательным веществом;
(c) смешивания смеси из стадии (b) вместе с внегранулярным вспомогательным веществом и
(d) прессования смеси из стадии (с) с образованием таблетки.
Согласно некоторым вариантам осуществления стадия (а) включает: растворение таксана в достаточном количестве органического растворителя; растворение фармацевтически приемлемого полимера и фармацевтически приемлемого поверхностно-активного вещества в растворителе и смешивание двух растворов.
Согласно некоторым вариантам осуществления твердую дисперсию смешивают с внутригранулярным вспомогательным веществом в псевдоожиженном слое. Согласно некоторым вариантам осуществления внутригранулярное вспомогательное вещество добавляют в псевдоожиженный слой перед смешиванием его с твердой дисперсией. Согласно некоторым вариантам осуществления внутригранулярное вспомогательное вещество добавляют в псевдоожиженный слой, когда раствор для распыления из стадии (а) распыляется на псевдоожиженный слой.
Согласно некоторым вариантам осуществления таблетку, содержащую аморфную твердую дисперсию таксана по настоящему изобретению, можно получать с помощью способа, который предусматривает стадии:
(a) растворения таксана или его фармацевтически приемлемой соли, фармацевтически приемлемого полимера и фармацевтически приемлемого поверхностно-активного вещества в растворителе с получением раствора и затем удаления растворителя из раствора, например, выпариванием с применением технологии высушивания распылением в псевдоожиженном слое, где псевдоожиженный слой содержит внутригранулярное вспомогательное вещество, с получением твердой дисперсии;
(b) смешивания твердой дисперсии вместе с внегранулярным вспомогательным веществом и
(c) прессования полученной смеси с образованием таблетки.
Таблетки, один из примеров твердых лекарственных форм для перорального применения, особенно пригодные при практическом осуществлении настоящего изобретения, включают такие, выбранные из группы, состоящей из IR таблеток, CR таблеток, SR таблеток, покрытых IR таблеток, матричных таблеток, покрытых матричных таблеток, слоистых таблеток, покрытых слоистых таблеток, слоистых матричных таблеток и покрытых слоистых матричных таблеток.
Предпочтительная твердая лекарственная форма для перорального применения представляет собой лекарственную форму с немедленным высвобождением, которая незамедлительно распадается в полости желудка и высвобождает лекарственное средство и вспомогательные вещества в область желудка для повышения абсорбции энтероцитами. Предпочтительная лекарственная форма в виде таблетки представляет собой лекарственную форму в виде таблетки, покрытой пленочной оболочкой.
Таблетку по настоящему изобретению можно покрывать пленочной оболочкой с помощью покрывающего средства. Примерами покрывающего средства являются гидроксипропилметилцеллюлоза, этилцеллюлоза и т.д. Покрывающее средство может содержать, например, кроющее средство, такое как оксид титана, или пластификатор, такой как полиэтиленгликоль.
3. СПОСОБ ВВЕДЕНИЯ В СООТВЕТСТВИИ С НАСТОЯЩИМ ИЗОБРЕТЕНИЕМ
Предусматривается способ введения таксана нуждающемуся в этом субъекту, включающий: получение фармацевтического твердого дозированного состава для перорального применения, содержащего: таксан или его фармацевтически приемлемую соль, фармацевтически приемлемый полимер и фармацевтически приемлемое поверхностно-активное вещество, полученного в виде твердой дисперсии, и введение фармацевтического состава в терапевтически эффективном количестве нуждающемуся в этом субъекту.
Способ можно применять для перорального введения таксана пациентам с заболеванием, связанным с клеточной пролиферацией, таким как рак, в том числе без ограничения карцинома яичника человека, рак молочной железы, злокачественная лимфома, рак легкого, меланома и саркома Капоши.
В контексте данного документа выражение "нарушение, связанное с клеточной пролиферацией" относится к состояниям, при которых неконтролируемый или аномальный рост клеток, или как то, так и другое, могут привести к развитию нежелательного состояния или заболевания, которое может быть или может не быть раковым. Типичные нарушения, связанные с клеточной пролиферацией, по настоящему изобретению охватывают ряд состояний, при которых нарушена регуляция клеточного деления. Типичные нарушения, связанные с клеточной пролиферацией, включают без ограничения злокачественные новообразования, доброкачественные опухоли, злокачественные опухоли, предраковые состояния, in situ опухоли, инкапсулированные опухоли, метастазирующие опухоли, опухоли кроветворной и лимфоидной ткани, солидные опухоли, опухоли, связанные с иммунной системой, гемобластозы, виды рака, виды карциномы, виды лейкоза, виды лимфомы, виды саркомы и быстро делящиеся клетки. Выражение "быстро делящаяся клетка" в контексте данного документа определено как любая клетка, которая делится со скоростью, превосходящей или превышающей скорость, ожидаемую или наблюдаемую среди соседних или расположенных рядом клеток в пределах этой же ткани. Нарушение, связанное с клеточной пролиферацией, включает предрак или предраковое состояние. Нарушение, связанное с клеточной пролиферацией, включает рак. Предпочтительно предусмотренные в данном документе способы применяют для лечения или облегчения симптома рака. Выражение "рак" включает солидные опухоли, а также гемобластозы и/или злокачественные новообразования. "Предраковая клетка" или "предопухолевая клетка" представляет собой клетку, обнаруживаемую при нарушении, связанном с клеточной пролиферацией, которое является предраковым или предопухолевым состоянием. "Раковая клетка" или "опухолевая клетка" представляет собой клетку, обнаруживаемую при нарушении, связанном с клеточной пролиферацией, которое является раком. Для выявления раковых клеток или предопухолевых клеток можно применять любые воспроизводимые способы измерения. Раковые клетки или предопухолевые клетки можно выявлять с помощью гистологического типирования или оценки степени злокачественности образца ткани (например, биоптата). Раковые клетки или предопухолевые клетки можно выявлять путем применения соответствующих молекулярных маркеров.
Типичные не относящиеся к раку состояния или нарушения включают без ограничения ревматоидный артрит; воспаление; аутоиммунное заболевание; лимфопролиферативные состояния; ревматоидный спондилит; остеоартрит; подагру, другие состояния, связанные с суставами; сепсис; септический шок; эндотоксический шок; сепсис, вызванный грамотрицательной флорой; синдром токсического шока; астму; синдром расстройства дыхания у взрослых; хроническое обструктивное заболевание легких; хроническое воспаление легких; воспалительное заболевание кишечника; болезнь Крона; псориаз; экзему; язвенный колит; фиброз поджелудочной железы; фиброз печени; острую и хроническую почечную недостаточность; синдром раздраженного кишечника; гипертермию; рестеноз; церебральную малярию; инсульт и ишемию; травму нервной системы; болезнь Альцгеймера; болезнь Хантингтона; болезнь Паркинсона; острую и хроническую боль; аллергический ринит; аллергический конъюнктивит; хроническую сердечную недостаточность; острый коронарный синдром; кахексию; малярию; лепру; лейшманиоз; болезнь Лайма; синдром Рейтера; острый синовит; мышечную дегенерацию, бурсит; тендинит; тендовагинит; грыжевой, разорвавшийся диск или синдром ущемленного межпозвоночного диска; остеопетроз; тромбоз; рестеноз; силикоз; легочный саркоидоз; заболевание, связанное с костной резорбцией, такое как остеопороз; реакция «трансплантат против хозяина»; рассеянный склероз; волчанку; фибромиалгию; СПИД и другие вирусные заболевания, такие как опоясывающий герпес, простой герпес I или II типа, заболевание, вызванное вирусом гриппа и цитомегаловирусом; и сахарный диабет.
Типичные виды рака включают без ограничения адренокортикальную карциному, СПИД-ассоциированные виды рака, СПИД-ассоциированную лимфому, рак анальной области, рак аноректальной области, рак анального канала, рак аппендикса, астроцитому мозжечка у детей, астроцитому головного мозга у детей, базалиому, рак кожи (отличный от меланомы), рак желчных протоков, рак внепеченочных желчных протоков, рак внутрипеченочных желчных протоков, рак мочевого пузыря, опухоль мочевого пузыря, рак костей и суставов, остеогенную саркому и злокачественную фиброзную гистиоцитому, рак головного мозга, опухоль головного мозга, глиому ствола головного мозга, астроцитому мозжечка, астроцитому головного мозга/злокачественную глиому, эпендимому, медуллобластому, супратенториальные примитивные нейроэктодермальные опухоли, глиому зрительного нерва и глиому гипоталамуса, рак молочной железы, бронхиальные аденомы/карциноиды, карциноидную опухоль, рак желудочно-кишечного тракта, рак нервной системы, лимфому нервной системы, рак центральной нервной системы, лимфому центральной нервной системы, рак шейки матки, виды рака у детей, хронический лимфоцитарный лейкоз, хронический миелолейкоз, хронические миелопролиферативные нарушения, рак толстой кишки, колоректальный рак, Т-клеточная лимфома кожи, лимфосаркому, грибовидную гранулему, синдром Сезари, рак эндометрия, рак пищевода, внекраниальную герминогенную опухоль, внегонадную герминогенную опухоль, рак внепеченочных желчных протоков, рак глаза, внутриглазную меланому, ретинобластому, рак желчного пузыря, рак желудочно-кишечного тракта (рак желудка), карциноиды желудочно-кишечного тракта, стромальную опухоль желудочно-кишечного тракта (GIST), герминогенную опухоль, герминогенную опухоль яичника, гестационную трофобластическую опухоль, глиому, рак головы и шеи, гепатоцеллюлярный рак (рак печени), лимфому Ходжкина, гипофарингиальный рак, внутриглазную меланому, злокачественные новообразования глаза, опухоли островков поджелудочной железы (эндокринной ткани поджелудочной железы), саркому Капоши, рак почки, карциному почки, рак гортани, острый лимфобластный лейкоз, острый миелолейкоз, хронический лимфоцитарный лейкоз, хронический миелолейкоз, волосатоклеточный лейкоз, рак губы и полости рта, рак печени, рак легких, немелкоклеточный рак легкого, мелкоклеточный рак легкого, СПИД-ассоциированную лимфому, неходжкинскую лимфому, первичную лимфому центральной нервной системы, болезнь Вальденстрема, медуллобластому, меланому, внутриглазную меланому (меланому глаза), карциному из клеток Меркеля, злокачественную мезотелиому, мезотелиому, метастазирующий плоскоклеточный рак шеи, рак ротовой полости, рак языка, синдром множественной эндокринной неоплазии, грибовидную гранулему, миелодиспластические синдромы, миелодиспластические/миелопролиферативные заболевания, хронический миелолейкоз, острый миелолейкоз, миеломную болезнь, хронические миелопролиферативные нарушения, рак носоглотки, нейробластому, рак области рта, рак полости рта, рак ротоглотки, рак яичников, карцинома яичников, пограничная опухоль яичника, рак поджелудочной железы, рак из островковых клеток поджелудочной железы, рак придаточных пазух носа и носовой полости, рак паращитовидной железы, рак полового члена, фарингеальный рак, феохромацитому, пинеобластому и супратенториальные примитивные нейроэктодермальные опухоли, опухоль гипофиза, плазмоклеточную опухоль/миеломную болезнь, легочную бластому, рак предстательной железы, рак прямой кишки, переходноклеточный рак почечной лоханки и мочеточника, ретинобластому, рабдомиосаркому, рак слюнной железы, семейство опухолей типа саркомы Юинга, саркому Капоши, саркому мягких тканей, рак матки, саркому матки, рак кожи (отличный от меланомы), рак кожи (меланому), карциному из клеток Меркеля, рак тонкого кишечника, саркому мягких тканей, плоскоклеточную карциному, рак желудка (рак желудочно-кишечного тракта), супратенториальные примитивные нейроэктодермальные опухоли, рак яичка, рак горла, тимому, тимому и рак вилочковой железы, рак щитовидной железы, переходноклеточный рак почечной лоханки и мочеточника и других органов мочевой системы, гестационную трофобластическую опухоль, рак уретры, рак эндометрия, саркому матки, рак тела матки, рак влагалища, рак наружных половых женских органов и опухоль Вильма.
Таксан вводят отдельно или в комбинации с другими терапевтическими средствами, которые могут действовать с таксаном синергично.
Согласно дополнительным вариантам осуществления настоящее изобретение охватывает способы перорального введения таблетки, содержащей аморфную твердую дисперсию, содержащую таксан, и дополнительное терапевтическое средство. Согласно дополнительному варианту осуществления настоящее изобретение охватывает способы перорального введения таблетки, содержащей аморфную твердую дисперсию, содержащую таксан, нуждающемуся в этом пациенту, дополнительного терапевтического средства и ингибитора р-гликопротеина.
"Субъект" включает млекопитающих, например, людей, домашних животных (например, собак, котов, птиц и т.п.), сельскохозяйственных животных (например, коров, овец, свиней, коней, домашнюю птицу и т.п.) и лабораторных животных (например, крыс, мышей, морских свинок, птиц и т.п.). Согласно одному варианту осуществления субъектом является человек. Согласно одному варианту осуществления субъектом является ребенок (например, весом от приблизительно 30 кг до приблизительно 70 кг). Согласно одному варианту осуществления ребенок был подвержен гепатикоеюностомии по Касаи, при этом гепатикоеюностомия по Касаи у ребенка является эффективной для обеспечения функционального желчного протока в случае рождения ребенка без желчного протока или если при рождении желчный проток полностью блокирован.
В контексте данного документа выражение "приблизительно" или "примерно" и т.п. означает, что значение, к которому оно относится, может изменяться до определенной степени. Например, значение может изменяться на 10%, 5%, 2% или 1%. Согласно некоторым вариантам осуществления значение может изменяться на 5%, 2% или 1%. Например, подразумевается, что "приблизительно 5" включают любое значение от 4,5 до 5,5, или от 4,75 до 5,25, или от 4,9 до 5,1, или от 4,95 до 5,05.
В контексте данного документа фраза "фармацевтически приемлемый" относится к тем соединениям, материалам, композициям, носителям и/или лекарственным формам, которые в результате тщательной медицинской оценки подходят для применения в контакте с тканями людей и животных без чрезмерной токсичности, раздражения, аллергической реакции или другой проблемы или осложнения, соответствующим целесообразному соотношению польза/риск.
"Лечение" включает любой эффект, например, ослабление, уменьшение, модуляцию или устранение, который в результате приводит к улучшению состояния, заболевания, нарушения и т.д. "Лечение" или "осуществление лечения" болезненного состояния включает: ингибирование болезненного состояния, то есть прекращение развития болезненного состояния или его клинических симптомов; или облегчение болезненного состояния, то есть вызывание временной или окончательной ремиссии болезненного состояния или его клинических симптомов.
Выражение "эффективное количество" в контексте данного документа относится к количеству обетихолевой кислоты (например, лиганда, активирующего FXR), которое дает немедленный или хронический терапевтический эффект при введении соответствующей дозы. Эффект включает предупреждение, изменение, ингибирование или купирование симптомов, признаков, а также лежащей в основе патологии заболевания/состояния (например, фиброза печени, почки или кишечника) и сопутствующих осложнений, до любой определяемой степени.
"Терапевтически эффективное количество" означает количество обетихолевой кислоты, которое при введении млекопитающему для лечения заболевания является достаточным для получения эффекта такого лечения в отношении заболевания. "Терапевтически эффективное количество" будет варьировать в зависимости от обетихолевой кислоты, заболевания и его тяжести, а также возраста, веса и т.д. млекопитающего, подлежащего лечению.
Терапевтически эффективное количество можно оценивать предварительно либо в анализах с культурами клеток, либо в животных моделях, как правило, крыс, мышей, кроликов, собак или свиней. Животную модель также можно применять для определения соответствующего диапазона концентраций и пути введения. Такие данные затем можно применять для определения пригодных доз и путей введения для людей. Терапевтическая/профилактическая эффективность и токсичность может быть определена с помощью стандартных процедур в области фармацевтики в культурах клеток или на экспериментальных животных, например, ED50 (терапевтически эффективная доза для 50% популяции) и LD50 (летальная доза для 50% популяции). Соотношение доз, вызывающих токсичный и терапевтический эффекты, представляет собой терапевтический индекс, и при этом он может быть выражен в виде соотношения LD50/ED50. Фармацевтические композиции, характеризующиеся большими терапевтическими индексами, являются предпочтительными. Дозировка может варьировать в пределах данного диапазона в зависимости от используемой лекарственной формы, чувствительности пациента и пути введения.
Все публикации и патентные документы, цитируемые в данном документе, включены в данный документ с помощью ссылки, как если бы каждая такая публикация или документ были конкретно и отдельно указаны как включенные в данный документ с помощью ссылки. Цитирование публикаций и патентных документов не следует рассматривать как признание того, что любое из указанного относится к предшествующему уровню техники, а также не означает признание относительно содержания или даты публикации. Настоящее изобретение, описанное посредством письменного описания, позволяет специалисту в данной области понять, что настоящее изобретение может быть реализовано на практике в виде различных вариантов осуществления, и что вышеуказанное описание и примеры ниже приведены в иллюстративных целях и не ограничивают прилагаемую ниже формулу изобретения.
В настоящем описании формы единственного числа включают также формы множественного числа, если из контекста явно не следует иное. Если не указано иное, все технические и научные термины, используемые в данном документе, имеют то же значение, обычно понятное специалисту средней квалификации в области, к которой относится настоящее изобретение. В случае противоречия настоящее описание будет преимущественным.
Если не указано иное, все процентные значения и соотношения, используемые в данном документе, представлены по весу.
ПРИМЕРЫ
Настоящее раскрытие дополнительно проиллюстрировано следующими примерами, которые не должны быть истолкованы как ограничивающие настоящее раскрытие в отношении объема или сущности до конкретных процедур, описанных в настоящем документе. Следует понимать, что примеры приведены с целью иллюстрации некоторых вариантов осуществления и не подразумевают никаких ограничений в отношении объема настоящего раскрытия. Также следует понимать, что применение может иметь различные другие варианты осуществления, модификации и эквиваленты, которые могут быть предложены специалистам в данной области, не выходя за пределы сущности настоящего изобретения и/или объема прилагаемой формулы изобретения.
Примеры 1 и 2. Получение твердых дисперсий с различными типами полимеров
Твердые дисперсии из примеров 1 и 2, представленные в таблице 1, получали с помощью традиционного способа высушивания распылением с применением традиционной распылительной сушилки. Два различных полимера, НРМС и PVP, применяли для получения твердых дисперсий паклитаксела.
Высушивание распылением осуществляли в распылительной сушилке Buchi Mini. Подаваемый материал подвергали разбрызгиванию через форсунку со следующими условиями высушивания распылением: температура на входе 65°C, температура на выходе 45°C, давление при разбрызгивании 0,5 бар и интенсивность потока разбрызгивания 10% с 80% степенью распыления. Каждый раствор получали при 10% общем содержании твердых веществ в 3:2 (вес : вес) этанол:вода. Высушенные распылением образцы затем высушивали в вакуумном сушильном шкафу в течение по меньшей мере 2 часов при 50°C.
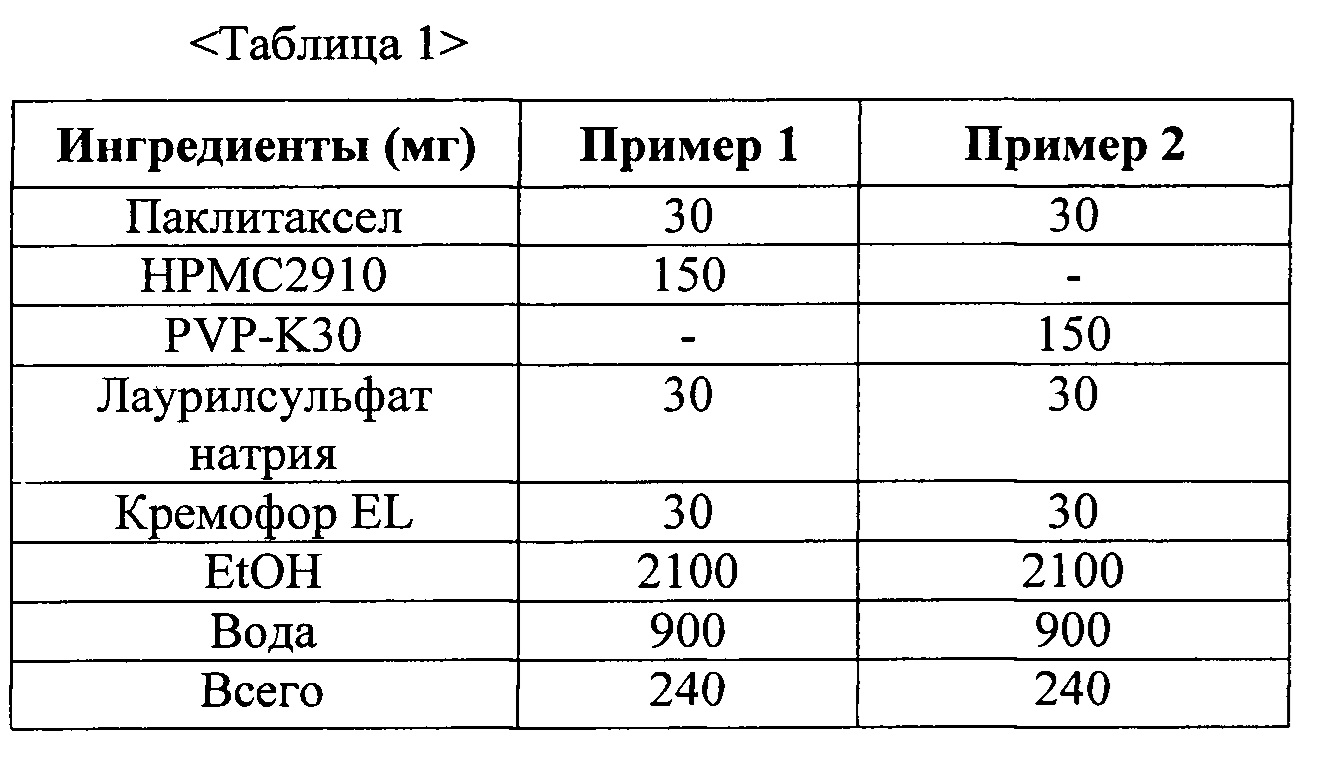
Примеры 3-6. Получение твердых дисперсий с различными типами поверхностно-активных веществ
Твердые дисперсии из примеров 3-6, представленные в таблице 2, получали с помощью вышеупомянутого традиционного способа высушивания распылением. Различные типы поверхностно-активных веществ применяли для получения твердых дисперсий паклитаксела.
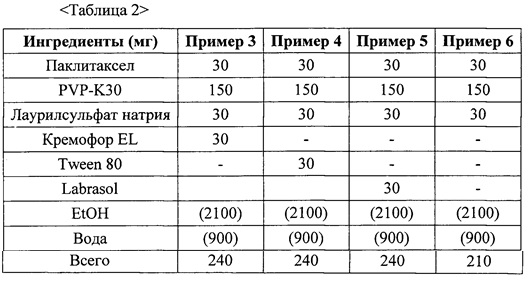
Примеры 7-10. Получение твердых дисперсий с различными количествами полимеров
Твердые дисперсии из примеров 7-10, представленные в таблице 3, получали с помощью вышеупомянутого традиционного способа высушивания распылением. Различные количества полимеров применяли для получения твердых дисперсий паклитаксела.
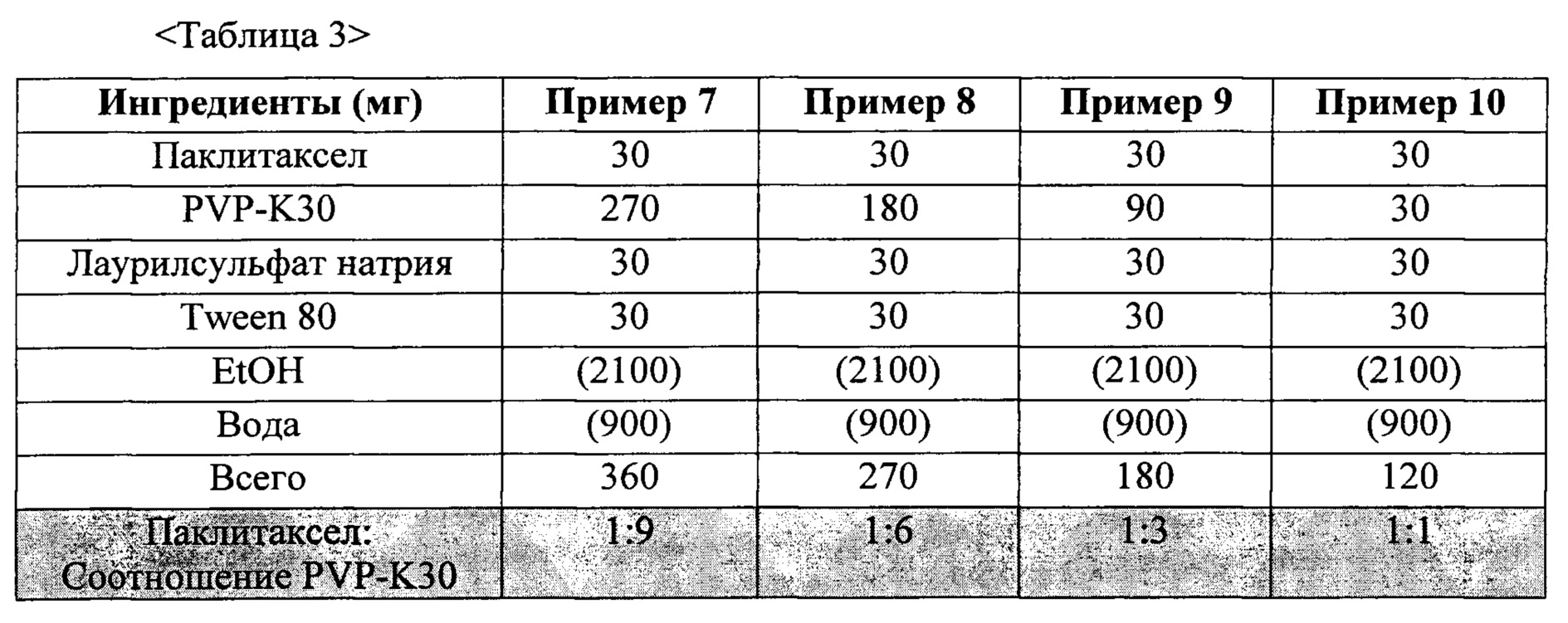
Пример 11. Получение твердой дисперсии с помощью технологии высушивания распылением
Твердую дисперсию из примера 11, представленную в таблице 4, получали с применением традиционного способа высушивания распылением, упомянутого в примере 1. Содержание паклитаксела в готовой твердой дисперсии было эквивалентным 30 мг на 210 мг порошкообразной смеси.
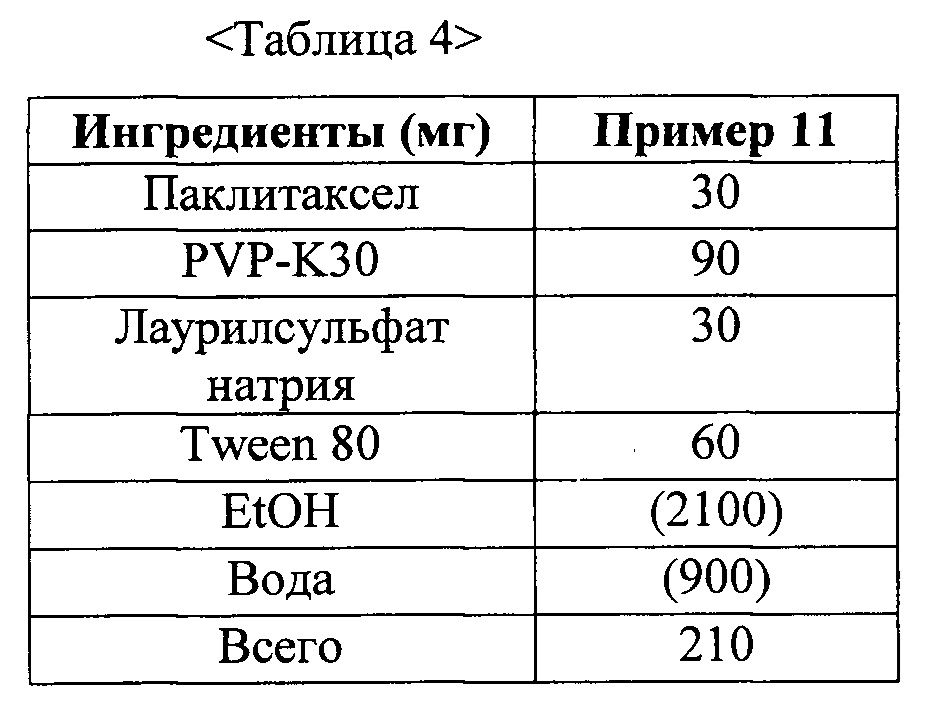
Пример 12. Получение твердой дисперсии с помощью технологии псевдоожиженного слоя
<Пример 12-1>. Получение твердой дисперсии, содержащей паклитаксел
Твердую дисперсию из примера 12-1, представленную в таблице 5, получали с применением технологии высушивания распылением в псевдоожиженном слое. Раствор для распыления получали путем растворения паклитаксела, PVP-K30, полисорбата 80 и лаурилсульфата натрия в системе растворителей этанол/вода. Раствор распыляли в 434 г смесь вспомогательных веществ, приведенных в таблице 5, в системе с псевдоожиженным слоем. Скорость распыления составляла 15~25 мл/мин с применением верхнего распылителя. Статическое давление на входе составляло 2,5-5 бар (250-500 кПа). Температура на входе составляла 65~70°C и температура продукта составляла 30-40°C. Полученная порошкообразная смесь на основе паклитаксела была свободно-текучей и содержала 30 мг паклитаксела на 644 мг конечной смеси.
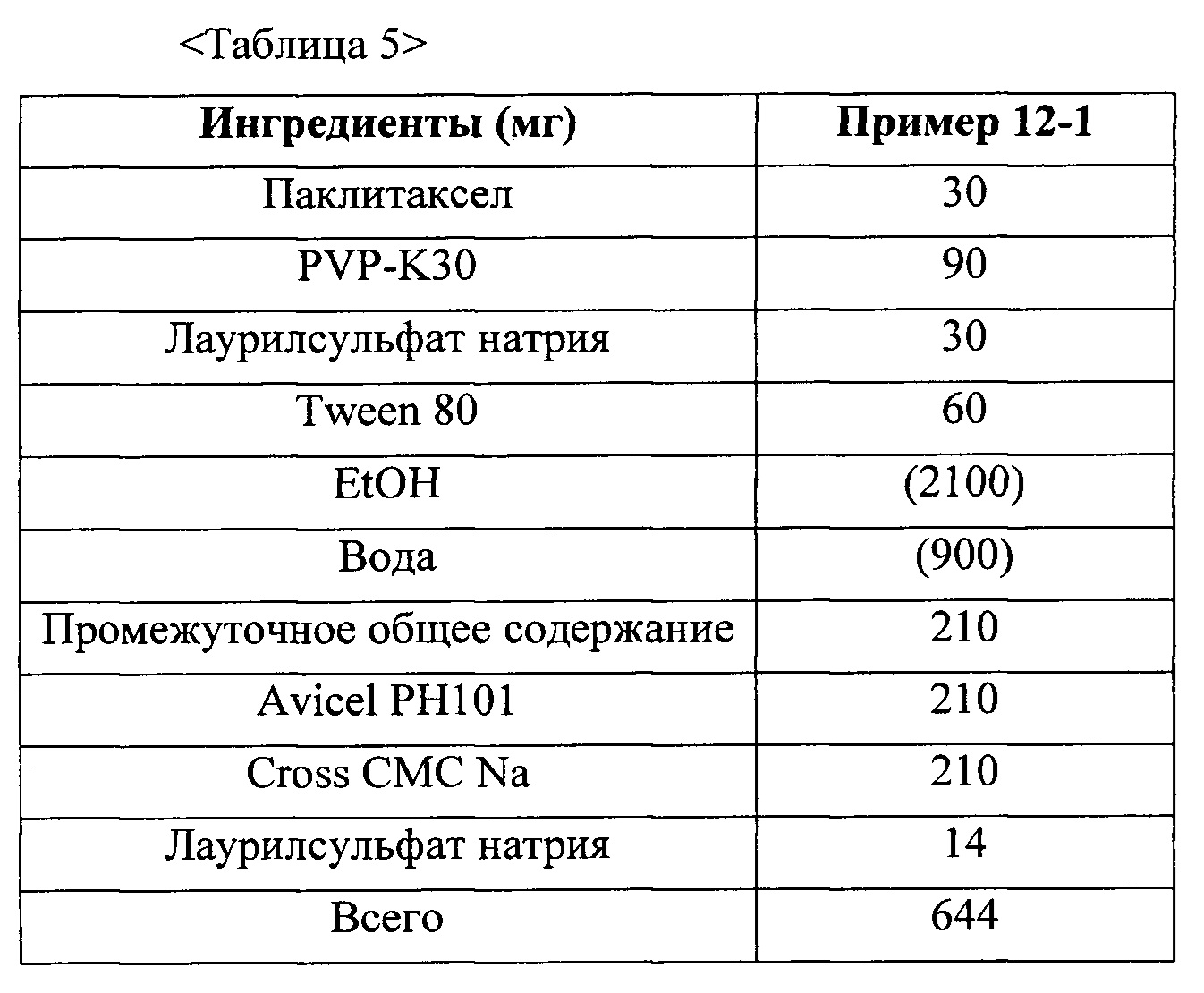
<Примеры 12-2-12-4>. Получение твердой дисперсии, содержащей различные типы таксанов
Твердые дисперсии из примеров 12-2-12-4, содержащие таксаны, отличные от паклитаксела, представленные в таблице 6, получали с применением технологии высушивания распылением в псевдоожиженном слое. Раствор для распыления получали путем растворения доцетаксела (кабазитаксела или тезетаксела), PVP-K30, полисорбата 80 и лаурилсульфата натрия в системе растворителей этанол/вода. Раствор распыляли в 434 г смеси вспомогательных веществ, приведенных в таблице 6, в системе с псевдоожиженным слоем. Скорость распыления составляла 15~25 мл/мин с применением верхнего распылителя. Статическое давление на входе составляло 2,5-5 бар (250-500 кПа). Температура на входе составляла 65~70°C и температура продукта составляла 30-40°C. Полученная порошкообразная смесь на основе таксана была свободно-текучей и содержала 30 мг таксана на 644 мг конечной смеси.
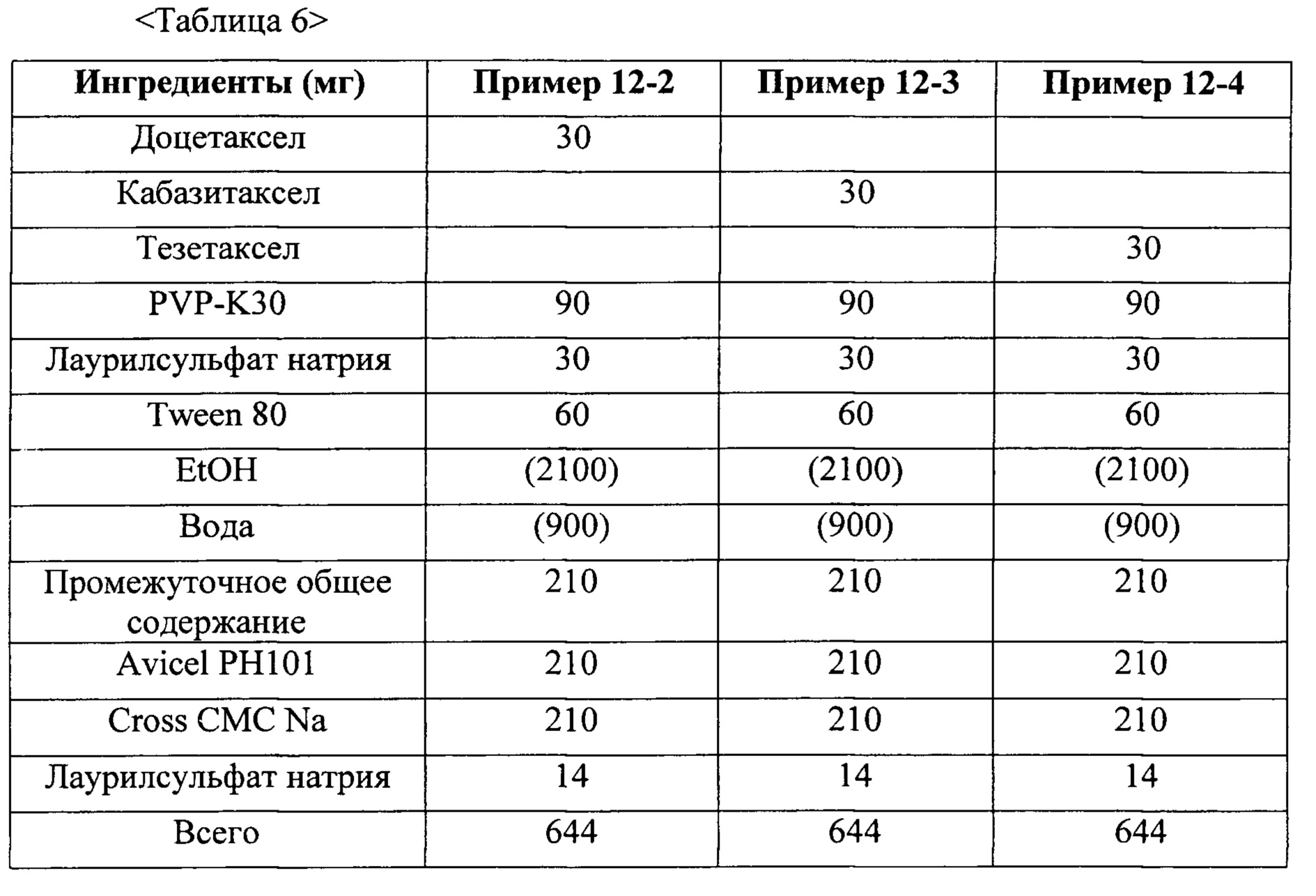
Сравнительный пример 1. Получение жидкого состава, содержащего паклитаксел
Жидкий состав, содержащий паклитаксел, получали с применением ингредиентов, приведенных в таблице 7. В частности, паклитаксел в качестве активного ингредиента полностью растворяли в Tween 80 в качестве поверхностно-активного вещества с применением магнитной мешалки.
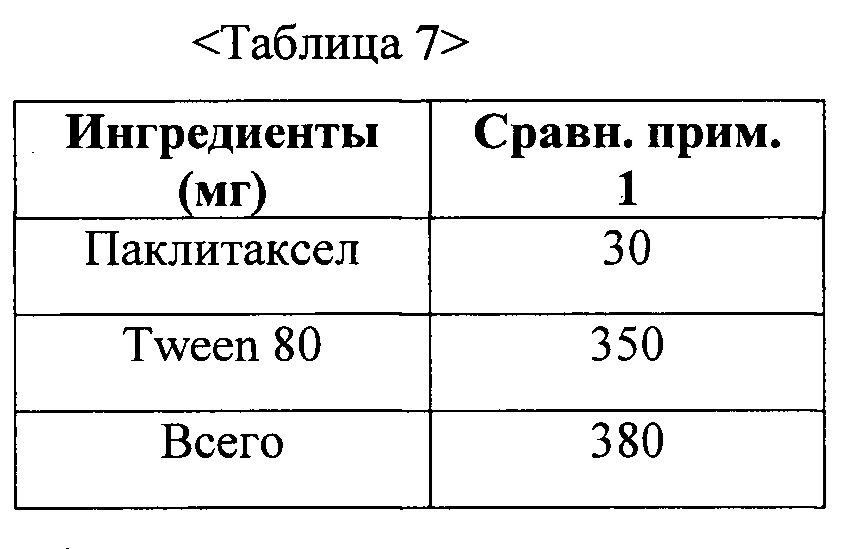
Пример 13. Получение таблетки, содержащей твердую дисперсию из примера 11
Таблетку получали с применением твердой дисперсии из примера 11, как показано в таблице 8.
Как только распыление заканчивалось, твердую дисперсию из примера 11 смешивали с внутригранулярным вспомогательным веществом, и к смеси гранул добавляли часть смазывающего вещества, и получали таблетки для процесса брикетирования с твердостью менее чем 2 кп. Брикет затем пропускали через сито №20. К этому брикету затем добавляли остаточное количество смазывающего вещества и внегранулярного вспомогательного вещества, а также хорошо перемешивали и получали конечные таблетки с помощью таблетировочной машины. Полученные таблетки были продолговатыми с толщиной около 6,90 мм, диаметром около 15,83 мм и твердостью около 2~5 кп.
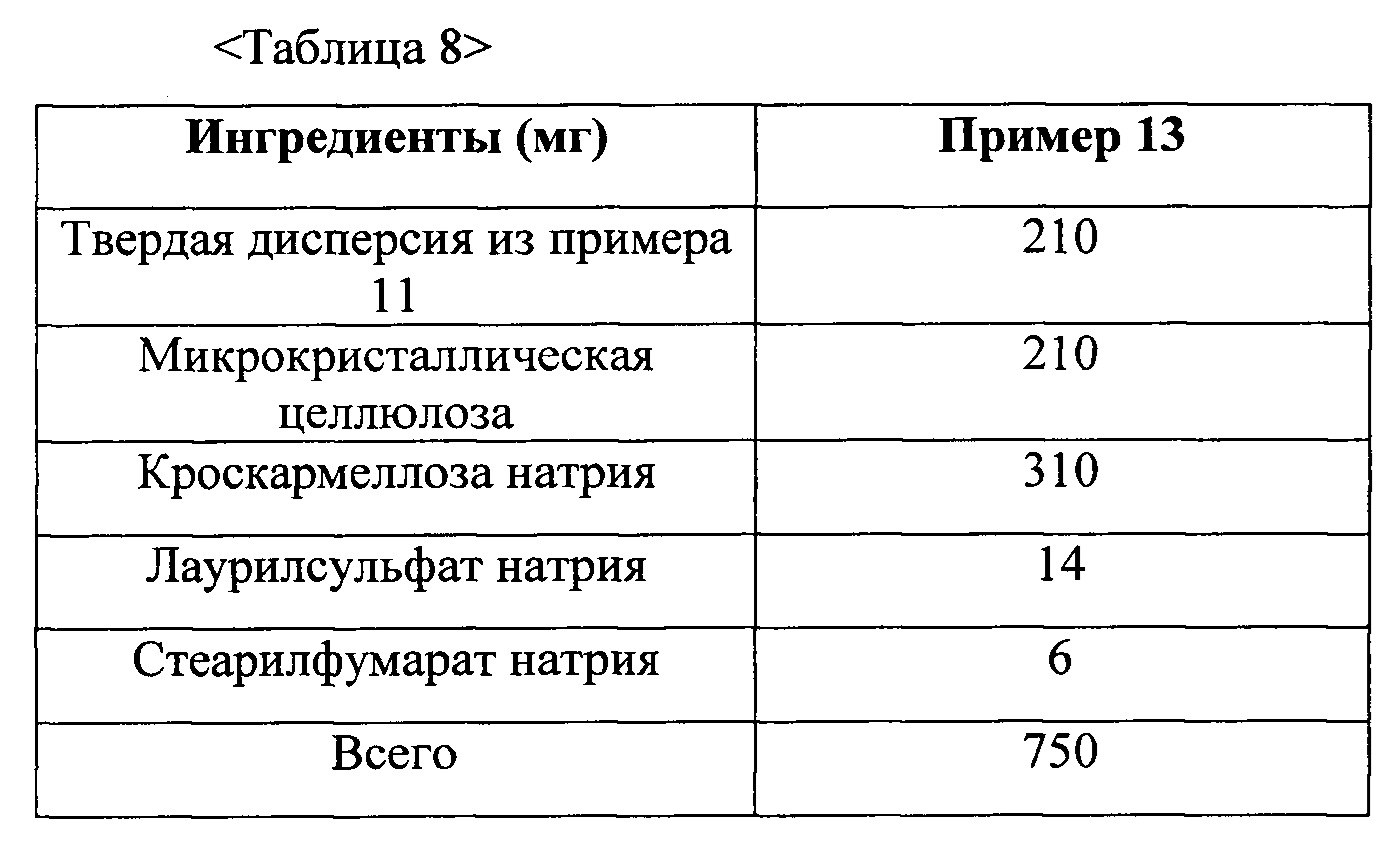
Пример 14. Получение таблетки, содержащей твердую дисперсию из примера 12
<Пример 14-1>. Получение таблетки, содержащей твердую дисперсию из примера 12-1
Таблетку получали с применением твердой дисперсии из примера 12-1, как показано в таблице 9.
Как только процесс с псевдоожиженным слоем заканчивался, к смеси гранул добавляли часть смазывающего вещества и получали таблетки для процесса брикетирования с твердостью менее чем 2 кп. Брикет затем пропускали через сито №20. К этому брикету затем добавляли остаточное количество смазывающего вещества, а также хорошо перемешивали и получали конечные таблетки с помощью таблетировочной машины. Полученные таблетки были продолговатыми с толщиной около 6,90 мм, диаметром около 15,83 мм и твердостью около 2-5 кп.
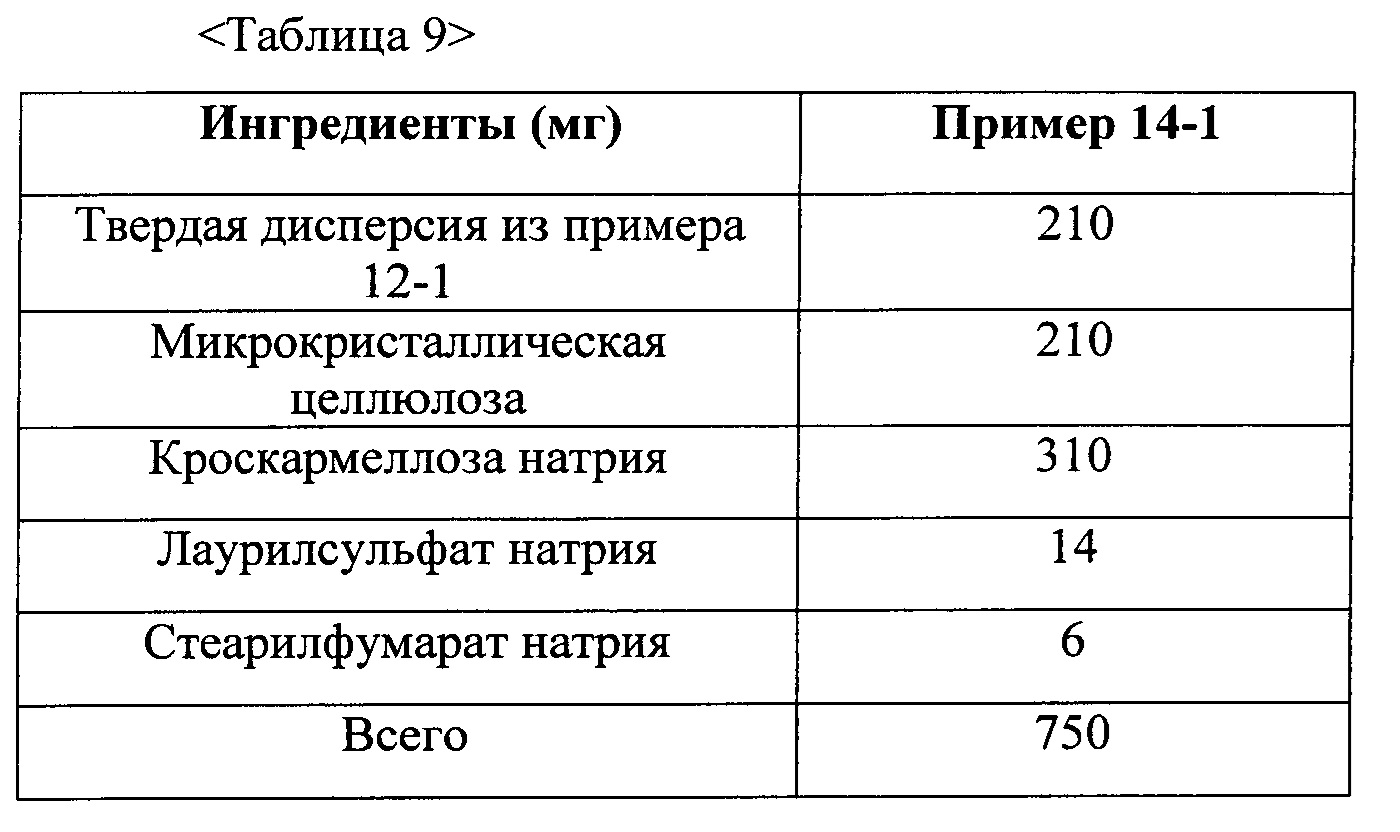
<Примеры 14-2-14-4>. Получение таблетки, содержащей твердую дисперсию из примеров 12-2-12-4
Таблетки получали с применением твердых дисперсий из примеров 12-2-12-4, как показано в таблице 10.
Как только процесс с псевдоожиженным слоем заканчивался, к смеси гранул добавляли часть смазывающего вещества и получали таблетки для процесса брикетирования с твердостью менее чем 2 кп. Брикет затем пропускали через сито №20. К этому брикету затем добавляли остаточное количество смазывающего вещества, а также хорошо перемешивали и получали конечные таблетки с помощью таблетировочной машины. Полученные таблетки были продолговатыми с толщиной около 6,90 мм, диаметром около 15,83 мм и твердостью около 2-5 кп.

Сравнительный пример 2. Получение таблетки, содержащей твердую дисперсию паклитаксела, с помощью технологии высушивания распылением в псевдоожиженном слое при соотношении паклитаксел : полимер 1:9 только с SLS
Таблетку из сравнительного примера 2, представленную в таблице 11, получали с применением технологии высушивания распылением в псевдоожиженном слое, как упоминается в примере 12-1. Раствор для распыления получали путем растворения паклитаксела, лаурилсульфат натрия и PVP K-30 в системе растворителей этанол/вода. Раствор распыляли в 300 г смеси вспомогательных веществ (микрокристаллической целлюлозы, кроскармеллозы натрия и лаурилсульфата натрия), приведенных в таблице 11, в системе с псевдоожиженным слоем. Скорость распыления составляла 15~25 мл/мин с применением верхнего распылителя. Статическое давление на входе составляло 2,5-5 бар (250-500 кПа). Температура на входе составляла 65~70°C, а температура продукта составляла 30~40°C. Полученные гранулы были свободно-текучими с содержанием аморфного паклитаксела, нанесенного на поверхность вспомогательных веществ. Полученные гранулы паклитаксела были свободно-текучими, при этом содержание паклитаксела было эквивалентным 30 мг.
Как только процесс с псевдоожиженным слоем заканчивался, к смеси гранул добавляли часть смазывающего вещества и получали таблетки для процесса брикетирования с твердостью менее чем 2 кп. Брикет затем пропускали через сито №20. К этому брикету затем добавляли остаточное количество смазывающего вещества, а также хорошо перемешивали и получали конечные таблетки с помощью таблетировочной машины. Полученные таблетки были продолговатыми с толщиной около 6,90 мм, диаметром около 15,83 мм и твердостью около 2~5 кп.
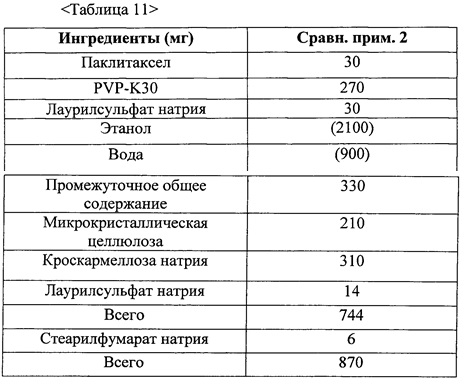
Сравнительный пример 3. Получение обычной таблетки паклитаксела
Обычную таблетку, содержащую паклитаксел, получали с применением ингредиентов, приведенных в таблице 12.
Сперва паклитаксел смешивали с PVP K-30, лаурилсульфатом натрия и полисорбатом 80 (Tween 80) в качестве внутригранулярных вспомогательных веществ и подвергали влажному гранулированию с образованием гранул. После высушивания гранул микрокристаллическую целлюлозу, кроскармеллозу натрия и лаурилсульфат натрия и стеарилфумарат натрия в качестве внегранулярных вспомогательных веществ смешивали, и получали конечные таблетки с помощью таблетировочной машины. Полученные таблетки были продолговатыми с толщиной около 6,90 мм, диаметром около 15,83 мм и твердостью около 2-5 кп.
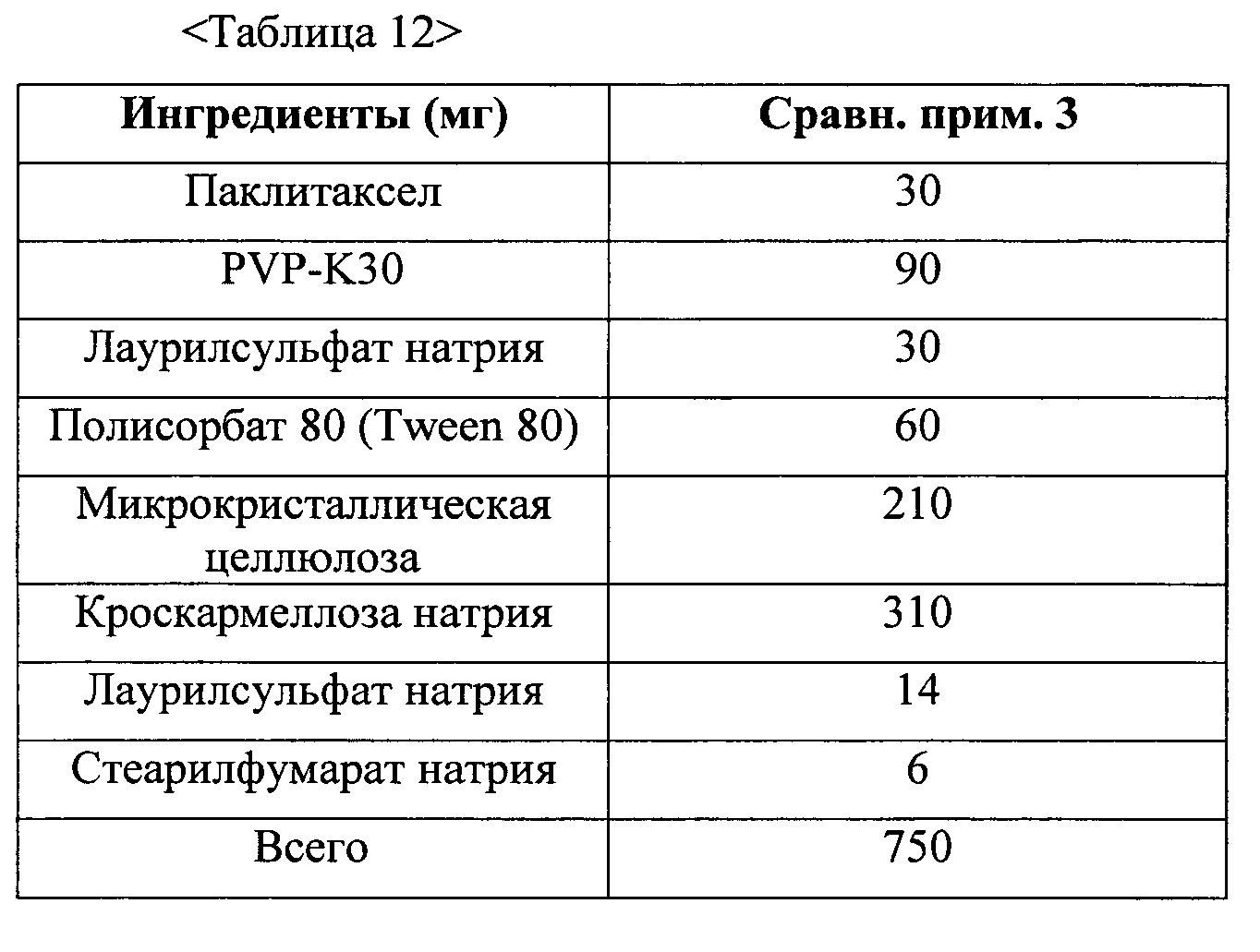
Тестовый пример 1. Исследование растворимости твердых дисперсий из примеров 1 и 2
Показатели растворимости твердых дисперсий из примеров 1 и 2 изучали с применением метода USP XXIII, аппарата для определения скорости растворения II с помощью 300 мл буфера с pH 1,2 в качестве среды растворения при 37±0,5°C со скоростью вращения лопасти 50 об/мин. Твердые дисперсии паклитаксела (90 мг в виде паклитаксела) вводили в прибор для проведения тестов растворения (Labfine, Корея). Через предварительно определенные промежутки времени отбирали аликвоту 5 мл, фильтровали и анализировали на предмет содержания паклитаксела с помощью способа HPLC. Для компенсации потери в связи с отбором образцов заменяли эквивалентным объемом (5 мл) свежей среды растворения и поддерживали условия достаточного разбавления на протяжении всего исследования. Теоретическая концентрация паклитаксела в среде составляла 300 РРМ (90 мг паклитаксела в 300 мл среды). Результаты показаны на фиг. 1.
Как показано на фиг. 1, растворимость твердой дисперсии из примера 2, содержащей полимер PVP, была лучше таковой для твердой дисперсии из примера 1. Кроме того, растворимость твердой дисперсии из примера 2, содержащей PVP, была выше, и растворение происходило быстрее, что было выбрано для дальнейшей обработки.
Тестовый пример 2. Исследование растворимости твердых дисперсий из примеров 3-6
Показатели растворимости твердых дисперсий из примеров 3-6 изучали с применением тех же условий, рассмотренных в тестовом примере 1. Эффекты различных типов поверхностно-активных веществ в отношении растворимости паклитаксела в дополнение к SLS показаны на фиг. 2.
Как можно видеть на фиг. 2, очевидно, что твердая дисперсия из примера 4, содержащая Tween 80 и SLS в качестве поверхностно-активных веществ, продемонстрировала наиболее высокий показатель растворимости среди тестируемых дисперсий. Твердая дисперсия из примера 5, содержащая только Labrasol и SLS, продемонстрировала слабую растворимость паклитаксела в среде растворения. Твердая дисперсия из примера 6, содержащая только SLS, без дополнительных поверхностно-активных веществ, характеризовалась наиболее слабой растворимостью среди тестируемых дисперсий при дозе паклитаксела, составляющей 30 мг. Твердая дисперсия из примера 3, содержащая кремофор EL, продемонстрировала вторую по величине растворимость. Таким образом, с учетом того, что кремофор является токсичным, и одной из целей настоящего изобретения является получение составов без кремофора, применение поверхностно-активного вещества Tween 80 в получении твердой дисперсии, как полагают, является весьма подходящим.
Тестовый пример 3. Исследование растворимости твердых дисперсий из примеров 7-10
Показатели растворимости твердых дисперсий из примеров 7-10 изучали с применением тех же условий, рассмотренных в тестовом примере 1. В этом исследовании изучали влияние количества полимера на растворимость паклитаксела. Для получения твердых дисперсий применяли количество полимера PVP K30 в диапазоне 30-270. Результаты показаны на фиг. 3. Весовое соотношение паклитаксела и применяемого PVP К-30 составляло 1:9 (30:270), 1:6 (30:180), 1:3 (30:90) и 1:1 (30:30).
Значимая разница между примерами 7, 8 и 9 с содержанием 270, 180 мг и 90 мг полимера соответственно, что соответствовало соотношению 1:9, 1:6 и 1:3 соответственно, не наблюдалась. Тем не менее, паклитаксел выпадал в осадок ранее на 90 мин при количестве полимера более 90 мг, тогда как растворимость была стабильной при 90 мг полимера (соотношение 1:3). Твердая дисперсия из примера 10, содержащая небольшое количество полимера (30 мг), продемонстрировала слабую растворимость паклитаксела, предполагая слабое влияние полимера в качестве носителя в этом количественном диапазоне.
Кроме того известным является научный факт о том, что повышение количества полимера будет повышать распадаемость и растворение прессованных таблеток за счет увеличения промежутка времени для гидратации, что приводит к длительным эффектам. Принимая во внимание этот фактор, рекомендуется применение минимального количества полимера, и соотношение 1:3 считается оптимальным с точки зрения предотвращения выпадения в осадок, уменьшения промежутка времени распадаемости и более быстрого растворения.
Тестовый пример 4. Тест растворимости твердых дисперсий из примера 11 и 12-1 и сравнительного примера 1
Показатели растворимости твердых дисперсий из примеров 11 и 12-1 изучали с применением метода USP XXIII, аппарата для определения скорости растворения II с помощью 300 мл буфера с pH 1,2 в качестве среды растворения при 37±0,5°C со скоростью вращения лопасти 50 об/мин. Для сравнения, жидкий состав из сравнительного примера 1 (эквивалент 90 мг паклитаксела) также добавляли непосредственно в среду растворения.
Твердые дисперсии паклитаксела (90 мг в виде паклитаксела) вводили в прибор для проведения тестов растворения (Labfine, Корея). Через предварительно определенные промежутки времени отбирали аликвоту 5 мл, фильтровали и анализировали на предмет содержания паклитаксела с помощью способа HPLC. Для компенсации потери в связи с отбором образцов заменяли эквивалентным объемом (5 мл) свежей среды растворения и поддерживали условия достаточного разбавления на протяжении всего исследования. Теоретическая концентрация паклитаксела в среде составляла 300 РРМ (90 мг паклитаксела в 300 мл среды).
Профили растворимости твердых дисперсий из примеров 11 и 12-1 и жидкого состава из сравнительного примера 1 приведены на фиг. 4. В тесте растворимости твердая дисперсия из примера 12-1, полученная с помощью технологии псевдоожиженного слоя, продемонстрировала наиболее быстрое растворение среди тестируемых образцов. Жидкий состав из сравнительного примера 1 продемонстрировал слабую растворимость и более быструю перекристаллизацию по сравнению с твердыми дисперсиями. В соответствии с фиг. 4 можно понять, что аморфные твердые дисперсии, полученные либо с помощью традиционной методики, либо с помощью методики псевдоожиженного слоя, были лучше жидкого состава, при этом данные композицию и способ получения можно рассматривать как очень хороший способ повышения растворимости паклитаксела.
Тестовый пример 5. Исследование растворимости таблеток из примеров 13 и 14-1 и сравнительного примера 2
Показатели растворимости таблеток из примеров 13 и 14-1 и сравнительных примеров 2 и 3 изучали с применением тех же условий, рассмотренных в тестовом примере 1. Три таблетки каждого из составов, содержащих паклитаксел из примеров 13 и 14-1 и сравнительных примеров 2 и 3 (эквивалент 90 мг паклитаксела), вводили в прибор для проведения тестов растворения (Labfine, Корея). Профили растворимости всех составов приведены на фиг. 5.
Среди тестируемых образцов, таблетка из примера 14-1, полученная с помощью технологии высушивания распылением в псевдоожиженном слое, продемонстрировала наиболее высокую скорость растворения и наиболее высокий показатель растворимости. Скорость растворения была очень высокой, и наиболее высокий показатель растворения/растворимости наблюдался в течение 20 мин. Это может быть связано с более быстрым распадом таблетки, который объясняется способом получения и более быстрым растворением аморфного паклитаксела в твердой дисперсии, содержащей гидрофильный полимер и поверхностно-активные вещества.
Таблетка из примера 13, полученная с помощью традиционной технологии высушивания распылением, продемонстрировала сравнительно более медленное растворение и более низкие показатели профиля растворения и растворимости по сравнению с таковыми из примера 14-1, и полное растворение происходило около 40 мин. Таблетка из сравнительного примера 2, полученная с помощью технологии высушивания распылением в псевдоожиженном слое, и с содержанием полимера в наиболее высоким количестве, продемонстрировала наиболее медленный распад и растворение по сравнению с другими тестируемыми составами. Несмотря на аморфное состояние, медленное высвобождение и низкая растворимость могут быть связаны с более высоким содержанием полимера, который предотвращает быструю гидратацию и высвобождение. Таблетка из сравнительного примера 3, полученная с помощью обычного метода изготовления таблеток, продемонстрировала медленное высвобождение и низкую растворимость по сравнению с таблетками из примеров 13 и 14-1, при этом растворимость была сравнима со сравнительным примером 2. Исходя из результатов этого теста очевидно, что ни кристаллический паклитаксел из сравнительного примера 3, ни сравнительный пример 2 с высоким содержанием полимера не обеспечивали ожидаемую растворимость.
Тестовый пример 6. Тест на распадаемость таблеток из примеров 13 и 14-1 и сравнительных примеров 2 и 3
Таблетку из примера 13 получали с помощью традиционной технологии высушивания распылением, таблетку из примера 14-1 получали с помощью технологии высушивания распылением в псевдоожиженном слое, таблетку из сравнительного примера 2 с наиболее высоким соотношением полимера, а также отдельно SLS и обычную таблетку из сравнительного примера 3 подвергали тесту на распадаемость согласно Фармакопеи США (USP). Период времени распада соответствующих таблеток приведено в таблице 13.
Таблетка из примера 14-1 продемонстрировала более короткий период времени распада по сравнению с примером 13. Период времени распада для сравнительного примера 2 с наиболее высоким соотношением полимера и SLS был самым большим. Более быстрый распад таблетки из примера 14-1 может быть связан с применением технологии псевдоожиженного слоя, которая обеспечивает получение гранул с более низкой плотностью с высокопористой поверхностью, которые легче смачиваются и, таким образом, быстрее распадаются.

Тестовый пример 7. Определение характеристик твердого состояния таблеток из примера 13 и 14-1 и паклитаксел в качестве API
Определение характеристик твердого состояния высушенной распылением таблетки из примера 13, полученной традиционным способом высушивания распылением, высушенной распылением таблетки из примера 14-1, полученной с помощью способа высушивания распылением в псевдоожиженном слое, и паклитаксела в качестве API проводили посредством оценки с помощью XRD с применением M18XHF-SRA (Macsciences Co., Ltd., Япония) при условиях рентгенографического анализа, медный анод, 40 кВ и 100 мА со скоростью сканирования 6°/мин.
Результаты в виде дифракционных рентгенограмм паклитаксела в качестве API и таблеток из примеров 13 и 14-1 приведены на фиг. 6. Как показано на фиг. 6А, активный ингредиент, паклитаксел, характеризовался пиками с углом два-тета (градус) 4,147, 5,224, 5,600, 6,138, 8,987, 9,711, 10,123, 11,195, 12,454, 13,690, 13,967, 15,682, 16,481, 17,144, 18,051, 18,791, 19,541, 20,191, 21,248, 22,022, 22,822, 23,558, 25,227, 26,339, 27,119, 28,689, 29,985, 31,963, 32,855 и 34,178. Тем не менее, как показано на фиг. 6В и 6С, таблетки из примеров 13 и 14-1 не демонстрировали пики, поскольку процесс высушивания распылением обеспечивал превращение активного ингредиента в аморфную форму с получением в результате композиции на основе аморфной твердой дисперсии.
Тестовый пример 8. Сравнение параметров PK in vivo и биодоступности таблеток из примеров 13 и 14-1 и сравнительного примера 3 у собак породы бигль.
Исследования биодоступности и фармакокинетики in vivo у собак проводили для изучения повышения биодоступности таблеток из примеров 13 и 14-1 и сравнительного примера 3.
Собак (собак породы бигль весом около 10-15 кг) подвергали голоданию в течение ночи до введения дозы, но допускалась вода в неограниченном количестве. Собак разделяли на три группы для примера 13 и 14-1 и сравнительного примера 3, и каждая собака перорально получала 30 мг ингибитора Pgp примерно за 30 минут до введения дозы составов на основе паклитаксела.
Через 30 минут каждой собаке вводили таблетки в эквиваленте 60 мг паклитаксела. После дозы следовало примерно 150 мл воды. Образцы крови от каждого животного получали до введения дозы и через 0,25, 0,5, 1,0, 1,5, 2, 3, 4, 6, 8, 10, 12 и 24 часа после введения лекарственного средства. Плазму крови отделяли с помощью центрифугирования и замораживали (-40°C) до анализа. Концентрацию паклитаксела в плазме крови определяли с помощью обращенно-фазовой HPLC с коротковолновой УФ-детекцией с последующей жидкостной экстракцией из образцов плазмы крови. Площадь под фармакинетической кривой паклитаксела рассчитывали способом трапеций на протяжении времени исследования. Представленные в таблице 14 значения представляют собой средние значения для каждой группы собак.
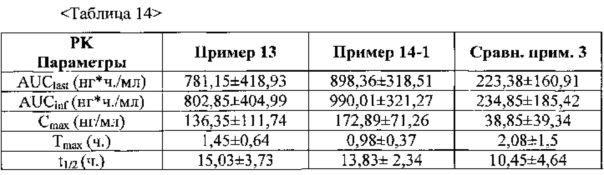
На фиг. 7 представлен фармакокинетический профиль таблеток из примеров 13 и 14-1 и сравнительного примера 3 у собак породы бигль. Все данные указаны в виде среднего значения из шести со стандартным отклонением. Профили откладывали на графике как функцию зависимости концентрации в плазме (нг/мл) от времени. На фиг. 7 и в таблице 14 показано, что таблетка из примера 14-1 продемонстрировала наиболее высокую биодоступность с наиболее высоким значением Cmax. Наряду с этим, для сравнительного примера 3, полученного обычным способом, была показана наиболее низкая биодоступность.
Tmax было ниже, a t1/2 было выше для таблеток из примеров 13 и 14-1. AUC тестируемых таблеток была больше для таблеток из примеров 13 и 14-1 по сравнению со сравнительным примером 3, полученным обычным способом. Кроме того, изменчивость индивидуальных значений для твердых дисперсий из примеров 13 и 14-1 была сравнительно ниже относительно сравнительного примера 3.
Повышенные значения Cmax и AUC в сочетании с пониженными значениями Tmax могли быть связаны с матрицей растворимого в воде полимера и аморфным лекарственным средством, что повышает растворимость in vivo и предотвращает выпадение в осадок, что приводит к повышению абсорбции паклитаксела.
Это наглядно продемонстрировало, что введение таблетки, содержащей твердую дисперсию паклитаксела, у собак приводит к повышенной растворимости и биодоступности.
Тестовый пример 9. Стабильность таблетки из примера 14-1 в условиях ускоренного хранения
Таблетку из примера 14-1 хранили в условиях ускоренного хранения в соответствии со следующим протоколом. Количество продуктов разложения каждого из активных ингредиентов измеряли для сравнения стабильности смешанных составов. Результаты приведены в таблице 16.
Условия ускоренного хранения
- Условия хранения: содержание в бутылке HDPE при 40°C, 75% RH
- Продолжительность теста: исходная, 1 и 3 месяца
- Цель анализа: паклитаксел и родственные соединения
Условия анализа паклитаксела и его родственных соединений
Колонка: Колонка из нержавеющей стали (внутренний диаметр приблизительно 4,6 мм и длина 15 см), заполненная октадецилсилил-силикагелем, для жидкостной хроматографии (например, Symmetry С18, размер частиц 3 мкм)
Подвижная фаза: А: ацетонитрил : вода (7:3); В: ацетонитрил
Детектор: Детектор с УФ-поглощением (поглощение при 227 нм)
Скорость потока: 1,2 мл/мин
Объем вводимой пробы: 10 мкл
Температура колонки: 35°C
Градиентная система:

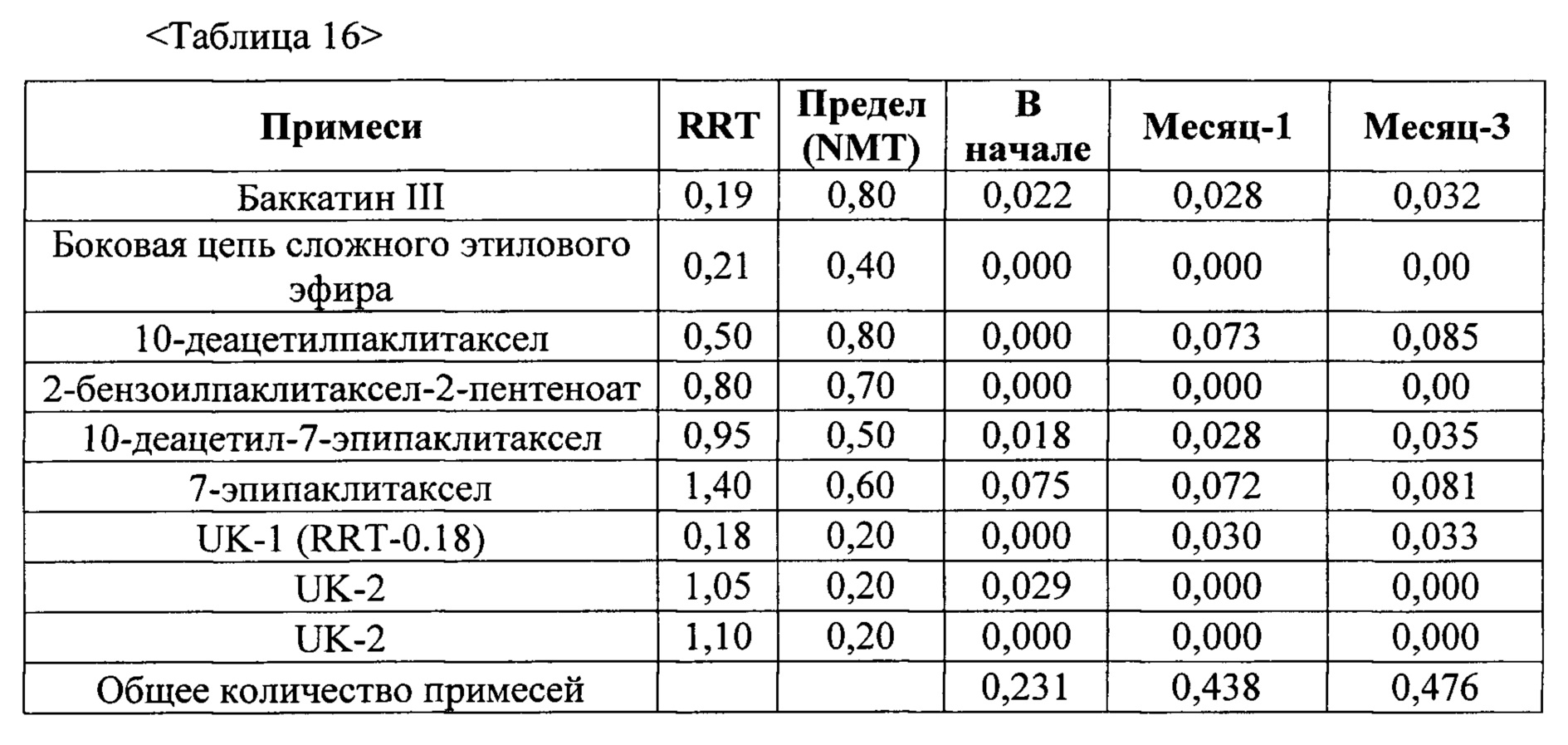
В соответствии с результатами стабильность таблетки в виде твердого дозированного состава из примера 14-1 была очень хорошей в течение периода до 3 месяцев в условиях ускоренного хранения. Все известные и неизвестные примеси находились в рамках нормативных пределов, указанных в USP.
Следовательно, согласно настоящему изобретению способ получения таблетки, содержащей твердую дисперсию паклитаксела, полученную с помощью традиционного способа высушивания распылением или с помощью способа высушивания распылением в псевдоожиженном слое, и фармацевтические вспомогательные вещества, будет иметь преимущество по сравнению с другими способами и может быть использован для перорального введения паклитаксела, в частности, в виде твердого дозированного состава для перорального применения. Полученная с помощью способа по настоящему изобретению таблетка, содержащая твердую дисперсию паклитаксела, оказалась высокостабильной, растворимой и характеризовалась высокой биодоступностью in vivo.
Хотя настоящее изобретение было описано посредством подробного описания, в котором были описаны различные варианты осуществления и аспекты настоящего изобретения, специалисту в данной области будет понятно, что полный объем настоящего изобретения не ограничивается представленными в данном документе примерами. Таким образом, основной объем настоящего изобретения будет определяться прилагаемой формулой изобретения и его эквивалентами.