Результат интеллектуальной деятельности: Олигонуклеотидные праймеры и флуоресцентно-меченый зонд, способ и тест-система для выявления генома вируса заразного узелкового дерматита (нодулярного дерматита) КРС в реакции полимеразной цепной реакции в режиме реального времени
Вид РИД
Изобретение
Изобретение относится к ветеринарной вирусологии, к средствам молекулярной диагностики, а именно к выявлению генома вируса заразного узелкового дерматита (нодулярного дерматита) крупного рогатого скота (ЗУД КРС).
Вирус ЗУД КРС относится к роду Capripoxvirus и является возбудителем трансграничного заболевания КРС, которое представляет серьезную угрозу скотоводства не только в Российской Федерации, но и в других странах, нанося существенные экономические потери хозяйствам и экономике стран [1, 2].
ЗУД КРС сопровождается лихорадкой, образованием кожных поражений на коже и слизистой [3]. Главным образом, ЗУД КРС регистрировался в странах Африканского континента, проявляя сезонный характер с максимальным распространением при обилии популяции кровососущих насекомых [4]. Впервые на территории РФ вспышки ЗУД КРС были зарегистрированы в 2015 году и были вызваны полевым изолятом [5]. Однако уже в 2017 году в ряде регионов Приволжского ФО в биоматериале из вспышек от КРС, при лабораторных исследованиях был выявлен вакциноподобный изолят вируса ЗУД, принадлежащий к генетической линии Neethling, который по генетическим свойствам отличался от полевого изолята [6]. Исходя из вышеизложенного требуется применение таких методов диагностики, которые позволили бы проводить скрининговые исследования на все возможные генетические варианты вируса ЗУД КРС.
Известен способ диагностики ЗУД КРС вирусологическим методом выделения возбудителя в чувствительных клеточных культурах, основанном на специфическом проявлении действия вируса в биологических системах [7]. Недостатками данного метода являются: длительность, трудоемкость и необходимость использования биологических моделей.
Известен способ диагностики каприпоксвирусных инфекций, к которым относится ЗУД КРС, через амплификацию фрагмента гена Р32 геномов каприпоксвирусов [8]. Недостатком такого подхода является то, что по данному консервативному локусу невозможно провести дифференциацию между каприпоксвирусами.
Известен способ, который основан на детекции вируса ЗУД КРС, вируса оспы коз и вируса оспы овец путем проведения амплификации фрагментов ДНК с последующим анализом их кривых плавления с высоким разрешением [9]. Недостатком этого способа является высокая зависимость способа от качества и концентрации ДНК в исследуемой пробе.
Наиболее близким к заявляемому методу является тест-система выявления генома полевых вирусов заразного узелкового дерматита КРС с помощью ПЦР в режиме реального времени на основе участка гена EEV126 [10]. Несмотря на высокую чувствительность и специфичность, данный метод не может выявлять вакциноподобные изоляты вируса ЗУД.
Таким образом, технической проблемой является разработка надежного метода с возможностью исследования широкого спектра биологического материала (внутренние органы, нодулы, сыворотка крови, цельная кровь, культура клеток), чувствительного и специфичного для обнаружения геномов всех возможных генетических вариантов вируса ЗУД КРС методом полимеразной цепной реакции в режиме реального времени путем конструирования набора, содержащего специфичные олигонуклеотидные праймеры и флуоресцентно-меченый зонд, а также подбора условий для проведения ПЦР с ними, обеспечивающий минимальный риск контаминации в лаборатории и исключающий субъективность при оценке результатов.
Изобретение касается тест-системы, состоящей из олигонуклеотидных праймеров и флуоресцентно-меченого зонда для специфичной экспресс-идентификации генома всех генетических вариантов ЗУД КРС методом полимеразной цепной реакции в режиме реального времени. Представленный метод включает последовательности олигонуклеотидов, специфичные только для вируса ЗУД КРС и имеющие следующую нуклеотидную последовательность:
zdf41n CAA+AAA+CAA+TCG+TAAC+TAATCCA
zdr41n TG+GAGTTTTTA+TG+TCATCGTC
zdpro41nl FAM TC+GT+CGT+CG+TT+TAA+AACTGA BHQ1
Знаком «+» обозначены модификации LNA. В качестве источника флуоресценции на 5' конце зонда применяют краситель FAM, а для тушения флуоресценции на 3' конце - BHQ1. Флуоресценцию измеряют по каналу FAM. Пересечение кривой флуоресценции линии threshold, свидетельствует о наличии в образце генома вируса ЗУД КРС, причем, чем меньше показатель «Ct», тем выше количество генома вируса ЗУД КРСв исследуемом образце. Отсутствие пересечения кривой флуоресценции линии threshold свидетельствует об отсутствии генома вируса ЗУД КРС в исследуемом материале.
Изобретение может быть использовано в ветеринарии, клинической и лабораторной диагностике для выявления ДНК вируса ЗУД КРС в пробах биологического и культурального материала.
Техническим результатом изобретения является: высокая специфичность в отношении всех возможных генетических вариантов вируса ЗУД КРС; расширенный спектр биологического материала, пригодный для проведения исследований без возможности получения ложноположительных результатов; возможность использования широкого спектра амплификаторов, отвечающего минимальным требованиям для постановки ПЦР; сокращение времени для проведения массовых исследований проб на наличие генома вируса ЗУД КРС, а также расширение арсенала средств диагностики ЗУД КРС.
Сущность изобретения заключается в том, что специфичное выявление ДНК вируса ЗУД КРС проводится в присутствии родственных каприпоксвирусов (вирусов оспы овец и коз) без какого-либо влияния последних. При помощи указанных праймеров (zdf41n, zdr41n) и зонда (zdpro41nl) проводят полимеразную цепную реакцию в режиме реального времени (ПЦР - РВ), позволяющую выявлять геном вируса ЗУД КРС. В качестве мишени выбран фрагмент гена LSDV044, кодирующий трансмембранный домен, присутствующий у всех генетических вариантов вируса ЗУД КРС. Высокая степень специфичности тест-системы подтверждена сравнением опубликованных в настоящее время последовательностей каприпоксвирусов с аналогичными нуклеотидными последовательностями других каприпоксвирусов (база данных GenBank), а также с помощью лабораторных исследований.
Сущность изобретения пояснена на графическом материале:
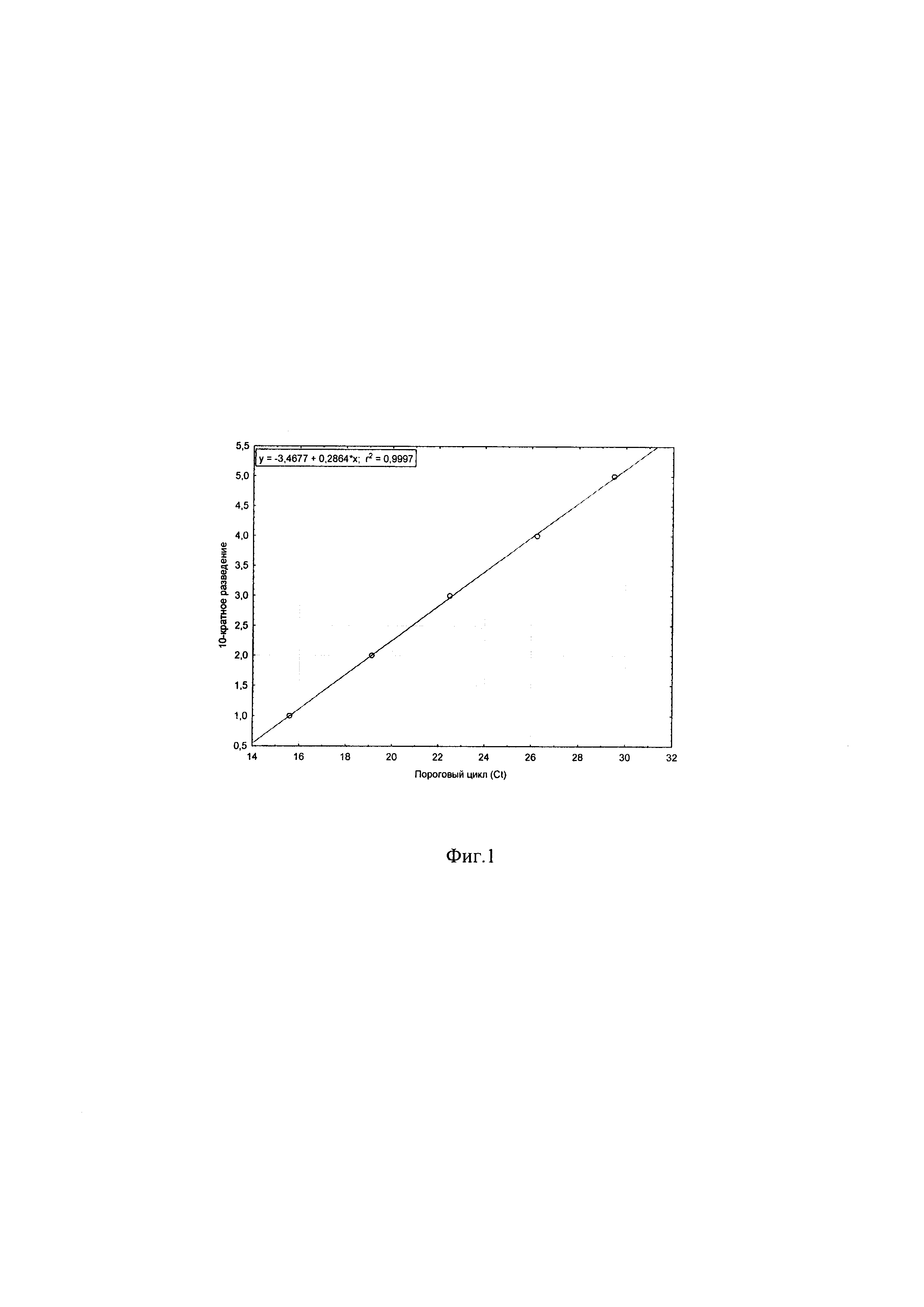
Фиг. 1 - представлена линейность результатов ПЦР-РВ при тестировании 10-кратных разведений выделенной ДНК вируса ЗУД КРС (штамм вируса нодулярного дерматита «ВНД КРС/Дагестан/2015»);
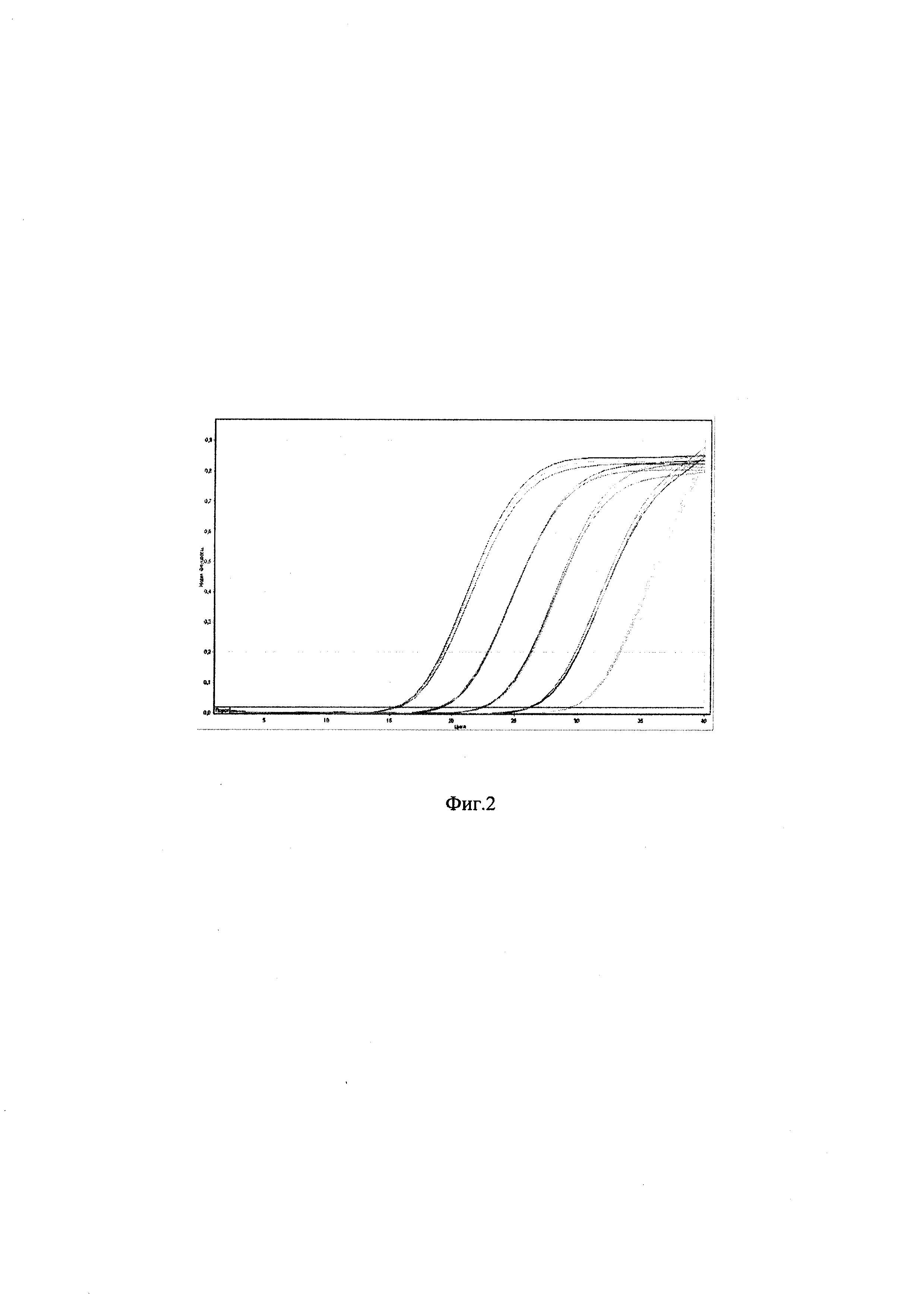
Фиг. 2 - представлены амплификационные кривые при тестировании пяти последовательных 10-кратных разведений выделенной ДНК вируса ЗУД КРС (штамм вируса нодулярного дерматита «ВНД КРС/Дагестан/2015»)
Детекция продуктов амплификации осуществляется методом регистрации флуоресценции, генерируемой в результате разрушения гибридизационного зонда, находящегося на 5'-конце флуорофор FAM, а на 3'-конце - гасителя BHQ1. В отсутствии мишени флуорофор и гаситель сближены, и наблюдается лишь незначительная флуоресценция, так как гаситель поглощает испускаемое флуорофором излучение. При накоплении в ходе ПЦР специфических продуктов зонд гибридизируется на ампликон, что ведет к его разрушению за счет 5'-экзонуклеазной активности Taq-полимеразы. В результате флуорофор отделяется от гасителя и его излучение может быть детектировано. Таким образом, увеличение флуоресценции прямо пропорционально количеству синтезированного ПЦР-продукта.
Праймеры и зонд разработаны для амплификации и детекции фрагмента LSDV044, в котором у других представителей сем. Capripoxviridae отсутствует делеция 3 п. н. в данном локусе, а у изолятов вирусов ЗУД КРС она присутствует.
Для разработки праймеров, из базы данных GenBank были получены полногеномные последовательности каприпоксвирусов. Последовательности выравнивали с помощью программы Bioedit, затем визуально оценивали консервативные участки, на основе которых были получены ряд праймеров. В результате тестирования при различных параметрах была получена оптимальная пара праймеров и зонда, которая используется в тест-системе.
Набор для выявления генома вируса ЗУД КРС в ПЦР-РВ состоит из следующих компонентов:
№1 готовая ПЦР смесь, объем 550 мкл - 2 пробирки;
№2 фермент Taq-ДНК-полимераза, объем 12,5 мл - 1 пробирка;
№3 положительный контрольный образец, объем 100 мкл - 1 пробирка;
№4 отрицательный контрольный образец, объем 100 мкл - 1 пробирка.
ПЦР-РВ проводится в одну стадию с использованием готовой ПЦР смеси (№1), включающей на одну реакцию буфер 5х для ПЦР-РВ (5 мкл), 25 мМ хлорид магния (3,5 мкл), дезоксирибонуклеотид трифосфаты (0,5 мкл 10 пмолль), олигонуклеотидные праймеры (1 мкл каждого праймера 15 пмоль), зонд (1 мкл 2,5 пмоль) и фермента Taq-ДНК-полимеразу в программируемом амплификаторе. Перед началом постановки реакции необходимо разморозить все необходимые компоненты реакции, встряхнуть на шейкере, затем центрифугировать несколько секунд на низкоскоростной центрифуге.
Реакционную смесь для проведения ПЦР-РВ готовят в пробирке в расчете на одну реакцию (V=25 мкл) следующим образом:
|
Приготовленную в отдельных 1,5 мл пробирках реакционную ПЦР-смесь переносят в 0,2 мл пробирки по 20 мкл и вносят 5 мкл суммарной ДНК. В соответствующие пробы вносят также выделенные образцы ДНК, отрицательного и положительного контролей. Общий объем смеси - 25 мкл.
Устанавливают пробирки в амплификатор для постановки ПЦР-РВ, отмечают в программе расположение и характеристику проб, выбирают рабочий краситель (FAM), устанавливают в программе температурно-временной профиль реакции.
После первоначальной денатурации при 95°С в течение 10 мин ПЦР в режиме реального времени проводят в следующих условиях: 95°С - 15 с, 60°С- 60 с - 45 циклов.
Результаты интерпретируют на основании наличия или отсутствия пересечения кривой флуоресценции с пороговой линией, что соответствует наличию или отсутствию значения порогового цикла «Ct» в соответствующей графе в таблице результатов реакции, выведенной в результате машинного анализа.
Результат считается достоверным только в случае прохождения положительного (Ct≤35) и отрицательного (Ct не определен) контролей амплификации.
Образец считается положительным на наличие ДНК вируса ЗУД КРС, если значение Ct не более 35. Однако в случае, если значение Ct для проб находится в пределах от 36 до 40, необходимо повторить реакцию с целью подтвердить или опровергнуть наличие ДНК вируса в исследуемой пробе.
Образец считается отрицательным на наличие ДНК вируса, если для него значение Ct отсутствует.
Результаты не подлежат учету (считаются недействительными):
- в случае отсутствия регистрации роста флуоресценции в пробе с положительным контролем, что может свидетельствовать об ошибках, допущенных на этапе постановки ПЦР-РВ;
- в случае регистрации значения Ct в таблице результатов на экране компьютера для отрицательного контрольного образца, что указывает на наличие контаминации.
В любом из этих случаев необходимо повторить анализ всех проб, а при повторном выявлении контаминации отрицательного контроля принять меры по выявлению и ликвидации источника контаминации.
Сущность предлагаемого изобретения пояснена примерами его использования, которые не ограничивают объем изобретения.
Пример 1. Оценка специфичности тест-системы.
Для оценки специфичности тест-системы использовались следующие образцы гомологичных и гетерологичных вирусов, депонированных в коллекции штаммов микроорганизмов ФГБУ «ВНИИЗЖ»: ДНК вируса ЗУД штамма «ВНД КРС/Дагестан/2015» (диагностический), ДНК вируса нодулярного дерматита штамма «Э-95», ДНК вакцинного штамма Neethling, ДНК вируса оспы овец штамма «Афганский», ДНК вируса оспы овец вакцинного штамма «ВНИИЗЖ», ДНК вируса оспы коз штамма «Приморский 2003», ДНК вируса оспы коз штамма «ВНИИЗЖ 2003», ДНК вируса чумы мелких жвачных штамма «ВНИИЗЖ», ДНК вируса везикулярного стоматита штамма «ВНИИЗЖ», ДНК вируса оспы коров штамма «ВНИИЗЖ».
Работу с ДНК проводили в условиях, регламентированных Методическими указаниями МУ 1.3. 2569-09 «Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I-IV групп патогенности» [11].
Процедуру выделения ДНК из исследуемого материала проводили с использованием набора реагентов на основе мембранных колонок.
ПЦР в режиме реального времени проводили в реакционной смеси следующего состава (на 1 исследование):
|
ПЦР в режиме реального времени и регистрацию результатов проводили в ПЦР-РВ приборе по программе, описанной выше.
Результаты интерпретировали на основании наличия (или отсутствия) пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линии, что соответствует наличию (или отсутствию) значения порогового цикла Ct в соответствующей графе в таблице результатов. Результат считали положительным в случаи, если кривая накопления флуоресценции для соответствующего образца имела характерную «сигмовидную» форму и пересекала пороговую линию.
При тестировании специфичности тест-системы с использованием ДНК гомологичных и гетерологичных вирусов ложноположительных и ложноотрицательных результатов не выявлено.
Пример 2. Оценка чувствительности тест-системы.
Для оценки чувствительности тест-системы использовали ДНК вируса ЗУД КРС штамма «ВНД/Дагестан/2015» с титром 5,23 lg ТЦД50/см3 [12]. Тест-система выявляла вирусную ДНК с чувствительностью 0,23 lg ТЦД50/см3. Для оценки эффективности амплификации было проведено 3 повторных эксперимента и получены значения Ct, которые использовались для вычисления эффективности. Была получена линейная регрессия со значением эффективности амплификации (Е) 93%. Полученные данные приведены на графическом изображении - Фиг. 1.
Пример 3. Оценка воспроизводимости тест-системы.
Воспроизводимость тест-системы определяли с помощью величины стандартного отклонения (SD) для каждой серии разведений, используя полученные значения Ct. SD варьировало от 0,02 до 0,16 на протяжении пяти 10-кратных разведений (Фиг. 2). Коэффициент детерминированности г2 составил 0,999.
Таким образом, изобретение может быть использовано в ветеринарной практике для выявления генетического материала вируса ЗУД КРС в биологических и культуральных образцах для постановки и уточнения диагноза, для решения научно-исследовательских задач по мониторингу распространения вируса ЗУД КРС среди восприимчивых животных. Использование специфических праймеров и зонда позволяет выявить генетический материал всех генетических вариантов ЗУД КРС в исследуемых образцах методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией в режиме реального времени (РВ).
Источники информации, принятые во внимание при составлении описания изобретения к заявке на выдачу патента РФ на изобретение «Олигонуклеотидные праймеры и флуоресцентно-меченый зонд, способ и тест-система для выявления генома вируса заразного узелкового дерматита (нодулярного дерматита) КРС в реакции полимеразной цепной реакции в режиме реального времени».
1. Beard, P.M. Lumpy skin disease: a direct threat to Europe. // Vet Rec, 2016, v. 28, p. 557-558.
2. Epidemiological and Molecular Studies on Lumpy Skin Disease Outbreaks in Turkey during 2014-2015.// Transbound Emerg Dis. 2016 (in Press).
Epidemiological and Molecular Studies on Lumpy Skin Disease Outbreaks in Turkey during 2014-2015.// Transbound Emerg Dis. 2016 (in Press).
3. Abutarbush S.M., Ababneh M.M., Al Zoubi I.G., Al Sheyab O.M., Al Zoubi M.G., Alekish M.O., Al Gharabat R.J. Lumpy Skin Disease in Jordan: Disease Emergence, Clinical Signs, Complications and Preliminary-associated Economic Losses. // Transbound Emerg Dis., 2015., v. 62(5), p. 549-554.
4. Tuppurainen ES, Venter EH, Shisler JL, Gari G, Mekonnen GA, JuleffN, Lyons NA, De Clercq K, Upton C, Bowden TR, Babiuk S, Babiuk LA. Capripoxvirus Diseases: Current Status and Opportunities for Control. // Transbound Emerg Dis., 2015., doi: 10.1111/tbed.l2444
5. Кононов A.B., Кононова С.В., Шумилова И.Н. [и др.] Культурально-биологические свойства возбудителя нодулярного дерматита крупного рогатого скота, выделенного на территории Российской Федерации в 2015 году: научное издание // Ветеринария сегодня. - 2016. - №3. - С. 8-18.
6. Sprygin A, Pestova Y, Prutnikov P, Kononov A. Detection or vaccine lumpy skin disease virus in cattle and Musca domestica L. flies in an outbreak of lumpy skin disease in Russia in 2017. Transboundary and Emerging Diseases. 2018. doi: 10.1111/tbed. 12889
7. Manual of Diagnostic Tests and Vaccines for Terrestrial Animals. Chapter 2.4.13: Lumpy skin disease. 2017
8. Олигонуклеотидные праймеры и флуоресцентно-меченый зонд, способ и тест-система ПЦР в режиме реального времени для выявления генома каприпоксвирусов / Пат.2658493, А.В. Спрыгин, А.В. Кононов, О.П. Бьядовская [и др.]; ФГБУ «ВНИИЗЖ». - №2017130118; Заявл. 24.08.2017; Опубл. 21.06.2018, Бюл. №18. - Введ. с 24.08.2017 по 24.08. 2037
9. Pestova Y, Byadovskaya О, Kononov A, Sprygin A. A real time high-resolution melting PCR assay for detection and differentiation among sheep pox virus, goat pox virus, field and vaccine strains of lumpy skin disease virus. Mol Cell Probes. 2018 Oct;41:57-60. doi: 10.1016/j.mcp.2018.08.003
10. Олигонуклеотидные праймеры и флуоресцентно-меченый зонд, способ и тест-система ПЦР в режиме реального времени для выявления генома полевых изолятов вируса нодулярного дерматита в реакции полимеразной цепной реакции в режиме реального времени» / Пат.№2668398, А.В. Спрыгин, А.В. Кононов, О.П. Бьядовская [и др.]; ФГБУ «ВНИИЗЖ»; Заявка №2017124318 от 07.07.2017; Опубл. 28.09.2018, Бюл. №28.
11. МУ 1.3.2569-09 Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I-IV групп патогенности
12. «Штамм вируса нодулярного дерматита крупного рогатого скота Dermatitis nodularis bovum,рода Capripoxvirus для изготовления биопрепаратов для диагностики и специфической профилактики нодулярного дерматита крупного рогатого скота» / Пат.№2606254, Заявка №2016118457 от 11.05.2016, Опубл. 10.01.2017, Бюл.№1.