Результат интеллектуальной деятельности: Способ выделения бактерий p. Bacillus из ризопланы и ризосферы прикорневой зоны растений
Вид РИД
Изобретение
Изобретение относится к биотехнологии бактерии, в первую очередь - к технологии извлечения природных штаммов из ризопланы и ризосферы прикорневой зоны растений. Изобретение предназначено для селективного извлечения «диких» штаммов спорообразующих бактерий, в первую очередь - p. BACILLUS, обладающих уникальными биопродуцентными характеристиками, что позволяет сократить затраты на получение искусственных штаммов.
Известен способ извлечения бактерий из ризопланы и ризосферы прикорневой зоны растений, включающий следующие операции: корни с почвой помещают в колбу, содержащую 100 мл стерильной воды, и взбалтывают в течение 2 мин. Стерильным крючком или пинцетом корни извлекают из колбы и переносят в другую емкость, содержащую 100 мл стерильной водопроводной воды. Процедуру повторяют, последовательно промывая корни в семи колбах (по 2 мин в каждой). Желательно, чтобы в последней (седьмой) колбе в воду перед стерилизацией было добавлено 5-7 г песка. Суспензию после первого отмывания рассматривают как образец ризосферы. Содержимое остальных шести колб сливают вместе и расценивают как образец ризопланы [Теппер Е.З., Шильникова В.К., Переверзева Г.И. / Практикум по микробиологии, Учебники и учеб. пособия для высш. учеб. заведений. Изд. 4-е перер. и доп. М., «Колос» 1993, с. 121-123].
Недостатком данного способа является почти полное отсутствие селективности, что приводит к длительным процессам последующей селекции.
Известен способ выделения бактерий ризопланы тыквы обыкновенной. Способ осуществляется по методу последовательных отмываний корней [Теппер, Е.З. Практикум по микробиологии / Е.З. Теппер. - М.: Дрофа, 2004, - 256 с.]. Для этого в пробирке с физиологическим раствором размачивали прилипшие к корням частицы почвы, затем 3 раза переносили в пробирки со стерильным физиологическим раствором и 4 раза промывали в стерильной воде. Очищенные таким образом корни измельчали стерильным пинцетом и ножницами, после чего помещали в стерильную чашку Петри. Затем отбирали навеску корней массой 5 г и растирали их в стерильной фарфоровой ступке. Измельченные корни смывали в колбу с таким расчетом, чтобы объем полученной суспензии составил 50 мл. В колбу добавляли 5 г кварцевого песка и встряхивали суспензию в течение 5 минут. Затем 5 мл жидкости переносили в другую колбу, содержащую 45 мл стерильной воды. Из первой колбы 5 мл суспензии добавляли во вторую колбу с 45 мл воды, из третьей - в четвертую. Таким образом, готовили 7 десятикратных разведений, которые высевали на поверхность плотных питательных сред. Недостаток способа в том, что высеваются как спорообразующие, так и не спорообразующие микроорганизмы, что требует дополнительных процедур для их разделения и идентификации.
Наиболее близким аналогом-прототипом можно считать способ селективного выделения из почвы отдельных групп почвенных бактерий. Для преимущественного выделения из почвы грамположительных спорообразующих бактерий проводят пастеризацию почвенных суспензий (прогревание при 80° в течение 10-15 мин), при которой погибают вегетативные клетки и сохраняются споры бактерий. Для элиминирования бацилл, при учете стрептомицетов, нокардий, коринеподобных бактерий и грамотрицательных бактерий используют добавление в питательные среды красителя метилового красного (0,015%) [Зенова Г.М., П.Ф. Степанов А.Л., Лихачева А.А., Манучарова Н.А. /Практикум по биологии почв: Учеб. пособие - М.: Издательство МГУ, 2002. С. 36-37].
Недостатком данного способа является низкая и неоднозначная селекция, после которой необходимо использовать дополнительные процедуры для разделения бактерий по роду.
Целью настоящего изобретения является - упрощение процесса выделения из ризопланы и ризосферы прикорневой обрасти растений бактерий p. Bacillus за счет:
уменьшения времени проведения исследования;
уменьшения количества используемых химических реактивов;
удешевление процесса, за счет использование недорогих химических реактивов (используется один, недорогой, общедоступный реактив - серная кислота);
упрощение выбора колоний для дальнейшей идентификации по видовым признакам, за счет небольшого количества колоний, выросших на твердой среде.
Поставленная цель достигается тем, что корни растений совместно с прилегающими частичками почвы выдерживают в серной кислоте с концентрацией от 75% до 96% в течение 1,5-3 минут, после чего 0,1 мл пробы высевают в чашки Петри на твердую питательную среду, культивируют при 37°С в течение не менее 24 часов для роста колоний.
Выросшие колонии - бактерии p. Bacillus - используют для дальнейшей идентификации видовых признаков и используют по назначению.
Пример. В стерильную колбу объемом 100 мл помещают 50 мл серной кислоты с концентрацией от 96% до 25%. Приготовление различных концентраций серной кислоты осуществляют по стандартным методикам, с учетом плотности кислоты (Справочник химика 21. Электронный ресурс: режим доступа: www.chem21.info. Дата доступа: 04.05.2019). Затем охлаждают выстаиванием до комнатной температуры (t=20-25°С) и помещают в колбу измельченные стерильными ножницами до 2-3 см части корней растений с прилипшими частицами почвы. Затем однократно перемешивают стерильной стеклянной палочкой, выдерживают 1,5-10 минут и производят посев 0,1 мл пробы стерильной пипеткой на чашки Петри с L-агаром следующего состава (г/л): агар-агар - 18, дрожжевой экстракт - 5, пептон - 15, хлорид натрия - 5, дистиллированная вода - до 1 л (рН 6,8-7,0). Стерилизация среды при 1.1 кгс/см2 40 минут. Пробу равномерно распределяют по поверхности среды стерильным шпателем Дригальского и культивируют в термостате в течение 24 часов при температуре 37°С. В чашках наблюдают рост колоний. Далее отбирают изолированные колонии для видовой идентификации.
Идентификацию ризобактерий осуществляли по морфологическим, тинкториальным, биохимическим свойствам с помощью:
- Хоулт Дж. Криг Н. Определитель бактерий Берджи, в 2 томах. Том 1. Москва. Издательство "Мир", 1997;
- Gordon, R. The genus Bacillus / R. Gordon // In Handb. Microbiol. Cleveland (Ohio). - 1973. - V. 1. - P. 71-88;
- Васильев Д.А., Калдыркаев А.И., Феоктистова H.A., Алешкин А.В. Идентификация бактерий Bacillus cereus на основе их фенотипической характеристики. Научное издание. - Ульяновск: НИИЦМиБ УлГСХА им. П.А. Столыпина, 2013, - 98 с.
Морфологические и тинкториальные свойства выделенных штаммов микроорганизмов изучали с помощью биологического микроскопа марки Биомед 5.
Идентификацию ризобактерий осуществляли по следующим методикам с использованием указанных питательных сред и реактивов.
Окраска по методу Грама:
1. Фиксированный мазок покрывают кусочком фильтровальной бумаги и на него наносят карболовый раствор генцианового фиолетового. Окрашивание проводят на протяжении 1-2 мин.
2. Бумажку снимают, краситель сливают и, не промывая препарат водой, обрабатывают его на протяжении 1-2 мин раствором Люголя до почернения.
3. Сливают раствор Люголя, окрашенный мазок обесцвечивают 96%-ным этиловым спиртом (препарат несколько раз помещают в стакан со спиртом до прекращения отхождения фиолетовых струек). Обесцвечивание проводят не более 30 с.
4. Препарат промывают водой.
5. Мазок дополнительно окрашивают на протяжении 1-2 мин водным раствором фуксина.
6. Краситель сливают, препарат промывают водой, высушивают фильтровальной бумагой и микроскопируют с иммерсионной системой. Грамположительные бактерии окрашиваются в фиолетовый цвет, грамотрицательные - в розовый.
Реактивы для окраски по Граму:
1. Карболовый раствор генциана фиолетового: 1 г генциана фиолетового, 10 мл ректификованного этилового спирта, 5 г фенола растирают в ступке, добавляя 100 мл дистиллированной воды. В ступке растереть краситель с карболовой кислотой до получения кашицеобразной массы, прибавить небольшими порциями спирт и развести водой. Слить раствор в бутыль, поместить в термостат до растворения, профильтровать.
2. Раствор Люголя: 1 г йода кристаллического, 2 г йодистого калия растворяют в 300 мл дистиллированной воды. Смесь поместить в бутыль матового стекла, хорошо закупорить и поставить на сутки в термостат, после чего добавить 300 мл дистиллированной воды. Хранить во флаконе из темного стекла.
3. Фуксин Циля: к 10 мл, насыщенного спиртового раствора основного фуксина прилить 90 мл 5% раствора карболовой кислоты. Карболовую кислоту влить в краситель, а не наоборот. Каждый краситель фильтруют не менее 2-х раз.
Тест Грегерсена:
Для работы используется 3%-ный раствор KOH.
На предметное стекло наносят каплю реактива, в которую стерильной бактериологической петлей вносят исследуемую чистую культуру бактерий. Тщательно перемешивают в течение 30 с и определяют вязкость полученной суспензии. При образовании вязких слизистых тянущихся нитей исследуемые клетки относят к грамотрицательным. Если вязкость суспензии не изменилась, то клетки являются грамположительными (Микробиология. Практикум: пособие / В.В. Лысак, Р.А. Желдакова, О.В. Фомина. - Минск: БГУ, 2015, - стр. 33-34).
Выявление каталазы проводят на предметном стекле в капле 3%-ного раствора перекиси водорода. Стерильной бактериологической петлей в каплю перекиси вносят исследуемую культуру и тщательно перемешивают. При наличии каталазы происходит разложение перекиси водорода с выделением пузырьков кислорода (Микробиология. Практикум: пособие / В.В. Лысак, Р.А. Желдакова, О.В. Фомина. - Минск: БГУ, 2015, – стр. 51).
Использовались готовые питательные среды МПА и МПБ. При посеве на МПА и МПБ использовали стандартные методы посева на плотные и жидкие питательные среды, бактерии культивировали при 37°С в течение 24 часов.
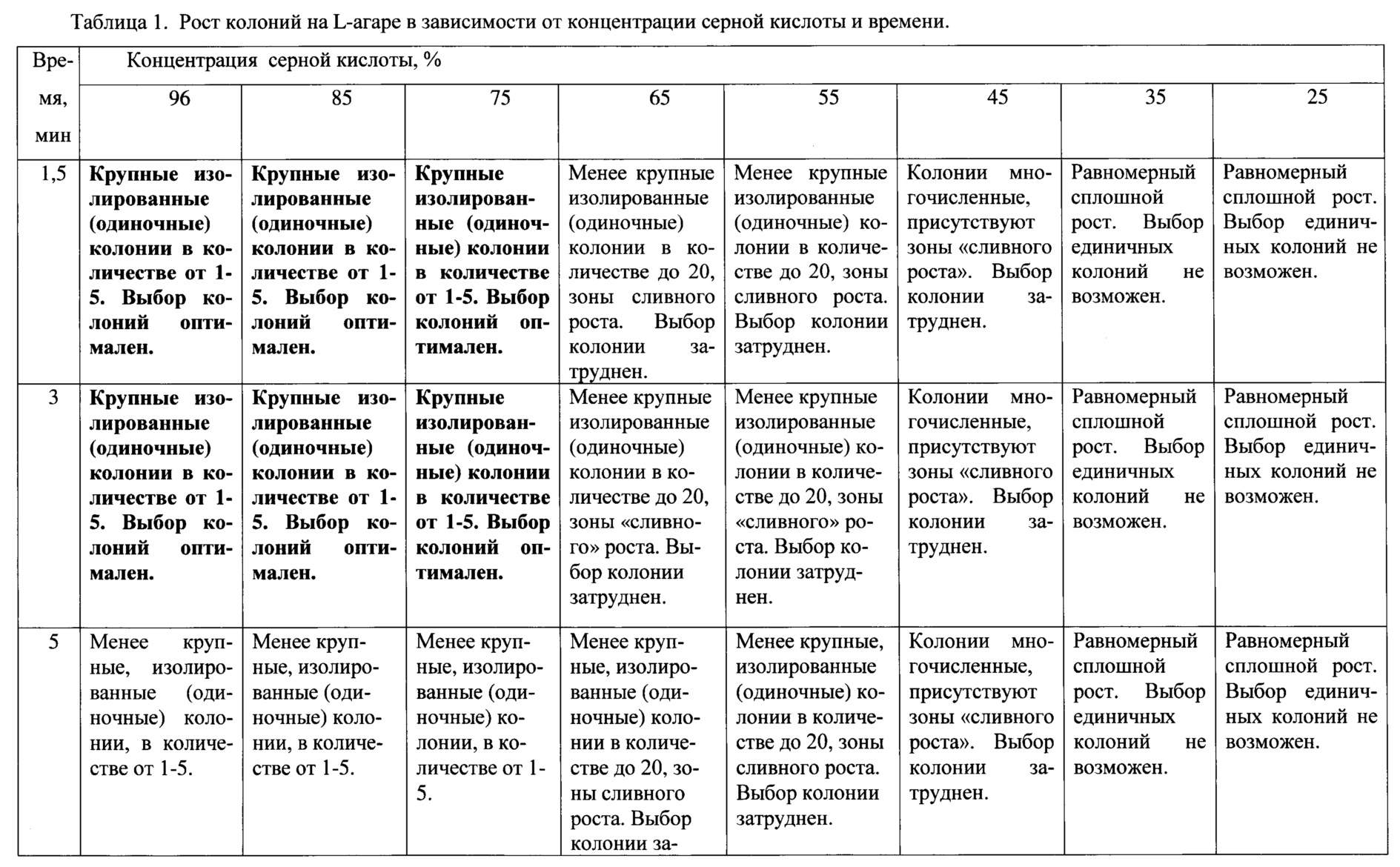
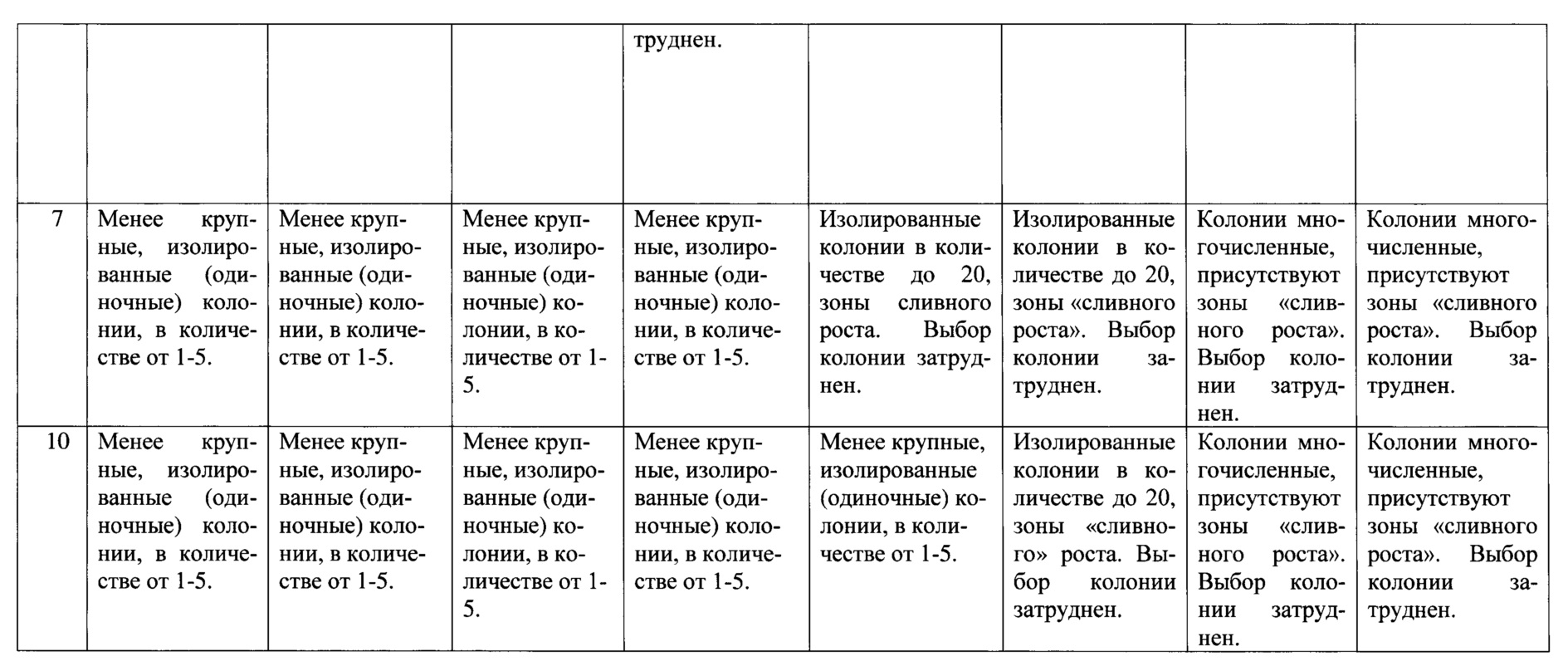
Таким образом, оптимальной является концентрация серной кислоты от 75 до 96%, т.к. при этой концентрации вырастают единичные крупные изолированные колонии, что делает их выборку (извлечение) и оценку морфологических свойств оптимальной. Минимальное время эксперимента, при котором вырастают изолированные колонии - 1,5-3 минуты.
Результаты идентификации колоний, выросших на питательных средах:
1. При росте на L-агаре - колонии средние и крупные. Максимальный диаметр составлял 0,7-1,2 см. Колонии округлой формы, серовато-белого цвета, матовые, бархатистые, с неровным краем. Все колонии сухие, не врастают в агар и легко отделяются от него.
2. Рост на МПА - колонии белые, серые, иногда желтые, морщинистые, твердые, восковидные, круглые или ползущие на стенку чашки.
3. Рост на МПБ - наблюдается помутнение среды, изредка образуется осадок.
4. Все штаммы грамположительные.
5. Прямые или почти прямые палочки, расположены одиночно, по две клетки или в коротких цепочках.
6. Образуют овальные споры, расположенные термально или субтермально.
7. Все штаммы подтвердили отрицательные реакцию Грегерсона.
8. Все штаммы подтвердили положительную реакцию на каталазу.
Все эти признаки подтверждают принадлежность выделенных штаммов к роду Bacillus. (Хоулт Дж. Криг Н. Определитель бактерий Берджи, в 2 томах. Том 1. Москва. Издательство "Мир", 1997; Gordon, R. The genus Bacillus / R. Gordon // In Handb. Microbiol. Cleveland (Ohio). - 1973. - V. l. - P. 71-88; Васильев Д.А., Калдыркаев А.И., Феоктистова H.A., Алешкин А.В. Идентификация бактерий Bacillus cereus на основе их фенотипической характеристики. Научное издание. - Ульяновск: НИИЦМиБ УлГСХА им. П.А. Столыпина, 2013, - 98 с.).
Способ выделения бактерий p. Bacillus из ризопланы и ризосферы прикорневой зоны растений, отличающийся тем, что измельченные корни растений совместно с прилегающими частичками почвы помещают в серную кислоту с концентрацией от 75% до 96% и температурой t=20-25°С, выдерживают в течение 1,5-3 мин, после чего 0,1 мл пробы высевают в чашки Петри на L-агар и культивируют при 37°С в течение 24 ч.
