Результат интеллектуальной деятельности: Рекомбинантная плазмида, экспрессирующая клонированный ген нейраминидазы Vibrio cholerae, и штамм Escherichia coli - суперпродуцент нейраминидазы Vibrio cholerae
Вид РИД
Изобретение
Изобретение относится к биотехнологии, генной инженерии, медицинской микробиологии и может быть использовано для получения препаратов нейраминидазы (NanH) Vibrio cholerae в целях создания специфических диагностикумов и фармацевтических препаратов, а также для изучения свойств, биохимической и биологической активности нейраминидазы (NanH)Vibrio cholerae.
Нейраминидаза (NanH) является одним из немаловажных факторов патогенности/персистенции холерных вибрионов. С одной стороны, она повышает чувствительность клеток кишечника к действию холерного токсина, с другой - участвуют в утилизации ганглиозидов высшего порядка в качестве источника питания. Известно, что продукция NanH может играть определенную роль в развитии легкой формы инфекции или кратковременного носительства [1-3]. Это обусловливает актуальность проведения дальнейших исследований свойств данного фактора, и требует наличия его препаратов.
Препараты NanH также широко используются в биохимических и медицинских исследованиях, в фармацевтической промышленности [4]. Показана перспективность их применения для создания новых пероральных средств лечения аллергических заболеваний [5].
Коммерческие препараты нейраминидазы Vibrio cholerae, производимые зарубежными компаниями (Sigma-Aldrich, ChemNet), отличаются высокой стоимостью (около 17000 евро за 0,2 мкМ продукта). Для их производства используют токсигенные штаммы холерных вибрионов, что требует соблюдения режима работы с возбудителями особо опасных инфекций. Согласно данным Taylor et al. [6], выход продукта составляет около 1 мг/л культуральной жидкости. Болгарскими исследователями в качестве продуцента был предложен более эффективный продуцент - нетоксигенный штамм V.cholerae nonO1/nonO139V13 [4], перспективный для использования в промышленных масштабах, однако и этом случае выход очищенного белка составляет ~2 мг/л культуральной жидкости.
Наиболее эффективным способом получения этого фактора в препаративных количествах представляется использование лабораторных штаммов E.coli, содержащих и экспрессирующих клонированный ген nanH.
За прототип выбран сконструированный ранее Vimr E.K. et al. [7] штамм E.coli НВ101 pCVD364, содержащий в составе рекомбинантной плазмиды pCVD364 фрагмент ДНК длиной 4,8 т.п.н. с геном nanH, экспрессирующимся под контролем собственного промотора. Активность продукта в экстрактах клеток несущего эту плазмиду штамма Е.coli HB101 составила 858 ед/мл общего белка. Авторам удалось выделить из этих экстрактов очищенный препарат, однако сведения о количестве использованной биомассы и выходе продукта в публикации не приведены.
Недостатком прототипа является неконтролируемая экспрессия гена NanH и невысокий выход искомого белка, для выделения которого в препаративных количествах потребуется наращивание продуцентов в больших объемах.
Техническая задача изобретения - клонирование гена nanH в составе плазмидного вектора pQE30, обеспечивающего экспрессию чужеродных генов под контролем мощного Т5-промотора, и создание штамма E.coli - суперпродуцента рекомбинантного белка NanH V.cholerae для выделения искомого продукта в препаративных количествах из минимальных объемов биомассы.
Задача решается путем создания:
- новой рекомбинантной плазмиды pNanH, экспрессирующей клонированный ген nanH холерного вибриона в штаммах кишечной палочки.
- штамма Escherichia coli JM103 pNanH - суперпродуцента нейраминидазы холерных вибрионов посредством трансформации штамма E.coli JM103 рекомбинантной плазмидой pNanH.
Векторная плазмида pQE30 несет ген устойчивости к ампициллину (bla) и содержит промоторно-операторную область, включающую Т5-промотор и два расположенных тандемом lac-оператора, обеспечивающих максимальную репрессию синтеза NanH в присутствии глюкозы, а также синтетический сайт связывания рибосомальной РНК, старт-кодон, последовательность триплетов, кодирующих синтез гексагистидина (6-His), полилинкер (MCS) и два терминатора транскрипции (t0 фага лямбда и Т1 из rrnB-оперона Е. coli). Экспрессия клонированных генов - происходит при индукции изопропил-β-D-тиогалактозидом (ИПТГ) и начинается с плазмидного старт-кодона, при этом образуется гибридный белок, перед первой аминокислотой которого располагается гексагистидиновый блок.
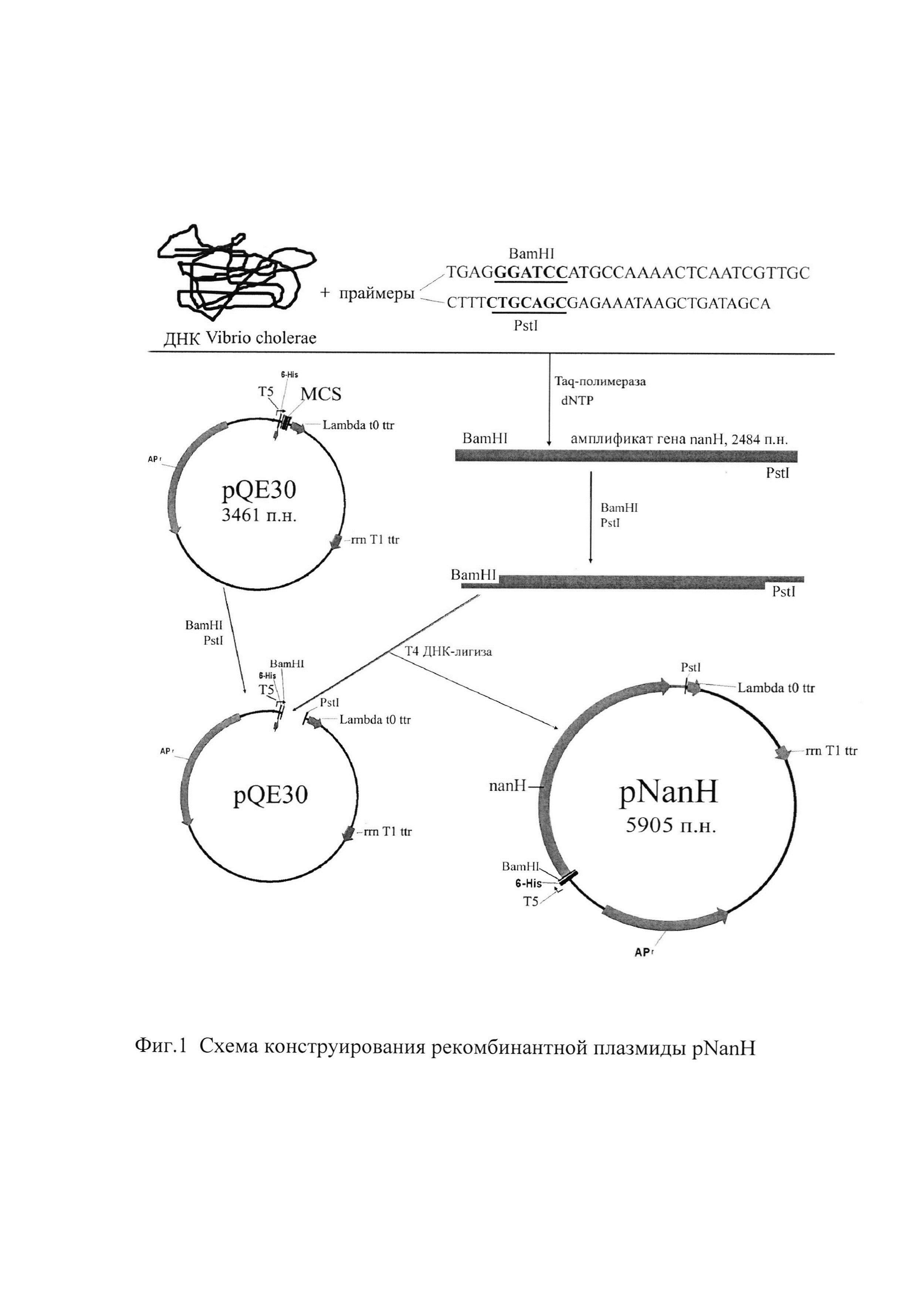
Плазмида pNanH представляет собой генно-инженерный вариант, полученный путем встраивания в вектор pQE30 гена nanH V.cholerae O1 биовараЭль Тор (см. фиг. 1).
Будучи трансформирована в штамм кишечной палочки JM103, рекомбинантная плазмида экспрессирует клонированный ген под контролем Т5-промотора. Экспрессия гена подавляется в присутствии глюкозы и индуцируется ИПТГ.
Штамм Е.coli JM103 pNanH представляет собой генно-инженерный вариант, полученный путем трансформации рекомбинантной плазмиды pNanH в штамм Е.coli JM103, и является продуцентом NanH V.cholerae. Штамм депонирован в Государственной коллекции патогенных бактерий «Микроб» под номером КМ2047.
Полученный штамм-продуцент характеризуется следующими признаками:
Культурально-морфологические свойства
В жидких питательных средах (бульоне Хоттингера, мясо-пептонном бульоне) образует равномерную муть, на плотных - круглые, выпуклые, гладкие, белые полупрозрачные колонии с ровным краем, тестообразной консистенции.
Физиолого-биохимические свойства
Штамм разлагает с образованием кислоты и газа глюкозу, арабинозуи маннит, не разлагает сахарозу, на среде Эндо образует лактозонегативные колонии. Ауксотроф.
Нейраминидазная активность: Свечение в УФ свете после инкубации в течение 20 мин 20 мкл культуры клеток штамма с равным объемом субстрата 4-метилумбеллиферил-N-ацетилнейраминовой кислоты (1 мг/мл)
Устойчивость к антибиотикам
Штамм устойчив к 50-100 мкг/мл ампициллина за счет экспрессии гена bla, находящегося в составе векторной плазмиды pQE30.
Способ получения и использования рекомбинантной плазмиды и штамма-продуцента иллюстрируется следующими примерами.
Пример 1. Клонирование гена nanH и получение рекомбинантной плазмиды.
Схема конструирования рекомбинантной плазмиды pNanH представлена на фиг. 1.
Для ПЦР-синтеза гена nanH используют праймеры, сконструированные заявителями на основе анализа нуклеотидной последовательности гена VC1784 в составе большой хромосомы V.cholerae N16961:
прямой - 
обратный - 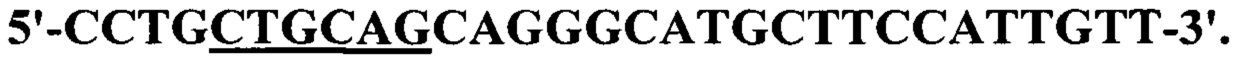
Поскольку амплификаты необходимо встроить в плазмидный вектор pQE30 в ориентации, обеспечивающей направление транскрипции под контролем Т5-промотора, на 5'-конце каждого праймера внесен сайт рестрикции для эндонуклеазы, образующей липкие концы: BamHI для прямого праймера и PstI - для обратного (в приведенных последовательностях выделены жирным шрифтом и подчеркнуты) в соответствии с порядком расположения сайтов рестрикции в полилинкере векторной плазмиды.
Из штамма V.cholerae Эль ТорР-5879 Инаба (Музей живых культур Ростовского-на-Дону противочумного института), нуклеотидная последовательность гена nanH которого (КU215667) полностью идентична таковой референс-штамма V.cholerae N16961, фенольным методом выделяют хромосомную ДНК, которая служит матрицей для синтеза искомого гена.
300 мкл реакционной смеси для полимеразной цепной реакции содержат 0,5 нг ДНК-матрицы и следующие компоненты в указанных концентрациях: по 2,5 мкл каждого праймера, по 2,5 мМ всех четырех дезоксинуклеотидтрифосфатов, 3 ед. Taq-полимеразы и 0,1 объема прилагаемого к ней 10-кратного буфера. Смесь разливают по 30 мкл в 0,5-мл пластиковые пробирки и осуществляют реакцию по следующей схеме: 94°С - денатурация (40 сек), 60°С - отжиг (40 сек), 72°С - синтез (40 сек). Всего проводят 30 циклов амплификации, в последнем цикле время синтеза увеличивают до 3 минут. По окончании реакции содержимое пробирок объединяют, очищают смесью фенол: хлороформ: изоамиловый спирт в соотношении 25:24:1 и осаждают этиловым спиртом.
Полученный таким образом ПЦР-амплификат длиной 2484 п.н. и ДНК векторной плазмиды pQE30 гидролизуют эндонуклеазами рестрикции BamHI и PstI согласно рекомендациям фирмы - изготовителя ферментов, очищают смесью фенол : хлороформ : изоамиловый спирт (25:24:1) и осаждают этиловым спиртом. Осадок растворяют в минимальном объеме деионизованной воды илигируют с использованием ДНК-лигазы фага Т4 и прилагаемого к ней буфера согласно рекомендациям изготовителя.
Лигазными смесями трансформируют компетентные клетки Е.coli Jm103, приготовленные накануне обработкой хлористым кальцием. После стандартной процедуры трансформации (0°С - 40 мин, 42°С - 2 мин, 0°С - 5 мин) клетки разводят в 10 раз средой LB с 0,5% глюкозы, подращивают в течение 1 ч и высевают на агар LB, содержащий 50 мкг/мл ампициллина и 0,5% глюкозы. Посевы инкубируют при 37°С. На следующие сутки рекомбинантные клоны отбирают по результатам ПЦР с праймерами для детекции искомого клона nanH:
прямой - 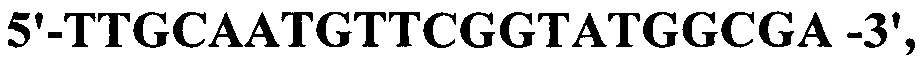
обратный - 
Положительным контролем служит ДНК штамма-донора Р-5879, отрицательным - штамма E.coli Jm103pQE30, содержащего векторную плазмиду без вставки. Результаты учитывают после электрофореза реакционных смесей в 1,8% агарозном геле по наличию/отсутствию амплификата длиной 585 п.н.
Пример 2. Изучение экспрессии клонированного гена nanH в Е.coli
Для проверки способности рекомбинантов к экспрессии ген nan отобранные по примеру 1 клоны культивируют в бульоне LB, содержащем 50 мг/мл ампициллина (без глюкозы) при 37°С в течение 3-4 ч с последующей индукцией ИПТГ в конечной концентрации 1 мМ в течение 1 ч. Затем по 20 мкл каждой культуры смешивают на стекле с равным объемом раствора субстрата 4-метилумбеллиферил-N-ацетилнейраминовой кислоты (1 мг/мл), спустя 20 мин просматривают в УФ свете и наблюдают флюоресценцию в пробах рекомбинантов, способных к синтезу NanH. У контрольного штамма E.coli Jm103pQE30E она отсутствует (фиг. 2). Позитивный клон с наилучшим свечением отбирают для дальнейших исследований.
На фиг. 2. отображена продукция NanH рекомбинантными клонами E.coli Jm103pNanH: свечение в УФ свете после инкубации с субстратом. 1 - контрольный штамм E.coli Jm103, содержащий векторную плазмиду pQE30 без вставки, 6 - NanH-негативный клон, 2-5, 7 - NanH-позитивные клоны, 8 - культура V.cholerae P-5879.
Пример 3. Изучение продуктивности штамма Е.coli Jm103pNanH и локализации рекомбинантного белка в его клетках.
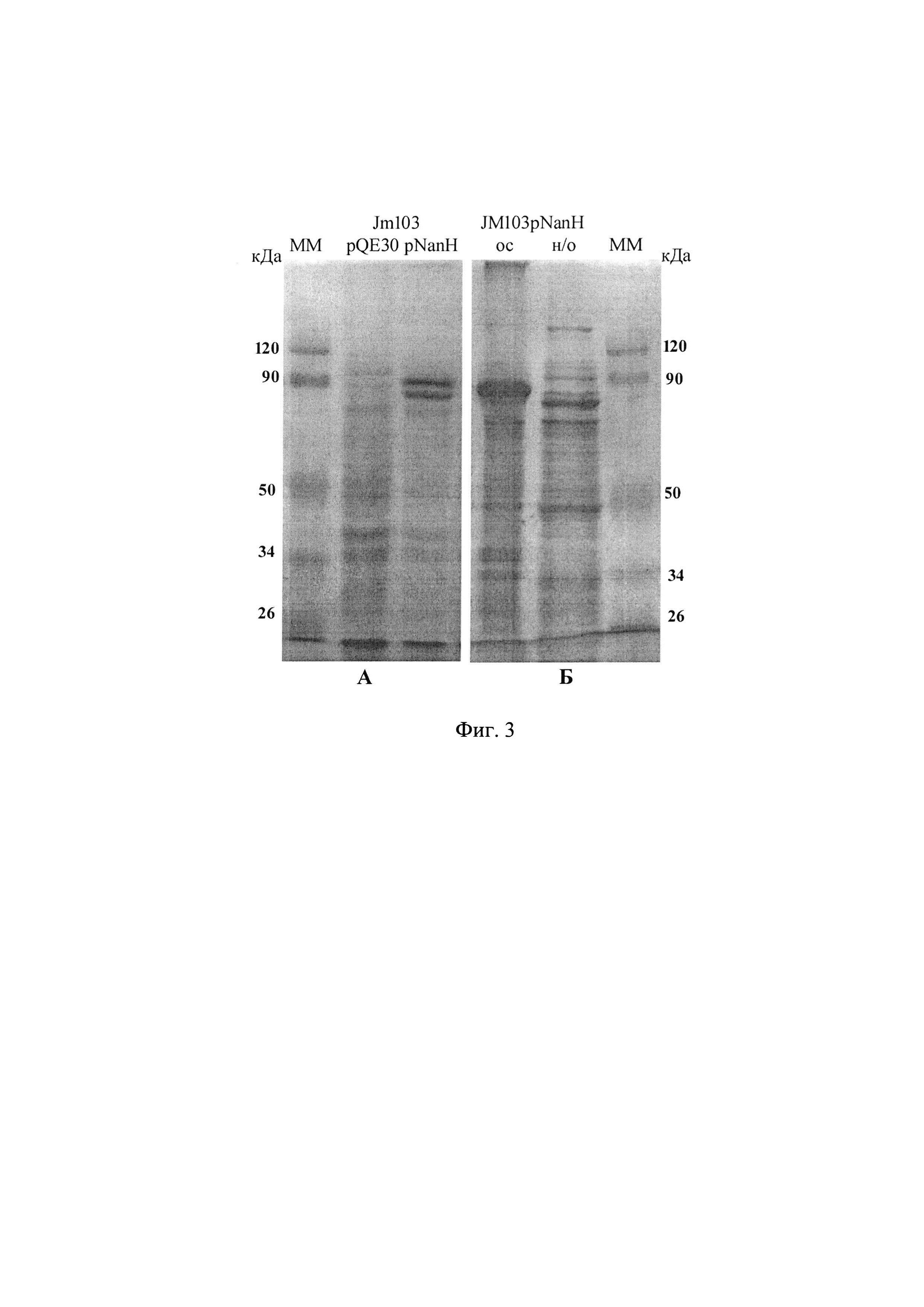
Рекомбинантный штамм E.coli JM103pNanH (КM 2047), а также контрольный штамм, содержащий векторную плазмиду pQE30 без вставки, выращивают в жидкой среде LB, содержащей 50 мкг/мл ампициллина (без глюкозы), в течение 3-4 ч при 37°С с шуттелированием при 150 об/мин и затем индуцируют 1 мМ ИПТГ в течение 1-2 ч, клетки осаждают центрифугированием, лизируют в буфере, содержащем 65 мМ трис-HClPH 6,8, 1% SDS и 10 мМ 2-меркаптоэтанола, при температуре 99°С в течение 10 мин. Лизат подвергают электрофорезу в 10% полиакриламидном геле (ПААГ) с SDS и окрашивают гель Coomassi Blue R250. В лизате клеток Е.coli JM103pNanH выявляются мажорные белковые полосы в области с ММ~83 кДа и ~89,5 кДа, (что соответствует молекулярной массе двух форм NanH) в отличие от лизата контрольного штамма, содержащего векторную плазмиду без вставки (фиг. 3А - лизаты целых клеток). По данным программы Quantity One, их общий удельный вес составляет приблизительно 9-10% суммарных клеточных белков.
Для определения локализации рекомбинантного белка клетки штамма JM103pNanH, выращенного с индукцией, разрушают ультразвуком на дезинтергаторе QSonica Q700 в течение 10 мин (40 импульсов по 5 сек, 357 Дж с перерывами в 10 сек; амплитуда 50) и подвергают электрофорезу растворимую (ос) и нерастворимую (н/о) фракции клеток, разделенных центрифугированием (фиг. 3Б).
На фиг. 3Б отображены:_нерастворимая (ос) и растворимая (н/о) фракции ультрозвуковых дезинтеграторов Jm103 р NanH.
Форма с молекулярной массой ~89,5 кДа представляет собой непроцессированный белок с гексатидиновым блоком (6His-tag) на N-конце и находится в нерастворимой фракции клеток в виде телец включения. Ее удельный вес составляет 5,6-6.6% суммарных клеточных белков. Вторая обнаруживается в основном в растворимой фракции, т.е. в периплазматическом пространстве клеток. Ее молекулярная масса ~83 кДа соответствует зрелой форме NanH, образующейся вследствие удаления сигнальной последовательности вместе с 6His-tag, общей длиной 58аа. Удельный вес зрелой формы составляет 3,4-3,8% суммарных белков.
Таким образом, сконструирован штамм E.coli M103pNanH-суперпродуцент нейраминидазы V.cholerae Эль Тор, который может быть использован для выделения целевого продукта в препаративных количествах. В зависимости от задач дальнейших исследований, можно получать исходный продукт (6His-NanH) из телец включения с помощью специфического сорбента типа Ni-NTA (никель-нитрилацетилированной сефарозы), либо зрелый белок NanH из осветленных ультразвуковых дезинтегратов клеток с использованием других методов очистки. Преимуществами полученного продуцента по сравнению с холерными вибрионами является высокий выход искомого белка, возможность культивирования без соблюдения режима работы с возбудителями особо опасных инфекций, отсутствие способности к синтезу каких-либо дополнительных биологически активных субстанций, которые могли бы затруднить его выделение и очистку, а по сравнению с известными рекомбинантными штаммами-продуцентами - непродолжительный период наращивания биомассы (4-6 часов включая индукцию), обеспечит ускоренное получение препарата.
Источники информации
1. Galen J.E., Ketley J.M., Fasano A., Richardson S.N., Wasserman S.S., Kaper J.B. Role of Vibrio cholerae neuraminidase in the function of cholerae toxin. Infect. Immun. 1992; 60(2):406-415.
2. Jermyn W.S., Boyd E.F. Characterization of a novel Vibrio pathogenicity island (VP1-2) encoding neuraminidase (nanH) among toxigenic Vibrio cholerae isolates. Microbiology. 2002; 148:3681-3693.
3. Figueiredo S.C., Neves-Borges A.C., Coelho A. The neuraminidase gene is present in the non-toxigenic Vibrio cholerae Amazonia strain: a different allele in comparison to the pandemic strains. Mem. Inst. Oswaldo Cruz. 2005; 100(6): 563-569.
4. Eneva R.T., Engibarov S.A., Petrova P., Abrashev R., Strateva Т., Kolyovska V., Abrashev J. High production of neuraminidase by a Vibrio cholerae non-01 strain - the first possible alternative to toxigenic producers. Appl. Biochem. Biotechnol. 2015; 176 (2): 412-427.
5. Diesner S.C., Bergmayr C., Wang X.Y., Heiden D., Exenberger S., Roth-Walter F., Starkl P., Ret D., Palischoll J., Gabor F., Untersmayr E. Characterisation of Vibrio cholerae neuraminidase as an immunomodulator for novel formulation of oral allergy immunotherapy. Clin. Immunol. 2018; 192:30-39.
6. Taylor G., Vimr E., Garman E., Laver G. Purification, crystallization and preliminary crystalografic study of neuraminidase from Vibrio cholerae and Salmonella typhimurium LT2. J. Mol. Biol. 1992; 226(4): 1287-1290.
7. Vimr E.R., Lawrisuk L., Galen J., Kaper J.B. Cloning and expression of the Vibrio cholerae-neuraminidase gene nanH in Escherichia coli. J. Bacteriol. 1988; 170: 1495-1504.