Результат интеллектуальной деятельности: ДОБАВКА ДЛЯ КУЛЬТИВИРОВАНИЯ ЭПИТЕЛИАЛЬНЫХ КЛЕТОК
Вид РИД
Изобретение
Изобретение относится к области биотехнологии и касается добавки для ускорения пролиферации клеточных культур в условиях in vitro, что может быть востребовано в химико-фармацевтической промышленности при получении значительного пула клеток-продуцентов биологически активных веществ, в медицине для быстрого накопления как ксеногенных, так и аутологичных клеток пациентов для заместительной терапии или 3D-биопечати органных конструктов, в токсикологии для тестирования на клеточных тест-системах косметических средств, детергентов, консервантов и инсектицидов, а также для изучения механизма действия и прогностического скрининга лекарственных препаратов и др.
Достигнутый в последние десятилетия прогресс в области молекулярной и клеточной биологии обусловил существенный рост числа отраслей, в которых востребованы клеточные технологии. В частности, в биотехнологии клеточные культуры широко используются в качестве продуцентов при производстве вакцин, гормонов и других секретируемых веществ, а также в качестве биологических тест-объектов при испытании новых фармакологических веществ и при установлении степени токсичности новых химических веществ (мутагенов, канцерогенов, детергентов, консервантов, косметических средств, изделий медицинского назначения). Суспензионные культуры нашли применение в вирусологии для выращивания и накопления вирусов. В медицине клеточные технологии применяют в заместительной терапии (ткане- и остеогенез), для диагностики и лечения ряда наследственных заболеваний. Кроме того, роль клеточных культур различного происхождения крайне высока при решении ряда общебиологических задач, таких как установление сущности важнейших и сложнейших механизмов дифференцировки, специализации, старения клеток, их биологической активности, злокачественной трансформации и многого другого. Клеточные линии необходимы для сохранения генофонда исчезающих видов животных и растений.
В большинстве случаев успех применения клеточных технологий обусловлен наличием достаточного количества клеточного материала, с чем связаны значительные проблемы. Прежде всего, проблемы касаются источника клеток: как известно, в условиях in vitro первичные культуры клеток, полученные из тканей животных и человека, обладают ограниченным пролиферативным потенциалом и нуждаются в целом спектре стимуляторов роста. Чтобы усилить пролиферацию клеток и повысить практический выход клеточного материала, в рецептуру стандартных (коммерческих) питательных сред вводят различные модифицирующие добавки.
В частности, известен способ повышения выхода биомассы клеток млекопитающих путем добавления в питательную среду экстракта лиофильно высушенной медицинской пиявки (см. патент РФ №. 2588666 по кл. МПК C12N 5/00, опуб. 10.07.2016), продукта ферментативного разложения мяса рыб или экстракта из мяса рыб (патент РФ № 2333242 по кл. МПК C12N 5/02, опуб. 10.09.2008), солей холина (патент РФ № 2563353 по кл. МПК C12N 5/02, опуб. 20.09.2015), железа в виде различных железосодержащих соединений (патент РФ № 2663794 по кл. МПК C12N 5/02, опуб. 09.08.2018). Известна композиция (см. патент РФ № 2341270 по кл. МПК А61К35/12, опуб. 20.08.2008), содержащая кондиционированную культуральную среду, полученную при культивировании лейкоцитов периферической крови и стволовых и/или прогениторных клеток в среде, а также разрушенные культивируемые клетки. Также известен способ повышения пролиферативных свойств диплоидных клеток фибробластов человека в результате их культивирования в питательной среде, содержащей 10% фибринолитически активной плазмы (ФАП) человека и тромбоцитарный фактор роста PDGF (патент РФ № 2536992, по кл. МПК C12N 5/02, опуб. 27.12.2014).
Однако предложенные добавки либо дорогостоящи, либо их получение является многоэтапным, трудоемким и высокозатратным процессом, либо они не обеспечивают быстрое ускорение пролиферации клеток. Последнее влечет за собой довольно серьезные осложнения, поскольку длительное накопление необходимого объема клеточного материала может привести к утере исходных свойств клеток и исчерпанию их пролиферативного потенциала. Более того, возникает необходимость частой смены питательной среды из-за протекающих в культуре метаболических процессов, что существенно увеличивает себестоимость получаемого продукта и делает применение клеточной технологии экономически несостоятельным.
Наиболее близким к заявляемой является добавка к стандартной питательной среде для культивирования различных типов клеток в виде полиэлектролитного комплекса (ПЭК) анионного производного целлюлозы и катионного хитозана (степень деацетилирования СД = 50−100 мольн.%, средневязкостная молекулярная масса ММ = 10−3000 кДа) (см. патент Японии № 3311074 по кл. МПК С12М3/00, С12N11/10, опуб. 05.08.2002). ПЭК получают смешением этих противоположно заряженных полимеров в дистиллированной воде или буферной среде. Для повышения водорастворимости ПЭК используют водные растворы метанола, этанола, ацетона и т.п. Физико-химические показатели реакционной смеси, в которой формируется ПЭК, варьируются в широких пределах: рН может колебаться от 3 до 9, ионная сила – от 0 до 1.0, а температура может достигать значения +60°С. Относительная концентрация этих двух полимеров в ПЭК зависит от типа культивируемых клеток, состава питательной среды и может варьироваться в пределах от 0.25 до 4.0. Кроме того, она определяет способ применения ПЭК: либо путем его прямого внесения в питательную среду, либо путем нанесения на поверхность культуральной посуды (пластика, стекла, полиэтилена, металла и др.) в качестве пленочного покрытия.
Однако, даже следовые количества метанола, этанола, ацетона и т.п. в составе ПЭК, высокие кислотность и ионная сила среды, а также повышение температуры среды, в которой формируется ПЭК, могут негативно отразиться как на функциональных свойствах полимерных компонентов комплекса, так и на процессах адгезии и пролиферации клеточных культур. Кроме того, при определенном составе полимеров образующийся ПЭК плохо растворим в воде, что делает невозможным введение ПЭК в состав питательной среды и предусматривает его использование только для получения пленочного покрытия на культуральной посуде. Следует также отметить, что ПЭК в клеточных технологиях используется, в основном, в качестве субстрата для клеток, поскольку он существенно повышает адгезивные свойства опорозависимых культур. Задача ускорения адгезии и пролиферации клеточных культур в изобретении не ставилась.
Технической проблемой заявляемого изобретения является создание добавки для культивирования эпителиальных клеток, обеспечивающей повышение пролиферативных свойств клеток.
Техническим результатом изобретения является ускорение адгезии и пролиферации клеток млекопитающих в условиях in vitro в ранние сроки культивирования.
Технический результат достигается тем, что добавка для культивирования эпителиальных клеток на основе хитозана, согласно изобретению, представляет собой хитозан в солевой форме, полученной при взаимодействии хитозана с органической кислотой, выбранной из аскорбиновой или аспарагиновой или аминокапроновой или гликолевой кислоты при мольном соотношении хитозан:кислота 0.4−1.6.
При этом хитозан имеет молекулярную массу 30 – 200 кДа, а добавка представляет собой стерильный водный раствор или лиофильно высушенный порошок хитозана в солевой форме.
Добавку получают по реакции солеобразования хитозана в водной среде с биоактивными функциональными лигандами, в частности, анионами фармакопейных органических кислот − аспарагиновой или аскорбиновой или аминокапроновой или гликолевой.
Данные фармакопейные органические кислоты биологически безвредны в используемых количествах, биосовместимы с тканями организма и не вызывают токсического действия. Кроме того, аскорбиновая и аспарагиновая кислоты снижают окислительное повреждение культивируемых клеток человека и обладают эффектом стимулирования выработки коллагена в фибробластах, что существенно повышает адгезивную активность клеточных культур. Гликолевая кислота благодаря низкому молекулярному весу свободно проникает сквозь плазматическую мембрану и запускает процессы регенерации в тканях, а также стимулирует синтез структур внеклеточного матрикса (гликопротеидов, протеогликанов и др.). Аминокапроновая кислота способствует ускорению пролиферации эпителиальных клеток.
В соответствии с настоящим изобретением могут применяться различные типы клеток млекопитающих. Для культивирования клеток может быть использована любая стандартная питательная среда, адекватно соответствующая потребностям клеточной культуры. Среда может быть дополнена любыми компонентами, необходимыми для поддержания культивируемых клеток.
Важным условием осуществления настоящего изобретения является порядок введения компонентов в питательную среду. Сначала в питательную среду вносится аликвотное количество водного раствора модифицирующей добавки в виде хитозана в солевой форме и аспарагиновой или аскорбиновой или аминокапроновой или гликолевой кислоты. Смесь тщательно перемешивается (не более 1 минуты) и в нее незамедлительно вносится суспензия клеток. Такое решение позволяет инициировать клетки к ускоренной пролиферации.
Изобретение поясняется иллюстрациями, где на фиг. 1 – 3 представлены результаты культивирования различных клеток в условиях насыщающей влажности в СО2-инкубаторе при температуре 37°С: (а) − в питательной среде DMEM с 10% FBS, (б) – в питательной среде DMEM с 10% FBS и с добавкой, а именно:
на фиг. 1. – формирование монослоя дермальных фибробластов через 48 часов культивирования без добавки (пример 1) и с добавкой на основе солевой формы хитозана и аспарагиновой кислоты (пример 2);
на фиг. 2. – формирование монослоя эпителиоподобных клеток линии МА-104 через 48 часов культивирования без добавки (пример 7) и с добавкой на основе солевой формы хитозана и аспарагиновой кислоты (пример 8);
на фиг. 3. – адгезия и распластывание эпителиоподобных клеток линии МА-104 через 1 час культивирования без добавки (пример 7) и с добавкой на основе солевой формы хитозана и аскорбиновой кислоты (пример 9);
на фиг. 4. представлены адгезия и распластывание нормальных кератиноцитов человека через 1 час культивирования в условиях насыщающей влажности в СО2-инкубаторе при температуре 37°С: (а) − в смеси питательных сред DMEM и F12 (3:1) с 10% FBS (пример 12), (б) − в смеси питательных сред DMEM и F12 (3:1) с 10% FBS и с добавкой на основе солевой формы хитозана и аминокапроновой кислоты (пример 16).
Приготовление добавки.
В качестве исходных реагентов для получения добавки используют воздушно-сухой порошок хитозана с СД ≥ 75−80 мольн.% и ММ = 30–200 кДа, аспарагиновую или аскорбиновую или аминокапроновую или гликолевую кислоты квалификации х.ч, бидистиллированную воду, дегазированную от CO2 и О2 кипячением при 100°С в течение 1 часа.
Готовят растворы хитозана концентрации 2.9–5.9·10-5 осново-моль/мл в водном растворе органической кислоты при соблюдении мольного соотношения [хитозан(−NН2)] / [кислота] = 0.4–1.6. Процесс растворения компонентов проводят по стандартной методике при комнатной температуре. Навески хитозана и аспарагиновой или аскорбиновой или аминокапроновой кислоты, либо навеску хитозана и объем гликолевой кислоты помещают в стерильную колбу заданного объема, добавляют расчетное количество бидистиллированной воды, перемешивают до полного растворения компонентов (формирования солевой формы) не более 2 часов и фильтруют через фильтр Millipore с диаметром пор ≤0.45 мкм. Хранят в стерильной посуде при +4°С не более 2 суток. Для культивирования клеток в питательную среду вносят водный раствор модифицированной добавки и незамедлительно добавляют суспензию клеточной культуры. Оптимальное количество вводимой модифицирующей добавки определяют в предварительных опытах с использованием стандартной питательной среды с индикатором рН. Вводимый объем модифицирующей добавки не должен изменять уровень кислотности (рН) культуральной среды, что контролируется постоянством цвета питательной среды с индикатором рН.
Из полученных растворов хитозана в аспарагиновой или аскорбиновой или аминокапроновой или гликолевой кислоте при необходимости может быть получена высушенная до порошкообразного состояния лиофилизированная солевая форма хитозана и аспарагиновой или аскорбиновой или аминокапроновой или гликолевой кислоты. При этом, срок хранения лиофилизированной солевой формы (полисоли) при +4°С увеличивается до 3−5 лет. Перед использованием лиофилизированную солевую форму растворяют в расчетном количестве бидистиллированной воды (не более 30 минут), вносят аликвотное количество модифицирующей добавки в питательную среду и незамедлительно добавляют суспензию клеточной культуры.
Состав модифицированной добавки, отношение концентраций компонентов модифицированной добавки, а также аликвотное количество модифицированной добавки, вносимое в питательную среду, определяет специалист, исходя из конкретных характеристик культивируемых клеток, состава питательной среды, в которой выращивают клетки, и условий их роста.
Культивирование клеток.
Настоящее изобретение может применяться при любом способе выращивания клеток в любом удобном объеме питательной среды. Для культивирования клеток может быть использована любая питательная среда, которая соответствует потребностям клеточной культуры. Среда может быть дополнена любыми компонентами, необходимыми для поддержания культивируемых клеток. В некоторых вариантах осуществления настоящего изобретения применяется среда DMEM (Dulbecco's Modified Eagle's Medium), дополненная 10% FBS и 1% антибиотиков. В других вариантах осуществления изобретения применяется смесь сред DMEM и F12 (3:1) с добавлением 10% FBS и 1% антибиотиков.
Могут применяться различные типы клеток млекопитающих, в том числе опорозависимые. В некоторых вариантах осуществления настоящего изобретения клетки млекопитающих выбирают из линии эпителиоподобных клеток эмбриональной почки макаки резус (MA-104). В некоторых вариантах осуществления изобретения клетки млекопитающих являются человеческими дермальными фибробластами и кератиноцитами, выделенными из фрагментов кожи здоровых взрослых доноров, подвергшихся косметической операции.
Для получения суспензии одиночных клеток клеточные линии выращивают в стандартной ростовой среде до фазы предконфлюэнтного монослоя. Затем монослой обрабатывают 0.25% раствором трипсина. Полученную взвесь клеток дважды отмывают центрифугированием в большом объеме свежей среды и вносят в питательную среду для культивирования сразу после внесения аликвотного количества модифицирующей добавки в виде солевой формы хитозана и аспарагиновой или аскорбиновой или аминокапроновой или гликолевой кислоты. Культивирование проводят при соответствующих условиях, необходимых для поддержания роста клеток.
Оценку ростовых свойств питательной среды с модифицирующей добавкой проводят путем сравнения скорости пролиферации клеток, а также времени их адгезии и распластывания относительно той же культуры клеток, выросшей в такой же питательной среде без модифицирующей добавки. Для объективизации исследования проводят по три опытных посева.
Наблюдение за пролиферацией, адгезией и распластыванием клеток выполняют на инвертированном микроскопе Биолам П. После инкубации культуры в течение определенного времени (в зависимости от конкретного эксперимента) неприкрепившиеся клетки удаляют. Клетки, прикрепившиеся к субстрату, фиксируют 70% раствором этилового спирта в течение 10 мин при 20°С, окрашивают 0.04% раствором трипанового синего и подсчитывают в камере Горяева.
В качестве количественного критерия оценки пролиферативных свойств питательной среды используют относительный индекс пролиферации (ОИП), который рассчитывают по формуле:
ОИП = NT / NК ,
где NT – количество клеток, снятых с чашки с тестируемой средой; NК – количество клеток, снятых с чашки с контрольной средой.
Настоящее изобретение более подробно поясняется на отдельных примерах, которые не могут рассматриваться как ограничивающие объем изобретения.
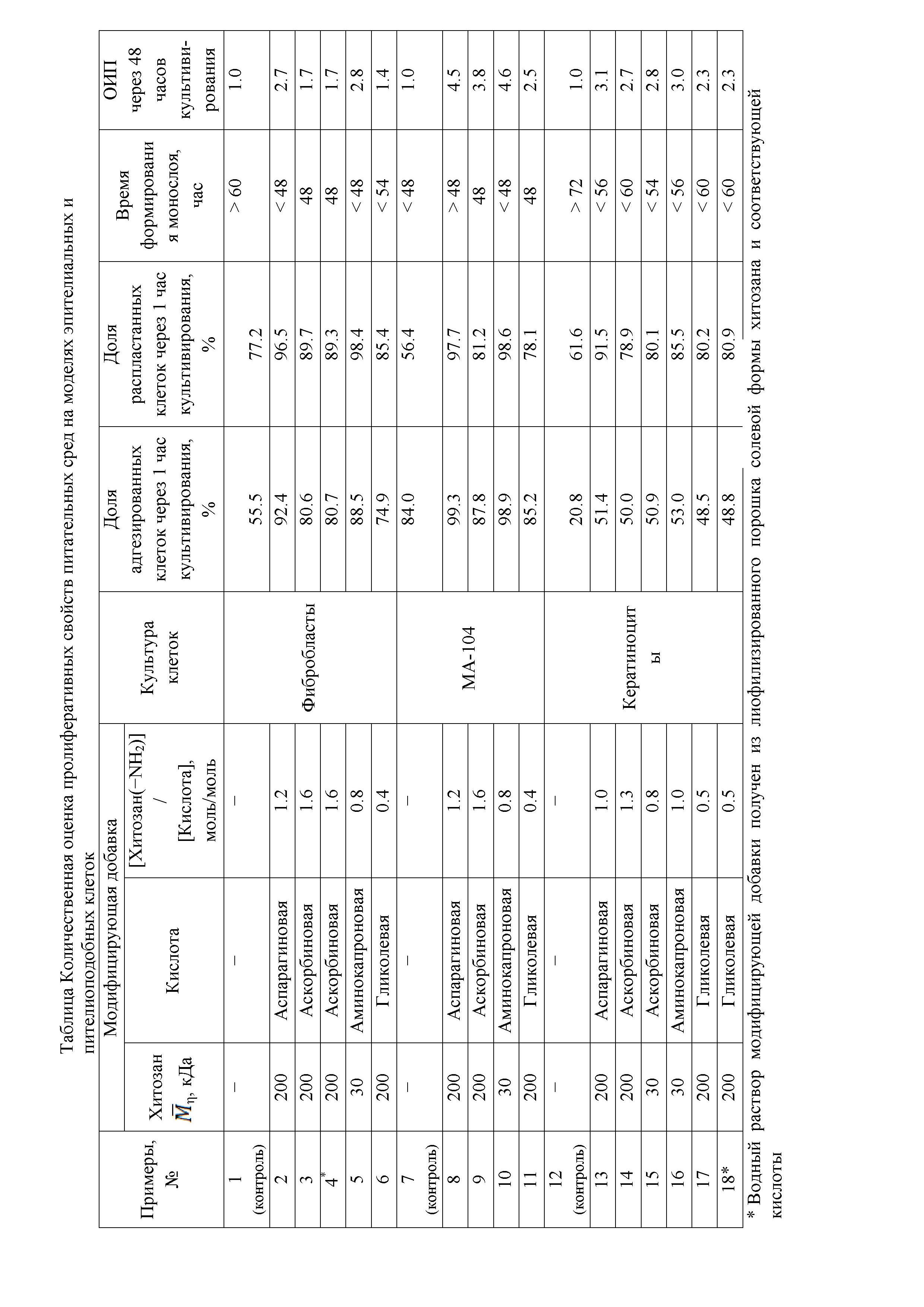
Ниже приведены примеры культивирования различных эпителиальных клеток без заявляемой добавки и в её присутствии, а в таблице представлена количественная оценка пролиферативных свойств питательных сред на моделях эпителиальных и эпителиоподобных клеток.
Пример 1. Контроль пролиферации фибробластов.
Фибробласты получают методом спонтанной миграции клеток из биоптатов кожи здоровых взрослых доноров, подвергшихся косметической операции. Фрагменты кожи (3–5 мм) промывают фосфатным буфером, помещают в чашки Петри (Costar), накрывают покровным стеклом и заливают средой DMEM (Sigma) с 10% FBS (Hyclone) и смесью антибиотиков (Sigma). Клетки выращивают в инкубаторе с 5% СО2 при температуре 37°С. Миграция фибробластов начинается через 3–5 суток. На 14–20-е сутки из сформировавшегося монослоя получают суспензию клеток путем обработки смесью 0.25%-ного трипсина и 0.02%-ного ЭДТА.
В стерильные чашки Петри вносят ростовую среду DMEM (Sigma), дополненную 10% FBS (Hyclone) и 1% антибиотиков (Sigma), и суспензию суточной культуры фибробластов (2–7 пассаж) из расчета 200 тыс.кл./мл. Клетки выращивают 48 часов в условиях насыщающей влажности в инкубаторе с 5% СО2 при 37єС. Питательную среду не меняют до окончания срока наблюдения.
Доля адгезированных фибробластов через 1 час культивирования в стандартных условиях составляет 55.5%, доля распластанных клеток – 77.2%. Время формирования зрелого монослоя клеток превышает 60 часов. Относительный индекс пролиферации (ОИП) фибробластов в стандартной среде через 48 часов культивирования составляет 1.
Пример сформированного монослоя дермальных фибробластов через 48 часов культивирования в условиях насыщающей влажности в СО2-инкубаторе при температуре 37°С в питательной среде DMEM с 10% FBS приведен на Фиг. 1 (а).
Пример 2. Все этапы выделения и культивирования фибробластов аналогичны примеру 1. Отличие в том, что в стандартную питательную среду дополнительно вводят аликвотное количество стерильного водного раствора солевой формы хитозана и аспарагиновой кислоты, полученной из хитозана с ММ = 200 кДа при мольном соотношении [хитозан(−NН2)] / [кислота] = 1.2, а затем незамедлительно вносят суспензию фибробластов.
Доля адгезированных фибробластов через 1 час культивирования в питательной среде с добавкой в виде солевой формы хитозана и аспарагиновой кислоты составляет 92.4%, доля распластанных клеток – 96.5%. Время формирования зрелого монослоя клеток не превышает 48 часов. ОИП фибробластов в модифицированной питательной среде через 48 часов культивирования составляет 2.7.
Пример сформированного монослоя дермальных фибробластов через 48 часов культивирования в условиях насыщающей влажности в СО2-инкубаторе при температуре 37°С в питательной среде DMEM с 10% FBS и модифицирующей добавкой на основе солевой формы хитозана и аспарагиновой кислоты и хитозана приведен на Фиг. 1 (б).
Пример 3. Все этапы выделения и культивирования фибробластов аналогичны примеру 2. Отличие в том, что в качестве модифицирующей добавки используют солевую форму хитозана и аскорбиновой кислоты, полученную при мольном соотношении [хитозан(−NН2)] / [кислота] = 1.6.
Доля адгезированных фибробластов через 1 час культивирования в питательной среде с добавкой в виде солевой формы хитозана и аскорбиновой кислоты составляет 80.6%, доля распластанных клеток – 89.7%. Время формирования зрелого монослоя клеток 48 часов. ОИП фибробластов в модифицированной питательной среде через 48 часов культивирования составляет 1.7.
Пример 4. Все этапы выделения и культивирования фибробластов аналогичны примеру 3. Отличие в том, что стерильный водный раствор хитозана и аскорбиновой кислоты получают из лиофилизированного порошка солевой формы хитозана и аскорбиновой кислоты.
Доля адгезированных фибробластов через 1 час культивирования в питательной среде с добавкой солевой формы хитозана и аскорбиновой кислоты составляет 80.7%, доля распластанных клеток – 89.3%. Время формирования зрелого монослоя клеток 48 часов. ОИП фибробластов в модифицированной питательной среде через 48 часов культивирования составляет 1.7.
Пример 5. Все этапы выделения и культивирования фибробластов аналогичны примеру 2. Отличие в том, что в качестве модифицирующей добавки используют солевую форму хитозана и аминокапроновой кислоты, полученную из хитозана с ММ = 30 кДа при мольном соотношении [хитозан(−NН2)] / [кислота] = 0.8.
Доля адгезированных фибробластов через 1 час культивирования в питательной среде с добавкой солевой формы хитозана и аминокапроновой кислоты составляет 88.5%, доля распластанных клеток – 98.4%. Время формирования зрелого монослоя клеток менее 48 часов. ОИП фибробластов в модифицированной питательной среде через 48 часов культивирования составляет 2.8.
Пример 6. Все этапы выделения и культивирования фибробластов аналогичны примеру 2. Отличие в том, что в качестве модифицирующей добавки используют солевую форму хитозана и гликолевой кислоты, полученную при мольном соотношении [хитозан(−NН2)] / [кислота] = 0.4.
Доля адгезированных фибробластов через 1 час культивирования в питательной среде с добавкой солевой формы хитозана и гликолевой кислоты составляет 74.9%, доля распластанных клеток – 85.4%. Время формирования зрелого монослоя клеток менее 54 часов. ОИП фибробластов в модифицированной питательной среде через 48 часов культивирования составляет 1.4.
В таблице (примеры №1–6) приведена количественная оценка пролиферативных свойств питательных сред на модели человеческих дермальных фибробластов: доля адгезированных и распластанных клеток через 1 час культивирования, время формирования монослоя и относительный индекс пролиферации фибробластов в стандартной питательной среде DMEM и с модифицирующей добавкой.
Представленные данные показывают, что предлагаемая добавка существенно улучшает ростовые качества питательной среды в отношении дермальных фибробластов. Доля (%) адгезированных и распластанных клеток через 1 час культивирования превышает таковые в контроле в 1.7 и 1.3 раза, соответственно, при использовании солевой формы хитозана и аспарагиновой кислоты, в 1.5 и 1.2 раза при использовании солевой формы хитозана и аскорбиновой кислоты, в 1.6 и 1.3 раза при использовании солевой формы хитозана и аминокапроновой кислоты, в 1.2 и 1.1 раза при использовании солевой формы хитозана и гликолевой кислоты. По сравнению с контролем, где время формирования монослоя клеток превышает 60 часов, время формирования зрелого монослоя клеток при использовании модифицирующей добавки не превышает 48–54 часов, что говорит о способности модифицированной среды стимулировать рост культуры в более ранние сроки. Относительный индекс пролиферации фибробластов в модифицированной питательной среде всегда выше, чем в контроле, что также свидетельствует о существенном ускорении роста клеточной популяции фибробластов.
Пример 7. Контроль пролиферации клеток линии МА-104. Культура MA-104 предоставлена Российской коллекцией клеточных культур позвоночных ИНЦ РАН (г. Санкт-Петербург).
В стерильные чашки Петри вносят ростовую среду DMEM (Sigma), дополненную 10 % FBS (Hyclone) и 1% антибиотиков (Sigma), и суспензию суточной культуры клеток линии МА-104 из расчета 110 тыс.кл./мл. Клетки выращивают 48 часов в условиях насыщающей влажности в инкубаторе с 5% СО2 при 37°С. Питательную среду не меняют до окончания срока наблюдения.
Доля адгезированных клеток линии МА-104 через 1 час культивирования в стандартных условиях составляет 84.0%, доля распластанных клеток – 56.4%. Время формирования зрелого монослоя клеток превышает 48 часов. ОИП клеток линии МА-104 в стандартной среде через 48 часов культивирования составляет 1.
Пример сформированного монослоя эпителиоподобных клеток линии МА-104 через 48 часов культивирования в условиях насыщающей влажности в СО2-инкубаторе при температуре 37°С в питательной среде DMEM с 10% FBS приведен на Фиг. 2 (а).
Пример адгезии и распластывания эпителиоподобных клеток линии МА-104 через 1 час культивирования в условиях насыщающей влажности в СО2-инкубаторе при температуре 37°С в питательной среде DMEM с 10% FBS приведен на Фиг. 3 (а).
Пример 8. Все этапы культивирования клеток линии МА-104 аналогичны примеру 7. Отличие в том, что в стандартную питательную среду дополнительно вводят аликвотное количество стерильного водного раствора солевой формы хитозана и аспарагиновой кислоты, полученной из хитозана с ММ = 200 кДа при мольном соотношении [хитозан(−NН2)] / [кислота] = 1.2, а затем незамедлительно вносят суспензию клеток линии МА-104.
Доля адгезированных клеток линии МА-104 через 1 час культивирования в питательной среде с добавкой солевой формы хитозана и аспарагиновой кислоты составляет 99.3%, доля распластанных клеток – 97.7%. Время формирования зрелого монослоя клеток менее 48 часов. ОИП клеток линии МА-104 в модифицированной питательной среде через 48 часов культивирования составляет 4.5.
Пример сформированного монослоя эпителиоподобных клеток линии МА-104 через 48 часов культивирования в условиях насыщающей влажности в СО2-инкубаторе при температуре 37°С в питательной среде DMEM с 10% FBS и модифицирующей добавкой на основе солевой формы хитозана и аспарагиновой кислоты приведен на Фиг. 2 (б).
Пример 9. Все этапы культивирования клеток линии МА-104 аналогичны примеру 8. Отличие в том, что в качестве модифицирующей добавки используют солевую форму хитозана и аскорбиновой кислоты, полученную при мольном соотношении [хитозан(−NН2)] / [кислота] = 1.6.
Доля адгезированных клеток линии МА-104 через 1 час культивирования в питательной среде с добавкой солевой формы хитозана и аскорбиновой кислоты составляет 87.8%, доля распластанных клеток – 81.2%. Время формирования зрелого монослоя клеток 48 часов. ОИП клеток линии МА-104 в модифицированной питательной среде через 48 часов культивирования составляет 3.8.
Пример адгезии и распластывания эпителиоподобных клеток линии МА-104 через 1 час культивирования в условиях насыщающей влажности в СО2-инкубаторе при температуре 37°С в питательной среде DMEM с 10% FBS и модифицирующей добавкой на основе солевой формы хитозана и аскорбиновой кислоты приведен на Фиг. 3 (б).
Пример 10. Все этапы культивирования клеток линии МА-104 аналогичны примеру 8. Отличие в том, что в качестве модифицирующей добавки используют солевую форму хитозана и аминокапроновой кислоты, полученную из хитозана с ММ = 30 кДа при мольном соотношении [хитозан(−NН2)] / [кислота] = 0.8.
Доля адгезированных клеток линии МА-104 через 1 час культивирования в питательной среде с добавкой солевой формы хитозана и аминокапроновой кислоты составляет 98.9%, доля распластанных клеток – 98.6%. Время формирования зрелого монослоя клеток менее 48 часов. ОИП клеток линии МА-104 в модифицированной питательной среде через 48 часов культивирования составляет 4.6.
Пример 11. Все этапы культивирования клеток линии МА-104 аналогичны примеру 8. Отличие в том, что в качестве модифицирующей добавки используют солевую форму хитозана и гликолевой кислоты, полученную при мольном соотношении [хитозан(−NН2)] / [кислота] = 0.4.
Доля адгезированных клеток линии МА-104 через 1 час культивирования в питательной среде с добавкой солевой формы хитозана и гликолевой кислоты составляет 85.2%, доля распластанных клеток – 78.1%. Время формирования зрелого монослоя клеток 48 часов. ОИП клеток линии МА-104 в модифицированной питательной среде через 48 часов культивирования составляет 2.5.
В таблице (примеры №7–11) приведена количественная оценка пролиферативных свойств питательных сред на модели эпителиоподобных клеток животного происхождения (линия МА-104).
Представленные данные показывают, что предлагаемая добавка существенно улучшает ростовые качества питательной среды в отношении клеток линии МА-104. Доля (%) адгезированных и распластанных клеток через 1 час культивирования превышает таковые в контроле в 1.2 и 1.7 раза, соответственно, при использовании солевой формы хитозана и аспарагиновой кислоты, в 1.1 и 1.4 раза при использовании солевой формы хитозана и аскорбиновой кислоты, в 1.2 и 1.8 раза при использовании солевой формы хитозана и аминокапроновой кислоты, в 1.1 и 1.4 раза при использовании солевой формы хитозана и гликолевой кислоты. По сравнению с контролем, где время формирования монослоя клеток превышает 48 часов, время формирования зрелого монослоя клеток линии МА-104 при использовании модифицирующей добавки составляет 48 часов и менее, что говорит о способности модифицированной среды стимулировать рост культуры в более ранние сроки. ОИП фибробластов в модифицированной питательной среде всегда выше, чем в контроле, что также свидетельствует о существенном ускорении роста клеточной популяции фибробластов.
Пример 12. Контроль пролиферации нормальных кератиноцитов человека. Культуру нормальных кератиноцитов человека получают из биоптатов кожи здоровых взрослых доноров по модифицированному методу Рейнвальда.
В стерильные чашки Петри вносят смесь ростовых сред DMEM (Sigma) и F12 (3:1), дополненную 10% FBS (Hyclone) и 1% антибиотиков (Sigma), и суспензию суточной культуры кератиноцитов из расчета 250 тыс.кл./мл. Клетки выращивают 48 часов в условиях насыщающей влажности в инкубаторе с 5% СО2 при 37°С. Питательную среду не меняют до окончания срока наблюдения.
Доля адгезированных кератиноцитов через 1 час культивирования в стандартных условиях составляет 20.8%, доля адгезированных и распластанных клеток – 61.6%. Формирование зрелого монослоя клеток протекает свыше 72 часов. Относительный индекс пролиферации кератиноцитов в стандартной среде через 48 часов культивирования составляет 1.
Пример адгезии и распластывания нормальных кератиноцитов человека через 1 час культивирования в условиях насыщающей влажности в СО2-инкубаторе при температуре 37°С в смеси питательных сред DMEM и F12 (3:1) с 10% FBS приведен на Фиг. 4 (а).
Пример 13. Все этапы выделения и культивирования кератиноцитов аналогичны примеру 12. Отличие в том, что в стандартную питательную среду DMEM / F12 дополнительно вводят аликвотное количество стерильного водного раствора солевой формы хитозана и аспарагиновой кислоты, полученной из хитозана с ММ = 200 кДа при мольном соотношении [хитозан(−NН2)] / [кислота] = 1.0, а затем незамедлительно вносят суспензию клеток линии МА-104.
Доля адгезированных кератиноцитов через 1 час культивирования в питательной среде с добавкой солевой формы хитозана и аспарагиновой кислоты составляет 51.4%, доля распластанных клеток – 91.5%. Время формирования зрелого монослоя клеток менее 56 часов. ОИП кератиноцитов в модифицированной питательной среде через 48 часов культивирования составляет 3.1.
Пример 14. Все этапы выделения и культивирования кератиноцитов аналогичны примеру 13. Отличие в том, что в качестве модифицирующей добавки используют солевую форму хитозана и аскорбиновой кислоты, полученную при мольном соотношении [хитозан(−NН2)] / [кислота] = 1.3.
Доля адгезированных кератиноцитов через 1 час культивирования в питательной среде с добавкой солевой формы хитозана и аскорбиновой кислоты составляет 50.0%, доля распластанных клеток – 78.9%. Время формирования зрелого монослоя клеток менее 60 часов. ОИП кератиноцитов в модифицированной питательной среде через 48 часов культивирования составляет 2.7.
Пример 15. Все этапы выделения и культивирования кератиноцитов аналогичны примеру 14. Отличие в том, что в качестве модифицирующей добавки используют солевую форму хитозана и аскорбиновой кислоты, полученную из хитозана с ММ = 30 кДа при мольном соотношении [хитозан(−NН2)] / [кислота] = 0.8.
Доля адгезированных кератиноцитов через 1 час культивирования в питательной среде с добавкой солевой формы хитозана и аскорбиновой кислоты составляет 50.9%, доля распластанных клеток – 80.1%. Время формирования зрелого монослоя клеток менее 54 часов. ОИП кератиноцитов в модифицированной питательной среде через 48 часов культивирования составляет 2.8.
Пример 16. Все этапы выделения и культивирования кератиноцитов аналогичны примеру 15. Отличие в том, что в качестве модифицирующей добавки используют солевую форму хитозана и аминокапроновой кислоты, полученную при мольном соотношении [хитозан(−NН2)] / [кислота] = 1.0.
Доля адгезированных кератиноцитов через 1 час культивирования в питательной среде с добавкой солевой формы хитозана и аминокапроновой кислоты составляет 53.0%, доля распластанных клеток – 85.5%. Время формирования зрелого монослоя клеток менее 56 часов. ОИП кератиноцитов в модифицированной питательной среде через 48 часов культивирования составляет 3.0.
Пример адгезии и распластывания нормальных кератиноцитов человека через 1 час культивирования в условиях насыщающей влажности в СО2-инкубаторе при температуре 37°С в смеси питательных сред DMEM и F12 (3:1) с 10% FBS и модифицирующей добавкой на основе солевой формы хитозана и аминокапроновой кислоты приведен на Фиг. 4 (б).
Пример 17. Все этапы выделения и культивирования кератиноцитов аналогичны примеру 13. Отличие в том, что в качестве модифицирующей добавки используют солевую форму хитозана и гликолевой кислоты, полученную при мольном соотношении [хитозан(−NН2)] / [кислота] = 0.5.
Доля адгезированных кератиноцитов через 1 час культивирования в питательной среде с добавкой солевой формы хитозана и гликолевой кислоты составляет 48.5%, доля распластанных клеток – 80.2%. Время формирования зрелого монослоя клеток менее 60 часов. ОИП кератиноцитов в модифицированной питательной среде через 48 часов культивирования составляет 2.3.
Пример 18. Все этапы выделения и культивирования кератиноцитов аналогичны примеру 17. Отличие в том, что аликвотное количество стерильного водного раствора солевой формы хитозана и гликолевой кислоты получают из лиофилизированного порошка солевой формы хитозана и гликолевой кислоты.
Доля адгезированных кератиноцитов через 1 час культивирования в питательной среде с добавкой солевой формы хитозана и гликолевой кислоты составляет 48.8%, доля распластанных клеток – 80.9%. Время формирования зрелого монослоя клеток менее 60 часов. ОИП кератиноцитов в модифицированной питательной среде через 48 часов культивирования составляет 2.3.
В таблице (примеры №12–18) приведена количественная оценка пролиферативных свойств питательных сред на модели нормальных человеческих кератиноцитов.
Представленные данные показывают, что предлагаемая добавка существенно улучшает ростовые качества питательной среды в отношении культуры кератиноцитов. Доля (%) адгезированных и распластанных клеток через 1 час культивирования превышает таковые в контроле в 2.5 и 1.5 раза, соответственно, при использовании солевой формы хитозана и аспарагиновой кислоты, в 2.4−2.5 и 1.3 раза при использовании солевой формы хитозана и аскорбиновой кислоты, в 2.6 и 1.4 раза при использовании солевой формы хитозана и аминокапроновой кислоты, в 2.3 и 1.3 раза при использовании солевой формы хитозана и гликолевой кислоты. По сравнению с контролем, где время формирования монослоя клеток составляет 72 часа и более, время формирования зрелого монослоя кератиноцитов при использовании модифицирующей добавки составляет 54−60 часов и менее, что говорит о способности модифицированной среды стимулировать рост культуры в более ранние сроки. ОИП фибробластов в модифицированной питательной среде всегда выше, чем в контроле, что также свидетельствует о существенном ускорении роста клеточной популяции фибробластов.
Получение водного раствора модифицирующей добавки путем растворения хитозана в водном растворе органической кислоты или путем растворения в воде порошка лиофилизированной солевой формы, полученной из соответствующего водного раствора хитозана и органической кислоты, не влияет на пролиферативные свойства модифицированной питательной среды. В обоих случаях введение в стандартную питательную среду модифицирующей добавки значимо ускоряет адгезию, распластывание и пролиферацию клеточных культур в условиях in vitro.