Результат интеллектуальной деятельности: КАНОЛА HO/LL С УСТОЙЧИВОСТЬЮ К ЗАБОЛЕВАНИЮ КИЛОЙ КРЕСТОЦВЕТНЫХ
Вид РИД
Изобретение
Испрашиваемый приоритет
По настоящей заявке испрашивается приоритет патентной заявки США с порядковым № 13/246757, поданной 27 сентября 2011 г.
Область техники, к которой относится изобретение
Настоящее раскрытие относится к растениям, устойчивым к заболеваниям, например, к растениям Brassica napus, устойчивым к заболеванию килой крестоцветных. Настоящее раскрытие относится также к молекулярным маркерам, которые сцеплены с устойчивостью к заболеванию килой крестоцветных. В конкретных вариантах осуществления раскрытие относится к композициям и способам введения в растение устойчивости к заболеванию килой крестоцветных, например, путем использования молекулярных маркеров, сцепленных с устойчивостью к заболеванию килой крестоцветных. Конкретные варианты осуществления относятся к способам использования конкретных последовательностей нуклеиновой кислоты для идентификации растений, которые, очевидно, имеют фенотип устойчивости к заболеванию килой крестоцветных.
Известный уровень техники
Кила крестоцветных представляет собой широко распространенное заболевание, которое создает серьезные проблемы во многих областях выращивания Brassica. См., например, Dixon (1999) Grower April 29:28-9. Заболевание вызывается одноклеточным организмом Plasmodiophora brassicae. Симптомы заболевания включают аномалии корней с твердыми наплывами (булавами), которые в конечном итоге гниют. Заболевание также вызывает карликовость из-за подавления роста, и при недостатке воды наблюдается увядание листьев. Контролирование заболевания с помощью химических агентов является неэффективным.
Род Brassica включает несколько видов, представляющих коммерческий интерес, таких как B. rapa (например, пекинская капуста, китайская капуста, турнепс); B. napus (например, масличное семя, брюква); B. juncea (например, горчица); B. nigra (например, черная горчица); и B. oleracea (например, цветная капуста, брокколи, кочанная капуста, брюссельская капуста, савойская капуста, листовая капуста, кольраби, браунколь и т.д.). Тогда как подвиды в пределах вида рода Brassica обычно являются совместимыми в отношении размножения, это необязательно в случае размножения различных видов рода Brassica. Например, B. rapa и B. oleracea не имеют одинакового количества хромосом (10 хромосом относительно 9 хромосом) и, следовательно, являются несовместимыми в отношении размножения. Это создает особые трудности для переноса признаков от одного вида Brassica к другому.
В пределах рода Brassica описано несколько вариантов происхождения устойчивости к киле крестоцветных. См., например, Bradshaw et al. (1997) Ann. Appl. Biol. 130:337-48; Gowers (1982) Euphytica 31:971-6. Некоторые варианты устойчивости являются моногенными, некоторые полигенными, некоторые являются доминантными, некоторые являются рецессивными. Моногенная доминантная устойчивость описана у B. rapa и B. napus, такая как, например, моногенная доминантная устойчивость у пекинской капусты B. rapa. Yoshikawa (1983) Japan Agricultural Research Quarterly 17(1):6-11. Гибриды F1 пекинской капусты с такой устойчивостью, как показано, обладают хорошей защитой против килы крестоцветных, хотя небольшое количество линий («рас») килы крестоцветных обладает способностью разрушать эту устойчивость.
Инфекционное заболевание килой крестоцветных рассматривается как главная угроза промышленному разведению канолы. Попытки скрещивания сортов канолы с устойчивостью к киле крестоцветных должны давать существенное количество растений c расщеплением, которые нуждаются в скрининге их устойчивости к заболеванию килой крестоцветных. Текущая практика скрининга продуктов скрещивания на устойчивость к заболеванию килой крестоцветных включает фенотипирование индивидуальных растений путем наблюдения за фенотипической реакцией этого растения после инокуляции растения патогеном P. brassicae. Этот и без того громоздкий процесс, требующий затрат времени, дополнительно осложняется текущими регуляторными ограничениями на транспорт патогена килы крестоцветных или любого инфицируемого материала. Предшествующие соображения делают цену скрининга продуктов скрещивания на устойчивость к заболеванию килой крестоцветных крайне высокой, а также существенно затрудняют попытки скрещивания за счет ограничения количества линий, которые могут быть протестированы одновременно.
Раскрытие изобретения
В настоящем документе описывается растение Brassica spp. и его части, где растение включает, по меньшей мере, один признак, выбранный из группы, состоящей из: высокого содержания олеиновой и/или низкого содержания линоленовой кислоты; устойчивости к Plasmodiophora brassicae; устойчивости к гербициду (например, к глифосату или имидазолиноновому гербициду); и восстановления цитоплазматической мужской стерильности. В некоторых вариантах осуществления растение Brassica spp. выбрано из группы, состоящей из B. rapa, B. napus, B. juncea, B. nigra, и B. oleracea. Например, в конкретных вариантах осуществления используется B. napus. В конкретных вариантах осуществления предлагается растение Brassica spp., где у растения подтверждается наличие высокого содержания олеиновой и/или низкого содержания линоленовой кислоты по сравнению с растением дикого типа того же вида, подтверждается устойчивость к Plasmodiophora brassicae по сравнению с растением дикого типа того же вида, выявляется устойчивость к имидазолинону по сравнению с растением дикого типа того же вида, и оно включает ген-восстановитель системы цитоплазматической мужской стерильности. Конкретные варианты осуществления могут включать способ выращивания растения Brassica spp. или его частей в соответствии с изобретением в поле, включающем P. brassicae.
В конкретных вариантах осуществления растение (или его части) могут включать геном, гомозиготный в отношении генетических аллелей, которые являются природными для первого родителя и неприродными для второго родителя растения, где у второго родителя подтверждается наличие существенно более низкого содержания олеиновой и/или более высокого содержания линоленовой кислоты, чем у первого родителя. В некоторых примерах растение (или его части) включает аллели от первого растения в гибриде или инбредной комбинации, по меньшей мере, в одном локусе, выбранном из локуса, картированного в группе сцепления, выбранной из N14, N4, N5 и N1 вида Brassica. В конкретных примерах аллель от первого растения может быть картирован с помощью одного или более маркеров, представленных SEQ ID NO: 5, 6, 14, и 15.
В настоящем документе описываются также молекулярные маркеры нуклеиновой кислоты, которые сцеплены (например, сцеплены; тесно сцеплены или предельно тесно сцеплены) с фенотипом Brassica napus с высоким содержанием олеиновой кислоты (HO) и/или низким содержанием линоленовой кислоты (LL). В конкретных вариантах осуществления маркер, который сцеплен с фенотипом HO, сцеплен с мутацией в гене fad2. В конкретных вариантах осуществления маркер, который сцеплен с фенотипом LL, сцеплен с мутацией в гене fad3. В некоторых вариантах осуществления маркеры, которые сцеплены с фенотипом HO/LL в B. napus, могут быть использованы для введения фенотипа HO/LL в другие растения (например, другие виды Brassica). Некоторые варианты осуществления включают способы применения, по меньшей мере, одного молекулярного маркера нуклеиновой кислоты, который сцеплен с фенотипом HO/LL в B. napus, например, без ограничения, для идентификации растений с фенотипом HO/LL; и/или для введения фенотипа HO/LL в новые генотипы растений и зародышевую плазму (например, путем селекции с использованием маркеров или генетической трансформации).
Дополнительно описываются способы введения фенотипа HO в растение рода Brassica и способы введения фенотипа LL в растение рода Brassica. В некоторых примерах способ введения фенотипа HO в растение рода Brassica заключается в мутации с заменой «C» на «T» в положении 411 гена fad2 в растении B. napus. В некоторых примерах способ введения фенотипа LL в растение рода Brassica заключается в мутации с заменой «G» на «A» в первом основании 5'-сайта сплайсинга третьего интрона гена fad32 в растении B. napus.
Описывается также способ идентификации растения, несущего ген, вносящий вклад в фенотип HO растения рода Brassica. В некоторых примерах способом идентификации растения, несущего ген, вносящий вклад в фенотип HO, является зонд, который специфически гибридизуется с сегментом гена fad2 B. napus, содержащим мутацию с заменой «C» на «T» в положении 411, но не гибридизуется с тем же самым сегментом гена fad2 B. napus дикого типа без этой мутации. Описывается также способ идентификации растения, несущего ген, вносящий вклад в фенотип LL растения рода Brassica. В некоторых примерах способом идентификации растения, несущего ген, вносящий вклад в фенотип LL, является зонд, который специфически гибридизуется с сегментом гена fad32 B. napus, содержащим мутацию с заменой «G» на «A» в первом основании 5'-сайта сплайсинга третьего интрона, но не гибридизуется с тем же самым сегментом гена fad32 B. napus дикого типа без этой мутации.
В некоторых вариантах осуществления семена растения Brassica spp. по изобретению могут включать, по меньшей мере, 63% олеиновой кислоты (С18:1). Например, семена растения Brassica spp. по изобретению могут включать, по меньшей мере, 77% олеиновой кислоты (С18:1). В некоторых вариантах осуществления семена растения Brassica spp. по изобретению могут включать не более 6% линоленовой кислоты (С18:3). Например, семена растения Brassica spp. по изобретению могут включать не более 1,5% линоленовой кислоты (С18:3).
В некоторых вариантах осуществления растение по изобретению (или его часть) может включать нуклеотидную последовательность, которая способна специфически гибридизоваться с комплементарной нуклеотидной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 7 и 12. В этих и дополнительных вариантах осуществления растение или его части могут быть устойчивы к имидазолинону (например, имидазолинону, выбранному из группы имазаметбенза, имазамокса, имазапика, имазапира, имазахина и имазэтапира). Особые варианты осуществления включают способ контролирования, по меньшей мере, одного сорняка в поле, где поле содержит, по меньшей мере, одно растение Brassica spp. или его части, и применения имидазолинона, по меньшей мере, в части поля.
В настоящем документе описываются также молекулярные маркеры нуклеиновой кислоты, которые сцеплены (например, сцеплены; тесно сцеплены или предельно тесно сцеплены) с фенотипом устойчивости к заболеванию килой крестоцветных у Brassica napus. В некоторых вариантах осуществления маркеры, которые сцеплены с фенотипом устойчивости к заболеванию килой крестоцветных у B. napus, могут быть использованы для введения фенотипа устойчивости к заболеванию килой крестоцветных в другие растения (например, другие виды Brassica). Некоторые варианты осуществления включают способы применения, по меньшей мере, одного молекулярного маркера нуклеиновой кислоты, который сцеплен с фенотипом устойчивости к заболеванию килой крестоцветных у B. napus, например, и без ограничения, для идентификации растений с фенотипом устойчивости к заболеванию килой крестоцветных; и/или для введения фенотипа устойчивости к заболеванию килой крестоцветных в генотипы новых растений (например, путем селекции с использованием маркеров или генетической трансформации). В конкретных примерах маркер, который сцеплен с устойчивостью к заболеванию килой крестоцветных, может быть определен и/или идентифицирован путем амплификации ДНК с использованием праймера, выбранного из группы, состоящей из SEQ ID NO: 18-22, или его функционального эквивалента.
Дополнительно описываются способы введения устойчивости к заболеванию килой крестоцветных в растение Brassica spp. и способы идентификации растения, несущего ген, вносящий вклад в устойчивость к заболеванию килой крестоцветных. В некоторых примерах способ введения устойчивости к заболеванию килой крестоцветных в растение Brassica spp. заключается в использовании последовательного сегмента геномной ДНК, который составляет 300 п.о. в длину и амплифицируется с помощью иллюстративных праймеров с SEQ ID NO: 18 и 19, причем маркер сцеплен с устойчивостью к заболеванию килой крестоцветных у растения B. napus. Описываются также способы идентификации растения, несущего ген, вносящий вклад в устойчивость к заболеванию килой крестоцветных. В некоторых примерах способом идентификации растения, несущего ген, вносящий вклад в устойчивость к заболеванию килой крестоцветных, является зонд, который специфически гибридизуется с последовательным сегментом геномной ДНК, который составляет 300 п.о. в длину и амплифицируется с помощью иллюстративных праймеров с SEQ ID NO: 18 и 19.
Представленные выше и другие особенности станут более понятны из последующего подробного описания некоторых вариантов осуществления, которые представлены со ссылкой на сопровождающие фигуры.
Краткое описание чертежей
Фиг.1 включает частичные геномные нуклеотидные последовательности гена fad2, клонированного из сортов B. napus DMS100 и Quantum. Вверху показана частичная геномная нуклеотидная последовательность гена fad2, клонированного из DMS100 (SEQ ID NO:7), а внизу показана последовательность частичной геномной нуклеотидной последовательности гена fad2, клонированного из Quantum (SEQ ID NO:9). Острие стрелки указывает на мутацию одиночного нуклеотида с заменой «С» на «T», что приводит к стоп-кодону («TAG») (заштриховано). Мутантные специфичные для аллеля прямой (SEQ ID NO:5) и обратный (SEQ ID NO:6) праймеры для идентификации с помощью ПЦР маркера, специфичного для мутантного аллеля, показаны жирным шрифтом и подчеркнуты.
Фиг.2 включает аминокислотные последовательности гена fad2 из вырожденной геномной нуклеотидной последовательности, клонированной из DMS100 (SEQ ID NO:8), Quantum (SEQ ID NO:10) и из опубликованного гена fad2 Brassica napus (BNfad2) (SEQ ID NO:11). Острие стрелки указывает на положение стоп-кодона, возникающего из-за мутации одиночного нуклеотида (замена «С» на «T») у DMS100.
Фиг.3 включает геномные нуклеотидные последовательности гена fad3c, клонированные из DMS100 и Quantum. Вверху показан ген fad3с, клонированный из DMS100 (SEQ ID NO:12), а внизу показан ген fad3с, клонированный из Quantum (SEQ ID NO:13). Экзоны, соответствующие экзонам 4, 5, 6 и 7 гена fad3 в Brassica rapa и Arabidopsis, заключены в прямоугольники, а интроны, соответствующие интронам 4, 5 и 6 гена fad3 в Brassica rapa и Arabidopsis, не заключены в прямоугольники. Острие стрелки указывает на мутацию одиночного нуклеотида с заменой «G» на «A». Прямой (SEQ ID NO:14) и мутантный, специфичный для аллеля обратный (SEQ ID NO:15) праймеры для идентификации с помощью ПЦР маркера, специфичного для мутантного аллеля, показаны жирным шрифтом и подчеркнуты.
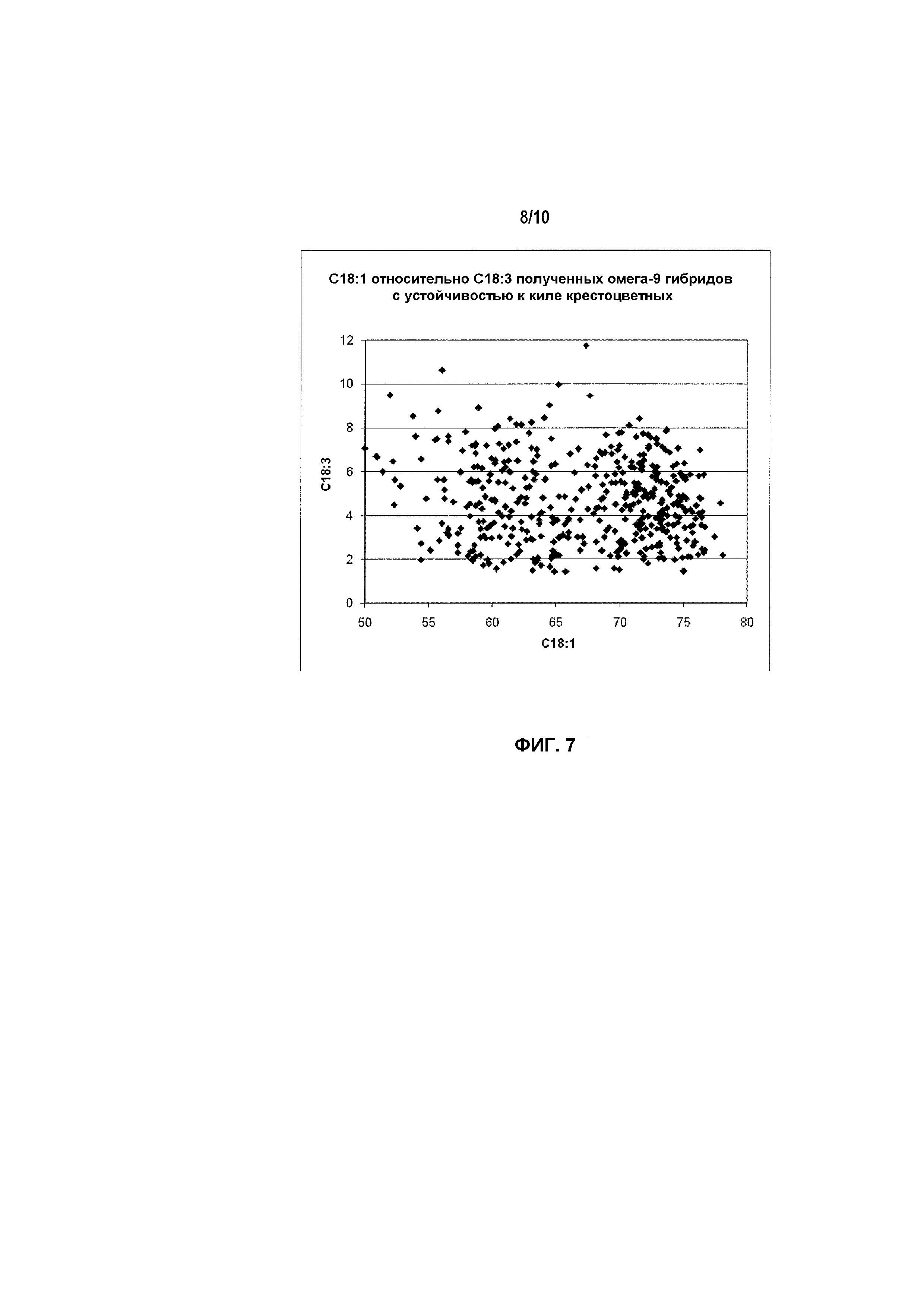
Фиг.4 включает таблицу, в которой представлены корреляции маркеров, специфичных для мутантного аллеля, с содержанием жирных кислот в 184 дважды гаплоидных (DH) линиях, происходящих от скрещивания Quantum и DMS100 (вверху), а также результаты электрофореза продуктов ПЦР, амплифицированных с маркера, специфичного для мутантного аллеля гена fad2 (внизу).
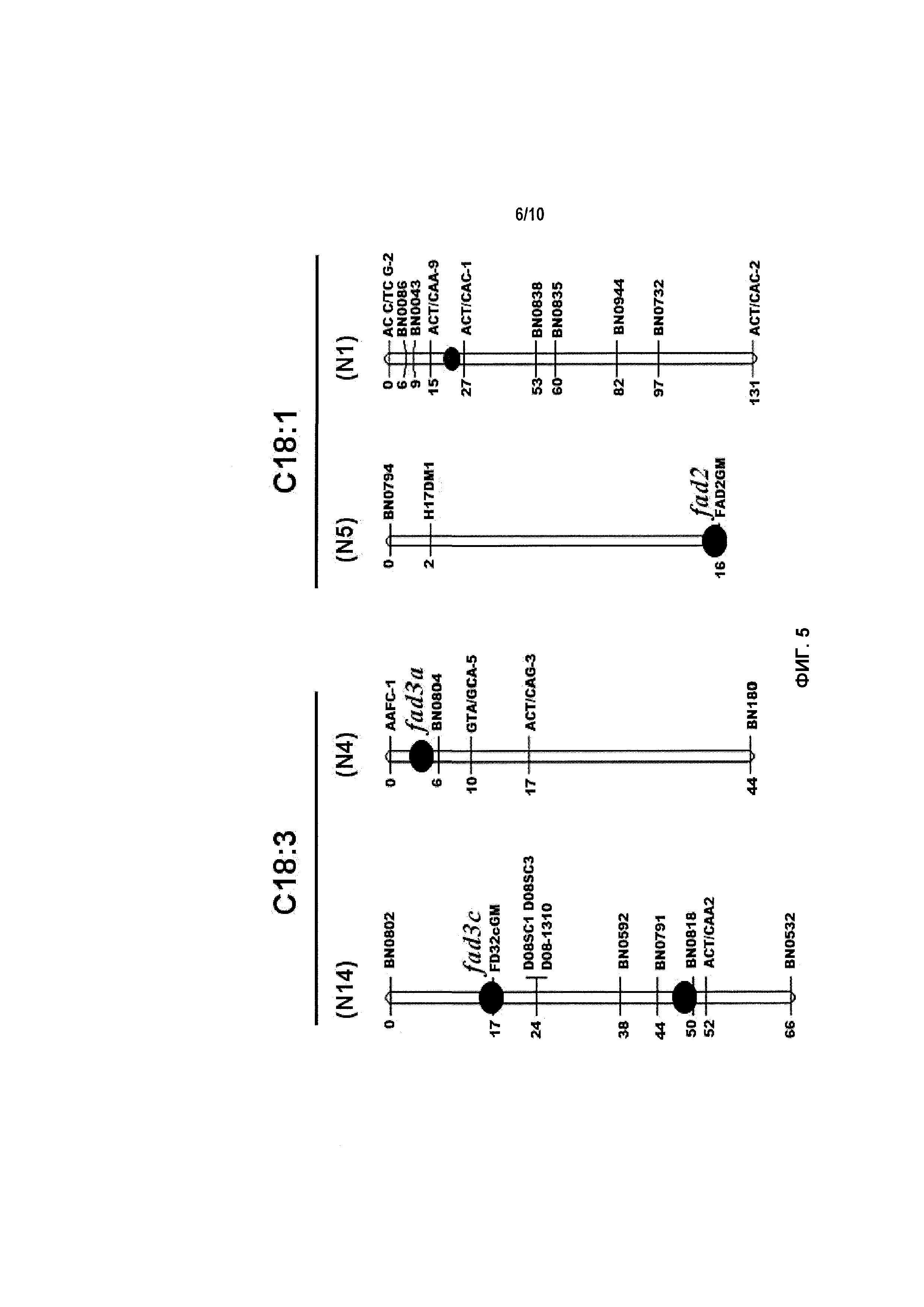
Фиг.5 включает картирование локуса количественных признаков (QTL), показывающее одну главную (N5) и одну минорную (N1) область QTL для высокого содержания олеиновой кислоты (С18:1) и три области QTL (N4 и N14) для низкого содержания линоленовой кислоты (С18:3), определенные с помощью маркеров по настоящему изобретению.
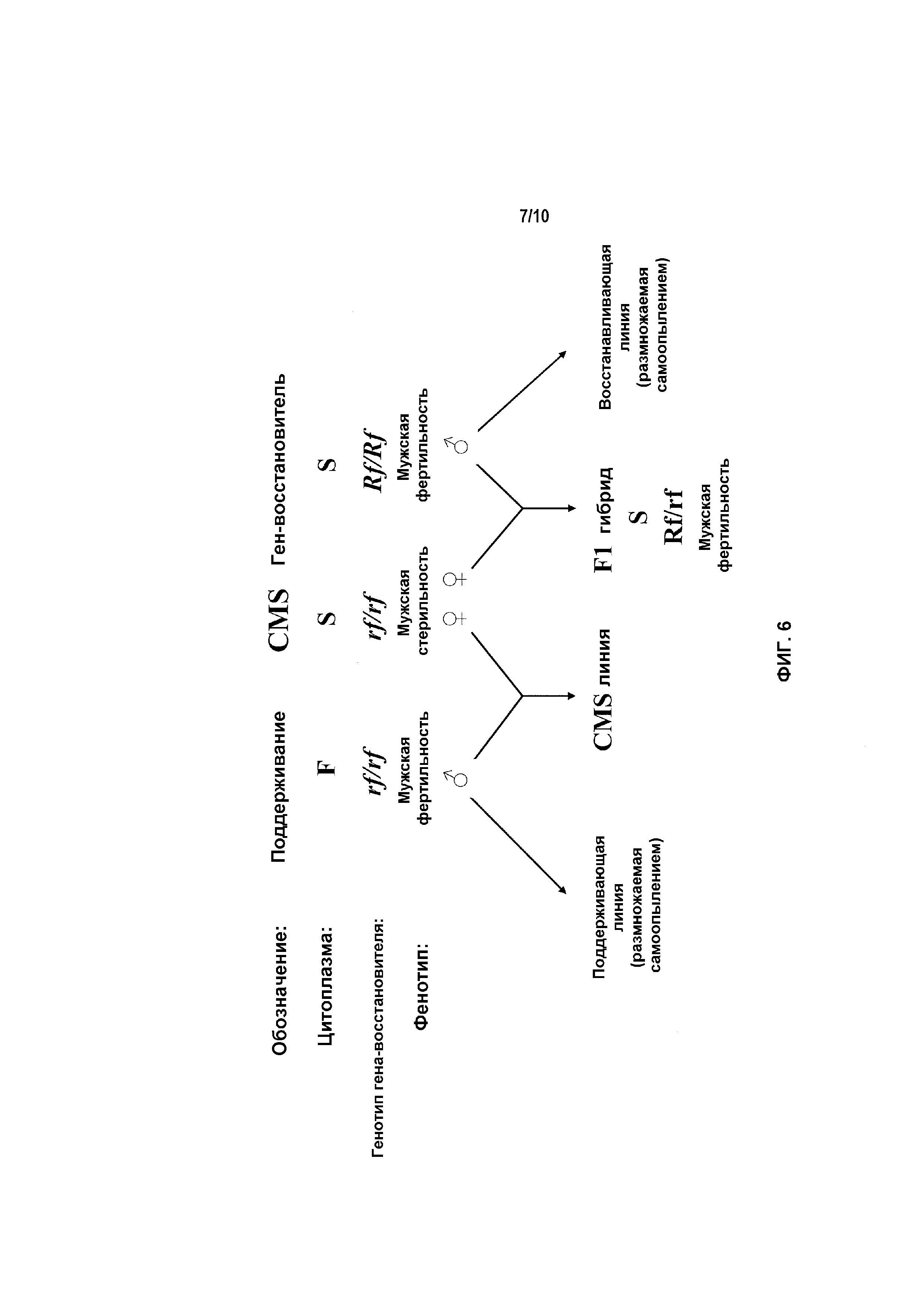
Фиг.6 включает схематическое представление одного варианта применения системы цитоплазматической мужской стерильности в схеме получения гибридных семян.
Фиг.7 включает диаграмму, показывающую распределение профилей жирных кислот для различных гибридов растений.
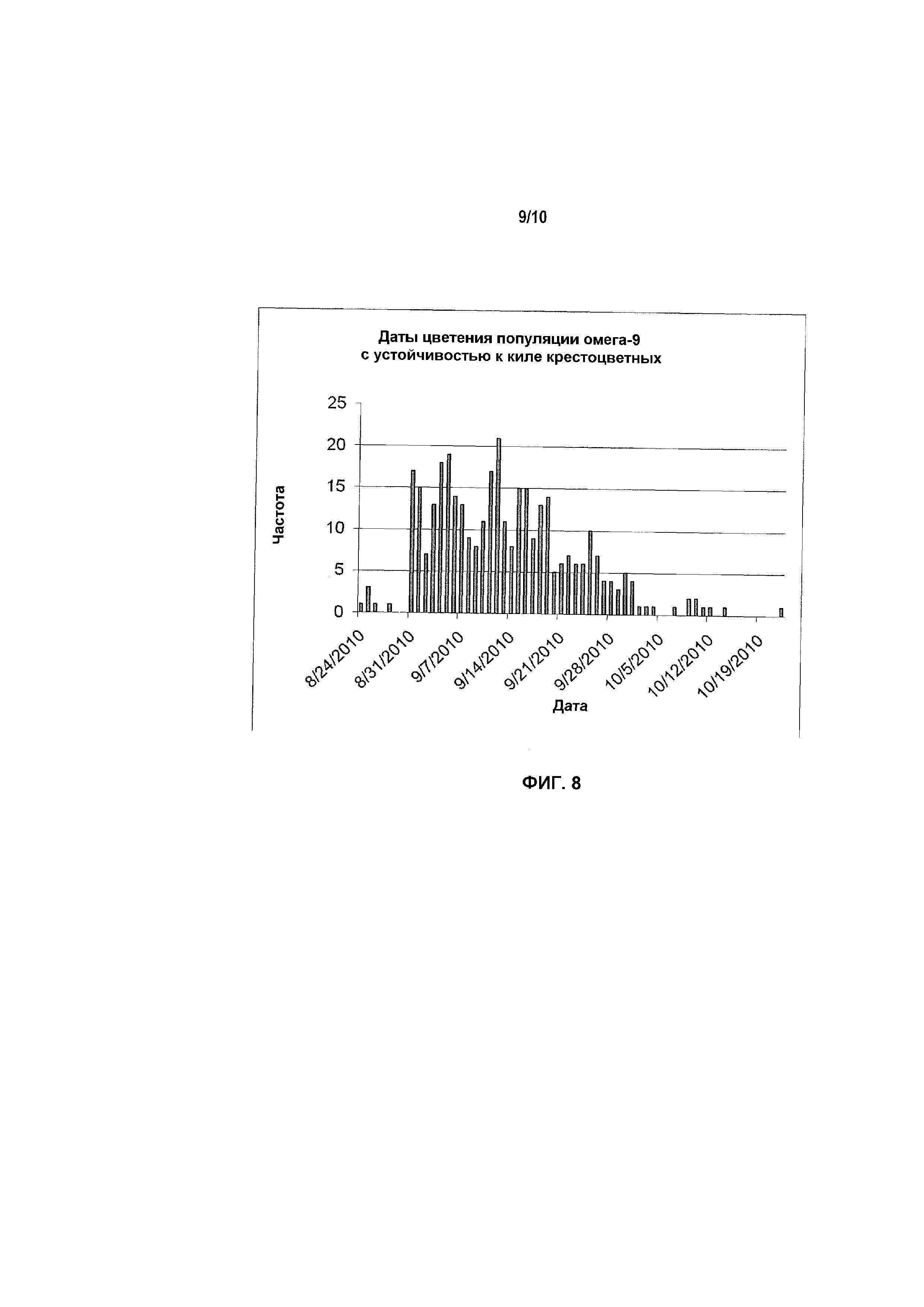
Фиг.8 включает иллюстрацию распределения дат цветения у иллюстративных растений канолы, устойчивых к заболеванию килой крестоцветных с высоким содержанием олеиновой кислоты и низким содержанием линоленовой кислоты.
Фиг.9 включает изображение геля, демонстрирующее идентификацию молекулярного маркера, сцепленного с устойчивостью к заболеванию килой крестоцветных у канолы. Полоса идентифицированного маркера, сцепленного с устойчивостью к киле крестоцветных, выделена красным, и в этом случае размер амплифицированного фрагмента составляет 333 п.о. (33 дополнительных пары оснований суммарно были добавлены к праймерам SEQ ID NO: 18 и 19 (26 оснований было добавлено к 5'-концу SEQ ID NO:18, и 7 оснований было добавлено к 5'-концу SEQ ID NO:19, как представлено в SEQ ID NO: 20 и 21, соответственно) для облегчения определения с использованием генетического анализатора ABI 3130). Представлена реакция каждой линии на заболевание килой крестоцветных.
Перечень последовательностей
Последовательности нуклеиновых кислот, перечисленные в прилагаемом перечне последовательностей, представлены с использованием стандартных буквенных аббревиатур для нуклеотидных оснований, как определено в § 1.822 37 C.F.R., показана только одна цепь каждой последовательности нуклеиновой кислоты, но понятно, что комплементарная цепь подлежит включению при любой ссылке на представленную цепь.
SEQ ID NO: 1-2 представляют собой праймеры, используемые для амплификации гена fad2 геномной ДНК B. napus родительских линий DMS100 и Quantum.
SEQ ID NO: 3-4 представляют собой праймеры, используемые для амплификации гена fad31 геномной ДНК B. napus родительских линий DMS100 и Quantum.
SEQ ID NO:5 представляет собой специфичный для мутанта прямой праймер для идентификации и/или определения аллеля fad2, который вносит вклад в высокое содержание олеиновой и/или низкое содержание линолевой кислоты у Brassica.
SEQ ID NO:6 представляет собой обратный праймер для идентификации и/или определения аллеля fad2, который вносит вклад в высокое содержание олеиновой и/или низкое содержание линолевой кислоты у Brassica.
SEQ ID NO:7 представляет собой родительскую геномную нуклеотидную последовательность гена fad2, клонированную из сорта B. napus DMS100.
SEQ ID NO:8 представляет собой аминокислотную последовательность продукта гена fad2 из вырожденной геномной нуклеотидной последовательности, клонированной из сорта B. napus DMS100, причем последовательность, как показано, прервана «стоп»-кодоном.
SEQ ID NO:9 представляет собой родительскую геномную нуклеотидную последовательность гена fad2, клонированную из сорта B. napus Quantum.
SEQ ID NO:10 представляет собой аминокислотную последовательность продукта гена fad2 из вырожденной геномной нуклеотидной последовательности, клонированной из сорта B. napus Quantum.
SEQ ID NO:11 представляет собой аминокислотную последовательность продукта гена fad2 из вырожденной геномной нуклеотидной последовательности из сорта B. napus BNfad2.
SEQ ID NO:12 представляет собой геномную нуклеотидную последовательность гена fad3с, клонированную из сорта B. napus DMS100.
SEQ ID NO:13 представляет собой геномную нуклеотидную последовательность гена fad3с, клонированную из сорта B. napus Quantum.
SEQ ID NO:14 представляет собой прямой праймер для идентификации и/или определения аллеля fad32, который вносит вклад в высокое содержание олеиновой и/или низкое содержание линолевой кислоты у Brassica.
SEQ ID NO:15 представляет собой специфичный для мутанта обратный праймер для идентификации и/или определения аллеля fad32, который вносит вклад в высокое содержание олеиновой и/или низкое содержание линолевой кислоты у Brassica.
SEQ ID NO: 16 и 17 представляют собой праймеры, используемые для амплификации гена fad32 геномной ДНК B. napus родительских линий DMS100 и Quantum.
SEQ ID NO: 18-21 представляют собой последовательности иллюстративных праймеров, пригодных для идентификации и/или определения маркера устойчивости к заболеванию килой крестоцветных.
SEQ ID NO:22 представляет собой последовательность флуоресцентно меченного универсального праймера M13, используемую для амплификации меченых фрагментов ДНК при использовании для определения с SEQ ID NO: 20 и 21.
Вариант(ы) осуществления изобретения
I. Обзор нескольких вариантов осуществления
В настоящем документе описываются растения Brassica spp. (например, B. napus) и их потомство, включающее фенотип устойчивости к заболеванию килой крестоцветных. В настоящем документе описываются также части растения, полученные из растения Brassica, включая семена и растительные материалы растения. В конкретных вариантах осуществления устойчивость к киле крестоцветных может быть моногенной и/или мультигенной. В конкретных вариантах осуществления устойчивость к киле крестоцветных может быть доминантной и/или рецессивной.
При использовании растения Brassica napus, включающего фенотип устойчивости к заболеванию килой крестоцветных, идентифицированы молекулярные маркеры, которые тесно сцеплены с фенотипом устойчивости к заболеванию килой крестоцветных. В частности идентифицирован локус маркера, представляющего собой повтор короткой последовательности (SSR), который тесно сцеплен с фенотипом устойчивости к заболеванию килой крестоцветных. Этот маркер SSR может быть особенно пригоден для введения этого фенотипа в другие растения (например, другие сорта B. napus и другие виды Brassica), например, путем традиционного скрещивания растений, а также для идентификации растений, вероятно имеющих этот фенотип (например, среди растений, созданных рекомбинантным генно-инженерным способом). Использование, по меньшей мере, одного молекулярного маркера, который тесно сцеплен с фенотипом устойчивости к заболеванию килой крестоцветных, в программе скрещивания Brassica может существенно снизить время и стоимость скрининга материалов для скрещивания на устойчивость к заболеванию килой крестоцветных. Например, использование такого маркера может снизить необходимость в дорогостоящем скрининге на устойчивость к заболеванию килой крестоцветных, тем самым существенно облегчая скрещивание сортов канолы с устойчивостью к заболеванию килой крестоцветных.
II. Термины
Обратное скрещивание: Методы обратного скрещивания могут быть использованы для введения последовательности нуклеиновой кислоты в растения. Метод обратного скрещивания широко используется в течение десятилетий для введения новых признаков в растения. Jensen, N., Ed. Plant Breeding Methodology, John Wiley & Sons, Inc., 1988. При типичном протоколе обратного скрещивания исходный представляющий интерес сорт (рекуррентный родитель) скрещивается со вторым сортом (нерекуррентным родителем), который несет представляющий интерес ген, предназначенный для переноса. Полученное потомство от этого скрещивания затем опять скрещивают с рекуррентным родителем, и процесс повторяют до тех пор, пока не получат растение, где в трансформированном растении открываются по существу все желаемые морфологические и физиологические характеристики рекуррентного родителя в дополнение к гену, перенесенному от нерекуррентного родителя.
Устойчивость к киле крестоцветных: Устойчивость или толерантность растения к киле крестоцветных относится к увеличенному росту, продуктивности и/или снижению размера и/или количества корневых наплывов у растения по сравнению с неустойчивым и/или нетолерантным сортом того же растения при выращивании в поле, включающем Plasmodiophora brassicae. При применении в настоящем описании устойчивость к киле крестоцветных также включает толерантность к киле крестоцветных. Устойчивость к киле крестоцветных может быть придана с помощью одного или более генов, аллелей или трансформантов.
Генетический локус: При применении в настоящем описании термин «генетический локус» относится к локализации в хромосоме.
Геномный локус: При применении в настоящем описании термин «геномный локус» относится к локализации в пределах полного набора хромосом организма.
Неравновесное сцепление: При применении в настоящем описании термин «неравновесное сцепление» относится к статистической связи между двумя локусами или между свойством и маркером.
Сцепленный, прочно сцепленный и предельно прочно сцепленный: При применении в настоящем описании сцепление между генами или маркерами относится к феномену, при котором гены или маркеры в хромосоме проявляют поддающуюся измерению вероятность совместной передачи индивидуумам в последующем поколении. Сцепление двух генов или маркеров происходит относительно друг друга, эта вероятность возникает при сцеплении с (1). Таким образом, термин «сцепленный» может относиться к одному или более генам или маркерам, которые передаются вместе с геном с вероятностью более 0,5 (которая ожидается при независимом наборе, когда маркеры/гены локализованы на различных хромосомах). Так как близость двух генов или маркеров в хромосоме прямо связана с вероятностью того, что эти гены или маркеры будут совместно переданы индивидуумам в следующем поколении, термин «сцепленные» в настоящем описании может также относиться к одному или более генам или маркерам, которые локализованы в пределах приблизительно 2,0 Мб относительно друг друга в одной и той же хромосоме Brassica spp. Таким образом, два «сцепленных» гена или маркера могут быть разделены приблизительно 2,1 Мб; 2,00 Мб; приблизительно 1,95 Мб; приблизительно 1,90 Мб; приблизительно 1,85 Мб; приблизительно 1,80 Мб; приблизительно 1,75 Мб; приблизительно 1,70 Мб; приблизительно 1,65 Мб; приблизительно 1,60 Мб; приблизительно 1,55 Мб; приблизительно 1,50 Мб; приблизительно 1,45 Мб; приблизительно 1,40 Мб; приблизительно 1,35 Мб; приблизительно 1,30 Мб; приблизительно 1,25 Мб; приблизительно 1,20 Мб; приблизительно 1,15 Мб; приблизительно 1,10 Мб; приблизительно 1,05 Мб; приблизительно 1,00 Мб; приблизительно 0,95 Мб; приблизительно 0,90 Мб; приблизительно 0,85 Мб; приблизительно 0,80 Мб; приблизительно 0,75 Мб; приблизительно 0,70 Мб; приблизительно 0,65 Мб; приблизительно 0,60 Мб; приблизительно 0,55 Мб; приблизительно 0,50 Мб; приблизительно 0,45 Мб; приблизительно 0,40 Мб; приблизительно 0,35 Мб; приблизительно 0,30 Мб; приблизительно 0,25 Мб; приблизительно 0,20 Мб; приблизительно 0,15 Мб; приблизительно 0,10 Мб; приблизительно 0,05 Мб; приблизительно 0,025 Мб; приблизительно 0,012 Мб и приблизительно 0,01 Мб. Ген может быть «сцеплен» с маркером, который находится в пределах экзона или интрона гена. В этом случае разделение между сцепленными геном и маркером составляет 0,00 Мб.
Конкретные примеры маркеров, которые «сцеплены» с fad2, включают нуклеотидные последовательности в группе сцепления N5 и N1 генома B. napus, например, с мутацией с заменой «С» на «T» в положении 411 гена fad2 B. napus. Конкретные примеры маркеров, которые «сцеплены» с fad3, включают нуклеотидные последовательности в группе сцепления N14 и N4 генома B. napus, например, с мутацией с заменой «G» на «A» в первом основании 5'-сайта сплайсинга третьего интрона гена fad32 в B. napus.
Маркеры и/или гены могут также быть «сцепленными» с фенотипом, например, с фенотипом, в который вовлечен сцепленный ген или ген, сцепленный со сцепленным маркером. Некоторые варианты осуществления включают маркеры, которые сцеплены с HO, LL, устойчивостью к имидазолинону и/или фенотипами устойчивости к заболеванию килой крестоцветных. Конкретные примеры маркеров, которые «сцеплены» с фенотипами HO/LL, включают маркеры, которые сцеплены с fad2 и fad3. Конкретные примеры маркеров, которые «сцеплены» с фенотипом устойчивости к заболеванию килой крестоцветных, включают последовательный сегмент геномной ДНК, который составляет 300 п.о. в длину и амплифицируется иллюстративными праймерами SEQ ID NO: 16 и 17. Как должно быть понятно специалистам в данной области техники, длина этого маркера SSR будет варьироваться, если нуклеотиды добавляются или удаляются из участка геномной ДНК, локализованного между дистальными концами конкретных праймеров, используемых при отжиге.
При применении в настоящем описании термин «тесно сцепленный» может относиться к одному или более генам или маркерам, которые расположены в пределах приблизительно 0,5 Мб относительно друг друга в одной и той же хромосоме. Таким образом, два «тесно сцепленных» гена или маркера могут быть разделены приблизительно 0,6 Мб; приблизительно 0,55 Мб; 0,5 Мб; приблизительно 0,45 Мб; приблизительно 0,4 Мб; приблизительно 0,35 Мб; приблизительно 0,3 Мб; приблизительно 0,25 Мб; приблизительно 0,2 Мб; приблизительно 0,15 Мб; приблизительно 0,12 Мб; приблизительно 0,1 Мб; приблизительно 0,05 Мб и приблизительно 0,00 Мб. Конкретные примеры маркеров, которые «тесно сцеплены» с fad2, включают определенные нуклеотидные последовательности в группе сцепления N5 и N1 генома B. napus, например, с мутацией с заменой «С» на «T» в положении 411 гена fad2 B. napus. Конкретные примеры маркеров, которые «тесно сцеплены» с fad3, включают определенные нуклеотидные последовательности в группе сцепления N14 и N4 генома B. napus, например, с мутацией с заменой «G» на «A» в первом основании 5'-сайта сплайсинга третьего интрона гена fad32 B. napus. Конкретные примеры маркеров, которые «тесно сцеплены» с фенотипом устойчивости к заболеванию килой крестоцветных, включают последовательный сегмент геномной ДНК, который составляет 300 п.о. в длину и амплифицируется иллюстративными праймерами SEQ ID NO: 16 и 17.
При применении в настоящем описании термин «предельно тесно сцепленный» может относиться к одному или более генам или маркерам, которые расположены в пределах приблизительно 100 т.п.о. относительно друг друга в одной и той же хромосоме. Таким образом, два «предельно тесно сцепленных» гена или маркера могут быть разделены приблизительно 125 т.п.о.; приблизительно 120 т.п.о.; приблизительно 115 т.п.о.; приблизительно 110 т.п.о.; приблизительно 105 т.п.о.; 100 т.п.о.; приблизительно 95 т.п.о.; приблизительно 90 т.п.о.; приблизительно 85 т.п.о.; приблизительно 80 т.п.о.; приблизительно 75 т.п.о.; приблизительно 70 т.п.о.; приблизительно 65 т.п.о.; приблизительно 60 т.п.о.; приблизительно 55 т.п.о.; приблизительно 50 т.п.о.; приблизительно 45 т.п.о.; приблизительно 40 т.п.о.; приблизительно 35 т.п.о.; приблизительно 30 т.п.о.; приблизительно 25 т.п.о.; приблизительно 20 т.п.о.; приблизительно 15 т.п.о.; приблизительно 12 т.п.о.; приблизительно 10 т.п.о.; приблизительно 5 т.п.о.; приблизительно 1 т.п.о. и приблизительно 0 т.п.о. Конкретные примеры маркеров, которые «предельно тесно сцеплены» с fad2, включают определенные нуклеотидные последовательности в группе сцепления N5 и N1 генома B. napus, например, с мутацией с заменой «С» на «T» в положении 411 гена fad2 B. napus. Конкретные примеры маркеров, которые «предельно тесно сцеплены» с fad3, включают определенные нуклеотидные последовательности в группе сцепления N14 и N4 генома B. napus, например, с мутацией с заменой «G» на «A» в первом основании 5'-сайта сплайсинга третьего интрона гена fad32 B. napus. Конкретные примеры маркеров, которые «предельно тесно сцеплены» с фенотипом устойчивости к заболеванию килой крестоцветных, включают последовательный сегмент геномной ДНК, который составляет 300 п.о. в длину и амплифицируется иллюстративными праймерами SEQ ID NO: 16 и 17.
Сцепленные, тесно сцепленные и предельно тесно сцепленные генетические маркеры могут применяться в программах селекции с использованием маркеров для идентификации индивидуумов, включающих сцепленные фенотипы и/или типы генов, и для воспроизведения этих признаков и/или генов в сортах Brassica.
Локус: При применении в настоящем описании термин «локус» относится к положению в геноме, которое соответствует поддающемуся измерению свойству (например, признаку). Локус SNP определяется зондом, который гибридизуется с ДНК, содержащейся в пределах локуса.
Маркер: При применении в настоящем описании маркер относится к гену или нуклеотидной последовательности, которая может быть использована для идентификации растений, имеющих определенный аллель, например, fad2, fad3 и последовательный сегмент геномной ДНК, который составляет 300 п.о. в длину и амплифицируется иллюстративными праймерами SEQ ID NO: 16 и 17. Маркер может быть описан как вариант данного геномного локуса. Генетический маркер может представлять собой короткую последовательность ДНК, такую как последовательность вокруг изменения одной пары оснований (полиморфизм по одному нуклеотиду или «SNP»), или более длинную последовательность, например, повтор минисателлитной/простой последовательности («SSR»). «Аллель маркера» относится к варианту маркера, который присутствует в конкретном растении. При применении в настоящем описании «маркер» включает ссылку на локус в хромосоме, который служит для идентификации индивидуального положения в хромосоме. Генотип может быть определен с помощью использования одного или множества маркеров. Таким образом, «маркер» включает ссылку на одно или более положение(ия) нуклеотида в гене, локализованном в хромосоме генома.
Молекулярные маркеры особенно пригодны для ускорения процесса введения гена или локусов количественных признаков (QTL) в элитный сорт культурного растения или скрещиваемую линию путем обратного скрещивания. Маркеры, сцепленные с геном, могут быть использованы для селекции растений, обладающих желаемым признаком, и маркеры, распределенные по геному, могут быть использованы для селекции растений, которые генетически сходны с рекуррентным родителем. Young and Tanksley (1989) Theor. Appl. Genet. 77:95-101; Hospital et al. (1992) Genetics 132:1199-210.
При применении в настоящем описании термин «маркер» может относиться к клонированному сегменту хромосомной ДНК Brassica (например, сегменту с нуклеотидной последовательностью либо SEQ ID NO:7, либо SEQ ID NO:12) и может также или альтернативно относиться к молекуле ДНК, которая комплементарна клонированному сегменту хромосомной ДНК Brassica.
Некоторые варианты осуществления включают «производное» маркера. При применении в настоящем описании термин «производное» может относиться к модификации конкретной последовательности маркера. Иллюстрациями таких модификаций в отношении молекулярных маркеров являются замена, вставка и/или делеция одного или более оснований относительно последовательности нуклеиновой кислоты маркера, раскрытой в настоящем описании, которые предохраняют, слегка изменяют или повышают функцию молекулярного маркера в отношении идентификации одного или более признака(ов) (например, устойчивости к заболеванию килой крестоцветных и признаков высокого содержания олеиновой и/или низкого содержания линоленовой кислот у Brassica или других видов семенных культур). Такие производные могут быть легко определены специалистом в данной области техники, например, с помощью использования методов компьютерного моделирования для предсказания и оптимизации структуры последовательности. Термин «производное», таким образом, включает последовательности нуклеиновой кислоты, которые по существу идентичны одной или более последовательностям раскрытых в настоящем описании маркеров, так что производные маркеров способны обладать раскрытыми функциями для использования в селекции с использованием маркеров.
Селекция с использованием маркеров: При применении в настоящем описании термин «селекция с использованием маркеров» может относиться к подходу к селекции непосредственно одного или более комплексов признаков (например, HO, LL, устойчивости к имидазолинону и/или устойчивости к заболеванию килой крестоцветных). В современной практике селекционеры растений делают попытки идентификации легко определяемых признаков, таких как цвет цветков, внешний вид оболочки семян или варианты изозимов, которые сцеплены с агрономически желаемым признаком. Селекционеры затем прослеживают агрономический признак в расщепляемых, селекционных популяциях, следя за расщеплением легко определяемого признака. Однако существует очень мало таких взаимоотношений сцепления, доступных для использования при селекции растений.
Селекция с использованием маркеров является способом улучшения сортов растений, целесообразным в отношении времени и цены. Ряд примеров применения селекции с использованием маркеров включает использование изозимных маркеров. См., например, Tanksley and Orton, eds. (1983) Isozymes in Plant Breeding and Genetics, Amsterdam: Elsevier. Одним примером является изозимный маркер, сцепленный с геном устойчивости к вредителям нематодам у томатов. Устойчивость контролируется геном, обозначаемым Mi, расположенным в 6 хромосоме томата и очень тесно сцепленным с Aps1, изозимом - кислой фосфатазой. Использование маркера изозима Aps1 для непрямой селекции гена Mi создало преимущества в том, что расщепление в популяции можно было однозначно определить с помощью стандартных методов электрофореза; маркер изозима может быть количественно оценен в ткани рассады, что исключает необходимость поддерживания растения до созревания; и кодоминантные аллели маркера изозима позволяют дискриминировать гомозигот от гетерозигот. См. Rick (1983) in Tanksley and Orton, выше.
В некоторых вариантах осуществления присутствие маркера в растении может быть определено при использовании зонда нуклеиновой кислоты. Зонд может представлять собой молекулу ДНК или молекулу РНК. РНК-зонды могут быть синтезированы с помощью методов, известных в данной области техники, например, с использованием матрицы молекулы ДНК. Зонд может содержать всю или часть нуклеотидной последовательности маркера и дополнительную, прилегающую нуклеотидную последовательность из генома Brassica. В настоящем описании это обозначается как «прилегающий зонд». Дополнительная, прилегающая нуклеотидная последовательность обозначается как «вышележащая» или «нижележащая» относительно исходного маркера в зависимости от того находится ли прилегающая нуклеотидная последовательность из хромосомы Brassica на 5'- или на 3'-конце исходного маркера, как обычно подразумевается. В случае примеров маркеров, сцепленных с признаком HO, дополнительная, прилегающая нуклеотидная последовательность может быть локализована между исходным маркером и положением 411 гена fad2 в хромосоме Brassica. В случае примеров маркеров, сцепленных с признаком LL, дополнительная, прилегающая нуклеотидная последовательность может быть локализована между исходным маркером и первым основанием 5'-сайта сплайсинга третьего интрона гена fad3 в хромосоме Brassica. Как известно специалистам в данной области техники, способ получения дополнительной, прилегающей нуклеотидной последовательности для включения в маркер может быть повторен почти неограниченно (ограничен только длиной хромосомы), тем самым идентифицируются дополнительные маркеры вдоль хромосомы Brassica. Все описанные выше маркеры могут быть использованы в некоторых вариантах осуществления настоящего изобретения.
Последовательность олигонуклеотидного зонда может быть получена синтетически или с помощью клонирования. Подходящие клонирующие векторы хорошо известны специалистам в данной области техники. Олигонуклеотидный зонд может быть меченым или немеченым. Существует большое разнообразие методов мечения молекул нуклеиновых кислот, включая, например, без ограничения: введение радиоактивной метки с помощью ник-трансляции; присоединение к хвосту концевой дезокситрансферазы; или тому подобные, где используемые олигонуклеотиды метят, например, радиоактивным 32P. Другие метки, которые могут быть использованы, включают, например, и без ограничения: флуорофоры; ферменты; субстраты ферментов; кофакторы ферментов; ингибиторы ферментов и тому подобное. Альтернативно использование метки, которая дает поддающийся определению сигнал сама по себе или в сочетании с другими реакционно-активными агентами, может быть заменено лигандами, с которыми связывается рецептор, когда метятся рецепторы (например, метками, указанными выше) для генерации поддающихся определению сигналов либо самими рецепторами, либо их сочетанием с другими реагентами. См., например, Leary et al. (1983) Proc. Natl. Acad. Sci. USA 80:4045-9.
Зонд может содержать нуклеотидную последовательность, которая не прилегает к последовательности исходного маркера, этот зонд обозначается в настоящем описании как «неприлегающий зонд». Последовательность неприлегающего зонда расположена достаточно близко к последовательности исходного маркера в хромосоме Brassica, так что неприлегающий зонд обычно связан с тем же самым геном (например, fad2 или fad3). Например, в некоторых вариантах осуществления неприлегающий зонд может быть расположен в пределах 500 т.п.о.; 450 т.п.о.; 400 т.п.о.; 350 т.п.о.; 300 т.п.о.; 250 т.п.о.; 200 т.п.о.; 150 т.п.о.; 125 т.п.о.; 120 т.п.о.; 100 т.п.о.; 0,9 т.п.о.; 0,8 т.п.о.; 0,7 т.п.о.; 0,6 т.п.о.; 0,5 т.п.о.; 0,4 т.п.о.; 0,3 т.п.о.; 0,2 т.п.о. или 0,1 т.п.о. от исходного маркера в хромосоме Brassica.
Зонд может представлять собой точную копию маркера, предназначенного для определения. Зонд может также представлять собой молекулу нуклеиновой кислоты, включающую или состоящую из нуклеотидной последовательности, которая по существу идентична клонированному сегменту хромосомной ДНК Brassica (например, как показано для сегмента SEQ ID NO:7, включая нуклеотид в 411 положении, или сегмента SEQ ID NO:12, включая положение первого нуклеотида 5'-сайта сплайсинга третьего интрона гена). При применении в настоящем описании термин «по существу идентичная» может относиться к нуклеотидным последовательностям, которые идентичны более чем на 85%. Например, по существу идентичная нуклеотидная последовательность может быть идентична референсной последовательности на 85,5%; 86%; 87%; 88%; 89%; 90%; 91%; 92%; 93%; 94%; 95%; 96%; 97%; 98%; 99% или 99,5%.
Зонд может также представлять собой молекулу нуклеиновой кислоты, которая «поддается специфической гибридизации» или «специфически комплементарна» точной копии маркера, предназначенного для определения («ДНК-мишени»). Термины «поддается специфической гибридизации» или «специфически комплементарна» являются терминами, которые указывают на достаточную степень комплементарности, так что возникает стабильное и специфическое связывание между молекулой нуклеиновой кислоты и ДНК-мишенью. Таким образом, в некоторых примерах зонд может быть комплементарен ДНК-мишени. Однако молекула нуклеиновой кислоты необязательно комплементарна на 100% своей последовательности-мишени, с которой она будет специфически гибридизоваться. Молекула нуклеиновой кислоты поддается специфической гибридизации, когда существует степень комплементарности, достаточная для избегания неспецифического связывания нуклеиновой кислоты со всеми последовательностями-немишенями в условиях, когда желательно специфическое связывание, например, в жестких условиях гибридизации. Таким образом, в некоторых примерах зонд может быть по существу идентичным комплементарной ДНК-мишени. Например, зонд может быть идентичен комплементарной ДНК-мишени на 85,5%; 86%; 87%; 88%; 89%; 90%; 91%; 92%; 93%; 94%; 95%; 96%; 97%; 98%; 99% или 99,5%.
Зонд может быть включен в молекулу нуклеиновой кислоты, включающую дополнительные последовательности нуклеиновой кислоты; например, промоторы; сигналы транскрипции; и/или последовательности вектора. Зонд может быть использован для определения дополнительных маркеров, которые тесно сцеплены с геном, вовлеченным в HO, LL, устойчивость к имидазолинону, и/или с фенотипом устойчивости к заболеванию килой крестоцветных (например, fad2 и fad3). Маркеры, идентифицированные таким образом, могут быть эквивалентными иллюстративным маркерам, представленным в настоящем раскрытии, и, таким образом, входят в объем изобретения.
Условия гибридизации, приводящие к конкретным степеням жесткости, должны варьироваться в зависимости от природы выбранного метода гибридизации и состава и длины гибридизирующихся последовательностей нуклеиновой кислоты. Обычно температура гибридизации и ионная сила (особенно концентрация Na+ и/или Mg++) буфера для гибридизации будут определять жесткость гибридизации, хотя время промывки также влияет на жесткость. Расчеты, касающиеся условий гибридизации, требуемые для достижения конкретных степеней жесткости, известны специалистам в данной области техники и обсуждаются, например, в Sambrook et al. (ed.) Molecular Cloning: A Laboratory Manual, 2nd ed., vol. 1-3, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, 1989, chapters 9 and 11; and Hames and Higgins (eds.) Nucleic Acid Hybridization, IRL Press, Oxford, 1985. Дополнительную подробную инструкцию и руководство по гибридизации нуклеиновых кислот можно найти, например, в Tijssen, «Overview of principles of hybridization and the strategy of nucleic acid probe assays,» in Laboratory Techniques in Biochemistry and Molecular Biology- Hybridization with Nucleic Acid Probes, Part I, Chapter 2, Elsevier, NY, 1993; and Ausubel et al., Eds., Current Protocols in Molecular Biology, Chapter 2, Greene Publishing and Wiley-Interscience, NY, 1995.
При применении в настоящем описании «жесткие условия» охватывают условия, при которых гибридизация должна наступать, только если существует менее 25% ошибочных спариваний между гибридизующейся молекулой и ДНК-мишенью. «Жесткие условия» включают дополнительные особые условия жесткости. Таким образом, при применении в настоящем описании условия «умеренной жесткости» представляют собой условия, при которых молекулы с более 25% ошибочных спариваний в последовательности не будут гибридизироваться; условия «средней жесткости» представляют собой условия, при которых молекулы с более 15% ошибочных спариваний не будут гибридизироваться; и условия «высокой жесткости» представляют собой условия, при которых последовательности с более 10% ошибочных спариваний не будут гибридизироваться. Условия «очень высокой жесткости» представляют собой условия, при которых последовательности с более 6% ошибочных спариваний не будут гибридизироваться.
В конкретных вариантах осуществления жесткие условия представляют собой гибридизацию при 65°С в буфере 6х физиологический раствор-цитрат натрия (SSC), 5х раствор Денхардта, 0,5% SDS и 100 мкг ДНК спермы лосося с последующими 15-30 минутными промывками при 65°С в 2х SSC буфере и 0,5% SDS, затем в 1х SSС буфере и 0,5% SDS, и наконец в 0,2х SSC буфере и 0,5% SDS.
Имидазолинон: При применении в настоящем описании термин «имидазолинон» относится к гербициду, который вмешивается в действие фермента ацетолактатсинтазы (ALS), также известного как синтаза ацетогидроксикислоты (AHAS) в растении, причем вмешательство может в конечном итоге приводить к гибели растения. Примеры имидазолинонов включают, но не ограничиваются этим: имазаметбенз; имазамокс; имазапик; имазапир; имазахин и имазэтапир.
При применении в настоящем описании термин «устойчивость к имидазолинону» относится к фенотипу, характеризуемому, по меньшей мере, частично снижением, ослаблением и/или исчезновением опасности для здоровья и/или жизнеспособности у устойчивого растения при сравнении с растением дикого типа того же вида. Устойчивость к имидазолинону включает толерантность к имидазолинону. Устойчивость к имидазолинону может быть придана с помощью одного или более генов, аллелей или трансформантов, которые изменяют ацетолактатсинтазу (ALS), также известную как синтаза ацетогидроксикислоты (AHAS), что позволяет ферменту быть устойчивым или толерантным к действию имидазолинонов. Иллюстративные гены, придающие устойчивость к имидазолинонам, включают, но не ограничиваются генами, описанными, например, в статьях Lee et al. (1988) EMBO J. 7:1241, и Miki et al. (1990) Theor. Appl. Genet. 80:449 (обе включены в настоящее описание в качестве ссылки в полном объеме). Устойчивость или толерантность растения к имидазолинону может позволять использование имидазолинонов при необходимости контроля над сорняками в области культивирования растения.
InDel: При применении в настоящем описании термин «InDel» используется обычно для описания вставки или делеции в гене. Таким образом, «InDel» обозначает конкретную мутацию, которая может представлять собой либо вставку, делецию, либо их сочетание. «Вставка» или «добавление» при применении в настоящем описании относится к изменению аминокислотной или нуклеотидной последовательности, приводящему к добавлению одного или более аминокислотных или нуклеотидных остатков, соответственно, по сравнению с природной молекулой.
«Содержание масла»: При применении в настоящем описании термин «содержание масла» относится к характеристике масла в растении или части растения (например, в семенах). В некоторых вариантах осуществления содержание масла выражается в виде процента от суммарной сухой массы семян. В некоторых вариантах осуществления конкретное содержание растительного масла является характеристикой конкретного сорта растения и может быть использовано для определения отличия растения этого конкретного сорта от других растений того же вида. Содержание масла может быть измерено с использованием различных аналитических методов, таких как, например, без ограничения: ЯМР, NIR, анализ FAME и экстракция в системе Soxlet. В конкретных вариантах осуществления характеристики содержания масла могут включать описание «процента олеиновой кислоты» и/или «процента линоленовой кислоты». При применении в настоящем описании «процент олеиновой кислоты» относится к проценту от суммарного масла семян, которое представляет собой олеиновую кислоту при определении с помощью анализа FAME. При применении в настоящем описании «процент линоленовой кислоты» относится к проценту от суммарного масла семян, которое представляет собой линоленовую кислоту при определении с помощью анализа FAME.
Анализ FAME может быть использован для измерения процентного содержания жирной кислоты по отношению к суммарным жирным кислотам в образце. Относительно растительного масла, его процент может быть определен путем экстракции образца масла из семян, получения метиловых эфиров жирных кислот, присутствующих в образце этого масла, и анализа пропорций различных жирных кислот в образце с использованием газовой хроматографии. Определенное таким образом содержание масла может быть отличительной характеристикой сорта.
Идентичность последовательностей: Термин «идентичность последовательностей» или «идентичность» при применении в настоящем описании в контексте двух последовательностей нуклеиновой кислоты или полипептидных последовательностей может относиться к остаткам в двух последовательностях, которые являются одинаковыми при выравнивании на максимальное соответствие в конкретном окне сравнения.
Когда процент идентичности последовательностей используют в отношении белков, понятно, что положения остатков, которые не являются идентичными, часто отличаются консервативными аминокислотными заменами, когда аминокислотные остатки заменяются другими аминокислотными остатками со сходными химическими свойствами (например, зарядом, гидрофобностью или стерическими эффектами), и, следовательно, не изменяют функциональных свойств молекулы.
Следовательно, когда последовательности отличаются консервативными заменами, процент идентичности последовательностей может быть повышен при выравнивании для коррекции на консервативную природу замены в сайте неидентичного остатка. Последовательности, которые отличаются такими консервативными заменами, как говорится, характеризуются «сходством последовательностей» или «сходством». Методы осуществления такого выравнивания хорошо известны специалистам в данной области техники. Обычно такие методы включают подсчет консервативных замен как частичных, а не полных нарушений комплементарности, в результате чего повышается процент идентичности последовательностей. Например, когда идентичной аминокислоте присваивается очко между 0 и 1, а неконсервативной замене дается очко 0, консервативной замене дается очко между 0 и 1. Очки консервативных замен могут быть подсчитаны, например, при использовании программы PC/GENE (Intelligenetics, Mountain View, CA).
При применении в настоящем описании термин «процент идентичности последовательностей» может относиться к величине, определенной путем сравнения двух оптимально выровненных последовательностей вдоль окна сравнения, где часть последовательности в окне сравнения может включать добавки или делеции (т.е. пробелы) по сравнению с референсной последовательностью (которая не включает добавок или делеций) для оптимального выравнивания двух последовательностей. Процент рассчитывается путем определения количества положений, в которых идентичный нуклеотидный или аминокислотный остаток присутствует в обеих последовательностях, что дает количество совпадающих положений, деления количества совпадающих положений на общее количество положений в окне сравнения и умножения результата на 100 с получением процента идентичности последовательностей. Компьютерные программы, которые могут быть использованы для определения идентичности и сходства между двумя последовательностями, включают: пакет программ GCG (Devereux et al. (1984) Nucleic Acids Res. 12(1):387); BLASTP; BLASTN; FASTA; и TFASTA (Atschul et al. (1990) J. Mol. Biol. 215:403).
Статистически связанные: При применении в настоящем описании термин «статистически связанные» относится к тенденции двух событий возникать совместно с частотой, более высокой, чем частота, характерная для случайности, где частоту, характерную для случайности, представляют предварительно определенным уровнем значимости. Статистическая связанность может быть определена любым из ряда тестов определения значимости, хорошо известных специалистам в данной области техники, например, ANOVA или t-критерием. См., например, Statistical Methods, G.W. Snedecor and W.G. Cochran, Iowa State University Press, Ames, Iowa (1985). Уровни значимости для альфа предпочтительно составляют менее 0,01. Например, уровни значимости для этого изобретения могут находиться в диапазоне между 0 и приблизительно 0,250, например, менее приблизительно 0,0001, 0,00050, 0,0010, 0,0050, 0,010, 0,025, 0,050, 0,100 или 0,250, включая любые уровни между ними.
Признак или фенотип: Термины «признак» и «фенотип» используются в настоящем описании взаимозаменяемо. Для целей настоящего раскрытия признаки, представляющие особый интерес, включают, например, без ограничения: высокое содержание олеиновой кислоты; низкое содержание линоленовой кислоты; устойчивость к имидазолинонам; устойчивость к заболеванию килой крестоцветных; и восстановление цитоплазматической мужской стерильности.
III. Мутации HO/LL в генах fad2 и fad3
Некоторые варианты осуществления включают мутации генов fad2 и fad3, которые придают фенотип HO/LL (высокого содержания олеиновой (fad2) и низкого содержания линоленовой (fad3) кислот) у растений рода Brassica. В некоторых вариантах осуществления изобретения используется выделенная молекула нуклеиновой кислоты, включающая последовательности нуклеиновой кислоты, включающие одну или более этих мутаций, для придания одного или обоих признаков HO/LL растению, в которое введена выделенная молекула нуклеиновой кислоты. Такие выделенные молекулы нуклеиновой кислоты могут дополнительно включать маркер, который тесно сцеплен с фенотипом HO и/или LL у канолы.
При клонировании аллелей fad2 (десатуразы 2 жирных кислот) и fad3 (десатуразы 3 жирных кислот) использовали сорта B. napus DMS100 (мутантный тип) и Quantum (дикий тип). Мутантный сорт DMS100 происходил от массовой селекции F4 индивидуальной селекции растений F3, происходящей от скрещивания сестринской линии Global X AG019. DMS100 представляет собой линию HO/LL с содержанием олеиновой кислоты приблизительно 77% и содержанием линоленовой кислоты приблизительно 3%. Quantum представляет собой коммерческий сорт дикого типа, который имеет относительно низкое содержание олеиновой кислоты (~66%) и высокое содержание линоленовой кислоты (~7%). Как подробно описывается в настоящем документе, секвенирование десатуразных ферментов fad2 и fad3 геномных клонов DMS100, вовлеченных в путь синтеза жирных кислот, выявило одиночные мутации нуклеотидов в каждом из генов. Дополнительный анализ последовательностей показал, что мутации являются причиной измененного содержания жирных кислот в DMS100. Эти две мутации отличаются от ранее опубликованных мутаций (Tanhuanpaa et al. (1998) Mol. Breeding 4:543-50; Jourdren et al. (1996) Theor. Appl. Genet. 93:512-8).
Некоторые варианты осуществления используются в интересах идентификации полиморфизма одиночного нуклеотида (SNP) в гене fad2, который связан с конкретным содержанием масел, которое может быть желательным при некоторых вариантах применения. Содержание олеиновой кислоты (С18:1) у канолы находится под влиянием гена fad2, который кодирует фермент (эндоплазматическую дельта-12-десатуразу), ответственный за десатурацию олеиновой кислоты до линолевой кислоты (С18:2). Конкретные варианты осуществления включают мутацию с одиночной нуклеотидной заменой, которая вводит преждевременный «стоп»-кодон в открытую рамку считывания fad2, приводя к экспрессии укороченного продукта. В определенных вариантах осуществления мутация с одиночной нуклеотидной заменой локализована в положении 411 гена fad2 (смотри фиг. 1). Например, мутация может представлять собой мутацию с заменой «С» на «T» в положении 411, которая создает стоп-кодон «TAG», и приводит к продукту экспрессии fad2, который состоит только из 185 аминокислот в длину. В некоторых вариантах осуществления мутация с одиночной нуклеотидной заменой в гене fad3 приводит к экспрессии укороченного полипептида, который характеризуется сниженной функцией (например, отсутствием функции или по существу отсутствием функции) в качестве активной десатуразы, десатурирующей олеиновую кислоту до линолевой кислоты.
Инактивирующий мутантный аллель гена fad2 вносит вклад в контроль содержания олеиновой кислоты у канолы путем снижения десатурации олеиновой кислоты до линолевой кислоты. В вариантах осуществления мутантный аллель fad2 включает нуклеотидную последовательность, которая способна специфически гибридизоваться с комплементарной SEQ ID NO:7 в области, включающей нуклеотид в положении 411, как определено при выравнивании SEQ ID NO:7. В конкретных вариантах осуществления мутантный аллель fad2 представляет собой SEQ ID NO:7. В некоторых вариантах осуществления изобретение также включает те нуклеотидные последовательности, которые по существу идентичны мутантному аллелю fad2 SEQ ID NO:7. Например, в некоторых вариантах осуществления молекула нуклеиновой кислоты представляет собой гомолог fad2 (например, ортолог), который идентичен мутантному аллелю fad2 SEQ ID NO:7, по меньшей мере, приблизительно на 85%. Гомолог fad2 может быть идентичен мутантному аллелю fad2 SEQ ID NO:7 на 86%; 87%; 88%; 89%; 90%; 91%; 92%; 93%; 94%; 95%; 96%; 97%; 98%; 99%; 99,5% или 99,8%. Такой гомолог fad2 может быть легко идентифицирован и выделен из любых полных или частичных геномов, легкодоступных специалистам в данной области техники для различных организмов, например, Brassica spp.
Некоторые варианты осуществления также включают функциональные варианты мутантного аллеля fad2 SEQ ID NO:7. Функциональные варианты fad2 включают, например, последовательность fad2 SEQ ID NO:7, причем последовательность включает одну или более нуклеотидных замен, делеций или вставок, где функциональный вариант снижает десатурацию олеиновой кислоты до линолевой кислоты в клетке Brassica и может быть измерен с помощью обычных методов, хорошо известных специалистам в данной области техники. Например, способность конкретного варианта гена fad2 снижать десатурацию олеиновой кислоты до линолевой кислоты в клетке Brassica может быть определена с помощью гомологичной рекомбинации мутанта или фрагмента в растении, гомозиготном по функциональному аллелю Fad2, с последующими обычными выделением растительных масел из растения и их характеристикой. Функциональные варианты гена fad2 могут быть созданы с помощью сайт-направленного мутагенеза, индуцируемой мутации, или они могут существовать в виде аллельных вариантов (полиморфизмов, например, SNPs). Конкретные варианты осуществления включают мутацию, которая вводит преждевременный «стоп»-кодон в открытую рамку считывания fad2, приводя к экспрессии укороченного и неактивного продукта.
Некоторые варианты осуществления имеют преимущества в идентификации одиночного полиморфизма нуклеотидов (SNP) в гене fad32, который связан с конкретным содержанием масел, которое может быть желательным при некоторых вариантах применения. Ген fad3 кодирует эндоплазматическую дельта-15-десатуразу линолевой кислоты, фермента, ответственного за десатурацию линолевой кислоты (С18:2) до линоленовой кислоты (С18:3). Ген fad32 вносит вклад особенно в контроль содержания линоленовой кислоты. Конкретные варианты осуществления включают мутацию с одиночной нуклеотидной заменой, которая мешает корректному сплайсингу гена fad32 и тем самым делает неполной трансляцию продукта экспрессии. В определенных вариантах осуществления мутация с одиночной нуклеотидной заменой локализована в первом основании 5'-сайта сплайсинга интрона гена fad32. Интрон может представлять собой, например, третий интрон гена fad32 B. napus, шестой интрон гена fad32 B. rapa или гомологичный интрон гена fad32 у дополнительных видов растений. Например, мутация может представлять собой мутацию с заменой «G» на «A» в первом основании 5'-сайта сплайсинга третьего интрона гена fad32 B. napus, что мешает корректному сплайсингу гена (см. фиг. 3). В некоторых вариантах осуществления мутация с одиночной нуклеотидной заменой, которая мешает корректному сплайсингу гена fad32 и тем самым делает неполной трансляцию продукта экспрессии, может вести к неактивному ферменту и блокировать десатурацию линолевой кислоты (С18:2) до линоленовой кислоты (С18:3), в конечном итоге приводя к снижению аккумуляции С18:3 в семенах канолы.
Инактивирующий мутантный аллель гена fad3 вносит вклад в контроль содержания линоленовой кислоты у канолы путем снижения десатурации линолевой кислоты до линоленовой кислоты. В вариантах осуществления мутантный аллель fad3 включает нуклеотидную последовательность, которая способна специфически гибридизоваться с комплементарной SEQ ID NO:12 в области, включающей нуклеотид в первом основании 5'-сайта сплайсинга интрона гена fad32, как определено при выравнивании с SEQ ID NO:12. В конкретных вариантах осуществления мутантный аллель fad3 представляет собой SEQ ID NO:12. В некоторых вариантах осуществления изобретение также включает те нуклеотидные последовательности, которые по существу идентичны мутантному аллелю fad3 SEQ ID NO:12. Например, в некоторых вариантах осуществления молекула нуклеиновой кислоты представляет собой гомолог fad3 (например, ортолог), который идентичен мутантному аллелю fad3 SEQ ID NO:12, по меньшей мере, приблизительно на 85%. Гомолог fad3 может быть идентичен мутантному аллелю fad3 SEQ ID NO:12 на 86%; 87%; 88%; 89%; 90%; 91%; 92%; 93%; 94%; 95%; 96%; 97%; 98%; 99%; 99,5% или 99,8%. Такой гомолог fad3 может быть легко идентифицирован и выделен из любых полных или частичных геномов, легкодоступных специалистам в данной области техники для различных организмов, например, Brassica spp.
Некоторые варианты осуществления включают также функциональные варианты мутантного аллеля fad3 SEQ ID NO:12. Функциональные варианты fad3 включают, например, последовательность fad3 SEQ ID NO:12, причем последовательность включает одну или более нуклеотидных замен, делеций или вставок, где функциональный вариант снижает десатурацию линолевой кислоты до линоленовой кислоты в клетке Brassica, и может быть измерен с помощью обычных методов, хорошо известных специалистам в данной области техники. Например, способность конкретного варианта гена fad3 снижать десатурацию линолевой кислоты до линоленовой кислоты в клетке Brassica может быть определена с помощью гомологичной рекомбинации мутанта или фрагмента в растении, гомозиготном по функциональному аллелю Fad3, с последующим обычным выделением растительных масел из растения и их характеристикой. Функциональные варианты гена fad3 могут быть созданы с помощью сайт-направленного мутагенеза, индуцируемой мутации, или они могут существовать в виде аллельных вариантов (полиморфизмов, например, SNPs). Конкретные варианты осуществления включают мутацию, которая вводит преждевременный «стоп»-кодон в открытую рамку считывания fad2, приводя к неполной трансляции продукта экспрессии.
IV. Молекулярные маркеры и их применение
Варианты осуществления настоящего изобретения включают молекулярные маркеры (т.е. маркеры нуклеиновой кислоты), которые сцеплены (например, сцеплены; прочно сцеплены; или предельно прочно сцеплены) с геном, представляющим интерес (например, fad2 или fad3). Например, в некоторых вариантах осуществления ген, представляющий интерес, может быть геном, вносящим вклад в фенотип или признак у Brassica, выбранный из группы, состоящей из высокого содержания олеиновой кислоты, низкого содержания линоленовой кислоты, устойчивости к гербициду (например, устойчивости к глифосату или устойчивости к имидазолинону) и устойчивости к заболеванию килой крестоцветных. Конкретные варианты осуществления включают способ использования таких маркеров, например, для переноса генов, представляющих интерес (например, включенных в сегмент ДНК), для введения генов, представляющих интерес, в хозяина и для идентификации гена, представляющего интерес, в организме или образце ДНК из организма. В конкретных вариантах осуществления маркер SSR может быть использован для переноса сегмента ДНК, включающего ген, вносящий вклад в устойчивость к заболеванию килой крестоцветных, из сорта B. napus, устойчивого к заболеванию килой крестоцветных. Такой маркер SSR может включать последовательный сегмент геномной ДНК, который составляет 300 п.о. в длину и амплифицируется с помощью иллюстративных праймеров SEQ ID NO: 18 и 19.
В некоторых вариантах осуществления маркеры, прилегающие к гену, представляющему интерес, могут быть использованы для переноса сегмента(тов) донорской родительской ДНК, которая однозначно содержит ген, представляющий интерес. В конкретных вариантах осуществления маркеры в группе сцепления N5 и N1 B. napus или маркеры, эквивалентные таким маркерам, могут быть использованы для переноса сегмента ДНК, включающего fad2 из сорта DMS100 B. napus. В этих и дополнительных вариантах осуществления маркеры в группе сцепления N14 и N4 B. napus или маркеры, эквивалентные таким маркерам, могут быть использованы для переноса сегмента ДНК, включающего fad32 из сорта DMS100 B. napus.
В некоторых вариантах осуществления использование маркеров, прилегающих к гену, представляющему интерес, для переноса сегмента(тов) донорской родительской ДНК, которая однозначно содержит ген, представляющий интерес, может включать анализ геномной ДНК двух родительских растений зондами, которые способны специфически гибридизоваться с маркерами, сцепленными с геном, представляющим интерес; половое скрещивание двух родительских генотипов растений с получением популяции потомков и анализ этого потомства на присутствие маркеров, сцепленных с геном, представляющим интерес; обратное скрещивание потомства, которое содержит маркеры, сцепленные с геном, представляющим интерес, с генотипом реципиента с получением первой популяции обратного скрещивания и затем продолжение программы обратного скрещивания до получения конечного потомства, которое включает любой желаемый признак(и), обнаруживаемый(мые) у родительского генотипа и представляющий интерес ген. В конкретных вариантах осуществления индивидуальное потомство, получаемое при каждой стадии скрещивания и обратного скрещивания, отбирают путем анализа маркеров в каждом поколении. В некоторых вариантах осуществления анализ геномной ДНК двух родительских растений зондами, которые способны специфически гибридизоваться с маркерами, сцепленными с геном, представляющим интерес, показывает, что одно из родительских растений включает меньше сцепленных маркеров, с которыми специфически гибридизуются зонды, или не включает сцепленных маркеров, с которыми специфически гибридизуются зонды.
В некоторых вариантах осуществления маркер, который сцеплен с геном, представляющим интерес, может быть использован для введения гена, представляющего интерес, в растение рода Brassica с помощью генетической трансформации. В конкретных вариантах осуществления маркер в группе сцепления N5 или N1 или маркер, эквивалентный такому маркеру, может быть использован для переноса гена fad2 в растение рода Brassica. В этих и дополнительных вариантах осуществления маркер в группе сцепления N14 или N4 или маркер, эквивалентный такому маркеру, может быть использован для переноса гена fad32 в растение рода Brassica. В этих и других вариантах осуществления маркер SSR может быть использован для переноса гена, вносящего вклад в устойчивость к заболеванию килой крестоцветных, в растение рода Brassica. Такой маркер SSR может включать последовательный сегмент геномной ДНК, который составляет 300 п.о. в длину и амплифицируется с помощью иллюстративных праймеров SEQ ID NO: 18 и 19.
В некоторых вариантах осуществления способ введения гена, представляющего интерес, в растение рода Brassica с помощью генетической рекомбинации может включать анализ геномной ДНК растения (например, сорта DMS100 B. napus) зондом, который способен специфически гибридизоваться с маркером, сцепленными с геном, представляющим интерес, для идентификации гена, представляющего интерес, в растении; выделение сегмента геномной ДНК растения, включающего ген, представляющий интерес, например, путем экстракции геномной ДНК и гидролиза геномной ДНК одним или более ферментами рестрикционными эндонуклеазами; необязательную амплификацию выделенного сегмента ДНК; введение выделенного сегмента ДНК в клетку или ткань растения-хозяина рода Brassica; и анализ ДНК растения-хозяина зондом, который способен специфически гибридизоваться с маркером, сцепленными с геном, представляющим интерес, для идентификации гена, представляющего интерес, в растении-хозяине. В конкретных вариантах осуществления выделенный сегмент ДНК может быть введен в растение-хозяин так, что он стабильно интегрируется в геном растения-хозяина.
В некоторых вариантах осуществления маркер, который сцеплен с геном, представляющим интерес, может быть использован для введения гена, представляющего интерес, в организм (например, в растение), отличный от растения рода Brassica. В конкретных вариантах осуществления ген, представляющий интерес, представляет собой fad2, а маркер представляет собой маркер группы сцепления N5 или N1 B. napus или является эквивалентным маркером. В конкретных вариантах осуществления ген, представляющий интерес, представляет собой fad3, а маркер представляет собой маркер группы сцепления N14 или N4 B. napus или является эквивалентным маркером. В конкретных вариантах осуществления ген, представляющий интерес, представляет собой ген, вносящий вклад в устойчивость к заболеванию килой крестоцветных, а маркер представляет собой маркер SSR, включающий последовательный сегмент геномной ДНК, который составляет 300 п.о. в длину, который амплифицируется с помощью иллюстративных праймеров SEQ ID NO: 18 и 19, или эквивалентный маркер.
В некоторых вариантах осуществления способ введения гена, представляющего интерес, в организм (например, в растение), отличный от растения рода Brassica, может включать анализ геномной ДНК растения Brassica (например, растения B napus сорта DMS100) зондом, который способен специфически гибридизоваться с маркером, сцепленными с геном, представляющим интерес, для идентификации гена, представляющего интерес, в растении; выделение сегмента геномной ДНК растения, включающего ген, представляющий интерес, например, путем экстракции геномной ДНК и гидролиза геномной ДНК одним или более ферментами рестрикционными эндонуклеазами; необязательную амплификацию выделенного сегмента ДНК; введение выделенного сегмента ДНК в организм, отличный от растения рода Brassica; и анализ ДНК организма зондом, который способен специфически гибридизоваться с маркером, сцепленными с геном, представляющим интерес, для идентификации гена, представляющего интерес, в организме. В конкретных вариантах осуществления выделенный сегмент ДНК может быть введен в организм так, что он стабильно интегрируется в геном организма.
В некоторых вариантах осуществления маркеры, которые сцеплены с геном, представляющим интерес, могут быть использованы для идентификации растения, включающего ген, представляющий интерес. В конкретных вариантах осуществления растение может представлять собой Brassica spp. В некоторых вариантах осуществления молекулы нуклеиновой кислоты (например, геномной ДНК или мРНК) могут быть проэкстрагированы из растения. Проэкстрагированные молекулы нуклеиновой кислоты могут быть затем введены в контакт с зондом, который способен специфически гибридизоваться с маркером, сцепленными с геном, представляющим интерес. Специфическая гибридизация зонда с проэкстрагированными молекулами нуклеиновой кислоты является показателем присутствия гена, представляющего интерес, в растении.
Общая информация относительно молекулярных маркеров и способов их применения может быть найдена, например, в Andrew H. Paterson, "The DNA Revolution" (Chapter 2) in: Genome Mapping in Plants, Ed. Andrew H. Paterson, 1996, Academic Press/R. G. Landis Company, Austin, Tex., pp. 7-21.
V. Молекулярные маркеры генов fad2 и fad3
Предлагаются молекулярные маркеры, которые сцеплены (например, прочно сцеплены) с каждым из мутантных аллелей fad2 и fad3 в Brassica spp. Идентифицированы сегменты ДНК, содержащие последовательности, вовлеченные в признак HO (fad2) и признак LL (fad3). Эти сегменты локализованы вокруг и между маркерами, которые сцеплены (например, прочно сцеплены) с мутантными аллелями в геномной группе сцепления. Таким образом, предлагаются также молекулы нуклеиновой кислоты, включающие мутантный ген fad2 или fad3, имеющие инактивирующую мутацию. В настоящем документе описываются идентифицированные сегменты и их маркеры в частности по их положению в группах сцепления генома B. napus. Например, fad2 и сцепленные с ним молекулярные маркеры могут быть локализованы в группах сцепления N5 и N1. Также, в виде примеров, fad3 и сцепленные с ним молекулярные маркеры могут быть локализованы в группах сцепления N14 и N4.
Положение идентифицированных сегментов и их маркеров может быть выражено как частота рекомбинации или единицы картирования. Варианты осуществления, описанные в настоящем документе, использовали в популяции B. napus, DMS100 x Quantum. Однако положения конкретных сегментов и маркеров в виде единиц картирования может быть выражено со ссылкой на последовательность инбредного генома Brassica. Ожидается, что номера, данные конкретным сегментам и маркерам в виде единиц картирования, могут варьироваться от сорта к сорту культурного растения и не являются частью значимого определения сегментов ДНК и маркеров, эти сегменты ДНК и маркеры описываются иным образом, например, с помощью нуклеотидной последовательности.
Конкретные примеры инактивирующих мутаций одиночных нуклеотидов в генах fad2 и fad3, присутствующие в зародышевой плазме линии канолы DMS100, являются факторами, которые отвечают за повышенное содержание олеиновой кислоты (HO) и пониженное содержание линоленовой (LL) кислоты, что наблюдается в этой линии. Используя молекулярные маркеры, сцепленные с каждой или с обеими этими мутациями, можно применить интрогрессию с использованием маркеров для введения в линии канолы и в их потомство или производные признаков HO/LL DMS100, и/или мутантных генов fad2 и fad32 DMS100 в их потомство или производные (SEQ ID NO:7 (см. фиг. 1) и SEQ ID NO:12 (смотри фиг.3), соответственно).
Методы использования молекулярных маркеров нуклеиновой кислоты, которые сцеплены с мутантным аллелем fad2 или fad3 или которые находятся в нем, для введения признаков HO/LL в новые растения и зародышевые плазмы, а также для идентификации растений с признаками HO/LL могут привести для селекционера растений к снижению стоимости, потому что такие методы могут снизить или исключить необходимость фенотипирования потомков скрещиваний с планируемым введением признаков HO/LL.
В вариантах осуществления маркер, который предельно прочно сцеплен с признаком HO, представляет собой нуклеотид «T» в положении 411 гена fad2 B. napus (или в таком же положении выровненной последовательности, например, из Brassica spp.), как описано на фиг.1 и представлено в SEQ ID NO:7. В вариантах осуществления маркер, который предельно прочно сцеплен с признаком LL, представляет собой нуклеотид «A» в первом основании 5'-сайта сплайсинга третьего интрона гена fad32 в растении B. napus (или в таком же положении выровненной последовательности, например, из Brassica spp.), как описано на фиг. 3 и представлено в SEQ ID NO:12. Дополнительные маркеры могут быть идентифицированы в качестве эквивалентов любого из этих иллюстративных маркеров, например, путем определения частоты рекомбинаций между дополнительным маркером и иллюстративным маркером. Такие определения могут использоваться в качестве улучшенного метода ортогональных контрастов, основанного на методе Mather (1931), The Measurement of Linkage in Heredity, Methuen & Co., London, с последующим тестированием максимума вероятности для определения частоты рекомбинации. Allard (1956) Hilgardia 24:235-78. Если число частоты рекомбинации меньше или равно 0,10 (т.е. 10%) у любого культурного сорта, то дополнительный маркер рассматривается как эквивалентный конкретному референсному маркеру для целей использования в методах, раскрытых в настоящем описании.
Маркеры, которые предельно прочно сцеплены с признаком высокого содержания олеиновой кислоты (HO), включают маркеры как инструменты введения фенотипа HO в растение рода Brassica. Инструменты введения фенотипа HO в растение рода Brassica могут включать последовательность нуклеиновой кислоты из растения, причем определение этой нуклеиновой кислоты дает, по меньшей мере, четкое указание на то, что растение включает последовательность нуклеиновой кислоты, включающей мутантный аллель fad2, который вносит вклад в признак HO. Примером инструмента введения фенотипа HO в растение рода Brassica является нуклеотид «T» в положении 411 гена fad2 B. napus, как показано на фиг.1 и представлено в SEQ ID NO:7. Маркеры, которые предельно прочно сцеплены с признаком низкого содержания линоленовой кислоты (LL), включают маркеры как инструменты введения фенотипа LL в растение рода Brassica. Инструменты введения фенотипа LL в растение рода Brassica могут включать последовательность нуклеиновой кислоты из растения, причем определение этой нуклеиновой кислоты дает, по меньшей мере, четкое указание на то, что растение включает последовательность нуклеиновой кислоты, включающей мутантный аллель fad32, который вносит вклад в признак LL. Примером инструмента введения фенотипа LL в растение рода Brassica является нуклеотид «A» в первом основании 5'-сайта сплайсинга третьего интрона гена fad32 B. napus, как показано на фиг.3 и представлено в SEQ ID NO:12.
Относительно маркеров, которые предельно прочно сцеплены с признаком высокого содержания олеиновой кислоты (HO), они являются инструментами идентификации растения, несущего ген, вносящий вклад в фенотип HO растения рода Brassica. Такие инструменты включают молекулу, которая дает поддающийся определению сигнал при добавлении к образцу, полученному из растения, несущего ген, вносящий вклад в фенотип HO растения рода Brassica. Поддающимся определению сигналом является специфическая гибридизация нуклеиновых кислот, и зонд нуклеиновой кислоты, который специфически гибридизуется с геном, вносящим вклад в фенотип HO, может, следовательно, являться инструментом идентификации растения, несущего ген, вносящий вклад в фенотип HO растения рода Brassica. В некоторых примерах инструментом идентификации растения, несущего ген, вносящий вклад в фенотип HO растения рода Brassica, является зонд, который специфически гибридизуется с сегментом гена fad2 B. napus, включающим мутацию с заменой «С» на «T» в положении 411, но не гибридизуется с тем же самым сегментом гена fad2 B. napus дикого типа (например, SEQ ID NO:5).
Относительно маркеров, которые предельно прочно сцеплены с признаком низкого содержания линоленовой кислоты (LL), они являются инструментами идентификации растения, несущего ген, вносящий вклад в фенотип LL растения рода Brassica. Такие инструменты включают молекулу, которая дает поддающийся определению сигнал при добавлении к образцу, полученному из растения, несущего ген, вносящий вклад в фенотип LL растения рода Brassica. Поддающимся определению сигналом является специфическая гибридизация нуклеиновых кислот, и зонд нуклеиновой кислоты, который специфически гибридизуется с геном, вносящим вклад в фенотип LL, может, следовательно, являться инструментом идентификации растения, несущего ген, вносящий вклад в фенотип LL растения рода Brassica. В некоторых примерах инструментом идентификации растения, несущего ген, вносящий вклад в фенотип LL растения рода Brassica, является зонд, который специфически гибридизуется с сегментом гена fad32 B. napus, включающим мутацию с заменой «G» на «A» в первом основании 5'-сайта сплайсинга третьего интрона, но не гибридизуется с тем же самым сегментом гена fad32 B. napus дикого типа (например, SEQ ID NO:15).
VI. Маркеры устойчивости к заболеванию килой крестоцветных
Предлагаются молекулярные маркеры, которые сцеплены (например, прочно сцеплены) с устойчивостью к заболеванию килой крестоцветных у Brassica. Сегменты ДНК, содержащие гены, вовлеченные в устойчивость к заболеванию килой крестоцветных, связаны с этими маркерами. Таким образом, молекулы нуклеиновой кислоты, включающие ген, который вовлечен в устойчивость к заболеванию килой крестоцветных, дают возможность использования и манипуляций с использованием предлагаемых маркеров. Идентифицированные маркеры и связанные с ними последовательности могут быть описаны частично по их положению в группах сцепления в геноме B. napus. В некоторых примерах маркер, который сцеплен с устойчивостью к заболеванию килой крестоцветных у Brassica, представляет собой маркер SSR.
Описанные в настоящем документе варианты осуществления выполнялись на популяции B. napus, полученной путем скрещивания сорта Mendel, устойчивого к заболеванию килой крестоцветных, с инбредным HO/LL B. napus, содержащим ген-восстановитель фертильности (rest) и устойчивость к глифосату (gly). Положение идентифицированных маркеров и сцепленных с ними последовательностей ДНК (например, генов) может быть выражено как частота рекомбинации или единицы картирования. Положения конкретных последовательностей и маркеров в виде единиц картирования могут быть выражены со ссылкой на последовательность инбредного генома Brassica. Ожидается, что номера, данные конкретным последовательностям и маркерам в виде единиц картирования, могут варьироваться от сорта к сорту культурного растения и не являются частью значимого определения каких-либо последовательностей ДНК или маркеров, эти последовательности ДНК и маркеры могут описываться иным образом, например, с помощью нуклеотидной последовательности.
Маркеры, присутствующие в зародышевой плазме линии Mendel канолы, могут быть сцеплены с фактором(ами), которые отвечают за устойчивость к заболеванию килой крестоцветных, которая наблюдается у этой исходной линии. Например, при использовании этих маркеров или их эквивалентов может быть применена интрогрессия с использованием маркеров для введения в линии канолы и в их потомки и производные устойчивости к заболеванию килой крестоцветных от Mendel.
Маркер, который сцеплен с устойчивостью к заболеванию килой крестоцветных у Brassica, может быть интегрирован в программу селекции с использованием маркеров для создания новых генотипов и зародышевой плазмы, устойчивых к заболеванию килой крестоцветных. Такая программа позволяет осуществить скрининг тысяч потомков Brassica, происходящих, например, от скрещивания инбредных сортов Brassica, имеющих один или более желаемых признаков, и Mendel (или его потомства или производных). Такой маркер позволяет также сравнительно быстро и недорого идентифицировать линии с устойчивостью к заболеванию килой крестоцветных в процессе биологического скрининга устойчивости к заболеванию килой крестоцветных перед использованием ресурсов, таких как теплицы, поля и т.д. В настоящее время скрининг устойчивости к заболеванию обычно осуществляется в ограниченных тепличных рядах внутри помещений, что приводит к существенным затратам.
В вариантах осуществления маркер, который сцеплен в фенотипом устойчивости к заболеванию килой крестоцветных, представляет собой маркер SSR, включающий последовательный сегмент геномной ДНК B. napus, который составляет 300 п.о. в длину и амплифицируется с помощью иллюстративных праймеров с SEQ ID NO: 18 и 19, причем маркер сцеплен с устойчивостью к заболеванию килой крестоцветных у растения B. napus. Специалистам в данной области техники понятно, что эквивалентные маркеры в том же самом локусе могут быть определены путем изменения длины или положения праймеров, используемых для изменения длины последовательного сегмента геномной ДНК B. napus, который амплифицируется с помощью праймеров.
В качестве эквивалента этому иллюстративному маркеру могут быть идентифицированы дополнительные маркеры, например, путем определения частоты рекомбинаций между дополнительным маркером и иллюстративным маркером SSR. При таких определениях можно использовать улучшенный метод ортогональных контрастов, основанный на методе Mather (1931), The Measurement of Linkage in Heredity, Methuen & Co., London, с последующим тестированием максимума вероятности для определения частоты рекомбинации. Allard (1956) Hilgardia 24:235-78. Если число частоты рекомбинации меньше или равно 0,10 (т.е. 10%) у любого культурного сорта, то дополнительный маркер рассматривается как эквивалентный конкретному референсному маркеру для целей использования в методах, раскрытых в настоящем описании.
Маркеры, которые сцеплены с устойчивостью к заболеванию килой крестоцветных, включают инструменты введения устойчивости к заболеванию килой крестоцветных в растение рода Brassica. Инструменты введения устойчивости к заболеванию килой крестоцветных в растение рода Brassica могут включать последовательность нуклеиновой кислоты из растения, причем определение этой нуклеиновой кислоты дает, по меньшей мере, четкое указание на то, что растение включает последовательность нуклеиновой кислоты, включающей последовательность ДНК, которая вносит вклад в фенотип устойчивости к заболеванию килой крестоцветных. Примером инструмента введения устойчивости к заболеванию килой крестоцветных в растение рода Brassica является последовательный сегмент геномной ДНК, который составляет 300 п.о. в длину и амплифицируется с помощью иллюстративных праймеров с SEQ ID NO: 18 и 19, причем маркер сцеплен с устойчивостью к заболеванию килой крестоцветных у растения B. napus.
Относительно маркеров, которые сцеплены с устойчивостью к заболеванию килой крестоцветных, они являются инструментами идентификации растения, несущего ген, вносящий вклад в устойчивость к заболеванию килой крестоцветных у растения рода Brassica. Такие инструменты включают молекулу, которая дает поддающийся определению сигнал при добавлении к образцу, полученному из растения, несущего ген, вносящий вклад в устойчивость к заболеванию килой крестоцветных у растения рода Brassica. Поддающимся определению сигналом является специфическая гибридизация нуклеиновых кислот, и зонд нуклеиновой кислоты, который специфически гибридизуется с последовательностью ДНК, вносящей вклад в фенотип устойчивости к заболеванию килой крестоцветных, может, следовательно, являться инструментом идентификации растения, несущего ген, вносящий вклад в устойчивость к заболеванию килой крестоцветных у растения рода Brassica. В некоторых примерах инструментом идентификации растения, несущего ген, вносящий вклад в устойчивость к заболеванию килой крестоцветных у растения рода Brassica, является зонд, который специфически гибридизуется с последовательным сегментом геномной ДНК, который составляет 300 п.о. в длину и амплифицируется с помощью иллюстративных праймеров с SEQ ID NO: 18 и 19, но не гибридизуется с любым сегментом, амплифицируемым теми же самыми праймерами из геномной ДНК дикого типа.
В дополнение к представленному выше, праймеры, представленные как SEQ ID NO: 18-22, или их эквиваленты, могут быть использованы в вариантах осуществления для скрининга присутствия гена, вовлеченного в устойчивость к заболеванию килой крестоцветных. Когда эти праймеры или их эквиваленты используются для амплификации последовательностей ДНК из образца геномной ДНК Brassica, в которые производилось вмешательство, амплифицированные фрагменты ДНК могут быть визуализированы (например, с помощью гель-электрофореза). Присутствие фрагмента 300 п.о. (или фрагмента ожидаемого размера для использования праймеров, функционально эквивалентных SEQ ID NO: 18-22), указывает на то, что растение, из которого был получен образец геномной ДНК, включает ген, вовлеченный в устойчивость к заболеванию килой крестоцветных.
VII. Растения Brassica HO/LL, устойчивые к гербицидам и заболеванию килой крестоцветных
В некоторых вариантах осуществления изобретения предлагается или другим образом включается в изобретение растение Brassica (например, растение B. napus), которое имеет высокое содержание олеиновой кислоты и/или низкое содержание линоленовой кислоты (HO/LL) по сравнению с растением Brassica дикого типа того же вида (например, сортом Quantum B. napus). В этих и дополнительных вариантах осуществления растение Brassica может включать признак устойчивости к имидазолиноновым гербицидам. В этих и дополнительных вариантах осуществления растение Brassica может включать признак устойчивости к заболеванию килой крестоцветных. Таким образом, в некоторых вариантах осуществления изобретения предлагается или другим образом включается в изобретение растение Brassica, включающее все признаки высокого содержания олеиновой кислоты, низкого содержания линоленовой кислоты, устойчивости к имидазолинонам и устойчивости к заболеванию килой крестоцветных.
Таким образом, растение Brassica, которое устойчиво к заболеванию килой крестоцветных, может включать маркер, сцепленный с фенотипом устойчивости к заболеванию килой крестоцветных, а также включает маркер, сцепленный с признаком HO. В этих и других вариантах осуществления растение Brassica может также включать генетический маркер, сцепленный с признаком LL. Например, растение Brassica, устойчивое к киле крестоцветных, может также включать одну или более последовательностей нуклеиновой кислоты, соответствующих мутантным генам fad2 и/или fad3. Эти гены могут быть введены в канолу или другие масличные семенные растения с помощью любого из ряда методов, известных в данной области техники. Кроме того, гены fad2 и/или fad3 могут быть изменены с помощью известных методов in vivo или in vitro для получения иллюстративных мутантных генов fad2 и/или fad3 или их эквивалентов. Примеры таких генов, маркеров и мутаций могут быть найдены без ограничения в этой раскрытой патентной публикации США 2006/0248611 (полное содержание которой включено в настоящее описание в качестве ссылки).
В конкретных вариантах осуществления семена растения Brassica могут включать благоприятный профиль масла. Например, семена могут включать, по меньшей мере, 63%, 64%, 65%, 66%, 67%, 68%, 69%, 70%, 71%, 72%, 73%, 74%, 75%, 76% или 77% олеиновой кислоты (C18:1). В этих и других примерах семена растения Brassica могут включать не более 6%, 5%, 4%, 3%, 2% или 1,5% линоленовой кислоты (C18:3).
В вариантах осуществления изобретения растения B. napus, устойчивые к киле крестоцветных, могут быть также устойчивы или толерантны к имидазолинону.
В некоторых вариантах осуществления растение Brassica, устойчивое к заболеванию килой крестоцветных, может также включать систему восстановления цитоплазматической мужской стерильности. Цитоплазматическая мужская стерильность (CMS) является широко распространенным и классическим признаком расщепления не по Менделю. Растения CMS не способны к самоопылению. Следовательно, когда линия CMS высаживается поблизости с линией с мужской фертильностью, все семена, которые образуются у стерильных растений, будут представлять собой гибриды двух родителей. В отличие от большинства признаков CMS передается по материнской линии (т.е. она переходит к потомству только через родительское семя). Это свойство является следствием того факта, что ген или гены, которые определяют CMS, локализованы в митохондриальной ДНК (mtDNA). В отличие от большинства генов, которые находятся в ядерной ДНК, гены в mtDNA передаются у большинства видов растений исключительно через женского родителя. В результате наличия этого свойства передачи по материнской линии возникает возможность легкого размножения женских линий CMS с помощью опыления мужской фертильной «поддерживающей» линией, которая идентична линии CMS в отношении ее ядерных генов, но которая является мужской фертильной из-за отсутствия mtDNA, вызывающей CMS. Однако в результате передачи CMS через женского родителя гибридные растения, полученные с использованием женских линий CMS, также характеризуются мужской стерильностью; они несут mtDNA, придающую мужскую стерильность. Это проблематично для семенных растений (например, маиса и канолы), для которых требуется продукция пыльцы для образования семян как собираемого продукта.
К счастью у многих видов культур идентифицированы специфические доминантные ядерные гены, обозначенные как восстановители фертильности (Rf), которые могут подавлять фенотип мужской стерильности и «восстанавливать» фертильность у гибридов F1. Таким образом, компоненты системы CMS включают: (1) линию CMS (которая содержит цитоплазму с мужской стерильностью (S) или (mtDNA) и является гомозиготной для рецессивного или поддерживающего аллеля гена-восстановителя); (2) поддерживающую линию (которая содержит фертильную или нормальную mtDNA (F), но изогенна линии CMS в ядерных генетических локусах), и (3) линию восстановителя (которая обычно содержит mtDNA мужской стерильности, но является гомозиготной для доминантного ядерного гена Rf). Использование этих компонентов в схеме получения гибридных семян проиллюстрировано на фиг.6. Системы мужской стерильности и восстановители, пригодные для настоящего изобретения, включают, но не ограничиваются этим: polima-систему; систему Ogura; систему, описанную в патенте США 6365798; и систему, описанную в патентной публикации США № 2004/0237141 (полное содержание каждой из которых включено в настоящее описание в качестве ссылки).
Все публикации, патенты и патентные заявки, цитированные в настоящем описании, включены таким образом в качестве ссылки. Если в настоящем описании не указано иначе, для целей настоящего изобретения могут быть использованы стандартные методы очистки ДНК, гидролиза ферментами рестрикции, анализа на агарозном геле, выделения фрагментов ДНК, лигирования и трансформации. Такие методы описаны, например, в руководствах Sambrook et al. (1989) Molecular Cloning: A Laboratory Manual, 2nd Ed., Cold Spring Harbor Laboratory Press; и Ausubel et al. (1987) Current Protocols in Molecular Biology, John Wiley and Sons, New York (оба включены в настоящее описание в качестве ссылки).
Последующие примеры предлагаются для иллюстрации определенных конкретных особенностей и/или вариантов осуществления. Примеры не должны толковаться как ограничивающие раскрытие тех конкретных особенностей или вариантов осуществления, которые они иллюстрируют. Предполагается, что специалисты в данной области техники могут различить и на практике осуществить вариации или альтернативные варианты предлагаемых в настоящем описании конкретных указаний, не выходя за объем настоящего изобретения.
Примеры
Пример 1: Материалы и методы
Растительный материал
Сорта канолы DMS100 (мутантный тип) и Quantum (дикий тип) в этом исследовании использовали для клонирования аллелей fad2 (десатуразы-2 жирных кислот) и fad3 (десатуразы-3 жирных кислот). DMS100 представляет собой линию HO/LL (высокое содержание олеиновой и низкое содержание линоленовой кислот) с содержанием олеиновой кислоты приблизительно 77% и содержанием линоленовой кислоты приблизительно 3%. DMS100 происходит от массовой селекции F4 индивидуальной селекции растений F3, происходящей от скрещивания сестринской линии Global X AG019. Quantum представляет собой коммерческий сорт и имеет низкое содержание олеиновой кислоты (~66%) и высокое содержание линоленовой кислоты (~7%). Популяция двойных гаплоидов (DH) создана с помощью культуры микроспор из растений F1 от скрещивания между линией канолы Quantum и DMS100. Популяция DH включала 604 линии. Полный анализ жирных кислот семян линий DH и их родителей был осуществлен с использованием газовой хроматографии. Из 604 линий DH 183 линии были выбраны случайным образом для анализа маркеров и картирования.
Экстракция и количественная оценка геномной ДНК
ДНК обеих родительских линий и 183 линий DH экстрагировали из листьев двухнедельных растений, выращенных в теплице, с использованием набора для тестирования растений Qiagen DNeasy™ 96. Подробности методов экстракции ДНК описаны в руководстве набора для тестирования растений DNeasy™ 96. Этот набор позволяет экстрагировать ДНК в 96-луночном формате для высокой производительности экстракции.
Для количественной оценки ДНК краситель PicoGreen™ разводили в 200 раз в 1X TE буфере. В каждую лунку планшета для микротитрования добавляли 100 мкл разведенного раствора красителя PicoGreen™ и затем добавляли 5 мкл каждого образца ДНК или стандарта ДНК (5 мкг/мл, 10 мкг/мл и 20 мкг/мл). Затем планшет кратковременно перемешивали на шейкере для планшетов и показания считывали на микропланшетном флуориметре Spectra Max GEMINIS™ XS от Molecular Devices.
ПЦР-амплификация
Реакционные смеси для ПЦР-амплификации содержали от 20 до 30 нг геномной ДНК, 0,25 мкМ 10-членного праймера, 2,5 мМ MgCl2, 0,2 мМ каждого dNTP, 1 ПЦР буфер и 0,6 единиц ДНК-полимеразы Tag. Реакции амплификации осуществляли в системе GeneAmp PCR System 9700, запрограммированной на 35 циклов по 45 секунд при 94°С, 30 секунд при от 55°С до 60°С, 1 минуте при 72°С и окончание в течение 7 минут при 72°С.
Представляющие интерес продукты ПЦР-амплификации разделяли электрофорезом в агарозном геле, и полосы, представляющие интерес, вырезали из геля. Вырезанные полосы помещали в микроцентрифужную пробирку, содержащую стерильную воду, и нагревали в течение 5 минут в кипящей воде. Растворенную ДНК амплифицировали путем ПЦР с соответствующими парами праймеров. Амплифицированные продукты лигировали с клонирующим вектором PCR2.1-TOPO с использованием TA-клонирующего набора (Invitrogen Corp., San Diego, CA) в соответствии с инструкциями производителя. Продукты лигирования затем трансформировали в компетентные клетки и помещали на плашки LB-агара, содержащие ампициллин или канамицин, X-GAL и IPTG для возможности бело-голубой селекции. Белые колонии в плашках трансформантов собирали, и идентификацию клонированных продуктов ПЦР верифицировали ферментом рестрикции EcoRI, что выявило фрагмент ДНК вектора и вставленный фрагмент ожидаемого размера. Позитивные клоны, содержащие вставку, секвенировали с помощью Sequetech Corporation (Mountain View, CA).
Анализы секвенирования и данных
Последовательности анализировали и выравнивали с использованием компьютерной программы анализа последовательностей на базе интернета SeqWeb™ (версия 2) пакета компьютерных программ GCG (Wisconsin University). Сцепленность связей между маркерами и признаками высокого содержания олеиновой кислоты или никого содержания линоленовой кислоты (HO/LL) определяли с помощью t-критерия. Карту генетических сцеплений создавали с использованием компьютерной программы JoinMap™ V2.0 с использованием минимального LOD, составляющего 3,0. Дистанции карты превращали в сантиМорганы, используя функцию Kosambi. Предполагаемые области QTL, связанные с C18:1 и C18:3, локализовали с помощью картирования интервалов с использованием компьютерной программы MapQTL V 3.0. Количественный показатель LOD 3,0 использовали для идентификации областей, потенциально влияющих на признаки HO и LL.
Тестирование внедрения
Наборы для тестирования внедрения, специфичные для мутаций генов fad2 и fad3, были разработаны с помощью Third Wave Technologies (Madison, WI). Концентрацию ДНК образцов для тестирования внедрения нормализовали до 15 нг/мкл с использованием QiaGen Bio-Robot 3000 (Valencia, CA). Тестирование внедрения осуществляли в 96-луночных планшетах по инструкции производителя. Вкратце, образцы ДНК денатурировали при 95°С в течение десяти минут. Семь мкл денатурированной ДНК (15 нг/мкл) и 8 мкл реакционной смеси (3 мкл смеси олигонуклеотидов и 5 мкл 24 мМ MgCl2) добавляли в каждую лунку 96-луночных планшетов для тестирования внедрения. Затем каждую реакцию останавливали 15 мкл минерального масла, и планшеты инкубировали в BioOven III от St. John Associates, Inc. (Belts ille, Maryland) при 63°С в течение четырех часов. Планшеты с прореагировавшим материалом считывали с использованием микропланшетного флуориметра Spectra Max GEMINIS™ XS от Molecular Devices для флуоресцентных сигналов. Для расчета отношения процент сигнала по отношению к фону для мутантного аллеля делили на процент сигнала для аллеля дикого типа для каждого образца. Генотипы образцов определяли, основываясь на рассчитанном отношении.
Пример 2: Клонирование аллелей fad2 и fad3
Фрагменты геномной ДНК гена fad2 родительских линий B. napus DMS100 (мутантной) и Quantum (дикого типа) амплифицировали с использованием праймеров, гомологичных последовательностям генов fad2 Arabidopsis или B. rapa. Tanhuanpaa et al. (1998), выше. Фиг.1. Фрагменты fad2, амплифицированные с каждого из родителей праймерами FAD2-2F и FAD2-6R, клонировали и секвенировали. Эта пара праймеров амплифицировала фрагмент fad2 той же самой длины (986 п.о.) от каждого из двух родителей. Последовательности этих двух праймеров представляют собой:
FAD2-2F: CAATCCCTCGCTCTTTCTCCTACC (SEQ ID NO:1)
FAD2-6R: CCTTTCTTGTCACCTTCCCTGTCC (SEQ ID NO:2)
Между двумя родительскими линиями была идентифицирована мутация с заменой одного нуклеотида в положении 411 гена fad2. Ген fad2 Quantum дикого типа содержит нуклеотид «С» в положении 411. Однако ген fad2 HO/LL DMS100 содержит SNP в том же положении, где нуклеотид заменен на «T». Присутствие в этом положении «T» вводит стоп-кодон и приводит к существенно укороченному продукту экспрессии fad2, который содержит только 185 аминокислот в длину. Фиг.2.
Последовательности ДНК локусов fad31 и fad32 эндоплазматической дельта-15-десатуразы линолевой кислоты B. napus были найдены и извлечены из GenBank (номера поступления AF056569 (fad31) и AF066570 (fad32)). Три пары праймеров для каждого локуса fad31 и локуса fad32 были созданы из последовательностей генов fad31 и fad32 с использованием компьютерной программы создания праймеров Primer Express (PE Applied Biosystems, Foster City, CA). Клонировали фрагменты fad31, амплифицированные парой праймеров BNFD31-CF (GAGGCTTGGACGACCACTTG) (SEQ ID NO:3) и BNFD31-CR (GACTGGACCAACGAGGAATG) (SEQ ID NO:4), и фрагменты fad32, амплифицированные парой праймеров BNFD32-CF (CAAGAATTTGTCCCACAGTACAC) (SEQ ID NO:16) и BNFD32-CR (CAACTGTTGTTAATCCTCCACG) (SEQ ID NO:17), с каждого из родителей. Секвенировали семь клонов DMS100 и шесть клонов Quantum fad31 и шесть клонов DMS100 и шесть клонов Quantum fad32.
Анализ последовательностей и выравнивание выявили отсутствие различий между клонами DMS100 и Quantum в отношении fad31 (данные не показаны). Однако выравнивание последовательностей выявило мутацию в одиночном нуклеотиде (замена «G» на «A») в первом основании 5'-сайта сплайсинга третьего интрона гена fad32. Фиг.3. Этот интрон соответствует интрону 6 гена fad3 в B. rapa (Tanhuanpaa (2000) Mapping and cloning of Fad3 gene in Brassica rapa subsp. Oleifera. Прямое предоставление GenBank. Поступления в GenBank NO. AF308975, AF308976, AF308977 и AF308978) и Arabidopsis (Nishiuchi et al. (1994) Plant Physiol. 105:767-8). Гены fad3 B. rapa и Arabidopsis содержат восемь экзонов и семь интронов, тогда как последовательность B. napus, исследованная в настоящем описании, охватывает экзоны 4 (частично), 5, 6 и 7 (частично) и интроны 4, 5 и 6. Это представление экзонов/интронов в гене fad3 поддерживается тем фактом, что последовательность гена fad3 высоко консервативна среди секвенированных видов Brassica и Arabidopsis.
Интроны растений содержат высоко консервативные 5’-сайты сплайсинга (соединение экзона/интрона AG/GTAAG) и 3'-сайты сплайсинга (соединение экзона/интрона TGCAG/G). Среди более 1000 исследованных интронов Arabidopsis первые два нуклеотида в 5’-сайте сплайсинга последовательности соединения интрона, +1G и +2T, консервативны на 100% и 99%, соответственно. Lorkovic et al. (2000) Trends Plant Set. 5(4): 160-7; и Brown (1996) Plant Mol. Biol. 32(3):531-5. Правильность сплайсинга зависит от механизмов узнавания сигнала интрона и корректного выбора 5'- и 3'-сайтов сплайсинга. Мутация с заменой +1G на +1A в 5'-сайте сплайсинга (положение 530), идентифицированная в настоящем описании (см. фиг.3), может отменить сплайсинг или привести к пропуску экзона; т.е. влияет на экзон (экзон 6), и оба прилегающих интрона могут быть удалены при единичном событии сплайсинга. Lorkovic et al. (2000), выше; и Simpson et al. (1998) Plant J. 15(1 ): 125-31. Такой пропуск экзона может привести к синтезу полипептида с пропуском аминокислот, кодируемых экзоном 6 гена fad3. Эта мутация может также блокировать сплайсинг в нормальном 5'-сайте сплайсинга и активировать скрытые сайты сплайсинга в различных положениях, что может привести к скрытому сплайсингу подверженного влиянию экзона совместно с нижележащим интроном. McCullough et al. (1993) Mol. Cell. Biol. 13(3):1323-31. Такой скрытый сплайсинг может привести к ранней терминации трансляции и синтезу более короткого полипептида дельта-15-десатуразы линолеата с гена fad3, потому что интрон содержит стоп-кодоны во всех трех возможных рамках считывания и, следовательно, экзоны 7 и 8 остаются нетранслируемыми. Неполная трансляция fad3 может приводить к инактивации фермента и блокированию десатурации линолевой кислоты (C18:2) до линоленовой кислоты (C18:3), приводя к снижению аккумуляции C18:3 в семенах канолы.
Эти данные существенно поддерживают предположение о том, что мутации одиночных нуклеотидов, идентифицированные в генах fad2 и fad3, являются факторами, которые отвечают за увеличение содержания олеиновой кислоты и снижение содержания линоленовой кислоты в линии канолы DMS100. Как показано на фиг.1 и 3, соответственно, специфичные для мутантов праймеры FAD2GM (CGCACCGTGATGTTAACGGTTT) (SEQ ID NO:5) и FAD3cGM (ATAAATAATGTTGATCTACTTAT) (SEQ ID NO:15), созданы с целью определения мутантных аллелей HO/LL fad2 и fad32 с использованием ПЦР амплификации. При использовании молекулярных маркеров, сцепленных с каждой или обеими двумя мутациями, описанными выше, может быть применена интрогрессия с использованием маркеров для введения признаков HO/LL в линии канолы DMS100 и их потомство или производные, и/или мутантных генов fad2 (SEQ ID NO:7) и fad3 (SEQ ID NO:12) DMS100 в их потомство или производные. Фиг.1 и 3.
Пример 3: Мутантные специфичные для аллеля SNP маркеры генов fad2 и fad3
Мутации одиночного нуклеотида, присутствующие в генах fad2 и fad3, использовали в качестве маркеров SNP для введения метки в гены fad2 и fad3 для селекции на высокое содержание С18:1 и низкое содержание С18:3 при скрещивании канолы. Создавали специфичные для мутантов праймеры (FAD2GM: CGCACCGTGATGGTTAACGGTTT (SEQ ID NO:5); и FAD3cGM: ATAAATAATGTTGATCTACTTAT (SEQ ID NO:15)), для того чтобы определить мутантные аллели fad2 и fad32 с использованием ПЦР амплификации. Праймеры создавали так, чтобы мутантное основание (SNP) было на 3'-конце одного из праймеров для специфичной для аллеля ПЦР амплификации. Фиг.1 и 3.
Праймеры, специфичные для fad2, амплифицировались полиморфной полосой, которая присутствовала в DMS100 и объемах ДНК при высоком содержании олеиновой кислоты (С18:1), но отсутствовала в Quantum и объемах ДНК при низком содержании олеиновой кислоты. Фиг.4. Этот специфичный для гена маркер был протестирован в популяции DH, происходящей от скрещивания Quantum и DMS100, где было найдено, что распределение аллеля высоко коррелировало с высоким содержанием С18:1. Фиг.4; таблица 1. Специфичные для аллеля fad3 праймеры, также амплифицировались как полиморфный фрагмент, который присутствовал в DMS100, но отсутствовал в Quantum. Анализ популяции DH показал, что этот специфичный для гена маркер был статистически связан с низким содержанием С18:3. Фиг.4; таблица 1. Таким образом, успешно созданы специфичные для гена маркеры на основе ПЦР, которые являются непосредственными метками генетических мутаций. Это содержание настоящего раскрытия, варианты или производные маркеров, раскрытых в настоящем описании (включая маркеры разного типа), основанные, например, на высокой значительной гомологии существенного количества пар оснований, должно быть с легкостью понято специалистом в данной области техники.
|
В процессе генетического и QTL картирования с использованием популяции DH, происходящей от скрещивания Quantum x DMS100, были найдены одна основная (N5) и одна минорная (N1) области QTL для высокого содержания С18:1 и три области QTL (N4 и N14) для низкого содержания С18:3. Фиг.5. Результат этого картирования согласуется с генетическими анализами, показавшими, что высокое содержание С18:1 контролируется одним главным геном, а низкое содержание С18:3 контролируется многими генами. Маркер на основе гена fad2 локализован точно в картированной локализации локуса QTL для С18:1, поддерживая тот факт, что QTL соответствует функционирующему гену fad2, который подвергнут мутации в DMS100. Это также совпадает с предшествующими исследованиями, показавшими, что ген fad2 может быть локализован в группе сцепления N5. См. Schierholt et al. (2000) Theor. Appl. Genet. 101:897-901. Локализация маркера, основанного на гене fad3, точно совпадает с картированной локализацией одного из главных локусов QTL для С18:3 в группе сцепления 14 (геном С), поддерживая заключение о том, что QTL представляет собой ген fad3c (fad3 в геноме C, ранее называемый как fad32) и что он подвержен второй мутации в DMS100.
Пример 4: Получение популяций для селекции
Исходное межсортовое скрещивание включало канолу HOLL x канолу сорта не HOLL. F1 использовали в качестве двойного гаплоидного донора, и все донорские растения были гемизиготными для каждого из трех мутантов fad. Все донорские растения были гемизиготными для каждой из трех требуемых мутаций десатуразы жирных кислот. Все три гена, как прогнозировалось, группировались независимо. Таким образом, представлена популяция из 457 собранных индивидуумов, ожидалось, что 1/8 этих индивидуумов (1/2×1/2×1/2) должна содержать все три маркера FAD. Следовательно, из 457 индивидуумов приблизительно 57 индивидуумов, как прогнозировалось, содержат все три маркера FAD, которые вносят вклад в канолу HO/LL. Однако, как продемонстрировано с помощью анализа FAME, представленного на фиг.7, этот прогноз в данной популяции не оправдался
Профиль распределения жирных кислот при скрещивании HO/LL x не HO/LL не был ожидаемым. В этой популяции было меньшее количество индивидуумов с низким содержанием С18:3, чем должно было ожидаться, и намного больше индивидуумов с очень низким содержанием композиции С18:1. 202 индивидуума продуцировали уровень С18:1 выше 70%, но только 101 индивидуум продуцировал уровень С18:3 ниже 3,0%. Только 41 индивидуум имел сочетание содержания С18:1 выше 70% и С18:3 ниже 3%. Это было ниже, чем ожидаемое количество в 57 индивидуумов. Вместо 12% индивидуумов, содержащих профиль масла семян HO/LL (как ожидалось), только 9% индивидуумов демонстрировало такой профиль.
Исследовали также влияние сочетания двух наборов родительского материала. Растения HO/LL скрещивали с растениями сорта не HO/LL для получения популяций для селекции. Эта популяция дала большое количество линий DH, которые не имели профиля HO/LL или стандартных профилей жирных кислот канолы, даже если оба родителя были HO/LL или имели стандартные профили жирных кислот канолы (С18-1; С18-3). 88 линий DH продуцировало профиль менее 60% С18:1, обычно обнаруживаемый в материалах с качеством, не соответствующем каноле. Это было неожиданным результатом, так как генетический состав растений-доноров был гемизиготным для всех трех мутаций FAD. Наблюдалась более высокая продукция как С16:0, так и С18-2 в этих материалах по сравнению с типами HO/LL и близкими к HO/LL. Эти типы с качеством, не соответствующем каноле, продуцировали слегка повышенный уровень С16:0 по сравнению с линиями HO/LL, но самое большое различие между этими двумя классами линий заключалось в уровне линоленовой кислоты (С18:2). Линии, содержащие очень низкие уровни С18:1, имели очень высокие уровни С18:2, а также очень высокие уровни С18:3. Существовали линии с содержанием С18:1 менее 60%, которые имели очень низкие уровни С18:3 (менее 2%), представляющие интересное сочетание генетических признаков, которое заявители не видели у этих разновидностей скрещивания ранее.
Из данных генетических прогнозов относительно родительских линий, гемизиготных по всем трем мутациям FAD, должно ожидаться, что большая доля линий HO/LL должна проявлять устойчивость к киле крестоцветных. Однако сложность состава жирных кислот, наблюдаемая у потомства таких растений, указывает на то, что создание линий HO/LL с устойчивостью к киле крестоцветных с помощью скрещивания гемизиготных растений FAD должно быть затруднено.
Другая сложность, наблюдаемая при комбинации родителей HO/LL и не HO/LL, состояла в получении раннего цветения линий HO/LL в популяции потомков. Как проиллюстрировано на диаграмме цветения на фиг.8, частоту ряда селекционных линий сравнивали с датой цветения. Очень мало селекционных линий характеризовалось ранним цветением, и наблюдалась тенденция к распределению, являющемуся уплощенным, с большим количеством линий, проявляющих более позднее цветение. Получение очень рано цветущей линии HO/LL и линий, устойчивых к киле крестоцветных, с использованием этого родительского материала оказалось неожиданно трудным. Существенные различия в цветении также очевидны для линий с устойчивостью, представленных на фиг.7.
Устойчивые линии, идентифицированные в таблице 1 (от DAS 34 до DAS 74), высаживали для осуществления селекционного обратного скрещивания родителя HOLL. Устойчивые линии таблицы 1 давали очень большие различия в дате первого цветения от 19 марта до 2 апреля. Четыре устойчивых линии давали крайне позднее цветение и не цвели до тех пор, пока родитель HOLL оказывался уже без цветков. Следует отметить, что четыре линии, устойчивые к киле крестоцветных, с наиболее ранним цветением в этом эксперименте имели только два из трех маркеров FAD. Две из четырех линий с предельно поздним цветением имели все три мутанта FAD и две из линий с предельно поздним цветением имели два мутанта FAD. Это указывает на сложность и трудность получения зародышевой плазмы, устойчивой к киле крестоцветных, с ранним цветением и HOLL, в одной линии Brassica.
Пример 5: Анализ FAME
Для 40 отдельных линий, проанализированных в примере 3, проводили анализ FAME для определения содержания жирных кислот в линиях. Результаты представлены в таблицах 2 и 3 ниже:
|
|
Пример 6: Селекция устойчивости к гербицидам
Приблизительно 1000 индивидуумов поколения BC1 (от обратного скрещивания индивидуумов Mendel x HO/LL/rest/gly с устойчивыми к имидазолинону и глифосату инбредными линиями) исследовали на ген-восстановитель фертильности. Было обнаружено, что приблизительно 156 индивидуумов BC1 были гомозиготными, 469 были гемизиготными и 370 индивидуумов характеризовались признаком восстановления фертильности дикого типа. Доли фертильных (гомозиготных и гемизиготных) индивидуумов были ниже ожидаемых с данными ожидаемыми отношениями 50% гомозиготных и 50% гемизиготных для признака восстановления фертильности; фактические результаты составляли 625 фертильных:469 стерильных, существенно отходя от ожидаемого отношения.
Были проведены дополнительные тесты на фертильность (гомозиготных и гемизиготных) растений для определения наличия устойчивости к глифосату. 327 растений BC1 с устойчивостью к глифосату использовали для селекции устойчивости к имидазолинону. Типы, устойчивые к имидазолинону, получали в приблизительном отношении 1:1 гомозиготы:гемизиготы для каждого из трех генов FAD (173:150 для FAD2, 144:177 для FAD3A и 174:153 для FAD3С), и из полученных растений 83 были гомозиготными для гена-восстановителя и 244 были гемизиготными. Линии с индивидуальной негативной устойчивостью к глифосату сравнивали на присутствие генов FAD, а также гена-восстановителя, и растения, идентифицированные как гомозиготные для двух из трех генов FAD, а также гомозиготные для гена-восстановителя, выращивали в горшках в теплице для селекции «раннего цветения».
Дни до цветения в условиях теплицы определяли для каждого растения, и растения с наиболее ранним цветением с двумя или тремя генами FAD и признаком восстановления индивидуально помещали в мешочки для самоопыления для получения чистых семян BC1S1. После сбора небольшие образцы семян тестировали для подтверждения профилей жирных кислот масла семян. Содержание олеиновой кислоты (С18:1) в этих образцах находилось в диапазоне от 63,34% до 77,34%. Содержание линоленовой кислоты (С18:3) находилось в диапазоне от 5,81% до 1,32%, и состав насыщенных жирных кислот находился в диапазоне от 9,64% до 6,49%. Тестировали оставшиеся семена от 20 наиболее рано цветущих линий BС1S1, устойчивых к имидазолинону, с высоким содержанием олеиновой, низким содержанием линоленовой кислот, геном- восстановителем, и у всех определяли носительство устойчивости к заболеванию килой крестоцветных.
Пример 7: Маркеры, сцепленные с устойчивостью к заболеванию килой крестоцветных
Сорт Mendel культурного растения B. napus с устойчивостью к заболеванию килой крестоцветных использовали для получения серий скрещиваний с инбредной линией HO/LL B. napus, содержащей ген-восстановитель фертильности (restr) и устойчивости к глифосату (gly). Полученное потомство F1 подвергали обратному скрещиванию с инбредными линиями, устойчивыми к имидазолинону и глифосату, с селекцией на HO/LL, восстановитель фертильности и устойчивость к гербицидам. Растения F1 были промежуточными в отношении признаков роста и требовали низкотемпературной яровизации для индукции цветения. Использовали характеристики молекулярных маркеров для объединения устойчивости к гербицидам, профилей масла семян и восстановления фертильности для идентификации индивидуумов F1 с целью применения в качестве родителей при скрещивании для создания поколений BC1. После получения поколения BC1 определяли устойчивость к киле крестоцветных с использованием биологического метода, который показал, что устойчивость к заболеванию килой крестоцветных передавалась родительским типам HO/LL. В таблице 4 представлены результаты тестирования на устойчивость к киле крестоцветных для множества растений из 40 отдельных линий. Растения подразделяли на категории с ранжированием от 0 (устойчивые) до 3 (восприимчивые). Линию в целом затем оценивали с помощью буквенной градации от R (устойчивая), M (смешанная устойчивость) до S (восприимчивая).
|
Осуществляли тройное скрещивание инбредной линии Mendel (устойчивость к киле крестоцветных) HO/LL с инбредной линией B. napus, восприимчивой к заболеванию килой крестоцветных. Проводили скрининг сорока линий DH, происходящих от растения поколения F1 этого тройного скрещивания на устойчивость к заболеванию килой крестоцветных с использованием биологического метода. Таблица 5. Выращивали эти выбранные линии DH, две родительские линии и три сорта канолы (NEX 827, NEX 830 и NEX 845), и собирали ткань листьев от каждой. Собранные ткани листьев лиофилизовали и растирали для экстракций ДНК.
|
ДНК экстрагировали из лиофилизованных растертых тканей листьев с использованием набора для экстракции ДНК растений Qiagen™ Mini в соответствии с инструкциями набора. Образцы проэкстрагированной ДНК количественно оценивали с использованием NanoDrop™ 8000 и доводили до концентрации 5 нг/мкл особо чистой водой. Два отдельных образца суммарной ДНК составляли с использованием равных количеств ДНК от 5 линий DH, устойчивых к киле крестоцветных («R-пул») (линии DH 140227, 145776, 145853, 145882 и 146058) и от 5 чувствительных линий DH («S-пул») (линии DH 145506, 145645, 145666, 145842, 145850).
Эти два суммарных образца ДНК вместе с образцами родительской ДНК использовали для идентификации маркеров SSR (маркеров повторов простых последовательностей), сцепленных с устойчивостью к заболеванию килой крестоцветных у канолы, с использованием способа массового сегрегационного анализа: заявители применяли способ массового сегрегационного анализа (BSA) с использованием R-пула, S-пула и образцов ДНК от их соответствующих родительских линий с молекулярными маркерами повторов простых последовательностей (SSR). Затем маркеры SSR, идентифицированные как полиморфные между двумя суммарными образцами ДНК и родительскими линиями, тестировали у 40 индивидуальных линий DH с известной устойчивостью к заболеванию килой крестоцветных.
Проводили скрининг двух суммарных образцов ДНК и ДНК двух родительских линий с помощью суммарно 713 пар SSR M13-меченных праймеров и генетического анализатора ABI 3130 для идентификации полиморфных маркеров между устойчивыми и чувствительными пулами, а также родительской ДНК. Скрининг проводили с помощью осуществления реакций ПЦР с праймерами, имеющими последовательности, представленные в SEQ IDs 20, 21 и 22 (FAM-меченными); Taq-полимеразой HotMaster™; и реакционным буфером HotMaster™. Реакции ПЦР осуществляли в 1 цикле при 95°C в течение 3 минут; 4 циклах профиля touchdown ПЦР, состоящего из 94°C в течение 30 секунд, 56°C в течение 50 секунд (-2°C/цикле), и 72°C в течение 55 секунд; 24 циклах при 94°C в течение 30 секунд, 51°C в течение 50 секунд и 72°C в течение 55 секунд; 1 цикле при 72°C в течение 10 минут; и при конечной инкубации при 8°C до завершения. Реакционные смеси после окончания ПЦР разводили (7 мкл реакционной смеси в 100 мкл H2O) и 4 мкл разведенного продукта ПЦР смешивали с подвижным буфером SSR (10,8 мкл HiDi формамида и 0,2 мкл стандартной ДНК Gene Scan 600 LIZ) и переносили в планшет для использования в генетическом анализаторе ABI 3130x1. Планшеты затем быстро крутили короткое время (макс. 500 об/мин в течение нескольких секунд), денатурировали в течение 5 минут при 95°С и охлаждали на льду. Планшеты опять быстро крутили для уверенности в том, что вся жидкость скопилась на дне каждой лунки, и не наблюдается пузырьков воздуха. Полученные планшеты затем вставляли в планшетный блок и загружали в генетический анализатор ABI 3130x1. Данные анализировали с использованием компьютерной программы GeneMapper™.
42 из 713 пар праймеров SSR, подвергшихся скринингу, были полиморфными при амплификациях ДНК между устойчивым ДНК-пулом (R-пулом) и чувствительным ДНК-пулом (S-пулом), и наблюдаемые полиморфизмы совпадали с устойчивой родительской линией (Mendel) и чувствительным инбредным родителем. Эти 42 маркера SSR использовали для скрининга сорока индивидуальных линий DH, родительских сортов, NEX 827, NEX 830 и NEX 845, для определения сцепления между маркером и фенотипом устойчивости к киле крестоцветных.
Массовый сегрегационный анализ идентифицировал одну пару праймеров SSR (BN1810), обеспечивающую амплификацию фрагмента ДНК 333 п.о., тесно связанного с фенотипом устойчивости к заболеванию килой крестоцветных.
Таблица 6.
Маркер BN1810 SSR
BN1810-DAS-Ml3F: CACGACGTTGTAAAACGACGGCCAGTTTCTCC GACCAAAGCTGTTT (SEQ ID NO:20)
BN 1810-Tailed R: GTTTCTTAAGGAGCTGGATTCACATGG (SEQ ID NO:21)
M13-6FAM (флуоресцентно меченный праймер): 6FAM- CACGACGTTGTAAAACGA (SEQ ID NO:22)
За исключением двух ошибочных классификаций этот маркер безошибочно предсказывает реакцию протестированных линий канолы на заболевание килой крестоцветных. Данные таблицы 6 демонстрируют 19 устойчивых индивидуумов, 13 чувствительных индивидуумов и 6 индивидуумов, классифицируемых как умеренно устойчивые. Этот маркер был протестирован также с другой популяцией DH, которая происходила от Mendel как устойчивого растения, и маркер предсказывал ожидаемое соотношение сегрегации устойчивых индивидуумов к чувствительным. Индивидуумы, оцениваемые в этой, другой популяции DH происходили не от гомозиготных родителей, так что ожидалась некоторая сегрегация.
|
Пример 8: Идентификация гена(ов) устойчивости к заболеванию килой крестоцветных
Секвенирована область геномной ДНК B. napus, амплифицированная парой праймеров BN1810 SSR. Последовательность амплифицированной области используется для геномных баз данных зондов для идентификации гена, включающего маркер BN1810 SSR. Ген, включающий маркер BN1810 SSR, идентифицирован, и этот ген определен как являющийся источником устойчивости к заболеванию килой крестоцветных.
Идентифицированный ген устойчивости к заболеванию килой крестоцветных локализован в геноме Brassica, и идентифицированы маркеры, которые расположены достаточно близко к гену, являющиеся сцепленными в процессе мейоза. Проведен скрининг идентифицированных маркеров в популяциях F1 гибридов между сортами, устойчивыми к заболеванию килой крестоцветных и чувствительными к нему, для дополнительной идентификации подгруппы маркеров, которые являются полиморфными, и таким образом пригодны в качестве маркеров источника устойчивости к заболеванию килой крестоцветных, представленного маркером BN1810 SSR. Некоторые маркеры в этой подгруппе могут быть более тесно сцеплены с устойчивостью к заболеванию килой крестоцветных, чем маркер BN1810 SSR.
Геномную ДНК выделяли из предоставленных сортов, и выделенную ДНК амплифицировали с использованием пары праймеров BN1810 SSR. Если амплификация последовательности выделенной ДНК с последовательностями, соответствующими паре праймеров BN1810 SSR, показывает присутствие маркера, данные представляют доказательство того, что источник потенциальной устойчивости к киле крестоцветных является аллельным вариантом источника, присутствующего в Mendel.
Предоставленные сорта, каждый гибридизуется с линией, чувствительной к заболеванию килой крестоцветных, для получения популяции F1. Двойные гаплоидные (DH) линии получают из этой популяции F1, и проводят скрининг линий на устойчивость к заболеванию килой крестоцветных с использованием биологического метода. Выбранные линии DH, две родительские линии и Mendel выращивают, и ткань растения собирают от каждой линии. ДНК экстрагируют из собранных тканей растений. Образцы проэкстрагированной ДНК количественно оценивают и составляют образцы суммарной ДНК из линий DH, устойчивых к киле крестоцветных, и линий DH, чувствительных к киле крестоцветных.
Образцы суммарной ДНК вместе с образцами родительской ДНК используют в способе массового сегрегационного анализа для определения того, является ли маркер BN1810 SSR полиморфным между пулами ДНК, устойчивыми к заболеванию килой крестоцветных и чувствительными к нему, родительскими линиями и линиями DH. Если маркер является полиморфным, данные совпадают с гипотезой о том, что источником потенциальной устойчивости к киле крестоцветных является вариант, аллельный источнику, присутствующему в линии Mendel.
Несмотря на то, что в настоящем документе описаны иллюстративные варианты осуществления, специалисты в данной области техники должны понимать и принимать во внимание, что могут быть сделаны многочисленные добавления, удаления и модификации иллюстративных вариантов осуществления без выхода за рамки объема последующей формулы изобретения. Кроме того, характерные свойства одного варианта осуществления могут быть объединены с характерными свойствами другого варианта осуществления.