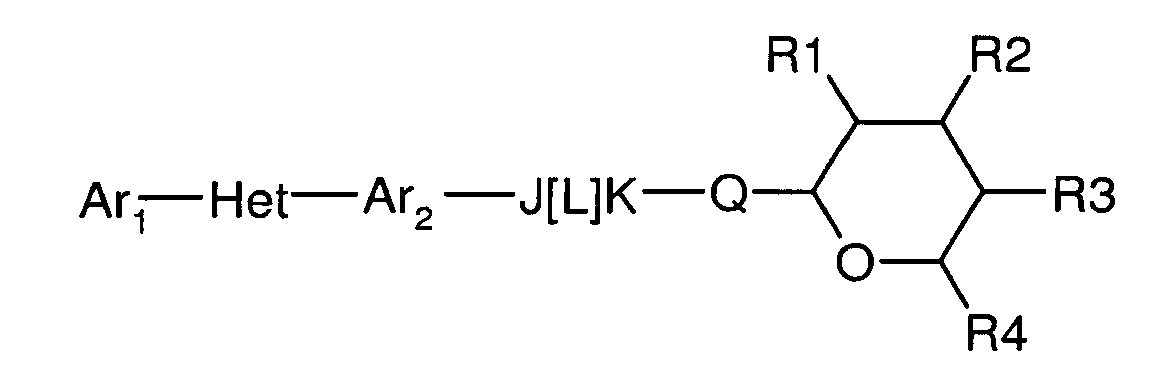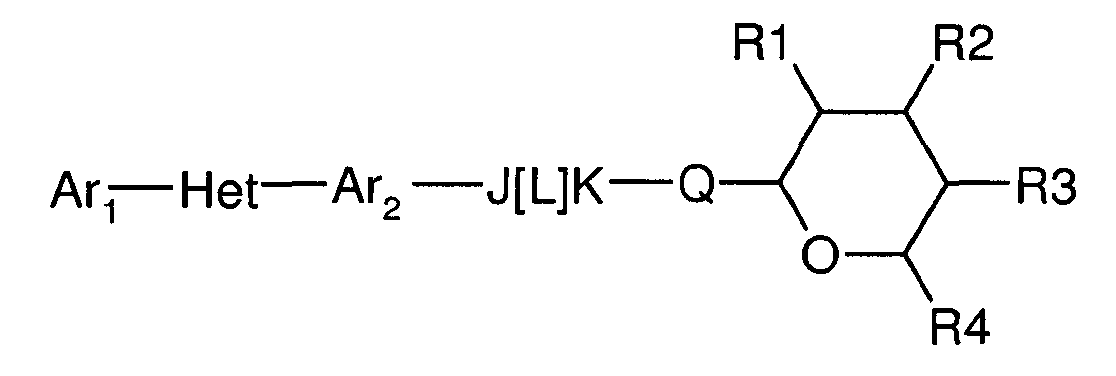Результат интеллектуальной деятельности: ПЕСТИЦИДНЫЕ КОМПОЗИЦИИ
Вид РИД
Изобретение
Перекрестная ссылка на родственную заявку
По настоящей заявке испрашивается приоритет в соответствии с предварительной заявкой США, серийный номер 61/065475, поданной 12 февраля 2008, полное содержание которой включено здесь в виде ссылки.
Область изобретения
Описанное в настоящем документе изобретение относится к области пестицидов и их применению для борьбы с вредителями.
Уровень техники
Каждый год вредители вызывают миллионы смертельных случаев у людей во всем мире. Кроме того, существует более десяти тысяч разновидностей вредителей, являющихся причиной потерь в сельском хозяйстве. Каждый год эти сельскохозяйственные потери составляют миллиарды долларов США. Термиты наносят урон различным сооружениям, таким как, например, дома. Эти потери в результате вредоносной деятельности термитов составляют миллиарды долларов США каждый год. И, наконец, большое количество вредителей поедают и портят хранящиеся в магазинах и на складах пищевые продукты. Эти потери продуктов питания составляют миллиарды долларов США каждый год, но что еще более важно, они лишают людей необходимой пищи.
Существует острая необходимость в новых пестицидах. К используемым в настоящее время пестицидам у насекомых развивается устойчивость. Сотни разновидностей насекомых являются устойчивыми к одному или нескольким пестицидам. Развитие устойчивости к некоторым из давно используемых пестицидов, таких как ДДТ, карбаматы и органофосфаты, хорошо известно. Однако устойчивость развивалась даже к некоторым более новым пестицидам. Соответственно существует потребность в новых пестицидах и в частности пестицидах, которые обладают новым принципом действия.
Заместители (неполный перечень)
Приведенные для заместителей примеры являются (за исключением галогена) неполными и не могут быть истолкованы как ограничивающие описанное в настоящем документе изобретение.
Термин “алкенил” обозначает ациклический ненасыщенный (по меньшей мере одна углерод-углеродная двойная связь) разветвленный или неразветвленный заместитель, содержащий углерод и водород, например винил, аллил, бутенил, пентенил, гексенил, гептенил, октенил, ноненил и деценил.
Термин “алкенилокси” обозначает алкенил, дополнительно имеющий углерод-кислородную одинарную связь, например аллилокси, бутенилокси, пентенилокси, гексенилокси, гептенилокси, октенилокси, ноненилокси и деценилокси.
Термин “алкокси” обозначает алкил, дополнительно имеющий углерод-кислородную одинарную связь, например метокси, этокси, пропокси, изопропокси, 1-бутокси, 2-бутокси, изобутокси, трет-бутокси, пентокси, 2-метилбутокси, 1,1-диметилпропокси, гексоокси, гептокси, октокси, нонокси и децокси.
Термин “алкил” обозначает ациклический насыщенный разветвленный или неразветвленный заместитель, содержащий углерод и водород, например, метил, этил, пропил, изопропил, 1-бутил, 2-бутил, изобутил, трет-бутил, пентил, 2-метилбутил, 1,1-диметилпропил, гексил, гептил, октил, нонил и децил.
Термин “алкинил” обозначает ациклический ненасыщенный (по меньшей мере одна углерод-углеродная тройная связь и любые двойные связи) разветвленный или неразветвленный заместитель, содержащий углерод и водород, например этинил, пропаргил, бутинил, пентинил, гексинил, гептинил, октинил, нонинил и децинил.
Термин “галоген” обозначает фтор, хлор, бром и иод.
Термин “галогеналкокси” обозначает галогеналкил, дополнительно содержащий углерод-кислородную одинарную связь, например фторметокси, дифторметокси и трифторметокси, 2-фторэтокси, 1,1,2,2,2-пентафторэтокси, 1,1,2,2-тетрафтор-2-бромэтокси и 1,1,2,2-тетрафторэтокси.
Термин “галогеналкил” обозначает алкил, дополнительно содержащий, в количестве от одного до максимально возможного, одинаковых или различных, галогенов, например фторметил, дифторметил, трифторметил, 2-фторэтил, 2,2,2-трифторэтил, хлорметил, трихлорметил и 1,1,2,2-тетрафторэтил.
Термин “галогенфенилокси” обозначает фенилокси, содержащий один или несколько, одинаковых или различных, галогенов.
Термин “гидроксиалкил” обозначает алкил, содержащий одну или несколько гидроксигрупп.
Подробное описание изобретения
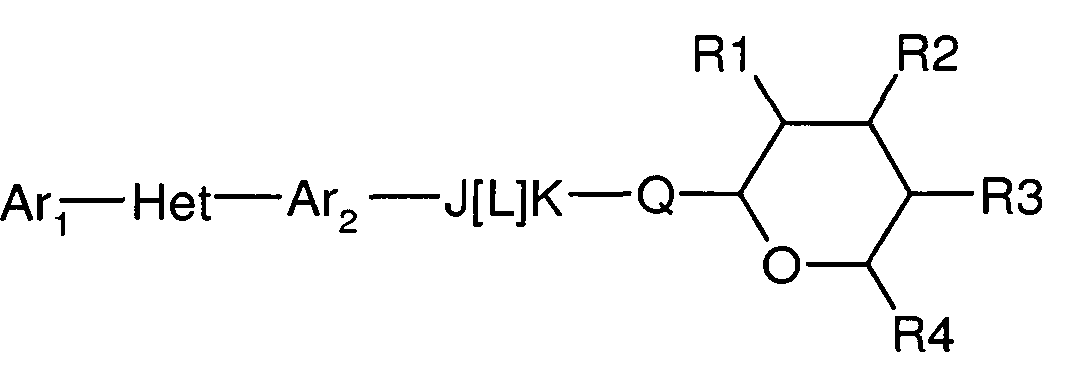
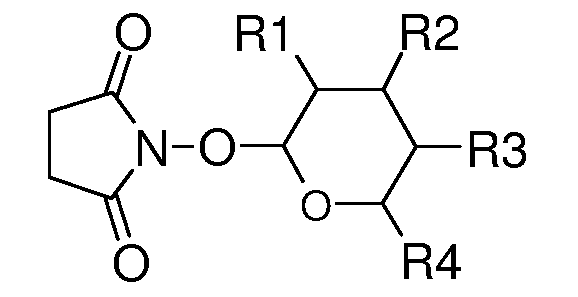
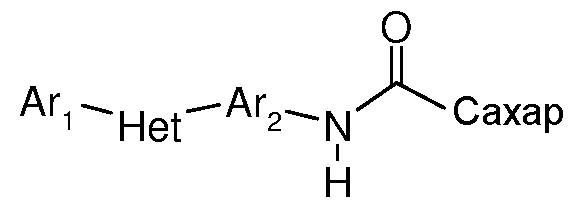
Соединения по настоящему изобретению, имеют следующую формулу:
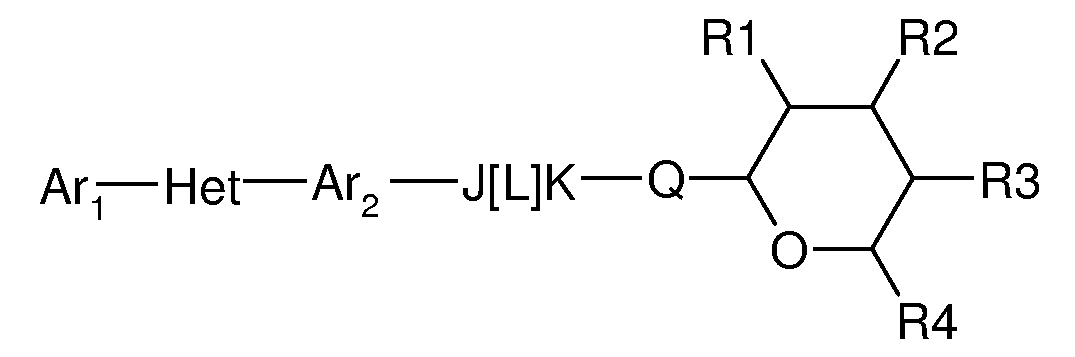
где:
(a) Ar1 представляет собой
(1) фуранил, фенил, пиридазинил, пиридил, пиримидинил, тиенил или
(2) замещенный фуранил, замещенный фенил, замещенный пиридазинил, замещенный пиридил, замещенный пиримидинил или замещенный тиенил, где указанные замещенный фуранил, замещенный фенил, замещенный пиридазинил, замещенный пиридил, замещенный пиримидинил и замещенный тиенил содержат один или несколько заместителей, которые независимо выбраны из H, OH, F, Cl, Br, I, CN, NO2, C1-C6алкила, C1-C6галогеналкила, C1-C6гидроксиалкила, C3-C6циклоалкила, C3-C6галогенциклоалкила, C3-C6гидроксициклоалкила, C3-C6циклоалкокси, C3-C6галогенциклоалкокси, C3-C6гидроксициклоалкокси, C1-C6алкокси, C1-C6галогеналкокси, C2-C6алкенила, C2-C6алкинила, S(=O)n(C1-C6алкил), S(=O)n(C1-C6галогеналкил), OSO2(C1-C6алкил), OSO2(C1-C6галогеналкил), C(=O)H, C(=O)OH, C(=O)NRxRy, (C1-C6алкил)NRxRy, C(=O)(C1-C6алкил), C(=O)O(C1-C6алкил), C(=O)(C1-C6галогеналкил), C(=O)O(C1-C6галогеналкил), C(=O)(C3-C6циклоалкил), C(=O)O(C3-C6циклоалкил), C(=O)(C2-C6алкенил), C(=O)O(C2-C6алкенил), (C1-C6алкил)O(C1-C6алкил), (C1-C6алкил)S(C1-C6алкил), C(=O)(C1-C6алкил)C(=O)O(C1-C6алкил), фенила, фенокси, замещенного фенила и замещенного фенокси (где такой замещенный фенил и замещенный фенокси содержат один или несколько заместителей, которые независимо выбраны из H, OH, F, Cl, Br, I, CN, NO2, C1-C6алкила, C1-C6галогеналкила, C1-C6гидроксиалкила, C3-C6циклоалкила, C3-C6галогенциклоалкила, C3-C6гидроксициклоалкила, C3-C6циклоалкокси, C3-C6галогенциклоалкокси, C3-C6гидроксициклоалкокси, C1-C6алкокси, C1-C6галогеналкокси, C2-C6алкенила, C2-C6алкинила, S(=O)n(C1-C6алкил), S(=O)n(C1-C6галогеналкил), OSO2(C1-C6алкил), OSO2(C1-C6галогеналкил), C(=O)H, C(=O)OH, C(=O)NRxRy, (C1-C6алкил)NRxRy, C(=O)(C1-C6алкил), C(=O)O(C1-C6алкил), C(=O)(C1-C6галогеналкил), C(=O)O(C1-C6галогеналкил), C(=O)(C3-C6циклоалкил), C(=O)O(C3-C6циклоалкил), C(=O)(C2-C6алкенил), C(=O)O(C2-C6алкенил), (C1-C6алкил)O(C1-C6алкил), (C1-C6алкил)S(C1-C6алкил), C(=O)(C1-C6алкил)C(=O)O(C1-C6алкил)фенила и фенокси);
(b) Het представляет собой 5- или 6-членное насыщенное или ненасыщенное гетероциклическое кольцо, содержащее один или несколько гетероатомов, которые независимо выбраны из атомов азота, серы или кислорода, и где Ar1 и Ar2 не находятся в орто-положении относительно друг друга (но могут находиться в мета- или пара-положении, например, для пятичленного кольца - это 1,3-положения, и для 6-членного кольца - это либо 1,3-, либо 1,4-положения), и где указанное гетероциклическое кольцо также может быть замещено одним или несколькими заместителями, независимо выбранными из H, OH, F, Cl, Br, I, CN, NO2, оксо, C1-C6алкила, C1-C6галогеналкила, C1-C6гидроксиалкила, C3-C6циклоалкила, C3-C6галогенциклоалкила, C3-C6гидроксициклоалкила, C3-C6циклоалкокси, C3-C6галогенциклоалкокси, C3-C6гидроксициклоалкокси, C1-C6алкокси, C1-C6галогеналкокси, C2-C6алкенила, C2-C6алкинила, S(=O)n(C1-C6алкил), S(=O)n(C1-C6галогеналкил), OSO2(C1-C6алкил), OSO2(C1-C6галогеналкил), C(=O)H, C(=O)OH, C(=O)NRxRy, (C1-C6алкил)NRxRy, C(=O)(C1-C6алкил), C(=O)O(C1-C6алкил), C(=O)(C1-C6галогеналкил), C(=O)O(C1-C6галогеналкил), C(=O)(C3-C6циклоалкил), C(=O)O(C3-C6циклоалкил), C(=O)(C2-C6алкенил), C(=O)O(C2-C6алкенил), (C1-C6алкил)O(C1-C6алкил), (C1-C6алкил)S(C1-C6алкил), C(=O)(C1-C6алкил)C(=O)O(C1-C6алкил), фенила, фенокси, замещенного фенила и замещенного фенокси (где такие замещенный фенил и замещенный фенокси содержат один или несколько заместителей, которые независимо выбраны из H, OH, F, Cl, Br, I, CN, NO2, C1-C6алкила, C1-C6галогеналкила, C1-C6гидроксиалкила, C3-C6циклоалкила, C3-C6галогенциклоалкила, C3-C6гидроксициклоалкила, C3-C6циклоалкокси, C3-C6галогенциклоалкокси, C3-C6гидроксициклоалкокси, C1-C6алкокси, C1-C6галогеналкокси, C2-C6алкенила, C2-C6алкинила, S(=O)n(C1-C6алкил), S(=O)n(C1-C6галогеналкил), OSO2(C1-C6алкил), OSO2(C1-C6галогеналкил), C(=O)H, C(=O)OH, C(=O)NRxRy, (C1-C6алкил)NRxRy, C(=O)(C1-C6алкил), C(=O)O(C1-C6алкил), C(=O)(C1-C6галогеналкил), C(=O)O(C1-C6галогеналкил), C(=O)(C3-C6циклоалкил), C(=O)O(C3-C6циклоалкил), C(=O)(C2-C6алкенил), C(=O)O(C2-C6алкенил), (C1-C6алкил)O(C1-C6алкил), (C1-C6алкил)S(C1-C6алкил), C(=O)(C1-C6алкил)C(=O)O(C1-C6алкил), фенила и фенокси);
(c) Ar2 представляет собой
(1) фуранил, фенил, пиридазинил, пиридил, пиримидинил, тиенил или
(2) замещенный фуранил, замещенный фенил, замещенный пиридазинил, замещенный пиридил, замещенный пиримидинил или замещенный тиенил, где указанные замещенный фуранил, замещенный фенил, замещенный пиридазинил, замещенный пиридил, замещенный пиримидинил и замещенный тиенил содержат один или несколько заместителей, которые независимо выбраны из H, OH, F, Cl, Br, I, CN, NO2, C1-C6алкила, C1-C6галогеналкила, C1-C6гидроксиалкила, C3-C6циклоалкила, C3-C6галогенциклоалкила, C3-C6гидроксициклоалкила, C3-C6циклоалкокси, C3-C6галогенциклоалкокси, C3-C6гидроксициклоалкокси, C1-C6алкокси, C1-C6галогеналкокси, C2-C6алкенила, C2-C6алкинила, S(=O)n(C1-C6алкил), S(=O)n(C1-C6галогеналкил), OSO2(C1-C6алкил), OSO2(C1-C6галогеналкил), C(=O)H, C(=O)OH, C(=O)NRxRy, (C1-C6алкил)NRxRy, C(=O)(C1-C6алкил), C(=O)O(C1-C6алкил), C(=O)(C1-C6галогеналкил), C(=O)O(C1-C6галогеналкил), C(=O)(C3-C6циклоалкил), C(=O)O(C3-C6циклоалкил), C(=O)(C2-C6алкенил), C(=O)O(C2-C6алкенил), (C1-C6алкил)O(C1-C6алкил), (C1-C6алкил)S(C1-C6алкил), C(=O)(C1-C6алкил)C(=O)O(C1-C6алкил), фенила, фенокси, замещенного фенила и замещенного фенокси (где такие замещенный фенил и замещенный фенокси содержат один или несколько заместителей, которые независимо выбраны из H, OH, F, Cl, Br, I, CN, NO2, C1-C6алкила, C1-C6галогеналкила, C1-C6гидроксиалкила, C3-C6циклоалкила, C3-C6галогенциклоалкила, C3-C6гидроксициклоалкила, C3-C6циклоалкокси, C3-C6галогенциклоалкокси, C3-C6гидроксициклоалкокси, C1-C6алкокси, C1-C6галогеналкокси, C2-C6алкенила, C2-C6алкинила, S(=O)n(C1-C6алкил), S(=O)n(C1-C6галогеналкил), OSO2(C1-C6алкил), OSO2(C1-C6галогеналкил), C(=O)H, C(=O)OH, C(=O)NRxRy, (C1-C6алкил)NRxRy, C(=O)(C1-C6алкил), C(=O)O(C1-C6алкил), C(=O)(C1-C6галогеналкил), C(=O)O(C1-C6галогеналкил), C(=O)(C3-C6циклоалкил), C(=O)O(C3-C6циклоалкил), C(=O)(C1-C6галогеналкил), C(=O)(C2-C6алкенил), C(=O)O(C2-C6алкенил), (C1-C6алкил)O(C1-C6алкил), (C1-C6алкил)S(C1-C6алкил), C(=O)(C1-C6алкил)C(=O)O(C1-C6алкил), фенила и фенокси);
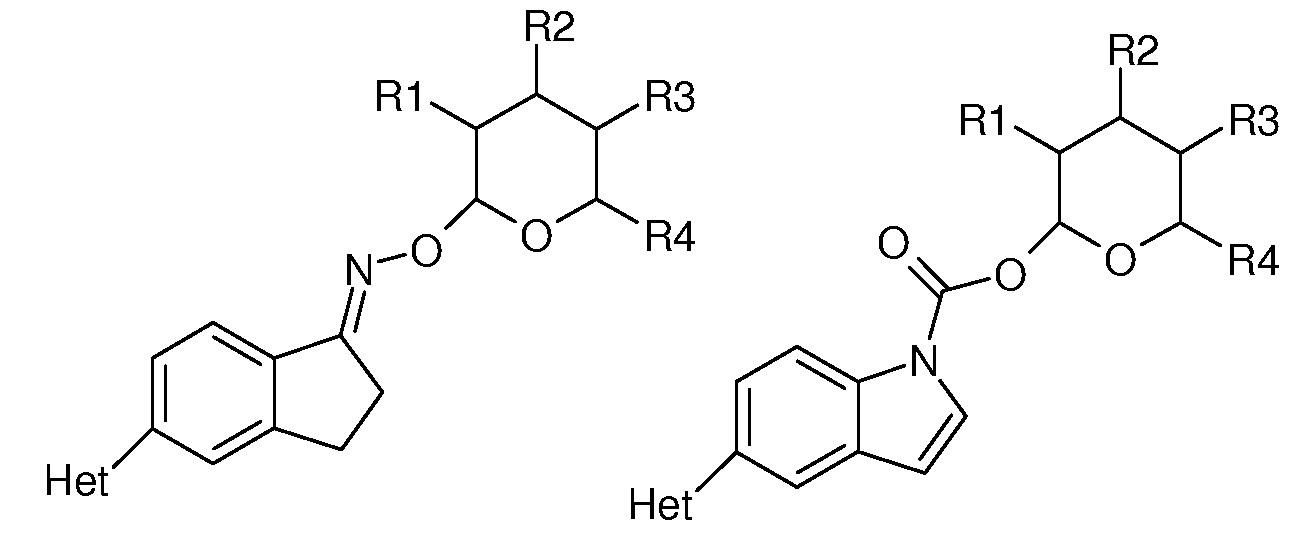
(d) J представляет собой O, N, NR5, CR5, C=O, или J и Ar2 образуют 3-, 4-, 5- или 6-членное кольцо, такое как индан или индол, как представлено, например, в следующих структурах:
(e) L представляет собой одинарную или двойную связь;
(f) K представляет собой CR5, C=O, N, NR5 или C=S;
(g) Q представляет собой O или S;
(h) R1 представляет собой H, OH, F, Cl, Br, I, оксо, C1-C6алкил, C1-C6галогеналкил, C1-C6алкокси, C3-C6циклоалкокси, C1-C6галогеналкокси, C2-C6алкенилокси, (C1-C6алкил)O(C1-C6алкил), (C1-C6алкил)O(C1-C6алкокси), OC(=O)(C1-C6алкил), OC(=O)(C3-C6циклоалкил), OC(=O)(C1-C6галогеналкил), OC(=O)(C2-C6алкенил) или NRxRy;
(i) R2 представляет собой H, OH, F, Cl, Br, I, оксо, C1-C6алкил, C1-C6галогеналкил, C1-C6алкокси, C3-C6циклоалкокси, C1-C6галогеналкокси, C2-C6алкенилокси, (C1-C6алкил)O(C1-C6алкил), (C1-C6алкил)O(C1-C6алкокси), OC(=O)(C1-C6алкил), OC(=O)(C3-C6циклоалкил), OC(=O)(C1-C6галогеналкил), OC(=O)(C2-C6алкенил) или NRxRy;
(j) R3 представляет собой H, OH, F, Cl, Br, I, оксо, C1-C6алкил, C1-C6галогеналкил, C1-C6алкокси, C3-C6циклоалкокси, C1-C6галогеналкокси, C2-C6алкенилокси, (C1-C6алкил)O(C1-C6алкил), (C1-C6алкил)O(C1-C6алкокси), OC(=O)(C1-C6алкил), OC(=O)(C3-C6циклоалкил), OC(=O)(C1-C6галогеналкил), OC(=O)(C2-C6алкенил) или NRxRy;
(k) R4 представляет собой H, C1-C6алкил, C1-C6галогеналкил, C1-C6алкокси, C1-C6галогеналкокси, C2-C6алкенилокси, (C1-C6алкил)O(C1-C6алкил); и
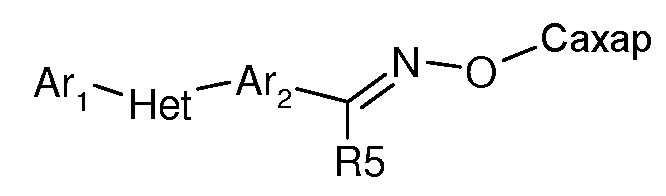
(l) R5 представляет собой H, OH, F, Cl, Br, I, CN, NO2, C1-C6алкил, C1-C6галогеналкил, C1-C6гидроксиалкил, C3-C6циклоалкил, C3-C6галогенциклоалкил, C3-C6гидроксициклоалкил, C3-C6циклоалкокси, C3-C6галогенциклоалкокси, C3-C6гидроксициклоалкокси, C1-C6алкокси, C1-C6галогеналкокси, C2-C6алкенил, C2-C6алкинил, S(=O)n(C1-C6алкил), S(=O)n(C1-C6галогеналкил), OSO2(C1-C6алкил), OSO2(C1-C6галогеналкил), C(=O)H, C(=O)OH, C(=O)NRxRy, (C1-C6алкил)NRxRy, C(=O)(C1-C6алкил), C(=O)O(C1-C6алкил), C(=O)(C1-C6галогеналкил), C(=O)O(C1-C6галогеналкил), C(=O)(C3-C6циклоалкил), C(=O)O(C3-C6циклоалкил), C(=O)(C2-C6алкенил), C(=O)O(C2-C6алкенил), (C1-C6алкил)O(C1-C6алкил), (C1-C6алкил)S(C1-C6алкил), C(=O)(C1-C6алкил)C(=O)O(C1-C6алкил), фенил, фенокси,
где каждый алкил, галогеналкил, гидроксиалкил, циклоалкил, галогенциклоалкил, гидроксициклоалкил, циклоалкокси, галогенциклоалкокси, гидроксициклоалкокси, алкокси, галогеналкокси, алкенил, алкинил, фенил и фенокси необязательно замещены одним или несколькими заместителями, независимо выбранными из OH, F, Cl, Br, I, CN, NO2, оксо, C1-C6алкила, C1-C6галогеналкила, C1-C6гидроксиалкила, C3-C6циклоалкила, C3-C6галогенциклоалкила, C3-C6гидроксициклоалкила, C3-C6циклоалкокси, C3-C6галогенциклоалкокси, C3-C6гидроксициклоалкокси, C1-C6алкокси, C1-C6галогеналкокси, C2-C6алкенила, C2-C6алкинила, S(=O)n(C1-C6алкил), S(=O)n(C1-C6галогеналкил), OSO2(C1-C6алкил), OSO2(C1-C6галогеналкил), C(=O)H, C(=O)OH, C(=O)NRxRy, (C1-C6алкил)NRxRy, C(=O)(C1-C6алкил), C(=O)O(C1-C6алкил), C(=O)(C1-C6галогеналкил), C(=O)O(C1-C6галогеналкил), C(=O)(C3-C6циклоалкил), C(=O)O(C3-C6циклоалкил), C(=O)(C2-C6алкенил), C(=O)O(C2-C6алкенил), (C1-C6алкил)O(C1-C6алкил), (C1-C6алкил)S(C1-C6алкил), C(=O)(C1-C6алкил)C(=O)O(C1-C6алкил), фенила и фенокси;
(m) n = 0, 1 или 2;
(n) Rx и Ry независимо выбраны из H, C1-C6алкила, C1-C6галогеналкила, C1-C6гидроксиалкила, C3-C6циклоалкила, C3-C6галогенциклоалкила, C3-C6гидроксициклоалкила, C3-C6циклоалкокси, C3-C6галогенциклоалкокси, C3-C6гидроксициклоалкокси, C1-C6алкокси, C1-C6галогеналкокси, C2-C6алкенила, C2-C6алкинила, S(=O)n(C1-C6алкил), S(=O)n(C1-C6галогеналкил), OSO2(C1-C6алкил), OSO2(C1-C6галогеналкил), C(=O)H, C(=O)OH, C(=O)(C1-C6алкил), C(=O)O(C1-C6алкил), C(=O)(C1-C6галогеналкил), C(=O)O(C1-C6галогеналкил), C(=O)(C3-C6циклоалкил), C(=O)O(C3-C6циклоалкил), C(=O)(C2-C6алкенил), C(=O)O(C2-C6алкенил), (C1-C6алкил)O(C1-C6алкил), (C1-C6алкил)S(C1-C6алкил), C(=O)(C1-C6алкил)C(=O)O(C1-C6алкил), фенила и фенокси.
В другом варианте осуществления данного изобретения:
(a) Ar1 представляет собой фенил, пиридазинил, пиридил, тиенил, замещенный фенил, замещенный пиридазинил, замещенный пиридил или замещенный тиенил, где указанные замещенный фенил, замещенный пиридазинил, замещенный пиридил и замещенный тиенил содержат один или несколько заместителей, которые независимо выбраны из F, Cl, Br, I, CN, NO2, C1-C6алкила, C1-C6галогеналкила, C1-C6гидроксиалкила, C1-C6галогеналкокси, C2-C6алкенила, S(=O)n(C1-C6алкил), S(=O)n(C1-C6галогеналкил), OSO2(C1-C6галогеналкил), C(=O)(C1-C6алкил), (C1-C6алкил)S(C1-C6алкил) и фенокси (где такой замещенный фенокси имеет один или несколько заместителей, которые независимо выбраны из F, Cl, Br или I).
В другом варианте осуществления изобретения:
(a) Ar1 представляет собой замещенный фенил или замещенный пиридил, где указанные замещенный фенил и замещенный пиридил содержат один или несколько заместителей, которые независимо выбраны из F, Cl, Br, I, CN, NO2, C1-C6алкила, C1-C6галогеналкила, C1-C6гидроксиалкила, C1-C6галогеналкокси, C2-C6алкенила, S(=O)n(C1-C6алкил), S(=O)n(C1-C6галогеналкил), OSO2(C1-C6галогеналкил), C(=O)(C1-C6алкил), (C1-C6алкил)S(C1-C6алкил) и фенокси (где такой замещенный фенокси имеет один или несколько заместителей, которые независимо выбраны из F, Cl, Br или I).
В другом варианте осуществления изобретения:
(a) Ar1 представляет собой замещенный фенил, где указанный замещенный фенил имеет один или несколько заместителей, которые независимо выбраны из F, Cl, Br, I, C1-C6алкила, C1-C6галогеналкила и C1-C6галогеналкокси.
В другом варианте осуществления изобретения:
(b) Het представляет собой имидазолил, изотиазолил, изоксазолил, 1,2,4-оксадиазолил, 1,3,4-оксадиазолил, оксазолинил, оксазолил, пиперазинил, пиперидинил, пиразинил, пиразолинил, пиразолил, пиридазинил, пиридил, пиримидинил, пирролил, 1,2,3,4-тетразолил, тиадиазолил, тиазолинил, тиазолил, 1,2,3-триазинил, 1,2,4-триазинил, 1,3,5-триазинил, 1,2,3-триазолил, 1,2,4-триазолил, замещенный имидазолил, замещенный изотиазолил, замещенный изоксазолил, замещенный 1,2,4-оксадиазолил, замещенный 1,3,4-оксадиазолил, замещенный оксазолинил, замещенный оксазолил, замещенный пиперазинил, замещенный пиперидинил, замещенный пиразинил, замещенный пиразолинил, замещенный пиразолил, замещенный пиридазинил, замещенный пиридил, замещенный пиримидинил, замещенный пирролил, замещенный тетразолил, замещенный тиадиазолил, замещенный тиазолинил, замещенный тиазолил, замещенный 1,2,3-триазинил, замещенный 1,2,4-триазинил, замещенный 1,3,5-триазинил, замещенный 1,2,3-триазолил и замещенный 1,2,4-триазолил, где указанные замещенные группы содержат один или несколько заместителей, которые независимо выбраны из H, OH, F, Cl, Br, I, CN, NO2, оксо, C1-C6алкила, C1-C6галогеналкила, C1-C6гидроксиалкила, C3-C6циклоалкила, C3-C6галогенциклоалкила, C3-C6гидроксициклоалкила, C3-C6циклоалкокси, C3-C6галогенциклоалкокси, C3-C6гидроксициклоалкокси, C1-C6алкокси, C1-C6галогеналкокси, C2-C6алкенила, C2-C6алкинила, S(=O)n(C1-C6алкил), S(=O)n(C1-C6галогеналкил), OSO2(C1-C6алкил), OSO2(C1-C6галогеналкил), C(=O)H, C(=O)OH, C(=O)NRxRy, (C1-C6алкил)NRxRy, C(=O)(C1-C6алкил), C(=O)O(C1-C6алкил), C(=O)(C1-C6галогеналкил), C(=O)(C3-C6циклоалкил), C(=O)O(C3-C6циклоалкил), C(=O)(C1-C6галогеналкил), C(=O)(C2-C6алкенил), C(=O)O(C2-C6алкенил), (C1-C6алкил)O(C1-C6алкил), (C1-C6алкил)S(C2-C6алкил), C(=O)(C1-C6алкил)C(=O)O(C1-C6алкил) фенила, фенокси, замещенного фенила и замещенного фенокси (где такие замещенный фенил и замещенный фенокси содержат один или несколько заместителей, которые независимо выбраны из H, OH, F, Cl, Br, I, CN, NO2, оксо, C1-C6алкила, C1-C6галогеналкила, C1-C6гидроксиалкила, C3-C6циклоалкила, C3-C6галогенциклоалкила, C3-C6гидроксициклоалкила, C3-C6циклоалкокси, C3-C6галогенциклоалкокси, C3-C6гидроксициклоалкокси, C1-C6алкокси, C1-C6галогеналкокси, C2-C6алкенила, C2-C6алкинила, S(=O)n(C1-C6алкил), S(=O)n(C1-C6галогеналкил), OSO2(C1-C6алкил), OSO2(C1-C6галогеналкил), C(=O)H, C(=O)OH, C(=O)NRxRy, (C1-C6алкил)NRxRy, C(=O)(C1-C6алкил), C(=O)O(C1-C6алкил), C(=O)(C1-C6галогеналкил), C(=O)(C3-C6циклоалкил), C(=O)O(C3-C6циклоалкил), C(=O)(C1-C6галогеналкил), C(=O)(C2-C6алкенил), C(=O)O(C2-C6алкенил), (C1-C6алкил)O(C1-C6алкил), (C1-C6алкил)S(C1-C6алкил), C(=O)(C1-C6алкил)C(=O)O(C1-C6алкил) фенила и фенокси).
В другом варианте осуществления данного изобретения:
(b) Het представляет собой имидазолил, изоксазолил, 1,2,4-оксадиазолил, 1,3,4-оксадиазолил, оксазолил, пиперазинил, пиразинил, пиразолил, пиридазинил, пиридил, пиримидинил, пирролил, 1,2,3,4-тетразолил, тиадиазолил, тиазолил, 1,2,4-триазинил, 1,3,5-триазинил, 1,2,3-триазолил, 1,2,4-триазолил, замещенный имидазолил, замещенный 1,3,4-оксадиазолил, замещенный пиперазинил, замещенный пиразолил, замещенный пиримидинил и замещенный 1,2,4-триазолил, где указанные замещенные группы содержат один или несколько заместителей, которые независимо выбраны из F, Cl, Br, I, CN, NO2, оксо, C1-C6алкила, C1-C6галогеналкила, C1-C6гидроксиалкила, C1-C6алкокси, C1-C6галогеналкокси, C2-C6алкенила, S(=O)n(C1-C6алкил), S(=O)n(C1-C6галогеналкил), OSO2(C1-C6галогеналкил), C(=O)O(C1-C6алкил) и (C1-C6алкил)S(C1-C6алкил),
В другом варианте осуществления данного изобретения:
(b) Het представляет собой имидазолил, изоксазолил, 1,2,4-оксадиазолил, пиразинил, пиримидинил, тиазолил, 1,3,5-триазинил, 1,2,4-триазолил, замещенный имидазолил, замещенный пиразолил и замещенный 1,2,4-триазолил, где указанные замещенные группы содержат один или несколько заместителей, которые независимо выбраны из оксо, C1-C6алкила, C1-C6галогеналкила, C2-C6алкенила и C(=O)O(C1-C6алкил).
В другом варианте осуществления данного изобретения:
(c) Ar2 представляет собой фенил, пиридазинил, пиридил, тиенил, замещенный фенил, замещенный пиридазинил, замещенный пиридил или замещенный тиенил, где указанные замещенный фенил, замещенный пиридазинил, замещенный пиридил и замещенный тиенил содержат один или несколько заместителей, которые независимо выбраны из F, Cl, Br, I, CN, NO2, C1-C6алкила, C1-C6галогеналкила, C1-C6гидроксиалкила, C1-C6галогеналкокси, C2-C6алкенила, S(=O)n(C1-C6алкил), S(=O)n(C1-C6галогеналкил), OSO2(C1-C6галогеналкил), C(=O)(C1-C6алкил), (C1-C6алкил)S(C1-C6алкил) и фенокси (где такой замещенный фенокси имеет один или несколько заместителей, которые независимо выбраны из F, Cl, Br или I).
В другом варианте осуществления изобретения:
(c) Ar2 представляет собой замещенный фенил или замещенный пиридил, где указанные замещенный фенил и замещенный пиридил, содержат один или несколько заместителей, которые независимо выбраны из F, Cl, Br, I, CN, NO2, C1-C6алкила, C1-C6галогеналкила, C1-C6гидроксиалкила, C1-C6галогеналкокси, C2-C6алкенила, S(=O)n(C1-C6алкил), S(=O)n(C1-C6галогеналкил), OSO2(C1-C6галогеналкил), C(=O)(C1-C6алкил), (C1-C6алкил)S(C1-C6алкил) и фенокси (где такой замещенный фенокси имеет один или несколько заместителей, которые независимо выбраны из F, Cl, Br или I).
В другом варианте осуществления изобретения:
(c) Ar2 представляет собой замещенный фенил, где указанный замещенный фенил имеет один или несколько заместителей, которые независимо выбраны из F, Cl, Br, I, C1-C6алкила, C1-C6галогеналкила и C1-C6алкокси.
В другом варианте осуществления данного изобретения:
(d) J представляет собой NR5, CR5 или C=O.
В другом варианте осуществления данного изобретения:
(f) K представляет собой C=O, N, NR5 или C=S.
В другом варианте осуществления данного изобретения:
(h) R1 представляет собой H или C1-C6алкокси.
В другом варианте осуществления данного изобретения:
(i) R2 представляет собой H, C1-C6алкокси или C2-C6алкенилокси.
В другом варианте осуществления данного изобретения:
(j) R3 представляет собой C1-C6алкокси.
В другом варианте осуществления данного изобретения:
(k) R4 представляет собой H, C1-C6алкил, C1-C6алкокси или (C1-C6алкил)O(C1-C6алкил).
В другом варианте осуществления данного изобретения:
(l) R5 представляет собой H, C1-C6алкил, C1-C6галогеналкил, C1-C6гидроксиалкил, C2-C6алкенил, C(=O)(C1-C6алкил), (C1-C6алкил)O(C1-C6алкил) и C(=O)(C1-C6алкил)C(=O)O(C1-C6алкил).
В другом варианте осуществления данного изобретения:
(l) R5 представляет собой H, C1-C6алкил, C1-C6алкокси или C1-C6галогеналкил.
В другом варианте осуществления изобретения:
(a) Ar1 представляет собой фенил, пиридил, тиенил, замещенный фенил, замещенный пиридазинил или замещенный пиридил,
где указанный замещенный фенил имеет один или несколько заместителей, которые независимо выбраны из F, Cl, Br, I, CN, CH3, C3H7, C4H9, OCH3, OC4H9, CF3, C2F5, C3F7, OCF3, OC2F5, OCH2CF3, OCF2CHF2, SCF3, SCH3, S(=O)CF3, S(=O)2CF3, OPhCl и C(OH)C2H5;
где указанный замещенный пиридазинил имеет один или несколько Cl,
где указанный замещенный пиридил имеет один или несколько заместителей, которые независимо выбраны из F, Cl, I, CF3, OCF3, OCF2CHFCF3 и OCH2CF3.
В другом варианте осуществления данного изобретения:
(b) Het представляет собой имидазолил, изоксазолил, 1,3,4-оксадиазолил, пиразинил, пиразолинил, пиразолил, пиридил, пиримидинил, пирролил, 1,2,3,4-тетразолил, тиазолил, 1,3,5-триазинил, 1,2,3-триазолил, 1,2,4-триазолил, замещенный пиразолинил, замещенный пиримидинил или замещенный 1,2,4-триазолил,
где указанный замещенный пиразолил имеет один или несколько заместителей, которые независимо выбраны из H, CH3, C3H7, C(=O)OCH3, C(=O)OC2H5 и C(=O)OC4H9,
где указанный замещенный пиримидинил имеет один или несколько заместителей, которые независимо выбраны из CF3 и C3F7,
где указанный замещенный 1,2,4-триазолил имеет один или несколько заместителей, которые выбраны из CH3 и оксо.
В другом варианте осуществления данного изобретения:
(c) Ar2 представляет собой фенил, тиенил или замещенный фенил,
где указанный замещенный фенил имеет один или несколько заместителей, которые независимо выбраны из F, Cl, OCH3 и CF3.
В другом варианте осуществления данного изобретения:
(d) J представляет собой NH, CH, CCH3 или C=O.
В другом варианте осуществления данного изобретения:
(h) R1 представляет собой OCH3 или OC2H5.
В другом варианте осуществления данного изобретения:
(i) R2 представляет собой OCH2CH=CH2, OCH3, OC2H5, OC3H7 или OC4H9.
В другом варианте осуществления данного изобретения:
(j) R3 представляет собой OH, OCH3, OC2H5 или OC3H7.
В другом варианте осуществления данного изобретения:
(k) R4 представляет собой CH3 или CH2OCH3.
В другом варианте осуществления данного изобретения:
(a) Ar1 представляет собой фуранил, фенил, пиридазинил, пиридил, пиримидинил, тиенил, замещенный фуранил, замещенный фенил, замещенный пиридазинил, замещенный пиридил, замещенный пиримидинил или замещенный тиенил, где указанные замещенный фуранил, замещенный фенил, замещенный пиридазинил, замещенный пиридил, замещенный пиримидинил и замещенный тиенил содержат один или несколько заместителей, которые независимо выбраны из H, F, Cl, Br, I, CN, NO2, оксо, C1-C6алкила, C2-C6алкенила, C2-C6алкинила, C1-C6алкокси, C1-C6галогеналкила, C1-C6галогеналкокси, S(=O)nC1-C6алкила, S(=O)nC1-C6галогеналкила, OSO2C1-C6галогеналкила, C(=O)OC1-C6алкила, C(=O)C1-C6алкила, C(=O)C1-C6галогеналкила, фенила, фенокси, галогенфенокси и C1-C6гидроксиалкила;
(b) Het представляет собой 5- или 6-членное насыщенное или ненасыщенное гетероциклическое кольцо, содержащее один или несколько гетероатомов, которые независимо выбраны из азота, серы или кислорода, и где Ar1 и Ar2 не находятся в орто-положении относительно друг друга (но могут находиться в мета- или пара-положении, например, для пятичленного кольца - это 1,3-положения, и для 6-членного кольца - это либо 1,3-, либо 1,4-положения, соответственно), и где указанное гетероциклическое кольцо также может быть замещено одним или несколькими заместителями, независимо выбранными из H, F, Cl, Br, I, CN, NO2, оксо, C1-C6алкила, C2-C6алкенила, C2-C6алкинила, C1-C6алкокси, C1-C6галогеналкила, C1-C6галогеналкокси, S(=O)nC1-C6алкила, S(=O)nC1-C6галогеналкила, OSO2C1-C6галогеналкила, C(=O)OC1-C6алкила, C(=O)C1-C6алкила, C(=O)C1-C6галогеналкила, фенила, фенокси, галогенфенокси и C1-C6гидроксиалкила;
(c) Ar2 представляет собой фуранил, фенил, пиридазинил, пиридил, пиримидинил, тиенил, замещенный фуранил, замещенный фенил, замещенный пиридазинил, замещенный пиридил, замещенный пиримидинил или замещенный тиенил, где указанные замещенный фуранил, замещенный фенил, замещенный пиридазинил, замещенный пиридил, замещенный пиримидинил и замещенный тиенил содержат один или несколько заместителей, которые независимо выбраны из H, F, Cl, Br, I, CN, NO2, оксо, C1-C6алкила, C2-C6алкенила, C2-C6алкинила, C1-C6алкокси, C1-C6галогеналкила, C1-C6галогеналкокси, S(=O)nC1-C6алкила, S(=O)nC1-C6галогеналкила, OSO2C1-C6галогеналкила, C(=O)OC1-C6алкила, C(=O)C1-C6алкила, C(=O)C1-C6галогеналкила, фенила, фенокси, галогенфенокси и C1-C6гидроксиалкила;
(d) J представляет собой O, N, NR5, CR5 или C=O;
(e) L представляет собой одинарную или двойную связь;
(f) K представляет собой CR5, C=O, N, NR5 или C=S;
(g) Q представляет собой O или S;
(h) R1 представляет собой C1-C6алкил, C1-C6алкил-O-C1-C6алкил, C1-C6галогеналкил, галоген, оксо, C1-C6галогеналкокси, C1-C6алкил-O-C1-C6алкокси, H, OH, C1-C6алкокси, C2-C6алкенилокси;
(i) R2 представляет собой C1-C6алкил, C1-C6алкил-O-C1-C6алкил, C1-C6галогеналкил, галоген, оксо, C1-C6галогеналкокси, C1-C6алкил-O-C1-C6алкокси, H, OH, C1-C6алкокси, C2-C6алкенилокси;
(j) R3 представляет собой C1-C6алкил, C1-C6алкил-O-C1-C6алкил, C1-C6галогеналкил, галоген, оксо, C1-C6галогеналкокси, C1-C6алкил-O-C1-C6алкокси, H, OH, C1-C6алкокси, C2-C6алкенилокси;
(k) R4 представляет собой C1-C6алкил, C1-C6алкил-O-C1-C6алкил, C1-C6галогеналкил, H, C1-C6алкокси, C1-C6галогеналкокси, C2-C6алкенилокси;
(l) R5 представляет собой H или C1-C6алкил; и
(m) n = 0, 1 или 2.
Несмотря на то, что представлены эти варианты осуществления изобретения, возможны и другие варианты осуществления и сочетания данных представленных вариантов осуществления и других вариантов осуществления.
ПОЛУЧЕНИЕ ПИРАНОЗА-ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ
Для получения соединений по настоящему изобретению может быть использовано широкое разнообразие пираноз (в виде различных структурных форм, например, D и L). Например, могут быть использованы следующий не-исчерпывающий перечень пираноз: рибоза, арабиноза, ксилоза, ликсоза, рубилоза, ксилулоза, аллоза, альтроза, глюкоза, манноза, гулоза, идоза, галактоза, талоза, псикоза, фруктоза, сорбоза, тагатоза, фукоза, микароза, хиновоза, олеандроза, рамноза и паратоза. В большинстве примеров, представленных ниже, для получения пираноза-промежуточных соединений использовали L-рамнозу.
Обычно, пираноза-промежуточные соединения могут быть получены следующим образом (используя L-рамнозу в качестве примера). O-алкилированные производные рамнозы могут быть получены исходя из коммерчески доступных L-рамнозы или гидрата L-рамнозы используя алкилиодид и порошкообразный гидроксид калия в сухом диметилсульфоксиде (ДМСО) при температуре от 5°C до 15°C. Полностью алкилированный продукт затем выделяли с помощью экстракции диметилсульфоксидного раствора гексаном, затем концентрированием гексанового слоя в вакууме. Этот промежуточный продукт - алкилпиранозид затем обрабатывали напрямую водной HCl или другой водной кислотой, которая образует свободный гидрокси сахар, обычно в виде смеси α- и β-аномеров.
Альтернативно, пер-алкилированная L-рамноза может быть выделена гидролизом спиносада (spinosad) или другого три-(O-алкил)рамнозилированного природного продукта, используя условия, подобные тем, которые описаны для выделения метилолеандрозида из авермектина B2 (Loewe et al. J. Org. Chem. 1994, 59, 7870). Таким образом, обработка технического спиносада избытком концентрированной серной кислоты в сухом метаноле (MeOH) приводит к гидролизу сахара рамнозы и преобразованию в метилпиранозид. Чистый метилпиранозид затем может быть удален из реакционной среды исчерпывающей экстракцией гексаном или другим углеводородным растворителем. Чистый рамнопиранозид затем может быть выделен с общим выходом прибл. 65-75% с помощью перегонки сырой вязкой жидкости в вакууме.
3-O-Этил-2,4-ди-O-метил рамноза может быть получена тем же способом, исходя из спинеторама. Другие алкилированные производные могут быть получены подобным образом исходя из производных спинозоидов с соответствующими функциональными группами, которые получены из какого-либо представителя спиносина (спиносин), которое имеет одну или несколько свободных гидроксильных групп, присоединенных к рамнозе (например, спиносин J), используя условия, описанные в документе DeAmicis et al. U.S. Patent 6001981, 1999.
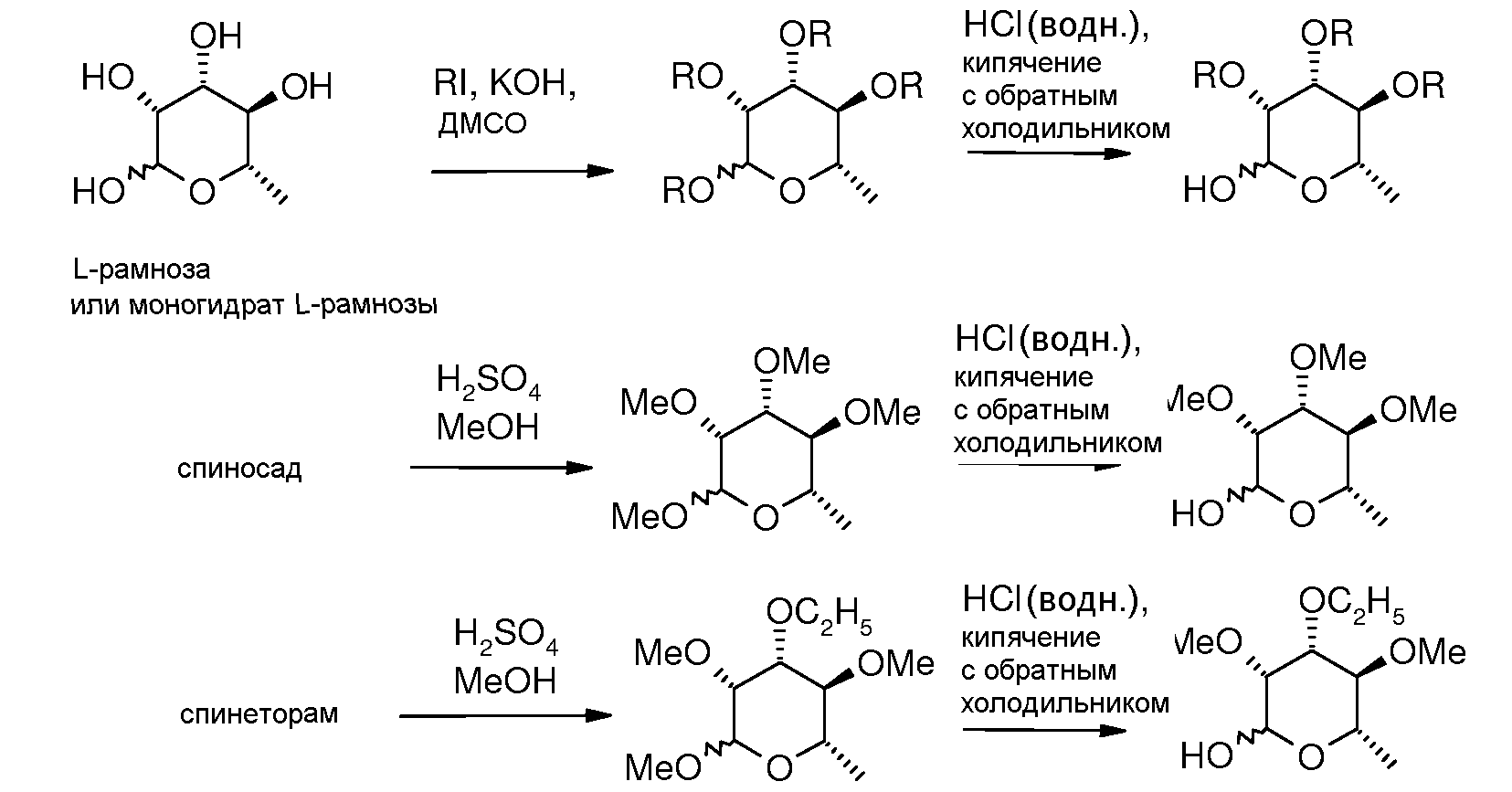
Предшественник рамноза, который селективно алкилирован более объемным заместителем у C3, был описан (смотри, например, Pozsgay et al. Can. J. Chem. 1987, 65, 2764). Альтернативный путь, который позволяет использовать реагенты на основе олова, описан ниже. Взаимодействие метилпиранозида L-рамнозы с одним эквивалентом фенилбороновой кислоты или трифенилбороксола в условиях, которые позволяют удалять воду, приводят к образованию боронацеталя. Обработка данного ацеталя алкилгалогенидом и оксидом серебра в полярном апротонном растворителе, таком как диметилформамид, при температуре от 0°C до 110°C приводит к селективному алкилированию на C3-OH, давая 3-O-алкилметилпиранозид. Данный продукт затем может быть далее метилирован в положениях 2-OH и 4-OH с помощью метилиодида, используя условия, описанные ранее. Полностью алкилированная рамноза затем может быть гидролизована как описано выше с получением 2,4-ди-O-метил-3-O-алкил-L-рамнозы.
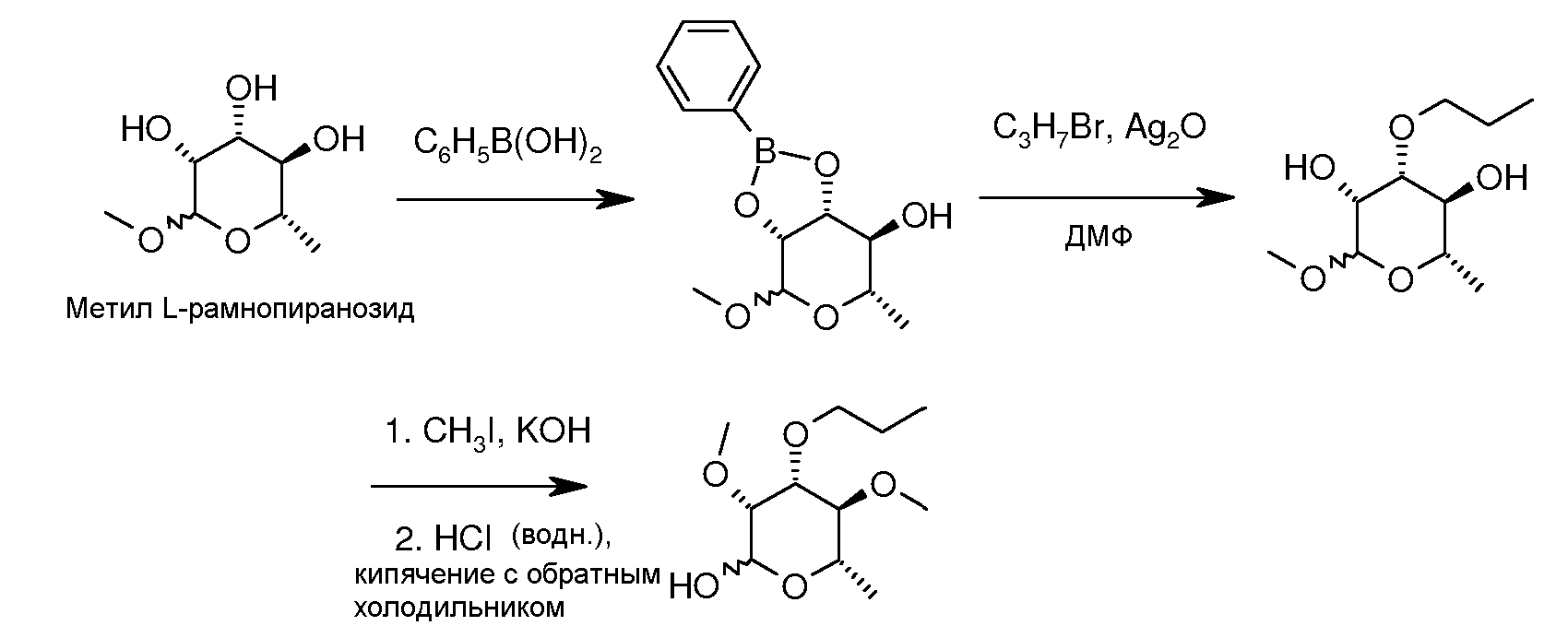
Иллюстрация способов получения таких пираноза-промежуточных соединений дана в примерах.
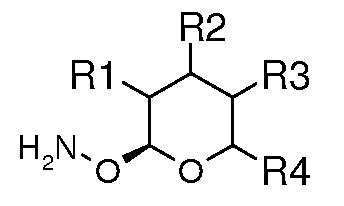
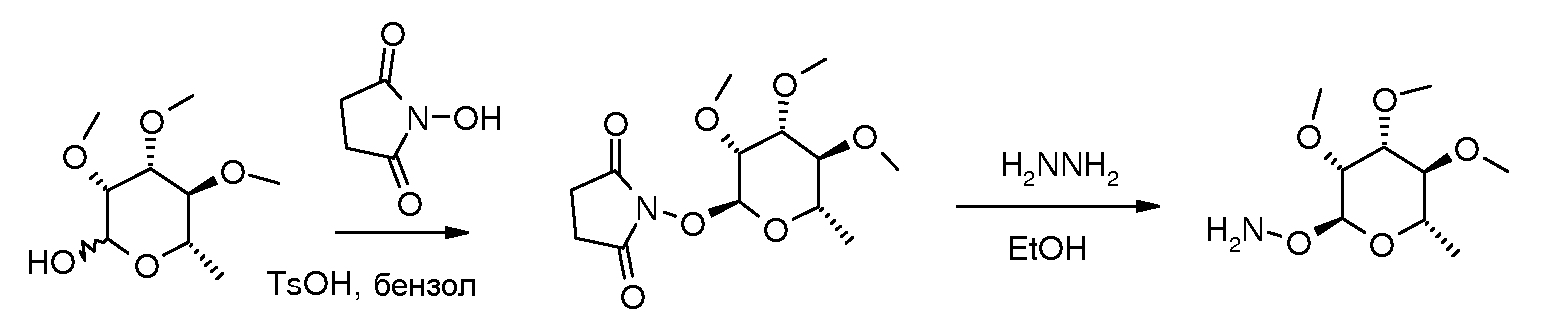
Также могут быть получены гидроксиламино пираноза-промежуточные соединения. Например, они могут быть получены исходя из соответствующего производного рамнозы и N-гидроксисукцинимида (NHS) в условиях, при которых образующаяся вода удаляется азеотропно, давая аддукт N-сукцинимидоил гидроксиламин. В одном варианте осуществления, эти условия включают объединение рамнозы и NHS в толуоле или бензоле, добавление каталитического количества кислоты, такой как п-толуолсульфоновая кислота (TsOH), и нагревание при кипячении с обратным холодильником в аппарате, снабженном устройством Дина-Старка. Преобразование в свободный гидроксиламиновый промежуточный продукт осуществляют путем обработки сукцинимидоильного аддукта избытком гидразингидрата или безводным гидразином в спиртовом растворителе, таком как метанол (MeOH) или этанол (EtOH). Взаимодействие O-рамнозил гидроксиламина с альдегидом или кетоном, используя EtOH или другой растворитель на основе низшего спирта при температуре от комнатной до кипячения с обратным холодильником, приводит к получению O-рамнозил оксима.
ПОЛУЧЕНИЕ ТРИАРИЛПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ
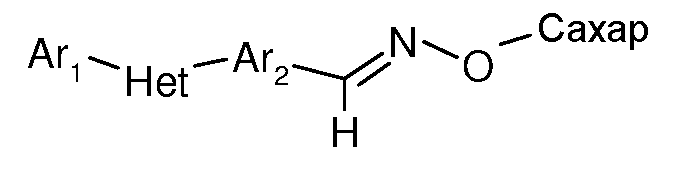
Соединения по данному изобретению получают связыванием вышеописанных пираноз с триарилпромежуточным продуктом, Ar1-Het-Ar2, посредством ковалентного линкера J[L]KQ (описанного выше). Для получения соединений по данному изобретению может быть использовано широкое многообразие триариловых предшественников, при условии, что они содержат подходящую функциональную группу на Ar2, к которой может быть присоединен промежуточный продукт пиранозы для образования ковалентного линкера. Подходящие функциональные группы включают амино, оксоалкил, формил или карбоксильную группу. Эти триарилпромежуточные соединения могут быть получены способами, ранее описанными в химической литературе. Некоторые из этих способов описаны ниже.
Промежуточные соединения, где 'Het' представляет собой дизамещенный пиридин, пиримидин, пиразин или пиридизин, могут быть получены путем конденсации галоген- или алкилтиозамещенных пиридина, пиримидина или пиразина с арилбороновой кислотой или боратным эфиром, в условиях арилирования по Сузуки. Смотри, например, следующие документы.
Для пиридинов: Couve-Bonnaire et al. Tetrahedron 2003, 59, 2793 and Puglisi et al. Eur, J. Org. Chem. 2003, 1552.
Для пиразинов: Schultheiss and Bosch Heterocycles 2003, 60, 1891.
Для пиримидинов: Qing et al. J. Fluorine Chem. 2003, 120, 21 and Ceide and Montalban Tetrahedron Lett. 2006, 47, 4415.
Для 2,4-диарилпиримидинов: Schomake rand Delia, J. Org.Chem. 2001, 66, 7125.
Таким образом, последующие арилирования, катализируемые палладием, используя 4-формилфенилбороновую кислоту и 4-трифторметоксифенилбороновую кислоту, может привести к получению практически к любому конкретной модели замещения, как показано на схеме ниже:
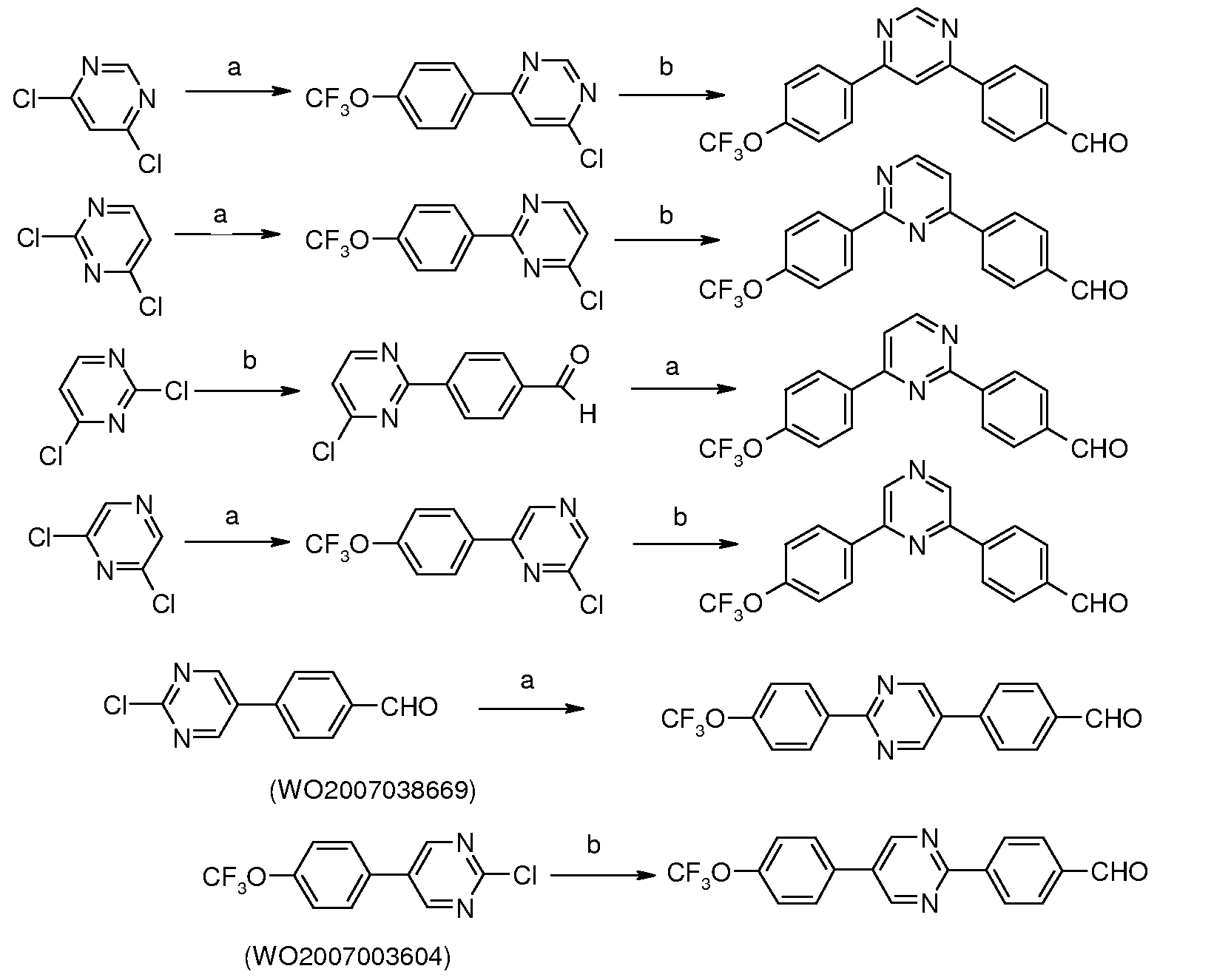
Условия:
a) 4-трифторметоксифенилбороновая кислота, (Ph3P)4Pd;
b) 4-формилфенилбороновая кислота, (Ph3P)4Pd.
Подобным же образом, диарилпиридины и пиразины и другие дигалогенированные гетероциклические ароматические соединения могут быть получены исходя из дигалогенированных пиридинов и пиразинов и других дигалогенированных гетероциклических ароматических соединений, используя тот же метод:
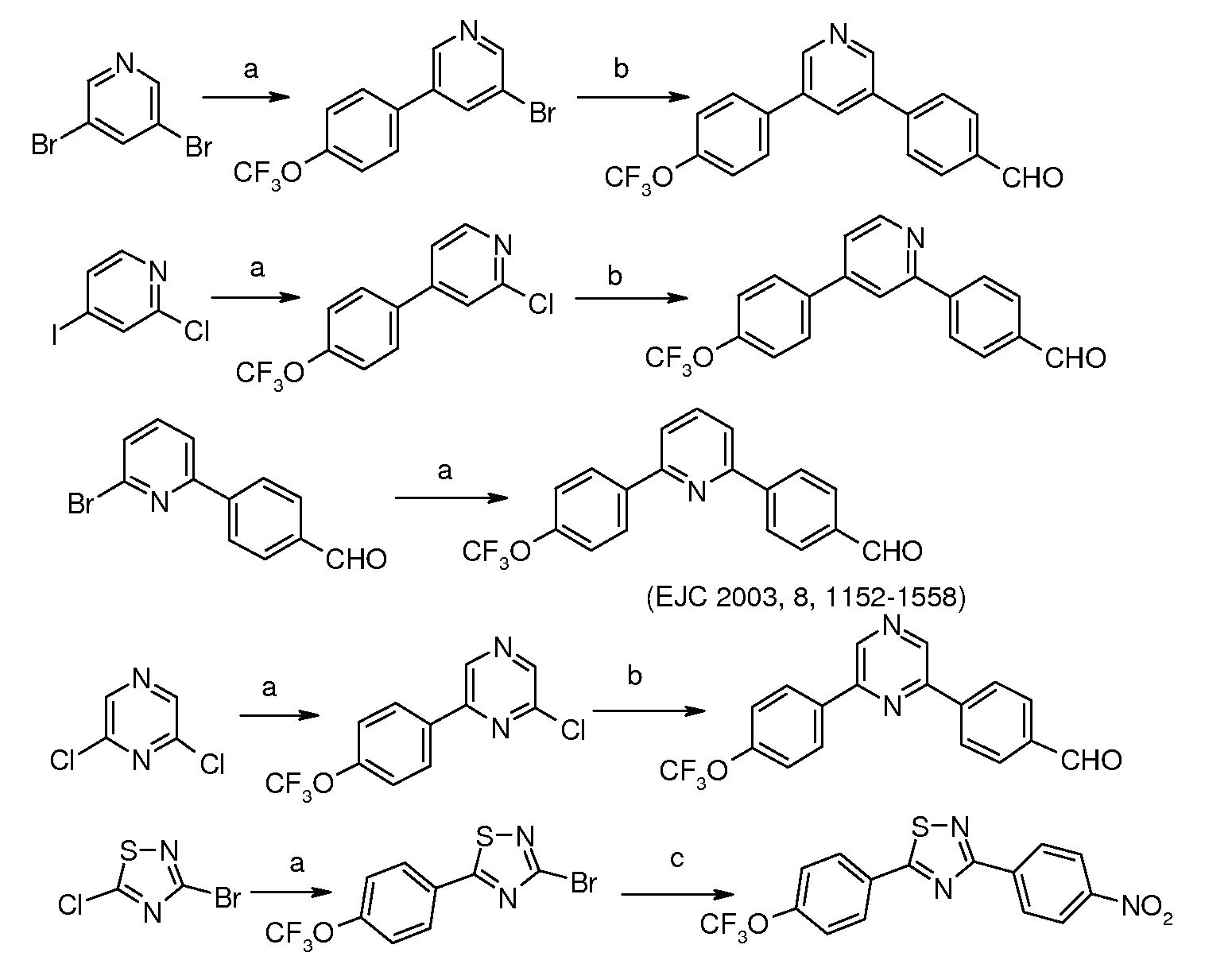
Условия:
a) 4-трифторметоксифенилбороновая кислота, (Ph3P)4Pd;
b) 4-формилфенилбороновая кислота, (Ph3P)4Pd;
С) 4-нитрофенилбороновая кислота, (Ph3P)4Pd.
Галоген- или алкилтиопиримидиновые и пиридиновые предшественники являются либо коммерчески доступными, либо могут быть синтезированы путями, описанными в литературе (Rorig and Wagner U.S. Patent 3149109, 1964; Kreutzberger and Tesch Arzneim.-Forsch. 1978, 28, 235).
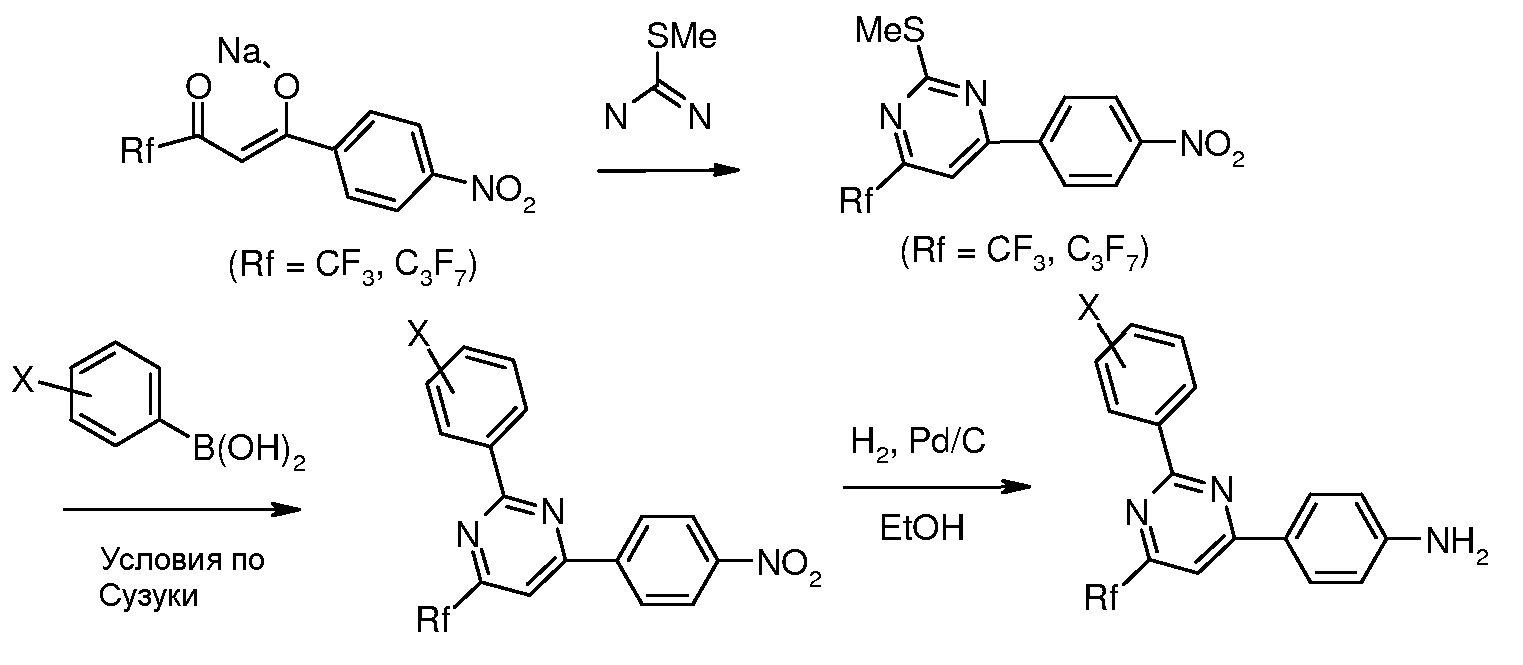
Соединения, где 'Het' представляет собой 1,3-диарил-6-перфторалкил пиримидин, могут быть получены в соответствии со следующей схемой. 2-Метилтиозамещенный пиримидин арилировали в модифицированных условиях реакции по Сузуки (Liebeskind and Srogl Org. Lett. 2002, 4, 979) с получением 2-фенилпиримидинов, которые затем восстанавливали до соответствующих анилинов, используя, например, катализатор Pd/C в EtOH в атмосфере водорода.
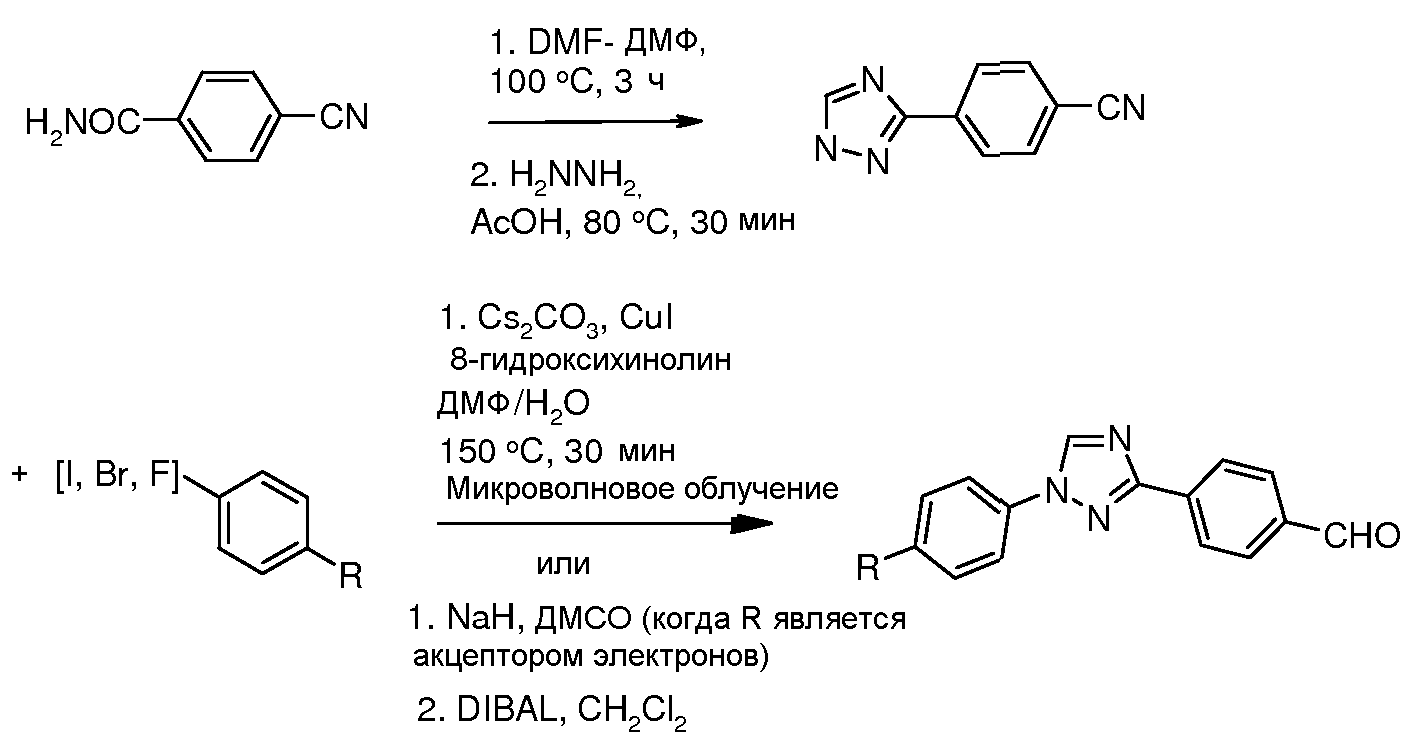
Промежуточные соединения, где 'Het' представляет собой 1,3-дизамещенный 1,2,4-триазол, могут быть получены в соответствии с одной из следующих схем.
Путь A: 1,3-диарил 1,2,4-триазолы получали из соответствующих -NH 3-арил 1,2,4-триазолов согласно следующему опубликованному методу N-арилировния имидазолов (Lin et al. J. Org. Chem. 1979, 44, 4160). Конденсацию 1,2,4-триазолов с арилгалогенидами осуществляли при повышенной температуре или, предпочтительно, в условиях микроволнового облучения (Antilla et al. J. Org. Chem. 2004, 69, 5578). (DIBAL представляет собой диизобутилалюминий гидрид.)
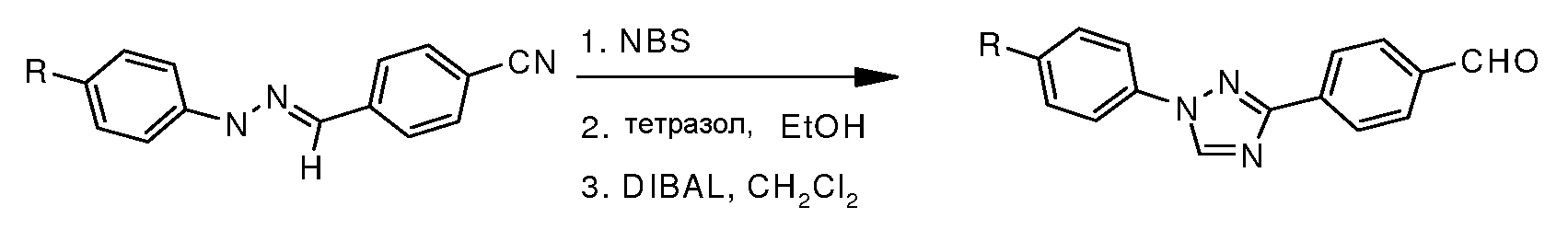
Путь B: Бромирование гидразонов с последующей обработкой бромгидразона тетразолом приводит к образованию 1,3-диарил 1,2,4-триазола (Butler и Fitzgerald J. Chem. Soc., Perkin Trans. 1 1988, 1587).
Путь C: 1,2,4-Триазольные соединения, в которых 5-е положение замещено далее алкилом или замещенной алкильной группой, могут быть получены в соответствии со следующей схемой (Paulvannan and Hale Tetrahedron 2000, 56, 8071):
Соединения, где 'Het' представляет собой имидазол, могут быть получены в соответствии с одной из следующих схем:
Путь A (Стадия 1: Lynch et al. J. Am. Chem. Soc. 1994, 116, 11030. Стадия 2: Liu et al. J. Org. Chem. 2005, 70, 10135):

Путь B. Для галогенарильных групп, которые содержат также активирующую группу, такую как нитро или циано, замена арилгалогенида на имидазол, используя основание, такое как карбонат калия, в полярном апротонном растворителе, таком как N,N-диметилформамид (ДМФ) или диметилсульфоксид (ДМСО), может быть осуществлена следующим образом (Bouchet et al., Tetrahedron 1979, 35, 1331):
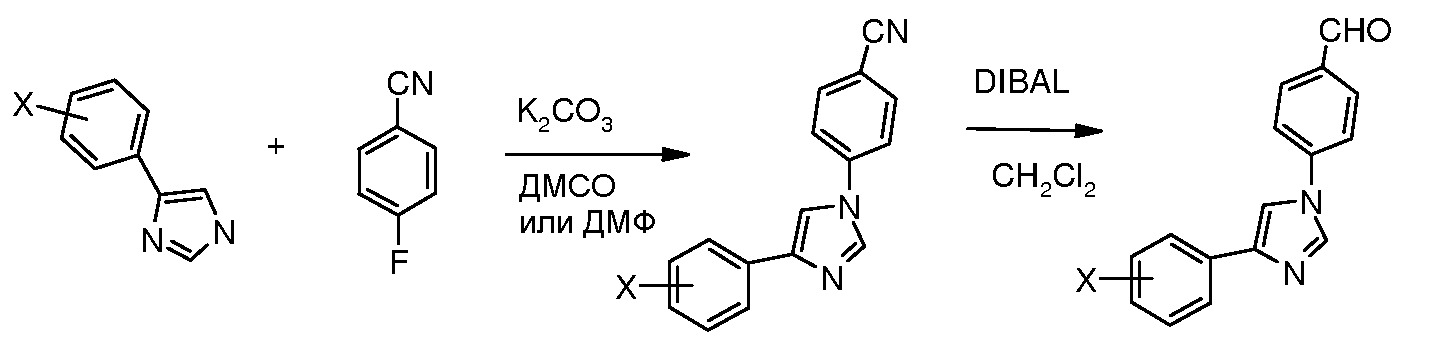
Путь C: Следуя способу, впервые описанному Porretta et al. (Farmaco, Edizione Scientifica 1985, 40, 404), N-фенациланилин обрабатывали тиоцианатом калия в кислой среде (HCl) и полученный 2-меркаптоимидазол затем преобразовывали в десульфированный диарилимидазол путем обработки азотной кислотой в уксусной кислоте.
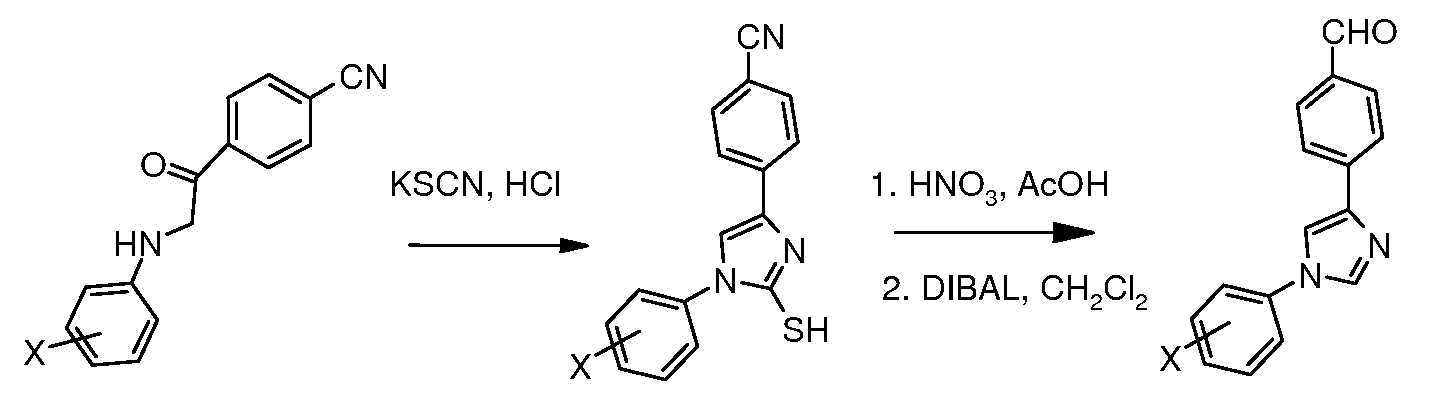
Путь D. N-Арилирование 4-бромимидазола в условиях микроволнового облучения (путь A, стадия 2) давали промежуточное соединение 1-арил-4-бромимидазол, которое преобразовывали в триарил-промежуточные соединения путем обработки арилборными кислотами в катализируемых палладием условиях.
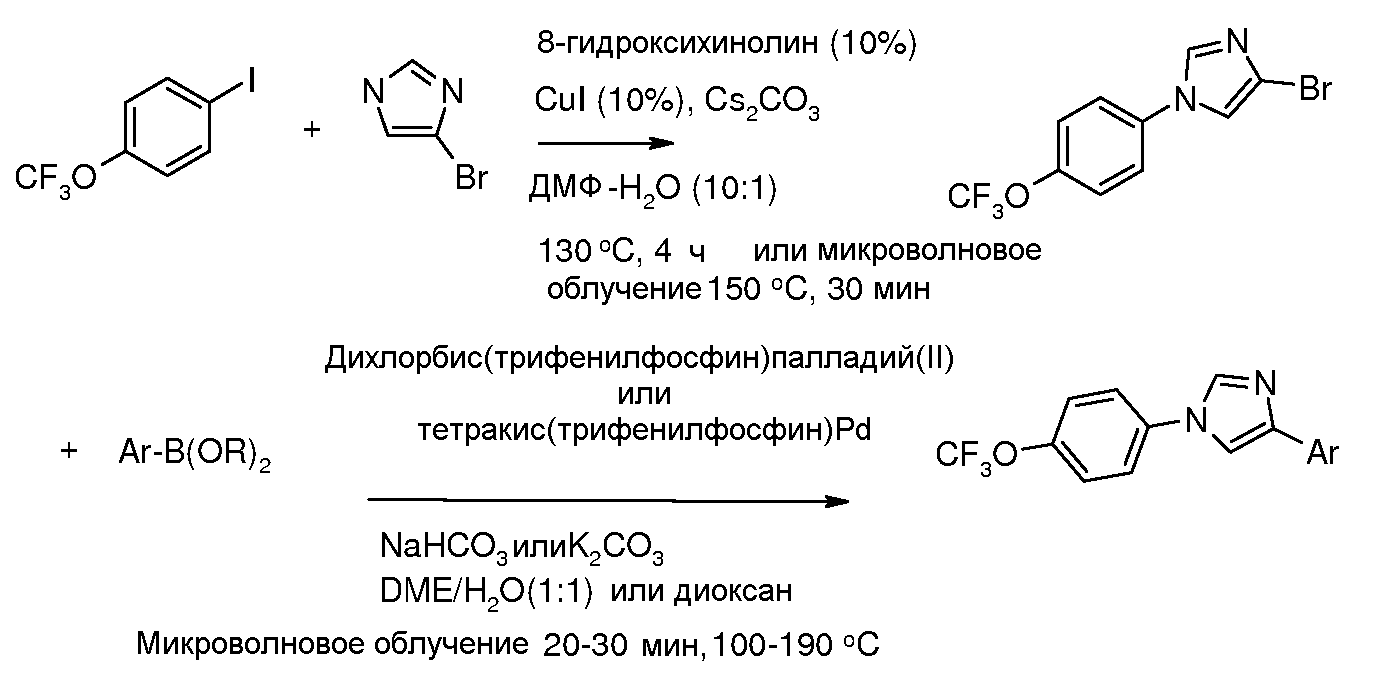
Соединения, где 'Het' представляет собой 1,4-дизамещенный 1,2,3-триазол, могут быть получены в соответствии со следующей схемой (Feldman et al. Org Lett. 2004, 6, 3897):
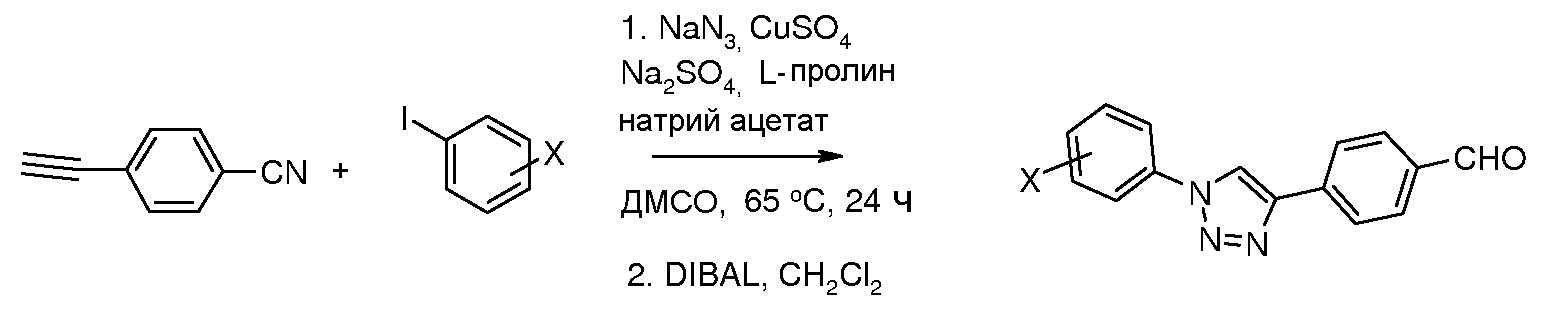
Соединения, где 'Het' представляет собой 3,5-дизамещенный 1,2,4-триазол, могут быть получены в соответствии со следующей схемой (Yeung et al. Tetrahedron Lett. 2005, 46, 3429):
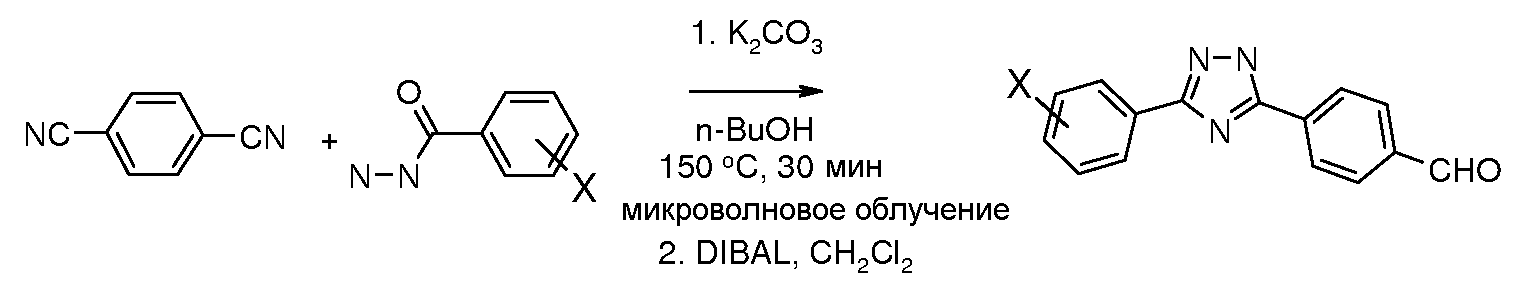
Соединения, где 'Het' представляет собой 1,3-дизамещенный 1,2,4-триазолин-5-он, могут быть получены в соответствии со следующей схемой (Pirrung and Tepper J. Org. Chem. 1995, 60, 2461 and Lyga Synth. Commun. 1986, 16, 163). (DPPA представляет собой дифенилфосфорилазид):
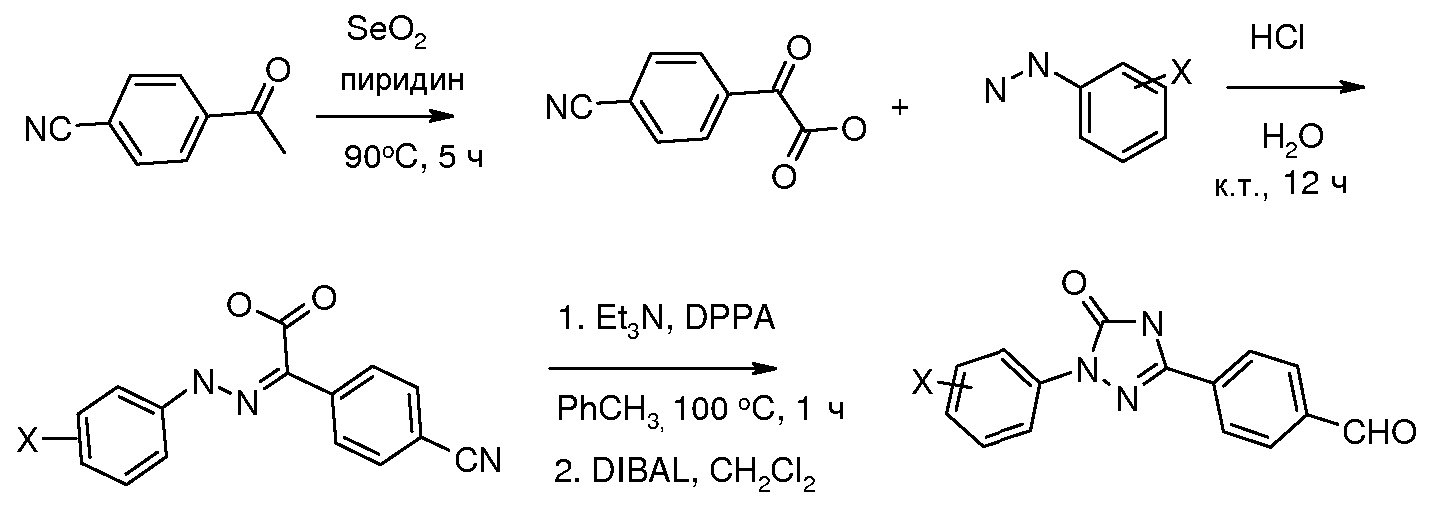
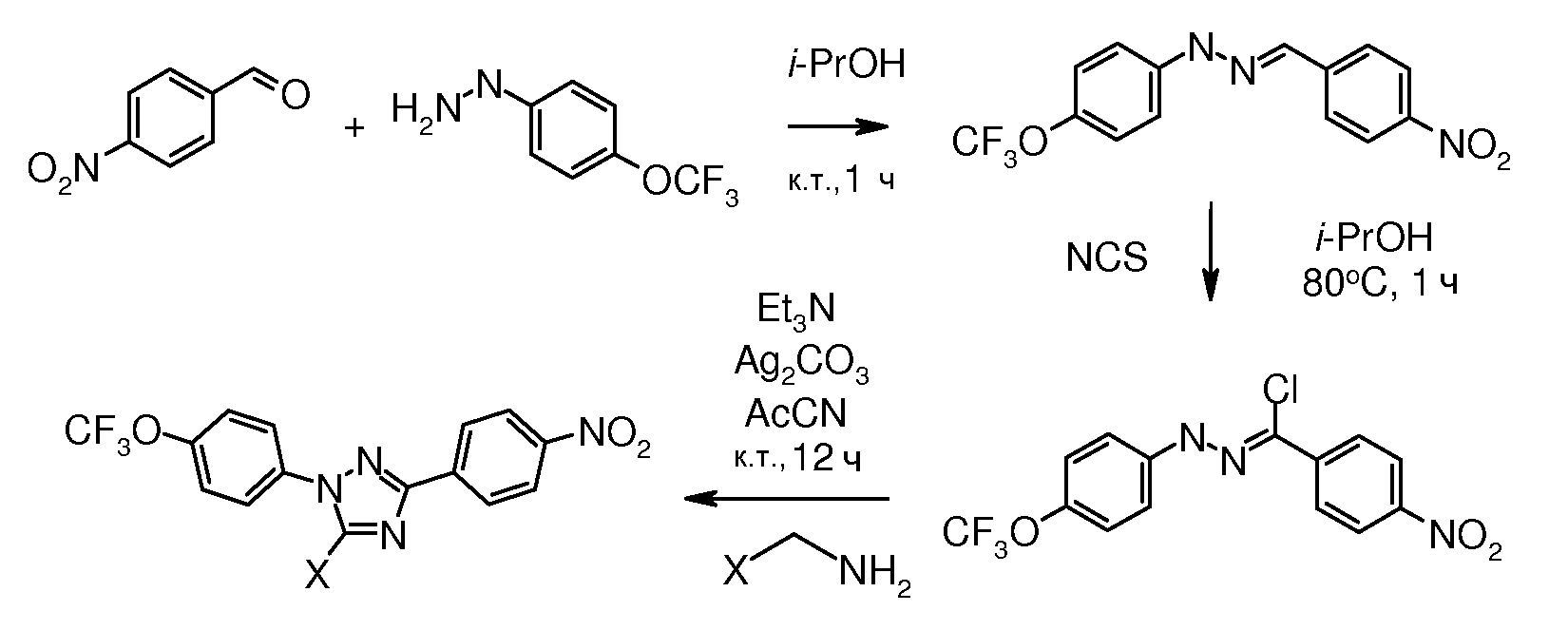
Соединения, где 'Het' представляет собой 1,3-диарилпиразолин, могут быть получены в соответствии со следующей схемой. Моногидразон альдегида терефталевой кислоты обрабатывали NCS в изо-PrOH и полученный промежуточный хлоргидразон напрямую обрабатывали основанием и замещенным олефином с получением пиразолина:
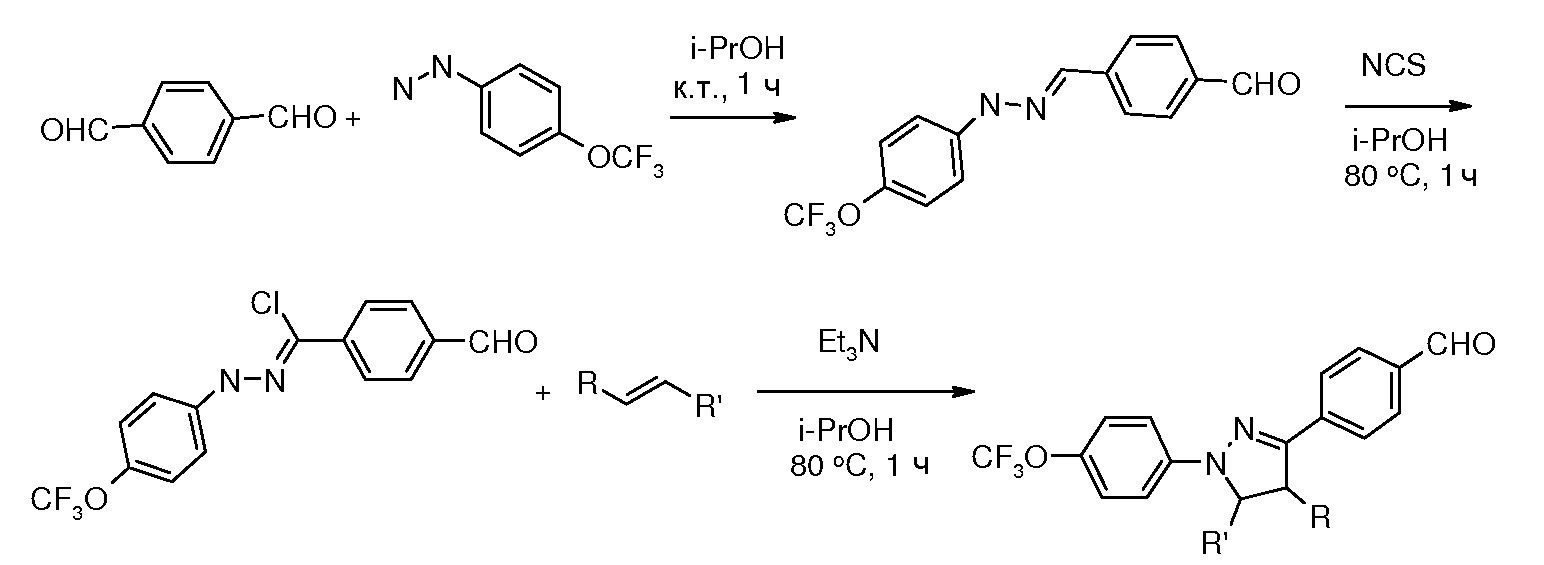
Соединения, где 'Het' представляет собой 3,5-дизамещенный изоксазол, могут быть получены в соответствии со следующей схемой:
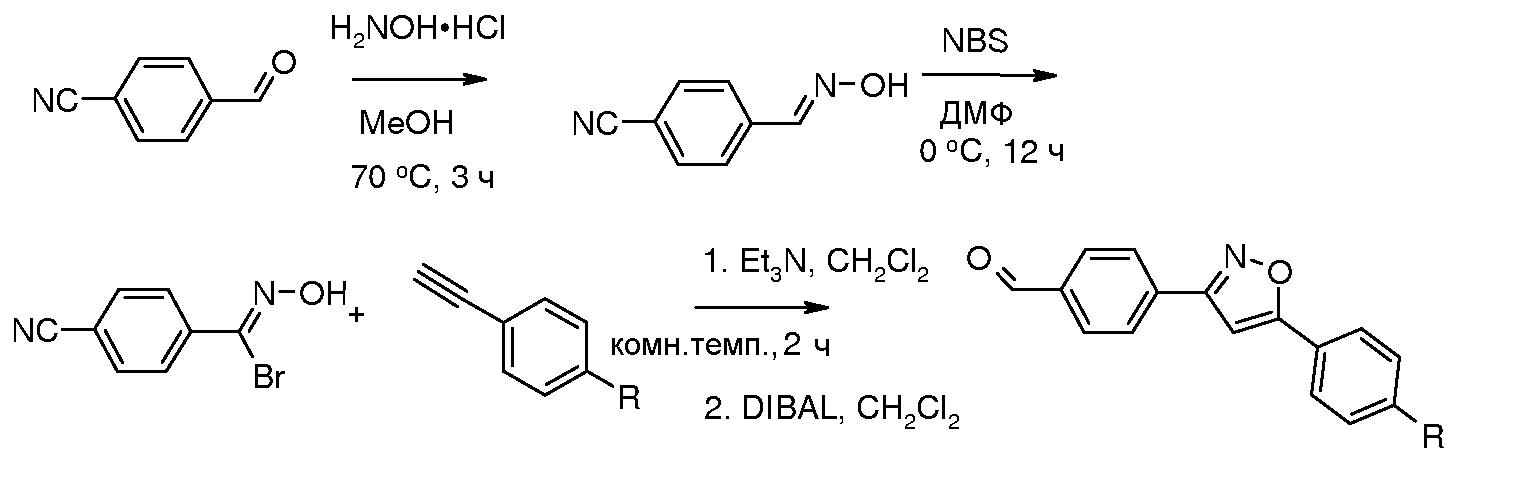
Соединения, где 'Het' представляет собой 1,3-дизамещенный пиразол, могут быть получены в соответствии со следующей схемой. Конденсацию пиразола с галогенированными ароматическими производными осуществляли используя условия микроволнового облучения, описанные Liu et al., путь A, стадия 2, выше. (DMA представляет собой диметилацеталь.)
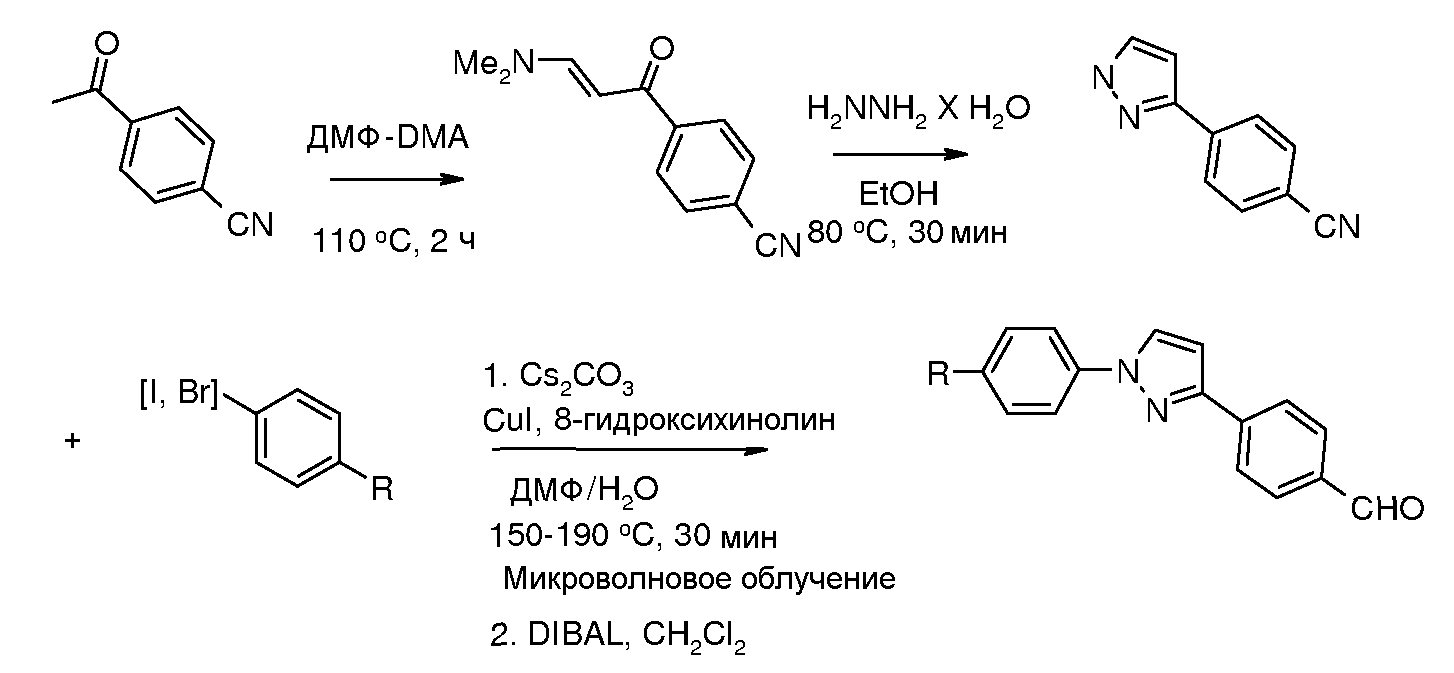
Соединения, где 'Het' представляет собой 2,4-дизамещенный триазол, получали конденсированием тиоамида с α-галогенацетофеноном в протонном растворителе, таком как этанол (например, Potts and Marshall J. Org. Chem. 1976, 41, 129).

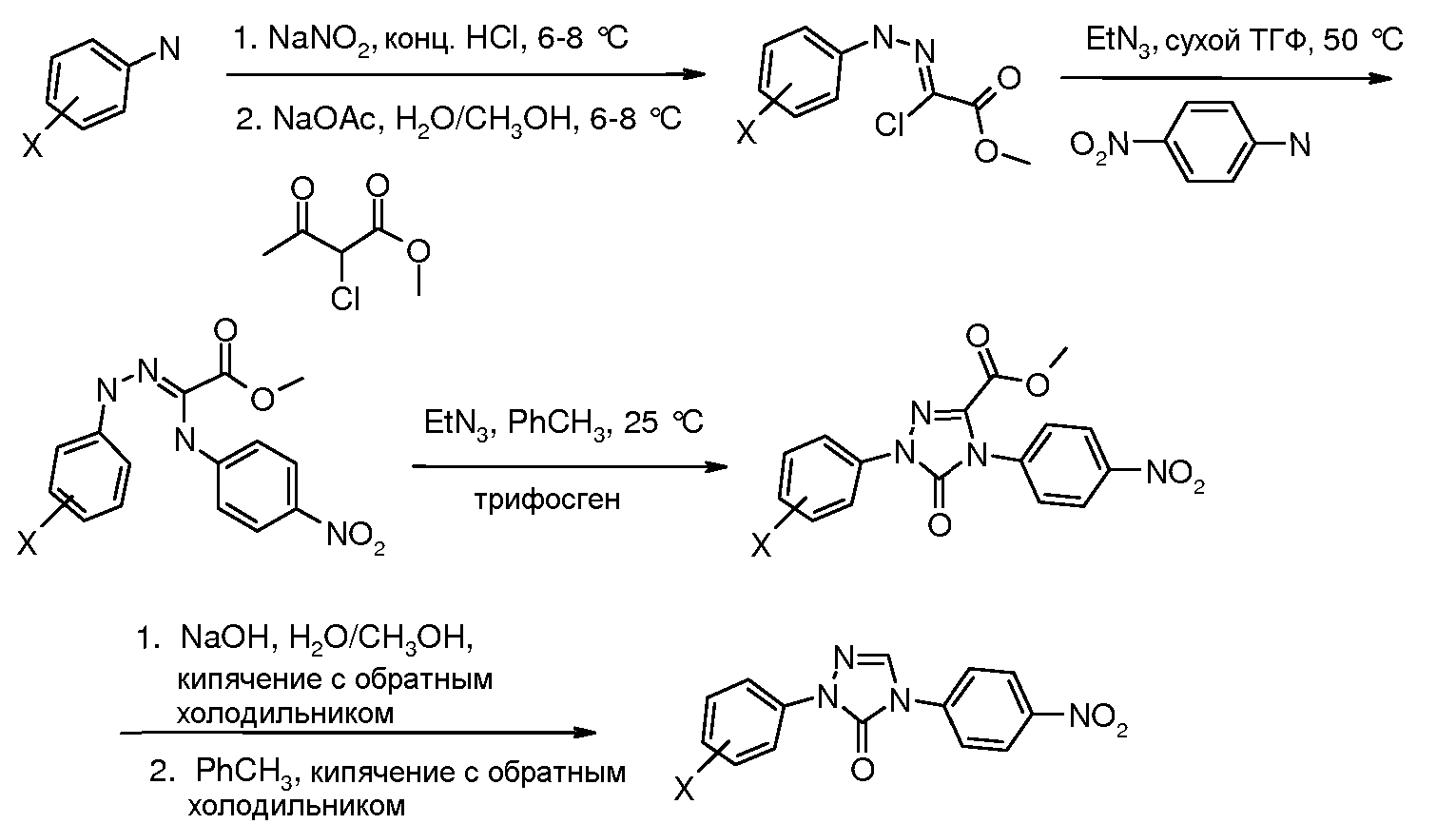
Соединения, где 'Het' представляет собой 1,4-дизамещенный 1,2,4-триазолин-5-он, получали в соответствии со следующей схемой (Henbach DE 2724819 A1, 1978, с незначительным модифицированием в две стадии):
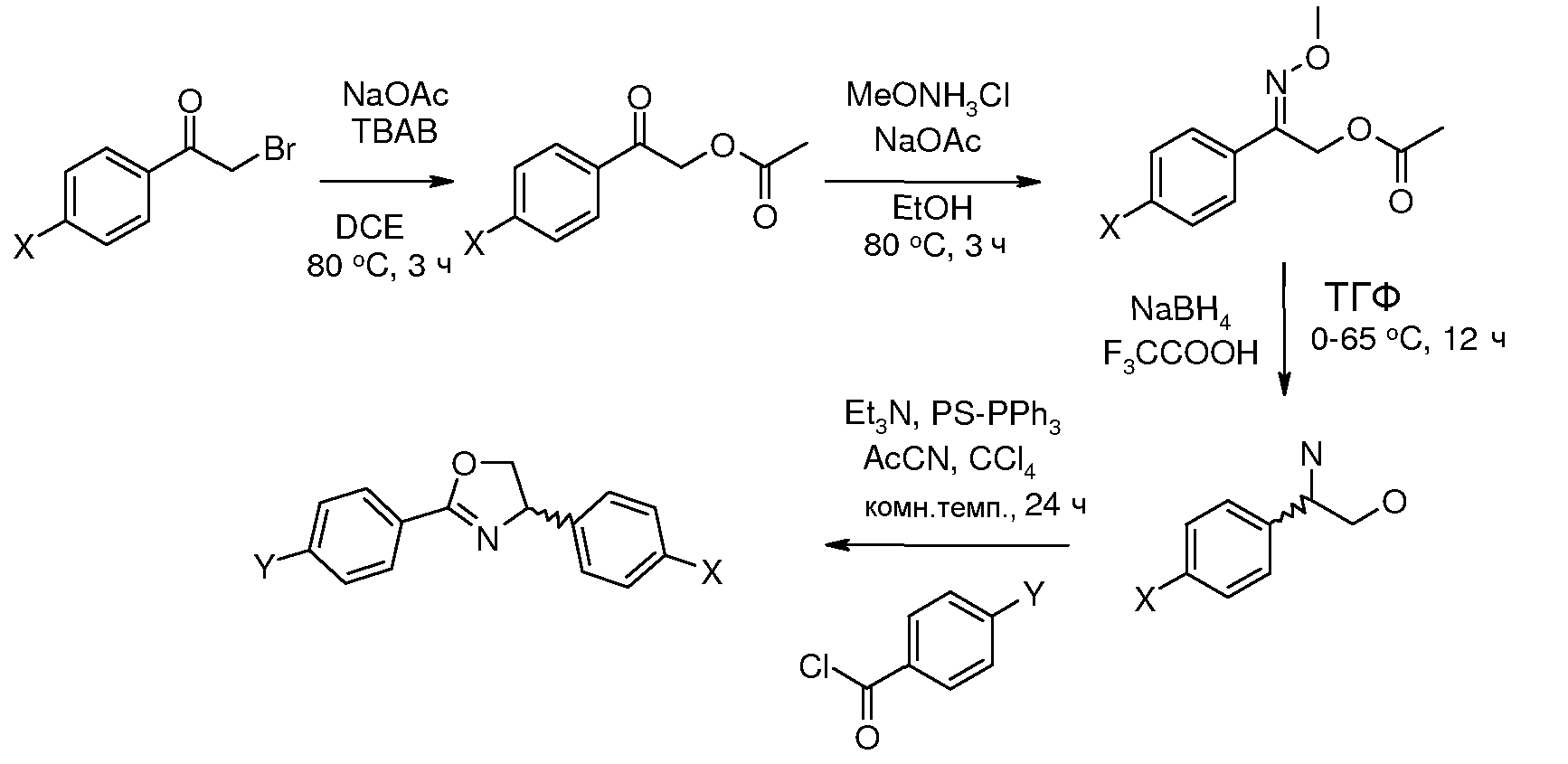
Соединения, где 'Het' представляет собой 2,4-дизамещенный оксозолин, получали исходя из α-бромацетофенона в соответствии со следующей схемой (Periasamy et al. Синтез 2003, 1965 and Liu et al. J. Am. Chem. Soc. 2007, 129, 5834).
Соединения, где 'Het' представляет собой 2,5-дизамещенный оксозолин, получали в соответствии со следующей схемой (Favretto et al. Tetrahedron Lett. 2002, 43, 2581 and Liu et al. J. Am. Chem. Soc. 2007, 129, 5834):
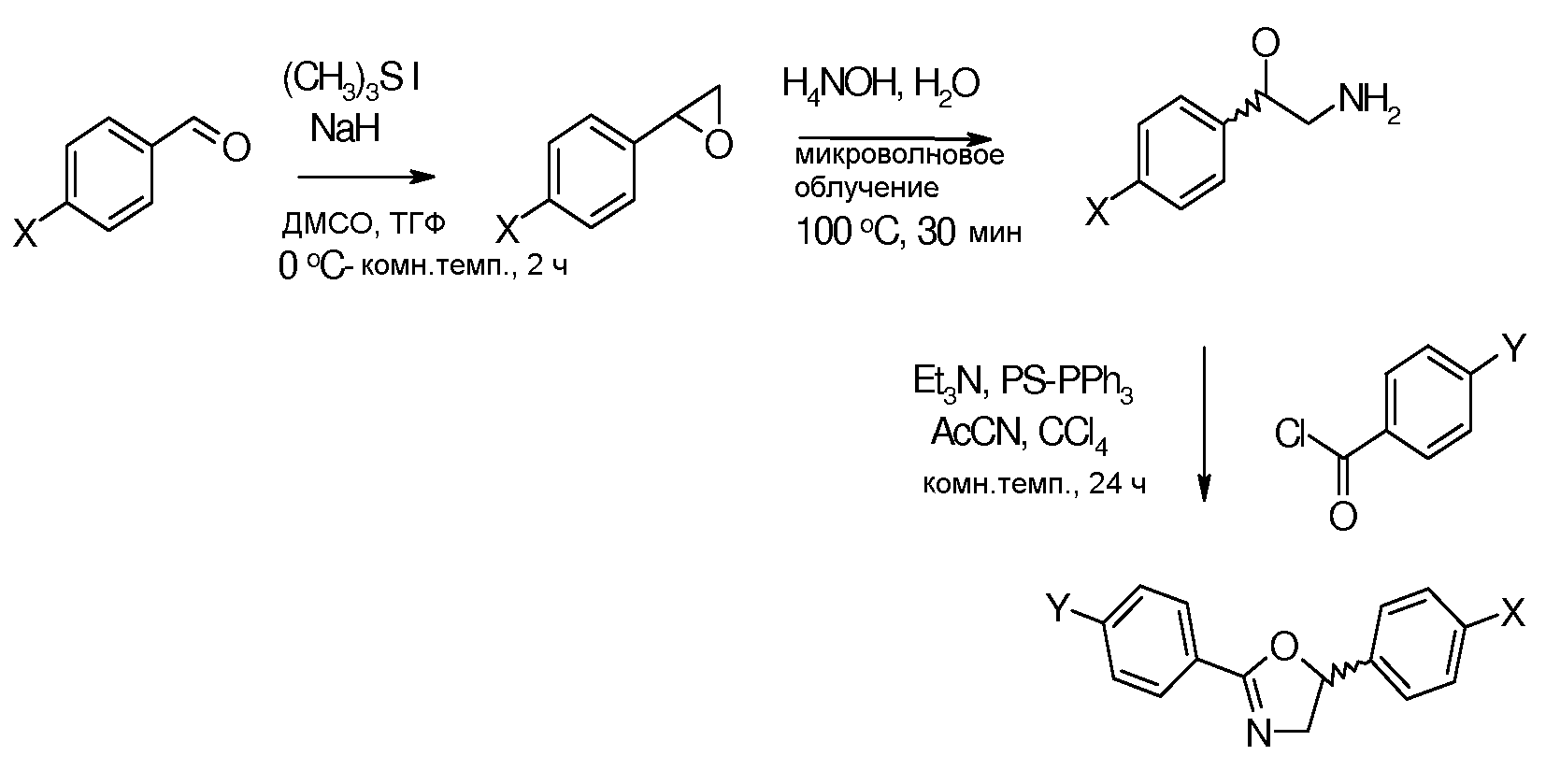
Соединения, где 'Het' представляет собой 1,4-дизамещенный пиперазин, получали в соответствии со следующей схемой (Evans et al. Tetrahedron Lett. 1998, 39, 2937):
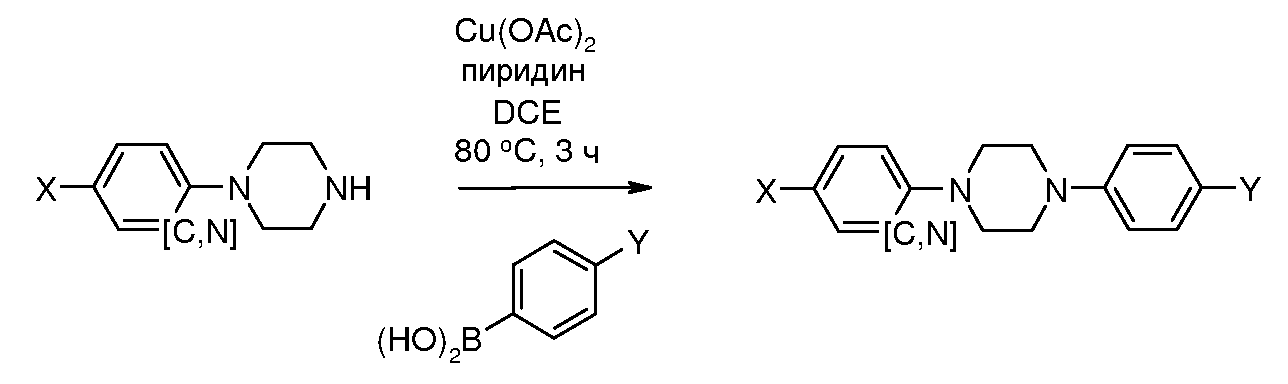
Соединения, где 'Het' представляет собой 1,3-дизамещенный пиразолин, получали добавлением арилгидразина к β-диметиламино пропиофенону, как показано на следующей схеме, которая описана в работах Linton et al. Tetrahedron Lett. 2007, 48, 1993, и Wheatley et al. J. Am. Chem. Soc. 1954, 76, 4490. При добавлении к пиразолину минимальное по количеству бис-добавление приводит к соответствующему диметиламинометил пиразолину. Эти продукты могут быть разделены хроматографически.
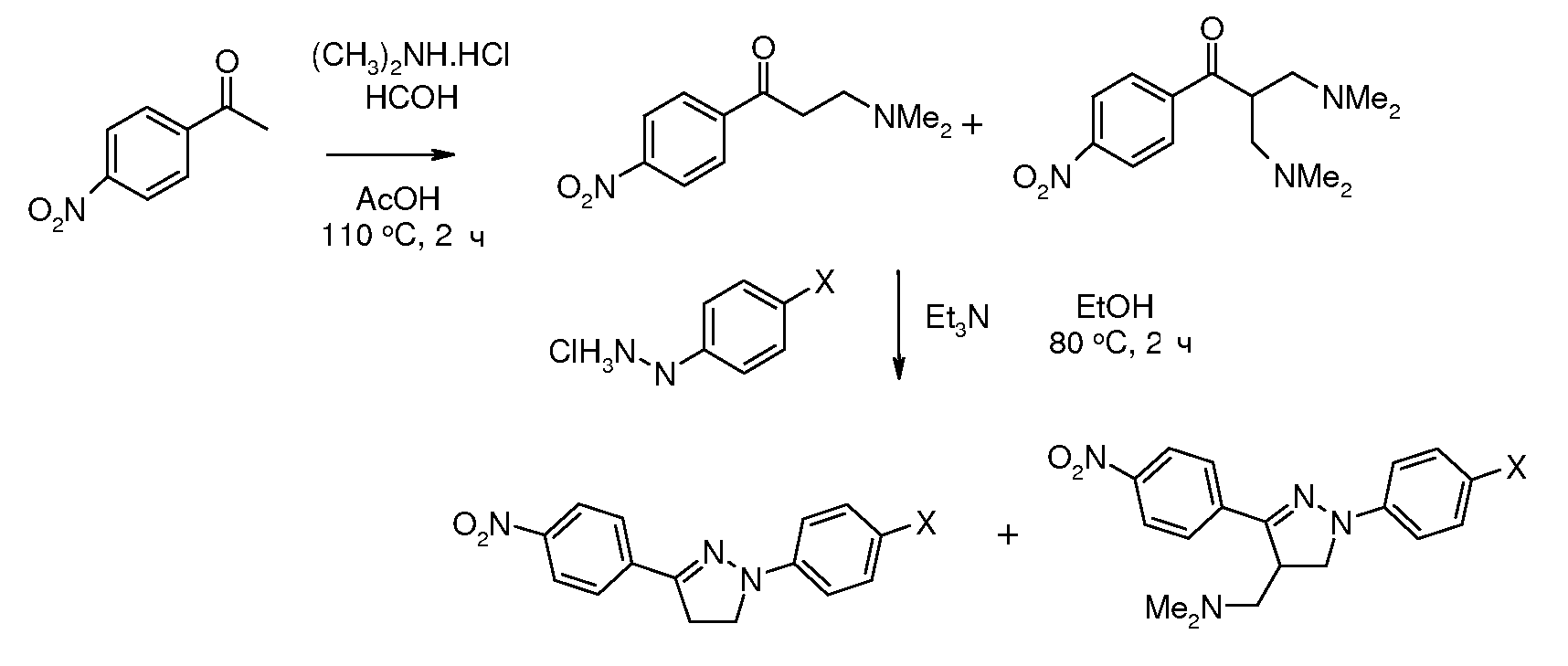
Соединения, где 'Het' представляет собой 3,5-дизамещенный 1,2,4-триазин, получали в соответствии со следующей схемой (Reid et al. Bioorg. Med. Chem. Lett. 2008, 18, 2455 and Saraswathi and Srinivasan Tetrahedron Lett. 1971, 2315):
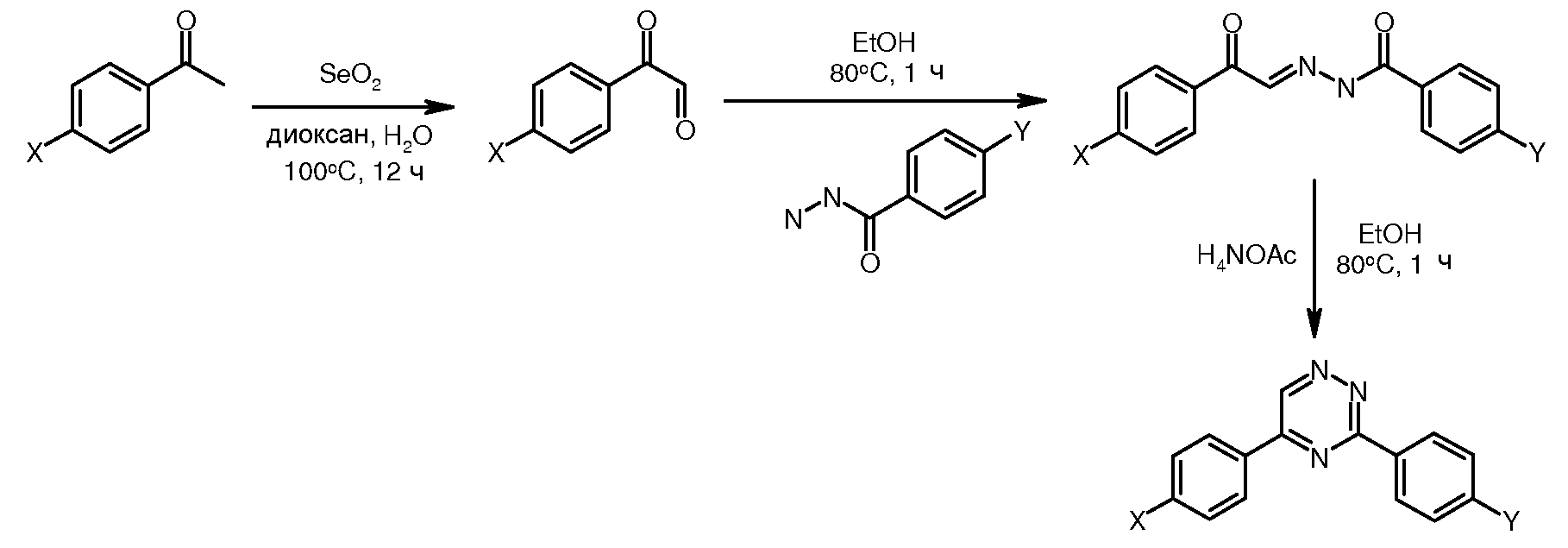
Соединения, где 'Het' представляет собой 2-кетопиперазин или 2,5-дикетопиперазин, получали как описано на следующей схеме. Нитрофениловый сложный эфир глицина может быть ацилирован используя хлорацетил хлорид и промежуточный N-хлорацетилированый сложный эфир глицина, при обработке анилином, подвергается замене и замыканию кольца при температуре от 120 до 180°C с образованием дикетопиперазина. Альтернативно, монокето насыщенные или ненасыщенные пиперазины могут быть получены из промежуточного ацеталя, ниже, гидролизом и замыканием кольца.

ПОЛУЧЕНИЕ ОКСИМ-ЛИНКЕРНЫХ СОЕДИНЕНИЙ
Оксим-линкерные соединения могут быть получены исходя из соответствующих арил альдегидов или кетонов путем взаимодействия с соответствующим 2-гидроксиламиносахаром, в органическом растворителе, таком как MeOH или EtOH, при температуре между 0 и 100°C.
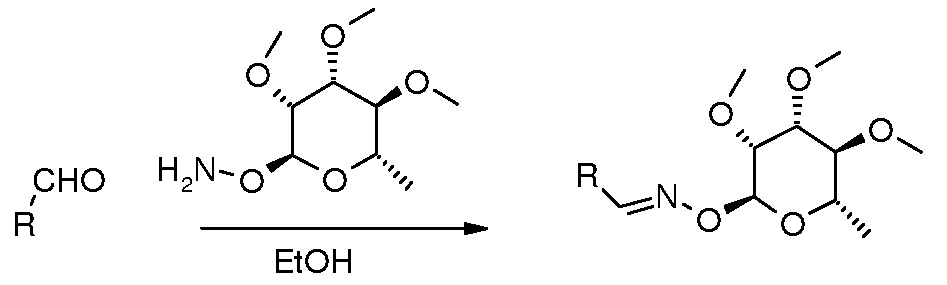
ПОЛУЧЕНИЕ (ТИО)КАРБАМАТ-ЛИНКЕРНЫХ СОЕДИНЕНИЙ
Карбамат- или тио-карбамат линкерные соединения могут быть получены исходя из соответствующих ариламинов путем преобразования либо в изоцианат, изотиоцианат, либо в п-нитрофенилкарбамат, с последующей обработкой соответствующим спиртом (ROH) и органическим или неорганическим основанием в подходящем растворителе, таком как тетрагидрофуран (ТГФ), при температуре между 0 и 100°C.
Альтернативно, промежуточный изоцианат может быть получен исходя из карбоновой кислоты путем обработки источником азида, таким как дифенилфосфорил азид (DPPA). Ацил азид затем может быть подвергнут перегруппировке Куртиуса путем нагревания до 110°C в толуоле, и полученный изоцианат обрабатывали соответствующим сахаром, и основание, как описано выше, давало карбамат.
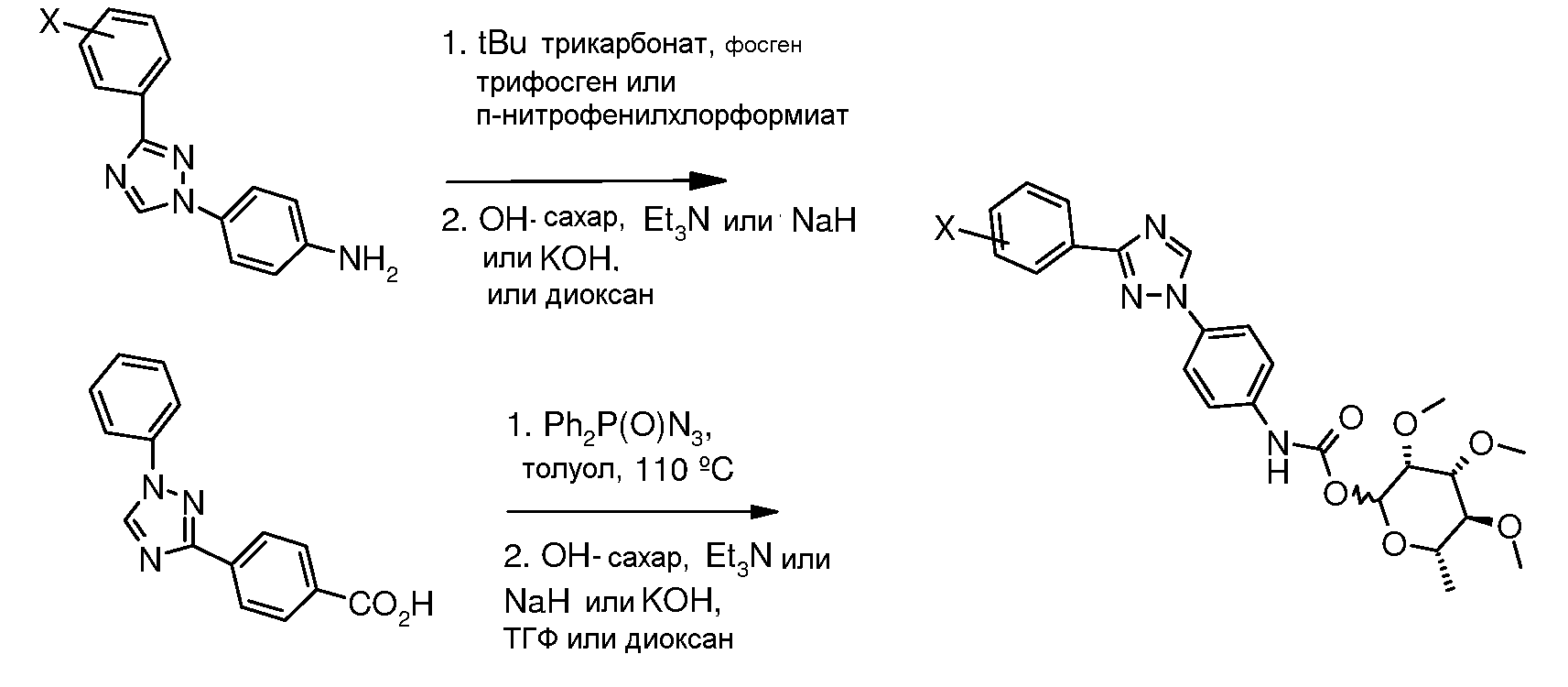
В этих реакциях, α-конфигурация у C1 группы рамнозы обычно присуща основному продукту, хотя небольшое количество β-аномера также образуется. Эти два изомера могут быть разделены с помощью хроматографии или они могут использоваться в виде смеси.
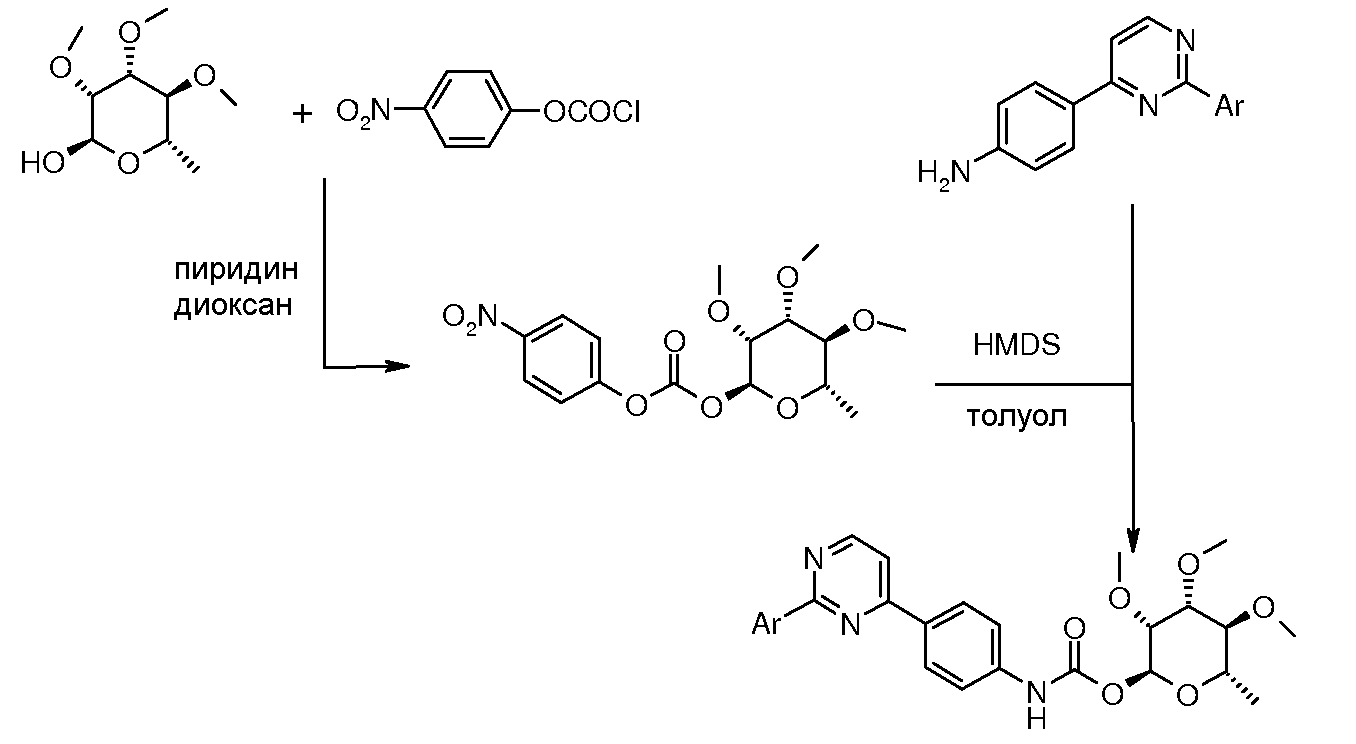
Карбаматы могут быть также получены через нитрофенил карбонаты, как показано позже. Предпочтительно обрабатывать пиримидиниланилин сначала сильным основанием, таким как гексаметилдисилазид лития или калия (HMDS), а затем нитрофенилкарбонатом. п-Нитрофенилкарбонат может быть получен путем взаимодействия полуацеталя три-O-метилрамнозы с п-нитрофенилхлорформиатом в смеси пиридин/диоксан.
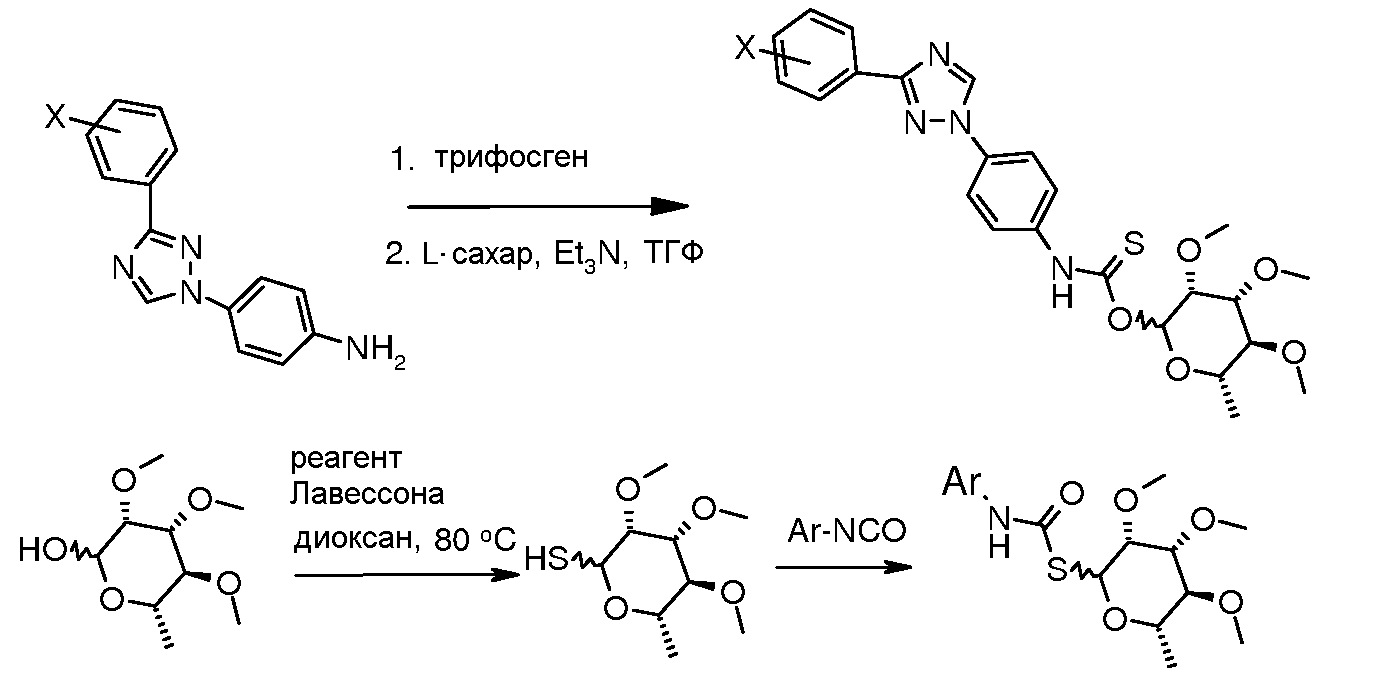
Тио-карбамат производные могут быть получены исходя из S-алкил рамнозы, которая получается из рамнозилпиранозида путем обработки реагентом Лавессона (Lawesson) (Bernardes et al. Angew. Chem. Int. Ed. 2006, 45, 4007). Обработка гликозилтиола изоцианатом или п-нитрофенилкарбаматом и органическим основанием, таким как триэтиламин, дает тиокарбамат.
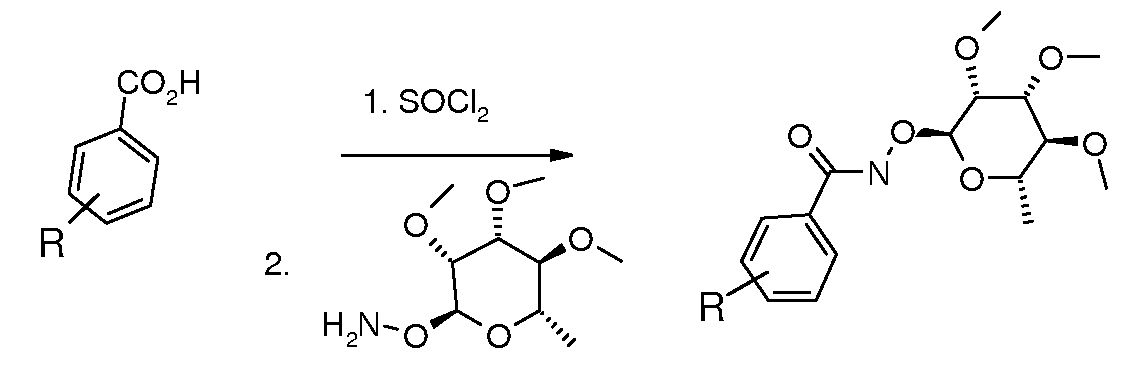
ПОЛУЧЕНИЕ ГИДРОКСАМАТ-ЛИНКЕРНЫХ СОЕДИНЕНИЙ
Эфиры гидроксамовой кислоты-линкерные соединения могут быть получены путем обработки хлорангидрида кислоты гидроксиламином и органическим основанием, таким как триэтиламин:
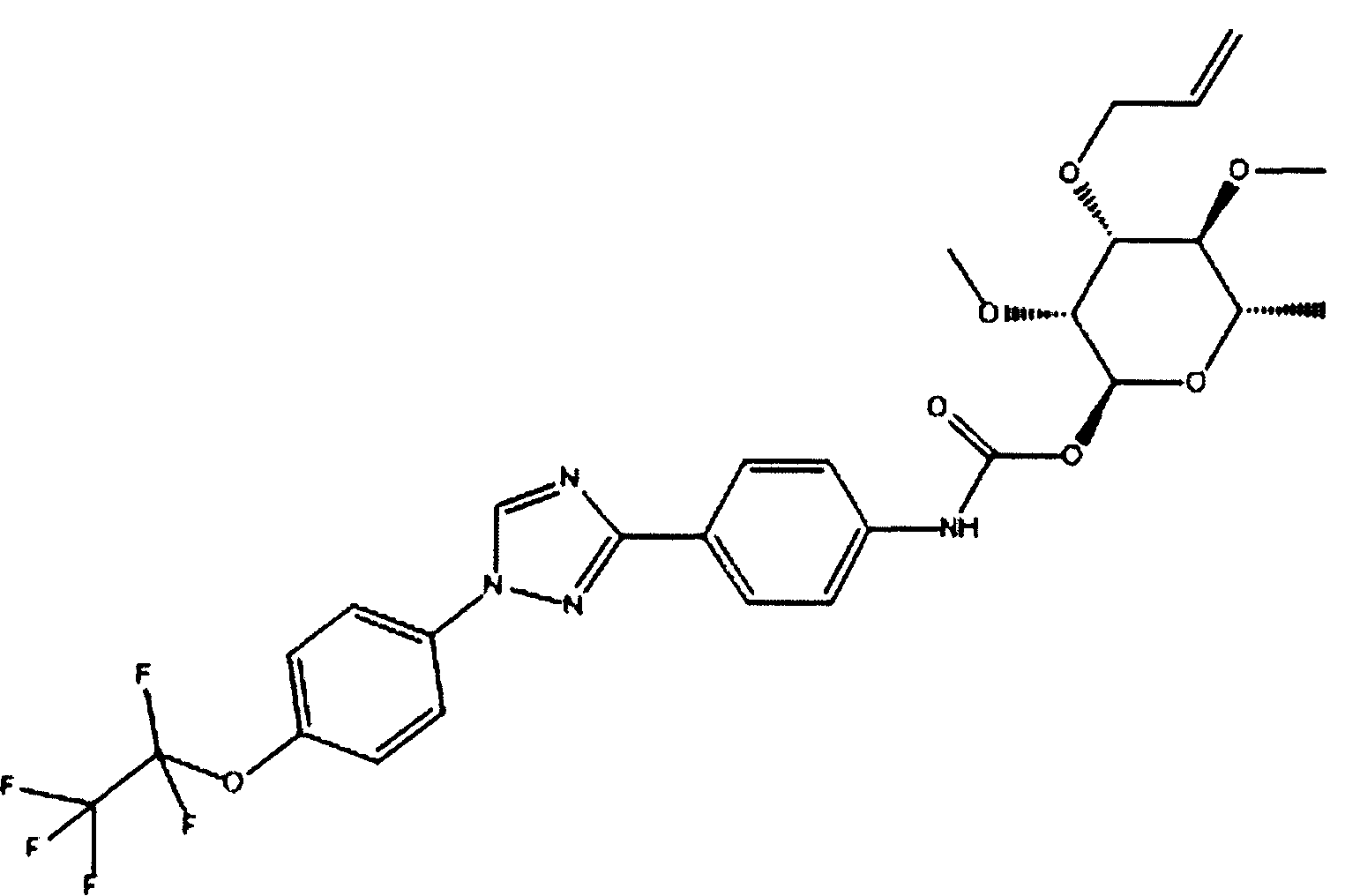
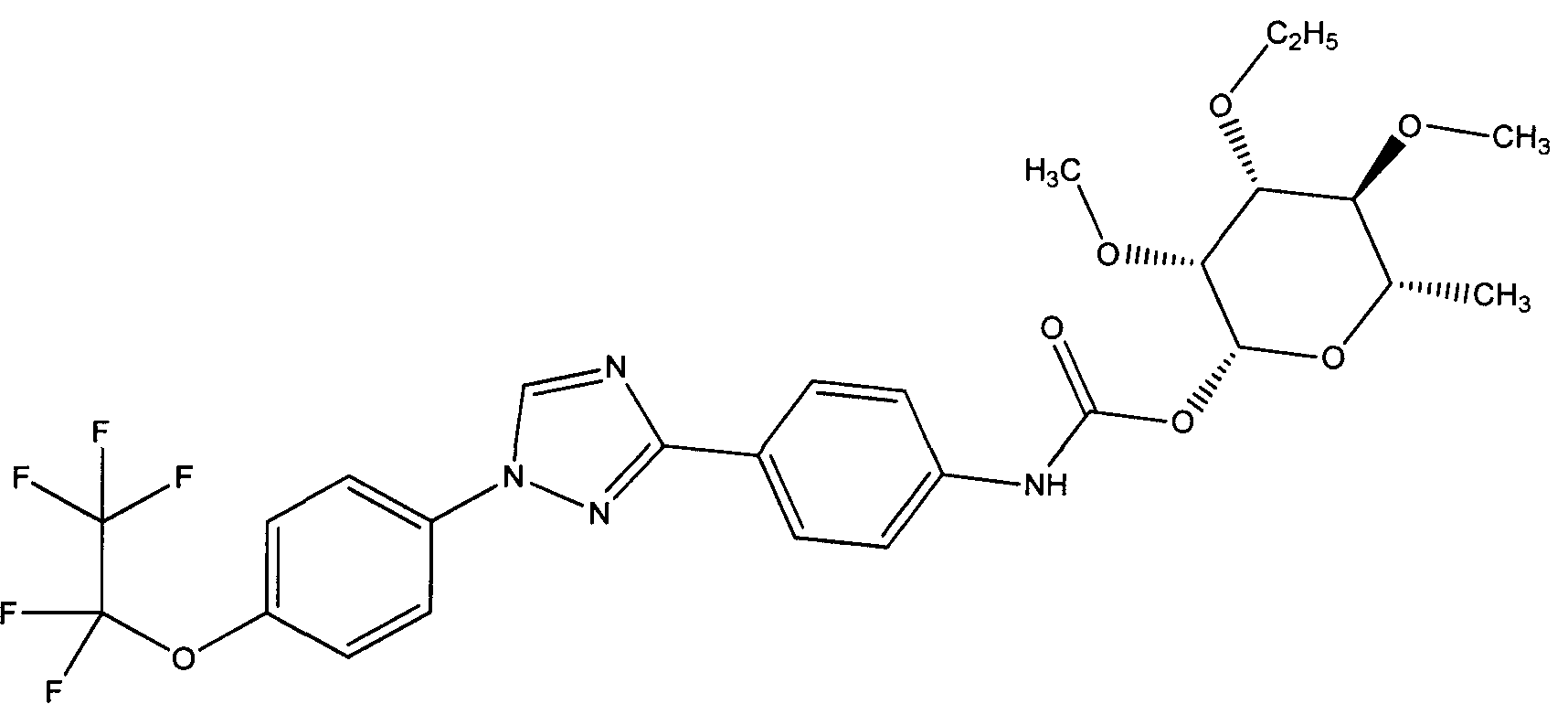
Получение соединений в объеме притязаний данного изобретения может быть осуществлено синтезом соответствующего промежуточного триарила, содержащего кислотную, альдегидную, кетонную или аминофункциональную группу для присоединения к промежуточной пиранозе.
ПРИМЕРЫ
Данные примеры приведены в иллюстративных целях и не должны рассматриваться как ограничивающие изобретение, описанное в данном документе, только представленными вариантами осуществления.
Пример 1
Получение (3R,4R,5S,6S)-2,3,4,5-тетраметокси-6-метилтетрагидропирана (соединение E-1)
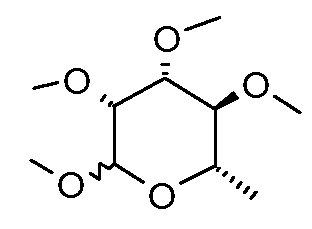
Раствор гидрата L-рамнозы (40 г, 0,22 моль) в 450 мл сухого диметилсульфоксида помещали в 2 л 3-горлую круглодонную колбу и перемешивали с помощью механической мешалки, в это время одной порцией добавляли порошкообразный KOH (75 г, 1,34 моль). К этому раствору добавляли иодметан (187 г, 1,32 моль) с такой скоростью, чтобы температура раствора поддерживалась ниже 30°C. Для поддержания данной температуры периодически подставляли и убирали баню сухой лед-ацетон. После завершения добавления (приблизительно 2 час) раствор перемешивали еще 3 час, затем оставляли стоять при комнатной температуре в течение ночи. Этот прозрачный раствор затем экстрагировали с помощью 4×500 мл гексана и объединенный гексановый раствор промывали насыщенным солевым раствором, затем высушивали и упаривали растворитель. Таким образом получали 44 г (92%) раствора светло-оранжевого цвета. Перегонка давала 40 г бесцветного масла, т.кип. 150°C (0,5 мм рт.ст.).
Пример 2
Получение (3R,4R,5S,6S)-3,4,5-триметокси-6-метилтетрагидропиран-2-ола (соединение E-2)
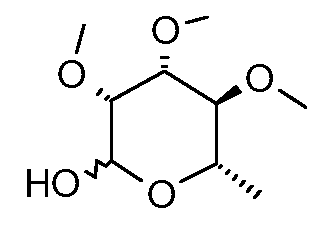
Раствор 35,7 г (0,162 моль) E-1 в 300 мл 2 н. соляной кислоты нагревали при температуре 98°C в течение 5 час, затем охлаждали до комнатной температуры и экстрагировали с помощью четырех 170-мл-овых порций дихлорметана (DCM). Объединенные экстракты сушили над сульфатом магния и обесцвечивали с помощью активированного угля. Концентрирование давало 24,7 г (74%) указанного в заголовке соединения в виде смолистого масла. Часть сырого продукта (960 мг) подвергали вакуумной перегонке, используя аппарат Кугельрора, собирая 890 мг при температуре 145-155°C (1-2 мм).
Пример 3
Получение (3R,4R,5S,6S)-4-этокси-2,3,5-триметокси-6-метилтетрагидропирана (соединение E-3)
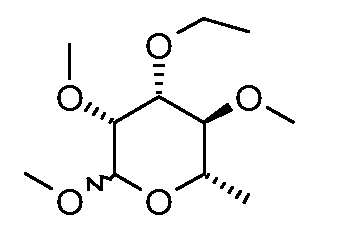
Серную кислоту (300 мл, 98%, 5,6 моль) медленно добавляли к перемешиваемому раствору 2,5 л метанола в 4 л сосуде Эрленмейера. После того как раствор охладился до температуры окружающей среды, добавляли 3'-OEt спиносин J/L (350 г, 0,47 мол, полученный, как описано в документе DeAmicis et al., U.S. Patent 6001981, 1999), и полученный раствор нагревали при температуре кипения с обратным холодильником в течение 6 час. Охлажденный раствор переносили в 4 л делительную воронку и экстрагировали с помощью 3×1 л гексана. Объединенный органический раствор сушили и концентрировали в вакууме, затем перегоняли используя аппарат Кугельрора. Таким образом получали 65 г (60%) бесцветного масла, т.кип. 165°C (при 10 мТорр).
Пример 4
Получение (2R,3R,4R,5S,6S)-2,3,5-триметокси-6-метил-4-пропокситетрагидропирана (соединение E-5)
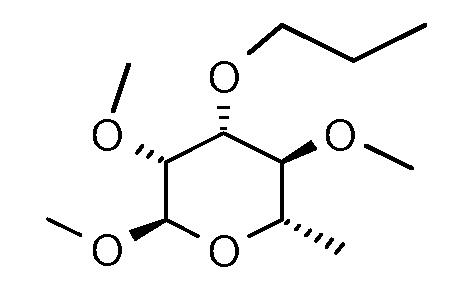
Стадия 1. (2R,3R,4R,5R,6S)-2-Метокси-6-метил-4-пропокситетрагидропиран-3,5-диол. Следуя способу, описанному в работе Aoyama et al. (Tetrahedron Lett. 1997, 38, 5001) для получения 3,4-боронатного сложного эфира метил α-L-фукопиранозида, метил α-L-рамнопиранозид преобразовывали в 2,3-боронатный сложный эфир. Сырой сложный эфир (10,0 г, 37,7 ммоль) растворяли в 150 мл толуола и обрабатывали иодпропаном (8,0 г, 47 ммоль), оксидом серебра (21,8 г, 94,3 ммоль) и триэтиламином (4,47 г, 47,1 ммоль). Раствор нагревали до температуры 100°C и оставляли перемешиваться в течение ночи (16 час). После охлаждения и фильтрования раствор концентрировали до смолистого масла и очищали с помощью хроматографии на силикагеле, элюируя градиентом смеси EtOAc-гексан с получением 5,9 г чистого продукта.
Стадия 2. Продукт со стадии 1 подвергали метилированию, используя MeI и KOH, в условиях, описанных в примере 1, с получением соединение E-4.
Промежуточные пиранозы, представленные в таблице 1 (соединения E-1 через E-E-22), получали способами, описанными ранее и проиллюстрированными в примерах 1-4.
Пример получения промежуточной 2-O-сукцинимидоил пиранозы описан ниже.
Пример 5
Получение 1-((2S,3R,4R,5S,6S)-3,4,5-триметокси-6-метилтетрагидропиран-2-илокси)пирролидин-2,5-диона (соединение E-23)
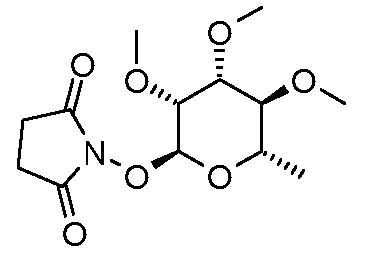
К перемешиваемому раствору 2,3,4-три-O-метил-L-рамнозы (6,5 г, 31,5 ммоль) и N-гидроксисукцинимида (5,4 г, 47 ммоль) в 50 мл бензола добавляли 50 мг (кат.) п-толуолсульфоновой кислоты. Раствор нагревали при кипячении с обратным холодильником и отбирали воду, используя насадку Дина-Старка. Через 4 часа раствор охлаждали и поверхностный толуольный слой отделяли от небольшого количества нерастворимой смолы. Органический слой промывали 20 мл насыщенного раствора NaHCO3, затем сушили над MgSO4 и концентрировали с получением твердого продукта. Перекристаллизация из смеси эфир-гексан давала 4,95 г (52%) указанного в заголовке соединения в виде твердого продукта не совсем белого цвета.
Пример 6
Получение 1-((2S,3R,4R,5S,6S)-5-гидрокси-3,4-диметокси-6-метилтетрагидропиран-2-илокси)пирролидин-2,5-диона (соединение E-24)
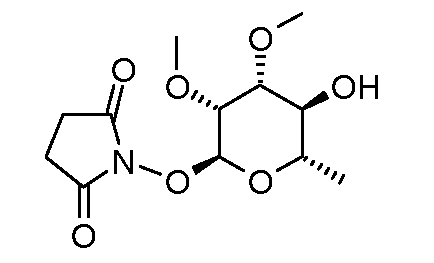
Раствор (2R,3R,4R,5S,6S)-5-бензилокси-3,4-диметокси-6-метилтетрагидропиран-2-ола (10,5 г, 26,6 ммоль, полученный, как описано в работе Wu et al. Carbohydr. Res. 1998, 306, 493), N-гидроксисукцинимида (5,0 г, 50 ммоль) и TsOH (250 мг, кат.) в 100 мл бензола нагревали при температуре кипения с обратным холодильником в течение 24 час с удалением воды, используя насадку Дина-Старка. Коричневый раствор охлаждали, фильтровали, промывали насыщенным раствором бикарбоната натрия и концентрировали. Смолистое масло очищали с помощью хроматографии на силикагеле, элюируя смесью 70:30 гексан:ацетон. Чистый O-сукцинимид (7,5 г, 14,5 ммоль) затем переносили в 500 мл аппарат Парра для гидрирования и дебензилировали, используя 0,95 г Pd(OH)2/C в 75 мл EtOH. Раствор, который обрабатывали при довлении 19 фунт на кв. дюйм водородом в течение 24 час, затем фильтровали и концентрировали, получая твердый остаток, который перекристаллизовывали из EtOH с получением 3,25 г твердого продукта белого цвета.
Промежуточные O-сукцинимидил пиранозы, представленные в таблице 2 (соединения E-23 через E-29), получали способами, описанными ранее и проиллюстрированными в примерах 5 и 6.
Пример получения промежуточной 2-гидроксиламино пиранозы исходя из соответствующего промежуточной O-сукцинимидоил пиранозы описан далее.
Пример 7
Получение O-((2S,3R,4R,5S,6S)-3,4,5-триметокси-6-метилтетрагидропиран-2-ил)гидроксиламина (соединение E-30)
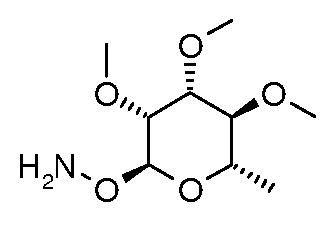
Производное 2,3,4-три-O-метил-N-сукцинимидил рамнозы E-23 (0,50 г, 1,6 ммоль), полученное, как описано в примере 5, растворяли в 5 мл абсолютного EtOH и обрабатывали избытком гидразингидрата (0,4 г, 8 ммоль). Раствор оставляли перемешиваться при комнатной температуре в течение 60 мин, при этом образовывался объемный осадок белого цвета. Добавляли еще 5 мл EtOH и раствор перемешивали при комнатной температуре в течение ночи. Раствор фильтровали и концентрировали, затем очищали с помощью хроматографии (100% EtOAc) с получением E-30 в виде кристаллического твердого продукта.
Промежуточные пиранозы, представленные в таблице 3 (соединения E-30 через E-38), получали способами, описанными ранее и проиллюстрироваными в примере 7.
Примеры 8-63 иллюстрируют получение дополнительных веществ, которые могут быть использованы при различных вариантах осуществления данного изобретения.
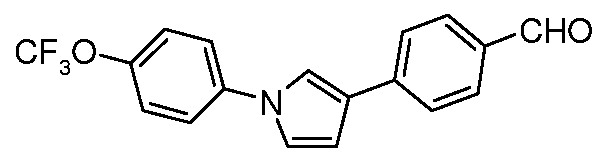
Пример 8
Получение 4-[1-(4-трифторметоксифенил)-1H-пиррол-3-ил]бензальдегида
Стадия 1. 1-(4-Трифторметоксифенил)-1H-пиррол. Соединение получали, как описано в работе Colotta et al. J. Med. Chem. 2006, 49, 6015. Раствор 4-трифторметоксифениламина (500 мг, 2,82 ммоль, 1,00 экв.) и 2,5-диэтокситетрагидрофурана (452 мг, 2,82 ммоль, 1,00 экв.) в ледяной уксусной кислоте (20 мл) нагревали при температуре 90°C в течение 1 час, затем сушили на силикагеле. Остаток затем переводили во взвесь путем кипячения с обратным холодильником в гексане, фильтровали горячим и концентрировали досуха, получая желаемое промежуточное соединение (519 мг, 81%).
Стадия 2. 3-Бром-1-(4-трифторметоксифенил)-1H-пиррол. Соединение получали, как описано в работе Bray et al. J. Org. Chem. 1990, 55, 6317. К раствору 1-(4-трифторметоксифенил)-1H-пиррола (519 мг, 2,29 ммоль, 1,00 экв.) в ТГФ (250 мл) при температуре -78°C добавляли 0,05M раствор N-бромсукцинимида (408 мг, 2,29 ммоль, 1,00 экв.) в ТГФ в течение 45 мин. Сосуд медленно нагревали до комнатной температуры, затем концентрировали с получением сырого бромпиррола, который показывал с помощью GC/MS содержание желаемого промежуточного соединения как 55%. Продукт использовали в последующей реакции без дополнительной очистки.
Стадия 3. 4-[1-(4-Трифторметоксифенил)-1H-пиррол-3-ил]бензальдегид. Суспензию сырого 3-бром-1-(4-трифторметоксифенил)-1H-пиррола (356 мг, 1,26 ммоль, 1,00 экв.), 4-формилфенилбороновой кислоты (283 мг, 1,89 ммоль, 1,50 экв.), дихлорида бис(трифенилфосфин)палладия(II) (27 мг, 0,04 ммоль, 0,03 экв.), 2M Na2CO3 (водн.) (1,26 мл, 2,52 ммоль, 2,0 экв.) и 1,4-диоксана (5 мл) нагревали при температуре 150°C в сосуде для микроволнового облучения в течение 45 мин. Охлажденный раствор затем разбавляли EtOAc (20 мл), фильтровали через Celite®, концентрировали досуха и очищали с помощью хроматографии (2:2:1, гексан:EtOAc:ацетон) с получением желаемого промежуточного соединения (79 мг, 21%).
Пример 9
Получение 4-[1-(4-трифторметоксифенил)-4,5-дигидро-1H-пиразол-3-ил]бензальдегида
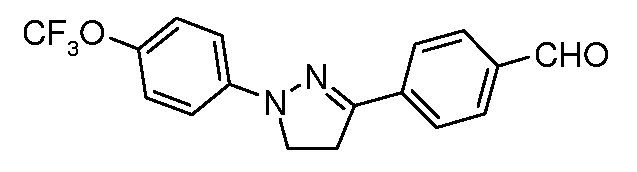
Стадия 1. 1-(4-Трифторметоксифенил)пиразолидин-3-он. Соединение получали, как описано в работе Rees and Tsoi Chem. Commun. 2000, 415. Суспензию гидрохлорида (4-трифторметоксифенил)гидразина (300 мг, 1,32 ммоль, 1,00 экв.), 3-хлорпропионилхлорида (167 мг, 1,32 ммоль, 1,00 экв.) и PS-DIEA (1,30 г, 5,28 ммоль, 4,00 экв.) в ТГФ (20 мл) перемешивали при комнатной температуре в течение 12 час. Раствор затем фильтровали, концентрировали досуха и очищали с помощью хроматографии (2:2:1, гексан:EtOAc:ацетон) с получением желаемого промежуточного соединения (120 мг, 37%).
Стадия 2. 3-Хлор-1-(4-трифторметоксифенил)-4,5-дигидро-1H-пиразол. Воспользовались общим способом, описанным в работе Wang et al. Tetrahedron Lett. 2005, 46, 2631. К раствору 1-(4-трифторметоксифенил)пиразолидин-3-она (120 мг, 0,49 ммоль, 1,00 экв.) в толуоле (20 мл) медленно добавляли фосфорилхлорид (22,5 мг, 1,47 ммоль, 3,00 экв.). Смесь затем нагревали при температуре 80°C в течение 1 час, далее охлаждали до комнатной температуры и гасили с помощью H2O (10 мл). Сосуд перемешивали в атмосфере N2 в течение 8 час, затем продукт экстрагировали EtOAc (200 мл), сушили (MgSO4) и концентрировали при пониженном давлении. Анализ GC/MS показывал 88%-ное образование желаемого промежуточного соединения, которое использовали в последующих реакциях без дополнительной очистки.
Стадия 3. 4-[1-(4-Трифторметоксифенил)-4,5-дигидро-1H-пиразол-3-ил]бензальдегид. Суспензию 3-хлор-1-(4-трифторметоксифенил)-4,5-дигидро-1H-пиразола (114 мг, 0,43 ммоль, 1,00 экв.), 4-формилфенилбороновой кислоты (97 мг, 0,65 ммоль, 1,50 экв.), дихлорида бис(трифенилфосфин)палладия(II) (10 мг, 0,01 ммоль, 0,03 экв.), 2M Na2CO3 (водн.) (0,43 мл, 0,86 ммоль, 2,0 экв.) и 1,4-диоксана (5 мл) нагревали при температуре 150°C в сосуде для микроволнового облучения в течение 45 мин. Охлажденный раствор затем разбавляли EtOAc (20 мл), фильтровали через Celite®, концентрировали досуха и очищали с помощью хроматографии (2:2:1, гексан:EtOAc:ацетон) с получением желаемого промежуточного соединения (50 мг, 0,15 ммоль, 31%).
Пример 10
Получение 4-[1-(5-бром-2-хлорфенил)-1H-имидазол-4-ил]бензальдегида
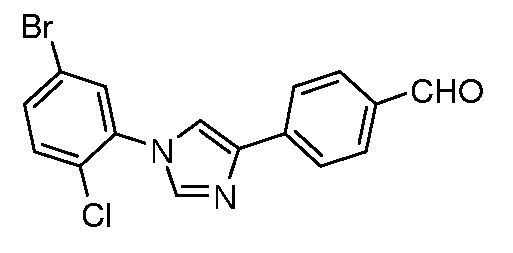
Стадия 1. 4-[1-(5-Бром-2-хлорфенил)-1H-имидазол-4-ил]бензонитрил. Соединение получали, как описано в работе Liu et al. J. Org. Chem. 2005, 70, 10135. 4-(1H-Имидазол-4-ил)бензонитрил (75 мг, 0,44 ммоль, полученный исходя из 4-(2-бромацетил)бензонитрила, используя способ, описанный Lynch et al. J. Am. Chem. Soc. 1994, 116, 11030), 4-бром-1-хлор-2-иодбензол (169 мг, 0,532 ммоль), Cs2CO3 (577 мг, 1,77 ммоль), CuI (3 мг, 0,013 ммоль), 8-гидроксихинолин (2 мг, 0,013 ммоль) и ДМФ/H2O (2 мл раствора 10:1) объединяли в 10 мл сосуде для микроволнового облучения (CEM Microwave), снабженном магнитной мешалкой, и подвергали микроволновому облучению при температуре 150°C в течение 30 мин. Содержимое затем фильтровали и концентрировали досуха, получая промежуточное соединение 5-бром-2-хлорфенил)-1H-имидазол-4-ил]бензонитрил (68 мг, 43%).
Стадия 2. 4-[1-(5-Бром-2-хлорфенил)-1H-имидазол-4-ил]бензальдегид. К суспензии нитрила (68 мг, 0,19 ммоль) в DCM (3 мл) при температуре -78°C медленно добавляли гидрид диизобутилалюминия (DIBAL) в толуоле (0,48 мл, 0,475 ммоль). Ледяную баню затем убирали и температуре давали подняться до 0-10°C и ее поддерживали в течение 2 час. Содержимое опять охлаждали до -78°C и медленно подкисляли (pH 6) с помощью 1 н. HCl (водн.). Колбу нагревали до температуры окружающей среды в течение ночи, затем удаляли оставшиеся соли алюминия путем фильтрования. Фильтрат затем промывали H2O (5 мл), насыщенным солевым раствором (5 мл), сушили (Mg2 SO4) и концентрировали досуха, получая промежуточное соединение 1-(5-бром-2-хлорфенил)-1H-имидазол-4-ил]бензальдегид (33 мг, 48%).
Пример 11
Получение 4-[5-(4-пропилфенил)изоксазол-3-ил]бензальдегида
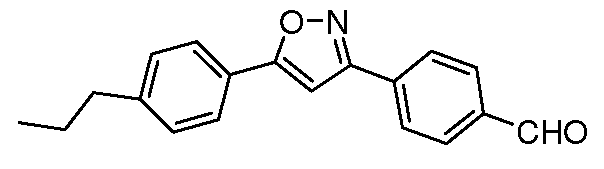
Стадия 1. 4-(гидроксииминометил)бензонитрил. Соединение получали, как описано в работе Biasotti et al. Bioorg. Med. Chem. 2003, 11, 2247. Суспензию 4-формилбензонитрила (500 мг, 3,81 ммоль, 1,00 экв.), гидрохлорида гидроксиламина (290 мг, 4,19 ммоль, 1,10 экв.) и ацетата натрия (1,56 г, 19,05 ммоль, 5,00 экв.) в MeOH (50 мл) нагревали при температуре 70°C в течение 4 час, затем концентрировали досуха. Остаток затем переводили во взвесь в Et2O, фильтровали и концентрировали с получением желаемого промежуточного соединения (496 мг, 3,39 ммоль, 89%).
Стадия 2. 4-(Гидроксииминобромметил)бензонитрил. Соединение получали, как описано в работе Tanaka et al. Bull. Chem. Soc. Jpn. 1984, 57, 2184. 0,05M раствор N-бромсукцинимида (724 мг, 4,07 ммоль, 1,20 экв.) в DCM добавляли по каплям к охлажденному до 0°C раствору 4-(гидроксииминометил)бензонитрила (496 мг, 3,39 ммоль, 1,00 экв.) в DCM (50 мл). Раствор нагревали до комнатной температуры, затем в равных объемах распределяли в два различных реакционных сосуда. Каждый сосуд затем концентрировали и сырые остатки использовали без дополнительной очистки.
Стадия 3. 4-[5-(4-Пропилфенил)изоксазол-3-ил]бензонитрил. Раствор 4-(гидроксииминобромметил)бензонитрила (381 мг, 1,70 ммоль), триэтиламина (0,71 мл, 5,10 ммоль, 3,0 экв.) и 1-этинил-4-пропилбензола (1,23 г, 8,50 ммоль, 5,0 экв.) в толуоле (20 мл) нагревали при температуре 100°C в течение 1 час, затем концентрировали досуха и очищали посредством обычной фазовой хроматографии с получением желаемого промежуточного соединения (108 мг, 22%). Восстановление нитрила до соответствующего альдегида осуществляли в соответствии со способом, использующим DIBAL, описанным ранее.
Пример 12
Получение 4-{1-[4-(1-гидроксипропил)фенил]-1H-пиразол-3-ил}бензальдегида
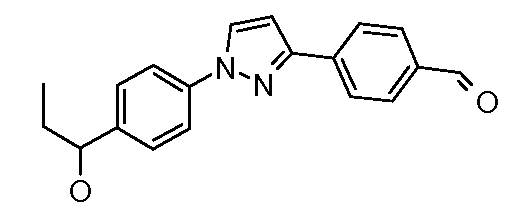
Стадия 1. 3-(4-Цианофенил)пиразол. В круглодонную колбу, снабженную механической мешалкой и обратным холодильником, добавляли п-цианоацетофенон (5 г, 34,44 ммоль) и диметилацеталь диметилформамида (40 мл). Смесь перемешивали при кипячении с обратным холодильником в течение 5 час, затем концентрировали при пониженном давлении, что давало сырой промежуточный диметиламиноакрилоилбензонитрил. Остаток затем суспендировали в минимальном объеме EtOH (~20 мл), добавляли моногидрат гидразина (1,67 мл, 34,4 ммоль) и нагревали при температуре 80°C в течение 30 мин, затем концентрировали с получением сырого 3-(4-цианофенил)пиразола (5,59 г, 33 ммоль, 96%), степень чистоты которого была достаточна для использования в последующей реакции.
Стадия 2. 4-[1-(4-Пропионилфенил)-1H-пиразол-3-ил]бензонитрил. 4-(1H-Пиразол-3-ил)бензонитрил (100 мг, 0,591 ммоль), 1-(4-бромфенил)-пропан-1-он (126 мг, 0,591 ммоль), Cs2CO3 (770 мг, 2,364 ммоль), CuI (4 мг, 0,018 ммоль), 8-гидроксихинолин (3 мг, 0,018 ммоль) и ДМФ/H2O (2 мл 10:1 раствор) объединяли в 10 мл сосуде для микроволнового облучения (CEM Microwave), снабженном магнитной мешалкой, и подвергали микроволновому облучению при температуре 150°C в течение 30 мин. Содержимое затем фильтровали и концентрировали досуха, получая нитрил (158 мг, 0,508 ммоль, 86%). Восстановление нитрила до соответствующего альдегида осуществляли в соответствии со способом, использующим DIBAL, описанным ранее.
Пример 13
Получение диэтилового эфира 5-(4-формилфенил)-2-(4-трифторметоксифенил)-3,4-дигидро-2H-пиразол-3,4-дикарбоновой кислоты
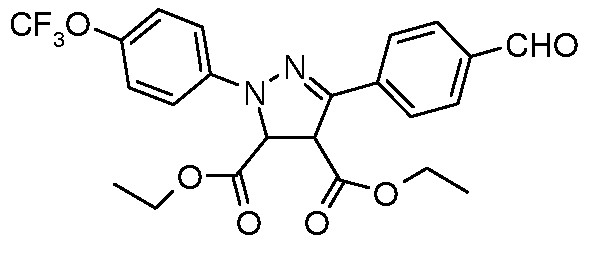
Стадия 1. Получение 4-[(4-трифторметоксифенил)гидразонометил]бензальдегида. Соединение получали, как описано в работе Paulvannan et al. Tetrahedron. 2000, 56, 8071. К перемешиваемому раствору бензол-1,4-дикарбальдегида (1,50 г, 11,2 ммоль, 1,0 экв.) в изо-PrOH (250 мл) добавляли гидрохлорид 4-трифторметокси)фенилгидразина (2,55 г, 11,2 ммоль, 1,0 экв.) по частям в течение 5 мин. Раствор перемешивали при комнатной температуре в течение 1 час, затем концентрировали досуха и очищали с помощью хроматографии (2:2:1, гексан:EtOAc:ацетон) с получением промежуточного соединения (2,48 г, 72%).
Стадия 2. Синтез хлоргидразона. Промежуточное соединение получали, как описано в работе Lokanatha Rai and Hassner Synth. Commun. 1989, 19, 2799. Раствор 4-[(4-трифторметоксифенил)гидразонометил]бензальдегида (2,48 г, 8,05 ммоль, 1,00 экв.) и N-хлорсукцинимида (1,61 г, 12,08 ммоль, 1,5 экв.) в изо-PrOH (100 мл) нагревали при температуре 80°C в течение 1 час. Раствор затем охлаждали и в равных объемах распределяли в шесть различных реакционных сосудов так, чтобы каждый содержал 1,34 ммоль промежуточного соединения.
Стадия 3. Синтез пиразолина. Соединения получали в соответствии со способом, описанным Paulvannan et al. Tetrahedron 2000, 56, 8071. В каждый реакционный сосуд добавляли триэтиламин (0,56 мл, 4,02 ммоль, 3,00 экв.) и соответствующий акрилат (6,70 ммоль, 5,00 экв.). Сосуды затем нагревали при температуре 70°C в течение 90 мин, затем концентрировали досуха и очищали с помощью хроматографии (2:2:1, гексан:EtOAc:ацетон). Восстановление нитрилов до соответствующих альдегидов осуществляли в соответствии со способом, использующим DIBAL, описанным ранее.
Пример 14
Получение 4-{1-[4-(2,2,2-трифторэтокси)фенил]-1H-имидазол-4-ил}бензальдегида
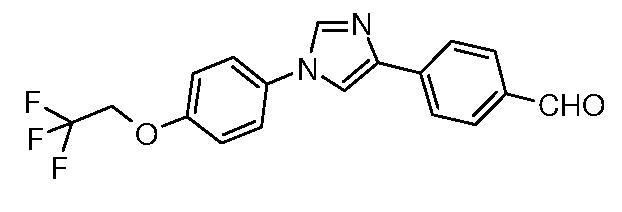
4-(2-Бромацетил)бензонитрил (58 мг, 0,21 ммоль) и 4-(2,2,2-трифторэтокси)фениламин (50 мг, 0,21 ммоль) объединяли в 100 мл сосуде Эрленмейера, снабженном магнитной мешалкой. Содержимое растворяли в 1 мл EtOH и перемешивали при комнатной температуре в течение 2 час. Сырой промежуточный продукт затем переносили в 100 мл-овую круглодонную колбу, содержащую KSCN (21 мг, 0,21 ммоль) и концентрированную HCl (18 мкл, 0,21 ммоль). Сосуд нагревали при температуре 80°C в течение 1 час, затем его содержимое выливали в 5 мл раствора 1:1 H2O/NH4OH. Раствор оставляли стоять в течение 24 час и затем твердый продукт фильтровали и промывали эфиром с получением промежуточного имидазолтиола (32 мг, 0,086 ммоль, 33%). Затем к суспензии имидазолтиола в 2 мл уксусной кислоты добавляли по каплям в течение 10 мин водный раствор HNO3 (1,35 мл, 0,387 ммоль) и KNO3 (1 мг, 0,003 ммоль). После перемешивания в течение 2 час при комнатной температуре раствор выливали на измельченный лед и нейтрализовали (pH 7) с помощью 0,1 н. NaOH (водн.). Промежуточный нитрил выделяли путем вакуумной фильтрации и сушили в вакуумной печи при 45°C в течение 12 час (23 мг, 78%), т.пл. 179°C. Восстановление до соответствующего альдегида осуществляли, используя DIBAL, в условиях, описанных выше.
Пример 15
Получение 4-[1-(4-пропилфенил)-1H-имидазол-4-ил]бензальдегида
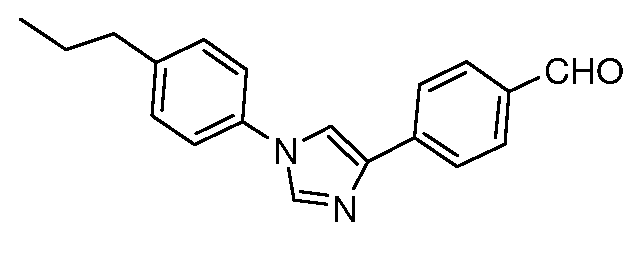
4-Пропиланилин (2,70 г, 20 ммоль) добавляли по каплям к раствору 4-цианофенацилбромида (2,20 г, 10 ммоль) в 5 мл ДМФ. Этот раствор затем добавляли к 20 мл горячего (180°C) формамидного раствора в течение 5 мин и этот раствор оставляли перемешиваться при температуре 180°C в течение 2 час. Охлажденный раствор затем выливали на 100 мл льда и экстрагировали с помощью 2×75 мл эфира. После высушивания и концентрирования полученное темное масло очищали с помощью хроматографии (3:1:2 гексан:EtOAc:DCM). Первый продукт (510 мг) был идентифицирован как 4-(5-пропил-1H-индол-3-ил)бензонитрил, т.пл. 140°C. Вторая фракция (275 мг) была идентифицирована как желаемый имидазол. 1H ЯМР (400 МГц, CDCl3) δ 7,95 (д, J=6 Гц, 2H), 7,90 (с, 1H), 7,70 (д, J=6 Гц, 2H), 7,68 (с, 1H), 7,38 (д, J=4 Гц, 2H), 7,31 (д, J=4 Гц, 2H), 2,69 (т, J=8,9 Гц, 2H), 1,68 (м, 2H), 0,98 (т, J=7,5 Гц, 3H); т.пл. 133°C; ESIMS 288,1 (M+H).
Восстановление до соответствующего альдегида осуществляли, используя DIBAL, в условиях, описанных выше. 1H ЯМР (300 МГц, CDCl3) δ 10,02 (с, 1H), 8,03 (д, J=6 Гц, 2H), 7,92 (д, J=6 Гц, 2H), 7,90 (с, 1H), 7,72 (с, 1H), 7,38 (д, J=4 Гц, 2H), 7,31 (д, J=4 Гц, 2H), 2,69 (т, J=8,9 Гц, 2H), 1,68 (м, 2H), 0,98 (т, J=7,5 Гц, 3H); ESIMS 291,1 (M+H); т.пл. 97°C.
Пример 16
Получение 4-[1-(4-трифторметоксифенил)-1H-имидазол-4-ил]бензальдегида
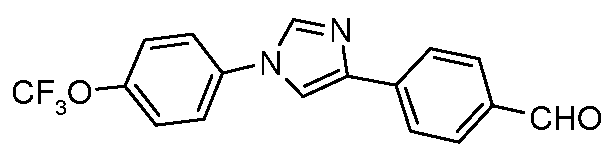
4-Трифторметоксианилин (2,20 г, 12,4 ммоль) добавляли по каплям к раствору 4-цианофенацилбромида (1,50 г, 6,7 ммоль) в 5 мл ДМФ. Этот раствор затем добавляли к 20 мл горячего (180 oC) формамидного раствора в течение 5 мин и этот раствор оставляли перемешиваться при температуре 180°C в течение 2 час. Охлажденный раствор затем выливали на 100 мл льда и экстрагировали с помощью 2×75 мл эфира. После высушивания и концентрирования полученный полутвердый продукт кристаллизовали из MeOH/H2O. Вторая перекристаллизация из смеси MeOH/H2O позволяла удалить следы примеси форманилида и давала 200 мг чистого продукта, т.пл. 155°C. Анал. Вычисл. для C17H10F3N3O: C, 62,01; H, 3,06; N, 12,76. Найдено: C. 61,53; H, 3,13; N, 12,55. Восстановление до соответствующего альдегида осуществляли, используя DIBAL, в условиях, описанных выше. 1H ЯМР (300 МГц, CDCl3) δ 10,0 (с, 1H), 8,05-7,90 (м, 5H), 7,70 (с, 1H), 7,50 (д, J=6 Гц, 2H), 7,42 (д, J=6 Гц, 2H); МС 333,0 (M+H); т.пл. 112°C.
Пример 17
Получение 4-[1-(4-трифторметоксифенил)-1H-имидазол-4-ил]бензойной кислоты
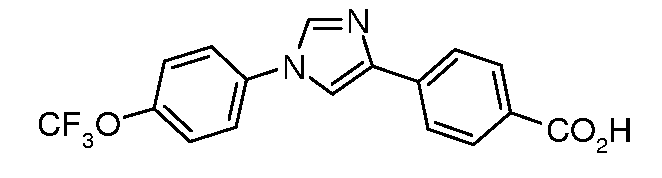
Раствор нитрила (1,1 г, 3,3 ммоль) в EtOH (5 мл) и воде (2 мл) обрабатывали 1 г NaOH (20 ммоль), и раствор нагревали при кипячении с обратным холодильником в течение 6 час. Его затем охлаждали и подкисляли с помощью 1 н. HCl и полученный твердый продукт белого цвета фильтровали и сушили на воздухе с получением 1,1 г кислоты в виде твердого продукта светло-серого цвета.
1H ЯМР (400 МГц, CDCl3) δ 11,4 (с, 1H), 7,90 (д, J=6,4 Гц, 2H), 7,89 (с, 1H), 7,80 (д, J=8,6 Гц, 2H), 7,63 (д, J=1,3 Гц, 1H), 7,49 (д, J=9,3 Гц, 2H), 7,38 (д, J=8,9 Гц, 2H); т.пл. 230°C.
Пример 18
Получение 4-[4-(4-трифторметилфенил)-1H-имидазол-1-ил]бензальдегида
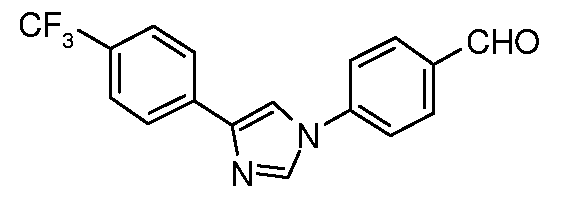
4-Трифторметилфенил имидазол (4,0 г, 19 ммоль), 4-фторбензонитрил (1,2 г, 8,5 ммоль) и карбонат калия (1,5 г, 10,9 ммоль) объединяли в 15 мл ДМСО и нагревали при температуре 100°C в течение 6 час. Охлажденный раствор затем выливали в 100 мл воды и полученный твердый продукт фильтровали и сушили на воздухе с получением 4,65 г имидазолнитрила в виде твердого продукта белого цвета: т.пл. 252°C; 1H ЯМР (300 МГц, CDCl3) δ 8,05 (с, 1H), 7,95 (д, J=8 Гц, 2H), 7,85 (д, 2H), 7,72 (с, 1H), 7,72 (д, J=8 Гц, 2H), 7,62 (д, J=8 Гц, 2H); MC 314,1 (M+H). Анал. Вычисл. для C16H10F3N3O2: C, 65,18; H, 3,22; N, 13,41. Найдено: C, 64,49; H, 3,23; N, 13,08. Часть нитрила (3,8 г) подвергали восстановлению в присутствии DIBAL в условиях, описанных выше, с получением 2,41 г соответствующего альдегида. 1H ЯМР (300 МГц, CDCl3) δ 10,1 (с, 1H), 8,10 (д, J=8 Гц, 2H), 8,05 (с, 1H), 7,95 (д, J=8 Гц, 2H), 7,75 (с, 1H), 7,7 (м, 4H); МС 317,1 (M+H); т.пл. 141°C.
Пример 19
Получение 4-бром-1-(4-трифторметоксифенил)-1H-имидазола
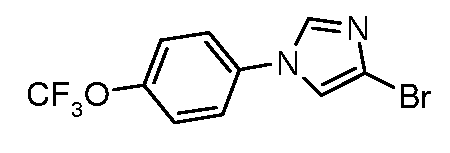
В круглодонную колбу помещали 4-бромимидазол (1,15 г, 7,81 ммоль), CuI (0,07 г, 0,36 ммоль), 8-гидроксихинолин (0,05 г, 0,36 ммоль), карбонат цезия (3,39 г, 10,4 ммоль) и 4-трифторметоксииодбензол (1,50 г, 5,21 ммоль). В реакционную смесь добавляли смесь 10:1 ДМФ (15 мл) и H2O (1,5 мл) и раствор нагревали до температуры 130°C в течение 4 час. Реакционную смесь затем разбавляли EtOAc и промывали последовательно водой, хлоридом аммония (насыщенный), водой и бикарбонатом натрия. Органические продукты сушили над MgSO4, фильтровали и очищали на колонке с обращенной фазой с получением 820 мг имидазола в виде твердого продукта белого цвета. МС 308,0 (M+H); т.пл. 139-141°C.
Пример 20
Получение 4-метокси-2-[1-(4-трифторметоксифенил)-1H-имидазол-4-ил]бензальдегида
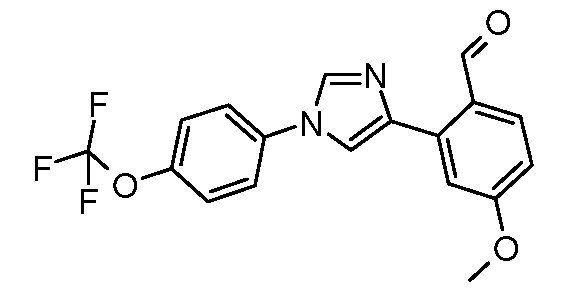
4-Бром-1-(4-трифторметоксифенил)-1H-имидазол (100 мг, 0,326 ммоль), 2-формил-5-метоксифенилборную кислоту (73 мг, 0,41 ммоль), дихлорид бис(трифенилфосфин)палладия (2 мг, 0,003 ммоль), бикарбонат натрия (49 мг, 0,59 ммоль) и смесь 1:1 DME/H2O (8:8 мл) объединяли и добавляли в сосуд для микроволнового облучения. Реакционную смесь нагревали при микроволновом облучении при перемешивании при температуре 100°C в течение 12 мин. При микроволновом облучении требовалось 5 мин, чтобы достичь 100°C, затем выдерживали при температуре 100°C в течение 12 мин и затем охлаждали. Данные ТСХ (1:1 EtOAc:циклогексан) показывали наличие исходных продуктов, поэтому образец нагревали до температуры 100°C в течение еще 8 мин. При охлаждении образовывался осадок; его фильтровали и промывали водой с получением 86 мг твердого продукта серого цвета. ESIMS 363,0 (M+H).
Представленный далее промежуточный продукт также был получен, используя данный способ:
Пример 21
Получение 2-фтор-4-[1-(4-трифторметоксифенил)-1H-имидазол-4-ил]бензальдегида
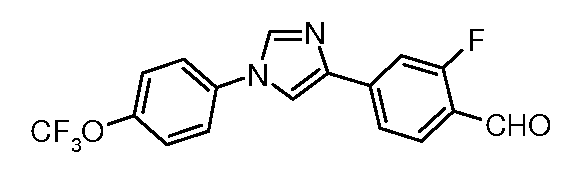
ESIMS 351,0 (M+H).
Пример 22
Получение 1-{4-фтор-3-[1-(4-трифторметоксифенил)-1H-имидазол-4-ил]фенил}этанона
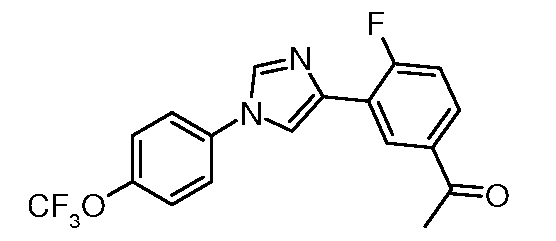
4-Бром-1-(4-трифторметоксифенил)-1H-имидазол (200 мг, 0,651 ммоль), 5-ацетил-2-фторфенилборную кислоту (178 мг, 0,977 ммоль), тетракис(трифенилфосфин)палладий(0) (7 мг, 0,007 ммоль), 2 н. водный раствор карбоната калия (0,651 мл) и диоксан (8 мл) объединяли и добавляли в сосуд для микроволнового облучения. Реакционную смесь нагревали при микроволновом облучении при перемешивании при температуре 150° C в течение 20 мин. Данные LC-MS указывали на 88% ожидаемого продукта; данные ТСХ (1:1 гексаны:EtOAc) указывали на присутствие исходного продукта и 3 других продуктов. В реакционную смесь добавляли EtOAc и воду. Водный слой экстрагировали с помощью EtOAc и органические экстракты промывали насыщенным солевым раствором, сушили над MgSO4 и концентрировали в вакууме. Сырой продукт очищали с помощью хроматографии с градиентным элюированием (от 100% гексана до 100% EtOAc) с получением 90 мг твердого продукта не совсем белого цвета. ESIMS 265,0 (M+H); т.пл. 129°C.
Пример 23
Получение 4-[1-(4-трифторметоксифенил)-1H-[1,2,4]триазол-3-ил]бензальдегида
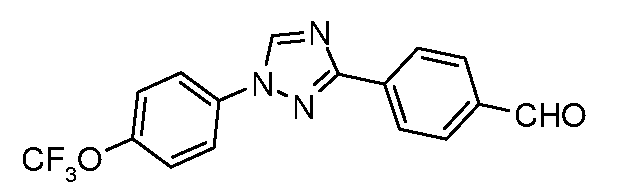
Стадия 1. 4-(1H-[1,2,4]триазол-3-ил)бензонитрил. Для получения 3-(4-нитрофенил)-1H-[1,2,4]триазола использовали общий способ, описанный в работе Lin et. al. (J. Org. Chem. 1979, 44, 4163). 4-Цианобензамид (21,63 г, 0,148 моль) растворяли в ДМФ-DMA (100 мл) и перемешивали при кипячении с обратным холодильником в атмосфере N2 в течение 8 час. Смесь концентрировали досуха и суспендировали в 50 мл AcOH. В сосуд затем загружали моногидрат гидразина (7,18 мл, 0,148 ммоль) и перемешивали при кипячении с обратным холодильником в течение 1 часа, затем концентрировали. Желаемый 4-(1H-[1,2,4]триазол-3-ил)бензонитрил получали с 98%-ной чистотой путем растирания в Et2O и далее путем фильтрования (12,17 г, 0,072 мол, 48%).
Стадия 2. 4-[1-(4-Трифторметоксифенил)-1H-[1,2,4]триазол-3-ил]бензонитрил. Триазол (70 мг, 0,41 ммоль), 1-иод-4-трифторметоксибензол (142 мг, 0,493 ммоль), Cs2CO3 (535 мг, 1,644 ммоль), CuI (3 мг, 0,012 ммоль), 8-гидроксихинолин (2 мг, 0,012 ммоль) и ДМФ/H2O (2 мл 10:1 раствор) объединяли в 10 мл сосуде для микроволнового облучения (CEM Microwave), снабженном магнитной мешалкой, и подвергали микроволновому облучению при температуре 150°C в течение 30 мин. Содержимое затем фильтровали и концентрировали досуха, получая промежуточный продукт, 1,3-дифенил триазол (18 мг, 13%).
Стадия 3. 4-[1-(4-Трифторметоксифенил)-1H-[1,2,4]триазол-3-ил]бензальдегид. Нитрил подвергали восстановлению в присутствии DIBAL в условиях, описанных выше. 1H ЯМР (300 МГц, CDCl3) δ 10,1 (с, 1H), 8,61 (с, 1H), 8,37 (д, J=9 Гц, 2H), 8,0 (д, J=8,4 Гц, 2H), 7,8 (д, J=9 Гц, 2H), 7,4 (д, J=8,4 Гц, 2H); ESIMS 334,2 (M+H); т.пл. 137-140°C.
Пример 24
Получение 4-[1-(4-пентафторэтилсульфанилфенил)-1H-[1,2,4]триазол-3-ил]бензальдегида
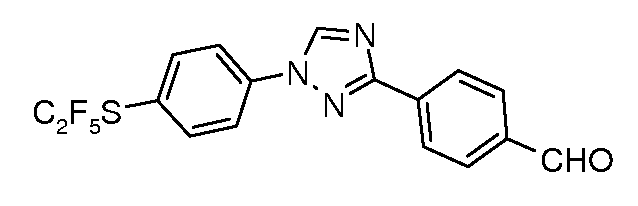
Стадия 1. 1-Бром-4-пентафторэтилсульфанилбензол. Указанное в заголовке соединение получали, используя условия перфторалкилирования согласно описанным в работе Popov et. al. J. Fluorine Chem. 1982, 21, 365. В раствор 4-бромбензолтиола (500 мг, 2,64 ммоль, 1,00 экв.) и хлорида триэтилбензиламмония (60 мг, 0,26 ммоль, 0,10 экв.) в 10 мл 1:1 Et2O/NaOH (25% водн.) при температуре 0°C барботировали газообразный 1,1,1,2,2-пентафтор-2-иодэтан в течение 30 мин (>5 экв.). В течение указанного времени УФ-лампа была направлена на реакционный сосуд, при этом температура поддерживалась ниже 10°C путем подставления и удаления ледяной бани. Содержимое затем нагревали до комнатной температуры, экстрагировали Et2O (300 мл), сушили (MgSO4) и концентрировали при пониженном давлении. Часть данного сырого продукт использовали в последующих реакциях без дополнительной очистки (200 мг остаток: 120 мг продукт, 0,39 ммоль, 1,2 экв.).
Стадия 2. 4-[1-(4-Пентафторэтилсульфанилфенил)-1H-[1,2,4]триазол-3-ил]бензонитрил. Конденсация с 4-(1H-[1,2,4]триазол-3-ил)бензонитрилом, как описано выше, давала 4-[1-(4-пентафторэтилсульфанилфенил)-1H-[1,2,4]триазол-3-ил]бензонитрил: 70 мг, 46%. Восстановление с DIBAL, как описано выше, давало соответствующий альдегид.
Пример 25
Получение 4-[1-(4-пентафторэтилоксифенил)-1H-[1,2,4]триазол-3-ил]бензальдегида
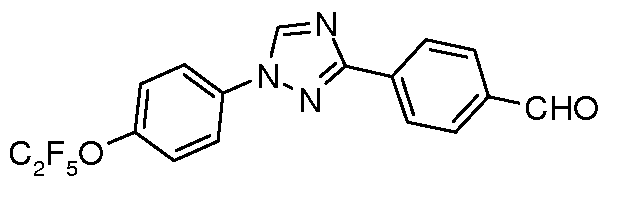
Стадия 1. Раствор 3-п-толил-1H-[1,2,4]триазола (4,85 г, 30,5 ммоль), 4-бромфенилового пентафторэтилового эфира (10,0 г, 34,4 ммоль), Cs2CO3 (25 г, 77 ммоль), CuI (1,25 г, 6,5 ммоль) и 8-гидроксихинолина (0,35 г, 2,4 ммоль) в 50 мл смеси 9:1 ДМФ/H2O энергично перемешивали и нагревали до температуры 130°C (внутренняя температура) в течение 20 час. Раствор затем охлаждали, выливали в воду и подкисляли с помощью 2 н. HCl до pH 2. Затем добавляли эфир (250 мл) и раствор встряхивали и фильтровали, затем слои разделяли. Органический слой сушили и концентрировали и полученный смолистый твердый продукт нагревали со 100 мл гексана. Горячий гексановый слой декантировали от нерастворенного остатка, полученный раствор охлаждали до 0°C и выпавший в осадок твердый продукт фильтровали и сушили на воздухе с получением 7,0 г (61% в расчете на исходный триазол) 1-(4-пентафторэтилоксифенил)-3-п-толил-1H-[1,2,4]триазола в виде твердого продукта не совсем белого цвета, т.пл. 130-132°C; ESIMS 370,8 (M+H).
Стадия 2. Продукт со стадии 1 (7,0 г, 18,7 ммоль) растворяли в 200 мл ацетонитрила и перемешивали при комнатной температуре при этом частями в течение 10 мин добавляли нитрат церия(IV) аммония (32 г, 58 ммоль) в 60 мл воды. Раствор затем нагревали при кипячении с обратным холодильником в течение 4 час, охлаждали и разбавляли 200 мл воды. Раствор экстрагировали с помощью 2×200 мл эфира и объединенный органический слой сушили и концентрировали с получением масла оранжевого цвета. Продукт растворяли в 40 мл диоксана и обрабатывали раствором KOH (5 г, 90 ммоль) в 20 мл воды. Раствор нагревали при кипячении с обратным холодильником в течение 2 час, затем охлаждали и разбавляли 100 мл воды. Альдегид выпадал в осадок и его собирали путем фильтрования. Перекристаллизация из смеси MeOH/H2O давала чистый альдегид в виде твердого продукта белого цвета. 1H ЯМР (300 МГц, CDCl3) δ 10,1 (с, 1H), 8,65 (с, 1H), 8,40 (д, J=8,4 Гц, 2H), 8,0 (д, J=8,4 Гц, 2H), 7,85 (д, J=9 Гц, 2H), 7,45 (д, J=9 Гц, 2H); ESIMS 384,2 (M+H); т.пл. 137-144°C.
Пример 26
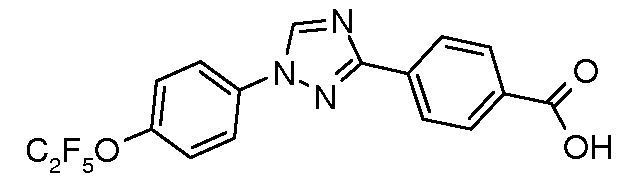
Получение 4-[1-(4-пентафторэтилоксифенил)-1H-[1,2,4]триазол-3-ил]бензойной кислоты
Раствор 4-[1-(4-пентафторэтилоксифенил)-1H-[1,2,4]триазол-3-ил]бензальдегида (1,7 г, 4,4 ммоль), бромата натрия (2,1 г, 13,9 ммоль) и бисульфата натрия (0,53 г, 4,5 ммоль) в 50 мл ацетонитрила нагревали при кипячении с обратным холодильником в течение 5 час, в процессе чего образовывался объемный осадок. Раствор затем охлаждали и выливали в 100 мл воды, фильтровали и сушили с получением 1,67 г кислоты в виде твердого продукта белого цвета. 1H ЯМР (300 МГц, CDCl3) δ 10,1 (с, 1H), 8,65 (с, 1H), 8,40 (д, J=8,4 Гц, 2H), 8,0 (д, J=8,4 Гц, 2H), 7,85 (д, J=9 Гц, 2H), 7,45 (д, J=9 Гц, 2H); ESIMS 399,2 (M+H+); т.пл. 225°C.
Пример 27
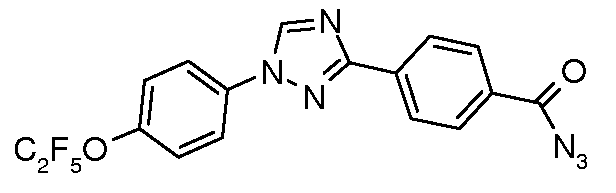
Получение 4-[1-(4-пентафторэтилоксифенил)-1H-[1,2,4]триазол-3-ил]бензоил азида
Раствор 4-[1-(4-пентафторэтилоксифенил)-1H-[1,2,4]триазол-3-ил]бензойной кислоты (1,67 г, 4,2 ммоль), дифенилфосфорил азида (1,26 г, 4,58 ммоль) и триэтиламина (0,5 г, 5 ммоль) в 10 мл сухого трет-BuOH нагревали до температуры 75°C в течение 90 мин, что приводило к растворению исходной кислоты и последующему выпадению в осадок азида. Охлажденный раствор затем выливали на 10 г льда и полученную смесь фильтровали и сушили с получением 0,80 г азида в виде твердого продукта белого цвета. 1H ЯМР (300 МГц, CDCl3) δ 10,1 (с, 1H), 8,65 (с, 1H), 8,40 (д, J=8,4 Гц, 2H), 8,0 (д, J=8,4 Гц, 2H), 7,85 (д, J=9 Гц, 2H), 7,45 (д, J=9 Гц, 2H); ESIMS 399,2 (M+H); т.пл. 175°C разл.
Пример 28
Получение 4-[1-(4-бутилфенил)-1H-[1,2,4]триазол-3-ил]бензальдегида

Стадия 1. 4-[1-(4-Бутилфенил)-1H-[1,2,4]триазол-3-ил]бензонитрил. Раствор 4-н-бутилфенилгидразина (1,0 г, 5 ммоль) и 4-цианобензальдегида (0,8 г, 6,0 ммоль) в 15 мл изо-PrOH нагревали на паровой бане в течение 2 час и затем охлаждали и разбавляли 5 мл воды. Полученный твердый продукт оранжевого цвета фильтровали и сушили на воздухе с получением 1,30 г гидразона в виде твердого продукта желтого цвета, т.пл. 107°C. Раствор полученного гидразона (1,1 г, 4,0 ммоль) и NCS (0,67 г, 5 ммоль) в 20 мл изо-PrOH перемешивали в атмосфере азота при комнатной температуре в течение 2 час, во время этого процесса первоначальный твердый продукт растворялся и образовывался новый твердый продукт. Полученный раствор оранжевого цвета затем обрабатывали тетразолом (0,45 г, 6,4 ммоль) и триэтиламином (960 мл, 7,0 ммоль). Раствор оранжево-коричневого цвета нагревали при температуре кипения с обратным холодильником в течение 2 час. Раствор затем охлаждали, разбавляли 25 мл воды, экстрагировали с помощью EtOAc, сушили, концентрировали и очищали с помощью хроматографии (Biotage, 4:1 Hex:EtOAc) с получением 0,42 г (35%) триазола в виде твердого продукта не совсем белого цвета. 1H ЯМР (300 МГц, CDCl3) δ 8,58 (с, 1H), 8,33 (д, J=8 Гц, 2H), 7,78 (д, J=8 Гц, 2H), 7,64 (д, J=8,2 Гц, 2H), 7,33 (д, J=8,2 Гц, 2H), 2,70 (т, J=7,8 Гц, 2H), 1,63 (м, 2H), 1,38 (м, 2H), 0,95 (т, J=7,5 Гц, 3H); ESIMS 303,1; т.пл. 124°C.
Стадия 2. 4-[1-(4-Бутилфенил)-1H-[1,2,4]триазол-3-ил]бензальдегид. Восстановление с помощью DIBAL, как описано ранее, давало соответствующий альдегид. 1H ЯМР (300 МГц, CDCl3) δ 10,08 (с, 1H), 8,58 (с, 1 H), 8,37 (д, J=8 Гц, 2H), 7,98 (д, J=8 Гц, 2H), 7,62 (д, J=8,2 Гц, 2H), 7,33 (д, J=8,2 Гц, 2H), 2,70 (т, J=7,8 Гц, 2H), 1,63 (м, 2H), 1,38 (м, 2H), 0,95 (т, J=7,5 Гц, 3H); ESIMS 306,1; т.пл. 124°C.
Пример 29
Получение 4-[1-(4-пентафторэтилфенил)-1H-[1,2,4]триазол-3-ил]бензальдегида
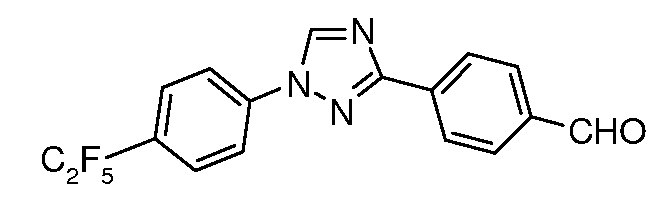
Стадия 1. 1-(4-Пентафторэтилфенил)-3-п-толил-1H-[1,2,4]триазол. Пентафторэтилиодид (521 мг, 2,12 ммоль) подвергали конденсации в сосуде, содержащем 1-бром-4-иодбензол (300 мг, 1,06 ммоль), порошок меди(0) (135 мг, 2,12 ммоль) и ДМСО (5 мл). Сосуд затем герметично закрывали и подвергали микроволновому облучению при температуре 150°C в течение 60 мин. Данные GC/MS подтверждали израсходование исходного продукта с получением двух промежуточных соединений, 1-бром-4-пентафторэтилбензола и 1-иод-4-пентафторэтилбензола. Смесь (1,06 ммоль) переносили в 250 мл круглодонную колбу и добавляли 3-п-толил-1H-[1,2,4]триазол (169 мг, 1,06 ммоль), Cs2CO3 (1,38 г, 4,24 ммоль), CuI (202 мг, 1,06 ммоль), 8-гидроксихинолин (2 мг, 0,011 ммоль) и ДМФ/H2O (12 мл 10:1 раствор), и раствор кипятили с обратным холодильником при температуре 160°C в течение 6 час. После окончания кипячения раствор охлаждали, содержимое выливали в H2O и оставляли высаживаться в течение 1 час. Осадок собирали вакуумной фильтрацией и сушили в течение ночи при 45°C в вакуумной печи. Сырой промежуточный продукт, 1-(4-пентафторэтилфенил)-3-п-толил-1H-[1,2,4]триазол, использовали на стадии 2 без дополнительной очистки.
Стадия 2. Окисление до альдегида. Нитрат аммония церия(IV) (3,32 г, 4,24 ммоль) и промежуточное соединение со стадии 1 объединяли в круглодонной колбе с ацетонитрилом и водой (20 мл, 1:1). Раствор перемешивали при кипячении с обратным холодильником при температуре 110°C в течение 4 час, получая смесь промежуточных соединений, 3-(4-нитрооксиметилфенил)-1-(4-пентафторэтилфенил)-1H-[1,2,4]триазола и 4-[1-(4-пентафторэтилфенил)-1H-[1,2,4]триазол-3-ил]бензальдегида. Ацетонитрил удаляли в вакууме, а осадки сырых промежуточных продуктов собирали путем фильтрования. Продукт затем объединяли с порошкообразным KOH (178 мг, 3,18 ммоль) в диоксане и воде (10 мл, 1:1) и перемешивали при кипячении с обратным холодильником при температуре 105°C в течение 90 мин, затем в вакууме удаляли диоксан, давая выпасть в осадок из воды промежуточному соединению. Промежуточный 4-[1-(4-пентафторэтилфенил)-1H-[1,2,4]триазол-3-ил]бензальдегид собирали путем фильтрования (35 мг, 0,095 ммоль, 9% всего из 4-толилтриазола).
Пример 30
Получение 4-[3-(4-формилфенил)-[1,2,4]триазол-1-ил]фенилового эфира трифторметансульфоновой кислоты
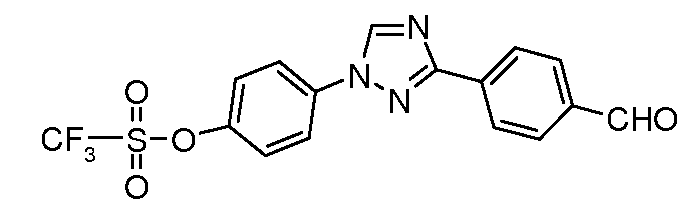
Стадия 1. 1-(4-Метоксифенил)-3-п-толил-1H-[1,2,4]триазол получали путем конденсации 3-п-толил-1H-[1,2,4]триазола с 4-иоданизолом в условиях, описанных для стадии 1 предыдущего примера. Этот продукт затем деметилировали, используя условия, описанные в работе Hitchcock et al. Synlett 2006, 2625. Трибромид бора (1M раствор в гексане; 1,67 мл, 1,67 ммоль) добавляли по каплям к раствору 1-(4-метоксифенил)-3-п-толил-1H-[1,2,4]триазола (300 мг, 1,28 ммоль) в DCM (10 мл) при температуре 0°C в атмосфере N2. После завершения добавления сосуд нагревали до температуры окружающей среды, затем кипятили с обратным холодильником при температуре 40°C в течение 6 час. Охлажденное содержимое затем гасили H2O, далее удаляли DCM и распределяли между EtOAc и водой. Органический слой собирали, промывали насыщенным солевым раствором, сушили (MgSO4), концентрировали и очищали с помощью хроматографии (3:1:1, гексаны:EtOAc:ацетон) с получением промежуточного 4-(3-п-толил-[1,2,4]триазол-1-ил)фенола (219 мг, 0,872 ммоль, 68%). Ангидрид трифторметансульфоновой кислоты (0,16 мл, 0,96 ммоль) добавляли по каплям к раствору фенола и 4-трет-бутил-2,6-диметилпиридина (142 мг, 0,872 ммоль) в DCM (10 мл) при температуре 0°C в атмосфере N2. Сосуд нагревали до температуры окружающей среды, затем растворитель удаляли при пониженном давлении и остаток очищали с помощью хроматографии (2:2:1, гексан:EtOAc:ацетон), получая промежуточный 4-(3-п-толил-[1,2,4]триазол-1-ил)фениловый эфир трифторметансульфоновой кислоты (304 мг, 0,794 ммоль, 91%).
Стадия 2. Окисление 4-метилового промежуточного продукта, указанного выше, до соответствующего альдегида осуществляли, используя нитрат аммония церия(IV) в условиях, описанных для стадия 2 предшествующего примера.
Пример 31
Получение 4-[5-(4-трифторметилфенил)-1H-[1,2,4]триазол-3-ил]бензальдегида
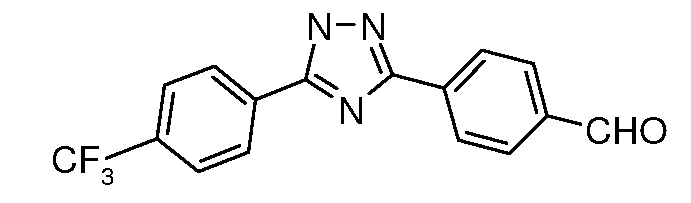
Терефталонитрил (115 мг, 0,90 ммоль), гидразид 4-трифторметилбензойной кислоты (92 мг, 0,450 ммоль), K2CO3 (31 мг, 0,225 ммоль) и н-бутиловый спирт (~2 мл) объединяли в 10 мл реакционном сосуде для микроволнового облучения (CEM Microwave), снабженном магнитной мешалкой, и подвергали микроволновому облучению при температуре 150°C в течение 30 мин. Содержимое затем фильтровали и концентрировали досуха. Хроматография (3:1 гексан/EtOAc) давала 1,2,4-триазолнитрил (72 мг, 0,230 ммоль, 51%). Затем восстановление с помощью DIBAL приводило к получению соответствующего альдегида.
Пример 32
Получение 4-[1-(3,4-дихлорфенил)-5-оксо-4,5-дигидро-1H-[1,2,4]триазол-3-ил]бензальдегида
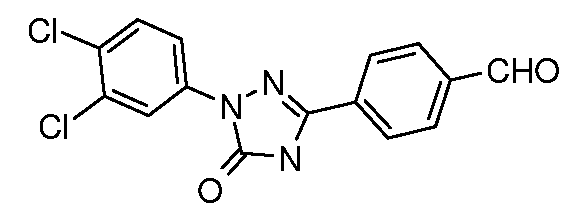
Стадия 1. 4-Цианофенилоксоуксусная кислота. В круглодонную колбу, снабженную механической мешалкой и обратным холодильником, помещали п-цианоацетофенон (5 г, 34,44 моль), SeO2 (9,55 г, 86,1 ммоль) и пиридин (~100 мл). Смесь перемешивали при кипячении с обратным холодильником в течение 6 час, затем осадок удаляли путем фильтрования и фильтрат обрабатывали 10% HCl (водн.) (20 мл). Фильтрат экстрагировали EtOAc (3×50 мл) и объединенные органические слои опять экстрагировали почти насыщенным NaHCO3. Водный слой затем осторожно подкисляли (pH 1) с помощью концентрированной HCl, получая небольшое количество желаемого продукта. Остальную оксоуксусную кислоту выделяли путем экстракции EtOAc, высушивания (MgSO4) и концентрирования (1,69 г, 28%).
Стадия 2. 4-[1-(3,4-Дихлорфенил)-5-оксо-4,5-дигидро-1H-[1,2,4]триазол-3-ил]бензонитрил. Суспензию 4-цианофенилоксоуксусной кислоты (100 мг, 0,571 ммоль), (3,4-дихлорфенил)гидразин гидрохлорида (122 мг, 0,571 ммоль), 12,1 н. HCl (5 мкл, 0,057 ммоль) и H2O (~10 мл) в 25 мл реакционном сосуде энергично перемешивали при комнатной температуре в течение 24 час. Гидразон получали с помощью вакуумной фильтрации и помещали в 100 мл круглодонную колбу с магнитной мешалкой. В колбу затем добавляли триэтиламин (0,08 мл, 0,571 ммоль), дифенилфосфорил азид (157 мг, 0,571 ммоль) и толуол (20 мл), затем нагревали при температуре 110°C в течение 1 часа. После охлаждения содержимое гасили с помощью 10% NaOH (водн.) и подкисляли (pH 1) с помощью концентрированной HCl. В течение 15 мин давали возможность образовываться осадку, затем промежуточное соединение выделяли с помощью вакуумной фильтрации и сушили в течение ночи в вакуумной печи при 45°C (16 мг, 8%). Нитрил подвергали восстановлению до альдегида, используя DIBAL в ранее описанных условиях.
Пример 33
Получение 4-[1-(4-хлорфенил)-1H-[1,2,3]триазол-4-ил]бензальдегида
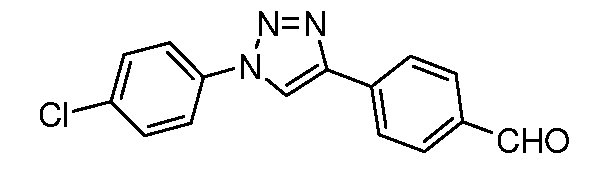
Следуя способу, опубликованному в работе Feldman et al. (Org Lett. 2004, 6, 3897), суспензию 4-этинилбензонитрила (50 мг, 0,393 ммоль), 1-хлор-4-иодбензола (94 мг, 0,393 ммоль), L-пролина (9 мг, 0,079 ммоль), аскорбиновой кислоты (7 мг, 0,039 ммоль), NaN3 (31 мг, 0,472 ммоль), CuSO4 (3 мг, 0,020 ммоль) и Na2SO4 (11 мг, 0,079 ммоль) в ДМСО (1,5 мл) нагревали при температуре 65°C в течение 24 час. После охлаждения смесь разбавляли H2O и перемешивали в течение 30 мин при комнатной температуре. Промежуточное соединение, 4-[1-(4-хлорфенил)-1H[1,2,3]триазол-4-ил]бензонитрил (54 мг, 48%), затем, после промывки большими объемами H2O и 20% NH4OH (~20 мл), выделяли с помощью вакуумной фильтрации. Далее осуществляли восстановление до альдегида в условиях, описанных ранее.
Пример 34
Получение 4-[5-(4-трифторметилфенил)тетразол-2-ил]бензальдегида
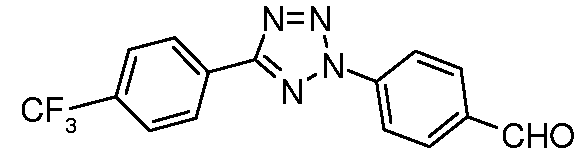
Указанный альдегид получали исходя из 4-трифторметилбензальдегида, следуя методу, описанному в работе Roppe et al. J. Med Chem. 2004, 47, 4645.
Пример 35
Получение 4-[5-(4-трифторметоксифенил)пиридин-3-ил]бензальдегида
Стадия 1. 3,5-Дибромпиридин (4,4 ммоль), 4-трифторметоксифенил бороновую кислоту (5,1 ммоль), тетракис(трифенилфосфин)палладий(0) (0,04 ммоль), 2M карбонат калия (8,44 ммоль) и диоксан (21 мл) объединяли в сосуде и нагревали с помощью микроволнового облучения в течение 10 мин при температуре 150°C. Реакционную смесь обрабатывали эфиром и промывали насыщенным солевым раствором. Эфирный слой сушили над сульфатом магния, фильтровали и растворитель удаляли в вакууме. Сырую смесь очищали с помощью хроматографии на силикагеле с получением 130 мг 3-бром-5-(4-трифторметоксифенил)пиридина в виде твердого продукта желтого цвета. 1H ЯМР (400 МГц, CDCl3) δ 8,71 (м, 2H), 8,00 (т, J=2,1 Гц, 1H), 7,58 (д, J=8,8 Гц, 2H), 7,34 (д, J=8,0 Гц, 2H); EIMS 317 m/z (M+).
Стадия 2. Соединение получали путем катализируемого палладием арилирования продукта со стадии 1 с помощью 4-формилфенил бороновой кислоты.
Пример 36
Получение 4-[4-(4-трифторметоксифенил)пиридин-2-ил]бензальдегида
Стадия 1. Соединение получали путем катализируемого палладием арилирования 2-хлор-4-иодпиридина с помощью 4-трифторметоксифенилбороновой кислоты.
Стадия 2. 2-Хлор-4-(4-трифторметоксифенил)пиридин (0,55 ммоль), полученный исходя из 2-хлор-4-иодпиридина, 4-формилфенил бороновую кислоту (0,82 ммоль), тетракис(трифенилфосфин)палладий(0) (0,005 ммоль), 2M карбонат калия (0,55 мл) и диоксан (3 мл) объединяли в сосуде и подвергали микроволновому облучению в течение 15 мин при температуре 150°C. Реакционную смесь обрабатывали EtOAc и промывали насыщенным солевым раствором. Органический слой сушили над сульфатом магния, фильтровали и растворитель удаляли в вакууме. Очищали с помощью хроматографии на силикагеле (EtOAc/гексаны), получая 120 мг твердого продукта не совсем белого цвета. 1H ЯМР (400 МГц, CDCl3) δ 10,11 (с, 1H), 8,81 (д, J=4,8 Гц, 1H), 8,24 (д, J=8,7 Гц, 2H), 8,03 (д, J=8,4 Гц, 2H), 7,96 (м, 1H), 7,73 (д, J=9,0 Гц, 2H), 7,49 (дд, J=5,3, 1,8 Гц, 1H), 7,37 (д, J=8,1 Гц, 2H); EIMS 343 m/z (M+).
Пример 37
Получение 4-[6-(4-трифторметоксифенил)пиридин-2-ил]бензальдегида
Стадия 1. 4-(6-Бромпиридин-2-ил)бензальдегид (0,31 ммоль) получали как описано в работе Puglisi et al. Eur. J. Org. Chem 2003, 8, 1552-1558.
Стадия 2. 4-[6-(4-Трифторметоксифенил)пиридин-2-ил]бензальдегид.
4-(6-Бром-пиридин-2-ил)бензальдегид (0,31 ммоль), 4-трифторметокси бороновую кислоту (0,46 ммоль), тетракис(трифенилфосфин)палладий(0) (0,003 ммоль), 2M карбонат калия (0,31 мл) и диоксан (2 мл) объединяли в реакционном сосуде и подвергали микроволновому облучению в течение 10 мин при температуре 150°C. Реакционную смесь обрабатывали эфиром и промывали насыщенным солевым раствором. Органический слой сушили над сульфатом магния, фильтровали и растворитель удаляли в вакууме. Очищали с помощью хроматографии на силикагеле (EtOAc/гексан), получая 80 мг продукта в виде твердого продукта не совсем белого цвета. 1H ЯМР (400 МГц, CDCl3) δ 10,11 (с, 1H), 8,32 (д, J=8,5 Гц, 2H), 8,19 (д, J=8,1 Гц, 2H), 8,03 (д, J=8,4 Гц, 2H), 7,89 (т, J=7,9 Гц, 1H), 7,79 (д, J=7,7 Гц, 1H), 7,74 (д, J=8,0 Гц, 1H), 7,35 (д, J=8,3 Гц, 2H); EIMS 343 m/z (M+); т.пл. 109-112°C.
Пример 38
Получение 4-[6-(4-трифторметоксифенил)пиримидин-4-ил]бензальдегида
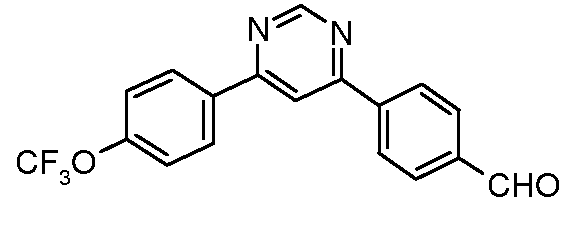
Стадия 1. 4-Хлор-6-(4-трифторметоксифенил)пиримидин получали путем катализируемого палладием арилирования 4,6-дихлорпиримидина 4-трифторметоксифенилбороновой кислотой. 1H ЯМР (400 МГц, CDCl3) δ 9,05 (с, 1H), 8,14 (д, J=9,8 Гц, 2H), 7,74 (м, 1H), 7,36 (д, J=8,4 Гц, 2H); EIMS 274 m/z (M+).
Стадия 2. Соединение получали путем катализируемого палладием арилирования продукта со стадии 1 4-формилфенилбороновой кислотой. 1H ЯМР (400 МГц, CDCl3) δ 10,15 (с, 1H), 9,38 (д, J=0,9 Гц, 1H), 8,33 (д, J=8,4 Гц, 2H), 8,23 (д, J=8,5 Гц, 2H), 8,16 (д, J=0,8 Гц, 1H), 8,08 (д, J=8,8 Гц, 2H), 7,40 (д, J=8,1 Гц, 2H); EIMS 344 m/z (M+).
Пример 39
Получение 4-[2-(4-трифторметоксифенил)пиримидин-4-ил]бензальдегида
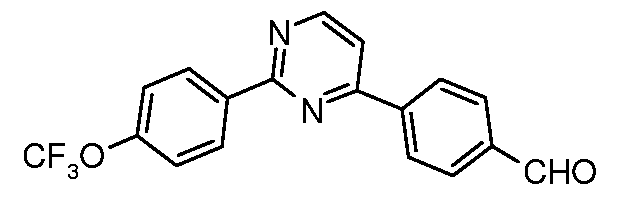
Стадия 1. 4-Хлор-2-(4-трифторметоксифенил)пиримидин. Указанное в заголовке соединение получали путем катализируемого палладием арилирования 2,4-дихлорпиримидина 4-трифторметоксифенилбороновой кислотой. 1H ЯМР (400 МГц, CDCl3) δ 8,68 (д, J=5,6 Гц, 1H), 8,16 (д, J=9,1 Гц, 2H), 7,65 (д, J=5,3 Гц, 1H), 7,36 (дд, J=9,2, 0,9 Гц, 2H); EIMS 274 m/z (M+); т.пл. 70-73°C.
Стадия 2. Соединение получали путем катализируемого палладием арилирования продукта со стадии 1 4-формилфенилбороновой кислотой. 1H ЯМР (400 МГц, CDCl3) δ 10,13 (с, 1H), 8,91 (д, J=4,8 Гц, 1H), 8,74 (д, J=8,5 Гц, 2H), 8,28 (д, J=8,4 Гц, 2H), 8,03 (д, J=8,4 Гц, 2H), 7,65 (д, J=5,3 Гц, 1H), 7,39 (д, J=8,6 Гц, 2H); EIMS 344 m/z (M+).
Пример 40
Получение 4-[4-(4-трифторметоксифенил)пиримидин-2-ил]бензальдегида
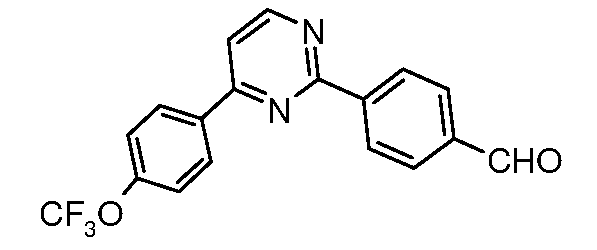
Стадия 1. 4-(4-Хлорпиримидин-2-ил)бензальдегид. Соединение получали путем катализируемого палладием арилирования продукта 2,4-дихлорпиримидина 4-формилфенилбороновой кислотой. 1H ЯМР (400 МГц, CDCl3) δ 10,13 (с, 1H), 8,74 (д, J=5,0 Гц, 1H), 8,27 (д, J=7,8 Гц, 2H), 8,04 (д, J=7,9 Гц, 2H), 7,74 (м, 1H); EIMS 218 m/z (M+).
Стадия 2. Соединение получали путем катализируемого палладием арилированием продукта со стадии 1 4-трифторметоксифенилбороновой кислотой. 1H ЯМР (400 МГц, CDCl3) δ 10,14 (с, 1H), 8,91 (д, J=4,2 Гц, 1H), 8,63 (д, J=8,5 Гц, 2H), 8,37 (д, J=8,4 Гц, 2H), 8,06 (д, J=8,8 Гц, 2H), 7,67 (д, J=5,4 Гц, 1H), 7,35 (д, J=8,7 Гц, 2H); EIMS 344 m/z (M+).
Пример 41
Получение 4-[6-(4-трифторметоксифенил)пиразин-2-ил]бензальдегида
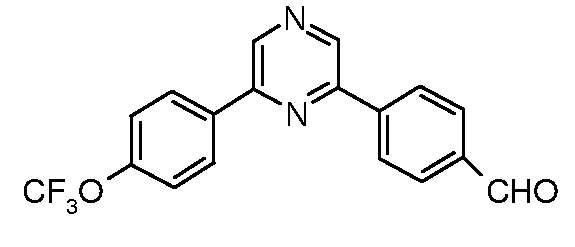
Стадия 1. 2-Хлор-6-(4-трифторметоксифенил)пиразин. Соединение получали путем катализируемого палладием арилирования 2,6-дихлорпиразина 4-трифторметоксифенилбороновой кислотой. 1H ЯМР (400 МГц, CDCl3) δ 8,94 (с, 1H), 8,57 (с, 1H), 8,10 (д, J=9,0 Гц, 2H), 7,37 (д, J=8,4 Гц, 2H); EIMS 274 m/z (M+); т.пл. 58-60°C.
Стадия 2. Соединение получали путем катализируемого палладием арилирования продукта со стадии 1 4-формилфенилбороновой кислотой. 1H ЯМР (400 МГц, CDCl3) δ 10,13 (с, 1H), 9,07 (с, 1H), 9,03 (с, 1H), 8,33 (д, J=8,1 Гц, 2H), 8,21 (д, J=8,7 Гц, 2H), 8,07 (д, J=7,6 Гц, 2H), 7,40 (д, J=8,3 Гц, 2H); EIMS 344 m/z (M+).
Пример 42
Получение 4-[2-(4-трифторметоксифенил)пиримидин-5-ил]бензальдегида
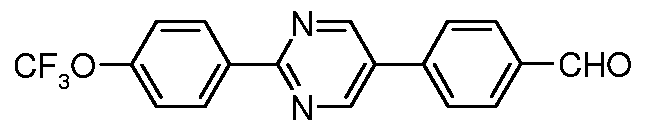
Стадия 1. 4-(2-Хлорпиримидин-5-ил)бензальдегид. Соединение получали путем катализируемого палладием арилированием продукта 2,5-дихлорпиримидина 4-формилфенил бороновой кислотой.
Стадия 2. 4-(2-Хлорпиримидин-5-ил)бензальдегид (0,92 ммоль), 4-трифторметоксифенилбороновую кислоту (1,10 ммоль), дихлорбис(трифенилфосфин)палладий(II) (0,01 ммоль), 2M карбонат калия (0,92 мл) и диоксан (5 мл) объединяли в реакционном сосуде и подвергали микроволновому облучению в течение 10 мин при температуре 150°C. Органический слой из реакционной смеси напрямую помещали на силикагель и сушили в вакууме. Очищали с помощью хроматографии на силикагеле (EtOAc/гексан) с получением 140 мг твердого продукта белого цвета. 1H ЯМР (400 МГц, CDCl3) δ 10,11 (с, 1H), 9,07 (с, 2H), 8,57 (д, J=9,0 Гц, 2H), 8,07 (д, J=8,5 Гц, 2H), 7,82 (д, J=8,3 Гц, 2H), 7,35 (д, J=8,3 Гц, 2H); EIMS 344 m/z (M+).
Пример 43
Получение 4-[5-(4-трифторметоксифенил)пиримидин-2-ил]бензальдегида
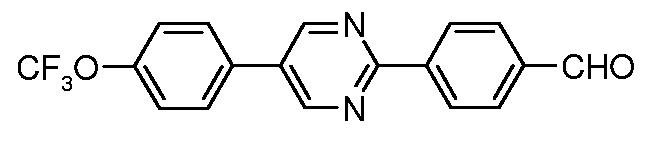
Стадия 1. 2-Хлор-5-(4-трифторметоксифенил)пиримидин. Соединение получали путем катализируемого палладием арилирования 2,5-дихлорпиримидина 4-трифторметоксифенилбороновой кислотой.
Стадия 2. 2-Хлор-5-(4-трифторметоксифенил)пиримидин (4,22 ммоль), 4-формилфенилбороновую кислоту (5,1 ммоль), дихлорбис(трифенилфосфин)палладий(II) (0,05 ммоль), 2M карбонат калия (4,2 мл) и диоксан (21 мл) объединяли в реакционном сосуде и подвергали микроволновому облучению в течение 20 мин при температуре 150°C. Органический слой из реакционной смеси напрямую помещали на силикагель и сушили в вакууме. Очищали с помощью хроматографии на силикагеле (EtOAc/гексаны) с получением 75 мг твердого продукта белого цвета. 1H ЯМР (400 МГц, CDCl3) δ 10,13 (с, 1H), 9,06 (с, 2H), 8,68 (д, J=8,8 Гц, 2H), 8,03 (д, J=8,3 Гц, 2H), 7,68 (д, J=8,8 Гц, 2H), 7,40 (д, J=8,7 Гц, 2H); EIMS 344 m/z (M+).
Пример 44
Получение 4-гептафторпропил-6-(4-нитрофенил)-2-(4-трифторметилфенил)пиримидина
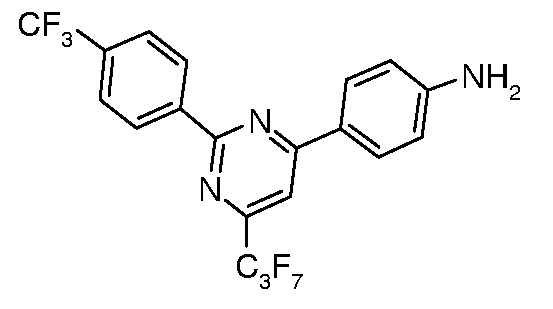
Стадия 1. 4-Гептафторпропил-6-(4-нитрофенил)-2-(4-трифторметилфенил)пиримидин. Раствор 4-гептафторпропил-2-метилсульфанил-6-(4-нитрофенил)пиримидина (1,20 г, 2,90 ммоль, полученный исходя из 1-(4-нитрофенил-4,4,5,5,6,6,6-гептафторгексан-1,3-диона в соответствии со способом, описанным в работе Green et al. WO 200138311 A2), 4-трифторметилфенилбороновую кислоту (0,608 г, 3,2 ммоль), трифурилфосфин (114 мг, 0,49 ммоль) и 2-тиофенкарбоксилат меди (II) (750 мг, 3,9 ммоль) объединяли в 15 мл сухого ТГФ и нагревали до температуры 50°C. Затем тремя порциями в течение 3 час добавляли катализатор - аддукт трис(дибензилиденацетон)дипалладий(0)-хлороформ (60 мг, кат.), и раствор затем оставляли перемешиваться при температуре 50°C в течение ночи. Концентрирование и хроматография (Biotage, 5:1 гексан/DCM) давали 0,60 г (40%) указанного в заголовке соединения в виде твердого продукта светло-желтого цвета. EIMS 514,0 (M+H); т.пл. 191°C.
Стадия 2. 4-Гептафторпропил-6-(4-аминофенил)-2-(4-трифторметилфенил)пиримидин. Раствор 4-гептафторпропил-2-(4-трифторметилфенил)-6-(4-нитрофенил)пиримидина (0,18 г, 0,35 ммоль), порошок железа (0,20 г, 3,5 ммоль), сульфат железа аммония (0,15 г, 0,3 ммоль) в смеси 3:1 EtOH/вода нагревали на водяной бане в течение 3 час. Затем ее охлаждали, разбавляли 50 мл Et2O, фильтровали через Celite® и концентрировали с получением анилина в виде твердого продукта желтого цвета. 1H ЯМР (300 МГц, CDCl3) δ 8,75 (д, J=8 Гц, 2H), 8,18 (д, J=8 Гц, 2H), 7,90 (с, 1H), 7,80 (д, J=8 Гц, 2H), 6,82 (д, J=8 Гц, 2 H), 4,20 (с, 2H).
Пример 45
Получение 4-трифторметил-6-(4-аминофенил)-2-(4-трифторметилфенил)пиримидина
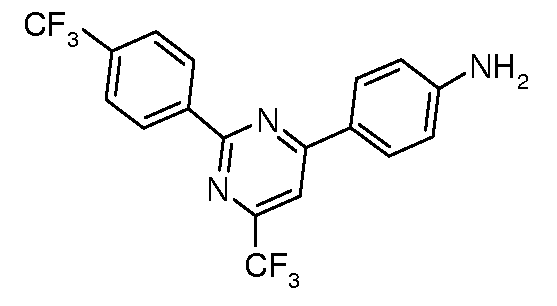
Стадия 1. 4-Трифторметил-6-(4-нитрофенил)-2-(4-трифторметилфенил)пиримидин. Раствор 4-трифторметил-2-метилсульфанил-6-(4-нитрофенил)пиримидина (1,25 г, 4,0 ммоль, полученный исходя из 1-(4-нитрофенил-4,4,4-трифторбутан-1,3-дион, полученный в соответствии со способом, описанным в работе Green et al. WO 200138311 A2), 4-трифторметилфенилбороновую кислоту (0,95 г, 5,0 ммоль), трифурилфосфин (140 мг, 0,60 ммоль) и 2-тиофенкарбоксилат меди(II) (1,05 г, 5,0 ммоль) объединяли в 25 мл сухого ТГФ и нагревали до температуры 52°C. Затем тремя порциями в течение 3 час добавляли катализатор - аддукт трис(дибензилиденацетон)дипалладий(0)-хлороформ (100 мг) и раствор затем оставляли перемешиваться при температуре 50°C в течение 12 час. Концентрирование и хроматография (Biotage, 4:1 гексан/DCM) давали 0,67 г (41%) указанного в заголовке соединения в виде твердого продукта светло-желтого цвета. 1H ЯМР (300 МГц, CDCl3) δ 8,75 (д, J=8 Гц, 2H), 8,41 (с, 4H), 8,03 (с, 1H), 7,80 (д, J=8 Гц, 2H); EIMS 414,1 (M+H); т.пл. 162°C.
Стадия 2. 4-Трифторметил-6-(4-аминофенил)-2-(4-трифторметилфенил)пиримидин. Раствор 4-трифторметил-2-(4-трифторметилфенил)-6-(4-нитрофенил)пиримидина (0,50 г, 1,2 ммоль), порошок железа (0,50 г, 9 ммоль), сульфат железа аммония (0,5 г, 1,0 ммоль) в 30 мл смеси 3:1 EtOH-вода нагревали на паровой бане в течение 3 час. Затем охлаждали, разбавляли 50 мл диэтилового эфира, фильтровали через Celite® и концентрировали. Сырой амин очищали с помощью колонки Biotage (4:1:1 гексаны/EtOAc/DCM) с получением 0,22 г чистого анилина. Данный продукт использовали напрямую при получении соответствующего карбамата. 1H ЯМР (300 МГц, CDCl3) δ 8,75 (д, J=8 Гц, 2H), 8,16 (д, J=8 Гц, 2H), 7,81 (с, 1H), 7,77 (д, J=8 Гц, 2H), 6,82 (д, J=8 Гц, 2H), 4,15 (с, 2H).
Пример 46
Получение 4-[2-(4-трифторметилфенил)пиримидин-4-ил]фениламина
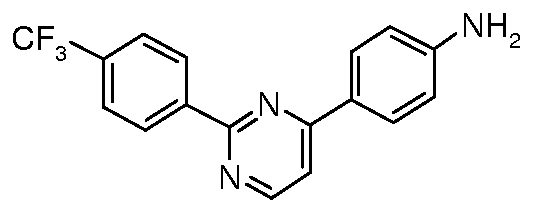
Стадия 1. 4-(4-Нитрофенил)-2-(4-трифторметилфенил)пиримидин. К 82,7 мг (3,60 ммоль) металлического натрия, растворенного в 3 мл абсолютного EtOH, добавляли 938 мг (3,60 ммоль) 4-трифторметилбензамидин гидрохлорид дигидрата, затем 4 мл EtOH. Через 30 мин добавляли 498 мг (2,26 ммоль) 3-диметиламино-1-(4-нитрофенил)пропенона и смесь нагревали при температуре кипения с обратным холодильником приблизительно 66 час и оставляли охлаждаться. Смесь концентрировали до твердого продукта рыжевато-коричневого цвета, который растирали в насыщенном растворе бикарбоната натрия. Твердый продукт собирали и сушили на воздухе с получением 937 мг. Затем его растворяли в смеси хлороформ/EtOAc и пропускали через силикагель, элюируя смесью 7:3 хлороформ/EtOAc с получением 710 мг (91%) указанного в заголовке соединения. 1H ЯМР δ 9,01 (д, J=5,3 Гц, 1H), 8,73 (д, J=8,2 Гц, 2H), 8,43 (с, 4H), 7,82 (д, J=8,1 Гц, 2H), 7,76 (д, J=5,2 Гц, 1H); EIMS 345 (M+, 100), 299 (57); т.пл. 175-176,5°C. Анал. Вычисл. для C17H10F3N3O2: C, 59,13; H, 2,92; N, 12,17. Найдено: C, 58,82; H, 2,63; N, 11,98.
Стадия 2. 4-[2-(4-Трифторметилфенил)пиримидин-4-ил]фениламин. Смесь 670 мг (1,94 ммоль) нитробензол 4-(4-нитрофенил)-2-(4-трифторметилфенил)пиримидина и 75 мг 10% Pd/C в 30 мл EtOH помещали на аппарат Парра при давлении газообразного водорода в 40 фунт на кв.дюйм при комнатной температуре. После 7 час смесь фильтровали через Celite® и EtOH удаляли в вакууме. Остаток распределяли между EtOAc и насыщенным бикарбонатом натрия и органическую фазу сушили (MgSO4). Концентрирование давало твердый продукт, который растворяли в EtOAc и фильтровали через слой силикагеля. Концентрирование давало 500 мг (82%) указанного в заголовке соединения. 1H ЯМР δ 8,75 (д, J=5,30 Гц, 1H), 8,67 (д, J=8,3 Гц, 2H), 8,10 (д, J=8,9 Гц, 2H), 7,75 (д, J=7,9 Гц, 2H), 7,54 (д, J=5,3 Гц, 1H), 6,80 (д, J=8,6 Гц, 2H), 4,03 (ушир.с, 2H); МС (API-ES+) 316 ([M+H]+, 100); т.пл. 166-167°C. Анал. Вычисл. для C17H12F3N3: C, 64,46; H, 3,84; N, 13,33. Найдено: C, 64,37; H, 3,71; N, 13,08.
Пример 47
Получение 2-хлор-4-[3-(4-трифторметилфенил)-[1,2,4]триазол-1-ил]фениламина
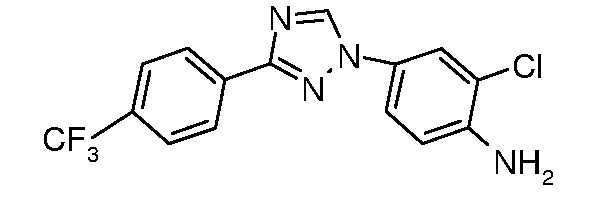
Стадия 1. 1-(3-Хлор-4-нитрофенил)-3-(4-трифторметилфенил)-1H-[1,2,4]триазол. Раствор NBS (180 мг, 1 ммоль) в 4 мл CH2Cl2 перемешивали в атмосфере азота при температуре 0°C, при этом с помощью шприца добавляли диметилсульфид (110 мг, 1,8 ммоль). Раствор, в котором образовывался твердый продукт белого цвета, затем охлаждали до -20°C и добавляли (N-(3-хлор-4-нитрофенил)-N'-(4-трифторметил-бензилиден)гидразин (200 мг, 0,58 ммоль) в 4 мл DCM. Раствор оставляли нагреваться до температуры окружающей среды и перемешивали в течение еще 2 час. Полученный раствор оранжевого цвета затем разбавляли 25 мл DCM и промывали водой и насыщенным солевым раствором, затем высушивали и концентрировали. Полученный твердый продукт оранжевого цвета - гидразонил бромид (150 мг) далее обрабатывали напрямую тетразолом (25 мг, 0,35 ммоль) и триэтиламином (50 мл, 0,35 ммоль) в 5 мл абсолютного EtOH. Полученный раствор оранжево-коричневого цвета нагревали при температуре кипения с обратным холодильником в течение 2 час. Данные ТСХ показывали, что исходный бромид сначала преобразовывался в два промежуточных соединения желтого цвета, которые затем исчезали и заменялись одним бесцветным пятном. Раствор оранжевого цвета затем разбавляли 10 мл воды, с получением твердого продукта, который фильтровали, сушили на воздухе и перекристаллизовывали из толуола с получением 60 мг твердого продукта желто-рыжевато-коричневого цвета. 1H ЯМР (300 МГц, CDCl3) δ 8,60 (с, 1 H), 8,41 (д, J=8,7 Гц, 1H), 8,33 (д, J=7,5 Гц, 2H), 7,90 (д, J=2 Гц, 1H), 7,70 (д, J=7,5 Гц, 2H), 7,65 (дд, J=8,7, 2Гц, 1H); EIMS 368,9; т.пл. 185°C. Анал. Вычисл. для C15H8ClF3N4O2: C, 48,86; H, 2,19; N, 15,20. Найдено: C, 48,39; H, 2,61; N, 14,91.
Стадия 2. 2-Хлор-4-[3-(4-трифторметилфенил)-[1,2,4]триазол-1-ил]фениламин. Раствор нитрофенильного производного (0,75 г, 2,0 ммоль) в 7 мл MeOH и 3 мл воды обрабатывали порошком железа (0,7 г, 12,5 ммоль) и сульфатом железа аммония (гексагидрат; 0,7 г, 1,8 ммоль). Раствор нагревали на паровой бане в течение 3 час, при этом данные ТСХ показывали, что происходило полное преобразование в более полярный флуоресцирующий продукт. Раствор охлаждали и фильтровали и фильтрат концентрировали в вакууме и очищали с помощью хроматографии через короткий слой силикагеля (7:2:1 гексан/EtOAc/DCM) с получением 0,55 г амина в виде твердого продукта светлого рыжевато-коричневого цвета. 1H ЯМР (300 МГц, CDCl3) δ 8,40 (с, 1H), 8,31 (д, J=8,4 Гц, 1H), 7,72 (д, J=8,4 Гц, 2H), 7,69 (д, J=2 Гц, 1H), 7,42 (дд, J=8,5, 2 Гц, 1H), 6,9 (д, J=8,4 Гц, 1H); EIMS 340,4, 342,3 (M+H); т.пл. 148°C. Анал. Вычисл. для C15H10ClF3N4: C, 53,19; H, 2,98; N, 16,83. Найдено: C, 52,90; H, 3,10; N, 16,83.
Пример 48
Получение 4-[1-(4-трифторметоксифенил)-1H-[1,2,4]триазол-3-ил]фениламина
Стадия 1. 1-(4-Трифторметоксифенил)-3-(4-нитрофенил)-1H-[1,2,4]триазол. Раствор NBS (0,70 г, 3,9 ммоль) в 25 мл CH2Cl2 перемешивали в атмосфере азота при температуре 0°C, в процессе чего с помощью шприца добавляли диметилсульфид (0,40 г, 6,5 ммоль). Раствор, в котором образовывался твердый продукт белого цвета, затем охлаждали до -20°C и добавляли N-(4-нитробензидиден)-N'-(4-трифторметоксифенил)гидразин (0,70 г, 2,15 ммоль) в 10 мл DCM. Раствор оставляли нагреваться до температуры окружающей среды и перемешивали еще 2 час. Полученный раствор оранжевого цвета затем разбавляли 25 мл DCM и промывали водой и насыщенным солевым раствором, затем высушивали и концентрировали. Полученный твердый гидразонил бромид (0,9 г) оранжевого цвета затем напрямую обрабатывали тетразолом (154 мг, 2,2 ммоль) и триэтиламином (280 мл, 0,23 ммоль) в 5 мл абсолютного EtOH. Полученный раствор оранжево-коричневого цвета нагревали при температуре кипения с обратным холодильником в течение 2 час. Данные ТСХ показывали, что исходный бромид сначала преобразовывался в два промежуточных соединения желтого цвета, которые затем заменялись одним бесцветным пятном. Раствор оранжевого цвета затем концентрировали и очищали с помощью хроматографии (2:1:2 гексан/EtOAc/DCM), получая 0,30 г указанного в заголовке соединения в виде твердого продукта светло-желтого цвета. 1H ЯМР (300 МГц, CDCl3) δ 8,68 (с, 1H), 8,40 (д, J=5 Гц, 2H), 8,35 (д, J=5 Гц, 2H), 7,85 (д, J=8 Гц, 2H), 7,42 (д, J=8 Гц, 2H); EIMS 350 (M+, 100), 299 (57); т.пл. 147°C.
Стадия 2. 4-[1-(4-Трифторметоксифенил)-1H-[1,2,4]триазол-3-ил]фениламин. Каталитическое восстановление, используя катализатор Pd/C в EtOH в атмосфере водорода, давало соответствующий анилин в виде твердого продукта светло-серого цвета. 1H ЯМР (300 МГц, CDCl3) δ 8,50 (с, 1H), 8,00 (д, J=8,4 Гц, 2H), 7,78 (д, J=8,7 Гц, 2H), 7,35 (д, J=8 Гц, 2H), 6,76 (д, J=8,7 Гц, 2H), 3,9 (ушир.с, 2H); EIMS 321; т.пл. 160°C.
Пример 49
Получение 4-[1-(4-пентафторэтилоксифенил)-1H-[1,2,4]триазол-3-ил]фениламина
Стадия 1. 1-(4-Пентафторэтилоксифенил)-3-(4-нитрофенил)-1H-[1,2,4]триазол. Взвесь 3-(4-нитрофенил)триазола (11,4 г, 60 ммоль), 1-иод-4-пентафторэтоксибензола (20 г, 60 ммоль), карбоната цезия (39,0 г, 120 ммоль), CuI (3,5 г, 18 ммоль), 8-гидроксихинолина (2,0 г, 13,8 ммоль) и 155 мл 9:1 ДМФ-H2O нагревали при температуре 150°C в течение 5 час, затем охлаждали и содержимое выливали в 150 мл воды и экстрагировали с помощью 2×100 мл Et2O. Органический слой сушили и концентрировали и твердый остаток перекристаллизовывали из MeOH и воды с получением 11,8 г (49%) нитротриазола в виде твердого продукта рыжевато-коричневого цвета. 1H ЯМР (300 МГц, CDCl3) δ 8,68 (с, 1H), 8,40 (д, J=5 Гц, 2H), 8,35 (д, J=5 Гц, 2H), 7,85 (д, J=8 Гц, 2H), 7,42 (д, J=5,2 Гц, 8 Гц, 2H); EIMS 400 (M+); т.пл. 170-175°C.
Стадия 2. 4-[1-(4-Пентафторэтилоксифенил)-1H-[1,2,4]триазол-3-ил]фениламин. Каталитическое восстановление, используя катализатор Pd/C в EtOH в атмосфере водорода, давало соответствующий анилин в виде твердого продукта светло-рыжевато-коричневого цвета. 1H ЯМР (300 МГц, CDCl3) δ 8,55 (с, 1H), 8,00 (д, J=7 Гц, 2H), 7,78 (д, J=8 Гц, 2H), 7,35 (д, J=8 Гц, 2H), 6,78 (д, J=8 Гц, 2H), 3,9 (ушир.с, 2H); EIMS 371; т.пл. 160°C.
Пример 50
Получение 4-[1-(4-гептафторпропилоксифенил)-1H-[1,2,4]триазол-3-ил]фениламина
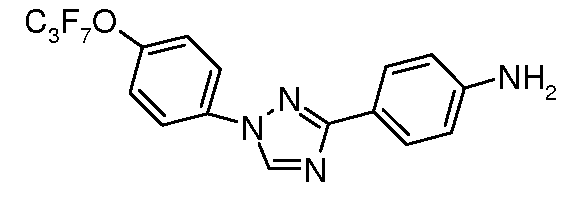
Стадия 1. 1-(4-Гептафторпропилоксифенил)-3-(4-нитрофенил)-1H-[1,2,4]триазол. Взвесь 3-(4-нитрофенил) триазола (1,0 г, 5,2 ммоль), 1-иод-4-гептафторпропилоксибензола (6,1 г, 15,8 ммоль), карбоната цезия (10,0 г, 30,7 ммоль), CuI (900 мг, 4,4 ммоль) и 8-гидроксихинолина (500 мг, 3,4 ммоль) в 40 мл 9:1 ДМФ-H2O нагревали при температуре 150°C в течение 12 час, затем охлаждали и содержимое выливали в 50 мл воды и 50 мл концентрированного NH4OH. Раствор голубого цвета экстрагировали с помощью 100 мл эфира, и органический слой отделяли и фильтровали для удаления некоторого количества нерастворимого продукта, затем сушили и концентрировали. Твердый остаток перекристаллизовывали из смеси MeOH/вода с получением 4,69 г нитрофенилтриазола в виде твердого продукта светло-рыжевато-коричневого цвета. 1H ЯМР (300 МГц, CDCl3) δ 8,66 (с, 1H), 8,40 (м, 4H), 7,85 (д, J=8 Гц, 2H), 7,42 (д, J=8 Гц, 2H); EIMS 450,1 (M+); т.пл. 114-116°C.
Стадия 2. 4-[1-(4-Гептафторпропилоксифенил)-1H-[1,2,4]триазол-3-ил]фениламин. Каталитическое восстановление в условиях, описанных выше, давало соответствующий анилин в виде твердого продукта светло-рыжевато-коричневого цвета. 1H ЯМР (300 МГц, CDCl3) δ 8,54 (с, 1H), 8,00 (д, J=8 Гц, 2H), 7,80 (д, J=8 Гц, 2H), 7,40 (д, J=8 Гц, 2H), 6,78 (д, J=8 Гц, 2H), 3,9 (ушир.с, 2H); EIMS 421,3 (M+1); т.пл. 181-183°C.
Пример 51
Получение 4-[4-(4-трифторметилфенил)имидазол-1-ил]фениламина
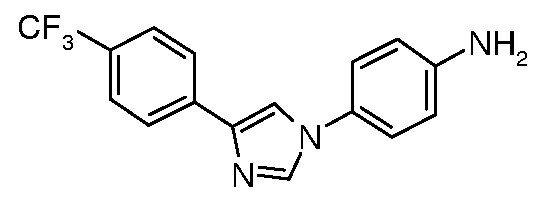
Стадия 1. 4-[4-(4-Трифторметилфенил)-1H-имидазол-1-ил]нитробензол. 4-Трифторметилфенил имидазол (1,43 г, 6,7 ммоль), 4-фторнитробензол (1,2 г, 8,5 ммоль) и карбонат калия (1,5 г, 10,9 ммоль) объединяли в 15 мл ДМФ и нагревали при температуре 100°C в течение 6 час. Охлажденный раствор затем выливали в 100 мл воды и полученный твердый продукт фильтровали и сушили на воздухе с получением 1,0 г указанного в заголовке имидазола в виде твердого продукта светло-желтого цвета, т.пл. 197°C. Анал. Вычисл. для C16H10F3N3O2: C, 57,66; H, 3,02; N, 12,61. Найдено: C, 57,69; H, 3,01; N, 12,48.
Стадия 2. 4-[4-(4-Трифторметилфенил)имидазол-1-ил]фениламин. Каталитическое восстановление, используя катализатор Pd/C в EtOH в атмосфере водорода, давало соответствующий анилин в виде твердого продукта светло-серого цвета. 1H ЯМР (400 МГц, CDCl3) δ 7,90 (д, J=7 Гц, 2H), 7,75 (с, 1H), 7,65 (д, J=7 Гц, 2H), 7,52 (с, 1H), 7,19 (д, J=8 Гц, 2H), 6,75 (д, J=8 Гц, 2H), 3,8 (ушир.с, 2H); EIMS 302,0; т.пл. 142-143°C.
Пример 52
Получение 4-[1-(4-трифторметилфенил)-1H-имидазол-4-ил]фениламина
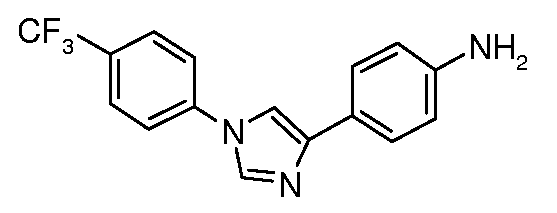
Стадия 1. 4-[4-(4-Трифторметилфенил)-1H-имидазол-1-ил]нитробензол. Получен как описано для стадии 1 предшествующего примера.
Стадия 2. 4-[1-(4-Трифторметилфенил)-1H-имидазол-4-ил]фениламин. Каталитическое восстановление, используя катализатор Pd/C в EtOH в атмосфере водорода, давало соответствующий анилин в виде твердого продукта светло-серого цвета. 1H ЯМР (400 МГц, CDCl3) δ 7,92 (с, 1H), 7,76 (д, J=8 Гц, 2H), 7,66 (д, J=4,5 Гц, 2H), 7,55 (с, 1H), 6,75 (д, J=4,5 Гц, 2H), 3,8 (ушир.с, 2H); EIMS 304,0; т.пл. 191°C. Анал. Вычисл. для C16H12F3N3: C, 63,36; H, 3,99; N, 13,85. Найдено: C, 63,14; H, 4,07; N, 13,52.
Пример 53
Получение 4-[1-(4-трифторметоксифенил)-1H-имидазол-4-ил]фениламина
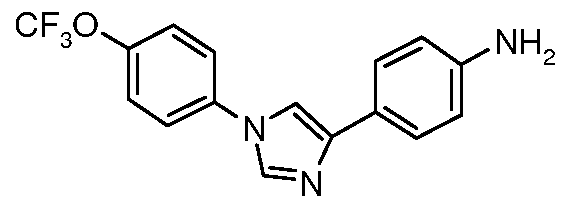
Стадия 1. 4-(4-Нитрофенил)-1-(4-трифторметоксифенил)-1H-имидазол. Для преобразования 4-трифторметоксианилина (5,3 г, 30 ммоль) и α-бром-4-нитроацетофенона (3,7 г, 15 ммоль) в 2,1 г (41% общий выход) имидазола использовали условия, описанные в работе Porretta et al. Farmaco, Edizione Scientifica 1985, 40, 404.
Стадия 2. 4-[1-(4-Трифторметоксифенил)-1H-имидазол-4-ил]фениламин. Каталитическое восстановление, используя катализатор Pd/C в EtOH в атмосфере водорода, давало соответствующий анилин в виде твердого продукта светло-серого цвета. 1H ЯМР (300 МГц, CDCl3) δ 7,83 (с, 1H), 7,64 (д, J=4,8 Гц, 2H), 7,47 (д, J=4,4 Гц, 2H), 7,40 (с, 1H), 7,36 (д, J=4,8 Гц, 2H), 6,75 (д, J=4,4 Гц, 2H), 3,5 (ушир.с, 2H); EIMS 320; т.пл. 167 oC. Анал. Вычисл. для C16H12F3N3O: C, 60,19; H, 3,79; N, 13,16. Найдено: C, 59,91; H, 3,67; N, 13,03.
Пример 54
Получение 4-(4-аминофенил)-2-(4-трифторметоксифенил)-2,4-дигидро-[1,2,4]триазол-3-она
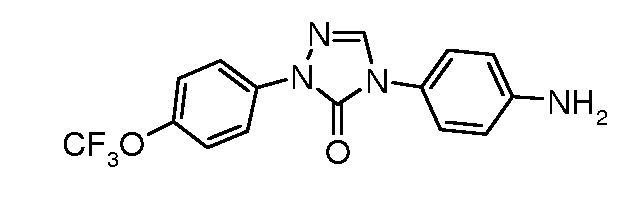
Стадия 1. 4-(4-Нитрофенил)-2-(4-трифторметоксифенил)-2,4-дигидро-[1,2,4]триазол-3-он. Указанное в заголовке соединение получали, как описано в документе Henbach, DE 2724891 A1, 1978, с модификацией до трех стадий: При добавлении анилина вместо 3,5-дихлоранилина использовали 4-нитроанилин, а вместо толуола в качестве растворителя использовали сухой ТГФ. При образовании триазолинонового кольца вместо фосгена использовали трифосген (0,65 экв.). 1H ЯМР (300 МГц, CDCl3) δ 8,40 (д, J=8,8 Гц, 2H), 8,05 (д, J=8,8 Гц, 2H), 7,99 (с, 1H), 7,89 (д, J=9,3 Гц, 2H), 7,32 (д, J=9,3 Гц, 2H); ESIMS 367 (M+H); т.пл. 136-140°C.
Стадия 2. 4-(4-Аминофенил)-2-(4-трифторметоксифенил)-2,4-дигидро-[1,2,4]триазол-3-он. Нитрофенилтриазолинон (0,037 г, 0,10 ммоль) растворяли в абсолютном EtOH (1 мл) в атмосфере N2. К этой смеси добавляли дигидрат хлорида олова(II) (0,114 г, 0,51 ммоль) и смесь перемешивали при кипячении с обратным холодильником в течение 2 час. Смесь охлаждали до температуры 25°C, выливали на лед-H2O (25 мл) и pH водной смеси доводили до 9-10 с помощью 1 н. NaOH. Смесь экстрагировали с помощью Et2O (3×25 мл) и объединенные органические экстракты сушили (MgSO4), фильтровали и концентрировали с получением твердого продукта темно-коричневого цвета (0,0297 г, 87%), который использовали без дополнительной очистки. 1H ЯМР (300 МГц, CDCl3) δ 8,07 (д, J=9,7 Гц, 2H), 7,73 (с, 1H), 7,32-7,23 (м, 4H), 6,77 (д, J=8,5 Гц, 2H), 3,85 (шир., 2H); ESIMS 336 (M+); т.пл. 115-120°C.
Пример 55
Получение 4-[5-(4-трифторметилфенил)-4,5-дигидроизоксазол-3-ил]фениламина
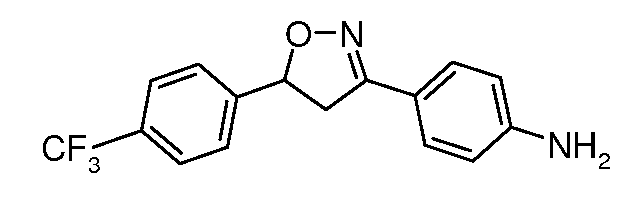
Стадия 1. трет-Бутиловый эфир {4-[5-(4-трифторметилфенил)-4,5-дигидроизоксазол-3-ил]фенил}карбаминовой кислоты. К перемешиваемому раствору N-хлорсукцинимида (57 мг, 0,424 ммоль) и пиридина (3 мкл) в 1,7 мл хлороформа добавляли оксим 4-N-трет-BOC-аминобензальдегида (100 мг, 0,424 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 10 мин. Затем добавляли 4-трифторметилстирол (78 мкл, 0,53 ммоль) и температуру повышали до 45°C. К этому раствору добавляли по каплям триэтиламин (62 мкл, 0,445 ммоль), растворенный в 0,5 мл CHCl3. Реакционную смесь перемешивали при температуре 45°C в течение 5 час. Охлажденный раствор разбавляли хлороформом (10 мл) и промывали водой (2×5 мл). Органическую фазу затем сушили над MgSO4, фильтровали и концентрировали с получением изоксазолина (100 мг, 58%). 1H ЯМР (400 МГц, CDCl3) δ 7,40-7,83 (м, 8H), 6,60 (ушир.с, 1H), 5,76 (дд, J=11,0, 7,7 Гц, 1H), 3,81 (дд, J=16,5, 11,0 Гц, 1H), 3,29 (дд, J=16,5, 7,7 Гц, 1H); EIMS 406 (M+).
Стадия 2. 4-[5-(4-Трифторметилфенил)-4,5-дигидроизоксазол-3-ил]фениламин. К перемешиваемому раствору N-BOC изоксазолина (полученного на стадии 1) в CH2Cl2 (2,5 мл) добавляли трифторуксусную кислоту (6,16 ммоль, 0,46 мл) и реакционную смесь перемешивали при комнатной температуре в течение 3 час. Раствор концентрировали и остаток помещали в 5 мл насыщенного раствора KHCO3 и перемешивали в течение 30 мин. Смесь затем экстрагировали с помощью CH2Cl2 (3×10 мл). Органическую фазу затем сушили над MgSO4, фильтровали и концентрировали с получением ожидаемого анилина (68 мг, 90%). 1H ЯМР (400 МГц, CDCl3) δ 7,45-7,63 (м, 6H), 6,67 (д, J=8,6 Гц, 2H), 5,72 (дд, J=10,9, 7,6 Гц, 1H), 3,92 (ушир.с, 2H), 3,78 (дд, J=16,7, 10,9 Гц, 1H), 3,25 (дд, J=16,7, 7,6 Гц, 1H); EIMS 306 (M+).
Пример 56
Получение 4-[3-(4-трифторметоксифенил)-4,5-дигидроизоксазол-5-ил]фениламина
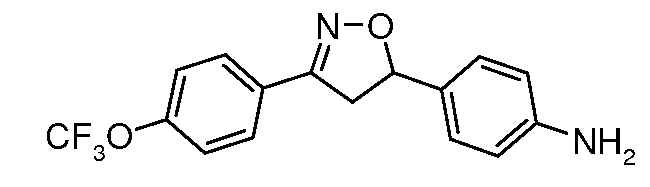
К перемешиваемому раствору N-хлорсукцинимида (0,634 ммоль, 85 мкл) и пиридина (4 мкл) в 2,5 мл хлороформа добавляли оксим п-трифторметоксибензальдегида (130 мг, 0,634 ммоль). Реакционную смесь нагревали при температуре 50°C в течение 3 час. Затем добавляли 4-аминостирол (0,793 ммоль, 93 мкл), далее по каплям раствор триэтиламина (0,666 ммоль, 93 мкл), растворенного в 0,5 мл CHCl3. Реакционную смесь перемешивали при температуре 50°C в течение 3 час. Охлажденный раствор разбавляли хлороформом (15 мл) и промывали водой (2×10 мл). Органическую фазу затем сушили над MgSO4, фильтровали и концентрировали. Остаток очищали посредством радиальной хроматографии, используя раствор 2:1 гексан/EtOAc в качестве элюента (Rf=0,18) с получением 4-[3-(4-трифторметоксифенил)-4,5-дигидроизоксазол-5-ил]фениламина (125 мг; 61%). 1H ЯМР (400 МГц, CDCl3) δ 7,73 (д, J=8,2 Гц, 2H), 7,25 (д, J=8,2 Гц, 2H), 7,17 (д, J=8,2 Гц, 2H), 6,68 (д, J=8,2 Гц, 2H), 5,65 (дд, J=10,9, 8,9 Гц, 1H), 3,55-3,75 (ушир.с, 2H), 3,67 (дд, J=16,8, 10,9 Гц, 1H), 3,30 (дд, J=16,8, 8,9 Гц, 1H); EIMS 322 (M+).
Пример 57
Получение 1-(4-аминофенил)-3-(4-трифторметоксифенил)-1,3-дигидроимидазол-2-она
Эти соединения получали в соответствии со способом, описанным в работе Bromidge et al. WO 2003057220 A1 с незначительными модификациями.
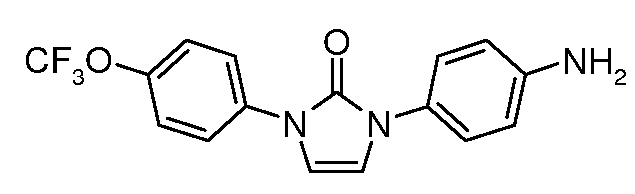
Стадия 1. (2,2-Диметоксиэтил)-(4-трифторметоксифенил)амин. К перемешиваемому раствору 4-трифторметоксианилина (1 мл, 7,46 ммоль) и диметилацеталя глиоксальдегида (60% об./об. в воде, 8,95 ммоль, 1,6 мл) в 37 мл EtOH добавляли 300 мг 10%-ного палладия на угле. Смесь вакуумировали и три раза продували азотом. Затем подавали водород из баллона и смесь перемешивали при давлении водорода в 1 атм в течение 31 часа. Смесь затем фильтровали через слой из Celite® и слой промывали EtOH (25 мл). Этанол удаляли при пониженном давлении, а остаток разбавляли 30 мл CH2Cl2. Слои разделяли и органическую фазу сушили над MgSO4, фильтровали и концентрировали с получением (2,2-диметоксиэтил)-(4-трифторметоксифенил)амина (1,7 г, 86%). 1H ЯМР (400 МГц, CDCl3) δ 7,04 (д, J=8,9 Гц, 2H), 6,59 (д, J=8,9 Гц, 2H), 4,56 (т, J=5,4 Гц, 1H), 3,92 (ушир.с, 1H), 3,51 (д, J=5,4 Гц, 2H), 3,42 (с, 6H); EIMS 265 (M+).
Стадия 2. 1-(2,2-Диметоксиэтил)-3-(4-нитрофенил)-1-(4-трифторметоксифенил)мочевина. К перемешиваемому раствору (2,2-диметоксиэтил)-(4-трифторметоксифенил)амина (3,2 ммоль, 0,85 г), растворенному в 32 мл CH2Cl2, добавляли п-нитрофенилизоцианат (3,53 ммоль, 0,58 г) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Смесь разбавляли CH2Cl2 (50 мл) и промывали последовательно NaHCO3 (30 мл) и насыщенным солевым раствором (30 мл). Органическую фазу затем сушили над MgSO4, фильтровали и концентрировали. Остаток очищали посредством радиальной хроматографии, используя раствор 2:1 гексан/EtOAc в качестве элюента (Rf=0,32) с получением 1-(2,2-диметоксиэтил)-3-(4-нитрофенил)-1-(4-трифторметоксифенил)мочевины (0,87 г, 63%). 1H ЯМР (400 МГц, CDCl3) δ 8,15 (д, J=9,2 Гц, 2H), 7,30-7,50 (м, 6H), 7,02 (ушир.с, 1H), 4,65 (т, J=5,4 Гц, 1H), 3,82 (д, J=5,4 Гц, 2H), 3,41 (с, 6H); EIMS 429 (M+).
Стадия 3. 1-(4-Нитрофенил)-3-(4-трифторметоксифенил)-1,3-дигидроимидазол-2-он. К перемешиваемому раствору 1-(2,2-диметоксиэтил)-3-(4-нитрофенил)-1-(4-трифторметоксифенил)мочевины (0,23 г, 0,53 ммоль), растворенной в 28 мл толуола, добавляли 2 капли концентрированной HCl. Реакционную смесь перемешивали при кипячении с обратным холодильником в течение 3 час. Охлажденный раствор разбавляли EtOAc (75 мл) и промывали насыщенным NaHCO3 (25 мл) и насыщенным солевым раствором (25 мл). Органическую фазу затем сушили над MgSO4, фильтровали и концентрировали. Остаток очищали посредством радиальной хроматографии, используя раствор 2:1 гексан/EtOAc в качестве элюента (Rf=0,28) с получением 1-(4-нитрофенил)-3-(4-трифторметоксифенил)-1,3-дигидроимидазол-2-она (134 мг, 71%). 1H ЯМР (400 МГц, CDCl3) δ 8,35 (д, J=9,2 Гц, 2H), 7,93 (д, J=9,2 Гц, 2H), 7,67 (д, J=9,2 Гц, 2H), 7,34 (д, J=9,2 Гц, 2H), 6,87 (д, J=3,3 Гц, 1H), 6,81 (д, J=3,3 Гц, 1H); EIMS 365 (M+).
Стадия 4. 1-(4-Аминофенил)-3-(4-трифторметоксифенил)-1,3-дигидроимидазол-2-он. К перемешиваемому раствору 1-(4-нитрофенил)-3-(4-трифторметоксифенил)-1,3-дигидроимидазол-2-она (120 мг, 0,33 ммоль) в 3,5 мл EtOAc добавляли дихлорид олова (371 мг, 1,64 ммоль) и реакционную смесь перемешивали при кипячении с обратным холодильником в течение 3 час. Охлажденный раствор выливали на лед (15 мл) и устанавливали pH равным 7-8 с помощью добавления 10%-ного раствора NaHCO3. Смесь экстрагировали с помощью EtOAc (3×10 мл) и промывали насыщенным солевым раствором (10 мл). Органическую фазу затем сушили над MgSO4, фильтровали и концентрировали с получением 1-(4-аминофенил)-3-(4-трифторметоксифенил)-1,3-дигидроимидазол-2-она. (102 мг, 92%). 1H ЯМР (400 МГц, CDCl3) δ 7,72 (д, J=8,8 Гц, 2H), 7,37 (д, J=8,8 Гц, 2H), 7,32 (д, J=8,8 Гц, 2H), 6,76 (д, J=8,8 Гц, 2H), 6,69 (д, J=3,3 Гц, 1H), 6,65 (д, J=3,3 Гц, 1H); EIMS 335 (M+).
Пример 58
Получение 1-(4-аминофенил)-3-(4-трифторметоксифенил)имидазолидин-2-она
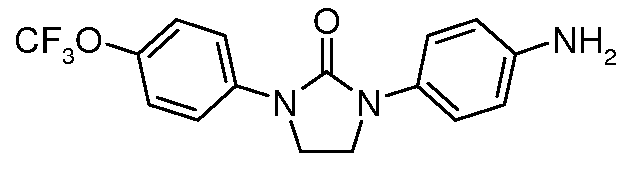
К раствору 1-(4-нитрофенил)-3-(4-трифторметоксифенил)-1,3-дигидроимидазол-2-она (144 мг, 0,395 ммоль) в 40 мл EtOH добавляли 100 мг 10% палладия на угле. Смесь вакуумировали и три раза продували азотом. В аппарат Парра подавали водород под давлением 45 фунт на кв. дюйм и встряхивали в течение 5 час. Раствор под нормальным давлением фильтровали через слой из Celite® и слой промывали EtOH (25 мл). Этанол удаляли при пониженном давлении с получением указанного в заголовке продукта (114 мг, 95%). 1H ЯМР (400 МГц, CDCl3) δ 7,61 (д, J=9,2 Гц, 2H), 7,33 (д, J=9,2 Гц, 2H), 7,21 (д, J=8,6 Гц, 2H), 6,71 (д, J=9,2 Гц, 2H), 3,92 (с, 4H), 3,61 (ушир.с, 2H); EIMS 307 (M+).
Пример 59
Получение 4-[6-(4-трифторметоксифенил)пиридазин-3-ил]фениламина
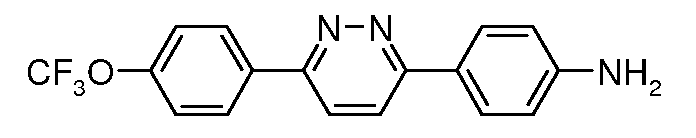
Стадия 1. 3-Хлор-6-(4-трифторметоксифенил)пиридазин. К раствору, содержащему 3,6-дихлорпиридазин (0,3 г, 2,01 ммоль), 4-трифторметоксифенилбороновую кислоту (0,50 г, 2,42 ммоль) и 2 M K2CO3 (2 мл, 4,03 ммоль), растворенную в 11 мл сухого 1,4-диоксана, добавляли дихлорбис(трифенилфосфин)палладий(II) (14 мг, 0,02 ммоль). Смесь облучали, используя CEM Discover Microwave, при температуре 190°C в течение 30 мин. Смесь разбавляли 100 мл эфира и промывали насыщенным солевым раствором (30 мл). Органическую фазу затем сушили над MgSO4, фильтровали и концентрировали. Остаток очищали посредством радиальной хроматографии, используя раствор 3:1 гексан/EtOAc в качестве элюента. Выделяли две фракции. Данные анализа показывали, что первая фракция (Rf=0,63) является продуктом бис-Сузуки (95 мг, 12%). Вторая выделенная фракция (Rf=0,34) была идентифицирована как 3-хлор-6-(4-трифторметоксифенил)пиридазин (174 мг, 32%). 1H ЯМР (400 МГц, CDCl3) δ 8,10 (д, J=9,2 Гц, 2H), 7,83 (д, J=8,9 Гц, 2H), 7,60 (д, J=8,9 Гц, 2H), 7,37 (д, J=9,2 Гц, 2H); EIMS 274 (M+).
Стадия 2. 4-[6-(4-Трифторметоксифенил)пиридазин-3-ил]фениламин. К раствору, содержащему 3-хлор-6-(4-трифторметоксифенил)пиридазин (157 мг, 0,57 ммоль), 4-аминофенилбороновую кислоту (118 мг, 0,86 ммоль) и 2M K2CO3 (0,57 мл, 1,14 ммоль), растворенному в 3,5 мл сухого 1,4-диоксана, добавляли дихлорбис(трифенилфосфин)палладий(II) (4 мг, 0,006 ммоль). Смесь облучали, используя CEM Discover Microwave, при температуре 190 oC в течение 30 мин. Смесь разбавляли 100 мл эфира и промывали насыщенным солевым раствором (30 мл). Органическую фазу затем сушили над MgSO4, фильтровали и концентрировали. Остаток очищали посредством радиальной хроматографии, используя раствор 97:3 CHCl3/CH3OH в качестве элюента (Rf=0,26) с получением указанного в заголовке соединения (105 мг, 56%). 1H ЯМР (400 МГц, CDCl3) δ 8,18 (д, J=8,6 Гц, 2H), 8,01 (д, J=8,6 Гц, 2H), 7,30-7,45 (м, 4H), 6,82 (д, J=8,6 Гц, 2H), 3,96 (ушир. с, 2H); EIMS 331 (M+).
Пример 60
Получение 4-[3-(4-трифторметоксифенил)-4-5-дигидро-[1,2,4]оксадиазол-5-ил]бензальдегида
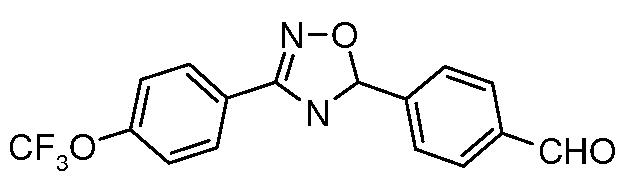
Соединение получали в соответствии с общим способом, описанным в работе Srivastava et al. J. Heterocycl. Chem. 1987, 24, 101 с небольшими модификациями. К перемешиваемому раствору 4-(трифторметокси)бензамидоксима (Acros) (300 мг, 1,36 ммоль), растворенного в 1,4 мл уксусной кислоты, добавляли 1,4-терефтальдегид (1,1 г, 8,18 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение 4 дней. Смесь затем растворяли в CHCl3 (20 мл), затем добавляли 10 мл гептана. Этот раствор концентрировали при пониженном давлении. Эту процедуру повторяли дважды. Остаток очищали с помощью радиальной хроматографии, используя раствор 99:1 CHCl3/CH3OH в качестве элюента. Выделяли две фракции. Первая выделенная фракция (Rf=0,30), как показано, представляет собой исходный продукт (20 мг). Вторая выделенная фракция (Rf=0,17) указанное в заголовке соединение (23 мг, 5%). 1H ЯМР (400 МГц, CDCl3) δ 10,02 (с, 1H), 7,91 (д, J=8,2 Гц, 2H), 7,77 (д, J=9,2 Гц, 2H), 7,70 (д, J=8,2 Гц, 2H), 7,27 (д, J=8,2 Гц, 2H), 6,64 (д, J=4,3 Гц, 1H), 5,18 (д, J=4,3 Гц, 1H); EIMS 336 (M+).
Пример 61
Получение 4-[5-(4-трифторметоксифенил)-[1,2,4]оксадиазол-3-ил]фениламина
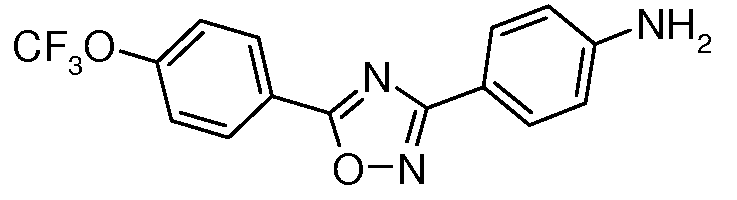
Стадия 1. трет-Бутиловый эфир {4-[5-(4-трифторметоксифенил)-[1,2,4]оксадиазол-3-ил]фенил}карбаминовой кислоты. К перемешиваемому раствору трет-бутил-4-(N-гидроксикарбамимидоил)фенилкарбамата (Ace Synthesis) (500 мг; 1,99 ммоль) растворяли в 2,5 мл уксусной кислоты, добавляли 4-трифторметоксибензальдегид (1,7 мл; 11,94 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 4 дней. Смесь разбавляли CHCl3 (20 мл) и фильтровали через слой из Celite®. Слой промывали CHCl3 (20 мл). Затем к раствору добавляли гептан (20 мл) и раствор концентрировали при пониженном давлении. Эту процедуру повторяли дважды. Остаток очищали с помощью радиальной хроматографии, используя раствор 3:1 гексан/EtOAc в качестве элюента. Выделяли две фракции. Первая выделенная фракция (Rf=0,42), как показано, представляет собой указанное в заголовке соединение (127 мг; 15%). 1H ЯМР (300 МГц, CDCl3) δ 8,26 (д, J=8,9 Гц, 2H), 8,09 (д, J=8,9 Гц, 2H), 7,52 (д, J=8,6 Гц, 2H), 7,39 (д, J=8,3 Гц, 2H), 6,70 (с, 1H), 1,54 (с, 9H); EI/MS 421 [M]+. Вторая выделенная фракция (Rf=0,11), как показано, представляет собой 4,5-дигидро-1,2,4-оксадиазол (96 мг; 11%). 1H ЯМР (300 МГц, CDCl3) δ 8,40 (д, J=8,9 Гц, 2 H), 8,00 (д, J=8,9 Гц, 2 H), 7,51 (д, J=8,9 Гц, 2 H), 7,22-7,31 (м, 3 H), 6,87 (с, 1 H), 1,54 (с, 9 H); EI/MS 423 [M]+.
Стадия 2. 4-[5-(4-Трифторметоксифенил)-[1,2,4]оксадиазол-3-ил]фениламин. К перемешиваемому раствору трет-бутилового эфира {4-[5-(4-трифторметоксифенил)-[1,2,4]оксадиазол-3-ил]фенил}карбаминовой кислоты (198 мг; 0,47 ммоль) в CH2Cl2 (4,7 мл) добавляли трифторуксусную кислоту (11,76 ммоль; 0,87 мл) и реакционную смесь перемешивали при комнатной температуре в течение 3 час. Раствор концентрировали и остаток помещали в 10 мл насыщенного раствора KHCO3 и перемешивали в течение 30 мин. Смесь затем экстрагировали с помощью CH2Cl2 (3×10 мл). Органическую фазу затем сушили над MgSO4, фильтровали и концентрировали с получением 4-[5-(4-трифторметоксифенил)-[1,2,4]оксадиазол-3-ил]фениламина (127 мг; 84%). 1H ЯМР (300 МГц, CDCl3) δ 8,26 (д, J=8,9 Гц, 2H), 7,97 (д, J=8,9 Гц, 2H), 7,39 (д, J=8,6 Гц, 2H), 6,77 (д, J=8,6 Гц, 2H), 3,40-3,80 (ушир.с, 2H); EI/MS 321 [M]+.
Пример 62
Получение 1-(4-аминофенил)-4-(4-трифторметоксифенил)пиперазин-2,5-диона
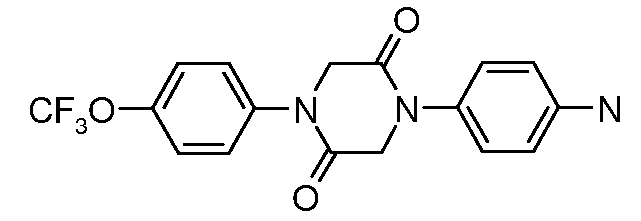
Стадия 1. Метиловый эфир 4-нитрофениламиноуксусной кислоты. К раствору этилбромацетата (60 г, 0,36 моль) и 4-нитроанилина (5 г, 0,036 моль) в 100 мл ДМФ добавляли NaHCO3 (60 г, 0,71 моль) и иодид тетра-н-бутиламмония (500 мг, кат.). Раствор нагревали до температуры 90°C в течение 16 час и затем охлаждали и выливали в 300 мл воды. Полученный твердый продукт желтого цвета фильтровали и сушили на воздухе. Перекристаллизация из MeOH давала 5 г метилового эфира в виде твердого продукта светло-желтого цвета. 1H ЯМР (400 МГц, CDCl3) δ 8,36 (д, J=8 Гц, 2H), 7,65 (д, J=8 Гц, 2H), 4,42 (2, 2H), 3,93 (с, 2H), 3,79 (с, 2H); т.пл. 179-182°C.
Стадия 2. Метиловый эфир [(2-хлорацетил)-(4-трифторметоксифенил)амино]уксусной кислоты. В суспензию метилового эфира 4-нитрофениламиноуксусной кислоты (3,0 г, 14,2 ммоль) в 30 мл толуола добавляли хлорацетилхлорид (3 мл, избыток). Раствор нагревали до температуры 80°C в течение 1 часа, при этом твердый продукт растворялся. Раствор затем охлаждали и концентрировали, и затем оставшийся твердый продукт перекристаллизовывали из MeOH с получением 3,5 г сложного эфира в виде твердого продукта светло-желтого цвета. 1H ЯМР (400 МГц, CDCl3) δ 8,36 (д, J=8 Гц, 2H), 7,65 (д, J=8 Гц, 2H), 4,42 (2, 2H), 3,93 (с, 2H), 3,79 (с, 3H); МС 286 (M+); т.пл. 106-109°C.
Стадия 3. 1-(4-Аминофенил)-4-(4-трифторметоксифенил)пиперазин-2,5-дион. Продукт со стадии 2 (0,6 г, 2,3 ммоль) объединяли с 4-трифторметоксианилином (0,81 г, 4,6 ммоль) и продукты нагревали до температуры 140°C в течение 90 мин. Оставшийся твердый продукт перемешивали с 50 мл DCM и фильтровали для удаления гидрохлоридной соли анилина и затем остаток концентрировали и очищали. Хроматография (элюирование смесью EtOAc-гексан) давала 0,44 г нитрофенилпиперазиндиона в виде твердого продукта белого цвета, т.пл. 223-224°C. Восстановление нитрогруппы, используя катализатор Pd/C в условиях, описанных выше, давало указанный в заголовке амин в виде твердого продукта белого цвета. 1H ЯМР (400 МГц, CDCl3) δ 7,4 (д, J=8,5 Гц, 2H), 7,33 (д, J=8,6 Гц, 2H), 7,12 (д, J=8,7 Гц, 2H), 6,75 (д, J=8,7 Гц, 2H), 4,5 (с, 2H), 4,45 (с, 2H); МС 366,2 (M+H+); т.пл. 250°C (разл.).
Пример 63
Получение 5-(4-аминофенил)-3-(4-трифторметилфенил)-3H-[1,3,4]оксадиазол-2-она
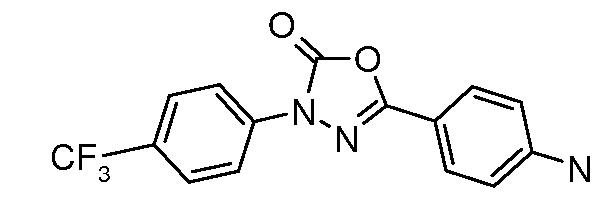
5-(4-Нитрофенил)-3-(4-трифторметилфенил) 3H-[1,3,4]оксадиазол-2-он получали путем обработки N'-(4-трифторметилфенил)гидразида соответствующей 4-нитробензойной кислоты фосгеном, используя условия, описанные Reimlinger, et al, in Chemische Berichte 1970, 103, 1934. Нитрогруппу затем восстанавливали до амина обработкой водородом и Pd/C в EtOH. 1H ЯМР (400 МГц, CDCl3) δ 8,1 (д, J=8,4 Гц, 2H), 7,75 (м, 4H), 6,75 (д, J=8,4 Гц, 2H), 4,1 (ушир.с, 2H); МС 322,6 (M+H+); т.пл. 160-163°C.
Пример 64
Получение O-((2S,3R,4R,5S,6S)-3,4,5-триметокси-6-метилтетрагидропиран-2-ил)оксима 4-[1-(4-трифторметоксифенил)-1H-имидазол-4-ил]бензальдегида (соединение 26)
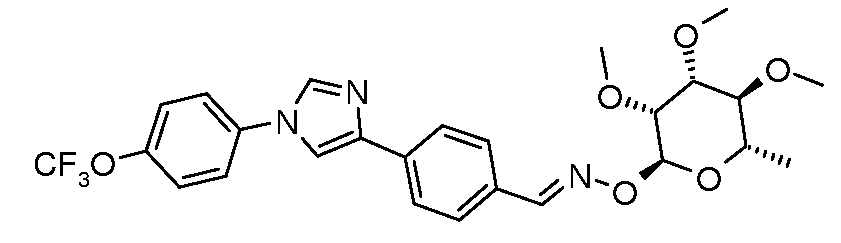
Раствор 4-[1-(4-трифторметоксифенил)-1H-имидазол-4-ил]бензальдегида (50 мг, 0,15 ммоль) и O-(2S,3R,4R,5S,6S)-(3,4,5-триметокси-6-метилтетрагидропиран-2-ил)гидроксиламина (45 мг, 0,20 ммоль) объединяли в 5 мл сухого EtOH, и раствор нагревали при кипении с обратным холодильником в атмосфере N2 в течение 12 час. Полученный раствор концентрировали в вакууме и очищали с помощью хроматографии (Biotage, 1:1:1 гексан/EtOAc/DCM) с получением 35 мг (44%) соединения 26 в виде твердого продукта белого цвета. 1H ЯМР (300 МГц, CDCl3) δ 8,15 (с, 1H), 7,90 (с, 1H), 7,85 (д, J=6 Гц, 2H), 7,68 (д, J=6 Гц, 2H), 7,60 (с, 1H), 7,68 (с, 1H), 7,50 (д, J=6 Гц, 2H), 7,38 (д, J=6 Гц, 2H), 3,77 (дд, J=3,2, 2,0Гц, 1H), 3,68 (дд, J=9,6, 6,2Гц, 1H), 3,59 (с, 3H), 3,56 (с, 3H), 3,55 (с, 3H), 3,51 (м, 1H), 3,21 (т, J=9,3 Гц, 1H), 1,33 (д, J=6,1 Гц, 3 H); МС 536,1 (M+H); т.пл. 178°C. Анал. Вычисл. для C16H10F3N3O2: C, 59,01; H, 5,50; N, 7,65. Найдено: C, 58,86; H, 5,58; N, 7,63.
Соединения по настоящему изобретению, приведенные в таблице 4, получали путями, описанными ранее и проиллюстрированными в примере 64.
Пример 65
Получение O-((2S,3R,4R,5S,6S)-4-этокси-3,5-диметокси-6-метилтетрагидропиран-2-ил)оксима 2,2,2-трифтор-1-{4-[1-(4-трифторметилфенил)-1H-[1,2,4]триазол-3-ил]фенил}этанона (соединение 169)
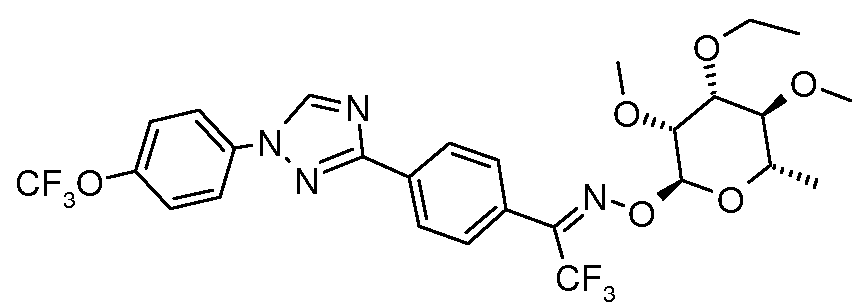
Оксим получали исходя из соответствующего трифторметилацетофенона, используя условия, описанные в предшествующих примерах. 1H ЯМР (300 МГц, CDCl3) δ 8,68 (с, 1H), 8,26 (д, J=8,30 Гц, 2H), 7,88 (д, J=8,26 Гц, 2H), 7,81 (д, J=8,26 Гц, 2H), 7,68 (д, J=8,30 Гц, 2H), 5,63 (д, J=1,85 Гц, 1H), 3,79-3,61 (м, 4H), 3,57 (с, 3H), 3,56 (с, 3H), 3,44 (дд, J=9,31, 3,36 Гц, 1H), 3,18 (т, J=9,48 Гц, 1H), 1,36-1,23 (м, 6H); МС 602 ([M+H]+).
Соединения по настоящему изобретению, приведенные в таблице 5, получали путями, описанными ранее и проиллюстрированными в примерах 64 и 65.
Пример 66
Получение O-((2S,3R,4R,5S,6S)-4-этокси-3,5-диметокси-6-метилтетрагидропиран-2-ил)оксима 5-[1-(4-трифторметоксифенил)-1H-[1,2,4]триазол-3-ил)индан-1-она (соединение 170)
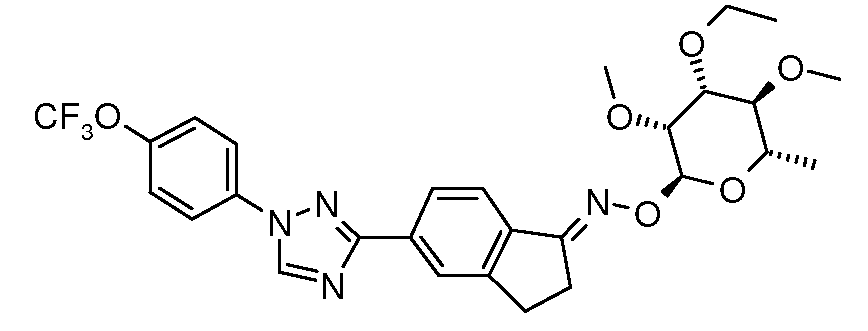
Оксим получали исходя из соответствующего 2-инданона, используя условия, описанные в примере 64. 1H ЯМР (300 МГц, CDCl3) δ 8,62 (с, 1H), 8,22-8,16 (м, 2H), 7,84-7,78 (м, 3H), 7,42-7,38 (м, 2H), 5,63 (д, J=1,85 Гц, 1H), 3,79-3,61 (м, 4H), 3,57 (с, 3H), 3,56 (с, 3H), 3,44 (дд, J=9,31, 3,36 Гц, 1H), 3,22-3,18 (м, 3H), 3,02-2,96 (м, 2H), 1,36-1,23 (м, 6H); МС 576 ([M+H]+).
Пример 67
Получение O-((2S,3R,4R,5S,6S)-3,4,5-триметокси-6-метилтетрагидропиран-2-ил)оксима 4-{1-[5-(1,1,2,3,3,3-гексафторпропокси)пиридинил]-1H-[1,2,4]триазол-3-ил}бензальдегида (соединение 94)
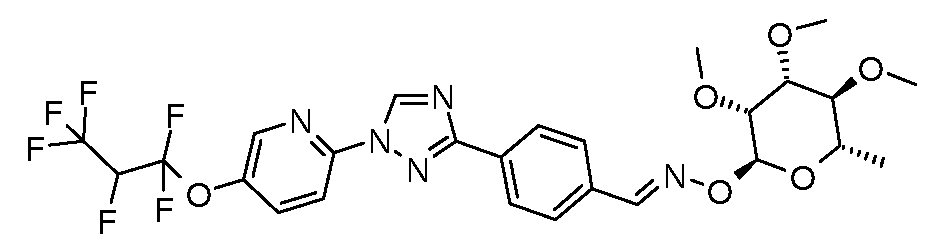
Условия фторалкилирования основывались на статье Timperley et al. J. Fluorine Chem. 2006, 127, 249. Раствор O-((2S,3R,4R,5S,6S)-3,4,5-триметокси-6-метилтетрагидропиран-2-ил)оксима 4-[1-(5-гидроксипиридин-2-ил)-1H-[1,2,4]триазол-3-ил]бензальдегида в 10 мл безводной смеси ДМФ/ТГФ (1:1) в атмосфере N2 охлаждали до температуре 0 oC и добавляли избыток газообразного гексафторпропилена в течение 15 мин. После добавления, прибавляли триэтиламин (15 мкл, 0,109 ммоль) и реакционную смесь нагревали до температуры окружающей среды, затем концентрировали досуха. Хроматография (EtOAc/гексан, 1:1) давала соединение 94 (16 мг, 24%). 1H ЯМР (CDCl3) δ 9,17 (с, 1H), 8,39 (д, J=7,68 Гц, 1H), 8,21 (д, J=8,22 Гц, 2H), 8,19 (с, 1H), 8,08 (д, J=7,68 Гц, 1H), 7,74 (д, J=8,22 Гц, 2H), 6,97 (с, 1H), 5,63 (д, J=1,85 Гц, 1H), 5,17 (м, 1H), 3,78 (дд, J=3,28, 1,99 Гц, 1H), 3,63 (м, 1H), 3,59 (с, 3H), 3,57 (с, 3H), 3,56 (с, 3H), 3,43 (дд, J=9,31, 3,36 Гц, 1H), 3,18 (т, J=9,48 Гц, 1H), 1,29 (д, J=6,26 Гц, 3H); EIMS 619 m/z (M+).
Пример 68
Получение O-((2S,3R,4R,5S,6S)-3,4,5-триметокси-6-метилтетрагидропиран-2-ил)оксима 4-[1-(4-трифторметансульфинилфенил)-1H-[1,2,4]триазол-3-ил]бензальдегида (соединение 103)
и
O-((2S,3R,4R,5S,6S)-3,4,5-триметокси-6-метилтетрагидропиран-2-ил)оксима 4-[1-(4-трифторметансульфонилфенил)-1H-[1,2,4]триазол-3-ил]бензальдегида (соединение 104)
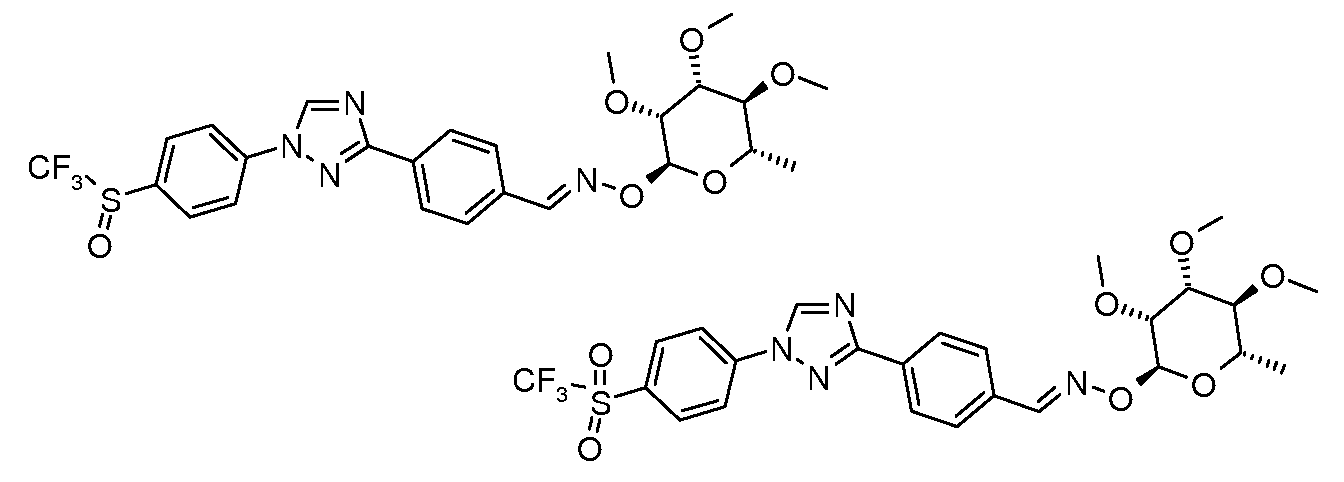
Раствор O-((2S,3R,4R,5S,6S)-3,4,5-триметокси-6-метилтетрагидропиран-2-ил)оксима 4-[1-(4-трифторметилсульфанилфенил)-1H-[1,2,4]триазол-3-ил]бензальдегида (100 мг, 0,18 ммоль, 1,0 экв.) и 3-хлорпероксибензойной кислоты (124 мг, 0,72 ммоль, 4,0 экв.) в DCM (10 мл) перемешивали в обычных условиях в течение 48 час. Раствор затем промывали насыщенным NaHSO3 (водн.), экстрагировали DCM (100 мл), концентрировали досуха и очищали с помощью хроматографии (2:2:1, гексан/EtOAc/ацетон) с получением 55 мг сульфоксида (54%) и сульфона (5,6 мг, 5%).
Для сульфоксида (соединение 103): 1H ЯМР (CDCl3) δ 8,78 (с, 1H), 8,26 (д, J=8,24 Гц, 2H), 8,21 (с, 1H), 8,09 (д, J=8,38 Гц, 2H), 7,99 (д, J=8,38 Гц, 2H), 7,78 (д, J=8,24 Гц, 2H), 5,63 (д, J=1,85 Гц, 1H), 3,68 (дд, J=3,28, 1,99 Гц, 1H), 3,63 (м, 1H), 3,59 (с, 3H), 3,57 (с, 3H), 3,56 (с, 3H), 3,44 (дд, J=9,31, 3,36 Гц, 1H), 3,20 (т, J=9,48 Гц, 1H), 1,25 (д, J=6,26 Гц, 3H); EIMS 568 m/z (M+).
Для сульфона (соединение 104): 1H ЯМР (CDCl3) δ 8,79 (с, 1H), 8,24-8,18 (м, 5H), 8,15 (д, J=8,28 Гц, 2H), 7,79 (д, J=8,32 Гц, 2H), 5,63 (д, J=1,85 Гц, 1H), 3,68 (дд, J=3,28, 1,99 Гц, 1H), 3,63 (м, 1H), 3,59 (с, 3H), 3,57 (с, 3H), 3,56 (с, 3H), 3,44 (дд, J=9,31, 3,36 Гц, 1H), 3,20 (т, J=9,48 Гц, 1H), 1,25 (д, J=6,26 Гц, 3H); EIMS 584 m/z (M+).
Пример 69
Получение O-((2S,3R,4R,5S,6S)-3,4-диметокси-6-метил-5-пропокситетрагидропиран-2-ил)оксима 4-[1-(4-пентафторэтилоксифенил)-1H-[1,2,4]триазол-3-ил]бензальдегида (соединение 113)
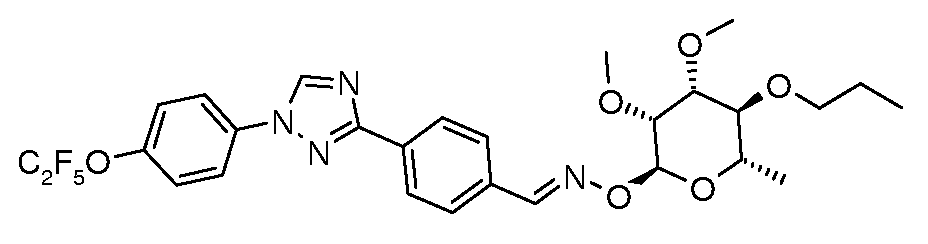
Соединение 111 (60 мг, 0,1 ммоль) растворяли в 1 мл бромпропана и обрабатывали 50 мг порошкообразного KOH и 5 мг порошкообразного Bu4NI (избыток). Раствор перемешивали при комнатной температуре в течение 16 час и затем разбавляли 10 мл сухого Et2O, фильтровали и концентрировали. Остаток элюировали через короткую колонку с силикагелем с получением 25 мг соединения 113. 1H ЯМР (CDCl3) δ 8,61 (с, 1H), 8,23 (д, J=8,1 Гц, 2H), 8,01 (с, 1H), 7,85 (д, J=9 Гц, 2H), 7,76 (д, J=8,1 Гц, 2H), 7,42 (д, J=9 Гц, 2H), 7,38 (д, J=8,2 Гц, 2H), 5,70 (д, J=1,8 Гц, 1H), 3,8-3,6 (м, 3H), 3,60-3,55 (м, 8H), 3,30 (т, J=9,6 Гц, 1H), 1,65 (м, 2H), 1,33 (д, J=7 Гц, 3H), 0,98 (т, J=7,5 Гц, 3H); EIMS 615,0 m/z (M+); т.пл. 121-128°C.
Пример 70
Получение O-((2S,3R,4R,5S,6S)-3,4,5-триметокси-6-метилтетрагидропиран-2-ил)оксима 4-[2-(4-трифторметоксифенил)пиридин-2-ил]бензальдегида (соединение 132)
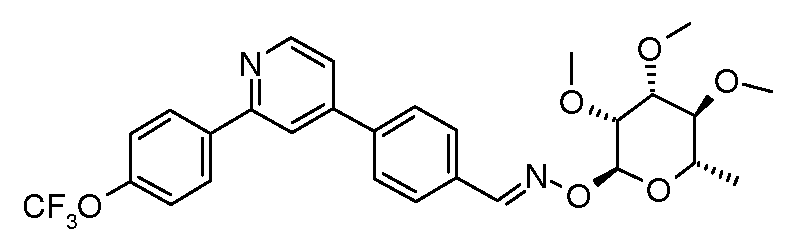
Стадия 1. 2-Хлор-4-иодпиридин (1,6 ммоль), 4-цианофенилбороновую кислоту (2,5 ммоль), 2 M карбонат калия (3,3 ммоль), тетракис(трифенилфосфин)палладия(0) (0,01 ммоль) и диоксан (8 мл) объединяли в небольшом стеклянном сосуде и нагревали с помощью микроволнового облучения в течение 10 мин при температуре 150°C. Кристаллизовавшийся продукт фильтровали и затем сушили в вакууме с получением 250 мг 4-(2-хлорпиридин-4-ил)бензонитрила в виде желтых игл. 1H ЯМР (400 МГц, CDCl3) δ 8,52 (д, J=5,1 Гц, 1H), 7,81 (д, J=8,4 Гц, 2H), 7,72 (д, J=8,2 Гц, 2H), 7,55 (м, 1H), 7,43 (дд, J=5,2, 1,4 Гц, 1H); EIMS 214 m/z (M+).
Стадия 2. 4-(2-Хлорпиридин-4-ил)бензонитрил (4,65 ммоль) подвергали восстановлению с DIBAL в условиях, описанных ранее, с получением альдегида в виде твердого продукта рыжевато-коричневого цвета. 1H ЯМР (400 МГц, CDCl3) δ 10,11 (с, 1H), 8,50 (д, J=4,8 Гц, 1H), 8,02 (д, J=8,3 Гц, 2H), 7,78 (д, J=8,2 Гц, 2H), 7,59 (д, J=1,4 Гц, 1H), 7,47 (дд, J=5,2, 1,5 Гц, 1H); EIMS 217 m/z (M+).
Стадия 3. 4-(2-Хлорпиридин-4-ил)бензальдегид (1,5 ммоль) и O-((2S,3R,4R,5S,6S)-3,4,5-триметокси-6-метилтетрагидропиран-2-ил)гидроксиламин (1,5 ммоль) объединяли в EtOH в условиях, описанных выше для получения соединение 26, с получением оксима. 1H ЯМР (400 МГц, CDCl3) δ 8,45 (д, J=5,9 Гц, 1H), 8,21 (с, 1H), 7,76 (д, J=8,3 Гц, 2H), 7,65 (д, J=8,3 Гц, 2H), 7,55 (м, 1H), 7,44 (дд, J=5,4, 1,6 Гц, 1H), 5,68 (д, J=1,8 Гц, 1H), 3,78 (дд, J=3,1, 2,0 Гц, 1H), 3,68 (дд, J=9,6, 6,3 Гц, 1H), 3,59 (с, 3H), 3,56 (с, 3H), 3,55 (с, 3H), 3,52 (м, 1H), 3,21 (т, J=9,5 Гц, 1H), 1,32 (д, J=6,2 Гц, 3H); EIMS 420 m/z (M+).
Стадия 4. O-((2S,3R,4R,5S,6S)-3,4,5-Триметокси-6-метилтетрагидропиран-2-ил)оксим 4-[2-(4-трифторметоксифенил)пиридин-4-ил]бензальдегида. O-((2S,3R,4R,5S,6S)-3,4,5-Триметокси-6-метилтетрагидропиран-2-ил)оксим 4-(2-хлорпиридин-4-ил)бензальдегида (0,24 ммоль), 4-трифторметоксифенил бороновую кислоту (0,36 ммоль), (Ph3P)4Pd(0) (0,002 ммоль), 2M K2CO3 (0,475 ммоль) и диоксан (1 мл) объединяли в небольшом стеклянном сосуде и нагревали с помощью микроволнового облучения в течение 10 мин при температуре 150°C. Реакционную смесь помещали в эфир и промывали насыщенным солевым раствором. Эфирный слой сушили над сульфатом магния, фильтровали и растворитель удаляли в вакууме. Сырую смесь очищали с помощью хроматографии на силикагеле с получением 48 мг соединения 132 в виде масла рыжевато-коричневого цвета. 1H ЯМР (400 МГц, CDCl3) δ 8,76 (д, J=5,0 Гц, 1H), 8,21 (с, 1H), 8,09 (д, J=8,8 Гц, 2H), 7,91 (с, 1H), 7,78 (д, J=8,6 Гц, 2H), 7,72 (д, J=8,7 Гц, 2H), 7,48 (дд, J=5,3, 1,7 Гц, 1H), 7,34 (д, J=8,6 Гц, 2H), 5,69 (д, J=1,7 Гц, 1H), 3,78 (м, 1H), 3,69 (м, 1H), 3,59 (с, 3H), 3,57 (с, 3H), 3,55 (с, 3H), 3,52 (д, J=3,3 Гц, 1H), 3,22 (т, J=9,4 Гц, 1H), 1,33 (д, J=6,2 Гц, 3H); EIMS 546 m/z (M+).
Пример 71
Получение (2S,3R,4R,5S,6S)-3,4,5-триметокси-6-метилтетрагидропиран-2-илового эфира {4-[2-(4-трифторметилфенил)пиримидин-4-ил]фенил}карбаминовой кислоты (соединение 232)
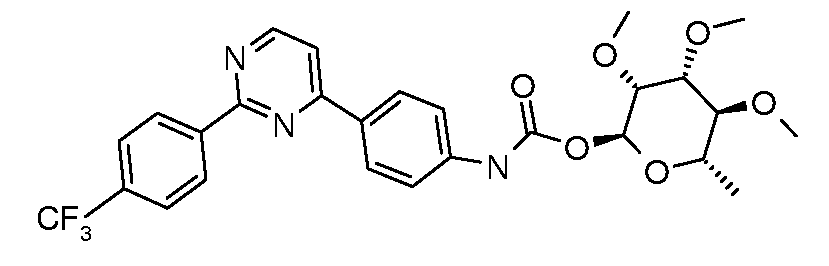
Стадия 1. 4-Нитрофениловый эфир (2S,3R,4R,5S,6S)-3,4,5-триметокси-6-метилтетрагидропиран-2-иловый эфир карбоновой кислоты. К охлажденному на ледяной бане раствору 509 мг (2,52 ммоль) 4-нитрофенилхлорформиата в 2 мл диоксана добавляли по каплям с помощью шприца раствор 0,50 г (2,42 ммоль) 3,4,5-триметокси-6-метилтетрагидропиран-2-ола в 3 мл пиридина. Содержимому давали постепенно нагреться до комнатной температуры и перемешивали в течение ночи. Пиридин удаляли в вакууме при комнатной температуре и остаток растирали в этиловом эфире. Смесь фильтровали и фильтрат сушили (MgSO4). Концентрирование давало 840 мг масла, которое очищали с помощью хроматографии на силикагеле, используя смесь 3:2 гексан/EtOAc в качестве элюента с получением 337 мг (37%) α-аномерного карбамата в виде более высокого компонента Rf; 1H ЯМР (400 МГц, CDCl3) δ 8,30 (д, J=9,3 Гц, 2H), 7,43 (д, J=9,2 Гц, 2H), 6,12 (д, J=2,3 Гц, 1H), 3,73-3,71 (м, 2H), 3,58 (с, 3H), 3,56 (с, 3H), 3,56 (с, 3H), 3,52 (м, 1H), 3,23 (т, J=9,2 Гц, 1H), 1,36 (д, J=6,2 Гц, 3H); и 157 мг (17%) β-аномерного карбамата в виде более низкого компонента Rf; 1H ЯМР (300 МГц, CDCl3) δ 8,32 (д, J=9,3 Гц, 2H), 7,42 (д, J=9,3 Гц, 2H), 5,57 (д, J=2,1 Гц, 1H), 3,87 (м, 1H), 3,71 (с, 3H), 3,59 (с, 3H), 3,56 (с, 3H), 3,43 (м, 1H), 3,31-3,18 (м, 2H), 1,43 (д, J=6,2 Гц, 3H); т.пл. 113-116°C.
Стадия 2. К охлажденной на ледяной бане смеси 126 мг (0,40 ммоль) 4-[2-(4-трифторметилфенил)пиримидин-4-ил]фениламина в 1 мл сухого толуола добавляли по каплям с помощью шприца 1,6 мл (0,80 ммоль) 0,5M раствора гексаметилдисилазида калия в толуоле в течение 10-15 минутного периода времени. К этой смеси затем добавляли по каплям раствор 148 мг (0,400 ммоль) 4-нитрофенилового эфира 3,4,5-триметокси-6-метилтетрагидропиран-2-илового эфира карбоновой кислоты в 2 мл толуола. Содержимому давали постепенно нагреться до комнатной температуры и перемешивали в течение ночи и добавляли к холодному насыщенному раствору бикарбоната натрия. Смесь экстрагировали два раза хлороформом и объединенные экстракты сушили (MgSO4). Концентрирование давало 130 мг продукта, который очищали с помощью хроматографии на силикагеле, используя смесь 9:1 DCM/EtOAc с получением 64 мг (29%) соединения 232. 1H ЯМР (300 МГц, CDCl3) δ 8,87 (д, J=5,2 Гц, 1H), 8,71 (д, J=8,2 Гц, 2H), 8,26 (д, J=8,8 Гц, 2H), 7,79 (д, J=8,2 Гц, 2H), 7,65 (д, J=5,2 Гц, 1H), 7,63 (д, 2H), 6,86 (ушир.с, 1H), 6,26 (д, J=1,9 Гц, 1H), 3,74-3,70 (м, 2H), 3,61 (с, 3H), 3,60 (с, 3H), 3,57 (с, 3H), 3,53 (м, 1H), 3,24 (т, J=9,5 Гц, 1H), 1,36 (д, J=6,0 Гц, 3H); МС (API-ES+) 549 ([M+H]+, 10), 358 (100); т.пл. 176-179°C.
Пример 72
Получение (2S,3R,4R,5S,6S)-3,4,5-триметокси-6-метилтетрагидропиран-2-илового эфира {4-[2-(4-метоксифенил)пиримидин-4-ил]фенил}карбаминовой кислоты (соединение 234)
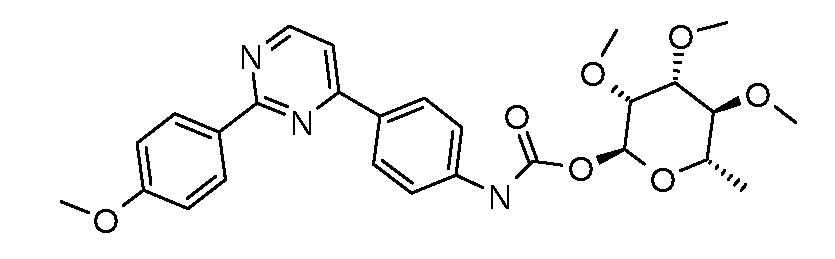
К охлажденной на ледяной бане смеси 112 мг (0,404 ммоль) 4-[2-(4-метоксифенил)пиримидин-4-ил]фениламина в 1,5 мл сухого ТГФ добавляли по каплям с помощью шприца 0,81 мл (0,40 ммоль) 0,5 M раствора гексаметилдисилазида калия в толуоле в течение 10-15 минутного периода времени. Этот раствор затем добавляли по каплям с помощью шприца к охлажденному на ледяной бане раствору 126 мг (0,386 ммоль) 4-нитрофенилового эфира 3,4,5-триметокси-6-метилтетрагидропиран-2-илового эфира карбоновой кислоты в 2 мл ТГФ. Содержимому давали постепенно нагреться до комнатной температуры и перемешивали в течение ночи и добавляли к холодному насыщенному раствору бикарбоната натрия. Смесь экстрагировали два раза этиловым эфиром и объединенные экстракты сушили (MgSO4). Концентрирование давало масло красного цвета, которое очищали с помощью хроматографии на силикагеле, используя смесь 1:1 гексан/EtOAc с получением 16 мг (8%) соединения 234. 1H ЯМР (300 МГц, CDCl3) δ 8,79 (д, J=5,2 Гц, 1H), 8,55 (д, J=8,8 Гц, 2H), 8,25 (д, J=8,8 Гц, 2H), 7,62 (д, J=8,5 Гц, 2H), 7,53 (д, J=5,5 Гц, 1H), 7,05 (д, J=9,0 Гц, 2H), 6,84 (ушир.с, 1H), 6,26 (д, J=1,7 Гц, 1H), 3,92 (с, 3H), 3,71-3,69 (м, 2H), 3,61 (с, 3H), 3,60 (с, 3H), 3,57 (с, 3H), 3,55-3,47 (м, 1H), 3,24 (т, J=9,4 Гц, 1H), 1,36 (д, J=6,1 Гц, 3H); МС (API-ES+) 510 ([M+H]+, 100).
Пример 73
Получение (2S,3R,4R,5S,6S)-3,4,5-триметокси-6-метилтетрагидропиран-2-илового эфира {2-хлор-4-[3-(4-трифторметилфенил)-[1,2,4]триазол-1-ил]фенил}карбаминовой кислоты (α-аномер, соединение 189) и (2R,3R,4R,5S,6S)-3,4,5-триметокси-6-метилтетрагидропиран-2-илового эфира {2-хлор-4-[3-(4-трифторметилфенил)-[1,2,4]триазол-1-ил]фенил}карбаминовой кислоты (β-аномер, соединение 190))
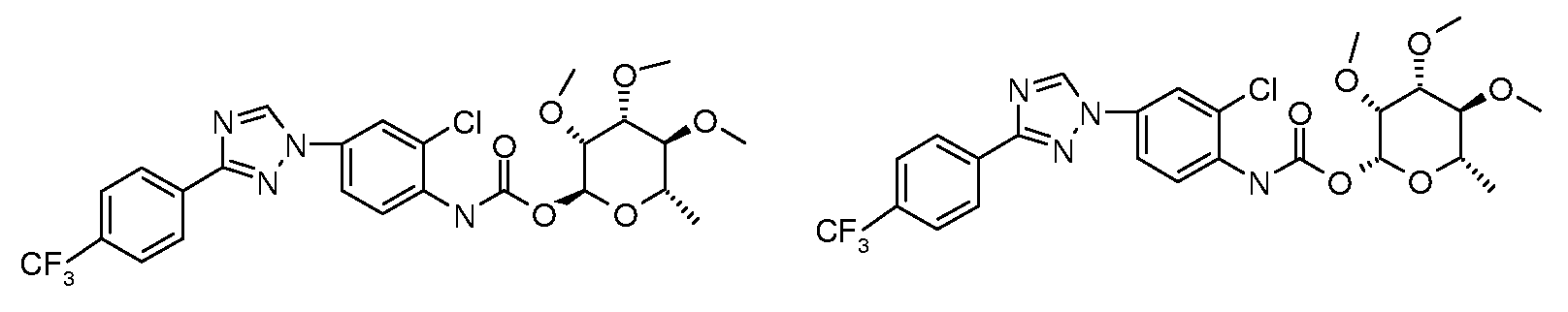
Раствор анилина (0,45 г, 1,3 ммоль) в сухом ТГФ (5 мл) обрабатывали 2 мл 20% раствор фосгена в толуоле (4 ммоль). Раствор герметично закрывали и выдерживали в течение 18 час, затем концентрировали и опять растворяли в 5 мл сухого ТГФ. Этот раствор, в котором растворение прошло не полностью, обрабатывали три-O-метилрамнопиранозидом (0,3 г, 1,45 ммоль) и триэтиламином (0,2 мл, 1,6 ммоль) и раствор нагревали при кипячении с обратным холодильником в течение 1 часа. Данные ТСХ показывали, что образовывались два новых более полярных продукта. Раствор концентрировали в вакууме, затем сразу наносили на колонку Biotage и элюировали с помощью раствора 1:1:1 EtOAc/гексан/DCM. Два новых продукта выделяли и концентрировали с получением 75 мг α-аномера (соединение 189) и 110 мг β-аномера (соединение 190). Для α-аномера: 1H ЯМР (300 МГц, CDCl3) δ 8,60 (с, 1H), 8,41 (д, J=8 Гц, 1H), 8,33 (д, J=7,8 Гц, 2H), 7,90 (д, J=1 Гц, 1H), 7,75 (д, J=7,8 Гц, 2H), 7,65 (дд, J=1, 8 Гц, 1H), 6,22 (д, J=1,2 Гц, 1H), 3,8-3,65 (м, 2H), 3,65-3,5 (м, 10H), 3,22 (т, J=9,2 Гц, 1H), 1,36 (д, J=6,3 Гц, 3H); т.пл. 175°C. Для β-аномера: 1H ЯМР (300 МГц, CDCl3) δ 8,60 (с, 1H), 8,38 (д, J=8 Гц, 1H), 8,37 (д, J=7,8 Гц, 2H), 7,90 (д, J=1,5 Гц, 1H), 7,75 (д, J=7,8 Гц, 2H), 7,65 (дд, J=1,5, 8 Гц, 1H), 7,45 (с, 1H, NH), 5,72 (с, 1H), 3,85 (м, 1H), 3,75 (с, 3H), 3,62 (с, 3H), 3,58 (с, 3H), 3,45 (м, 1H), 3,35 (м, 1H), 3,22 (т, J=9,2 Гц, 1H), 1,36 (д, J=6,3 Гц, 3H).
Пример 74
Получение (2S,3R,4R,5S,6S)-3,4,5-триметокси-6-метилтетрагидропиран-2-илового эфира {4-[1-(4-трифторметоксифенил)-1H-[1,2,4]триазол-3-ил]фенил}карбаминовой кислоты (соединение 191)
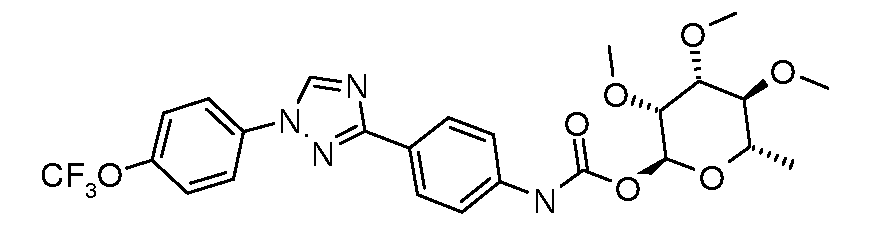
Анилин (0,15 г, 0,47 ммоль) помещали в 5 мл DCM и обрабатывали ди-трет-бутилтрикарбонатом (0,15 г 0,57 ммоль). Раствор оставляли перемешиваться с помощью магнитной мешалки в течение 1 час и затем концентрировали в вакууме и повторно растворяли в сухом ТГФ. К этому раствору добавляли три-O-метил рамнопиранозид (0,13 г, 0,63 ммоль) и триэтиламин (0,1 г, 1 ммоль) и раствор нагревали при кипячении с обратным холодильником в течение 1 час, затем охлаждали, концентрировали и очищали с помощью хроматографии (1:1:1 гексан/EtOAc/DCM) с получением 160 мг соединения 191 в виде твердого продукта белого цвета. 1H ЯМР (300 МГц, CDCl3) δ 8,55 (с, 1H), 8,16 (д, J=8,7 Гц, 2H), 7,79 (д, J=9,1 Гц, 2H), 7,53 (д, J=8,7 Гц, 2H), 7,38 (д, J=8,8 Гц, 2H), 6,78 (с, 1H), 6,23 (д, J=1,9 Гц, 1H), 3,70 (м, 2H), 3,59 (с, 3H), 3,57 (с, 3H), 3,54 (с, 3H), 3,51 (м, 1H), 3,21 (т, J=9,4 Гц, 1H), 1,34 (д, J=6,2 Гц, 3H); МС 553,0 (M+H); т.пл. 186-188°C.
Пример 75
Получение (2S,3R,4R,5S,6S)-4-этокси-3,5-диметокси-6-метилтетрагидропиран-2-илового эфира {4-[1-(4-пентафторэтилоксифенил)-1H-[1,2,4]триазол-3-ил]фенил}карбаминовой кислоты и (2R,3R,4R,5S,6S)-4-этокси-3,5-диметокси-6-метилтетрагидропиран-2-илового эфира {4-[1-(4-пентафторэтилоксифенил)-1H-[1,2,4]триазол-3-ил]фенил}карбаминовой кислоты (соединения 201 и 202)
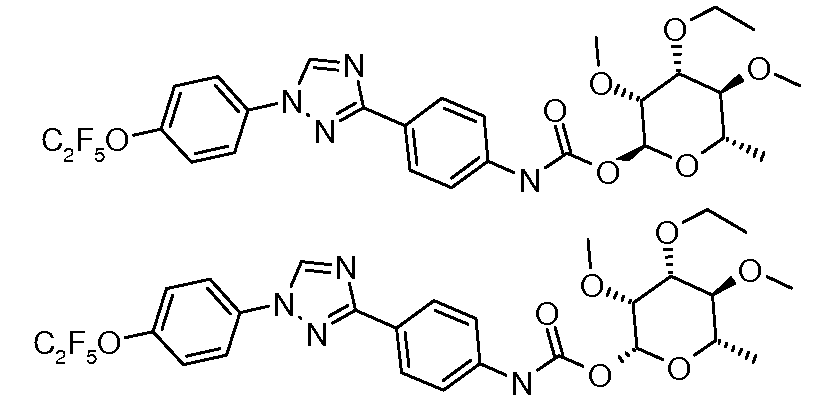
Раствор 4-[1-(4-пентафторэтилоксифенил)-1H-[1,2,4]триазол-3-ил]фениламина (1,0 г, 2,7 ммоль) перемешивали в 8 мл сухого ТГФ и при этом добавляли одной порцией п-нитрофенилхлорформиат (0,60 г, 3 ммоль) и раствор оставляли перемешиваться в течение 3 час. Полученный твердый продукт фильтровали и сушили на воздухе и затем вновь суспендировали в 15 мл сухого ТГФ. Добавляли 3'-O-этилрамнозу (0,6 г, 2,7 ммоль), далее 0,12 г 60% NaH (2,7 ммоль). Раствор затем нагревали при кипячении с обратным холодильником в течение 30 мин, затем добавляли другой эквивалент NaH и нагревание продолжали в течение еще 60 мин. Смесь охлаждали и выливали на 50 мл смеси лед/вода, экстрагировали эфиром, сушили и концентрировали. Данные ТСХ показывали приблизительное соотношение α- и β- аномеров как 90:10, аномеры разделяли с помощью хроматографии на силикагеле (30% ацетон в гексанах). Для α-аномера (соединение 201): 1H ЯМР (CDCl3) δ 8,59 (с, 1H), 8,20 (д, J=9 Гц, 2H), 7,81 (д, J=8 Гц, 2H), 7,5 (д, J=8 Гц, 2H), 7,40 (д, J=9 Гц, 2H), 6,90 (с, 1H), 6,22 (с, 1H), 3,80-3,52 (м, 11H), 3,20 (т, J=9,3 Гц, 1H), 1,33 (м, 6H); EIMS 617,0 m/z (M+); т.пл. 192-193°C. Для β-аномера (соединение 202): 1H ЯМР (CDCl3) δ 8,59 (с, 1H), 8,20 (д, J=9 Гц, 2H), 7,81 (д, J=8 Гц, 2H), 7,5 (д, J=8 Гц, 2H), 7,40 (д, J=9 Гц, 2H), 7,0 (с, 1H), 5,72 (с, 1H), 3,80-3,20 (м, 12H), 1,33 (м, 6H); EIMS 617,0 m/z (M+).
Пример 76
Получение (2S,3R,4R,5S,6S)-4-пропокси-3,5-диметокси-6-метилтетрагидропиран-2-илового эфира {4-[1-(4-пентафторэтилоксифенил)-1H-[1,2,4]триазол-3-ил]фенил}карбаминовой кислоты (соединение 207)
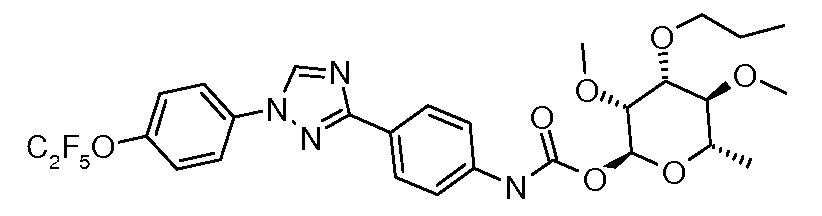
Раствор 4-[1-(4-пентафторэтилоксифенил)-1H-[1,2,4]триазол-3-ил]бензоилазида (описанный в примере 27) (12,5 г, 29,5 ммоль) в 150 мл сухого толуола нагревали при температуре 110°C в течение 90 мин, затем охлаждали до комнатной температуры и обрабатывали 3-O-пропил-2,4-ди-O-метил L-рамнозой (6,9 г, 29,5 ммоль) и 2,4 г 60% NaH (60 ммоль). Раствор затем нагревали до температуры 40°C в течение 1 час и потом охлаждали до температуры окружающей среды и выливали в 150 мл смеси лед/вода, экстрагировали эфиром, сушили и концентрировали. Сырой продукт очищали с помощью хроматографии на силикагеле и затем перекристаллизовывали из смеси эфир-гексан с получением 9,6 г соединения 207. 1H ЯМР (300 МГц, CDCl3) δ 8,58 (с, 1H), 8,2 (д, J=8 Гц, 2H), 7,82 (д, J=8 Гц, 2H), 7,55 (д, J=9 Гц, 2H), 7,41 (д, J=9 Гц, 2H), 6,81 (с, 1H), 6,22 (д, J=1,5 Гц, 1H), 3,75-3,44 (м, 11H), 3,23 (т, J=9,3 Гц, 1H), 1,71 (м, 2H), 1,35 (д, J=6,3 Гц, 3H), 1,00 (т, J=7,5 Гц, 3H); МС 630,0 (M+H); т.пл. 158°C.
Соединения по настоящему изобретению, указанные в таблице 6, получали путями, описанными ранее и проиллюстрированными в примерах 71-76.
Пример 77
Получение (2S,3R,4R,5S,6S)-3,4,5-триметокси-6-метилтетрагидропиран-2-илового эфира {4-[1-(4-трифторметоксифенил)-1H-имидазолил]фенил}тиокарбаминовой кислоты (соединение 176)
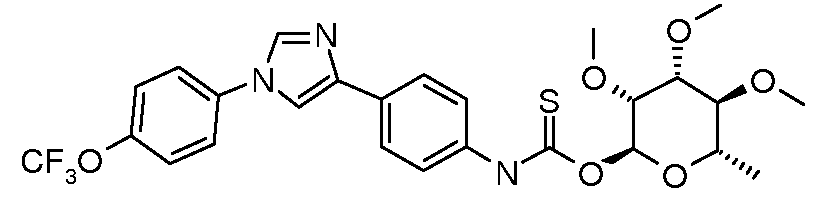
К раствору 150 мг (0,47 ммоль) 4-[1-(4-трифторметоксифенил)-1H-имидазол-4-ил]фениламина в 5 мл DCM, охлажденному до 0°C, добавляли 0,09 г (0,50 ммоль) тиокарбонилдиимидазола (TDI) и 0,07 г (0,5 ммоль) диизопропилэтиламина (основание Ханига). Через 30 мин добавляли другой эквивалент TDI и основание Ханига и раствор оставляли нагреваться до температуры окружающей среды, затем концентрировали и очищали с помощью хроматографии (50:50 EtOAc-гексаны) с получением 0,10 г изотиоцианата в виде твердого продукта не совсем белого цвета. Этот продукт затем растворяли в 5 мл сухого ТГФ и обрабатывали 60 мг (0,29 ммоль) три-O-метил рамнозы и 20 мг (0,5 ммоль) 60% NaH. Раствор оставляли перемешиваться при комнатной температуре в течение 3 час, после чего распределяли между водой и EtOAc. Органический слой затем сушили и концентрировали. Хроматография давала 30 мг соединения 176 в виде бесцветного твердого продукта. 1H ЯМР (300 МГц, CDCl3) δ д 7,94 (с, 1H), 7,80 (д, J=7,5 Гц, 2H), 7,50 (м, 3 H), 7,40 (д, J=7 Гц, 2H), 7,3 (с, 1H), 7,23 (ушир.д, J=7 Гц, 2H), 6,80 (с, 1H), 3,90-3,20 (м, 13H), 1,39 (д, J=6,3 Гц, 3H); МС 568,9 (M+H); т.пл. 129°C.
Следующий далее тиокарбамат также был получен путем, описанным в предыдущем примере.
Пример 78
Получение (2S,3R,4R,5S,6S)-4-этокси-3,5-диметокси-6-метилтетрагидропиран-2-илового эфира {4-[1-(4-пентафторэтилоксифенил)-1H-[1,2,4]триазол-3-ил]фенил}тиокарбаминовой кислоты (соединение 203)
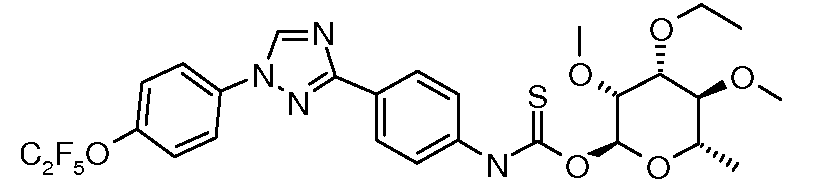
1H ЯМР (400 МГц, CDCl3) δ 8,59 (с, 1H), 8,24 (д, J=7,6 Гц, 2H), 7,80 (м, 4H), 7,40 (д, J=8,9 Гц, 2H), 6,79 (д, J=0,8 Гц, 1H), 3,90-3,40 (м, 10H),,3,22 (м, 1H), 3,18 (т, J=9,3 Гц, 1H), 1,3 (м, 6H); МС 633,0 (M+H); т.пл. 126°C.
Пример 79
Получение (2S,3R,4R,5S,6S)-3,4,5-триметокси-6-метилтетрагидропиран-2-илового эфира {4-[1-(4-пентафторэтилоксифенил)-1H-[1,2,4]триазол-3-ил]фенил}тиокарбаминовой кислоты (соединение 211)
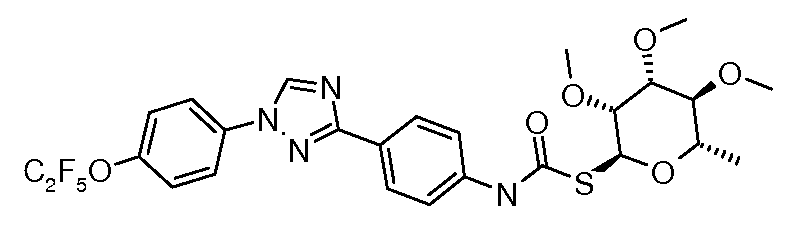
Азид, полученный в примере 27 (0,22 г, 0,52 ммоль), растворяли в 5 мл толуола и нагревали до температуры 110°C в течение 1 час, затем охлаждали и обрабатывали три-O-метил тиорамнопиранозидом (0,125 г, 0,56 ммоль). Раствор нагревали до температуры 40°C в течение 1 час, затем охлаждали, концентрировали и очищали с помощью хроматографии (0-100% EtOAc/гексаны) с получением 75 мг соединения 211 в виде смолистого твердого продукта бледно-желтого цвета. 1H ЯМР (300 МГц, CDCl3) δ 8,58 (с, 1H), 8,18 (д, J=8,7 Гц, 2H), 7,79 (д, J=9,1 Гц, 2H), 7,53 (д, J=8,7 Гц, 2H), 7,38 (д, J=8,8 Гц, 2H), 6,78 (с, 1H), 6,23 (д, J=1,9 Гц, 1H), 3,70 (м, 2H), 3,59 (с, 3H), 3,57 (с, 3H), 3,54 (с, 3H), 3,51 (м, 1H), 3,21 (т, J=9,4 Гц, 1H), 1,34 (д, J=6,2 Гц, 3H).
Пример 80
Получение (2S,3R,4R,5S,6S)-4-этокси-3,5-диметокси-6-метилтетрагидропиран-2-илового эфира {4-[1-(4-трифторметоксифенил)-1H-имидазол-4-ил]фенил}тиокарбаминовой кислоты (соединение 177)
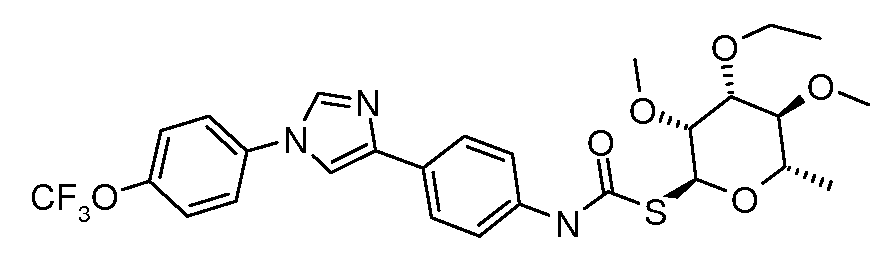
(2S,3R,4R,5S,6S)-4-Этокси-3,5-диметокси-6-метилтетрагидропиран-2-тиол (0,080 г, 0,34 ммоль) объединяли с 4-нитрофениловым эфиром {4-[1-(4-трифторметоксифенил)-1H-имидазол-4-ил]фенил}карбаминовой кислоты (0,165 г, 0,34 ммоль) и основанием Ханига (0,06 г, 0,46 ммоль) в 3 мл ТГФ и раствор нагревали при температуре кипения с обратным холодильником в течение 2 час. Концентрирование и хроматография через колонку с силикагелем затем давали тиокарбамат (соединение 177) в виде твердого продукта светло-желтого цвета. 1H ЯМР δ 7,88 (с, 1H), 7,75 (д, J=7 Гц, 2H), 7,68 (с, 1H), 7,5 (д, J=7 Гц, 2H), 7,45 (с, 1H), 7,37 (д, J=8 Гц, 2H), 6,15 (д, J=1,5 Гц, 1H), 3,78-3,45 (м, 11H), 3,18 (т, J=9,2 Гц, 1H), 1,36 (д, J=6,2 Гц, 3H), 1,3 (т, J=7,5 Гц, 3H); т.пл. 173-176°C.
Пример 81
Получение 4-[1-(4-трифторметоксифенил)-1H-имидазол-4-ил]-N-((2S,3R,4R,5S,6S)-3,4,5-триметокси-6-метилтетрагидропиран-2-илокси)бензамида (соединение 171)
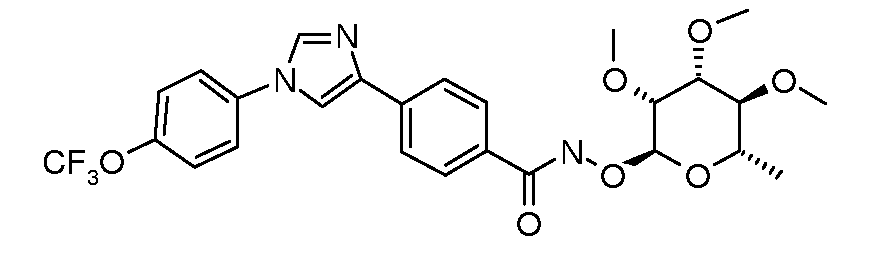
Раствор 4-[1-(4-трифторметоксифенил)-1H-имидазол-4-ил]бензойной кислоты (50 мг, 0,14 ммоль) обрабатывали избытком тионилхлорида и быстро нагревали на паровой бане. Масло рыжевато-коричневого цвета затем концентрировали в вакууме и растворяли в 5 мл ТГФ. Добавляли соединение E-30 (44 мг, 0,2 ммоль) и этилдиизопропиламин (52 мг, 0,4 ммоль) и раствор оставляли перемешиваться в течение 15 мин. Раствор затем распределяли между водным NaHCO3 и эфиром и органический слой сушили, концентрировали и очищали с помощью хроматографии (50:50 EtOAc-гексаны) с получением 20 мг соединения 171 в виде бесцветного твердого продукта. 1H ЯМР (400 МГц, CDCl3) δ 7,90 (д, J=6,4 Гц, 2 H), 7,89 (с, 1H), 7,80 (д, J=8,6 Гц, 2H), 7,63 (д, J=1,3 Гц, 1H), 7,49 (д, J=9,3 Гц, 2H), 7,38 (д, J=8,9 Гц, 2H), 5,31 (с, 1H), 3,97 (м, 1H), 3,80 (м, 1H), 3,57 (с, 3H), 3,56 (с, 3H), 3,53 (с, 3H), 3,50 (м, 1H), 3,21 (т, J=9,4 Гц, 1H), 1,36 (д, J=6,2 Гц, 3H); МС 552,0 (M+); т.пл. 185°C.
Пример 82
Получение (2S,3R,4R,5S,6S)-4-этокси-3,5-диметокси-6-метилтетрагидропиран-2-илового эфира метил {4-[1-(4-трифторметоксифенил)-1H-[1,2,4]триазол-3-ил]фенил}карбаминовой кислоты (соединение 250)
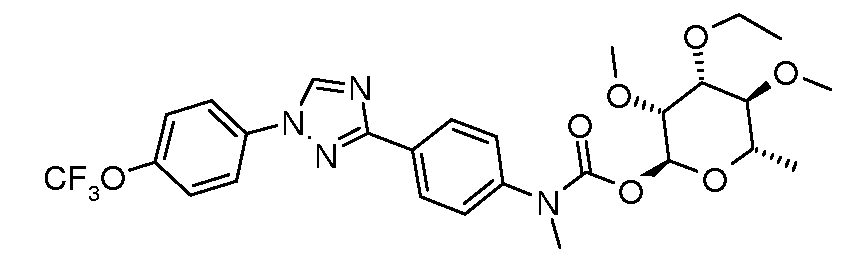
Соединение 193 (0,15 г, 0,26 ммоль) и иодметан объединяли в 5 мл сухого ДМФ и раствор перемешивали в атмосфере N2 и обрабатывали 0,025 г (0,62 ммоль) NaH (60% в масле). Раствор оставляли перемешиваться при комнатной температуре в течение ночи и затем распределяли между водой и Et2O. Высушивание, концентрирование и хроматография органического слоя давали 73 мг соединения 250 в виде бесцветной твердой пены. 1H ЯМР (300 МГц, CDCl3) δ 8,61 (с, 1H), 8,2 (д, J=8 Гц, 2H), 7,82 (д, J=8 Гц, 2H), 7,55 (д, J=9 Гц, 2H), 7,41 (д, J=9 Гц, 2H), 6,17 (с, 1H), 3,7-3,4 (м, 11H), 3,39 (с, 3H, N-CH3), 3,18 (т, J=9 Гц, 1H), 1,35 (д, J=6,3 Гц, 3H), 1,2 (т, J=7 Гц, 3H); МС 581,9 ([M+H]+).
Пример 83
Получение (2S,3R,4R,5S,6S)-4-этокси-3,5-диметокси-6-метилтетрагидропиран-2-илового эфира метил {4-[1-(4-пентафторэтоксифенил)-1H-[1,2,4]триазол-3-ил]фенил}карбаминовой кислоты (соединение 251)
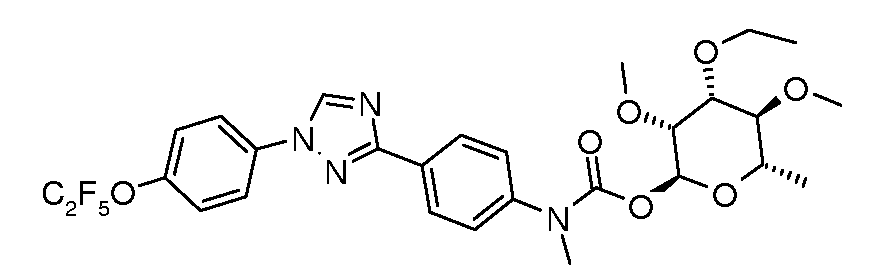
Соединение 207 подвергали метилированию как в примере 82 с получением соединения 251. 1H ЯМР (300 МГц, CDCl3) δ 8,60 (с, 1H), 8,20 (д, J=6 8 Гц, 2H), 7,83 (д, J=8,8 Гц, 2H), 7,41 (д, J=9 Гц, 2H), 7,39 (д, J=8,6 Гц, 2H), 6,17 (с, 1H), 3,70-3,40 (м, 11H), 3,39 (с, 3H, NCH3), 1,38 (д, J=6,0 Гц, 3H), 1,20 (т, J=7,5 Гц, 3H); МС 630,99 ([M+H]+).
Пример 84
Получение (2S,3R,4R,5S,6S)-4-этокси-3,5-диметокси-6-метилтетрагидропиран-2-илового эфира метил-{4-[1-(4-пентафторэтилоксифенил)-4,5-дигидро-1H-пиразол-4-ил]фенил}карбаминовой кислоты (соединение 252)
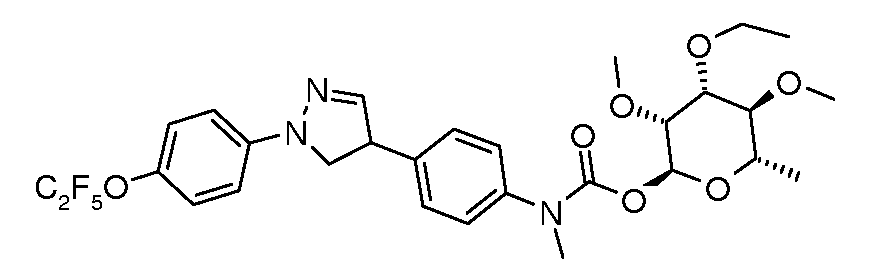
Соединение 179 подвергали метилированию как в примере 82 с получением соединения 252. 1H ЯМР (300 МГц, CDCl3) δ 7,68 (д, J=8,24 Гц, 2H), 7,24 (д, J=8,24 Гц, 2H), 7,12 (д, J=8,28 Гц, 2H), 7,08 (д, J=8,28 Гц, 2H), 6,12 (д, J=1,85 Гц, 1H), 3,92 (т, J=9,44 Гц, 2H), 3,79-3,61 (м, 4H), 3,57 (с, 3H), 3,56 (с, 3H), 3,44 (дд, J=9,31, 3,36 Гц, 1H), 3,38 (с, 3H), 3,32-3,18 (м, 3H), 1,36-1,23 (м, 6H); EI/МС 631 (M+).
Пример 85
Получение (2S,3R,4R,5S,6S)-4-пропокси-3,5-диметокси-6-метилтетрагидропиран-2-илового эфира этил {4-[1-(4-пентафторэтоксифенил)-1H-[1,2,4]триазол-3-ил]фенил}карбаминовой кислоты (соединение 253)
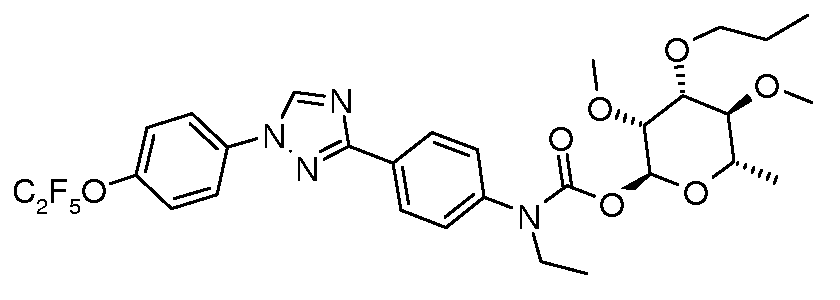
Соединение 207 N-этилировали как в примере 82, используя иодэтан вместо иодметана, с получением соединения 253. 1H ЯМР (300 МГц, CDCl3) δ 8,60 (с, 1H), 8,22 (д, J=6 8 Гц, 2H), 7,83 (д, J=8,8 Гц, 2H), 7,41 (д, J=9 Гц, 2H), 7,39 (д, J=8,6 Гц, 2H), 6,17 (с, 1H), 3,8 (кв, J=7,5 Гц, 2H), 3,60-3,30 (м, 11H), 3,10 (ушир.с, 1H), 1,38 (д, J=6,0 Гц, 3H), 1,20 (т, J=7,5 Гц, 3H); МС 659,12 ([M+H]+).
Пример 86
Получение (2S,3R,4R,5S,6S)-4-этокси-3,5-диметокси-6-метилтетрагидропиран-2-илового эфира метоксиметил {4-[1-(4-трифторметоксифенил)-1H-[1,2,4]триазол-3-ил]фенил}карбаминовой кислоты (соединение 254)
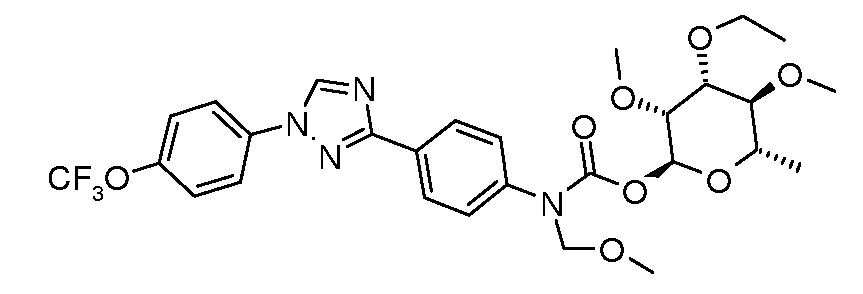
Соединение 193 (0,15 г, 0,26 ммоль) и бромметиловый метиловый эфир (78 мг, 0,6 ммоль) объединяли в 5 мл сухого ТГФ и раствор перемешивали в атмосфере N2 и обрабатывали 0,025 г (0,6 ммоль) NaH (60% в масле). Раствор оставляли перемешиваться при комнатной температуре в течение ночи и затем распределяли между водой и Et2O. Высушивание, концентрирование и хроматография органического слоя давали 110 мг соединения 254 в виде бесцветной твердой пены. 1H ЯМР (300 МГц, CDCl3) δ 8,61 (с, 1H), 8,24 (д, J=8 Гц, 2H), 7,82 (д, J=8 Гц, 2H), 7,4 (перекрывающий д, J=8 Гц, 4H), 6,17 (с, 1H), 5,05 (ушир.с, 2H), 3,6-3,3 (м, 14H), 3,18 (т, J=9 Гц, 1H), 1,35 (д, J=6,3 Гц, 3H), 1,2 (т, J=7 Гц, 3H); МС 611,8 ([M+H]+).
Пример 87
Получение (2S,3R,4R,5S,6S)-4-этокси-3,5-диметокси-6-метилтетрагидропиран-2-илового эфира метоксиметил {4-[1-(4-пентафторэтоксифенил)-1H-[1,2,4]триазол-3-ил]фенил}карбаминовой кислоты (соединение 255)
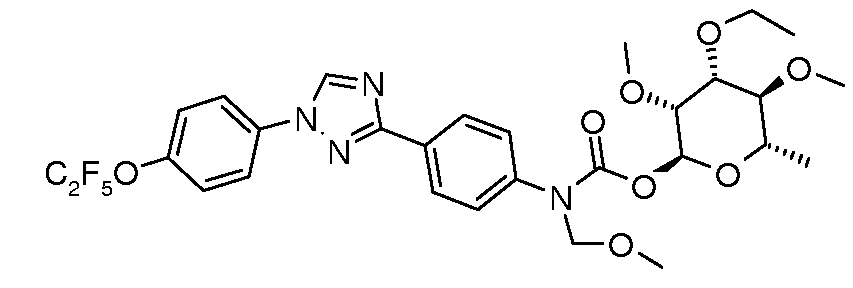
Метоксиметилирование соединения 201 в условиях, описанных в примере 86, давало соединение 255 в виде вязкой пены. 1H ЯМР (300 МГц, CDCl3) δ 8,61 (с, 1H), 8,22 (д, J=8 Гц, 2H), 7,82 (д, J=8 Гц, 2H), 7,4 (м, 4H), 6,17 (с, 1H), 5,05 (ушир.с, 2H), 3,6-3,3 (м, 14H), 3,18 (т, J=9 Гц, 1H), 1,35 (д, J=6,3 Гц, 3H), 1,2 (т, J=7 Гц, 3H); МС 661,8 ([M+H]+).
Пример 88
Получение (2S,3R,4R,5S,6S)-4-этокси-3,5-диметокси-6-метилтетрагидропиран-2-илового эфира аллил {4-[1-(4-пентафторэтоксифенил)-1H-[1,2,4]триазол-3-ил]фенил}карбаминовой кислоты (соединение 256)
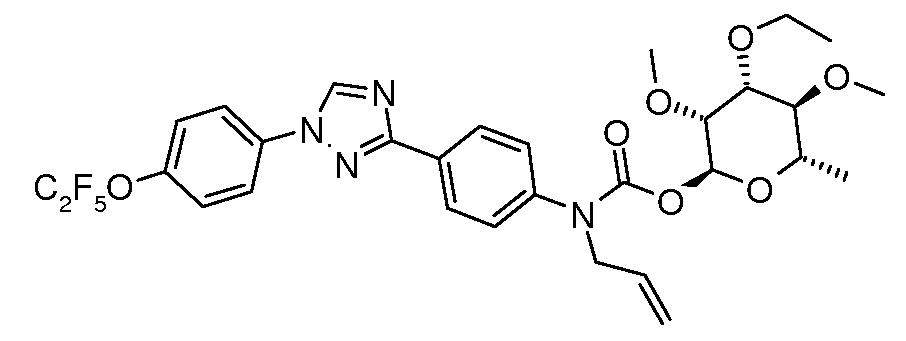
60% NaH (0,015 г, 0,40 ммоль) добавляли к раствору соединения 201 (0,15 г, 0,24 ммоль) и аллилбромида (0,41 г, 0,34 ммоль) в сухом ДМФ (1,1 мл) при температуре 0°C в атмосфере N2. Реакционную смесь затем оставляли нагреваться до температуры 25°C и перемешивали в течение 5 час, после чего выливали на лед-H2O (50 мл) и экстрагировали с помощью EtOAc (3×50 мл). Объединенные органические экстракты промывали H2O (50 мл) и сушили (Na2SO4), фильтровали и концентрировали. Хроматографирование давало соединение 256 (0,040 г, 25%) в виде смолистого твердого продукта белого цвета. 1H ЯМР (300 МГц, CDCl3) δ 8,59 (с, 1H), 8,21 (д, J=8,1 Гц, 2H), 7,83 (д, J=9,0 Гц, 2H), 7,42 (д, J=9,3 Гц, 2H), 7,35 (ушир., 2H), 6,17 (ушир., 1H), 6,00-5,92 (м, 1H), 5,27-5,17 (м, 2H), 4,34 (ушир., 2H), 3,80-3,30 (м, 11H), 3,08 (ушир., 1H), 1,44 (ушир., 3H), 1,30 (ушир., 3H); МС 657 ([M]+).
Пример 89
Получение (2S,3R,4R,5S,6S)-4-пропокси-3,5-диметокси-6-метилтетрагидропиран-2-илового эфира гидроксиметил {4-[1-(4-пентафторэтоксифенил)-1H-[1,2,4]триазол-3-ил]фенил}карбаминовой кислоты (соединение 257)
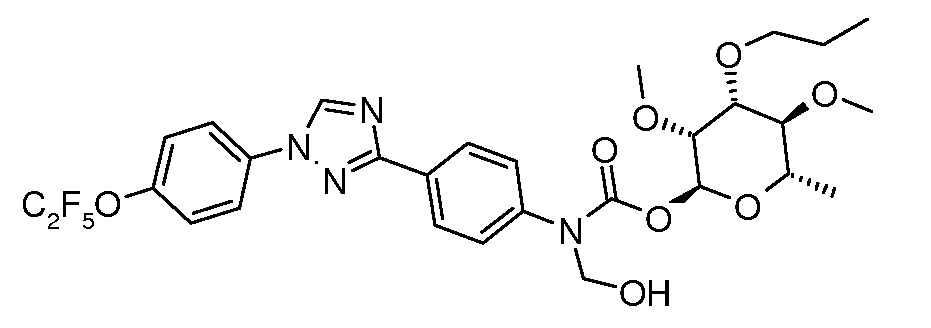
Раствор соединения 207 (0,15 г, 0,24 ммоль) растворяли в 4 мл DCM и обрабатывали параформальдегидом (50 мг, избыток) и трифторуксусной кислотой (250 мкл, избыток). Раствор перемешивали при комнатной температуре в течение 20 час и затем концентрировали в вакууме. Хроматография (от 0 до 100% EtOAc в гексане) давала 25 мг гидроксиметильного производного (соединение 257) в виде твердой пены. 1H ЯМР (300 МГц, CDCl3) δ 8,60 (с, 1H), 8,20 (д, J=6 8 Гц, 2H), 7,83 (д, J=8,8 Гц, 2H), 7,41 (д, J=9 Гц, 4H), 7,39 6,17 (с, 1H), 5,15 (дд, J=6, 14 Гц, 2H), 3,65-3,20 (м, 12H), 3,15 (ушир.с, 1H), 1,52 (м, 2H), 1,38 (д, J=6,0 Гц, 3H 0,95 (т, J=7,5 Гц, 3H); МС 661,10 ([M+H]+).
Пример 90
Получение (2S,3R,4R,5S,6S)-4-этокси-3,5-диметокси-6-метилтетрагидропиран-2-илового эфира ацетил {4-[1-(4-пентафторэтоксифенил)-1H-[1,2,4]триазол-3-ил]фенил}карбаминовой кислоты (соединение 258)
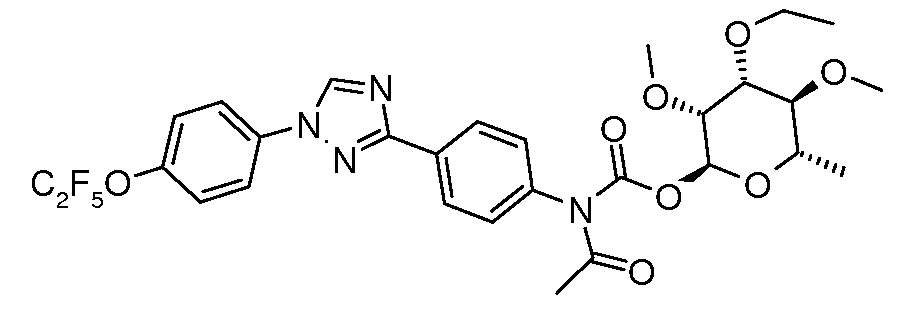
60% NaH (0,016 г, 0,40 ммоль) добавляли к раствору соединения 201 (0,15 г, 0,24 ммоль) в сухом ДМФ (1,1 мл) при температуре 0°C в атмосфере N2 и смесь перемешивали в течение ~5 мин. Затем добавляли ацетилхлорид (0,03 мл, 0,42 ммоль) и реакционную смесь оставляли нагреваться до температуры 25°C и перемешивали всего в течение 64 час. Смесь выливали на лед-H2O (50 мл) и экстрагировали с помощью EtOAc (3×50 мл). Объединенные органические экстракты промывали H2O (50 мл) и насыщенным водным NaCl (75 мл) и сушили (Na2SO4), фильтровали и концентрировали. Хроматографирование давало соединение 258 (0,042 г, 26%) в виде твердого продукта светло-желтого цвета. 1H ЯМР (400 МГц, CDCl3) δ 8,59 (с, 1H), 8,29 (д, J=8,1 Гц, 2H), 7,81 (д, J=9,0 Гц, 2H), 7,40 (д, J=9,1 Гц, 2H), 7,24 (д, J=8,5 Гц, 2H), 6,07 (д, J=2,0 Гц, 1H), 3,48 (с, 3H), 3,41 (с, 3H), 3,49-3,35 (м, 1H), 3,31-3,20 (м, 3H), 3,04 (т, J=9,4 Гц, 1H), 2,74 (дд, J=9,8, 3,4 Гц, 1H), 2,69 (с, 3H), 1,25 (д, J=6,1 Гц, 3H), 1,01 (т, J=7,0 Гц, 3H); МС 658 (M+); т.пл. 70-72°C.
Пример 91
Получение метилового эфира 4-(((2S,3R,4R,5S,6S)-4-этокси-3,5-диметокси-6-метилтетрагидропиран-2-илоксикарбонил)-{4-[1-(4-пентафторэтоксифенил)-1H-[1,2,4]триазол-3-ил]фенил}амино)-4-оксобутановой кислоты (соединение 259)
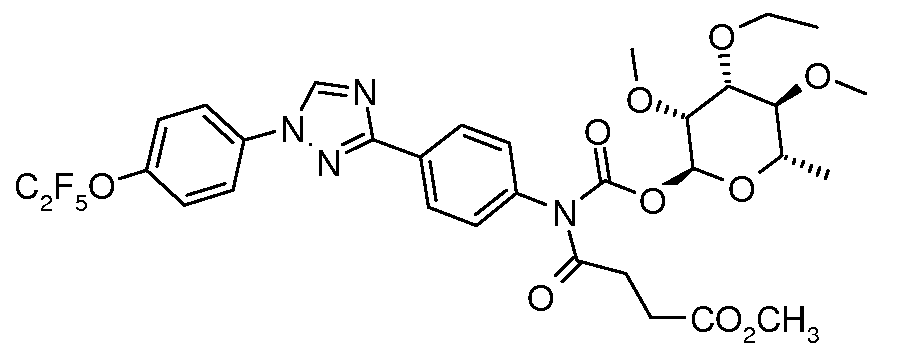
60% NaH (0,041 г, 1,0 ммоль) добавляли одной порцией к раствору соединения 201 (0,500 г, 0,81 ммоль) в сухом ДМФ (3,6 мл) при температуре 25°C и смесь перемешивали в течение ~5 мин. Затем добавляли метилсукцинил хлорид (0,12 мл, 0,97 ммоль) и реакционную смесь оставляли перемешиваться при температуре 60°C в течение 3 час. Смесь охлаждали, выливали в насыщенный водный NH4Cl (50 мл) и экстрагировали с помощью EtOAc (3×50 мл). Объединенные органические экстракты промывали H2O (50 мл) и насыщенным водным NaCl (75 мл) и сушили (Na2SO4), фильтровали и концентрировали. Хроматографирование давало соединение 259 (0,079 г, 13%) в виде твердого продукта белого цвета. 1H ЯМР (300 МГц, CDCl3) δ 8,60 (с, 1H), 8,30 (д, J=9,0 Гц, 2H), 7,82 (д, J=9,0 Гц, 2H), 7,41 (д, J=8,7 Гц, 2H), 7,29-7,22 (м, 2H), 6,08 (д, J=1,8 Гц, 1H), 3,70 (с, 3H), 3,50-3,19 (м, 9H), 3,05 (т, J=9,3 Гц, 1H), 2,79-2,69 (м, 3H), 1,29-1,22 (м, 6H), 1,03 (т, J=6,9 Гц, 3H); МС 730 (M+); т.пл. 72-76°C.
ИССЛЕДОВАНИЕ СОЕДИНЕНИЙ
Биологические исследования осуществляли на совке малой (BAW; Spodoptera exigua: Lepidoptera), проводя либо высокопроизводительное (HTS) биологическое исследование с применением 96-луночного титрационного микропланшета, либо исследование на 128-луночном планшете с питательной средой. HTS исследование основано на модификации, описанной Lewer et al. J. Nat. Prod. 2006, 69, 1506. Яйца BAW помещали поверх искусственной питательной среды (100 мкл) в каждую лунку 96-луночного титрационного микропланшета. Среду предварительно обрабатывали исследуемым соединением (12 мкг растворяли в 30 мкл смеси ДМСО-ацетон-вода), слоями поверх среды, используя систему для транспортировки жидкости, и затем оставляли сушиться в течение нескольких часов. Потом инвазированные планшеты накрывали слоем стерильной хлопковой ваты и планшетной крышкой и далее выдерживали в темноте при температуре 29°C. Гибель регистрировали в течение 6 дней после обработки. Каждый планшет имел шесть репликаций. Гибель, выраженную в процентном отношении, вычисляли из среднего значения шести репликаций. В случае исследования с 128-луночным планшетом с питательной средой, повторно три-пять взрослых личинок BAW помещали в каждую лунку (3 мл) планшета со средой, предварительно наполненного 1 мл искусственной питательной среды, на которую наносили (в каждую восьмую лунку) 50 мкг/см2 исследуемого соединения (растворенного в 50 мкл смеси 90:10 ацетон-вода) и затем оставляли сушится. Планшеты накрывали прозрачным самоприлипающим покрытием и выдерживали при температуре 25°C, 14:10 освещено-затемнено в течение шести дней. Гибель личинок, выраженную в процентном отношении, регистрировали для каждой лунки; затем активность в восьми лунках усредняли. Результаты для обоих биологических исследований представлены в таблице 7. В таблице 7, под заголовками BAW HTS или BAW 50, “A” обозначает, что соединение исследовали и, по меньшей мере, наблюдали 50 процентную гибель, тогда как, “B” обозначает, что либо (1) соединение исследовали и наблюдали менее чем 50 процентную гибель, либо (2) соединение не подвергали исследованию.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
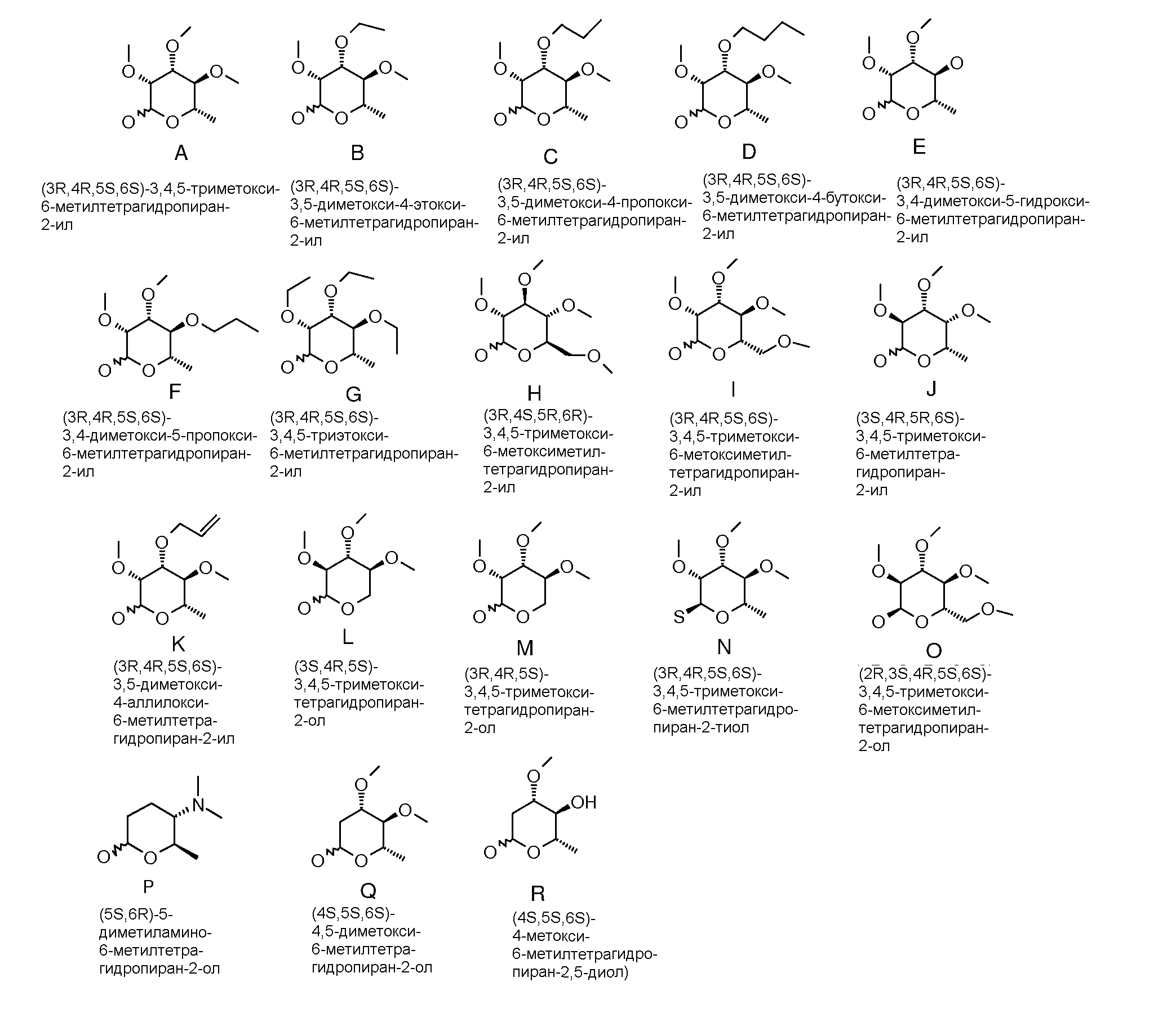
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
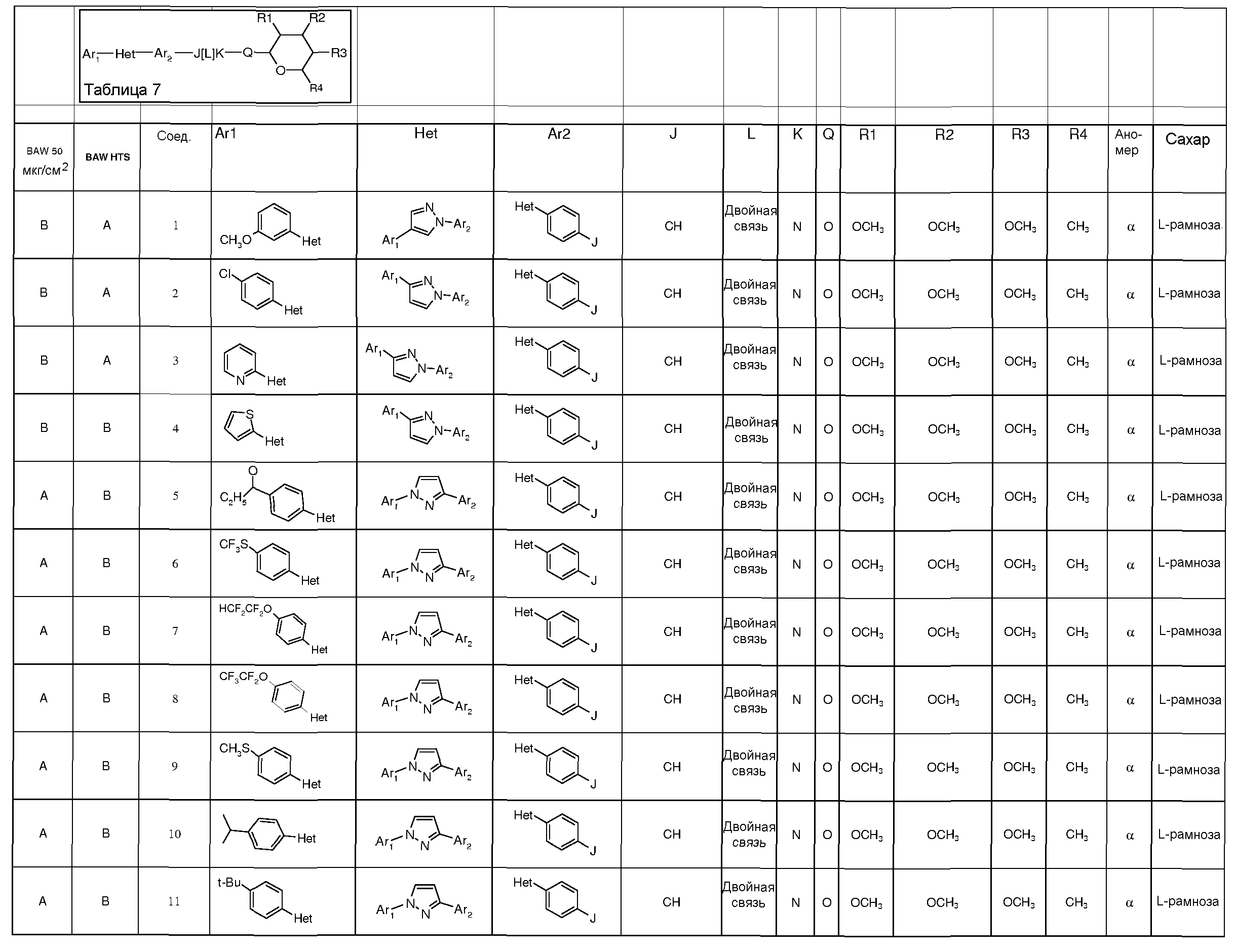

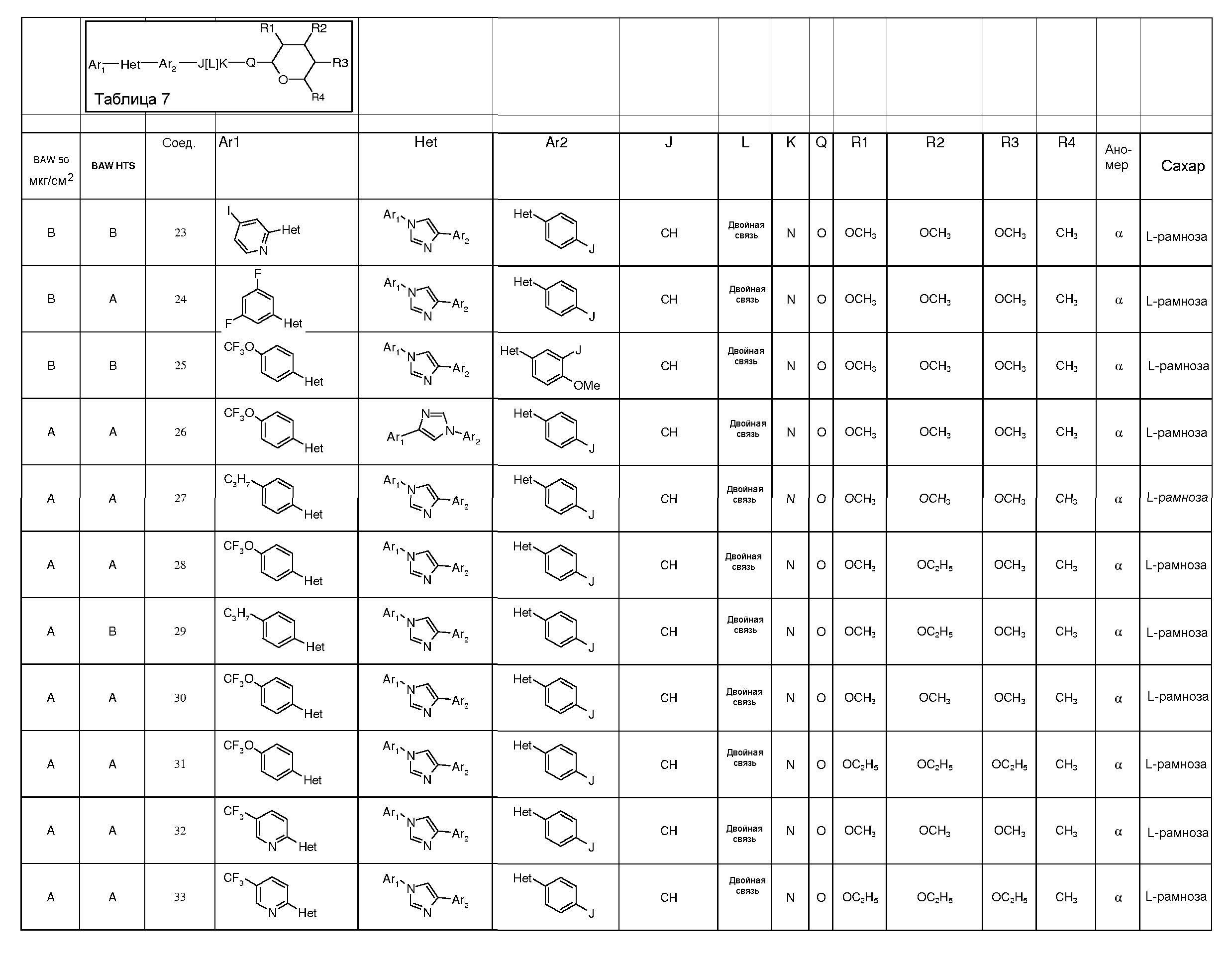
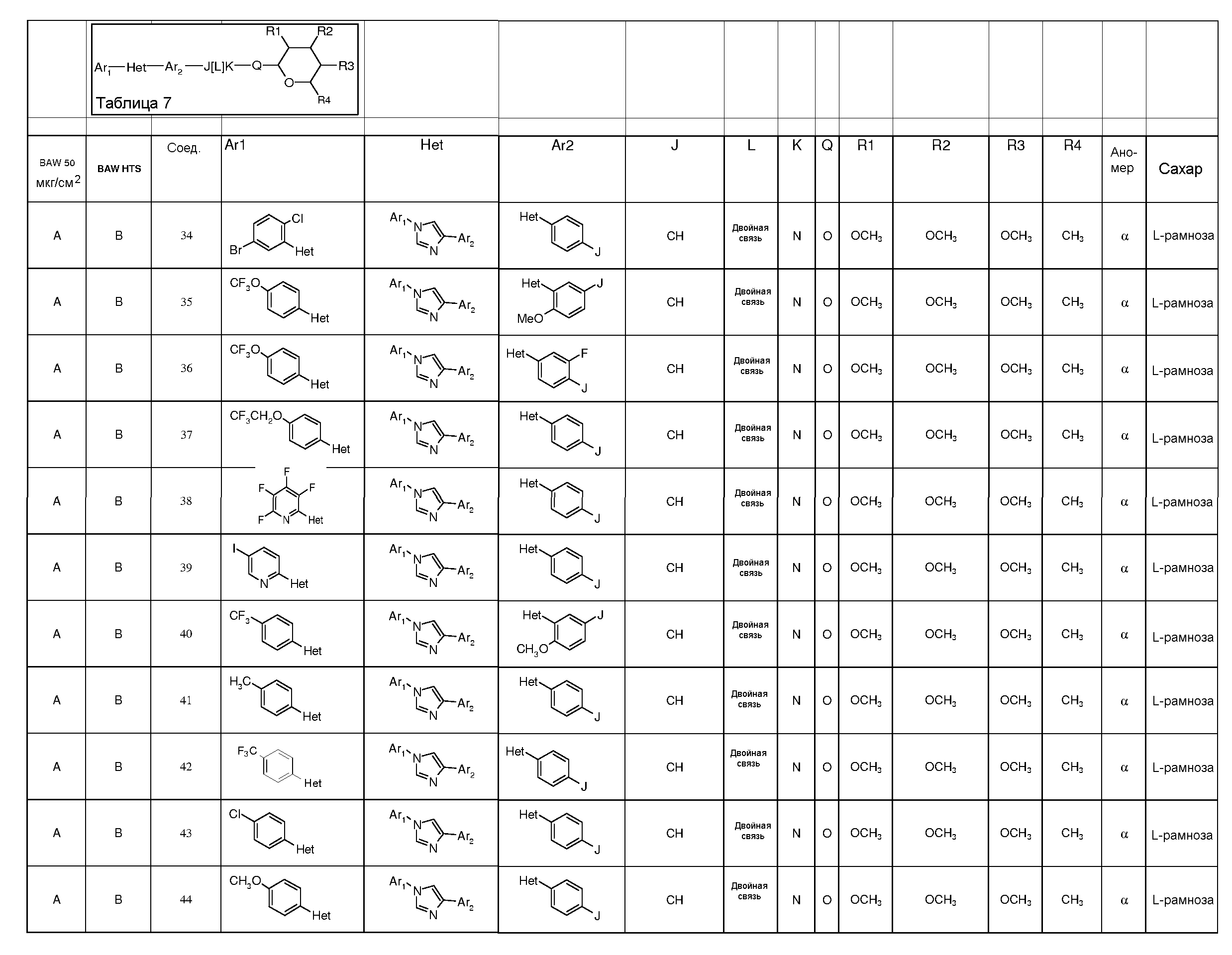
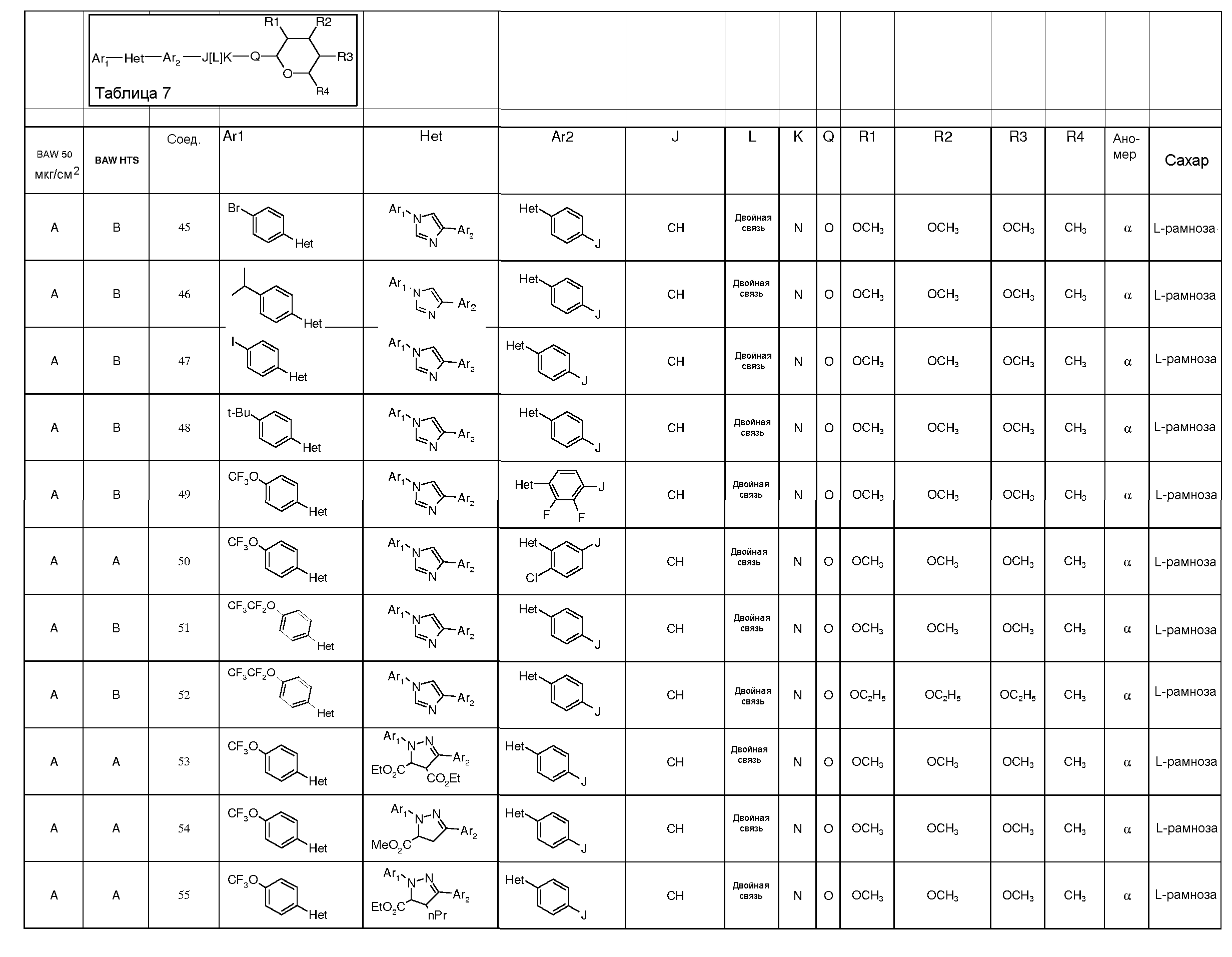
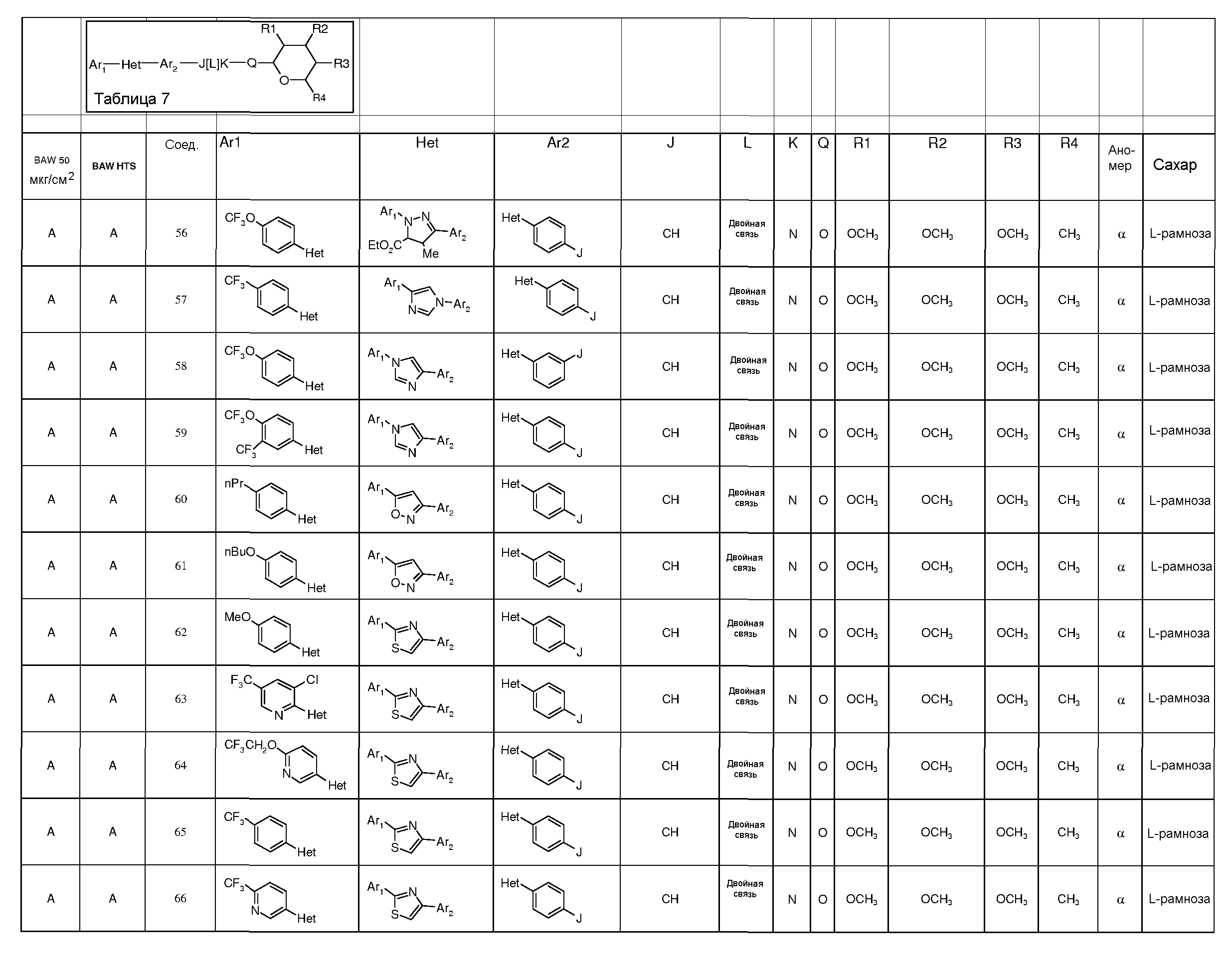
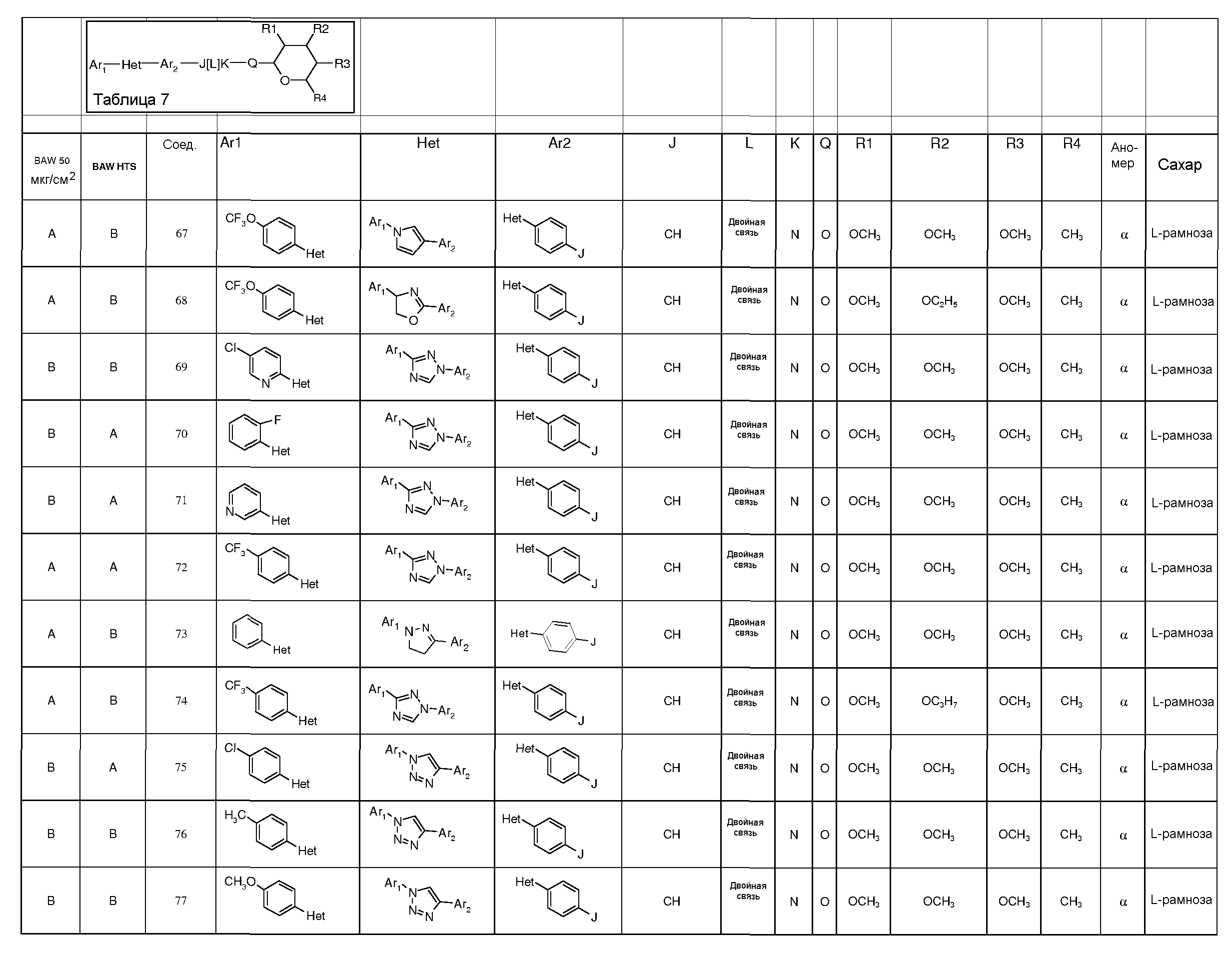
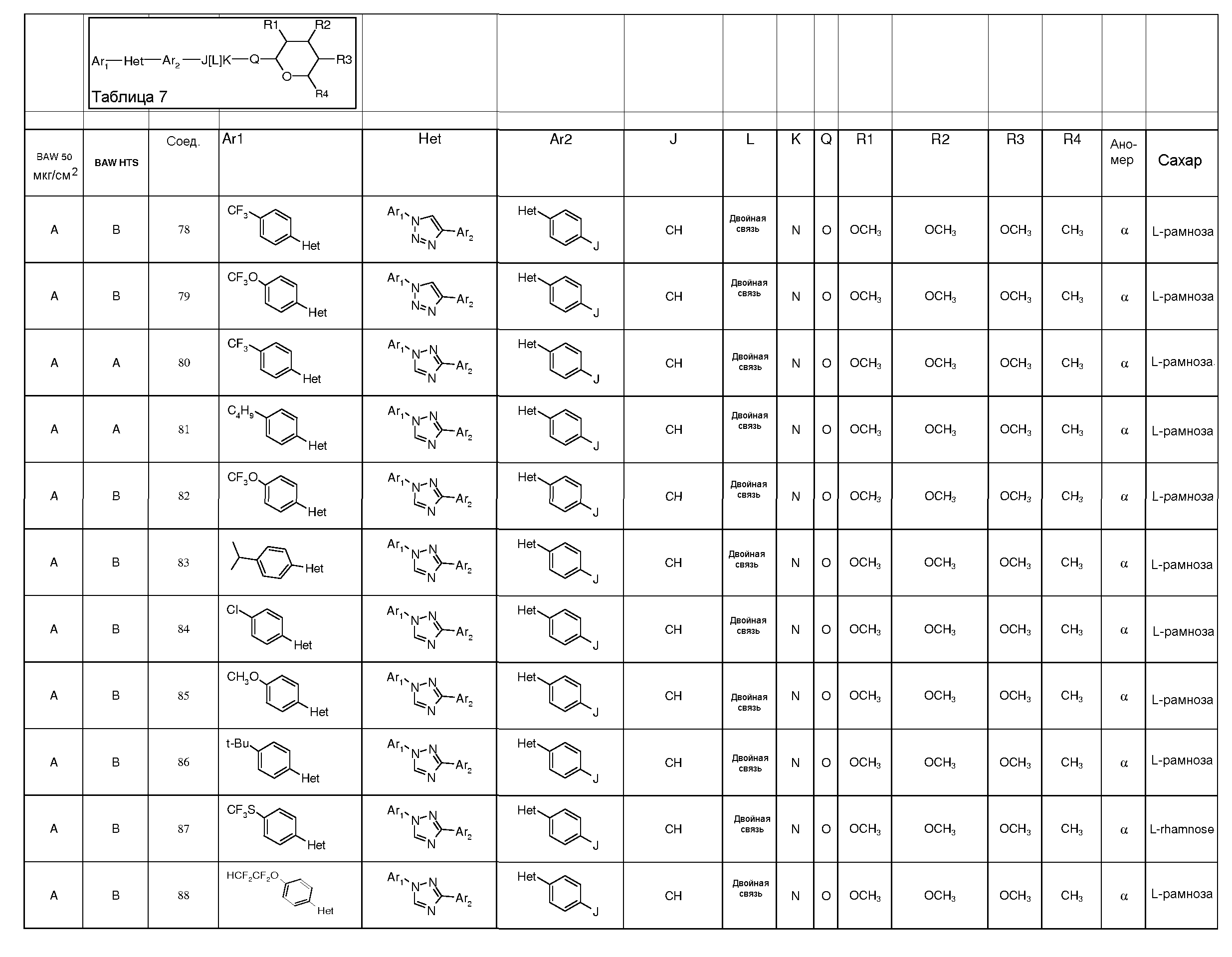
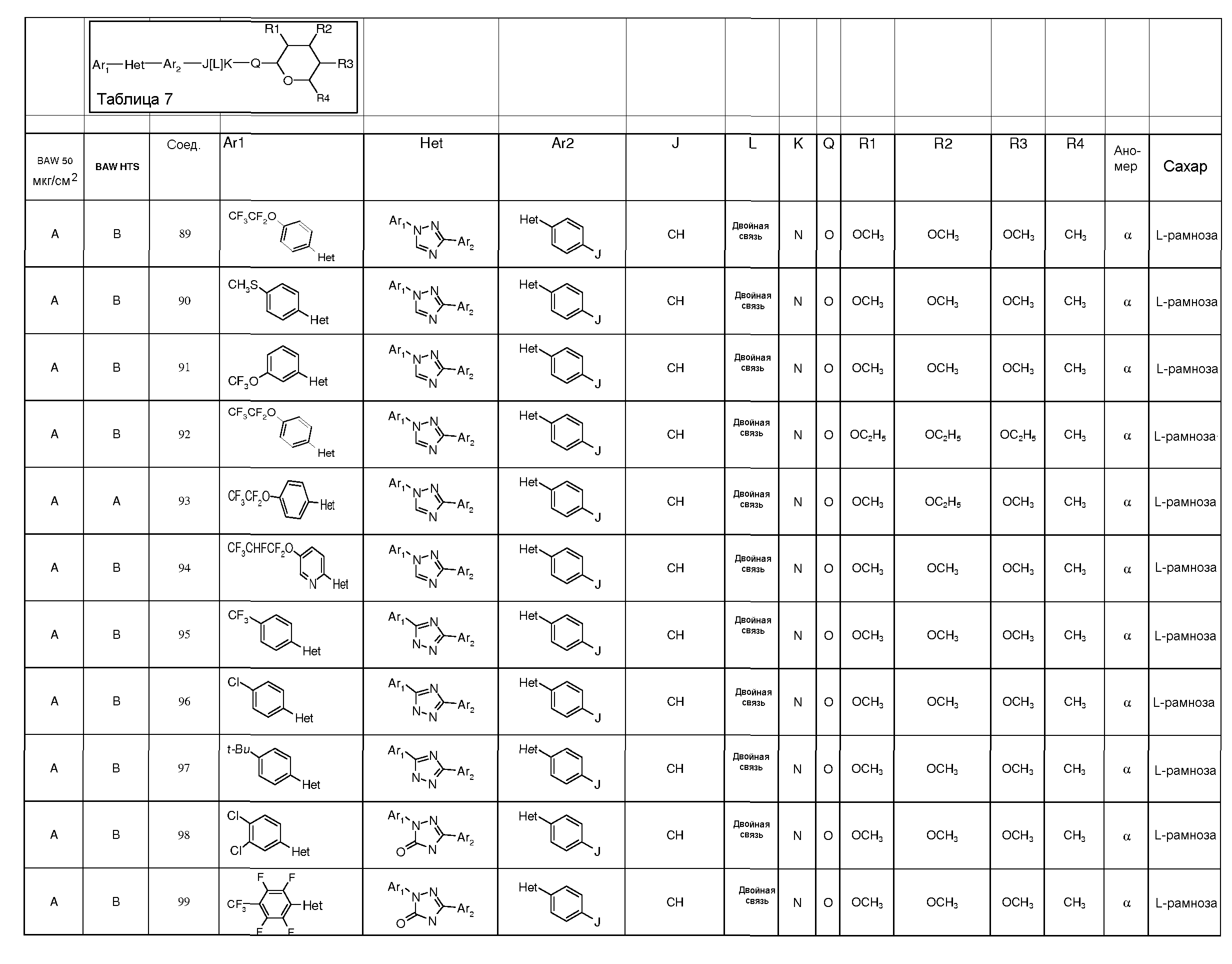
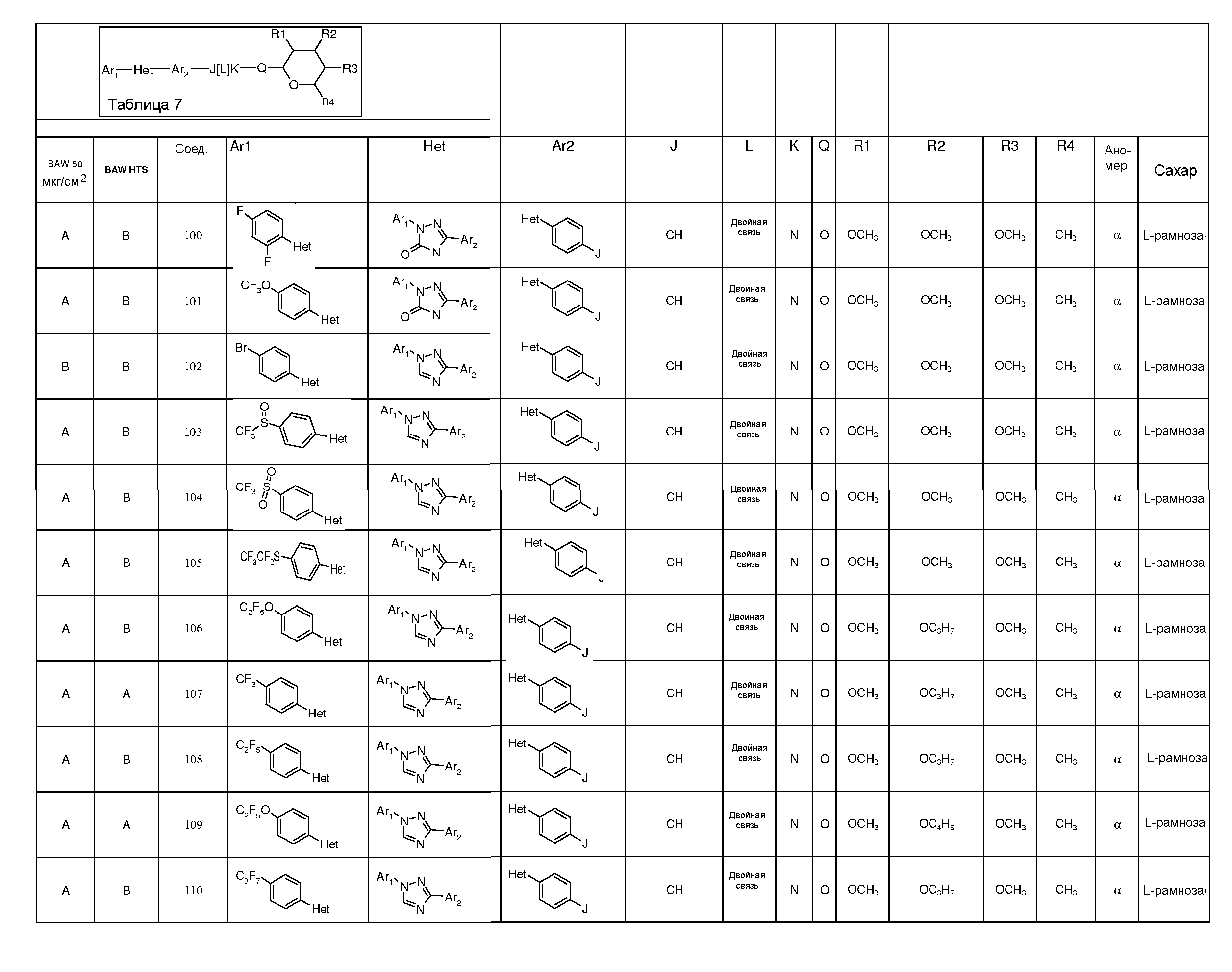
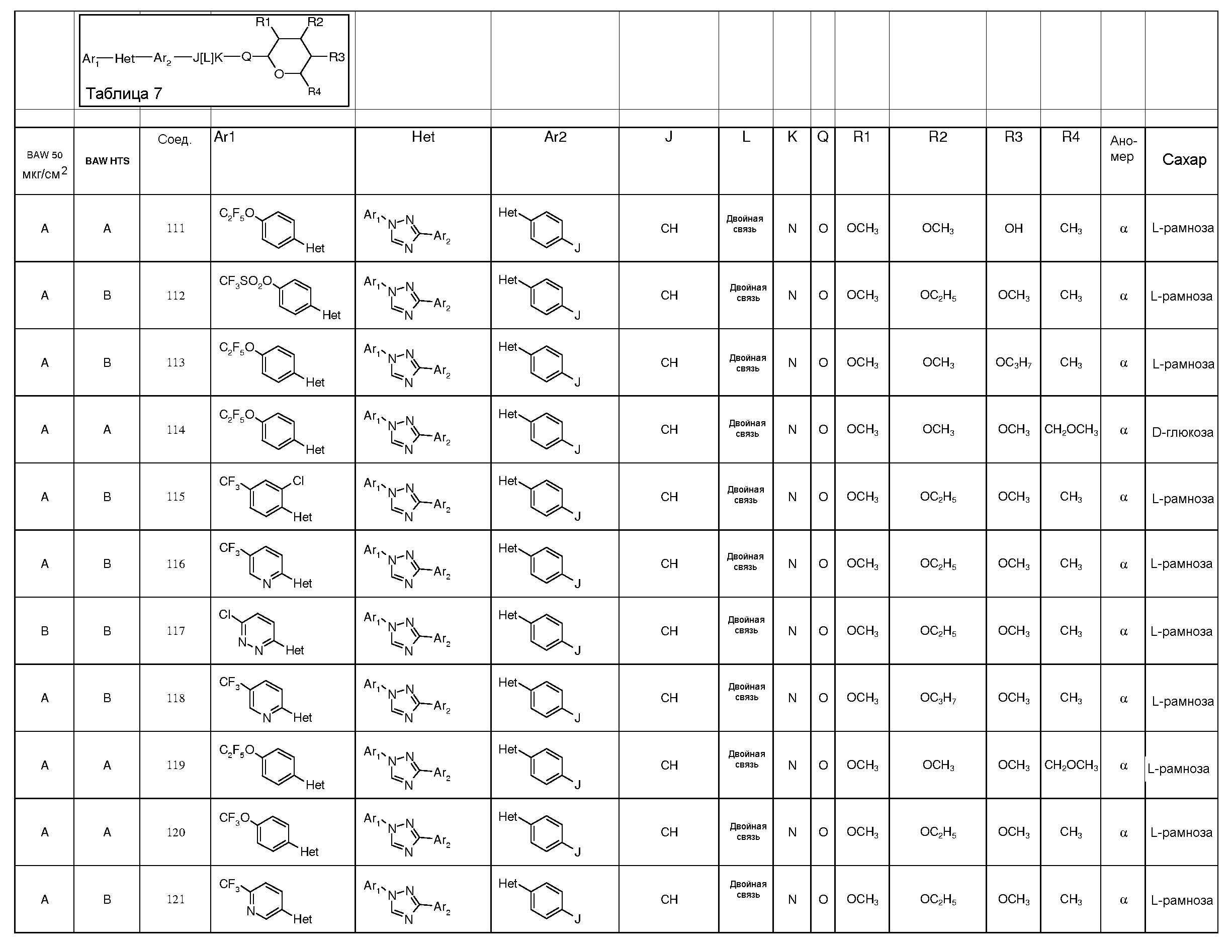
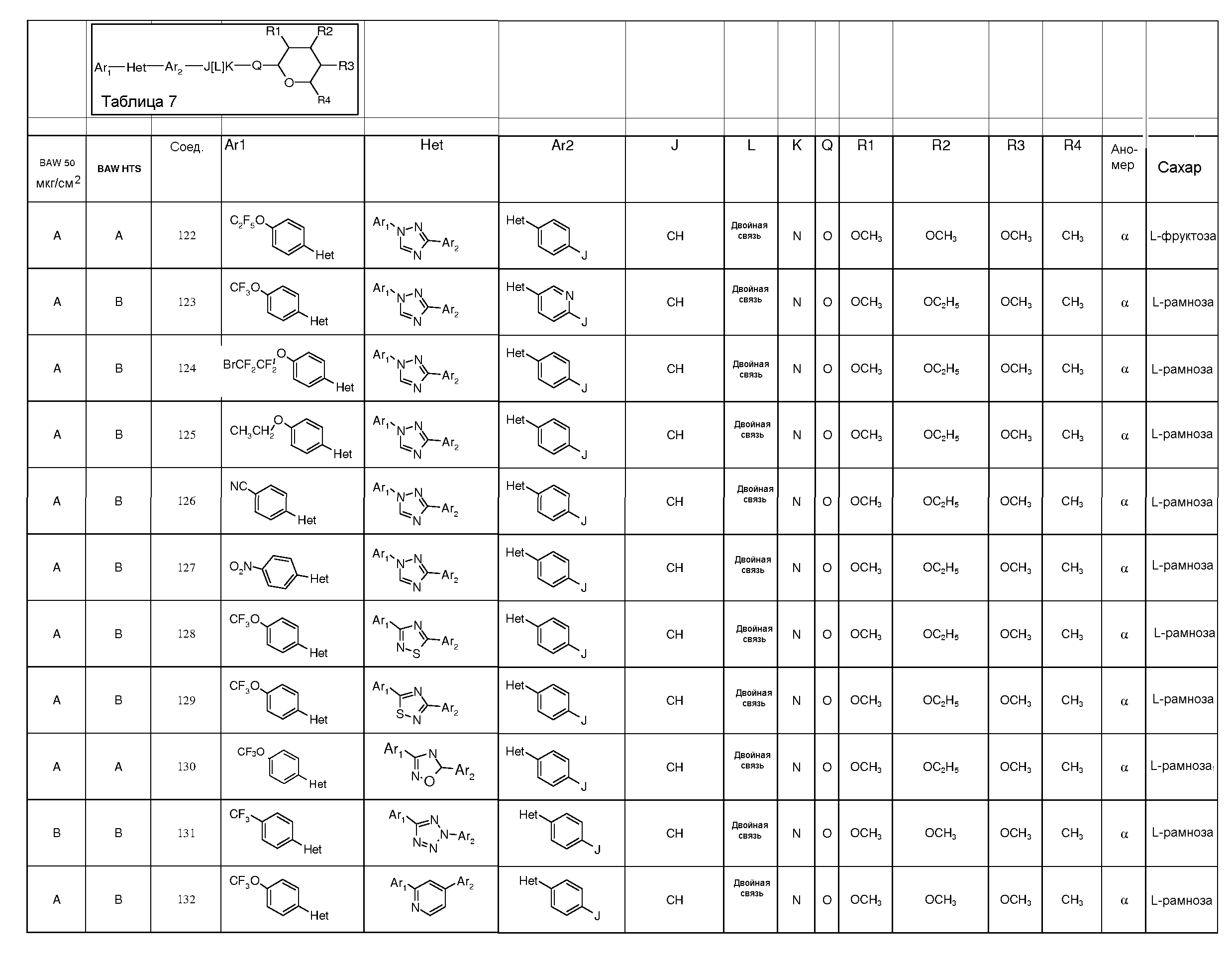
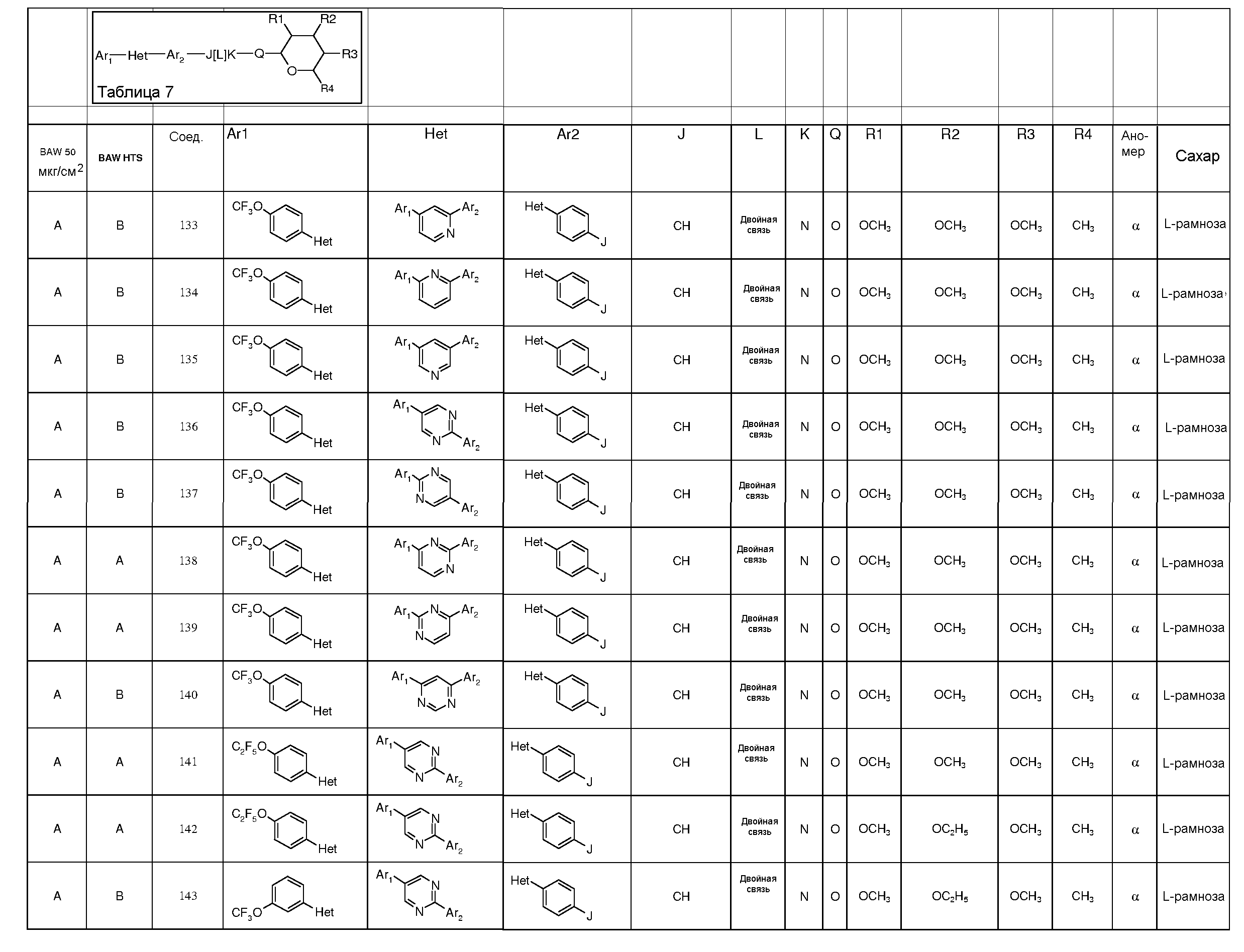
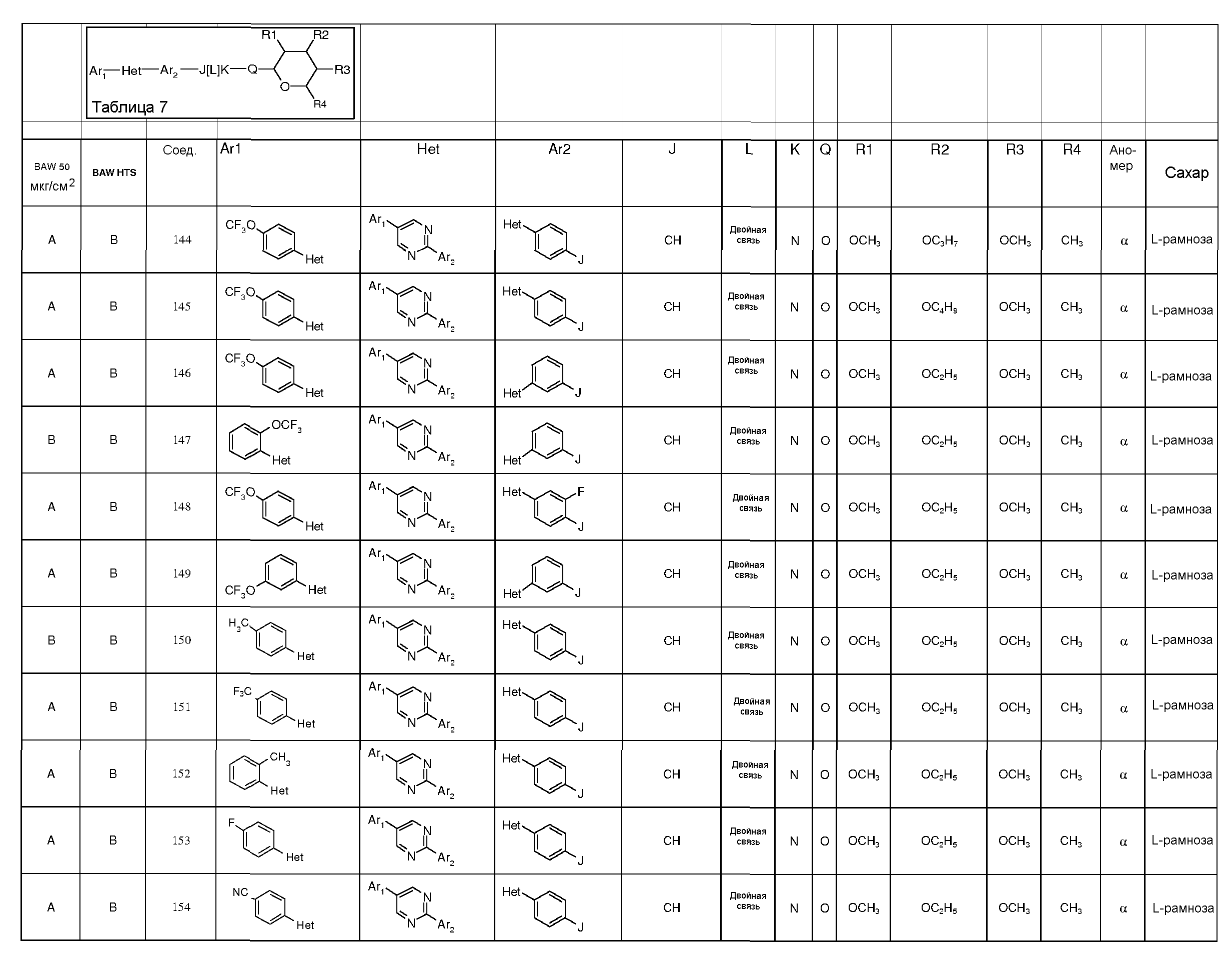
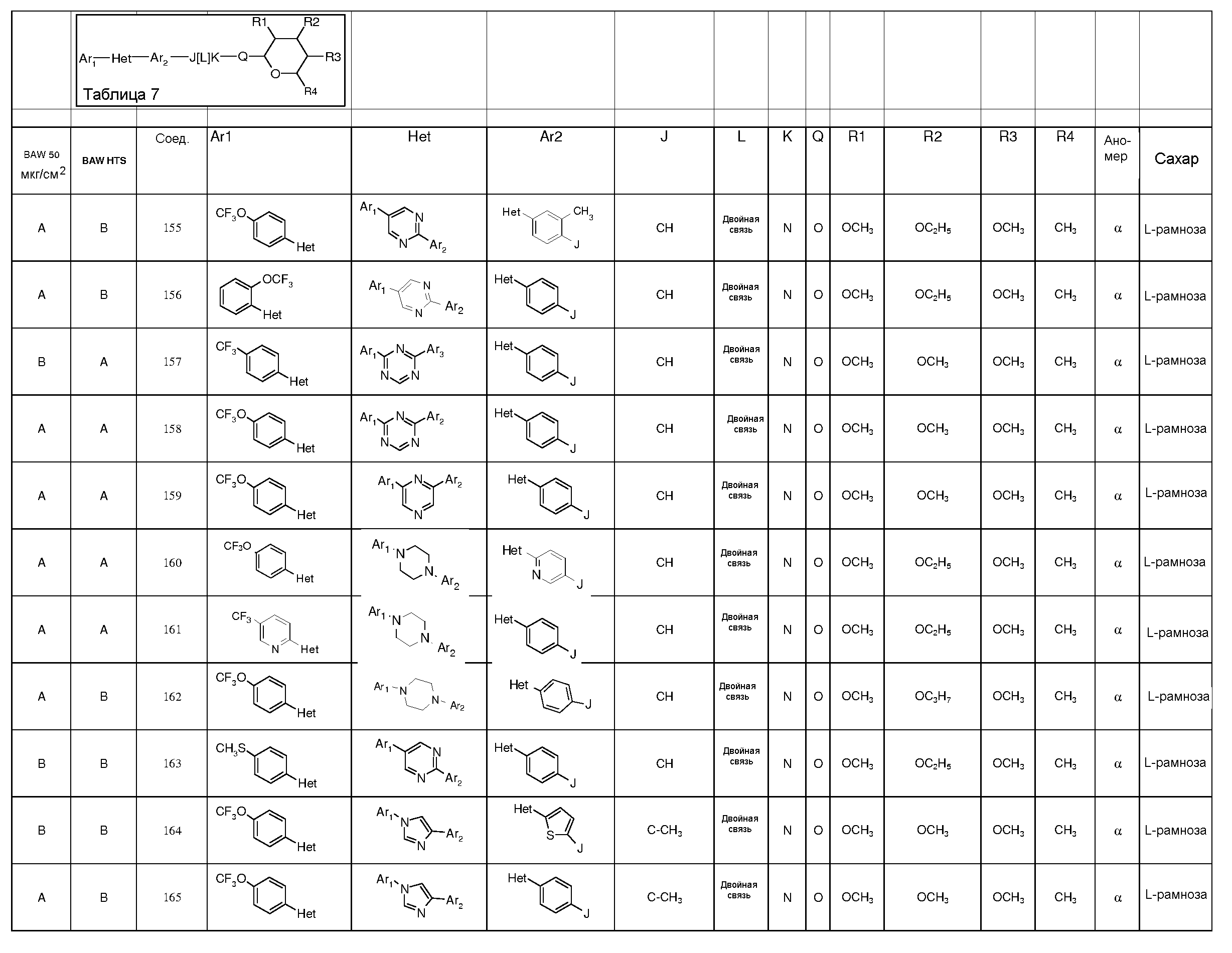
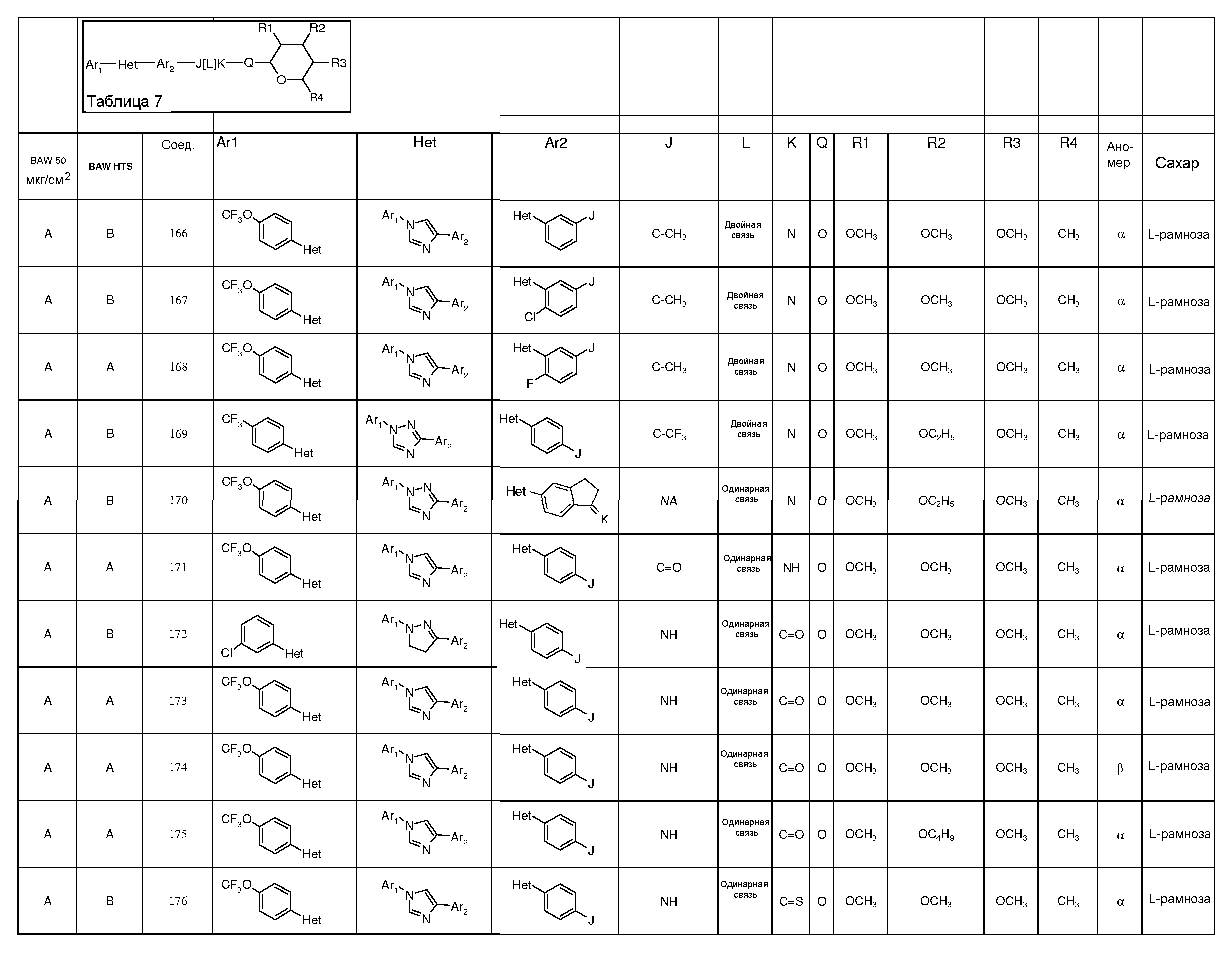
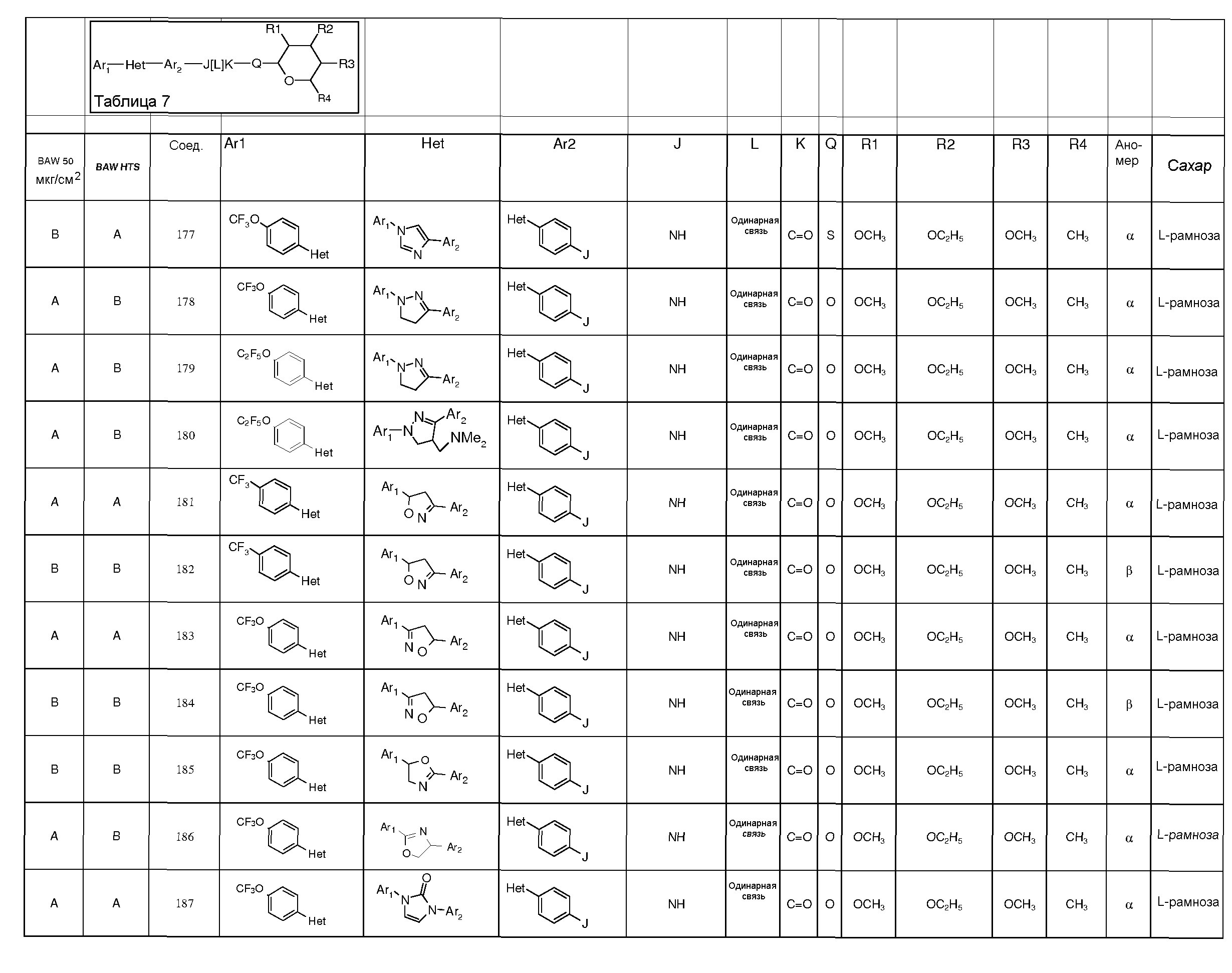
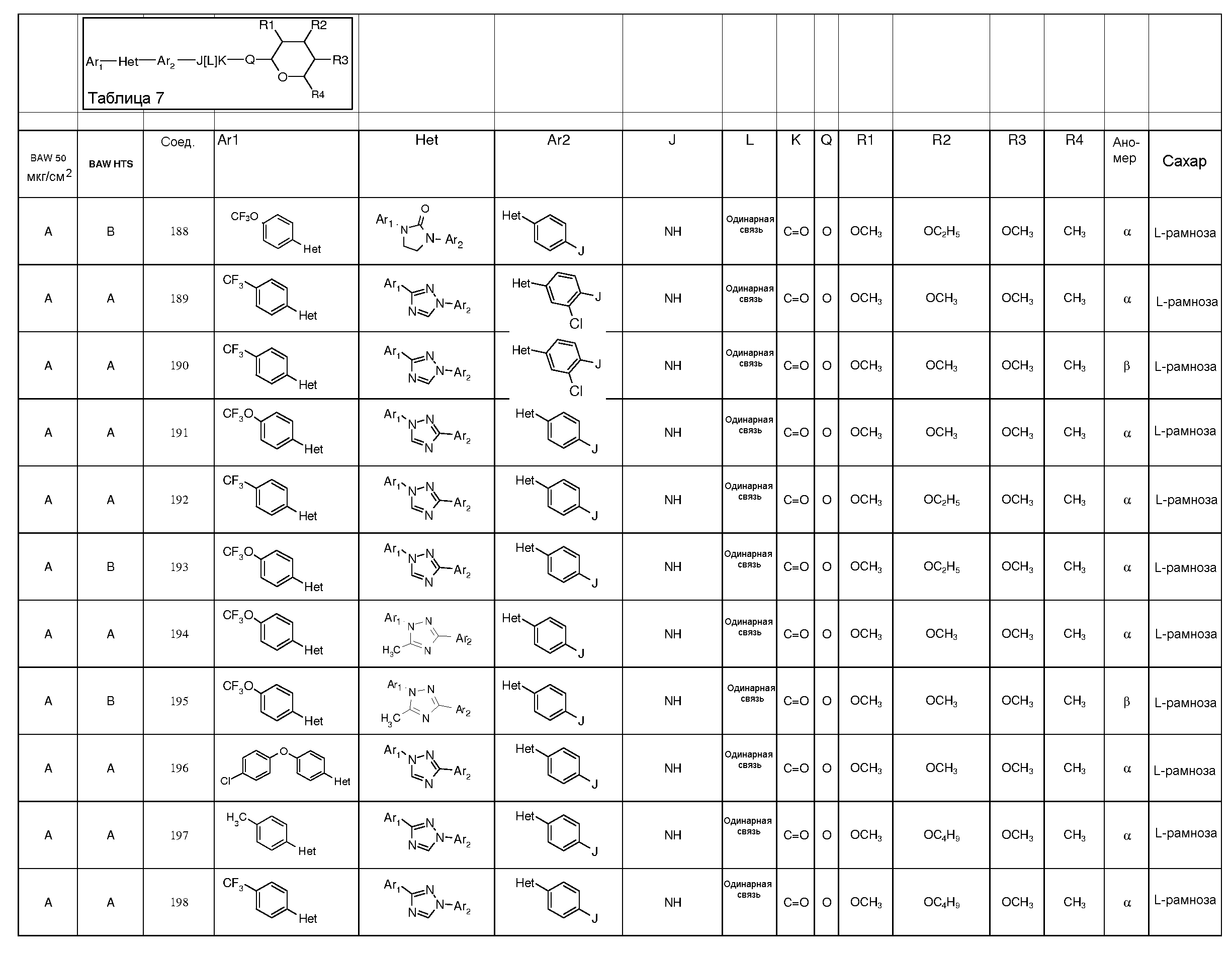
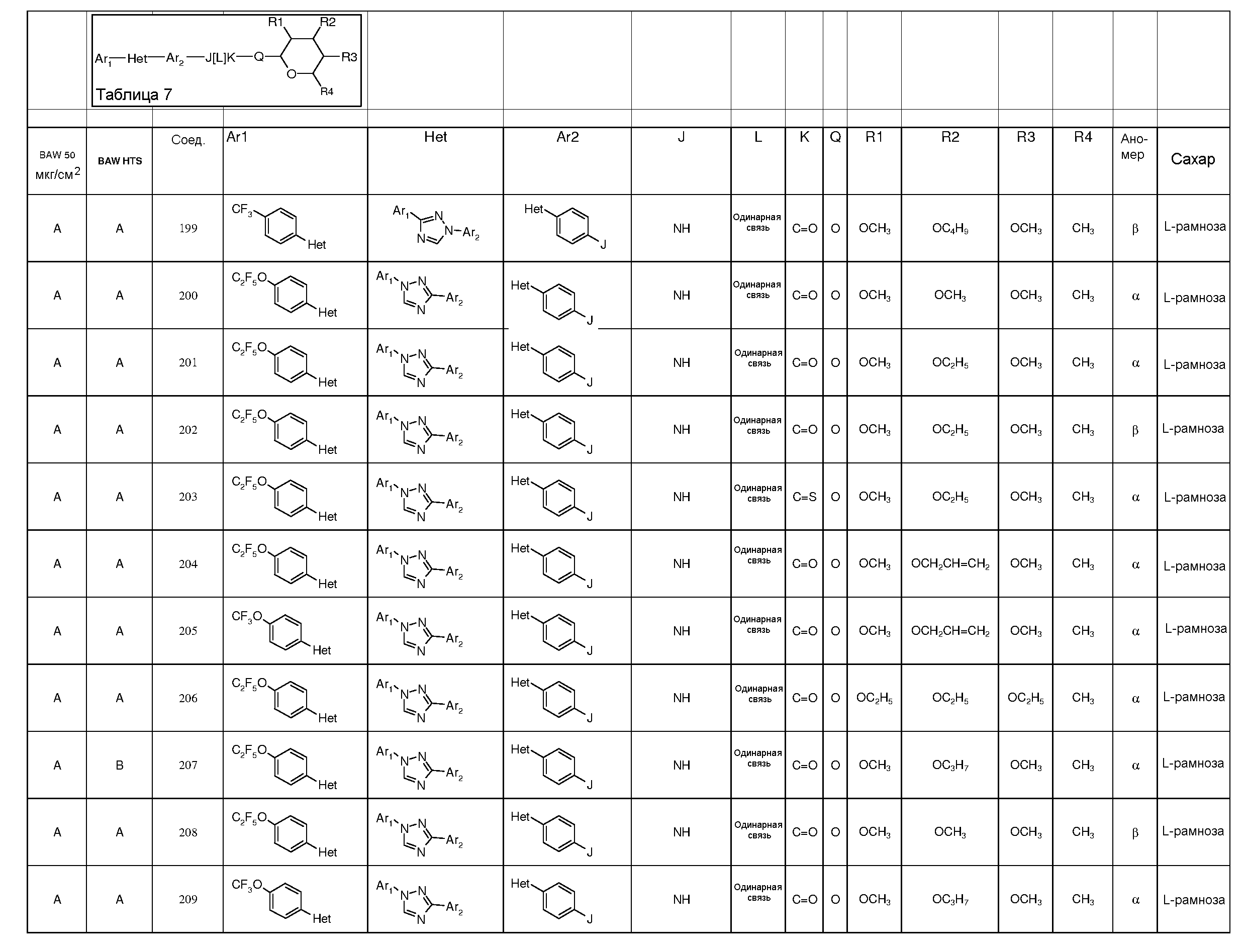
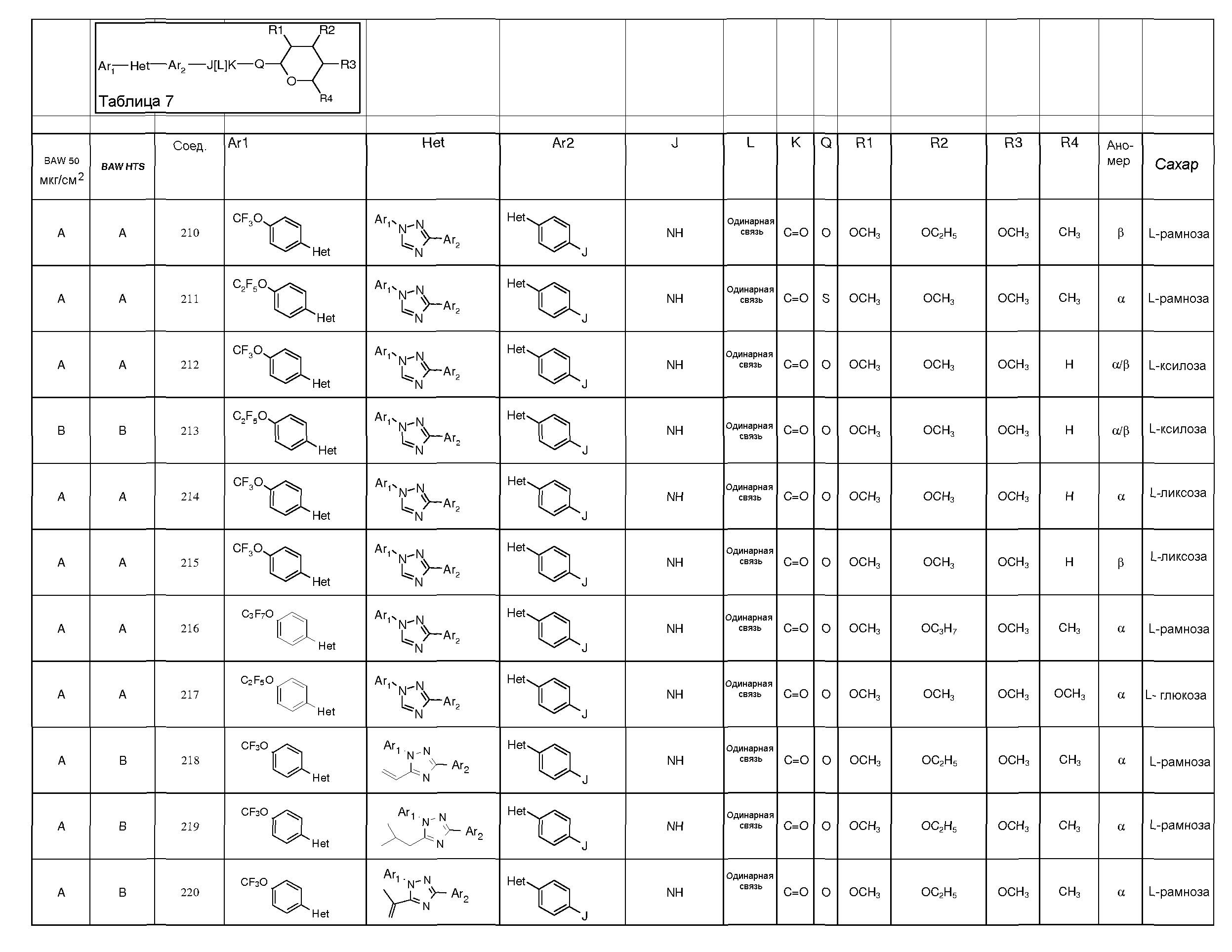
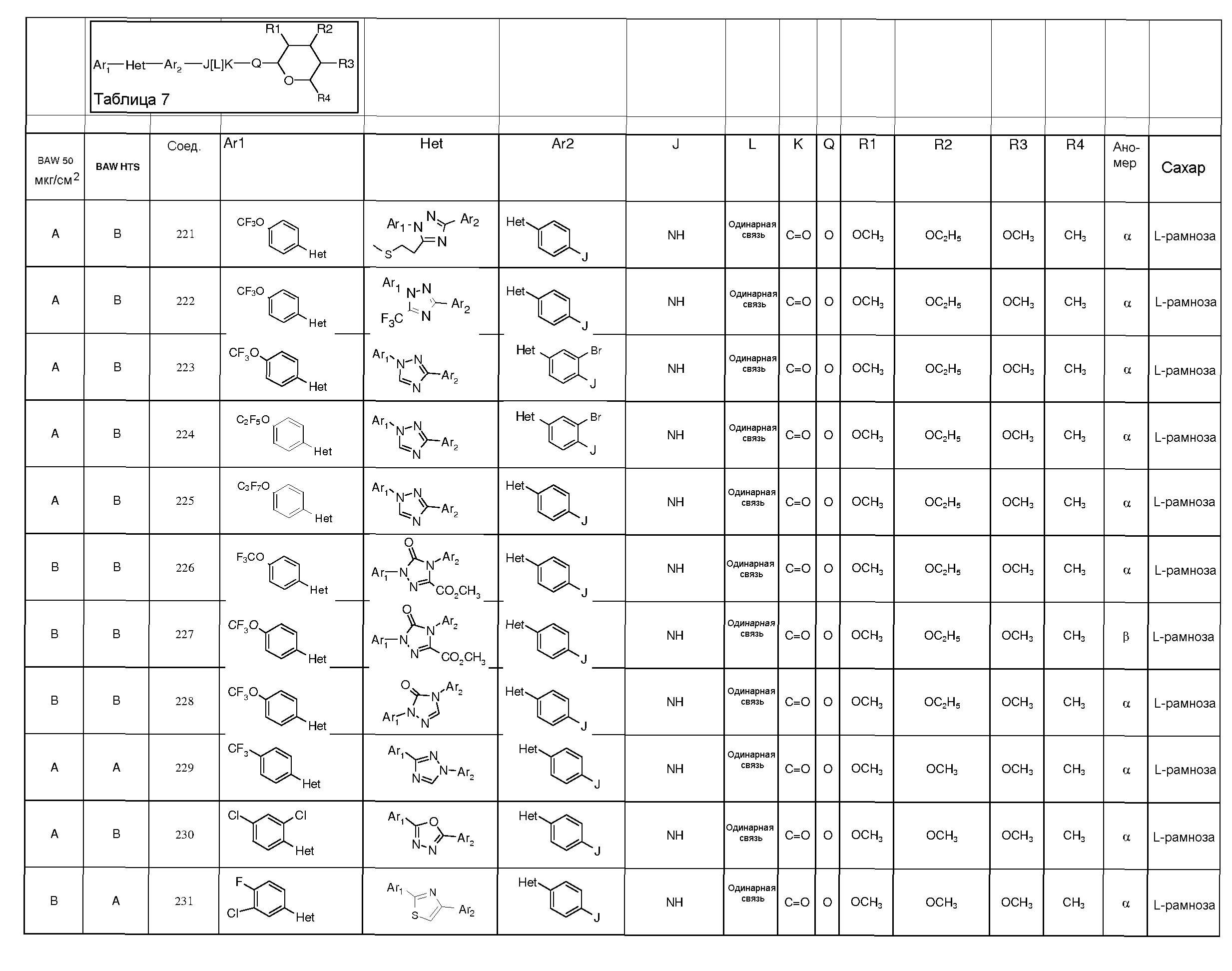
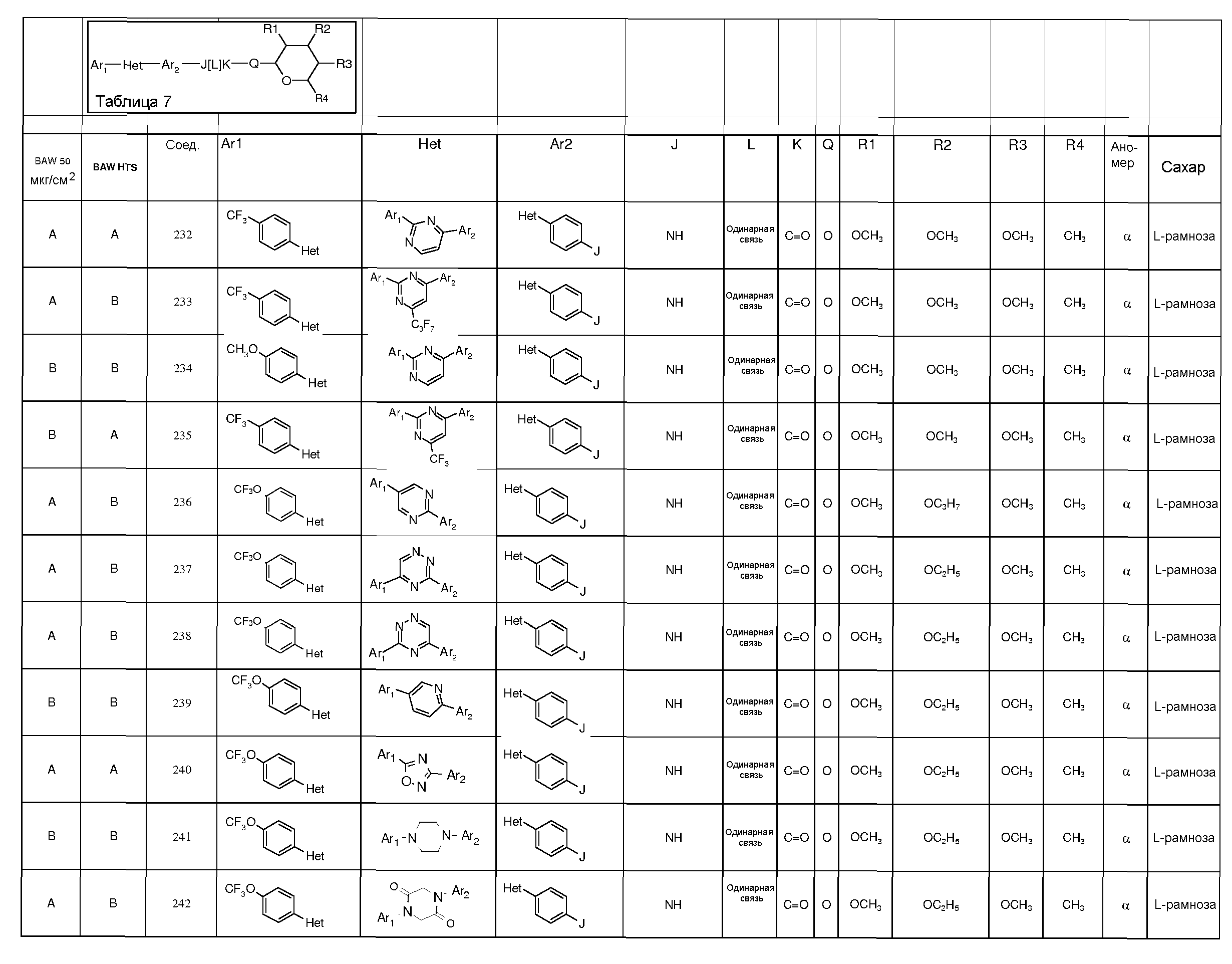
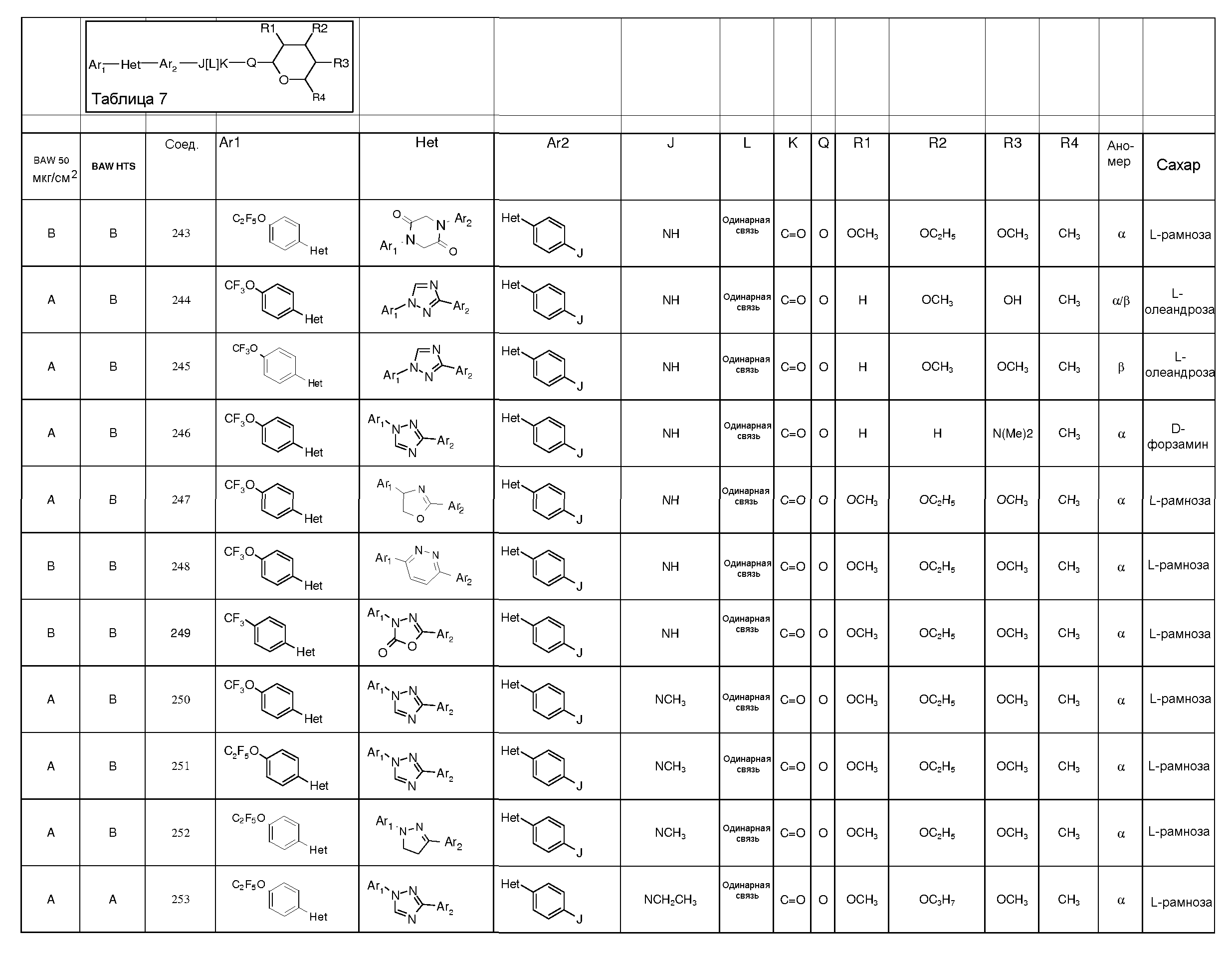
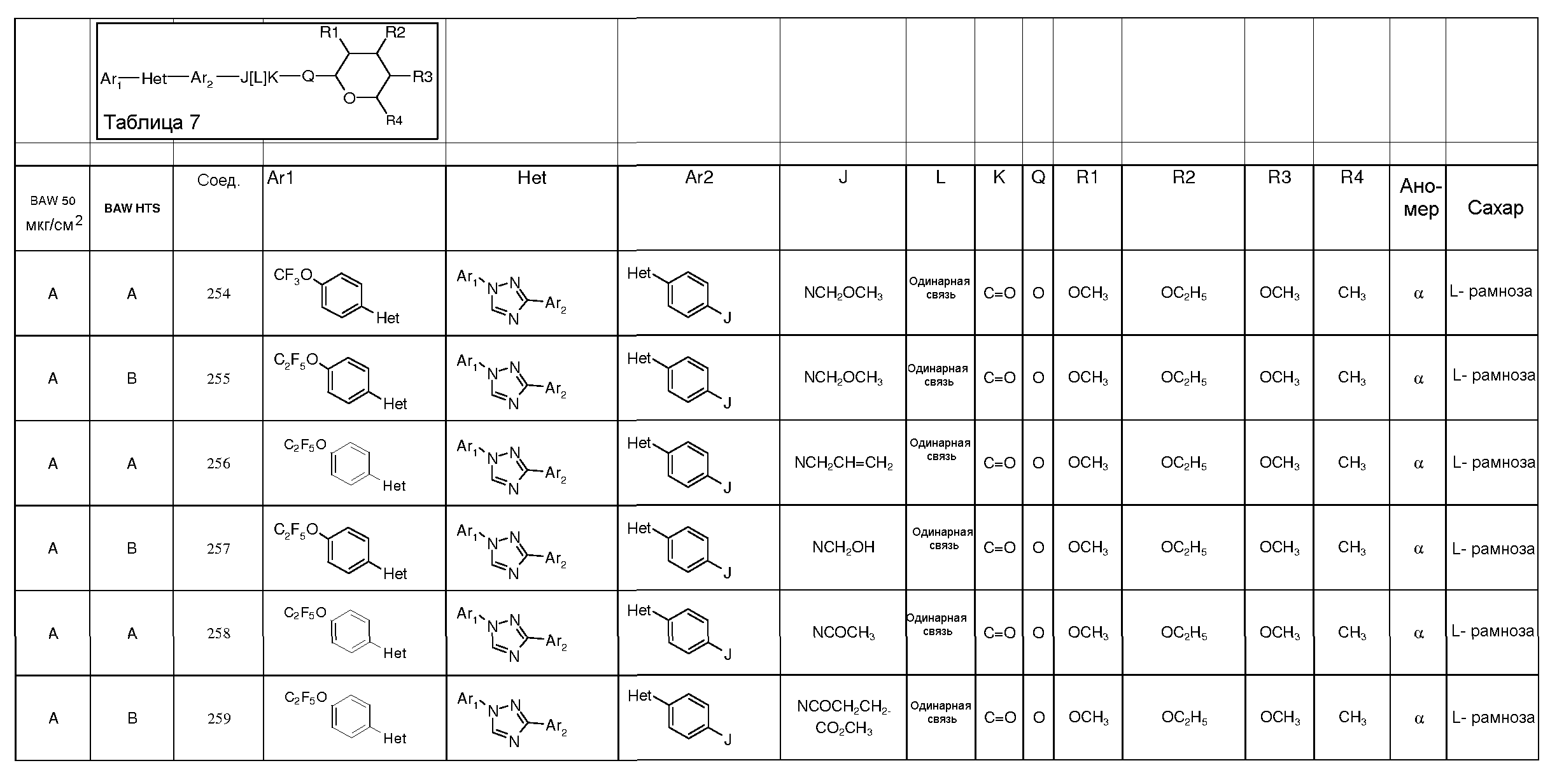
ПРОИЗВОДНЫЕ КИСЛОТ И СОЛЕЙ И СОЛЬВАТЫ
Соединения, описанные в данном изобретении, могут быть в виде пестицидно приемлемых слей добавления кислот.
В качестве не ограничивающего примера, функциональная аминогруппа может образовывать соли с хлористоводородной, бромистоводородной, серной, фосфорной, уксусной, бензойной, лимонной, малоновой, салициловой, яблочной, фумаровой, щавелевой, янтарной, виноградной, молочной, глюконовой, аскорбиновой, малеиновой, аспарагиновой, бензолсульфоновой, метансульфоновой, этансульфоновой, гидроксиметансульфоновой и гидроксиэтансульфоновой кислотами.
Кроме того, в качестве не ограничивающего примера, функциональная кислотная группа может образовывать соли, включая соли щелочных или щелочноземельных металлов, а также соли аммония и аминов. Примеры предпочтительных катионов включают катионы натрия, калия, магния и аммония.
Соли получают путем контактирования основания в свободной форме с желаемой кислотой в количестве, достаточном для получения соли. Основания в свободной форме могут быть регенерированы путем обработки соли подходящим разбавленным водным раствором щелочи, таким как разбавленный водный раствор NaOH, карбоната калия, аммиака и бикарбоната натрия. В качестве примера, во многих случаях, пестицид модифицируют в более водорастворимую форму, например, диметиламиновая соль 2,4-дихлорфеноксиуксусной кислоты является более водорастворимой, чем 2,4-дихлорфеноксиуксусная кислота, хорошо известный гербицид.
Соединения, описанные в данном изобретении, могут быть в виде подходящих комплексов с молекулами растворителя, остающимися нетронутыми после неполного удаления молекул растворителя от соединений. На эти комплексы часто ссылаются как на "сольваты”.
СТЕРЕОИЗОМЕРЫ
Некоторые соединения, описанные в данном изобретении, могут существовать в виде одного или нескольких стереоизомеров. Различные стереоизомеры включают геометрические изомеры, диастереомеры и энантиомеры. Таким образом, соединения, описанные в данном изобретении, включают рацемические смеси, индивидуальные стереоизомеры и оптически активные смеси. Специалисту в данной области понятно, что один стереоизомер может быть более активным, чем другие. Индивидуальные стереоизомеры и оптически активные смеси могут быть получены селективными способами синтеза, общеизвестными способами синтеза, используя стереохимически разделенные исходные продукты или общеизвестные методы стереохимического разделения.
ВРЕДИТЕЛИ
В другом варианте осуществления, изобретение, описанное в настоящем документе, может быть использовано для контроля над вредителями.
В другом варианте осуществления, изобретение, описанное в настоящем документе, может быть использовано для контроля над вредителями, принадлежащими к классу Phylum Nematoda.
В другом варианте осуществления, изобретение, описанное в настоящем документе, может быть использовано для контроля над вредителями, принадлежащими к классу Phylum Arthropoda.
В другом варианте осуществления, изобретение, описанное в настоящем документе, может быть использовано для контроля над вредителями, принадлежащими к классу Subphylum Chelicerata.
В другом варианте осуществления, изобретение, описанное в настоящем документе, может быть использовано для контроля над вредителями, принадлежащими к классу Class Arachnida.
В другом варианте осуществления, изобретение, описанное в настоящем документе, может быть использовано для контроля над вредителями, принадлежащими к классу Subphylum Myriapoda.
В другом варианте осуществления, изобретение, описанное в настоящем документе, может быть использовано для контроля над вредителями, принадлежащими к классу Class Symphyla.
В другом варианте осуществления, изобретение, описанное в настоящем документе, может быть использовано для контроля над вредителями, принадлежащими к классу Subphylum Hexapoda.
В другом варианте осуществления, изобретение, описанное в настоящем документе, может быть использовано для контроля над вредителями, принадлежащими к классу Class Insecta.
В другом варианте осуществления, изобретение, описанное в настоящем документе, может быть для контроля над Coleoptera (жуки). Неисчерпывающий перечень этих вредителей включает, но ими не ограничивается, Acanthoscelides spp. (долгоносики), Acanthoscelides obtectus (зерновка фасолевая), Agrilus planipennis (изумрудная узкотелая златка), Agriotes spp. (жук-щелкун), Anoplophora glabripennis (Азиатский усач), Anthonomus spp. (долгоносики), Anthonomus grandis (долгоносик хлопковый), Aphidius spp., Apion spp. (долгоносики), Apogonia spp. (червь), Ataenius spretulus (Black Turgrass Ataenius), Atomaria linearis (свекловичная крошка), Aulacophore spp., Bothynoderes punctiventris (долгоносик свекловичный), Bruchus spp. (долгоносики), Bruchus pisorum (зерновка гороховая), Cacoesia spp., Callosobruchus maculatus (южный долгоносик гороховый), Carpophilus hemipteras (блестянка полужесткокрылая), Cassida vittata, Cerosterna spp, Cerotoma spp. (листоеды), Cerotoma trifurcata (листоед бобовый), Ceutorhynchus spp. (долгоносики), Ceutorhynchus assimilis (семенной рапсовый скрытнохоботник), Ceutorhynchus napi (скрытнохоботник репный), Chaetocnema spp. (листоеды), Colaspis spp. (жуки грунтовые), Conoderus scalaris, Conoderus stigmosus, Conotrachelus nenuphar (плодовый долгоносик), Cotinus nitidis (хрущ блестящий зеленый), Crioceris asparagi (трещалка спаржевая), Cryptolestes ferrugineus (мукоед ржаво-красный), Cryptolestes pusillus (мукоед малый), Cryptolestes turcicus (мукоед турецкий), Ctenicera spp. (жуки-щелкуны), Curculio spp. (долгоносики), Cyclocephala spp. (гусеницы), Cylindrocpturus adspersus (долгоносик, вредящий стеблям подсолнечника), Deporaus marginatus (долгоносик-листорез манговый), Dermestes lardarius (кожеед ветчинный), Dermestes maculates (кожеед пятнистый), Diabrotica spp. (жук диабротика), Epilachna varivestis (мексиканский жук), Faustinus cubae, Hylobius pales (жук-долгоносик), Hypera spp. (долгоносики), Hypera postica (долгоносик люцерновый), Hyperdoes spp. (долгоносик Hyperodes), Hypothenemus hampei (огневка кофейная), Ips spp. (заболонники), Lasioderma serricorne (жук табачный), Leptinotarsa decemlineata (колорадский жук), Liogenys fuscus, Liogenys suturalis, Lissorhoptrus oryzophilus (долгоносик рисовый водяной), Lyctus spp. (древесные жуки/капюшонники), Maecolaspis joliveti, Megascelis spp., Melanotus communis, Meligethes spp., Meligethes aeneus (цветоед рапсовый), Melolontha melolontha (обычный майский жук европейский), Oberea brevis, Oberea linearis, Oryctes rhinoceros (пальмовый жук-носорог), Oryzaephilus mercator (плоскотелка арахисовая), Oryzaephilus surinamensis (рисоед суринамский), Otiorhynchus spp. (долгоносики), Oulema melanopus (пьявица красногрудая), Oulema oryzae, Pantomorus spp. (долгоносики), Phyllophaga spp. (майский/июньский жук), Phyllophaga cuyabana, Phyllotreta spp. (листоеды), Phynchites spp., Popillia japonica (хрущик японский), Prostephanus truncates (большой точильщик зерновой), Rhizopertha dominica (точильщик зерновой), Rhizotrogus spp. (европейский хрущ), Rhynchophorus spp. (долгоносики), Scolytus spp. (жуки-короеды), Shenophorus spp. (долгоносик), Sitona lineatus (долгоносик полосатый), Sitophilus spp. (долгоносик амбарный обыкновенный), Sitophilus granaries (долгоносик амбарный), Sitophilus oryzae (долгоносик рисовый), Stegobium paniceum (точильщик хлебный), Tribolium spp. (мучные хрущаки), Tribolium castaneum (хрущак каштановый), Tribolium confusum (хрущак малый мучной), Trogoderma variabile (трогодерма изменчивая) и Zabrus tenebioides.
В другом варианте осуществления, изобретение, описанное в настоящем документе, может быть использовано для контроля над Dermaptera (кожистокрылые).
В другом варианте осуществления, изобретение, описанное в настоящем документе, может быть использовано для контроля над Dictyoptera (тараканы). Неисчерпывающий перечень этих вредителей включает, но ими не ограничивается, Blattella germanica (таракан рыжий), Blatta orientalis (таракан черный), Parcoblatta pennylvanica, Periplaneta americana (таракан американский), Periplaneta australoasiae (таракан австралийский), Periplaneta brunnea (коричневый таракан), Periplaneta fuliginosa (темно-коричневый таракан), Pyncoselus suninamensis (таракан суринамский) и Supella longipalpa (мебельный таракан).
В другом варианте осуществления, изобретение, описанное в настоящем документе, может быть использовано для контроля над Diptera (двукрылые). Неисчерпывающий перечень этих вредителей включает, но ими не ограничивается, Aedes spp. (комары), Agromyza frontella (минер люцерновый), Agromyza spp. (минирующие мушки), Anastrepha spp. (плодовые мушки), Anastrepha suspensa (карибская плодовая мушка), Anopheles spp. (комары), Batrocera spp. (плодовые мушки), Bactrocera cucurbitae (муха дынная), Bactrocera dorsalis (муха восточная фруктовая), Ceratitis spp. (плодовая мушка), Ceratitis capitata (средиземноморская плодовая мушка), Chrysops spp. (олений слепень), Cochliomyia spp. (личинки мясной мухи), Contarinia spp. (галлицы), Culex spp. (комары), Dasineura spp. (галлицы), Dasineura brassicae (галлица капустная), Delia spp., Delia platura (личинка зерновая), Drosophila spp. (дрозофилы), Fannia spp. (комнатные мухи), Fannia canicularis (муха комнатная малая), Fannia scalaris (муха лестничная), Gasterophilus intestinalis (желудочные оводы), Gracillia perseae, Haematobia irritans (жигалка коровья малая), Hylemyia spp. (личинки корневые), Hypoderma lineatum (личинка бычьего полосатого овода), Liriomyza spp. (минирующие мушки), Liriomyza brassica (муха-минер), Melophagus ovinus (рунец овечий), Musca spp. (настоящие мухи), Musca autumnalis (муха полевая обыкновенная), Musca domestica (муха комнатная), Oestrus ovis (овод овечий), Oscinella frit (мушка шведская), Pegomyia betae (муха свекловичная), Phorbia spp., Psila rosae (муха морковная), Rhagoletis cerasi (муха вишневая), Rhagoletis pomonella (личинка пестрокрылки яблонной), Sitodiplosis mosellana (оранжевая злаковая галлица), Stomoxys calcitrans (жигалка обыкновенная), Tabanus spp. (слепни) и Tipula spp. (долгоножки).
В другом варианте осуществления, изобретение, описанное в настоящем документе, может быть использовано для контроля над Hemiptera (клопы). Неисчерпывающий перечень этих вредителей включает, но ими не ограничивается, Acrosternum hilare (щитник), Blissus leucopterus (клоп постельный), Calocoris norvegicus (клоп картофельный), Cimex hemipterus (клоп постельный тропический), Cimex lectularius (клоп постельный), Dagbertus fasciatus, Dichelops furcatus, Dysdercus suturellus (красноклоп хлопковый), Edessa meditabunda, Eurygaster maura (черепашка маврская), Euschistus heros, Euschistus servus (щитник коричневый), Helopeltis antonii, Helopeltis theivora (слепняк чайный индийский), Lagynotomus spp. (щитники), Leptocorisa oratorius, Leptocorisa varicornis, Lygus spp. (слепняки), Lygus hesperus (клоп травяной западный), Maconellicoccus hirsutus, Neurocolpus longirostris, Nezara viridula (южный зеленый овощной клоп), Phytocoris spp. (слепняки), Phytocoris californicus, Phytocoris relativus, Piezodorus guildingi, Poecilocapsus lineatus (четырех полосый слепняк), Psallus vaccinicola, Pseudacysta perseae, Scaptocoris castanea и Triatoma spp. (кровососущие клопы триатомиды/триатомиды).
В другом варианте осуществления, изобретение, описанное в настоящем документе, может быть использовано для контроля над Homoptera (тли, равнокрылые, белокрылки, цикадки). Неисчерпывающий перечень этих вредителей включает, но ими не ограничивается, Acrythosiphon pisum (тля гороховая), Adelges spp. (тля хмелевая), Aleurodes proletella (белокрылка капустная), Aleurodicus disperses, Aleurothrixus floccosus (белокрылка шерстеводная), Aluacaspis spp., Amrasca bigutella bigutella, Aphrophora spp. (цикадки), Aonidiella aurantii (щитовка красная померанцевая), Aphis spp. (тля), Aphis gossypii (тля хлопковая), Aphis pomi (тля яблонная), Aulacorthum solani (тля картофельная обыкновенная), Bemisia spp. (белокрылки), Bemisia argentifolii, Bemisia tabaci (белокрылка табачная), Brachycolus noxius (тля ячменная), Brachycorynella asparagi (тля спаржевая), Brevennia rehi, Brevicoryne brassicae (тля капустная), Ceroplastes spp.(равнокрылые), Ceroplastes rubens (рубиновая ложнощитовка), Chionaspis spp. (равнокрылые), Chrysomphalus spp. (равнокрылые), Coccus spp. (равнокрылые), Dysaphis plantaginea (тля розовая), Empoasca spp. (цикадки), Eriosoma lanigerum (тля кровяная яблонная), Icerya purchasi (червец австралийский желобчатый), Idioscopus nitidulus (манговая цикадка), Laodelphax striatellus (малый коричневый дельфацид), Lepidosaphes spp., Macrosiphum spp., Macrosiphum euphorbiae (тля картофельная), Macrosiphum granarium (тля злаковая), Macrosiphum rosae (астровая тля резаная листовая), Macrosteles quadrilineatus (астровая цикадка), Mahanarva frimbiolata, Metopolophium dirhodum (тля розанно-злаковая), Mictis longicornis, Myzus persicae (тля персиковая), Nephotettix spp. (цикадки), Nephotettix cinctipes (цикадка зеленая), Nilaparvata lugens (коричневый дельфацид), Parlatoria pergandii (щитовка цитрусовая фиолетовая), Parlatoria ziziphi (щитовка черная), Peregrinus maidis (цикада кукурузная), Philaenus spp. (пенницы), Phylloxera vitifoliae (филлоксера виноградная), Physokermes piceae (ложнощитовка еловая малая), Planococcus spp. (войлочники), Pseudococcus spp. (войлочники), Pseudococcus brevipes (мучнистый червец ананасовый), Quadraspidiotus perniciosus (щитовка калифорнийская), Rhapalosiphum spp. (тли), Rhapalosiphum maida (тля кукурузная), Rhapalosiphum padi (тля черемухо-злаковая), Saissetia spp. (равнокрылые), Saissetia oleae (червец черный), Schizaphis graminum (тля злаковая обыкновенная), Sitobion avenae (тля злаковая), Sogatella furcifera (дельфацид белоспинный), Therioaphis spp. (тли), Toumeyella spp. (равнокрылые), Toxoptera spp. (тли), Trialeurodes spp. (белокрылки), Trialeurodes vaporariorum (белокрылка тепличная), Trialeurodes abutiloneus (белая муха с окаймленными крылышками), Unaspis spp. (равнокрылые), Unaspis yanonensis (щитовка восточная цитрусовая) и Zulia entreriana.
В другом варианте осуществления, изобретение, описанное в настоящем документе, может быть использовано для контроля над Hymenoptera (муравьи, осы и пчелы). Неисчерпывающий перечень этих вредителей включает, но ими не ограничивается, Acromyrrmex spp., Athalia rosae, Atta spp. (муравьи-листорезы), Camponotus spp. (муравьи-древоточцы), Diprion spp. (пилильщики), Formica spp. (муравьи), Iridomyrmex humilis (муравей аргентинский), Monomorium ssp., Monomorium minumum (муравей малый), Monomorium pharaonis (муравей домовый), Neodiprion spp. (пилильщики), Pogonomyrmex spp. (муравей-жнец), Polistes spp. (бумажные осы), Solenopsis spp. (муравьи огненные), Tapoinoma sessile (odorous house ant), Teтpanomorium spp. (муравей дерновый), Vespula spp. (настоящие осы) и Xylocopa spp. (пчелы-плотники).
В другом варианте осуществления, изобретение, описанное в настоящем документе, может быть использовано для контроля над Isoptera (термиты). Неисчерпывающий перечень этих вредителей включает, но ими не ограничивается, Coptotermes spp., Coptotermes curvignathus, Coptotermes frenchii, Coptotermes formosanus (китайский подземный термит), Cornitermes spp. (термиты-солдаты с рострумом), Cryptotermes spp. (термиты, поедающие сухое дерево), Heterotermes spp. (пустынные ринотермиты), Heterotermes aureus, Kalotermes spp. (термиты, поедающие сухое дерево), Incistitermes spp. (термиты, поедающие сухое дерево), Macrotermes spp. (термиты, разводящие грибковые сады), Marginitermes spp. (термиты, поедающие сухое дерево), Microcerotermes spp. (термиты-жнецы), Microtermes obesi, Procornitermes spp., Reticulitermes spp. (subterranean termites), Reticulitermes banyulensis, Reticulitermes grassei, Reticulitermes flavipes (термит желтоногий), Reticulitermes hageni, Reticulitermes hesperus (западный ринотермит), Reticulitermes santonensis, Reticulitermes speratus, Reticulitermes tibialis, Reticulitermes virginicus, Schedorhinotermes spp. и Zootermopsis spp. (термиты, поедающие трухлявое дерево).
В другом варианте осуществления, изобретение, описанное в настоящем документе, может быть использовано для контроля над Lepidoptera (мотыльки и бабочки). Неисчерпывающий перечень этих вредителей включает, но ими не ограничивается, Achoea janata, Adoxophyes spp., Adoxophyes orana, Agrotis spp. (совки), Agrotis Agrotis ipsilon (совка-ипсилон), Alabama argillacea (гусеница хлопковая), Amorbia cuneana, Amyelosis transitella (гусеница, вредящая цитрусовым), Anacamptodes defectaria, Anarsia lineatella (моль фруктовая полосатая), Anomis sabulifera (джутовая пяденица), Anticarsia gemmatalis (гусеница, вредящая соевым культурам), Archips argyrospila (листовертка плодовых деревьев), Archips rosana (листовертка европейская), Argyrotaenia spp. (листовертки), Argyrotaenia citrana (листовертка апельсиновая), Autographa gamma, Bonagota cranaodes, Borbo cinnara (огневка рисовая), Bucculatrix thurberiella (сверлильщик хлопковый), Caloptilia spp. (минирующие мушки), Capua reticulana, Carposina niponensis (персиковая плодожорка), Chilo spp., Chlumetia transversa (листовертка манговая), Choristoneura rosaceana (листовертка косополосая), Chrysodeixis spp., Cnaphalocerus medinalis (листовертка травяная), Colias spp., Conpomorpha cramerella, Cossus cossus (древоточец), Crambus spp. (луговые мотыльки), Cydia funebrana (плодожорка сливовая), Cydia molesta (плодожорка восточная персиковая), Cydia nignicana (листовертка гороховая), Cydia pomonella (плодожорка яблонная), Darna diducta, Diaphania spp. (точильщики стеблевые), Diatraea spp. (стеблевые точильщики), Diatraea saccharalis (огневка сахарного тростника), Diatraea graniosella (огневка кукурузная юго-западная), Earias spp. (совки хлопковые), Earias insulata (“шипованный червь”), Earias vitella (северная совка шершавая), Ecdytopopha aurantianum, Elasmopalpus lignosellus (бабочка эласмопальпус), Epiphysias postruttana (светло-коричневая моль яблонная), Ephestia spp. (огневка мельничная), Ephestia cautella (огневка сухофруктовая), Ephestia elutella (моль табачная), Ephestia kuehniella (огневка амбарная), Epimeces spp., Epinotia aporema, Erionota thrax (листовертка банановая), Eupoecilia ambiguella (листовертка виноградная), Euxoa auxiliaris (гусеница озимой совки), Feltia spp. (совки), Gortyna spp. (сверлильщик), Grapholita molesta (плодожорка восточная), Hedylepta indicata (соевый мотылек), Helicoverpa spp. (ночницы), Helicoverpa armigera (совка хлопковая), Helicoverpa zea (совка хлопковая), Heliothis spp. (ночницы), Heliothis virescens (табачная листовертка), Hellula undalis (огневка капустная), Indarbela spp. (вредитель корней), Keiferia lycopersicella (нематода томатная), Leucinodes orbonalis (баклажанный сверлильщик), Leucoptera malifoliella, Lithocollectis spp., Lobesia botrana (листовертка гроздевая), Loxagrotis spp. (ночницы), Loxagrotis albicosta (совка западная бобовая), Lymantria dispar (шелкопряд непарный), Lyonetia clerkella (моль яблонная минирующая), Mahasena corbetti (мешочницы масляной пальмы), Malacosoma spp. (коконопряды), Mamestra brassicae (совка капустная), Maruca testulalis (огневка акациевая), Metisa plana (мешочница), Mythimna unipuncta (гладкий походный червь), Neoleucinodes elegantalis (маленький томатный точильщик), Nymphula depunctalis (рисовая куколка), Operophthera brumata (пяденица зимняя), Ostrinia nubilalis (мотылек кукурузный), Oxydia vesulia, Pandemis cerasana (листовертка кривоусая смородинная), Pandemis heparana (коричневая яблочная листовертка), Papilio demodocus, Pectinophora gossypiella (розовый коробочный червь), Peridroma spp. (совки), Peridroma saucia (совка грязно-бурая земляная), Perileucoptera coffeella (белая кофейная минирующая мушка), Phthorimaea operculella (картофельная моль), Phyllocnisitis citrella, Phyllonorycter spp. (минирующие мушки), Pieris rapae (белянка репная), Plathypena scabra, Plodia interpunctella (моль индийская мучная), Plutella xylostella (моль капустная), Polychrosis viteana (листовертка виноградная), Prays endocarpa, Prays oleae (моль маслинная), Pseudaletia spp. (ночницы), Pseudaletia unipunctata (походный червь), Pseudoplusia includens (пяденица соевая), Rachiplusia nu, Scirpophaga incertulas, Sesamia spp. (стеблевые огневки), Sesamia inferens (розовая совка рисовая стеблевая), Sesamia nonagrioides, Setora nitens, Sitotroga cerealella (Angoumois grain moth), Sparganothis pilleriana, Spodoptera spp. (походные черви), Spodoptera exigua (совка малая), Spodoptera fugiperda (совка травяная), Spodoptera oridania (южные походные черви), Synanthedon spp. (точильщики корневые), Thecla basilides, Thermisia gemmatalis, Tineola bisselliella (моль комнатная), Trichoplusia ni (совка ни), Tuta absoluta, Yponomeuta spp., Zeuzera coffeae (сверлильщик красных веток) и Zeuzera pyrina (древесница въедливая).
В другом варианте осуществления, изобретение, описанное в настоящем документе, может быть использовано для контроля над Mallophaga (пухоеды). Неисчерпывающий перечень этих вредителей включает, но ими не ограничивается, Bovicola ovis (вошь овечья), Menacanthus stramineus (пухоед двухщетинковый куриный) и Menopon gallinea (обычный вредитель куриных гнезд).
В другом варианте осуществления, изобретение, описанное в настоящем документе, может быть использовано для контроля над Orthoptera (кузнечики, саранча и сверчки). Неисчерпывающий перечень этих вредителей включает, но ими не ограничивается, Anabrus simplex (кобылка), Gryllotalpidae (медведка обыкновенная), Locusta migratoria, Melanoplus spp. (кузнечики), Microcentrum retinerve (кузнечик углокрылый), Pterophylla spp. (кузнечики углокрылые), chistocerca gregaria, Scudderia furcata (кузнечик вилохвостый) и Valanga nigricorni.
В другом варианте осуществления, изобретение, описанное в настоящем документе, может быть использовано для контроля над Phthiraptera (вши). Неисчерпывающий перечень этих вредителей включает, но ими не ограничивается, Haematopinus spp. (коровья и свинная вошь), Linognathus ovillus (вошь овечья), Pediculus humanus capitis (человеческая вошь головная), Pediculus humanus humanus (человеческая вошь нательная) и Pthirus pubis (вошь лобковая).
В другом варианте осуществления, изобретение, описанное в настоящем документе, может быть использовано для контроля над Siphonaptera (блохи). Неисчерпывающий перечень этих вредителей включает, но ими не ограничивается, Ctenocephalides canis (блоха собачья), Ctenocephalides fells (блоха кошачья) и Pulex irritans (блоха человеческая).
В другом варианте осуществления, изобретение, описанное в настоящем документе, может быть использовано для контроля над Thysanoptera (трипсы). Неисчерпывающий перечень этих вредителей включает, но ими не ограничивается, Frankliniella fusca (трипс табачный), Frankliniella occidentalis (трипс цветочный западный), Frankliniella shultzei Frankliniella williamsi (трипс хлебный), Heliothrips haemorrhaidalis (трипс тепличный), Riphiphorothrips cruentatus, Scirtothrips spp., Scirtothrips citri (трипс цитрусовый), Scirtothrips dorsalis (трипс желтый чайный), Taeniothrips rhopalantennalis и Thrips spp.
В другом варианте осуществления, изобретение, описанное в настоящем документе, может быть использовано для контроля над Thysanura (щетинохвостки). Неисчерпывающий перечень этих вредителей включает, но ими не ограничивается, Lepisma spp. (чешуйница) и Thermobia spp. (чешуйница домашняя).
В другом варианте осуществления, изобретение, описанное в настоящем документе, может быть использовано для контроля над Acarina (зудень и клещ). Неисчерпывающий перечень этих вредителей включает, но ими не ограничивается, Acarapsis woodi (пчелиный трахеальный клещ), Acarus spp. (тироглифоидные клещи), Acarus siro (зерновой клещ), Aceria mangiferae (клещ манговых почек), Aculops spp., Aculops lycopersici (ржавый клещ томатов), Aculops pelekasi, Aculus pelekassi, Aculus schlechtendali (клещик Шлехтендаля), Amblyomma americanum (иксодовый клещ), Boophilus spp. (клещи), Brevipalpus obovatus (оранжерейная плоскотелка), Brevipalpus phoenicis (красная и черная плоскотелка), Demodex spp. (зудень чесоточный), Dermacentor spp. (клещи с твердым покровом), Dermacentor variabilis (иксодовый клещ изменчивый), Dermatophagoides pteronyssinus (клещ домашней пыли), Eotetranycus spp., Eotetranychus carpini (желтый клещ паутинный), Epitimerus spp., Eriophyes spp., Ixodes spp. (клещи), Metatetranycus spp., Notoedres cati, Oligonychus spp., Oligonychus coffee, Oligonychus ilicus (клещ паутинный южный), Panonychus spp., Panonychus citri (клещ красный цитрусовый), Panonychus ulmi (клещ красный плодовый), Phyllocoptruta oleivora (клещ красный цитрусовый), Polyphagotarsonemun latus (клещ оранжерейный прозрачный), Rhipicephalus sanguineus (коричневый собачий клещ), Rhizoglyphus spp. (клещ корневой), Sarcoptes scabiei (клещ чесоточный), Tegolophus perseaflorae, Tetranychus spp., Tetranychus urticae (обыкновенный паутинный клещ) и Varroa destructor (варриатозный клещ).
В другом варианте осуществления, изобретение, описанное в настоящем документе, может быть использовано для контроля над Nematoda (нематоды). Неисчерпывающий перечень этих вредителей включает, но ими не ограничивается, Aphelenchoides spp. (паразитирующие на листве и почках деревьев нематоды и хвойные нематоды), Belonolaimus spp. (жалящие нематоды), Criconemella spp. (кольчатые нематоды), Dirofilaria immitis (нематода, паразитирующая в сердце собаки), Ditylenchus spp. (стеблевые и луковичные нематоды), Heterodera spp. (цистообразующие нематоды), Heterodera zeae (цистообразующие нематоды зерновых культур), Hirschmanniella spp. (корневые нематоды), Hoplolaimus spp. (копьевидные нематоды), Meloidogyne spp. (клубеньковые нематоды), Meloidogyne incognita (клубеньковая нематода), Onchocerca volvulus (червь с крюкообразным хвостом), Pratylenchus spp. (lesion нематоды), Radopholus spp. (земляные нематоды) и Rotylenchus reniformis (нематода имеющая форму почки).
В другом варианте осуществления, изобретение, описанное в настоящем документе, может быть использовано для контроля над Symphyla (симфилы). Неисчерпывающий перечень этих вредителей включает, но ими не ограничивается, Scutigerella immaculata.
Для более подробной информации смотри “Handbook of Pest Control - The Behavior, Life Histroy and Control of Household Pests” под редакцией Arnold Mallis, 9-ый выпуск, издательство GIE Media Inc, 2004.
СМЕСИ
Некоторые пестициды, которые могут быть успешно использованы в сочетании с изобретением, описанным в настоящем документе, включают, но этим не оганичиваются, следующие:
1,2 дихлорпропан, 1,3 дихлорпропен,
абамектин, ацефат, ацексиноцил, ацетамиприд, ацетион, ацетопрол, акринафрин, акрилонитрил, аланикарб, алдикарб, алдоксикарб, алдрин, аллетрин, аллосамидин, алликсикарб, альфа-циперметрин, альфа-экдизон, альфа-эндосульфан, АКД-1022, амидитион, амидофлумет, аминокарб, амитон, амитраз, анабазин, оксид мышьяка, атидатион, азадирахтин, азаметифос, азинфос этил, азинфос метил, азобензол, азоциклотин, азотоат,
Bacillus thyringiensis, бария гексафторсиликат, бартрин, бенклотиаз, бендиокарб, бенфуракарб, беномил, беноксафос, бенсультап, бензоксимат, бензил бензоат, бета-цифлутрин, бета-циперметрин, бифеназат, бифентрин, бинапакрил, биоаллетрин, биоэтанометрин, биоперметрин, бистрифлурон, боракс, борная кислота, бромфенвинфос, бром ДДТ, бромциклен, бромофос, бромофос этил, бромпропилат, буфенкарб, бупрофезин, бутакарб, бутатиофос, бутокарбоксим, бутонат, бутоксикарбоксим,
кадусафос, кальция арсенат, кальция полисульфид, камфехлор, карбанолат, карбарил, карбофуран, карбон дисульфид, карбон тетрахлорид, карбофенотион, карбосульфан, картап, ксинометионат, хлорантранилипрол, хлорбензид, хлорбициклен, хлордан, хлордекон, хлордимеформ, хлорэтоксифос, хлорфенапир, хлорфенетол, хлорфензон, хлорфенсульфид, хлорфенвинфос, хлорфлуазурон, хлормефос, хлорбензилат, 3-(4-хлор-2,6-диэтилфенил)-4-гидрокси-8-окса-1-азаспиро[4,5]дек-3-ен-2-он, 3-(4'-хлор-2,4-диметил[1,1'-бифенил]-3-ил)-4-гидрокси-8-окса-1-азаспиро[4,5]дек-3-ен-2-он, 4-[[(6-хлор-3-пиридинил)метил]метиламино]-2(5H)-фуранон, 4-[[(6-хлор-3-пиридинил)метил]циклопропиламино]-2(5H)-фуранон, 3-хлор-N2-[(1S)-1-метил-2-(метилсульфонил)этил]-N1-[2-метил-4-[1,2,2,2-тетрафтор-1-(трифторметил)этил]фенил]-1,2-бензолдикарбоксамид, хлороформ, хлормебуформ, хлорметиурон, хлорпикрин, хлорпропилат, хлорфоксим, хлорпразофос, хлорпирифос, хлорпирифос-метил, хлортиофос, хромафенозид, цинерин I, цинерин II, цисметрин, клоэтокарб, клофентезин, клозантел, клотианидин, меди ацетоарсенит, меди арсенат, меди нафтенат, меди олеат, кумафос, кумитоат, кротамитон, кротоксифос, круэнтарен A и B, круфомат, криолит, цианофенфос, цианофос, циантоат, циантранилипрол, циклетрин, циклопротрин, циенопирафен, цифлуметофен, цифлутрин, цигалотрин, цигексатин, циперметрин, цифенотрин, циромазин, цитиоат, 2-циано-N-этил-4-фтор-3-метокси-бензолсульфонамид, 2-циано-N-этил-3-метокси-бензолсульфонамид, 2-циано-3-дифторметокси-N-этил-4-фтор-бензолсульфонамид, 2-циано-3-фторметокси-N-этил-бензолсульфонамид, 2-циано-6-фтор-3-метокси-N,N-диметил-бензолсульфонамид, 2-циано-N-этил-6-фтор-3-метокси-N-метил-бензолсульфонамид, 2-циано-3-дифторметокси-N,N-диметил-бензолсульфонамид.
d-лимонен, дазомет, DBCP, DCIP, DDT, декарбофуран, дельтаметрин, демефион, демефион O, демефион С, деметон, деметон метил, деметон O, деметон O метил, деметон С, деметон С метил, деметон С метилсульфон, диафентиурон, диалифос, диамидафос, диазинон, дикаптон, дихлофентион, дихлофлуанид, дихлорвос, дикофол, дикрезил, дикротофос, дицикланил, диелдрин, диенохлор, дифловидазин, дифлубензурон, 3-(дифторметил)-N-[2-(3,3-диметилбутил)фенил]-1-метил-1H-пиразол-4-карбоксамид, дилор, димефлутрин, димефокс, диметан, диметоат, диметрин, диметилвинфос, диметилан, динекс, динобутон, динокар, динокар 4, динокар 6, диностон, динопентон, динопроп, динозам, диносульфон, динотефуран, динотербон, диофенолан, диоксабензофос, диоксакарб, диоксатион, дифенил сульфон, дисульфирам, дисульфотон, дитикрофос, DNOC, дофенапин, дорамектин,
экдистерон, эмамектин, EMPC, эмпентрин, эндосульфан, эндотион, эндрин, EPN, эпофенонан, эприномектин, эсфенвалерат, этафос, этиофенкарб, этион, этипрол, этоат метил, этопрофос, этил DDD, этил формиат, этилен дибромид, этилен дихлорид, этилен оксид, этофенпрокс, этоксазол, этримфос, EXD,
F1050, фамфур, фенамифос, феназафлор, феназаксин, фенбутатин оксид, фенхлорфос, фенетакарб, фенфлутрин, фенитротион, фенобукарб, фенотиокарб, феноксакрим, феноксикарб, фенпиритрин, фенпропатрин, фенрироксимат, фензон, фенсульфотион, фентион, фентион этил, фентрифанил, фенвалерат, фипронил, FKI-1033, флоникамид, флуакрипирим, флуазурон, флубендиамид, флубензимин, флукофурон, флуциклоксурон, флуцитринат, флуентил, флуфенерим, флуфеноксурон, флуфенпрокс, флуметрин, флуорбензид, флувалинат, фонофос, форметанат, формотион, формпаранат, фосметилан, фоспират, фостиазат, фостиетан, фостиетан, фуратиокарб, фуретрин, фурфурал,
гамма-цигалотрин, гамма-HCH,
галфенпрокс, галофенозид, HCH, HEOD, гептахлор, гептенофос, гетерофос, гексафлумурон, гекситиазокс, HHDN, гидраметилнон, цианид водорода, гидропрен, гиксинкарб,
имициафос, имидаклоприд, имидаклотиз, имипротрин, индоксакарб, йодметан, IPSP, изамидофос, изазофос, изобензан, изокарбофос, изодрин, изофенфос, изопрокарб, изопротиолан, изотиоат, изоксатион, ивермектин
жасмолин I, жасмолин II, йодфенфос, ювенильный гормон I, ювенильный гормон II, ювенильный гормон III, JC118,
келеван, кинопрен,
лямбда цигалотрин, свинца арсенат, лепимектин, лептофос, линдан, лиримфос, луфенурон, литидатион,
малатион, малонобен, мазидокс, мекарбам, мекарфон, меназон, мефосфолан, ртути хлорид, месульфен, месульфенфос, метафлумизон, метам, метакрифос, метамидофос, метидатион, метиокарб, метокротофос, метомил, метопрен, метоксихлор, метоксифенозид, метил бромид, метил изотиоцианат, метилхлороформ, метилен хлорид, метофлутрин, метолкарб, метоксадиазон, мевинфос, мексакарбат, милбемектин, милбемицин оксим, мипафокс, мирекс, MNAF, монокротофос, морфотион, моксидектин,
нафталофос, налед, нафтален, нереистоксин, N-этил-2,2-диметилпропионамид-2-(2,6-дихлор-α,α,α-трифтор-п-толил)гидразон, N-этил-2,2-дихлор-1-метилциклопропан-карбоксамид-2-(2,6-дихлор-α,α,α-трифтор-п-толил)гидразонникотин, нифлуридид, никкомицин, нитенпирам, нитиазин, нитрилакарб, новалурон, новифлумурон,
ометоат, оксамил, оксидметон метил, оксидепрофос, оксидисульфотон,
парадихлорбензол, паратион, паратион метил, ренфлурон, пентахлорфенол, пентметрин, перметрин, фенкаптон, фенотрин, фентоат, форат, фосалон, фосфолан, фосмет, фоснихлор, фосфамидон, фосфин, фосфокарб, фоксим, фоксим метил, пиперонил бутоксид, пириметафос, пиримикарб, пиримифос этил, пиримифос метил, калия арсенит, калия тиоцианат, пп' ДДТ, праллетрин, прекоцен I, прекоцен II, прекоцен III, примидофос, проклонол, профенофос, профлутрин, промацил, промекарб, пропафос, пропаргит, пропетамфос, пропоксур, протидатион, протиофос, протоат, протрифенбут, пираклофос, пирафлупрол, пиразофос, пиресметрин, пиретрин I, пиретрин II, пиридабен, пиридалил, пиридафентион, пирифлуксиназон, пиримидифен, пиримитат, пирипрол, пирипроксифен,
кцид, гуассиа, хиналфос, хиналфос, хиналфос метил, хинотион, квантифиес,
рафоксанид, ресметрин, ротенон, рианиа,
сабадилла, скрадан, селамектин, силафлуофен, натрия арсенит, натрия флуорид, натрия гексафторсиликат, натрия тиоцианат, софамид, спинеторам, спиносад, спиродиклофен, спиромесифен, спиротетрамат, сулькофурон, сульфирам, сульфлурамид, сульфотеп, сульфоксафлор, сера, фторид серы, сульпрофос,
тау-флувалинат, тазимкарб, TDE, тебуфенозид, тебуфенпирад, тебупиримфос, тефлубензурон, тефлутрин, темефос, TEPP, тераллетрин, тербуфос, тетрахлорэтан, тетрахлорвинфос, тетрадифон, тетраметрин, тетранактин, тетрасул, тэта-циперметрин, тиаклоприд, тиаметоксам, тикрофос, тиокарбоксим, тиоциклам, тиодикарб, тиофанокс, тиометон, тионазин, тиохинокс, тиосультап, турингиенсин, толфенпирад, тралометрин, трансфлутрин, трансперметрин, триаратен, триазамат, триазофос, трихлорфон, трихлорметафос 3, трихлоронат, трифенофос, трифлумурон, триметакарб, трипрен,
вамидотион, ванилипрол, вертицилид
XDE-208, XMC, ксилилкарб,
зета-циперметрин и золапрофос.
Кроме того, могут быть использованы любые сочетания вышеуказанных пестицидов.
Изобретение, описанное в настоящем документе, может быть также использовано с гербицидами и фунгицидами, как в целях экономии, так и ввиду синергизма.
Изобретение, описанное в настоящем документе, может быть также использовано с противомикробными, бактерицидными, дефолиантными, защитными агентами, синергетиками, альгицидами, аттрактантами, десиккантами, феромонами, репеллентами, растворами для обработки животных, средствами для истребления птиц, дезинфицирующими средствами, химическими сигнальными веществами и средствами для уничтожения моллюсков (эти категории не обязательно взаимно исключающие) как в целях экономии, так и ввиду синергизма.
С целью получения большей информации смотри документ “Compendium of Pesticide Common Names”, размещенный на сайте http://www.alanwood.net/pesticides/index.html в качестве даты подачи данного документа. Также смотри “The Pesticide Manual” 14th Edition, edited by C D S Tomlin, copyright 2006 by British Crop Production Council.
СИНЕРГЕТИЧЕСКИЕ СМЕСИ
Изобретение, описанное в настоящем документе, может быть использовано совместно с другими соединениями, такими как указаны в разделе «Смеси», с образованием синергетических смесей, где проявления активностей соединениями в смеси является одинаковыми, подобными или отличающимися.
Примеры проявления активности включают, но этим не ограничиваются: ингибитор ацетил холин эстеразы; модулятор натриевых каналов; ингибитор биосинтеза хитина; антагонист ГАМК-зависимого хлоридного канала; GABA и агонист глютамат-зависимого хлоридного канала; агонист ацетилхолиновых рецепторторов; ингибитор MET I; ингибитор Mg-стимулированный АТФазы; никотиновый ацетилхолиновый рецептор; разрушитель клеточных мембран желудка; и разрушитель механизма оксидативного фосфорилирования.
Кроме того, в качестве синергетиков известны следующие соединения и они могут быть использованы совместно с соединениями по настоящему изобретению в данном документе: пиперонил бутоксид, пипроталь, пропил изом, сезамекс, сезамолин и сульфоксид.
ПРЕПАРАТЫ
Пестициды редко подходят для нанесения их в чистом виде. Обычно бывает необходимым добавить другое вещество, чтобы пестицид можно было использовать в требуемой концентрации и в приемлемом виде, позволяющем упростить нанесение, обращение с ним, транспортировку, хранение, а также сохранять максимум пестицидной активности. Поэтому пестициды вводят в состав препаратов, например, приманок, концентрированных эмульсий, порошков, эмульсионных концентратов, фумигантов, гелей, гранул, микрокапсул, протравителей для семян, концентратов суспензий, суспоэмульсий, таблеток, водорастворимых жидкостей, диспергируемых в воде гранул или сыпучих порошков, смачиваемых порошков и растворов ультрамаленького объема.
Более детальную информацию по видам препаратов смотри в монографии “Catalogue of pecticide formulation types and international coding system” Technical Monograph n°2, 5th Edition by CropLife International (2002).
Пестициды наиболее часто наносят в виде водных суспензий или эмульсий, получаемых исходя из концентрированных препаратов этих пестицидов. Такие водорастворимые, суспендируемые или эмульгируемые в воде препараты представляют собой либо твердые продукты, обычно известные как смачиваемые порошки, или диспергируемые в воде гранулы или жидкости, обычно известные как эмульсионные концентраты или водные суспензии. Смачиваемые порошки, которые могут быть скомпанованы в диспергируемые в воде гранулы, содержат глубокую смесь пестицида, носителя и поверхностно-активного вещества. Концентрация пестицида обычно составляет от приблизительно 10% до приблизительно 90% по массе. Носитель обычно выбирают из аттапульгитовых глин, монтмориллонитовых глин, диатомовых земель или очищенных силикатов. Эффективные поверхностно-активные вещества, содержащие от приблизительно 0,5% до приблизительно 10% смачиваемых порошков, можно найти среди сульфированных лигнинов, конденсированных нафталинсульфонатов, нафталинсульфонатов, алкилбензолсульфонатов, алкилсульфатов и неионных поверхностно-активных веществ, таких как этиленоксидные аддукты алкилфенолов.
Эмульгируемые концентраты пестицидов содержат подходящую концентрацию пестицида, такую как от приблизительно 50 до приблизительно 500 грамм на литр жидкости, растворенной в носителе, который представляет собой либо смешивающийся с водой растворитель, либо смесь смешивающегося с водой органического растворителя и эмульгаторов. Используемые органические растворители включают ароматические, особенно ксилолы, петролейные фракции, особенно высококипящие нафталиновые и олефиновые части петролеума, такие как тяжелый ароматический лигроин. Могут быть использованы также другие органические растворители, такие как терпеновые растворители, включая производные канифоли, алифатические кетоны, такие как циклогексанон, и смешанные спирты, такие как 2-этоксиэтанол. Подходящие эмульгаторы для эмульсионных концентратов выбирают из общеизвестных анионных и неионных поверхностно-активных веществ.
Водные суспензии содержат нерастворимые в воде пестициды, диспергированные в водном носителе при концентрации в области от приблизительно 5% до приблизительно 50% по массе. Суспензии получают путем тонкого помола пестицида и энергичного смешивания его с носителем, содержащим воду и поверхностно-активные вещества. Для повышения плотности и вязкости водного носителя могут быть также добавлены дополнительные компоненты, такие как неорганические соли и синтетические или природные смолы. Часто бывает наиболее эффективным измельчение и смешивание пестицида с одновременным получением водной смеси и гомогенизацией ее в аппарате, таком как песочная мельница, шаровая мельница или гомогенизатор поршневого типа.
Пестициды также могут быть нанесены в виде гранулированных композиций, что является удобным при практическом нанесении на почву. Гранулированные композиции обычно содержат от приблизительно 0,5% до приблизительно 10% по массе пестицида, диспергированного в носителе, который содержит глину или подобное вещество. Такие композиции обычно получают растворением пестицида в подходящем растворителе и нанесением его на гранулированный носитель, который был заранее получен с подходящим размером частиц, в области от приблизительно 0,5 до 3 мм. Такие композиции могут быть также введены в состав препарата путем изготовления густой массы или пасты из носителя и соединения и измельчения ее и высушивания с получением желаемого размера гранулированных частиц.
Дусты, содержащие пестицид, получают тщательным смешиванием пестицида в порошкообразном виде с подходящим сельскохозяйственным носителем для дустов, таким как каолиновая глина, земляная вулканическая порода и тому подобное. Дусты подходящим образом могут содержать от приблизительно 1% до приблизительно 10% пестицида. Они могут быть нанесены в виде удобрений для семян или путем опыления листвы с помощью машины, распыляющей дуст.
Равным образом удобным является нанесение пестицида в виде раствора в подходящем органическом растворителе, обычно петролейного масла, такого как масло для распыления, которое широко используются в сельскохозяйственной химии.
Пестициды также могут быть нанесены в виде аэрозольной композиции. В таких композициях пестицид растворяют или диспергируют в носителе, который представляет собой смесь в виде сжатой под давлением жидкости для аэрозольного устройства. Аэрозольная композиция помещается в контейнер, из которого смесь подается через распылительный клапан.
Пестицидные приманки изготовляют, когда пестицид смешан с пищей или аттрактантом, или с ними обоими. Когда вредители поедают приманку, они также поглощают пестицид. Приманки могут принимать форму гранул, гелей, сыпучих порошков, жидкостей или твердых продуктов. Они используются в местах обитания вредителей.
Фумиганты представляют собой пестициды, которые имеют относительно высокое давление паров и поэтому могут существовать в виде газа достаточной концентрации для уничтожения вредителей на почве или прилегающих областях. Токсичность фумиганта пропорциональна его концентрации и времени воздействия. Они характеризуются хорошей способностью к диффузии и действуют путем проникания в респираторную систему вредителей или адсорбированием через кутикулы вредителей. Для уничтожения вредителей в хранящихся продуктах фумиганты применяют в виде газов под газонепроницаемыми пленками, в герметичных для проникновения газов помещениях или в специальных камерах.
Пестициды могут быть микроинкапсулированы путем суспендирования частиц или капелек пестицидов в пластичные полимеры различных видов. Путем внесения изменений в синтез полимера или изменяя условия проведения процесса, микрокапсулы могут быть получены различных размеров, растворимости, толщины стенок и степени проницаемости. Эти факторы определяют скорость, с которой активный ингредиент, находящийся внутри микрокапсулы, будет высвобождаться, которая, в свою очередь, влияет на конечный результат, то есть на скорость действия и на запах продукта.
Маслорастворимые концентраты изготавливают путем растворения пестицида в растворителе, который будет удерживать пестицид в растворе. Масляные растворы пестицида обычно обеспечивают более быстрое поражение и уничтожение вредителей по сравнению с другими препаратами благодаря тому, что сами растворители обладают пестицидным действием, а растворение воска, покрывающего оболочку, увеличивает скорость воздействия пестицида. Другие преимущества масляных растворов включают лучшую устойчивость при хранении, более легкое проникновение в щели и более высокую адгезию на загрязненных поверхностях.
Другим вариантом осуществления является эмульсия масло-в-воде, где эмульсия содержит масляные глобулы, каждая из которых имеет слоистое жидкое кристаллическое покрытие и которые диспергированы в водной фазе, при этом каждая масляная глобула содержит по меньшей мере одно соединение, являющееся сельскохозяйственно активным, и индивидуально покрыта монослойным или олигослойным покрытием, содержащим: (1) по меньшей мере один неионный липофильный поверхностно-активный агент, (2) по меньшей мере один неионный гидрофильный поверхностно-активный агент и (3) по меньшей мере один ионный поверхностно-активный агент, где указанные глобулы имеют диаметр частиц менее 800 нанометров. Дополнительная информация по данному варианту осуществления раскрыта в патентной публикации U.S. 20070027034, опубликован 1 февраля, 2007, имеет серийный номер патентной заявки 11/495228. Для удобства упоминания данного варианта осуществления, далее оно будет указываться как “OIWE”.
Для получения большей информации смотри “Insect Pest Management” 2nd Edition by D. Dent, copyright CAB International (2000). Кроме того, более подробная информации изложена в публикации “Handbook of Pest Control - The Behavior, Life Histroy and Control of Household Pests” by Arnold Mallis, 9th Edition, copyright 2004 by GIE Media Inc.
ДРУГИЕ КОМПОНЕНТЫ ПРЕПАРАТОВ
Обычно при использовании препарата согласно изобретению, описанному в данном документе, такой препарат также может содержать другие компоненты. Эти компоненты включают, но этим не ограничиваются (это не исчерпывающий и не взаимоисключающий перечень), увлажнители, поверхностно-активные вещества, клейкие вещества, усилители проницаемости, буферы, разрыхлители, уменьшающие пыление агенты, повышающие совместимость агенты, противопенящие агенты, очищающие агенты и эмульгаторы. Небольшая часть компонентов описана непосредственно ниже.
Увлажняющий агент представляет собой вещество, которое при добавлении к жидкости увеличивает распространение или проникновение порошка в жидкость путем снижения межфазного натяжения между жидкостью и поверхностностью, на которую его наносят. В агрохимических препаратах увлажняющие агенты используют по двум основным назначениям: в процессе получения и изготовления для увеличения скорости смачивания порошков водой при приготовлении концентратов для растворимых жидких или суспензионных концентратов; и в процессе смешивания продукта с водой в контейнере для спрея для снижения времени увлажнения смачиваемых порошков и усиления проникновения воды в диспергируемые в воде гранулы. Примерами увлажняющих агентов, используемых в таких препаратах, как смачиваемые порошки, суспензионные концентраты и диспергируемые в воде гранулы, являются: натрий лаурилсульфат; натрий диоктилсульфосукцинат; алкилфенолэтоксилаты; и этоксилаты алифатических спиртов.
Диспергирующий агент представляет собой вещество, которое абсорбируется на поверхностности частиц и помогает частицам сохранить состояние дисперсии и предохраняет их от повторной агрегации. Диспергирующие агенты добавляют к агрохимическим препаратам для облегчения диспергирования и суспендирования в процессе приготовления, а также для гарантии того, что частицы вновь диспергируются в воде в емкости для спрея. Они широко используются в смачиваемых порошках, суспензионных концентратах и в диспергируемых в воде гранулах. Поверхностно-активные вещества, которые используются в качестве диспергирующих агентов, обладают способностью абсорбироваться на поверхности частиц и обеспечивают ионный или стерический барьер для повторной агрегации частиц. Наиболее широко используемыми поверхностно-активными веществами являются анионные, неионные или смеси обоих этих видов. В случае препаратов на основе смачиваемых порошков, наиболее широко используемыми диспергирующими агентами являются лигносульфонаты натрия. В случае суспензионных концентратов очень хорошие показатели абсорбции и стабилизации получали используя полиэлектролиты, такие как конденсаты натрий нафталин сульфонат формальдегида. Также используются тристирилфенол этоксилат фосфатные эфиры. Неионные поверхностно-активные вещества, такие как конденсаты алкиларилэтиленоксида и EO-PO блок-сополимеры, иногда объединяют с анионными поверхностно-активными веществами в качестве диспергирующих агентов для суспензионных концентратов. Недавно в качестве диспергирующих агентов были разработаны новые типы полимерных поверхностно-активных веществ с очень высокой молекулярной массой. Они обладают очень длинными гидрофобными «скелетами» и большим числом этиленоксидных цепей, образующих «зубья» «гребней» поверхностно-активных веществ. Эти полимеры с высокой молекулярной массой могут придавать очень хорошую продолжительную стабильность суспензионным концентратам, поскольку гидрофобные скелеты имеют много точек присоединения на поверхностности частиц. Примерами диспергирующих агентов, используемых в агрохимических препаратах, являются: натрий лигносульфонаты; натрий нафталин сульфонат формальдегидные конденсаты; тристирилфенол этоксилат фосфатные эфиры; этоксилаты алифатических спиртов; алкилэтоксилаты; EO-PO блок сополимеры; и графт сополимеры.
Эмульгирующий агент представляет собой вещество, которое стабилизирует капельки суспензии одной жидкой фазы в другой жидкой фазе. Без эмульгирующего агента две жидкости могли бы разделиться на две несмешивающиеся жидкие фазы. Наиболее общеизвестные используемые эмульгирующие смеси содержат алкилфенол или алифатический спирт с 12 или более этиленоксидными звеньями и маслорастворимую кальциевую соль додецилбензолсульфоновой кислоты. В области гидрофильного-липофильного равновесия (“HLB”) значения от 8 до 18 естественным образом обеспечивают хорошую стабильность эмульсии. Стабильность эмульсии может быть иногда повышена путем добавления небольшого количества поверхностно-активного вещества на основе EO-PO блок сополимера.
Солюбилизирующий агент представляет собой поверхностно-активное вещество, которое будет образовывать мицеллы в воде при концентрации выше критической концентрации мицеллообразования. Мицеллы затем способны растворять или солюбилизировать нерастворимые в воде продукты внутри гидрофобной части мицеллы. Тип поверхностно-активного вещества, обычно используемого для солюбилизации, является неионным: моноолеаты сорбитана; этоксилаты моноолеаты сорбитана; и метилолеатные эфиры.
Иногда используют поверхностно-активные вещества, либо самостоятельно, либо с другими дополнительными веществами, такими как минеральные или растительные масла в качестве адъювантов для смесей в емкостях для спреев с целью улучшения биологического действия пестицида на цель. Виды поверхностно-активных веществ, используемых для усиления биологического действия, зависят, главным образом, от природы и вида действия пестицида. Однако они часто являются и неионными, такими как: алкилэтоксилаты; этоксилаты линейных алифатических спиртов; этоксилаты алифатических аминов.
Носитель или разбавитель в сельскохозяйственном препарате представляет собой вещество, добавляемое к пестициду с получением продукта требуемой силы действия. Носителями обычно являются вещества с высокой абсорбционной способностью, тогда как разбавителями обычно являются вещества с низкой абсорбционной способностью. Носители и разбавители используются в составах для дустов, смачиваемых порошков, гранул и диспергируемых в воде гранул.
Органические растворители, главным образом, используются в составах эмульсионных концентратов, препаратов ULV, а также используются в гранулированных препаратах. Иногда используют смеси растворителей. Первыми главными группами растворителей являются алифатические парафиновые масла, такие как керосин или очищенные парафины. Вторую главную и наиболее часто используемую группу составляют ароматические растворители, такие как ксилол и фракции C9 и C10 ароматических растворителей с более высокими молекулярными массами. Когда препарат эмульгирован в воде, в качестве сорастворителей для предотвращения кристаллизации пестицидов могут быть использованы углеводороды. Для увеличения силы растворителя иногда используют в качестве сорастворителей спирты.
Загустители или желирующие агенты используются главным образом в таких препаратах, как суспензионные концентраты, эмульсии и суспоэмульсии, для модифицирования реологии или текучих свойств жидкости и для предотвращения отделения и выпадения в осадок диспергированных частиц или капелек. Загустители, желирующие агенты и антиосадочные агенты обычно подразделяются на две категории, а именно: нерастворимые в воде частицы и растворимые в воде полимеры. Можно приготовить препараты суспензионных концентратов, используя глины и силикагели. Примеры этих видов продуктов включают, но этим не ограничиваются, монтмориллонит, например бентонит; силикат магния алюминия; и аттапульгит. Уже много лет в качестве загустителей или желирующих агентов используют водорастворимые полисахариды. Видами наиболее часто используемых полисахаридов являются природные экстракты семян и морских водорослей, либо они являются синтетическими производными целлюлозы. Примеры этих типов продуктов включают, но этим не ограничиваются, гуаровую смолу; смолу плодов рожкового дерева; каррагенан; альгинаты; метилцеллюлозу; натрия карбоксиметилцеллюлозу (SCMC); гидроксиэтил целлюлозу (HEC). Другие виды антиосадочных агентов основаны на модифицированных крахмалах, полиакрилатах, поливиниловом спирте и полиэтиленоксиде. Другим хорошим антиосадочныхм агентом является ксантановая смола.
Микроорганизмы вызывают порчу препаратов. Поэтому для устранения или уменьшения их действия используются предохраняющие агенты. Примеры таких агентов включают, но этим не ограничиваются: пропионовую кислоту и ее натриевую соль; сорбиновую кислоту и ее натриевую или калиевую соли; бензойную кислоту и ее натриевую соль; натриевую соль п-гидроксибензойной кислоты; метил п-гидроксибензоат; и 1,2-бензизотиазалин-3-он (BIT).
Присутствие поверхностно-активных веществ, которые снижают межфазное натяжение, часто вызывает в основанных на воде препаратах образование пены в процессе смешивания при их получении или нанесении с помощью емкости для спрея. Для снижения способности к образованию пены часто добавляют противопенные агенты либо на стадии получения, либо перед наполнением бутылей. В основном, существует два вида противопенящих агентов, а именно: силиконы и несиликоны. Силиконы обычно представляют собой водные эмульсии диметилполисилоксана, тогда как несиликоновыми противопенными агентами являются нерастворимые в воде масла, такие как октанол и нонанол или силикагель. В обоих случаях функцией противопенного агента является удаление поверхностно-активного вещества c границы раздела воздух-вода.
Для дальнейшей информации смотри “Chemistry and Technology of Agrochemical Formulation” edited by D.A. Knowles, copyright 1998 by Kluwer Academic Publishers. Также смотри “Insecticides in Agriculture and Environment - Retrospects and Prospects” by A.S. Perry, I. Yamamoto, I. Ishaaya and R. Perry, copyright 1998 by Springer-Verlag.
НАНЕСЕНИЕ
Фактическое количество пестицида, которое должно быть нанесено на локус вредителей, не является критическим и легко может быть установлено специалистом в данной области. Обычно, для обеспечения хорошего подавления вредителей, предполагается концентрация пестицида от приблизительно 0,01 грамм на гектар до приблизительно 5000 грамм пестицида на гектар.
Локус, на который наносят пестицид, может быть любым локусом обитания вредителя, например урожай овощей, фруктовые и ореховые деревья, виноградные вина, декоративные растения, домашние животные, внутренние или внешние поверхности зданий и почва вокруг зданий.
Что касается приманок, то они, главным образом, находятся на почве, где, например, термиты могут быть в контакте с приманкой. Приманки также могут быть нанесены на поверхностности зданий (горизонтальные, вертикальные или наклонные поверхностности), где, например, муравьи, термиты, тараканы и мухи могут контактировать с приманкой.
Ввиду уникальной способности яиц некоторых вредителей сопротивляться воздействию пестицидов, может быть желательным повторное их нанесение для уничтожения появляющихся личинок.
Пестициды для растений могут быть использованы для уничтожения вредителей нанесением как на ту, так и на иную часть растения. Например, уничтожение насекомых, питающихся листьями, может быть осуществлено путем опрыскивания, или нанесением при вспашке, или путем обработки семян перед посадкой. Обработку семян можно осуществлять на всех видах семян, включая те, в которых растения генетически преобразованы для проявления специальных характеристик при прорастании. Представительные примеры включают семена или растения, экспрессирующие токсичность к белкам и/или двойным РНК спиралям у беспозвоночных вредителей, таких как Bacillus thuringiensis, Bt Cry токсины, Bt Vip токсины, RNAi или другие инсектицидные токсины, растения, экспрессирующие гербицидную устойчивость, такие как семена “Roundup Ready” или растения c “уложенными” чужеродными генами, экспрессирующими инсектицидные токсины, гербицидную усточивость, улучшение питательных свойств или какие-либо другие улучшенные характеристики. Более того, такая обработка семян в соответствии с изобретением, описанным в данном документе, далее повышает способность растений лучше противостоять сложным условиям роста. Эти результаты проявляются в оздоровлении и укреплении растений, что может привести к повышению собранного урожая.
Должно быть легко понятным, что изобретение может быть использовано на растениях, генетически модифицированных с целью проявления специальных характеристик, таких как Bacillus thuringiensis, RNAi или другие инсектицидные токсины, или на растениях, проявляющих гербицидную устойчивость, или на растениях с “уложенными” чужеродными генами, эксперессирующими инсектицидные токсины, гербицидную устойчивость, улучшение питательных свойств или какие-либо другие улучшенные характеристики.
Изобретение, описанное в данном документе, является подходящим для подавления эндопаразитов и эктопаразитов в области ветеринарной медицины или в области содержания животных (которые, чтобы было яснее, включают домашних питомцев, например, кошек, собак и птиц). Соединения в соответствии с данным изобретением используются обычными способами, такими как пероральное введение в виде, например, таблеток, капсул, питья, гранул, нанесением на кожу в виде, например, окунания, обрызгивания спреем, обливания, смачивания и присыпкой, и парентеральным введением в виде, например, инъекции.
Изобретение, раскрытое в данном документе, также может успешно использоваться при содержании домашних животных, например крупного рогатого скота, овец, свиней, кур и гусей. Подходящие препараты вводят животным перорально с питьевой водой или кормом. Дозы и препараты, которые являются подходящими, зависят от вида животного.
Перед тем как пестицид может быть использован или коммерчески реализован, такой пестицид подвергается долго длящейся процедуре его оценки различными государственными органами (местными, региональными, штата, национальными, интернациональными). Требования многочисленных сведений устанавливаются действующим органом власти, и при подготовке и направлении документов они должны быть учтены заявителем продукта иным лицом от имени заявителя продукта для регистрируемого продукта. Эти органы власти затем просматривают такие документы и, если требования к безопасности соблюдаются, выдают возможному пользователю или продавцу разрешение на регистрацию продукта. После этого, в той местности, где регистрация продукта установлена и подтверждена, такие пользователи или продавцы могут использовать или продавать такой пестицид.
Заголовки в данном документе даны только для удобства и не должны использоваться для интерпретации какого-либо его раздела.
Для устранения недопонимания, следует учесть, что Ar1 иногда указывают как Ar1 для удобства типографии и форматирования. Кроме того, Ar2 иногда указывают как Ar2 для удобства типографии и форматирования. Для целей данного изобретения насыщение двойной или тройной связи другими атомами рассматривается как замещение.