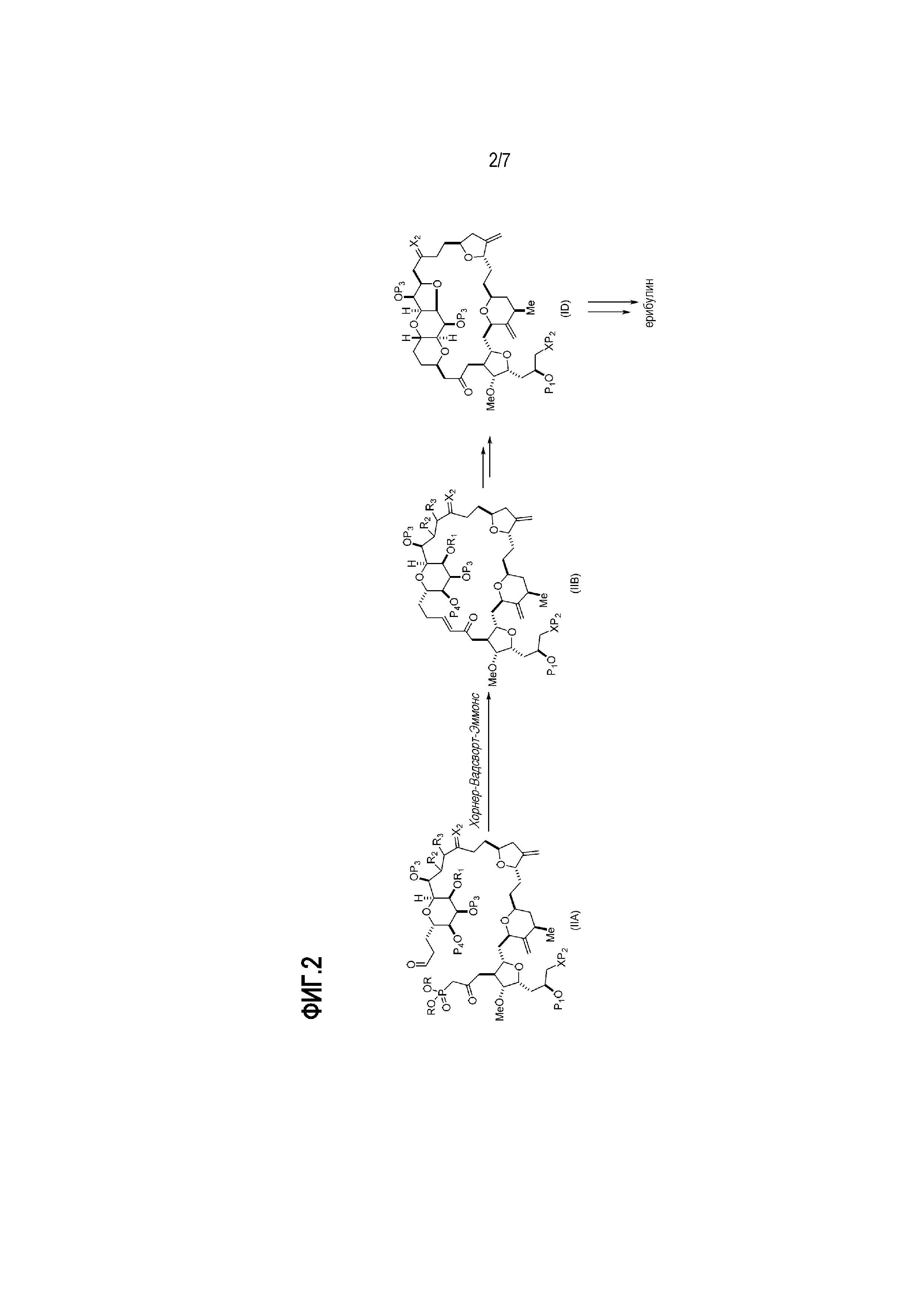
Результат интеллектуальной деятельности: РЕАКЦИИ МАКРОЦИКЛИЗАЦИИ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ И ДРУГИЕ ФРАГМЕНТЫ, ПРИГОДНЫЕ В ПОЛУЧЕНИИ АНАЛОГОВ ХАЛИХОНДРИНА B
Вид РИД
Изобретение
Уровень техники настоящего изобретения
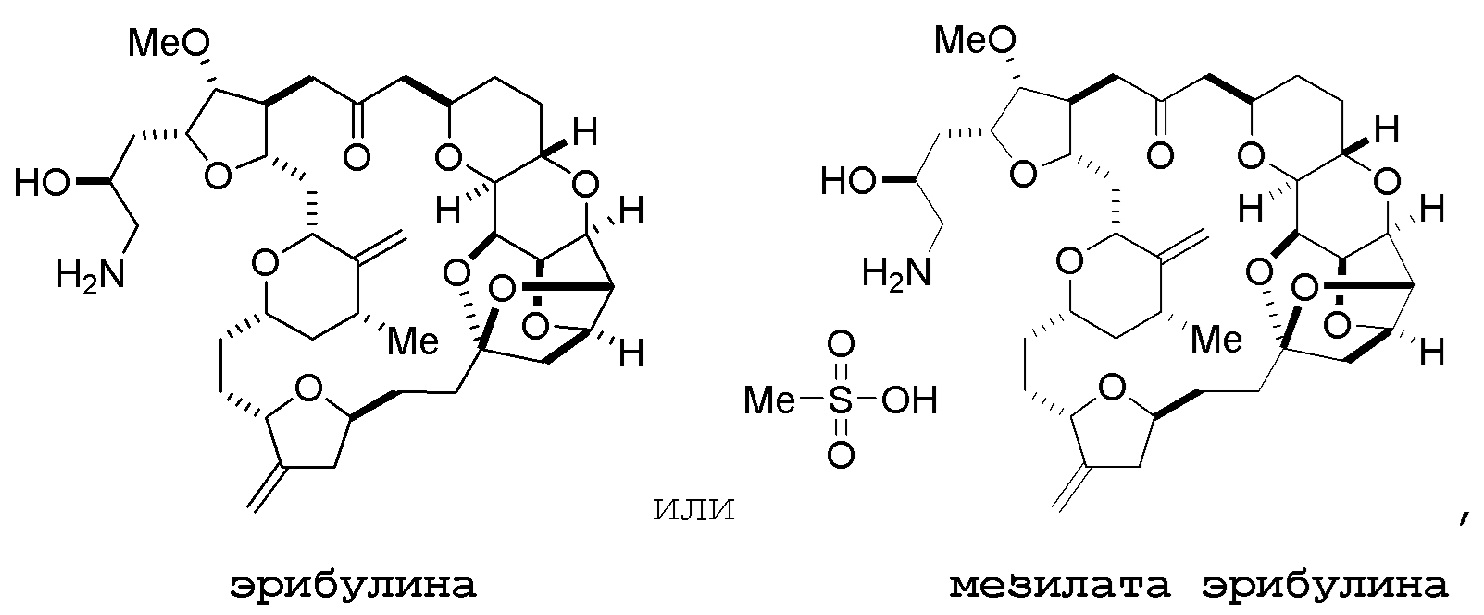
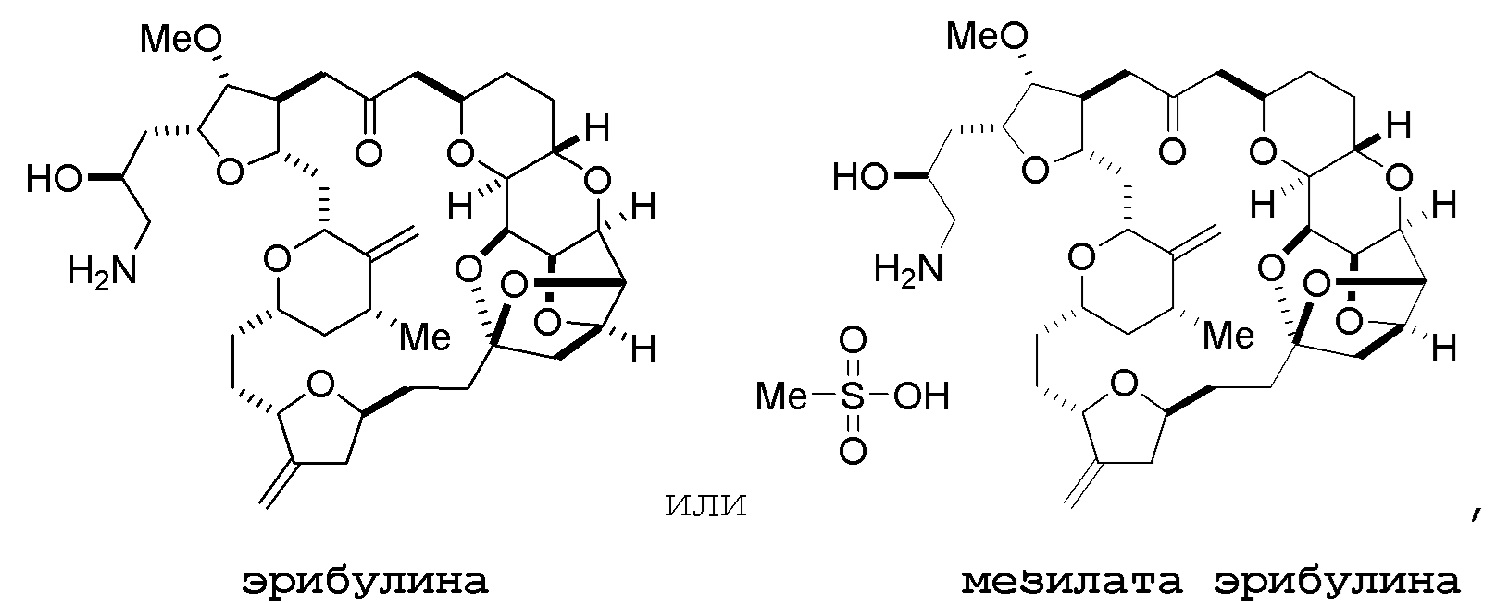
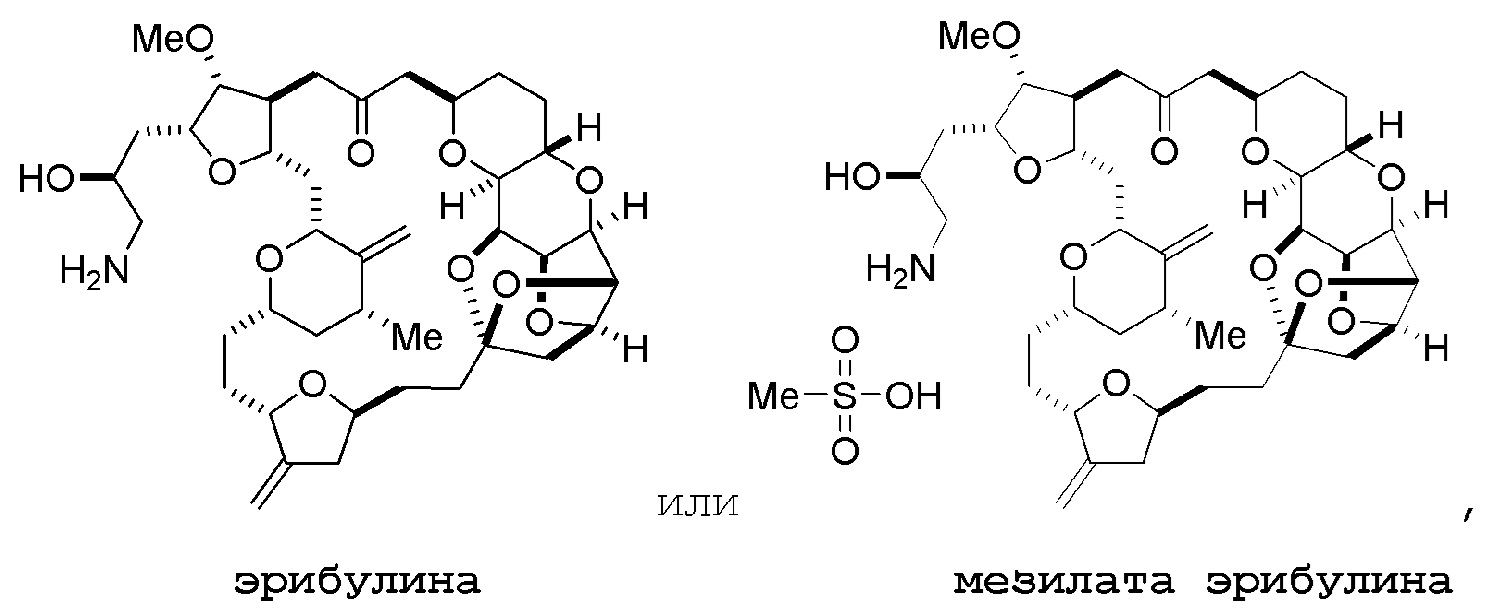
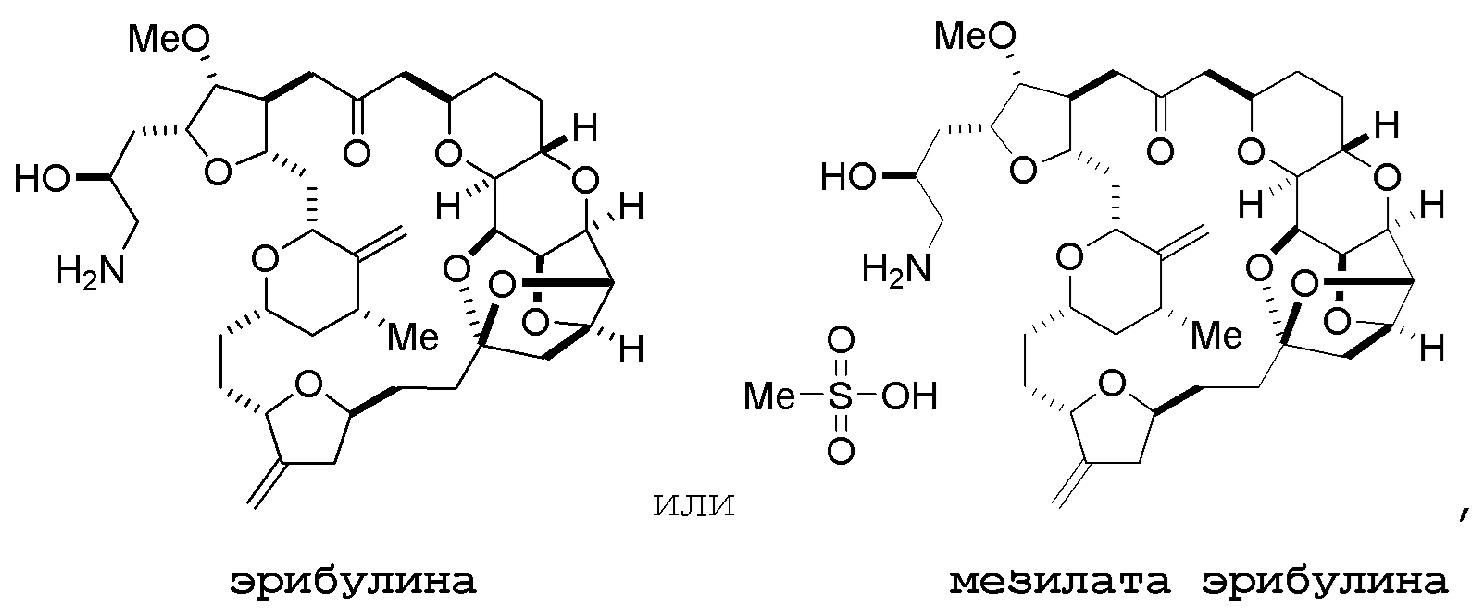
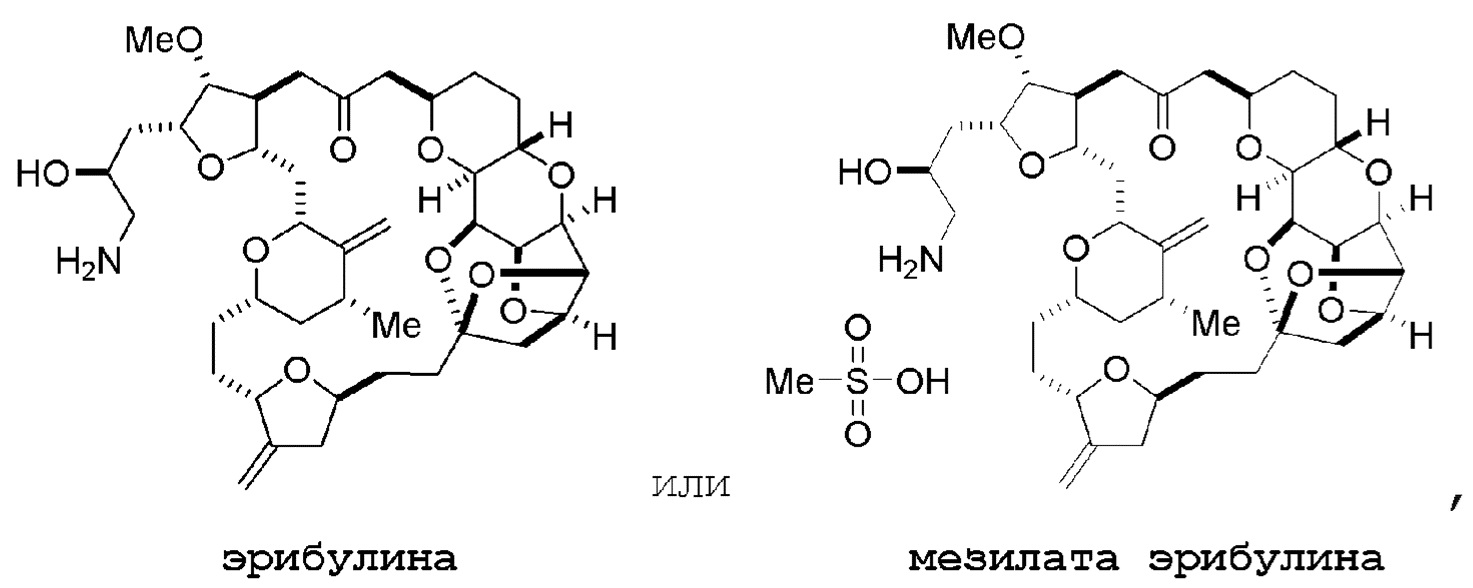
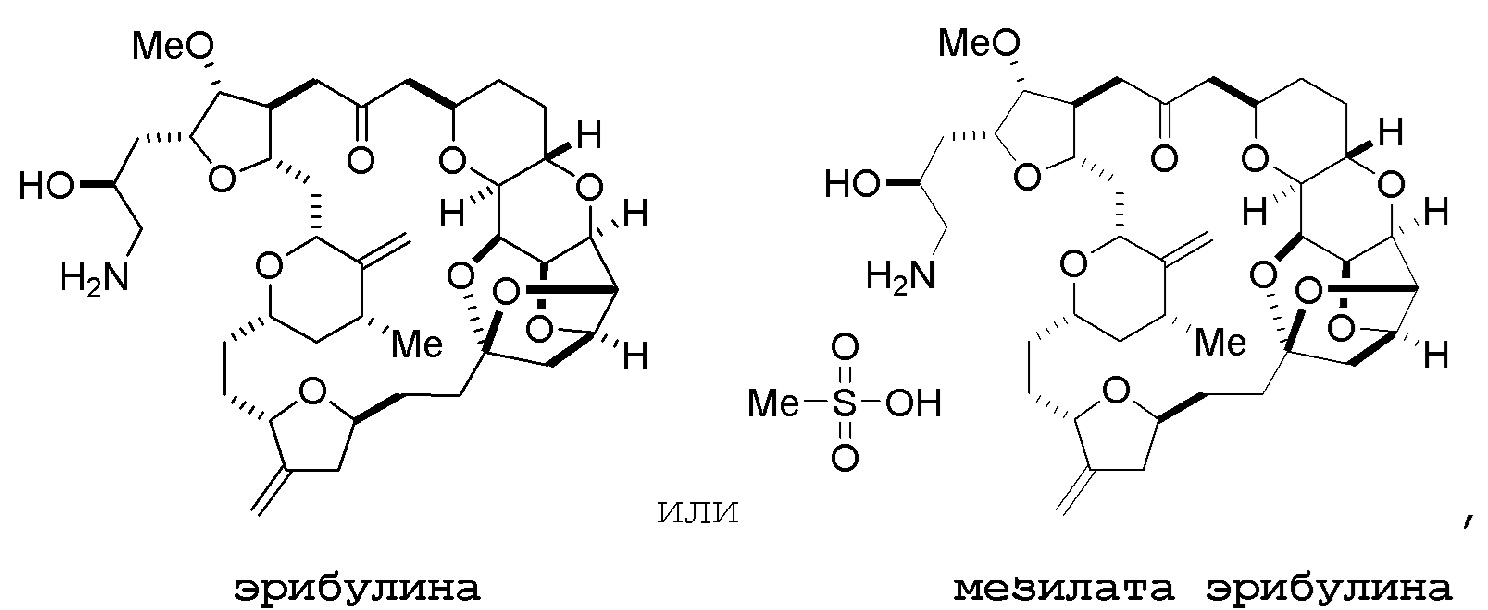
Настоящее изобретение относится к промежуточным соединениям, пригодным в получении фармацевтически активных макролидных соединений, и способам получения макролидных соединений. Халихондрин B представляет собой эффективный противораковый агент, впервые выделенный из морской губки Halichondria okadai, и затем обнаруженный в Axinella sp., Phakellia carteri и Lissodendoryx sp. Полный синтез халихондрина B опубликован в 1992 (Aicher, T. D. et al., J. Am. Chem. Soc. 114:3162-3164). Мезилат эрибулина (также называемый Halaven®, E7389 и мезилатная соль B1939), нетаксановый ингибитор динамики микротрубочек, представляет собой структурно упрощенный синтетический аналог халихондрина B. Способы и промежуточные соединения для получения мезилата эрибулина и других аналогов халихондрина B описаны в международных публикациях No WO 2005/118565, WO 2009/046308, WO 2009/064029 и WO 2009/124237; патенте США No 6214865; Austad et al., Synlett 24(3):333-337, 2013; Austad et al., Synlett. 24(3):327-332, 2013; и Chase et al., Synlett 24(3):323-326, 2013; каждая из которых включена в настоящее изобретение с помощью ссылки во всей своей полноте. Новые способы получения аналогов халихондрина B, в частности эрибулина, являются востребованным.
Сущность настоящего изобретения
В общем, настоящее изобретение относится к способам макроциклизации промежуточных соединений в получении эрибулина или его фармацевтически приемлемой соли (например, мезилата эрибулина). Настоящее изобретение также относится к промежуточным соединениям, которые можно применять в реакциях макроциклизации, описанных в настоящем изобретении.
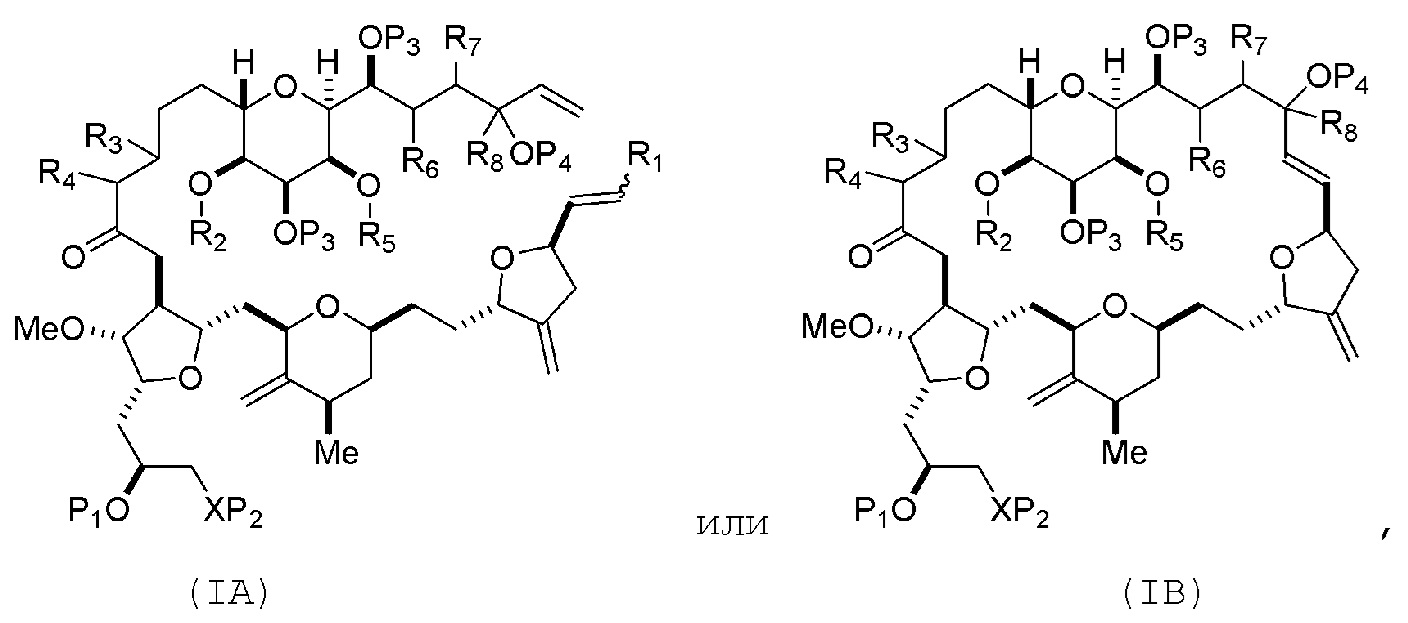
В первом аспекте, настоящее изобретение относится к способу получения промежуточного соединения в получении эрибулина, причем способ включает проведение реакции макроциклизации на немакроциклическом промежуточном соединении, причем реакция макроциклизации дает промежуточное соединение в получении эрибулина образованием C.15-C.16, C.2-C.3, C.3-C.4, C.19-C.20, C.0-C.1 или C.26-C.27 связи в структуре эрибулина.
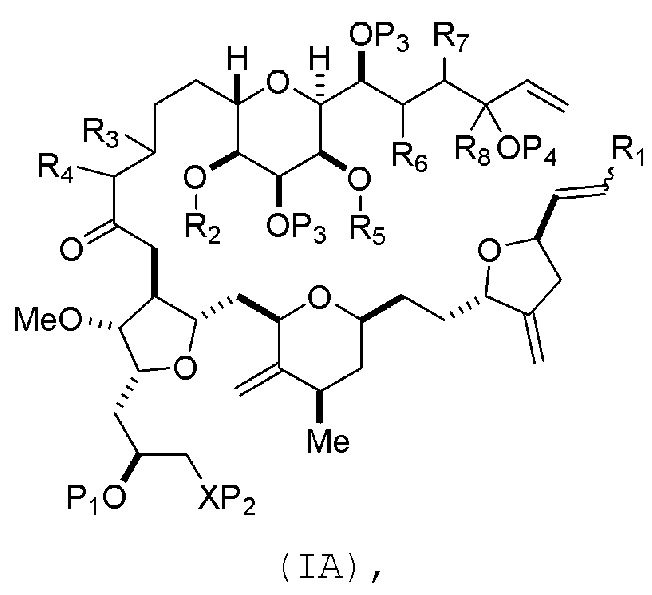
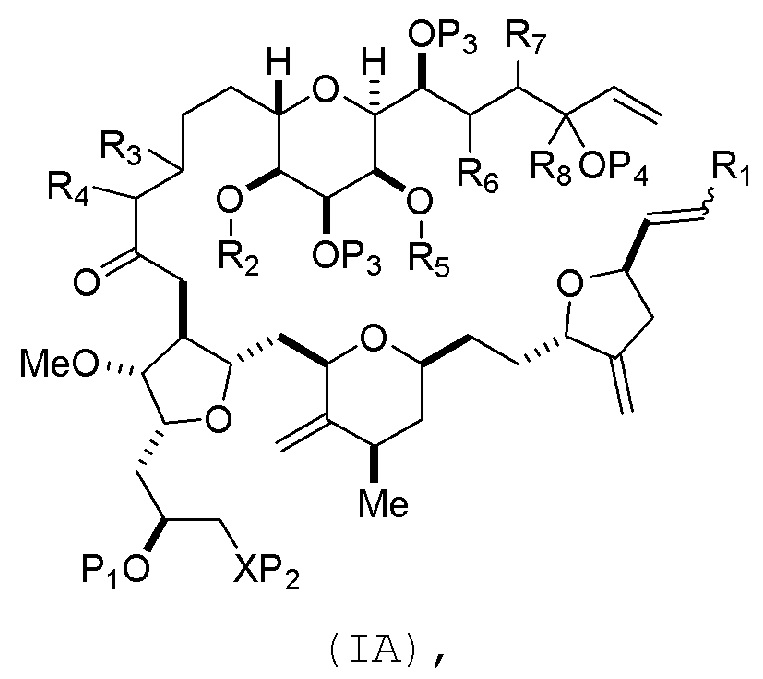
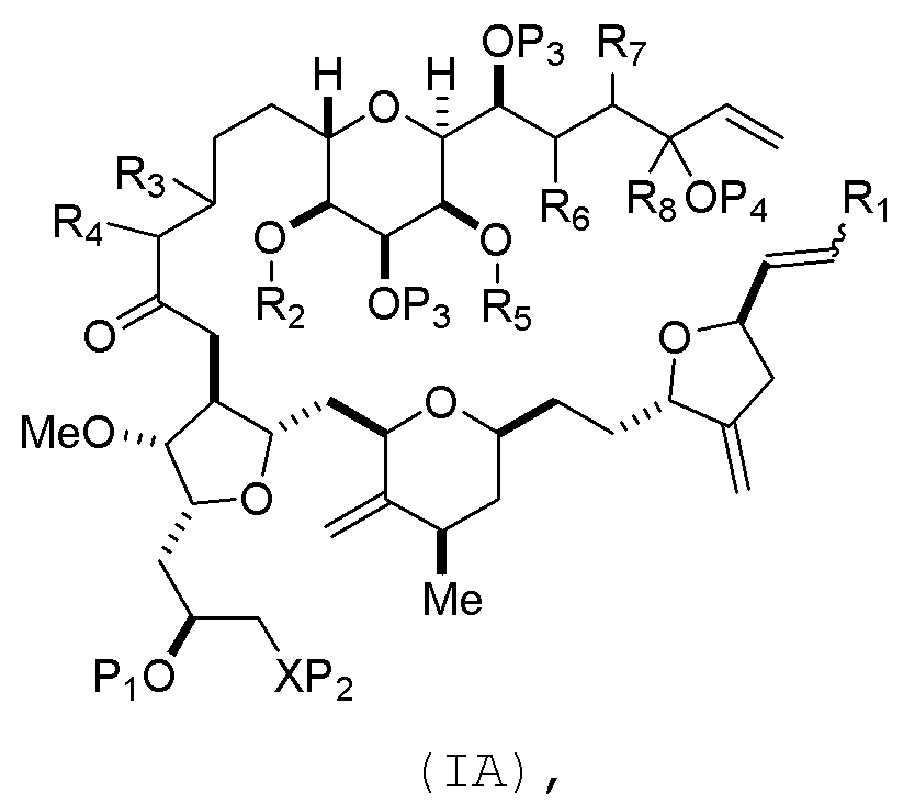
В некоторых вариантах осуществления первого аспекта, проведение реакции макроциклизации может включать контакт немакроциклического промежуточного соединения (например, соединения формулы (IA)) с катализатором метатезиса олефинов (например, рутений-карбеновым комплексом). Немакроциклическое промежуточное соединение может представлять собой соединение формулы (IA) или его соль:
где
R1 представляет собой H или -CH2X1CH2CH=CH2, где X1 представляет собой O, -C(R9)2- или NP5, и где каждый R9 независимо представляет собой H или -COOR10, P5 представляет собой N-защитную группу, и R10 представляет собой C1-6 алкил;
(a1) R2 представляет собой H или защитную группу гидроксила, R3 представляет собой C1-6 алкиловый эфир, и R4 представляет собой H;
(a2)R2 представляет собой H или защитную группу гидроксила, и R3 и R4 соединяют, образуя двойную связь;
или
(a3) R2 и R3 соединяют, образуя связь, и R4 представляет собой H;
(b1) R5 представляет собой H или защитную группу гидроксила, и R6 и R7 соединяют, образуя двойную связь;
или
(b2) R5 и R6 соединяют, образуя связь, и R7 представляет собой H;
(c1) R8 представляет собой H, и P4 представляет собой H или защитную группу гидроксила;
или
(c2) R8 и P4 соединяют, образуя двойную связь;
каждый P3 независимо представляет собой H или защитную группу гидроксила; и
X представляет собой O, и
каждый P1 и P2 независимо представляет собой H или защитную группу гидроксила,
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя циклический защищенный диол;
или
X представляет собой N, и
P1 представляет собой H или защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино;
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя аминаль или 1,3-оксазолидин-2-он-5-ил; и
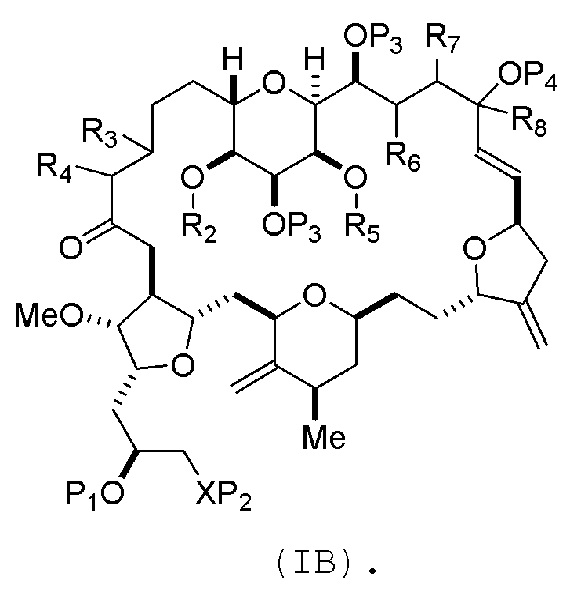
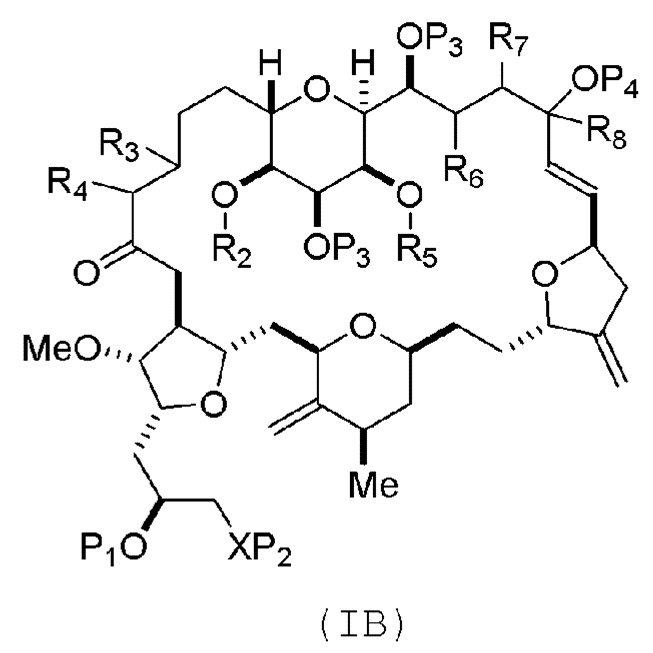
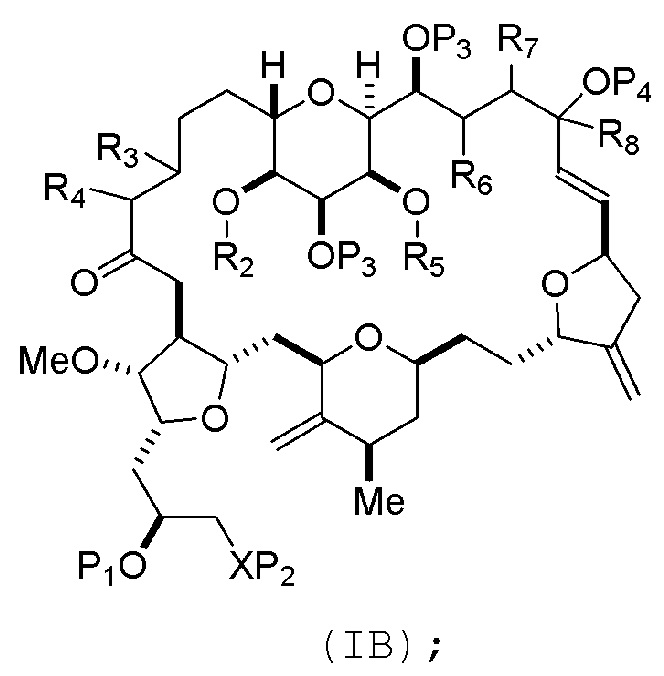
где промежуточное соединение в получении эрибулина может представлять собой соединение формулы (IB) или его соль:
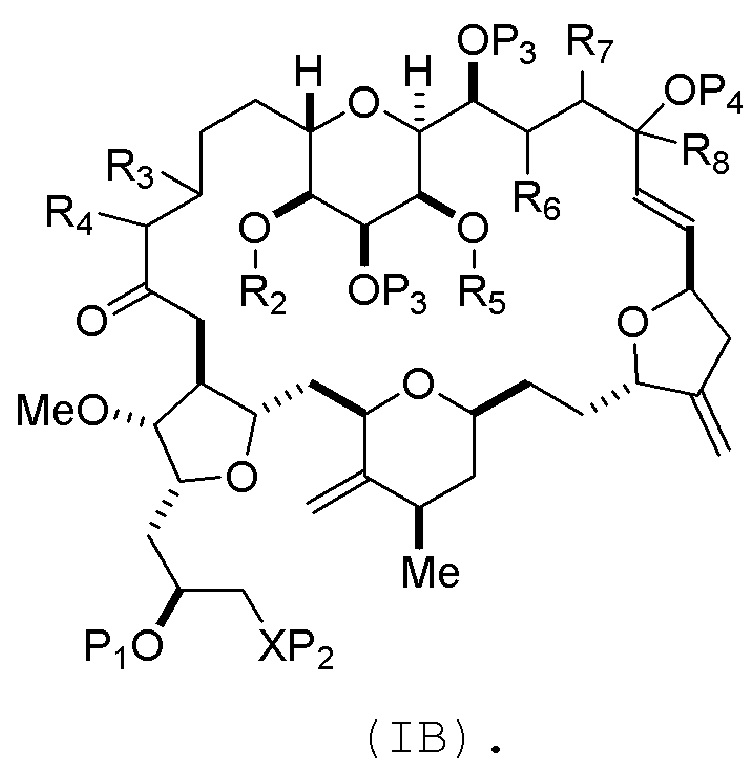
В формуле (IA) или (IB), каждый P3 и P4 может независимо представлять собой защитную группу гидроксила (например, силил). В формуле (IA) или (IB), P1 может представлять собой защитную группу гидроксила (например, силил). В формуле (IA) или (IB), X может представлять собой O. В формуле (IA) или (IB), P2 представляет собой защитную группу гидроксила (например, силил). В формуле (IA) или (IB), X может представлять собой N, и P1 и P2, вместе с атомами, с которыми каждый из них соединен, можно соединять, образуя аминаль. В формуле (IA) или (IB), R2 и R3 можно соединять, образуя связь, и R4 может представлять собой H. В формуле (IA) или (IB), R5 и R6 можно соединять, образуя связь, и R7 может представлять собой H. В формуле (IA) или (IB), R8 может представлять собой H, и P4 может представлять защитную группу гидроксила (например, силил).
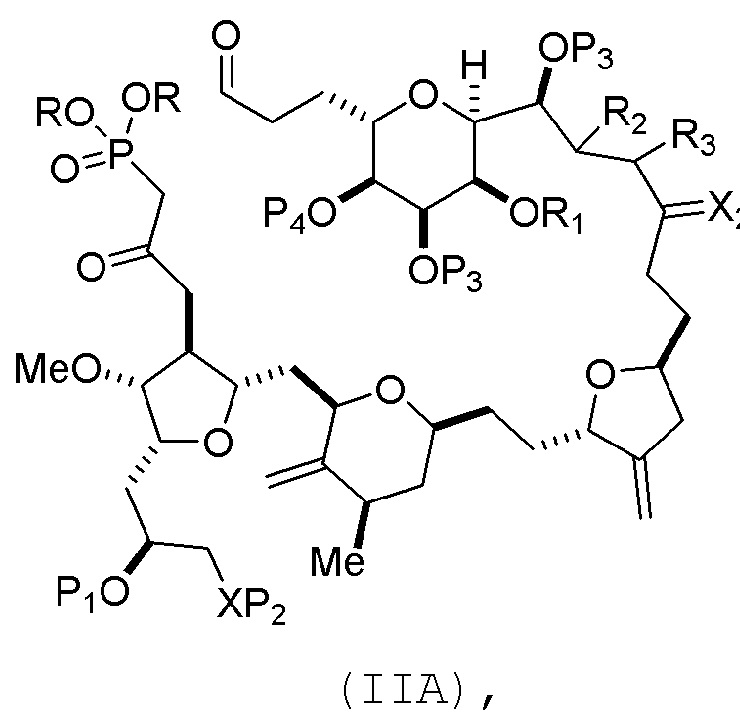
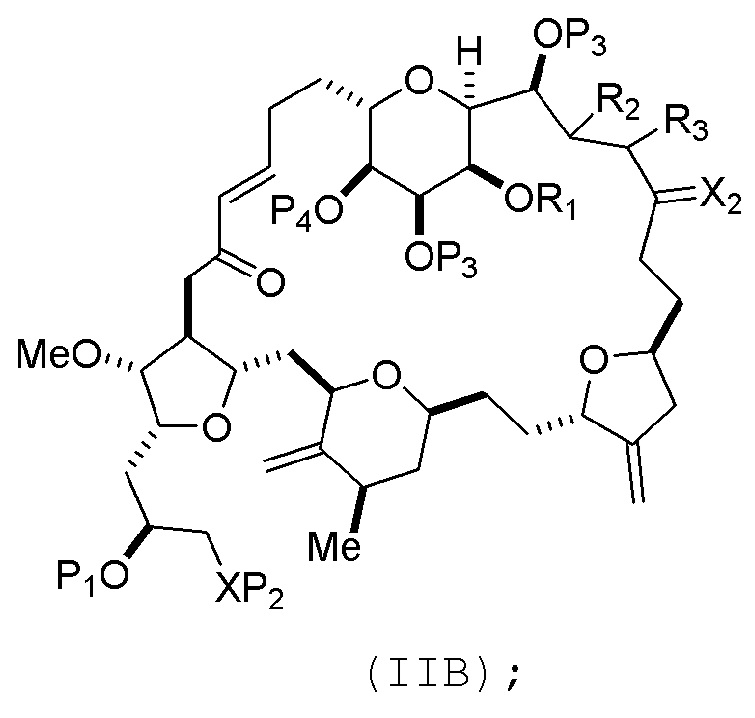
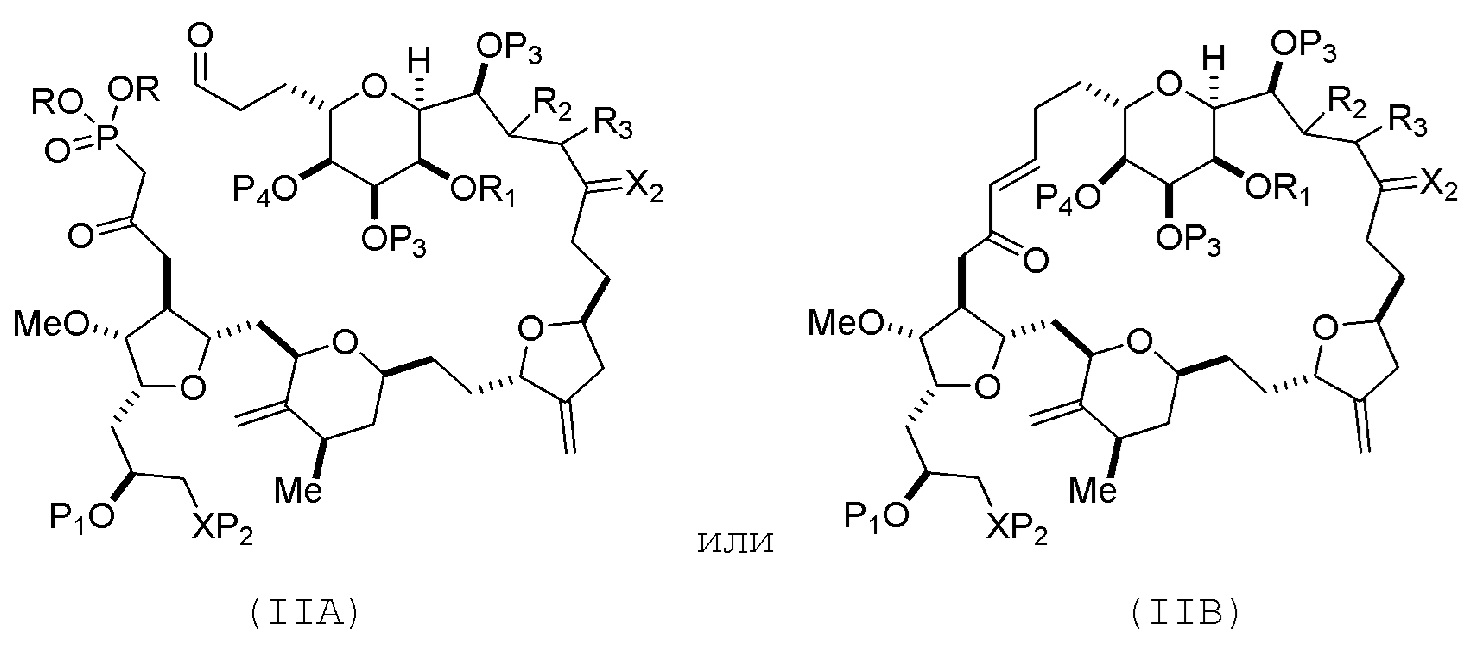
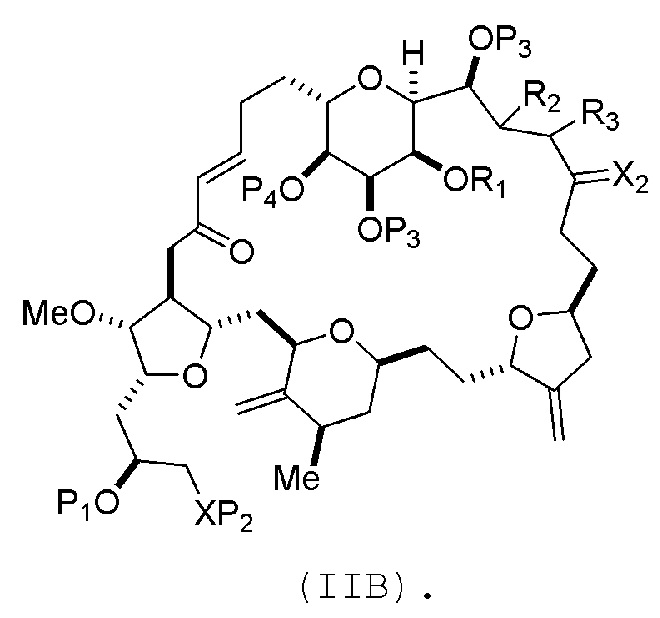
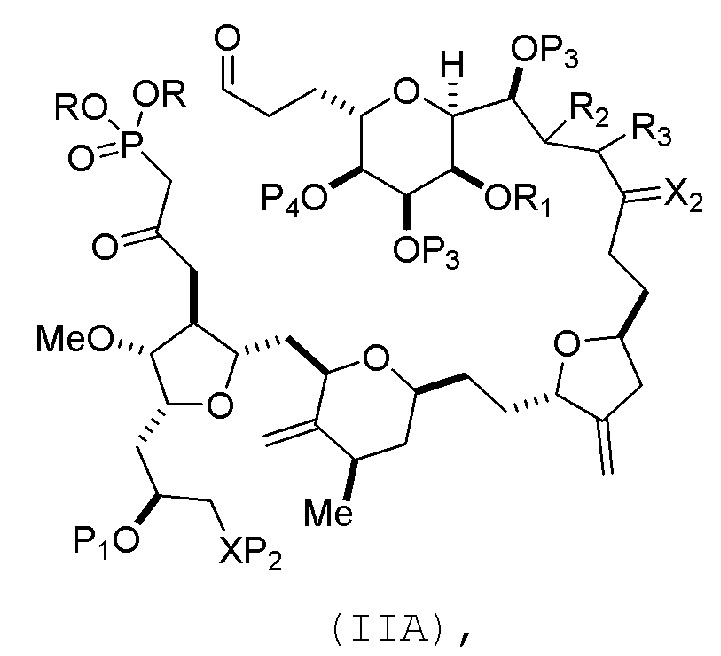
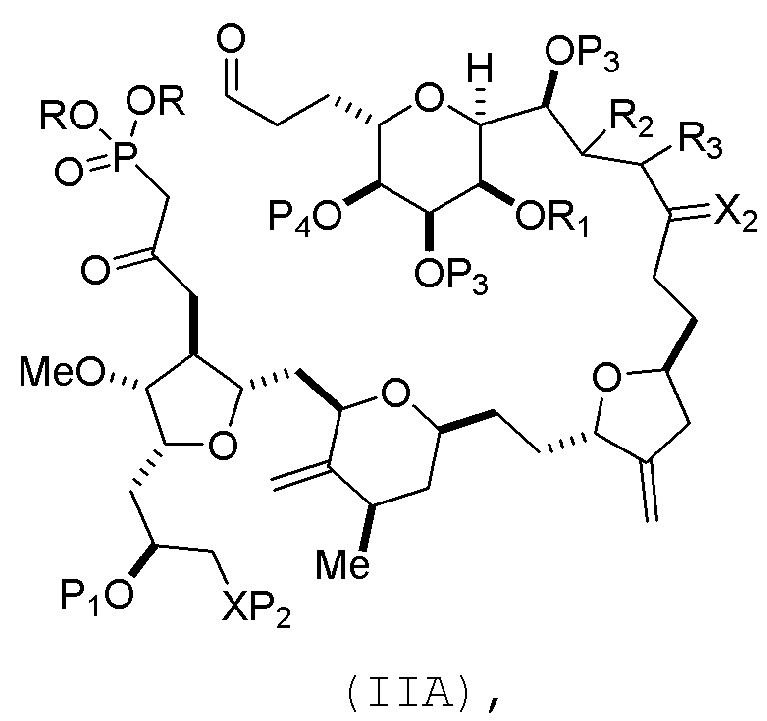
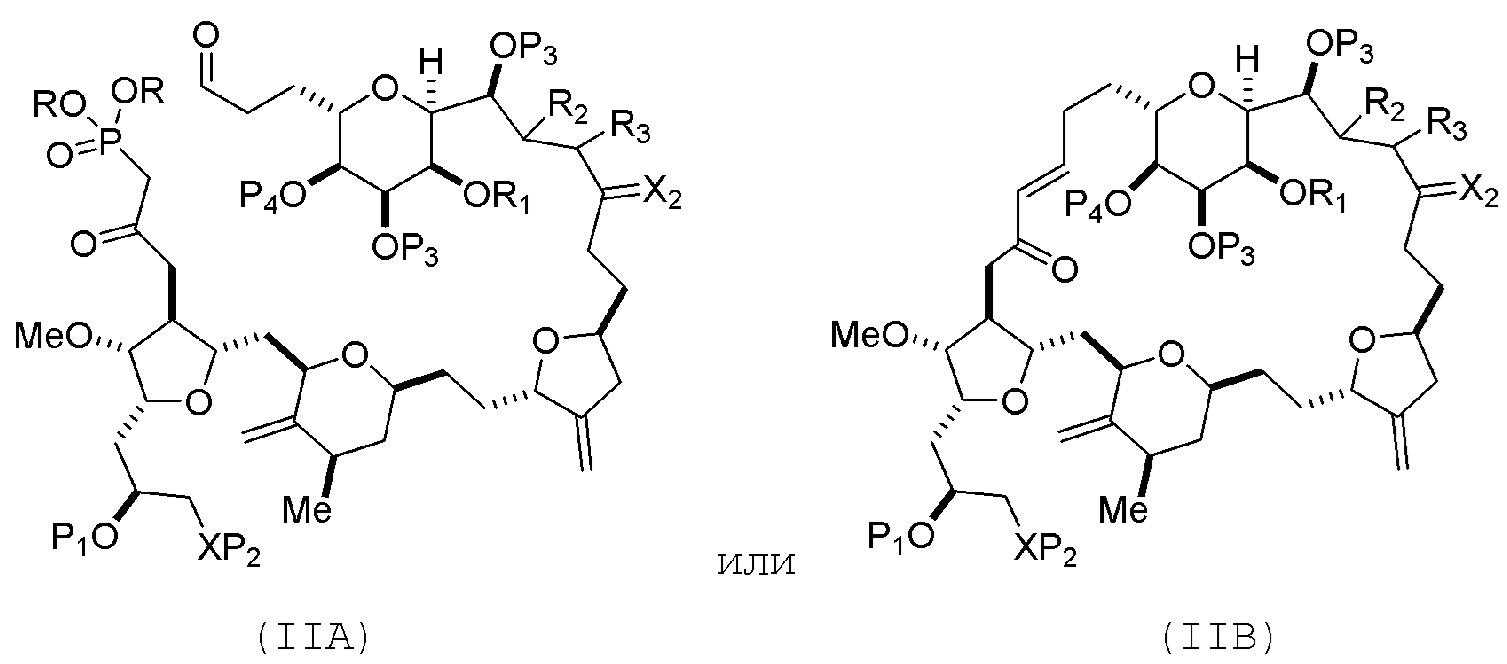
В конкретных вариантах осуществления первого аспекта, проведение реакции макроциклизации включает реакцию немакроциклического промежуточного соединения (например, соединения формулы (IIA)) с органическим основанием (например, органическим основанием, имеющим pKa 11±2 (например, DBU или триалкиламином (например, триэтиламином))) и кислотой Льюиса (например, солью Li, Mg или Zn (например, хлоридом лития или трифторметансульфонатом цинка)). В частности, способ может включать проведение реакции Хорнера-Вадсворта-Эммонса на соединении формулы (IIA), получая соединение формулы (IIB). Немакроциклическое промежуточное соединение может представлять собой соединение формулы (IIA) или его соль:
где
каждый R представляет собой независимо необязательно замещенный алкил или необязательно замещенный арил;
(i) R1 представляет собой H или защитную группу гидроксила, и R2 и R3 соединяют, образуя двойную связь;
или
(ii) R1 и R2 соединяют, образуя связь, и R3 представляет собой H;
каждый P3 независимо представляет собой H или защитную группу гидроксила, и X2 представляет собой оксо; или обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь;
P4 представляет собой H или защитную группу гидроксила; и
X представляет собой O, и
каждый P1 и P2 независимо представляет собой H или защитную группу гидроксила,
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя циклический защищенный диол;
или
X представляет собой N, и
P1 представляет собой H или защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино;
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя аминаль или 1,3-оксазолидин-2-он-5-ил; и
где промежуточное соединение в получении эрибулина может представлять собой соединение формулы (IIB) или его соль:
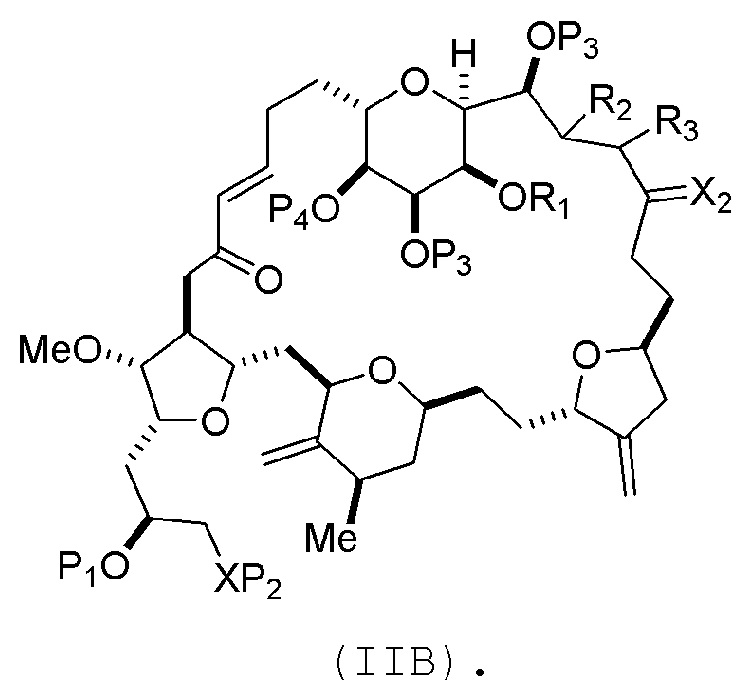
В формуле (IIA), каждый R может представлять собой необязательно замещенный алкил. В формуле (IIA) или (IIB), P1 может представлять защитную группу гидроксила (например, силил). В формуле (IIA) или (IIB), P2 может представлять защитную группу гидроксила (например, силил). В формуле (IIA) или (IIB), обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, можно соединять, образуя кеталь. В формуле (IIA) или (IIB), R1 и R2 могут образовывать связь, и R3 может представлять собой H. В формуле (IIA) или (IIB), P4 может представлять защитную группу гидроксила (например, силил).
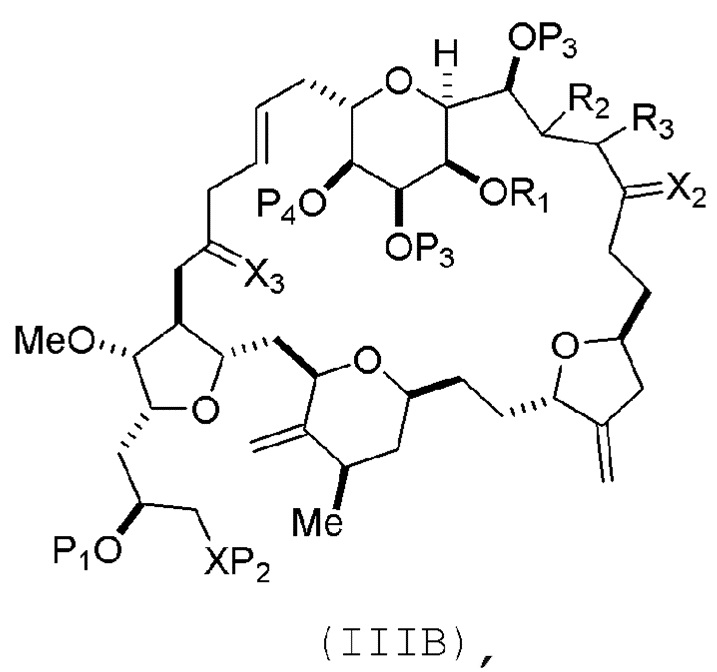
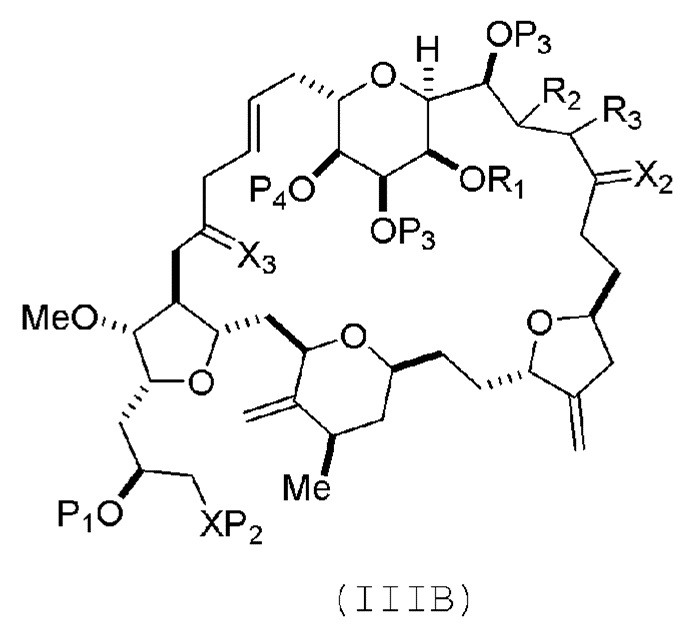
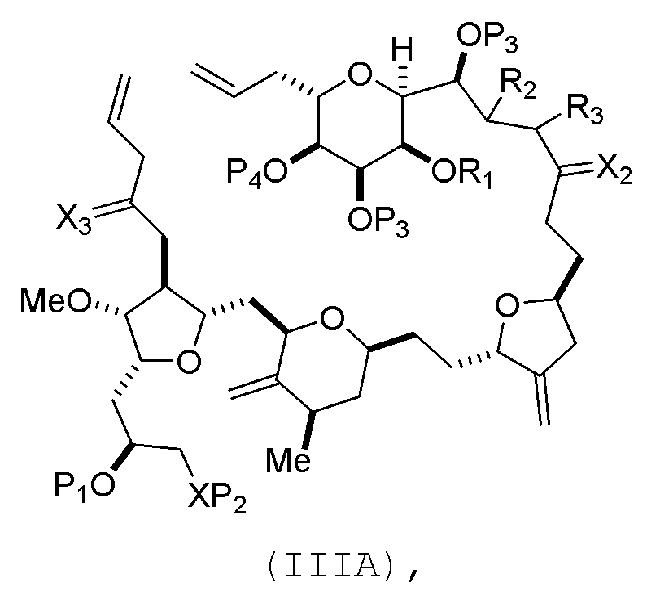
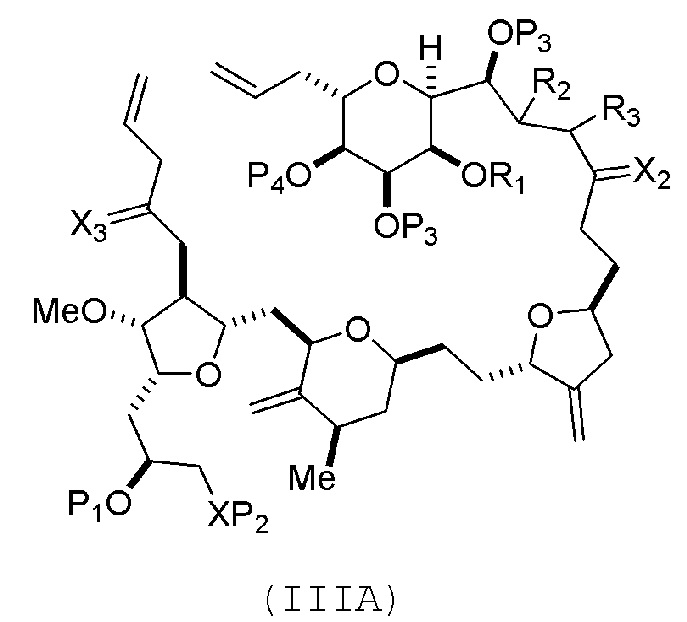
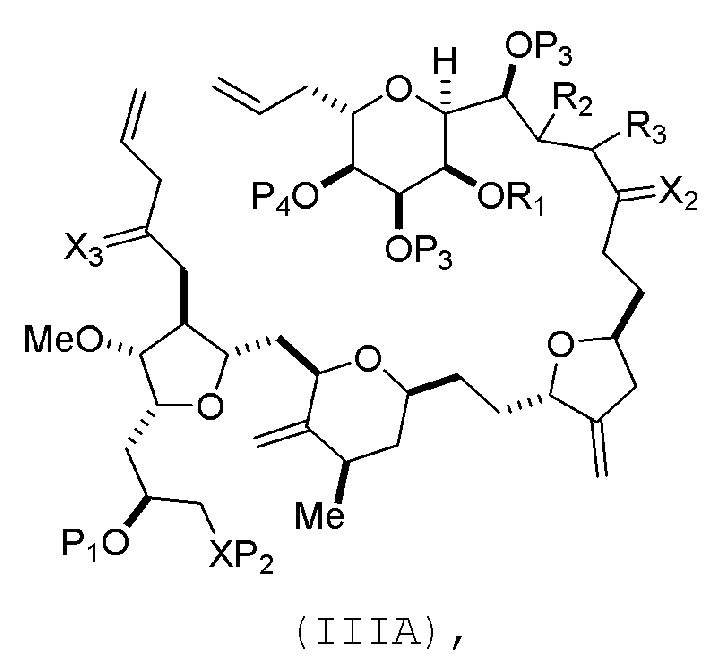
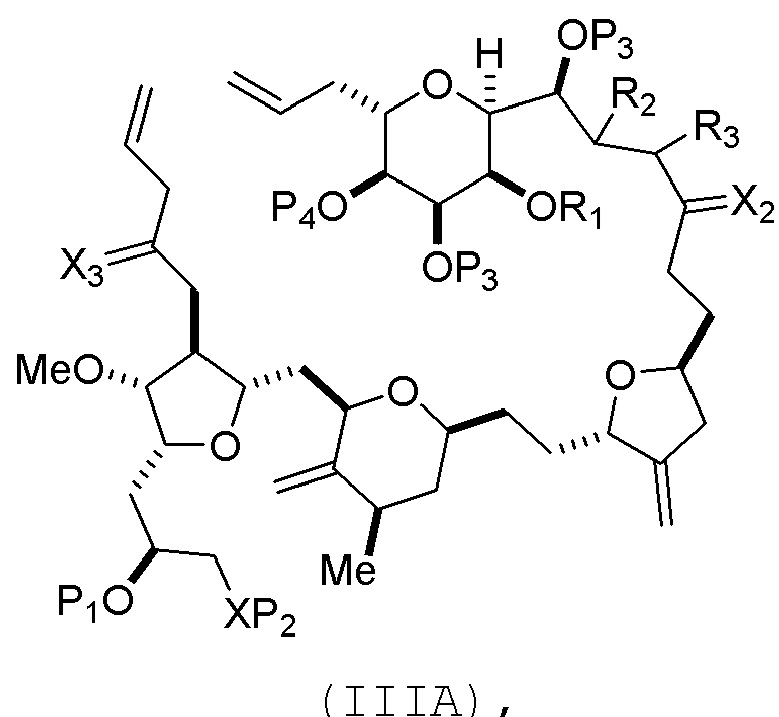
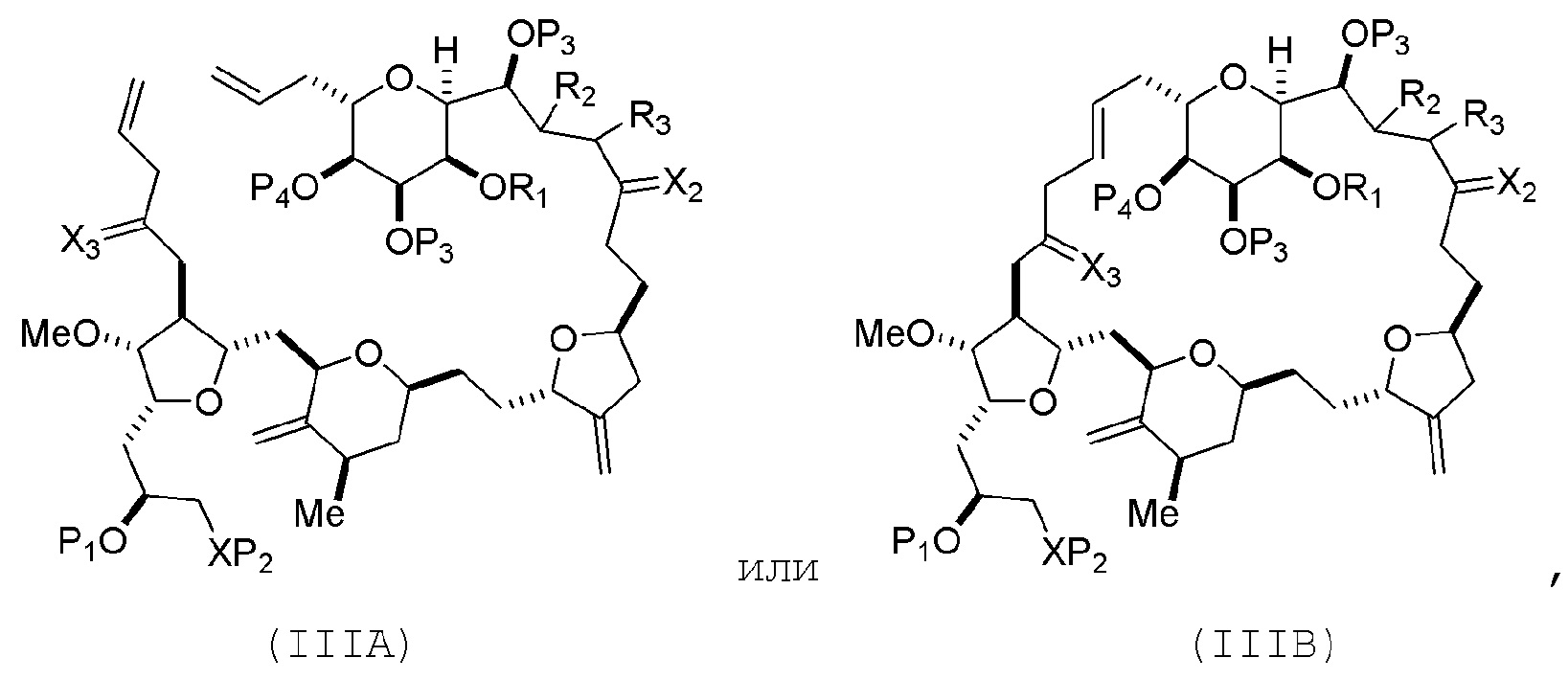
В некоторых вариантах осуществления первого аспекта, проведение реакции макроциклизации включает контакт немакроциклического промежуточного соединения (например, соединения формулы (IIIA)) с катализатором метатезиса олефинов (например, рутений-карбеновым комплексом). Немакроциклическое промежуточное соединение может представлять собой соединение формулы (IIIA) или его соль:
где
(i) R1 представляет собой H или защитную группу гидроксила, и R2 и R3 соединяют, образуя двойную связь;
или
(ii) R1 и R2 соединяют, образуя связь, и R3 представляет собой H;
X3 представляет собой оксо, или X3 комбинируют с атомом углерода, с которым он соединен, образуя кеталь, тиокеталь или -(CH(OP5))-, где P5 представляет собой H или защитную группу гидроксила;
каждый P3 независимо представляет собой H или защитную группу гидроксила, и X2 представляет собой оксо; или обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь;
P4 представляет собой H или защитную группу гидроксила; и
X представляет собой O, и
каждый P1 и P2 независимо представляет собой H или защитную группу гидроксила,
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя циклический защищенный диол;
или
X представляет собой N, и
P1 представляет собой H или защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино;
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя аминаль или 1,3-оксазолидин-2-он-5-ил; и
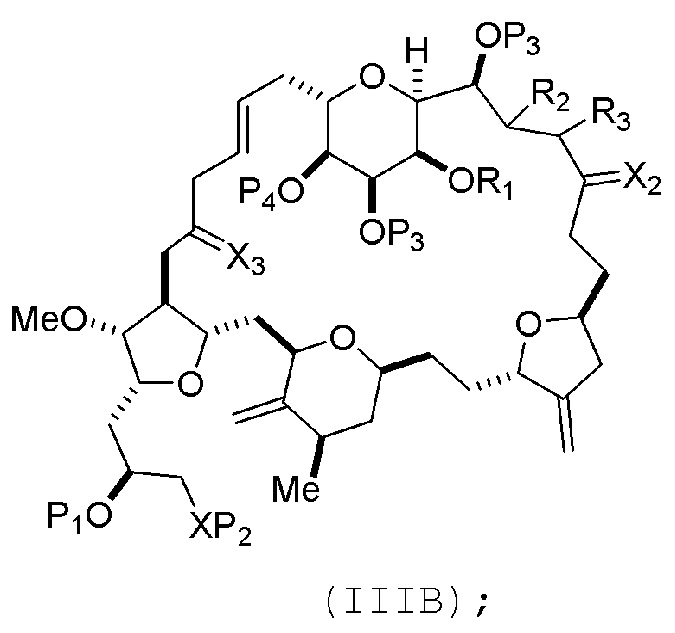
где промежуточное соединение в получении эрибулина может представлять собой соединение формулы (IIIB) или его соль:
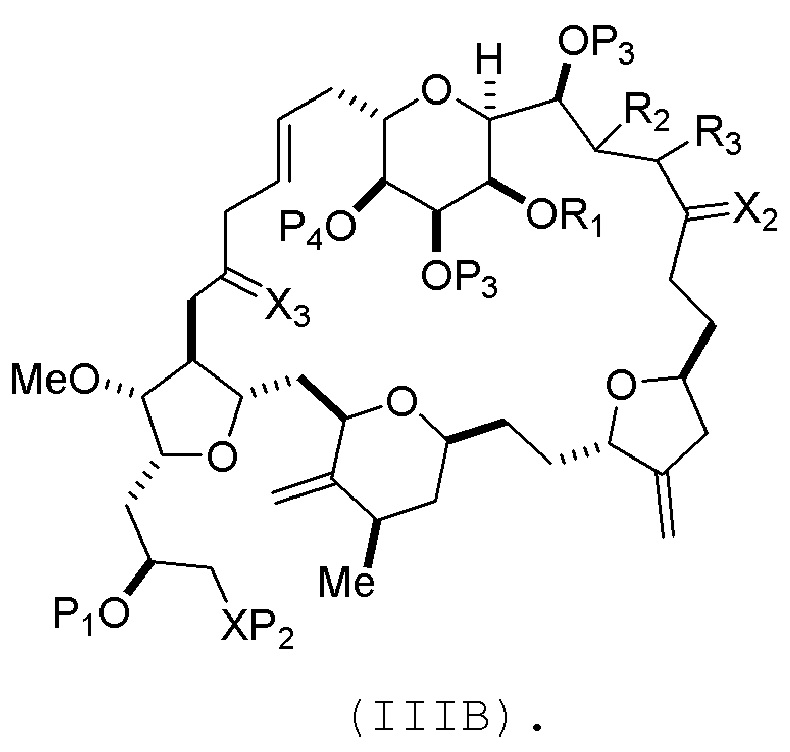
В формуле (IIIA) или (IIIB), P4 может представлять защитную группу гидроксила (например, силил). В формуле (IIIA) или (IIIB), обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, можно соединять, образуя кеталь. В формуле (IIIA) или (IIIB), R1 и R2 могут образовывать связь, и R3 может представлять собой H. В формуле (IIIA) или (IIIB), X3 можно комбинировать с атомом углерода, с которым он соединен, образуя -(CH(OP5))-. В частности, в формуле (IIIA) или (IIIB), P5 может представлять собой H. В формуле (IIIA) или (IIIB), P1 может представлять защитную группу гидроксила (например, силил). В формуле (IIIA) или (IIIB), P2 может представлять защитную группу гидроксила.
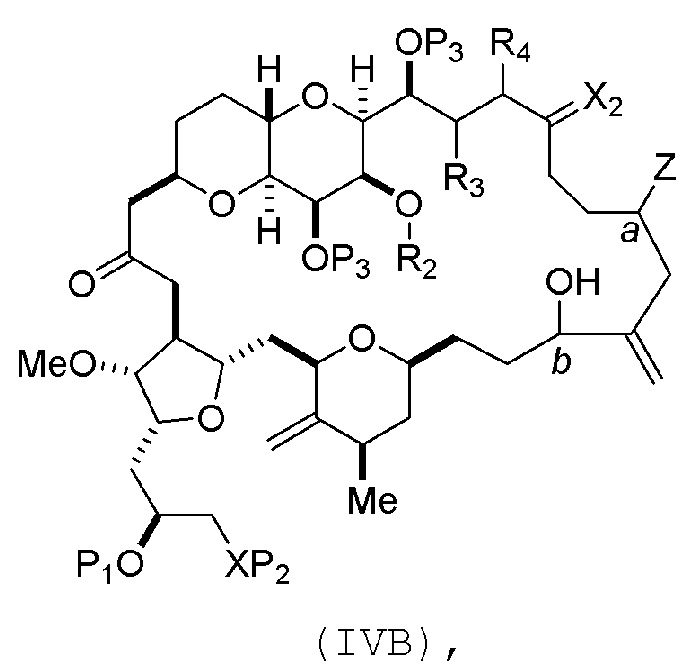
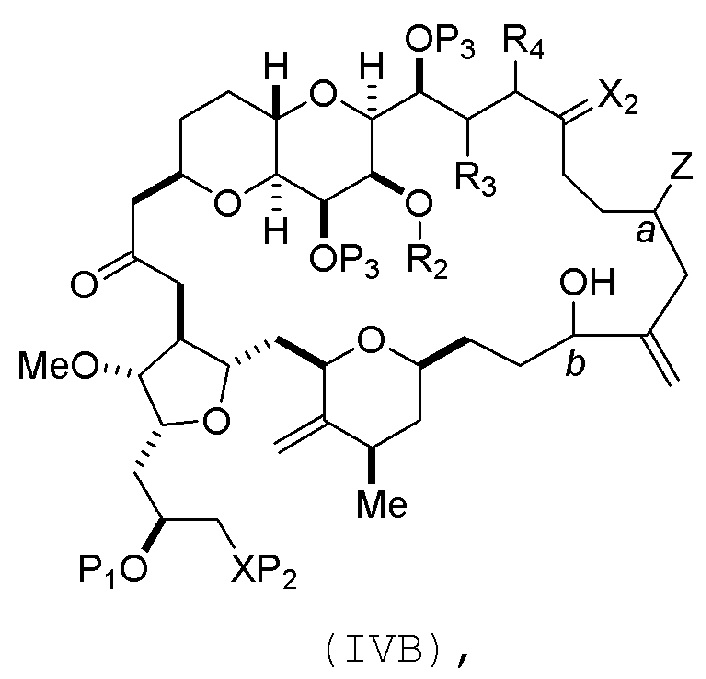
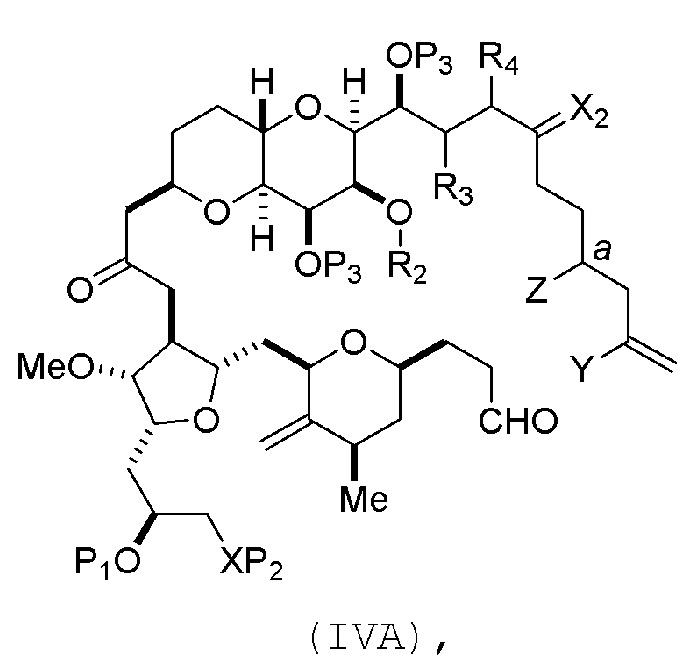
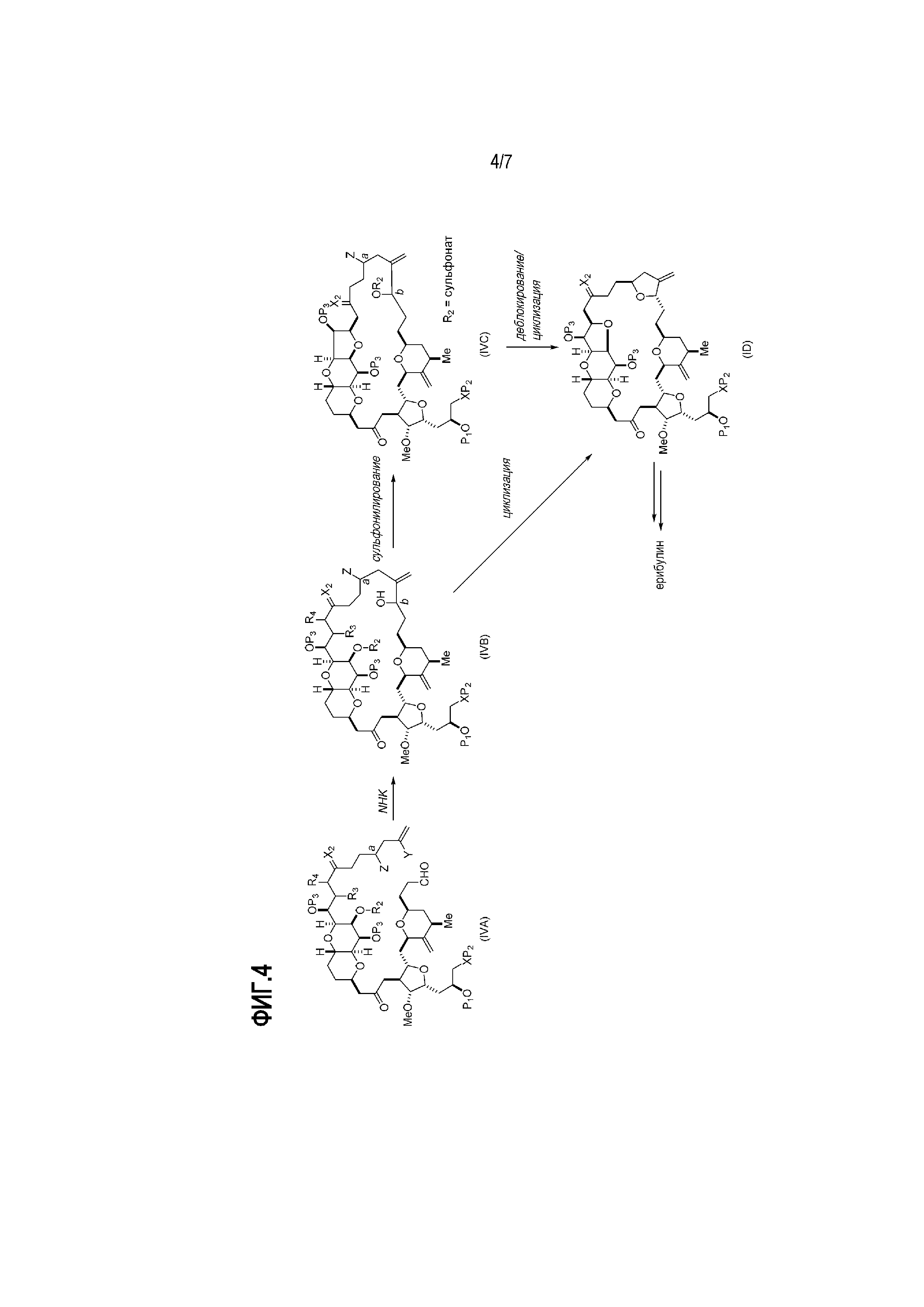
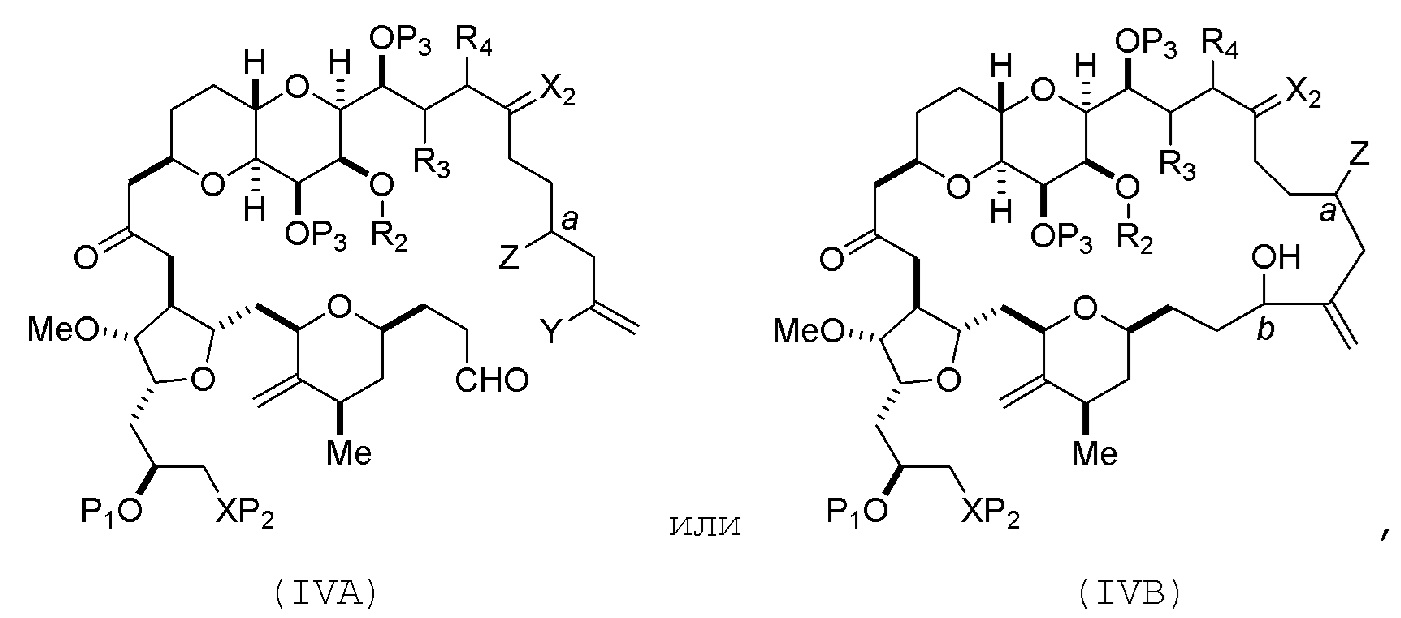
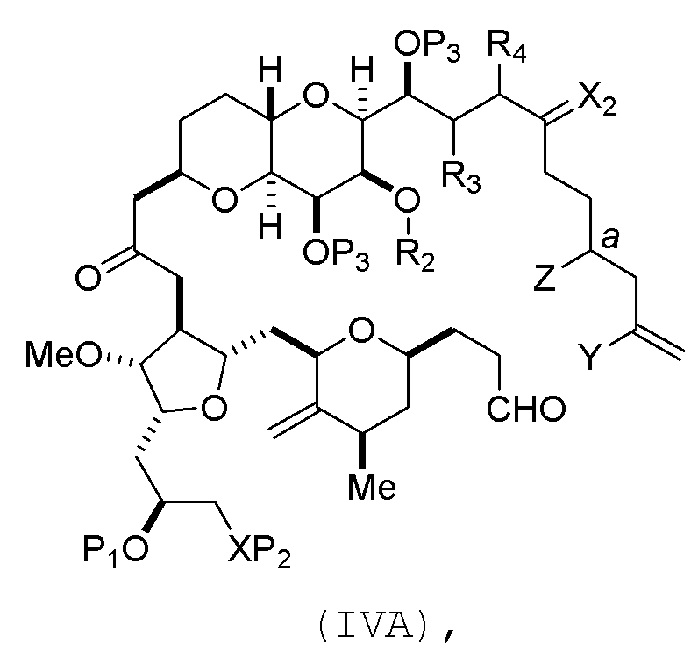
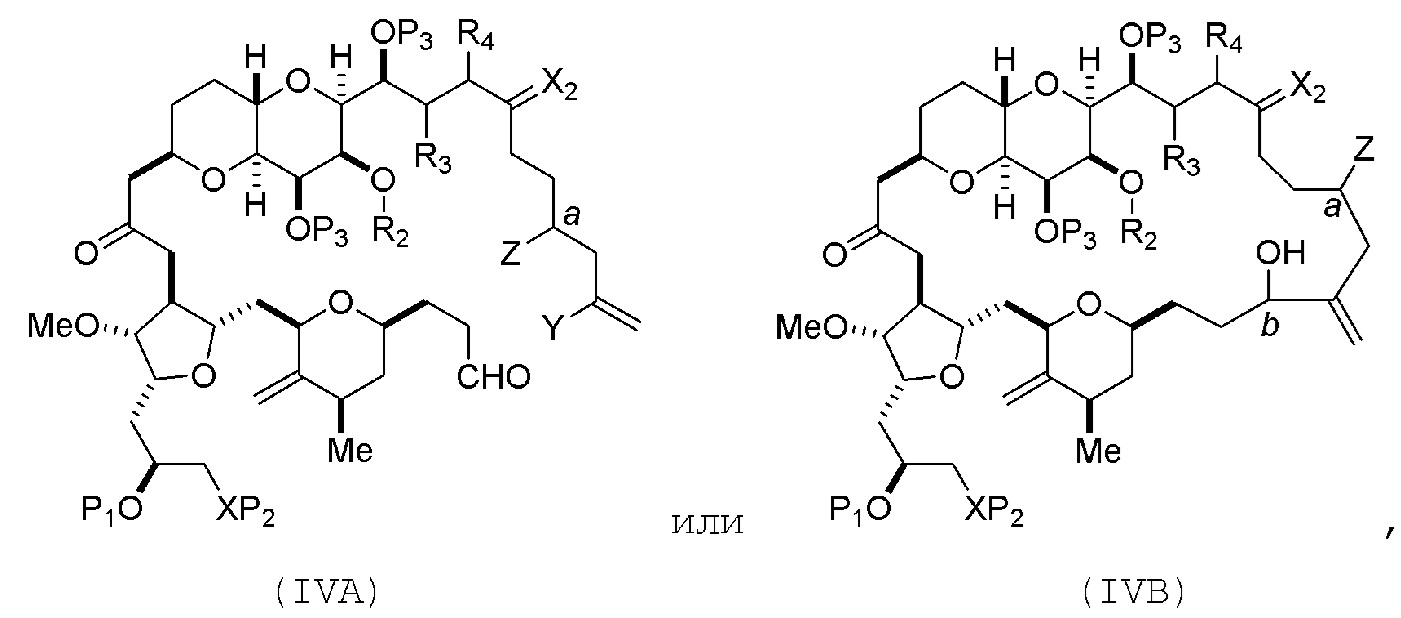
В определенных вариантах осуществления первого аспекта, проведение реакции макроциклизации включает контакт немакроциклического промежуточного соединения (например, соединения формулы (IVA)) с Cr(II) солью и Ni(II) солью. В частности, способ может включать воздействие на соединение формулы (IVA) условий реакции Нозаки-Хияма-Киши. Немакроциклическое промежуточное соединение может представлять собой соединение формулы (IVA) или его соль:
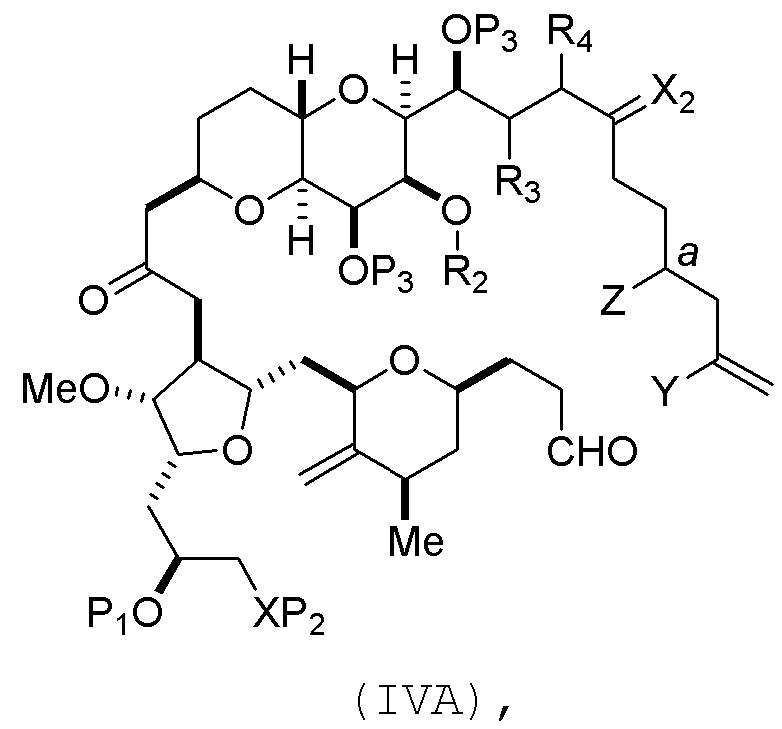
где
Y представляет собой йодид, бромид или трифторметансульфонат;
a может обозначать R стереогенный центр, и Z представляет собой сульфонат, хлорид, бромид или йодид; или a может обозначать S стереогенный центр, и Z представляет собой OR1, где R1 представляет собой защитную группу гидроксила;
(i) R2 представляет собой H или защитную группу гидроксила, и R3 и R4 соединяют, образуя двойную связь;
или
(ii) R2 и R3 соединяют, образуя связь, и R4 представляет собой H;
каждый P3 независимо представляет собой H или защитную группу гидроксила, и X2 представляет собой оксо; или обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь; и
X представляет собой O, и
каждый P1 и P2 независимо представляет собой H или защитную группу гидроксила,
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя циклический защищенный диол;
или
X представляет собой N, и
P1 представляет собой H или защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино;
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя аминаль или 1,3-оксазолидин-2-он-5-ил; и
где промежуточное соединение в получении эрибулина может представлять собой соединение формулы (IVB) или его соль:
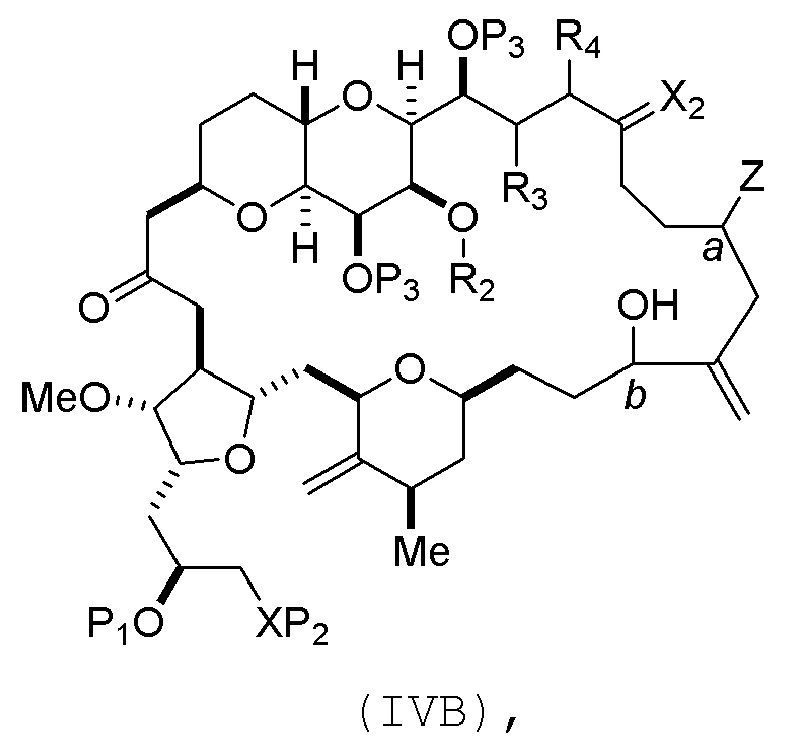
где
a обозначает R стереогенный центр, b обозначает S стереогенный центр, и Z представляет собой сульфонат, хлорид, бромид или йодид;
или
a обозначает S стереогенный центр, b обозначает R стереогенный центр, и Z представляет собой OR1, где R1 представляет собой защитную группу гидроксила.
В формуле (IVA) или (IVB), Y может представлять собой бромид. В формуле (IVA) или (IVB), R2 и R3 можно соединять, образуя связь, и R4 может представлять собой H. В формуле (IVA) или (IVB), обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, можно соединять, образуя кеталь. В формуле (IVA) или (IVB), P1 может представлять защитную группу гидроксила (например, силил). В формуле (IVA) или (IVB), P2 может представлять защитную группу гидроксила (например, силил). В формуле (IVA) или (IVB), Z может представлять собой сульфонат. В формуле (IVA) или (IVB), Z может представлять собой OR1, где R1 может представлять защитную группу гидроксила (например, Z может представлять собой эфир, карбонат или карбамат (например, Z может представлять собой эфир)).
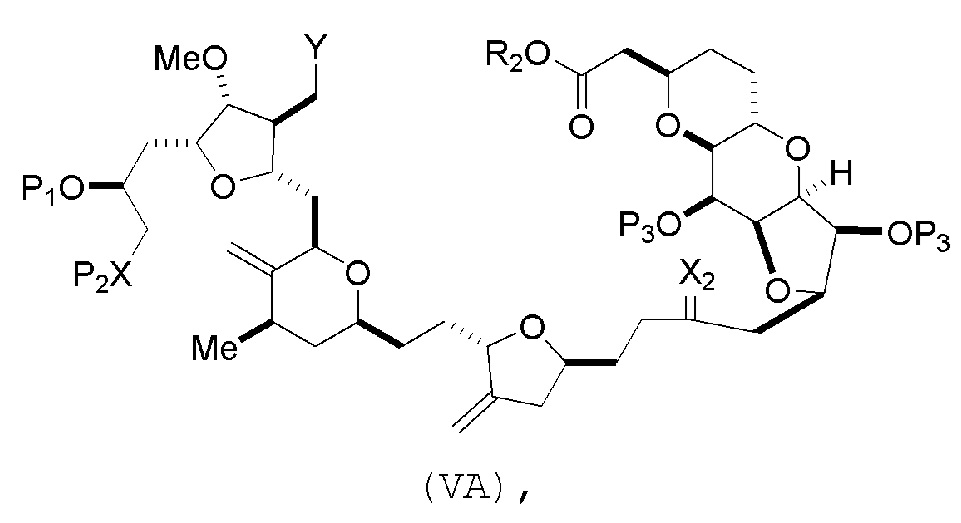
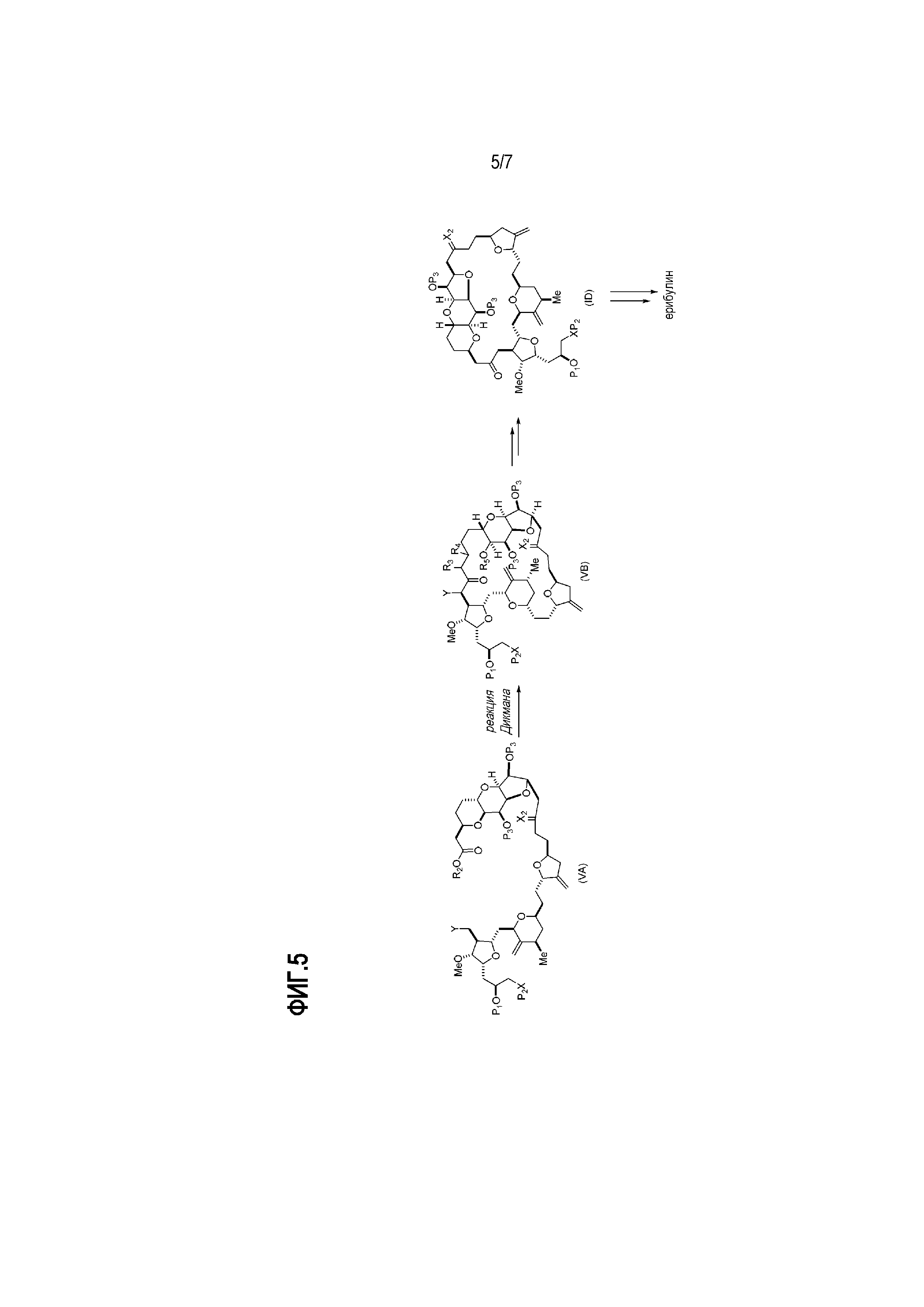
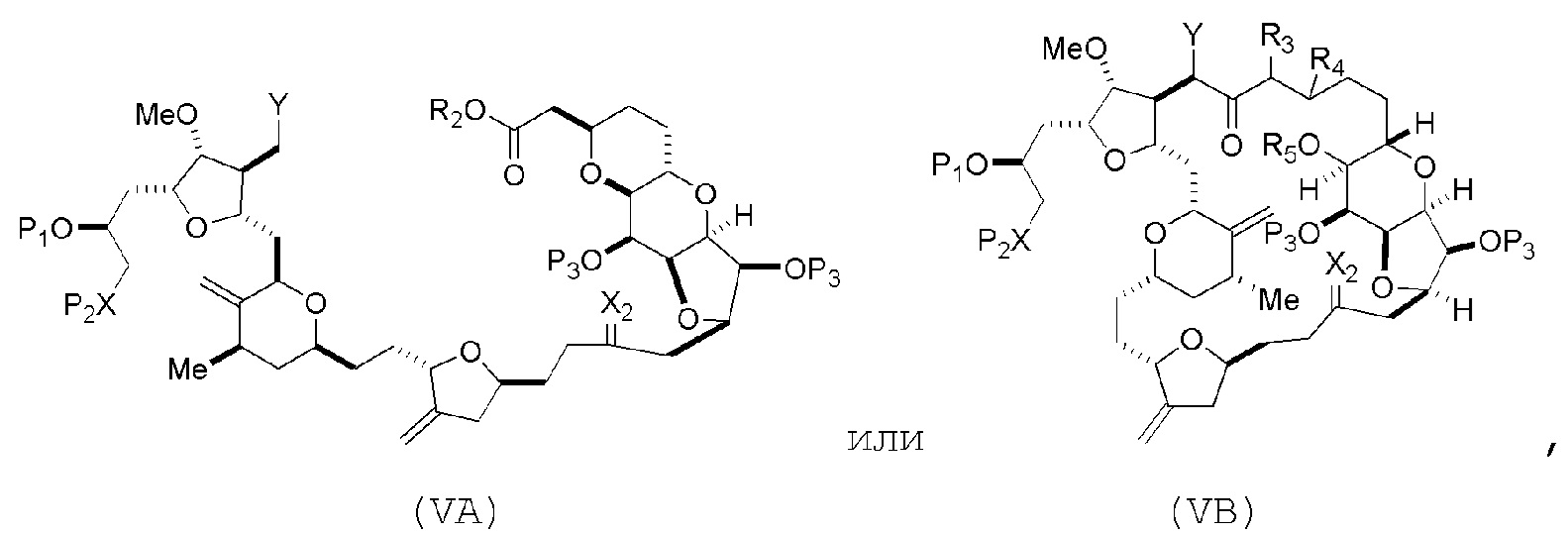
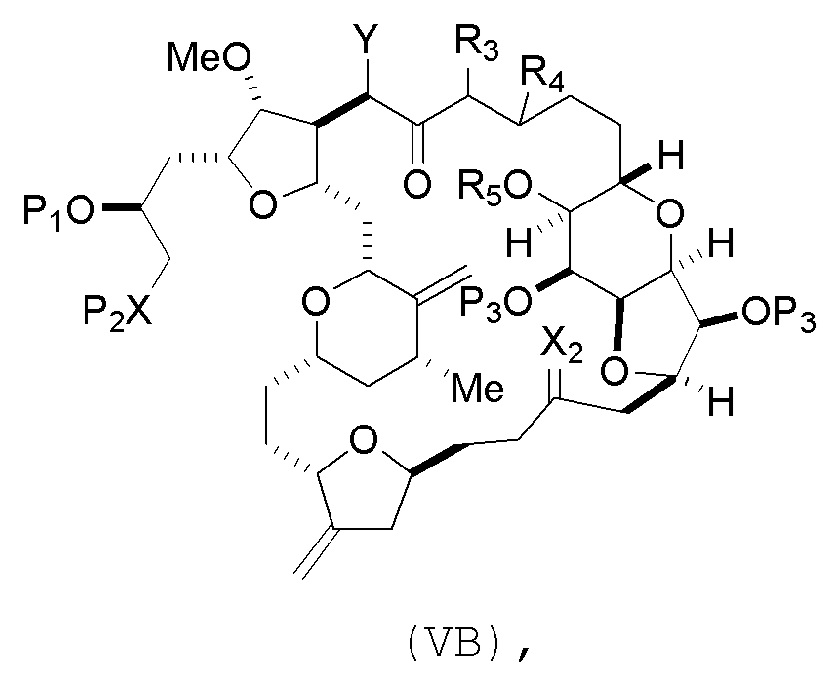
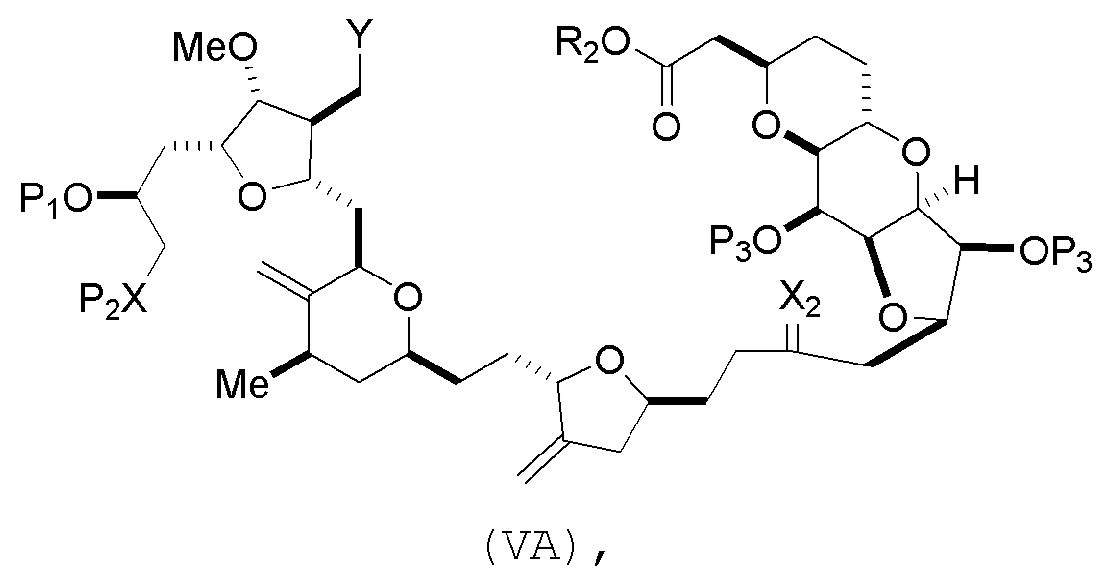
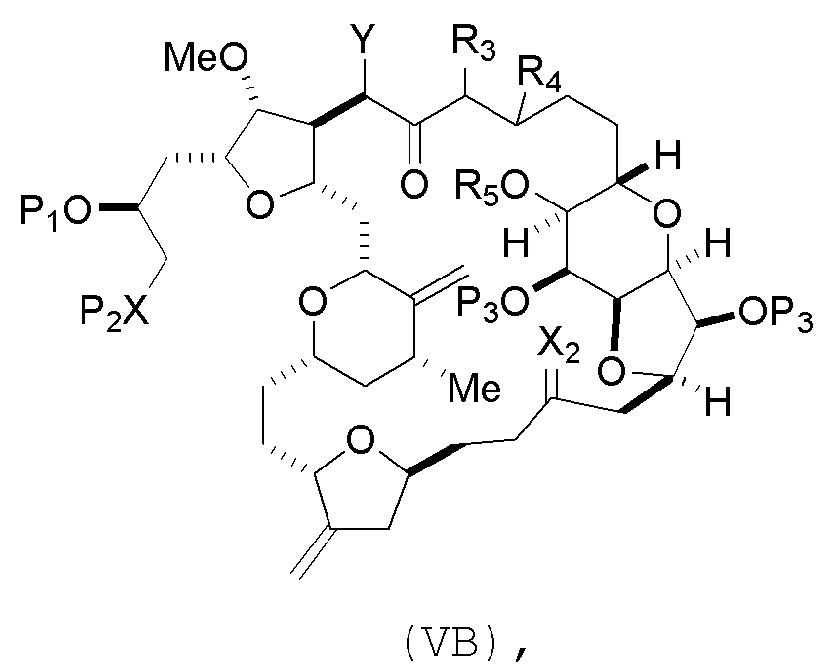
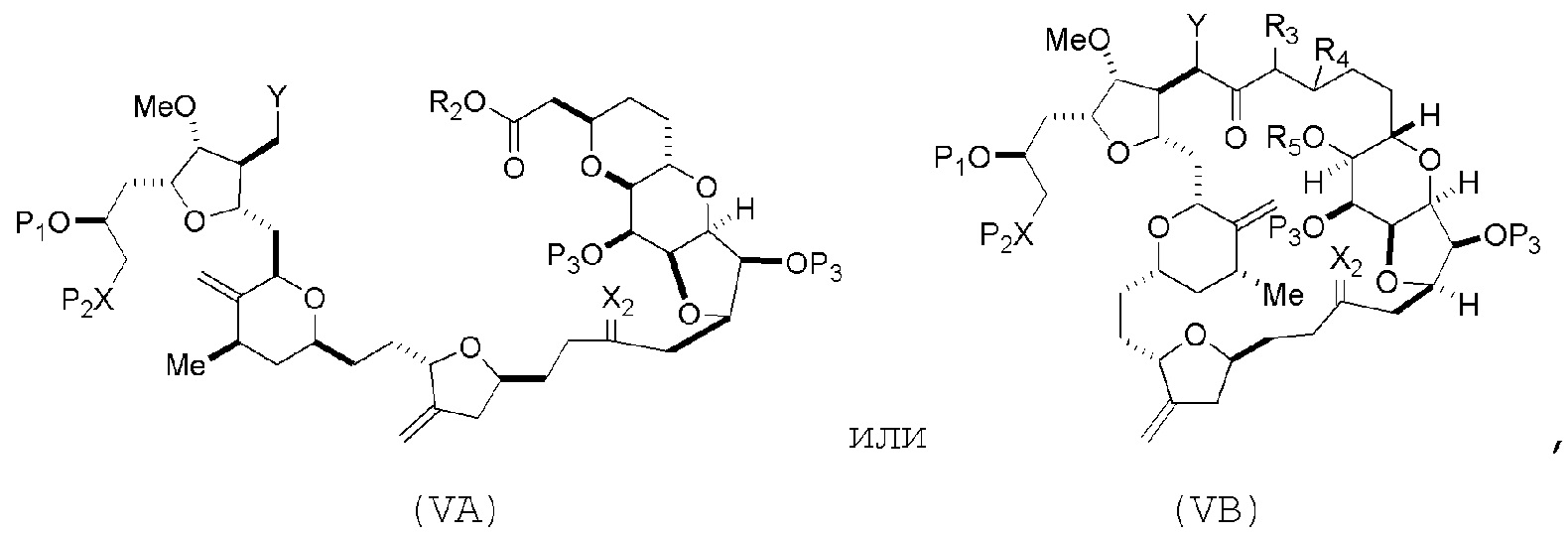
В некоторых вариантах осуществления первого аспекта, проведение реакции макроциклизации включает контакт немакроциклического промежуточного соединения (например, соединения формулы (VA)) с основанием (например, третичным C4-6 алкоксидом (например, щелочным третичным C4-6 алкоксидом)). В частности, способ может включать воздействие на соединение формулы (VA) условий реакции Дикмана. Немакроциклическое промежуточное соединение может представлять собой соединение формулы (VA) или его соль:
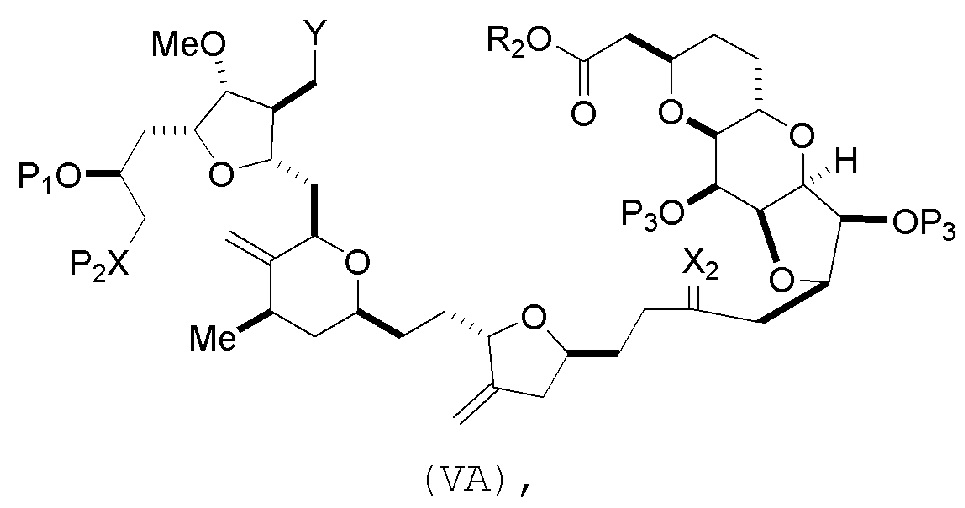
где
Y представляет собой SO2R1 или COOR1, где, когда Y представляет собой SO2R1, R1 представляет собой необязательно замещенный арил или необязательно замещенный неенолизируемый алкил, и когда Y представляет собой COOR1, R1 представляет собой необязательно замещенный алкил, необязательно замещенный арил или необязательно замещенный арилалкил;
каждый P3 независимо представляет собой H или защитную группу гидроксила, и X2 представляет собой оксо, или обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь;
R2 представляет собой необязательно замещенный алкил, необязательно замещенный арилалкил или необязательно замещенный арил; и
X представляет собой O, и
каждый P1 и P2 независимо представляет собой защитную группу гидроксила,
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя циклический защищенный диол;
или
X представляет собой N, и
P1 представляет собой H или защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино;
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя аминаль или 1,3-оксазолидин-2-он-5-ил; и
где промежуточное соединение в получении эрибулина может представлять собой соединение формулы (VB) или его соль:
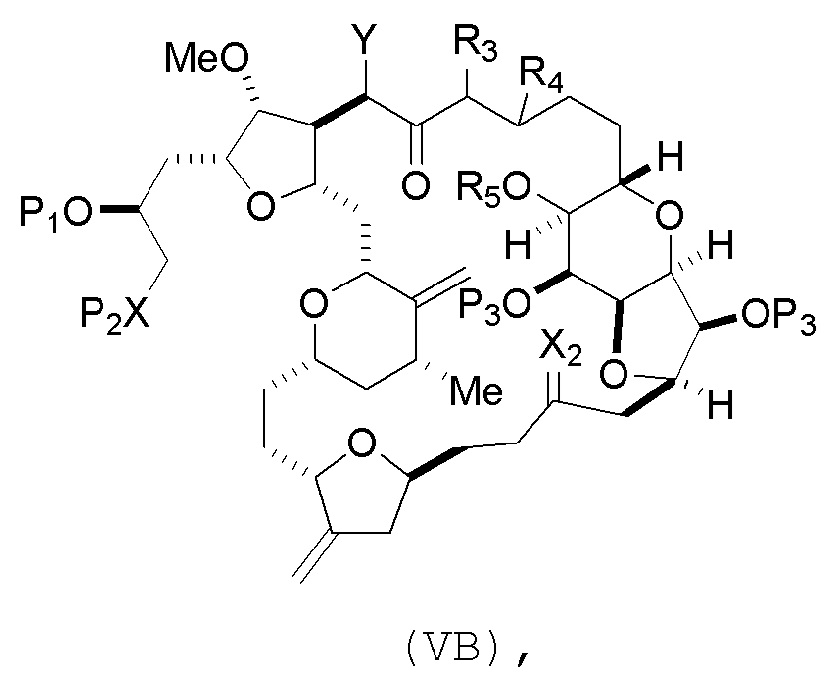
где
(i) R3 представляет собой H, R4 представляет собой необязательно замещенный C1-6 алкиловый эфир, и R5 представляет собой H;
(ii) R5 представляет собой H, и R3 и R4 соединяют, образуя двойную связь;
или
(iii) R3 представляет собой H, и R4 и R5 соединяют, образуя связь.
В формуле (VA) или (VB), Y может представлять собой SO2R1 (например, R1 может представлять собой необязательно замещенный арил). В формуле (VA) или (VB), обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, можно соединять, образуя кеталь. В формуле (VA) или (VB), R2 может представлять собой необязательно замещенный алкил (например, незамещенный C1-6 алкил). В формуле (VA) или (VB), R3 может представлять собой H, и R4 и R5 можно соединять, образуя связь.
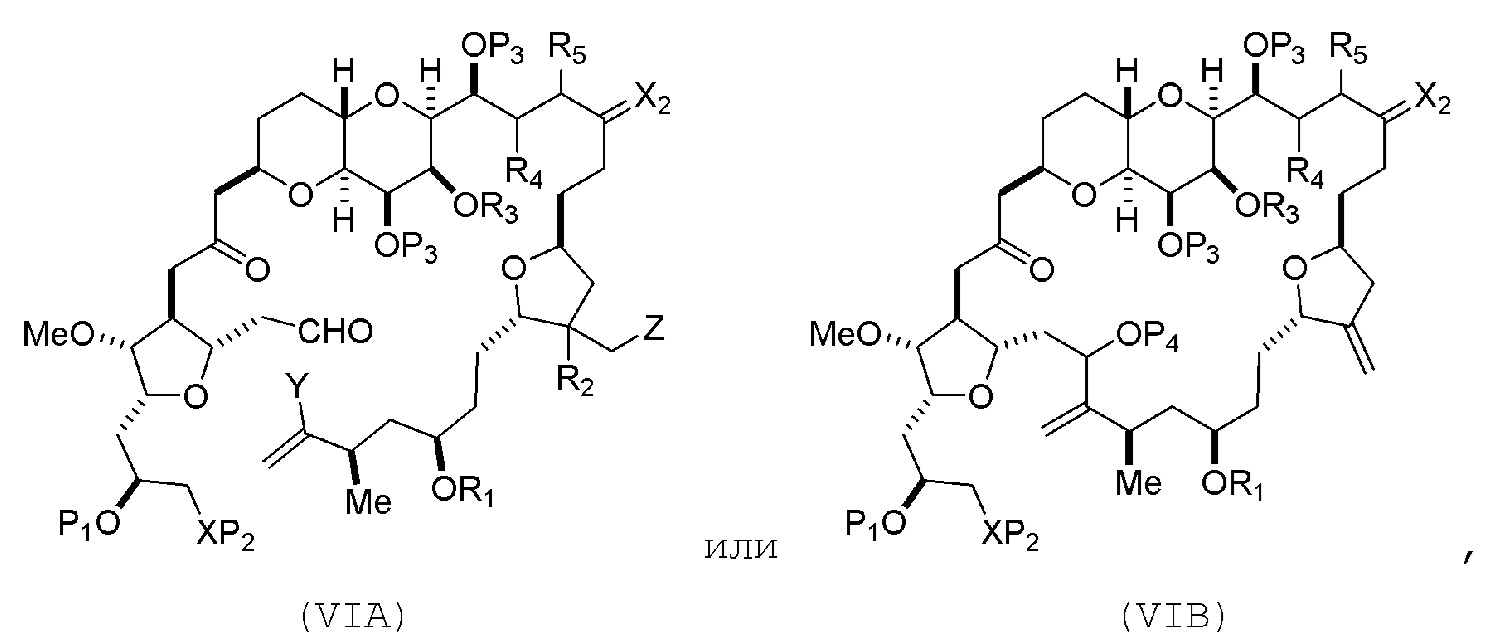
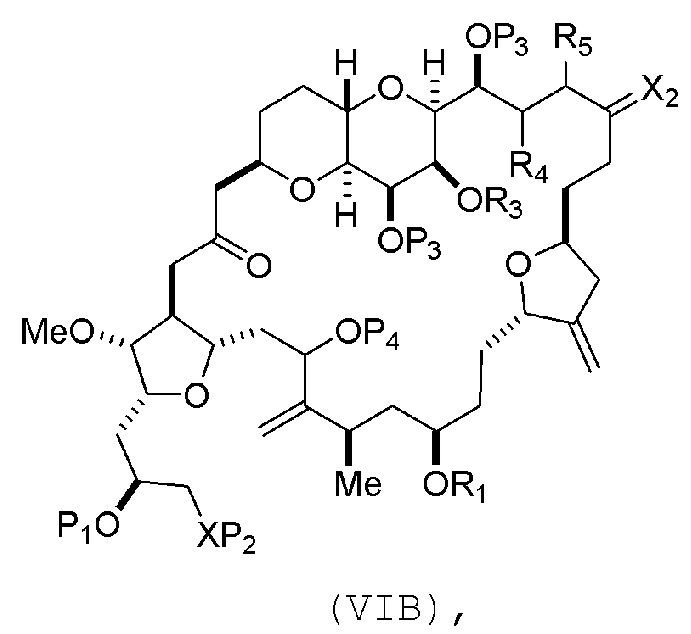
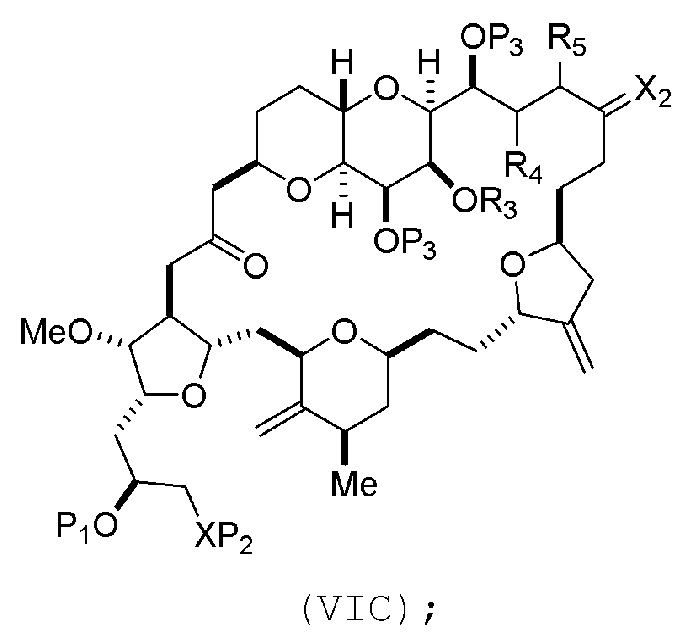
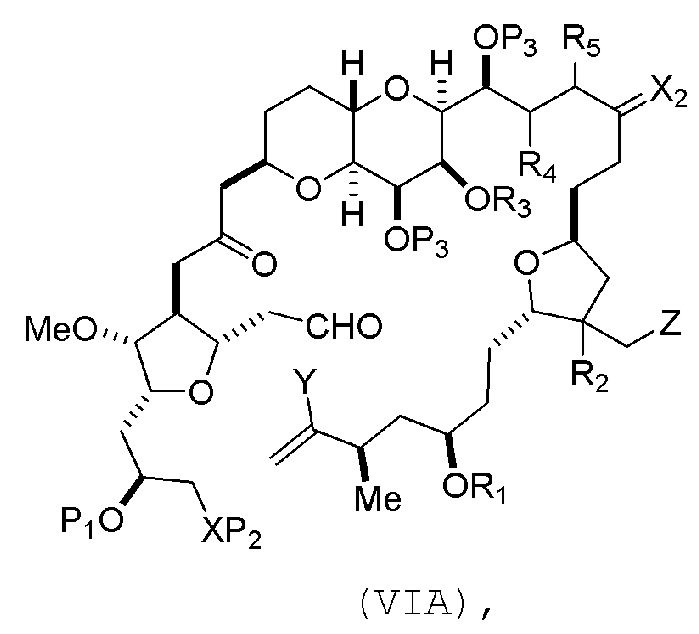
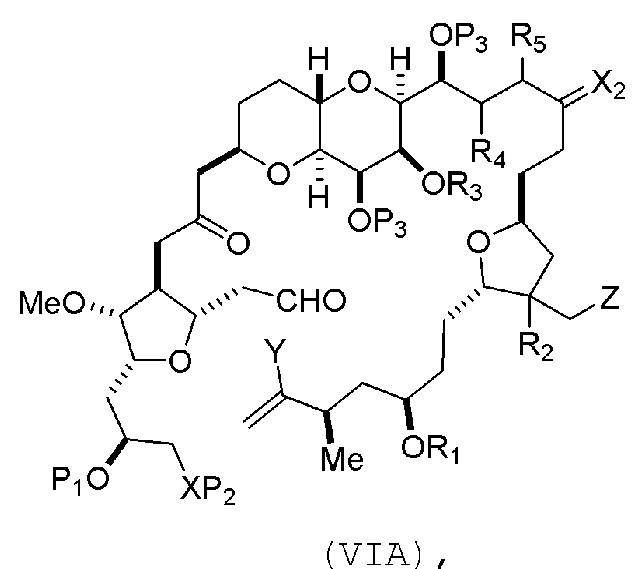
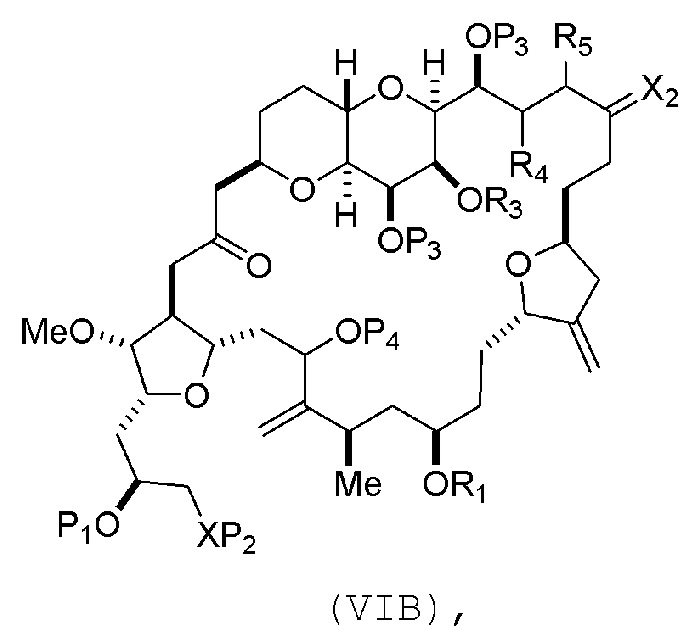
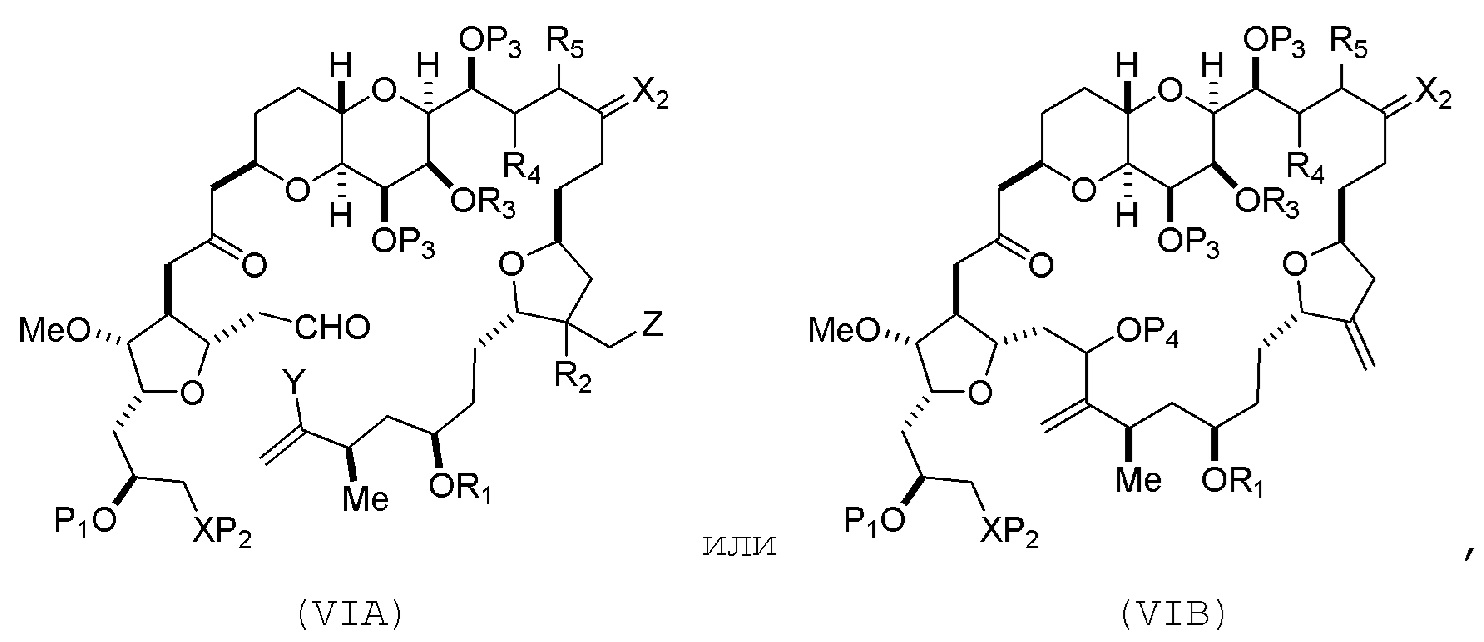
В других вариантах осуществления первого аспекта, проведение реакции макроциклизации включает контакт немакроциклического промежуточного соединения (например, соединения формулы (VIA)) с Cr(II) солью и Ni(II) солью. В частности, способ может включать воздействие на соединение формулы (VIA) условий реакции Нозаки-Хияма-Киши. Немакроциклическое промежуточное соединение может представлять собой соединение формулы (VIA) или его соль:
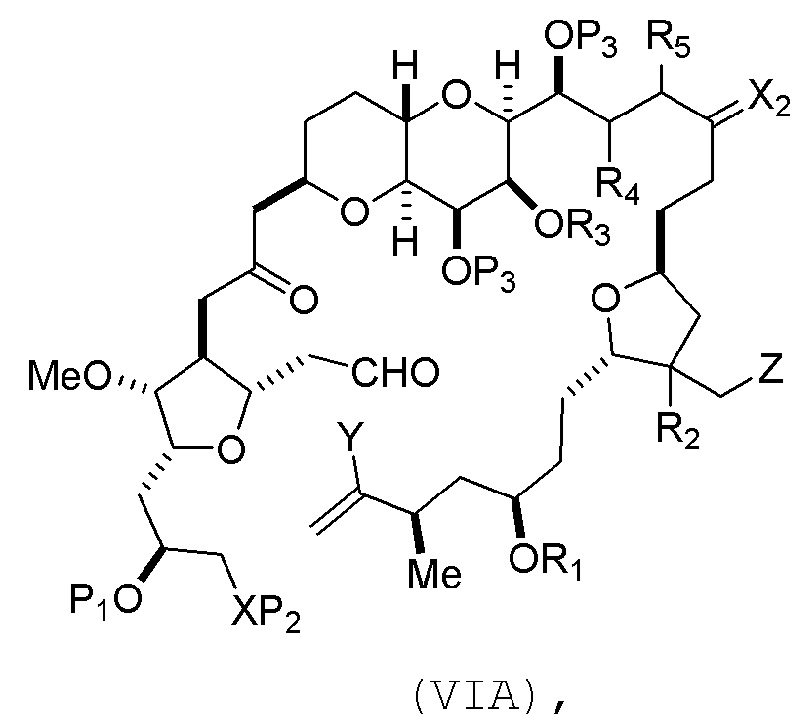
где
Y представляет собой йодид, бромид или трифторметансульфонат;
(a1) R3 представляет собой H или защитную группу гидроксила, R4 и R5 соединяют, образуя двойную связь, каждый P3 независимо представляет собой H или защитную группу гидроксила, и X2, вместе с атомом углерода, с которым он соединен, образует карбонил или -(CH(OR6))-, где R6 представляет собой H или защитную группу гидроксила;
или
(a2) R3 и R4 соединяют, образуя связь, R5 представляет собой H, и
каждый P3 независимо представляет собой H или защитную группу гидроксила, и X2, вместе с атомом углерода, с которым он соединен, образует карбонил или -(CH(OR6))-;
или
обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь;
(b1) Z представляет собой хлорид, бромид или йодид, и R1 и R2 соединяют, образуя связь;
или
(b2) Z и R2 соединяют, образуя двойную связь, и R1 представляет собой защитную группу гидроксила;
и
X представляет собой O, и
каждый P1 и P2 независимо представляет собой H или защитную группу гидроксила,
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя циклический защищенный диол;
или
X представляет собой N, и
P1 представляет собой H или защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино;
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя аминаль или 1,3-оксазолидин-2-он-5-ил; и
где промежуточное соединение в получении эрибулина представляет собой соединение формулы (VIB) или его соль:
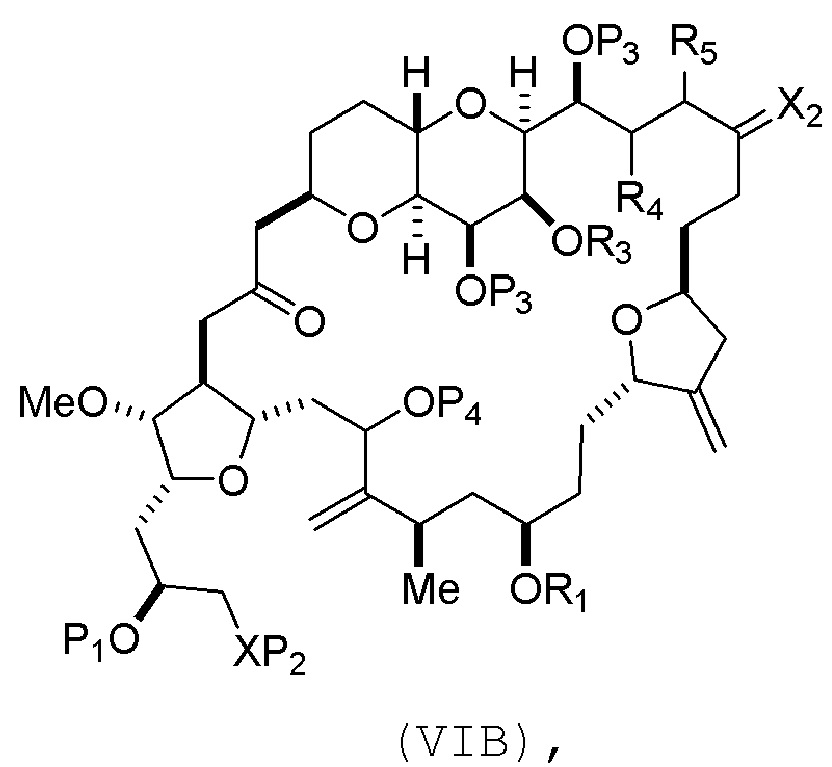
где P4 представляет собой H или защитную группу гидроксила.
В формуле (VIA), Z может представлять собой йодид, и R1 и R2 можно соединять, образуя связь. В формуле (VIA), Y может представлять собой трифторметансульфонат. В формуле (VIA) или (VIB), R1 может представлять собой H, или O и R1 можно соединять, образуя сульфонат. В формуле (VIA) или (VIB), P1 может представлять защитную группу гидроксила (например, силил). В формуле (VIA) или (VIB), P2 может представлять защитную группу гидроксила (например, силил). В формуле (VIA) или (VIB), R3 может представлять собой H или защитную группу гидроксила, R4 и R5 можно соединять, образуя двойную связь, каждый P3 может независимо представлять собой H или защитную группу гидроксила, и X2, вместе с атомом углерода, с которым он соединен, может образовывать карбонил или -(CH(OR6))-, где R6 может представлять собой H или защитную группу гидроксила. В формуле (VIA) или (VIB), R3 может представлять защитную группу гидроксила (например, силил), R4 и R5 можно соединять, образуя двойную связь, каждый P3 может независимо представлять собой защитную группу гидроксила, и X2, вместе с атомом углерода, с которым он соединен, могут образовывать карбонил или -(CH(OR6))-, где R6 может представлять собой H или защитную группу гидроксила (например, O можно соединять с R6, образуя эфир). В формуле (VIB), P4 может представлять защитную группу гидроксила (например, O и P4 можно соединять, образуя эфир).
Получение соединения формулы (VIB) из соединения формулы (VIA) может дополнительно включать
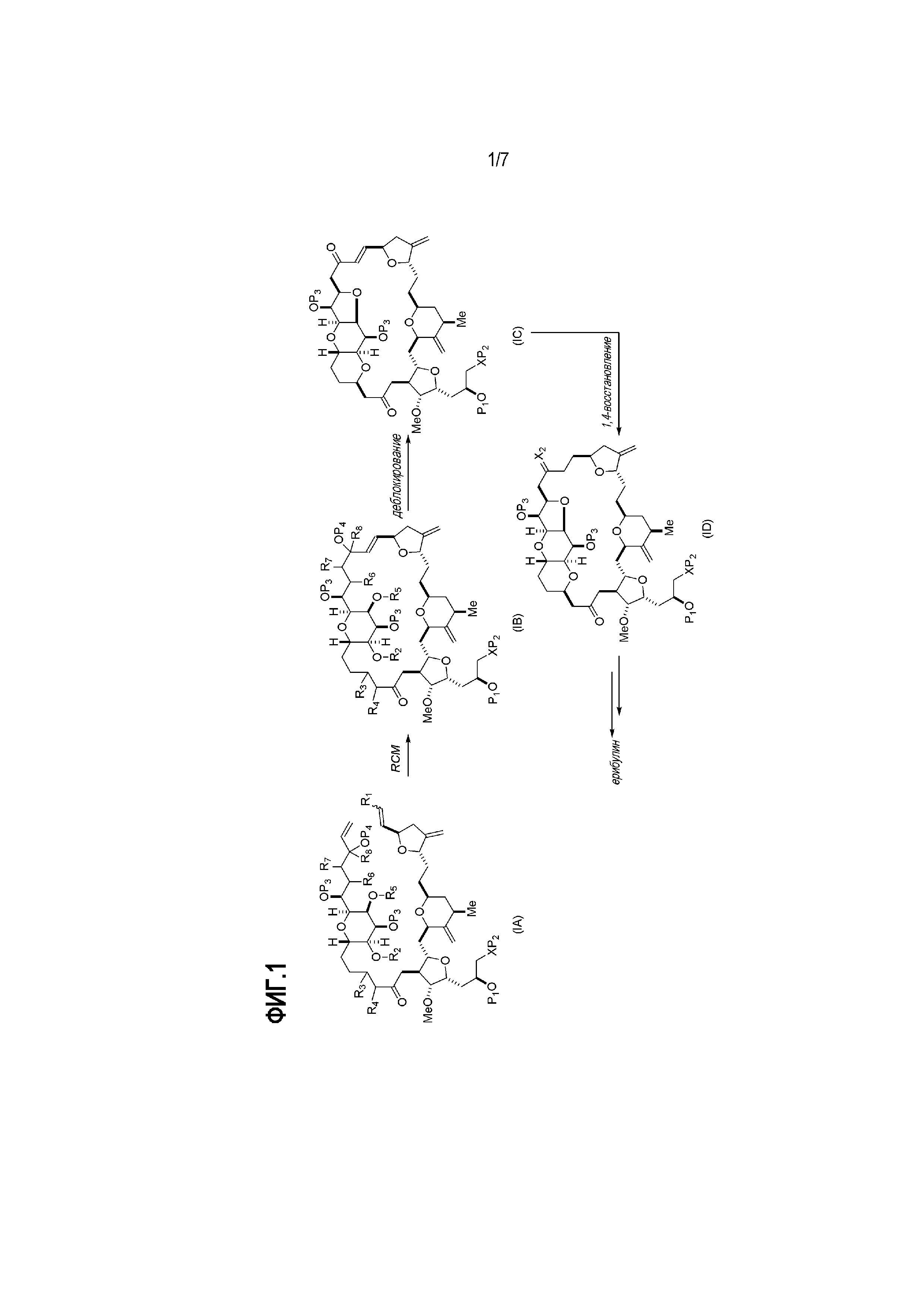
Во втором аспекте, настоящее изобретение относится к способу получения:
В некоторых вариантах осуществления второго аспекта, способ включает:
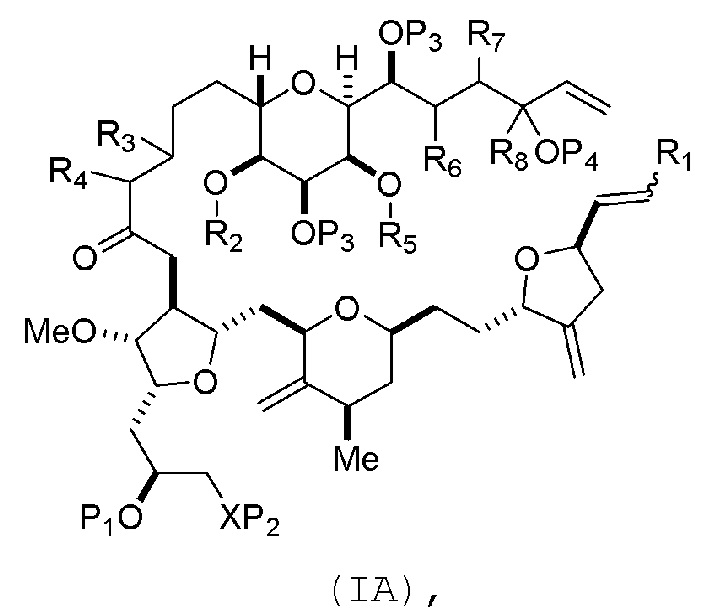
(A) получение соединения формулы (IB) из соединения формулы (IA), причем соединение формулы (IA) имеет следующую структуру:
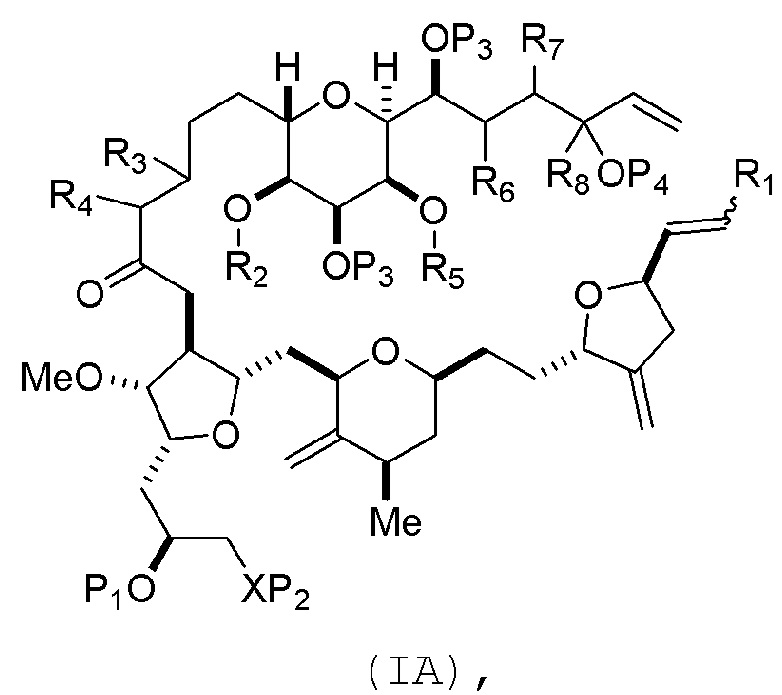
где
R1 представляет собой H или -CH2X1CH2CH=CH2, где X1 представляет собой O, -C(R9)2- или NP5, и где каждый R9 независимо представляет собой H или -COOR10, P5 представляет собой N-защитную группу, и R10 представляет собой C1-6 алкил;
(a1) R2 представляет собой H или защитную группу гидроксила, R3 представляет собой C1-6 алкиловый эфир, и R4 представляет собой H;
(a2) R2 представляет собой H или защитную группу гидроксила, и R3 и R4 соединяют, образуя двойную связь;
или
(a3) R2 и R3 соединяют, образуя связь, и R4 представляет собой H;
(b1) R5 представляет собой H или защитную группу гидроксила, и R6 и R7 соединяют, образуя двойную связь;
или
(b2) R5 и R6 соединяют, образуя связь, и R7 представляет собой H;
(c1) R8 представляет собой H, и P4 представляет собой H или защитную группу гидроксила;
или
(c2) R8 и P4 соединяют, образуя двойную связь;
каждый P3 независимо представляет собой H или защитную группу гидроксила; и
X представляет собой O, и
каждый P1 и P2 независимо представляет собой H или защитную группу гидроксила,
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя циклический защищенный диол;
или
X представляет собой N, и
P1 представляет собой H или защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино;
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя аминаль или 1,3-оксазолидин-2-он-5-ил;
соединение формулы (IB) имеет следующую структуру:
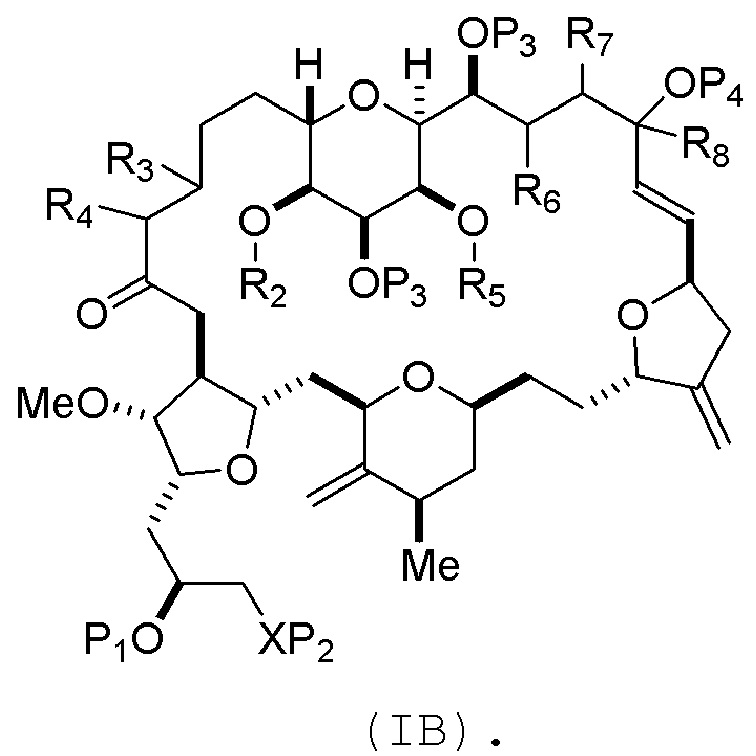
где каждая переменная представляет собой, как определено для формулы (IA).
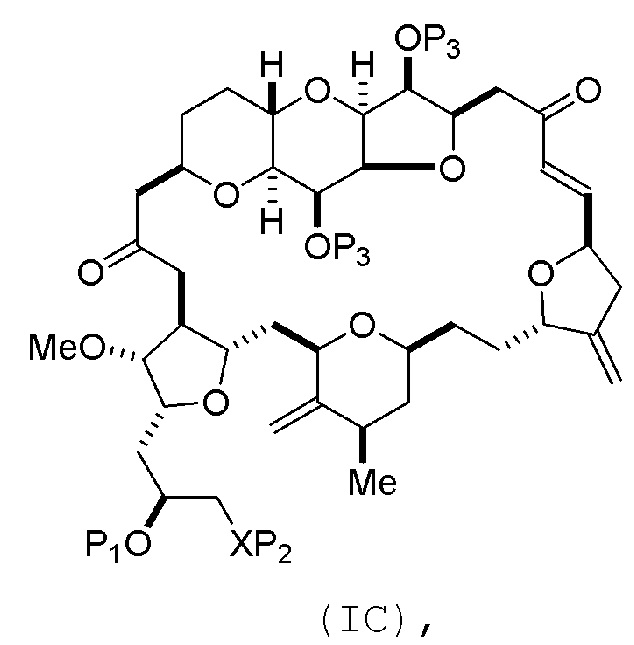
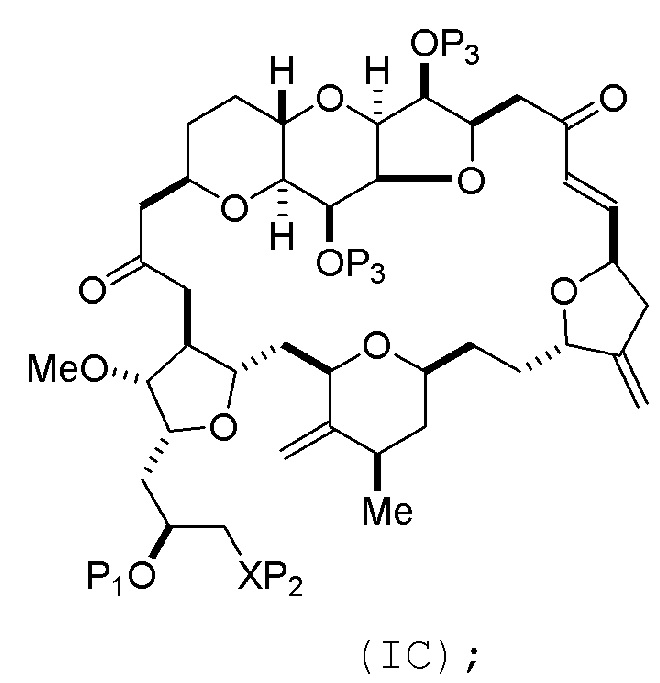
Способ может включать (B) получение соединения формулы (IC) из соединения формулы (IB), причем соединение формулы (IC) имеет следующую структуру:
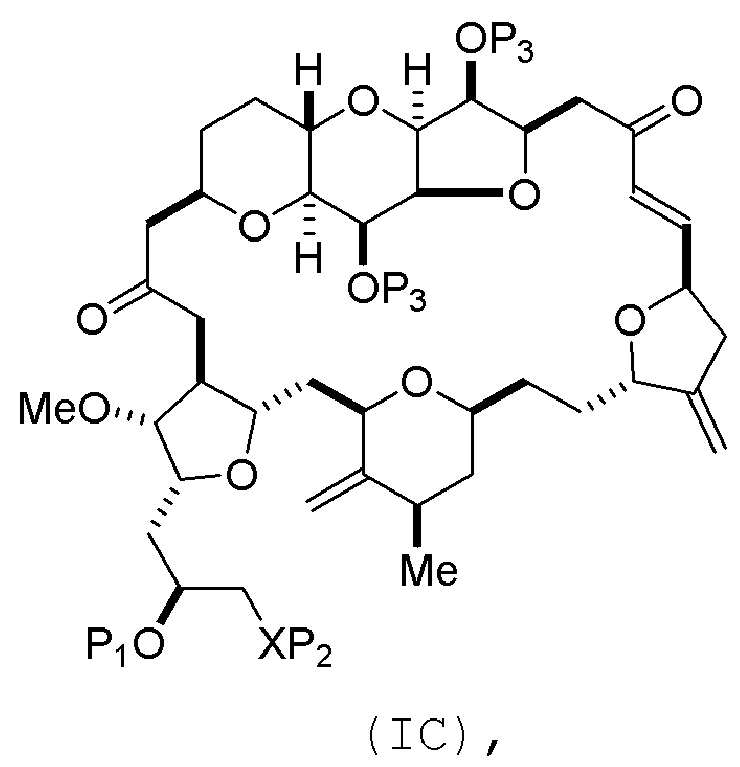
где каждая переменная может представлять собой, как определено для формулы (IB).
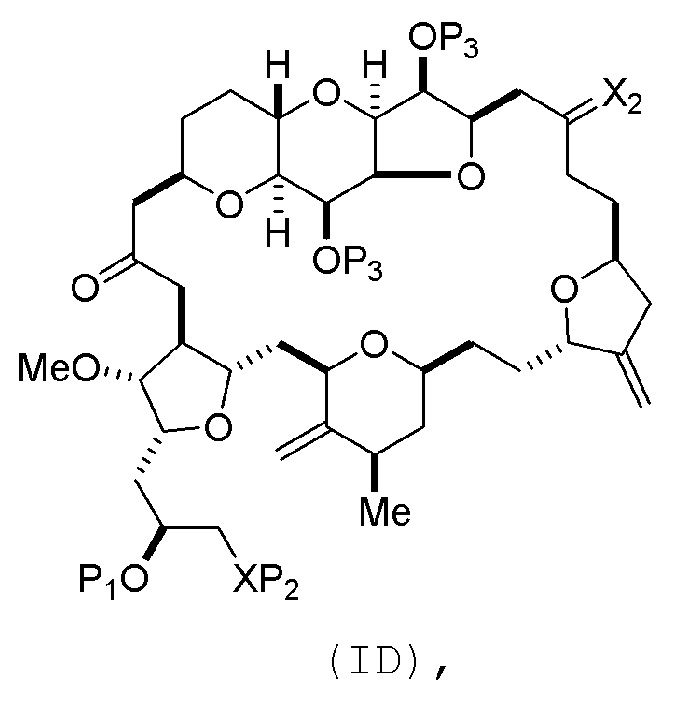
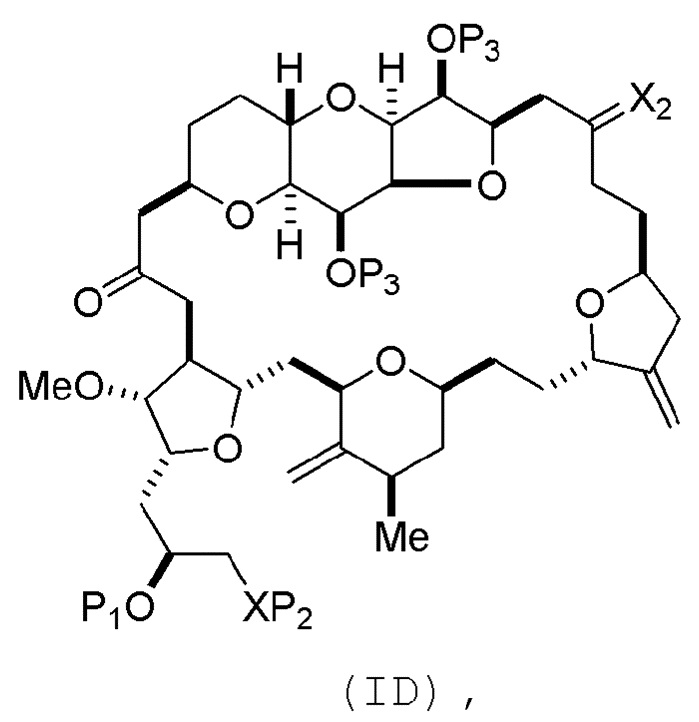
Способ может включать (C) получение соединения формулы (ID) из соединения формулы (IC), причем соединение формулы (ID) имеет следующую структуру:
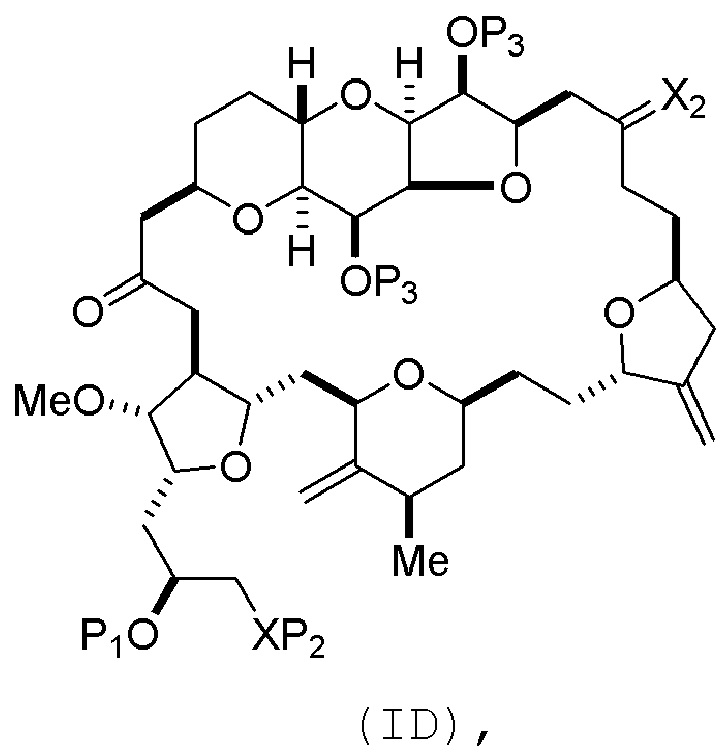
где каждый P3 независимо представляет собой H или защитную группу гидроксила, и X2 представляет собой оксо; или обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь; и каждая из оставшихся переменных представляет собой, как определено для формулы (IC).
Способ может дополнительно включать (D) получение эрибулина или мезилата эрибулина из соединения формулы (ID).
В формуле (IA) или (IB), P4 может представлять защитную группу гидроксила (например, силил). В формуле (IA) или (IB), R2 и R3 можно соединять, образуя связь, и R4 может представлять собой H. В формуле (IA) или (IB), R5 и R6 можно соединять, образуя связь, и R7 может представлять собой H. В формуле (IA) или (IB), R8 может представлять собой H, и P4 может представлять защитную группу гидроксила (например, силил).
В формуле (IA) или (IB), каждый P3 может представлять собой независимо защитную группу гидроксила (например, силил). В формуле (IC), P3 может представлять собой H или защитную группу гидроксила (например, силил).
В формуле (IA), (IB), (IC), или (ID), P1 может представлять защитную группу гидроксила (например, силил). В формуле (IA) или (IB), X может представлять собой O. В формуле (IA), (IB), (IC), или (ID), P2 представляет собой защитную группу гидроксила (например, силил). В формуле (IA), (IB), (IC), или (ID), X может представлять собой N, и P1 и P2, вместе с атомами, с которыми каждый из них соединен, можно соединять, образуя аминаль.
Способ может дополнительно включать окисление соединения формулы (IB) (например, когда R8 представляет собой H) катализатором метатезиса олефинов, например, реакцией с окисляющим агентом, способным окислять спирт до карбонильной группы (например, периодинаном Десс-Мартина). Если P4 представляет собой защитную группу гидроксила (например, силил) в соединении формулы (IB), данное соединение может реагировать с агентом, удаляющим защитную группу гидроксила перед окислением соединение формулы (IB).
Получение соединения формулы (IB) из соединения формулы (IA) может включать реакцию соединения формулы (IA) с катализатором метатезиса олефинов.
Получение соединения формулы (IC) может включать окисление соединение формулы (IB), где в соединении формулы (IB), R8 представляет собой H, и P4 представляет собой H, например, реакцией соединения формулы (IB) с окисляющим агентом, способным окислять спирт до карбонильной группы (например, периодинаном Десс-Мартина).
Получение соединения формулы (ID) может включать реакцию соединения формулы (IC) с 1,4-восстанавливающим агентом. Соединение формулы (ID), в котором каждый P3 независимо представляет собой защитную группу гидроксила, может реагировать с агентом, удаляющим защитную группу гидроксила, давая соединение формулы (ID), в котором каждый P3 представляет собой H, или обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь.
В формуле (ID), обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, можно соединять, образуя кеталь. В формуле (ID), P1 может представлять собой H. В формуле (ID), X может представлять собой O, и P2 может представлять собой H. Получение эрибулина или мезилата эрибулина из соединения формулы (ID) может включать аминирование соединения формулы (ID).
В формуле (ID), X и P2 можно соединять, образуя защищенный амино. Получение эрибулина или мезилата эрибулина из соединения формулы (ID) может включать реакцию соединения формулы (ID) с агентом, деблокирующим амино.
Мезилат эрибулина можно получить образованием соли эрибулина с метансульфокислотой.
В определенных вариантах осуществления второго аспекта, способ включает:
(A) получение соединения формулы (IIB) из соединения формулы (IIA) или его соли:
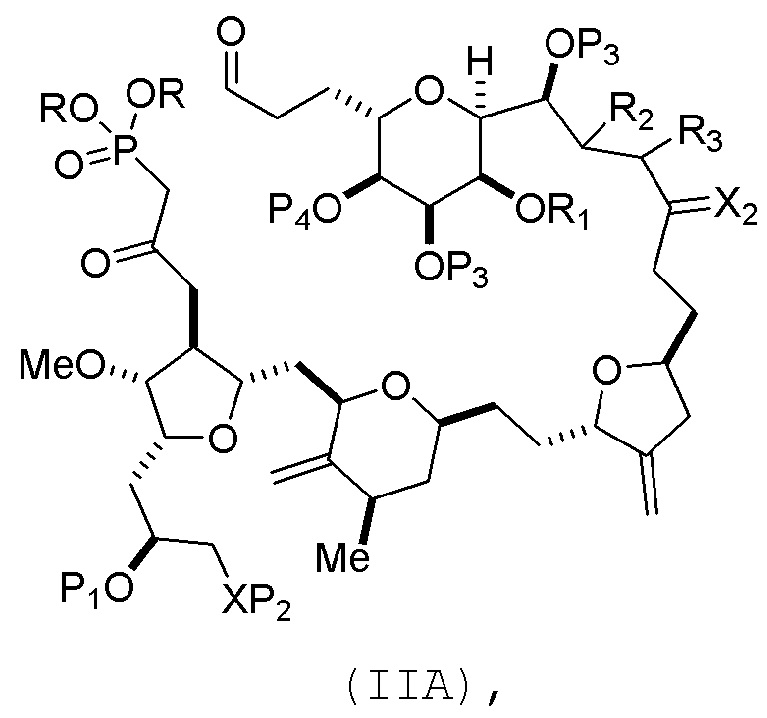
где
каждый R независимо представляет собой необязательно замещенный алкил или необязательно замещенный арил;
(i) R1 представляет собой H или защитную группу гидроксила, и R2 и R3 соединяют, образуя двойную связь;
или
(ii) R1 и R2 соединяют, образуя связь, и R3 представляет собой H;
каждый P3 независимо представляет собой H или защитную группу гидроксила, и X2 представляет собой оксо; или обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь;
P4 представляет собой H или защитную группу гидроксила; и
X представляет собой O, и
каждый P1 и P2 независимо представляет собой H или защитную группу гидроксила,
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя циклический защищенный диол;
или
X представляет собой N, и
P1 представляет собой H или защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино;
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя аминаль или 1,3-оксазолидин-2-он-5-ил; и
соединение формулы (IIB) имеет следующую структуру:
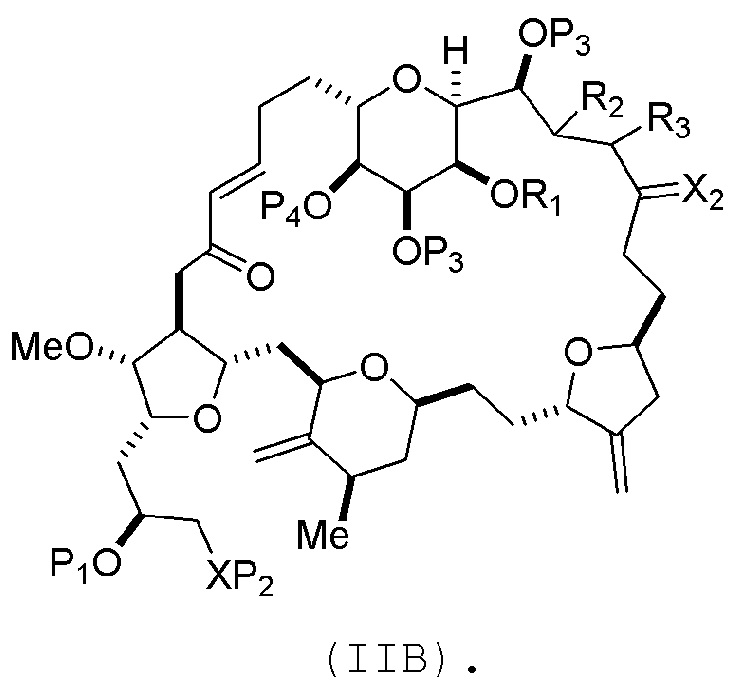
(B) получение соединения формулы (ID) из соединения формулы (IIB), причем соединение формулы (ID) имеет следующую структуру:
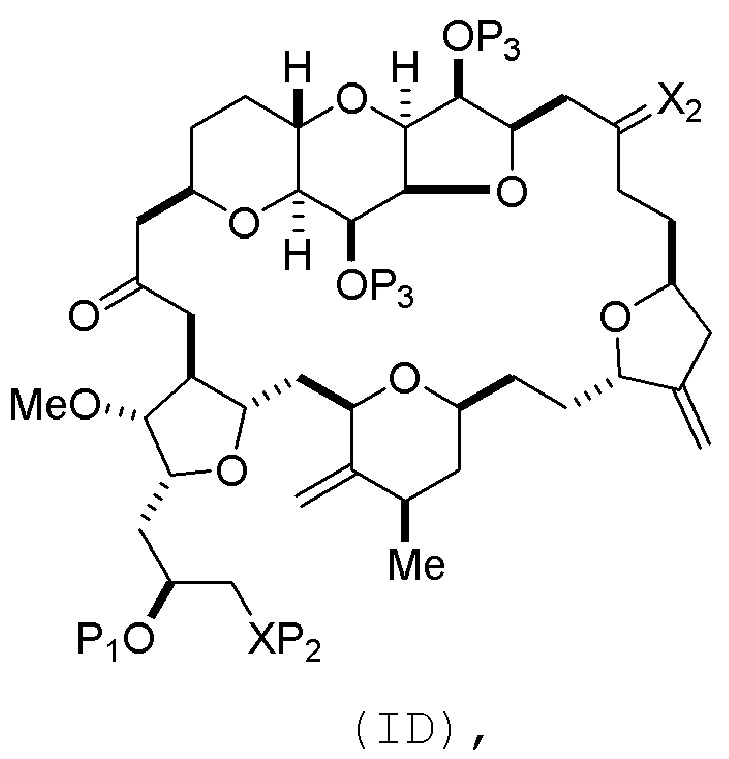
(C) получение эрибулина или мезилата эрибулина из соединения формулы (ID).
В формуле (IIA), каждый R может представлять собой необязательно замещенный алкил. В формуле (IIA) или (IIB), P1 может представлять защитную группу гидроксила (например, силил). В формуле (IIA) или (IIB), P2 может представлять защитную группу гидроксила (например, силил). В формуле (IIA) или (IIB), R1 и R2 могут образовывать связь, и R3 может представлять собой H. В формуле (IIA) или (IIB), P4 может представлять защитную группу гидроксила (например, силил). В формуле (IIA), (IIB), или (ID), обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, можно соединять, образуя кеталь.
Получение соединения формулы (IIB) может включать реакцию соединения формулы (IIA) с органическим основанием (например, органическим основанием, имеющим pKa 11±2 (например, DBU или триалкиламином (например, триэтиламином))) и кислотой Льюиса (например, солью Li, Mg или Zn (например, хлоридом лития или трифторметансульфонатом цинка)).
Получение соединения формулы (ID) может включать реакцию соединения формулы (IIB) с агентом, удаляющим защитную группу гидроксила.
В формуле (ID), обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, можно соединять, образуя кеталь. В формуле (ID), P1 может представлять собой H. В формуле (ID), X может представлять собой O, и P2 может представлять собой H. Получение эрибулина или мезилата эрибулина из соединения формулы (ID) может включать аминирование соединения формулы (ID).
В формуле (ID), X и P2 можно соединять, образуя защищенный амино. Получение эрибулина или мезилата эрибулина из соединения формулы (ID) может включать реакцию соединения формулы (ID) с агентом, деблокирующим амино.
Мезилат эрибулина можно получить образованием соли эрибулина с метансульфокислотой.
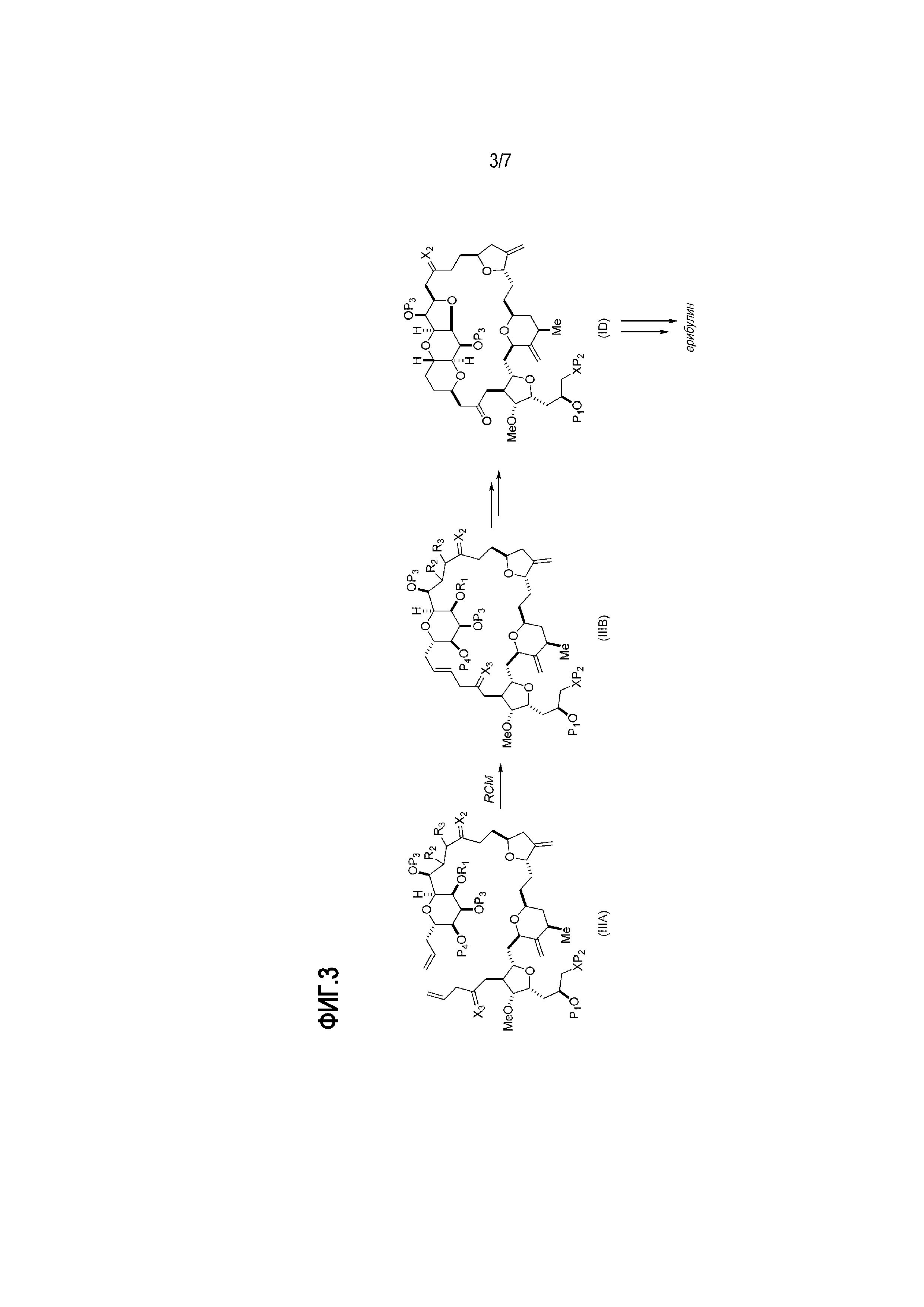
В определенных вариантах осуществления второго аспекта, способ включает:
(A) получение соединения формулы (IIIB) из соединения формулы (IIIA), причем соединение формулы (IIIA) имеет следующую структуру:
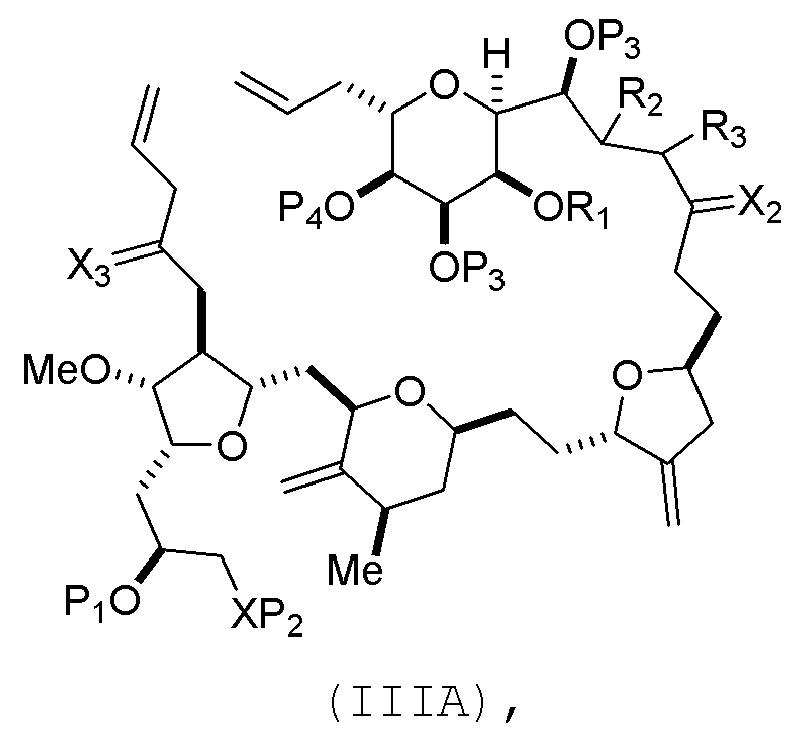
где
(i) R1 представляет собой H или защитную группу гидроксила, и R2 и R3 соединяют, образуя двойную связь;
или
(ii) R1 и R2 соединяют, образуя связь, и R3 представляет собой H;
X3 представляет собой оксо, или X3 комбинируют вместе с атомом углерода, с которым он соединен, образуя кеталь, тиокеталь или -(CH(OP5))-, где P5 представляет собой H или защитную группу гидроксила; каждый P3 независимо представляет собой H или защитную группу гидроксила, и X2 представляет собой оксо; или обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь;
P4 представляет собой H или защитную группу гидроксила; и
X представляет собой O, и
каждый P1 и P2 независимо представляет собой H или защитную группу гидроксила,
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя циклический защищенный диол;
или
X представляет собой N, и
P1 представляет собой H или защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино;
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя аминаль или 1,3-оксазолидин-2-он-5-ил;
соединение формулы (IIIB) имеет следующую структуру:
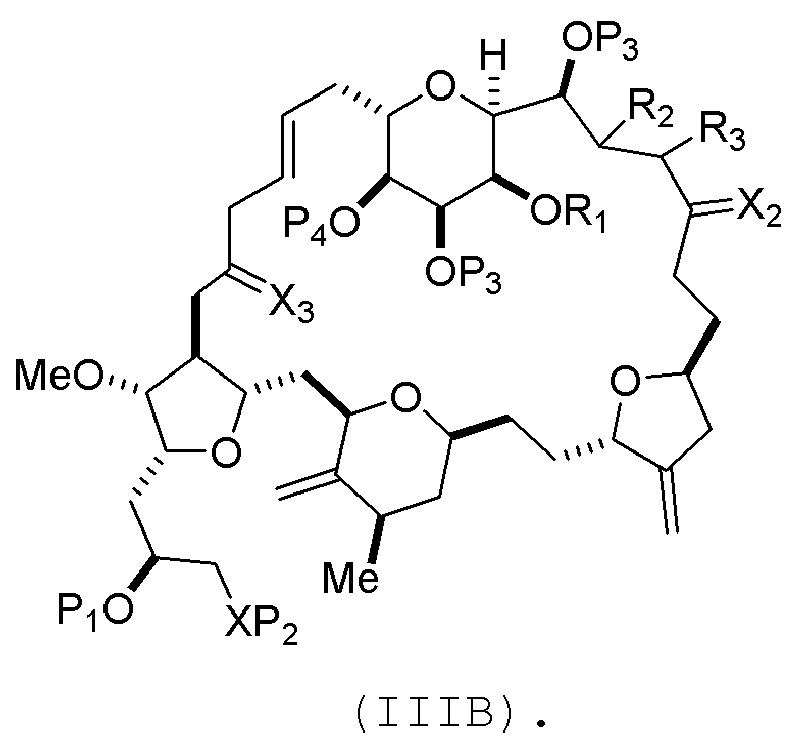
(B) получение соединения формулы (ID) из соединения формулы (IIIB), причем соединение формулы (ID) имеет следующую структуру:
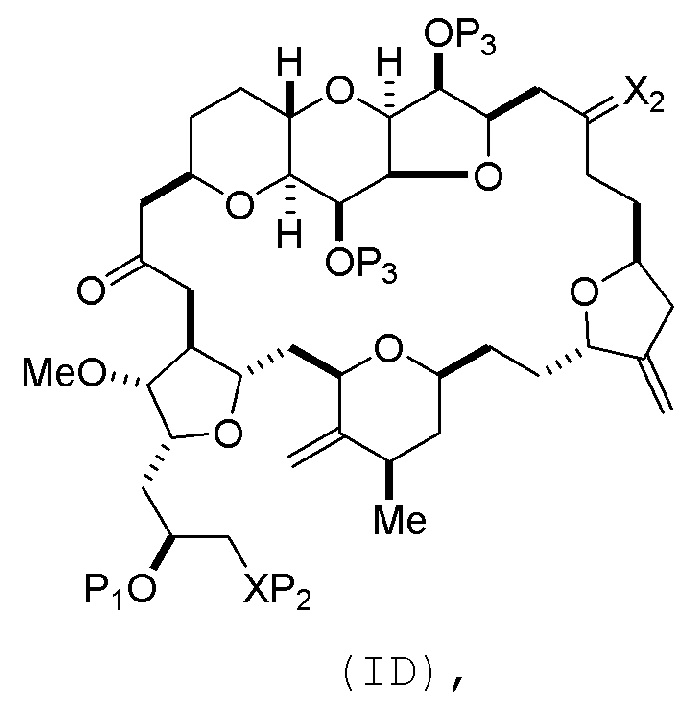
и
(C) получение эрибулина или мезилата эрибулина из соединения формулы (ID).
В формуле (IIIA) или (IIIB), P4 может представлять защитную группу гидроксила (например, силил). В формуле (IIIA) или (IIIB), R1 и R2 могут образовывать связь, и R3 может представлять собой H. В формуле (IIIA) или (IIIB), X3 можно комбинировать с атомом углерода, с которым он соединен, образуя -(CH(OP5))-. В частности, в формуле (IIIA) или (IIIB), P5 может представлять собой H. В формуле (IIIA) или (IIIB), P1 может представлять защитную группу гидроксила (например, силил). В формуле (IIIA) или (IIIB), P2 может представлять защитную группу гидроксила. В формуле (IIIA), (IIIB), или (ID), обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, можно соединять, образуя кеталь.
Получение соединения формулы (IIIB) может включать реакцию соединения формулы (IIIA) с катализатором метатезиса олефинов.
Получение соединения формулы (ID) может включать окисление (например, реакцией с окисляющим агентом, способным окислять спирт до карбонильной группы) соединения формулы (IIIB), где в соединении формулы (IIIB), X3, вместе с атомом углерода, с которым он соединен, образует -(CH(OP5))-, где P5 представляет собой H.
Получение соединения формулы (ID) может также включать реакцию соединения формулы (IIIB), где в соединении формулы (IIIB), P4 представляет собой защитную группу гидроксила, и R4 и R5 соединяют, образуя двойную связь, с агентом, удаляющим защитную группу гидроксила.
В формуле (ID), обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, можно соединять, образуя кеталь. В формуле (ID), P1 может представлять собой H. В формуле (ID), X может представлять собой O, и P2 может представлять собой H. Получение эрибулина или мезилата эрибулина из соединения формулы (ID) может включать аминирование соединения формулы (ID).
В формуле (ID), X и P2 можно соединять, образуя защищенный амино. Получение эрибулина или мезилата эрибулина из соединения формулы (ID) может включать реакцию соединения формулы (ID) с агентом, деблокирующим амино.
Мезилат эрибулина можно получить образованием соли эрибулина с метансульфокислотой.
В определенных вариантах осуществления второго аспекта, способ включает:
(A) получение соединения формулы (IVB) из соединения формулы (IVA), причем соединение формулы (IVA) имеет следующую структуру:
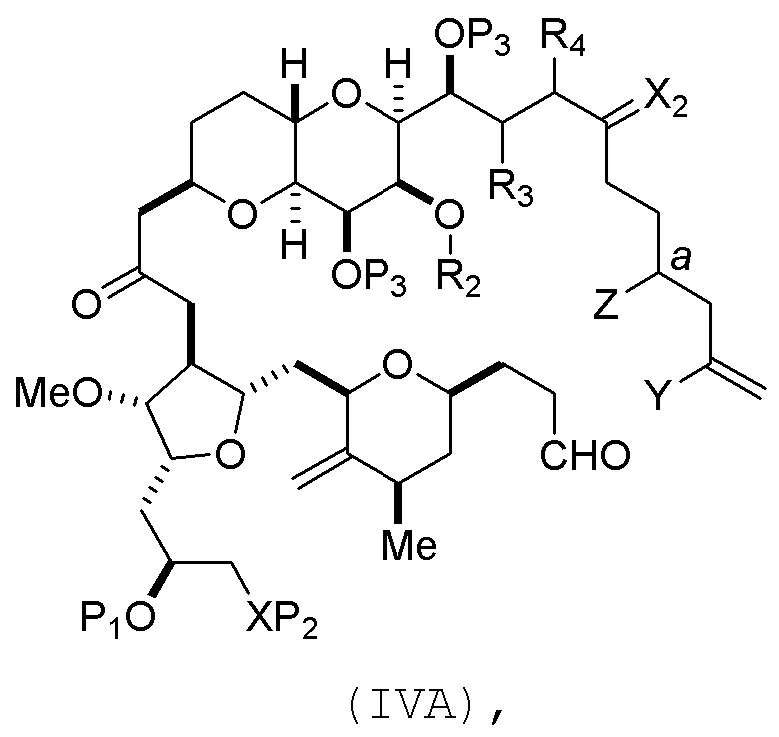
где
Y представляет собой йодид, бромид или трифторметансульфонат;
a обозначает R стереогенный центр, и Z представляет собой сульфонат, хлорид, бромид или йодид; или a обозначает S стереогенный центр, и Z представляет собой OR1, где R1 представляет собой защитную группу гидроксила;
(i) R2 представляет собой H или защитную группу гидроксила, и R3 и R4 соединяют, образуя двойную связь;
или
(ii) R2 и R3 соединяют, образуя связь, и R4 представляет собой H;
каждый P3 независимо представляет собой H или защитную группу гидроксила, и X2 представляет собой оксо; или обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь; и
X представляет собой O, и
каждый P1 и P2 независимо представляет собой H или защитную группу гидроксила,
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя циклический защищенный диол;
или
X представляет собой N, и
P1 представляет собой H или защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино;
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя аминаль или 1,3-оксазолидин-2-он-5-ил;
соединение формулы (IVB) имеет следующую структуру:
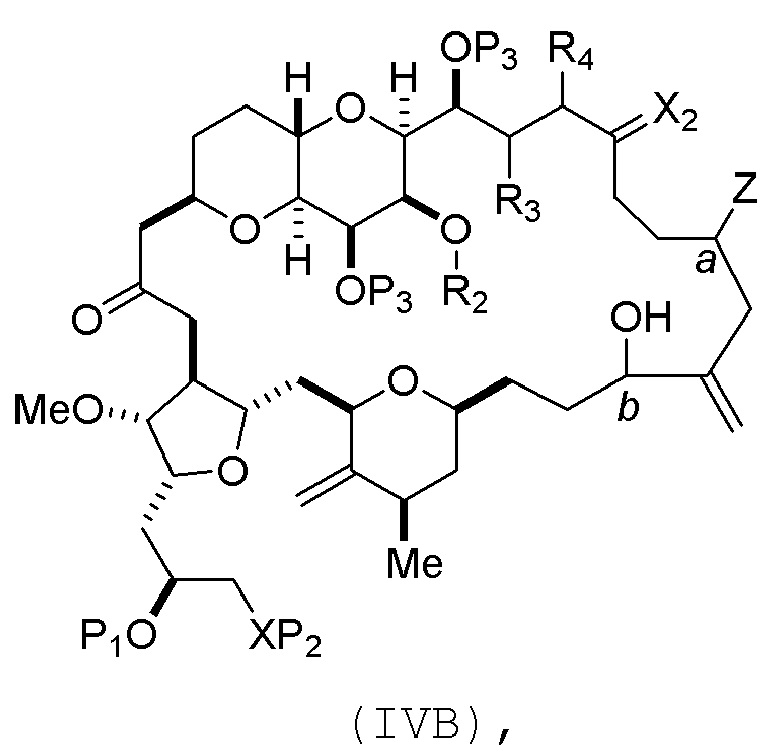
где
a обозначает R стереогенный центр, b обозначает S стереогенный центр, и Z представляет собой сульфонат, хлорид, бромид или йодид;
или
a обозначает S стереогенный центр, b обозначает R стереогенный центр, и Z представляет собой OR1, где R1 представляет собой защитную группу гидроксила;
(B) получение соединения формулы (ID) из соединения формулы (IVB), причем соединение формулы (ID) имеет следующую структуру:
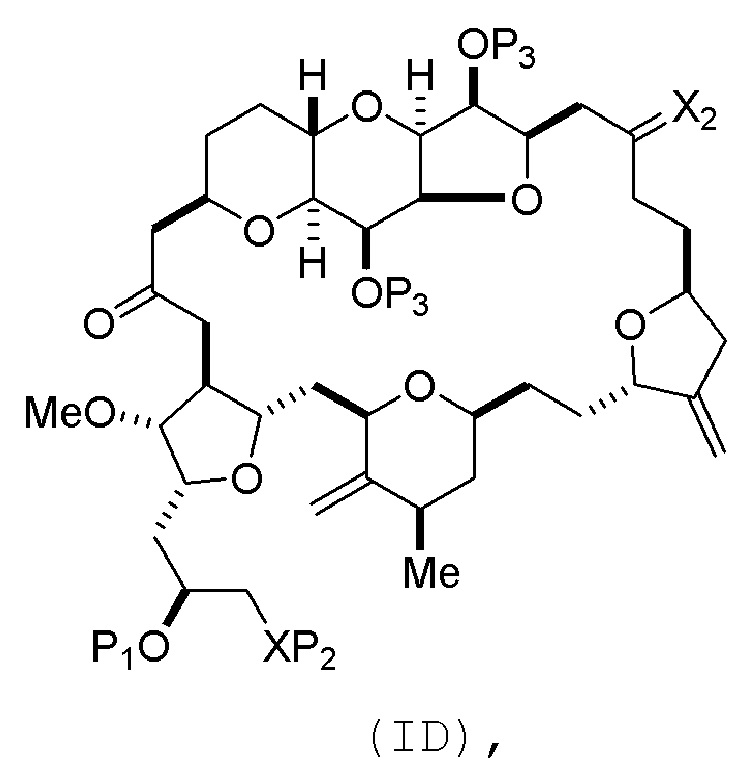
и
(C) получение эрибулина или мезилата эрибулина из соединения формулы (ID).
В формуле (IVA) или (IVB), Y может представлять собой бромид. В формуле (IVA) или (IVB), R2 и R3 можно соединять, образуя связь, и R4 может представлять собой H. В формуле (IVA) или (IVB), P1 может представлять защитную группу гидроксила (например, силил). В формуле (IVA) или (IVB), P2 может представлять защитную группу гидроксила (например, силил). В формуле (IVA) или (IVB), Z может представлять собой сульфонат. В формуле (IVA) или (IVB), Z может представлять собой OR1, где R1 может представлять защитную группу гидроксила (например, Z может представлять собой эфир, карбонат или карбамат (например, Z может представлять собой эфир)). В формуле (IVA), (IVB) или (ID), обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, можно соединять, образуя кеталь.
Получение соединения формулы (IVB) может включать реакцию соединения формулы (IVA) с Cr(II) солью и Ni(II) солью. Получение соединения формулы (IVB) может включать воздействие на соединение формулы (IVA) условий реакции Нозаки-Хияма-Киши.
Получение соединения формулы (ID) может включать стадию нуклеофильного замыкания кольца соединения формулы (IVB).
В формуле (ID), обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, можно соединять, образуя кеталь. В формуле (ID), P1 может представлять собой H. В формуле (ID), X может представлять собой O, и P2 может представлять собой H. Получение эрибулина или мезилата эрибулина из соединения формулы (ID) может включать аминирование соединения формулы (ID).
В формуле (ID), X и P2 можно соединять, образуя защищенный амино. Получение эрибулина или мезилата эрибулина из соединения формулы (ID) может включать реакцию соединения формулы (ID) с агентом, деблокирующим амино.
Мезилат эрибулина можно получить образованием соли эрибулина с метансульфокислотой.
В конкретных вариантах осуществления второго аспекта, способ включает:
(A) получение соединения формулы (VB) из соединения формулы (VA):
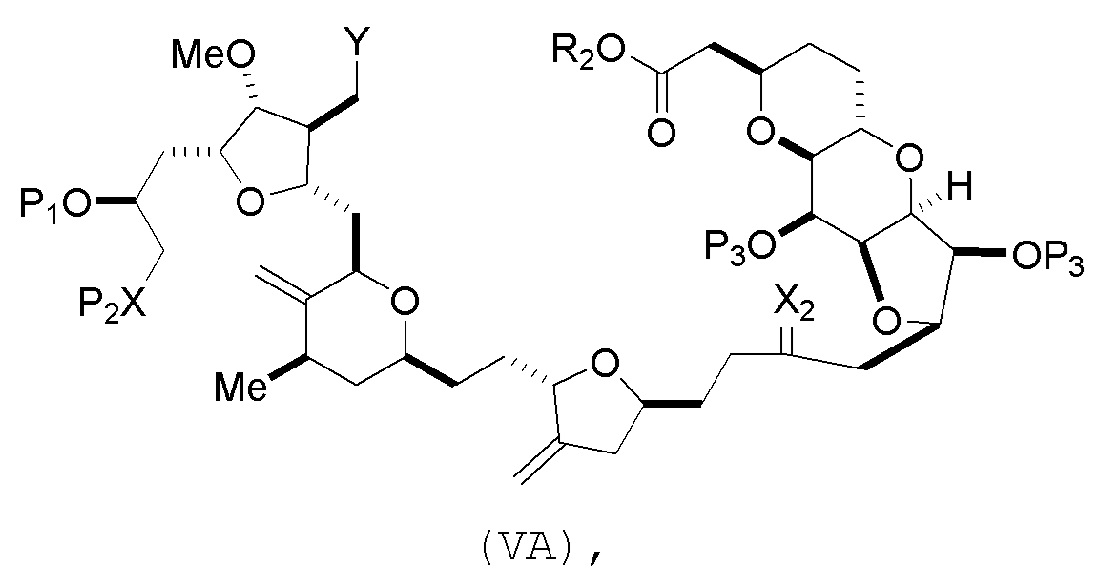
где
Y представляет собой SO2R1 или COOR1, где, когда Y представляет собой SO2R1, R1 представляет собой необязательно замещенный арил или необязательно замещенный неенолизируемый алкил, и когда Y представляет собой COOR1, R1 представляет собой необязательно замещенный алкил, необязательно замещенный арил или необязательно замещенный арилалкил;
каждый P3 независимо представляет собой H или защитную группу гидроксила, и X2 представляет собой оксо, или обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь;
R2 представляет собой необязательно замещенный алкил, необязательно замещенный арилалкил или необязательно замещенный арил; and
X представляет собой O, и
каждый P1 и P2 представляет собой независимо защитную группу гидроксила,
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя циклический защищенный диол;
или
X представляет собой N, и
P1 представляет собой H или защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино;
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя аминаль или 1,3-оксазолидин-2-он-5-ил;
соединение формулы (VB) имеет следующую структуру:
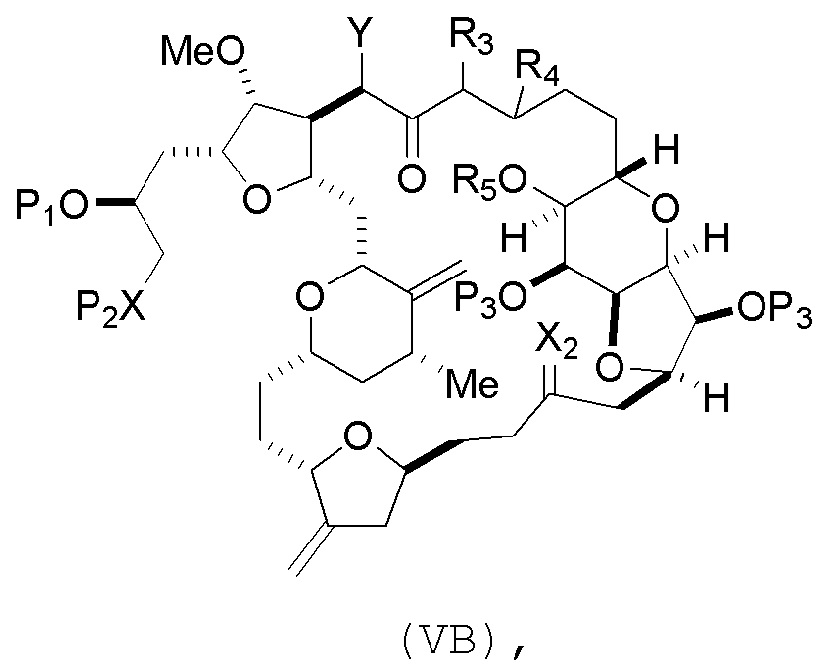
где
(i) R3 представляет собой H, R4 представляет собой эфир, и R5 представляет собой H;
(ii) R5 представляет собой H, и R3 и R4, вместе со связью, соединяющей атомы, с которыми каждый из них соединен, соединяют, образуя двойную связь;
или
(iii) R3 представляет собой H, и R4 и R5 соединяют, образуя связь;
(B) получение соединения формулы (ID) из соединения формулы (VB), причем соединение формулы (ID) имеет следующую структуру:
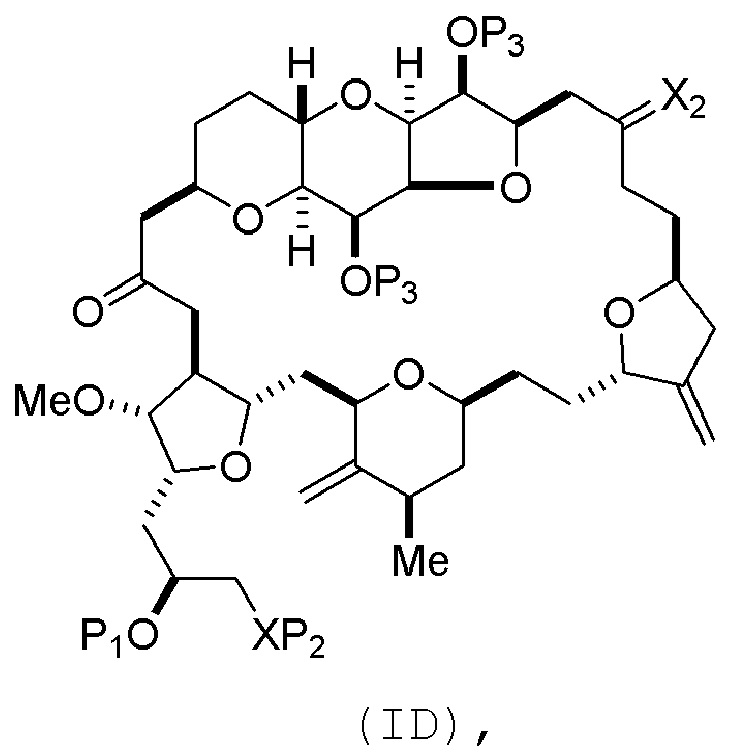
и
(C) получение эрибулина или мезилата эрибулина из соединения формулы (ID).
В формуле (VA) или (VB), Y может представлять собой SO2R1 (например, R1 может представлять собой необязательно замещенный арил). В формуле (VA) или (VB), R2 может представлять собой необязательно замещенный алкил (например, незамещенный C1-6 алкил). В формуле (VB), R3 может представлять собой H, и R4 и R5 можно соединять, образуя связь. В формуле (VA), (VB) или (ID), обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, можно соединять, образуя кеталь.
Получение соединения формулы (VB) может включать реакцию соединения формулы (VA) с сильным основанием (например, третичным C4-6 алкоксидом).
Получение соединения формулы (ID) может включать реакцию соединения формулы (VB), в котором Y представляет собой SO2R1, и R1 представляет собой необязательно замещенный арил, с электронпереносящим восстанавливающим агентом (например, SmI2, Mg(0), или Cr(III) с Mn(0)).
В формуле (ID), обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, можно соединять, образуя кеталь. В формуле (ID), P1 может представлять собой H. В формуле (ID), X может представлять собой O, и P2 может представлять собой H. Получение эрибулина или мезилата эрибулина из соединения формулы (ID) может включать аминирование соединения формулы (ID).
В формуле (ID), X и P2 можно соединять, образуя защищенный амино. Получение эрибулина или мезилата эрибулина из соединения формулы (ID) может включать реакцию соединения формулы (ID) с агентом, деблокирующим амино.
Мезилат эрибулина можно получить образованием соли эрибулина с метансульфокислотой.
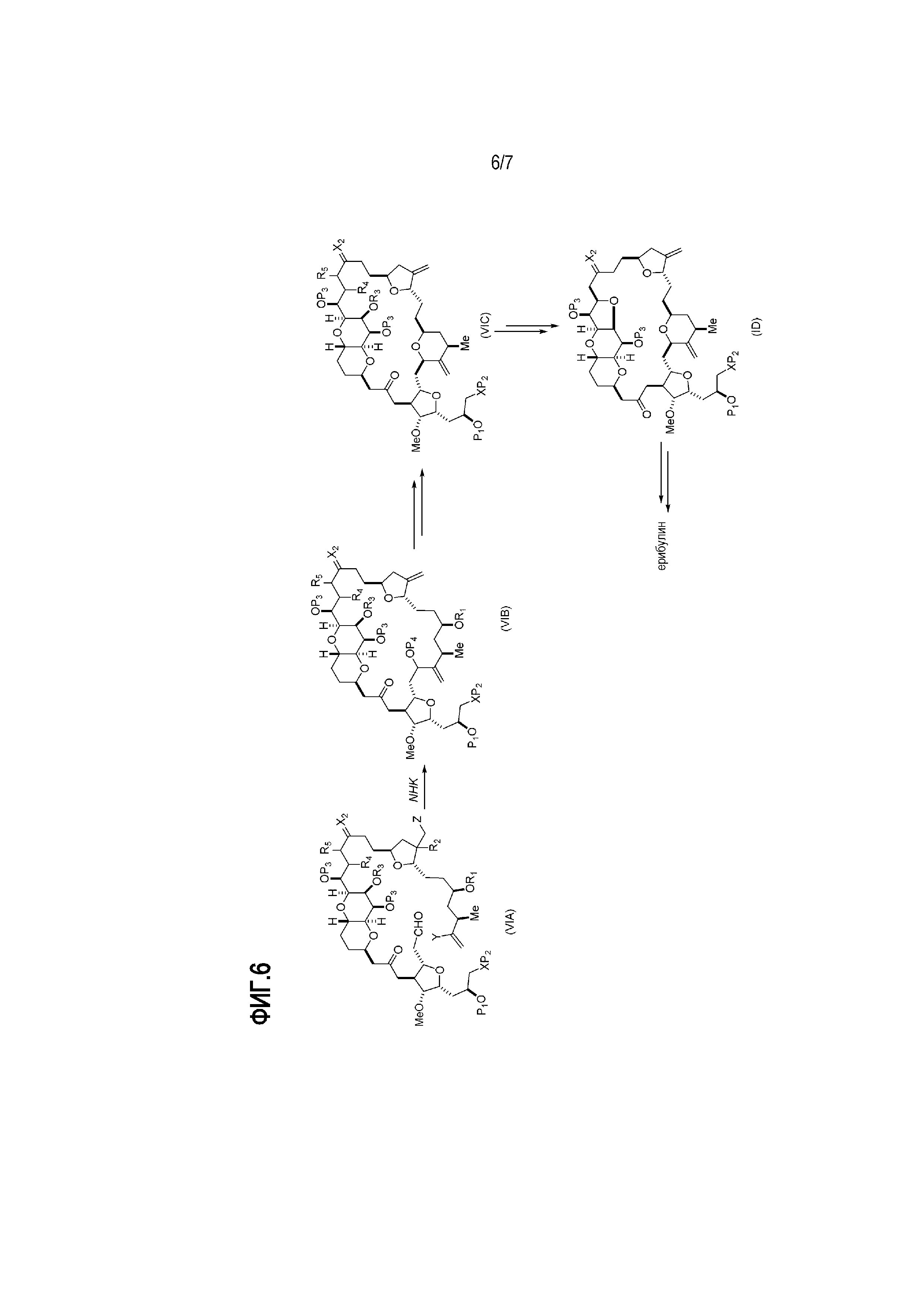
В других вариантах осуществления второго аспекта, способ включает:
(A) получение соединения формулы (VIB) из соединения формулы (VIA), причем соединение формулы (VIA) имеет следующую структуру:
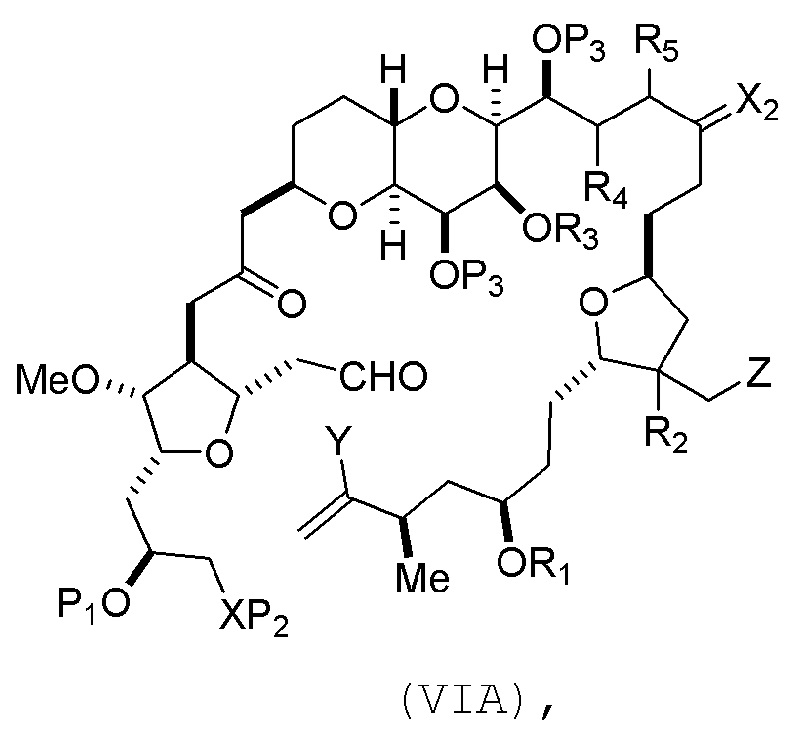
где
Y представляет собой йодид, бромид или трифторметансульфонат;
(a1) R3 представляет собой H или защитную группу гидроксила, R4 и R5 соединяют, образуя двойную связь, каждый P3 независимо представляет собой H или защитную группу гидроксила, и X2, вместе с атомом углерода, с которым он соединен, образует карбонил или -(CH(OR6))-, где R6 представляет собой H или защитную группу гидроксила;
или
(a2) R3 и R4 соединяют, образуя связь, R5 представляет собой H, и
каждый P3 независимо представляет собой H или защитную группу гидроксила, и X2, вместе с атомом углерода, с которым он соединен, образует карбонил или -(CH(OR6))-;
или
обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь;
(b1) Z представляет собой хлорид, бромид или йодид, и R1 и R2 соединяют, образуя связь;
или
(b2) Z и R2 соединяют, образуя двойную связь, и R1 представляет собой защитную группу гидроксила;
и
X представляет собой O, и
каждый P1 и P2 независимо представляет собой H или защитную группу гидроксила,
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя циклический защищенный диол;
или
X представляет собой N, и
P1 представляет собой H или защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино;
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя аминаль или 1,3-оксазолидин-2-он-5-ил; и
соединение формулы (VIB) имеет следующую структуру:
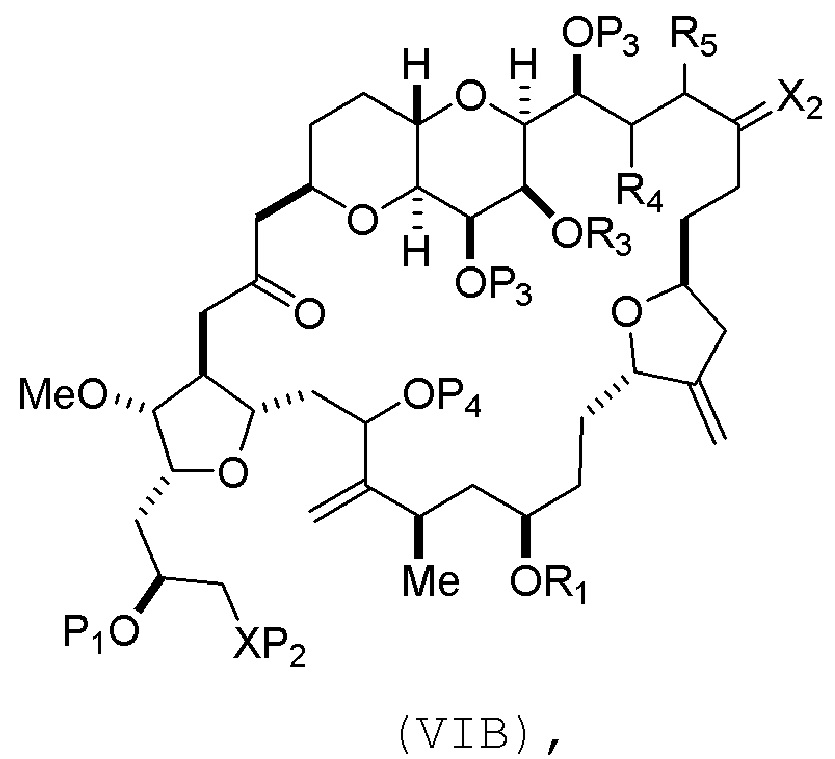
где P4 представляет собой H или защитную группу гидроксила;
(B) получение соединения формулы (VIC) из соединения формулы (VIB), причем соединение формулы (VIC) имеет следующую структуру:
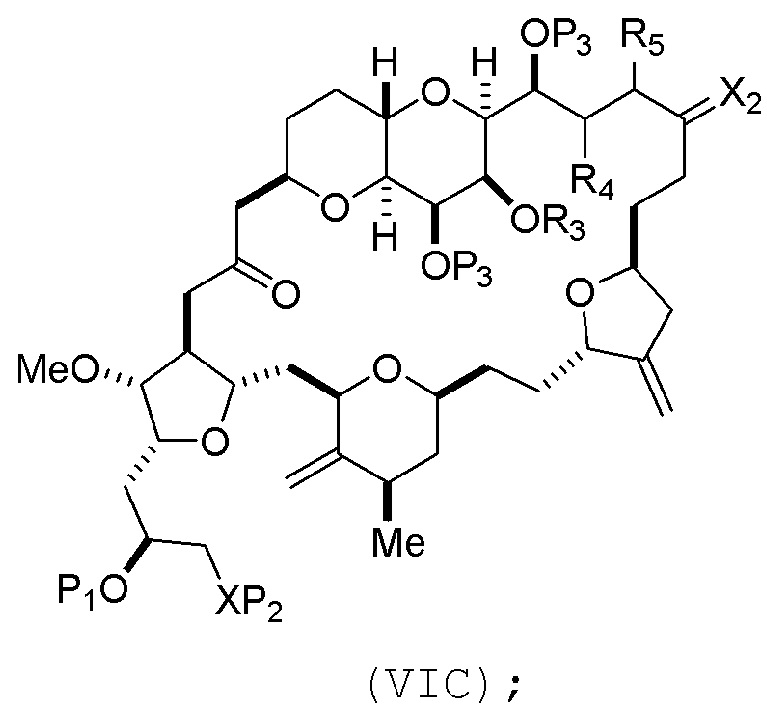
(C) получение соединения формулы (ID) из соединения формулы (VIC), причем соединение формулы (ID) имеет следующую структуру:
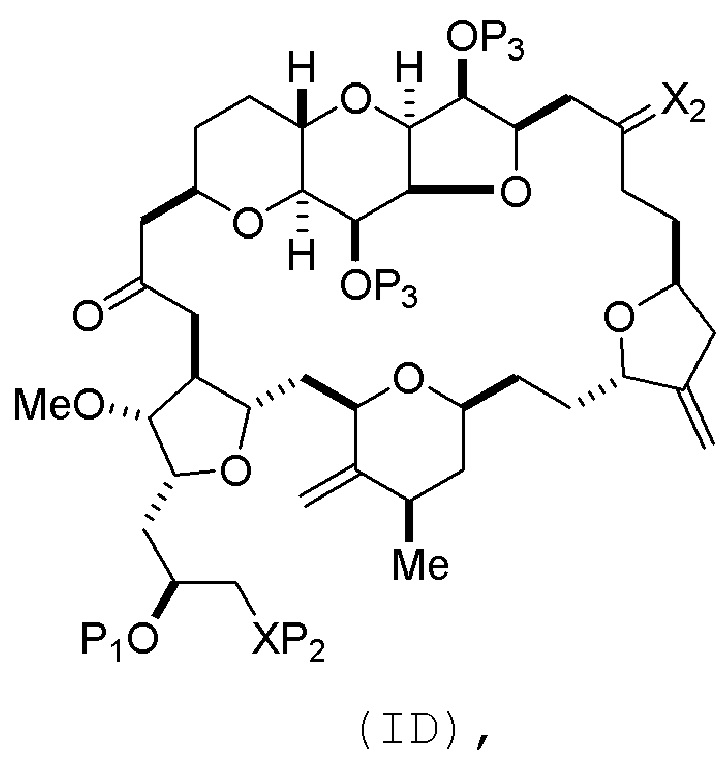
и
(D) получение эрибулина или мезилата эрибулина из соединения формулы (ID).
Получение соединения формулы (VIB) может включать реакцию соединения формулы (VIA) с Cr(II) солью и Ni(II) солью.
Получение соединения формулы (ID) может включать реакцию соединения формулы (VIB) с агентом, удаляющим защитную группу гидроксила.
В формуле (ID), обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, можно соединять, образуя кеталь. В формуле (ID), P1 может представлять собой H. В формуле (ID), X может представлять собой O, и P2 может представлять собой H. Получение эрибулина или мезилата эрибулина из соединения формулы (ID) может включать аминирование соединения формулы (ID).
В формуле (ID), X и P2 можно соединять, образуя защищенный амино. Получение эрибулина или мезилата эрибулина из соединения формулы (ID) может включать реакцию соединения формулы (ID) с агентом, деблокирующим амино.
Мезилат эрибулина можно получить образованием соли эрибулина с метансульфокислотой.
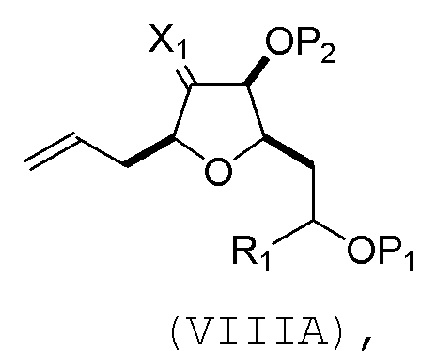
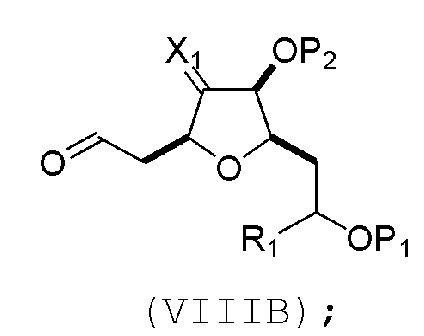
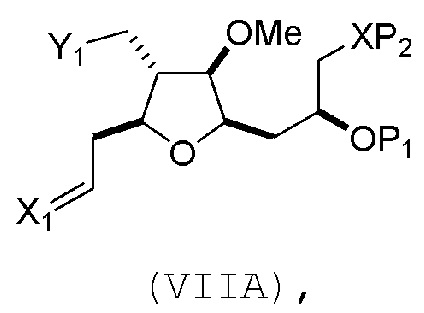
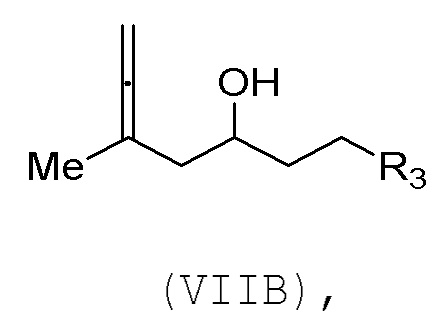
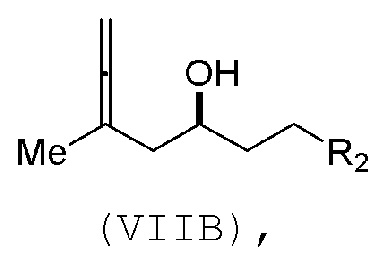
В третьем аспекте, настоящее изобретение относится к способу получения промежуточного соединения в получении эрибулина, причем способ включает проведение реакции Принса контактом соединения формулы (VIIA) с соединением формулы (VIIB) и R3OH,
где R3 может представлять собой необязательно замещенный ацил;
где соединение формулы (VIIA) может иметь следующую структуру:
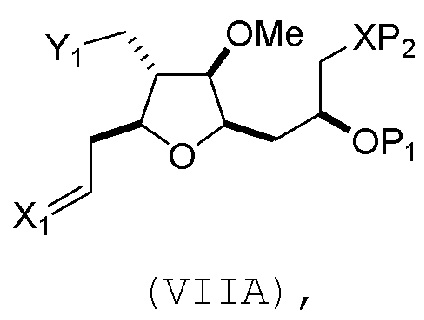
где
Y1 представляет собой SO2R1 или COOR1, и R1 представляет собой необязательно замещенный алкил, необязательно замещенный арил или необязательно замещенный арилалкил;
X1 представляет собой O, или X1, вместе с атомом углерода, с которым он соединен, образует циклический ацеталь; и
X представляет собой O, и
каждый P1 и P2 независимо представляет собой H или защитную группу гидроксила,
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя циклический защищенный диол;
или
X представляет собой N, и
P1 представляет собой H или защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино;
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя аминаль или 1,3-оксазолидин-2-он-5-ил;
где соединение формулы (VIIB) может иметь следующую структуру:
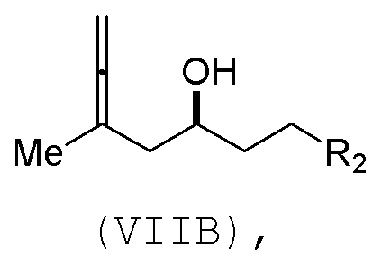
где
R2 представляет собой -CH2-OP3, 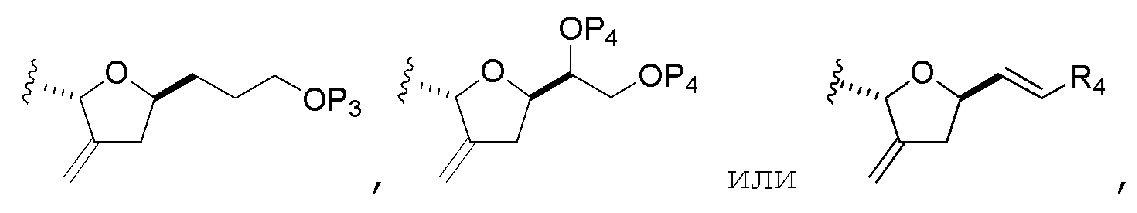
где P3 представляет собой H или защитную группу гидроксила; каждый P4 представляет собой независимо защитную группу гидроксила, или обе P4 группы, вместе с атомами, с которыми каждая из них соединена, соединяют, образуя циклический защищенный диол; и R4 представляет собой H или -CH2X2CH2CH=CH2, где X2 представляет собой O, -CH2-, или NP5, где P5 представляет собой сульфонил;
и где промежуточное соединение представляет собой соединение формулы (VIIC):
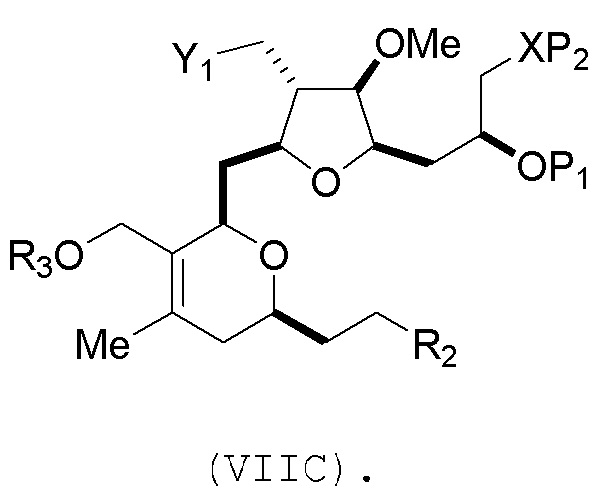
Проведение реакции Принса может включать реакцию соединения формулы (VIIA) с кислотой Льюиса (например, трифторидом бора или его сольватом).
В четвертом аспекте, настоящее изобретение относится к способу получения промежуточного соединения в получении эрибулина, причем способ может включать:
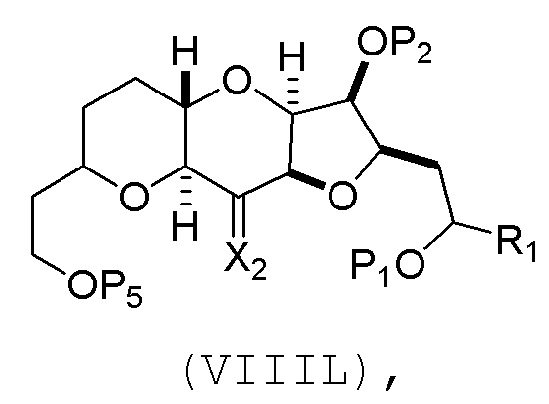
(A) расщепление двойной связи в соединении формулы (VIIIA), получая соединение формулы (VIIIB), причем соединение формулы (VIIIA) имеет структуру:
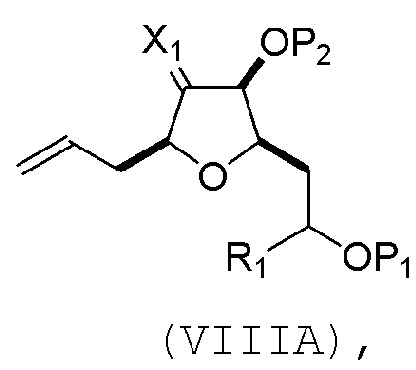
где
X1 может представлять собой оксо, или X1, вместе с атомом углерода, с которым он может быть соединен, образует кеталь или -(CH(OP3))-, где P3 может представлять собой H или защитную группу гидроксила;
R1 может представлять собой H или -CH2OP4;
каждый P1, P2, и P4 может представлять собой независимо защитную группу гидроксила, или
P1 и P4, вместе с атомами, с которыми каждый из них может быть соединен, можно соединять, образуя циклический защищенный диол; и
соединение формулы (VIIIB) имеет структуру:
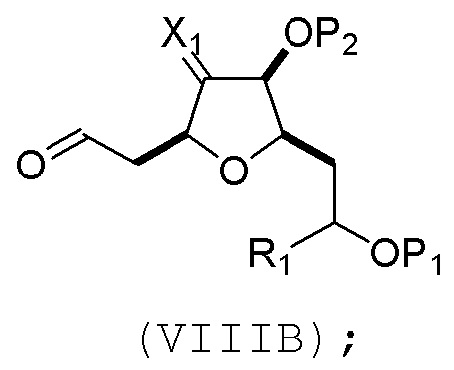
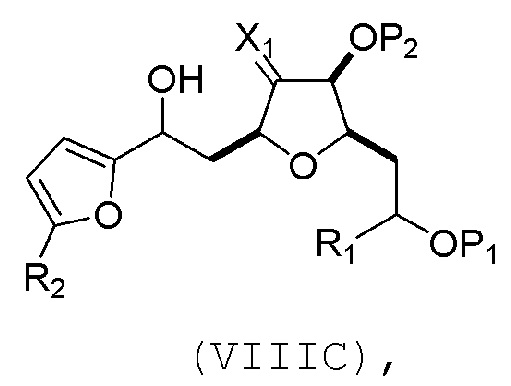
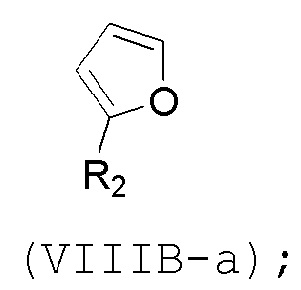
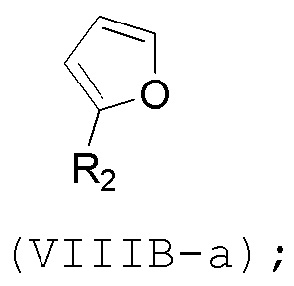
(B) реакцию соединения формулы (VIIIB) с соединением формулы (VIIIB-a), получая соединение формулы (VIIIC):
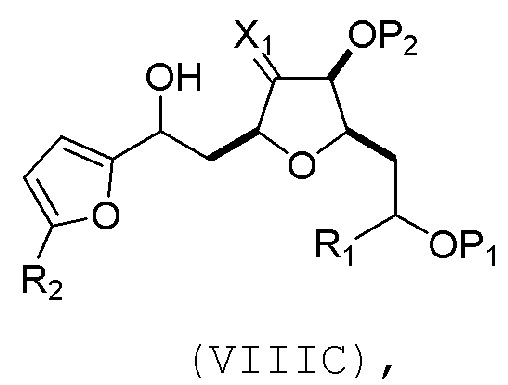
где R2 может представлять собой H или -CH2CH2OP5, и P5 может представлять защитную группу гидроксила;
и соединение формулы (VIIIB-a) имеет следующую структуру:
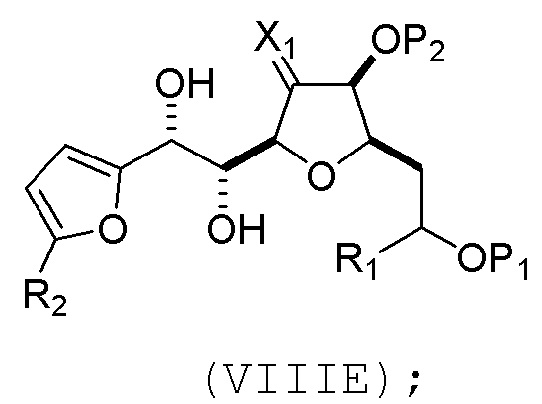
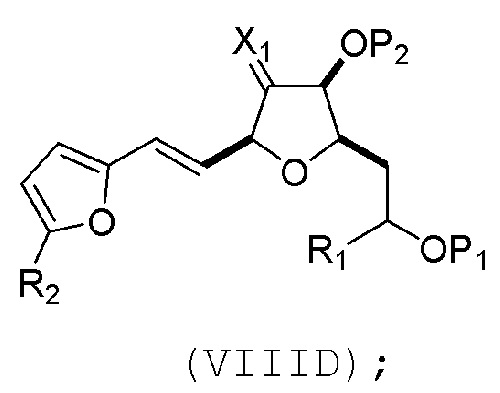
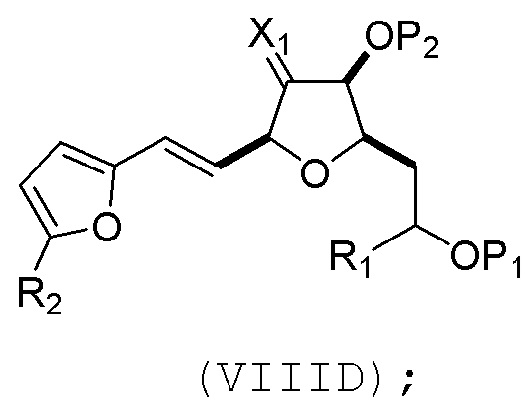
(C) реакцию соединения формулы (VIIIC) с дегидратирующим агентом, получая соединение формулы (VIIID):
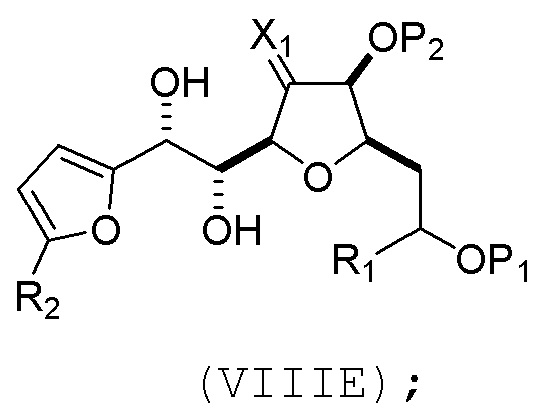
(D) реакцию соединения формулы (VIIID) с дегидроксилирующим агентом, получая соединение формулы (VIIIE):
(E) получение соединения формулы (VIIIF) последовательностью реакций, включающей реакцию соединения формулы (VIIIE) с N-бромсукцинимидом, получая первое промежуточное соединение, реакцию первого промежуточного соединения с ацилирующим агентом (например, ангидридом карбоновой кислоты), получая второе промежуточное соединение, и (a) когда R2 может представлять собой -CH2CH2OP5, контакт второго промежуточного соединения с восстанавливающим агентом, или (b) когда R2 может представлять собой H, аллилирование второго промежуточного соединения формулы (VIIIF):
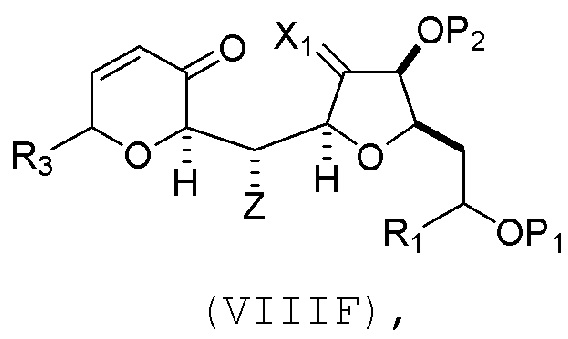
где Z может представлять собой эфир или -OP7, где P7 может представлять собой H или защитную группу гидроксила, и R3 может представлять собой -CH2CH2OP5 или -CH2CH=CH2;
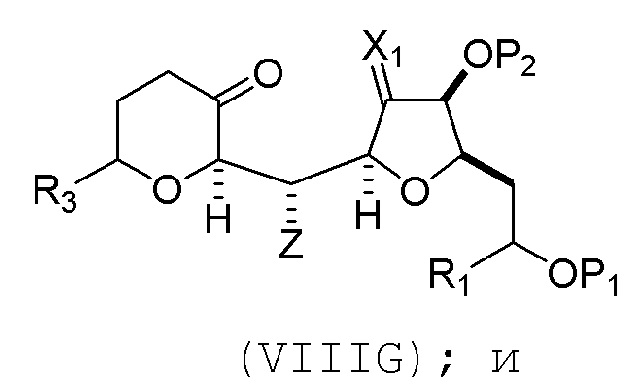
(F) реакцию соединения формулы (VIIIF) с 1,4-восстанавливающим агентом, получая соединение формулы (VIIIG):
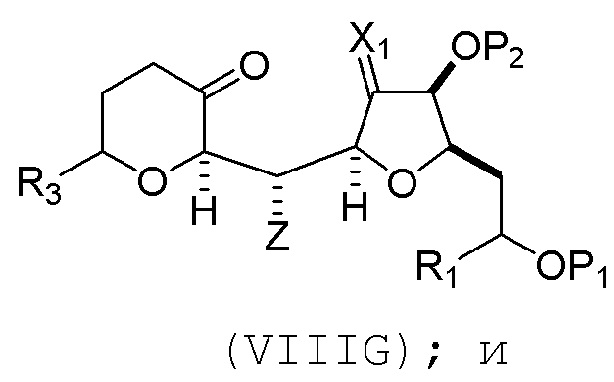
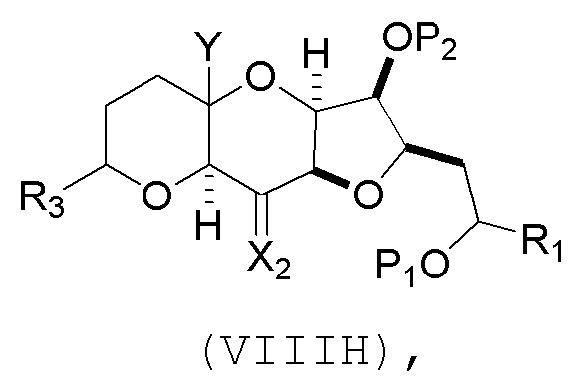
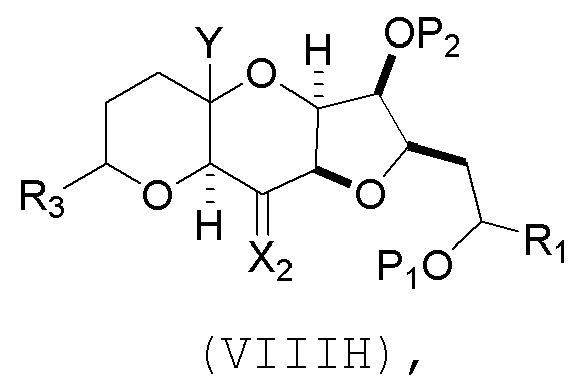
(G) образование соединения формулы (VIIIH) последовательностью реакций, включающей реакцию соединения формулы (VIIIG) с кислотой Бренстеда и Y-H, где Y может представлять собой необязательно замещенный C1-6 алкил, причем соединение формулы (VIIIH) имеет следующую структуру:
где Y может представлять собой необязательно замещенный C1-6 алкиловый эфир; R2 может представлять собой -CH2CH2OP5; X2 может представлять собой оксо, или X2, вместе с атомом углерода, с которым он может быть соединен, образует кеталь или -(CH(OP6))-, где P6 может представлять защитную группу гидроксила.
В некоторых вариантах осуществления четвертого аспекта, способ дополнительно включает:
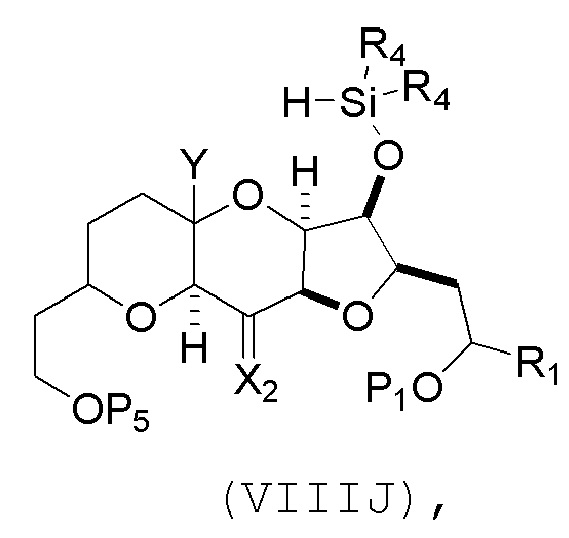
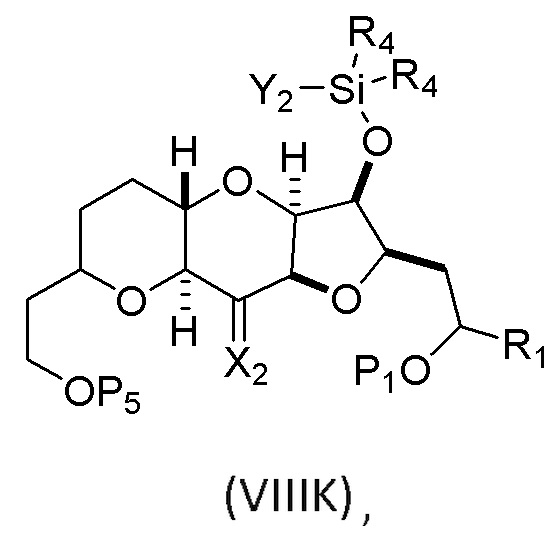
(H) замещение P2 в соединении формулы (VIIIH) -Si(R4)2H, получая соединение формулы (VIIIJ):
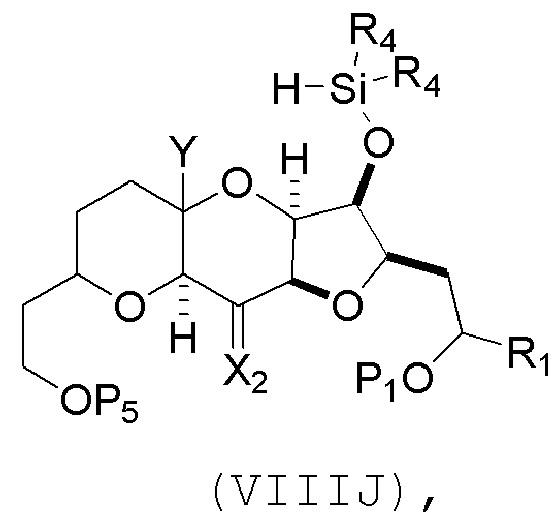
где каждый R4 независимо представляет собой необязательно замещенный алкил, необязательно замещенный арил или необязательно замещенный арилалкил;
(I) реакцию соединения формулы (VIIIJ) с кислотой Льюиса, получая соединение формулы (VIIIK):
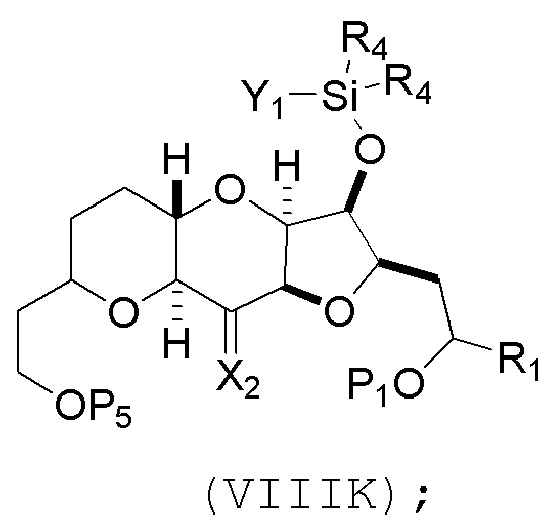
где Y1 представляет собой фтор, хлор или бром; и
(J) реакцию соединения формулы (VIIIK) с агентом, удаляющим защитную группу гидроксила, и затем реакцию с защищающим гидроксил агентом, получая соединение формулы (VIIIL):
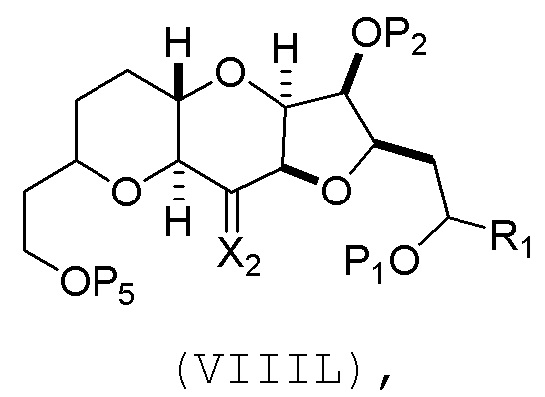
где P2 представляет собой защитную группу гидроксила.
В пятом аспекте, настоящее изобретение относится к соединениям формул (IA), (IB), (IC), (IIA), (IIB), (IIIA), (IIIB), (IVA), (IVB), (IVE), (VA), (VB), (VIA), (VIB), (VIIB) и (VIIC). Настоящее изобретение также относится к соединениям формулы (VIIIC), (VIIID), (VIIIE), (VIIIF), (VIIIG), (VIIIH), (VIIIJ), (VIIIK) и (VIIIL).
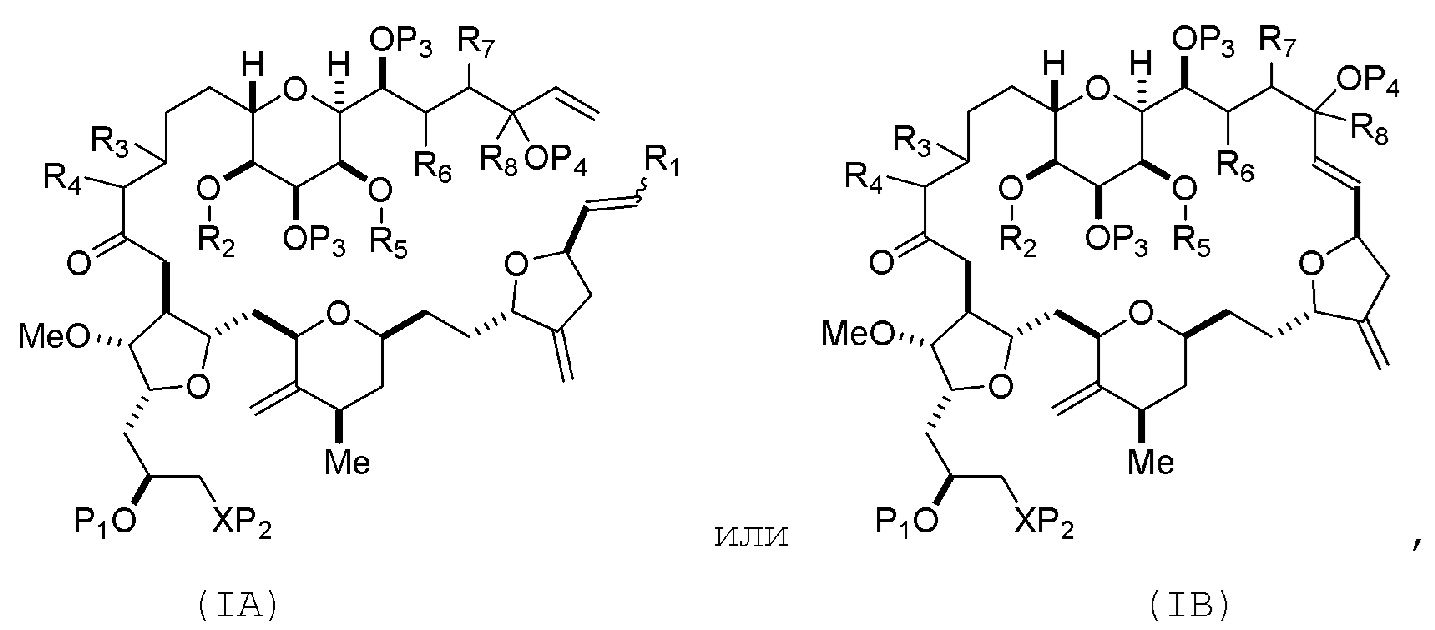
Соединение пятого аспекта может представлять собой соединение формулы (IA) или (IB):
или их соль,
где
R1 представляет собой H или -CH2X1CH2CH=CH2, где X1 представляет собой O, -C(R9)2- или NP5, и где каждый R9 независимо представляет собой H или -COOR10, P5 представляет собой N-защитную группу, и R10 представляет собой C1-6 алкил;
(a1) R2 представляет собой H или защитную группу гидроксила, R3 представляет собой C1-6 алкиловый эфир, и R4 представляет собой H;
(a2) R2 представляет собой H или защитную группу гидроксила, и R3 и R4 соединяют, образуя двойную связь;
или
(a3) R2 и R3 соединяют, образуя связь, и R4 представляет собой H;
(b1) R5 представляет собой H или защитную группу гидроксила, и R6 и R7 соединяют, образуя двойную связь;
или
(b2) R5 и R6 соединяют, образуя связь, и R7 представляет собой H;
(c1) R8 представляет собой H, и P4 представляет собой H или защитную группу гидроксила;
или
(c2) R8 и P4 соединяют, образуя двойную связь;
каждый P3 независимо представляет собой H или защитную группу гидроксила; и
X представляет собой O, и
каждый P1 и P2 независимо представляет собой H или защитную группу гидроксила,
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя циклический защищенный диол;
или
X представляет собой N, и
P1 представляет собой H или защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино;
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя аминаль или 1,3-оксазолидин-2-он-5-ил.
Соединение пятого аспекта может представлять собой соединение формулы (IC):
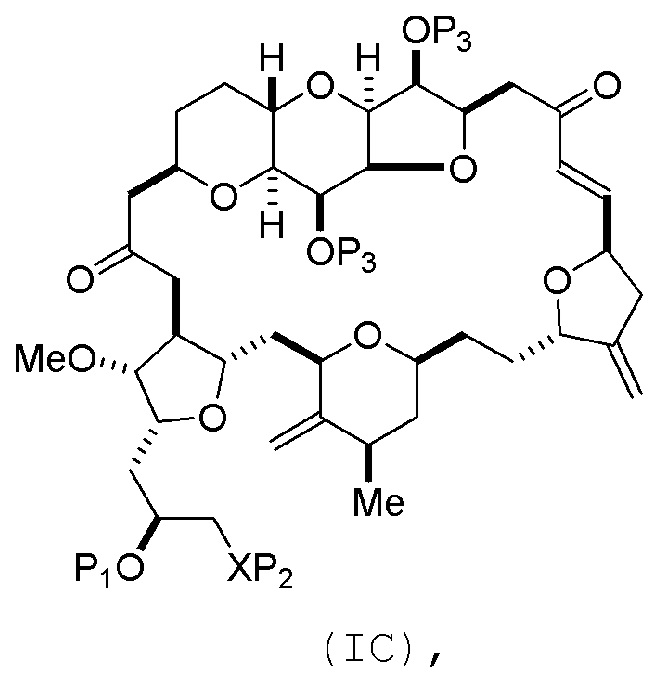
или его соль,
где
каждый P3 независимо представляет собой защитную группу гидроксила; и
X представляет собой O, P1 представляет собой защитную группу гидроксила, и P2 представляет собой H или защитную группу гидроксила;
или
P1 представляет собой защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино.
Соединение пятого аспекта может представлять собой соединение формулы (IIA) или (IIB):
или их соль,
где
каждый R независимо представляет собой необязательно замещенный алкил или необязательно замещенный арил;
(i) R1 представляет собой H или защитную группу гидроксила, и R2 и R3 соединяют, образуя двойную связь;
или
(ii) R1 и R2 соединяют, образуя связь, и R3 представляет собой H;
каждый P3 независимо представляет собой H или защитную группу гидроксила, и X2 представляет собой оксо; или обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь;
P4 представляет собой H или защитную группу гидроксила; и
X представляет собой O, и
каждый P1 и P2 независимо представляет собой H или защитную группу гидроксила,
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя циклический защищенный диол;
или
X представляет собой N, и
P1 представляет собой H или защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино;
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя аминаль или 1,3-оксазолидин-2-он-5-ил.
Соединение пятого аспекта может представлять собой соединение формулы (IIIA) или (IIIB):
или их соль,
где
(i) R1 представляет собой H или защитную группу гидроксила, и R2 и R3 соединяют, образуя двойную связь;
или
(ii) R1 и R2 соединяют, образуя связь, и R3 представляет собой H;
X3 представляет собой оксо, или X3 комбинируют вместе с атомом углерода, с которым он соединен, образуя кеталь, тиокеталь или -(CH(OP5))-, где P5 представляет собой H или защитную группу гидроксила;
каждый P3 независимо представляет собой H или защитную группу гидроксила, и X2 представляет собой оксо; или обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь;
P4 представляет собой H или защитную группу гидроксила; and
X представляет собой O, и
каждый P1 и P2 независимо представляет собой H или защитную группу гидроксила,
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя циклический защищенный диол;
или
X представляет собой N, и
P1 представляет собой H или защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино;
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя аминаль или 1,3-оксазолидин-2-он-5-ил.
Соединение пятого аспекта может представлять собой соединение формулы (IVA) или (IVB):
или их соль,
где
Y представляет собой йодид, бромид или трифторметансульфонат;
(a1) a обозначает R стереогенный центр, b обозначает S стереогенный центр, и Z представляет собой сульфонат, хлорид, бромид или йодид;
или
(a2) a обозначает S стереогенный центр, b обозначает R стереогенный центр, и Z представляет собой OR1, где R1 представляет собой защитную группу гидроксила;
(b1) R2 представляет собой H или защитную группу гидроксила, и R3 и R4 соединяют, образуя двойную связь;
или
(b2) R2 и R3 соединяют, образуя связь, и R4 представляет собой H;
каждый P3 независимо представляет собой H или защитную группу гидроксила, и X2 представляет собой оксо; или обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь; и
X представляет собой O, и
каждый P1 и P2 независимо представляет собой H или защитную группу гидроксила,
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя циклический защищенный диол;
или
X представляет собой N, и
P1 представляет собой H или защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино;
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя аминаль или 1,3-оксазолидин-2-он-5-ил.
Соединение пятого аспекта может представлять собой соединение формулы (VA) или (VB):
или их соль,
где
Y представляет собой SO2R1 или COOR1, где, когда Y представляет собой SO2R1, R1 представляет собой необязательно замещенный арил или необязательно замещенный неенолизируемый алкил, и когда Y представляет собой COOR1, R1 представляет собой необязательно замещенный алкил, необязательно замещенный арил или необязательно замещенный арилалкил;
каждый P3 независимо представляет собой H или защитную группу гидроксила, и X2 представляет собой оксо, или обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь;
R2 представляет собой необязательно замещенный алкил, необязательно замещенный арилалкил или необязательно замещенный арил; и
X представляет собой O, и
каждый P1 и P2 независимо представляет собой защитную группу гидроксила,
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя циклический защищенный диол;
или
X представляет собой N, и
P1 представляет собой H или защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино;
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя аминаль или 1,3-оксазолидин-2-он-5-ил.
Соединение формулы (VIA) или (VIB):
или их соль,
где
Y представляет собой йодид, бромид или трифторметансульфонат;
P4 представляет собой H или защитную группу гидроксила;
(a1) R3 представляет собой H или защитную группу гидроксила, R4 и R5 соединяют, образуя двойную связь, каждый P3 независимо представляет собой H или защитную группу гидроксила, и X2, вместе с атомом углерода, с которым он соединен, образует карбонил или -(CH(OR6))-, где R6 представляет собой H или защитную группу гидроксила;
или
(a2) R3 и R4 соединяют, образуя связь, R5 представляет собой H, и
каждый P3 независимо представляет собой H или защитную группу гидроксила, и X2, вместе с атомом углерода, с которым он соединен, образует карбонил или -(CH(OR6))-;
или
обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь;
(b1) Z представляет собой хлорид, бромид или йодид, и R1 и R2 соединяют, образуя связь;
или
(b2) Z и R2 соединяют, образуя двойную связь, и R1 представляет собой защитную группу гидроксила;
и
X представляет собой O, и
каждый P1 и P2 независимо представляет собой H или защитную группу гидроксила,
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя циклический защищенный диол;
или
X представляет собой N, и
P1 представляет собой H или защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино;
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя аминаль или 1,3-оксазолидин-2-он-5-ил.
Соединение пятого аспекта может представлять собой соединение формулы (VIIC):

или его соль,
где
Y1 представляет собой SO2R1 или COOR1, и R1 представляет собой необязательно замещенный алкил, необязательно замещенный арил или необязательно замещенный арилалкил;
R2 представляет собой -CH2-OP3, -CH=CH2, 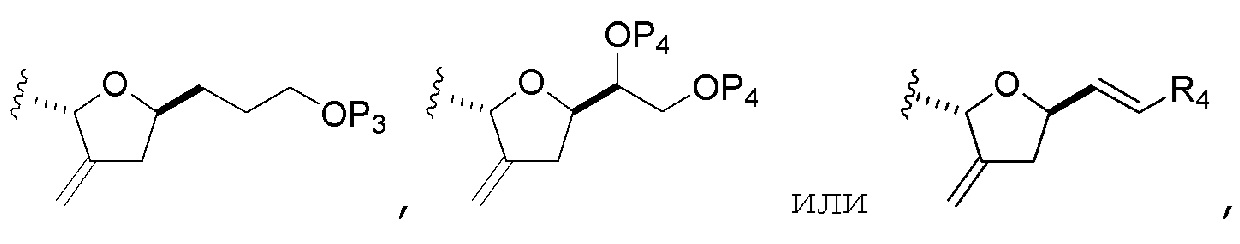
где P3 представляет собой H или защитную группу гидроксила; каждый P4 независимо представляет собой защитную группу гидроксила, или обе P4 группы, вместе с атомами, с которыми каждая из них соединена, соединяют, образуя циклический защищенный диол; и R4 представляет собой H или -CH2X2CH2CH=CH2, где X2 представляет собой O, -CH2-, или NP5, где P5 представляет собой сульфонил;
R3 представляет собой необязательно замещенный ацил; и
X представляет собой O, и
каждый P1 и P2 независимо представляет собой H или защитную группу гидроксила,
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя циклический защищенный диол;
или
X представляет собой N, и
P1 представляет собой H или защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино;
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя аминаль или 1,3-оксазолидин-2-он-5-ил.
Соединение пятого аспекта может представлять собой соединение формулы (VIIB):
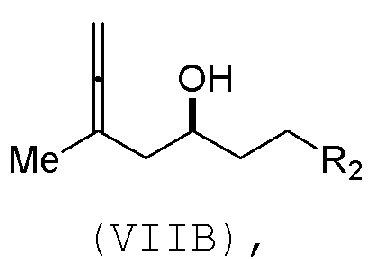
где
R3 представляет собой -CH2-OP3, 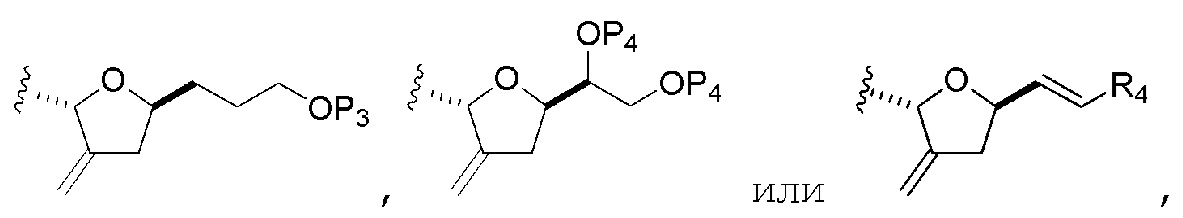
где
P3 представляет собой защитную группу гидроксила; каждый P4 независимо представляет собой защитную группу гидроксила, или обе P4 группы, вместе с атомами, с которыми каждая из них соединена, соединяют, образуя циклический защищенный диол; и R4 представляет собой H или -CH2X2CH2CH=CH2, где X2 представляет собой O, -CH2-, или NP5, где P5 представляет собой сульфонил.
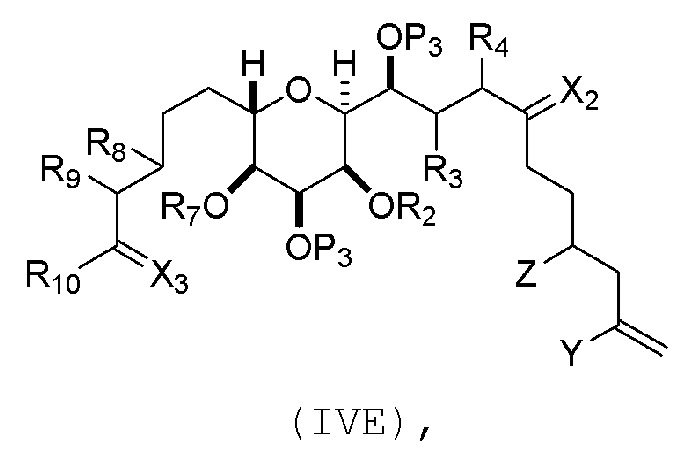
Соединение пятого аспекта может представлять собой соединение формулы (IVE):
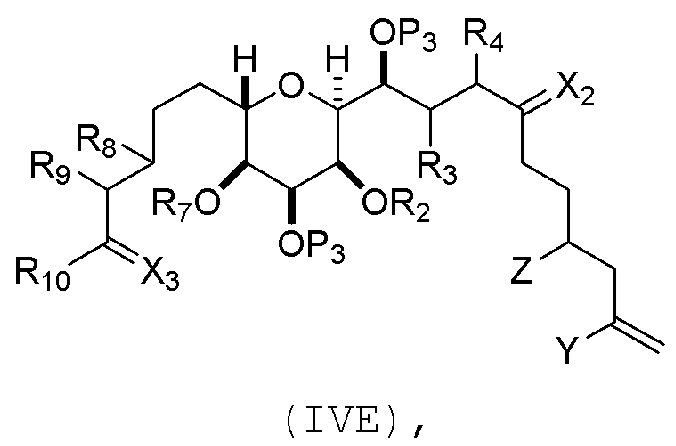
где
Y представляет собой йодид, бромид или трифторметансульфонат;
Z представляет собой эфир, сульфонат, хлорид, бромид или йодид;
каждый P3 независимо представляет собой H или защитную группу гидроксила, и X2 представляет собой оксо; или обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь; и
(a1) R2 представляет собой H или защитную группу гидроксила, R3 и R4 соединяют, образуя двойную связь;
или
(a2) R2 и R3 соединяют, образуя связь, и R4 представляет собой H;
(b1) R7 и R8 соединяют, образуя связь, и R9 представляет собой H;
или
(b2) R7 представляет собой H или защитную группу гидроксила, и R8 и R9 соединяют, образуя двойную связь;
(c1) X3 представляет собой оксо, и R10 представляет собой H или -OP5, где P5 представляет собой H или эфирную защитную группу гидроксила;
или
(c2) X3 и R10 вместе с атомами углерода, с которым они соединены, образуют -CH2OP6, где P6 представляет собой H или защитную группу гидроксила, и R10 представляет собой H.
Определения
Соединения, пригодные в настоящем изобретении, могут представлять собой изотопномеченные соединения. Подходящие изотопы могут включать водород, углерод, азот и кислород (например, 2H, 3H, 13C, 14C, 15N, 18O и 17O). Изотопномеченные соединения можно получить получением соединения, применяя легко доступный изотопномеченный реагент вместо изотопнонемеченого реагента.
Для любого из следующих химических определений, номер после символа атома показывает суммарное количество атомов данного элемента, которое присутствует в конкретной химической группе. Как будет ясно, другие атомы, такие как атомы водорода или замещающие группы, как описано в настоящем изобретении, могут присутствовать, при необходимости, удовлетворяя валентностям атомов. Например, незамещенная C2 алкильная группа имеет формулу-CH2CH3. При применении с группами, определенными в настоящем изобретении, ссылка на количество атомов углерода включает двухвалентный углерод в ацетальной и кетальной группах, но не включает карбонильный углерод в ацильной, эфирной, карбонатной или карбаматной группах. Ссылка на количество атомов кислорода, азота или серы в гетероарильной группе включает те атомы, которые образуют часть гетероциклического кольца.
Под “ацеталем” подразумевают -O-(CHR)-O-, где R представляет собой H, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный арил или необязательно замещенный арилалкил.
Под “ацилом” подразумевают -C(O)R, где R представляет собой H, алкил, алкенил, арил или арилалкил. В примерных ацильных группах, R представляет собой H, C1-12 алкил (например, C1-8, C1-6, C1-4, C2-7, C3-12 или C3-6 алкил), C2-12 алкенил (например, C2-8, C2-6, C2-4, C3-12 или C3-6 алкенил), C6-20 арил (например, C6-15, C6-10, C8-20 или C8-15 арил), моноциклический C1-6 гетероарил (например, моноциклический C1-4 или C2-6 гетероарил), C4-19 гетероарил (например, C4-10 гетероарил), (C6-15)арил(C1-6)алкил, (C1-6)гетероарил(C1-6)алкил или (C4-19)гетероарил(C1-6)алкил. Как определено в настоящем изобретении, любая гетероарильная группа, присутствующая в ацильной группе, содержит 1-4 гетероатома, независимо выбранные из O, N, и S. Ацильная группа может быть незамещенной или замещенной (например, необязательно замещенный ацил). В необязательно замещенной ацильной группе, заместитель R представляет собой H, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный арил или необязательно замещенный арилалкил.
Под “ацилирующим агентом” подразумевают соединение, которое реагирует с аминовой или гидроксильной группой, давая амид или эфир, соответственно. Ацилирующий агент имеет формулу R-LG, где R представляет собой ацил, и LG представляет собой галоген, карбонат или -OR’, где R’ представляет собой ацил.
Под “алкоксидом” подразумевают анионное соединение RO-, где R представляет собой алкил. Противоион для алкоксида может представлять собой катион щелочного металла, катион щелочноземельного металла или тетраалкиламмониевый катион. Алкоксид может быть необязательно замещенным тем же способом, как алкил.
Под “алкокси” подразумевают -OR, где R представляет собой алкил. Алкокси может быть необязательно замещенным тем же способом, как алкил.
Под “алкоксиалкилом” подразумевают -OR, где R представляет собой алкил, замещенный алкокси. Каждая часть алкоксиалкила может быть необязательно замещенной тем же способом, как алкил.
Под “алкилом” подразумевают нормальную или разветвленную насыщенную циклическую (т.е., циклоалкил) или ациклическую углеводородную группу из 1-12 атомов углерода, если не указано иначе. Примерные алкильные группы включают C1-8, C1-6, C1-4, C2-7, C3-12 и C3-6 алкил. Конкретные примеры включают метил, этил, 1-пропил, 2-пропил, 2-метил-1-пропил, 1-бутил, 2-бутил и подобные. Алкильная группа может быть необязательно замещенной 1, 2, 3, или 4 заместителями, выбранными из группы, состоящей из галогена, алкокси, арилокси, арилалкилокси, оксо, алкилтио, алкилендитио, алкиламино, [алкенил]алкиламино, [арил]алкиламино, [арилалкил]алкиламино, диалкиламино, силил, сульфонил, циано, нитро, карбоксил и азидо.
Под “алкиламино” подразумевают -NHR, где R представляет собой алкил. Под “[алкенил]алкиламино” подразумевают -NRR’, где R представляет собой алкил, и R’ представляет собой алкенил. Под “[арил]алкиламино” подразумевают -NRR’, где R представляет собой алкил, и R’ представляет собой арил. Под “[арилалкил]алкиламино” подразумевают -NRR’, где R представляет собой алкил, и R’ представляет собой арилалкил. Под “диалкиламино” подразумевают -NR2, где каждый R представляет собой независимо выбранный алкил.
Под “алкиленом” подразумевают двухвалентную алкильную группу. Алкиленовые группы могут быть необязательно замещенными тем же способом, как алкильные группы. Например, C1 алкиленовая группа представляет собой -CH2-.
Под “алкилендитио” подразумевают -S-алкилен-S-. Алкилендитио может быть необязательно замещенным тем же способом, как алкиленовая группа.
Под “алкилтио” подразумевают -SR, где R представляет собой алкил. Алкилтио может быть необязательно замещенным тем же способом, как алкильная группа.
Под “алкенилом” подразумевают нормальную или разветвленную циклическую или ациклическую углеводородную группу, если не указано иначе, из 2-12 атомов углерода и содержащую одну или более углерод-углеродных двойных связей. Примерные алкенильные группы включают C2-8, C2-7, C2-6, C2-4, C3-12 и C3-6 алкенил. Конкретные примеры включают этенил (т.е., винил), 1-пропенил, 2-пропенил (т.е., аллил), 2-метил-1-пропенил, 1-бутенил, 2-бутенил (т.е., кротил) и подобные. Алкенильная группа может быть необязательно замещенной тем же способом, как алкильные группы. Алкенильные группы, применяемые в любом контексте в настоящем изобретении, могут также быть замещены арильной группой.
Под “амидо” подразумевают -NHR, где R представляет собой ацил. Амидо может быть необязательно замещенным тем же способом, как ацил.
Под “аминалем” подразумевают -O-CR2-NR’-, где каждый R независимо представляет собой H, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный арил или необязательно замещенный арилалкил, или обе R группы вместе представляют собой необязательно замещенный алкилен, и R’ представляет собой H или N-защитную группу. В частности, R’ может представлять собой N-защитную группу (например, Boc).
Под “амино” подразумевают -NR2, где N и R2 соединяют, образуя азидо, или каждый R независимо представляет собой H или N-защитную группу, или обе R соединяют, образуя N-защитную группу. Амино может быть незащищенным, когда каждый R представляет собой H, или защищенным, когда, по меньшей мере, один R не является H. Таким образом, необязательно защищенный амино может представлять собой защищенный или незащищенный амино.
Под “арилом” подразумевают моноциклическую или многоциклическую кольцевую систему, содержащую одно или более ароматических колец, где кольцевая система может быть карбоциклической или гетероциклической. Гетероциклические арильные группы также называют гетероарильными группами. Гетероарильная группа содержит 1-4 атомов, независимо выбранные из O, N и S. Примеры карбоциклических арильных групп включают C6-20, C6-15, C6-10, C8-20 и C8-15 арил. Предпочтительная арильная группа представляет собой C6-10 арильную группу. Конкретные примеры карбоциклических арильных групп включают фенил, инданил, инденил, нафтил, фенантрил, антрацил и флуроренил. Примерные гетероарильные группы включают моноциклические кольца, содержащие 1-4 гетероатома, независимо выбранные из O, N, и S, и 1-6 атомов углерода (например, C1-6, C1-4 и C2-6). Моноциклические гетероарильные группы предпочтительно содержат 5-9 кольцевых членов. Другие гетероарильные группы предпочтительно содержат 4-19 атомов углерода (например, C4-10). Конкретные примеры гетероарильных групп включают пиридинил, хинолинил, дигидрохинолинил, изохинолинил, хиназолинил, дигидрохиназолил и тетрагидрохиназолил. Арильная группа может быть необязательно замещенной 1, 2, 3, 4 или 5 заместителями, выбранными из группы, состоящей из алкила, алкенила, арила, арилалкила, галогена, алкокси, арилокси, арилалкилокси, алкилтио, алкилендитио, алкиламино, [алкенил]алкиламино, [арил]алкиламино, [арилалкил]алкиламино, диалкиламино, силила, сульфонила, циано, нитро, карбоксил и азидо.
Под “арилалкилом” подразумевают -R’R”, где R’ представляет собой алкилен, и R” представляет собой арил. Арилалкил может быть необязательно замещенным тем же способом, как определено для каждой R’ и R” группы.
Под “арилалкилокси” подразумевают -OR, где R представляет собой арилалкил. Арилалкилокси может быть необязательно замещенным тем же способом, как определено для арилалкила.
Под “арилокси” подразумевают -OR, где R представляет собой арил. Арилокси может быть необязательно замещенным тем же способом, как арил.
Под “азидо” подразумевают -N3.
Под “боронатом” подразумевают -OBRO-, где R представляет собой алкил, алкенил, арил, арилалкил, алкокси или 2,6-диацетамидофенил. Боронат может быть замещенным, когда R представляет собой замещенный алкил, замещенный алкенил, замещенный арил, замещенный арилалкил или замещенный алкокси. Альтернативно, боронат может быть незамещенным, когда R представляет собой незамещенный алкил, незамещенный алкенил, арил, незамещенный арилалкил, незамещенный алкокси или 2,6-диацетамидофенил.
Под “карбаматом” подразумевают защитную группу гидроксила, имеющую формулу -OC(O)NR2, или защитную группу амина, имеющую формулу -NR’-C(O)OR, где каждый R и R’ независимо представляет собой H, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный арил или необязательно замещенный арилалкил.
Под “карбонатом” подразумевают -OC(O)OR, где R представляет собой необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный арил или необязательно замещенный арилалкил.
Под “карбонилом” подразумевают -C(O)-.
Под “карбоксилом” подразумевают -C(O)OH, в виде свободной кислоты, в ионизированной или солевой форме.
Под “карбоновой кислотой ” подразумевают R-OH, где R представляет собой необязательно замещенный ацил.
Под “ангидридом карбоновой кислоты” подразумевают R-O-R, где каждый R независимо представляет собой необязательно замещенный ацил.
Под “дикарбонилом” подразумевают -C(O)-C(O)-.
Под “сложным эфиром” подразумевают -OC(O)R, где -C(O)R представляет собой необязательно замещенную ацильную группу.
Под “эфиром” подразумевают -OR, где R представляет собой алкил, алкенил, арилалкил, силил или 2-тетрагидропиранил. Эфир может быть необязательно замещен, как определено для каждой R группы.
Под “галогеном” подразумевают фтор, хлор, бром или йод.
Под “защитной группой гидроксила” подразумевают любую группу, способную защищать атом кислорода, с которым он соединен, от реагирования или связывания. Защитные группы гидроксила являются известными в данной области техники, например, как описано в Wuts, Greene's Protective Groups in Organic Synthesis, Wiley-Interscience, 4ое издание, 2006. Примерные защитные группы (с атомом кислорода, с которым они соединены) независимо выбраны из группы, состоящей из эфиров, карбонатов, карбаматов, сульфонатов и эфиров. В примерных эфирных защитных группах гидроксила, R ацильной группы представляет собой C1-12 алкил (например, C1-8, C1-6, C1-4, C2-7, C3-12 и C3-6 алкил), C2-12 алкенил (например, C2-8, C2-6, C2-4, C3-12 и C3-6 алкенил), карбоциклический C6-20 арил (например, C6-15, C6-10, C8-20 и C8-15 арил), моноциклический C1-6 гетероарил (например, C1-4 и C2-6 гетероарил), C4-19 гетероарил (например, C4-10 гетероарил), (C6-15)арил(C1-6)алкил, (C4-19)гетероарил(C1-6)алкил, или (C1-6)гетероарил(C1-6)алкил. Конкретные примеры ацильных групп для применения в эфирах включают формил, бензоилформил, ацетил (например, незамещенный или хлорацетил, трифторацетил, метоксиацетил, трифенилметоксиацетил и п-хлорфеноксиацетил), 3-фенилпропионил, 4-оксопентаноил, 4,4-(этилендитио)пентаноил, пивалоил (Piv), винилпивалоил, кротонил, 4-метоксикротонил, нафтоил (например, 1- или 2-нафтоил) и бензоил (например, незамещенный или замещенный, например, п-метоксибензоил, фталоил (включая соли, такие как триэтиламиновая и калиевая), п-бромбензоил и 2,4,6-триметилбензоил). Как определено в настоящем изобретении, любая гетероарильная группа, присутствующая в эфирной группе, содержит 1-4 гетероатома, независимо выбранные из O, N и S. В примерных карбонатных защитных группах гидроксила, R представляет собой C1-12 алкил (например, C1-8, C1-6, C1-4, C2-7, C3-12 и C3-6 алкил), C2-12 алкенил (например, C2-8, C2-6, C2-4, C3-12 и C3-6 алкенил), карбоциклический C6-20 арил (например, C6-15, C6-10, C8-20 и C8-15 арил), моноциклический C1-6 гетероарил (например, C1-4 и C2-6 гетероарил), C4-19 гетероарил (например, C4-10 гетероарил), (C6-15)арил(C1-6)алкил, (C4-19)гетероарил(C1-6)алкил, или (C1-6)гетероарил(C1-6)алкил. Конкретные примеры включают метил, 9-флуоренилметил, этил, 2,2,2-трихлорэтил, 2-(триметилсилил)этил, 2-(фенилсульфонил)этил, винил, аллил, трет-бутил, п-нитробензил и бензилкарбонаты. Как определено в настоящем изобретении, любая гетероарильная группа, присутствующая в карбонатной группе, содержит 1-4 гетероатома, независимо выбранные из O, N и S. В примерных карбаматных защитных группах гидроксила, каждый R независимо представляет собой H, C1-12 алкил (например, C1-8, C1-6, C1-4, C2-7, C3-12 и C3-6 алкил), C2-12 алкенил (например, C2-8, C2-6, C2-4, C3-12 и C3-6 алкенил), карбоциклический C6-20 арил (например, C6-15, C6-10, C8-20, и C8-15 арил), моноциклический C1-6 гетероарил (например, C1-4 и C2-6 гетероарил), C4-19 гетероарил (например, C4-10 гетероарил), (C6-15)арил(C1-6)алкил, (C4-19)гетероарил(C1-6)алкил или (C1-6)гетероарил(C1-6)алкил. Конкретные примеры включают N-фенил и N-метил-N-(о-нитрофенил)карбаматы. Как определено в настоящем изобретении, любая гетероарильная группа, присутствующая в карбаматной группе, содержит 1-4 гетероатома, независимо выбранные из O, N и S. Примерные эфирные защитные группы гидроксила включают C1-12 алкил (например, C1-8, C1-6, C1-4, C2-7, C3-12 и C3-6 алкил), C2-12 алкенил (например, C2-8, C2-6, C2-4, C3-12 и C3-6 алкенил), (C6-15)арил(C1-6)алкил, (C4-19)гетероарил(C1-6)алкил, (C1-6)гетероарил(C1-6)алкил, (C1-6)алкокси(C1-6)алкил, (C1-6)алкилтио(C1-6)алкил, (C6-10)арил(C1-6)алкокси(C1-6)алкил и силил (например, три(C1-6 алкил)силил, три(C6-10 арил или C1-6 гетероарил)силил, ди(C6-10 арил или C1-6 гетероарил)(C1-6 алкил)силил и (C6-10 арил или C1-6 гетероарил)ди(C1-6 алкил)силил). Конкретные примеры алкильных эфиров включают метил и трет-бутил, и пример алкенильного эфира представляет собой аллил. Эфирные защитные группы гидроксила можно применять для защиты карбоксильных групп (например, C1-12 алкил (например, C1-8, C1-6, C1-4, C2-7, C3-12 и C3-6 алкил), (C6-15)арил(C1-6)алкил, (C1-6)алкокси(C1-6)алкил, (C1-6)алкилтио(C1-6)алкил или (C6-10)арил(C1-6)алкокси(C1-6)алкил). Примеры алкоксиалкилов и алкилтиоалкилов, которые можно применять в качестве эфирных защитных групп гидроксила, включают метоксиметил, метилтиометил, (2-метоксиэтокси)метил и β-(триметилсилил)этоксиметил. Примеры арилалкильных групп, которые можно применять в качестве эфирных защитных групп гидроксила, включают бензильный, п-метоксибензильный (MPM), 3,4-диметоксибензильный, трифенилметильный (тритильный), о-нитробензильный, п-нитробензильный, п-галогенбензильный, 2,6-дихлорбензильный, п-цианобензильный, нафтилметильный и 2- и 4-пиколильные эфиры. Конкретные примеры силиловых эфиров включают триметилсилильный (TMS), триэтилсилильный (TES), трет-бутилдиметилсилильный (TBS), трет-бутилдифенилсилильный (TBDPS), триизопропилсилильный (TIPS) и трифенилсилильный (TPS) эфиры. Пример арилалкилоксиалкилового эфира представляет собой бензилоксиметиловый эфир. Как определено в настоящем изобретении, любая гетероарильная группа, присутствующая в эфирной группе, содержит 1-4 гетероатома, независимо выбранные из O, N и S. Вицинальные или 1,3-диолы можно защищать диолзащитной группой (например, получая “циклический защищенный диол”), такой как ацеталь (например, содержащий C1-6 алкилен), кеталь (например, содержащий C3-6 алкилен или C3-6 циклоалкил), циклический силилен, циклический карбонат и циклический боронат. Примеры ацетальных и кетальных групп включают метилендиоксо, этилидендиоксо, бензилидендиоксо, изопропилидендиоксо, циклогексилидендиоксо и циклопентилидендиоксо. Пример циклического силилена представляет собой ди-трет-бутилсилилен. Другая диолзащитная группа представляет собой 1,1,3,3-тетраизопропилсилоксандиил. Примеры циклических боронатов включают метиловый, этиловый, фениловый и 2,6-диацетамидофениловый боронаты. Защитные группы можно замещать, как известно в данной области техники; например, арильные и арилалкильные группы, такие как фенил, бензил, нафтил или пиридинил, можно замещать C1-6 алкилом, C1-6 алкокси, нитро, циано, карбоксилом или галогеном. Алкильные группы, такие как метил, этил, изопропил, н-пропил, трет-бутил, н-бутил и втор-бутил, и алкенильные группы, такие как винил и аллил, можно также замещать оксо, арилсульфонилом, галогеном и триалкилсилильной группой. Предпочтительные защитные группы представляют собой TBS и Piv. Защитные группы, которые являются ортогональными, удаляют в различных условиях, как известно в данной области техники.
Под “имидо” подразумевают -NR2, где каждый R независимо представляет собой необязательно замещенный ацил.
Под “кеталем” подразумевают -O-CR2-O-, где каждый R независимо представляет собой необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный арил или необязательно замещенный арилалкил, или обе R группы вместе представляют собой необязательно замещенный алкилен.
Под “макроциклизацией” подразумевают реакцию, превращающую немакроциклическое соединение в соединение, содержащее, по меньшей мере, одно n-членное кольцо, где n равен или является большим, чем 16.
Под “неенолизируемой” подразумевают группу, которая, или отдельно или в комбинации с группой, с которой она соединена, не может образовывать енол посредством последовательности депротонирования/протонирования. Например, ”неенолизируемый алкил” может быть соединен с сульфоновой группой или карбонильной группой через четвертичный атом углерода (т.е., атом углерода, который не соединен с атомом водорода).
Под “немакроциклическим” подразумевают соединение, не содержащее колец или содержащее одно или более m-членных колец, где m является меньшим или равным 15.
Под “N-защитной группой” подразумевают группу, защищающую атом азота в молекуле от участия в одной или более нежелательных реакций в процессе химического синтеза (например, реакциях окисления или определенных нуклеофильных и электрофильных замещениях). Общепринятые N-защитные группы описаны в Wuts, Greene's Protective Groups in Organic Synthesis, Wiley-Interscience, 4ое издание, 2006. Примерные N-защитные группы включают ацил (например, формил, ацетил, трифторацетил, пропионил, пивалоил, трет-бутилацетил, 2-хлорацетил, 2-бромацетил, трифторацетил, трихлорацетил, фталил, о-нитрофеноксиацетил, α-хлорбутирил, бензоил, 4-хлорбензоил и 4-бромбензоил); содержащие сульфонил группы (например, бензолсульфонил, п-толуолсульфонил, о-нитробензолсульфонил и п-нитробензолсульфонил); образующие карбамат группы (например, бензилоксикарбонил, п-хлорбензилоксикарбонил, п-метоксибензилоксикарбонил, п-нитробензилоксикарбонил, 2-нитробензилоксикарбонил, п-бромбензилоксикарбонил, 3,4-диметоксибензилоксикарбонил, 3,5-диметоксибензилоксикарбонил, 2,4-диметоксибензилоксикарбонил, 4-метоксибензилоксикарбонил, 2-нитро-4,5-диметоксибензилоксикарбонил, 3,4,5-триметоксибензилоксикарбонил, 1-(п-бифенилил)-1-метилэтоксикарбонил, α,α-диметил-3,5-диметоксибензилоксикарбонил, бензгидрилоксикарбонил, трет-бутилоксикарбонил, диизопропилметоксикарбонил, изопропилоксикарбонил, этоксикарбонил, метоксикарбонил, аллилоксикарбонил, 2,2,2-трихлорэтоксикарбонил, феноксикарбонил, 4-нитрофеноксикарбонил, флуоренил-9-метоксикарбонил, циклопентилоксикарбонил, адамантилоксикарбонил, циклогексилоксикарбонил и фенилтиокарбонил), арилалкил (например, трифенилметил); силильные группы (например, триметилсилил); и образующие имин группы (например, дифенилметилен). Предпочтительные N-защитные группы представляют собой ацетил, бензоил, фенилсульфонил, п-толуолсульфонил, п-нитробензолсульфонил, о-нитробензолсульфонил, трет-бутилоксикарбонил (Boc) и бензилоксикарбонил (Cbz).
Под “1,3-оксазолидин-2-он-5-илом” подразумевают 1,3-оксазолидин-2-он-5-ил, в котором атом азота замещен H или N-защитной группой (например, Boc).
Под “оксо” или (O) подразумевают =O.
Под “фармацевтически приемлемой солью” подразумевают соль, по результатам тщательной медицинской оценки пригодную для применения в контакте с тканями человека и животных без чрезмерной токсичности, раздражения, аллергической реакции и подобных и соответствующую приемлемому соотношению риск/польза. Фармацевтически приемлемые соли являются хорошо известными в данной области техники. Например, фармацевтически приемлемые соли описаны в: Berge et al., J. Pharmaceutical Sciences 66:1-19, 1977 и в Pharmaceutical Salts: Properties, Selection, and Use, (Eds. P.H. Stahl и C.G. Wermuth), Wiley-VCH, 2008. Репрезентативные соли присоединения кислоты включают ацетатную, адипатную, альгинатную, аскорбатную, аспартатную, бензолсульфонатную, бензоатную, бисульфатную, боратную, бутиратную, камфоратную, камфорсульфонатную, цитратную, циклопентанпропионатную, диглюконатную, додецилсульфатную, этансульфонатную, фумаратную, глюкогептонаты, глицерофосфатную, гемисульфатную, гептаноатную, гексаноатную, гидробромидную, гидрохлоридную, гидройодидную, 2-гидроксиэтансульфонатную, лактобионатную, лактатную, лауратную, лаурилсульфатную, малатную, малеатную, малонатную, метансульфонатную, 2-нафталинсульфонатную, никотинатную, нитратную, олеатную, оксалатную, пальмитатную, памоатную, пектинатную, персульфатную, 3-фенилпропионатную, фосфатную, пикратную, пивалатную, пропионатную, стеаратную, сукцинатную, сульфатную, тартратную, тиоцианатную, толуолсульфонатную, ундеканоатную, валератную соли и подобные. Предпочтительная соль представляет собой мезилатную соль.
Под “силилом” подразумевают -SiR3, где каждый R независимо представляет собой алкил, алкенил, арил или арилалкил. Примеры силильных групп включают три(C1-6 алкил)силил, три(C6-10 арил или C1-6 гетероарил)силил, ди(C6-10 арил или C1-6 гетероарил)(C1-6 алкил)силил и (C6-10 арил или C1-6 гетероарил)ди(C1-6 алкил)силил. Ясно, что, когда силильная группа содержит две или более алкильных, алкенильных, арильных, гетероарильных или арилалкильных групп, данные группы выбраны независимо. Как определено в настоящем изобретении, любая гетероарильная группа, присутствующая в силильная группа, содержит 1-4 гетероатома, независимо выбранные из O, N и S. Силил может быть необязательно замещенным тем же способом, как определено для каждой R группы.
Под “силиленом” подразумевают -SiR2-, где каждый R независимо представляет собой алкил, алкенил, арил, арилалкил или алкокси. Под “диалкилсилиленом” подразумевают силилен, где каждый R представляет собой алкил. Силилен может быть необязательно замещенным тем же способом, как определено для каждой R группы.
Под “сильным основанием” подразумевают основание Бренстеда, сопряженная кислота которого имеет pKa, который является большим или равным 13. Неограничивающие примеры сильных оснований включают алкил щелочные металлы (например, бутил лития или основание Шлоссера), реагенты Гриньяра (например, алкилмагнийгалогенид), алкоксиды (например, третичные алкоксиды, такие как трет-бутоксид), амиды (например, диизопропиламид, тетраметилпиперидин, или бис(триметилсилил)амин) и фосфазеновые основания (например, основание Швезингера).
Под “сульфонамидом” подразумевают -NR, где R представляет собой сульфонил.
Под “сульфонатом” подразумевают -OS(O)2R, где R представляет собой необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный арил или необязательно замещенный арилалкил. В примерных сульфонатах, R представляет собой C1-12 алкил (например, C1-8, C1-6, C1-4, C2-7, C3-12 или C3-6 алкил), C2-12 алкенил (например, C2-8, C2-6, C2-4, C3-12 или C3-6 алкенил), карбоциклический C6-20 арил (например, C6-15, C6-10, C8-20 или C8-15 арил), моноциклический C1-6 гетероарил (например, C1-4 и C2-6 гетероарил), C4-19 гетероарил (например, C4-10 гетероарил), (C6-15)арил(C1-6)алкил, (C4-19)гетероарил(C1-6)алкил или (C1-6)гетероарил(C1-6)алкил. Как определено в настоящем изобретении, любая гетероарильная группа, присутствующая в сульфонатной группе, содержит 1-4 гетероатома, независимо выбранные из O, N и S.
Под “сульфонилом” подразумевают -S(O)2R, где R представляет собой необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный арил, необязательно замещенный арилалкил или силил. Предпочтительные R группы для сульфонила являются такими же, как группы, описанные выше для сульфонатов.
Под “тиоацеталем” подразумевают -S-(CHR)-S-, где R представляет собой H, необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный арил или необязательно замещенный арилалкил.
Под “тиокеталем” подразумевают -S-(CR2)-S-, где каждый R независимо представляет собой необязательно замещенный алкил, необязательно замещенный алкенил, необязательно замещенный арил или необязательно замещенный арилалкил.
Под “трифлатом” подразумевают трифторметансульфонат.
Величины pKa, приведенные в настоящем описании, относятся к величинам pKa сопряженной кислоты Бренстеда в воде при комнатной температуре, если не указано иначе.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1 представляет собой схему, показывающую получение эрибулина через макроциклизацию с образованием C.15-C.16 связи.
Фигура 2 представляет собой схему, показывающую получение эрибулина через макроциклизацию с образованием C.2-C.3 связи.
Фигура 3 представляет собой схему, показывающую получение эрибулина через макроциклизацию с образованием C.3-C.4 связи.
Фигура 4 представляет собой схему, показывающую получение эрибулина через макроциклизацию с образованием C.19-C.20 связи.
Фигура 5 представляет собой схему, показывающую получение эрибулина через макроциклизацию с образованием C.0-C.1 связи.
Фигура 6 представляет собой схему, показывающую получение эрибулина через макроциклизацию с образованием C.26-C.27 связи.
Фигура 7 представляет собой изображение сокристалла 2-((2R,3S,3aS,4aS,7R,8aR,9S,9aS)-2-((2,2-диметил-1,3-диоксолан-4-ил)метил)-3,9-дигидроксидекагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)этилпивалата и его C3-эпимера.
ПОДРОБНОЕ ОПИСАНИЕ
Настоящее изобретение относится к способам получения эрибулина или его фармацевтически приемлемой соли (например, мезилата эрибулина) посредством макроциклизаций. Макроциклизации настоящего изобретения включают воздействие на немакроциклическое промежуточное соединение реакции с образованием углерод-углеродной связи (например, каталитический метатезис олефинов с замыканием кольца, реакция олефинирования (например, олефинирование по Хорнера-Вадсворта-Эммонса), реакция Нозаки-Хияма-Киши или реакция Дикмана), получая макроциклическое промежуточное соединение (например, соединение формулы (IB), (IIB), (IIIB), (IVB), (VB) или (VIB)). Реакция образования углерод-углеродной связи относится к C.0-C.1, C.2-C.3, C.3-C.4, C.15-C.16, C.19-C.20 или C.26-C.27 связи в структуре эрибулина или его фармацевтически приемлемой соли. Схема нумерации атомов углерода эрибулина и его фармацевтически приемлемых солей показана на схеме 1.
Схема 1
Настоящее изобретение также относится к промежуточным соединениям в получении эрибулина и способам их получения, как описано в настоящем изобретении.
Макроциклизация с образованием C.15-C.16 связи
Реакция макроциклизации настоящего изобретения может представлять собой реакцию образования углерод-углеродной связи (например, каталитический метатезис олефинов с замыканием кольца (RCM)), которая относится к C.15-C.16 связи в эрибулине или его фармацевтически приемлемой соли (например, мезилате эрибулина). Общая последовательность получения, включающая RCM, которую можно применять для получения эрибулина или его фармацевтически приемлемой соли (например, мезилатной соли) показана на фигуре 1. Как показано на фигуре 1, немакроциклическое промежуточное соединение в получении эрибулина может представлять собой соединение формулы (IA):
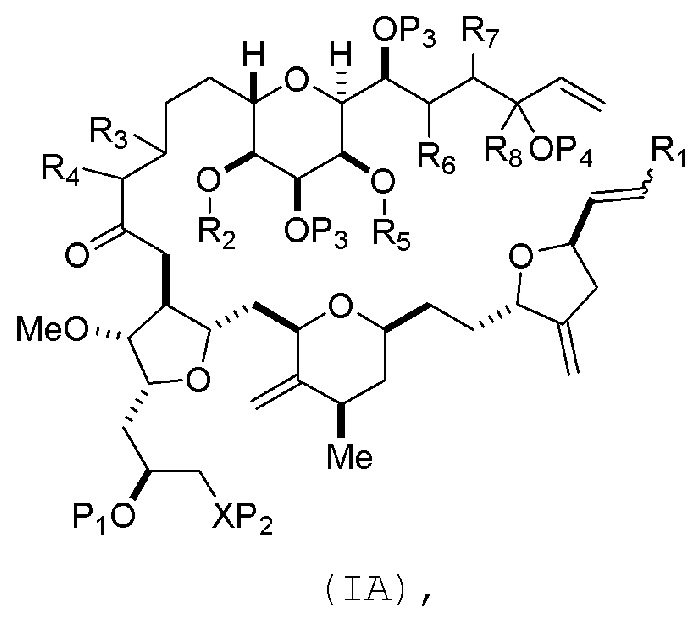
где
R1 представляет собой H или -CH2X1CH2CH=CH2, в которой X1 представляет собой O, -C(R9)2- или NP5, и где каждый R9 независимо представляет собой H или -COOR10, P5 представляет собой N-защитную группу и R10 представляет собой C1-6 алкил;
(a1) R2 представляет собой H или защитную группу гидроксила, R3 представляет собой C1-6 алкиловый эфир, и R4 представляет собой H;
(a2) R2 представляет собой H или защитную группу гидроксила, и R3 и R4 соединяют, образуя двойную связь;
или
(a3) R2 и R3 соединяют, образуя связь, и R4 представляет собой H;
(b1) R5 представляет собой H или защитную группу гидроксила, и R6 и R7 соединяют, образуя двойную связь;
или
(b2) R5 и R6 соединяют, образуя связь, и R7 представляет собой H;
(c1) R8 представляет собой H, и P4 представляет собой H или защитную группу гидроксила;
или
(c2) R8 и P4 соединяют, образуя двойную связь;
каждый P3 независимо представляет собой H или защитную группу гидроксила; и
X представляет собой O, и
каждый P1 и P2 независимо представляет собой H или защитную группу гидроксила,
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя циклический защищенный диол;
или
X представляет собой N, и
P1 представляет собой H или защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино;
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя аминаль или 1,3-оксазолидин-2-он-5-ил.
Промежуточное соединение в получении эрибулина может представлять собой соединение формулы (IB), которое можно получить реакцией соединения формулы (IA) с катализатором метатезиса олефинов (например, рутений-карбеновым комплексом). Соединение формулы (IB) имеет следующую структуру:
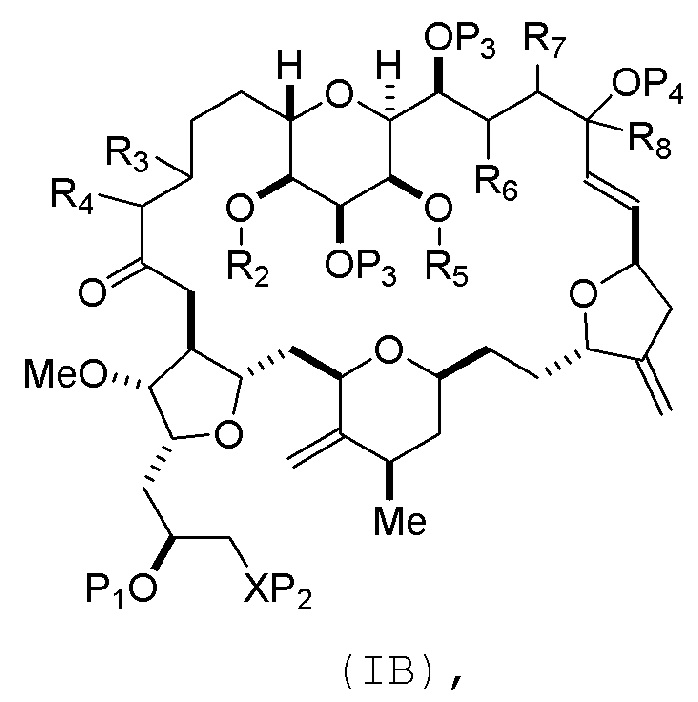
где все переменные представляют собой, как определено для соединения формулы (IA).
Катализаторы, которые можно применять для превращения соединения формулы (IA) в соединение формулы (IB), могут представлять собой катализаторы, известные в данной области техники. Катализаторы метатезиса олефинов включают Ru-карбеновые комплексы (например, катализаторы Граббса и Ховейда-Граббса).
Соединение формулы (IB) может реагировать с агентом, удаляющим защитную группу гидроксила, и, необязательно, окисляющим агентом (например, когда R8 представляет собой H в соединении формулы (IB)), способным превращать спирт в карбонильную группу (например, способным превращать аллиловый спирт в енон), давая соединение формулы (IC):
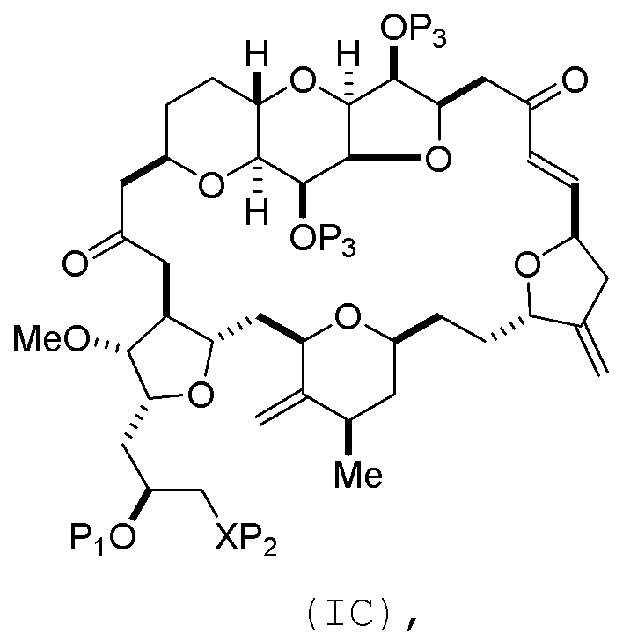
где P1, P2, P3 и X представляют собой, как определено для соединения формулы (IB).
Агент, удаляющий защитную группу гидроксила, применяемый на стадии образования соединения формулы (IC), может представлять собой Кислоту Бренстеда (например, карбоновую кислоту, такую как карбоновая кислота, имеющая pKa 4±1).
Соединение формулы (ID) можно получить из соединения формулы (IC) способом получения, включающим реакцию соединения формулы (IC) с 1,4-восстанавливающим агентом, получая соединение формулы (ID):
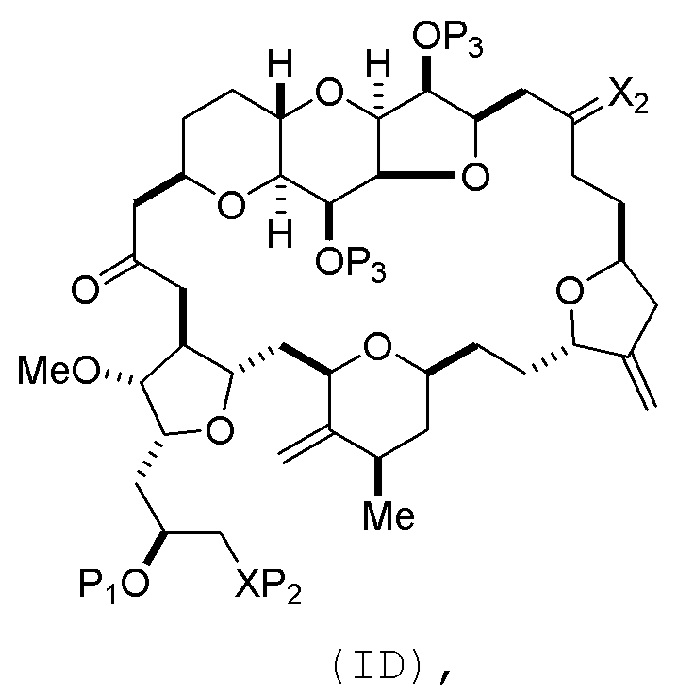
где P1, P2 и X представляют собой, как определено для соединения формулы (IC); и
каждый P3 независимо представляет собой H или защитную группу гидроксила, и X2 представляет собой оксо; или обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь.
1,4-Восстанавливающие агенты включают гидриды меди (I), которые можно выделить (например, реагент Страйкера) или получить in situ (например, из соли меди (I) или меди (II) и источника гидрида). Каталитические количества соли меди (или соли меди (I) или меди (II)) в комбинации с стехиометрическими или сверхстехиометрическими количествами источника гидрида (например, боргидридная соль, боран, PMHS или гидросилан (например, Ph2SiH2)). Неограничивающий пример условий реакции, которые можно применять для превращения соединения формулы (IC) в соединение формулы (ID), описаны, например, в Baker et al., Org. Lett., 10:289-292, 2008, описание которой включено в настоящее изобретение с помощью ссылки. Другие металлы можно применять для катализирования 1,4-восстановления соединения формулы (IC), получая соединение формулы (ID), например, Ru, Pd, и Ir соединения.
Если P1 представляет собой защитную группу гидроксила в соединении формулы (ID), соединение формулы (ID) может реагировать с агентом, удаляющим защитную группу гидроксила, давая:

где
обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь; и
X представляет собой O, и каждый P1 и P2 представляет собой H,
или
P1 представляет собой H, и X и P2 соединяют, образуя необязательно защищенный амино.
Соединение формулы (ID) (например, соединение формулы (ID), в котором X представляет собой O, P2 представляет собой H, и обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь) можно аминировать, получая эрибулин, например, применяя сульфонилирование, с последующей обработкой источником азота (например, аммиаком (например, водным аммиаком) или сульфаминовой кислотой). Когда источник азота не является аммиаком или сульфаминовой кислотой, можно применять дополнительный контакт с агентом, деблокирующим амино, получая эрибулин. Соединение формулы (ID), в котором P1 представляет собой защитную группу гидроксила, может реагировать с агентом, удаляющим защитную группу гидроксила, перед реакцией аминирования. Альтернативно, соединение формулы (ID) (в котором P1 представляет собой H, X и P2 соединяют, образуя защищенный амино, и обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь) может реагировать с агентом, деблокирующим амино, давая эрибулин, как описано в настоящем изобретении. Затем, мезилат эрибулина можно получить солеобразованием эрибулина с метансульфокислотой. Детали реакций аминирования и солеобразования описаны ниже.
Соединение формулы (IA) можно получить из соединения формулы (IE):
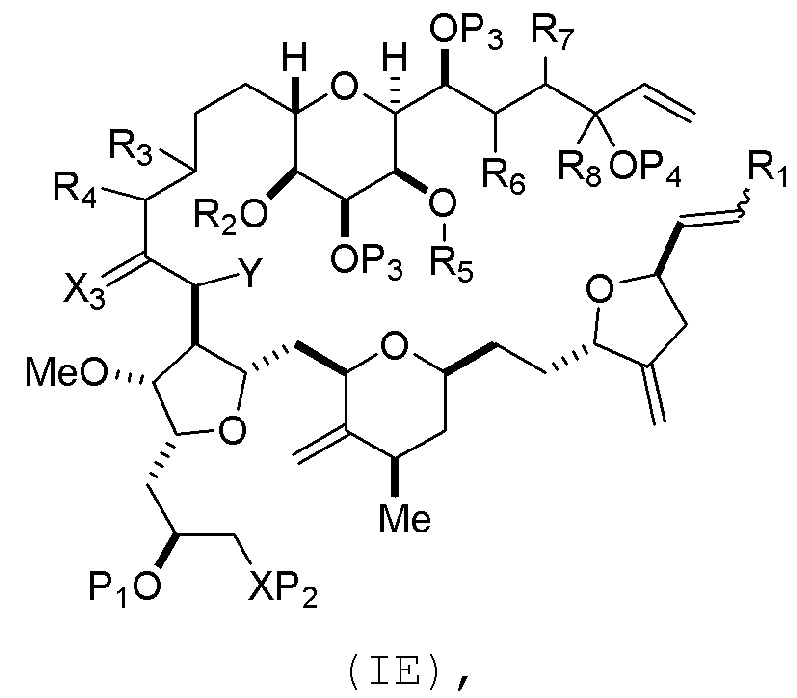
где
R1 представляет собой H или -CH2X1CH2CHCH2, где X1 представляет собой O, -C(R9)2- или NP5, и где каждый R9 независимо представляет собой H или -COOR10, P5 представляет собой N-защитную группу, и R10 представляет собой C1-6 алкил;
(a1) R2 представляет собой H или защитную группу гидроксила, R3 представляет собой C1-6 алкиловый эфир, и R4 представляет собой H;
(a2) R2 представляет собой H или защитную группу гидроксила, и R3 и R4 соединяют, образуя двойную связь;
или
(a3) R2 и R3 соединяют, образуя связь, и R4 представляет собой H;
(b1) R5 представляет собой H или защитную группу гидроксила, и R6 и R7 соединяют, образуя двойную связь;
или
(b2) R5 и R6 соединяют, образуя связь, и R7 представляет собой H;
(c1) R8 представляет собой H, и P4 представляет собой H или защитную группу гидроксила;
или
(c2) R8 и P4 соединяют, образуя двойную связь;
каждый P3 независимо представляет собой H или защитную группу гидроксила;
Y представляет собой SO2R11, и R11 необязательно представляет собой замещенный арил или необязательно замещенный неенолизируемый алкил; или Y представляет собой COOR11, и R11 представляет собой необязательно замещенный алкил, необязательно замещенный арил или необязательно замещенный арилалкил;
X3 представляет собой оксо, или X3, вместе с атомом углерода, с которым он соединен, образует -(CH(OH))-; и
X представляет собой O, и
каждый P1 и P2 независимо представляет собой H или защитную группу гидроксила,
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя циклический защищенный диол;
или
X представляет собой N, и
P1 представляет собой H или защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино;
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя аминаль или 1,3-оксазолидин-2-он-5-ил.
В некоторых вариантах осуществления, получение соединения формулы (IA) из соединения формулы (IE) включает реакцию декарбоксилирования (где X3 представляет собой оксо, и Y представляет собой COOR11) или реакцию десульфонилирования (где X3 представляет собой оксо, и Y представляет собой SO2R11). Условия реакции декарбоксилирования или десульфонилирования могут представлять собой условия, описанные в настоящем изобретении. Получение соединения формулы (IA) из соединения формулы (IE) может дополнительно включать окисление соединения формулы (IE) (например, соединения формулы (IE), в котором X3, вместе с атомом углерода, с которым он соединен, образует -(CH(OH))-), например, контактом с окисляющим агентом, способным окислять спирт до карбонильной группы.
Макроциклизация с образованием C.2-C.3 связи
Реакция макроциклизации настоящего изобретения может представлять собой реакция образования углерод-углеродной связи (например, реакцию Хорнера-Вадсворта-Эммонса), которая относится к C.2-C.3 связи в эрибулине или его фармацевтически приемлемой соли (например, мезилате эрибулина). Общая последовательность получения, включающая реакцию Хорнера-Вадсворта-Эммонса, которую можно применять для получения эрибулина или его фармацевтически приемлемой соли (например, мезилатной соли), показана на фигуре 2. Как показано на фигуре 2, немакроциклическое промежуточное соединение может представлять собой соединение формулы (IIA):
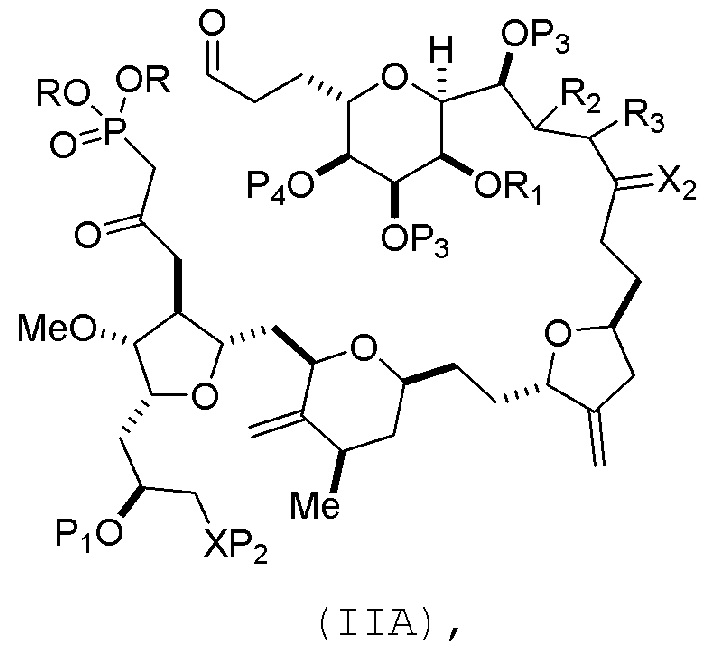
где
каждый R независимо представляет собой необязательно замещенный алкил или необязательно замещенный арил;
(i) R1 представляет собой H или защитную группу гидроксила, и R2 и R3 соединяют, образуя двойную связь;
или
(ii) R1 и R2 соединяют, образуя связь, и R3 представляет собой H;
каждый P3 независимо представляет собой H или защитную группу гидроксила, и X2 представляет собой оксо; или обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь;
P4 представляет собой H или защитную группу гидроксила; и
X представляет собой O, и
каждый P1 и P2 независимо представляет собой H или защитную группу гидроксила,
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя циклический защищенный диол;
или
X представляет собой N, и
P1 представляет собой H или защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино;
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя аминаль или 1,3-оксазолидин-2-он-5-ил.
Промежуточное соединение в получении эрибулина может представлять собой соединение формулы (IIB), которое можно получить из соединения формулы (IIA), применяя реакцию Хорнера-Вадсворта-Эммонса. Соединение формулы (IIB) имеет следующую структуру:
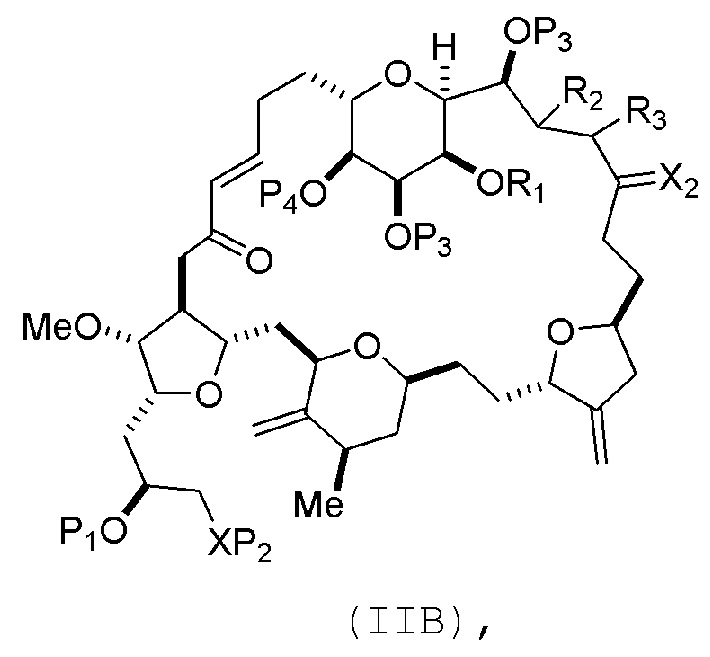
где все переменные представляют собой, как определено для соединения формулы (IIA).
Условия реакции, которые можно применять для превращения соединения формулы (IIA) в соединение формулы (IIB), включают условия, известные в данной области техники для реакции Хорнера-Вадсворта-Эммонса, например, условия реакции Масамунэ-Роуша или протокол Хелквиста. В частности, соединение формулы (IIA) может реагировать с органическим основанием (например, органическим основанием, сопряженная кислота которого имеет pKa 11±2) и кислотой Льюиса (например, солью Li, Mg или Zn). Неограничивающие примеры органических оснований, которые можно применять в реакции Хорнера-Вадсворта-Эммонса, включают триалкиламины (например, триэтиламин или основание Хунига), DBU и DBN. Неограничивающие примеры кислот Льюиса, которые можно применять в реакции Хорнера-Вадсворта-Эммонса, включают LiCl, Zn(OTf)2 и MgCl2.
Соединение формулы (IIB) можно превратить в соединение формулы (ID):
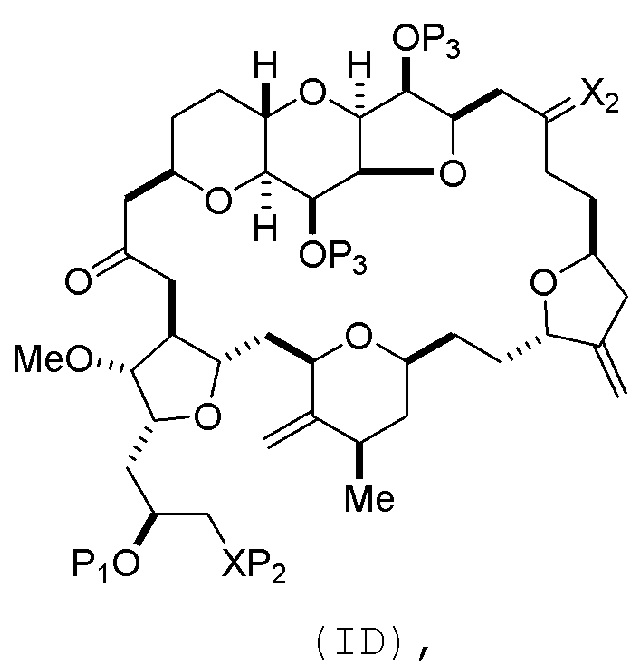
где
каждый P3 независимо представляет собой H или защитную группу гидроксила, и X2 представляет собой оксо; или обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь; и
X представляет собой O, и
каждый P1 и P2 независимо представляет собой H или защитную группу гидроксила,
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя циклический защищенный диол;
или
X представляет собой N, и
P1 представляет собой H или защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино;
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя аминаль или 1,3-оксазолидин-2-он-5-ил.
В неограничивающем примере, получение соединения формулы (ID) из соединения формулы (IIB) может включать реакцию соединения формулы (IIB) (например, соединения формулы (IIB), в котором P4 представляет собой защитную группу, R1 и R2 образуют связь, и R3 представляет собой H) с агентом, удаляющим защитную группу гидроксила.
Соединение формулы (ID) (в котором X представляет собой O, P1 и P2 представляют собой H, и обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь) можно аминировать, получая эрибулин, как описано в настоящем изобретении. Альтернативно, соединение формулы (ID) (в котором P1 представляет собой H, X и P2 соединяют, образуя защищенный амино, и обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь) может реагировать с агентом, деблокирующим амино, давая эрибулин, как описано в настоящем изобретении. Мезилат эрибулина можно получить солеобразованием эрибулина, как описано в настоящем изобретении.
Соединение формулы (IIA) можно получить из соединения формулы (IIC):
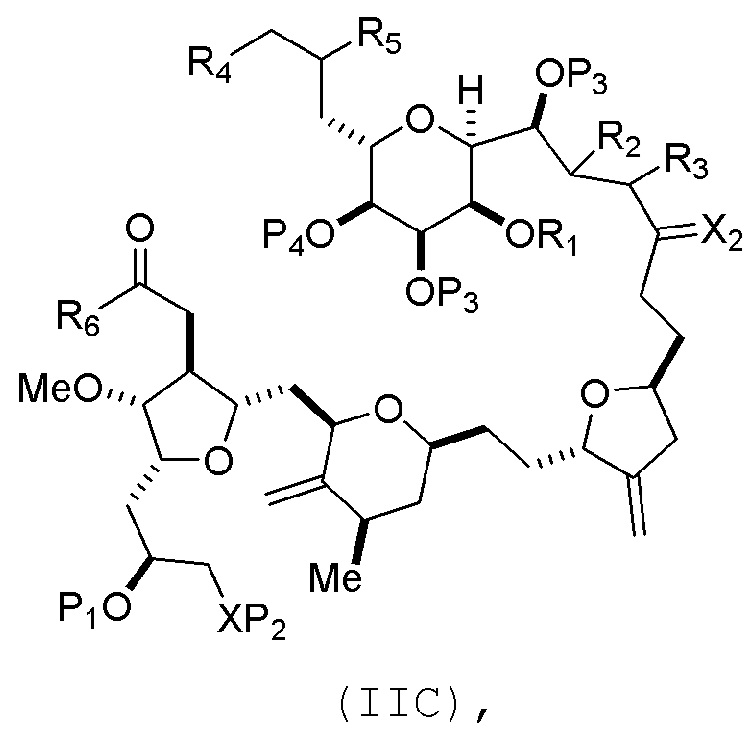
где
(i) R1 представляет собой H или защитную группу гидроксила, и R2 и R3 соединяют, образуя двойную связь;
или
(ii) R1 и R2 соединяют, образуя связь, и R3 представляет собой H;
R4 представляет собой OH, и R5 представляет собой H, или R4 и R5 соединяют, образуя двойную связь;
R6 представляет собой -OP5 или CH2P(O)(OR6)2, где P5 представляет собой эфирную защитную группу гидроксила, и каждый R6 независимо представляет собой необязательно замещенный алкил или необязательно замещенный арил;
каждый P3 независимо представляет собой H или защитную группу гидроксила, и X2 представляет собой оксо; или обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь;
P4 представляет собой H или защитную группу гидроксила; и
X представляет собой O, и
каждый P1 и P2 независимо представляет собой H или защитную группу гидроксила,
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя циклический защищенный диол;
или
X представляет собой N, и
P1 представляет собой H или защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино;
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя аминаль или 1,3-оксазолидин-2-он-5-ил.
В некоторых вариантах осуществления, получение соединения формулы (IIA) из соединения формулы (IIC) может включать проведение реакции гидроборирования/окисления на соединении формулы (IIC) (например, соединении формулы (IIC), в котором R4 и R5 соединяют, образуя двойную связь; R1 и R2 соединяют, образуя связь; и R3 представляет собой H). Получение может включать применение соединения формулы (IIC) (например, соединения формулы (IIC), в котором R6 представляет собой -OP5) в реакции фосфо-Кляйзена с CH3P(O)(OR6)2. Условия реакции фосфо-Кляйзена могут представлять собой условия, известные в данной области техники. В неограничивающем примере, CH3P(O)(OR6)2 можно депротонировать (например, контактом с сильным основанием), и затем подвергать контакту с соединением формулы (IIC). Получение может также включать окисление соединения формулы (IIC) (например, соединения формулы (IIC), в котором R4 представляет собой OH, R5 представляет собой H, и R6 представляет собой CH2P(O)(OR6)2), например, контактом данного продукта с окисляющим агентом, способным окислять спирт до карбонильной группы.
Соединение формулы (IIC) можно получить из соединения формулы (VIIE), причем соединение формулы (VIIE) имеет следующую структуру:
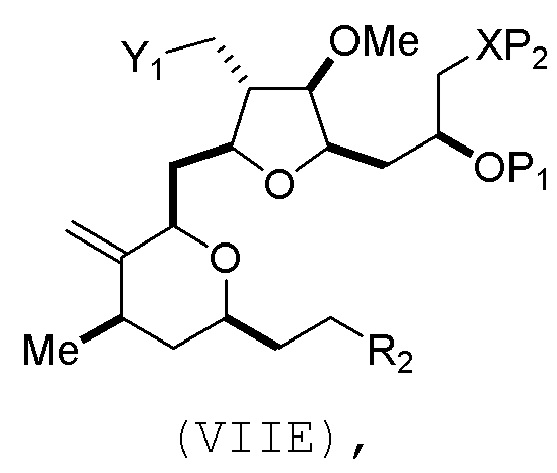
где
Y1 представляет собой SO2R1, и R1 представляет собой необязательно замещенный неенолизируемый алкил или необязательно замещенный арил, или Y1 представляет собой COOR1, и R1 представляет собой необязательно замещенный алкил, необязательно замещенный арил или необязательно замещенный арилалкил;
R2 представляет собой 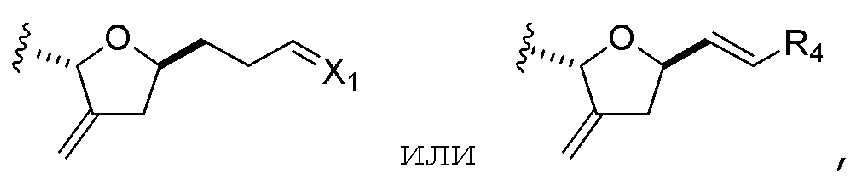 где X1 представляет собой оксо, и R4 представляет собой CHO; и
где X1 представляет собой оксо, и R4 представляет собой CHO; и
X представляет собой O, и
каждый P1 и P2 независимо представляет собой H или защитную группу гидроксила,
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя циклический защищенный диол;
или
X представляет собой N, и
P1 представляет собой H или защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино;
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя аминаль или 1,3-оксазолидин-2-он-5-ил.
В неограничивающем примере, соединение формулы (IIC) получают реакцией соединения формулы (VIIE) (например, соединения формулы (VIIE), в котором R2 представляет собой 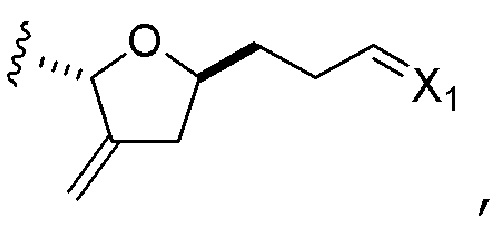
и X1 представляет собой оксо) с соединением формулы (IID), причем соединение формулы (IID) имеет следующую структуру:
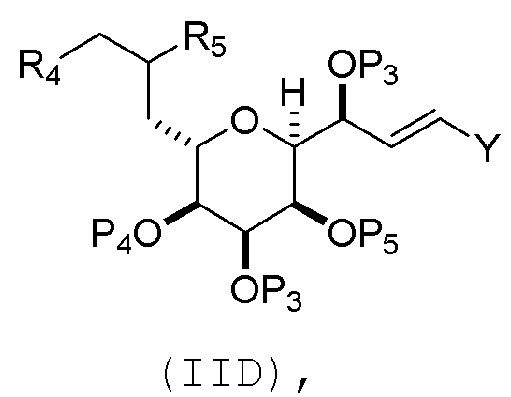
где
R4 представляет собой OH или OP5, и R5 представляет собой H, или R4 и R5 соединяют, образуя двойную связь;
каждый P3, P4, и P5 независимо представляет собой защитную группу гидроксила; и
Y представляет собой хлор, бром, йод или трифторметансульфонат.
Соединение формулы (VIIE), в котором X1 представляет собой оксо, может реагировать с соединением формулы (IID) в условиях реакции Нозаки-Хияма-Киши, как описано в настоящем изобретении.
Макроциклизация с образованием C.3-C.4 связи
Реакция макроциклизации настоящего изобретения может представлять собой реакцию образования углерод-углеродной связи (например, каталитический метатезис олефинов с замыканием кольца (RCM)), которая относится к C.3-C.4 связи в эрибулине или его фармацевтически приемлемой соли (например, мезилате эрибулина). Общая последовательность получения, включающая RCM, которую можно применять для получения эрибулина или его фармацевтически приемлемой соли (например, мезилатной соли), показана на фигуре 3. Как показано на фигуре 3, немакроциклическое промежуточное соединение в получении эрибулина может представлять собой соединение формулы (IIIA):
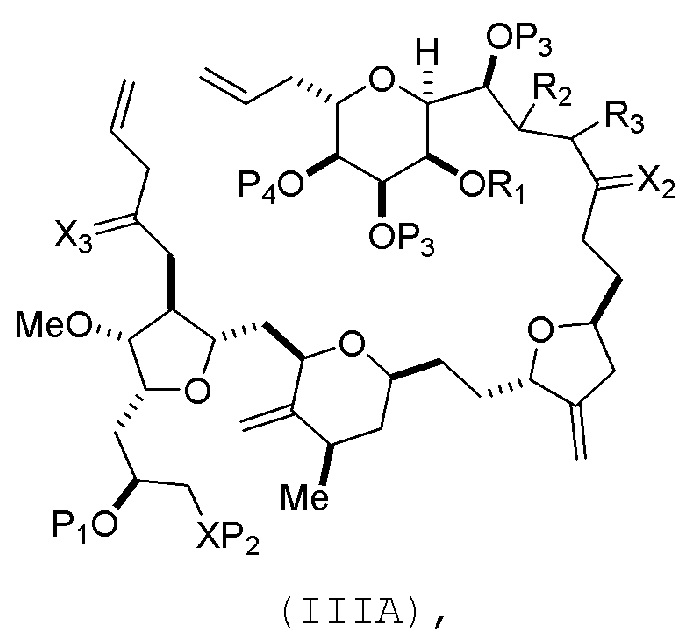
где
(i) R1 представляет собой H или защитную группу гидроксила, и R2 и R3 соединяют, образуя двойную связь;
или
(ii) R1 и R2 соединяют, образуя связь, и R3 представляет собой H;
X3 представляет собой оксо, или X3 комбинируют вместе с атомом углерода, с которым он соединен, образуя кеталь, тиокеталь или -(CH(OP5))-, где P5 представляет собой H или защитную группу гидроксила;
каждый P3 независимо представляет собой H или защитную группу гидроксила, и X2 представляет собой оксо; или обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь;
P4 представляет собой H или защитную группу гидроксила; и
X представляет собой O, и
каждый P1 и P2 независимо представляет собой H или защитную группу гидроксила,
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя циклический защищенный диол;
или
X представляет собой N, и
P1 представляет собой H или защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино;
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя аминаль или 1,3-оксазолидин-2-он-5-ил.
Промежуточное соединение в получении эрибулина может представлять собой соединение формулы (IIIB), которое можно получить реакцией соединения формулы (IIIA) с катализатором метатезиса олефинов (например, рутений-карбеновым комплексом). Соединение формулы (IIIB) имеет следующую структуру:
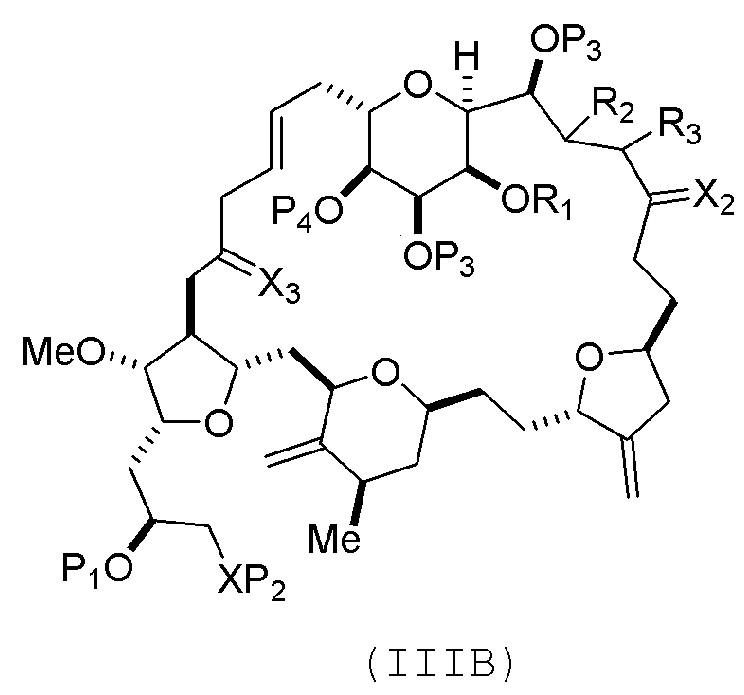
где все переменные представляют собой, как определено для формулы (IIIA).
Катализаторы, которые можно применять для превращения соединения формулы (IIIA) в соединение формулы (IIIB), могут представлять собой катализаторы, известные в данной области техники. Катализаторы метатезиса олефинов включают Ru-карбеновые комплексы (например, катализаторы Граббса и Ховейда-Граббса).
Соединение формулы (IIIB) можно превратить в соединение формулы (ID), из которого можно получить эрибулин или мезилат эрибулина, как описано в настоящем изобретении. Неограничивающий пример получения соединения формулы (ID) из соединения формулы (IIIB) представлен ниже.
Соединение формулы (IIIB), в котором X3, вместе с атомом углерода, с которым он соединен, образует -(CH(OP5))-, где P5 представляет собой H, можно окислить, получая соединение формулы (IIIB), в котором X3 представляет собой оксо.
Окисление -(CH(OH))- в соединении формулы (IIIB), получая соединение формулы (IIIB), в котором X3 представляет собой оксо, можно проводить, применяя способы, известные в данной области техники для окисления спиртов до карбонильных групп, например, контактом соединения формулы (IIIB) с окисляющим агентом, способным превращать спирт в карбонильную группу.
Соединение формулы (IIIB) (например, соединение формулы (IIIB), в котором X3 представляет собой оксо, и P1 представляет собой защитную группу гидроксила) может реагировать с агентом, удаляющим защитную группу гидроксила, давая соединение формулы (ID):
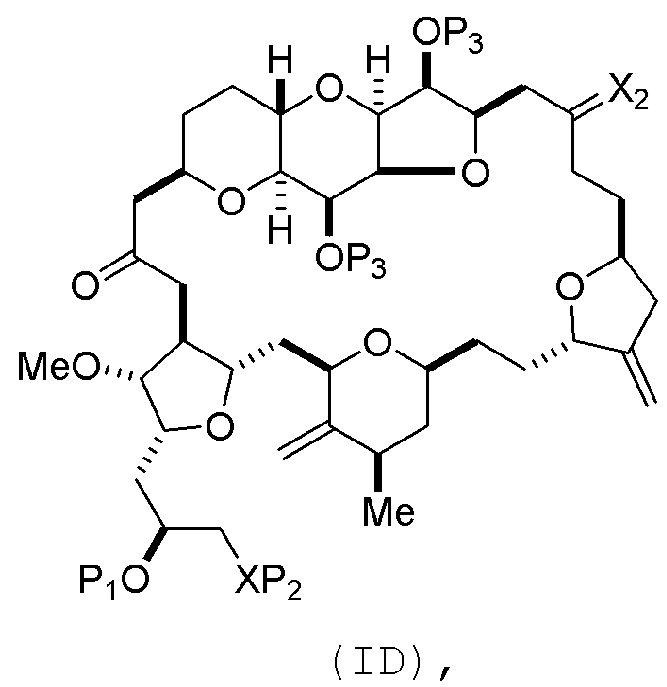
где
каждый P3 представляет собой H, и X2 представляет собой оксо; или обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь; и
X представляет собой O, и P1 и P2 представляют собой H;
или
P1 представляет собой H, и X и P2 соединяют, образуя необязательно защищенный амино.
Условия реакции, применяемой в получении соединения формулы (ID) из соединения формулы (IIIB), могут представлять собой условия, обеспечивающие изомеризацию β,γ-енона до α,β-енона (например, включающие основные или кислые соединения). Например, агент, удаляющий защитную группу гидроксила, такой как источник фтора (например, TBAF), может опосредовать изомеризацию β,γ-енона до α,β-енона, деблокируя гидроксильные группы, защищенные необязательно защищенными силильными группами.
Соединение формулы (ID) (в котором X представляет собой O, P1 и P2 представляют собой H, и обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь) можно аминировать, получая эрибулин, как описано в настоящем изобретении. Альтернативно, соединение формулы (ID) (в котором P1 представляет собой H, X и P2 соединяют, образуя защищенный амино, и обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь) может реагировать с агентом, деблокирующим амино, давая эрибулин, как описано в настоящем изобретении. Мезилат эрибулина можно получить солеобразованием эрибулина, как описано в настоящем изобретении.
Соединение формулы (IIIA) можно получить из соединения формулы (IIIC):
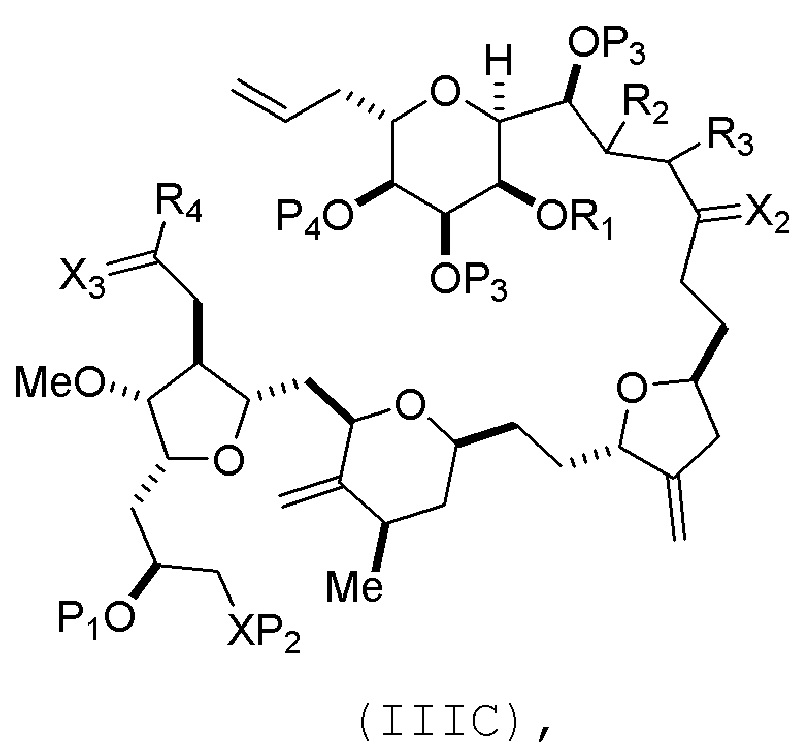
где
(i) R1 представляет собой H или защитную группу гидроксила, и R2 и R3 соединяют, образуя двойную связь;
или
(ii) R1 и R2 соединяют, образуя связь, и R3 представляет собой H;
X3 представляет собой оксо, и R4 представляет собой H или OP6, или X3 и R4 комбинируют с атомом углерода, с которым они соединены, образуя ацеталь, тиоацеталь или -CH2OP5; где P5 представляет собой H или защитную группу гидроксила, и P6 представляет собой эфирную защитную группу гидроксила;
каждый P3 независимо представляет собой H или защитную группу гидроксила, и X2 представляет собой оксо; или обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь;
P4 представляет собой H или защитную группу гидроксила; и
X представляет собой O, и
каждый P1 и P2 независимо представляет собой H или защитную группу гидроксила,
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя циклический защищенный диол;
или
X представляет собой N, и
P1 представляет собой H или защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино;
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя аминаль или 1,3-оксазолидин-2-он-5-ил.
В некоторых вариантах осуществления, получение соединения формулы (IIIA) из соединения формулы (IIIC) включает аллилирование соединения формулы (IIIC) (например, соединения формулы (IIIC), в котором R4 представляет собой H, и X3 представляет собой оксо, или X3 и R4 комбинируют с атомом углерода, с которым они соединены, образуя тиоацеталь). Аллилирование соединения формулы (IIIC) можно проводить, применяя условия, известные в данной области техники. В неограничивающем примере, когда X3 представляет собой оксо, и R4 представляет собой H, аллилирование соединения формулы (IIIC) может представлять собой нуклеофильное аллилирование (например, контактом соединения формулы (IIIC) с нуклеофильным аллилирующим агентом (например, аллилборным реагентом (например, аллилборонатом или аллилбораном), аллилстаннаном, аллиловым реагентом Гриньяра, аллилсиланом или аллилиндием). Альтернативно, аллилирование соединения формулы (IIIC) можно проводить, применяя электрофильное аллилирование (например, когда X3 и R4 соединяют с атомом углерода, с которым они соединены, образуя тиоацеталь). В неограничивающих примерах электрофильного аллилирования, соединение формулы (IIIC), в котором X3 и R4 соединяют с атомом углерода, с которым они соединены, образуя тиоацеталь, может контактировать с сильным основанием, с последующим контактом с аллильным электрофилом (например, аллилгалогенидом или аллилсульфонатом).
Получение соединения формулы (IIIA) из соединения формулы (IIIC) может также включать восстановление соединения формулы (IIIC), в котором X3 представляет собой оксо, и R4 представляет собой OP6, 1,2-восстанавливающим агентом, получая соединение формулы (IIIC), в котором X3 представляет собой оксо или -(CH(OH))-, и R4 представляет собой H. Образование соединения формулы (IIIC), в котором X3 представляет собой оксо, и R4 представляет собой H, может быть непосредственным (например, обработкой DIBAL при температуре от приблизительно -70°C до приблизительно -80°C) или опосредованным соединением формулы (IIIC), в котором X3 комбинируют вместе с атомом углерода, с которым он соединен, образуя -(CH(OH))-, и R4 представляет собой H. Таким образом, опосредованный путь получения соединения формулы (IIIC), в котором X3 представляет собой оксо, и R4 представляет собой H, включает первое восстановление соединения формулы (IIIC), в котором X3 представляет собой оксо, и R4 представляет собой OP6, 1,2-восстанавливающим агентом, получая соединение формулы (IIIC), в котором X3 комбинируют вместе с атомом углерода, с которым он соединен, образуя -(CH(OH))-, и R4 представляет собой H. Последнее соединение может реагировать с окисляющим агентом, способным окислять спирт до карбонильной группы, давая соединение формулы (IIIC), в котором X3 представляет собой оксо, и R4 представляет собой H.
В процессе реакций окисления, восстановления и аллилирования, описанных выше, чувствительные функциональные группы, присутствующие в соединениях формулы (IIIC), можно защищать (например, R1 и каждый P3 независимо представляет собой защитную группу гидроксила) или может присутствовать в нереакционноспособной форме (например, обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь).
Макроциклизация с образованием C.19-C.20 связи
Реакция макроциклизации настоящего изобретения может представлять собой реакцию образования углерод-углеродной связи (например, реакцию Нозаки-Хияма-Киши (NHK)), которая относится к C.19-C.20 связи в эрибулине или его фармацевтически приемлемой соли (например, мезилате эрибулина). Общая последовательность получения, включающая NHK, которую можно применять для получения эрибулина или его фармацевтически приемлемой соли (например, мезилатной соли), показана на фигуре 4. Как показано на фигуре 4, немакроциклическое промежуточное соединение в получении эрибулина может представлять собой соединение формулы (IVA):
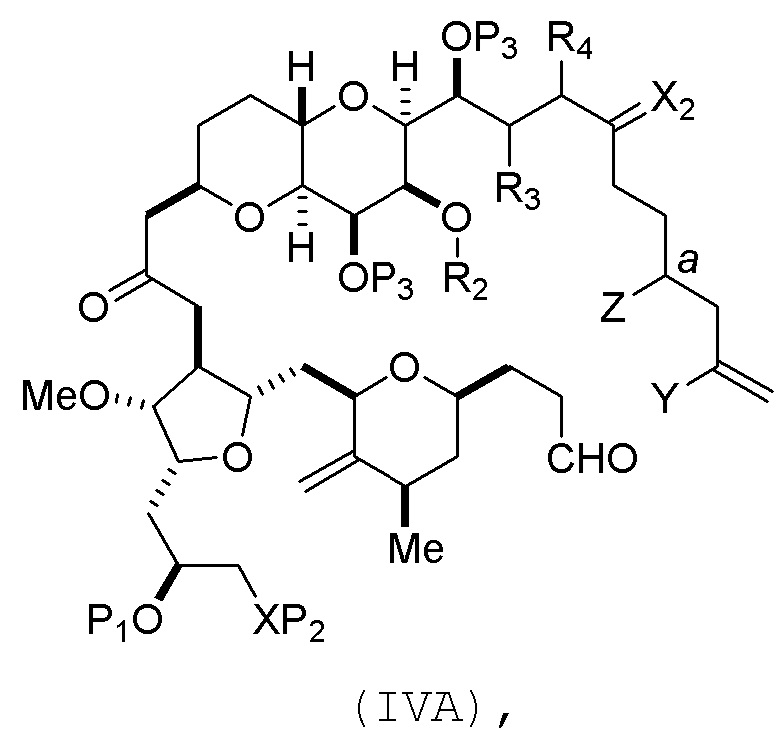
где
Y представляет собой йодид, бромид или трифторметансульфонат;
a обозначает R стереогенный центр, и Z представляет собой сульфонат, хлорид, бромид или йодид; или a обозначает S стереогенный центр, и Z представляет собой OR1, где R1 представляет собой защитную группу гидроксила;
(i) R2 представляет собой H или защитную группу гидроксила, R3 и R4 соединяют, образуя двойную связь;
или
(ii) R2 и R3 соединяют, образуя связь, и R4 представляет собой H;
каждый P3 независимо представляет собой H или защитную группу гидроксила, и X2 представляет собой оксо; или обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь; и
X представляет собой O, и
каждый P1 и P2 независимо представляет собой H или защитную группу гидроксила,
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя циклический защищенный диол;
или
X представляет собой N, и
P1 представляет собой H или защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино;
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя аминаль или 1,3-оксазолидин-2-он-5-ил.
Промежуточное соединение в получении эрибулина может представлять собой соединение формулы (IVB), которое можно получить воздействием на соединение формулы (IVA) условий реакции Нозаки-Хияма-Киши (например, реакции с солью Cr(II) и солью Ni(II)). Соединение формулы (IVB) имеет следующую структуру:
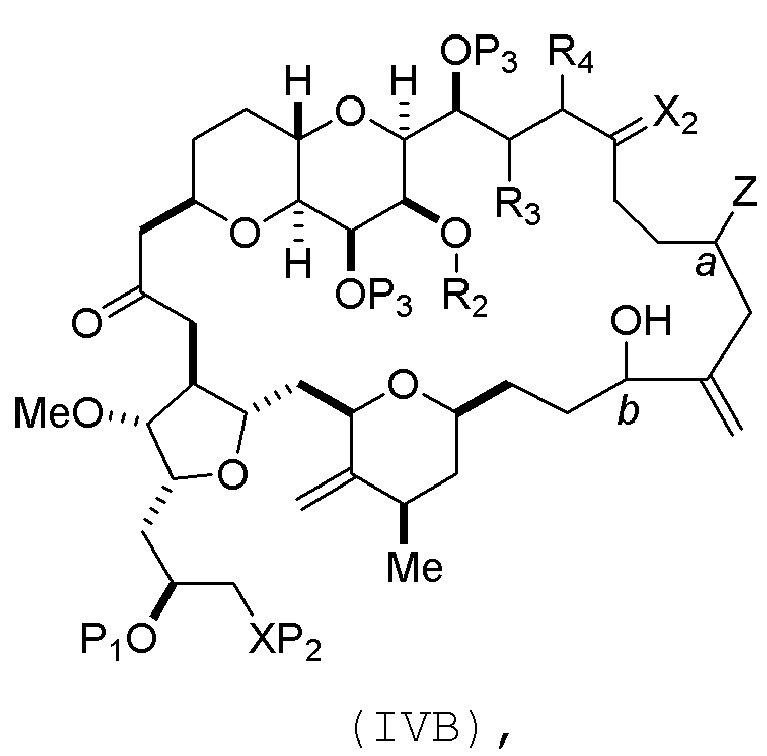
где P1, P2, P3, X, и X2 представляют собой, как определено для соединения формулы (IVB);
a обозначает R стереогенный центр, b обозначает S стереогенный центр, Z представляет собой сульфонат, хлорид, бромид или йодид;
или
a обозначает S стереогенный центр, b обозначает R стереогенный центр, и Z представляет собой OR1, где R1 представляет собой защитную группу гидроксила.
Условия реакции Нозаки-Хияма-Киши, которые можно применять для получения соединения формулы (IVB) из соединения формулы (IVA), могут представлять собой условия, известные в данной области техники. Реакция Нозаки-Хияма-Киши на соединении формулы (IVA) может включать реакцию соединения формулы (IVA) с солью Cr(II) и солью Ni(II). Дополнительные лиганды можно применять в комбинации с солями металлов. В неограничивающем примере, замещенный 1,10-фенантролин можно применять в комбинации с солью Ni(II). Хиральные дополнительные лиганды можно применять для придания реакции стереоселективности. В неограничивающем примере, хиральные N-(дигидрооксазолилфенил)сульфонамиды можно применять с солью Cr(II), контролируя стереохимию карбонильного углерода, к которому присоединяется винильный нуклеофил в процессе реакции Нозаки-Хияма-Киши.
Соединение формулы (IVB) можно превратить в соединение формулы (ID), из которого можно получить эрибулин или мезилат эрибулина, как описано в настоящем изобретении. Неограничивающая примерная последовательность реакций превращения соединения формулы (IVB) в соединение формулы (ID) приведена ниже.
Соединение формулы (IVB) можно превратить в соединение формулы (ID) непосредственно или через промежуточное соединение формулы (IVC). Таким образом, соединение формулы (IVB), в котором Z представляет собой эфир, a обозначает S стереогенный центр, b обозначает R стереогенный центр, можно превратить в соединение формулы (IVC), например, реакцией с сульфонильным электрофилом, таким как сульфонилхлорид или ангидрид сульфокислоты.
где
a обозначает S стереогенный центр;
b обозначает R стереогенный центр;
Z представляет собой эфир;
(i) R2 представляет собой H или защитную группу гидроксила, R3 и R4 соединяют, образуя двойную связь;
или
(ii) R2 и R3 соединяют, образуя связь, и R4 представляет собой H;
R5 представляет собой сульфонил;
каждый P3 независимо представляет собой защитную группу гидроксила, и X2 представляет собой оксо; или обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь;
и
X представляет собой O, и
каждый P1 и P2 независимо представляет собой защитную группу гидроксила,
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя циклический защищенный диол;
или
P1 представляет собой защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино.
Получение соединения формулы (ID) из соединения формулы (IVC) может включать реакцию соединения формулы (IVC) с C1-6 алкоксидом. Соединение формулы (ID) имеет следующую структуру:
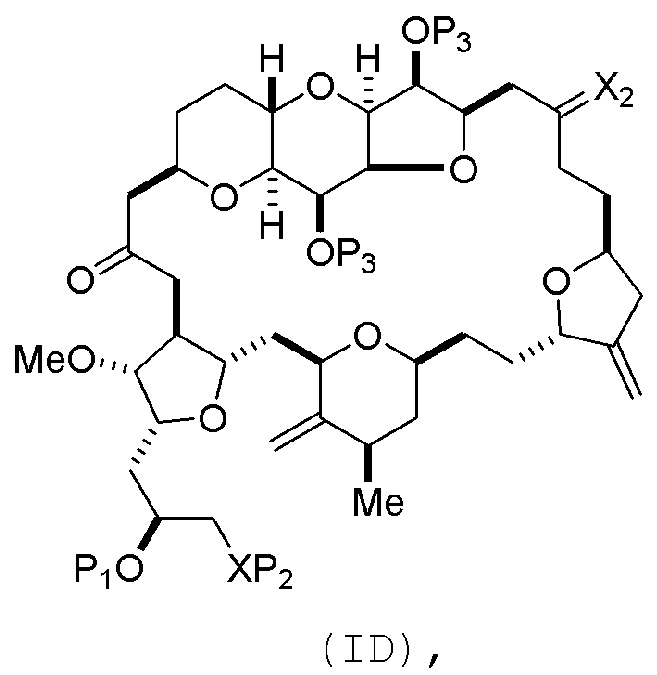
где
каждый P3 независимо представляет собой H или защитную группу гидроксила, и X2 представляет собой оксо; или обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь; и
X представляет собой O, и
каждый P1 и P2 независимо представляет собой защитную группу гидроксила,
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя циклический защищенный диол;
или
P1 представляет собой защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино.
Соединение формулы (IVB) (в котором Z представляет собой сульфонат, хлорид, бромид или йодид, a обозначает R стереогенный центр, b обозначает S стереогенный центр, R2 и R3 соединяют, образуя связь, и R4 представляет собой H) можно превратить в соединение формулы (ID) непосредственно, например, после выделения из смеси в результате реакции Нозаки-Хияма-Киши (например, обработкой основанием) или контактом смеси, содержащей продукт реакции Нозаки-Хияма-Киши, с силикагелем.
Соединение формулы (ID) (например, соединение формулы (ID) в котором P1 представляет собой защитную группу гидроксила) может реагировать с агентом, удаляющим защитную группу гидроксила, давая:

где
каждый P3 независимо представляет собой H или защитную группу гидроксила, и X2 представляет собой оксо; или обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь; и
X представляет собой O, и
каждый P1 и P2 независимо представляет собой H или защитную группу гидроксила,
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя циклический защищенный диол;
или
X представляет собой N, и
P1 представляет собой H или защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино;
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя аминаль или 1,3-оксазолидин-2-он-5-ил.
Соединение формулы (ID) (в котором X представляет собой O, P1 и P2 представляют собой H, и обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь) можно аминировать, получая эрибулин, как описано в настоящем изобретении. Альтернативно, соединение формулы (ID) (в котором P1 представляет собой H, X и P2 соединяют, образуя защищенный амино, и обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь) может реагировать с агентом, деблокирующим амино, давая эрибулин, как описано в настоящем изобретении. Мезилат эрибулина можно получить солеобразованием эрибулина, как описано в настоящем изобретении.
Соединение формулы (IVA) можно получить из соединения формулы (IVD):
где
Y представляет собой йодид, бромид или трифторметансульфонат;
Y1 представляет собой H, COOR6 или SO2R6, где, когда Y1 представляет собой COOR6, R6 представляет собой необязательно замещенный алкил, необязательно замещенный арил или необязательно замещенный арилалкил, и, когда Y1 представляет собой SO2R6, R6 представляет собой необязательно замещенный арил или необязательно замещенный неенолизируемый алкил;
Z представляет собой эфир, сульфонат, хлорид, бромид или йодид;
(i) R2 представляет собой H или защитную группу гидроксила, R3 и R4 соединяют, образуя двойную связь;
или
(ii) R2 и R3 соединяют, образуя связь, и R4 представляет собой H;
каждый P3 независимо представляет собой H или защитную группу гидроксила, и X2 представляет собой оксо; или обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь;
X3 представляет собой оксо, или X3 комбинируют вместе с атомом углерода, с которым он соединен, образуя -(CH(OH))-; и
X представляет собой O, и
каждый P1 и P2 независимо представляет собой H или защитную группу гидроксила,
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя циклический защищенный диол;
или
X представляет собой N, и
P1 представляет собой H или защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино;
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя аминаль или 1,3-оксазолидин-2-он-5-ил.
В некоторых вариантах осуществления, получение соединения формулы (IVA) включает окисление соединение формулы (IVD), в котором X3 представляет собой -(CH(OH))-, и/или P4 представляет собой H, например, реакцией с окисляющим агентом, способным окислять спирт до карбонильной группы. Получение соединения формулы (IVA) может также включать проведение реакции декарбоксилирования или десульфонилирования на соединении формулы (IVA), в котором Y1 представляет собой COOR6 (декарбоксилирование) или SO2R6 (десульфонилирование).
В определенных вариантах осуществления, соединение формулы (IVD) можно получить из соединения формулы (IVE) и соединения формулы (VIIE):
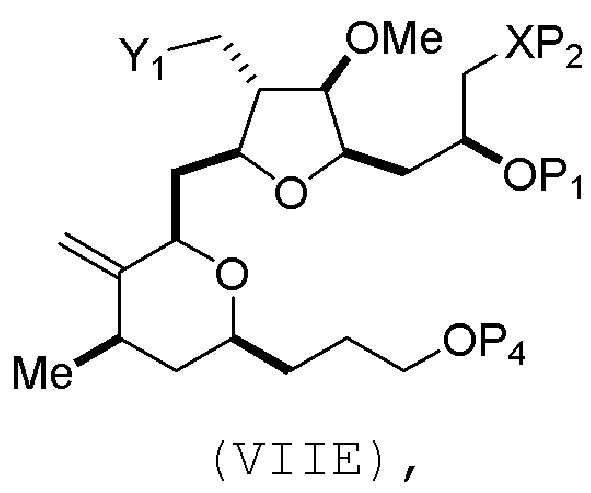
или их соли,
где все переменные представляют собой, как определено в формуле (IVD).
Соединение формулы (IVE) может иметь следующую структуру:
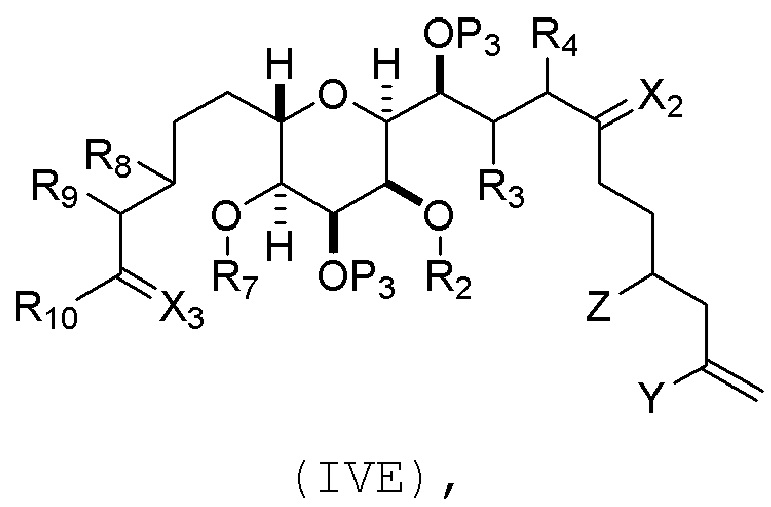
где
(a1) R7 и R8 соединяют, образуя связь, и R9 представляет собой H;
или
(a2) R7 представляет собой H или защитную группу гидроксила, и R8 и R9 соединяют, образуя двойную связь;
X3 представляет собой оксо, и R10 представляет собой H или -OP5, где P5 представляет собой H или эфирную защитную группу гидроксила; и
оставшиеся переменные представляют собой, как определено в формуле (IVD).
В конкретных вариантах осуществления, соединение формулы (IVD) получают реакцией соединения формулы (IVE) (например, соединения формулы (IVE), в котором X представляет собой оксо) с соединением формулы (VIIE), которое предварительно обрабатывают сильным основанием.
Макроциклизация с образованием C.0-C.1 связи
Реакция макроциклизации настоящего изобретения может представлять собой реакцию образования углерод-углеродной связи (например, реакцию Дикмана), которая относится к C.0-C.1 связи в эрибулине или его фармацевтически приемлемой соли (например, мезилате эрибулина). Общая последовательность получения, включающая реакцию Дикмана, которую можно применять для получения эрибулина или его фармацевтически приемлемой соли (например, мезилатной соли), показана на фигуре 5. Как показано на фигуре 5, немакроциклическое промежуточное соединение в получении эрибулина может представлять собой:
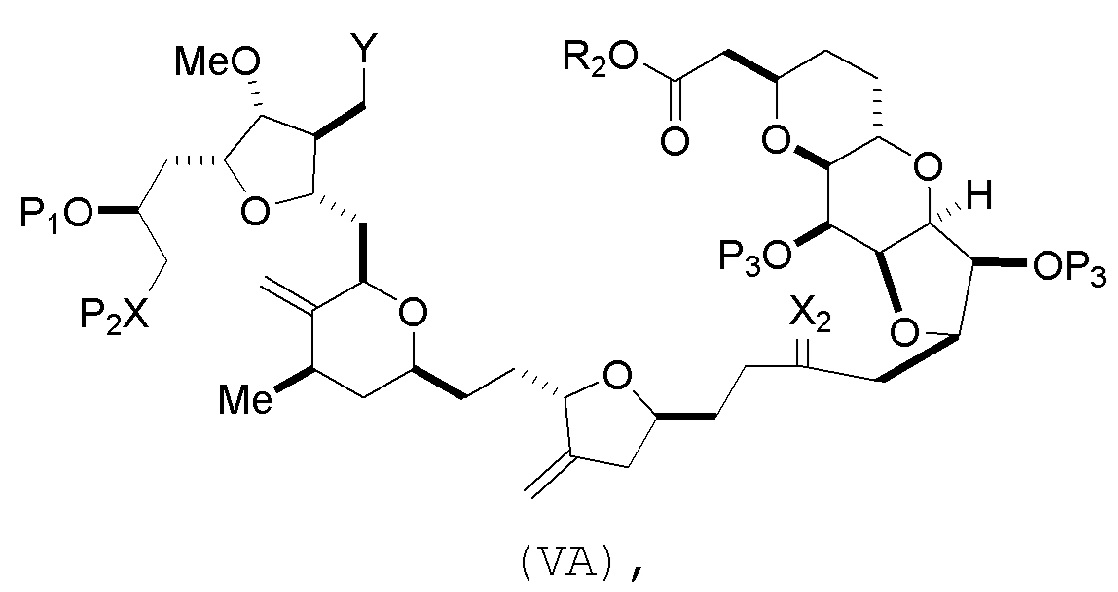
где
Y представляет собой SO2R1 или COOR1, где, когда Y представляет собой SO2R1, R1 представляет собой необязательно замещенный арил или необязательно замещенный неенолизируемый алкил, и когда Y представляет собой COOR1, R1 представляет собой необязательно замещенный алкил, необязательно замещенный арил или необязательно замещенный арилалкил;
каждый P3 независимо представляет собой H или защитную группу гидроксила, и X2 представляет собой оксо, или обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь;
R2 представляет собой необязательно замещенный алкил, необязательно замещенный арилалкил или необязательно замещенный арил; и
X представляет собой O, и
каждый P1 и P2 независимо представляет собой защитную группу гидроксила,
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя циклический защищенный диол;
или
X представляет собой N, и
P1 представляет собой H или защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино;
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя аминаль или 1,3-оксазолидин-2-он-5-ил.
Промежуточное соединение в получении эрибулина может представлять собой соединение формулы (VB), которое можно получить из соединения формулы (VA), применяя реакцию Дикмана. Соединение формулы (VB) имеет следующую структуру:
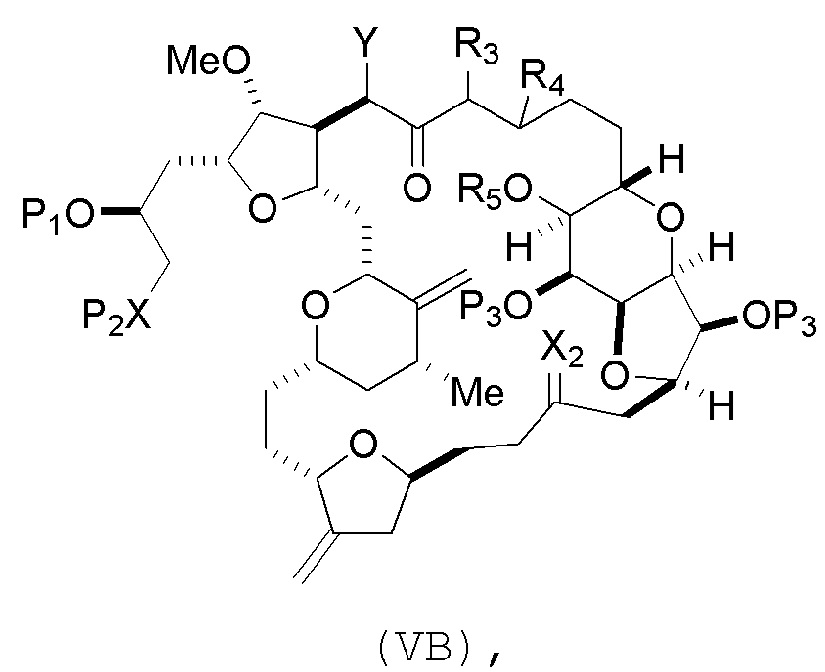
где P1, P2, P3, X, X2, и Y представляют собой, как определено для соединения формулы (VA); и
(i) R3 представляет собой H, R4 представляет собой необязательно замещенный C1-6 алкиловый эфир, и R5 представляет собой H;
(ii) R5 представляет собой H, и R3 и R4 соединяют, образуя двойную связь;
или
(iii) R3 представляет собой H, и R4 и R5 соединяют, образуя связь
Условия реакции, которые можно применять для превращения соединения формулы (VA) в соединение формулы (VB), включают условия, известные в данной области техники для реакции Дикмана или конденсации Кляйзена. В частности, соединение формулы (VA) может контактировать с сильным основанием (например, C4-6 алкоксидом), давая соединение формулы (VB). Соединение формулы (VB)(i) или (VB)(ii) можно превратить в соединение формулы (VB)(iii) перед следующей стадией контактом соединение формулы (IIB)(i) или (VB)(ii) с водным бикарбонатом (например, при обработке смеси реакции Дикмана) или силикагелем (например, очисткой соединения формулы (VB) хроматографией на силикагеле).
Соединение формулы (VB) можно превратить в соединение формулы (ID), из которого можно получить эрибулин или мезилат эрибулина, как описано в настоящем изобретении. Например, последовательность реакций превращения соединения формулы (VB) в соединение формулы (ID) может включать (i) реакцию десульфонилирования или декарбоксилирования и (ii) реакции с агентом, удаляющим защитную группу гидроксила, или деблокирующим аминогруппу агентом. Условия для реакции декарбоксилирования могут представлять собой условия, известные в данной области техники, например, декарбоксилирование по Крапчо или последовательность, включающую деблокирование (превращение R1 в H) и протодекарбоксилирование. Условия для реакции десульфонилирования могут представлять собой условия, известные в данной области техники. Например, реакция десульфонилирования может включать контакт соединения формулы (IIB), в котором Y представляет собой SO2R1, с электронпереносящим восстанавливающим агентом (например, SmI2; солью Cr(III) и Mn(0); или Mg(0)). Что касается примерных условий десульфонилирования, смотри WO 2009/064029.
Соединение формулы (ID) (например, соединение формулы (ID) в котором P1 представляет собой защитную группу гидроксила) может реагировать с агентом, удаляющим защитную группу гидроксила, давая:
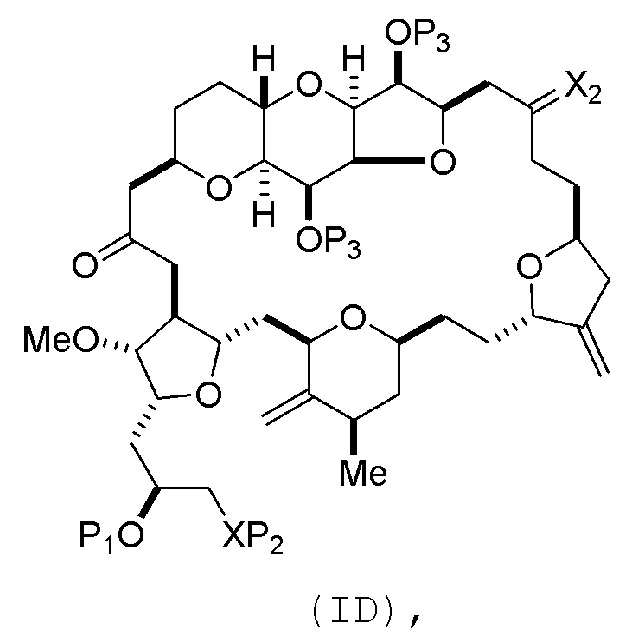
где
обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь; и
X представляет собой O, и каждый P1 и P2 представляет собой H,
или
P1 представляет собой H, и X и P2 соединяют, образуя необязательно защищенный амино.
Соединение формулы (ID) (в котором X представляет собой O, P1 и P2 представляют собой H, и обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь) можно аминировать, получая эрибулин, как описано в настоящем изобретении. Альтернативно, соединение формулы (ID) (в котором P1 представляет собой H, X и P2 соединяют, образуя защищенный амино, и обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь) может реагировать с агентом, деблокирующим амино, давая эрибулин, как описано в настоящем изобретении. Мезилат эрибулина можно получить солеобразованием эрибулина, как описано в настоящем изобретении.
Соединение формулы (VA) можно получить из соединения формулы (VIIE):
где
Y представляет собой SO2R1 или COOR1, где, когда Y представляет собой SO2R1, R1 представляет собой необязательно замещенный арил или необязательно замещенный неенолизируемый алкил, и когда Y представляет собой COOR1, R1 представляет собой необязательно замещенный алкил, необязательно замещенный арил или необязательно замещенный арилалкил;
P3 представляет собой H или защитную группу гидроксила; и
X представляет собой O, и
каждый P1 и P2 независимо представляет собой H или защитную группу гидроксила,
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя циклический защищенный диол;
или
X представляет собой N, и
P1 представляет собой H или защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино;
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя аминаль или 1,3-оксазолидин-2-он-5-ил.
Получение соединения формулы (VA) из соединения формулы (VIIE) может включать окисление соединения формулы (VIIE), в котором P3 представляет собой H, и применение продукта в реакции Нозаки-Хияма-Киши с соединением формулы (VC):
где
R2 представляет собой необязательно замещенный алкил, необязательно замещенный арилалкил или необязательно замещенный арил;
Y1 представляет собой хлор, бром, йод или трифторметансульфонат; и
каждый P3 и P4 независимо представляет собой защитную группу гидроксила.
Последующая реакция с агентом, удаляющим защитную группу гидроксила, и реакция с кислотой Бренстеда могут давать соединение формулы (VA).
Макроциклизация с образованием C.26-C.27 связи
Реакция макроциклизации настоящего изобретения может представлять собой реакцию образования углерод-углеродной связи (например, реакцию Нозаки-Хияма-Киши (NHK)), которая относится к C.26-C.27 связи в эрибулине или его фармацевтически приемлемой соли (например, мезилате эрибулина). Общая последовательность получения, включающая NHK, которую можно применять для получения эрибулина или его фармацевтически приемлемой соли (например, мезилатной соли), показана на фигуре 6. Как показано на фигуре 6, немакроциклическое промежуточное соединение в получении эрибулина может представлять собой соединение формулы (VIA):
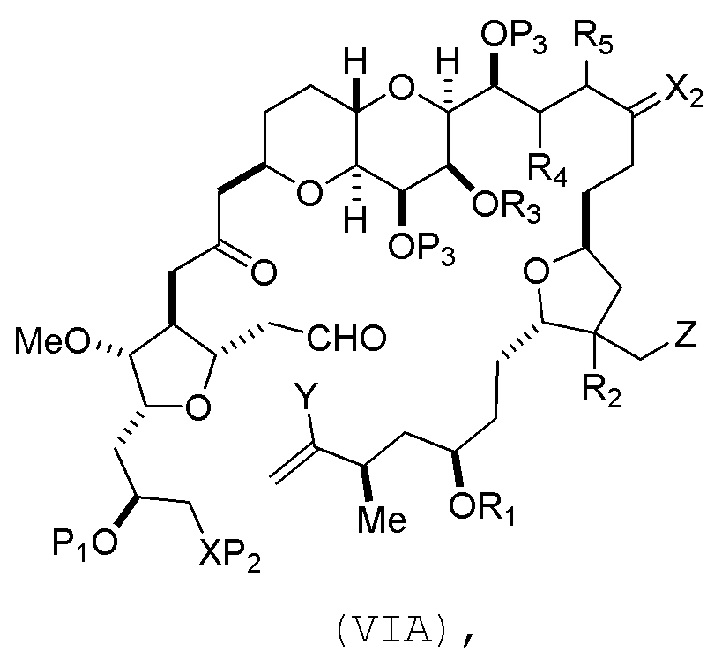
где
Y представляет собой йодид, бромид или трифторметансульфонат;
(a1) R3 представляет собой H или защитную группу гидроксила, R4 и R5 соединяют, образуя двойную связь, каждый P3 независимо представляет собой H или защитную группу гидроксила, и X2, вместе с атомом углерода, с которым он соединен, образует карбонил или -(CH(OR6))-, где R6 представляет собой H или защитную группу гидроксила;
или
(a2) R3 и R4 соединяют, образуя связь, R5 представляет собой H, и
каждый P3 независимо представляет собой H или защитную группу гидроксила, и X2, вместе с атомом углерода, с которым он соединен, образует карбонил или -(CH(OR6))-;
или
обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь;
(b1) Z представляет собой хлорид, бромид или йодид, и R1 и R2 соединяют, образуя связь;
или
(b2) Z и R2 соединяют, образуя двойную связь, и R1 представляет собой H или защитную группу гидроксила;
и
X представляет собой O, и
каждый P1 и P2 независимо представляет собой H или защитную группу гидроксила,
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя циклический защищенный диол;
или
X представляет собой N, и
P1 представляет собой H или защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино;
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя аминаль или 1,3-оксазолидин-2-он-5-ил.
Промежуточное соединение в получении эрибулина может представлять собой соединение формулы (VIB), которое можно получить воздействием на соединение формулы (VIA) условий реакции Нозаки-Хияма-Киши (например, реакции с солью Cr(II) и солью Ni(II)). Соединение формулы (VIB) имеет следующую структуру:
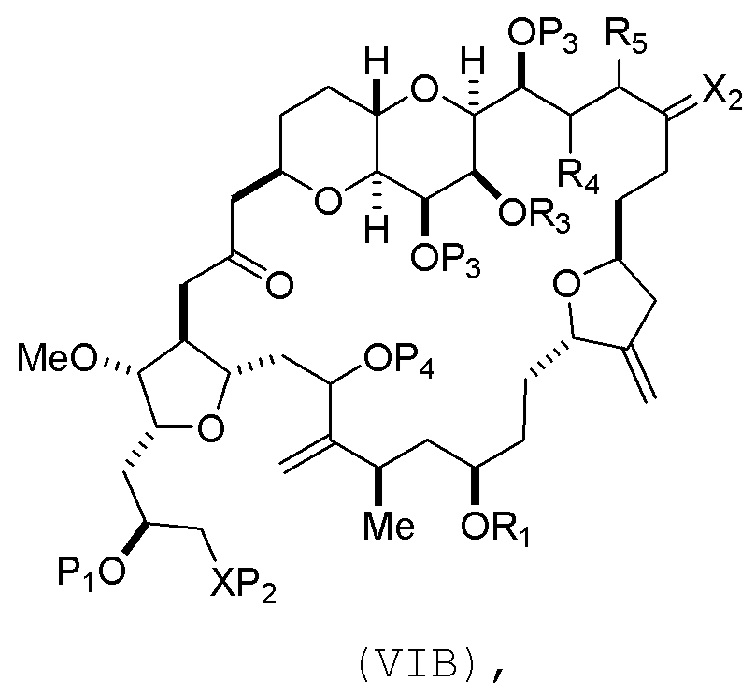
где все переменные представляют собой, как определено для соединения формулы (VIA); и
P4 представляет собой H или защитную группу гидроксила.
Условия реакции Нозаки-Хияма-Киши представляют собой, как описано выше.
Соединение формулы (VIC) можно получить из соединения формулы (VIB):
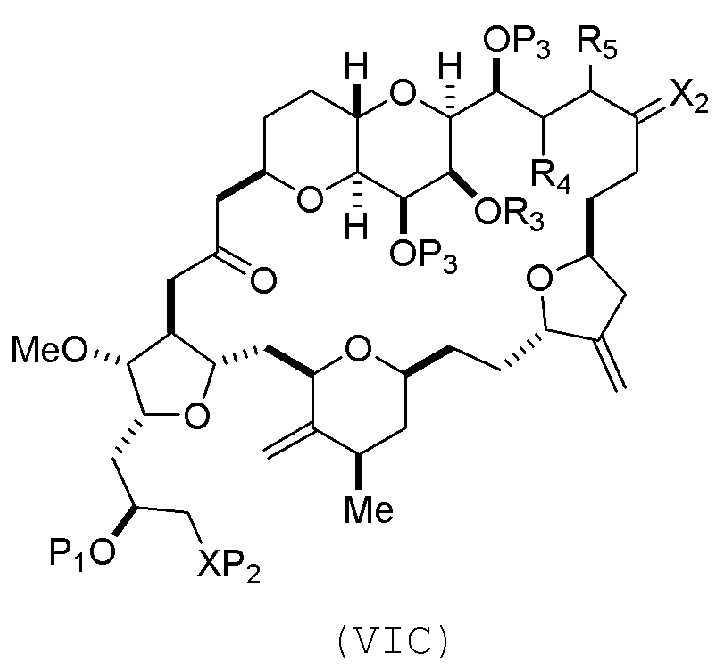
где все переменные представляют собой, как определено для соединения формулы (VIB).
Получение соединения формулы (VIC) может включать фрагментацию по Васселу, реакцию (реакции) с одним или более защищающими гидроксил агентами, реакцию нуклеофильной циклизации, и реакции окисления, например, перед или после стадии NHK (т.е., реакции, дающей соединение формулы (VIB)).
Соединение формулы (VIC) можно превратить в соединение формулы (ID), из которого можно получить эрибулин или мезилат эрибулина, как описано в настоящем изобретении. В неограничивающем примере, соединение формулы (VIC) (например, соединение формулы (VIC), в котором каждый P1, P2, P3 и R3 представляет собой защитную группу гидроксила, X2 представляет собой оксо, и R4 и R5 соединяют, образуя двойную связь) можно превратить в соединение формулы (ID) посредством получения, включающего реакцию соединения формулы (VIC) с агентом, удаляющим защитную группу гидроксила. Получение может дополнительно включать реакцию с кислотой Бренстеда (например, кислотой Бренстеда, имеющей pKa 5±3) после реакции соединения формулы (VIC) с агентом, удаляющим защитную группу гидроксила.
Соединение формулы (ID) (например, соединение формулы (ID) в котором P1 представляет собой защитную группу гидроксила) может реагировать с агентом, удаляющим защитную группу гидроксила:
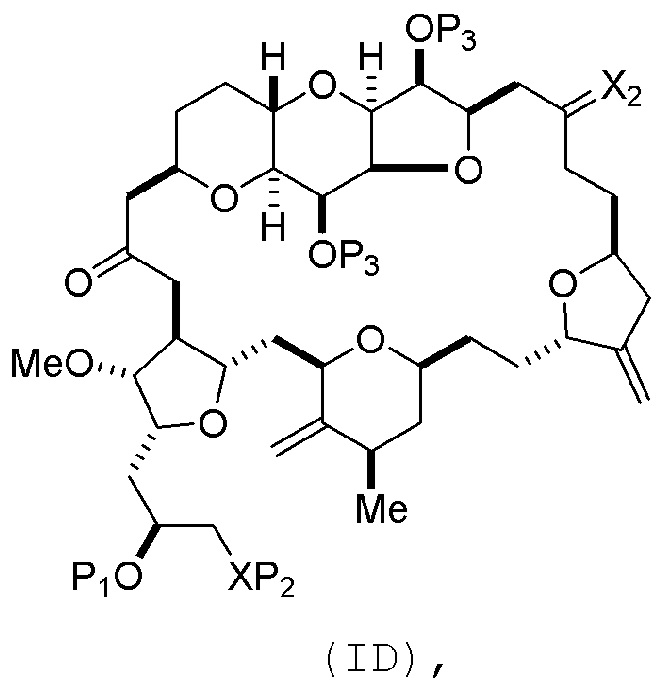
где
обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь; и
X представляет собой O, и каждый P1 и P2 представляет собой H,
или
P1 представляет собой H, и X и P2 соединяют, образуя необязательно защищенный амино.
Соединение формулы (ID) (в котором X представляет собой O, и P1 и P2 представляют собой H) можно аминировать, получая эрибулин, как описано в настоящем изобретении. Альтернативно, соединение формулы (ID) (в котором P1 представляет собой H, и X и P2 соединяют, образуя защищенный амино) может реагировать с агентом, деблокирующим амино, давая эрибулин, как описано в настоящем изобретении. Мезилат эрибулина можно получить солеобразованием эрибулина, как описано в настоящем изобретении.
Соединение формулы (VIA) можно получить из соединения формулы (VID):
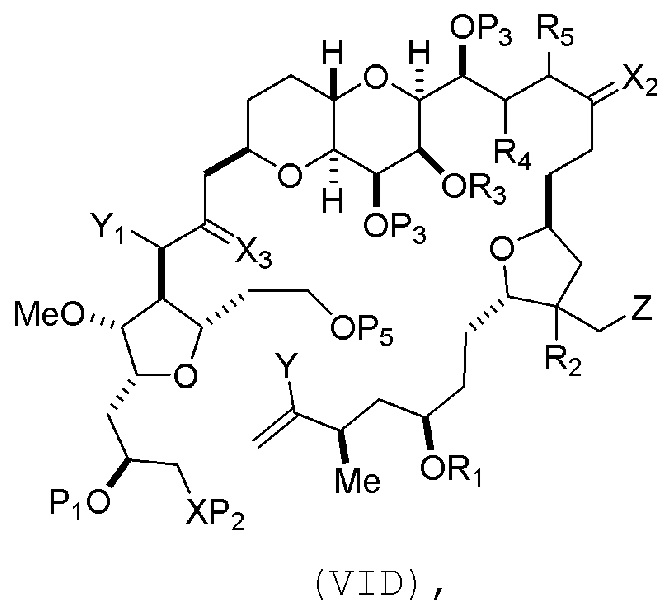
где
Y представляет собой йодид, бромид или трифторметансульфонат;
Y1 представляет собой H, SO2R7, или COOR7, где, когда Y1 представляет собой COOR7, R7 представляет собой необязательно замещенный алкил, необязательно замещенный арил или необязательно замещенный арилалкил, и, когда Y1 представляет собой SO2R7, R7 представляет собой необязательно замещенный арил или необязательно замещенный неенолизируемый алкил;
X3 представляет собой оксо, или X3 комбинируют с углеродом, с которым он соединен, образуя -(CH(OR6))-;
P5 представляет собой H или защитную группу гидроксила;
(a1) R3 представляет собой H или защитную группу гидроксила, R4 и R5 соединяют, образуя двойную связь, каждый P3 независимо представляет собой H или защитную группу гидроксила, и X2, вместе с атомом углерода, с которым он соединен, образует карбонил или -(CH(OR6))-;
или
(a2) R3 и R4 соединяют, образуя связь, R5 представляет собой H, и
каждый P3 независимо представляет собой H или защитную группу гидроксила, и X2, вместе с атомом углерода, с которым он соединен, образует карбонил или -(CH(OR6))-;
или
обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь;
(b1) Z представляет собой хлорид, бромид или йодид, и R1 и R2 соединяют, образуя связь;
или
(b2) Z и R2 соединяют, образуя двойную связь, и R1 представляет собой защитную группу гидроксила;
и
X представляет собой O, и
каждый P1 и P2 независимо представляет собой H или защитную группу гидроксила,
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя циклический защищенный диол;
или
X представляет собой N, и
P1 представляет собой H или защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино;
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя аминаль или 1,3-оксазолидин-2-он-5-ил;
где каждый R6 независимо представляет собой H или защитную группу гидроксила.
Получение соединения формулы (VIA) может включать окисление соединения формулы (VID) (например, соединения формулы (VID), в котором P5 представляет собой H или защитную группу гидроксила, и/или X3 комбинируют с углеродом, с которым он соединен, образуя -(CH(OR6))-), например, реакцией с окисляющим агентом, способным окислять гидроксил до карбонильной группы. Смесь, содержащая окисляющий агент, может также действовать как агент, удаляющий защитную группу гидроксила. Получение может дополнительно включать реакцию десульфонилирования (когда Y1 представляет собой COOR7) или десульфонилирования (когда Y1 представляет собой SO2R7), как описано в настоящем изобретении.
Соединение формулы (VID) можно получить реакцией соединения формулы (VIE) с соединением формулы (VIF). Соединение формулы (VIE) может иметь следующую структуру:
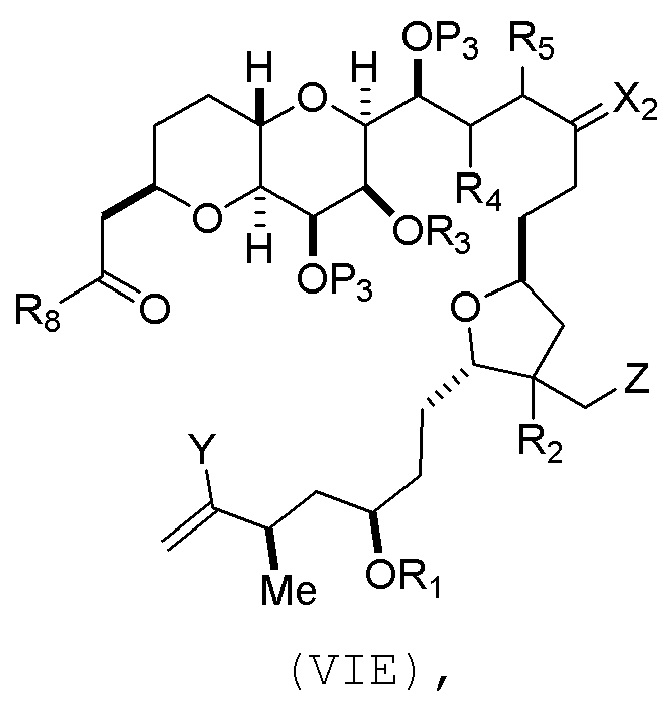
где
R8 представляет собой H или -OR9, где R9 представляет собой H или эфирную защитную группу гидроксила; и
оставшиеся переменные представляют собой, как определено в формуле (VID).
Соединение формулы (VIF) может иметь следующую структуру
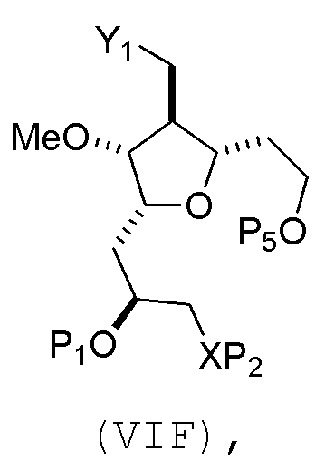
где все переменные представляют собой, как определено в формуле (VID).
Алленовая реакция Принса в получении C.20-C.35, C.16-C.35 и C.14-C35 фрагментов эрибулина
Настоящее изобретение дополнительно относится к способу получения фрагмента эрибулина (например, C.20-C.35, C.16-C.35 и C.14-C35 фрагментов), который может представлять собой промежуточное соединение в получении эрибулина или его фармацевтически приемлемой соли (например, мезилата эрибулина). Преимущества данного способа по сравнению с современным способом получения C.14-C.35, C.16-C.35 и C.20-C.35 фрагментов эрибулина включает сборку, не опосредованную металлом, в которой не применяют C.23 уходящую группу. Кроме того, способ не требует хирального лиганда. Способ включает проведение алленовой реакции Принса на соединении формулы (VIIA), соединении формулы (VIIB) и R3OH, получая промежуточное соединение в получении эрибулина,
где R3 представляет собой необязательно замещенный ацил;
где соединение формулы (VIIA) имеет следующую структуру:
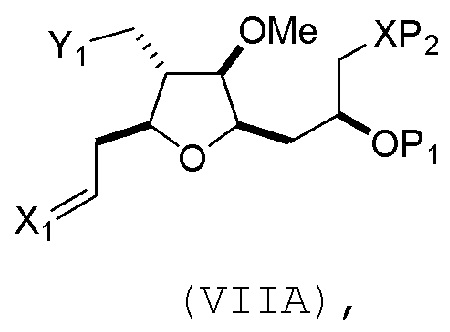
где
Y1 представляет собой SO2R1 или COOR1, и R1 представляет собой необязательно замещенный алкил, необязательно замещенный арил или необязательно замещенный арилалкил;
X1 представляет собой O, или X1, вместе с атомом углерода, с которым X1 группы соединены, образует циклический ацеталь;
X представляет собой O, и
каждый P1 и P2 независимо представляет собой H или защитную группу гидроксила,
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя циклический защищенный диол;
или
X представляет собой N, и
P1 представляет собой H или защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино;
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя аминаль или 1,3-оксазолидин-2-он-5-ил; и
где соединение формулы (VIIB) имеет следующую структуру:
где
R2 представляет собой -CH2-OP3, -CH=CH2, 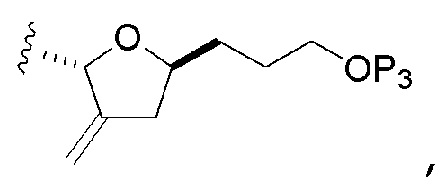
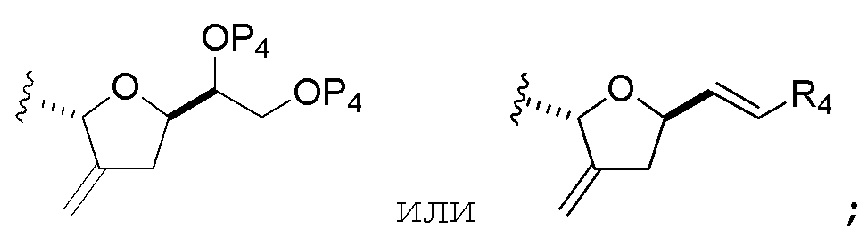
где
P3 представляет собой H или защитную группу гидроксила; каждый P4 независимо представляет собой защитную группу гидроксила, или обе P4 группы, вместе с атомами, с которыми каждая из них соединена, соединяют, образуя циклический защищенный диол; и R4 представляет собой H или -CH2X2CH2CH=CH2, где X2 представляет собой O, -CH2-, или NP5, где P5 представляет собой сульфонил;
и где промежуточное соединение в получении эрибулина представляет собой соединение формулы (VIIC):

где a обозначает R стереогенный центр или S стереогенный центр.
Условия реакции, которые можно применять для получения соединения формулы (VIIC), применяя алленовую реакцию Принса, представляют собой условия, известные в данной области техники для реакции Принса и могут включать реакцию соединения формулы (VIIA), соединения формулы (VIIB) и R3OH с кислотой Льюиса (например, трифторидом бора или его сольватом).
Соединение формулы (VIIC) можно подвергать условиям восстановления аллильного эфира, получая соединение формулы (VIID):
Y1 представляет собой SO2R1 или COOR1, и R1 представляет собой необязательно замещенный алкил, необязательно замещенный арил или необязательно замещенный арилалкил;
R2 представляет собой -CH2-OP3, -CH=CH2, 

где
P3 представляет собой H или защитную группу гидроксила; каждый P4 независимо представляет собой защитную группу гидроксила, или обе P4 группы, вместе с атомами, с которыми каждая из них соединена, соединяют, образуя циклический защищенный диол; и R4 представляет собой H или -CH2X2CH2CH=CH2, где X2 представляет собой O, -CH2-, или NP5, где P5 представляет собой сульфонил;
X представляет собой O, и
каждый P1 и P2 независимо представляет собой H или защитную группу гидроксила,
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя циклический защищенный диол;
или
X представляет собой N, и
P1 представляет собой H или защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино;
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя аминаль или 1,3-оксазолидин-2-он-5-ил.
Соединение формулы (VIIB) можно получить из соединения формулы (VIIF):
где
Y представляет собой хлор, бром, йод или сульфонат; и
R2 представляет собой -CH2-OP3, -CH=CH2, 

где
P3 представляет собой защитную группу гидроксила; каждый P4 независимо представляет собой защитную группу гидроксила, или обе P4 группы, вместе с атомами, с которыми каждая из них соединена, соединяют, образуя циклический защищенный диол; и R4 представляет собой H или -CH2X2CH2CH=CH2, где X2 представляет собой O, -CH2-, или NP5, где P5 представляет собой сульфонил.
Соединение формулы (VIIF) может реагировать с комплексом Pd(0), который можно получить in situ, и основанием, давая соединение формулы (VIIB). Альтернативно, соединение формулы (VIIB) может реагировать с основанием непосредственно (например, N-метилимидазолом), давая соединение формулы (VIIB).
Соединение формулы (VIIB) можно получить из соединения формулы (VIIG):
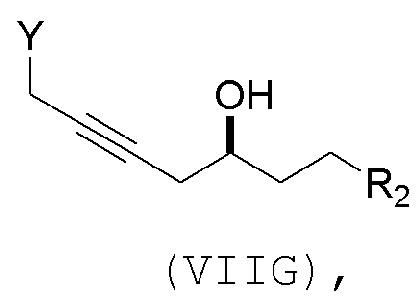
где
Y представляет собой хлор, бром, йод или сульфонат; и
R2 представляет собой -CH2-OP3, -CH=CH2, 

где
P3 представляет собой защитную группу гидроксила; каждый P4 независимо представляет собой защитную группу гидроксила, или обе P4 группы, вместе с атомами, с которыми каждая из них соединена, соединяют, образуя циклический защищенный диол; и R4 представляет собой H или -CH2X2CH2CH=CH2, где X2 представляет собой O, -CH2-, или NP5, где P5 представляет собой сульфонил.
Соединение формулы (VIIG) может реагировать с метилкупратной (I) солью (например, метилцианокупратом лития), образуя соединение формулы (VIIB).
Соединение формулы (VIIB) можно получить из соединения формулы (VIIH):
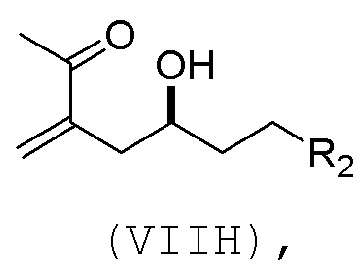
где
R2 представляет собой -CH2-OP3, -CH=CH2, 

где
P3 представляет собой защитную группу гидроксила; каждый P4 независимо представляет собой защитную группу гидроксила, или обе P4 группы, вместе с атомами, с которыми каждая из них соединена, соединяют, образуя циклический защищенный диол; и R4 представляет собой H или -CH2X2CH2CH=CH2, где X2 представляет собой O, -CH2-, или NP5, где P5 представляет собой сульфонил.
Соединение формулы (VIIH) может реагировать с сульфонилгидразидом (например, мезитилсульфонилгидразидом) и основанием (например, органическим основанием, имеющим pKa 10-14).
C.1-C.15 фрагмент
Настоящее изобретение также относится к C.1-C.15 фрагменту эрибулина, который можно применять в получении эрибулина. C.1-C.15 фрагмент можно получить из потока отходов в получении эрибулина, описанного в WO 2005/118565 (смотри получение промежуточного соединения ER-806055). C.1-C.15 фрагмент может представлять собой соединение формулы (VIIIL):
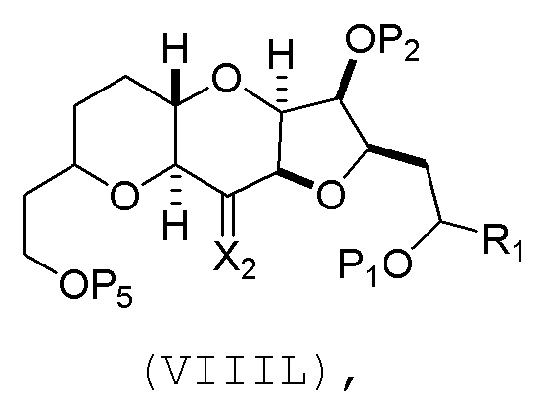
где
R1 представляет собой H или -CH2OP4;
X2 представляет собой оксо, или X2, вместе с атомом углерода, с которым он соединен, образует кеталь или -(CH(OP6))-;
каждый P1 и P4, когда он присутствует, независимо представляет собой H или защитную группу гидроксила, или P1 и P4, когда он присутствует, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя циклический защищенный диол; и
каждый P2, P5, и P6 независимо представляет собой H или защитную группу гидроксила.
Способ получения C.1-C.15 фрагмента может включать:
(A) расщепление двойной связи в соединении формулы (VIIIA), получая соединение формулы (VIIIB), причем соединение формулы (VIIIA) имеет структуру:
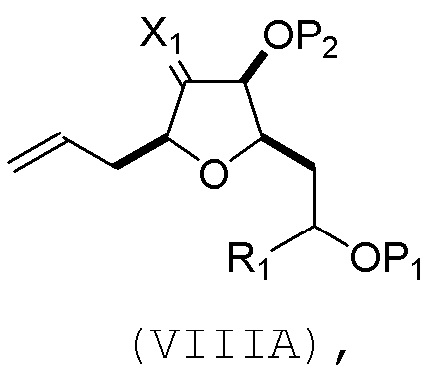
где
X1 представляет собой оксо, или X1, вместе с атомом углерода, с которым он соединен, образует кеталь или -(CH(OP3))-, где P3 представляет собой H или защитную группу гидроксила;
R1 представляет собой H или -CH2OP4;
каждый P1, P2, и P4 независимо представляет собой защитную группу гидроксила, или
P1 и P4, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя циклический защищенный диол; и
соединение формулы (VIIIB), имеющее структуру:
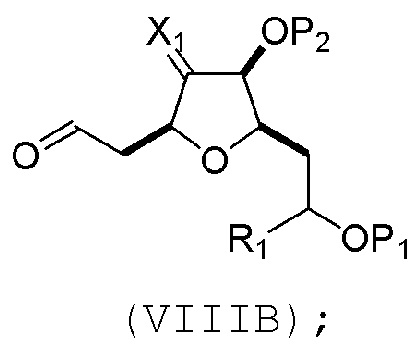
(B) реакцию соединения формулы (VIIIB) с соединением формулы (VIIIB-a), получая соединение формулы (VIIIC):
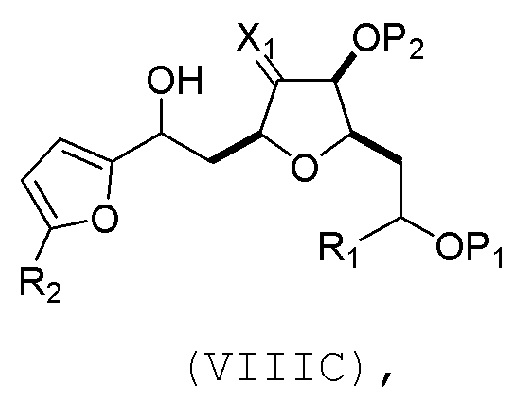
где R2 представляет собой H или -CH2CH2OP5, и P5 представляет собой защитную группу гидроксила;
и соединение формулы (VIIIB-a) имеет следующую структуру:
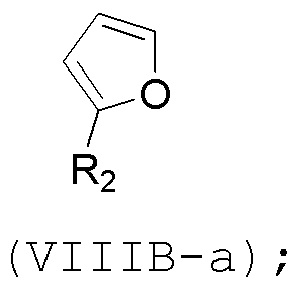
(C) реакцию соединения формулы (VIIIC) с дегидратирующим агентом, получая соединение формулы (VIIID):
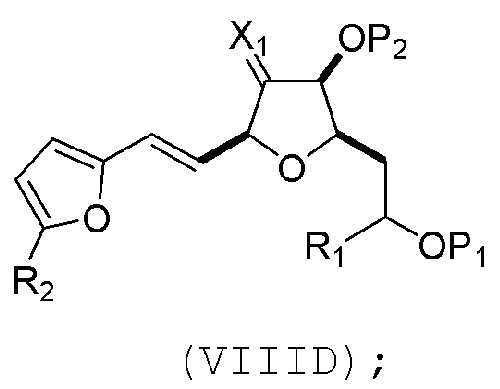
(D) реакцию соединения формулы (VIIID) с дегидроксилирующим агентом, получая соединение формулы (VIIIE):
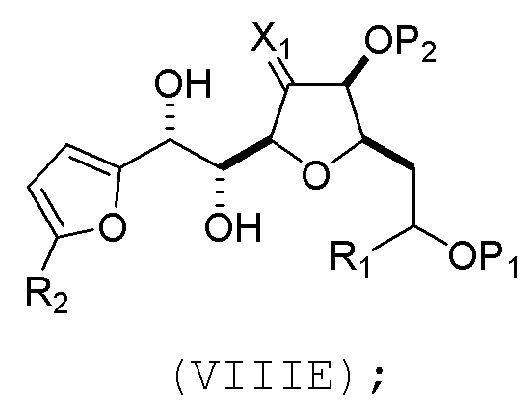
(E) получение соединения формулы (VIIIF) последовательностью реакций, включающей реакцию соединения формулы (VIIIE) с N-бромсукцинимидом, получая первое промежуточное соединение, и (a), когда R2 представляет собой -CH2CH2OP5, контакт указанного первого промежуточного соединения с восстанавливающим агентом (например, гидросиланом и кислотой Бренстеда или Льюиса), или (b) когда R2 представляет собой H, реакцию указанного первого промежуточного соединения с ацилирующим агентом (например, ангидридом карбоновой кислоты), получая второе промежуточное соединение, и аллилирование указанного второго промежуточного соединения, получая соединение формулы (VIIIF):
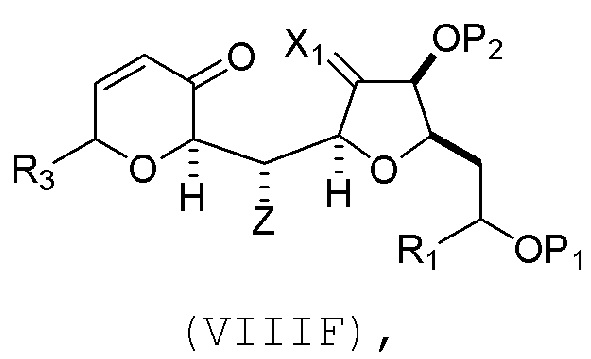
где Z представляет собой эфир или -OP7, где P7 представляет собой H или защитную группу гидроксила, и R3 представляет собой -CH2CH2OP5 или -CH2CH=CH2;
(F) реакцию соединения формулы (VIIIF) с 1,4-восстанавливающим агентом, получая соединение формулы (VIIIG):
(G) образование соединения формулы (VIIIH) последовательностью реакций, включающей реакцию соединения формулы (VIIIG) с кислотой Бренстеда и Y-H, где Y представляет собой необязательно замещенный C1-6 алкил, причем соединение формулы (VIIIH) имеет следующую структуру:
где Y представляет собой необязательно замещенный C1-6 алкиловый эфир; R3 представляет собой -CH2CH2OP5; X2 представляет собой оксо, или X2, вместе с атомом углерода, с которым он соединен, образует кеталь или -(CH(OP6))-, где P6 представляет собой защитную группу гидроксила;
(H) замещение P2 в соединении формулы (VIIIH) -Si(R4)2H, получая соединение формулы (VIIIJ):
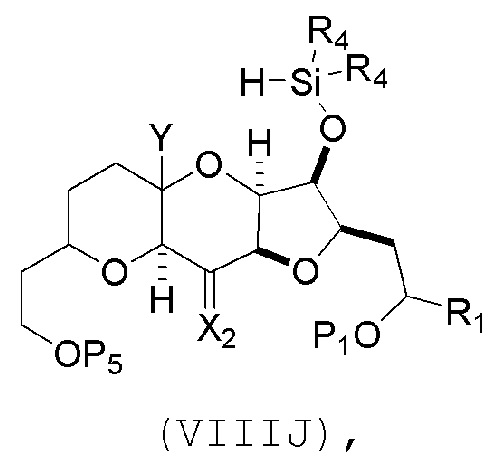
где каждый R4 независимо представляет собой необязательно замещенный алкил, необязательно замещенный арил или необязательно замещенный арилалкил;
(I) реакцию соединения формулы (VIIIJ) с кислотой Льюиса, получая соединение формулы (VIIIK):
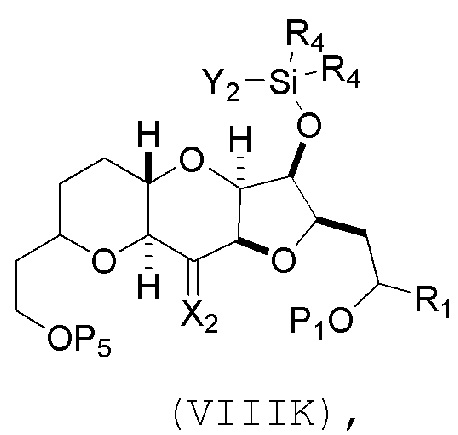
где Y2 представляет собой фтор, хлор или бром;
и
(J) реакцию соединения формулы (VIIIK) с агентом, удаляющим защитную группу гидроксила, и затем реакцию с защищающим гидроксил агентом, получая соединение формулы (VIIIL):
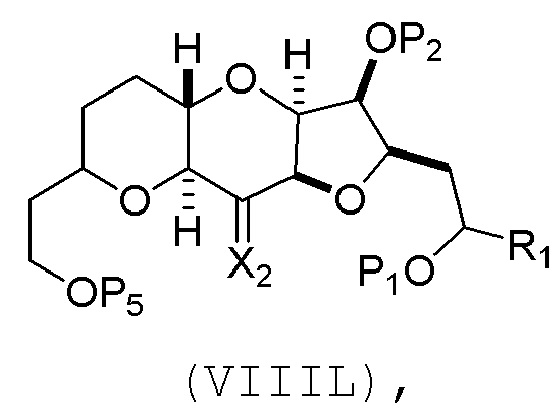
где P2 представляет собой защитную группу гидроксила.
Соединения
Настоящее изобретение также относится к соединениям, которые можно применять в получении эрибулина или его фармацевтически приемлемой соли (например, мезилата эрибулина), например, соединениям формулы (IA), (IB), (IC), (ID), (IE), (IIA), (IIB), (IIC), (IIIA), (IIIB), (IIIC), (IVA), (IVB), (IVC), (IVD), (VA), (VB), (VIA), (VIB), (VIC), (VID), (VIIB), (VIIC), (VIIF), (VIIG), (VIIH) или (VIIIL), или их солям. Настоящее изобретение также включает соединение формулы (VIIE):
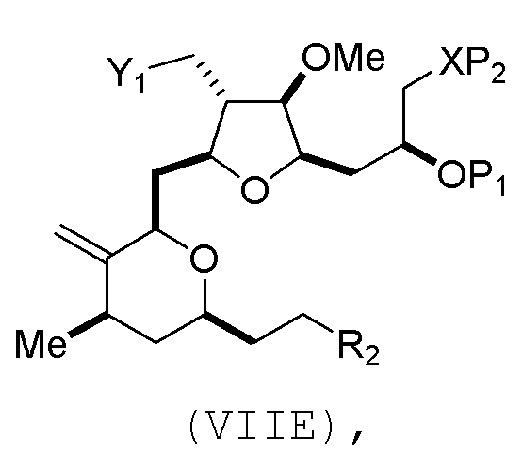
или его соль,
где
Y1 представляет собой SO2R1 или COOR1, и R1 представляет собой необязательно замещенный алкил, необязательно замещенный арил или необязательно замещенный арилалкил;
R2 представляет собой -CH2-OP3, -CH=CH2, 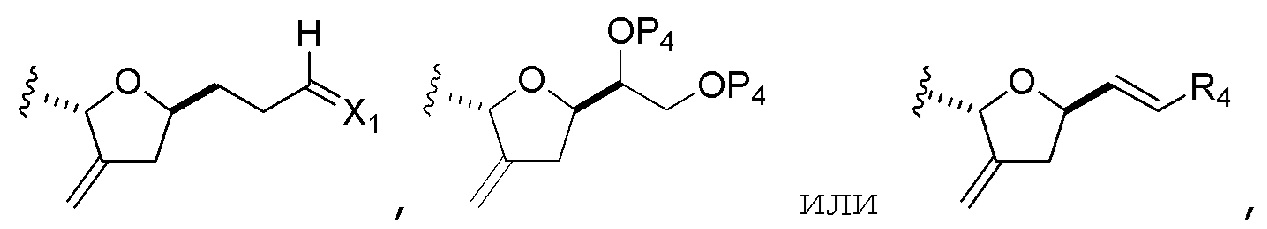
где X1 представляет собой оксо, или X1 комбинируют вместе с атомом углерода, с которым он соединен, образуя -(CH(OP3))-; каждый P3 независимо представляет собой H или защитную группу гидроксила; каждый P4 независимо представляет собой H или защитную группу гидроксила, или обе P4 группы, вместе с атомами, с которыми каждая из них соединена, соединяют, образуя циклический защищенный диол; R4 представляет собой H, CHO, или -CH2X2CH2CH=CH2, где X2 представляет собой O, -CH2-, или NP5, где P5 представляет собой сульфонил; и
X представляет собой N, и P1 представляет собой H или защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино; или P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя аминаль или 1,3-оксазолидин-2-он-5-ил.
Настоящее изобретение включает соединение формулы (IVE):
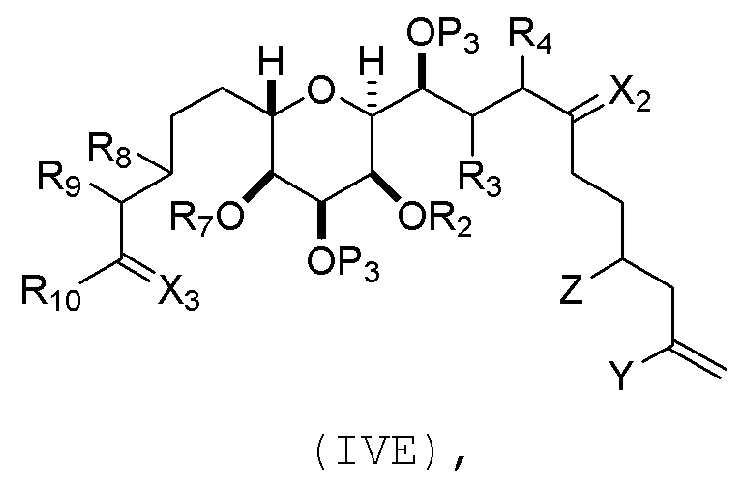
где
Y представляет собой йодид, бромид или трифторметансульфонат;
Z представляет собой эфир, сульфонат, хлорид, бромид или йодид;
каждый P3 независимо представляет собой H или защитную группу гидроксила, и X2 представляет собой оксо; или обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь;
(a1) R2 представляет собой H или защитную группу гидроксила, R3 и R4 соединяют, образуя двойную связь;
или
(a2) R2 и R3 соединяют, образуя связь, и R4 представляет собой H;
(b1) R7 и R8 соединяют, образуя связь, и R9 представляет собой H;
или
(b2) R7 представляет собой H или защитную группу гидроксила, и R8 и R9 соединяют, образуя двойную связь; и
(c1) X3 представляет собой оксо, и R10 представляет собой H или -OP5, где P5 представляет собой H или эфирную защитную группу гидроксила;
или
(c2) X3 и R10 комбинируют с атомом углерода, с которым они соединены, образуя ацеталь или -CH2OP6, где P6 представляет собой H или защитную группу гидроксила.
Настоящее изобретение включает соединение формулы (VIE):
где
Y представляет собой йодид, бромид или трифторметансульфонат;
(a1) R3 представляет собой H или защитную группу гидроксила, R4 и R5 соединяют, образуя двойную связь, каждый P3 независимо представляет собой H или защитную группу гидроксила, и X2, вместе с атомом углерода, с которым он соединен, образует карбонил или -(CH(OR6))-;
или
(a2) R3 и R4 соединяют, образуя связь, R5 представляет собой H, и
каждый P3 независимо представляет собой H или защитную группу гидроксила, и X2, вместе с атомом углерода, с которым он соединен, образует карбонил или -(CH(OR6))-;
или
обе P3 группы и X2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя кеталь;
(b1) Z представляет собой хлорид, бромид или йодид, и R1 и R2 соединяют, образуя связь;
или
(b2) Z и R2 соединяют, образуя двойную связь, и R1 представляет собой H или защитную группу гидроксила;
(c1) X3 представляет собой оксо, и R8 представляет собой H или -OR9, где R9 представляет собой H или защитную группу гидроксила;
(c2) X3 и R8 соединяют с атомом углерода, с которым они соединены, образуя ацеталь;
(c3) X3 и R8 соединяют с атомом углерода, с которым они соединены, образуя -CH2OR6;
или
(c4) X3 и R8 соединяют с атомом углерода, с которым они соединены, образуя -CN;
и
X представляет собой O, и
каждый P1 и P2 независимо представляет собой H или защитную группу гидроксила,
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя циклический защищенный диол;
или
X представляет собой N, и
P1 представляет собой H или защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино;
или
P1 и P2, вместе с атомами, с которыми каждый из них соединен, соединяют, образуя аминаль или 1,3-оксазолидин-2-он-5-ил;
где каждый R6 независимо представляет собой H или защитную группу гидроксила.
Аминирование
Условия аминирования могут представлять собой условия, известные в данной области техники. В неограничивающем примере, C.35 гидроксил в соединении формулы (IC) (например, соединении формулы (IC), в котором каждый P1 и P2 представляет собой H, и X представляет собой O) можно сульфонилировать (например, реакцией ангидридом сульфокислоты или сульфонилхлоридом) и подвергать реакции с источником азота (например, аммиаком, азидом, сульфаминовой кислотой, мочевиной (H2NCONH2) или тиомочевиной (H2NCSNH2)), получая эрибулин или его фармацевтически приемлемую соль после оптимального деблокирования аминогруппы (если источник азота представлял собой азид, мочевину или тиомочевину). В другом неограничивающем примере, C.35 гидроксил в соединении формулы (IC) (например, соединении формулы (IC), в котором P1 представляет собой защитную группу гидроксила, и P2 представляет собой H, и X представляет собой O) можно галогенировать (например, реакцией Аппеля или реакцией с тионилхлоридом, сульфурилхлоридом, хлоридом фосфора (III) или оксихлоридом фосфора(V)) и подвергать реакции с источником азота (например, аммиаком, азидом, сульфаминовой кислотой, фталимидной солью, мочевиной (H2NCONH2) или тиомочевиной (H2NCSNH2)), получая эрибулин или его фармацевтически приемлемую соль после оптимального деблокирования аминогруппы (если источник азота представлял собой азид, фталимидную соль, мочевину или тиомочевину). В еще другом неограничивающем примере, C.35 гидроксил в соединении формулы (IC) (например, соединении формулы (IC), в котором P1 представляет собой защитную группу гидроксила, и X и P2 соединяют, образуя необязательно защищенный амино) может реагировать с агентом, удаляющим защитную группу гидроксила, давая эрибулин (когда X и P2 соединяют, образуя деблокированный амино) или, когда X и P2 соединяют, образуя защищенный амино, или до или после обработки агентом, удаляющим защитную группу гидроксила, соединение формулы (IC) может реагировать с агентом, деблокирующим амино, давая эрибулин. Деблокирующие аминогруппу агенты дополнительно описаны в настоящем изобретении. Реакция аминирования может непосредственно давать фармацевтически приемлемую соль эрибулина. Альтернативно, реакция аминирования может давать эрибулин в свободной основной форме. Фармацевтически приемлемую соль эрибулина можно получить из эрибулина реакцией солеобразования, как описано в настоящем изобретении.
Солеобразование
Условия реакции солеобразования являются известными в данной области техники. Солеобразование эрибулина может давать фармацевтически приемлемую соль эрибулина (например, мезилат эрибулина). В частности, реакция солеобразования может включать контакт эрибулина с кислотой Бренстеда (например, фармацевтически приемлемой кислотой Бренстеда (например, метансульфокислотой)), давая фармацевтически приемлемую соль эрибулина (например, Handbook of Pharmaceutical Salts: Properties, Selection and Use, ed.: Stahl and Wermuth, Wiley-VCH/VHCA, Weinheim/Zurich, 2002). Фармацевтически приемлемые соли эрибулина, например, мезилат эрибулина, можно получить способами, известными в данной области техники, например, in situ в процессе финального выделения и очистки соединения или отдельно реакцией свободной основной группы с подходящей органической кислотой. В одном примере, эрибулин обрабатывают раствором MsOH и NH4OH в воде и ацетонитриле. Смесь концентрируют. Остаток растворяют в смеси DCM-пентан, и раствор добавляют к безводному пентану. Полученный в результате осадок фильтруют и сушат при высоком вакууме, получая мезилат эрибулина.
Окисляющие агенты, способные превращать спирт в карбонильную группу
Окисляющие агенты, способные превращать спирт в карбонильную группу, являются известными в данной области техники. Неограничивающие примеры данных окисляющих агентов включают периодинан Десс-Мартина, TEMPO (в присутствии извести или BAIB), диметилсульфониевое соединение (например, хлорид диметилхлорсульфония), триалкоксид алюминия с избытком кетона (например, ацетона) и каталитический перрутенат тетрапропиламмония (TPAP) (в присутствии N-метилморфолиноксида). Диметилсульфониевое соединение можно получить in situ в условиях, известных для окисления по Перику-Дерингу, окисления по Сверну, окисления по Кори-Киму или окисления по Пфицнеру-Моффатту. Реакцию окисления спирта до карбонильной группы (например, кетона) можно проводить, применяя триалкоксид алюминия и избыток кетона (например, ацетона) в условиях, известных в данной области техники для окисления по Оппенауэру. Аллиловый и бензиловый спирты можно также окислить MnO2.
Восстанавливающие агенты
Восстанавливающие агенты, которые можно применять в способах настоящего изобретения, представляют собой агенты, известные в данной области техники. Восстанавливающий агент может представлять собой восстанавливающий агент, являющийся донором электронов, гидрид металла или гидрид амфотерного металла. Неограничивающие примеры восстанавливающего агента, являющегося донором электронов, включают щелочные металлы со степенью окисления (0), щелочноземельные металлы со степенью окисления (0), щелочные арениды, лантанидные (II) соли (например, SmI2), Zn(0), Fe(0) и Mn(0). Неограничивающие примеры гидридов металлов и гидридов амфотерных металлов включают боргидридные соединения (например, NaBH4, LiBH4, LiB(Et)3H, селектриды (например, L-селектрид) и бораны (например, 9-BBN и альпинборан)), алюмогидридные соединения (например, LiAlH4, Red-Al® и аланы (например, DIBAL)), гидросиланы (например, PMHS и Ph2SiH2), гидростаннаны (например, Bu3SnH), медь-гидридные комплексы (например, реагент Страйкера), палладий-гидридные комплексы, платина-гидридные комплексы, иридий-гидридные комплексы, родий-гидридные комплексы и рутений-гидридные комплексы. Восстанавливающие агенты можно получить in situ, например, медь-гидридный комплекс можно получить реакцией соли меди, например, с боргидридным соединением или гидросиланом. Таким образом, некоторые восстанавливающие агенты (например, боргидридные соединения, гидросиланы и гидростаннаны) можно применять в комбинации с каталитическим количеством соли металла (например, солью Cu, Pd, Pt, Ir, Rh или Ru). Альтернативно, каталитические восстанавливающие агенты могут представлять собой соли металлов (например, изопропоксид алюминия или рутениевый комплекс) в комбинации со спиртом, которые подвергают гидрированию с переносом водорода содержащие карбонильную группу соединения без посредничества гидрида металла. Неограничивающие примеры реакций гидрирования с переносом водорода включают восстановление по Меервейну-Пондорфу-Верли (например, применяя изопропоксид алюминия/изопропанол) и катализируемое Ru гидрирование с переносом водорода (например, Hashiguchi et al., J. Am. Chem. Soc., 117:7562-7563, 1995).
Когда субстрат представляет собой α,β-ненасыщенное карбонильное соединение (например, α,β-енон), восстанавливающий агент может представлять собой 1,2-восстанавливающий агент или 1,4-восстанавливающий агент. Например, реакция между α,β-ненасыщенным карбонильным соединением и 1,2-восстанавливающим агентом может давать, например, аллиловый спирт (или аллиламин, если исходное соединение представляет собой енамид), тогда как реакция между α,β-ненасыщенным карбонильным соединением и 1,4-восстанавливающим агентом может давать α,β-насыщенное соединение и может оставлять карбонильную группу интактной после обработки реакционной смеси. Неограничивающие примеры 1,2-восстанавливающих агентов включают гидриды металлов и гидриды амфотерных металлов, например, алюмогидридные соединения, боргидридные соединения (например, CeCl3 с NaBH4) и рутений-гидридные комплексы. Неограничивающие примеры 1,4-восстанавливающих агентов включают боргидридные соединения, гидростаннаны, медь-гидридные комплексы (например, реагент Страйкера), палладий-гидридные комплексы, платина-гидридные комплексы, иридий-гидридные комплексы, родий-гидридные комплексы и рутений-гидридные комплексы.
Соединение, содержащее аллильную уходящую группу (например, карбоксилат, галогенид или сульфонат) можно обрабатывать аллильным восстанавливающим агентом, замещая уходящую группу атомом водорода. Неограничивающий пример аллильных восстанавливающих агентов представляет собой палладиевую соль в комбинации с солью муравьиной кислоты (например, формиатом триалкиламмония).
Защищенные амины и деблокирующие аминогруппу агенты
Соединения, применяемые в способах настоящего изобретения, могут содержать защищенный или незащищенный амин (например, при C.35 углероде структуры эрибулина). Незащищенный амин представляет собой -NH2. Амин можно защищать, применяя способы, известные в данной области техники, например, защитой амина N-защитной группой. Альтернативно, амин можно защищать в виде содержащей азот группировки, которая может реагировать с деблокирующим амин агентом, давая амин. Неограничивающие примеры содержащих азот группировок включают азид, имид (например, фталимид), деблокирующие амин агенты могут представлять собой агенты, известные в данной области техники для удаления N-защитных групп из аминов. В неограничивающем примере, Boc группу можно удалять, применяя деблокирующие амин агенты, известные в данной области техники, например, кислоту Бренстеда (например, HCl в 1,4-диоксане или трифторуксусную кислоту). Когда амин защищен в виде азида, амин можно деблокировать воздействием на соединение, содержащее защищенный амин, условий реакции Штаудингера (например, контактом с фосфином, таким как триалкилфосфин, диалкиларилфосфин, алкилдиарилфосфин или триарилфосфин) или реакцией соединения, содержащего защищенный амин, с восстанавливающим агентом (например, LiAlH4). Когда амин защищен в виде имида (например, фталимида), амин можно деблокировать реакцией с деблокирующим амин агентом, известным в данной области техники, например, гидразином.
Защитные группы гидроксила и агенты, удаляющие защитные группы гидроксила
Защитные группы гидроксила могут представлять собой, как определено в настоящем изобретении. В частности, защитная группа гидроксила может представлять собой ацил, сульфонил, арилалкил (например, бензил или п-метоксибензил), арил (например, п-метоксифенил) или необязательно замещенный силил (например, TMS, TES, TBS, TIPS, TBDPS или TPS). Защитные группы гидроксила, защищающие гидроксил агенты и условия реакций защиты гидроксилов можно выбрать для селективной защиты определенных гидроксильных групп в соединении, оставляя другие гидроксильные группы незащищенными. Выбор защитных групп гидроксила для соединения может облегчать стратегии последующего деблокирования, поскольку некоторые защитные группы гидроксила можно удалять в присутствии других, применяя подходящие агенты, удаляющие защитные группы гидроксилов. Некоторые из данных стратегий, включающие выбор силильных защитных групп гидроксилов, обсуждаются, например, в Silicon-Based Blocking Agents, Gelest, Inc., 2011.
Агенты, удаляющие защитную группу гидроксила, представляют собой агенты, которые могут реагировать с соединением, содержащим защищенную гидроксильную группу, давая соединение с деблокированной гидроксильной группой. Агенты, удаляющие защитную группу гидроксила, и условия реакции деблокирования могут представлять собой агенты и условия, известные в данной области техники. В неограничивающем примере, гидроксил, защищенный в виде силильного эфира, можно деблокировать реакцией с источником фтора (например, фторидной солью, такой как KF или TBAF). Альтернативно, гидроксил, защищенный в виде TMS или TES эфира, можно деблокировать реакцией с кислотой Бренстеда (например, карбоновой кислотой). В другом неограничивающем примере, гидроксил, защищенный в виде эфира, можно деблокировать реакцией с C1-6 алкоксидом (например, щелочным C1-6 алкоксидом или щелочно-земельным C1-6 алкоксидом). В еще другом неограничивающем примере, гидроксил, защищенный в виде арилалкилового эфира (например, 1-арилалк-1-илового эфира), можно деблокировать, применяя реакцию восстановления, например, Pd/C и H2 или Na/NH3. Альтернативно, гидроксил, защищенный в виде алкоксиарилалкилового эфира (например, MPM эфира), можно деблокировать реакцией с 2,3-дихлор-5,6-дициано-1,4-бензохиноном (DDQ). В еще другом неограничивающем примере, гидроксил, защищенный в виде алкоксиалкилового эфира (например, 1-алкоксиалк-1-ила) или THP эфира, можно деблокировать реакцией с кислотой Бренстеда. Циклический защищенный диол, такой как ацетали или кетали (например, как 2-алкил-1,3-диоксолан, 2,2-диалкил-1,3-диоксолан, 2-алкил-1,3-диоксан или 2,2-диалкил-1,3-диоксан), можно деблокировать реакцией с кислотой Бренстеда (например, карбоновой кислотой).
Дигидроксилирование и окислительное расщепление углерод-углеродной связи
Реакция дигидроксилирования дает диолы из олефинов. Условия реакции могут представлять собой условия, известные в данной области техники. Реакция дигидроксилирования может быть непосредственной (например, дигидроксилирование по Шарплесу, дигидроксилирование по Апджону или дигидроксилирование по Миласу) или опосредованной (например, через эпоксидирование/гидролиз, диборилирование/окисление или карбоксилирование/гидролиз (например, реакцию Вудворда или реакцию Превоста)). Непосредственную реакцию дигидроксилирования можно проводить, применяя комплекс осмия (например, OsO4 или осматную соль). Каталитическое количество осмиевого комплекса можно применять в реакциях дигидроксилирования в комбинации с дополнительным окисляющим агентом (например, N-метилморфолин N-оксидом или пероксидом водорода). Реакции дигидроксилирования можно придавать стереоселективность включением хирального лиганда (например, в AD-смеси, которая представляет собой смесь осмата и хирального лиганда).
Когда реакцию дигидроксилирования проводят с комплексом осмия и периодатной солью в качестве окисляющего агента, углерод-углеродная двойная связь олефина может расщепляться, давая две карбонильные группы. Превращение олефина в две карбонильные группы называют в настоящем изобретении расщеплением олефинов. Условия реакции расщепления могут представлять собой условия, известные в данной области техники. Неограничивающие примеры условий реакции расщепления могут представлять собой условия реакции озонолиза или реакции с комплексом осмия (например, OsO4 или осматной солью) и периодатной солью. Вицинальный диол можно расщеплять периодатом натрия или перманганатом калия.
Эпимеризация
Реакции эпимеризации можно применять для обращения стереогенного центра, имеющего нежелательную стереохимию. Например, посредством эпимеризации, R стереогенный центр можно превратить в S стереогенный центр и наоборот. Эпимеризацию стереогенного sp3-углерода, соединенного с одним атомом водорода и с одной гидроксильной группой, можно осуществлять последовательностью реакций, включающей окисление гидроксильной группы до карбонильной группы, с последующей реакцией 1,2-восстановления. Реакция 1,2-восстановления может давать требуемую стереохимию диастереоселективно, или реакцию можно осуществлять, применяя хиральный катализатор, хиральное вспомогательное вещество или хиральный восстанавливающий агент. Неограничивающие примеры хиральных восстанавливающих агентов включают альпинборан и прапинборан. Неограничивающие примеры реакций 1,2-восстановления, включающих хиральные катализаторы, представляют собой восстановление по Кори-Бакши-Шибата, гидрирование по Нойори и гидрирование с переносом водорода по Нойори. Последовательность реакций окисления/восстановления можно осуществлять in situ, применяя динамическое кинетическое разделение рацематов. Динамическое кинетическое разделение рацематов может дополнительно включать реакцию с защищающим гидроксил агентом, который удаляет требуемый стереоизомер из равновесия восстановления/окисления. В неограничивающем примере, динамическое кинетическое разделение хиральных вторичных спиртов может включать уравновешивание восстановления/окисления, применяя η5-Ph5CpRu(CO)2H в комбинации с энантиоселективной этерификацией, применяя изопропенилацетат, катализируемой липазным ферментом (например, липазой B из Candida Antarctica, смотри, например, Martin-Matute et al., J. Am. Chem. Soc., 127:8817-8825, 2005).
Эпимеризацию можно также осуществлять на соединении, содержащем тетрагидропиран-2-ил-ацетальдегидную группу, в которой углерод 2 пиранового кольца имеет нежелательную стереохимию. Контакт данного соединения с L-пролином может обеспечивать равновесие между двумя стереоизомерами. Если другие, неуравновешивающиеся стереогенные центры присутствуют в соединении, самый стабильный стереоизомер будет присутствовать в большем количестве по сравнению с другим стереоизомером (стереоизомерами) в равновесии с самым стабильным стереоизомером.
Следующие примеры предполагаются для иллюстрации настоящего изобретения. Они не предполагаются ограничивающими настоящее изобретение любым способом.
Примеры
Пример 1-получение C.1-C.15 фрагмента
(2S,3S,4R,5R)-2-аллил-4-(бензилокси)-5-((2,2-диметил-1,3-диоксолан-4-ил)метил)тетрагидрофуран-3-ол
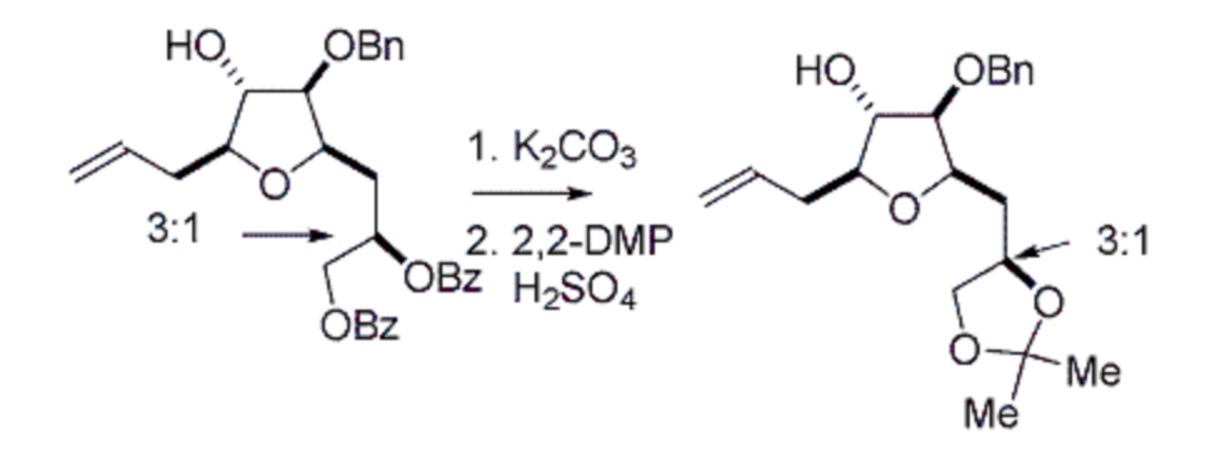
Диастереомерную смесь 3:1 (600 г) (R)-3-((2R,3R,4S,5S)-5-аллил-3-(бензилокси)-4-гидрокситетрагидрофуран-2-ил)пропан-1,2-диилдибензоата и (S)-3-((2R,3R,4S,5S)-5-аллил-3-(бензилокси)-4-гидрокситетрагидрофуран-2-ил)пропан-1,2-диилдибензоата растворяли в метаноле (1800 мл) при температуре окружающей среды. Добавляли карбонат калия (241 г, 1742 ммоль), и полученную в результате смесь перемешивали при 55-60°C в течение 4 часов. Добавляли воду (1500 мл), и полученную в результате смесь экстрагировали четыре раза н-гептаном (2400 мл каждый раз). Водный слой разбавляли водой (1200 мл) и экстрагировали дважды этилацетатом (3000 мл каждый раз). Объединенные органические слои концентрировали в вакууме и азеотропно упаривали дважды с толуолом (1200 мл, каждый раз). После добавления ацетона (1200 мл), образовывался белый нерастворимый материал. Смесь фильтровали через 200 г слой силикагеля, который затем промывали ацетоном (1200 мл). Объединенный фильтрат концентрировали в вакууме, получая 216 г коричневого масла, которое растворяли в ацетоне (864 мл) при температуре окружающей среды. Добавляли 2,2-диметоксипропан (103 мл, 841 ммоль) и серную кислоту (1,9 мл, 35 ммоль). Полученную в результате смесь перемешивали в течение 4 часов, и затем обрабатывали насыщенным водным NaHCO3 (8%) (216 мл) и водой (540 мл). Полученную в результате смесь экстрагировали дважды MTBE (864 мл каждый раз). Объединенные органические слои промывали дважды 30% водным NaCl (430 мл каждый раз), и затем три раза водой (450 мл каждый раз). Полученный в результате органический слой концентрировали в вакууме и азеотропно упаривали дважды с толуолом (864 мл), получая 219 г целевого продукта в виде коричневого масла. 1H ЯМР (3:1 диастереомерная смесь, 400 МГц, CDCl3) δ ppm 1,31 (с, 3 H (меньший)) 1,36 (с, 3 H (больший)) 1,40 (с, 3 H) 1,93 (т, J=6,4 Гц, 2 H) 1,96-2,09 (м, 1 H) 2,32-2,41 (м, 1 H) 2,42-2,52 (м, 1 H) 3,53-3,62 (м, 1 H) 3,66 (тд, J=6,7, 4,7 Гц, 1 H) 3,79 (дд, J=4,7, 2,1 Гц, 1 H (больший)) 3,81 (дд, J=4,7, 2,1 Гц, 1 H (меньший)) 3,97-4,04 (м, 1 H) 4,06-4,12 (м, 1 H) 4,12-4,17 (м, 1 H) 4,24 (дт, J=13,1, 6,5 Гц, 1 H) 4,51 (д, J=12,0 Гц, 1 H (меньший)) 4,54 (д, J=12,0 Гц, 1 H (больший)) 4,65 (д, J=11,7 Гц, 1 H (больший)) 4,66 (д, J=12,0 Гц, 1 H (меньший)) 5,05-5,18 (м, 2 H) 5,77-5,93 (м, 1 H) 7,28-7,41 (м, 5 H).
4-(((2R,3S,4S,5S)-5-аллил-3-(бензилокси)-4-((4-метоксибензил)окси)тетрагидрофуран-2-ил)метил)-2,2-диметил-1,3-диоксолан
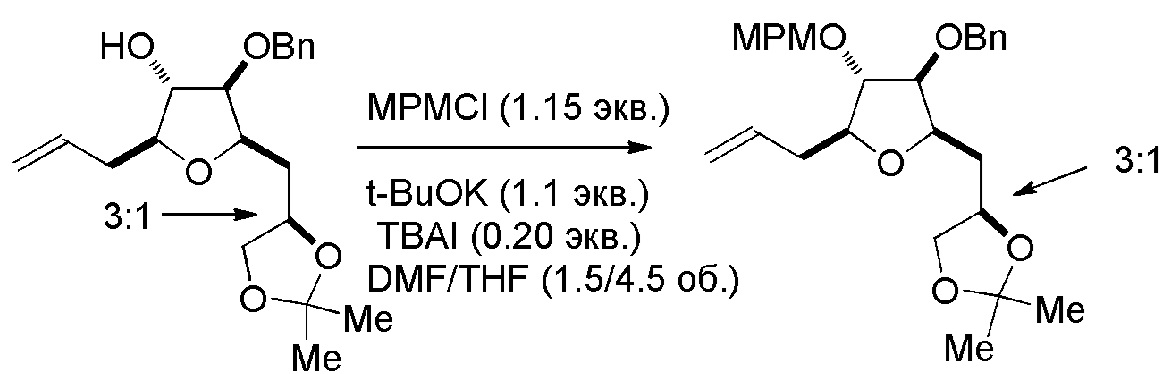
3:1 диастереомерную смесь (2S,3S,4R,5R)-2-аллил-4-(бензилокси)-5-(((R)-2,2-диметил-1,3-диоксолан-4-ил)метил)тетрагидрофуран-3-ола и (2S,3S,4R,5R)-2-аллил-4-(бензилокси)-5-(((S)-2,2-диметил-1,3-диоксолан-4-ил)метил)тетрагидрофуран-3-ола (219 г, 629 ммоль) азеотропно упаривали с безводным THF (329 мл). Полученное в результате масло добавляли в реактор с DMF (329 мл). Добавляли TBAI (46,4 г, 126 ммоль), и полученную в результате смесь охлаждали до температуры в диапазоне 0-5°C. 1,0 M калиевое производное трет-бутилового спирта (691 мл, 691 ммоль) добавляли при такой скорости, чтобы поддерживать температуру внутри реактора ниже 10°C. После добавления, реакцию перемешивали в течение 15 минут. Затем, добавляли альфа-хлор-4-метокситолуол (98 мл, 720 ммоль) при такой скорости, чтобы поддерживать температуру внутри реактора ниже 15 oC. После добавления, реакцию перемешивали при 0-5°C. После полного потребления исходного соединения, реакцию гасили MeONa (25%) в MeOH растворе (21,6 мл, 94,3 ммоль), разбавленном в безводном метаноле (288 мл), при такой скорости, чтобы температура внутри реактора оставалась ниже 10°C. Затем, смесь нагревали до 20-25°C, и затем концентрировали в вакууме, удаляя летучие компоненты. Оставшийся раствор распределяли между водой (1095 мл) и MTBE (1643 мл). Органический слой промывали дважды 30% водным NaCl (876 мл), сушили над MgSO4, фильтровали и концентрировали в вакууме. Полученный в результате остаток разбавляли MTBE (219 мл), и оставшийся твердый остаток отфильтровывали. Фильтрат концентрировали в вакууме, получая 295 г целевого продукта в виде красновато-коричневого масла. 1H ЯМР (3:1 диастереомерная смесь, 400 МГц, CDCl3) δ ppm 1,31 (с, 3 H (меньший)) 1,35 (с, 3 H (больший)) 1,37-1,42 (м, 3 H) 1,87-2,03 (м, 2 H) 2,26-2,52 (м, 2 H) 3,57 (т, J=7,9 Гц, 1 H) 3,72 (дд, J=7,3, 3,5 Гц, 1 H (больший)) 3,74 (д, J=3,2 Гц, 1 H (меньший)) 3,78-3,86 (м, 5 H) 3,98-4,14 (м, 2 H) 4,15-4,30 (м, 1 H) 4,33-4,41 (м, 2 H) 4,42-4,46 (м, 1 H) 4,57 (д, J=12,0 Гц, 1 H) 5,00-5,10 (м, 2 H) 5,73-5,91 (м, 1 H) 6,85-6,91 (м, 2 H) 7,19-7,24 (м, 2 H) 7,27-7,39 (м, 5 H)
2-((2S,3S,4S,5R)-4-(бензилокси)-5-((2,2-диметил-1,3-диоксолан-4-ил)метил)-3-((4-метоксибензил)окси)тетрагидрофуран-2-ил)ацетальдегид
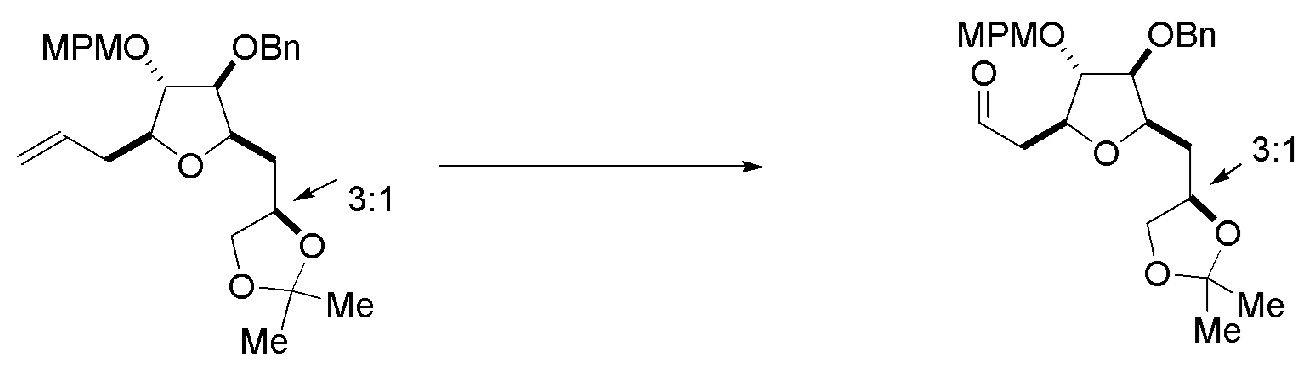
3:1 диастереомерная смесь 2-((2S,3S,4S,5R)-4-(бензилокси)-5-(((R)-2,2-диметил-1,3-диоксолан-4-ил)метил)-3-((4-метоксибензил)окси)тетрагидрофуран-2-ил)ацетальдегида и 2-((2S,3S,4S,5R)-4-(бензилокси)-5-(((S)-2,2-диметил-1,3-диоксолан-4-ил)метил)-3-((4-метоксибензил)окси)тетрагидрофуран-2-ил)ацетальдегида (100 г, 213 ммоль) растворяли в 1,4-диоксане (600 мл) и воде (200 мл). Добавляли 2,6-лутидин (49,7 мл, 427 ммоль) и раствор осмиевой кислоты (2,5% по массе, 25 мл, 2,458 ммоль) в трет-BuOH. Полученную в результате смесь охлаждали до температуры ниже 20°C и добавляли метапериодат натрия (137 г, 640 ммоль). После перемешивания в течение 5 часов при температуре окружающей среды, реакционную смесь обрабатывали водой (1250 мл). Полученную в результате смесь экстрагировали дважды толуолом (1000 мл каждый раз). Объединенные органические слои промывали последовательно раствором сульфита натрия (40,3 г, 320 ммоль) в воде (200 мл), 1,0 M хлористоводородной кислотой в воде (500 мл, 500 ммоль), насыщенным водным NaHCO3 (8%) (200 мл) и 30% водным NaCl (200 мл). Органический слой концентрировали в вакууме, и остаток фильтровали через слой силикагеля (150 мл), который промывали н-гептаном/этилацетатом (1/1=1000 мл). Концентрирование в вакууме давало 102 г целевого продукта в виде темно-коричневого масла. 1H ЯМР (3:1 диастереомерная смесь, 400 МГц, CDCl3) δ ppm 1,31 (с, 1 H(меньший)) 1,35 (с, 3 H(больший)) 1,39 (с, 3 H) 1,87-2,14 (м, 2 H) 2,66 (дд, J=5,8, 1,8 Гц, 1 H) 2,70-2,78 (м, 1 H) 3,55 (дд, J=8,2, 7,3 Гц, 1 H) 3,76 (дд, J=2,9, 0,8 Гц, 1 H(больший)) 3,77 (дд, J=2,7, 0,6 Гц, 1 H(меньший)) 3,79-3,84 (м, 4 H) 4,00 (дд, J=7,8, 6,0 Гц, 1 H(больший)) 4,06 (дд, J=8,2, 5,8 Гц, 1 H(меньший)) 4,12 (дт, J=8,9, 3,8 Гц, 1 H) 4,17-4,24 (м, 1 H) 4,28 (ддд, J=7,3, 5,6, 2,9 Гц, 1 H) 4,36-4,50 (м, 3 H) 4,54 (д, J=12,2 Гц, 1 H) 4,55 (д, J=11,9 Гц, 1 H) 6,85-6,91 (м, 2 H) 7,15-7,39 (м, 7 H) 9,73 (т, J=2,0 Гц, 1 H)
2-((2S,3S,4S,5R)-4-(бензилокси)-5-(((R)-2,2-диметил-1,3-диоксолан-4-ил)метил)-3-((4-метоксибензил)окси)тетрагидрофуран-2-ил)-1-(фуран-2-ил)этан-1-ол
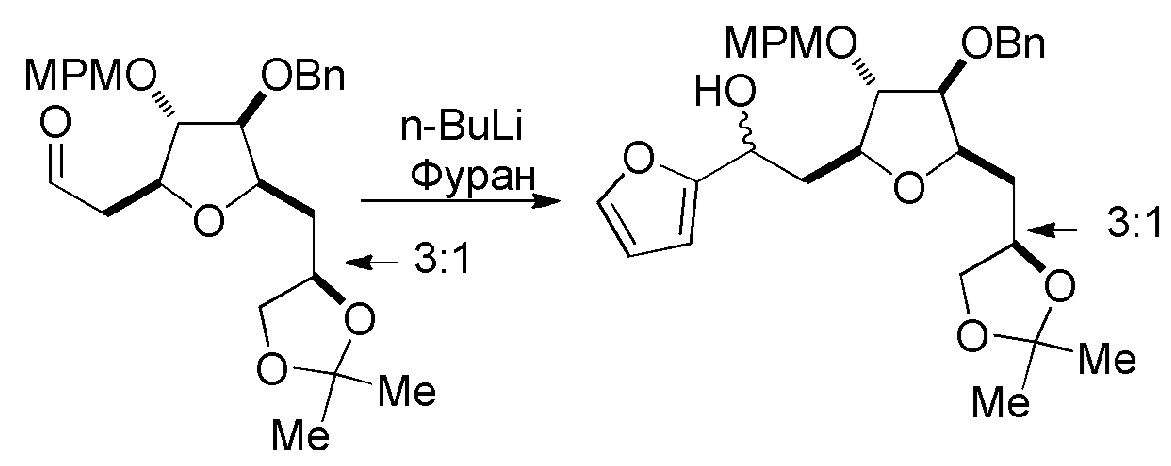
Фуран (22,40 мл, 308,0 ммоль) и THF (800 мл) добавляли в реактор и охлаждали до 0 oC. Добавляли н-BuLi (1,6 M, 110 мл, 276 ммоль), поддерживая температуру внутри реактора ниже 15 oC. После перемешивания в течение 1 часа при температуре 10-20 oC, полученный в результате раствор охлаждали до температуры ниже -20 oC. Добавляли раствор 3:1 диастереомерной смеси 2-((2S,3S,4S,5R)-4-(бензилокси)-5-(((R)-2,2-диметил-1,3-диоксолан-4-ил)метил)-3-((4-метоксибензил)окси)тетрагидрофуран-2-ил)ацетальдегида и 2-((2S,3S,4S,5R)-4-(бензилокси)-5-(((S)-2,2-диметил-1,3-диоксолан-4-ил)метил)-3-((4-метоксибензил)окси)тетрагидрофуран-2-ил)ацетальдегида (102 г, 212 ммоль) в THF (300 мл), поддерживая температуру внутри реактора ниже -10°C. Полученную в результате реакционную смесь перемешивали при температуре между -5 и -15°C в течение 1 часа. Добавляли насыщенный водный NH4Cl (27% по массе) (500 мл) и воду (200 мл), и смесь нагревали до температуры окружающей среды. Слои разделяли, и органический слой промывали дважды 30% водным NaCl (400 мл) и концентрировали в вакууме. Остаток фильтровали через слой силикагеля (300 мл), промывая н-гептаном/этилацетатом (3/2, 1300 мл). Концентрирование фильтрата давало 94 г целевого продукта в виде коричневого масла.
4-(((2R,3S,4S,5S)-3-(бензилокси)-5-((E)-2-(фуран-2-ил)винил)-4-((4-метоксибензил)окси)тетрагидрофуран-2-ил)метил)-2,2-диметил-1,3-диоксолан
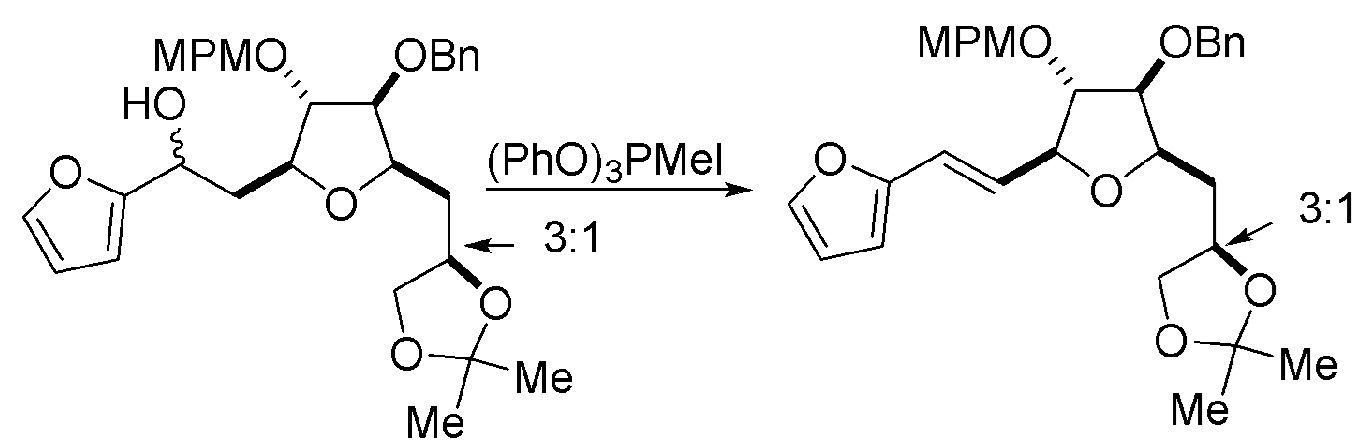
2-((2S,3S,4S,5R)-4-(бензилокси)-5-(((R)-2,2-диметил-1,3-диоксолан-4-ил)метил)-3-((4-метоксибензил)окси)тетрагидрофуран-2-ил)-1-(фуран-2-ил)этан-1-ол (94 г) растворяли в диметилацетамиде (893 мл). Добавляли йодид метилтрифеноксифосфония (99 г, 218 ммоль), поддерживая температуру внутри реактора ниже 25°C. Полученную в результате реакцию выдерживали, перемешивая при 20-25°C в темноте в течение 2,5 часов. Реакционную смесь разбавляли MTBE (1410 мл) и охлаждали ниже 10°C. Добавляли раствор KOH (88 г, 1571 ммоль) в воде (1128 мл), поддерживая температуру внутри реактора ниже 30 oC. Водный слой отделяли и экстрагировали дважды MTBE (940 мл). Объединенные органические слои промывали три раза 30% водным NaCl (1128 мл) и концентрировали в вакууме. Остаток фильтровали через слой силикагеля (200 мл), который затем промывали н-гептаном/этилацетатом (2/1, 1500 мл). Концентрирование фильтрата давало 87,9 г целевого продукта в виде коричневого масла. 1H ЯМР (3:1 диастереомерная смесь, 400 МГц, CDCl3) δ ppm 1,31 (с, 3 H(меньший)) 1,35 (с, 3 H(больший)) 1,40 (с, 3 H) 1,87-2,20 (м, 2 H) 3,58 (т, J=7,3 Гц, 1 H) 3,78-3,81 (м, 3 H) 3,88 (д, J=3,4 Гц, 1 H(больший)) 3,89 (д, J=3,7 Гц, 1 H(меньший)) 4,03 (дд, J=7,8, 6,0 Гц, 1 H(меньший)) 4,09 (дд, J=8,2, 6,1 Гц, 1 H(больший)) 4,17 (дт, J=9,5, 3,7 Гц, 1 H) 4,22-4,31 (м, 1 H) 4,36 (дд, J=7,3, 3,4 Гц, 1 H) 4,42-4,51 (м, 3 H) 4,59 (д, J=12,5 Гц, 1 H(больший)) 4,60 (д, J=11,9 Гц, 1 H(меньший)) 6,15-6,26 (м, 2 H) 6,37 (дд, J=3,2, 2,0 Гц, 1 H) 6,39-6,49 (м, 1 H) 6,84-6,89 (м, 2 H) 7,19-7,24 (м, 2 H) 7,26-7,38 (м, 5 H)
(2R)-1-((2S,3R,4S,5R)-4-(бензилокси)-5-((2,2-диметил-1,3-диоксолан-4-ил)метил)-3-((4-метоксибензил)окси)тетрагидрофуран-2-ил)-2-(фуран-2-ил)этан-1,2-диол
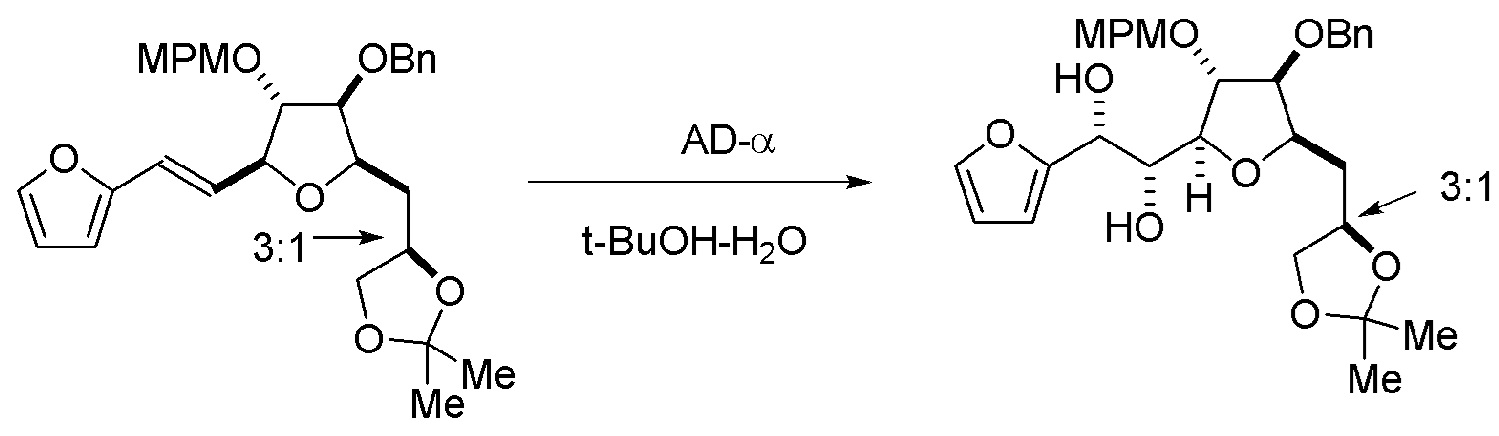
В реактор добавляли (DHQ)2PHAL (1,267 г, 1,627 ммоль), оксид калия осмия (VI) (0,216 г, 0,651 ммоль), карбонат калия (67,5 г, 488 ммоль), и гидрат феррицианида (III) калия (161 г, 488 ммоль). Добавляли воду (847 мл) и 2-метилпропан-2-ол (424 мл). Полученную в результате смесь охлаждали ниже 7 oC. Добавляли метансульфамид (18,57 г, 195 ммоль), с последующим добавлением раствора 3:1 диастереомерной смеси (R)-4-(((2R,3S,4S,5S)-3-(бензилокси)-5-((E)-2-(фуран-2-ил)винил)-4-((4-метоксибензил)окси)тетрагидрофуран-2-ил)метил)-2,2-диметил-1,3-диоксолана и (S)-4-(((2R,3S,4S,5S)-3-(бензилокси)-5-((E)-2-(фуран-2-ил)винил)-4-((4-метоксибензил)окси)тетрагидрофуран-2-ил)метил)-2,2-диметил-1,3-диоксолана (84,7 г, 162,693 ммоль) в трет-бутаноле (424 мл). Полученную в результате смесь перемешивали в течение 3 дней при 13-18°C. Добавляли сульфит натрия (103 г, 813 ммоль) и воду (339 мл), и полученную в результате смесь перемешивали в течение 30-60 минут, нагревая до температуры окружающей среды. Смесь экстрагировали дважды этилацетатом (2100 мл). Объединенные органические слои промывали 2M водным KOH (296 мл) и 30% водным NaCl (424 мл). Концентрирование в вакууме, с последующей очисткой на слое силикагеля, применяя 25-66% градиент этилацетата в н-гептане в качестве элюента, давало 71,6 г целевого продукта в виде коричневого масла. 1H ЯМР (3:1 диастереомерная смесь, 400 МГц, CDCl3) δ ppm 1,33-1,38 (м, 3 H) 1,39-1,42 (м, 3 H) 1,85-2,09 (м, 2 H) 3,57 (т, J=7,8 Гц, 1 H) 3,78 (д, J=3,1 Гц, 1 H) 3,81 (с, 3 H) 3,83-3,87 (м, 1 H) 3,89 (уш.с, 1 H) 4,04-4,12 (м, 3 H) 4,16-4,24 (м, 1 H) 4,34-4,49 (м, 3 H) 4,62 (д, J=11,6 Гц, 1 H(больший)) 4,63 (д, J=11,6 Гц, 1 H(меньший)) 4,73 (д, J=7,0 Гц, 1 H(больший)) 4,76 (д, J=6,1 Гц, 1 H(меньший)) 6,34-6,37 (м, 2 H) 6,86-6,91 (м, 2 H) 7,16-7,24 (м, 2 H) 7,27-7,44 (м, 6 H).
3-((2R,3S,4R,5S)-3-(бензилокси)-5-((2R)-2-(фуран-2-ил)-1,2-дигидроксиэтил)-4-((4-метоксибензил)окси)тетрагидрофуран-2-ил)пропан-1,2-диол
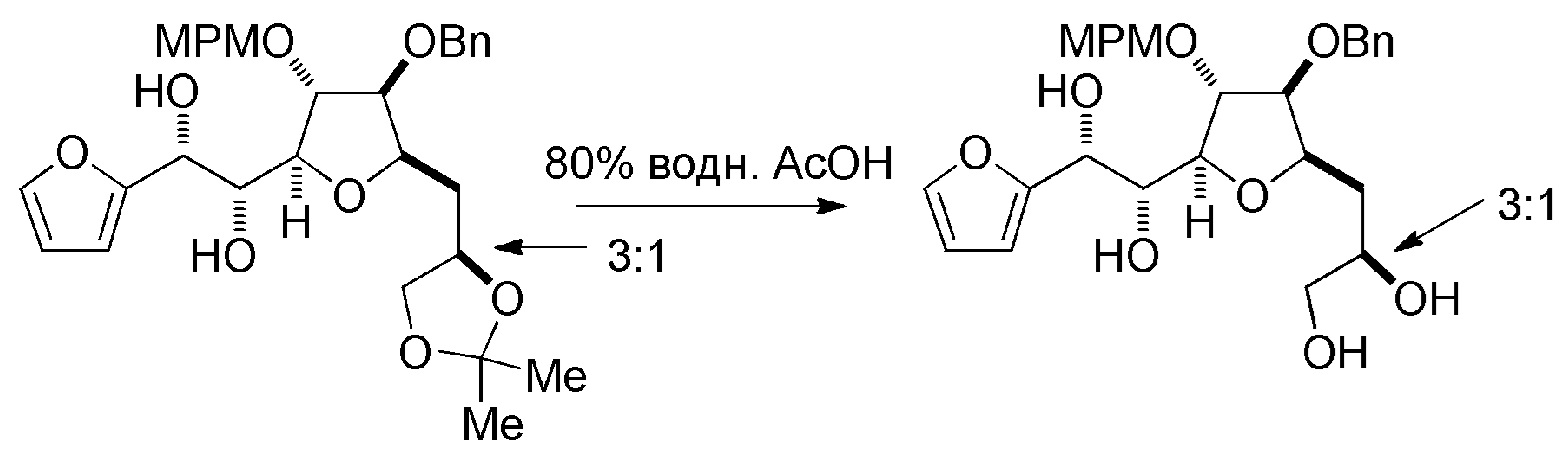
3:1 диастереомерную смесь (2R)-1-((2S,3R,4S,5R)-4-(бензилокси)-5-(((R)-2,2-диметил-1,3-диоксолан-4-ил)метил)-3-((4-метоксибензил)окси)тетрагидрофуран-2-ил)-2-(фуран-2-ил)этан-1,2-диола и (2R)-1-((2S,3R,4S,5R)-4-(бензилокси)-5-(((S)-2,2-диметил-1,3-диоксолан-4-ил)метил)-3-((4-метоксибензил)окси)тетрагидрофуран-2-ил)-2-(фуран-2-ил)этан-1,2-диола (71,6 г, 129 ммоль) растворяли в уксусной кислоте (501 мл). Добавляли воду (125 мл), и полученную в результате смесь перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь концентрировали в вакууме и азеотропно упаривали с толуолом (500 мл). Остаток фильтровали через слой силикагеля (200 мл), который затем промывали н-гептаном/этилацетатом (1/1, 1 л) и этилацетатом (3,5 л). Концентрирование фильтрата давало 69,4 г целевого продукта в виде коричневого масла.
3-((2R,3S,4R,5R)-5-((1S)-ацетокси((2R)-6-ацетокси-3-оксо-3,6-дигидро-2H-пиран-2-ил)метил)-3-(бензилокси)-4-((4-метоксибензил)окси)тетрагидрофуран-2-ил)пропан-1,2-диилдиацетат
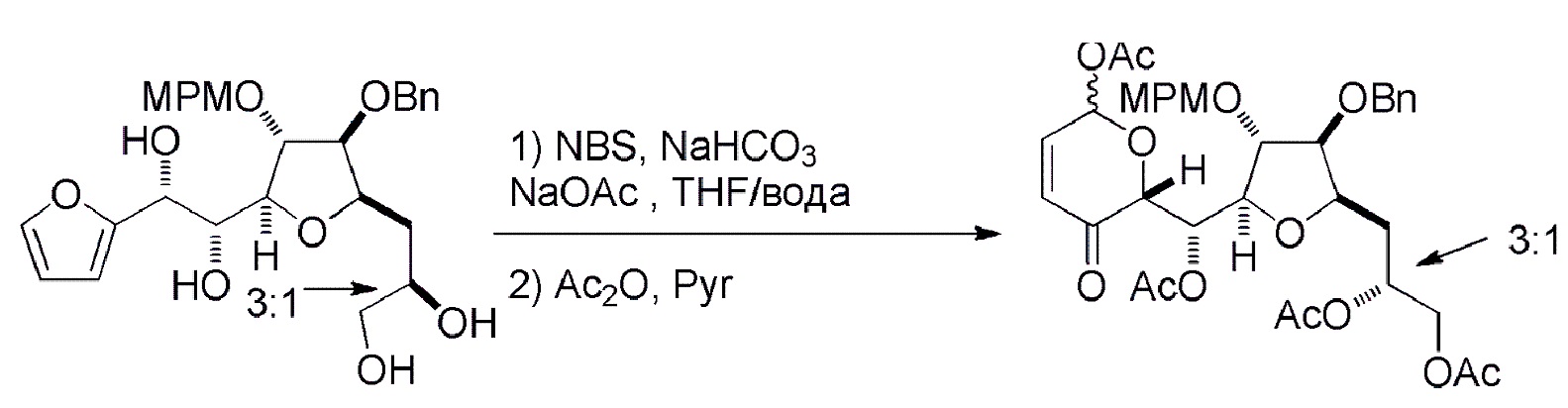
3:1 диастереомерную смесь (R)-3-((2R,3S,4R,5S)-3-(бензилокси)-5-((1R,2R)-2-(фуран-2-ил)-1,2-дигидроксиэтил)-4-((4-метоксибензил)окси)тетрагидрофуран-2-ил)пропан-1,2-диола и (S)-3-((2R,3S,4R,5S)-3-(бензилокси)-5-((1R,2R)-2-(фуран-2-ил)-1,2-дигидроксиэтил)-4-((4-метоксибензил)окси)тетрагидрофуран-2-ил)пропан-1,2-диола (69,4 г) растворяли в THF (989 мл) и воде (247 мл) и охлаждали ниже 5 oC. Добавляли бикарбонат натрия (21,53 г, 256,3 ммоль) и ацетат натрия (10,51 г, 128,1 ммоль). Добавляли NBS (23,94 г, 134,5 ммоль), поддерживая температуру внутри реактора ниже 5°C. После перемешивания в течение 1 часа при температуре 0-5°C, реакционную смесь обрабатывали раствором йодида калия (10,63 г, 64,06 ммоль) в воде (165 мл) и разбавляли EtOAc (2000 мл). Органический слой промывали раствором тиосульфата натрия (16,21 г, 102,5 ммоль) в воде (198 мл), с последующей промывкой 30% водным NaCl (132 мл). Растворители удаляли в вакууме. Полученный в результате остаток (71 г) растворяли в дихлорметане (613 мл) и охлаждали до 0°C. Добавляли пиридин (198 мл, 2444 моль), уксусный ангидрид (121 мл, 1285 моль) и 4-диметиламинопиридин (1,57 г, 12,8 ммоль). После перемешивания в течение ночи при температуре при 0-15°C, реакционную смесь обрабатывали насыщенным водным NH4Cl (27% по массе) (545 мл) и водой (136 мл). Слои разделяли, и водный слой экстрагировали дихлорметаном (341 мл). Объединенные органические слои промывали дважды 0,5 M водной хлористоводородной кислотой (409 мл), с последующей промывкой 30% водным NaCl (477 мл). Концентрирование, с последующим фильтрованием через слой силикагеля (60 мл), который затем промывали гептаном/этилацетатлм (1/1, 1500 мл), давало 92 г целевого продукта в виде коричневого масла.
3-((2R,3S,4R,5R)-5-((1S)-ацетокси((2R)-6-аллил-3-оксо-3,6-дигидро-2H-пиран-2-ил)метил)-3-(бензилокси)-4-((4-метоксибензил)окси)тетрагидрофуран-2-ил)пропан-1,2-диилдиацетат
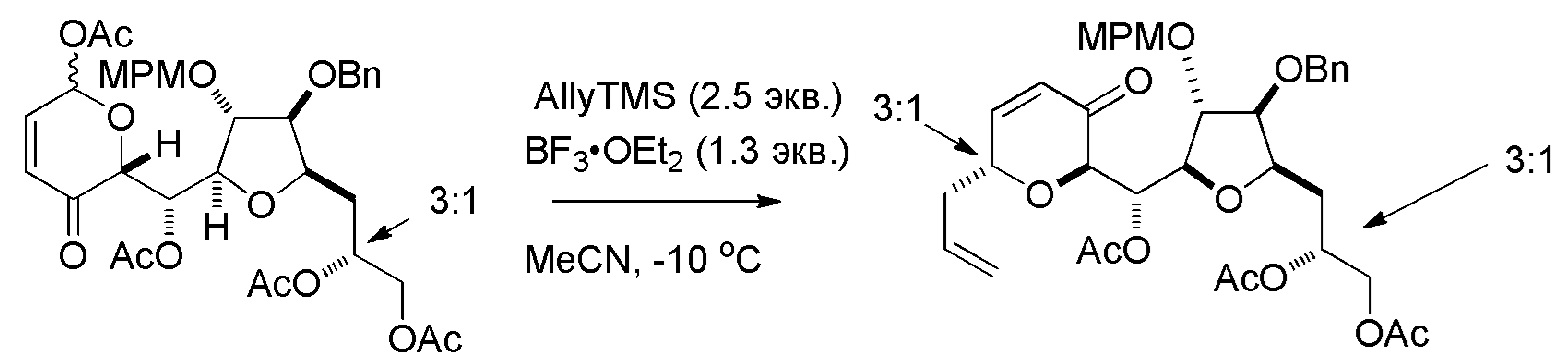
3-((2R,3S,4R,5R)-5-((1S)-Ацетокси((2R)-6-ацетокси-3-оксо-3,6-дигидро-2H-пиран-2-ил)метил)-3-(бензилокси)-4-((4-метоксибензил)окси)тетрагидрофуран-2-ил)пропан-1,2-диилдиацетат (92 г, 129 ммоль) растворяли в ацетонитрил (902 мл) и охлаждали до -15°C. Добавляли аллилтриметилсилан (51,3 мл, 323 ммоль), с последующим BF3·OEt2 (21,26 мл, 167,7 ммоль), поддерживая температуру внутри реактора ниже -10 oC. Полученный в результате раствор перемешивали при температуре между -10 и 0°C до того, как реакция завершалась. Затем, добавляли насыщенный водный NaHCO3 (8%) (902 мл) и MTBE (721 мл), и полученную в результате смесь нагревали до температуры окружающей среды. Слои разделяли, и водный слой экстрагировали MTBE (721 мл). Объединенные органические слои промывали дважды 30% водным NaCl (721 мл) и концентрировали в вакууме. Остаток разбавляли MTBE (1500 мл) и промывали последовательно 1M HCl (250 мл), насыщенным водным NaHCO3 (8%) (250 мл) и 30% водным NaCl (250 мл). Концентрирование, с последующим фильтрованием через слой силикагеля (100 мл), который затем промывали н-гептаном/этилацетатом (2/3, 1200 мл), давало 54,2 г целевого продукта в виде коричневого масла.
3-((2R,3R,4R,5R)-5-((1S)-ацетокси((2R)-6-аллил-3-оксо-3,6-дигидро-2H-пиран-2-ил)метил)-3-(бензилокси)-4-гидрокситетрагидрофуран-2-ил)пропан-1,2-диилдиацетат
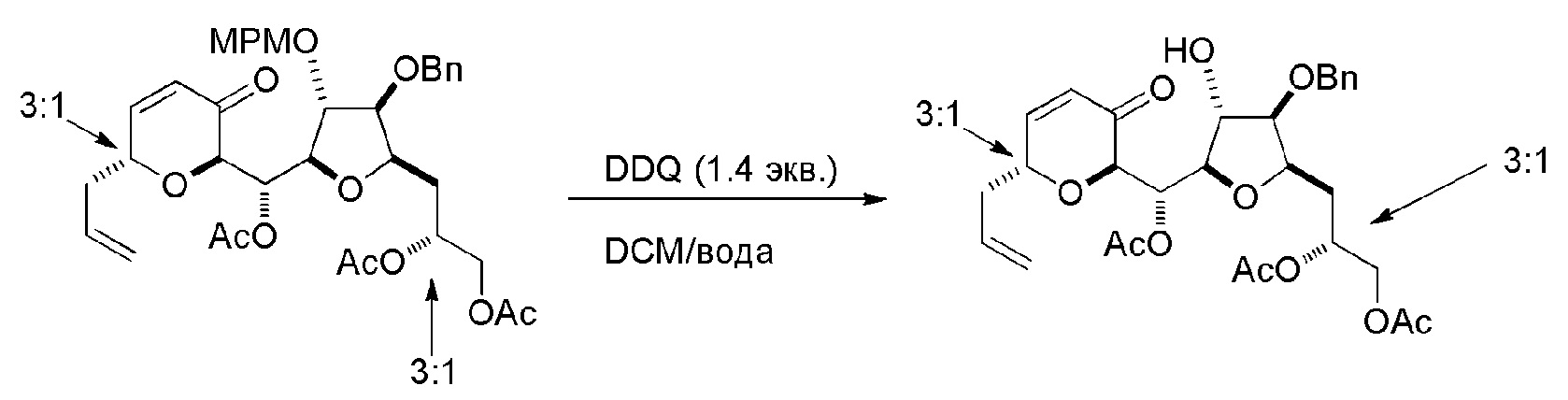
3-((2R,3S,4R,5R)-5-((1S)-ацетокси((2R)-6-аллил-3-оксо-3,6-дигидро-2H-пиран-2-ил)метил)-3-(бензилокси)-4-((4-метоксибензил)окси)тетрагидрофуран-2-ил)пропан-1,2-диилдиацетат (54,2 г) растворяли в дихлорметане (542 мл) и обрабатывали водой (136 мл) и DDQ (25,3 г, 111 ммоль). После перемешивания в течение 2 часов при температуре окружающей среды, реакционную смесь разбавляли дихлорметаном (700 мл) и водой (700 мл). Добавляли насыщенный водный NaHCO3 (8%) (870 мл) и тиосульфат натрия (35,2 г, 223 ммоль), и полученную в результате смесь перемешивали при температуре окружающей среды в течение 10 мин. Слои разделяли, и водный слой экстрагировали дихлорметаном (271 мл). Объединенные органические слои промывали насыщенным водным NaHCO3 (8%) (325 мл) и 30% водным NaCl (217 мл). Концентрирование в вакууме и очистка колоночной хроматографией на силикагеле, применяя 20-60% градиент этилацетата в н-гептане в качестве элюента, давали 31,2 г целевого продукта в виде коричневого масла.
1H ЯМР (9:3:3:1 смесь 4 диастереомеров, 400 МГц, CDCl3) δ ppm 1,84-1,98 (м, 2 H) 2,04 (д, J=12,9 Гц, 9 H) 2,43 (д, J=8,2 Гц, 2 H) 3,89 (дт, J=7,6, 2,1 Гц, 1 H) 3,98-4,06 (м, 2 H) 4,07-4,18 (м, 2 H) 4,34 (дд, J=11,9, 3,3 Гц, 1 H) 4,43 (д, J=5,1 Гц, 1 H) 4,55 (д, J=11,7 Гц, 1 H) 4,60-4,65 (м, 1 H) 4,66-4,73 (м, 1 H) 5,12-5,23 (м, 3 H) 5,51 (дд, J=6,6, 5,1 Гц, 1 H (больший)) 5,55 (дд, J=5,9, 4,7 Гц, 1 H(меньший)) 5,75-5,88 (м, 1 H) 6,12 (дд, J=10,6, 2,3 Гц, 1 H) 6,90 (дд, J=10,4, 1,4 Гц, 1 H(меньший)) 6,95 (дд, J=10,6, 2,3 Гц, 1 H(больший)) 7,27-7,40 (м, 5 H)
3-((2R,3S,5S)-5-((1R)-ацетокси((2R)-6-аллил-3-оксо-3,6-дигидро-2H-пиран-2-ил)метил)-3-(бензилокси)-4-оксотетрагидрофуран-2-ил)пропан-1,2-диилдиацетат
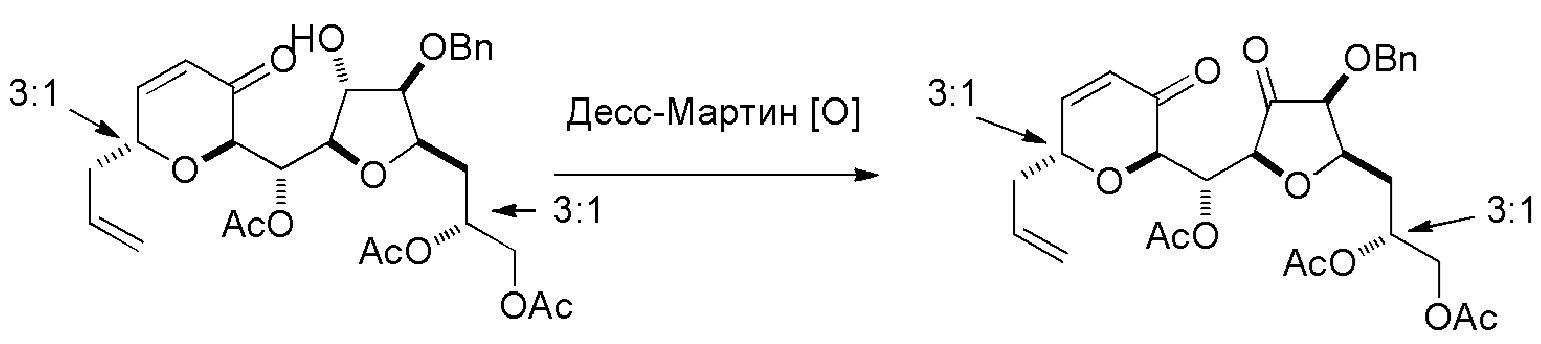
К 3-((2R,3R,4R,5R)-5-((1S)-ацетокси((2R)-6-аллил-3-оксо-3,6-дигидро-2H-пиран-2-ил)метил)-3-(бензилокси)-4-гидрокситетрагидрофуран-2-ил)пропан-1,2-диилдиацетату (27,4 г, 48,9 ммоль) добавляли дихлорметан (219 мл) при температуре окружающей среды. Добавляли бикарбонат натрия (12,32 г, 146,6 ммоль), периодинан Десс-Мартина (30,1 г, 70,872 ммоль) и воду (0,176 мл, 9,78 ммоль). Полученную в результате смесь перемешивали при температуре окружающей среды до потребления всего исходного соединения. Затем, ее разбавляли водой (301 мл) и MTBE (301 мл). Добавляли бикарбонат натрия (12,32 г, 146,6 ммоль) и тиосульфат натрия (19,32 г, 122,2 ммоль), и полученную в результате смесь перемешивали при температуре окружающей среды в течение 10 минут. Слои разделяли, и водный слой экстрагировали MTBE (219 мл). Объединенные органические слои промывали насыщенным водным NaHCO3 (8%) (137 мл) и 30% водным NaCl (137 мл). Концентрирование в вакууме, с последующим азеотропным упариванием с толуолом, давало 33,1 г целевого продукта в виде темно-коричневого масла.
3-((2R,3S,5S)-5-((1R)-ацетокси((2R)-6-аллил-3-оксо-3,6-дигидро-2H-пиран-2-ил)метил)-3-(бензилокси)-4-гидрокситетрагидрофуран-2-ил)пропан-1,2-диилдиацетат
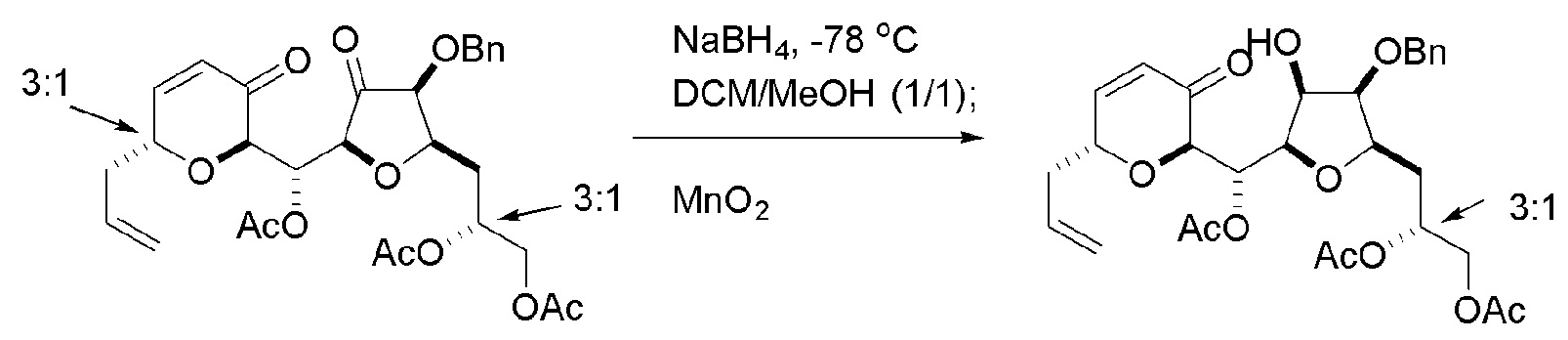
3-((2R,3S,5S)-5-((1R)-ацетокси((2R)-6-аллил-3-оксо-3,6-дигидро-2H-пиран-2-ил)метил)-3-(бензилокси)-4-оксотетрагидрофуран-2-ил)пропан-1,2-диилдиацетат растворяли в дихлорметане (406 мл) и MeOH (406 мл) и охлаждали до температуры ниже -75°C. Добавляли порциями боргидрид натрия (2,75 г, 72,3 ммоль), поддерживая температуру внутри реактора ниже -75°C. Через 1 час добавляли ацетон (95 мл, 1290 ммоль), поддерживая температуру внутри реактора ниже -75°C. Добавляли насыщенный водный NH4Cl (27% по массе) (216 мл), воду (108 мл) и MTBE (325 мл). Полученную в результате смесь нагревали до температуры окружающей среды. Слои разделяли, и водный слой экстрагировали MTBE (271 мл). Объединенные органические слои промывали дважды 30% водным NaCl (189 мл) и сушили над MgSO4. Фильтрование, с последующим концентрированием в вакууме, давало 30,8 г коричневого густого масла, которое растворяли в дихлорметане (271 мл). К полученному в результате раствору добавляли диоксид марганца (42,1 г, 484 ммоль). Полученную в результате суспензию энергично перемешивали при температуре окружающей среды в течение ночи. Затем, добавляли 40 г целита®, и полученную в результате суспензию перемешивали при температуре окружающей среды в течение 20 минут. Фильтрование через слой целита®, концентрирование в вакууме и очистка колоночной хроматографией на силикагеле, применяя н-гептан/этилацетат (1/2) в качестве элюента, давали 23,8 г целевого продукта в виде пенообразного твердого остатка.
3-((2R,3S,5S)-5-((1R)-ацетокси((2R)-6-аллил-3-оксотетрагидро-2H-пиран-2-ил)метил)-3-(бензилокси)-4-гидрокситетрагидрофуран-2-ил)пропан-1,2-диилдиацетат
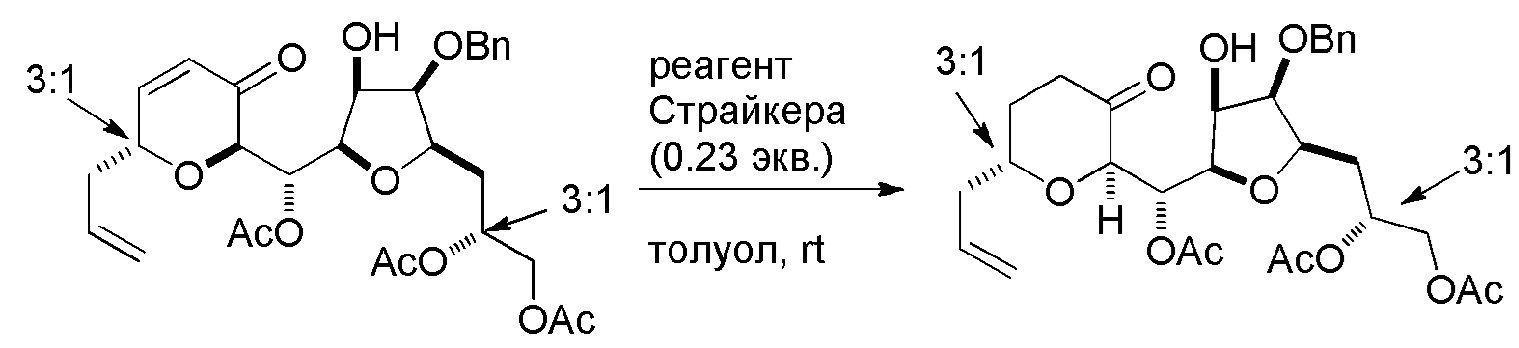
3-((2R,3S,5S)-5-((1R)-ацетокси((2R)-6-аллил-3-оксо-3,6-дигидро-2H-пиран-2-ил)метил)-3-(бензилокси)-4-гидрокситетрагидрофуран-2-ил)пропан-1,2-диилдиацетат (20 г, 35,7 ммоль) растворяли в обескислороженном толуоле (460 мл) при температуре окружающей среды. Полученный в результате раствор продували азотом в течение 1 часа и добавляли обескислороженную (продутую азотом в течение 40 мин) воду (1,22 мл, 67,8 ммоль). Добавляли 3 порциями гексамер гидридо(трифенилфосфина) меди (I) (16,0 г, 8,16 ммоль). Полученную в результате красную суспензию перемешивали в течение 4 часов. После завершения, реакцию помещали в воздушную атмосферу. Продукты разложения, содержащие медь, осаждались. Полученную в результате коричневую суспензию фильтровали через слой целита, который, затем, промывали толуолом до отсутствия продукта в элюенте. Концентрирование в вакууме, с последующей очисткой колоночной хроматографией, применяя 20-66% градиент этилацетата в н-гептане в качестве элюента, давало 18,07 г целевого продукта в виде коричневого масла.
3-((2R,3S,3aS,8aR,9S,9aR)-9-ацетокси-7-аллил-3-(бензилокси)-4a-метоксидекагидрофуро[3,2-b]пирано[2,3-e]пиран-2-ил)пропан-1,2-диилдиацетат
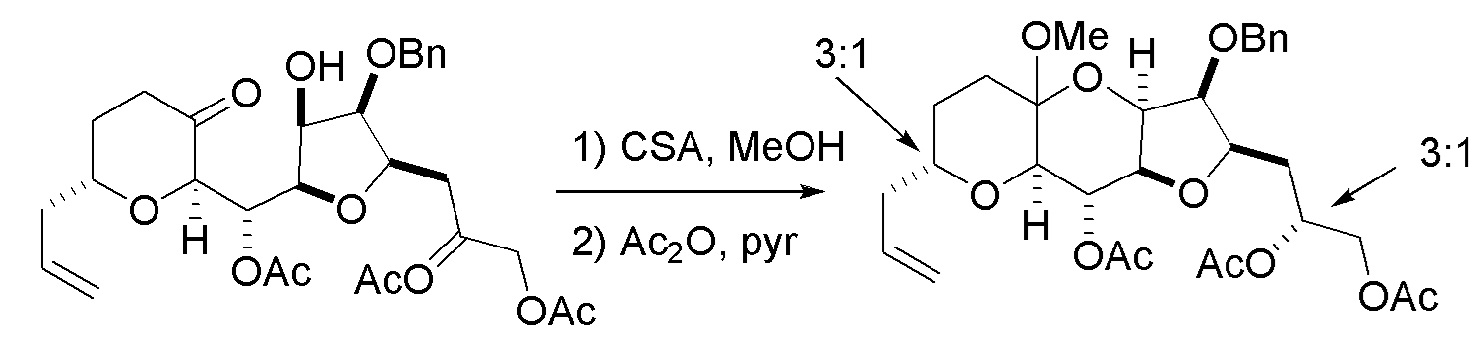
3-((2R,3S,5S)-5-((1R)-ацетокси((2R)-6-аллил-3-оксотетрагидро-2H-пиран-2-ил)метил)-3-(бензилокси)-4-оксотетрагидрофуран-2-ил)пропан-1,2-диилдиацетат (23,4 г, 41,6 ммоль) растворяли в метаноле (281 мл). Добавляли ((1S,4R)-7,7-диметил-2-оксобицикло[2,2,1]гептан-1-ил)метансульфокислоту (1,1 г, 5,0 ммоль), и полученный в результате раствор перемешивали при 60°C до потребления всего исходного соединения. Смесь охлаждали до температуры окружающей среды и обрабатывали TEA (0,870 мл, 6,24 ммоль). Растворители удаляли, и остаток растворяли в этилацетате (468 мл). Полученный в результате раствор промывали 30% водным NaCl (70,2 мл), сушили над MgSO4, фильтровали и концентрировали в вакууме. Остаток растворяли в дихлорметане (140 мл) и пиридине (46,8 мл) при температуре окружающей среды. Добавляли уксусный ангидрид (23,59 мл, 249,6 ммоль) и 4-диметиламинопиридин (0,508 г, 4,16 ммоль), и полученный в результате раствор перемешивали при температуре окружающей среды в течение 1 часа. Реакционную смесь обрабатывали насыщенным водным NH4Cl (27% по массе) (140 мл), водой (46,8 мл) и MTBE (281 мл). Органический слой отделяли и промывали последовательно 1M водной хлористоводородной кислотой (94 мл), насыщенным водным NaHCO3 (8%) (70,2 мл) и 30% водным NaCl (70,2 мл). Сушка над MgSO4, фильтрование, концентрирование и очистка колоночной хроматографией на силикагеле, применяя 25-40% градиент этилацетата в н-гептане в качестве элюента, давали 12,3 г целевого продукта в виде бледно-коричневого масла.
1H ЯМР (9:3:3:1 смесь 4 диастереомеров, CDCl3) δ ppm 1,29-1,48 (м, 1 H) 1,54-1,78 (м, 3 H) 1,93-2,16 (м, 11 H) 2,17-2,40 (м, 2 H) 3,25 (с, 3H (меньший 1)) 3,29 (с, 3H(меньший2)) 3,30 (с, 3H (больший)) 3,55 (д, J=11,1 Гц, 1 H (больший)) 3,56 (д, J=11,4 Гц, 1 H (меньший)) 3,62-3,75 (м, 1 H) 3,98-4,26 (м, 4 H) 4,29-4,38 (м, 1 H) 4,39-4,45 (м, 1 H) 4,50 (д, J=11,7 Гц, 1 H (меньший2)) 4,52 (д, J=12,0 Гц, 1 H (больший)) 4,57 (д, J=12,0 Гц, 1 H (меньший 3)) 4,59 (д, J=12,3 Гц, 1 H (меньший 1)) 4,73-4,83 (м, 1 H) 4,96-5,09 (м, 2 H) 5,18-5,27 (м, 1 H) 5,26 (дд, J=11,3, 6,0 Гц, 1 H) 5,37 (дд, J=11,4, 5,9 Гц, 1 H (больший)) 5,72 (дд, J=17,1, 10,1 Гц, 1 H (меньший)) 7,27-7,40 (м, 5 H).
3-((2R,3S,3aS,7R,8aR,9S,9aR)-9-ацетокси-3-(бензилокси)-7-(2-гидроксиэтил)-4a-метоксидекагидрофуро[3,2-b]пирано[2,3-e]пиран-2-ил)пропан-1,2-диилдиацетат
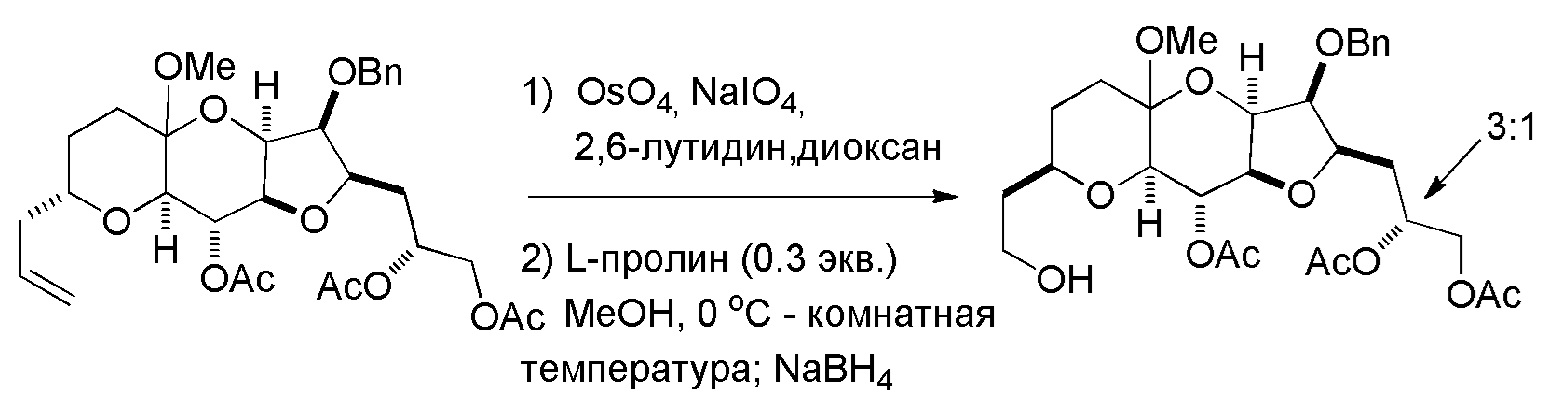
3-((2R,3S,3aS,8aR,9S,9aR)-9-ацетокси-7-аллил-3-(бензилокси)-4a-метоксидекагидрофуро[3,2-b]пирано[2,3-e]пиран-2-ил)пропан-1,2-диилдиацетат (13,5 г, 23,4 ммоль) растворяли в 1,4-диоксане (176 мл) и воде (58,1 мл). Добавляли 2,6-лутидин (8,18 мл, 70,2 ммоль), 4,0% осмиевую кислоту в воде (3,27 мл, 0,515 ммоль) и метапериодат натрия (25,04 г, 117,1 ммоль). Полученный в результате раствор перемешивали при температуре окружающей среды до потребления всего исходного соединения. После завершения, добавляли воду (203 мл) и толуол (203 мл). Водный слой отделяли и экстрагировали толуолом (135 мл). Объединенные органические слои промывали последовательно 1M хлористоводородной кислотой (67,5 мл, 67,5 ммоль), насыщенным водным NaHCO3 (8%) (54,0 мл), 10% водным Na2S2O3 (40,5 мл) и 30% водным NaCl (81 мл). Полученный в результате раствор сушили над MgSO4 и концентрировали в вакууме. Остаток (15,6 г) растворяли в метаноле (201 мл) при температуре окружающей среды. Полученный в результате раствор охлаждали до температуры ниже 10°C, и добавляли одной порцией L-пролин (0,801 г, 6,96 ммоль). Полученный в результате раствор перемешивали в течение ночи, нагревая до температуры окружающей среды. После перемешивания в течение дополнительных 6 часов при температуре окружающей среды, реакционную смесь разбавляли MTBE (335 мл) и добавляли насыщенный водный NaHCO3 (8%) (201 мл) и воду (108 мл). Слои разделяли, и водный слой экстрагировали дважды MTBE (201 мл каждый раз). Объединенные органические слои промывали дважды 30% водным NaCl (107 мл), сушили над MgSO4 и концентрировали в вакууме. Остаток (21 г) растворяли в метаноле (201 мл) и охлаждали до 0°C. Добавляли боргидрид натрия (1,14 г, 30,1 ммоль) 5 порциями. После завершения реакции, добавляли насыщенный водный NH4Cl (27% по массе) (134 мл) и воду (67,1 мл, 3723,506 ммоль). Смесь экстрагировали дважды этилацетатом (470 мл). Объединенный органический слой промывали 30% водным NaCl (107 мл), сушили над MgSO4, фильтровали и концентрировали в вакууме. Остаток фильтровали через слой силикагеля (200 мл), который, затем, промывали н-гептаном/этилацетатом (1/1, 400 мл) и этилацетатом (1200 мл). Объединенный фильтрат концентрировали в вакууме, получая 10,75 г целевого продукта.
3-((2R,3S,3aS,7R,8aR,9S,9aR)-9-ацетокси-3-(бензилокси)-4a-метокси-7-(2-(пивалоилокси)этил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-2-ил)пропан-1,2-диилдиацетат
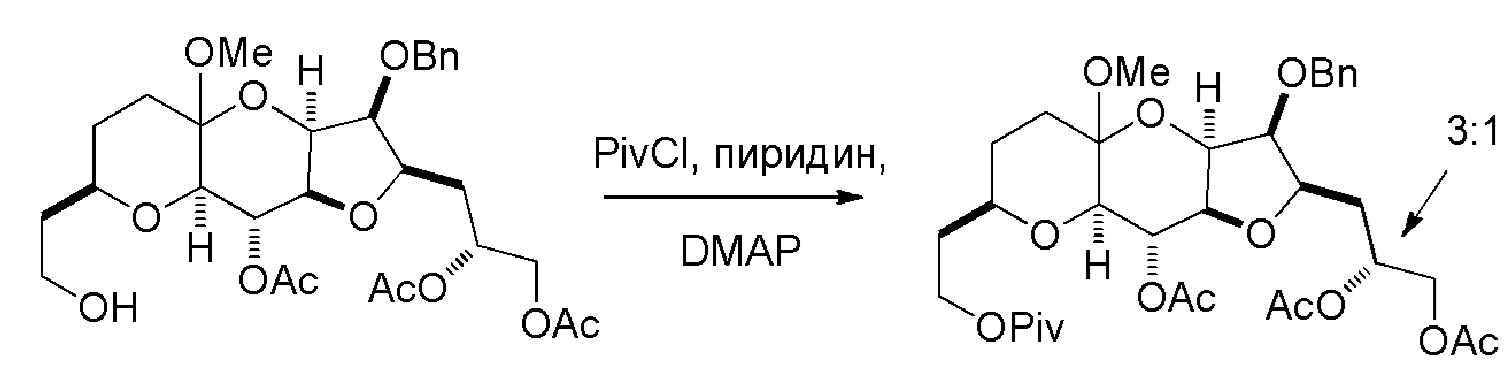
3-((2R,3S,3aS,7R,8aR,9S,9aR)-9-ацетокси-3-(бензилокси)-7-(2-гидроксиэтил)-4a-метоксидекагидрофуро[3,2-b]пирано[2,3-e]пиран-2-ил)пропан-1,2-диилдиацетат (10,6 г, 18,3 ммоль) растворяли в дихлорметане (106 мл) при 17-22°C. Добавляли пиридин (10,60 мл, 131 ммоль), пивалоилхлорид (6,74 мл, 54,8 ммоль) и 4-диметиламинопиридин (0,446 г, 3,65 ммоль). Через 2 часа при температуре окружающей среды, добавляли насыщенный водный NaHCO3 (8%) (106 мл), воду (31,8 мл) и MTBE (159 мл). После 10 минут перемешивания при температуре окружающей среды, слои разделяли, и органический слой промывали насыщенным водным NaHCO3 (8%) (53,0 мл) и 30% водным NaCl (53,0 мл). Сушка над MgSO4, концентрирование в вакууме и очистка колоночной хроматографией на силикагеле, применяя 33-50% градиент этилацетата в н-гептане в качестве элюента, давали 12,1 г целевого продукта в виде бледно-коричневого масла.
1H ЯМР (только основной изомер, 400 МГц, CDCl3) δ ppm 1,14-1,20 (м, 9 H) 1,43-1,88 (м, 6 H) 1,93-2,14 (м, 1 H) 2,02 (с, 3 H) 2,03 (с, 3 H) 2,05 (с, 3 H) 2,16-2,28 (м, 1 H) 3,26 (с, 3 H) 3,32-3,42 (м, 1 H) 3,76 (с, 1 H) 4,01-4,20 (м, 6 H) 4,24 (т, J=4,0 Гц, 1 H) 4,36 (дд, J=12,0, 2,9 Гц, 1 H) 4,58 (д, J=12,3 Гц, 1 H) 4,80 (дд, J=12,0, 3,8 Гц, 1 H) 5,02 (с, 1 H) 5,13-5,29 (м, 2 H) 7,30-7,39 (м, 5 H).
3-((2R,3S,3aS,7R,8aR,9S,9aR)-9-ацетокси-3-гидрокси-4a-метокси-7-(2-(пивалоилокси)этил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-2-ил)пропан-1,2-диилдиацетат
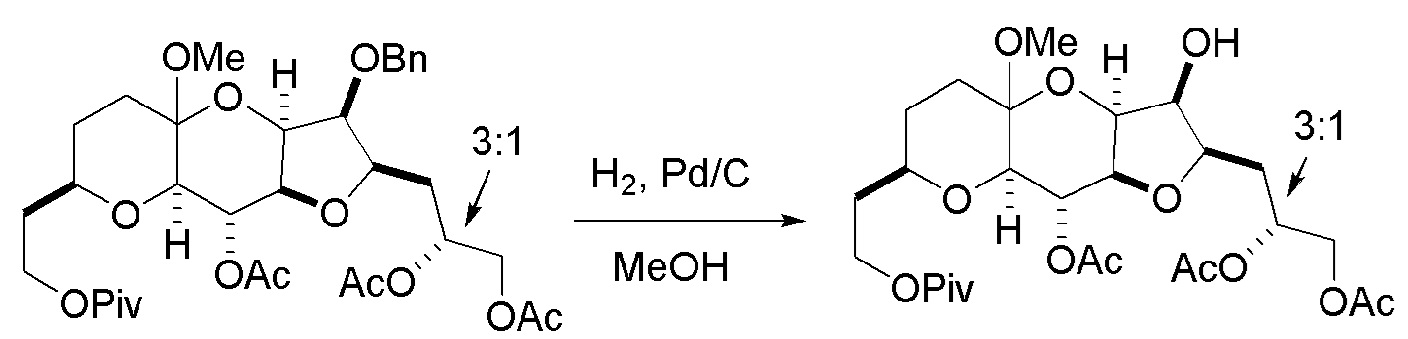
3-((2R,3S,3aS,7R,8aR,9S,9aR)-9-ацетокси-3-(бензилокси)-4a-метокси-7-(2-(пивалоилокси)этил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-2-ил)пропан-1,2-диилдиацетат (12,08 г, 18,17 ммоль) растворяли в метаноле (121 мл) и EtOAc (60,4 мл). Добавляли 10% палладий на угле (4,8 г), и полученную в результате смесь обрабатывали водородом, применяя баллон с водородом при температуре окружающей среды до потребления всего исходного соединения. Полученную в результате смесь продували азотом и фильтровали через слой целита® (20 г), который, затем, промывали EtOAc до того, как требуемого продукта на оставалось на слое. Фильтрат концентрировали в вакууме и азеотропно упаривали с толуолом (72,5 мл). Остаток фильтровали через слой силикагеля (200 мл), который, затем промывали н-гептаном/этилацетатом (50%-100%). Концентрирование объединенного фильтрата давало 9,5 г целевого продукта.
3-((2R,3S,3aR,7R,8aR,9S,9aR)-9-ацетокси-3-((диизопропилсилил)окси)-4a-метокси-7-(2-(пивалоилокси)этил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-2-ил)пропан-1,2-диилдиацетат
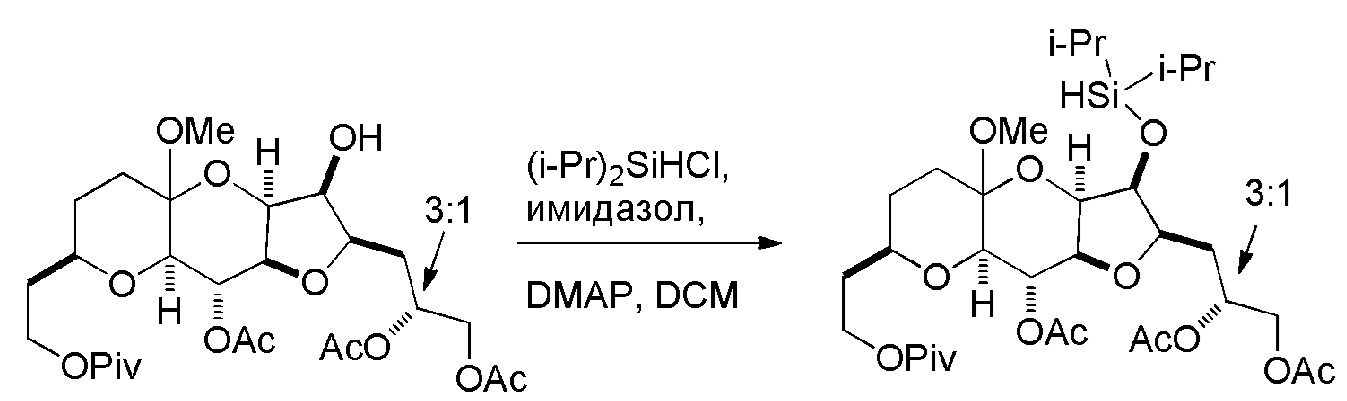
3-((2R,3S,3aS,7R,8aR,9S,9aR)-9-ацетокси-3-гидрокси-4a-метокси-7-(2-(пивалоилокси)этил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-2-ил)пропан-1,2-диилдиацетат (9,5 г, 16,5 ммоль) растворяли в дихлорметане (95 мл, 1480 ммоль) при температуре окружающей среды. Добавляли имидазол (3,49 г, 51,3 ммоль), диизопропилхлорсилан (5,64 мл, 33,1 ммоль) и 4-диметиламинопиридин (0,202 г, 1,65 ммоль). После перемешивания в течение 2 часов при температуре окружающей среды, реакцию гасили насыщенным водным NH4Cl (27% по массе) (95 мл). Полученную в результате смесь экстрагировали MTBE (143 мл), и органический слой промывали 30% водным NaCl (47,5 мл) и сушили над MgSO4. Фильтрование, концентрирование в вакууме и очистка колоночной хроматографией на силикагеле, применяя 180 г силикагеля, предварительно обработанного н-гептаном/EtOAc/TEA (500/50/1 мл), давали 9,5 г целевого продукта в виде бесцветного масла. 1H ЯМР (3:1 диастереомерная смесь, 400 МГц, CDCl3) δ ppm 0,99-1,10 (м, 14 H) 1,18 (с, 9 H) 1,44-2,00 (м, 7 H) 2,01-2,07 (м, 9 H) 2,08-2,19 (м, 1 H) 3,26 (с, 3 H) 3,33-3,43 (м, 1 H) 3,72 (т, J=3,2 Гц, 1 H(меньший)) 3,76 (т, J=3,8 Гц, 1 H(больший)) 3,98-4,19 (м, 5 H) 4,28 (с, 1 H) 4,35 (дд, J=12,2, 2,8 Гц, 1 H) 4,47 (дд, J=6,9, 4,5 Гц, 1 H) 4,96 (т, J=2,9 Гц, 1 H(меньший)) 5,01 (т, J=3,4 Гц, 1 H(больший)) 5,12-5,32 (м, 1 H).
3-((2R,3S,3aR,7R,8aS,9R,9aR)-9-ацетокси-3-((фтордиизопропилсилил)окси)-7-(2-(пивалоилокси)этил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-2-ил)пропан-1,2-диилдиацетат
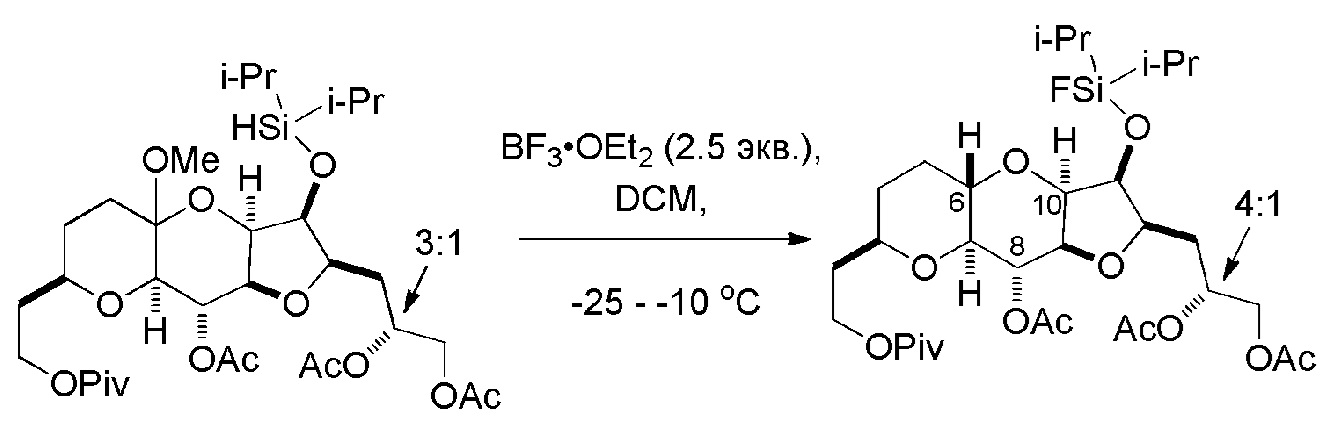
3-((2R,3S,3aR,7R,8aR,9S,9aR)-9-ацетокси-3-((диизопропилсилил)окси)-4a-метокси-7-(2-(пивалоилокси)этил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-2-ил)пропан-1,2-диилдиацетат (9,50 г, 13,8 ммоль) растворяли в дихлорметане (143 мл, 2215 ммоль) и охлаждали ниже -25°C. Добавляли BF3·OEt2 (2,55 мл, 20,7 ммоль), и полученный в результате бледно-желтый раствор перемешивали в течение 5 часов, нагревая до -10°C. Добавляли насыщенный водный NaHCO3 (8%) (95 мл) и дихлорметан (47,5 мл). Слои разделяли, и водный слой экстрагировали дихлорметаном (28,5 мл). Объединенные органические слои промывали 30% водным NaCl (47,5 мл) и сушили над MgSO4. Концентрирование в вакууме и очистка колоночной хроматографией на силикагеле, применяя 20-100% градиент этилацетата в н-гептане в качестве элюента, давала 5,24 г целевого продукта.
1H ЯМР (4:1 диастереомерная смесь, 400 МГц, CDCl3) δ ppm 1,12-1,16 (м, 14 H) 1,18 (с, 9 H) 1,23-1,47 (м, 2 H) 1,64-1,77 (м, 3 H) 1,78-1,88 (м, 1 H) 1,91-2,03 (м, 2 H) 2,04 (с, 3 H) 2,05 (с, 3 H) 2,09 (с, 3 H) 2,92 (дд, J=10,3, 9,4 Гц, 1 H) 3,29-3,40 (м, 1 H) 3,84-3,97 (м, 2 H) 3,98-4,19 (м, 4 H) 4,29 (дд, J=12,0, 3,2 Гц, 1 H) 4,38-4,49 (м, 2 H) 5,13-5,25 (м, 1 H) 5,32 (дд, J=10,5, 7,9 Гц, 1 H).
2-((2R,3S,3aR,4aS,7R,8aR,9R,9aS)-2-(2,3-дигидроксипропил)-3-((диизопропил(метокси)силил)окси)-9-гидроксидекагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)этилпивалат
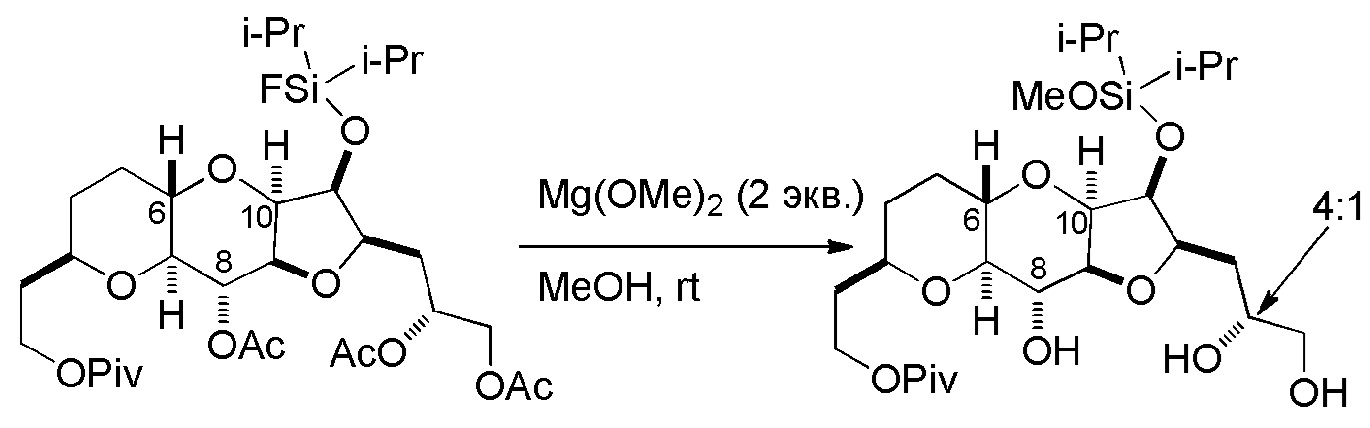
3-((2R,3S,3aR,4aS,7R,8aS,9R,9aR)-9-ацетокси-3-((фтордиизопропилсилил)окси)-7-(2-(пивалоилокси)этил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-2-ил)пропан-1,2-диилдиацетат (297 мг, 0,439 ммоль) растворяли в метаноле (4,46 мл) при температуре окружающей среды. Добавляли 0,5 M метоксид магния в MeOH (1,573 мл, 0,878 ммоль), и полученный в результате раствор перемешивали в течение ночи. Добавляли дополнительный раствор метоксида магния (0,5 M, 1,57 мл, 0,878 ммоль), и полученный в результате раствор перемешивали при температуре окружающей среды в течение 10 часов перед прекращением реакции насыщенным водным NH4Cl (27% по массе) (5,0 мл). Добавляли EtOAc (10 мл) и воду (2,0 мл), и полученную в результате белую смесь перемешивали при температуре окружающей среды в течение 20 минут. Слои разделяли, и водный слой экстрагировали дважды EtOAc (16 мл). Объединенные органические слои промывали дважды 30% водным NaCl (4,0 мл) и сушили над MgSO4. Фильтрование и концентрирование в вакууме давали 0,211 г целевого продукта в виде грязно-белого пенистого остатка.
2-((2R,3S,3aR,4aS,7R,8aR,9R,9aS)-3-((диизопропил(метокси)силил)окси)-2-((2,2-диметил-1,3-диоксолан-4-ил)метил)-9-гидроксидекагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)этилпивалат
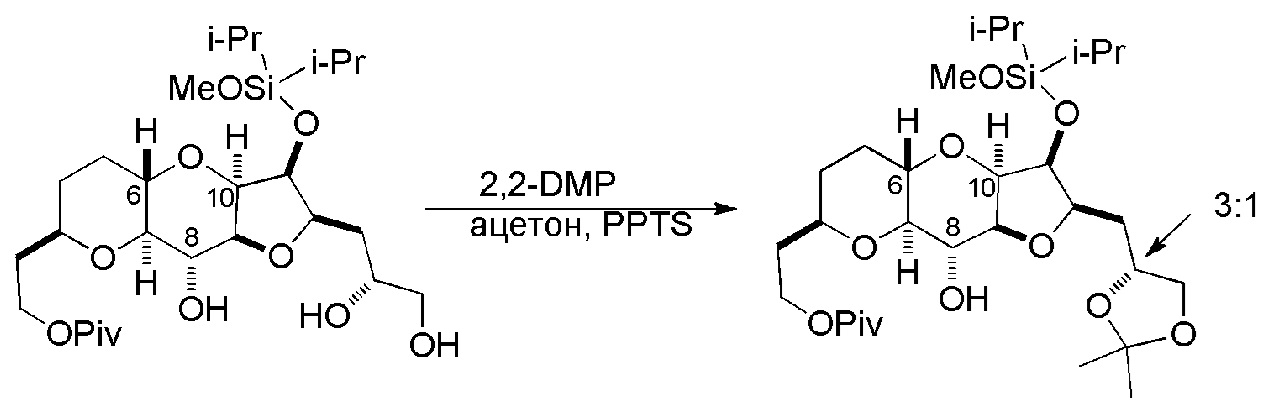
2-((2R,3S,3aR,4aS,7R,8aR,9R,9aS)-2-(2,3-дигидроксипропил)-3-((диизопропил(метокси)силил)окси)-9-гидроксидекагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)этилпивалат (0,190 г, 0,338 ммоль) растворяли в ацетоне (2,280 мл). Добавляли 2,2-диметоксипропан (0,570 мл, 4,641 ммоль) и п-толуолсульфонат пиридиния (0,017 г, 0,068 ммоль). Полученный в результате раствор перемешивали при температуре окружающей среды в течение 1 часа и обрабатывали насыщенным водным NaHCO3 (8%) (3,80 мл). Полученную в результате смесь экстрагировали дважды MTBE (10 мл), и объединенные органические слои промывали 30% водным NaCl (1,900 мл, 33,299 ммоль) и сушили над MgSO4. Фильтрование и концентрирование давало 0,214 г целевого продукта.
2-((2R,3S,3aR,4aS,7R,8aS,9aR)-3-((диизопропил(метокси)силил)окси)-2-((2,2-диметил-1,3-диоксолан-4-ил)метил)-9-оксодекагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)этилпивалат
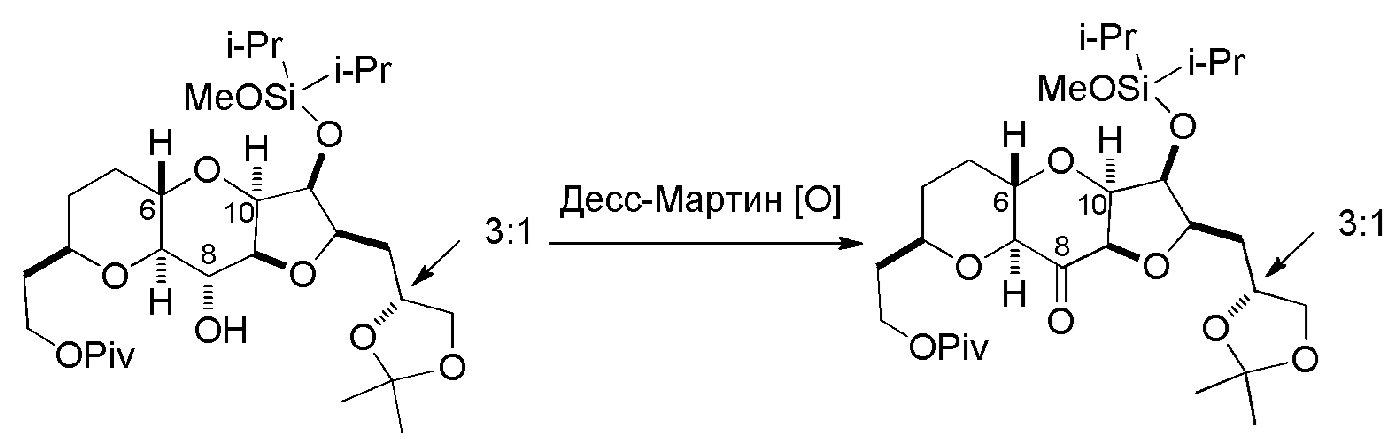
2-((2R,3S,3aR,4aS,7R,8aR,9R,9aS)-3-((Диизопропил(метокси)силил)окси)-2-((2,2-диметил-1,3-диоксолан-4-ил)метил)-9-гидроксидекагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)этилпивалат (0,214 г) растворяли в дихлорметане (4,07 мл). Добавляли бикарбонат натрия (0,113 г, 1,349 ммоль) и периодинан Десс-Мартина (0,286 г, 0,674 ммоль). После перемешивания при температуре окружающей среды в течение ночи, реакционную смесь разбавляли MTBE (10,17 мл, 85,34 ммоль) и водой (4,07 мл, 225,7 ммоль). Затем, добавляли насыщенный водный NaHCO3 (8%) (2,033 мл) и тиосульфат натрия (0,213 г, 1,349 ммоль), и полученную в результате смесь перемешивали при температуре окружающей среды в течение 30 минут. Слои разделяли, и водный слой экстрагировали MTBE (6,10 мл). Объединенные органические слои промывали 30% водным NaCl (2,033 мл) и сушили над MgSO4. Фильтрование, с последующим концентрированием, давало 206 мг целевого продукта.
2-((2R,3S,3aR,4aS,7R,8aR,9S,9aS)-3-((диизопропил(метокси)силил)окси)-2-((2,2-диметил-1,3-диоксолан-4-ил)метил)-9-гидроксидекагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)этилпивалат
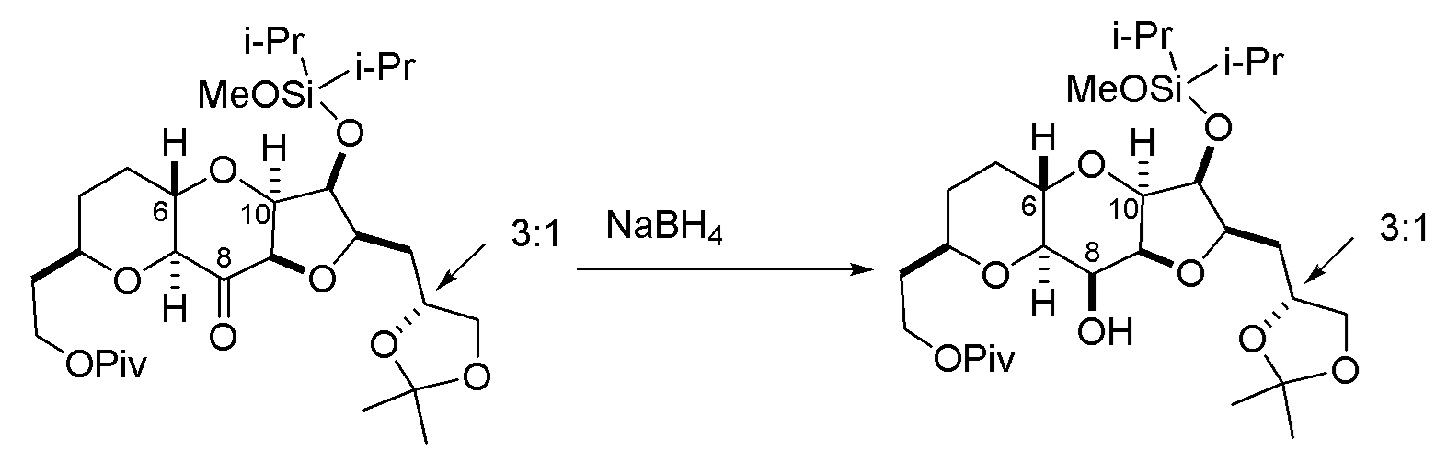
2-((2R,3S,3aR,4aS,7R,8aS,9aR)-3-((диизопропил(метокси)силил)окси)-2-((2,2-диметил-1,3-диоксолан-4-ил)метил)-9-оксодекагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)этилпивалат (206 мг) растворяли в метаноле (4,04 мл) и охлаждали до 0 oC. Затем, добавляли боргидрид натрия (0,019 г, 0,504 ммоль). Реакцию перемешивали в течение 30 минут при 0°C и прекращали насыщенным водным NH4Cl (27% по массе) (4,0 мл). Полученную в результате смесь экстрагировали дважды MTBE (8,0 мл). Объединенные органические слои промывали 30% водным NaCl (2,0 мл) и сушили над MgSO4. Фильтрование, с последующим концентрированием в вакууме, давало 216 мг целевого продукта.
2-((2R,3S,3aS,4aS,7R,8aR,9S,9aS)-2-((2,2-диметил-1,3-диоксолан-4-ил)метил)-3,9-дигидроксидекагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)этилпивалат
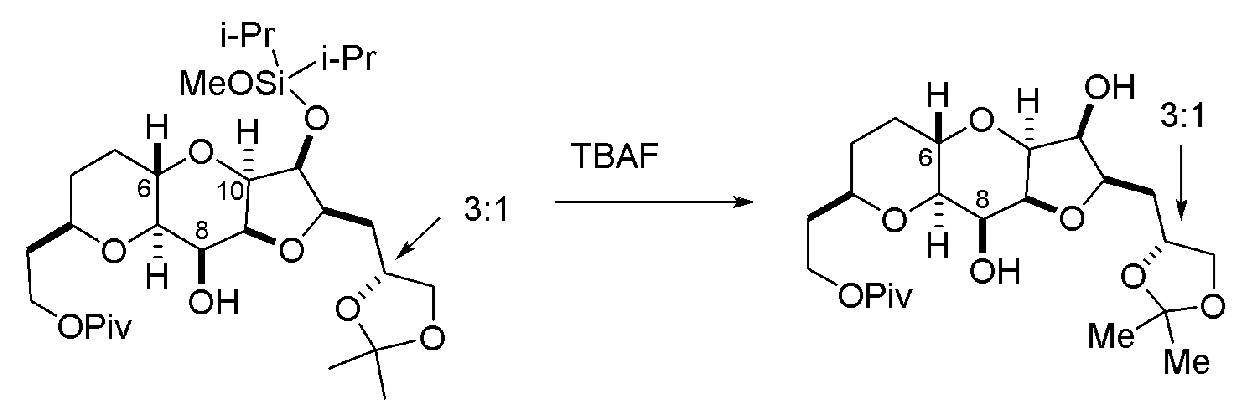
2-((2R,3S,3aR,4aS,7R,8aR,9S,9aS)-3-((диизопропил(метокси)силил)окси)-2-((2,2-диметил-1,3-диоксолан-4-ил)метил)-9-гидроксидекагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)этилпивалат (216 мг) растворяли в THF (4,0 мл) при температуре окружающей среды и охлаждали ниже 10°C. Добавляли 1,0 M TBAF в THF (0,500 мл, 0,50 ммоль). После потребления всех исходных соединений, добавляли насыщенный водный NH4Cl (27% по массе) (4,0 мл), и полученную в результате смесь экстрагировали дважды MTBE (10,04 мл). Объединенные органические слои промывали 30% водным NaCl (2,0 мл) и сушили над MgSO4. Фильтрование, с последующим концентрированием и очисткой колоночной хроматографией на силикагеле, применяя 33-80% градиент этилацетата в н-гептане в качестве элюента, давало 117 мг целевого продукта в виде белого твердого остатка.
1H ЯМР (3:1 диастереомерная смесь, 400 МГц, CDCl3) δ ppm 1,19 (с, 9 H) 1,35 (с, 3 H(меньший)) 1,36 (с, 3 H(больший)) 1,40 (s., 3 H(меньший)) 1,41 (с, 3 H(больший)) 1,70-2,01 (м, 7 H) 2,13-2,21 (м, 1 H) 3,00 (дд, J=9,7, 2,1 Гц, 1 H(больший)) 3,01 (дд, J=9,7, 2,1 Гц, 1 H(меньший)) 3,46-3,54 (м, 1 H) 3,59 (дд, J=8,2, 7,3 Гц, 1 H(больший)) 3,61 (дд, J=8,1, 7,2 Гц, 1 H(меньший)) 4,00-4,22 (м, 8 H) 4,22-4,31 (м, 1 H) 4,43 (дд, J=8,9, 4,5 Гц, 1 H).
Получали сокристалл требуемого продукта и C3-эпимера, и структуру подтверждали рентгеновским анализом на монокристалле (смотри фигуру 7).
2-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)окси)-2-(2,3-дигидроксипропил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)этилпивалат
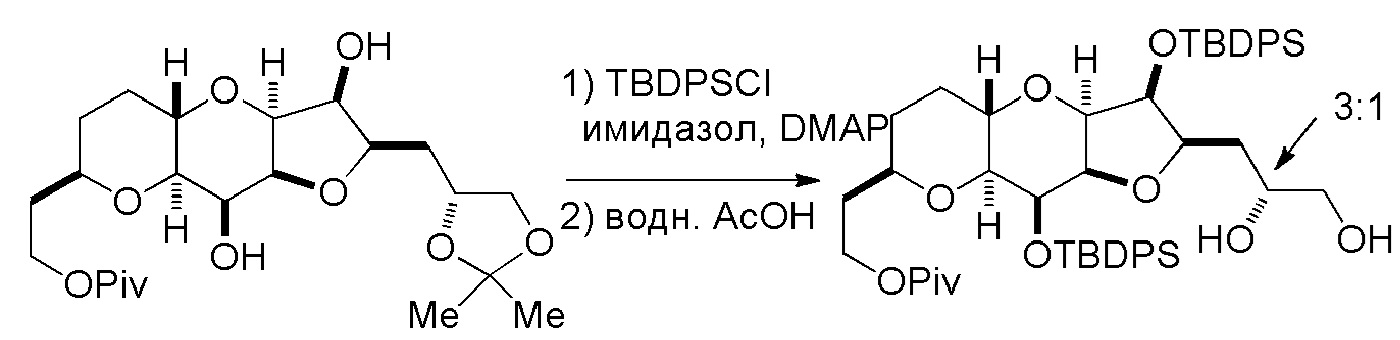
2-((2R,3S,3aS,4aS,7R,8aR,9S,9aS)-2-((2,2-диметил-1,3-диоксолан-4-ил)метил)-3,9-дигидроксидекагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)этилпивалат (110 мг, 0,24 ммоль) растворяли в DMF (2,200 мл) при температуре окружающей среды. Добавляли имидазол (131 мг, 1,92 ммоль), трет-бутилдифенилхлорсилан (308 мкл, 1,20 ммоль) и 4-диметиламинопиридин (14,65 мг, 0,12 ммоль). Полученную в результате смесь перемешивали при 45°C в течение ночи. Добавляли дополнительный имидазол (163 мг, 2,40 ммоль), TBDPS-Cl (308 мкл, 1,199 ммоль) и 4-диметиламинопиридин (29,3 мг, 0,24 ммоль). После перемешивания при температуре 60-70°C в течение 10 часов, реакционную смесь обрабатывали MTBE (15 мл) и насыщенным раствором NH4Cl (8 мл). Водный слой отделяли и экстрагировали MTBE (10 мл). Объединенные органические слои промывали дважды 30% водным NaCl (3 мл каждый) и сушили над MgSO4. Фильтрование, с последующей очисткой колоночной хроматографией на силикагеле, давало 0,75 г 2-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)окси)-2-((2,2-диметил-1,3-диоксолан-4-ил)метил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)этилпивалата с чистотой 10% по массе вместе с моносилиловым эфиром (81 мг) и исходным соединением (19 мг). Моносилиловый эфир (81 мг, 0,116 ммоль) и извлеченное исходное соединение (19 мг, 0,041 ммоль) растворяли в дихлорметане (1,5 мл) и охлаждали до 0°C. Добавляли 2,6-лутидин (0,068 мл, 0,581 ммоль) и трет-бутилдифенилсилилтрифторметансульфонат (0,097 мл, 0,314 ммоль). После перемешивания в течение ночи при температуре окружающей среды, реакционную смесь обрабатывали насыщенным раствором NH4Cl (5 мл). Полученную в результате смесь экстрагировали дважды MTBE (12 мл). Объединенные органические слои промывали 1M водной хлористоводородной кислотой (3 мл), насыщенным NaHCO3 (2 мл) и 30% водным NaCl (2 мл). Сушка над MgSO4 и концентрирование в вакууме давали 0,215 г густого масла, которое смешивали с ранее выделенным продуктом. К объединенному неочищенному продукту добавляли уксусную кислоту (8,0 мл) и воду (2,0 мл) при температуре окружающей среды. Полученную в результате смесь перемешивали при 25-30°C в течение ночи. Добавляли дополнительную уксусную кислоту (5 мл) и воду (1 мл), и реакционную смесь перемешивали при температуре 35-40°C в течение 4 часов. Концентрирование в вакууме, с последующей очисткой колоночной хроматографией на силикагеле, применяя 20-60% градиент этилацетата в н-гептане в качестве элюента, давало 0,171 г целевого продукта в виде пленкообразного масла.
1H ЯМР (3:1 диастереомерная смесь, 400 МГц, CDCl3) δ ppm 1,05-1,12 (м, 18 H) 1,18 (с, 9 H) 1,28-1,68 (м, 5 H) 1,82-1,93 (м, 2 H) 1,95-2,10 (м, 1 H) 2,63 (д, J=4,7 Гц, 1 H(больший)) 2,75 (д, J=5,6 Гц, 1 H(меньший)) 3,00 (дд, J=9,7, 4,1 Гц, 1 H(больший)) 3,15 (дд, J=10,3, 4,7 Гц, 1 H(меньший)) 3,23-3,30 (м, 1 H) 3,31-3,38 (м, 1 H) 3,43-3,51 (м, 1 H) 3,61 (дд, J=6,7, 4,7 Гц, 1 H) 3,70 (т, J=5,0 Гц, 1 H) 3,79-3,84 (м, 1 H) 3,87 (ддд, J=9,3, 6,2, 3,2 Гц, 1 H) 3,95 (т, J=6,6 Гц, 2 H) 4,06-4,14 (м, 1 H) 4,23 (т, J=5,3 Гц, 1 H) 4,30 (дд, J=6,3, 5,1 Гц, 1 H(больший)) 4,33 (дд, J=6,6, 4,2 Гц, 1 H(меньший)) 7,28-7,45 (м, 12 H) 7,62-7,79 (м, 8 H).
2-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)окси)-2-(2-оксоэтил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)этилпивалат
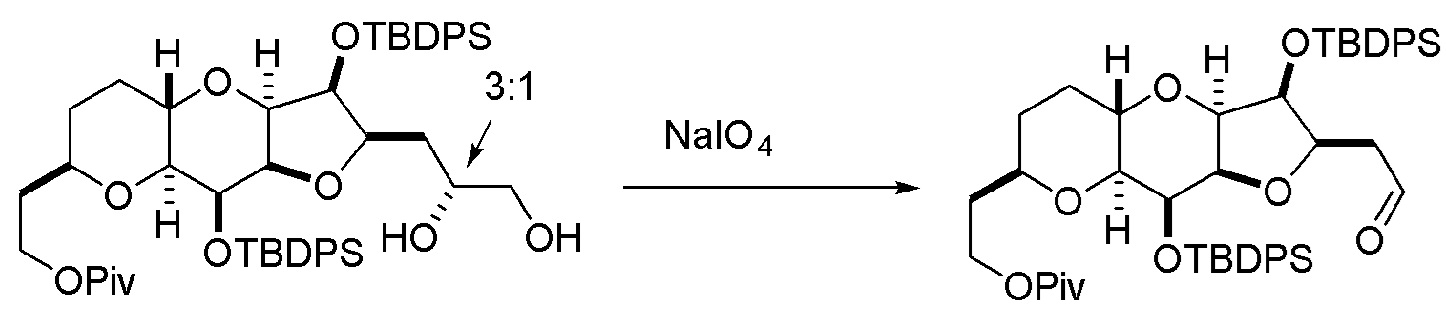
К 2-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)окси)-2-(2,3-дигидроксипропил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)этилпивалату (143 мг, 0,16 ммоль) добавляли THF (2,9 мл) и воду (1,4 мл) при температуре окружающей среды. Полученную в результате смесь охлаждали до 0°C и обрабатывали периодатом натрия (180 мг, 0,842 ммоль). После перемешивания при температуре окружающей среды в течение 2 часов, реакционную смесь разбавляли MTBE (12 мл). Смесь промывали насыщенным водным NaHCO3 (8%) (3,0 мл) и 30% водным NaCl (2,0 мл) и сушили над MgSO4. Фильтрование, с последующим концентрированием в вакууме, давало 136 мг целевого продукта.
2-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)окси)-2-(2-гидроксибут-3-ен-1-ил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)этилпивалат
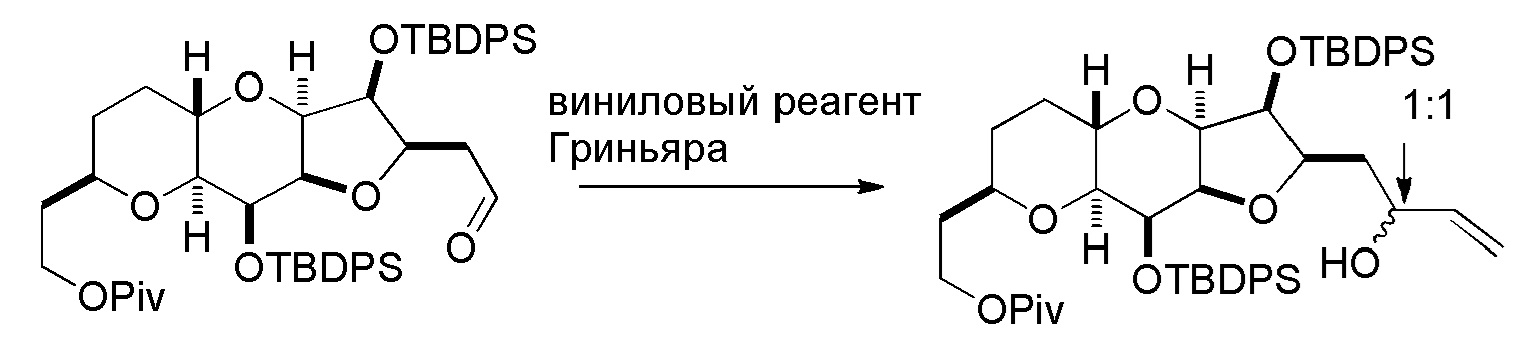
2-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)окси)-2-(2-оксоэтил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)этилпивалат (136 мг) растворяли в THF (2,72 мл, 33,2 ммоль) и охлаждали до -30°C. Добавляли винилмагнийбромид (1,0 M в THF, 0,394 мл, 0,394 ммоль), и полученный в результате раствор перемешивали при температуре между -30 и -35°C в течение 20 минут. Добавляли насыщенный водный NH4Cl (27% по массе) (4,0 мл), и полученную в результате смесь нагревали до температуры окружающей среды. Смесь экстрагировали MTBE (10 мл), и органический слой промывали 30% водным NaCl (2,0 мл) и сушили над MgSO4. Фильтрование и концентрирование фильтрата давали 129 мг целевого продукта в виде белого пенистого остатка.
2-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)окси)-2-(2-((триэтилсилил)окси)бут-3-ен-1-ил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)этилпивалат

2-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)окси)-2-(2-гидроксибут-3-ен-1-ил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)этилпивалат (129 мг) растворяли в дихлорметане (3,0 мл) при температуре окружающей среды. Добавляли имидазол (39,4 мг, 0,579 ммоль), хлортриэтилсилан (0,049 мл, 0,289 ммоль) и 4-диметиламинопиридин (0,884 мг, 7,24 мкмоль). После перемешивания при температуре окружающей среды в течение 2 часов, реакцию гасили насыщенным водным NH4Cl (27% по массе, 5,0 мл). Полученную в результате смесь экстрагировали MTBE (15 мл). Органический слой промывали 30% водным NaCl (3,0 мл), сушили над MgSO4, фильтровали и концентрировали в вакууме, получая 0,155 г требуемого продукта в виде масла.
2-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)окси)-2-(2-((триэтилсилил)окси)бут-3-ен-1-ил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)этанол
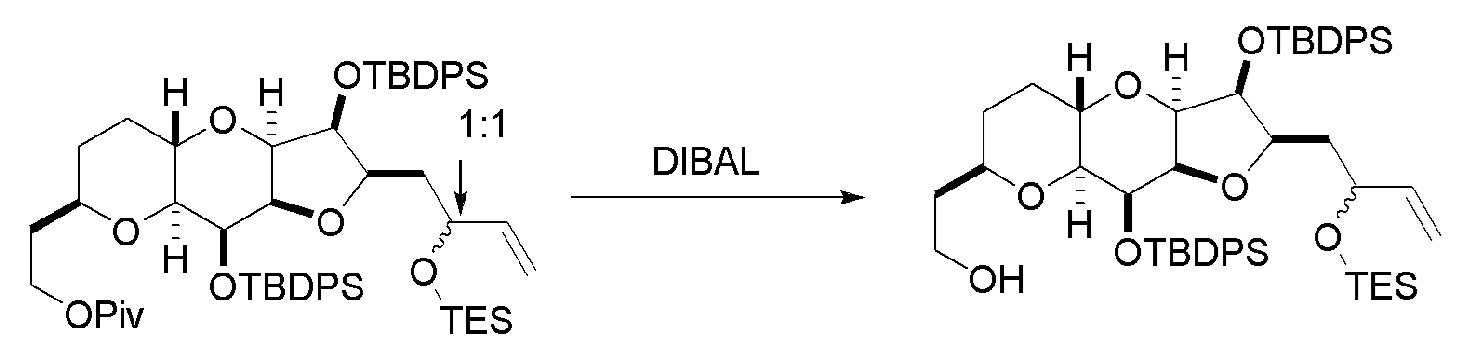
2-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)окси)-2-(2-((триэтилсилил)окси)бут-3-ен-1-ил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)этилпивалат (155 мг, 0,145 ммоль) растворяли в дихлорметане (2,91 мл) и охлаждали до -78°C. Добавляли DIBAL в толуоле (1,0 M, 0,724 мл, 0,724 ммоль), и полученный в результате раствор перемешивали в течение 1 часа. Добавляли метанол (0,1 мл, 2,5 ммоль) и раствор сегнетовой соли (613 мг, 2,173 ммоль) в воде (2,9 мл), и полученную в результате смесь нагревали до температуры окружающей среды. Слои разделяли, и водный слой экстрагировали дихлорметаном (2,91 мл). Объединенные органические слои промывали 30% водным NaCl (1,457 мл) и сушили над MgSO4. Фильтрование, концентрирование и очистка колоночной хроматографией на силикагеле, применяя 20-33% градиент этилацетата в н-гептане в качестве элюента, давали 107 мг целевого продукта в виде белой пены. 1H ЯМР (1:1 диастереомерная смесь, 400 МГц, CDCl3) δ ppm 0,48-0,57 (м, 3 H) 0,58-0,67 (м, 3 H) 0,83-0,93 (м, 4,5 H) 0,94-1,02 (м, 4,5 H) 1,06-1,18 (м, 18 H) 1,28-1,72 (м, 6,5 H) 1,85-1,94 (м, 1 H) 1,95-2,04 (м, 0,5 H) 2,12 (дд, J=10,3, 4,4 Гц, 1 H) 2,98 (дд, J=9,7, 3,2 Гц, 0,5 H) 3,11 (дд, J=9,7, 6,2 Гц, 0,5 H) 3,30 (т, J=5,1 Гц, 0,5 H) 3,33-3,40 (м, 0,5 H) 3,41-3,57 (м, 2,5 H) 3,58-3,70 (м, 2 H) 3,84-3,90 (м, 0,5 H) 3,92-4,02 (м, 0,5 H) 4,03-4,25 (м, 2,5 H) 4,32 (дд, J=5,9, 3,2 Гц, 0,5 H) 4,34-4,41 (м, 0,5 H) 4,93-5,16 (м, 2 H) 5,59-5,80 (м, 1 H) 7,24-7,46 (м, 12 H) 7,57-7,83 (м, 8 H).
2-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)окси)-2-(2-((триэтилсилил)окси)бут-3-ен-1-ил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)ацетальдегид
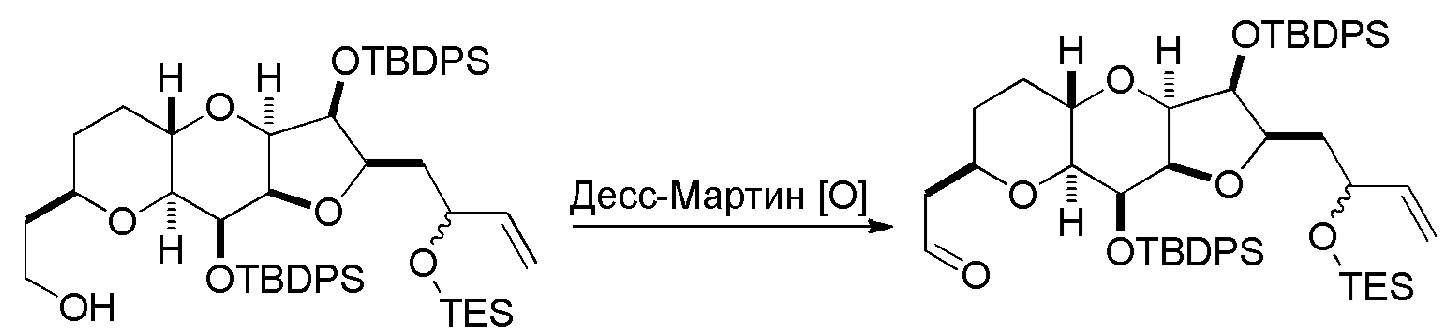
2-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)окси)-2-(2-((триэтилсилил)окси)бут-3-ен-1-ил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)этанол (80 мг, 0,087 ммоль) растворяли в дихлорметане (1,60 мл, 24,9 ммоль) при температуре окружающей среды. Добавляли бикарбонат натрия (36,5 мг, 0,434 ммоль) и периодинан Десс-Мартина (110 мг, 0,26 ммоль). После перемешивания в течение 3 часов, реакционную смесь обрабатывали MTBE (10 мл), насыщенным водным NaHCO3 (8%) (2,0 мл), водой (1,0 мл) и тиосульфатом натрия (137 мг, 0,868 ммоль). Полученную в результате смесь перемешивали при температуре окружающей среды в течение 30 минут. Слои разделяли, и органический слой промывали 30% водным NaCl (2,0 мл) и сушили над MgSO4. Фильтрование, концентрирование и фильтрование через слой силикагеля н-гептаном/EtOAc (2/1, 20 мл) давали 76 мг целевого продукта в виде бесцветной пленки.
1H ЯМР (1:1 диастереомерная смесь, 400 МГц, CDCl3) δ ppm 0,45-0,56 (м, 3 H) 0,56-0,65 (м, 3 H) 0,79-1,00 (м, 9 H) 1,06-1,17 (м, 18 H) 1,27-1,40 (м, 4,5 H) 1,59-1,67 (м, 1 H) 1,77 (м, 0,5 H) 1,85-1,99 (м, 1 H) 2,04-2,09 (м, 1 H) 2,14 (уш.с, 0,5 H) 2,16-2,20 (м, 0,5 H) 2,23 (дд, J=4,5, 1,9 Гц, 0,5 H) 2,30 (дд, J=7,9, 2,1 Гц, 0,5 H) 2,97 (дд, J=9,7, 3,2 Гц, 0,5 H) 3,03 (м, J=9,8, 5,7 Гц, 0,5 H) 3,47 (дд, J=6,3, 4,5 Гц, 0,5 H) 3,54-3,76 (м, 2,5 H) 3,92 (дд, J=7,0, 5,6 Гц, 0,5 H) 3,98-4,29 (м, 3,5 H) 4,37 (дд, J=6,2, 3,2 Гц, 1 H) 4,94 (дт, J=10,3, 1,4 Гц, 0,5H) 4,99-5,07 (м, 1 H) 5,09-5,18 (м, 0,5 H) 5,58-5,78 (м, 1 H) 7,27-7,44 (м, 12H) 7,63-7,82 (м, 8 H) 9,43 (т, J=2,1 Гц, 0,5 H) 9,51 (т, J=1,9 Гц, 0,5 H).
Пример 2: Получение субстрата для C.15-C.16 макроциклизации
(E)-3-((2R,5S)-5-(2-((2S,4R,6R)-6-(((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-3-((фенилсульфонил)метил)тетрагидрофуран-2-ил)метил)-4-метил-5-метилентетрагидро-2H-пиран-2-ил)этил)-4-метилентетрагидрофуран-2-ил)акрилальдегид
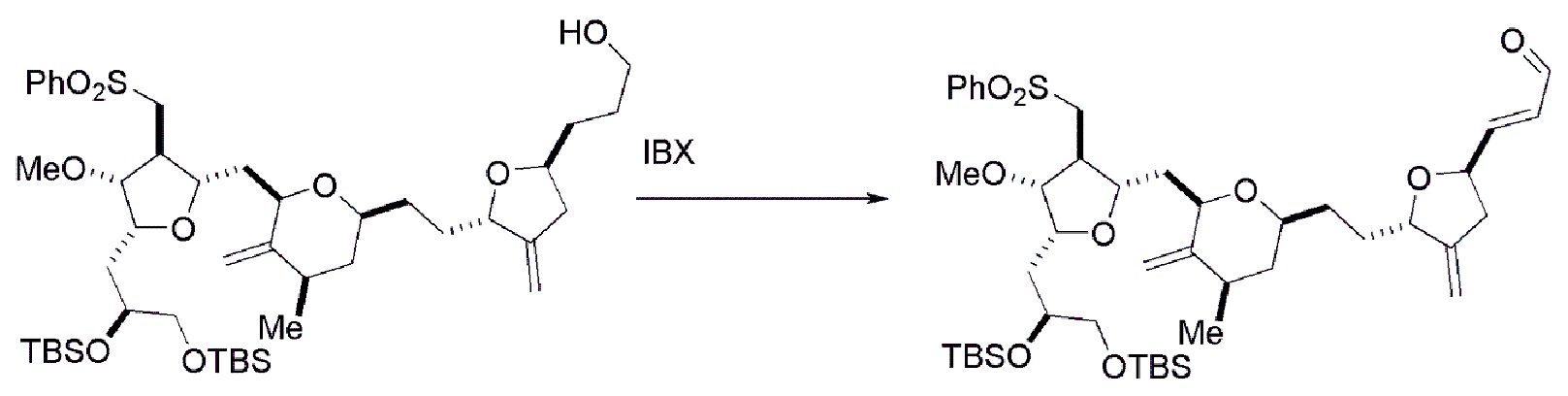
К перемешиваемому раствору 3-((2S,5S)-5-(2-((2S,4R,6R)-6-(((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-3-((фенилсульфонил)метил)тетрагидрофуран-2-ил)метил)-4-метил-5-метилентетрагидро-2H-пиран-2-ил)этил)-4-метилентетрагидрофуран-2-ил)пропан-1-ола (2,5 г, 2,9 ммоль) в смеси DMSO/толуол (20/40 мл) добавляли IBX (4,11 г, 14,7 ммоль), бензойную кислоту (1,79 г, 14,7 ммоль) и бикарбонат натрия (0,42 г, 5,0 ммоль) при температуре окружающей среды. После дегазирования, реакционную смесь перемешивали в течение 6 часов при 75°C (реакционную колбу оборачивали алюминиевой фольгой для защиты от света). Добавляли дополнительный IBX (2 г через 5 часов, 3 г через 10 часов), и смесь перемешивали в течение дополнительных 6 ч при 77°C. Добавляли 150 мл MTBE, и полученную в результате смесь промывали дважды насыщенным раствором NaHCO3. Органический слой сушили над MgSO4, фильтровали и очищали колоночной хроматографией на силикагеле, получая 1,5 г целевого продукта. 1H ЯМР (400 МГц,CDCl3) δ ppm -0,03-0,02 (м, 12 H) 0,79-0,82 (м, 18 H) 1,01 (д, J=6,6 Гц, 3 H) 1,38-1,341 (м, 1 H) 1,42-1,54 (м, 3 H) 1,58-1,85 (м, 4 H) 1,90-1,95 (м, 1 H) 1,97-2,16 (м, 3 H) 2,35-2,45 (м, 2 H) 2,46-2,49 (м, 2 H) 2,76-2,81 (м, 1 H) 2,91-3,00 (м, 2 H) 3,34 (с, 3 H) 3,35-3,42 (м, 2 H) 3,46-3,62 (м, 2 H) 3,56-3,62 (м, 1 H) 3,65-3,68 (м, 2 H) 3,70-3,77 (м, 2 H) 4,07-4,28 (м, 1 H) 4,66-4,70 (м, 2 H) 4,78 (уш с, 1 H) 4,84-4,90 (м, 1 H) 6,17 (ддд, J=15,6, 7,8, 1,6 Гц, 1H) 6,70 (дд, J=15,6, 4,6 Гц, 1H) 7,50-7,55 (м, 2 H) 7,60 -7,64 (м, 1 H) 7,87 (д, J= 9,9 Гц, 2 H) 9,49 (д, J=7,8 Гц, 1 H).
(E)-3-((2R,5S)-5-(2-((2S,4R,6R)-6-(((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-3-((фенилсульфонил)метил)тетрагидрофуран-2-ил)метил)-4-метил-5-метилентетрагидро-2H-пиран-2-ил)этил)-4-метилентетрагидрофуран-2-ил)проп-2-ен-1-ол
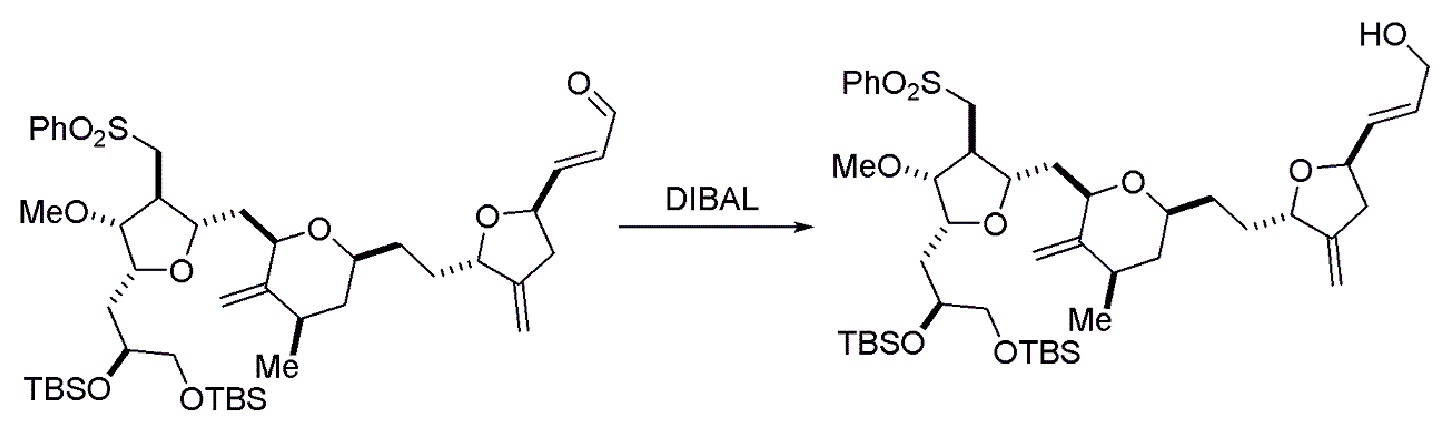
(E)-3-((2R,5S)-5-(2-((2S,4R,6R)-6-(((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-3-((фенилсульфонил)метил)тетрагидрофуран-2-ил)метил)-4-метил-5-метилентетрагидро-2H-пиран-2-ил)этил)-4-метилентетрагидрофуран-2-ил)акрилальдегид (3,4 г) растворяли в THF (70 мл) и охлаждали до -70°C. Добавляли DIBAL в толуоле (1,0 M, 5,42 мл) при данной температуре, и полученный в результате раствор медленно нагревали до -50°C в течение 2 часов. На данном этапе, реакцию прекращали добавлением метанола, с последующим добавлением водного хлорида аммония и MTBE. Полученную в результате смесь перемешивали в течение 2 часов при комнатной температуре. Экстракционная обработка данной смеси давала неочищенный продукт, который очищали флэш-хроматографией на силикагеле гексаном/этилацетатом (3:1-1:1) в качестве элюента, получая 2,4 г требуемого продукта в виде масла. 1H ЯМР (400 МГц, CDCl3) δ ppm -0,03-0,05 (м, 12 H) 0,80-0,86 (м, 18 H) 0,94-1,03 (м, 4 H) 1,31-1,41 (м, 2 H) 1,42-1,53 (м, 3 H) 1,61-1,88 (м, 3 H) 1,92-1,98 (м, 2 H) 2,10-2,17 (м, 2 H) 2,20-2,33 (м, 1 H) 2,46-2,49 (м, 1 H) 2,50-2,66 (м, 1 H) 2,92-3,01 (м, 2 H) 3,38 (с, 3 H) 3,39-3,43 (м, 2 H) 3,47-3,59 (м, 1 H) 3,61-3,63 (м, 1 H) 3,64-3,78 (м, 3 H) 4,07-4,08 (м, 1 H) 4,02-4,05 (м, 1H) 4,36-4,41 (м, 1 H) 4,60-4,63 (уш с, 1 H) 4,71 (уш с, 1 H) 4,85-4,89 (м, 1 H) 5,62-5,68 (м, 1H) 5,79-5,81 (м, 1H) 7,52-7,56 (м, 2 H) 7,60 -7,64 (м, 1 H) 7,87-7,89 (м, 1 H).
(S)-5-(((2R,3R,4S,5S)-5-(((2R,4R,6S)-6-(2-((2S,5R)-5-((E)-3-(аллилокси)проп-1-ен-1-ил)-3-метилентетрагидрофуран-2-ил)этил)-4-метил-3-метилентетрагидро-2H-пиран-2-ил)метил)-3-метокси-4-((фенилсульфонил)метил)тетрагидрофуран-2-ил)метил)-2,2,3,3,8,8,9,9-октаметил-4,7-диокса-3,8-дисиладекан
К раствору (E)-3-((2R,5S)-5-(2-((2S,4R,6R)-6-(((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-3-((фенилсульфонил)метил)тетрагидрофуран-2-ил)метил)-4-метил-5-метилентетрагидро-2H-пиран-2-ил)этил)-4-метилентетрагидрофуран-2-ил)проп-2-ен-1-ола (0,42 г, 0,50 ммоль) в сухом THF (5 мл) при 5°C добавляли гидрид натрия (60% в масле, 30 мг, 0,74 ммоль)), и полученную в результате суспензию выдерживали при температуре окружающей среды в течение 20 минут. Добавляли аллилбромид (0,060 мл, 0,69 ммоль) и TBAI (0,018 мг, 0,049 ммоль). Полученную в результате смесь перемешивали в течение 16 часов при температуре окружающей среды. Реакцию гасили добавлением насыщенного водного NH4Cl. Экстракция этилацетатом, концентрирование в вакууме и очистка колоночной хроматографией на силикагеле давали 0,28 г целевого продукта в виде масла.
1H ЯМР (400 МГц, CDCl3) δ ppm 0,037 (с, 3 H) 0,044 (с, 3 H) 0,09 (с, 3 H) 0,10 (с, 3 H) 0,87-0,89 (м, 18 H) 1,06 (д, J=6,6 Гц, 3 H) 1,22-1,32 (м, 1 H) 1,37-1,48 (м, 2 H) 1,52-1,62 (м, 2 H) 1,71-1,78 (м, 1 H) 1,79-1,93 (м, 2 H) 1,96-2,07 (м, 1 H) 2,13-2,26 (м, 2 H) 2,31-2,42 (м, 1 H) 2,52-2,60 (м, 1 H) 2,63-2,74 (м, 1 H) 2,96-3,08 (м, 2 H) 3,35-3,41 (м, 1 H) 3,43 (с, 3 H) 3,48 (м, J=5,5 Гц, 1 H) 3,54-3,62 (м, 2 H) 3,64-3,71 (м, 1 H) 3,76-3,87 (м, 3 H) 3,94-4,00 (м, 4 H) 4,26-4,34 (м, 1 H) 4,43 (кв, J=6,6 Гц, 1 H) 4,63-4,72 (м, 1 H) 4,77 (д, J=1,6 Гц, 1 H) 4,85 (с, 1 H) 4,89-4,96 (м, 1 H) 5,17 (дкв, J=10,5, 1,3 Гц, 1 H) 5,27 (дкв, J=17,2, 1,6 Гц, 1 H) 5,65-5,82 (м, 2 H) 5,84-5,98 (м, 1 H) 7,61 (д, J=7,8 Гц, 2 H) 7,65-7,73 (м, 1 H) 7,90-8,01 (м, 2 H).
(1S)-1-((2S,3S,4R,5R)-2-(((2R,4R,6S)-6-(2-((2S,5R)-5-((E)-3-(аллилокси)проп-1-ен-1-ил)-3-метилентетрагидрофуран-2-ил)этил)-4-метил-3-метилентетрагидро-2H-пиран-2-ил)метил)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокситетрагидрофуран-3-ил)-3-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)окси)-2-(2-((триэтилсилил)окси)бут-3-ен-1-ил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)-1-(фенилсульфонил)пропан-2-ол
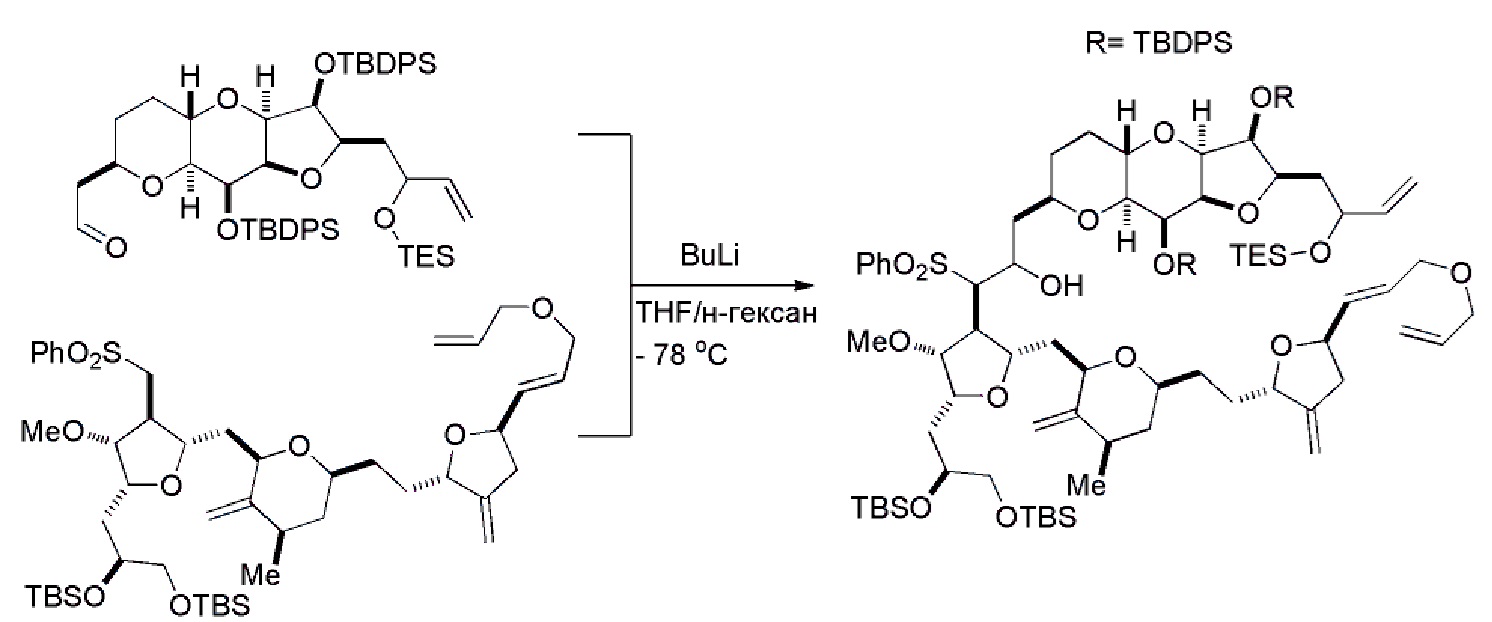
2-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)окси)-2-(2-((триэтилсилил)окси)бут-3-ен-1-ил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)ацетальдегид (76 мг, 0,083 ммоль) растворяли в THF (0,760 мл, 9,275 ммоль) и охлаждали до 0 oC. Добавляли н-бутиллитий (1,6 M, 0,108 мл, 0,174 ммоль), и полученный в результате раствор перемешивали при 0°C в течение 30 минут, и затем охлаждали до -78°C. Добавляли раствор (S)-5-(((2R,3R,4S,5S)-5-(((2R,4R,6S)-6-(2-((2S,5R)-5-((E)-3-(аллилокси)проп-1-ен-1-ил)-3-метилентетрагидрофуран-2-ил)этил)-4-метил-3-метилентетрагидро-2H-пиран-2-ил)метил)-3-метокси-4-((фенилсульфонил)метил)тетрагидрофуран-2-ил)метил)-2,2,3,3,8,8,9,9-октаметил-4,7-диокса-3,8-дисиладекана (147 мг, 0,165 ммоль) в н-гексане (1,52 мл), и реакционную смесь перемешивали при -78°C в течение 1 часа. Добавляли насыщенный водный NH4Cl (27% по массе) (3,0 мл), воду (1,0 мл) и MTBE (8,0 мл), и полученную в результате смесь нагревали до температуры окружающей среды. Органический слой отделяли, промывали 30% водным NaCl (2,0 мл) и сушили над MgSO4. Фильтрование, концентрирование в вакууме, и очистка колоночной хроматографией на силикагеле, применяя 20-50% градиент этилацетата в н-гептане в качестве элюента, давали 152 мг целевого продукта.
(1S)-1-((2S,3S,4R,5R)-2-(((2R,4R,6S)-6-(2-((2S,5R)-5-((E)-3-(аллилокси)проп-1-ен-1-ил)-3-метилентетрагидрофуран-2-ил)этил)-4-метил-3-метилентетрагидро-2H-пиран-2-ил)метил)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокситетрагидрофуран-3-ил)-3-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)окси)-2-(2-((триэтилсилил)окси)бут-3-ен-1-ил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)-1-(фенилсульфонил)пропан-2-он
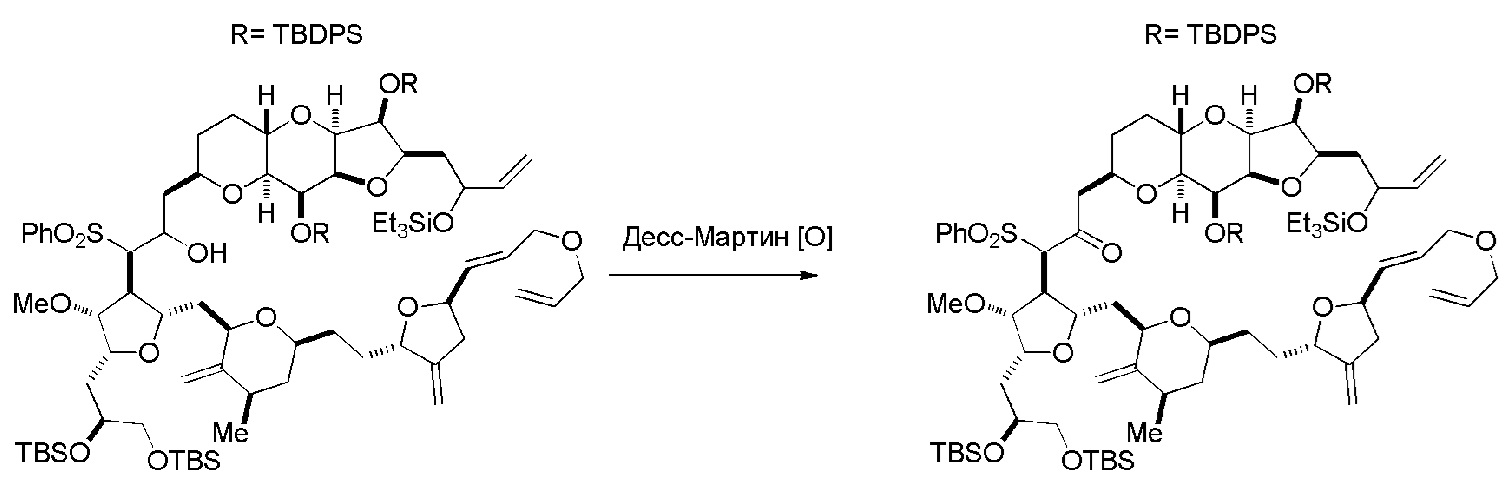
(1S)-1-((2S,3S,4R,5R)-2-(((2R,4R,6S)-6-(2-((2S,5R)-5-((E)-3-(аллилокси)проп-1-ен-1-ил)-3-метилентетрагидрофуран-2-ил)этил)-4-метил-3-метилентетрагидро-2H-пиран-2-ил)метил)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокситетрагидрофуран-3-ил)-3-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)окси)-2-(2-((триэтилсилил)окси)бут-3-ен-1-ил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)-1-(фенилсульфонил)пропан-2-ол (152 мг, 0,084 ммоль) растворяли в дихлорметане (3,04 мл) при температуре окружающей среды. Добавляли бикарбонат натрия (35,3 мг, 0,42 ммоль) и периодинан Десс-Мартина (89 мг, 0,21 ммоль), и полученную в результате смесь перемешивали при температуре окружающей среды в течение ночи. Добавляли MTBE (7,600 мл), воду (1,52 мл), насыщенный водный NaHCO3 (8%) (3,04 мл) и тиосульфат натрия (133 мг, 0,84 ммоль). После перемешивания при температуре окружающей среды в течение 1 часа, слои разделяли. Органический слой промывали 30% водным NaCl (3,0 мл) и сушили над MgSO4. Фильтрование, концентрирование и очистка колоночной хроматографией на силикагеле, применяя 12-25% градиент этилацетата в н-гептане в качестве элюента, давали 77 мг целевого продукта.
1-((2S,3S,4R,5R)-2-(((2R,4R,6S)-6-(2-((2S,5R)-5-((E)-3-(аллилокси)проп-1-ен-1-ил)-3-метилентетрагидрофуран-2-ил)этил)-4-метил-3-метилентетрагидро-2H-пиран-2-ил)метил)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокситетрагидрофуран-3-ил)-3-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)окси)-2-(2-((триэтилсилил)окси)бут-3-ен-1-ил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)пропан-2-он
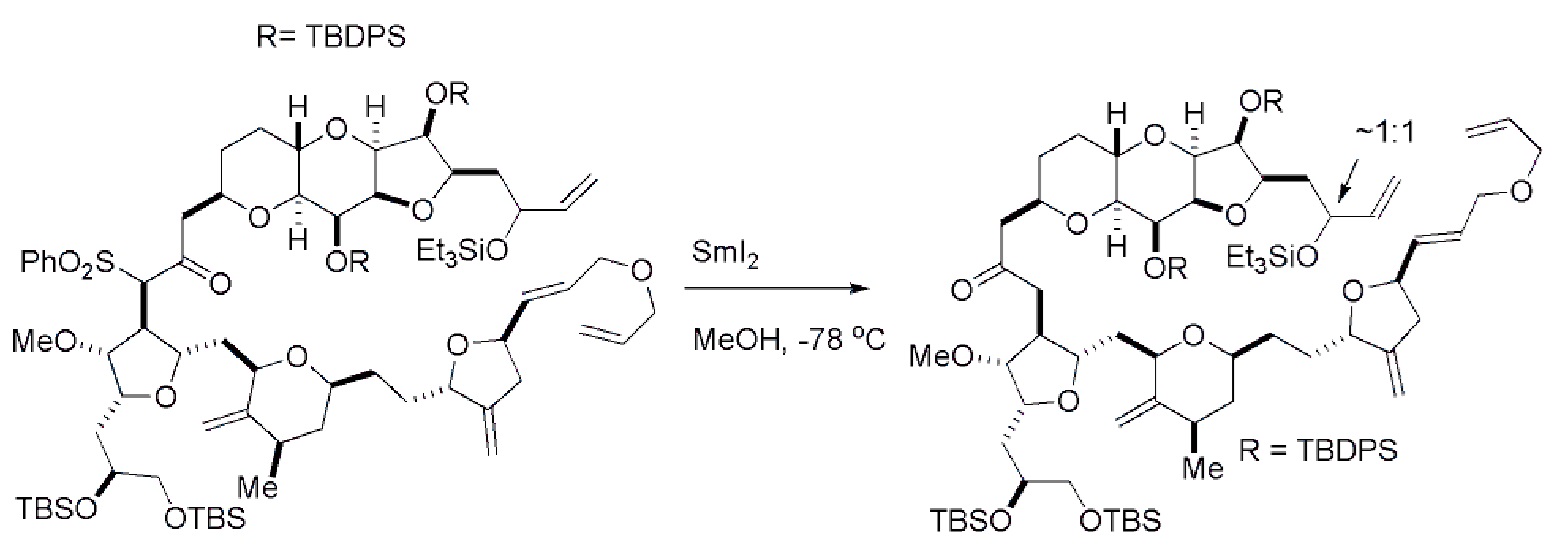
(1S)-1-((2S,3S,4R,5R)-2-(((2R,4R,6S)-6-(2-((2S,5R)-5-((E)-3-(аллилокси)проп-1-ен-1-ил)-3-метилентетрагидрофуран-2-ил)этил)-4-метил-3-метилентетрагидро-2H-пиран-2-ил)метил)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокситетрагидрофуран-3-ил)-3-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)окси)-2-(2-((триэтилсилил)окси)бут-3-ен-1-ил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)-1-(фенилсульфонил)пропан-2-он (77 мг) растворяли в THF (1,2 мл) и MeOH (0,77 мл). Полученный в результате раствор охлаждали до -78°C и обрабатывали 0,1M дийодидом самария (1,28 мл, 0,128 ммоль) в течение 1 часа. Реакцию гасили смесью сегнетовой соли (385 мг, 1,36 ммоль), карбоната калия (385 мг, 2,79 ммоль) и воды (3,85 мл). Добавляли MTBE (5,0 мл), и полученную в результате смесь нагревали до температуры окружающей среды. Слои разделяли, и водный слой экстрагировали MTBE (5,0 мл). Объединенные органические слои промывали 30% водным NaCl (2,0 мл) и сушили над MgSO4. Фильтрование, концентрирование и очистка колоночной хроматографией на силикагеле, применяя 25-33% градиент этилацетата в н-гептане в качестве элюента, давали 46 мг целевого продукта. 1H ЯМР (1:1 диастереомерная смесь, 400 МГц,CDCl3) δ ppm -0,01-0,13 (м, 12 H) 0,46-0,65 (м, 6 H) 0,84-0,99 (м, 27 H) 1,02-1,16 (м, 21 H) 1,22-1,36 (м, 1 H) 1,45-1,82 (м, 10 H) 1,87-2,29 (м, 9 H) 2,32-2,45 (м, 2 H) 2,65-2,77 (м, 1 H) 2,98 (дд, J=9,5, 3,1 Гц, 0,5 H) 3,04 (дд, J=9,7, 5,3 Гц,0,5 H) 3,20 (т, J=4,0 Гц, 1 H) 3,30 (с, 1,5H) 3,34 (м, 1,5 H) 3,39-3,90 (м, 12 H) 3,92-4,03 (м, 4 H) 4,06-4,24 (м, 3 H) 4,31-4,39 (м, 1 H) 4,39-4,51 (м, 2 H) 4,73-4,86 (м, 3 H) 4,91-5,06 (м, 3 H) 5,16 (д, J=1,2 Гц, 1 H) 5,22-5,30 (м, 1 H) 5,58-5,82 (м, 3 H) 5,84-5,97 (м, 1 H) 7,26-7,43 (м, 12 H) 7,62-7,80 (м, 8 H).
Пример 3: Получение соединения формулы (ID) через C.15-C.16 макроциклизацию
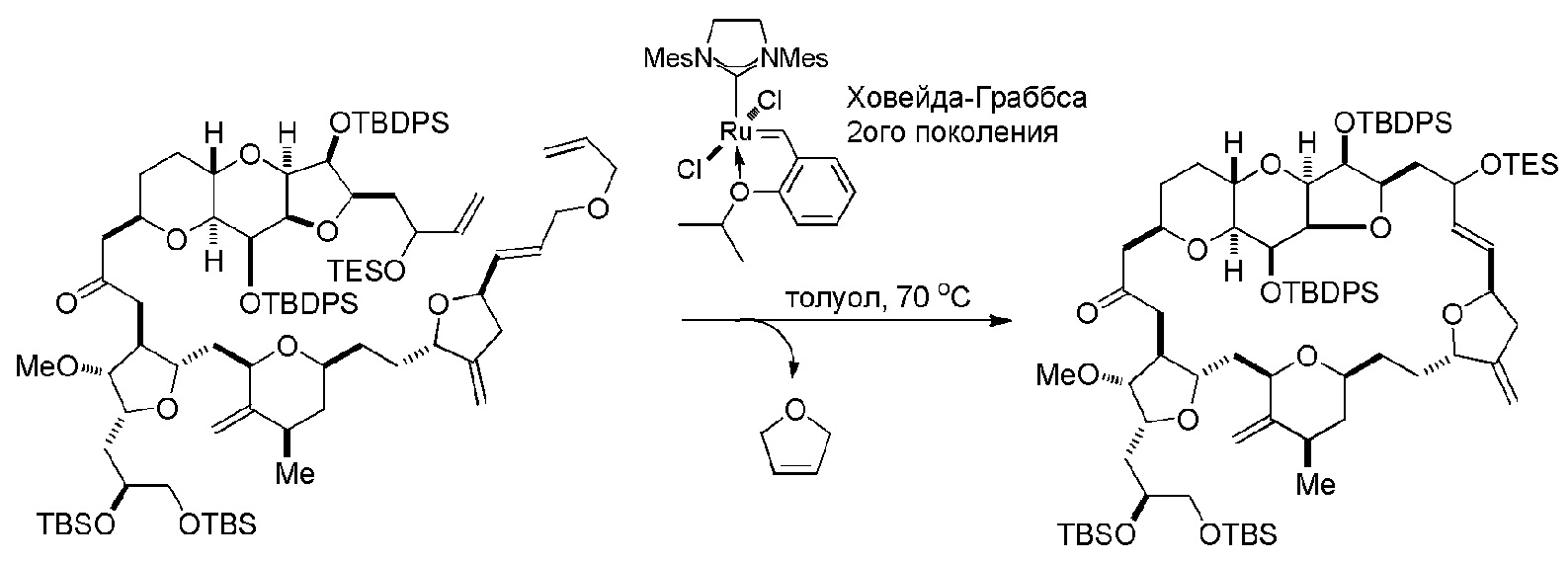
1-((2S,3S,4R,5R)-2-(((2R,4R,6S)-6-(2-((2S,5R)-5-((E)-3-(аллилокси)проп-1-ен-1-ил)-3-метилентетрагидрофуран-2-ил)этил)-4-метил-3-метилентетрагидро-2H-пиран-2-ил)метил)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокситетрагидрофуран-3-ил)-3-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)окси)-2-(2-((триэтилсилил)окси)бут-3-ен-1-ил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)пропан-2-он (32 мг, 0,019 ммоль) растворяли в толуоле (7,0 мл). Добавляли катализатор Ховейда-Граббса 2ого поколения (1,448 мг, 2,304 мкмоль), и полученный в результате раствор нагревали до 70°C. После перемешивания при 70°C в течение ночи, реакционную смесь охлаждали до температуры окружающей среды и концентрировали в вакууме. Колоночная хроматография на силикагеле остатка, применяя 10-50% градиент этилацетата в н-гептане в качестве элюента, давала 9,3 мг целевого продукта. MS m/z 1591,1 [M+Na]+. 1H ЯМР (1,5:1 диастереомерная смесь, 400 МГц,CDCl3) δ ppm 0,01-0,10 (м, 12 H) 0,58 (тд, J=7,8, 5,7 Гц, 6 H) 0,81-0,97 (м, 30 H) 1,00-1,12 (м, 18 H) 1,17-2,80 (м, 24 H) 2,88 (т, J=9,1 Гц, 1 H(больший)) 2,97 (т, J=9,4 Гц, 1 H(меньший)) 3,29-3,35 (м, 1 H) 3,37 (с, 3 H(больший)) 3,42 (с, 3 H(меньший)) 3,42-3,85 (м, 10H), 3,96-4,15 (м, 3 H) 4,34 (м, 2 H) 4,40-4,48 (м, 1 H) 4,54 -4,70 (м, 1H) 4,78-4,82 (м, 1 H) 4,85 (уш.с, 1 H) 4,90-4,92 (м, 1 H) 4,96-5,01 (м, 1 H) 5,51 (дд, J=15,2, 7,0 Гц, 1 H(меньший)) 5,81 (ддд, J=15,4, 7,6, 1,3 Гц, 1 H(больший)) 6,32 (дд, J=15,2, 3,5 Гц, 1 H(больший)) 6,59 (дд, J=15,4, 8,9 Гц, 1 H(меньший)) 7,28-7,45 (м, 12 H) 7,52-7,78 (м, 8 H).
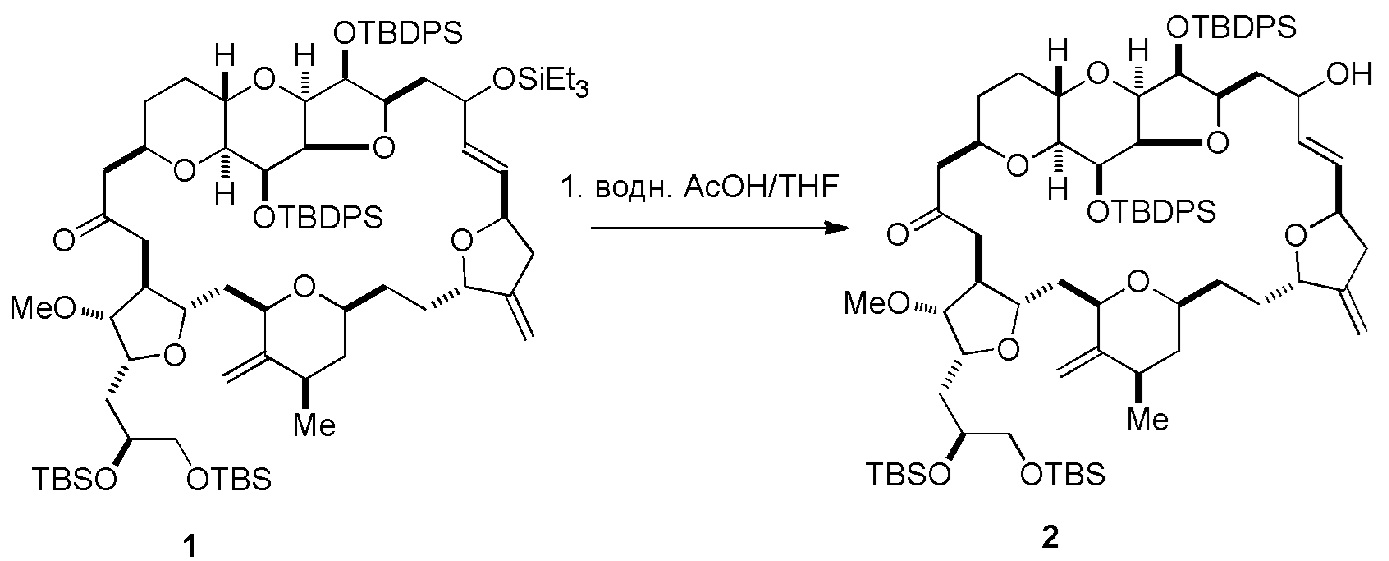
Соединение 1 (4,6 мг, 2,9 мкмоль) растворяли в THF (1,1 мл) при температуре окружающей среды. К раствору добавляли уксусную кислоту (0,5 мл) и воду (0,3 мл). После перемешивания в течение 3 часов при температуре окружающей среды, полученную в результате смесь концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле, применяя 10-33% градиент этилацетата в н-гептане в качестве элюента, получая 4,0 мг соединения 2. 1H ЯМР (основной изомер, 400 МГц,CDCl3) δ ppm -0,02-0,09 (м, 12 H) 0,88 (с, 9 H) 0,89 (с, 9 H) 1,03 (с, 9 H) 1,05 (д, J=6,4 Гц, 3 H) 1,07 (с, 9 H) 1,25-2,81 (м, 24 H) 2,95 (т, J=9,1 Гц, 1 H) 3,33 (д, J=3,5 Гц, 1 H) 3,40 (с, 3 H) 3,44-3,53 (м, 2 H) 3,53-3,61 (м, 2 H) 3,66-3,85 (м, 8 H) 4,08 (дд, J=8,6, 3,7 Гц, 1 H) 4,29-4,40 (м, 2 H) 4,42-4,48 (м, 1 H) 4,60-4,69 (м, 2 H) 4,79 (с, 1 H) 4,86 (уш.с, 1 H) 4,90 (с, 1 H) 4,99 (уш.с, 1 H) 5,79 (ддд, J=15,7, 7,9, 1,6 Гц, 1 H) 6,54 (дд, J=15,4, 3,7 Гц, 1 H) 7,28-7,45 (м, 12 H) 7,52-7,76 (м, 8 H).
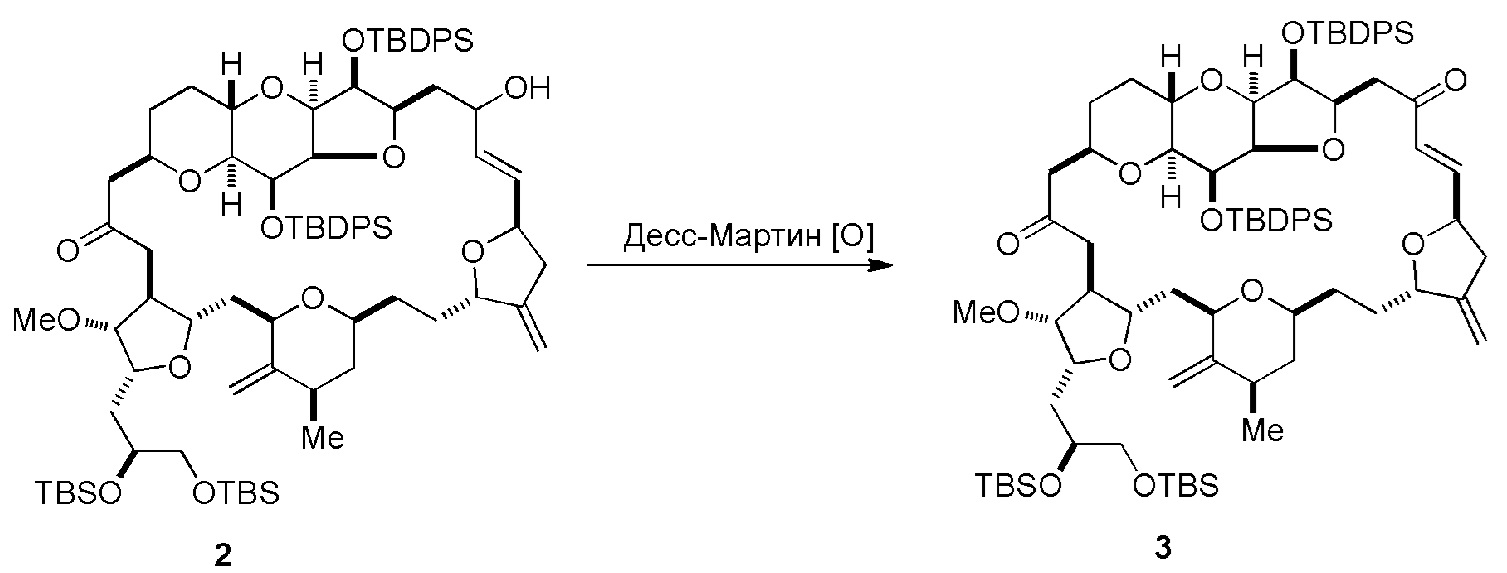
Соединение 2 (4,0 мг, 2,751 мкмоль) растворяли в дихлорметане (1,0 мл) при температуре окружающей среды. Добавляли бикарбонат натрия (1,4 мг, 0,017 ммоль) и периодинан Десс-Мартина (3,5 мг, 8,3 мкмоль), и полученную в результате смесь перемешивали при температуре окружающей среды в течение ночи. Добавляли MTBE (3,0 мл), воду (1,0 мл), насыщенный водный NaHCO3 (8%) (1,0 мл) и тиосульфат натрия (2,174 мг, 0,014 ммоль). Полученную в результате смесь перемешивали при температуре окружающей среды в течение 30 минут. Органический слой отделяли, промывали 30% водным NaCl (0,5 мл) и сушили над MgSO4. Фильтрование, с последующим концентрированием в вакууме, давало 3,3 мг соединения 3.
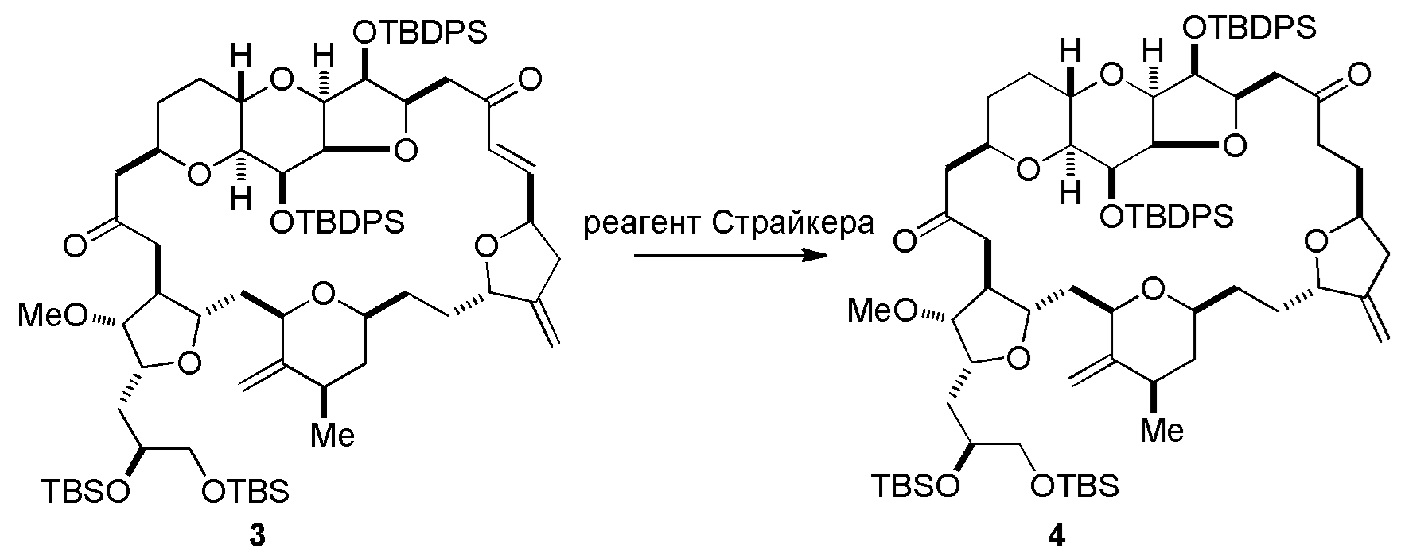
Соединение 3 (3,3 мг, 2,3 мкмоль) растворяли в обескислороженном толуоле (0,5 мл) при температуре окружающей среды. Добавляли обескислороженную (продутую азотом в течение 40 минут) воду (2 мкл, 0,11 ммоль), с последующим добавлением реагента Страйкера (4,5 мг, 2,3 мкмоль). Через 1 час, добавляли дополнительное количество реагента Страйкера (~2 мг). После перемешивания в течение дополнительного 1 часа, реакционную смесь обрабатывали воздухом. Образовывался осадок. Концентрирование, с последующей очисткой колоночной хроматографией, применяя 10-20% градиент этилацетата в н-гептане в качестве элюента, давало 2,5 мг соединения 4.
1H ЯМР (400 МГц, CDCl3) δ ppm 0,03-0,10 (м, 12 H) 0,88 (с, 9 H) 0,90 (с, 9 H) 1,00 (с, 9 H) 1,05 (д, J=6,4 Гц, 3 H) 1,08 (с, 9 H) 1,20 -2,20 (м, 21 H) 2,25-2,35 (м, 1 H) 2,46-2,81 (м, 6H) 2,90-2,99 (м, 1 H) 3,05 (т, J=11,7 Гц, 1 H) 3,09 (т, J=9,1 Гц, 1 H) 3,32 (д, J=2,3 Гц, 1 H) 3,42 (с, 3 H) 3,48 (дд, J=4,5, 3,7 Гц, 1 H) 3,51 (дд, J=10,5, 5,0 Гц, 1 H) 3,58 (дд, J=10,4, 5,7 Гц, 1 H) 3,69-3,92 (м, 7 H) 4,05 (дд, J=8,8, 3,2 Гц, 1 H) 4,11-4,20 (м, 1 H) 4,35 (м, 1 H) 4,37-4,44 (м, 1 H) 4,78 (с, 1 H) 4,86 (д, J=1,5 Гц, 1 H) 4,90 (с, 1 H) 4,98 (д, J=1,8 Гц, 1 H) 7,27-7,46 (м, 12 H) 7,58-7,69 (м, 8 H).
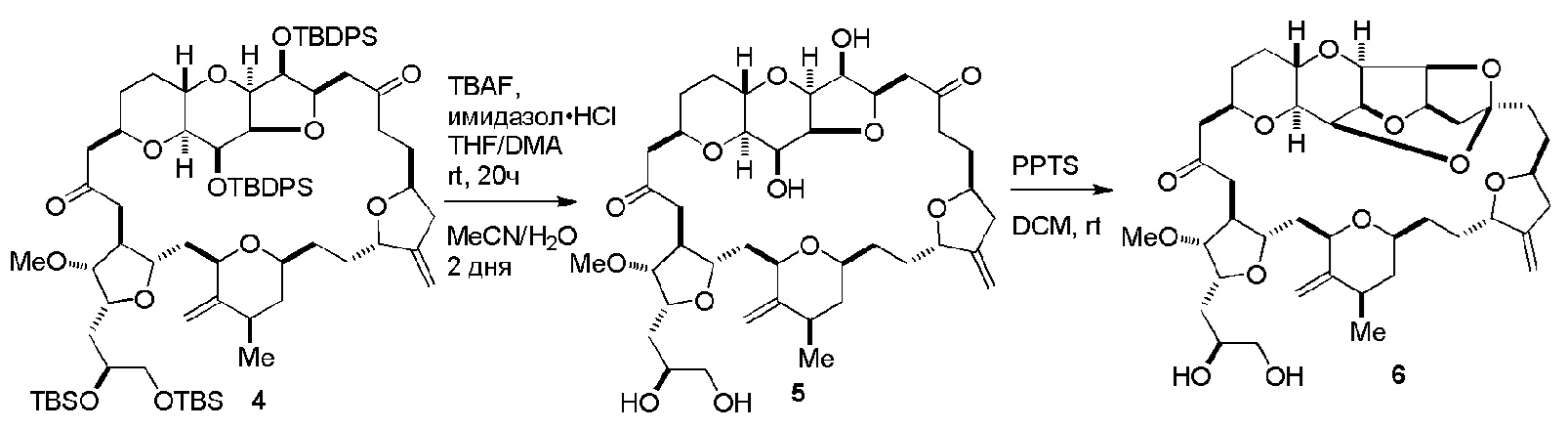
К соединению 4 (2,5 мг, 1,719 мкмоль) в пробирке добавляли THF (230 мкл) и N,N-диметилацетамид (88 мкл) при температуре окружающей среды. Добавляли смесь TBAF (34 мкл, 0,034 ммоль) и гидрохлорида имидазола (1,8 мг, 0,017 ммоль), и полученную в результате смесь перемешивали в течение 20 часов при температуре окружающей среды. Добавляли смесь ацетонитрила (60 мкл) и воды (20 мкл), и полученную в результате смесь перемешивали при температуре окружающей среды в течение 2 дней. Добавляли 30% водный NaCl (0,13 мл) и толуол (0,7 мл). Слои разделяли, и водный слой экстрагировали дважды смесью THF (1,4 мл) и толуола (1,4 мл). Объединенный органический слой концентрировали в потоке азота. Остаток растворяли в дихлорметане (0,2 мл) при температуре окружающей среды, и добавляли PPTS (0,80 мг, 3,2 мкмоль). Через 1 час и через 4 часа добавляли дополнительный PPTS (0,4 мг и 3 мг, соответственно). После потребления всего исходного соединения, реакционную смесь очищали колоночной хроматографией на силикагеле, применяя гептан/этилацетат (1/1), этилацетат и MTBE/MeCN (1/1) в качестве элюента, получая 1,6 мг соединения 6. Структуру подтверждали сравнением 1H ЯМР спектра с описанным в литературе спектром.
1H ЯМР (500 МГц, метанол-d4) δ ppm 1,01-1,10 (м, 2 H) 1,14 (д, J=6,6 Гц, 3 H) 1,30-1,64 (м, 7 H) 1,70-2,54 (м, 17 H) 2,67-2,81 (м, 2 H) 2,87-2,94 (м, 1 H) 2,96-2,98 (м, 1 H) 3,38-3,41 (м, 1 H) 3,45 (с, 3 H) 3,50 (дд, J=11,4, 6,2 Гц, 1 H) 3,54 (дд, J=11,0,4,4 Гц, 1 H) 3,69-3,80 (м, 2 H) 3,84-3,94 (м, 3 H) 4,01 (т, J=10,6 Гц, 1 H) 4,10-4,18 (м, 2 H) 4,21 (дд, J=6,4, 4,6 Гц, 1 H) 4,27-4,39 (м, 2 H) 4,51 (д, J=10,6 Гц, 1 H) 4,64 (т, J=4,4 Гц, 1 H) 4,74 (т, J=4,6 Гц, 1 H) 4,86 (уш.с, 1 H) 4,92 (с, 1 H) 5,06 (с, 1 H) 5,17 (д, J=1,8 Гц, 1 H).
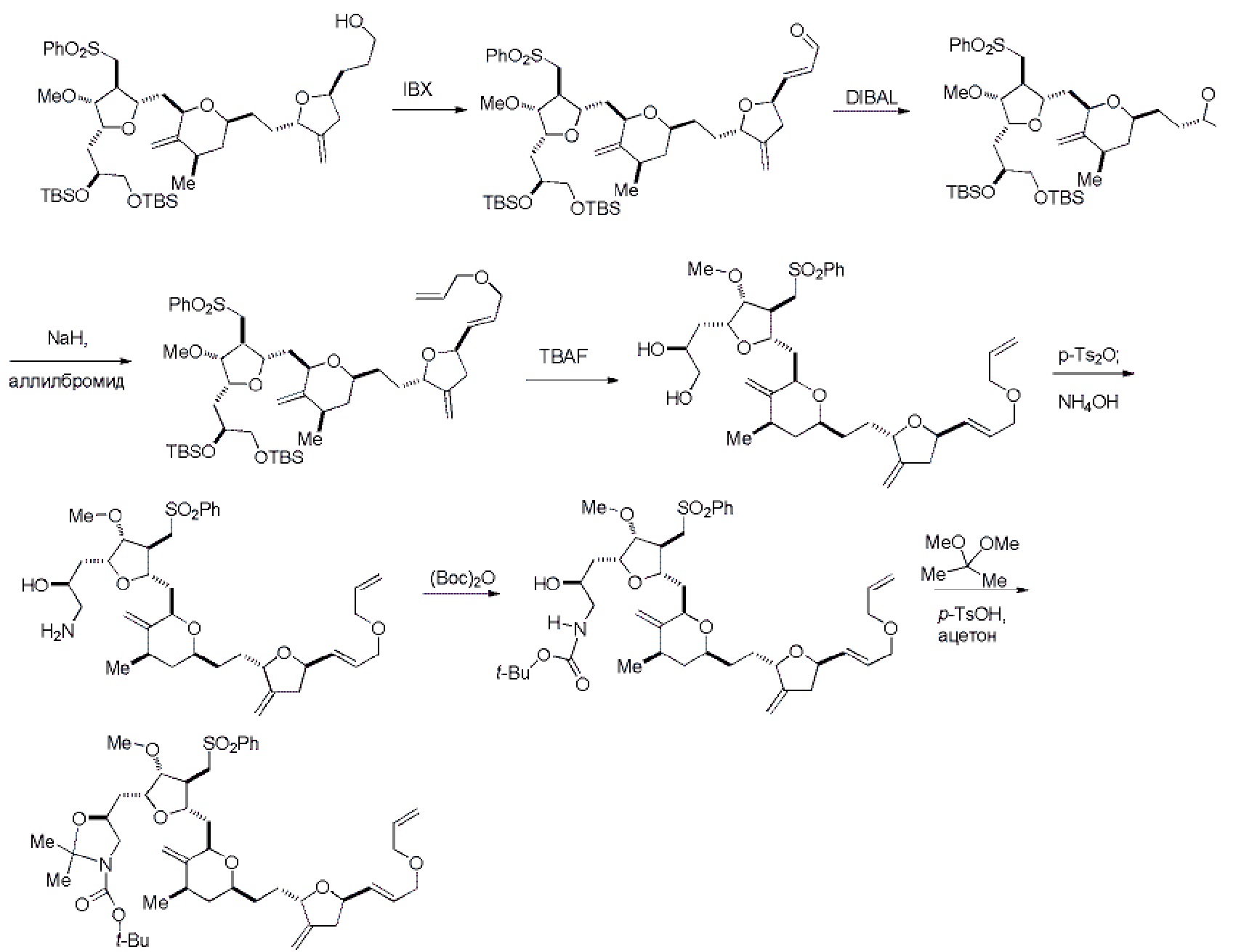
(S)-3-((2R,3R,4S,5S)-5-(((2R,4R,6S)-6-(2-((2S,5R)-5-((E)-3-(аллилокси)проп-1-ен-1-ил)-3-метилентетрагидрофуран-2-ил)этил)-4-метил-3-метилентетрагидро-2H-пиран-2-ил)метил)-3-метокси-4-((фенилсульфонил)метил)тетрагидрофуран-2-ил)пропан-1,2-диол
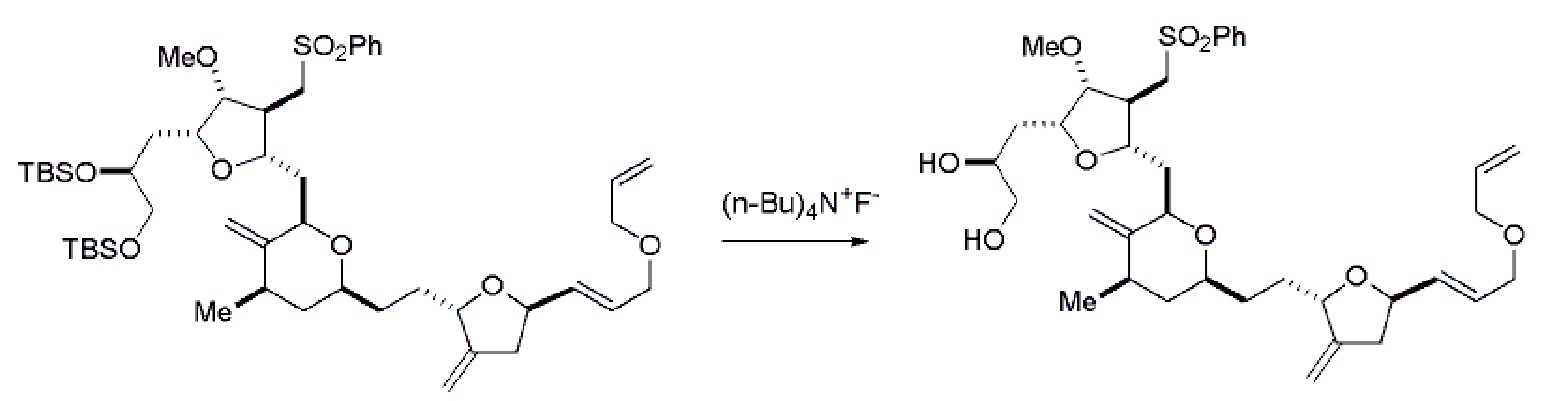
К перемешиваемому раствору (S)-5-(((2R,3R,4S,5S)-5-(((2R,4R,6S)-6-(2-((2S,5R)-5-((E)-3-(аллилокси)проп-1-ен-1-ил)-3-метилентетрагидрофуран-2-ил)этил)-4-метил-3-метилентетрагидро-2H-пиран-2-ил)метил)-3-метокси-4-((фенилсульфонил)метил)тетрагидрофуран-2-ил)метил)-2,2,3,3,8,8,9,9-октаметил-4,7-диокса-3,8-дисиладекана (3,8 г, 4,27 ммоль) в THF (50 мл) при 5°C добавляли 1M THF раствор TBAF (12,8 мл, 12,8 ммоль). Реакцию нагревали до комнатной температуры. После выдерживания в течение 16 часов при данной температуре, реакцию гасили добавлением водного хлорида аммония (10 мл). После разбавления этилацетатом (30 мл), фазы разделяли. Водный слой экстрагировали этилацетатом (2x 50 мл), и органические слои объединяли. Объединенные органические слои сушили над MgSO4. Удаление растворителя при пониженном давлении и флэш-хроматография на силикагеле остатка гептаном-этилацетатом (2:1-1:2) в качестве элюента давали 2,3 г (81%) требуемого продукта в виде масла.
1H ЯМР (400 МГц, CDCl3) δ ppm 1,34-1,41 (м, 2 H) 1,47-1,54 (м, 4 H) 1,67-1,77 (м, 3 H) 1,86-1,96 (м, 3 H) 2,10-2,17 (м, 2 H) 2,28-2,33 (м, 1 H) 2,51-2,55 (м, 1 H) 2,56-2,66 (м, 1 H) 2,99-3,08 (м, 2 H) 3,29-3,34 (м, 2 H) 3,38 (с, 3 H) 3,39-3,59 (м, 4 H) 3,73-3,78 (м, 1 H) 3,84-3,90 (м, 3 H) 3,90-3,92 (м, 4 H) 4,20-4,28 (м, 1 H), 4,37-4,39 (м, 1 H) 4,63-4,64 (м, 1 H) 4,73 (уш с, 1 H), 4,78 (уш с, 1 H) 4,86 (м, 1 H) 5,10-5,13 (м, 1 H) 5,19-5,23 (м, 1 H) 5,66-5,73 (м, 1H) 5,81-5,88 (м, 1 H) 7,53-7,57 (м, 2 H) 7,62 -7,67 (м, 1 H) 7,86-7,90 (м, 2 H).
(S)-1-((2R,3R,4S,5S)-5-(((2R,4R,6S)-6-(2-((2S,5R)-5-((E)-3-(аллилокси)проп-1-ен-1-ил)-3-метилентетрагидрофуран-2-ил)этил)-4-метил-3-метилентетрагидро-2H-пиран-2-ил)метил)-3-метокси-4-((фенилсульфонил)метил)тетрагидрофуран-2-ил)-3-аминопропан-2-ол
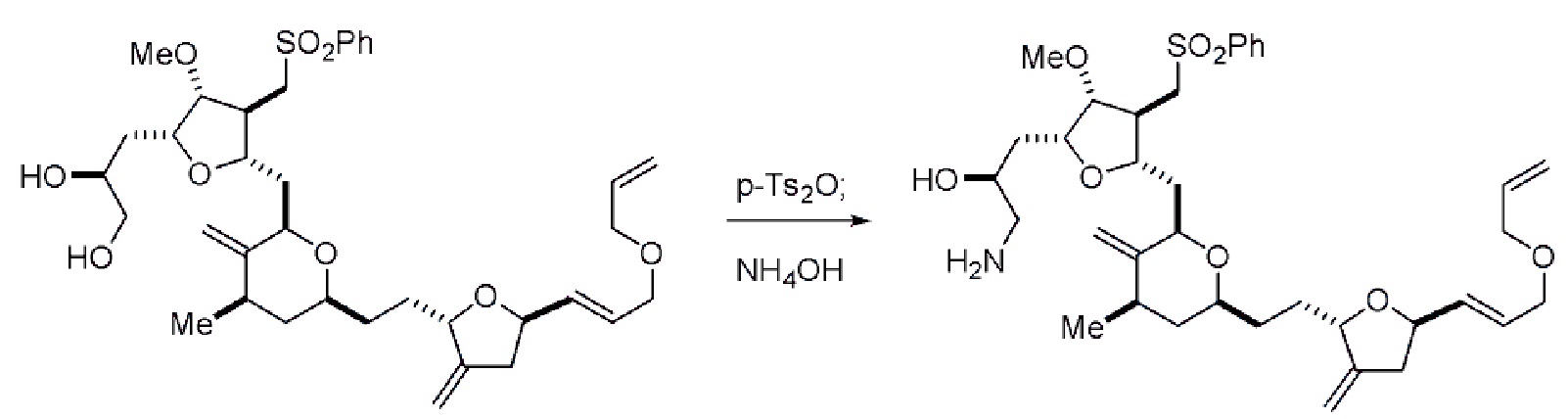
К перемешиваемому раствору (S)-3-((2R,3R,4S,5S)-5-(((2R,4R,6S)-6-(2-((2S,5R)-5-((E)-3-(аллилокси)проп-1-ен-1-ил)-3-метилентетрагидрофуран-2-ил)этил)-4-метил-3-метилен-тетрагидро-2H-пиран-2-ил)метил)-3-метокси-4-((фенилсульфонил)метил)тетрагидрофуран-2-ил)пропан-1,2-диола (1,05 г, 1,59 ммоль) в хлористом метилене (30 мл) добавляли 2,4,6-коллидин (0,84 мл, 6,35 ммоль) и пиридин (7 мкл, 0,08 ммоль). Полученную в результате смесь охлаждали до -10°C, и добавляли Ts2O (1,1 г, 1,75 ммоль) двумя порциями. Реакцию перемешивали в течение 3 часов при температуре между -10 и -5°C и при 0°C в течение 2 часов. Затем, реакцию нагревали до комнатной температуры, и добавляли изопропанол (75 мл) и гидроксид аммония (85 мл). После выдерживания в течение 16 часов при комнатной температуре, добавляли дополнительный гидроксид аммония (20 мл), и перемешивание продолжали в течение 6 часов при температуре 26-30°C. После удаления органических растворителей при пониженном давлении, остаток экстрагировали хлористым метиленом (3x 40 мл). Объединенные органические слои промывали соляным раствором и сушили над MgSO4. Удаление растворителя и хроматография на силикагеле остатка гексаном/этилацетатом (2:1-чистый этилацетат) в качестве элюента, давали требуемый продукт в виде пены. Поскольку продукт был загрязнен небольшим количеством 2,4,6-коллидина, его дополнительно очищали высаживанием продукта из циклогексана или н-гептана (740 мг, 70,6%). 1H ЯМР (400 МГц, CDCl3) δ ppm 0,95-1,11 (м, 3 H) 1,22-1,37 (м, 2 H) 1,46-1,50 (м, 2 H) 1,78-1,84 (м, 3 H) 2,04-2,19 (м, 3 H) 2,26-2,37 (м, 2 H) 2,50-2,59 (м, 2 H) 2,63-2,90 (м, 2 H) 2,92-3,04 (м, 2 H) 3,12-3,22 (м, 1 H) 3,26 (с, 3 H) 3,36-3,39 (м, 2 H) 3,44-3,49 (м, 1 H) 3,54-3,56 (м, 1 H) 3,60-3,68 (м, 1 H) 3,78-3,94 (м, 4 H), 4,03-4,06 (м, 1 H) 4,07-4,19 (м, 1 H) 4,36-4,38 (м, 1 H), 4,58-4,86 (м, 4 H) 5,08-5,16 (м, 2 H) 5,63-5,68 (м, 2 H) 5,66-5,83 (м, 1H) 7,48-7,62 (м, 3 H) 7,84-7,89 (м, 2 H).
трет-бутил ((S)-3-((2R,3R,4S,5S)-5-(((2R,4R,6S)-6-(2-((2S,5R)-5-((E)-3-(аллилокси)проп-1-ен-1-ил)-3-метилентетрагидрофуран-2-ил)этил)-4-метил-3-метилентетрагидро-2H-пиран-2-ил)метил)-3-метокси-4-((фенилсульфонил)метил)тетрагидрофуран-2-ил)-2-гидроксипропил)карбамат
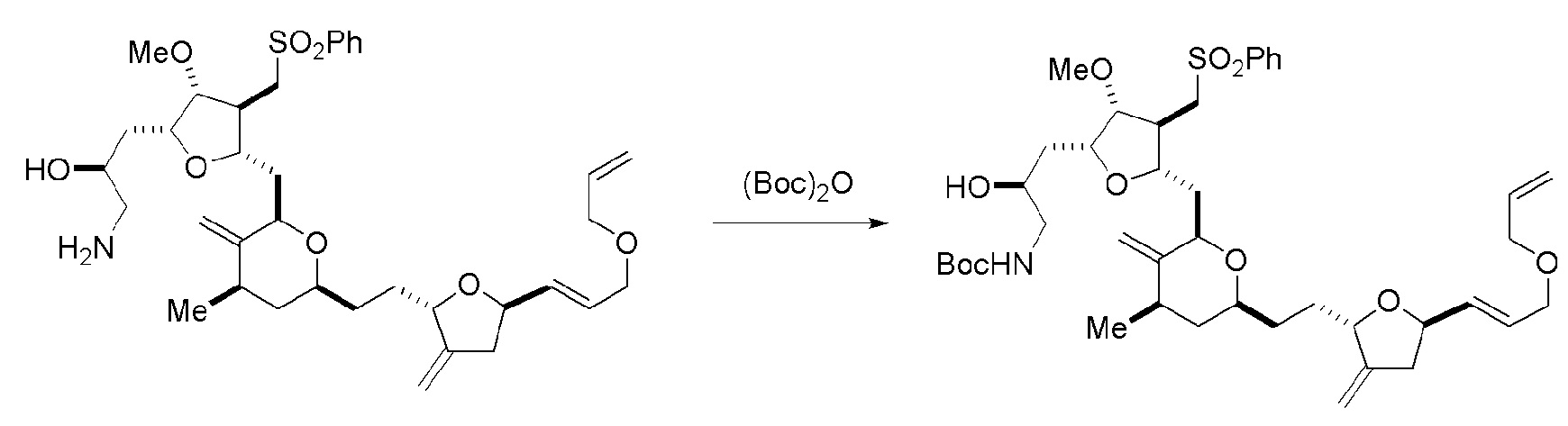
К перемешиваемому раствору (S)-1-((2R,3R,4S,5S)-5-(((2R,4R,6S)-6-(2-((2S,5R)-5-((E)-3-(аллилокси)проп-1-ен-1-ил)-3-метилентетрагидрофуран-2-ил)этил)-4-метил-3-метилентетрагидро-2H-пиран-2-ил)метил)-3-метокси-4-((фенилсульфонил)метил)тетрагидрофуран-2-ил)-3-аминопропан-2-ола (0,7 г, 1,06 ммоль) и триэтиламина (0,22 мл, 1,6 ммоль) в хлористом метилене (20 мл) добавляли ди-трет-бутилдикарбонат (290 мг, 1,34 ммоль) при комнатной температуре. Смесь выдерживали в течение 14 часов при комнатной температуре в атмосфере азота с отверстием для высвобождения CO2. После гашения водным насыщенным хлоридом аммония (15 мл), фазы разделяли. Водный слой экстрагировали хлористым метиленом (15 мл), и объединенные органические слои промывали соляным раствором и концентрировали досуха. Полученный в результате неочищенный продукт очищали колоночной хроматографией на силикагеле, применяя гексан-этилацетат (3:1-1:1), получая продукт в виде масла (0,6 г, 74%). 1H ЯМР (400 МГц, CDCl3) δ ppm 1,15-1,25 (м, 7 H) 1,30-1,42 (м, 2 H) 1,37 (уш с, 9 H) 1,43-1,56 (м, 3 H) 1,67-1,72 (м, 2 H) 1,81-1,93 (м, 2 H) 2,09-2,19 (м, 2 H) 2,27-2,33 (м, 1 H) 2,40-2,50 (м, 1 H) 2,51-2,59 (м, 1 H) 2,61-2,65 (м, 1 H) 3,00-3,10 (м, 2 H) 3,20-3,30 (м, 1 H) 3,33-3,39 (м, 1 H) 3,36 (с, 3 H) 3,51-3,53 (м, 1 H) 3,65-3,74 (м, 1 H) 3,79-3,86 (м, 2 H) 3,90-3,91 (м, 3 H) 4,24-4,34 (м, 1 H) 4,36-4,38 (м, 1 H) 4,62 (д, J=1,9 Hz 1 H) 4,72 (уш с, 1 H) 4,77 (уш с, 1 H) 4,85 (д, J=1,9 Гц, 1 H) 4,93 (уш с, 1 H) 5,12 (дд, J=10,5, 1,5 Гц, 1 H), 5,18-5,23 (м, 1 H) 5,65-5,72 (м, 2 H) 5,80-5,87 (м, 1 H) 7,52-7,56 (м, 2 H) 7,61-7,65 (м, 1 H) 7,845-7,89 (м, 2 H).
(S)-трет-бутил 5-(((2R,3R,4S,5S)-5-(((2R,4R,6S)-6-(2-((2S,5R)-5-((E)-3-(аллилокси)проп-1-ен-1-ил)-3-метилентетрагидрофуран-2-ил)этил)-4-метил-3-метилентетрагидро-2H-пиран-2-ил)метил)-3-метокси-4-((фенилсульфонил)метил)тетрагидрофуран-2-ил)метил)-2,2-диметилоксазолидин-3-карбоксилат
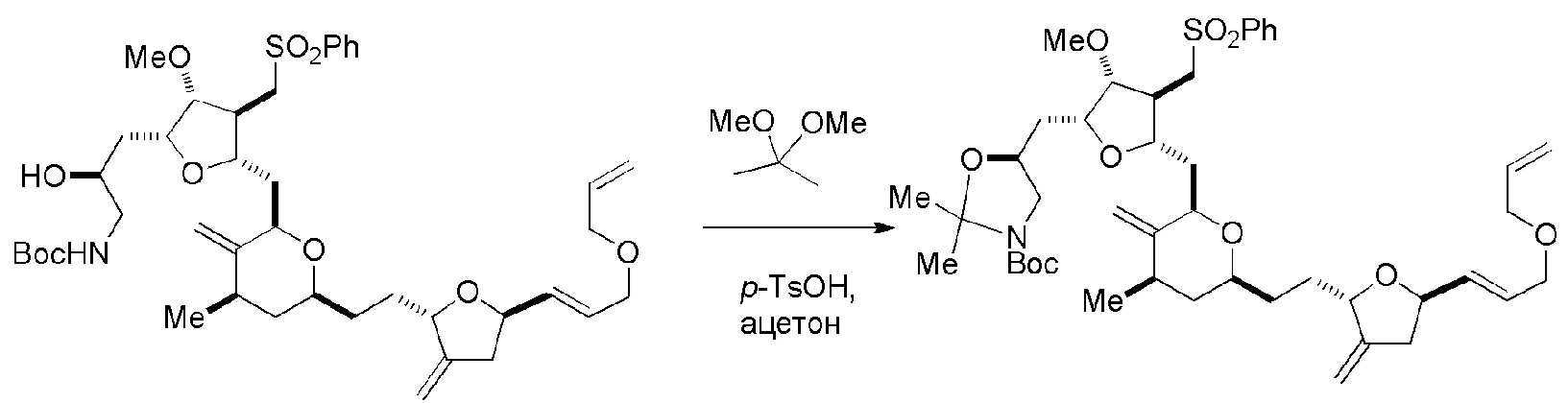
К перемешиваемому раствору трет-бутил ((S)-3-((2R,3R,4S,5S)-5-(((2R,4R,6S)-6-(2-((2S,5R)-5-((E)-3-(аллилокси)проп-1-ен-1-ил)-3-метилентетрагидрофуран-2-ил)этил)-4-метил-3-метилен-тетрагидро-2H-пиран-2-ил)метил)-3-метокси-4-((фенилсульфонил)метил)тетрагидрофуран-2-ил)-2-гидроксипропил)карбамата (0,50 г, 0,66 ммоль) в ацетоне (10 мл) добавляли 2,2-диметоксипропан (1,0 мл, 8,16 ммоль) и моногидрат п-толуолсульфокислоты (15 мг, 0,08 ммоль). Реакционную смесь перемешивали в течение 1,5 часов при комнатной температуре. После добавления бикарбоната натрия (200 мг), реакцию перемешивали в течение дополнительных 10 минут. После разбавления этилацетатом (40 мл) и насыщенным водным NaHCO3 (20 мл), полученную в результате смесь распределяли между фазами. Органический слой экстрагировали этилацетатом (25 мл). Объединенные органические слои промывали соляным раствором и концентрировали досуха. Полученную в результате неочищенный продукт дополнительно очищали колоночной хроматографией на силикагеле, применяя градиент 4:1-2:1 гептана/этилацетата в качестве элюента, получая 400 мг требуемого продукта в виде масла (76%). 1H ЯМР (400 МГц, CDCl3) δ ppm 1,15-1,29 (м, 4 H) 1,3-1,5 (м, 4 H), 1,40 (уш с 9H) 1,49 (с, 6 H) 1,66-1,69 (м, 1 H) 1,78-1,83 (м, 1 H) 1,89-1,98 (м, 1 H) 2,03-2,12 (м, 3 H) 2,27-2,32 (м, 1 H) 2,51-2,59 (м, 1 H) 2,61-2,64 (м, 1 H) 2,97 -3,08 (м, 3 H) 3,20 -3,33 (м, 1 H) 3,37 (с, 3 H) 3,46-3,53 (м, 1 H) 3,61-3,67 (м, 3 H) 3,80-3,91 (м, 4 H) 4,07-4,11 (м, 1 H) 4,20-4,25 (м, 1 H) 4,34 -4,37 (м, 1 H) 4,65 (д, d=2,0 Гц, 1 H) 4,71 (уш с, 1 H) 4,78 (уш с, 1 H) 4,84 (d J=2,0 Гц, 1 H) 5,10-5,23 (м, 2 H) 5,61-5,72 (м, 2 H) 5,80-5,87 (м, 1 H) 7,53-7,57 (м, 2 H) 7,61-7,65 (м, 1 H) 7,89- 7,90 (м, 2 H).
1-((5S)-5-(((2R,3R,4S,5S)-5-(((2R,4R,6S)-6-(2-((2S,5R)-5-((E)-3-(аллилокси)проп-1-ен-1-ил)-3-метилентетрагидрофуран-2-ил)этил)-4-метил-3-метилентетрагидро-2H-пиран-2-ил)метил)-4-((1S)-3-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)окси)-2-(2-((триэтилсилил)окси)бут-3-ен-1-ил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)-2-гидрокси-1-(фенилсульфонил)пропил)-3-метокситетрагидрофуран-2-ил)метил)-2,2-диметилоксазолидин-3-ил)-2,2-диметилпропан-1-он
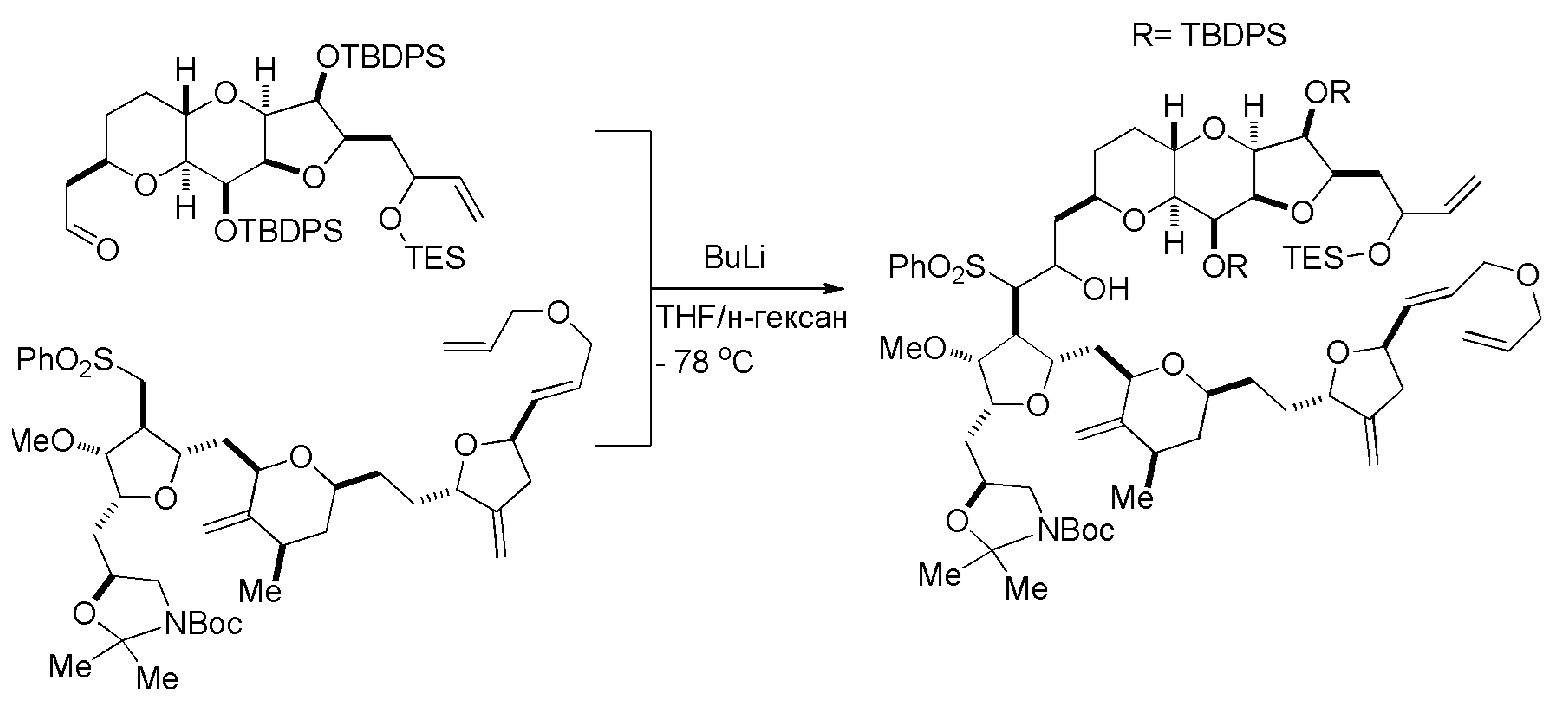
2-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)окси)-2-(2-((триэтилсилил)окси)бут-3-ен-1-ил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)ацетальдегид (100 мг, 0,109 ммоль) растворяли в THF (1,0 мл) и охлаждали до 0 oC. Добавляли н-бутиллитий (1,6 M, 0,109 мл, 0,174 ммоль), и полученный в результате раствор перемешивали при 0°C в течение 30 минут, и затем охлаждали до -78°C. Добавляли раствор 1-((S)-5-(((2R,3R,4S,5S)-5-(((2R,4R,6S)-6-(2-((2S,5R)-5-((E)-3-(аллилокси)проп-1-ен-1-ил)-3-метилентетрагидрофуран-2-ил)этил)-4-метил-3-метилентетрагидро-2H-пиран-2-ил)метил)-3-метокси-4-((фенилсульфонил)метил)тетрагидрофуран-2-ил)метил)-2,2-диметилоксазолидин-3-ил)-2,2-диметилпропан-1-она (0,128 г, 0,163 ммоль) в н-гептане (2,0 мл), и реакционную смесь перемешивали при -78°C в течение 1 часа. Добавляли насыщенный водный NH4Cl (27% по массе) (4,0 мл), воду (1,3 мл) и MTBE (10,5 мл), и полученную в результате смесь нагревали до температуры окружающей среды. Органический слой отделяли, промывали 30% водным NaCl (2,6 мл) и сушили над MgSO4. Фильтрование, концентрирование в вакууме и очистка колоночной хроматографией на силикагеле, применяя 20-66% градиент этилацетата в н-гептане в качестве элюента, давали 142 мг целевого продукта.
(5S)-трет-бутил 5-(((2R,3R,4S,5S)-5-(((2R,4R,6S)-6-(2-((2S,5R)-5-((E)-3-(аллилокси)проп-1-ен-1-ил)-3-метилентетрагидрофуран-2-ил)этил)-4-метил-3-метилентетрагидро-2H-пиран-2-ил)метил)-4-((1S)-3-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)окси)-2-(2-((триэтилсилил)окси)бут-3-ен-1-ил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)-2-оксо-1-(фенилсульфонил)пропил)-3-метокситетрагидрофуран-2-ил)метил)-2,2-диметилоксазолидин-3-карбоксилат
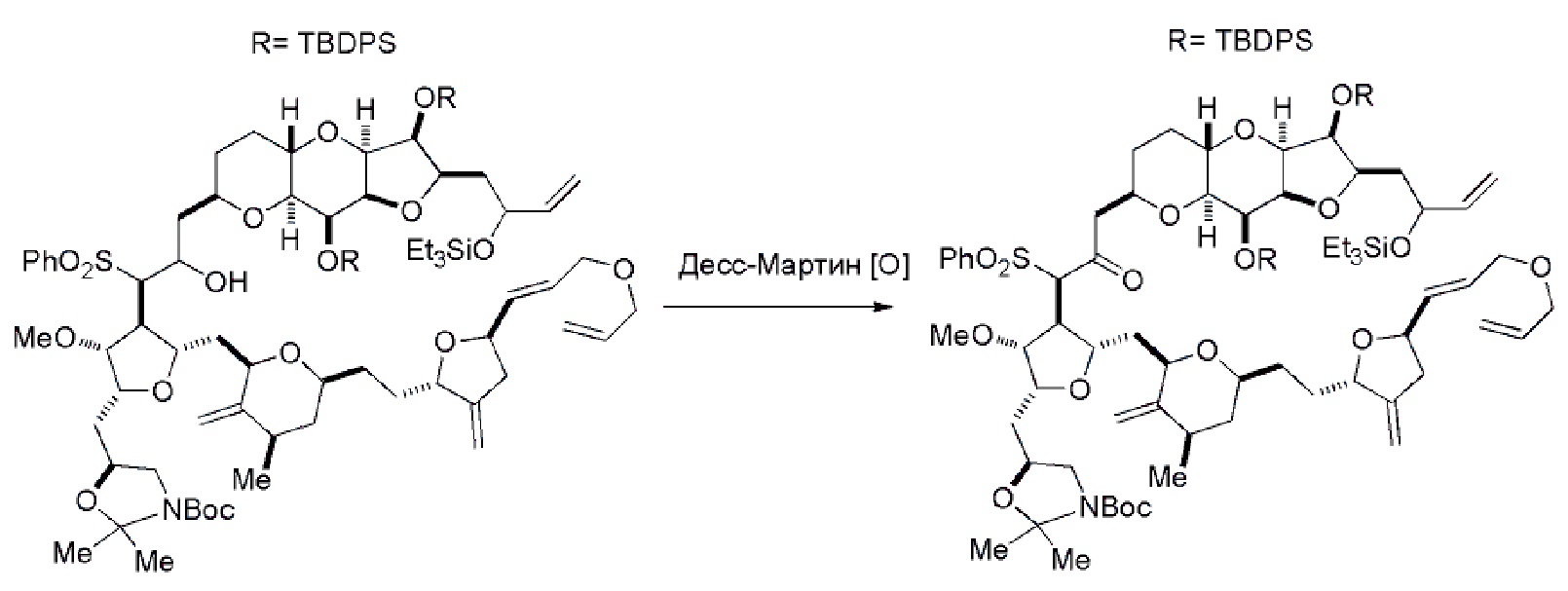
(5S)-трет-бутил 5-(((2R,3R,4S,5S)-5-(((2R,4R,6S)-6-(2-((2S,5R)-5-((E)-3-(аллилокси)проп-1-ен-1-ил)-3-метилентетрагидрофуран-2-ил)этил)-4-метил-3-метилентетрагидро-2H-пиран-2-ил)метил)-4-((1S)-3-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)окси)-2-(2-((триэтилсилил)окси)бут-3-ен-1-ил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)-2-гидрокси-1-(фенилсульфонил)пропил)-3-метокситетрагидрофуран-2-ил)метил)-2,2-диметилоксазолидин-3-карбоксилат (0,142 г,,083 ммоль) растворяли в дихлорметане (5,0 мл) при температуре окружающей среды. Добавляли бикарбонат натрия (35 мг, 0,41 ммоль) и периодинан Десс-Мартина (105 мг, 0,248 ммоль), и полученную в результате смесь перемешивали при температуре окружающей среды в течение ночи. Добавляли MTBE (14,2 мл), воду (7,1 мл) и тиосульфат натрия (131 мг, 0,83 ммоль). После перемешивания при температуре окружающей среды в течение 1 часа, слои разделяли. Органический слой промывали насыщенным водным NaHCO3 (8%) (2,84 мл), 30% водным NaCl (2,8 мл) и сушили над MgSO4. Фильтрование, концентрирование и фильтрование через слой силикагеля, который затем промывали 33% этилацетатом в н-гептане, давали 120 мг целевого продукта в виде бесцветной пленки.
(5S)-трет-бутил 5-(((2R,3R,4S,5S)-5-(((2R,4R,6S)-6-(2-((2S,5R)-5-((E)-3-(аллилокси)проп-1-ен-1-ил)-3-метилентетрагидрофуран-2-ил)этил)-4-метил-3-метилентетрагидро-2H-пиран-2-ил)метил)-4-(3-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)окси)-2-(2-((триэтилсилил)окси)бут-3-ен-1-ил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)-2-оксопропил)-3-метокситетрагидрофуран-2-ил)метил)-2,2-диметилоксазолидин-3-карбоксилат
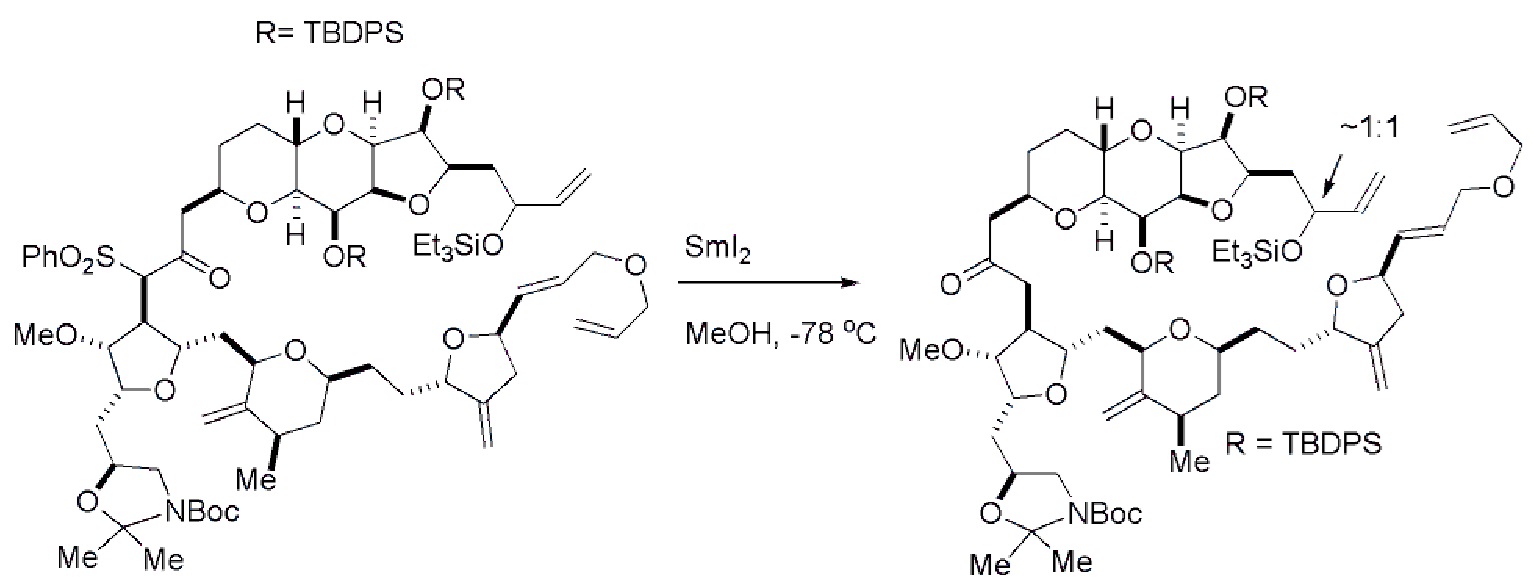
(5S)-трет-бутил 5-(((2R,3R,4S,5S)-5-(((2R,4R,6S)-6-(2-((2S,5R)-5-((E)-3-(аллилокси)проп-1-ен-1-ил)-3-метилентетрагидрофуран-2-ил)этил)-4-метил-3-метилентетрагидро-2H-пиран-2-ил)метил)-4-((1S)-3-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)окси)-2-(2-((триэтилсилил)окси)бут-3-ен-1-ил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)-2-оксо-1-(фенилсульфонил)пропил)-3-метокситетрагидрофуран-2-ил)метил)-2,2-диметилоксазолидин-3-карбоксилат (0,120 г, 0,07 ммоль) растворяли в THF (1,9 мл) и MeOH (1,2 мл). Полученный в результате раствор охлаждали до -78°C и обрабатывали 0,1M дийодидом самария (2,1 мл, 0,21 ммоль) в течение 30 минут. Добавляли дополнительный 0,1M дийодид самария (2,1 мл, 0,21 ммоль), и полученную в результате смесь перемешивали в течение 30 минут при -78°C. Реакцию гасили насыщенным раствором сегнетовой соли (8 мл). Добавляли воду (4 мл) и MTBE (7,2 мл), и полученную в результате смесь нагревали до температуры окружающей среды. Слои разделяли, и водный слой экстрагировали MTBE (7,2 мл). Объединенные органические слои промывали 30% водным NaCl (2,4 мл) и сушили над MgSO4. Фильтрование, концентрирование и очистка колоночной хроматографией на силикагеле, применяя 20-50% градиент этилацетата в н-гептане в качестве элюента, давали 74 мг целевого продукта в виде белой пены. 1H ЯМР (1:1 диастереомерная смесь, 400 МГц, CDCl3) δ ppm 0,45-0,65 (м, 6 H) 0,82-1,00 (м, 9 H) 1,03 (д, J=7,0 Гц, 1,5 H) 1,04 (д, J=7,0 Гц, 1,5 H) 1,06-1,17 (м, 18 H) 1,27-1,82 (м, 14 H) 1,47 (уш.с, 12 H) 1,85-2,47 (м, 10 H) 2,67-2,77 (м, 1 H) 2,95-3,07 (м, 1 H) 3,08-3,18 (м, 1 H) 3,23 (уш.с, 1 H) 3,29 (с, 1,5 H) 3,31 (с, 1,5 H) 3,36-3,82 (м, 10 H) 3,87 (т, J=6,3 Гц, 0,5 H) 3,96 (д, J=5,5 Гц, 4 H) 3,99-4,25 (м, 5 H) 4,33 (дд, J=6,3, 3,1 Гц, 1 H) 4,41 (уш.с, 1 H) 4,44-4,52 (м, 1 H) 4,73-4,82 (м, 2 H) 4,83 (с, 1 H) 4,91-5,15 (м, 2 H) 4,97 (д, J=2,0 Гц, 1 H) 5,16 (уш.с, 0,5 H) 5,18 (с, 0,5 H) 5,24 (д, J=1,6 Гц, 0,5 H) 5,28 (д, J=1,6 Гц, 0,5 H) 5,61-5,81 (м, 3 H) 5,84-5,97 (м, 1 H) 7,27-7,43 (м, 12 H) 7,62-7,81 (м, 8 H)
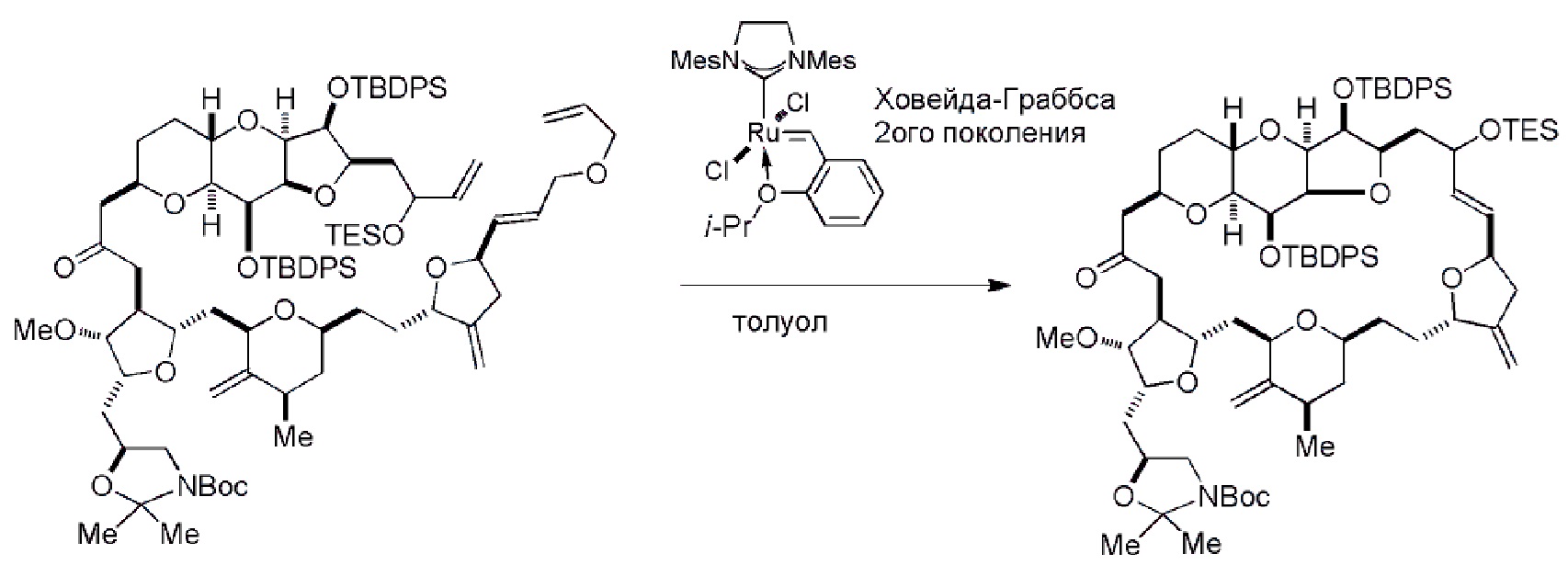
К раствору катализатора Ховейда-Граббса 2ого поколения (11,8 мг, 0,019 ммоль) в толуоле (50 мл) при 70°C добавляли раствор (5S)-трет-бутил 5-(((2R,3R,4S,5S)-5-(((2R,4R,6S)-6-(2-((2S,5R)-5-((E)-3-(аллилокси)проп-1-ен-1-ил)-3-метилентетрагидрофуран-2-ил)этил)-4-метил-3-метилентетрагидро-2H-пиран-2-ил)метил)-4-(3-((2R,3S,3aR,4aS,7R,8aS,9S,9aR)-3,9-бис((трет-бутилдифенилсилил)окси)-2-(2-((триэтилсилил)окси)бут-3-ен-1-ил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-7-ил)-2-оксопропил)-3-метокситетрагидрофуран-2-ил)метил)-2,2-диметилоксазолидин-3-карбоксилата (74 мг, 0,047 ммоль) в толуоле (10 мл) в течение 4 часов. После перемешивания при 80°C в течение 10 часов, реакционную смесь охлаждали до температуры окружающей среды и концентрировали в вакууме. Колоночная хроматография на силикагеле остатка, применяя 10-33% градиент этилацетата в н-гептане в качестве элюента, давала 35 мг целевого продукта. 1H ЯМР (1,4;1 диастереомерная смесь, 400 МГц, CDCl3) δ ppm 0,45-0,66 (м, 6 H) 0,83-0,96 (м, 9 H) 0,99-1,16 (м, 21 H) 1,27-3,03 (м, 31 H) 1,47 (уш.с, 9 H) 3,10-3,20 (м, 1 H) 3,28-3,91 (м, 12 H) 3,35 (с, 3 H(больший)) 3,40 (с, 3 H(меньший)) 3,99-4,09 (м, 1 H) 4,11-4,17 (м, 1 H) 4,29-4,38 (м, 1 H) 4,41-4,49 (м, 1 H) 4,56-4,70 (м, 1 H) 4,77-4,82 (м, 1 H) 4,85 (уш.с, 1 H) 4,89-4,93 (м, 1 H) 4,97-5,01 (м, 1 H) 5,51 (дд, J=15,4, 7,6 Гц, 1 H(меньший)) 5,81 (ддд, J=15,4, 7,8, 1,4 Гц, 1 H(больший)) 6,33 (д, J=15,6 Гц, 1 H(больший)) 6,58 (дд, J=15,4, 9,2 Гц, 1 H(меньший)) 7,27-7,45 (м, 12 H) 7,58-7,79 (м, 8 H)
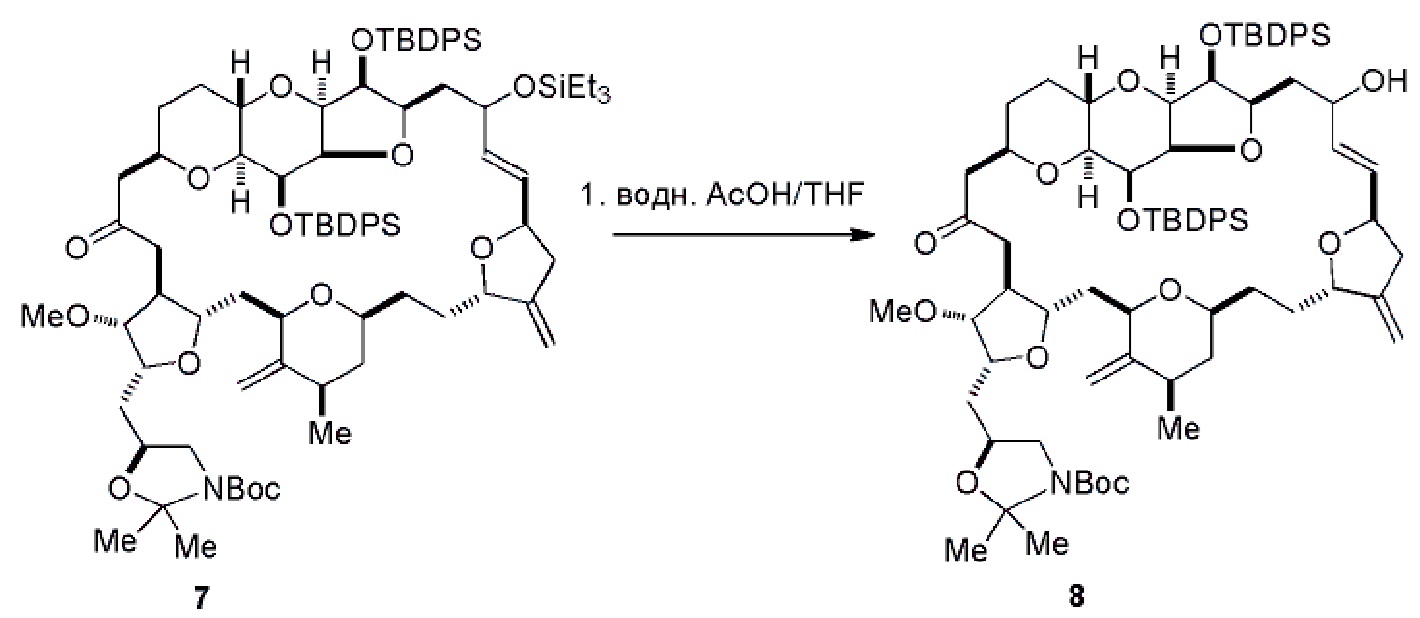
Соединение 7 (35 мг, 24 мкмоль) растворяли в THF (3,9 мл) при температуре окружающей среды. К раствору добавляли уксусную кислоту (1,8 мл) и воду (1,1 мл). После перемешивания в течение 3,5 часов при температуре окружающей среды, полученную в результате смесь концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле, применяя 20-50% градиент этилацетата в н-гептане в качестве элюента, получая 32 мг соединения 8.
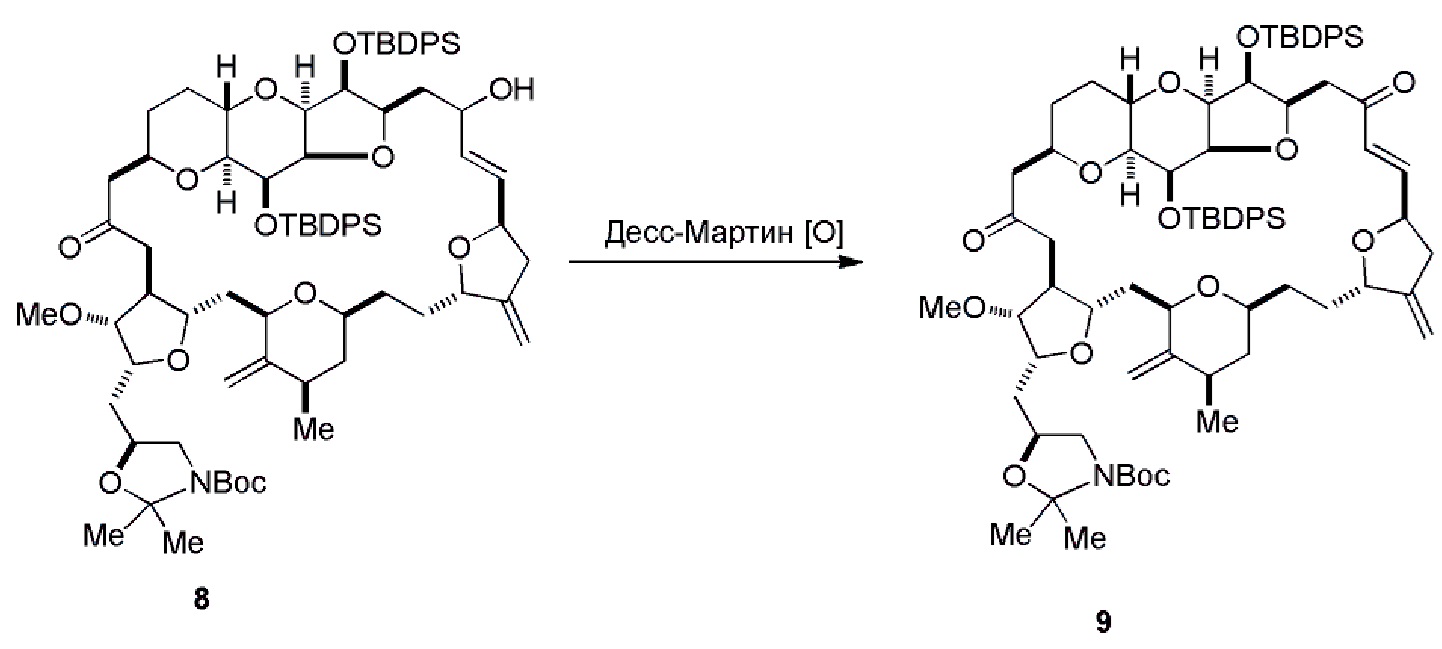
Соединение 8 (32 мг, 23 мкмоль) растворяли в дихлорметане (1,9 мл) при температуре окружающей среды. Добавляли бикарбонат натрия (11,8 мг, 0,141 ммоль) и периодинан Десс-Мартина (30 мг, 0,070 ммоль), и полученную в результате смесь перемешивали при температуре окружающей среды в течение 5 часов. Добавляли MTBE (10 мл), воду (5 мл), насыщенный водный NaHCO3 (8%) (2,0 мл) и тиосульфат натрия (56 мг, 0,35 ммоль). Полученную в результате смесь перемешивали при температуре окружающей среды в течение 30 минут. Органический слой отделяли, промывали 30% водным NaCl (2 мл) и сушили над MgSO4. Фильтрование, с последующим концентрированием в вакууме и очисткой колоночной хроматографией на силикагеле, применяя 20-50% градиент этилацетата в н-гептане в качестве элюента, давали 17 мг соединения 9 в виде бесцветной пленки. 1H ЯМР (400 МГц, CDCl3) δ ppm 0,98 (с, 9 H) 1,04-1,10 (м, 12 H) 1,26 (уш.с, 3 H) 1,29-1,84 (м, 8 H) 1,47 (уш.с, 9H) 1,55 (с, 3 H) 1,90-1,98 (м, 2 H) 2,03-2,11 (м, 3 H) 2,13-2,24 (м, 2 H) 2,46-2,56 (м, 3 H) 2,61 (дд, J=16,0, 7,4 Гц, 2 H) 2,74-2,83 (дд, J=16,2, 5,7 Гц, 2 H) 3,06-3,21 (м, 2 H) 3,25-3,33 (м, 1 H) 3,37 (д, J=3,9 Гц, 1 H) 3,38 (с, 3 H) 3,44-3,52 (м, 1 H) 3,63-3,93 (м, 8 H) 4,06 (дд, J=8,4, 3,7 Гц, 1 H) 4,12-4,21 (м, 1 H) 4,35 (т, J=6,4 Гц, 1 H) 4,46-4,54 (м, 1 H) 4,70 (кв, J=6,8 Гц, 1 H) 4,79 (с, 1 H) 4,87-4,95 (м, 2 H) 5,03 (д, J=2,0 Гц, 1 H) 6,58 (дд, J=16,0, 7,8 Гц, 1 H) 6,79 (дд, J=16,0, 5,5 Гц, 1 H) 7,28-7,44 (м, 12 H) 7,56-7,70 (м, 8 H)
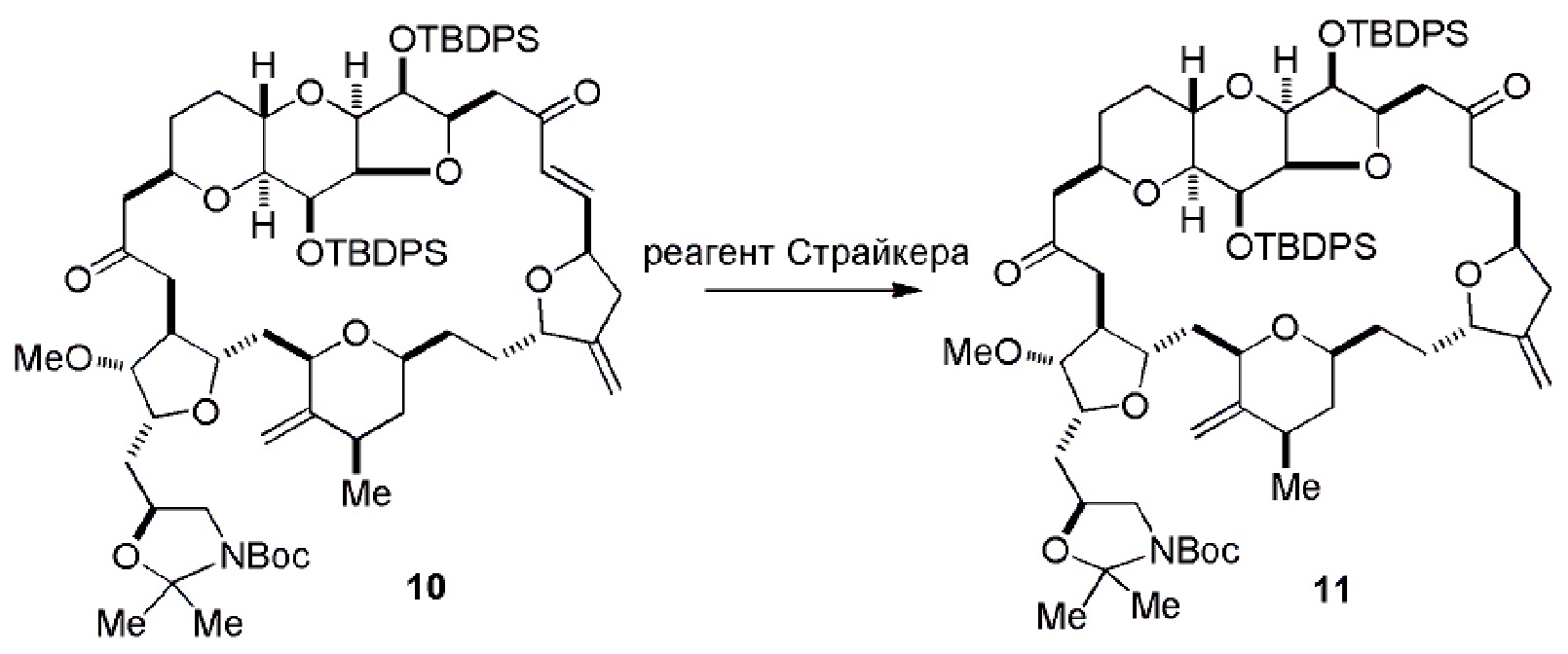
Соединение 10 (17 мг, 0,012 ммоль) растворяли в обескислороженном толуоле (2,6 мл) при температуре окружающей среды. Добавляли обескислороженную (продутую азотом в течение 40 минут) воду (10 мкл, 0,57 ммоль), с последующим добавлением реагента Страйкера (24,5 мг, 12 мкмоль). Через 1 час добавляли дополнительный реагент Страйкера (~20 мг). После перемешивания в течение дополнительного 1 часа, реакционную смесь обрабатывали воздухом. Образовывался осадок. Очистка колоночной хроматографией, применяя 10-50% градиент этилацетата в н-гептане в качестве элюента, давала 14,7 мг соединения 11 в виде бесцветной пленки. 1H ЯМР (400 МГц, CDCl3) δ ppm 1,00 (с, 9 H) 1,06 (д, J=6,3 Гц, 3 H) 1,08 (с, 9 H) 1,23-1,33 (м, 6 H) 1,47 (уш с, 12H), 1,50-2,00 (м, 11 H) 2,06 -2,23 (м, 4 H) 2,26-2,34 (м, 1 H) 2,46-2,54 (м, 1 H) 2,54-2,82 (м, 5 H) 2,89-3,00 (м, 1 H) 3,03-3,12 (м, 2 H) 3,13-3,20 (м, 1 H) 3,36 (д, J=3,1 Гц, 1 H) 3,41 (с, 3 H) 3,47-3,51 (м,1 H) 3,63-3,85 (м, 7 H) 3,92 (ддд, J=10,9, 7,4, 3,5 Гц, 1 H) 4,05 (дд, J=8,8, 3,3 Гц, 1 H) 4,11-4,22 (м, 2 H) 4,31-4,42 (м, 2 H) 4,79 (с, 1 H) 4,85 (с, 1 H) 4,90 (с, 1 H) 4,98 (д, J=1,6 Гц, 1 H) 7,26-7,48 (м, 12 H) 7,57-7,71 (м, 8 H)
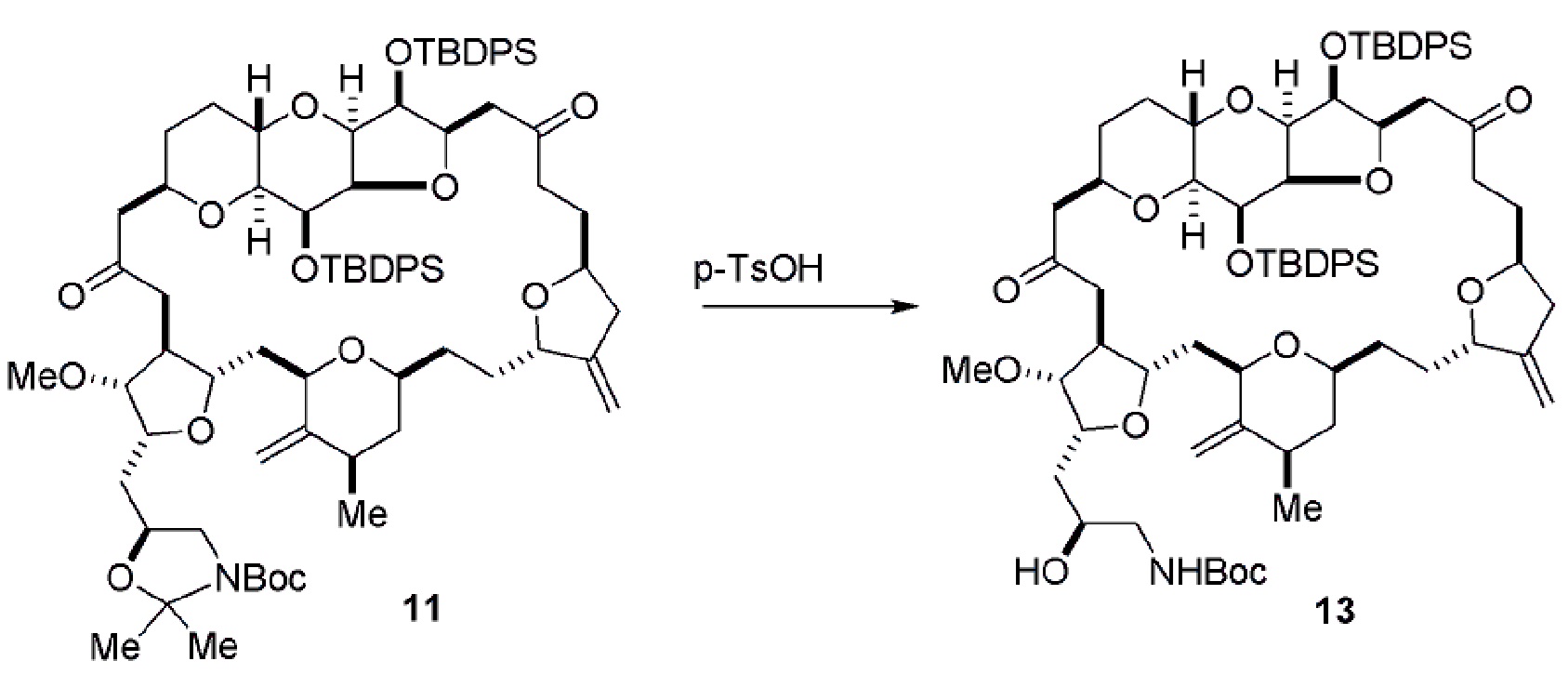
К раствору соединения 11 (14,7 мг, 10,8 мкмоль) в метаноле (1 мл) добавляли моногидрат п-толуолсульфокислоты (2,05 мг, 10,8 мкмоль) при температуре окружающей среды. Полученный в результате раствор перемешивали в течение 3 часов и обрабатывали насыщенным водным NaHCO3 (8%) (3 мл). Полученную в результате смесь экстрагировали дважды MTBE (12 мл). Объединенные органические слои промывали 30% водным NaCl (2 мл) и сушили над MgSO4. Фильтрование, с последующим концентрированием в вакууме, давали 14,7 мг соединения 13 в виде бесцветного масла.
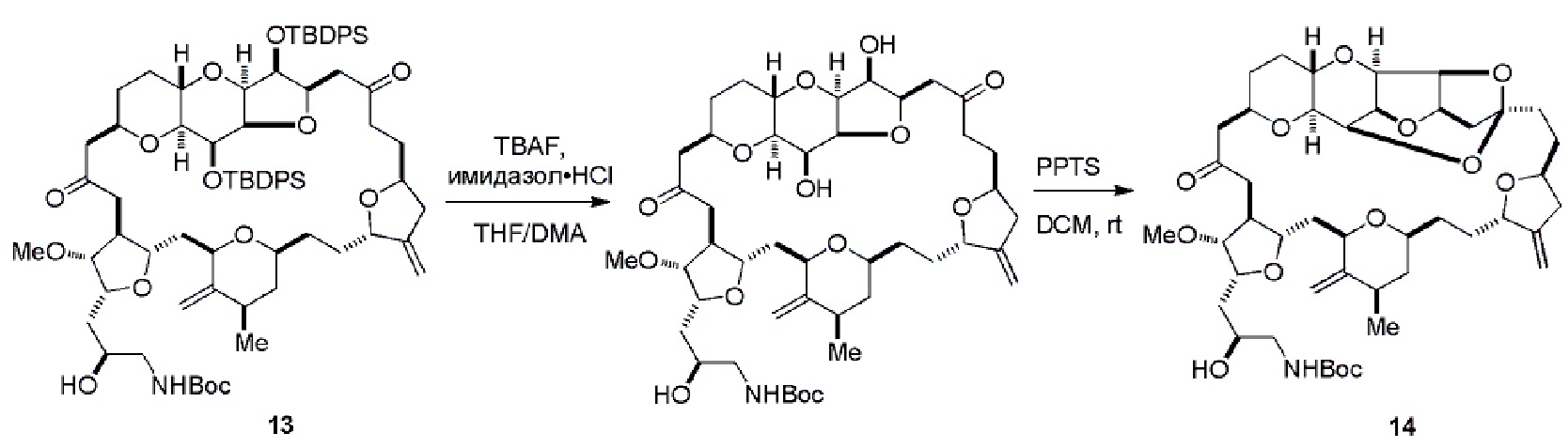
Соединение 13 (14,7 мг, 10,7 мкмоль) растворяли в THF (1,3 мл) и N,N-диметилацетамиде (0,5 мл) при температуре окружающей среды. Добавляли 1,0 M TBAF в THF (0,22 мл, 0,022 ммоль) и гидрохлорид имидазола (11,3 мг, 0,108 ммоль), и полученную в результате смесь перемешивали в течение 20 часов при температуре окружающей среды. Добавляли 30% водный NaCl (2 мл) и толуол (3 мл). Слои разделяли, и водный слой экстрагировали дважды смесью THF (3 мл) и толуола (3 мл). Объединенный органический слой концентрировали в вакууме. Остаток растворяли в дихлорметане (1,5 мл) при температуре окружающей среды, и добавляли п-толуолсульфонат пиридиния (27 мг, 0,107 ммоль). Через 3 часа, реакционную смесь очищали колоночной хроматографией на силикагеле, применяя этилацетат в качестве элюента, получая 6,5 мг соединения 14 в виде белой пены. 1H ЯМР (400 МГц, CDCl3) δ ppm 1,10 (д, J=6,6 Гц, 3 H) 1,28-1,79 (м, 11H) 1,44 (с, 9 H) 1,89-2,51 (м, 15 H) 2,71 (дд, J=16,0, 10,2 Гц, 1 H) 2,85 (дд, J=6,6, 2,0 Гц, 1 H) 2,89 (дд, J=7,4, 2,3 Гц, 1 H) 3,08-3,17 (м, 1 H) 3,26 (д, J=3,1 Гц, 1 H) 3,42 (с, 3 H) 3,55 (уш.с, 1 H) 3,58-3,66 (м, 2 H) 3,81 (дт, J=9,4, 3,3 Гц, 1 H) 3,87-3,99 (м, 3 H) 4,03 (дд, J=6,3, 4,3 Гц, 1 H) 4,09-4,16 (м, 1 H) 4,19 (дд, J=6,4, 4,5 Гц, 1 H) 4,29 (дд, J=10,6, 4,3 Гц, 1 H) 4,31-4,38 (м, 2 H) 4,60 (т, J=4,5 Гц, 1 H) 4,69 (т, J=4,7 Гц, 1 H) 4,81 (д, J=1,2 Гц, 1 H) 4,89 (с, 1 H) 4,93 (уш с, 1 H) 4,98-5,05 (м, 1 H) 5,07 (д, J=2,0 Гц, 1 H)
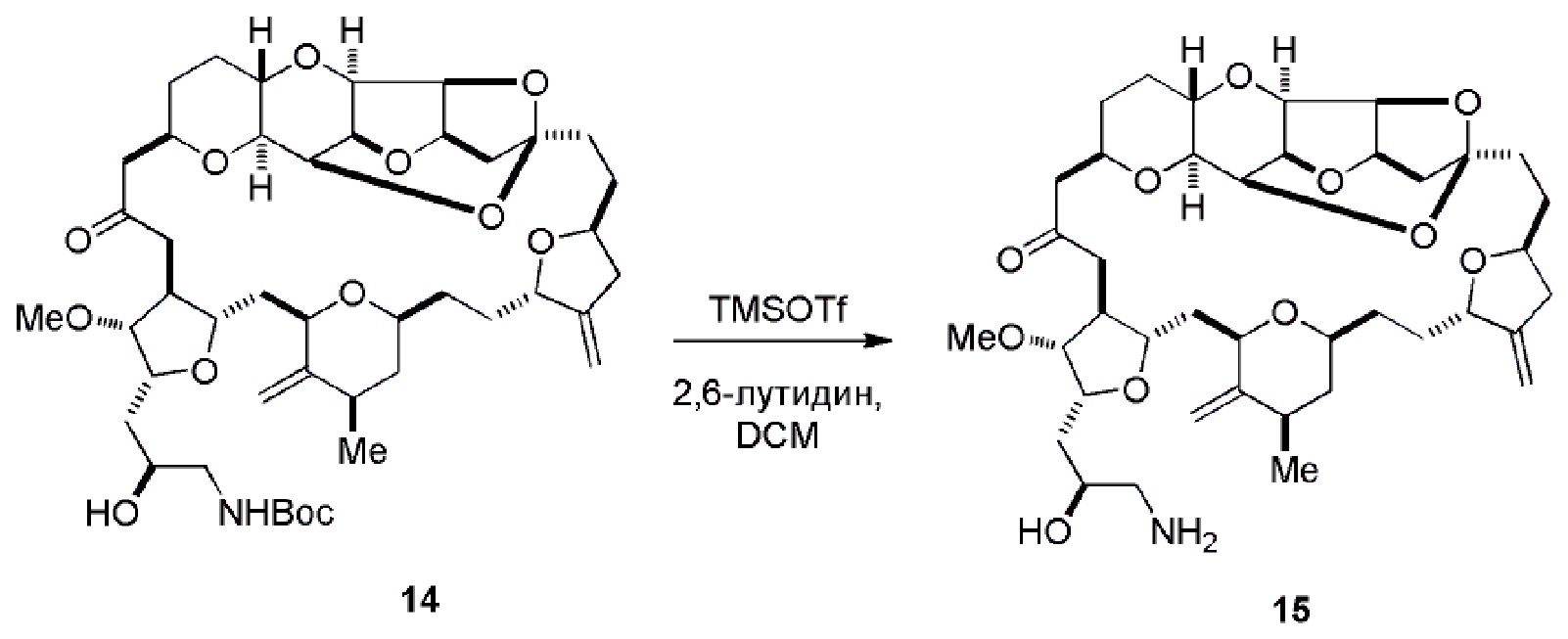
К раствору соединения 14 (3,2 мг, 3,9 мкмоль) в дихлорметане (0,5 мл) при 0°C добавляли 2,6-лутидин (4,9 мкл, 0,042 ммоль) и добавляли триметилсилилтрифторметансульфонат (5,9 мкл, 0,033 ммоль), и полученный в результате раствор нагревали до температуры окружающей среды. Через 1 час и 3 часа, добавляли каждый раз дополнительный 2,6-лутидин (5 мкл) и триметилсилилтрифторметансульфонат (6 мкл). После дополнительных 1,5 часов перемешивания, реакцию гасили водой (3 мл). Полученную в результате смесь экстрагировали дважды дихлорметаном (5 мл каждый раз). Объединенные органические слои сушили над MgSO4, фильтровали и концентрировали в вакууме. Остаток растворяли в метаноле (0,5 мл) и добавляли карбонат калия (1 мг, 7 мкмоль) при температуре окружающей среды. Полученную в результате смесь перемешивали в течение ночи, и затем концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле, применяя этилацетат, DCM/метанол (9/1) и DCM/метанол/NH4OH (9/1/0,1) в качестве элюента, получая 1,6 мг соединение 15. Структуру подтверждали сравнением 1H ЯМР спектра с описанным в литературе спектром.
1H ЯМР (400 МГц, CD3OD) δ ppm 0,97-1,07 (м, 1 H) 1,11 (д, J=6,3 Гц, 3 H) 1,30-1,62 (м, 6 H) 1,67-2,26 (м, 13 H) 2,27-2,42 (м, 3 H) 2,42-2,51 (м, 2 H) 2,62-2,78 (м, 2 H) 2,83-2,96 (м, 3 H) 3,04 (дд, J=12,7, 3,3 Гц, 1 H) 3,37 (д, J=3,1 Гц, 1 H) 3,43 (с, 3 H) 3,74 (д, J=11,7 Гц, 1 H) 3,82-4,02 (м, 5 H) 4,08-4,14 (м, 2 H) 4,18 (дд, J=4,7, 6,6 Гц, 1 H) 4,26-4,35 (м, 2 H) 4,48 (д, J=10,9 Гц, 1 H) 4,62 (т, J=4,3 Гц, 1 H) 4,71 (т, J=4,3 Гц, 1 H) 4,82-4,84 (м, 1 H) 4,86-4,87 (м, 1 H) 5,02 (уш с, 1 H) 5,14 (д, J=1,6 Гц, 1 H)
Пример 4: Получение соединения формулы (ID) через C.3-C.4 макроциклизацию
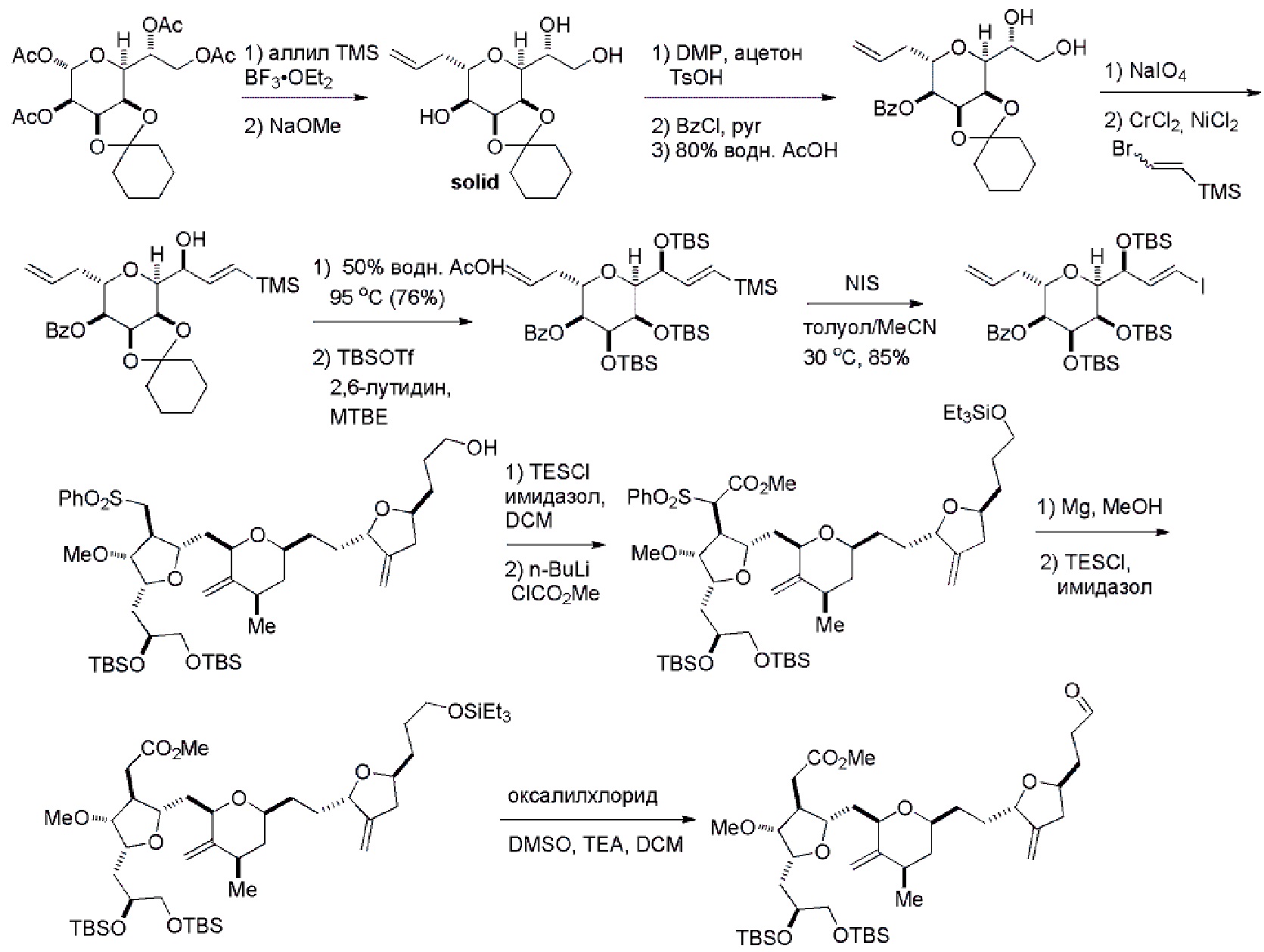
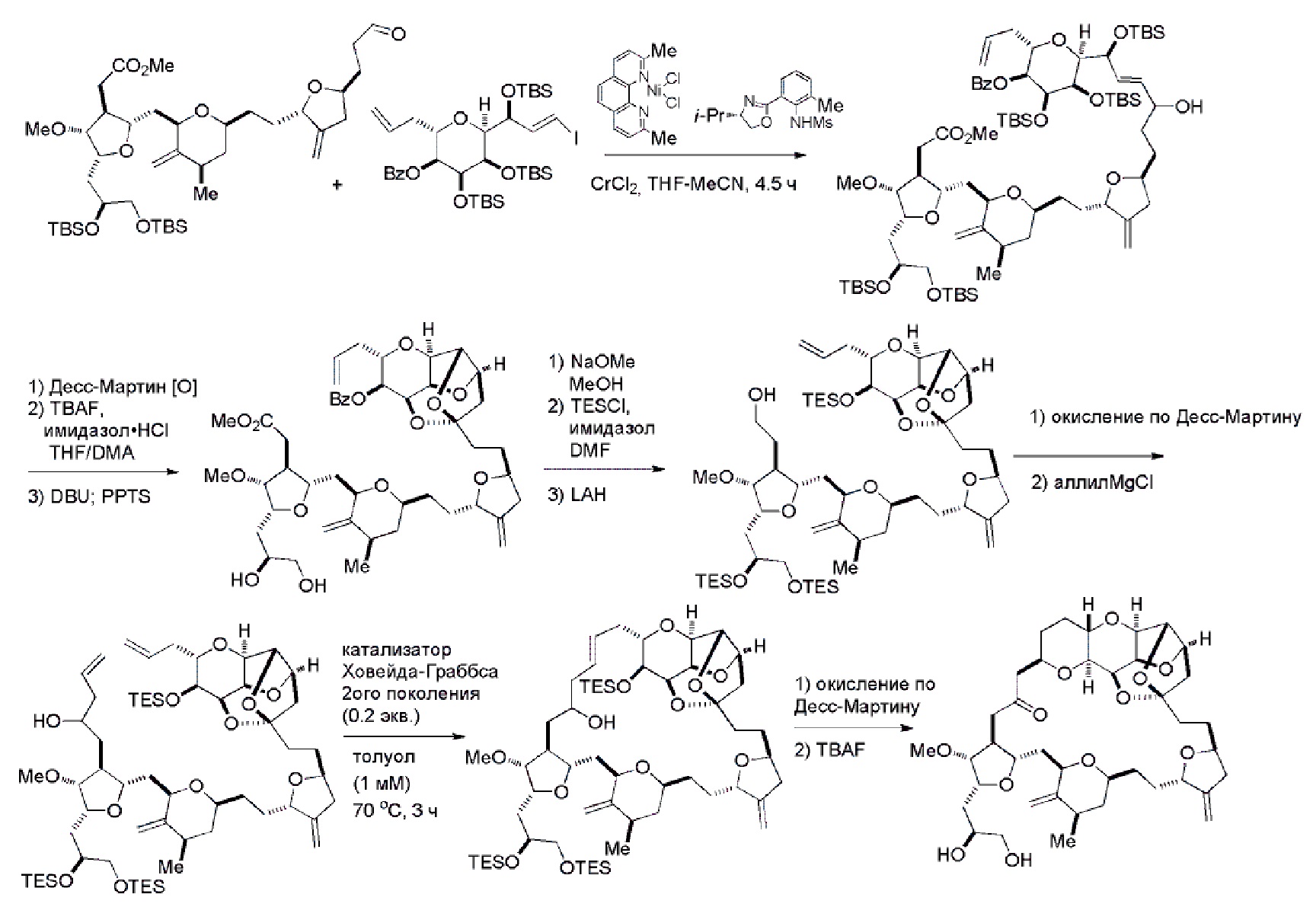
(R)-1-((3aR,4S,6S,7S,7aR)-7-ацетокси-6-аллилтетрагидро-3aH-спиро[[1,3]диоксоло[4,5-c]пиран-2,1'-циклогексан]-4-ил)этан-1,2-диилдиацетат
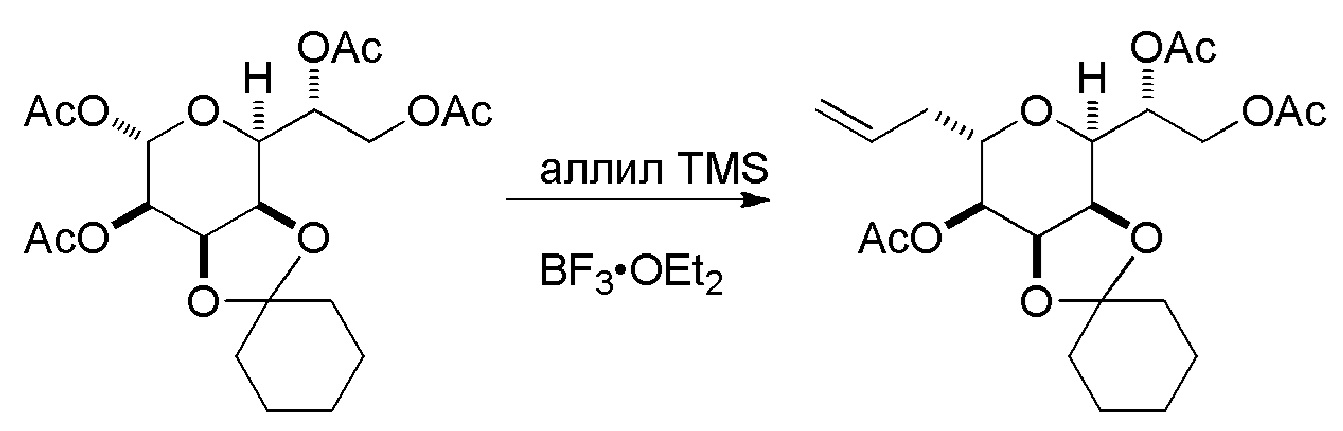
К раствору (3aR,4S,6S,7R,7aR)-4-((R)-1,2-диацетоксиэтил)тетрагидро-3aH-спиро[[1,3]диоксоло[4,5-c]пиран-2,1'-циклогексанe]-6,7-диилдиацетата (10 г, 21,812 ммоль) в ацетонитриле (70,0 мл) добавляли аллилтриметилсилан (10,40 мл, 65,44 ммоль). Полученный в результате раствор охлаждали до 0 oC, и добавляли BF3·OEt2 (5,53 мл, 43,6 ммоль), поддерживая температуру внутри реактора ниже 10°C. После перемешивания в течение 6 часов при температуре 0-10°C, реакционную смесь обрабатывали насыщенным водным NaHCO3 (8%) (100 мл). Полученную в результате смесь экстрагировали толуолом (200 мл). Объединенные органические слои промывали дважды водой (200 мл) и концентрировали в вакууме, получая 11 г целевого продукта в виде белого твердого остатка.
1H ЯМР (400 МГц, CDCl3) δ ppm 1,23-1,85 (м, 10 H) 2,07 (с, 3 H) 2,10 (с, 3 H) 2,14 (с, 3 H) 2,21-2,33 (м, 2 H) 3,74 (дд, J=7,6, 1,8 Гц, 1 H) 4,11 (ддд, J=9,7, 6,6, 5,1 Гц, 1 H) 4,25 (дд, J=12,6, 4,4 Гц, 1 H) 4,32 (дд, J=7,9, 1,8 Гц, 1 H) 4,46 (дд, J=12,6, 2,6 Гц, 1 H) 4,59 (дд, J=7,9, 2,6 Гц, 1 H) 4,92 (дд, J=9,7, 2,6 Гц, 1 H) 5,07 (т, J=1,2 Гц, 1 H) 5,09-5,16 (м, 1 H) 5,22 (ддд, J=7,5, 4,8, 2,6 Гц, 1 H) 5,69-5,90 (м, 1 H).
(R)-1-((3aR,4S,6S,7S,7aS)-6-аллил-7-гидрокситетрагидро-3aH-спиро[[1,3]диоксоло[4,5-c]пиран-2,1'-циклогексан]-4-ил)этан-1,2-диол
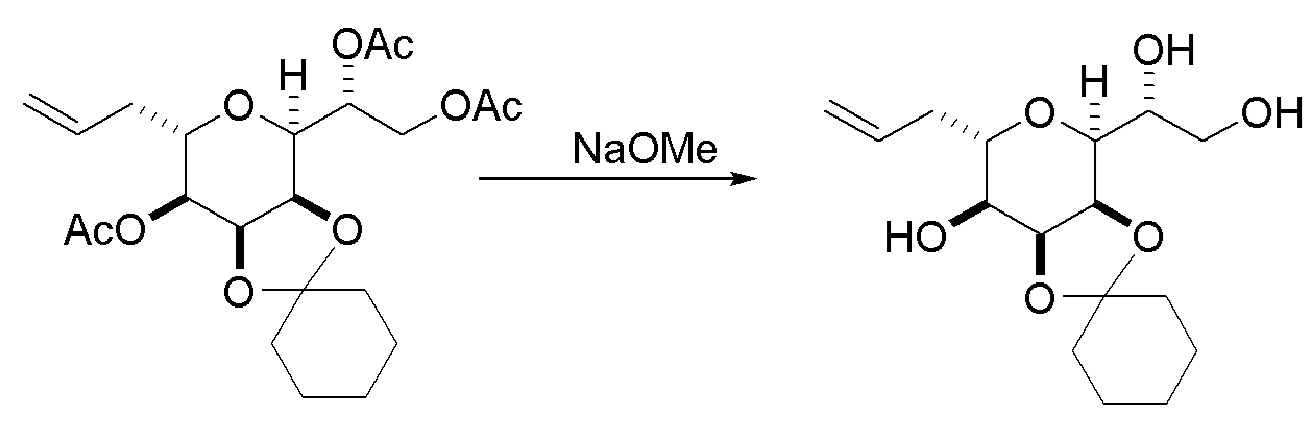
К раствору (R)-1-((3aR,4S,6S,7S,7aR)-7-ацетокси-6-аллилтетрагидро-3aH-спиро[[1,3]диоксоло[4,5-c]пиран-2,1'-циклогексан]-4-ил)этан-1,2-диилдиацетата (11,0 г, 21,7 ммоль) в метаноле (12 мл) и MTBE (57 мл) добавляли раствор метоксида натрия в MeOH (25% по массе, 7,45 мл, 32,6 ммоль) при температуре окружающей среды. Через 2,5 часа, реакционную смесь охлаждали до 10-15°C. Добавляли уксусную кислоту (2,0 мл, 35 ммоль), поддерживая температуру внутри реактора ниже 20°C. Полученную в результате смесь концентрировали в вакууме. Добавляли насыщенный водный NaHCO3 (8%) (38,3 мл), и полученную в результате смесь экстрагировали четыре раза EtOAc (191 мл). Объединенные органические слои промывали 30% водным NaCl (19 мл) и сушили над MgSO4. Фильтрование, концентрирование в вакууме и очистка колоночной хроматографией на силикагеле, применяя 50-100% градиент этилацетата в н-гептане в качестве элюента, давали 6,75 г целевого продукта в виде желтого твердого остатка.
1H ЯМР (400 МГц, CDCl3) δ ppm 1,33-1,80 (м, 10 H) 2,29-2,39 (м, 1 H) 2,47-2,56 (м, 1 H) 3,58-3,67 (м, 2 H) 3,73 (дд, J=11,7, 4,1 Гц, 1 H) 3,78 (дд, J=12,0, 3,8 Гц, 1 H) 3,83-3,95 (м, 2 H) 4,43 (дд, J=8,1, 1,6 Гц, 1 H) 4,54 (дд, J=7,9, 3,5 Гц, 1 H) 5,03-5,30 (м, 2 H) 5,78-5,99 (м, 1 H).
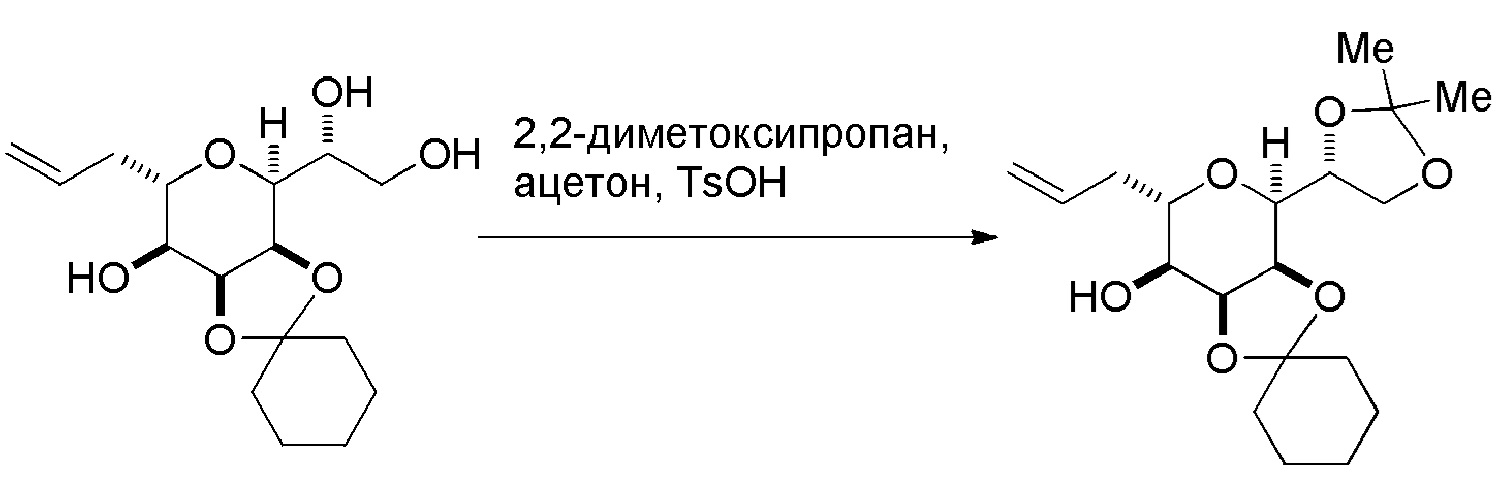
(R)-1-((3aR,4S,6S,7S,7aS)-6-аллил-7-гидрокситетрагидро-3aH-спиро[[1,3]диоксоло[4,5-c]пиран-2,1'-циклогексан]-4-ил)этан-1,2-диол (1,0 г, 3,18 ммоль) растворяли в ацетоне (5,0 мл, 68,1 ммоль) при температуре окружающей среды. Добавляли 2,2-диметоксипропан (1,369 мл, 11,13 ммоль) и моногидрат п-толуолсульфокислоты (0,061 г, 0,318 ммоль), и полученную в результате смесь перемешивали в течение 30 минут. Добавляли насыщенный водный NaHCO3 (10 мл), и полученную в результате смесь экстрагировали три раза EtOAc (12 мл каждый раз). Объединенные органические слои промывали соляным раствором (5 мл) и сушили над MgSO4. Фильтрование, с последующим концентрированием в вакууме, давало 1,09 г целевого продукта в виде белого твердого остатка.
(3aR,4S,6S,7S,7aR)-6-аллил-4-((R)-1,2-дигидроксиэтил)тетрагидро-3aH-спиро[[1,3]диоксоло[4,5-c]пиран-2,1'-циклогексан]-7-илбензоат
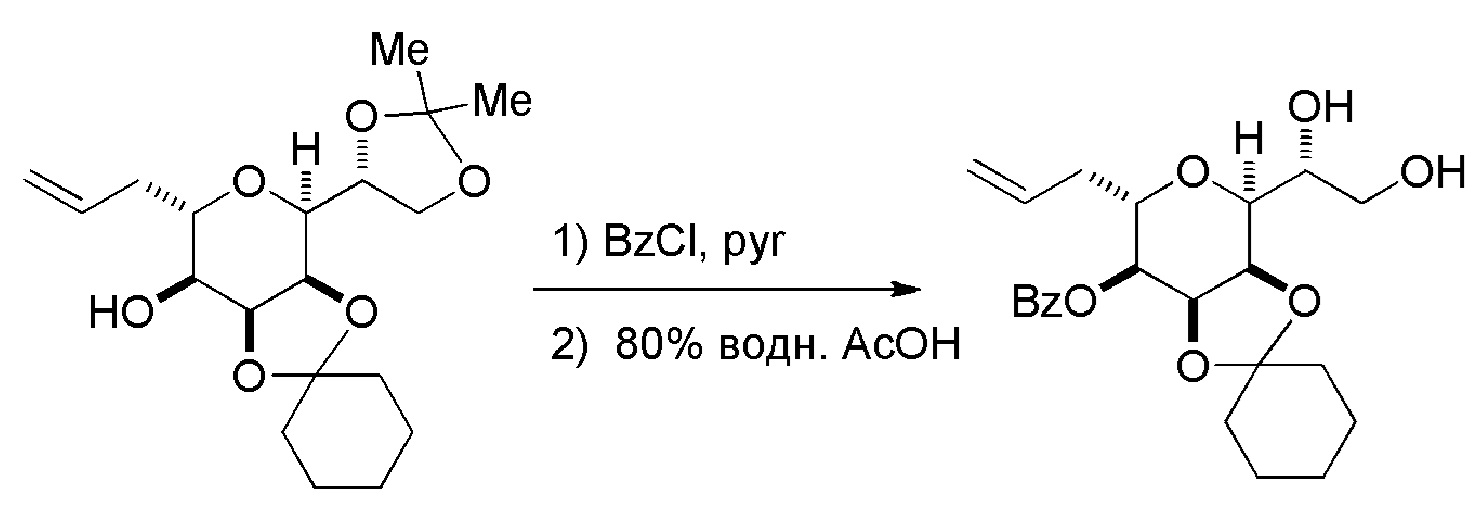
К раствору (3aR,4S,6S,7S,7aS)-6-аллил-4-((R)-2,2-диметил-1,3-диоксолан-4-ил)тетрагидро-3aH-спиро[[1,3]диоксоло[4,5-c]пиран-2,1'-циклогексан]-7-oла (1,09 г, 3,075 ммоль) в пиридине (5,45 мл) при температуре окружающей среды добавляли бензоилхлорид (0,714 мл, 6,151 ммоль) и 4-диметиламинопиридин (0,019 г, 0,154 ммоль). После полного потребления исходного соединения, добавляли насыщенный водный NH4Cl (27% по массе) (15 мл), MTBE (40 мл) и воду (5,0 мл). Слои разделяли, и органический слой промывали последовательно 1M водной хлористоводородной кислотой (10 мл, 10,00 ммоль), насыщенным водным NaHCO3 (8%) (5,0 мл) и 30% водным NaCl (5,0 мл). Полученный в результате органический слой сушили над MgSO4, фильтровали и концентрировали в вакууме. Остаток (1,1 г) растворяли в уксусной кислоте (16 мл) и воде (4 мл). Полученную в результате смесь перемешивали при температуре окружающей среды в течение ночи, и затем при температуре 35-40°C в течение 24 часов. Затем, смесь концентрировали в вакууме и азеотропно упаривали дважды с толуолом. Остаток очищали очисткой через слой силикагеля, получая 1,1 г целевого продукта в виде бледно-желтого твердого остатка.
(3aS,4R,6S,7S,7aR)-6-аллил-4-формилтетрагидро-3aH-спиро[[1,3]диоксоло[4,5-c]пиран-2,1'-циклогексан]-7-илбензоат
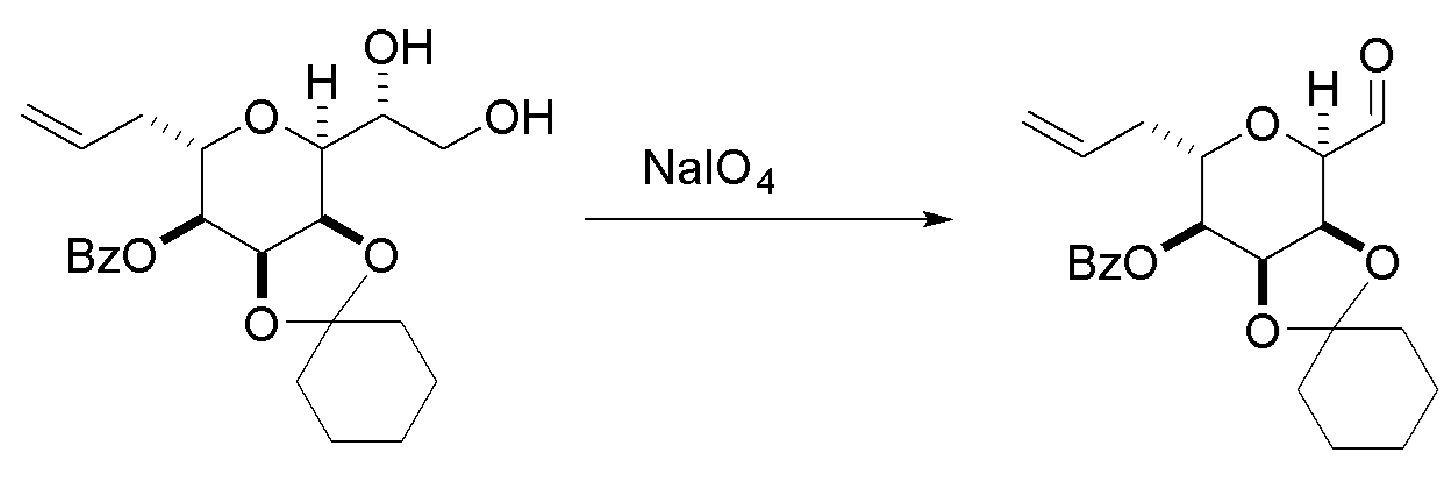
(3aR,4S,6S,7S,7aR)-6-аллил-4-((R)-1,2-дигидроксиэтил)тетрагидро-3aH-спиро[[1,3]диоксоло[4,5-c]пиран-2,1'-циклогексан]-7-илбензоат (1,1 г, 2,629 ммоль) растворяли в этилацетате (11,00 мл) и воде (11,00 мл) и охлаждали до 0 oC. Добавляли периодат натрия (0,843 г, 3,943 ммоль), и полученную в результате смесь перемешивали в течение 2,5 часов при температуре окружающей среды. Затем, добавляли дополнительный периодат натрия (0,2 г). После дополнительного перемешивания в течение 2,5 часов, слои разделяли. Водный слой экстрагировали дважды EtOAc (11,00 мл), и объединенные органические слои промывали 30% водным NaCl (5,50 мл) и сушили над MgSO4. Фильтрование, с последующим концентрированием в вакууме, давало 0,98 г в виде пенистого остатка.
(3aR,4S,6S,7S,7aR)-6-аллил-4-((с,E)-1-гидрокси-3-(триметилсилил)аллил)тетрагидро-3aH-спиро[[1,3]диоксоло[4,5-c]пиран-2,1'-циклогексан]-7-илбензоат
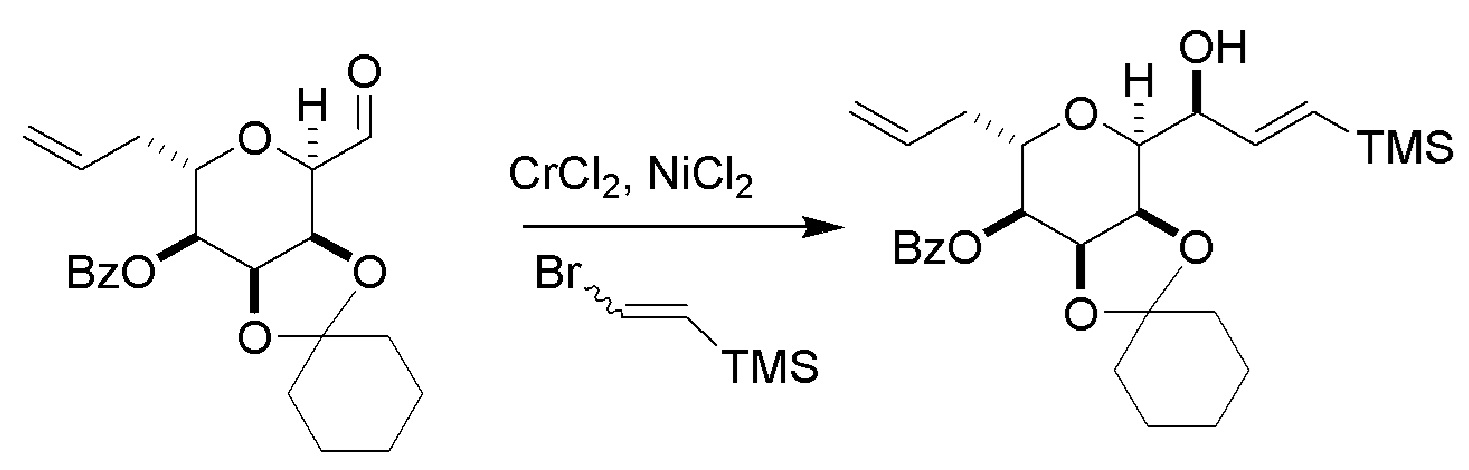
К раствору (3aS,4R,6S,7S,7aR)-6-аллил-4-формилтетрагидро-3aH-спиро[[1,3]диоксоло[4,5-c]пиран-2,1'-циклогексан]-7-илбензоата (0,98 г) в ацетонитриле (7 мл) добавляли (2-бромвинил)триметилсилан (1,941 мл, 12,68 ммоль). Полученный в результате раствор дегазировали в течение 0,5 часа. В другой реактор добавляли хлорид хрома (II) (3,12 г, 25,36 ммоль), хлорид никеля (II) (0,033 г, 0,254 ммоль), DMSO (6,86 мл) и MeCN (6,86 мл), и полученную в результате смесь охлаждали до 0-5°C. Раствор альдегида и винилбромида добавляли к смеси хрома и никеля. Реакционную смесь перемешивали в течение ночи при температуре 5-15°C, и затем обрабатывали метанолом (20,42 мл), водой (20,58 мл) и MTBE (24,50 мл). Слои разделяли, и водный слой экстрагировали дважды MTBE (34,3 мл). Объединенные органические слои промывали дважды 30% водным NaCl (19,60 мл) и сушили над MgSO4. Фильтрование, с последующим концентрированием в вакууме, давало 0,521 г целевого продукта в виде белого пенистого остатка.
1H ЯМР (400 МГц, CDCl3) δ ppm 0,07 (с, 9 H) 1,21-1,87 (м, 10 H) 2,24-2,33 (м, 1 H) 2,34-2,43 (м, 1 H) 2,59-2,68 (м, 1 H) 3,49 (дд, J=6,6, 2,0 Гц, 1 H) 4,28-4,37 (м, 2 H) 4,54 (дд, J=8,0, 1,8 Гц, 1 H) 4,72 (дд, J=7,8, 2,7 Гц, 1 H) 5,02-5,09 (м, 2 H) 5,13 (дд, J=9,8, 2,7 Гц, 1 H) 5,77-5,93 (м, 1 H) 6,07 (дд, J=18,7, 1,6 Гц, 1 H) 6,23 (дд, J=19,1, 4,3 Гц, 1 H) 7,43-7,48 (м, 2 H) 7,57 (д, J=7,4 Гц, 1 H) 8,07 (дд, J=8,4, 1,4 Гц, 2 H)
(2S,3R,4R,5S,6S)-2-аллил-4,5-дигидрокси-6-((с,E)-1-гидрокси-3-(триметилсилил)аллил)тетрагидро-2H-пиран-3-илбензоат
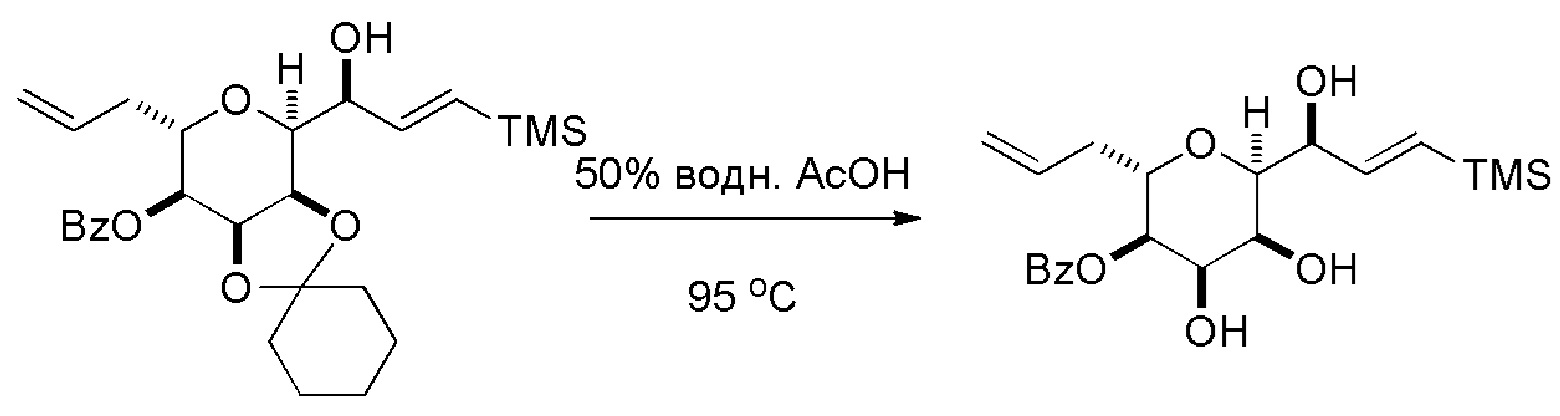
К (3aR,4S,6S,7S,7aR)-6-аллил-4-((с,E)-1-гидрокси-3-(триметилсилил)аллил)тетрагидро-3aH-спиро[[1,3]диоксоло[4,5-c]пиран-2,1'-циклогексан]-7-илбензоату (0,521 г, 1,071 ммоль) добавляли уксусную кислоту (7,8 мл) и воду (7,8 мл). Реакционную смесь нагревали при 90-97°C в течение 100 минут и концентрировали в вакууме. Остаток азеотропно упаривали с толуолом и очищали через слой силикагеля, получая 0,33 г целевого продукта в виде белого пенистого остатка.
(2S,3S,4S,5R,6S)-2-аллил-4,5-бис((трет-бутилдиметилсилил)окси)-6-((с,E)-1-((трет-бутилдиметилсилил)окси)-3-(триметилсилил)аллил)тетрагидро-2H-пиран-3-илбензоат
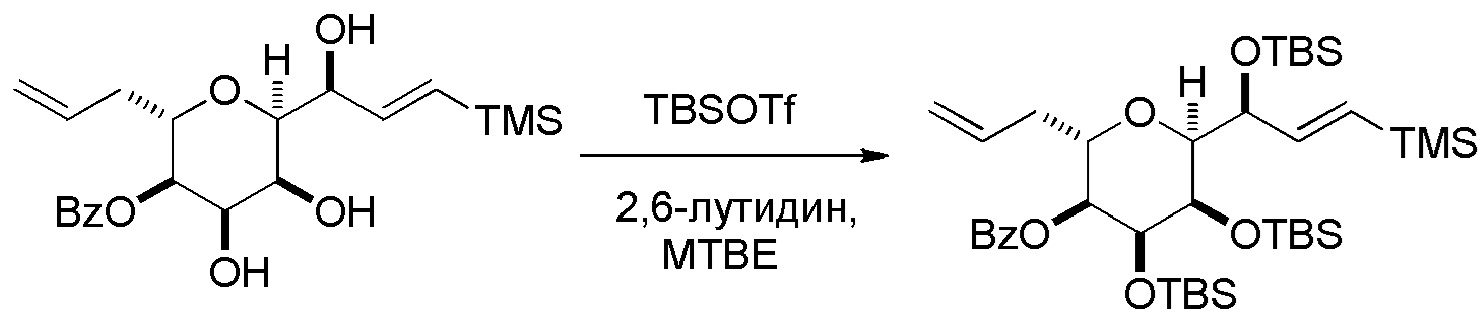
(2S,3R,4R,5S,6S)-2-аллил-4,5-дигидрокси-6-((с,E)-1-гидрокси-3-(триметилсилил)аллил)тетрагидро-2H-пиран-3-илбензоат (0,33 г) растворяли в MTBE (4,95 мл) и охлаждали до 0°C. Добавляли 2,6-диметилпиридин (0,95 мл, 8,1 ммоль) и трет-бутилдиметилсилилтрифторметансульфонат (0,84 мл, 3,7 ммоль). Полученную в результате смесь перемешивали при температуре окружающей среды в течение ночи. Добавляли насыщенный водный NH4Cl (27% по массе) (4,95 мл), MTBE (9,90 мл) и воду (3,30 мл). Органический слой отделяли и сушили над MgSO4. Фильтрование, концентрирование и очистка колоночной хроматографией на силикагеле, применяя 0-10% градиент этилацетата в н-гептане в качестве элюента, давали 0,619 г целевого продукта в виде масла.
(2S,3S,4S,5R,6S)-2-аллил-4,5-бис((трет-бутилдиметилсилил)окси)-6-((с,E)-1-((трет-бутилдиметилсилил)окси)-3-йодаллил)тетрагидро-2H-пиран-3-илбензоат
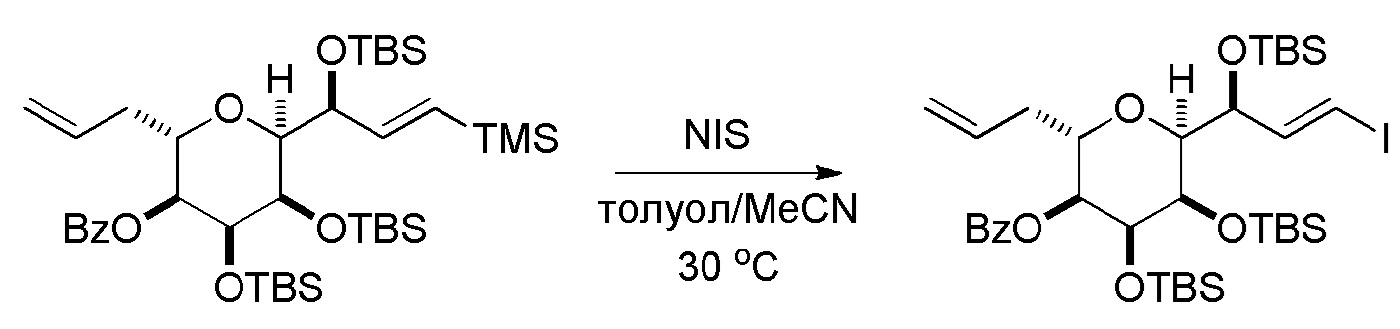
(2S,3S,4S,5R,6S)-2-аллил-4,5-бис((трет-бутилдиметилсилил)окси)-6-((с,E)-1-((трет-бутилдиметилсилил)окси)-3-(триметилсилил)аллил)тетрагидро-2H-пиран-3-илбензоат (0,510 г, 0,681 ммоль) растворяли в толуоле (2,295 мл) и MeCN (4,59 мл) при температуре окружающей среды. К раствору добавляли трет-бутилдиметилсилилхлорид (7,69 мг, 0,051 ммоль) и NIS (0,919 г, 4,08 ммоль). Реакционную смесь перемешивали при 28-31°C в течение 20 часов и охлаждали до температуры окружающей среды. Добавляли толуол (24,29 мл), тиосульфат натрия (1,076 г, 6,806 ммоль) и насыщенный водный NaHCO3 (8%) (5,10 мл), и полученную в результате смесь перемешивали в течение 2 часов при температуре окружающей среды. Слои разделяли, и органический слой промывали дважды 30% водным NaCl (7,29 мл) и сушили над MgSO4. Фильтрование, с последующим концентрированием и очисткой колоночной хроматографией на силикагеле, применяя 0-10% градиент этилацетата в н-гептане в качестве элюента, давали 467 мг целевого продукта в виде бледно-желтого масла.
1H ЯМР (400 МГц, CDCl3) δ ppm -0,04-0,27 (м, 18 H) 0,89 (уш.с, 9 H) 0,90 (уш.с, 9 H) 0,96 (с, 9 H) 2,22-2,53 (м, 2 H) 3,24-3,69 (м, 1 H) 3,76-4,50 (м, 4 H) 4,95-5,35 (м, 3 H) 5,71-5,90 (м, 1 H) 6,36 (д, J=14,9 Гц, 1 H) 6,50-6,73 (м, 1 H) 7,33-7,46 (м, 1 H) 7,48-7,60 (м, 2 H) 7,96-8,15 (м, 2 H).
(S)-5-(((2R,3R,4S,5S)-3-метокси-5-(((2R,4R,6S)-4-метил-3-метилен-6-(2-((2S,5S)-3-метилен-5-(3-((триэтилсилил)окси)пропил)тетрагидрофуран-2-ил)этил)тетрагидро-2H-пиран-2-ил)метил)-4-((фенилсульфонил)метил)тетрагидрофуран-2-ил)метил)-2,2,3,3,8,8,9,9-октаметил-4,7-диокса-3,8-дисиладекан
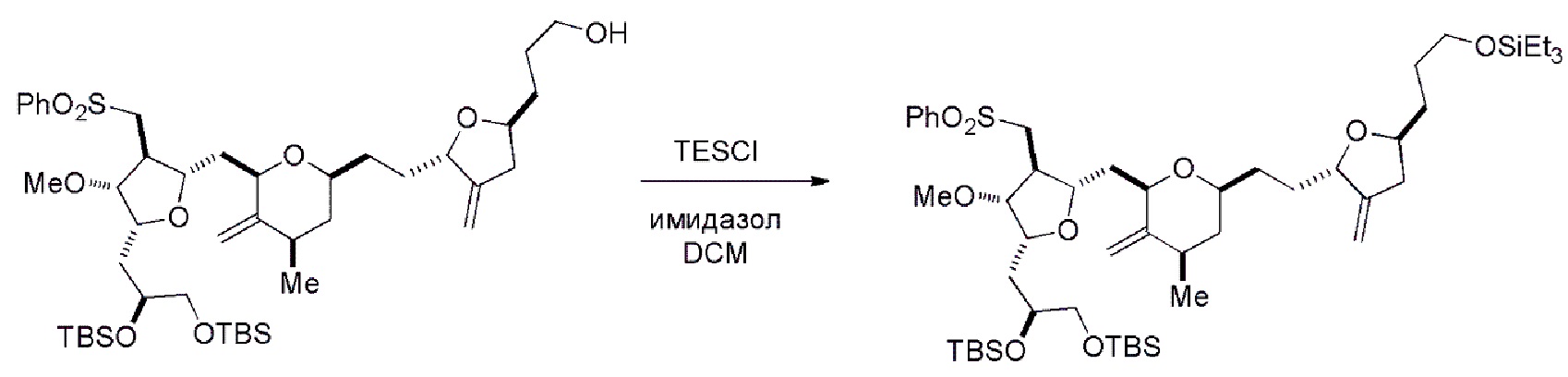
3-((2S,5S)-5-(2-((2S,4R,6R)-6-(((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-3-((фенилсульфонил)метил)тетрагидрофуран-2-ил)метил)-4-метил-5-метилентетрагидро-2H-пиран-2-ил)этил)-4-метилентетрагидрофуран-2-ил)пропан-1-ол (1,00 г, 1,175 ммоль) растворяли в дихлорметане (7,00 мл) при температуре окружающей среды. Добавляли имидазол (0,240 г, 3,52 ммоль) и хлортриэтилсилан (0,300 мл, 1,76 ммоль), и полученную в результате смесь перемешивали при температуре окружающей среды в течение 1 часа, после чего добавляли насыщенный водный NH4Cl (27% по массе) (12,00 мл, 64,205 ммоль), и полученную в результате смесь экстрагировали MTBE (15,00 мл, 125,924 ммоль). Объединенные органические слои промывали 30% водным NaCl (10,00 мл, 52,578 ммоль) и сушили над MgSO4. Концентрирование и азеотропное упаривание с толуолом давали 1,177 г целевого продукта в виде масла.
Метил (R)-2-((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-2-(((2R,4R,6S)-4-метил-3-метилен-6-(2-((2S,5S)-3-метилен-5-(3-((триэтилсилил)окси)пропил)тетрагидрофуран-2-ил)этил)тетрагидро-2H-пиран-2-ил)метил)тетрагидрофуран-3-ил)-2-(фенилсульфонил)ацетат
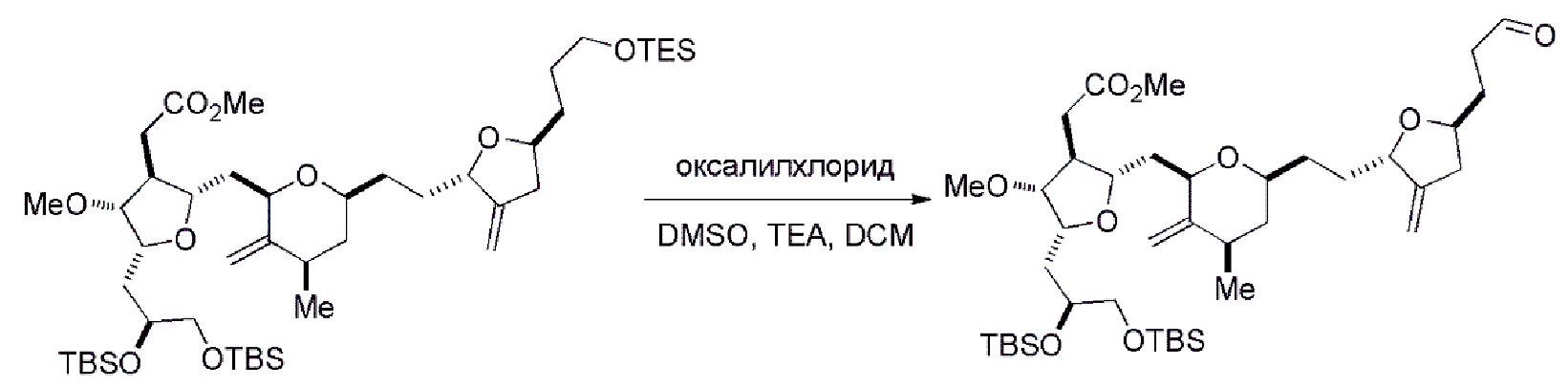
(S)-5-(((2R,3R,4S,5S)-3-метокси-5-(((2R,4R,6S)-4-метил-3-метилен-6-(2-((2S,5S)-3-метилен-5-(3-((триэтилсилил)окси)пропил)тетрагидрофуран-2-ил)этил)тетрагидро-2H-пиран-2-ил)метил)-4-((фенилсульфонил)метил)тетрагидрофуран-2-ил)метил)-2,2,3,3,8,8,9,9-октаметил-4,7-диокса-3,8-дисиладекан (1,177 г, 1,17 ммоль) растворяли в THF (11,3 мл) и охлаждали до 0°C. Добавляли н-BuLi (1,6 M, 0,95 мл, 1,5 ммоль). Полученный в результате раствор перемешивали в течение 20 минут при 0°C и охлаждали до -78°C. Добавляли метилхлорформиат (0,14 мл, 1,8 ммоль), и полученный в результате раствор перемешивали в течение 1,5 часов с нагреванием до -40°C. Добавляли насыщенный водный NH4Cl (27% по массе) (10 мл), воду (5 мл) и MTBE (11 мл), и полученную в результате смесь нагревали до температуры окружающей среды. Слои разделяли, и органический слой промывали насыщенным водным NaCl (4 мл) и сушили над MgSO4. Фильтрование, с последующим концентрированием в вакууме, давали 1,267 г целевого продукта в виде бесцветного масла.
метил 2-((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-2-(((2R,4R,6S)-4-метил-3-метилен-6-(2-((2S,5S)-3-метилен-5-(3-((триэтилсилил)окси)пропил)тетрагидрофуран-2-ил)этил)тетрагидро-2H-пиран-2-ил)метил)тетрагидрофуран-3-ил)ацетат
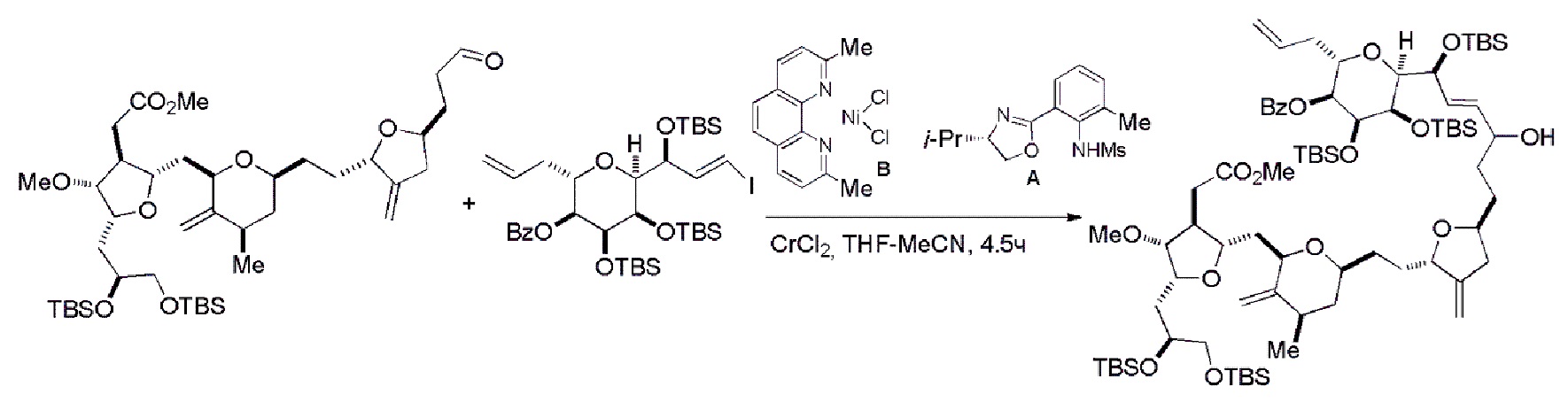
(S)-метил 2-((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-2-(((2R,4R,6S)-4-метил-3-метилен-6-(2-((2S,5S)-3-метилен-5-(3-((триэтилсилил)окси)пропил)тетрагидрофуран-2-ил)этил)тетрагидро-2H-пиран-2-ил)метил)тетрагидрофуран-3-ил)-2-(фенилсульфонил)ацетат (1,267 г, 1,176 ммоль) растворяли в метаноле (36,1 мл) при температуре окружающей среды. Добавляли магний (0,286 г, 11,8 ммоль), и полученную в результате смесь перемешивали при температуре окружающей среды. Добавляли дополнительный магний (0,56 г) и метанол (32 мл) в течение 20 часов. После потребления исходного соединения, реакционную смесь охлаждали ниже 10°C и обрабатывали моноосновным фосфатом натрия (4,66 г, 38,8 ммоль). Полученную в результате смесь концентрировали в вакууме. К остатку добавляли MTBE (36,1 мл), насыщенный водный NH4Cl (27% по массе) (18,0 мл) и воду (12,0 мл). Полученную в результате смесь перемешивали при температуре окружающей среды и фильтровали через слой целита®. Слои разделяли, и водный слой экстрагировали MTBE (24,0 мл). Объединенные органические слои промывали 30% водным NaCl (12,0 мл), сушили над MgSO4, фильтровали и концентрировали в вакууме. Остаток растворяли в дихлорметане (12,0 мл) при температуре окружающей среды и обрабатывали имидазолом (0,400 г, 5,88 ммоль) и хлортриэтилсиланом (0,59 мл, 3,53ммоль). Через 2 часа при температуре окружающей среды, реакцию гасили насыщенным водным раствором NH4Cl (10 мл). Полученную в результате смесь экстрагировали MTBE (30 мл). Органический слой промывали 30% водным NaCl (10 мл), сушили над MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле, применяя 5-20% градиент этилацетата в н-гептане в качестве элюента, получая 0,42 г целевого продукта в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3) δ ppm 0,03 (с, 3 H) 0,04 (с, 3 H) 0,06 (с, 3 H) 0,07 (с, 3 H) 0,55-0,62 (м, 6 H) 0,87-0,88 (м, 9 H) 0,88 (с, 9 H) 0,92-0,97 (м, 9 H) 1,07 (д, J=6,6 Гц, 3 H) 1,43-1,70 (м, 8 H) 1,79 (с, 2 H) 1,92-2,02 (м, 2 H) 2,09-2,19 (м, 1 H) 2,20-2,45 (м, 6 H) 2,59-2,69 (м, 1 H) 3,29 (с, 3 H) 3,41 (д, J=3,9 Гц, 1 H) 3,46-3,65 (м, 5 H) 3,67-3,73 (м, 1 H) 3,69 (с, 3 H) 3,74-3,81 (м, 2 H) 3,83-3,91 (м, 1 H) 3,95-4,06 (м, 1 H) 4,34-4,43 (м, 1 H) 4,79 (д, J=1,6 Гц, 1 H) 4,82 (д, J=2,0 Гц, 1 H) 4,87 (с, 1 H) 4,96 (д, J=2,0 Гц, 1 H).
метил 2-((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-2-(((2R,4R,6S)-4-метил-3-метилен-6-(2-((2S,5S)-3-метилен-5-(3-оксопропил)тетрагидрофуран-2-ил)этил)тетрагидро-2H-пиран-2-ил)метил)тетрагидрофуран-3-ил)ацетат
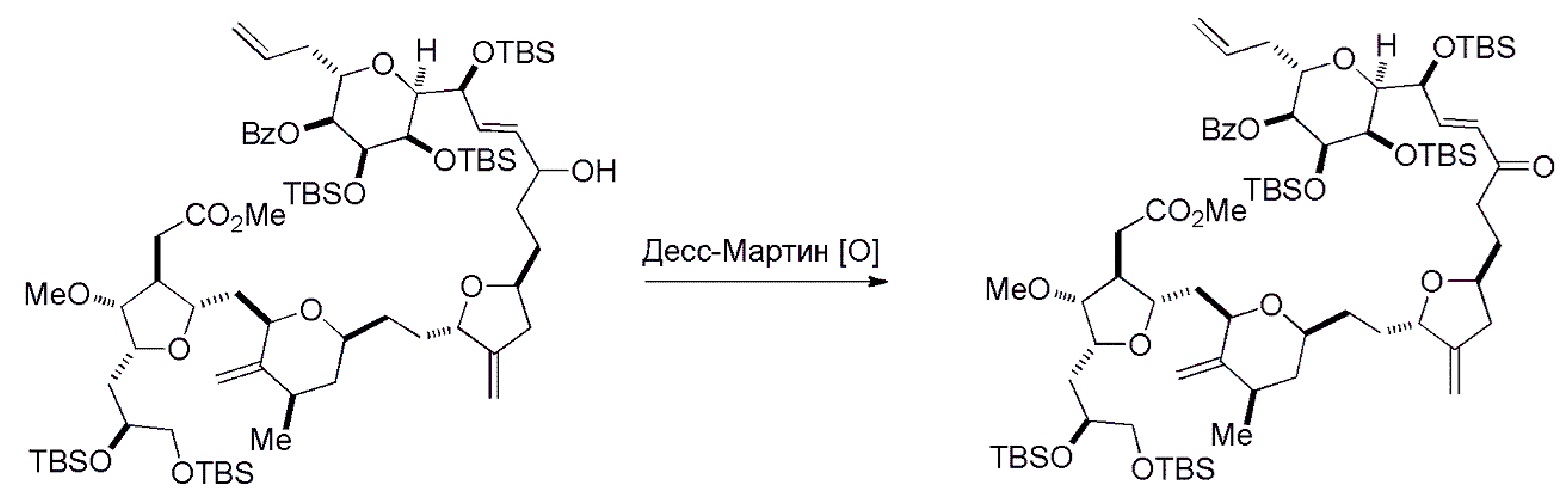
Раствор оксалилхлорида (0,2 M, 0,10 мл, 0,20 ммоль) в дихлорметане разбавляли дихлорметаном (1,0 мл) и охлаждали до -78°C. Добавляли раствор DMSO (0,030 мл, 0,419 ммоль) в дихлорметане (0,300 мл, 4,66 ммоль), с последующим добавлением раствора метил 2-((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-2-(((2R,4R,6S)-4-метил-3-метилен-6-(2-((2S,5S)-3-метилен-5-(3-((триэтилсилил)окси)пропил)тетрагидрофуран-2-ил)этил)тетрагидро-2H-пиран-2-ил)метил)тетрагидрофуран-3-ил)ацетата (0,10 г, 0,113 ммоль) в дихлорметане (0,500 мл). Полученный в результате раствор перемешивали в течение 30 минут при -50°C, охлаждали до -78°C и обрабатывали триэтиламином (0,095 мл, 0,679 ммоль). Смесь нагревали до температуры окружающей среды в течение 1 часа, разбавляли MTBE (15 мл) и промывали насыщенным водным раствором NH4Cl (5 мл) и 30% водным NaCl (3 мл). Органический слой сушили над MgSO4, фильтровали и концентрировали в вакууме. Остаток фильтровали через слой силикагеля MTBE. Концентрирование фильтрата в вакууме давало 89 мг целевого продукта в виде масла.
1H ЯМР (400 МГц, CDCl3) δ ppm 0,04 (с, 3 H) 0,04 (с, 3 H) 0,06 (с, 3 H) 0,07 (с, 3 H) 0,88 (с, 9 H) 0,89 (с, 9 H) 1,08 (д, J=6,3 Гц, 3 H) 1,42-1,69 (м, 5 H) 1,74-1,85 (м, 4 H) 1,93-2,03 (м, 2 H) 2,10-2,19 (м, 1 H) 2,22-2,32 (м, 3 H) 2,34-2,46 (м, 2 H) 2,47-2,62 (м, 2 H) 2,63-2,73 (м, 1 H) 3,29 (с, 3 H) 3,42 (д, J=3,5 Гц, 1 H) 3,50 (д, J=5,1 Гц, 2 H) 3,56 (д, J=5,9 Гц, 1 H) 3,67-3,73 (м, 1 H) 3,70 (с, 3 H) 3,78 (д, J=5,5 Гц, 2 H) 3,84-3,91 (м, 1 H) 4,04 (кв, J=6,4 Гц, 1 H) 4,34 (д, J=6,6 Гц, 1 H) 4,79-4,81 (м, 1 H) 4,84 (д, J=2,3 Гц, 1 H) 4,88 (с, 1 H) 4,98 (д, J=2,3 Гц, 1 H) 9,79 (т, J=1,4 Гц, 1 H)
(2S,3S,4S,5R,6S)-2-аллил-6-((1S,E)-6-((2S,5S)-5-(2-((2S,4R,6R)-6-(((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-3-(2-метокси-2-оксоэтил)тетрагидрофуран-2-ил)метил)-4-метил-5-метилентетрагидро-2H-пиран-2-ил)этил)-4-метилентетрагидрофуран-2-ил)-1-((трет-бутилдиметилсилил)окси)-4-гидроксигекс-2-ен-1-ил)-4,5-бис((трет-бутилдиметилсилил)окси)тетрагидро-2H-пиран-3-илбензоат
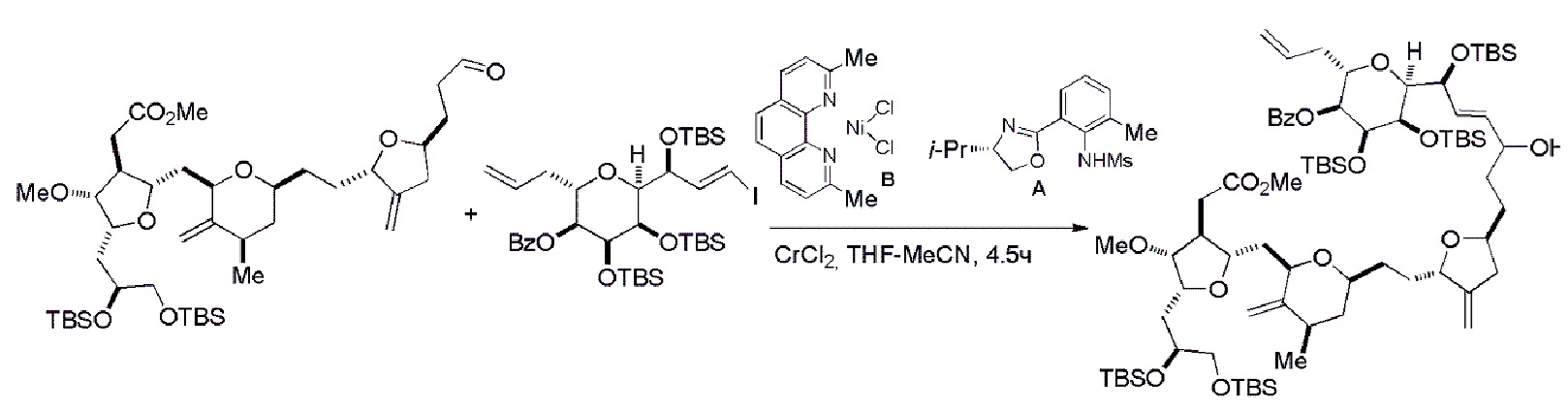
(S)-N-(2-(4-изопропил-4,5-дигидрооксазол-2-ил)-6-метилфенил)метансульфамид (688 мг, 2,32 ммоль) растворяли в ацетонитриле (4 мл) и продували азотом в течение 30 минут. Добавляли хлорид хрома (II) (285 мг, 2,32 ммоль) и триэтиламин (320 мкл, 2,32 ммоль), и полученную в результате темно-зеленую смесь перемешивали при 35°C в течение 1 часа. В другом реакторе, метил 2-((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-2-(((2R,4R,6S)-4-метил-3-метилен-6-(2-((2S,5S)-3-метилен-5-(3-оксопропил)тетрагидрофуран-2-ил)этил)тетрагидро-2H-пиран-2-ил)метил)тетрагидрофуран-3-ил)ацетат (89 мг, 0,116 ммоль) и (2S,3S,4S,5R,6S)-2-аллил-4,5-бис((трет-бутилдиметилсилил)окси)-6-((с,E)-1-((трет-бутилдиметилсилил)окси)-3-йодаллил)тетрагидро-2H-пиран-3-илбензоат (107 мг, 0,133 ммоль) растворяли в THF (870 мкл) и ацетонитриле (680 мкл) и продували азотом в течение 10 мин. Добавляли комплекс хлорида никеля (II) с 2,9-диметил-1,10-фенантролином (7,84 мг, 0,023 ммоль), с последующим добавлением раствора сульфамидного комплекса, полученного выше. Полученную в результате смесь энергично перемешивали в течение 5 часов при 15-23°C и разбавляли н-гептаном (6,5 мл). Полученную в результате смесь фильтровали через слой целита®, который, затем, промывали н-гептаном (10 мл) и ацетонитрилом (10 мл). Слои разделяли, и нижний ацетонитрильный слой экстрагировали дважды н-гептаном (7 мл каждый). Объединенные н-гептановые слои промывали дважды ацетонитрилом (5 мл каждый) и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле, применяя 10-33% градиент этилацетата в н-гептане в качестве элюента, получая 99 мг целевого продукта в виде белого пенистого остатка.
(2S,3S,4S,5R,6S)-2-аллил-6-((с,E)-6-((2S,5S)-5-(2-((2S,4R,6R)-6-(((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-3-(2-метокси-2-оксоэтил)тетрагидрофуран-2-ил)метил)-4-метил-5-метилентетрагидро-2H-пиран-2-ил)этил)-4-метилентетрагидрофуран-2-ил)-1-((трет-бутилдиметилсилил)окси)-4-оксогекс-2-ен-1-ил)-4,5-бис((трет-бутилдиметилсилил)окси)тетрагидро-2H-пиран-3-илбензоат
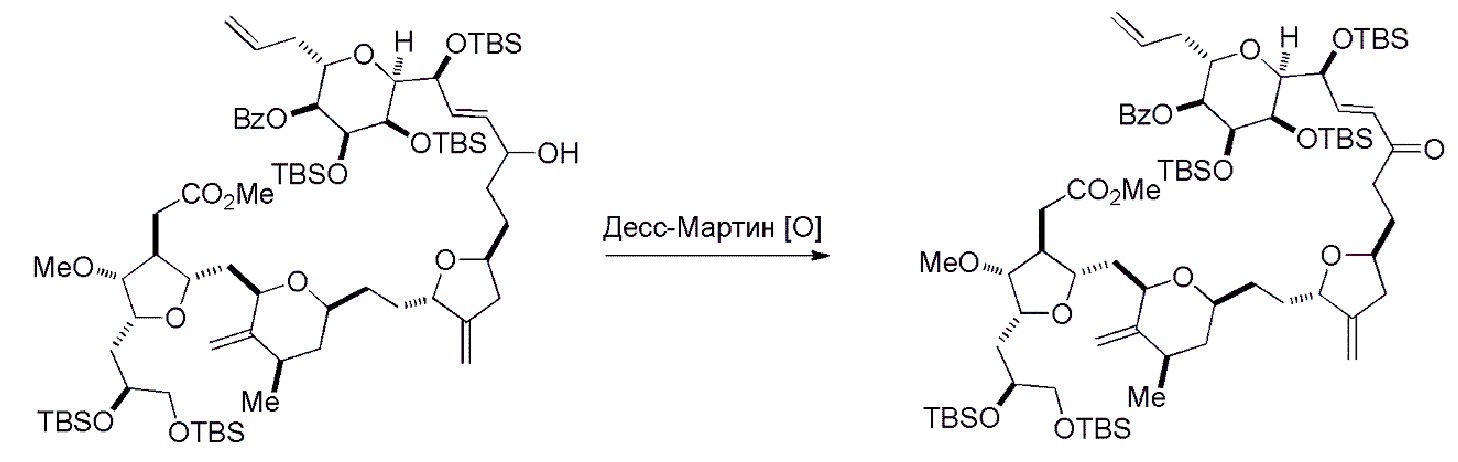
К раствору (2S,3S,4S,5R,6S)-2-аллил-6-((1S,E)-6-((2S,5S)-5-(2-((2S,4R,6R)-6-(((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-3-(2-метокси-2-оксоэтил)тетрагидрофуран-2-ил)метил)-4-метил-5-метилентетрагидро-2H-пиран-2-ил)этил)-4-метилентетрагидрофуран-2-ил)-1-((трет-бутилдиметилсилил)окси)-4-гидроксигекс-2-ен-1-ил)-4,5-бис((трет-бутилдиметилсилил)окси)тетрагидро-2H-пиран-3-илбензоата (0,284 г, 0,197 ммоль) в дихлорметане (5,7 мл) при температуре окружающей среды добавляли бикарбонат натрия (83 мг, 0,98 ммоль) и периодинан Десс-Мартина (250 мг, 0,59 ммоль). После перемешивания в течение 2 часов при температуре окружающей среды, реакционную смесь разбавляли MTBE (8,5 мл). Добавляли воду (2,8 мл), тиосульфат натрия (0,155 мг, 0,983 ммоль) и насыщенный водный NaHCO3 (8%) (2,84 мл), и полученную в результате смесь перемешивали в течение 30 минут. Слои разделяли, и органический слой промывали дважды 30% водным NaCl (1,4 мл каждый раз) и сушили над MgSO4. Фильтрование и концентрирование в вакууме давали 270 мг целевого продукта в виде белой пены.
1H ЯМР (400 МГц, CDCl3) δ ppm -0,13-0,23 (м, 30 H) 0,87 (с, 9 H) 0,88 (уш с, 18 H) 0,90-0,91 (м, 9 H) 0,96 (с, 9 H) 1,07 (д, J=6,3 Гц, 3 H) 1,41-1,70 (м, 6 H) 1,72-1,86 (м, 4 H) 1,93-2,03 (м, 2 H) 2,09-2,19 (м, 1 H) 2,20-2,56 (м, 7 H) 2,57-2,80 (м, 3 H) 3,29 (с, 3 H) 3,41 (д, J=3,5 Гц, 2 H) 3,43-3,55 (м, 4 H) 3,56 (м, J=5,5 Гц, 1 H) 3,65-3,73 (м, 1 H) 3,69 (с, 3 H) 3,74-3,82 (м, 2 H) 3,84-3,90 (м, 1 H) 3,92-4,15 (м, 4 H) 4,30-4,41 (м, 1 H) 4,59-4,70 (м, 1 H) 4,79 (д, J=1,2 Гц, 1 H) 4,81-4,85 (м, 1 H) 4,87 (с, 1 H) 4,95-5,00 (м, 1 H) 5,05-5,29 (м, 2 H) 5,62-5,83 (м, 1 H) 6,27 (д, J=15,2 Гц, 1 H) 6,65-6,85 (м, 1 H) 7,34-7,48 (м, 2 H) 7,50-7,60 (м, 1 H) 7,92-8,14 (м, 2 H)
(2S,3aR,4aR,5R,6S,7S,8aR,8bS)-7-аллил-2-(2-((2S,5S)-5-(2-((2S,4R,6R)-6-(((2S,3S,4R,5R)-5-((S)-2,3-дигидроксипропил)-4-метокси-3-(2-метокси-2-оксоэтил)тетрагидрофуран-2-ил)метил)-4-метил-5-метилентетрагидро-2H-пиран-2-ил)этил)-4-метилентетрагидрофуран-2-ил)этил)октагидро-2H-2,5-эпоксифуро[2',3':4,5]фуро[3,2-b]пиран-6-илбензоат
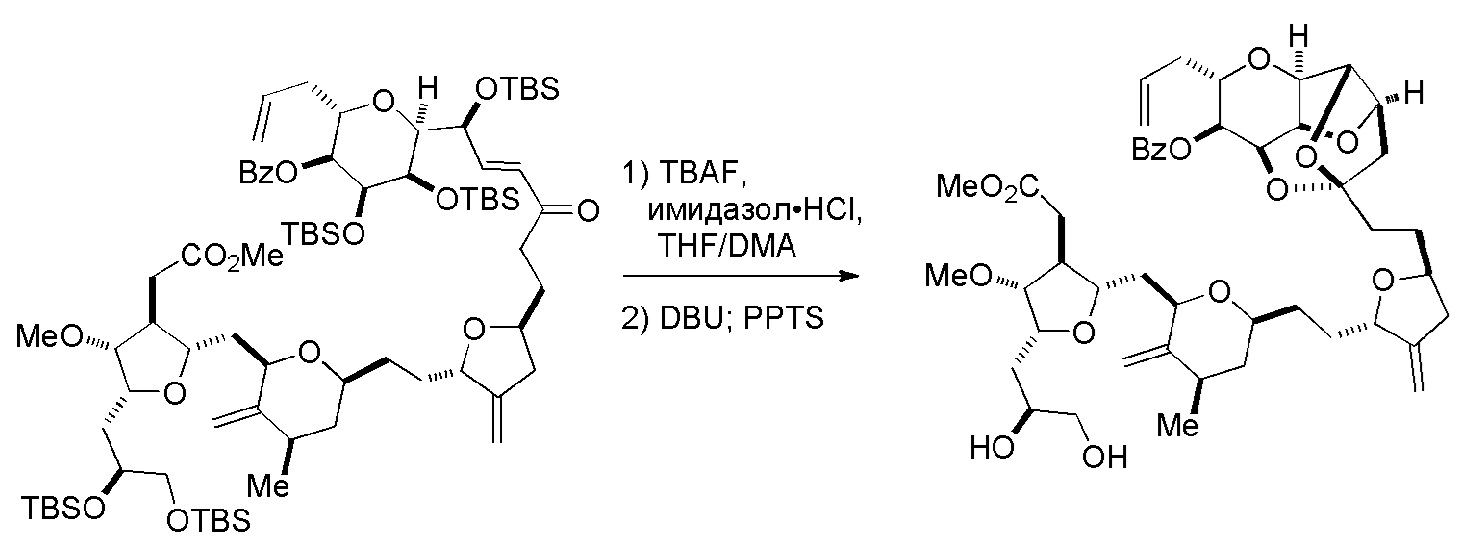
(2S,3S,4S,5R,6S)-2-аллил-6-((с,E)-6-((2S,5S)-5-(2-((2S,4R,6R)-6-(((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-3-(2-метокси-2-оксоэтил)тетрагидрофуран-2-ил)метил)-4-метил-5-метилентетрагидро-2H-пиран-2-ил)этил)-4-метилентетрагидрофуран-2-ил)-1-((трет-бутилдиметилсилил)окси)-4-оксогекс-2-ен-1-ил)-4,5-бис((трет-бутилдиметилсилил)окси)тетрагидро-2H-пиран-3-илбензоат (0,270 г, 0,187 ммоль) растворяли в N,N-диметилацетамиде (4,3 мл) и THF (10,8 мл) при температуре окружающей среды. Добавляли смесь фторида тетрабутиламмония (1,0 M, 1,9 мл, 1,9 ммоль) и гидрохлорида имидазола (0,098 г, 0,936 ммоль), и полученный в результате раствор перемешивали при температуре окружающей среды в течение 20 часов. Добавляли воду (5,4 мл) и толуол (11 мл), и слои разделяли. Водный слой экстрагировали дважды смесью толуола (11 мл) и THF (11 мл). Объединенные органические слои промывали 30% водным NaCl (5,4 мл), сушили над MgSO4, фильтровали и концентрировали в вакууме. Остаток азеотропно упаривали со смесью ацетонитрила (3,2 мл) и воды (1,1 мл) три раза, получая 0,26 г коричневого масла. Неочищенный продукт растворяли в дихлорметане (5,0 мл) и обрабатывали DBU (0,050 мл, 0,332 ммоль) в течение 1 часа при температуре окружающей среды. Добавляли п-толуолсульфонат пиридиния (496 мг, 1,98 ммоль), и полученную в результате смесь перемешивали в течение 3 часов при температуре окружающей среды. Реакционную смесь очищали колоночной хроматографией на силикагеле, применяя 0-100% градиент ацетонитрила в этилацетате в качестве элюента, получая 44 мг целевого продукта. 1H ЯМР (400 МГц, CDCl3) δ ppm 1,08 (д, J=6,6 Гц, 3 H) 1,43-2,49 (м, 23 H) 2,68 (ддд, J=15,7, 6,5, 1,6 Гц, 1 H) 3,32 (с, 3 H) 3,46-3,57 (м, 3 H) 3,61-3,66 (м, 1 H) 3,69 (с, 3 H) 3,76 (дд, J=9,0, 3,9 Гц, 1 H) 3,83 (дт, J=7,7, 5,3 Гц, 1 H) 3,90-4,01 (м, 2 H) 4,03 (д, J=7,0 Гц, 1 H) 4,21 (дд, J=6,6, 4,3 Гц, 1 H) 4,30 (дд, J=6,4, 4,5 Гц, 1 H) 4,35-4,40 (м, 1 H) 4,64 (дд, J=4,1, 2,1 Гц, 1 H) 4,66-4,69 (м, 1 H) 4,70-4,80 (м, 3 H) 4,81 (д, J=1,6 Гц, 1 H) 4,85 (д, J=1,6 Гц, 1 H) 4,86 (с, 1 H) 4,97 (д, J=2,0 Гц, 1 H) 5,00-5,04 (м, 1 H) 5,06 (д, J=1,6 Гц, 1 H) 5,80-5,99 (м, 1 H) 7,41-7,46 (м, 2 H) 7,54-7,59 (м, 1 H) 8,04 (дд, J=8,4, 1,4 Гц, 2 H).
метил 2-((2S,3S,4R,5R)-2-(((2R,4R,6S)-6-(2-((2S,5S)-5-(2-((3aR,4aR,5R,6S,7S,8aR,8bS)-7-аллил-6-((триэтилсилил)окси)октагидро-2H-2,5-эпоксифуро[2',3':4,5]фуро[3,2-b]пиран-2-ил)этил)-3-метилентетрагидрофуран-2-ил)этил)-4-метил-3-метилентетрагидро-2H-пиран-2-ил)метил)-5-((S)-2,3-бис((триэтилсилил)окси)пропил)-4-метокситетрагидрофуран-3-ил)ацетат
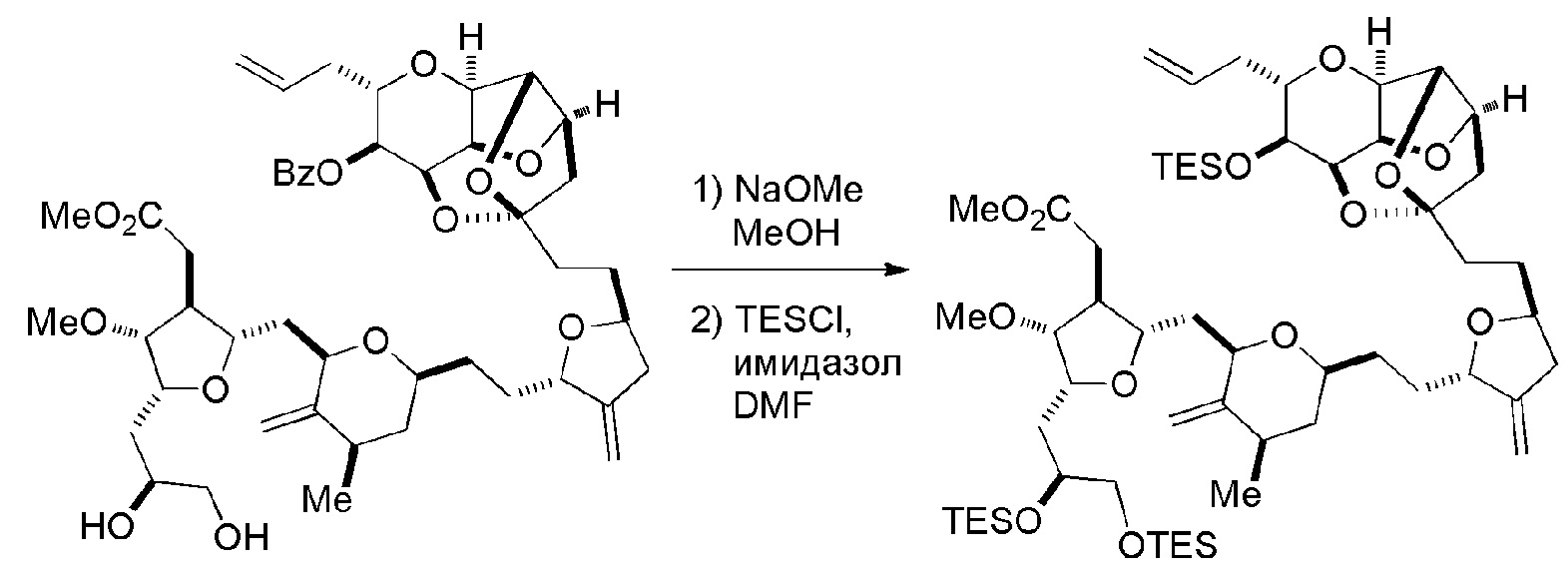
(3aR,4aR,5R,6S,7S,8aR,8bS)-7-аллил-2-(2-((2S,5S)-5-(2-((2S,4R,6R)-6-(((2S,3S,4R,5R)-5-((S)-2,3-дигидроксипропил)-4-метокси-3-(2-метокси-2-оксоэтил)тетрагидрофуран-2-ил)метил)-4-метил-5-метилентетрагидро-2H-пиран-2-ил)этил)-4-метилентетрагидрофуран-2-ил)этил)октагидро-2H-2,5-эпоксифуро[2',3':4,5]фуро[3,2-b]пиран-6-илбензоат (48,7 мг, 0,057 ммоль) растворяли в THF (1,5 мл) и охлаждали до 0 oC. Добавляли раствор метоксида натрия в метаноле (25% по массе, 17 мкл, 0,074 ммоль), и полученный в результате раствор перемешивали при температуре окружающей среды в течение 1 часа. Добавляли уксусную кислоту (6,54 мкл, 0,114 ммоль), и растворители удаляли потоком азота. Остаток азеотропно упаривали с толуолом и растворяли в DMF (1,5 мл) при температуре окружающей среды. К полученному в результате раствору добавляли имидазол (58,4 мг, 0,857 ммоль), хлортриэтилсилан (0,096 мл, 0,572 ммоль) и 4-диметиламинопиридин (7,0 мг, 0,057 ммоль). Полученную в результате смесь перемешивали при температуре окружающей среды в течение 2 дней, и затем обрабатывали насыщенным водным NaHCO3 (8%) (3,0 мл). Полученную в результате смесь экстрагировали дважды MTBE (12 мл). Объединенные органические слои промывали 30% водным NaCl (4,0 мл) и сушили над MgSO4. Фильтрование, с последующим концентрированием и очисткой колоночной хроматографией на силикагеле, применяя 10-33% градиент этилацетата в н-гептане в качестве элюента, давали 110 мг целевого продукта.
2-((2S,3S,4R,5R)-2-(((2R,4R,6S)-6-(2-((2S,5S)-5-(2-((2S,3aR,4aR,5R,6S,7S,8aR,8bS)-7-аллил-6-((триэтилсилил)окси)октагидро-2H-2,5-эпоксифуро[2',3':4,5]фуро[3,2-b]пиран-2-ил)этил)-3-метилентетрагидрофуран-2-ил)этил)-4-метил-3-метилентетрагидро-2H-пиран-2-ил)метил)-5-((S)-2,3-бис((триэтилсилил)окси)пропил)-4-метокситетрагидрофуран-3-ил)этан-1-ол
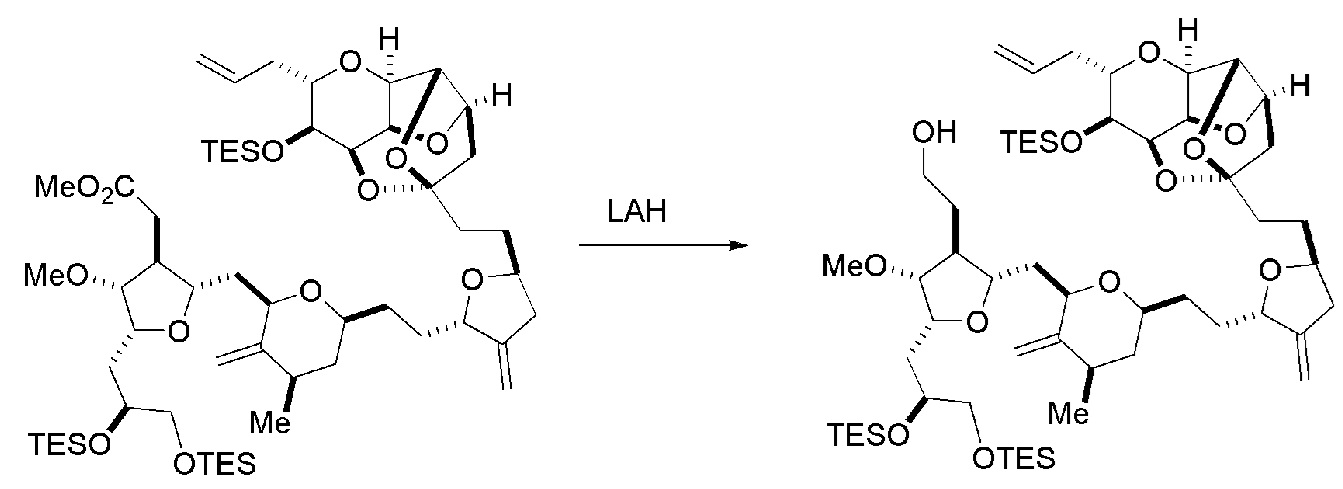
метил 2-((2S,3S,4R,5R)-2-(((2R,4R,6S)-6-(2-((2S,5S)-5-(2-((3aR,4aR,5R,6S,7S,8aR,8bS)-7-аллил-6-((триэтилсилил)окси)октагидро-2H-2,5-эпоксифуро[2',3':4,5]фуро[3,2-b]пиран-2-ил)этил)-3-метилентетрагидрофуран-2-ил)этил)-4-метил-3-метилентетрагидро-2H-пиран-2-ил)метил)-5-((S)-2,3-бис((триэтилсилил)окси)пропил)-4-метокситетрагидрофуран-3-ил)ацетат (110 мг) растворяли в THF (3,0 мл) и охлаждали до 0°C. Добавляли раствор литийалюмогидрида в THF (1,0 M, 0,11 мл, 0,11 ммоль), и полученный в результате раствор перемешивали в течение 30 минут. Добавляли насыщенный водный NH4Cl (27% по массе) (3,0 мл) и воду (1 мл), и полученную в результате смесь экстрагировали дважды MTBE (6 мл каждый раз). Объединенные органические слои промывали 30% водным NaCl (4,0 мл) и сушили над MgSO4. Фильтрование, с последующим концентрированием и очисткой колоночной хроматографией на силикагеле, применяя 25-50% градиент этилацетата в н-гептане в качестве элюента, давали 26,6 мг целевого продукта.
1H ЯМР (400 МГц, CDCl3) δ ppm 0,56-0,65 (м, 18 H) 0,91-0,99 (м, 27 H) 1,07 (д, J=6,2 Гц, 3 H) 1,46-1,83 (м, 12 H) 1,89-2,17 (м, 8 H) 2,20-2,31 (м, 2 H) 2,51-2,59 (м, 1 H) 2,60-2,69 (м, 1 H) 3,22 (дд, J=9,4, 2,3 Гц, 1 H) 3,30 (с, 3 H) 3,45 (дд, J=4,3, 3,1 Гц, 1 H) 3,50-3,62 (м, 3 H) 3,68-3,78 (м, 3 H) 3,78-3,84 (м, 1 H) 3,84-3,90 (м, 1 H) 3,90-3,96 (м, 1 H) 3,97-4,05 (м, 2 H) 4,18 (дд, J=6,6, 4,7 Гц, 1 H) 4,29 (дд, J=4,1, 2,1 Гц, 1 H) 4,30-4,36 (м, 1 H) 4,37-4,43 (м, 1 H) 4,58 (т, J=4,5 Гц, 1 H) 4,66 (т, J=4,7 Гц, 1 H) 4,79-4,80 (м, 1 H) 4,83 (д, J=2,0 Гц, 1 H) 4,88 (с, 1 H) 4,96 (д, J=2,0 Гц, 1 H) 5,07 (д, J=10,2 Гц, 1 H) 5,14 (д, J=1,2 Гц, 1 H) 5,91 (дддд, J=17,3, 10,1, 7,7, 5,9 Гц, 1 H)
2-((2S,3S,4R,5R)-2-(((2R,4R,6S)-6-(2-((2S,5S)-5-(2-((3aR,4aR,5R,6S,7S,8aR,8bS)-7-аллил-6-((триэтилсилил)окси)октагидро-2H-2,5-эпоксифуро[2',3':4,5]фуро[3,2-b]пиран-2-ил)этил)-3-метилентетрагидрофуран-2-ил)этил)-4-метил-3-метилентетрагидро-2H-пиран-2-ил)метил)-5-((S)-2,3-бис((триэтилсилил)окси)пропил)-4-метокситетрагидрофуран-3-ил)ацетальдегид
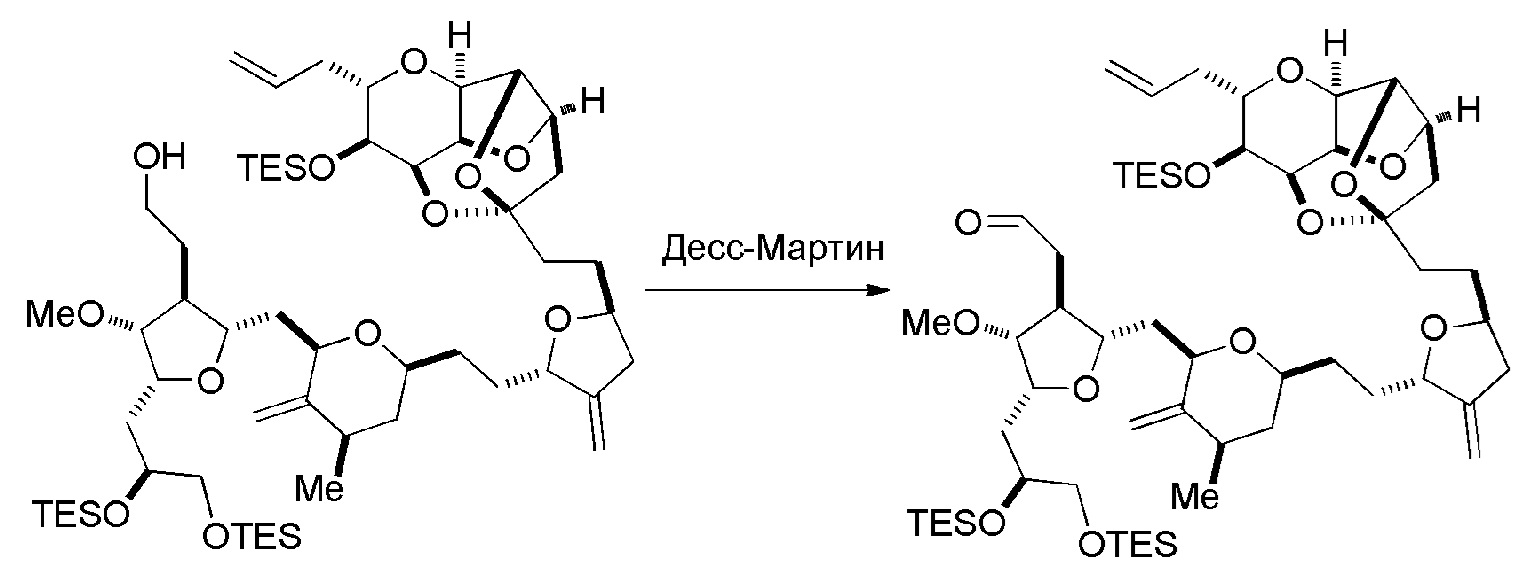
К раствору 2-((2S,3S,4R,5R)-2-(((2R,4R,6S)-6-(2-((2S,5S)-5-(2-((3aR,4aR,5R,6S,7S,8aR,8bS)-7-аллил-6-((триэтилсилил)окси)октагидро-2H-2,5-эпоксифуро[2',3':4,5]фуро[3,2-b]пиран-2-ил)этил)-3-метилентетрагидрофуран-2-ил)этил)-4-метил-3-метилентетрагидро-2H-пиран-2-ил)метил)-5-((S)-2,3-бис((триэтилсилил)окси)пропил)-4-метокситетрагидрофуран-3-ил)этанола (13,3 мг, 0,013 ммоль) в дихлорметане (1,0 мл) при температуре окружающей среды добавляли бикарбонат натрия (10,5 мг, 0,125 ммоль) и периодинан Десс-Мартина (26,5 мг, 0,063 ммоль). После перемешивания в течение 40 минут, реакционную смесь обрабатывали MTBE (6,0 мл), водой (3,0 мл) и тиосульфатом натрия (15,82 мг, 0,10 ммоль). После 10 минут перемешивания, слои разделяли, и органический слой промывали дважды 30% водным NaCl (2,0 мл) и сушили над MgSO4. Концентрирование в вакууме давало 12 мг целевого продукта.
1-((2S,3S,4R,5R)-2-(((2R,4R,6S)-6-(2-((2S,5S)-5-(2-((3aR,4aR,5R,6S,7S,8aR,8bS)-7-аллил-6-((триэтилсилил)окси)октагидро-2H-2,5-эпоксифуро[2',3':4,5]фуро[3,2-b]пиран-2-ил)этил)-3-метилентетрагидрофуран-2-ил)этил)-4-метил-3-метилентетрагидро-2H-пиран-2-ил)метил)-5-((S)-2,3-бис((триэтилсилил)окси)пропил)-4-метокситетрагидрофуран-3-ил)пент-4-ен-2-ол
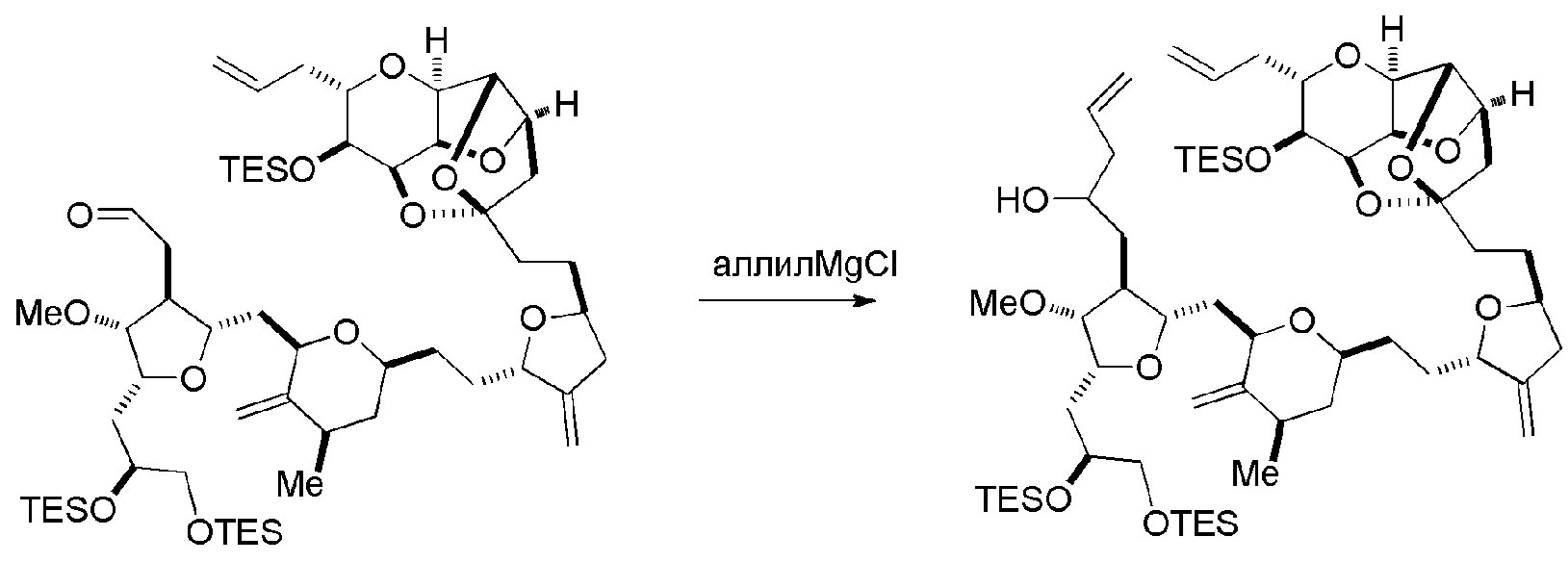
2-((2S,3S,4R,5R)-2-(((2R,4R,6S)-6-(2-((2S,5S)-5-(2-((3aR,4aR,5R,6S,7S,8aR,8bS)-7-аллил-6-((триэтилсилил)окси)октагидро-2H-2,5-эпоксифуро[2',3':4,5]фуро[3,2-b]пиран-2-ил)этил)-3-метилентетрагидрофуран-2-ил)этил)-4-метил-3-метилентетрагидро-2H-пиран-2-ил)метил)-5-((S)-2,3-бис((триэтилсилил)окси)пропил)-4-метокситетрагидрофуран-3-ил)ацетальдегид (12 мг, 0,011 ммоль) растворяли в THF (1,0 мл) и охлаждали до 0°C. Добавляли раствор хлорида аллилмагния в THF (2,0 M, 0,017 мл, 0,034 ммоль). Полученный в результате раствор перемешивали в течение 20 минут, и затем обрабатывали насыщенным водным NH4Cl (27% по массе) (3,0 мл). Полученную в результате смесь экстрагировали MTBE (10 мл). Органический слой промывали дважды 30% водным NaCl (2,0 мл), сушили над MgSO4, фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле, применяя 20-33% градиент этилацетата в н-гептане в качестве элюента, получая 11,7 мг целевого продукта.
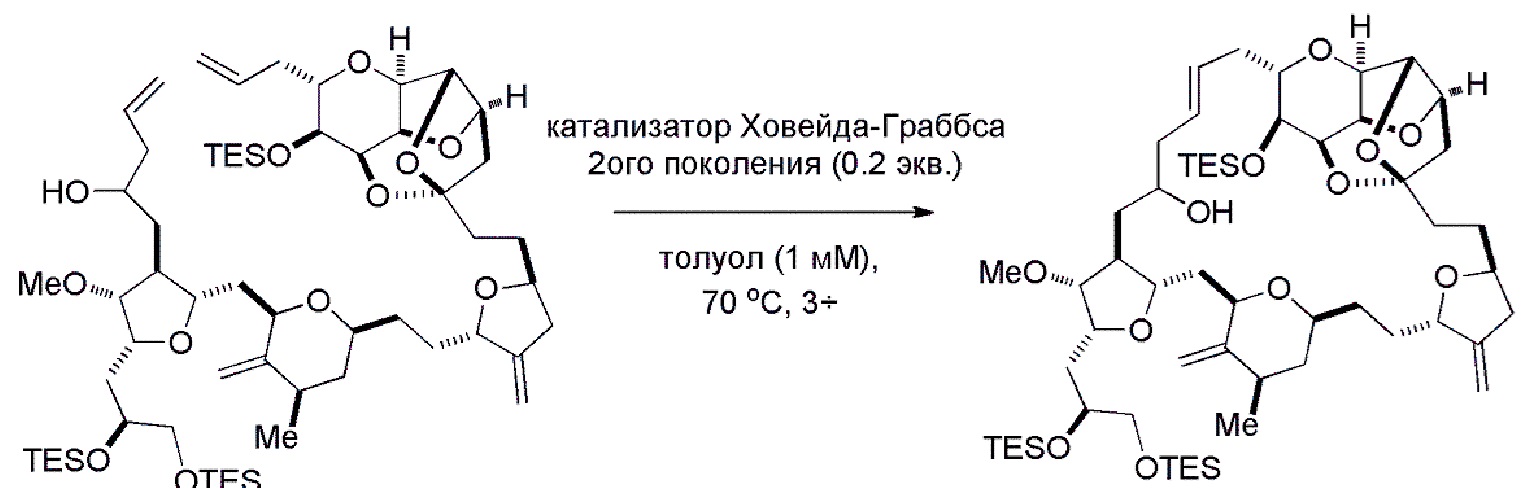
1-((2S,3S,4R,5R)-2-(((2R,4R,6S)-6-(2-((2S,5S)-5-(2-((3aR,4aR,5R,6S,7S,8aR,8bS)-7-аллил-6-((триэтилсилил)окси)октагидро-2H-2,5-эпоксифуро[2',3':4,5]фуро[3,2-b]пиран-2-ил)этил)-3-метилентетрагидрофуран-2-ил)этил)-4-метил-3-метилентетрагидро-2H-пиран-2-ил)метил)-5-((S)-2,3-бис((триэтилсилил)окси)пропил)-4-метокситетрагидрофуран-3-ил)пент-4-ен-2-ол (11,7 мг, 10,60 мкмоль) растворяли в толуоле (10 мл) и нагревали до 50°C. Добавляли катализатор Ховейда-Граббса 2ого поколения (1,333 мг, 2,12 мкмоль), и полученный в результате раствор перемешивали в течение 3 часов при температуре 68-73°C. Реакционную смесь охлаждали до температуры окружающей среды и очищали колоночной хроматографией на силикагеле, применяя 20-33% градиент этилацетата в н-гептане в качестве элюента, получая 7,7 мг целевого продукта. 1H ЯМР (400 МГц, CDCl3) δ ppm 0,56-0,68 (м, 18 H) 0,85-1,02 (м, 27 H) 1,08 (д, J=6,2 Гц, 3 H) 1,28-2,35 (м, 23 H) 2,39-2,84 (м, 3 H) 3,17 (ддд, J=9,5, 5,6, 2,1 Гц, 1 H) 3,31 (с, 3 H) 3,41-3,64 (м, 4 H) 3,65-4,07 (м, 6 H) 4,17 (д, J=6,6 Гц, 1 H) 4,28 (дд, J=4,1, 2,1 Гц, 1 H) 4,31-4,41 (м, 3 H) 4,56-4,69 (м, 2 H) 4,79 (с, 1 H) 4,83 (уш.с, 1 H) 4,92 (с, 1 H) 4,96 (д, J=2,3 Гц, 1 H) 5,45-5,61 (м, 1 H) 5,62-5,76 (м, 1 H)
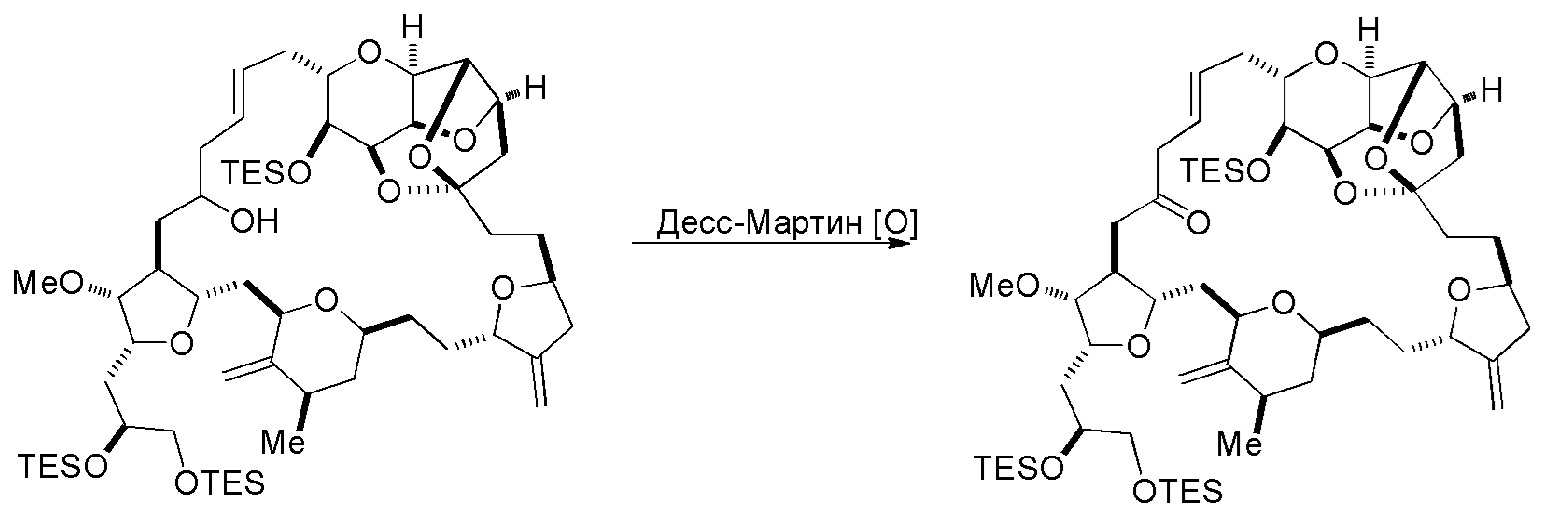
Исходное соединение (7,7 мг, 7,158 мкмоль) растворяли в дихлорметане (0,70 мл) и обрабатывали бикарбонатом натрия (6,01 мг, 0,072 ммоль) и периодинаном Десс-Мартина (12,14 мг, 0,029 ммоль). После перемешивания при температуре окружающей среды в течение 1 часа, реакционную смесь разбавляли MTBE (5,0 мл) и водой (3,0 мл). Добавляли тиосульфат натрия (11,32 мг, 0,072 ммоль), и полученную в результате смесь перемешивали в течение 20 минут. Слои разделяли, и органический слой промывали 30% по массе водным NaCl (1,0 мл) и сушили над MgSO4. Фильтрование, с последующим концентрированием и очисткой колоночной хроматографией на силикагеле, применяя н-гептан/этилацетат (2/1) в качестве элюента, давали 6,8 мг целевого продукта в виде пленки.
1H ЯМР (400 МГц, CDCl3) δ ppm 0,55-0,65 (м, 18 H) 0,91-1,02 (м, 27 H) 1,08 (д, J=6,6 Гц, 3 H) 1,40-2,33 (м, 20 H) 2,49-2,67 (м, 4 H) 3,03 (дд, J=15,6, 7,8 Гц, 1 H) 3,08-3,14 (м, 1 H) 3,16 (дд, J=9,4, 2,0 Гц, 1 H) 3,30 (д, J=3,1 Гц, 1 H) 3,35 (с, 3 H) 3,44-3,57 (м, 3 H) 3,73-3,87 (м, 3 H) 3,87-3,94 (м, 1 H) 3,97-4,00 (м, 1 H) 4,18 (дд, J=6,6, 4,3 Гц, 1 H) 4,29 (дд, J=4,1, 2,1 Гц, 1 H) 4,32-4,44 (м, 3 H) 4,59-4,66 (м, 2 H) 4,79 (с, 1 H) 4,83 (с, 1 H) 4,91 (с, 1 H) 4,98 (с, 1 H) 5,57 (дт, J=15,2, 7,0 Гц, 1 H) 5,69 (дт, J=14,8, 6,2 Гц, 1 H)
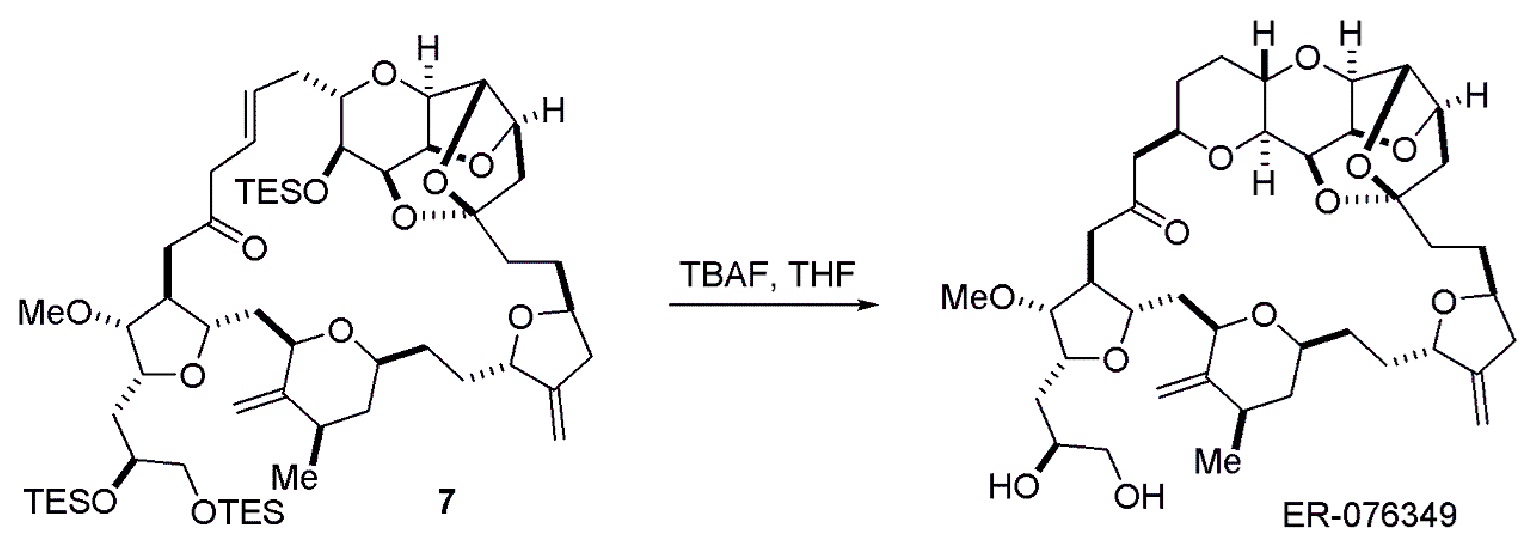
К раствору соединения 7 (3,4 мг, 3,167 мкмоль) в THF (0,5 мл) при температуре окружающей среды добавляли TBAF (1,0 M, 0,025 мл, 0,025 ммоль). Полученный в результате раствор перемешивали в течение 25 часов при температуре окружающей среды, и затем очищали колоночной хроматографией на силикагеле, применяя 0-100% градиент ацетонитрила в этилацетате в качестве элюента, получая 1,6 мг целевого продукта. Структуру подтверждали сравнением 1H ЯМР спектра со спектром аутентичного образца.
1H ЯМР (400 МГц, CDCl3) δ ppm 1,10 (д, J=6,6 Гц, 1 H) 1,19-1,83 (м, 8 H) 1,92-2,36 (м, 12 H) 2,39-2,58 (м, 3 H) 2,72 (дд, J=16,0, 9,8 Гц, 1 H) 2,82-2,92 (м, 2 H) 2,94-3,02 (м, 1 H) 3,29 (д, J=3,1 Гц, 1 H) 3,44 (с, 3 H) 3,51-3,69 (м, 4 H) 3,86 (дт, J=9,0, 3,1 Гц, 1 H) 3,89-3,99 (м, 3 H) 4,03 (дд, J=6,3, 4,3 Гц, 1 H) 4,08-4,16 (м, 1 H) 4,19 (дд, J=6,6, 4,7 Гц, 1 H) 4,26-4,41 (м, 3 H) 4,61 (т, J=4,7 Гц, 1 H) 4,69 (т, J=4,3 Гц, 1 H) 4,82 (д, J=1,6 Гц, 1 H) 4,89 (уш.с, 1 H) 4,93 (уш с, 1 H) 5,07 (д, J=2,0 Гц, 1 H)
Пример 5: Получение соединения формулы (ID) через C.2-C.3 макроциклизацию
Метил 2-((2S,3S,4R,5R)-5-((S)-2,3-бис((триэтилсилил)окси)пропил)-2-(((2R,4R,6S)-6-(2-((2S,5S)-5-(2-((2S,3aR,4aR,5R,6S,7S,8aR,8bS)-7-(3-гидроксипропил)-6-((триэтилсилил)окси)октагидро-2H-2,5-эпоксифуро[2',3':4,5]фуро[3,2-b]пиран-2-ил)этил)-3-метилентетрагидрофуран-2-ил)этил)-4-метил-3-метилентетрагидро-2H-пиран-2-ил)метил)-4-метокситетрагидрофуран-3-ил)ацетат
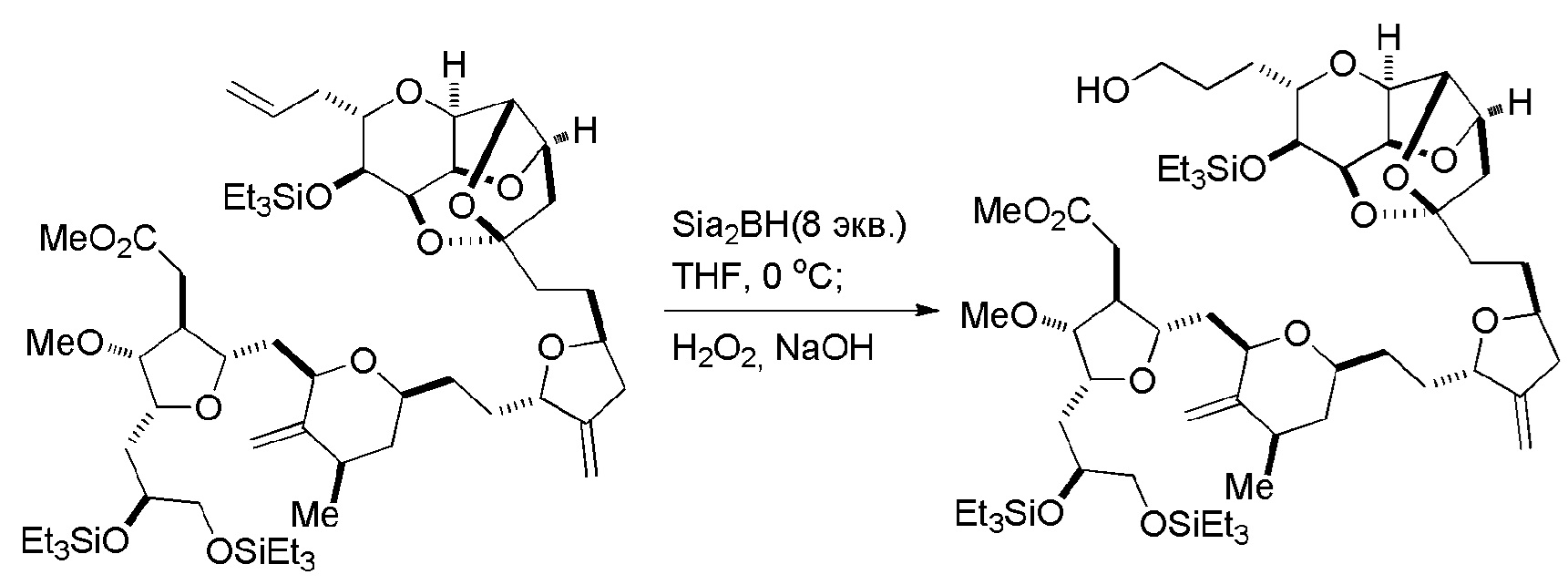
К раствору метил 2-((2S,3S,4R,5R)-2-(((2R,4R,6S)-6-(2-((2S,5S)-5-(2-((3aR,4aR,5R,6S,7S,8aR,8bS)-7-аллил-6-((триэтилсилил)окси)октагидро-2H-2,5-эпоксифуро[2',3':4,5]фуро[3,2-b]пиран-2-ил)этил)-3-метилентетрагидрофуран-2-ил)этил)-4-метил-3-метилентетрагидро-2H-пиран-2-ил)метил)-5-((S)-2,3-бис((триэтилсилил)окси)пропил)-4-метокситетрагидрофуран-3-ил)ацетата (10 мг, 9,16 мкмоль) в THF (0,2 мл) добавляли свежеприготовленный раствор диизоамилборана в THF (0,45 M, 0,041 мл, 0,018 ммоль) при 0°C. Полученный в результате раствор нагревали до температуры окружающей среды. Через 1 час, 2 часа и 4 часа, добавляли дополнительный раствор диизоамилборана (каждый раз 40 мкл). После перемешивания в течение 2 часов, реакционную смесь разбавляли MTBE (1,0 мл) и охлаждали до 0°C. Добавляли 3M гидроксид натрия (0,10 мл, 0,30 ммоль) и 30% пероксид водорода (0,10 мл, 0,979 ммоль). Полученную в результате смесь перемешивали при температуре окружающей среды в течение 2 часов и обрабатывали насыщенным водным раствором NH4Cl (2 мл) и MTBE (2 мл). Слои разделяли, и водный слой экстрагировали MTBE (3 мл). Объединенные органические слои промывали насыщенным водным NaHSO3 (1 мл) и 30% водным NaCl (1 мл) и сушили над MgSO4. Фильтрование, с последующим концентрированием в вакууме и очисткой колоночной хроматографией на силикагеле, применяя 20-33% градиент этилацетата в н-гептане в качестве элюента, давали 3,6 мг целевого продукта.
1H ЯМР (400 МГц, CDCl3) δ ppm 0,53-0,66 (м, 18 H) 0,91-0,99 (м, 27 H) 1,08 (д, J=6,6 Гц, 3 H) 1,17-1,24 (м, 1 H) 1,36 (м, 2 H) 1,65-1,85 (м, 9 H) 1,88-2,03 (м, 6 H) 2,14 (д, J=12,9 Гц, 2 H) 2,21-2,32 (м, 3 H) 2,35 (м, 1 H) 2,40 (м, 1 H) 2,59-2,69 (м, 1 H) 3,19 (дд, J=9,6, 2,1 Гц, 1 H) 3,29 (с, 3 H) 3,43 (д, J=3,5 Гц, 1 H) 3,49 (дд, J=10,2, 5,1 Гц, 2 H) 3,56 (дд, J=10,9, 6,6 Гц, 1 H) 3,62-3,69 (м, 2 H) 3,69-3,72 (м, 4 H) 3,78 (дд, J=9,0, 4,7 Гц, 1 H) 3,80-3,90 (м, 3 H) 3,97-4,06 (м, 2 H) 4,18 (дд, J=6,8, 4,5 Гц, 1 H) 4,24-4,31 (м, 2 H) 4,34-4,41 (м, 1 H) 4,57 (т, J=4,7 Гц, 1 H) 4,68 (т, J=4,7 Гц, 1 H) 4,80 (с, 1 H) 4,82 (с, 1 H) 4,87 (с, 1 H) 4,96 (д, J=2,0 Гц, 1 H).
диметил (3-((2S,3S,4R,5R)-5-((S)-2,3-бис((триэтилсилил)окси)пропил)-2-(((2R,4R,6S)-6-(2-((2S,5S)-5-(2-((2S,3aR,4aR,5R,6S,7S,8aR,8bS)-7-(3-гидроксипропил)-6-((триэтилсилил)окси)октагидро-2H-2,5-эпоксифуро[2',3':4,5]фуро[3,2-b]пиран-2-ил)этил)-3-метилентетрагидрофуран-2-ил)этил)-4-метил-3-метилентетрагидро-2H-пиран-2-ил)метил)-4-метокситетрагидрофуран-3-ил)-2-оксопропил)фосфонат
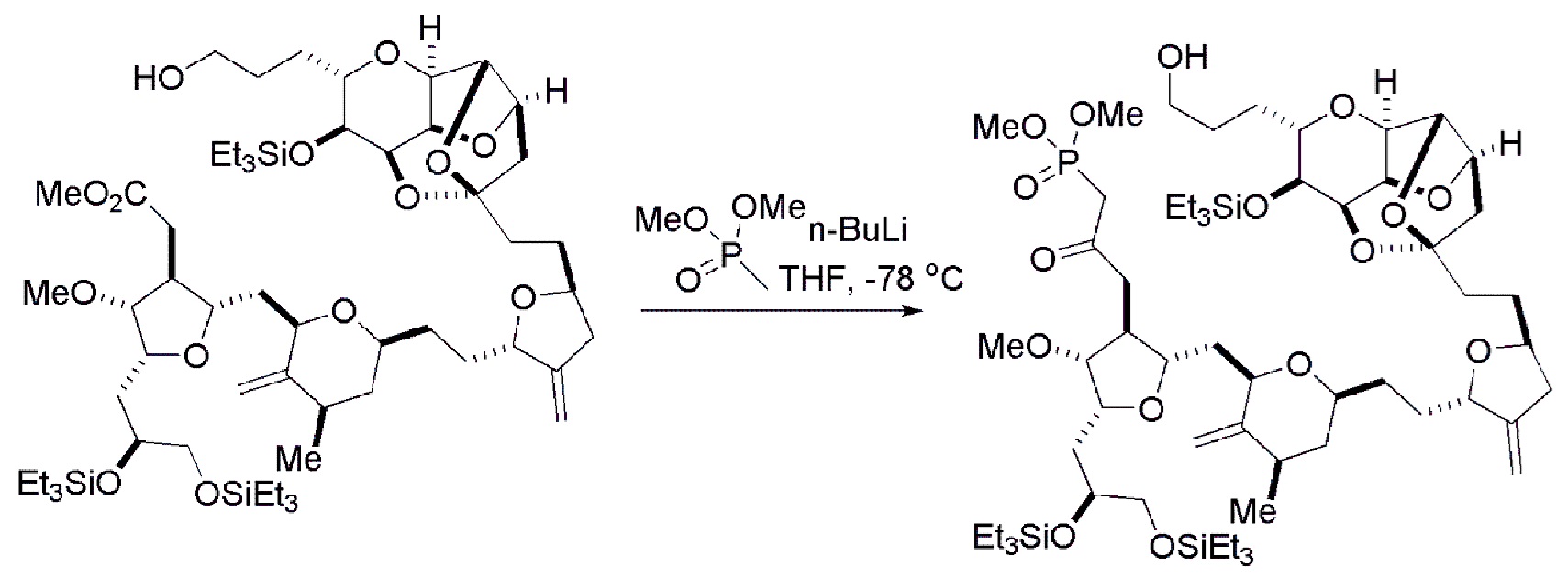
К раствору диметилметилфосфоната (11 мкл, 0,097 ммоль) в THF (0,50 мл) добавляли н-BuLi (1,6 M, 0,061 мл, 0,097 ммоль) при -78°C, и полученный в результате раствор перемешивали в течение 40 минут при -78°C. Затем, добавляли раствор метил 2-((2S,3S,4R,5R)-5-((S)-2,3-бис((триэтилсилил)окси)пропил)-2-(((2R,4R,6S)-6-(2-((2S,5S)-5-(2-((3aR,4aR,5R,6S,7S,8aR,8bS)-7-(3-гидроксипропил)-6-((триэтилсилил)окси)октагидро-2H-2,5-эпоксифуро[2',3':4,5]фуро[3,2-b]пиран-2-ил)этил)-3-метилентетрагидрофуран-2-ил)этил)-4-метил-3-метилентетрагидро-2H-пиран-2-ил)метил)-4-метокситетрагидрофуран-3-ил)ацетата (3,6 мг, 3,244 мкмоль) в THF (0,50 мл). Реакционную смесь перемешивали в течение 1,5 часов при -78°C и обрабатывали насыщенным водным раствором NH4Cl (2 мл). Полученную в результате смесь разбавляли этилацетатом (2 мл) и нагревали до температуры окружающей среды. Слои разделяли, и водный слой экстрагировали этилацетатом (5 мл). Объединенные органические слои сушили над MgSO4, фильтровали, концентрировали и очищали колоночной хроматографией на силикагеле, применяя гептан/EtOAc (1/1), EtOAc, EtOAc/MeCN (1/1) и DCM/MeOH (10/1) в качестве элюентов, получая 1 мг целевого продукта.
MS m/z 1202,2 [M+H]+, 1203,2, 1204,2. 1H ЯМР (400 МГц, CDCl3) δ ppm 0,55-0,66 (м, 18 H) 0,92-0,99 (м, 27 H) 1,07 (д, J=6,6 Гц, 3 H) 1,15-2,18 (м, 22 H) 2,20-2,30 (м, 1 H) 2,64-2,70 (м, 1 H) 3,07 (д, J=9,8 Гц, 1 H) 3,13 (д, J=9,8 Гц, 1 H) 3,16-3,24 (м, 1 H) 3,33 (дд, J=10,2, 3,5 Гц, 1 H) 3,33 (с, 3 H) 3,48-3,59 (м, 4 H) 3,63-3,72 (м, 2 H) 3,73-3,88 (м, 4 H) 3,77-3,79 (м, 3 H) 3,81 (с, 3 H) 3,99-4,06 (м, 2 H) 4,16-4,21 (м, 1 H) 4,26-4,31 (м, 2 H) 4,34-4,40 (м, 1 H) 4,57 (т, J=4,3 Гц, 1 H) 4,68 (т, J=4,7 Гц, 1 H) 4,79 (с, 1 H) 4,84 (уш с, 1 H) 4,86 (с, 1 H) 4,97 (уш с, 1 H)
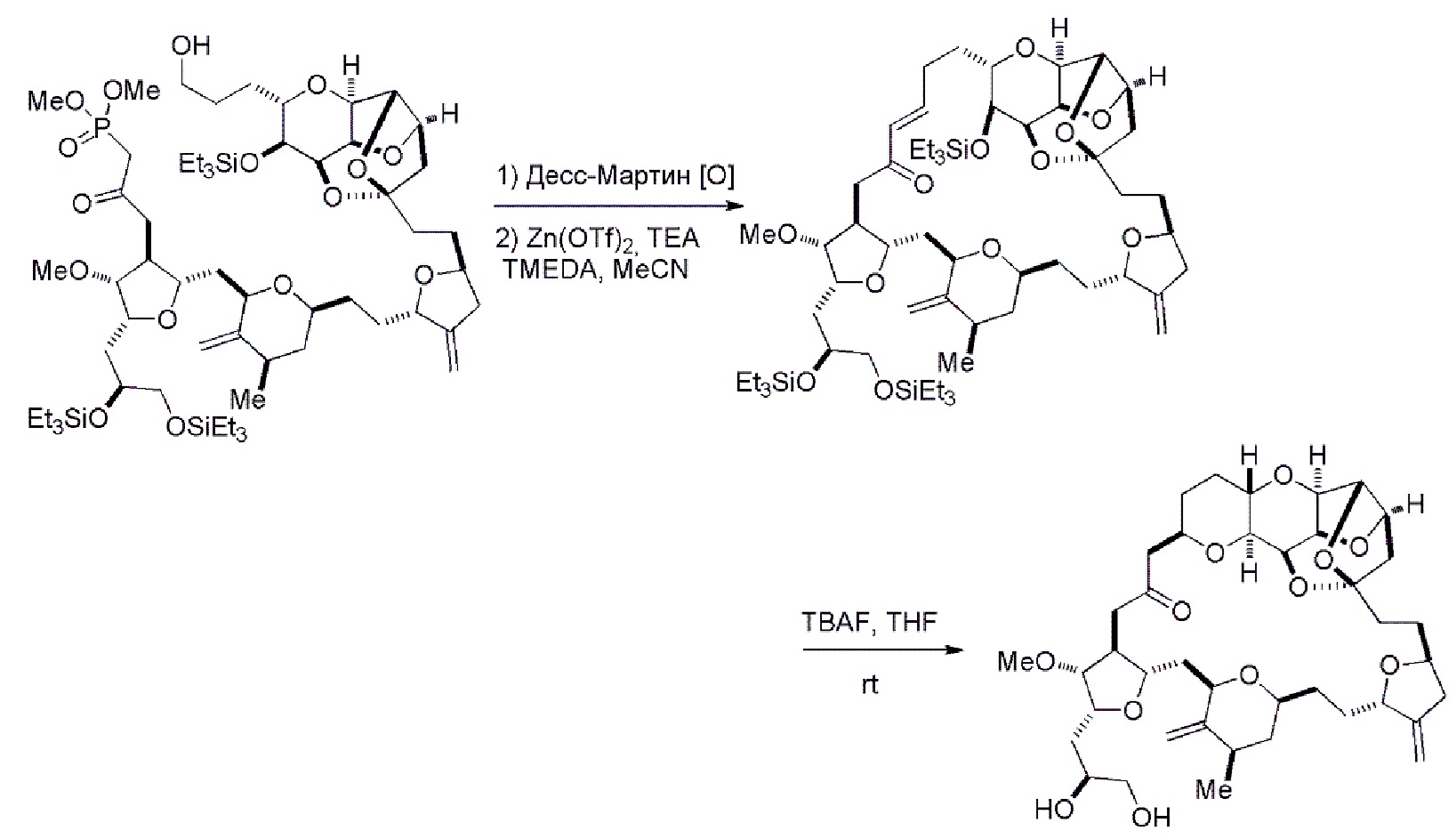
Диметил (3-((2S,3S,4R,5R)-5-((S)-2,3-бис((триэтилсилил)окси)пропил)-2-(((2R,4R,6S)-6-(2-((2S,5S)-5-(2-((3aR,4aR,5R,6S,7S,8aR,8bS)-7-(3-гидроксипропил)-6-((триэтилсилил)окси)октагидро-2H-2,5-эпоксифуро[2',3':4,5]фуро[3,2-b]пиран-2-ил)этил)-3-метилентетрагидрофуран-2-ил)этил)-4-метил-3-метилентетрагидро-2H-пиран-2-ил)метил)-4-метокситетрагидрофуран-3-ил)-2-оксопропил)фосфонат (1 мг, 0,832 мкмоль) растворяли в дихлорметане и обрабатывали бикарбонатом натрия (1,4 мг, 0,017 ммоль) и периодинаном Десс-Мартина (3,5 мг, 8,3 мкмоль) при температуре окружающей среды. Через 2 часа, реакционную смесь разбавляли MTBE (1 мл) и водой (0,5 мл). Добавляли тиосульфат натрия (3 мг), и полученную в результате смесь перемешивали в течение 20 минут при температуре окружающей среды. Слои разделяли, и водный слой экстрагировали EtOAc (2 мл). Объединенные органические слои сушили над MgSO4 и концентрировали в вакууме. Остаток разбавляли толуолом и фильтровали через слой силикагеля, который, затем, промывали EtOAc. Фильтрат концентрировали в вакууме, и полученный в результате остаток растворяли в THF(1,0 мл). Добавляли суспензию трифторметансульфоната цинка (2,4 мг, 0,0067 ммоль), TEA (3 мкл, 0,020 ммоль) и TMEDA (0,5 мкл, 0,0033 ммоль) в THF (2 мл). Полученную в результате реакционную смесь перемешивали при температуре окружающей среды в течение 1 дня и обрабатывали MTBE (6 мл) и 30% водным NaCl (2 мл). Органический слой отделяли и промывали 30% водным NaCl (1,5 мл). Сушка, фильтрование и концентрирование в вакууме давали целевой продукт. MS m/z 1073,6 [M+H]+. Неочищенный макроциклический продукт растворяли в THF (0,5 мл) при температуре окружающей среды и обрабатывали 1,0 M TBAF в THF (0,020 мл, 0,02 ммоль). После перемешивания при температуре окружающей среды в течение ночи, образование целевого продукта подтверждали LCMS анализом с аутентичным образцом (время удерживания и MS данные). MS m/z 731,6 [M+H]+, 753,6 [M+Na]+.
Пример 6: Получение соединения формулы (VIIB)
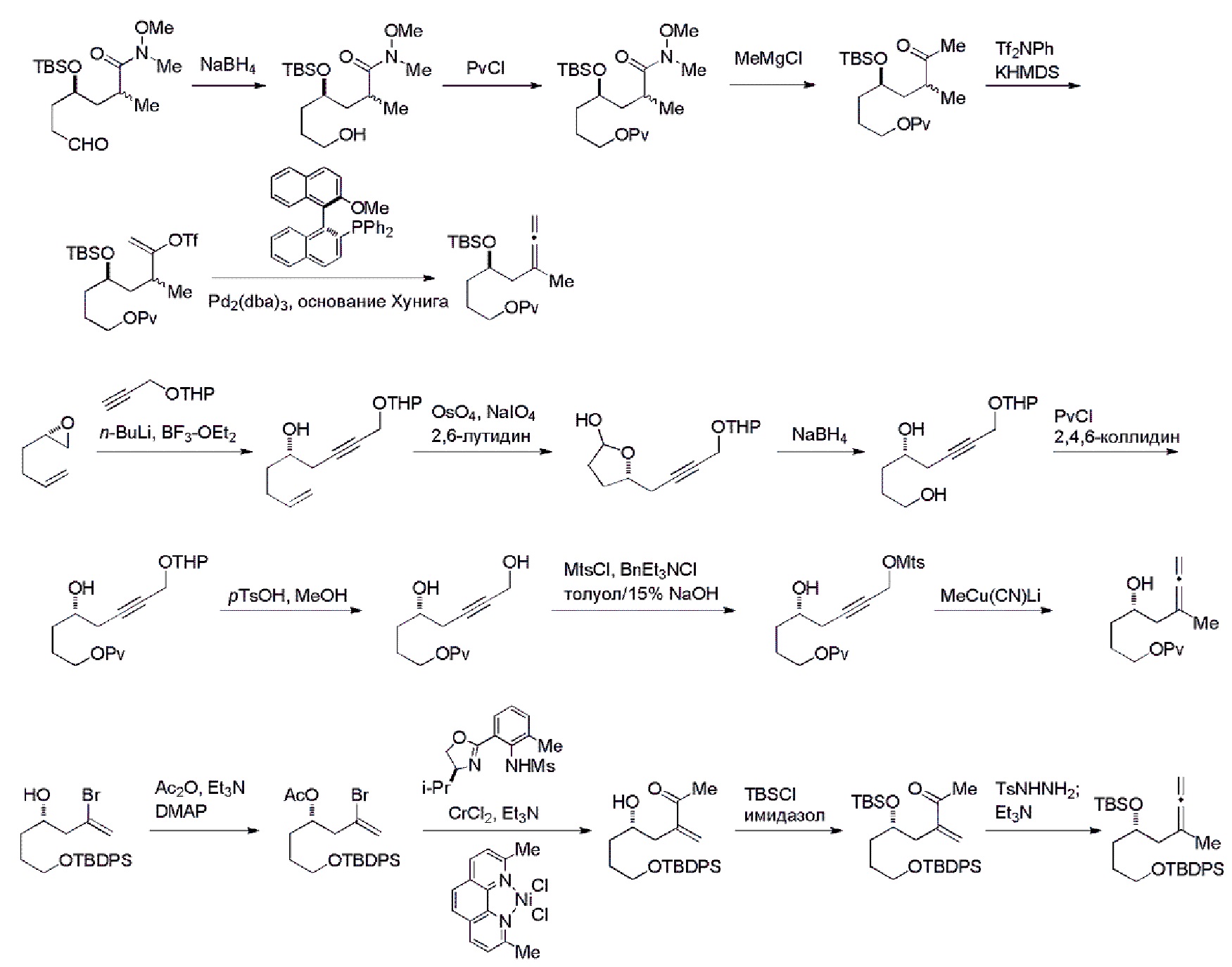
(4R)-4-((трет-бутилдиметилсилил)окси)-7-гидрокси-N-метокси-N,2-диметилгептанамид
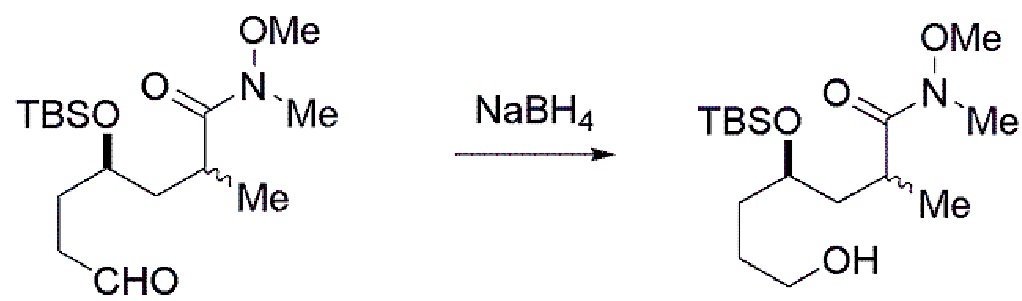
Раствор (4R)-4-((трет-бутилдиметилсилил)окси)-N-метокси-N,2-диметил-7-оксогептанамида (27 г, 81,4 ммоль) в метаноле (203 мл) охлаждали до 0°C и обрабатывали NaBH4 (1,54 г, 40,7 ммоль), который добавляли порциями в течение 30 минут, поддерживая температуру внутри реактора ниже 10°C. Реакционную смесь перемешивали при 0°C в течение 2 часов и гасили насыщенным водным NH4Cl (67,5 мл). После перемешивания при комнатной температуре в течение 20 минут, смесь разбавляли MTBE (189 мл). Органический слой отделяли, и водный слой экстрагировали MTBE (50 мл). Органические слои объединяли, промывали соляным раствором (47,3 мл) и концентрировали в вакууме. Остаток фильтровали через слой силикагеля (приблизительно 40 г), который промывали этилацетатом/н-гептаном=1/1 (300 мл). Фильтрат концентрировали в вакууме, получая заявленное в заголовке соединение (26 г, 96%). 1H ЯМР (400 МГц, CDCl3) δ 0,02 (с, 6H), 0,86 (с, 9H), 1,12 (д, 3H), 1,42-1,68 (м, 6H), 1,96 (м, 1H), 3,18 (с, 3H), 3,62 (м, 2H), 3,69 (с, 3H), 3,75 (м, 1H).
(4R)-4-((трет-бутилдиметилсилил)окси)-7-(метокси(метил)амино)-6-метил-7-оксогептилпивалат
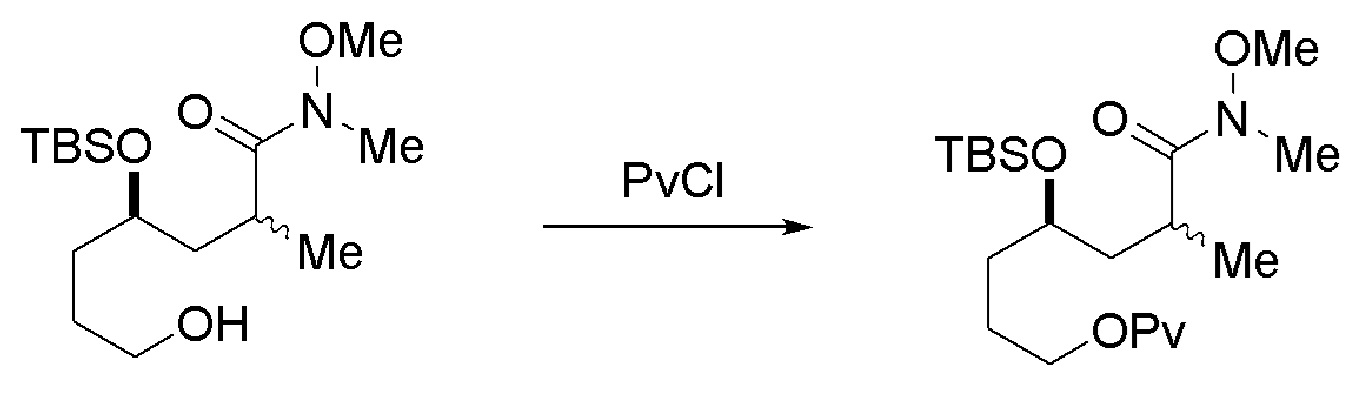
Раствор (4R)-4-((трет-бутилдиметилсилил)окси)-7-гидрокси-N-метокси-N,2-диметилгептанамида (26 г, 78,0 ммоль) в CH2Cl2 (130 мл) охлаждали до 0°C и обрабатывали триэтиламином (19,56 мл, 140,3 ммоль), TMEDA (1,18 мл, 7,80 ммоль) и пивалоилхлоридом (PvCl) (10,6 мл, 85,8 ммоль). После перемешивания при комнатной температуре в течение 15 часов, смесь обрабатывали PvCl (0,96 мл, 7,8 ммоль) и триэтиламином (5,43 мл, 39,0 ммоль) и перемешивали при комнатной температуре в течение следующих 5 часов. Реакцию гасили водой (260 мл). Органический слой отделяли, и водный слой экстрагировали MTBE (260 мл). Органические слои объединяли, промывали соляным раствором и сушили над MgSO4, получая заявленное в заголовке соединение (32,07 г, 99%). 1H ЯМР (400 МГц, CDCl3) δ 0,02 (с, 6H), 0,86 (с, 9H), 1,12 (д, 3H), 1,18 (с, 9H), 1,40-1,55 (м, 4H), 1,68 (м, 2H), 1,92 (м, 1H), 3,17 (с, 3H), 3,69 (м, 4H), 4,03 (т, 2H).
(4R)-4-((трет-бутилдиметилсилил)окси)-6-метил-7-оксооктилпивалат
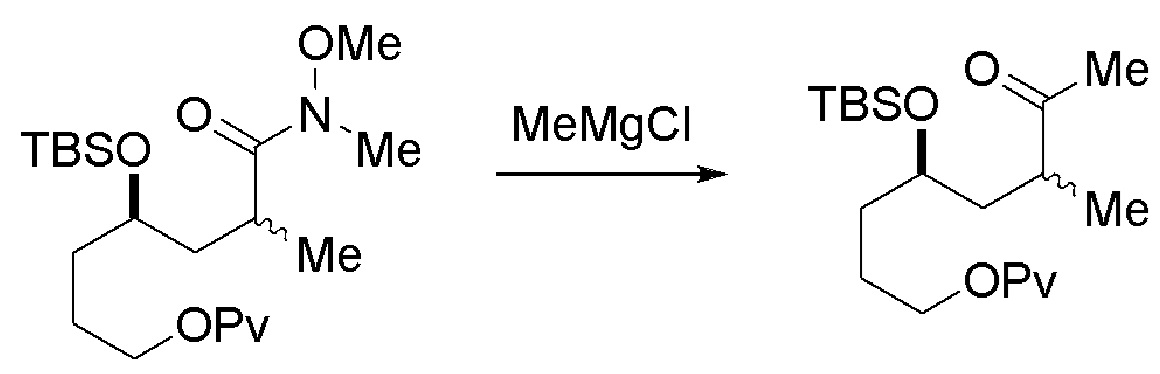
Раствор (4R)-4-((трет-бутилдиметилсилил)окси)-7-(метокси(метил)амино)-6-метил-7-оксогептилпивалата (32,07 г, 76,79 ммоль) в THF (96 мл) охлаждали до -20°C и обрабатывали 3 M MeMgCl в THF (30,7 мл, 92,1 ммоль) в течение 10 минут, поддерживая температуру внутри реактора ниже -10°C. Смесь нагревали до 0°C в течение 2 часов и перемешивали при 0°C в течение 13 часов. Добавляли дополнительный 3 M MeMgCl в THF (5,12 мл, 15,4 ммоль), и перемешивание продолжали при 0°C в течение следующих 5 часов. Реакцию гасили насыщенным водным NH4Cl (80 мл) и экстрагировали дважды MTBE (96 мл). Органические слои объединяли, сушили над MgSO4 и концентрировали в вакууме, получая заявленное в заголовке соединение (28,64 г, 100%). 1H ЯМР (400 МГц, CDCl3) δ 0,02 (с, 6H), 0,86 (с, 9H), 1,10 (д, 3H), 1,19 (с, 9H), 1,34 (м, 1H), 1,50 (м, 2H), 1,64 (м, 2H), 1,88 (м, 1H), 2,13 (с, 3H), 2,68 (м, 1H), 3,68 (м, 1H), 4,03 (т, 2H).
(4R)-4-((трет-бутилдиметилсилил)окси)-6-метил-7-(((трифторметил)сульфонил)окси)окт-7-ен-1-илпивалат
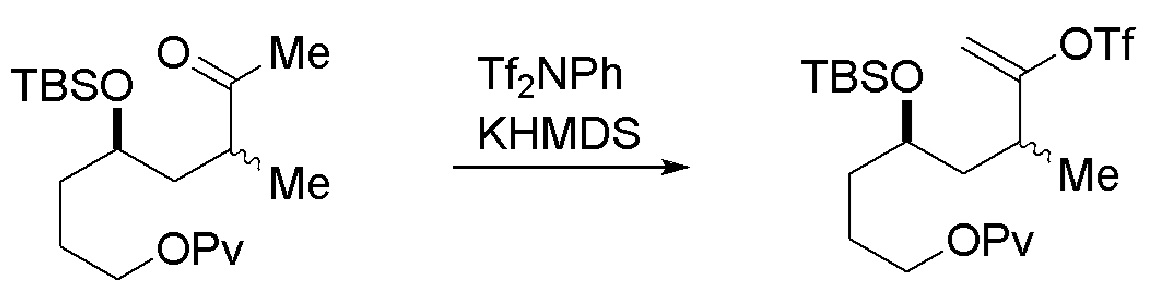
Смесь (4R)-4-((трет-бутилдиметилсилил)окси)-6-метил-7-оксооктилпивалата (15,0 г, 40,3 ммоль) и 1,1,1-трифтор-N-фенил-N-(трифторметил)сульфонилметансульфамида (21,6 г, 60,4 ммоль) в THF (150 мл) охлаждали до -20°C и обрабатывали 0,5 M KHMDS в толуоле (105 мл, 52,3 ммоль) в течение 20 минут, поддерживая температуру внутри реактора ниже -20°C. Смесь перемешивали при -20°C в течение 1 часа. Добавляли дополнительный 0,5 M KHMDS в толуоле (8,05 мл, 4,03 ммоль), и перемешивание продолжали при -20°C в течение следующего 1 часа. Реакцию гасили насыщенным водным NH4Cl (105 мл) и экстрагировали дважды н-гептаном (105 мл). Органические слои объединяли, промывали соляным раствором и концентрировали в вакууме. Остаток обрабатывали н-гептаном (80 мл) и выдерживали в морозильной камере (- 20°C) в течение ночи. Осадок фильтровали и промывали н-гептаном. Фильтрат концентрировали в вакууме и очищали колоночной хроматографией (этилацетат/н-гептан=1/20-1/10), получая заявленное в заголовке соединение (14,25 г, 70%). 1H ЯМР (400 МГц, CDCl3) δ 0,02 (д, 6H), 0,86 (с, 9H), 1,15 (д, 3H), 1,18 (с, 9H), 1,40-1,55 (м, 4H), 1,6-1,71 (м, 2H), 2,54 (м, 1H), 3,74 (м, 1H), 4,03 (т, 2H), 4,90 (д, 1H), 5,09 (д, 1H).
(R)-4-((трет-бутилдиметилсилил)окси)-6-метилокта-6,7-диен-1-илпивалат
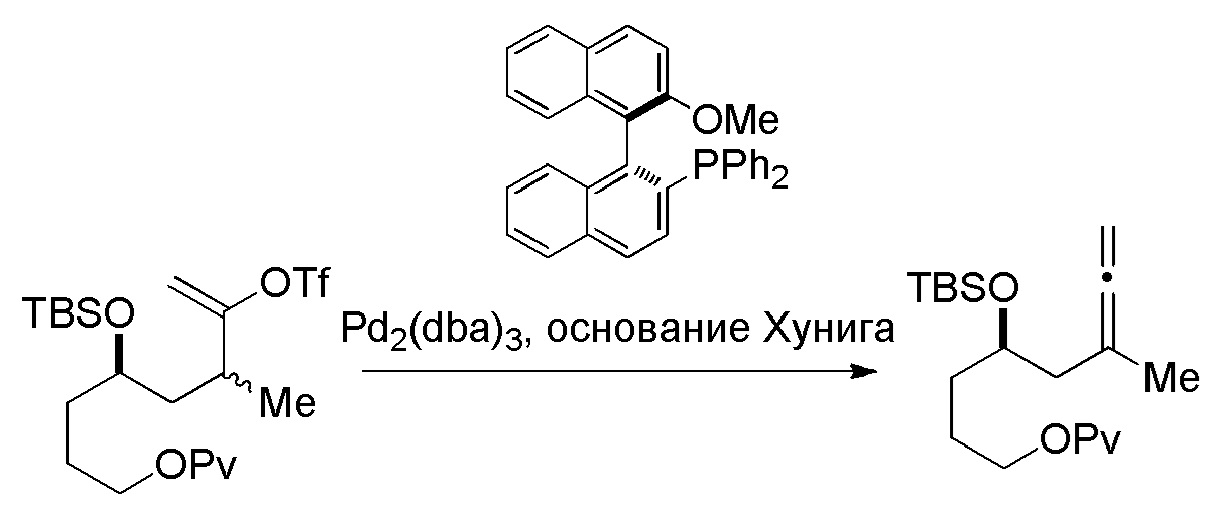
Смесь Pd2(dba)3 (7,3 мг, 7,9 мкмоль) и (S)-(-)-(дифенилфосфино)-2'-метокси-1,1'-бинафтила (0,015 г, 0,032 ммоль) продували азотом и обрабатывали н-гептаном (2,0 мл). Смесь перемешивали при 50°C в течение 4,5 часов. После охлаждения до комнатной температуры (rt), смесь фильтровали через слой целита®, удаляя катализатор, и слой целита® промывали н-гептаном. После концентрирования, остаток очищали колоночной хроматографией (этилацетат/н-гептан=1/20-1/10), получая заявленное в заголовке соединение (130 мг, 93%). 1H ЯМР (400 МГц, CDCl3) δ 0,02 (с, 6H), 0,84 (с, 9H), 1,18 (с, 9H), 1,40-1,75 (м, 4H), 1,68 (т, 3H), 2,02-2,17 (м, 2H), 3,80 (м, 1H), 4,03 (т, 2H), 4,55 (м, 2H).
(5S)-9-((тетрагидро-2H-пиран-2-ил)окси)нон-1-ен-7-ин-5-ол
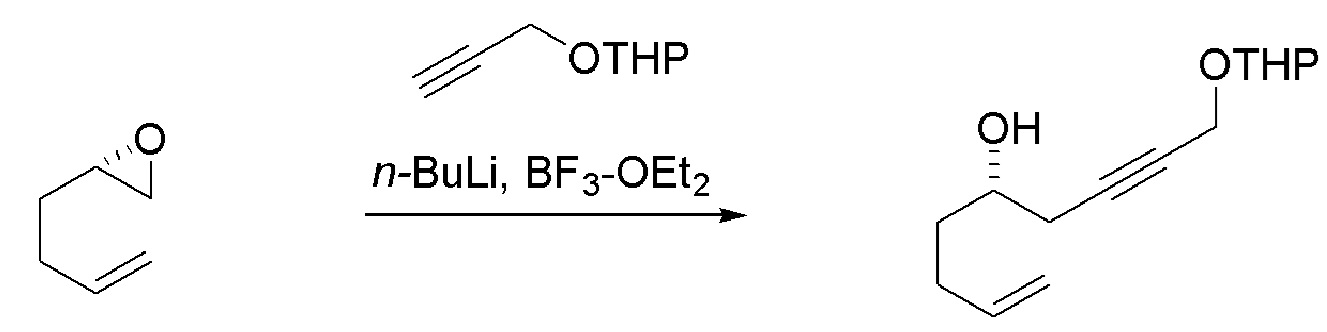
Раствор тетрагидро-2-(2-пропинилокси)-2H-пирана (27 г, 192,6 ммоль) в THF (270 мл) охлаждали до -78°C и обрабатывали 2 M н-BuLi в циклогексане (99 мл, 198,4 ммоль) в течение 30 минут, поддерживая температуру внутри реактора ниже -65°C. После перемешивания в течение 40 минут при -78°C, к смеси добавляли BF3·OEt2 (25,1 мл, 198,4 ммоль) в течение 5 минут, полученную в результате смесь перемешивали при -78°C в течение 15 минут. Добавляли раствор (S)-2-(бут-3-ен-1-ил)оксирана (20,79 г, 211,9 ммоль) в THF (54,0 мл) в течение 30 минут, поддерживая температуру внутри реактора ниже -65°C, и перемешивание продолжали при -78°C в течение 1 часа. Реакцию гасили насыщенным водным NH4Cl (270 мл) и нагревали до комнатной температуры. Органический слой отделяли, и водный слой экстрагировали MTBE (270 мл). Органические слои объединяли, промывали насыщенным водным NaHCO3 (81 мл) и соляным раствором (80 мл), и сушили над MgSO4, получая заявленное в заголовке соединение (40,1 г, 87%). 1H ЯМР (400 МГц, CDCl3) δ 1,45-1,88 (м, 7H), 2,00-2,30 (м, 3H), 2,34-2,50 (м, 2H), 3,51 (м, 1H), 3,70-3,88 (м, 2H), 4,25 (м, 2H), 4,80 (м, 1H), 5,00 (м, 2H), 5,81 (м, 1H).
(4S)-4-гидрокси-8-((тетрагидро-2H-пиран-2-ил)окси)окт-6-иналь
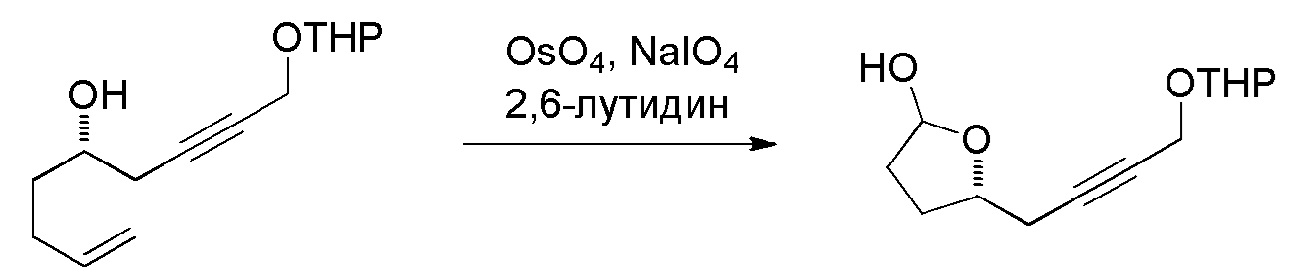
Смесь (5S)-9-((тетрагидро-2H-пиран-2-ил)окси)нон-1-ен-7-ин-5-ола (38 г, 159,4 ммоль), 1,4-диоксана (798 мл) и воды (266 мл) обрабатывали периодатом натрия (136 г, 637,8 ммоль) и 2,6-лутидином (37,1 мл, 319,0 ммоль). Смесь охлаждали в бане со льдом и обрабатывали OsO4 (0,020 г, 0,08 ммоль); баню со льдом удаляли, и смесь перемешивали при комнатной температуре (rt) в течение 20 минут. Добавляли дополнительный OsO4 (0,020 г, 0,08 ммоль), и перемешивание продолжали при комнатной температуре в течение следующих 6 часов. Смесь разбавляли водой (1824 мл) и CH2Cl2 (836 мл). Органический слой отделяли, и водный слой экстрагировали CH2Cl2 (836 мл). Органические слои объединяли, сушили над MgSO4 и концентрировали в вакууме, получая заявленное в заголовке соединение (55 г, 144%).
(4S)-8-((тетрагидро-2H-пиран-2-ил)окси)окт-6-ин-1,4-диол
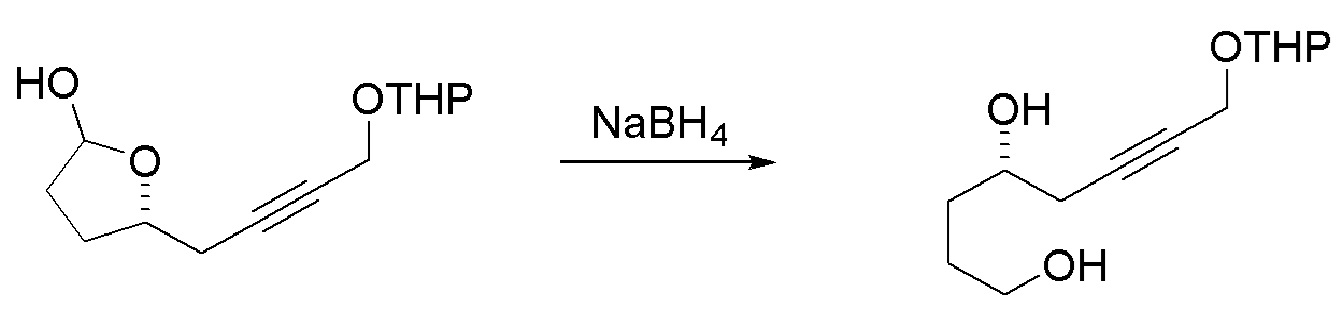
Раствор (4S)-4-гидрокси-8-((тетрагидро-2H-пиран-2-ил)окси)окт-6-иналя (55 г, 160 ммоль) в метаноле (308 мл) охлаждали до 0°C и обрабатывали боргидридом натрия (1,818 г, 48,066 ммоль), который добавляли порциями. После перемешивания при 0°C в течение 1 часа, добавляли дополнительный боргидрид натрия (0,606 г, 16,0 ммоль) двумя порциями с 0,5 часовым интервалом, и перемешивание продолжали при 0°C в течение следующих 0,5 часов. Реакцию гасили насыщенным водным NH4Cl (308 мл) и перемешивали при комнатной температуре (rt) в течение 0,5 часа. Смесь экстрагировали последовательно MTBE (308 мл × 2) и этилацетатом (308 мл × 2). Органические слои объединяли и промывали соляным раствором (116 мл). После концентрирования, остаток загружали на слой силикагеля и элюировали MTBE (приблизительно 600 мл). Фильтрат концентрировали в вакууме, получая заявленное в заголовке соединение (33,66 г, 87%). 1H ЯМР (400 МГц, CDCl3) δ 1,48-1,86 (м, 10H), 2,34-2,50 (м, 2H), 3,51 (м, 1H), 3,60-3,72 (м, 2H), 3,72-3,88 (м, 2H), 4,25 (м, 2H), 4,80 (м, 1H).
(4S)-4-гидрокси-8-((тетрагидро-2H-пиран-2-ил)окси)окт-6-ин-1-илпивалат
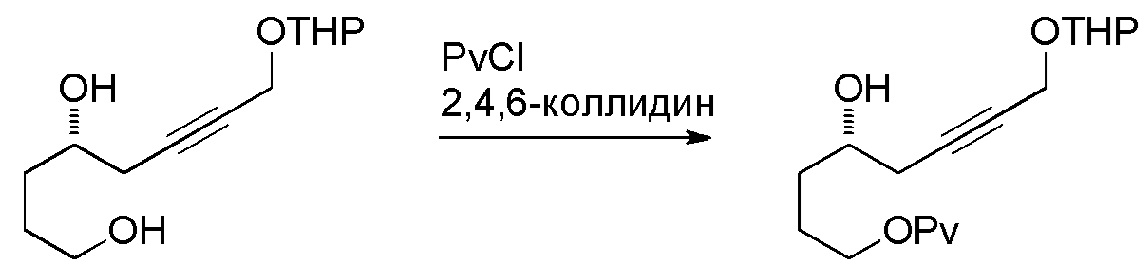
Раствор (4S)-8-((тетрагидро-2H-пиран-2-ил)окси)окт-7-ин-1,4-диола (15,0 г, 61,9 ммоль) в CH2Cl2 (120 мл) обрабатывали 2,4,6-коллидином (34,4 мл, 260 ммоль) и охлаждали до 0°C. После добавления пивалоилхлорида (8,38 мл, 68,094 ммоль) и DMAP (0,378 г, 3,095 ммоль), смесь перемешивали при 0°C в течение 4,5 часов. Реакцию гасили водой (105 мл) и экстрагировали дважды MTBE (105 мл). Органические слои объединяли, промывали 1 N HCl (105 мл) и соляным раствором (45,0 мл) и концентрировали в вакууме, получая заявленное в заголовке соединение (22 г, 109%). 1H ЯМР (400 МГц, CDCl3) δ 1,21 (с, 9H), 1,48-1,86 (м, 10H), 2,30-2,50 (м, 2H), 3,52 (м, 1H), 3,72-3,86 (м, 2H), 4,06 (м, 2H), 4,16-4,32 (м, 2H), 4,79 (м, 1H).
( S)-4,8-дигидроксиокт-7-ин-1-илпивалат
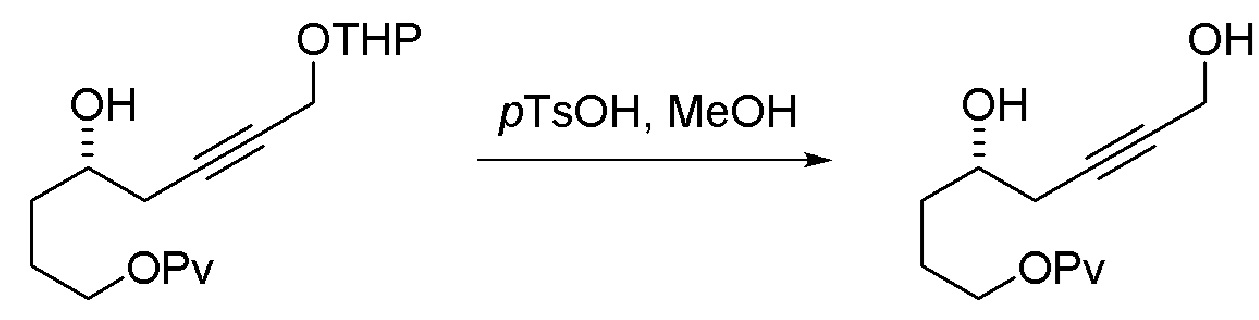
Раствор (4S)-4-гидрокси-8-((тетрагидро-2H-пиран-2-ил)окси)окт-7-ин-1-илпивалата (22 г, 67,4 ммоль) в метаноле (110 мл) обрабатывали п-TsOH (0,641 г, 3,37 ммоль). После перемешивания при комнатной температуре в течение 5,5 часов, смесь обрабатывали насыщенным водным NaHCO3 (56,6 мл) и концентрировали в вакууме. Остаток последовательно экстрагировали MTBE (154 мл) и этилацетатом (154 мл × 2). Органические слои объединяли и промывали соляным раствором. После концентрирования, остаток очищали колоночной хроматографией на силикагеле (этилацетат/н-гептан=1/10-3/2), получая заявленное в заголовке соединение (7,2 г, 37% для 5 стадий). 1H ЯМР (400 МГц, CDCl3) δ 1,19 (с, 9H), 1,55-1,63 (м, 2H), 1,63-1,83 (м, 2H), 2,35 (м, 1H), 2,47 (м, 1H), 3,77 (м, 1H), 4,08 (т, 2H), 4,25 (м, 2H).
(S)-4-гидрокси-8-((мезитилсульфонил)окси)окт-7-ин-1-илпивалат
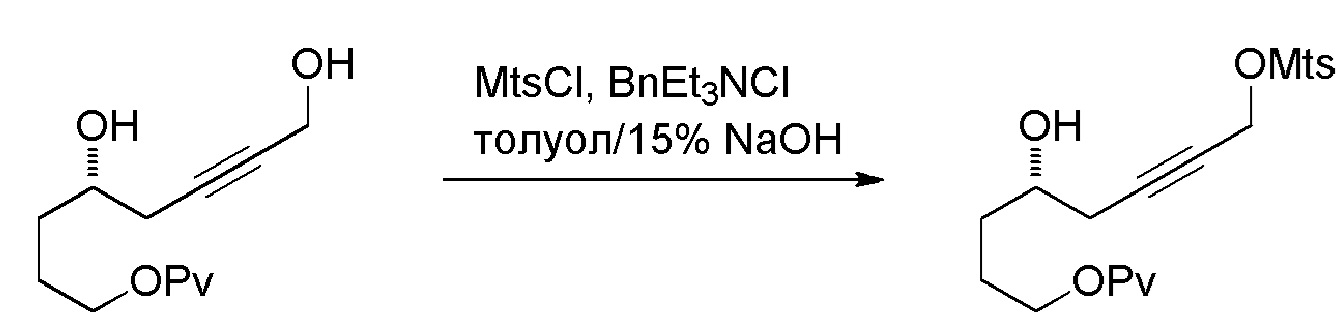
При 0°C смесь (S)-4,8-дигидроксиокт-7-ин-1-илпивалата (6,67 г, 27,527 ммоль), хлорида бензилтриэтиламмония (0,313 г, 1,38 ммоль), толуола (66,7 мл) и 15% водного NaOH (66,7 мл, 250 ммоль) обрабатывали 2-мезитиленсульфонилхлоридом (MtsCl) (3,61 г, 16,5 ммоль) в толуоле (40,0 мл) в течение 20 минут, поддерживая температуру внутри реактора ниже 5°C. Смесь перемешивали при 0°C в течение следующего 1 часа. Органический слой отделяли, и водный слой экстрагировали MTBE (74,1 мл). Органические слои объединяли и сушили над MgSO4. После концентрирования, остаток очищали колоночной хроматографией на силикагеле (этилацетат/н-гептан=1/10-5/3), получая заявленное в заголовке соединение (2,49 г, 21%). 1H ЯМР (400 МГц, CDCl3) δ 1,19 (с, 9H), 1,45-1,55 (м, 2H), 1,55-1,83 (м, 4H), 2,30 (с, 3H), 2,62 (с, 6H), 3,65 (м, 1H), 4,08 (т, 2H), 4,69 (м, 2H), 6,99 (с, 2H).
(S)-4-гидрокси-6-метилокта-6,7-диен-1-илпивалат
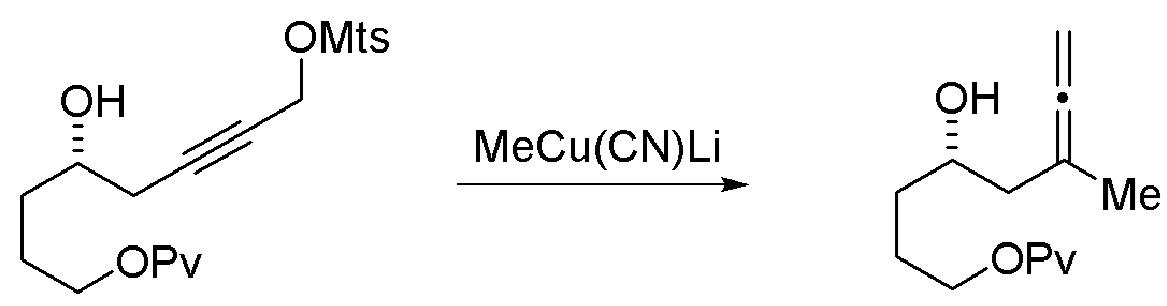
Суспензию цианида меди(I) (0,788 г, 8,80 ммоль) в THF (21,4 мл) охлаждали до -78°C и обрабатывали 1,6 M MeLi в диэтиловом эфире (5,50 мл, 8,80 ммоль) в течение 20 минут, поддерживая температуру внутри реактора ниже -60°C. Смесь перемешивали при -78°C в течение 20 минут и нагревали до 0°C в течение 40 минут. Смесь охлаждали до -78°C, перемешивали в течение следующих 10 минут и обрабатывали раствором (S)-4-гидрокси-8-((мезитилсульфонил)окси)окт-7-ин-1-илпивалата (2,49 г, 5,87 ммоль) в THF (10,7 мл) в течение 20 минут, поддерживая температуру внутри реактора ниже -65°C. После перемешивания при -78°C в течение 1 часа, реакцию гасили смесью насыщенного водного NH4Cl (37,4 мл) и 28% водного NH4OH (4,98 мл) и нагревали до комнатной температуры (rt). Органический слой отделяли, и водный слой экстрагировали дважды MTBE (24,90 мл). Органические слои объединяли и промывали соляным раствором. После концентрирования, остаток очищали колоночной хроматографией на силикагеле (этилацетат/н-гептан=1/10-1/3), получая заявленное в заголовке соединение (1,136 г, 81%). 1H ЯМР (400 МГц, CDCl3) δ 1,28 (с, 9H), 1,48-1,56 (м, 2H), 1,65-1,75 (м, 3H), 1,75-1,85 (м, 2H), 2,00-2,13 (м, 2H), 3,78 (м, 1H), 4,08 (м, 2H), 4,68 (м, 2H).
(S)-2-бром-7-((трет-бутилдифенилсилил)окси)гепт-1-ен-4-илацетат
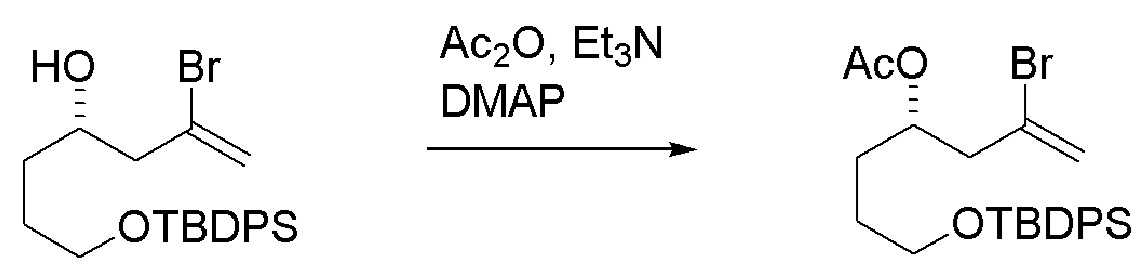
Раствор (S)-2-бром-7-((трет-бутилдифенилсилил)окси)гепт-1-ен-4-ола (6,0 г, 13,408 ммоль) в CH2Cl2 (48,0 мл) обрабатывали триэтиламином (3,74 мл, 26,8 ммоль), уксусным ангидридом (1,52 мл, 16,1 ммоль) и DMAP (0,164 г, 1,34 ммоль). После перемешивания при комнатной температуре (rt) в течение 20 часов, реакцию гасили водой (30,0 мл) и разбавляли MTBE (30,0 мл). Органический слой отделяли и промывали соляным раствором. После концентрирования, остаток очищали колоночной хроматографией на силикагеле (этилацетат/н-гептан=1/20-1/8), получая заявленное в заголовке соединение (5,254 г, 80%). 1H ЯМР (400 МГц, CDCl3) δ 1,05 (с, 9H), 1,52-1,70 (м, 3H), 1,76 (м, 1H), 2,02 (с, 3H), 2,60 (дд, 1H), 2,73 (дд, 1H), 3,68 (м, 2H), 5,19 (м, 1H), 5,49 (с, 1H), 5,63 (с, 1H), 7,39 (м, 6H), 7,65 (м, 4H).
(S)-8-((трет-бутилдифенилсилил)окси)-5-гидрокси-3-метиленоктан-2-он
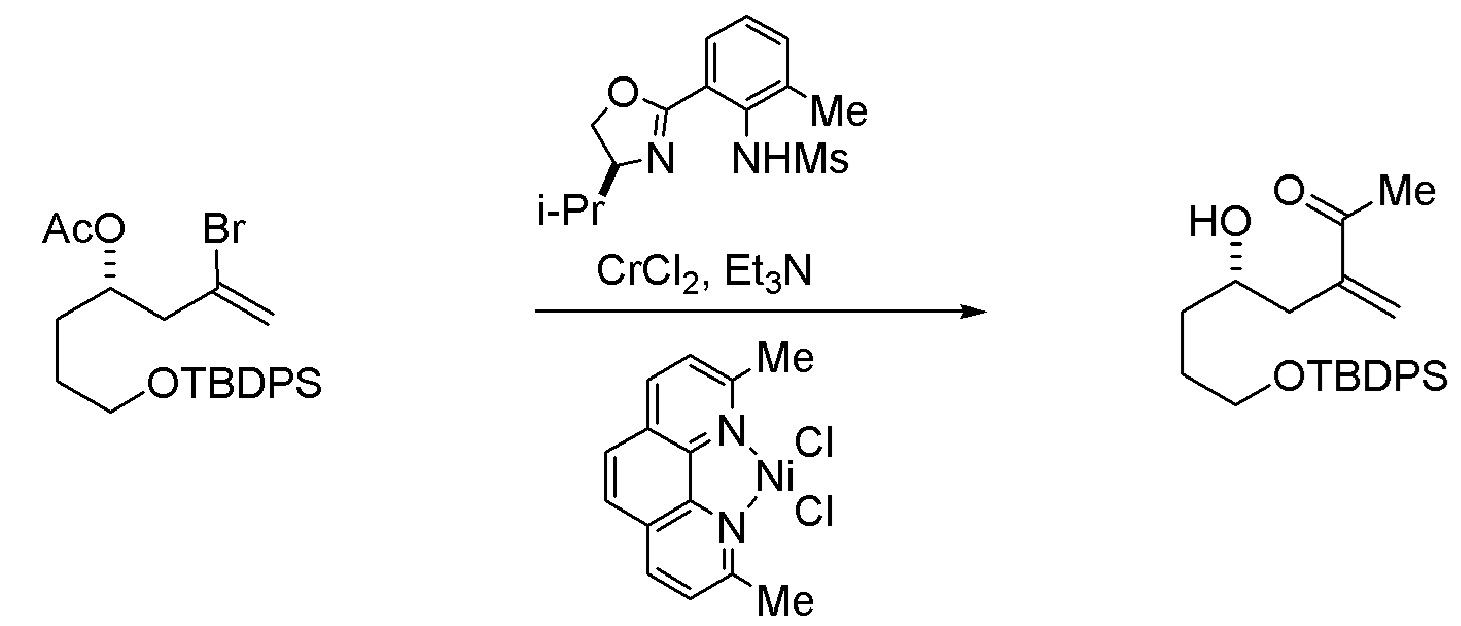
Раствор (S)-N-(2-(4-изопропил-4,5-дигидрооксазол-2-ил)-6-метилфенил)метансульфамида (2,44 г, 8,23 ммоль) в дегазированном THF (26,0 мл) обрабатывали хлоридом хрома (II) (1,01 г, 8,23 ммоль), продували азотом в течение 5 минут и нагревали до 30°C. После добавления триэтиламина (1,15 мл, 8,23 ммоль), смесь перемешивали при 30-35°C в течение 1 часа. Смесь охлаждали до 0°C, обрабатывали комплексом хлоридом никеля (II) и 2,9-диметил-1,10-фенантролина (0,090 г, 0,27 ммоль), продували азотом в течение 5 минут, и затем обрабатывали раствором (S)-2-бром-7-((трет-бутилдифенилсилил)окси)гепт-1-ен-4-илацетата (1,3 г, 2,7 ммоль) в THF (10 мл) (8 мл+2 мл промывка). Смесь перемешивали при 0°C в течение 10 мин и при комнатной температуре в течение 2 часов. Реакционную смесь обрабатывали флоризилом® (5,8 г) и перемешивали при комнатной температуре в течение 30 минут. Смесь разбавляли н-гептаном (19,5 мл), фильтровали через слой флоризила и промывали MTBE (19,5 мл). Фильтрат промывали водой (13 мл) и соляным раствором (6,50 мл). После концентрирования, остаток очищали колоночной хроматографией (этилацетат/н-гептан=1/10-1/2), получая заявленное в заголовке соединение (613 мг, 56%). 1H ЯМР (400 МГц, CDCl3) δ 1,01 (с, 9H), 1,42-1,70 (м, 4H), 2,32 (дд, 1H), 2,36 (с, 3H), 2,55 (м, 1H), 3,69 (м, 3H), 5,90 (с, 1H), 6,11 (с, 1H), 7,39 (м, 6H), 7,65 (м, 4H).
(S)-5-((трет-бутилдиметилсилил)окси)-8-((трет-бутилдифенилсилил)окси)-3-метиленоктан-2-он
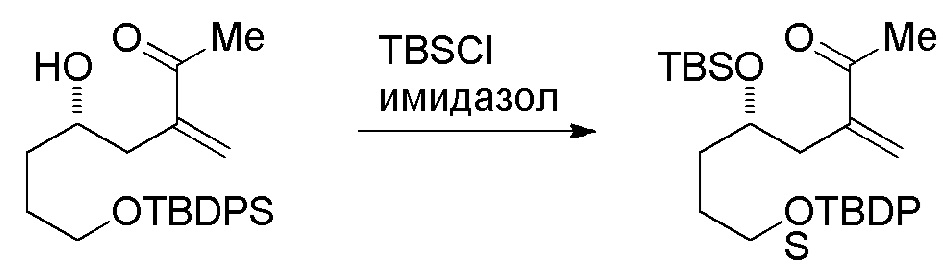
Раствор (S)-8-((трет-бутилдифенилсилил)окси)-5-гидрокси-3-метиленоктан-2-она (0,643 г, 1,57 ммоль) в DMF (5,14 мл) обрабатывали TBSCl (0,283 г, 1,88 ммоль) и имидазолом (0,213 г, 3,13 ммоль). Смесь перемешивали при комнатной температуре в течение 4,5 часов. Реакцию гасили водой (12,86 мл) и экстрагировали дважды MTBE (19,29 мл). Органические слои объединяли, и промывали водой (12,9 мл) и соляным раствором (6,43 мл). После концентрирования, остаток очищали колоночной хроматографией (этилацетат/н-гептан=1/10-1/8), получая заявленное в заголовке соединение (456 мг, 56%). 1H ЯМР (400 МГц, CDCl3) δ 0,00 (с, 6H), 0,88 (с, 9H), 1,03 (с, 9H), 1,42-1,70 (м, 4H), 2,31 (с, 3H), 2,32 (дд, 1H), 2,44 (дд, 1H), 3,63 (т, 2H), 3,79 (м, 1H), 5,81 (с, 1H), 6,04 (с, 1H), 7,39 (м, 6H), 7,66 (м, 4H).
(S)-2,2,3,3,11,11-гексаметил-5-(2-метилбута-2,3-диен-1-ил)-10,10-дифенил-4,9-диокса-3,10-дисиладодекан
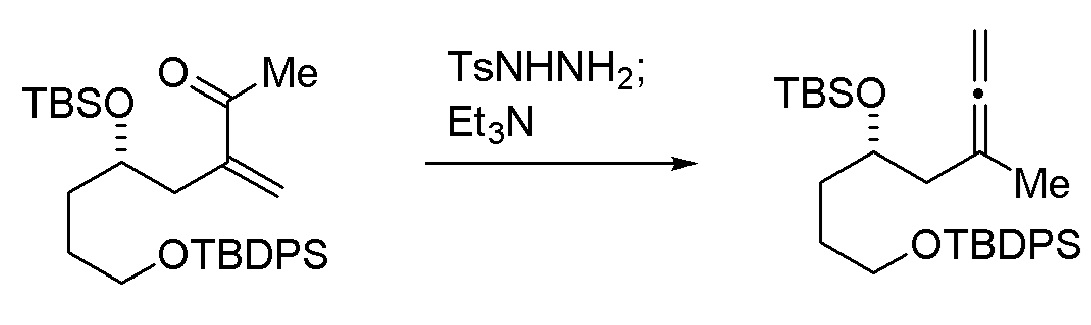
Раствор (S)-5-((трет-бутилдиметилсилил)окси)-8-((трет-бутилдифенилсилил)окси)-3-метиленоктан-2-она (0,20 г, 0,381 ммоль) в этаноле (2,0 мл) обрабатывали п-толуолсульфонилгидразидом (0,078 г, 0,42 ммоль) и перемешивали при комнатной температуре в течение 59 часов. Полученную в результате смесь обрабатывали этанолом (2,0 мл), триэтиламином (0,11 мл, 0,76 ммоль) и молекулярными ситами 4Å (500 мг). После перемешивания при 85°C (баня) в течение 1 дня, смесь фильтровали через слой целита®, удаляя молекулярные сита и промывали MTBE (20,0 мл). Фильтрат промывали водой (5 мл) и соляным раствором (5 мл) и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле (этилацетат/н-гептан=1/20-1/10), получая заявленное в заголовке соединение (68 мг, 35%). 1H ЯМР (400 МГц, CDCl3) δ 0,01 (с, 3H), 0,02 (с, 3H), 0,87 (с, 9H), 1,04 (с, 9H), 1,42-1,66 (м, 4H), 1,68 (т, 3H), 2,00-2,20 (м, 2H), 3,63 (т, 2H), 3,79 (м, 1H), 4,52 (м, 2H), 7,39 (м, 6H), 7,66 (м, 4H).
Пример 7: Получение соединения формулы (VIIC)
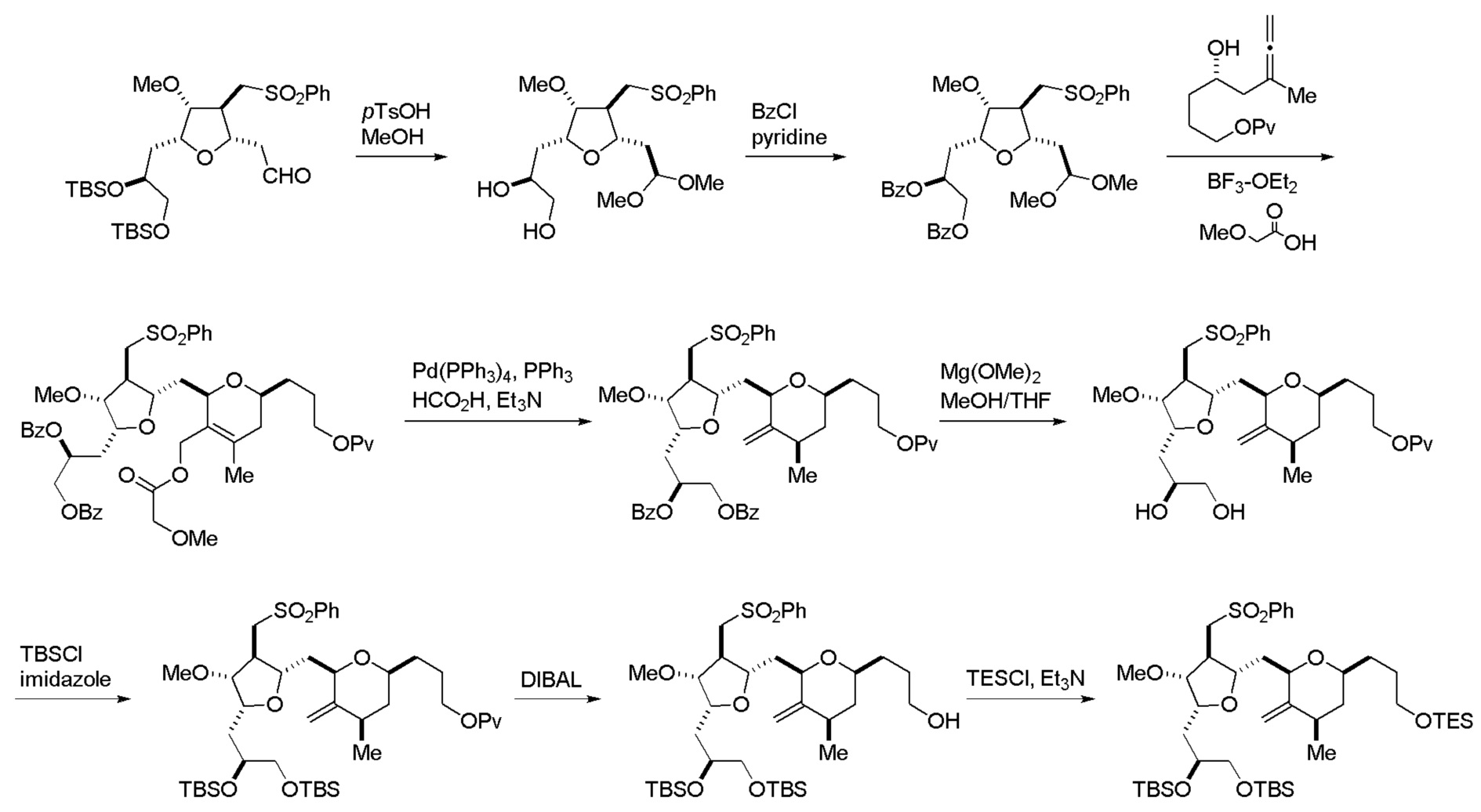
(S)-3-((2R,3R,4S,5S)-5-(2,2-диметоксиэтил)-3-метокси-4-((фенилсульфонил)метил)тетрагидрофуран-2-ил)пропан-1,2-диол
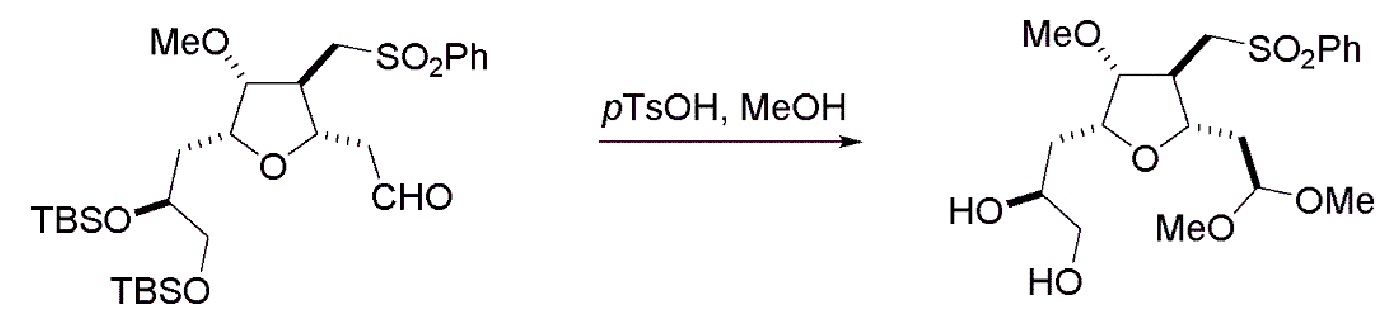
Раствор 2-((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-3-((фенилсульфонил)метил)тетрагидрофуран-2-ил)ацетальдегида (20,0 г, 33,28 ммоль) в метаноле (100 мл) обрабатывали CSA (0,773 г, 3,33 ммоль) и перемешивали при комнатной температуре в течение 3 дней. Реакцию гасили насыщенным водным NaHCO3 (50 мл) и экстрагировали MTBE (100 мл) и этилацетатом (100 мл × 3). Органические слои объединяли, сушили над MgSO4 и концентрировали в вакууме, получая заявленное в заголовке соединение (19,79 г). 1H ЯМР (400 МГц, CDCl3) δ 1,80 (м, 1H), 1,85-2,00 (м, 3H), 2,56 (м, 1H), 3,12 (м, 2H), 3,28 (с, 3H), 3,31 (с, 3H), 3,42 (с, 3H), 3,55 (м, 1H), 3,62-3,71 (м, 2H), 3,90-3,98 (м, 3H), 4,43 (м, 1H), 7,60 (м, 2H), 7,69 (м, 1H), 7,98 (м, 2H).
(S)-3-((2R,3R,4S,5S)-5-(2,2-диметоксиэтил)-3-метокси-4-((фенилсульфонил)метил)тетрагидрофуран-2-ил)пропан-1,2-диилдибензоат
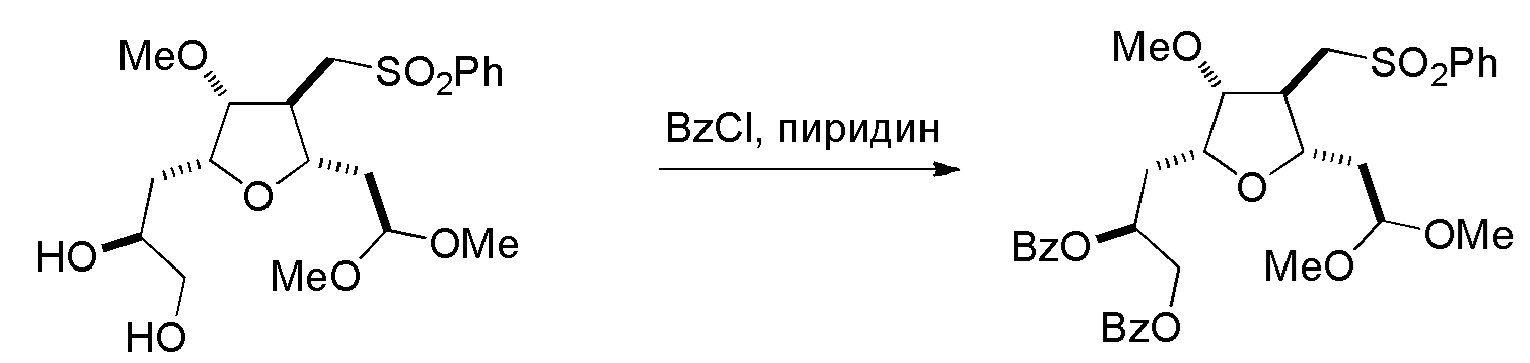
Раствор (S)-3-((2R,3R,4S,5S)-5-(2,2-диметоксиэтил)-3-метокси-4-((фенилсульфонил)метил)тетрагидрофуран-2-ил)пропан-1,2-диола (19,79 г, 47,29 ммоль) в пиридине (99 мл, 1223,429 ммоль) охлаждали до 0°C и обрабатывали бензоилхлоридом (12,08 мл, 104,0 ммоль). Смесь перемешивали при комнатной температуре в течение 20 часов. Добавляли дополнительные реагенты и перемешивание продолжали в течение 3 дней. Реакцию гасили водой (400 мл) и экстрагировали MTBE (200 мл × 3). Органические слои объединяли, промывали 1 N HCl (100 мл), и затем насыщенным водным NaHCO3 (50 мл), сушили над MgSO4 и концентрировали в вакууме. Остаток растворяли в CH2Cl2 (297 мл) и обрабатывали триэтиламином (26,4 мл, 189,2 ммоль), бензоилхлоридом (10,98 мл, 94,58 ммоль) и DMAP (0,289 г, 2,364 ммоль). Смесь перемешивали при комнатной температуре в течение 24 часов. Добавляли еще триэтиламина (23,2 мл, 166,3 ммоль), бензоилхлорида (7,74 мл, 66,6 ммоль) и DMAP (0,578 г, 4,72 ммоль), и перемешивание продолжали при комнатной температуре в течение 7 дней. Реакцию гасили водой (300 мл). Органический слой отделяли, и водный слой экстрагировали CH2Cl2 (150 мл). Органические слои объединяли и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле (этилацетат/н-гептан=1/10-1/1), получая заявленное в заголовке соединение (17,82 г, 85% для двух стадий). 1H ЯМР (400 МГц, CDCl3) δ 1,89 (м, 2H), 2,25 (м, 2H), 2,55 (м, 1H), 3,09 (м, 2H), 3,22 (с, 3H), 3,24 (с, 3H), 3,42 (с, 3H), 3,59 (м, 1H), 3,89 (м, 1H), 3,92 (м, 1H), 4,39 (м, 1H), 4,57 (д, 2H), 5,63 (м, 1H), 7,44 (м, 4H), 7,56 (м, 4H), 7,68 (м, 1H), 7,92 (д, 2H), 8,04 (м, 4H).
(S)-3-((2R,3R,4S,5S)-3-метокси-5-(((2R,6S)-4-метил-3-(2-метоксиацетокси)метил-6-(3-пивалоилокси)пропил)-3,6-дигидро-2H-пиран-2-ил)метил)-4-((фенил сульфонил)метил)тетрагидрофуран-2-ил)пропан-1,2-диилдибензоат
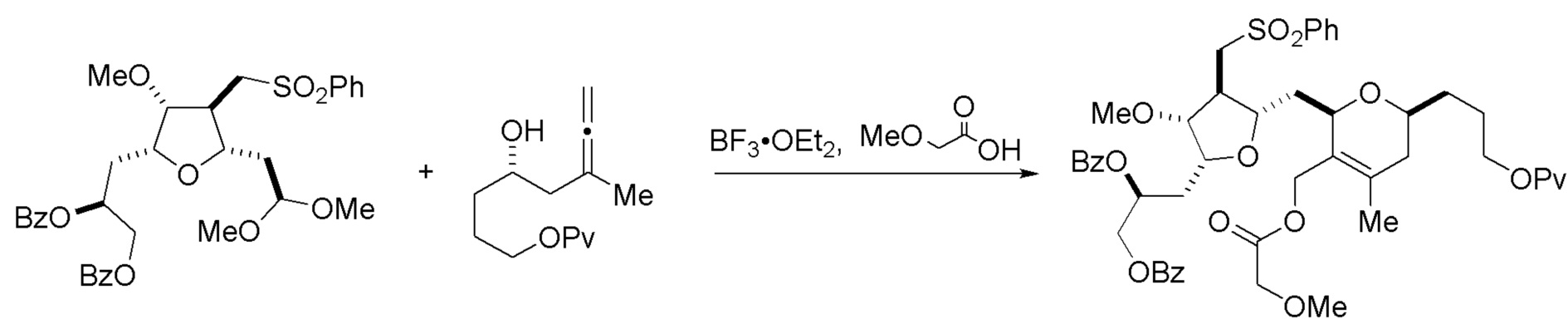
Смесь (S)-4-гидрокси-6-метилокта-6,7-диен-1-илпивалата (1,14 г, 4,73 ммоль) и (S)-3-((2R,3R,4S,5S)-5-(2,2-диметоксиэтил)-3-метокси-4-((фенилсульфонил)метил)тетрагидрофуран-2-ил)пропан-1,2-диилдибензоата (3,41 г, 5,44 ммоль) растворяли в CH2Cl2 (47,7 мл) и охлаждали до -40°C. Смесь последовательно обрабатывали метоксиуксусной кислотой (5,44 мл, 70,9 ммоль) и BF3-OEt2 (1,80 мл, 14,2 ммоль). Смесь нагревали до -30°C в течение 1 часа и перемешивали при -30°C в течение 0,5 часа. Реакцию гасили насыщенным водным NaHCO3 (119 мл) и экстрагировали дважды этилацетатом (100 мл). Органические слои объединяли, сушили над MgSO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле (этилацетат/н-гептан=1/10-2/3), получая заявленное в заголовке соединение (3,61 г, 86%). 1H ЯМР (400 МГц, CDCl3) δ 1,14 (м, 1H), 1,24 (с, 9H), 1,40-1,55 (м, 3H), 1,65 (м, 1H), 1,72 (с, 3H), 1,81 (м, 1H), 1,95 (м, 2H), 2,25 (м, 2H), 2,71 (м, 1H), 3,02 (дд, 1H), 3,11 (дд, 1H), 3,38 (м, 1H), 3,42 (с, 6H), 3,63 (м, 1H), 3,70 (м, 1H), 3,90-4,00 (м, 3H), 4,02 (д, 2H), 4,15 (м, 1H), 4,54 (д, 2H), 4,59 (д, 1H), 4,72 (д, 1H), 5,59 (м, 1H), 7,42 (м, 4H), 7,56 (м, 4H), 7,65 (м, 1H), 7,90 (д, 2H), 8,01 (м, 4H).
(S)-3-((2R,3R,4S,5S)-3-метокси-5-(((2R,4R,6S)-4-метил-3-метилен-6-(3-(пивалоилокси)пропил)тетрагидро-2H-пиран-2-ил)метил)-4-((фенилсульфонил)метил)тетрагидрофуран-2-ил)пропан-1,2-диилдибензоат
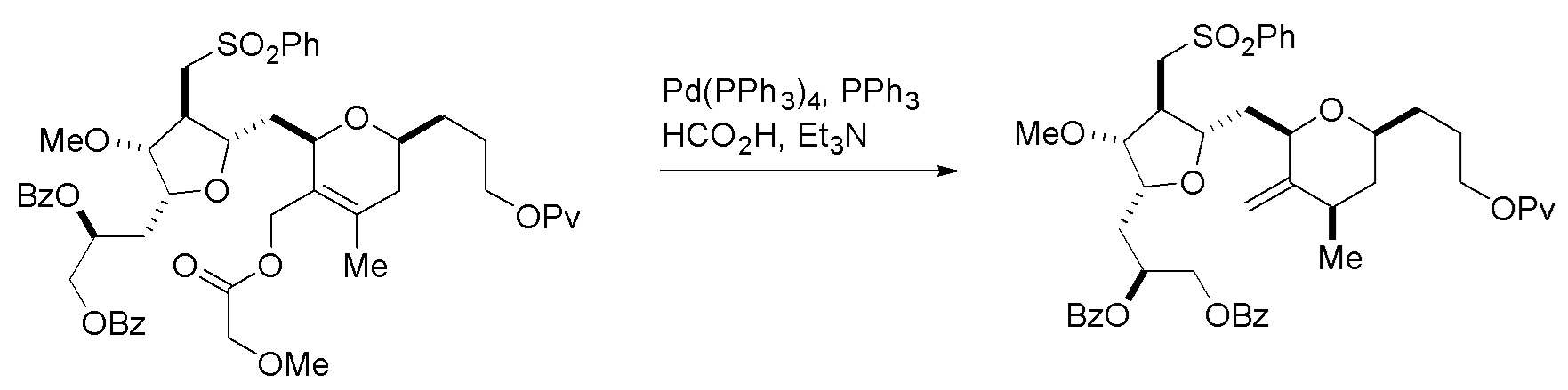
Смесь Pd(Ph3P)4 (0,467 г, 0,404 ммоль) и трифенилфосфина (0,424 г, 1,62 ммоль) в дегазированном THF (36,1 мл) нагревали до 60°C и перемешивали в течение 5 минут. Смесь обрабатывали смесью (S)-3-((2R,3R,4S,5S)-3-метокси-5-(((2R,6S)-4-метил-3-(2-метоксиацетокси)метил-6-(3-пивалоилокси)пропил-3,6-дигидро-2H-пиран-2-ил)метил)-4-((фенилсульфонил)метил)тетрагидрофуран-2-ил)пропан-1,2-диилдибензоата (3,61 г, 4,04 ммоль), муравьиной кислоты (0,775 мл, 20,2 ммоль) и триэтиламина (2,82 мл, 20,2 ммоль) в дегазированном THF (36,1 мл). Смесь перемешивали при 60°C в течение 52 часов. После охлаждения до комнатной температуры, смесь разбавляли MTBE (36,1 мл) и промывали водой (18,1 мл), и затем соляным раствором. После концентрирования, остаток очищали колоночной хроматографией на силикагеле (этилацетат/н-гептан=1/10-1/2), получая заявленное в заголовке соединение (2,8 г, 74% для 2 стадий из аллена). 1H ЯМР (400 МГц, CDCl3) δ 1,00 (м, 1H), 1,05 (д, 3H), 1,14 (с, 9H), 1,38 (м, 3H), 1,61 (м, 1H), 1,72 (м, 1H), 1,91 (м, 1H), 2,1-2,32 (м, 4H), 2,62 (м, 1H), 3,02 (дд, 1H), 3,06 (дд, 1H), 3,36 (м, 1H), 3,42 (с, 3H), 3,66 (м, 1H), 3,72 (м, 1H), 3,81 (м, 1H), 3,84-3,96 (м, 3H), 4,56 (д, 2H), 4,77 (с, 1H), 4,83 (с, 1H), 5,59 (м, 1H), 7,40 (м, 4H), 7,52 (м, 4H), 7,62 (м, 1H), 7,90 (м, 2H), 8,01 (м, 4H).
3-((2S,4R,6R)-6-(((2S,3S,4R,5R)-5-((S)-2,3-дигидроксипропил)-4-метокси-3-((фенилсульфонил)метил)тетрагидрофуран-2-ил)метил)-4-метил-5-метилентетрагидро-2H-пиран-2-ил)пропилпивалат
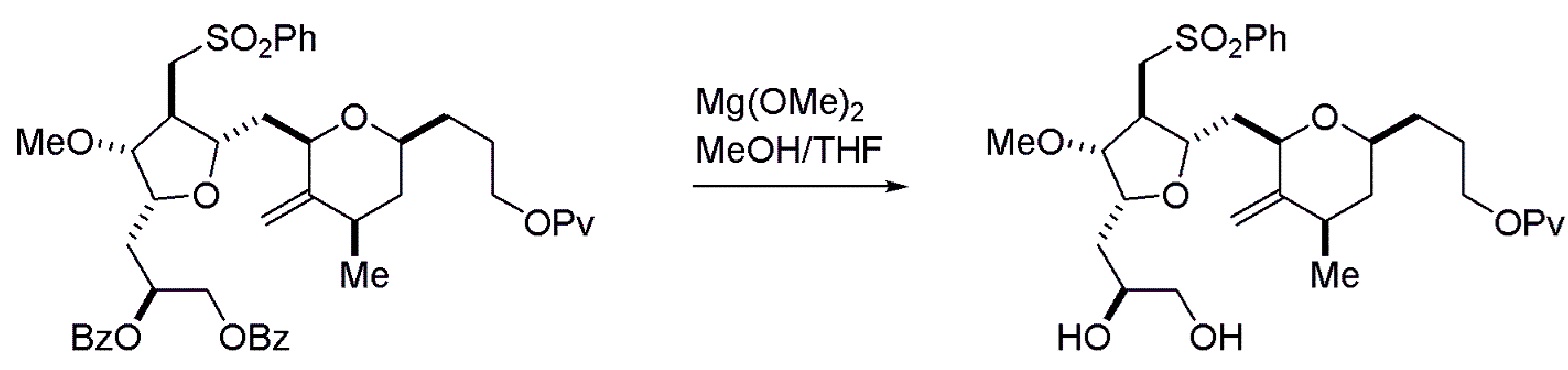
Раствор (S)-3-((2R,3R,4S,5S)-3-метокси-5-(((2R,4R,6S)-4-метил-3-метилен-6-(3-(пивалоилокси)пропил)тетрагидро-2H-пиран-2-ил)метил)-4-((фенилсульфонил)метил)тетрагидрофуран-2-ил)пропан-1,2-диилдибензоата (2,8 г, 3,5 ммоль) в смеси THF (2,80 мл) и метанола (56,0 мл) обрабатывали 6-10% Mg(OMe)2 в метаноле (18,5 г, 13,9 ммоль). После перемешивания при комнатной температуре в течение 22 часов, реакцию гасили насыщенным водным NH4Cl (22,4 мл) и экстрагировали MTBE (56,0 мл) и этилацетатом (42,0 мл x 2). Органические слои объединяли и сушили над MgSO4. После концентрирования, остаток азеотропно упаривали с метанолом и толуолом, получая неочищенный продукт, который применяли в следующей стадии без дополнительной очистки. 1H ЯМР (400 МГц, CDCl3) δ 1,02 (м, 1H), 1,05 (д, 3H), 1,30 (с, 9H), 1,38 (м, 3H), 1,61 (м, 1H), 1,72 (м, 1H), 1,85 (м, 1H), 1,90-2,03 (м, 2H), 2,05-2,27 (м, 2H), 2,67 (м, 1H), 3,05 (уш д, 1H), 3,23 (дд, 1H), 3,42 (с, 3H), 3,45 (м, 1H), 3,60 (м, 1H), 3,70 (м, 1H), 3,75 (м, 1H), 3,80-4,01 (м, 5H), 4,10 (м, 1H), 4,80 (с, 1H), 4,88 (с, 1H), 7,60 (м, 2H), 7,62 (м, 1H), 7,95 (м, 2H).
3-((2S,4R,6R)-6-(((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-3-((фенилсульфонил)метил)тетрагидрофуран-2-ил)метил)-4-метил-5-метилентетрагидро-2H-пиран-2-ил)пропилпивалат
Раствор 3-((2S,4R,6R)-6-(((2S,3S,4R,5R)-5-((S)-2,3-дигидроксипропил)-4-метокси-3-((фенилсульфонил)метил) тетрагидрофуран-2-ил)метил)-4-метил-5-метилентетрагидро-2H-пиран-2-ил)пропилпивалата (2,07 г, 3,469 ммоль) в DMF (16,56 мл, 213,871 ммоль) обрабатывали имидазолом (0,945 г, 13,9 ммоль) и TBSCl (1,20 г, 7,98 ммоль). Смесь перемешивали при комнатной температуре в течение 1 часа. Добавляли дополнительный имидазол (0,945 г, 13,9 ммоль) и TBSCl (1,20 г, 7,98 ммоль), и перемешивание продолжали при комнатной температуре в течение следующих 18 часов. Реакцию гасили водой (41,4 мл) и экстрагировали MTBE (41,4 мл × 2). Органические слои объединяли и сушили над MgSO4. После концентрирования, остаток очищали колоночной хроматографией на силикагеле (1/10-1/5), получая заявленное в заголовке соединение (3,115 г, 109%). 1H ЯМР (400 МГц, CDCl3) δ 0,03 (с, 6H), 0,09 (с, 6H), 0,91 (с, 18H), 1,02 (м, 1H), 1,05 (д, 3H), 1,15 (с, 9H), 1,40 (м, 3H), 1,61 (м, 1H), 1,72 (м, 1H), 1,82 (м, 1H), 1,90 (м, 1H), 1,99 (м, 1H), 2,15-2,27 (м, 2H), 2,58 (м, 1H), 3,02 (м, 2H), 3,39 (м, 1H), 3,40 (с, 3H), 3,45 (м, 1H), 3,55 (м, 1H), 3,65 (м, 2H), 3,75-3,85 (м, 3H), 3,85-4,0 (м, 2H), 4,79 (с, 1H), 4,88 (с, 1H), 7,60 (м, 2H), 7,62 (м, 1H), 7,92 (м, 2H).
3-((2S,4R,6R)-6-(((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-3-((фенилсульфонил)метил)тетрагидрофуран-2-ил)метил)-4-метил-5-метилентетрагидро-2H-пиран-2-ил)пропан-1-ол
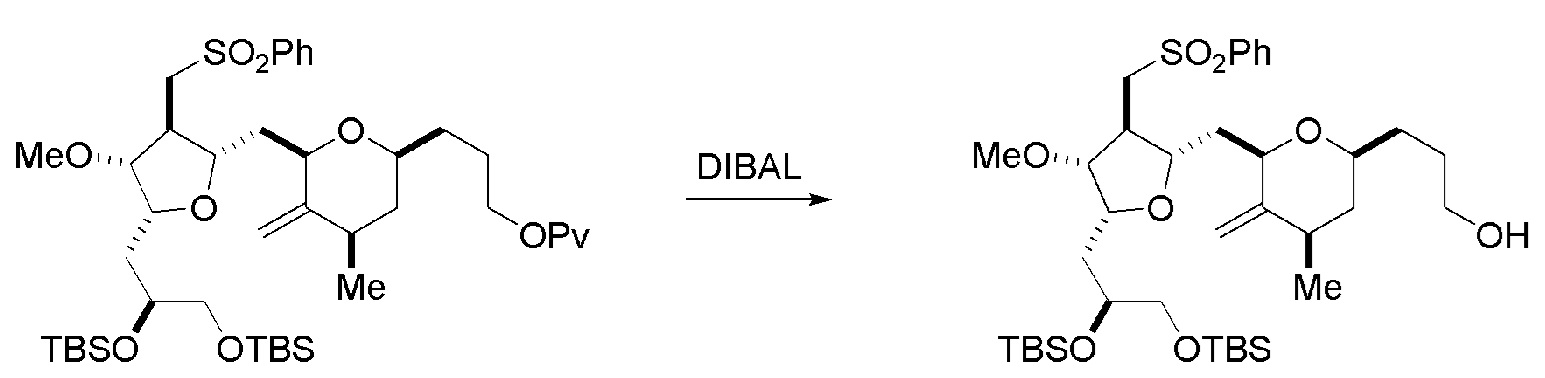
Раствор 3-((2S,4R,6R)-6-(((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-3-((фенилсульфонил)метил)тетрагидрофуран-2-ил)метил)-4-метил-5-метилентетрагидро-2H-пиран-2-ил)пропилпивалата (3,11 г, 3,77 ммоль) в CH2Cl2 (31,1 мл) охлаждали до -78°C и обрабатывали 1M DIBAL в толуоле (8,29 мл, 8,29 ммоль). Смесь перемешивали при -78°C в течение 1 часа. Добавляли дополнительный 1M DIBAL в толуоле (1,507 мл, 1,507 ммоль), и перемешивание продолжали в течение следующих 1,5 часов. После прекращения реакции метанолом (1,53 мл, 37,7 ммоль), смесь обрабатывали 1 N HCl (37,7 мл) и перемешивали при комнатной температуре в течение 1 часа. Смесь экстрагировали MTBE (31,1 мл × 2). Органические слои объединяли, промывали насыщенным водным NaHCO3 (15,6 мл), сушили над MgSO4 и концентрировали в вакууме, получая заявленное в заголовке соединение (2,9 г, 104%). 1H ЯМР (400 МГц, CDCl3) δ 0,03 (с, 6H), 0,09 (с, 6H), 0,88 (с, 18H), 1,08 (м, 1H), 1,08 (д, 3H), 1,48 (м, 3H), 1,63 (м, 1H), 1,72 (м, 1H), 1,82 (м, 1H), 1,88-2,02 (м, 2H), 2,12-2,27 (м, 2H), 2,58 (м, 1H), 3,03 (дд, 1H), 3,10 (дд, 1H), 3,40 (с, 3H), 3,42-3,50 (м, 2H), 3,55 (м, 3H), 3,68 (м, 2H), 3,80 (м, 3H), 4,79 (с, 1H), 4,88 (с, 1H), 7,60 (м, 2H), 7,62 (м, 1H), 7,97 (м, 2H).
(S)-5-(((2R,3R,4S,5S)-3-метокси-5-(((2R,4R,6S)-4-метил-3-метилен-6-(3-((триэтилсилил)окси)пропил)тетрагидро-2H-пиран-2-ил)метил)-4-((фенилсульфонил)метил)тетрагидрофуран-2-ил)метил)-2,2,3,3,8,8,9,9-октаметил-4,7-диокса-3,8-дисиладекан

Раствор 3-((2S,4R,6R)-6-(((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-3-((фенилсульфонил)метил)тетрагидрофуран-2-ил)метил)-4-метил-5-метилентетрагидро-2H-пиран-2-ил)пропан-1-ола (2,9 г, 3,9 ммоль) в CH2Cl2 (29,0 мл) обрабатывали триэтиламином (1,09 мл, 7,83 ммоль) и хлортриэтилсиланом (0,799 мл, 4,70 ммоль). После перемешивания при комнатной температуре в течение 17 часов, реакцию гасили водой (29,0 мл) и экстрагировали дважды MTBE (29,0 мл). Органические слои объединяли и промывали соляным раствором. После концентрирования, остаток очищали колоночной хроматографией на силикагеле (этилацетат/н-гептан=1/20-1/5), получая заявленное в заголовке соединение (2,95 г, 88%). 1H ЯМР (400 МГц, CDCl3) δ 0,03 (с, 6H), 0,04 (с, 6H), 0,56 (кв, 6H), 0,82-1,00 (м, 27H), 1,02 (м, 1H), 1,06 (д, 3H), 1,30-1,52 (м, 4H), 1,74 (м, 1H), 1,78-1,90 (м, 2H), 2,00 (м, 1H), 2,15-2,23 (м, 2H), 2,56 (м, 1H), 2,96-3,10 (м, 2H), 3,35 (м, 1H), 3,43 (с, 3H), 3,43-3,62 (м, 5H), 3,68 (м, 1H), 3,79 (м, 2H), 3,83 (м, 1H), 4,78 (с, 1H), 4,85 (с, 1H), 7,60 (м, 2H), 7,62 (м, 1H), 7,96 (м, 2H).
Пример 7: Получение соединения формулы (VD)
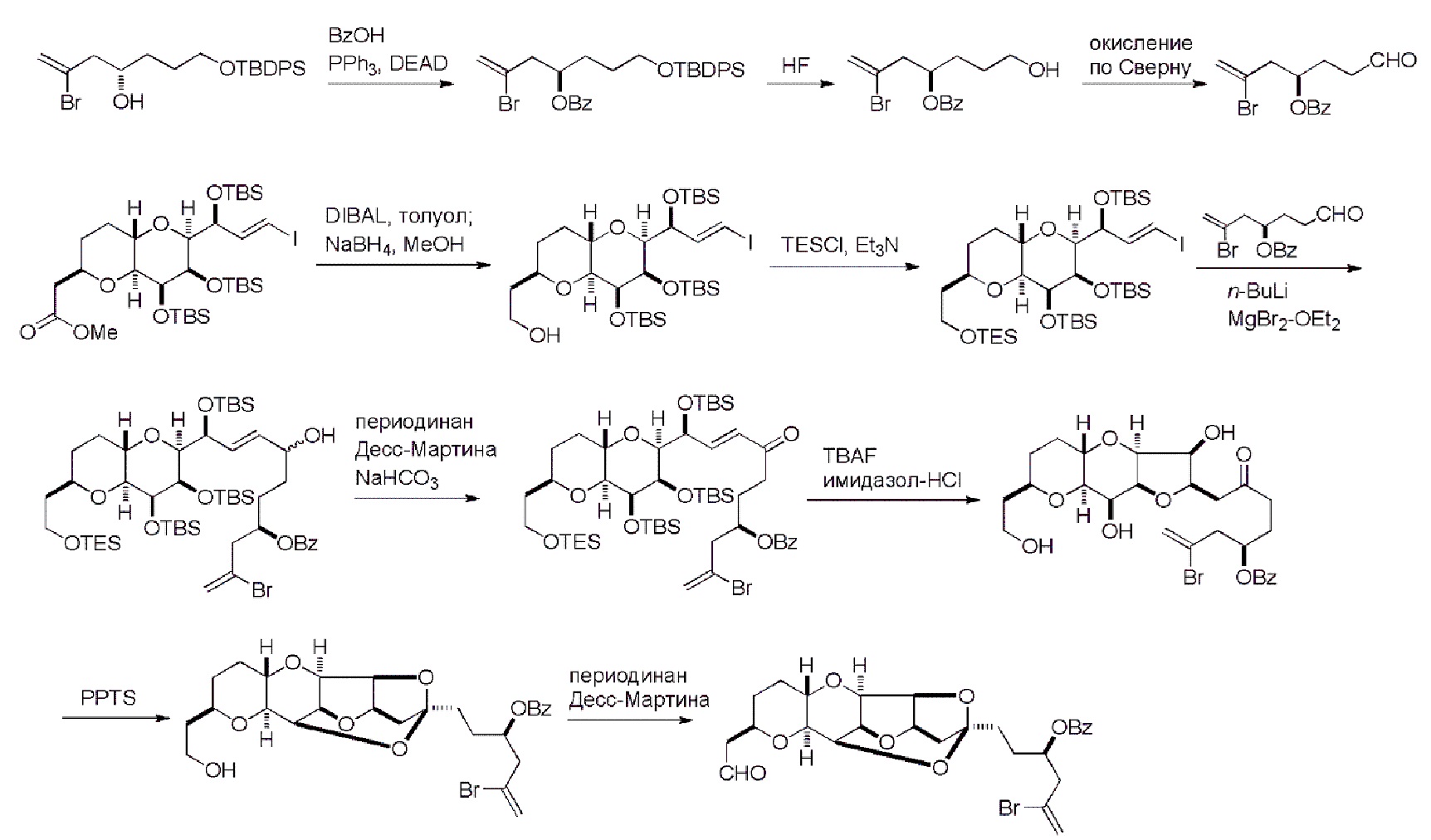
(R)-2-бром-7-((трет-бутилдифенилсилил)окси)гепт-1-ен-4-илбензоат

Раствор (S)-2-бром-7-((трет-бутилдифенилсилил)окси)гепт-1-ен-4-ола (25,0 г, 55,9 ммоль) в толуоле (200 мл) обрабатывали бензойной кислотой (8,19 г, 67,0 ммоль) и трифенилфосфином (17,58 г, 67,0 ммоль). После охлаждения до 0°C, смесь обрабатывали DEAD (24,32 мл, 61,46 ммоль) в течение 20 минут, поддерживая температуру внутри реактора ниже 6°C и перемешивали при 0°C в течение 2 часов. Смесь обрабатывали н-гептаном (83 мл) и перемешивали при 0°C в течение 30 минут. Осадок фильтровали и промывали н-гептаном (83 мл). Фильтрат концентрировали в вакууме, получая заявленное в заголовке соединение (46,6 г).
(R)-2-бром-7-гидроксигепт-1-ен-4-илбензоат
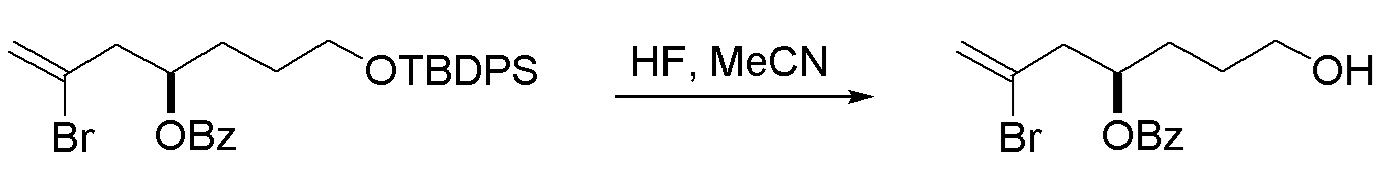
Раствор (R)-2-бром-7-((трет-бутилдифенилсилил)окси)гепт-1-ен-4-илбензоата (30,8 г, 55,8 ммоль) в ацетонитриле (200 мл) обрабатывали 48% HF в воде (10,1 мл, 279 ммоль) и перемешивали при комнатной температуре в течение 13 часов. Реакцию гасили насыщенным водным NaHCO3 (308 мл) и разбавляли MTBE (154 мл). Органический слой отделяли, и водный слой экстрагировали MTBE (154 мл). Органические слои объединяли и промывали соляным раствором. После концентрирования, остаток очищали колоночной хроматографией на силикагеле (этилацетат/н-гептан=1/10-1/2), получая заявленное в заголовке соединение (14,67 г, 84%). 1H ЯМР (400 МГц, CDCl3) δ 1,29 (м, 1H), 1,61-1,71 (м, 2H), 1,75-1,90 (м, 2H), 2,73 (дд, 1H), 2,90 (дд, 1H), 3,69 (т, 2H), 5,46 (м, 1H), 5,48 (с, 1H), 5,69 (с, 1H), 7,41 (м, 2H), 7,58 (м, 1H), 8,02 (м, 2H).
(R)-2-бром-7-оксогепт-1-ен-4-илбензоат
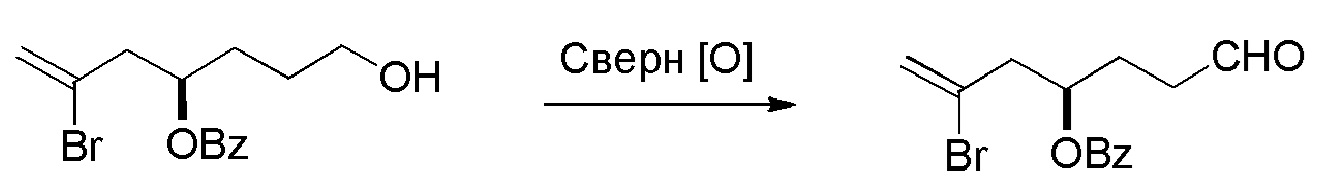
Раствор 2 M оксалилхлорида в CH2Cl2 (6,96 мл, 13,9 ммоль) в CH2Cl2 (21,80 мл) охлаждали до -78°C и обрабатывали DMSO (1,976 мл, 27,843 ммоль), поддерживая температуру внутри реактора ниже -60°C. После перемешивания при -78°C в течение 10 мин, добавляли раствор (R)-2-бром-7-гидроксигепт-1-ен-4-илбензоата (2,18 г, 6,961 ммоль) в CH2Cl2 (10,90 мл), и перемешивание продолжали при -78°C в течение 30 минут. Добавляли триэтиламин (9,70 мл, 69,6 ммоль), поддерживая температуру внутри реактора ниже -60°C. Затем, смесь перемешивали при -78°C в течение 10 мин и 0°C в течение 30 минут. Смесь обрабатывали водой (21,80 мл) и экстрагировали дважды MTBE (32,7 мл). Органические слои объединяли и промывали водой (21,80 мл) и соляным раствором. После концентрирования, остаток очищали колоночной хроматографией на силикагеле (этилацетат/н-гептан=1/10-1/3), получая заявленное в заголовке соединение (1,477 г, 68%). 1H ЯМР (400 МГц, CDCl3) δ 2,04 (м, 1H), 2,14 (м, 1H), 2,60 (м, 2H), 2,73 (дд, 1H), 2,92 (дд, 1H), 5,45 (м, 1H), 5,50 (с, 1H), 5,70 (с, 1H), 7,43 (м, 2H), 7,58 (м, 1H), 8,02 (м, 2H), 9,79 (с, 1H).
2-((2R,4aS,6S,7R,8S,8aS)-7,8-бис((трет-бутилдиметилсилил)окси)-6-((с,E)-1-((трет-бутилдиметилсилил)окси)-3-йодаллил)октагидропирано[3,2-b]пиран-2-ил)этанол
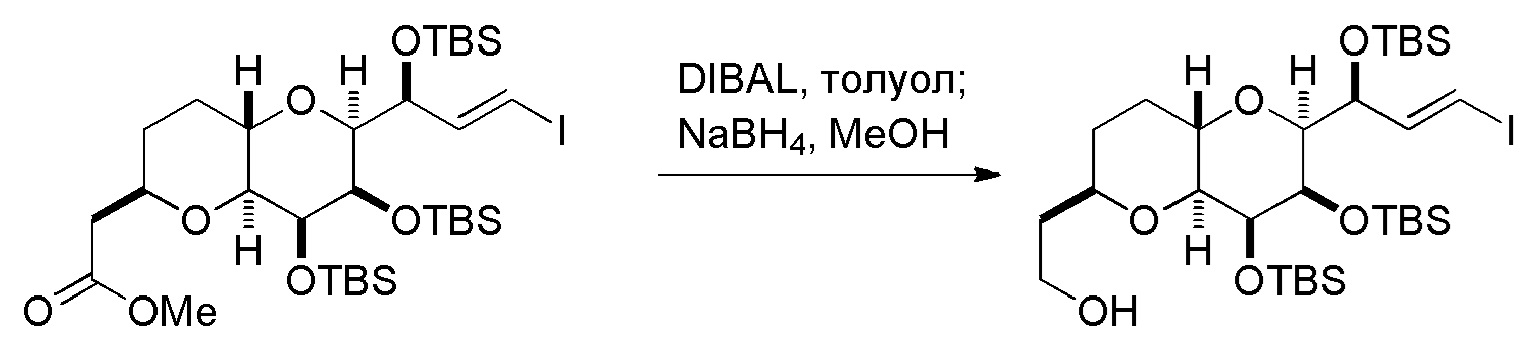
Метил 2-((2R,4aS,6S,7R,8S,8aS)-7,8-бис((трет-бутилдиметилсилил)окси)-6-((с,E)-1-((трет-бутилдиметилсилил)окси)-3-йодаллил)октагидропирано[3,2-b]пиран-2-ил)ацетат (90,0 г, 31,5 ммоль, раствор в толуоле, приблизительно 27%) разбавляли толуолом (316 мл) и охлаждали до -78°C. Смесь обрабатывали 1M DIBAL в толуоле (37,8 мл, 37,8 ммоль) и перемешивали при -78°C в течение 1 часа. После удаления бани со льдом, реакцию гасили метанолом (7,65 мл, 189 ммоль) и обрабатывали 1 N HCl (243 мл, 243 ммоль) и MTBE (170 мл). После перемешивания при комнатной температуре в течение 30 минут, органический слой отделяли, и водный слой экстрагировали MTBE (170 мл). Органические слои объединяли, промывали последовательно 1 N HCl (122 мл), водой (122 мл), насыщенным водным NaHCO3 (122 мл) и соляным раствором (120 мл).
После концентрирования, остаток растворяли в метаноле (194 мл), охлаждали до 0°C и обрабатывали боргидридом натрия (0,596 г, 15,8 ммоль). Реакционную смесь перемешивали при 0°C в течение 1 часа и гасили 1 N HCl (63,0 мл, 63,0 ммоль). После разбавления MTBE (365 мл), органический слой отделяли и промывали последовательно 1 N HCl (63,0 мл) и насыщенным водным NaHCO3 (122 мл) (соляным раствором). Органический слой сушили над MgSO4 и концентрировали в вакууме, получая заявленное в заголовке соединение (23,44 г, 100%).
(((2S,3R,4S,4aS,6R,8aS)-2-((с,E)-1-((трет-бутилдиметилсилил)окси)-3-йодаллил)-6-(2-((триэтилсилил)окси)этил)октагидропирано[3,2-b]пиран-3,4-диил)бис(окси))бис(трет-бутилдиметилсилан)
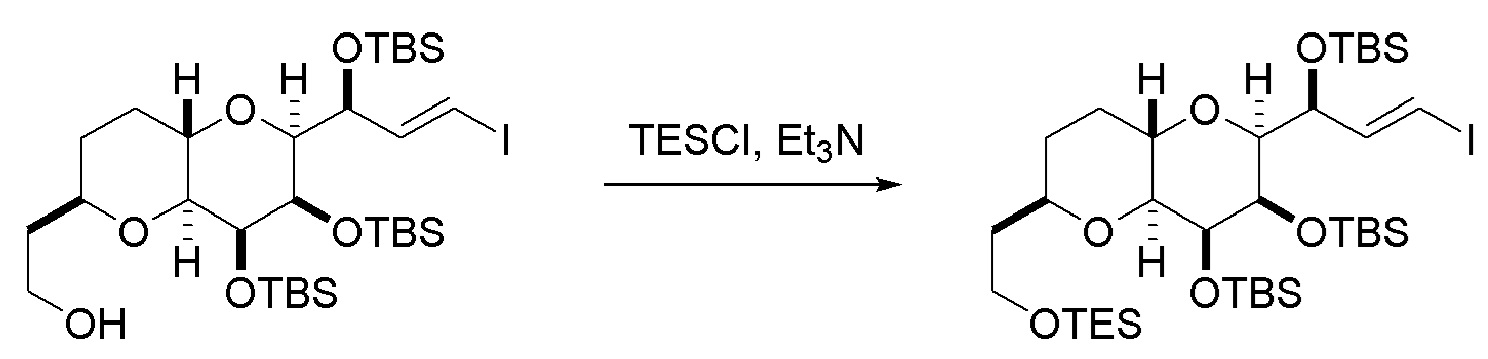
Раствор 2-((2R,4aS,6S,7R,8S,8aS)-7,8-бис((трет-бутилдиметилсилил)окси)-6-((с,E)-1-((трет-бутилдиметилсилил)окси)-3-йодаллил)октагидропирано[3,2-b]пиран-2-ил)этанола (23,44 г, 31,548 ммоль) в CH2Cl2 (211 мл) обрабатывали хлортриэтилсиланом (6,44 мл, 37,9 ммоль) и триэтиламином (8,79 мл, 63,1 ммоль) и перемешивали при комнатной температуре в течение 3 часов. Добавляли дополнительный хлортриэтилсилан (1,06 мл, 6,31 ммоль) и триэтиламин (1,32 мл, 9,46 ммоль), и перемешивание продолжали при комнатной температуре в течение следующих 8 часов. Реакцию гасили водой (117 мл). Органический слой отделяли, и водный слой экстрагировали MTBE (117 мл). Органические слои объединяли и сушили над MgSO4. После концентрирования, остаток очищали колоночной хроматографией на силикагеле (этилацетат/н-гептан=1/20-1/10), получая заявленное в заголовке соединение (23,7 г, 95%). 1H ЯМР (400 МГц, CDCl3) δ 0,02 (с, 3H), 0,03 (с, 3H), 0,10 (с, 3H), 0,11 (с, 3H), 0,12 (с, 3H), 0,14 (с, 3H), 0,59 (кв, 6H), 0,86 (с, 9H), 0,9-1,0 (м, 27 H), 1,25-1,35 (м, 2H), 1,60-1,72 (м, 3H), 1,92 (м, 1H), 2,84 (д, 1H), 3,45 (м, 2H), 3,58 (м, 1H), 3,73 (м, 1H), 3,83 (дд, 1H), 3,89 (дд, 1H), 4,09 (м, 1H), 4,91 (м, 1H), 6,29 (д, 1H), 6,85 (дд, 1H).
(4R,10S,E)-10-((2S,3R,4S,4aS,6R,8aS)-3,4-бис((трет-бутилдиметилсилил)окси)-6-(2-((триэтилсилил)окси)этил)октагидропирано[3,2-b]пиран-2-ил)-2-бром-10-((трет-бутилдиметилсилил)окси)-7-гидроксидека-1,8-диен-4-илбензоат
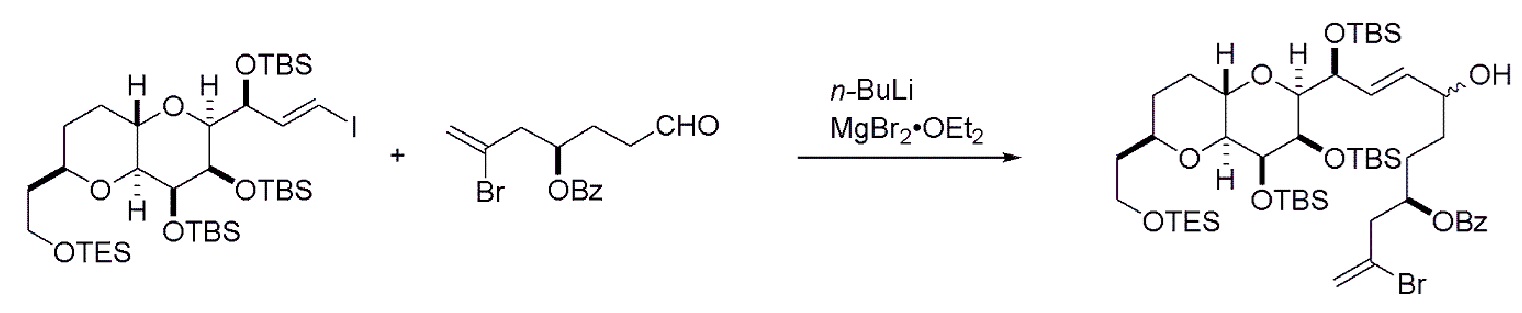
Раствор (((2S, 3R,4S,4aS,6R,8aS)-2-((с,E)-1-((трет-бутилдиметилсилил)окси)-3-йодаллил)-6-(2-((триэтилсилил)окси)этил)октагидропирано[3,2-b]пиран-3,4-диил)бис(окси))бис(трет-бутилдиметилсилана) (4,48 г, 5,22 ммоль) в THF (32,5 мл) охлаждали до -78°C и обрабатывали 1,6 M н-BuLi в н-гексане (3,26 мл, 5,22 ммоль), поддерживая температуру внутри реактора ниже -65°C. После перемешивания при -78°C в течение 20 минут, смесь обрабатывали раствором диэтилэфирата бромида магния (1,35 г, 5,22 ммоль) в THF (16,25 мл), поддерживая температуру внутри реактора ниже -65°C, и перемешивали при -78°C в течение 30 минут. Добавляли раствор (R)-2-бром-7-оксогепт-1-ен-4-илбензоата (1,477 г, 4,747 ммоль) и диэтилэфирата бромида магния (1,35 г, 5,22 ммоль) в THF (18,3 мл), и полученную в результате смесь перемешивали при -78°C в течение 10 мин, медленно нагревали до -25°C в течение 4 часов и перемешивали при -25°C в течение 1 часа. Реакцию гасили насыщенным водным NH4Cl (29,5 мл) и экстрагировали дважды MTBE (29,5 мл). Органические слои объединяли и промывали соляным раствором. После концентрирования, остаток очищали колоночной хроматографией на силикагеле (этилацетат/н-гептан=1/10-1/5), получая заявленное в заголовке соединение (3,35 г, 68%).
(4R,10S,E)-10-((2S,3R,4S,4aS,6R,8aS)-3,4-бис((трет-бутилдиметилсилил)окси)-6-(2-((триэтилсилил)окси)этил)октагидропирано[3,2-b]пиран-2-ил)-2-бром-10-((трет-бутилдиметилсилил)окси)-7-оксодека-1,8-диен-4-илбензоат
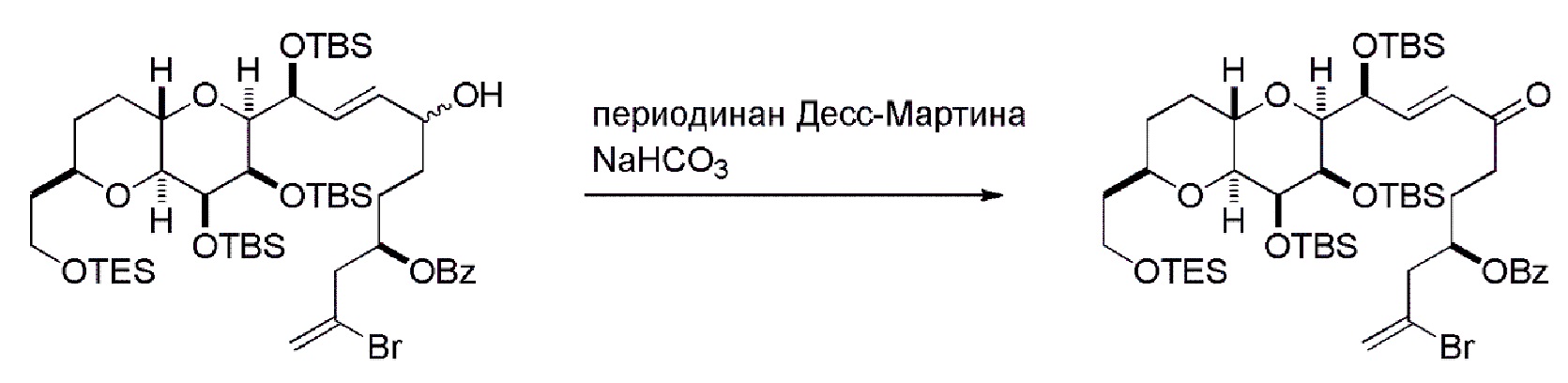
Раствор (4R,10S,E)-10-((2S,3R,4S,4aS,6R,8aS)-3,4-бис((трет-бутилдиметилсилил)окси)-6-(2-((триэтилсилил)окси) этил)октагидропирано[3,2-b]пиран-2-ил)-2-бром-10-((трет-бутилдиметилсилил)окси)-7-гидроксидека-1,8-диен-4-илбензоата (3,35 г, 3,213 ммоль) в CH2Cl2 (33,5 мл) обрабатывали бикарбонатом натрия (0,540 г, 6,43 ммоль) и периодинаном Десс-Мартина (1,64 г, 3,86 ммоль). Смесь перемешивали при комнатной температуре в течение 1 часа. Реакцию гасили насыщенным водным NaHCO3 (25,1 мл) и 20% Na2SO3 (25,1 мл) и экстрагировали дважды MTBE (26,8 мл). Органические слои объединяли и промывали соляным раствором (16,75 мл). После концентрирования, остаток очищали колоночной хроматографией на силикагеле (этилацетат/н-гептан=1/20-1/8), получая заявленное в заголовке соединение (2,26 г, 68%). 1H ЯМР (400 МГц, CDCl3) δ 0,07 (с, 3H), 0,02 (с, 3H), 0,11 (с, 6H), 0,12 (с, 3H), 0,13 (с, 3H), 0,60 (кв, 6H), 0,82 (с, 9H), 0,88 (т, 9H), 0,92 (с, 9H), 0,94 (с, 9H), 1,05-1,25 (м, 3H), 1,48-1,60 (м, 3H), 1,70 (м, 1H), 2,00-2,20 (м, 2H), 2,69 (м, 2H), 2,72 (дд, 1H), 2,82 (д, 2H), 2,91 (дд, 1H), 3,29 (м, 1H), 3,42 (м, 1H), 3,63 (м, 1H), 3,72 (м, 1H), 3,91 (м, 2H), 4,10 (уш с, 1H), 5,11 (м, 1H), 5,43 (м, 1H), 5,49 (д, 1H), 5,68 (с, 1H), 6,29 (д, 1H), 7,08 (дд, 1H), 7,41 (м, 2H), 7,52 (м, 1H), 8,01 (м, 2H).
(R)-2-бром-8-((2R,3S,3aS,4aS,7R,8aR,9S,9aS)-3,9-дигидрокси-7-(2-гидроксиэтил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-2-ил)-7-оксоокт-1-ен-4-илбензоат
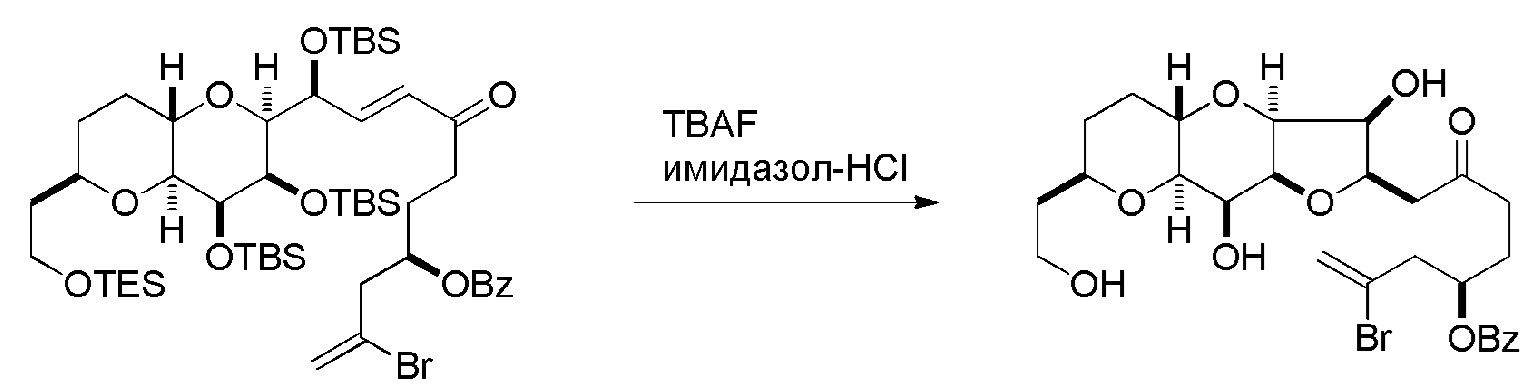
Смесь гидрохлорида имидазола (0,704 г, 6,73 ммоль) и 1 M TBAF в THF (14,12 мл, 14,1 ммоль) в THF (45,2 мл) обрабатывали раствором (4R,10S,E)-10-((2S,3R,4S,4aS,6R,8aS)-3,4-бис((трет-бутилдиметилсилил)окси)-6-(2-((триэтилсилил)окси)этил) октагидропирано[3,2-b]пиран-2-ил)-2-бром-10-((трет-бутилдиметилсилил)окси)-7-оксодека-1,8-диен-4-илбензоата (2,26 г, 2,17 ммоль) в THF (31,6 мл). Смесь перемешивали при комнатной температуре в течение 7 дней. Смесь обрабатывали толуолом (56,5 мл) и водой (56,5 мл). Органический слой отделяли, и водный слой экстрагировали дважды смесью толуола (38,4 мл) и THF (38,4 мл). Органические слои объединяли, концентрировали в вакууме, и затем азеотропно упаривали три раза с ацетонитрилом (18,1 мл), получая заявленное в заголовке соединение (1,4 г).
(R)-5-бром-1-((2S,3aR,4aR,5S,5aS,7R,9aS,10aR,10bS)-7-(2-гидроксиэтил)додекагидро-2,5-эпоксифуро[2',3':4,5]фуро[3,2-b]пирано[2,3-e]пиран-2-ил)гекс-5-ен-3-илбензоат
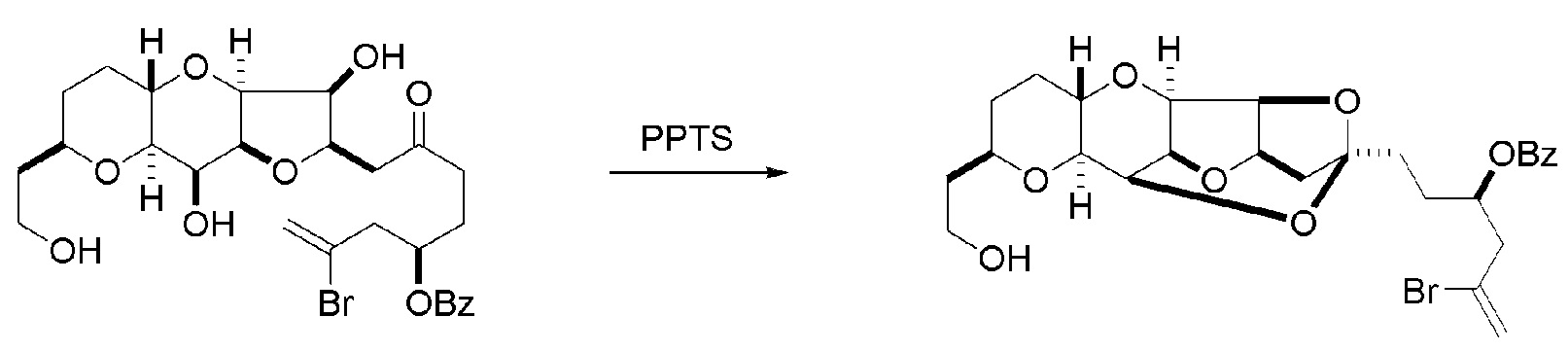
Раствор (R)-2-бром-8-((2R,3S,3aS,4aS,7R,8aR,9S,9aS)-3,9-дигидрокси-7-(2-гидроксиэтил)декагидрофуро[3,2-b]пирано[2,3-e]пиран-2-ил)-7-оксоокт-1-ен-4-илбензоата (1,27 г, 2,17 ммоль) в CH2Cl2 (68,4 мл) обрабатывали PPTS (3,00 г, 11,9 ммоль) и перемешивали при комнатной температуре в течение 23 часов. После концентрирования, оставшийся остаток (PPTS) обрабатывали этилацетатом (50,7 мл), перемешивали при комнатной температуре в течение 10 мин, фильтровали и промывали этилацетатом. Фильтрат концентрировали, обрабатывали снова этилацетатом (10,14 мл) и перемешивали при комнатной температуре в течение 2 часов. Осадок фильтровали, промывали этилацетатом (3 мл), и сушили продуванием N2, получая заявленное в заголовке соединение (1ая порция, 495 мг, загрязненная 14% PPTS).
Фильтрат обрабатывали этилацетатом (приблизительно 3 мл) при 40°C и перемешивали при температуре окружающей среды в течение 2 часов. Осадок фильтровали, промывали этилацетатом (1 мл) и сушили в потоке N2, получая заявленное в заголовке соединение (2ая порция, 175 мг, в сумме 47% (объединенные 1ая и 2ая порции) на 2 стадии). 1H ЯМР (400 МГц, CDCl3) δ 1,30-1,50 (м, 2H), 1,65-2,16 (м, 10H), 2,79 (м, 1H), 2,86-2,94 (м, 2H), 3,61 (м, 1H), 3,70-3,84 (м, 2H), 4,05 (дд, 1H), 4,19 (дд, 1H), 4,27 (м, 1H), 4,42 (м, 1H), 4,60 (дд, 1H), 4,68 (дд, 1H), 5,40 (м, 1H), 5,47 (с, 1H), 5,68 (с, 1H), 7,41 (м, 2H), 7,57 (м, 1H), 8,03 (м, 2H).
(R)-5-бром-1-((2S,3aR,4aR,5S,5aS,7R,9aS,10aR,10bS)-7-(2-оксоэтил)декагидро-2,5-эпоксифуро[2',3':4,5]фуро[3,2-b]пирано[2,3-e]пиран-2(3H)-ил)гекс-5-ен-3-илбензоат
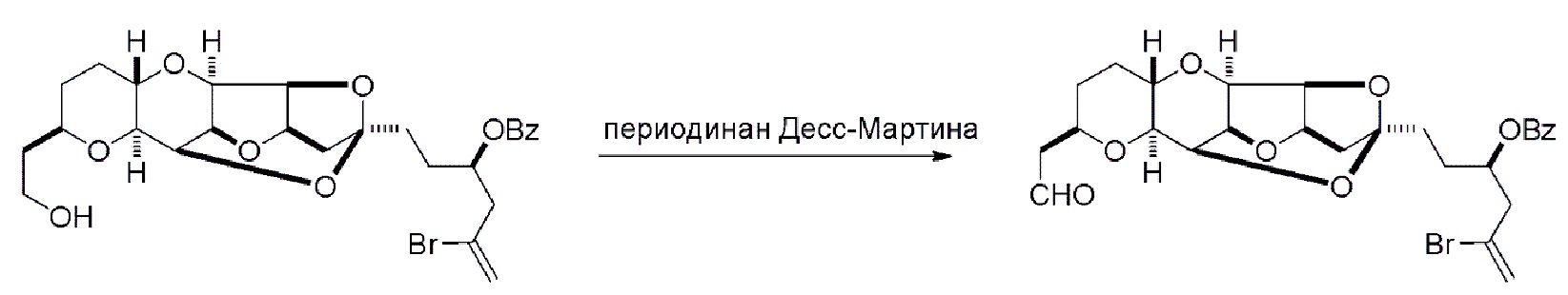
Смесь (R)-5-бром-1-((2S,3aR,4aR,5S,5aS,7R,9aS,10aR,10bS)-7-(2-гидроксиэтил)додекагидро-2,5-эпоксифуро[2',3':4,5]фуро[3,2-b]пирано[2,3-e]пиран-2-ил)гекс-5-ен-3-илбензоата (0,49 г, 0,87 ммоль) и бикарбоната натрия (0,182 г, 2,17 ммоль) в CH2Cl2 (4,9 мл) обрабатывали периодинаном Десс-Мартина (0,551 г, 1,30 ммоль) и перемешивали при комнатной температуре в течение 2 часов. Реакцию гасили 20% Na2SO3 (2,5 мл) и насыщенным водным NaHCO3 (2,5 мл). Смесь экстрагировали три раза MTBE (4,9 мл) и этилацетатом (4,9 мл). Объединенные органические слои сушили над MgSO4 и концентрировали в вакууме.
Остаток растворяли в этилацетате (приблизительно 3 мл) при нагревании и медленно охлаждали до комнатной температуры в течение 20 часов. Осадок фильтровали, промывали этилацетатом (1 мл) и сушили в потоке N2 в течение 2 часов, получая заявленное в заголовке соединение (216 мг, 44%) вместе с 200 мг из фильтрата. 1H ЯМР (400 МГц, CDCl3) δ 1,40 (м, 2H), 1,77 (м, 1H), 1,86 (м, 1H), 1,92-2,16 (м, 6H), 2,48 (м, 1H), 2,73 (м, 1H), 2,78 (м, 1H), 2,87-2,95 (м, 2H), 3,89 (м, 1H), 4,08 (дд, 1H), 4,20 (дд, 1H), 4,28 (м, 1H), 4,43 (м, 1H), 4,51 (дд, 1H), 4,69 (дд, 1H), 5,46 (м, 1H), 5,48 (с, 1H), 5,68 (с, 1H), 7,43 (м, 2H), 7,55 (м, 1H), 8,03 (м, 2H), 9,79 (с, 1H).
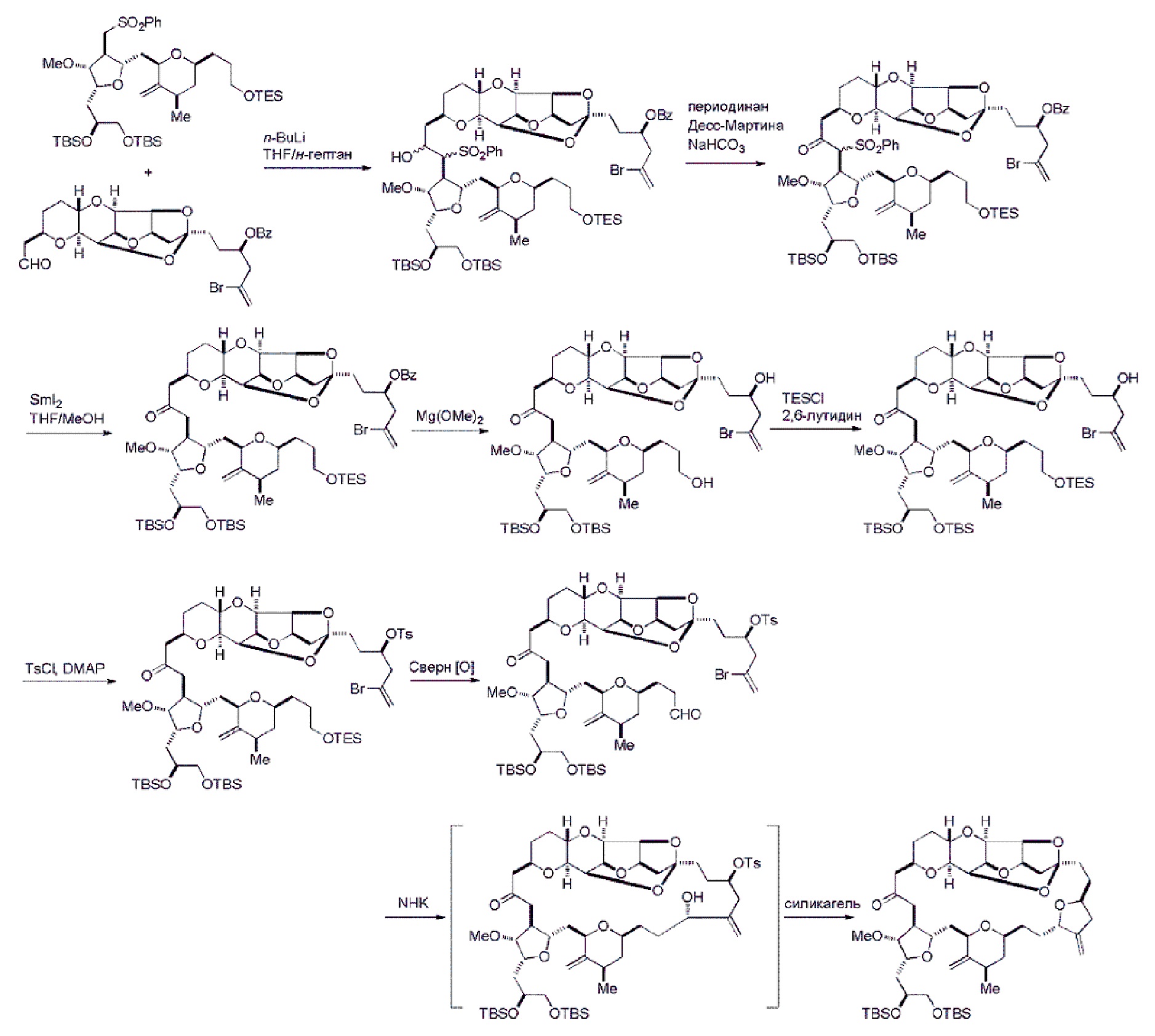
(3R)-1-((2S,3aR,4aR,5S,5aS,7R,9aS,10aR,10bS)-7-(3-((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-2-(((2R,4R,6S)-4-метил-3-метилен-6-(3-((триэтилсилил)окси)пропил)тетрагидро-2H-пиран-2-ил)метил)тетрагидрофуран-3-ил)-2-гидрокси-3-(фенилсульфонил)пропил)додекагидро-2,5-эпоксифуро[2',3':4,5]фуро[3,2-b]пирано[2,3-e]пиран-2-ил)-5-бромгекс-5-ен-3-илбензоат
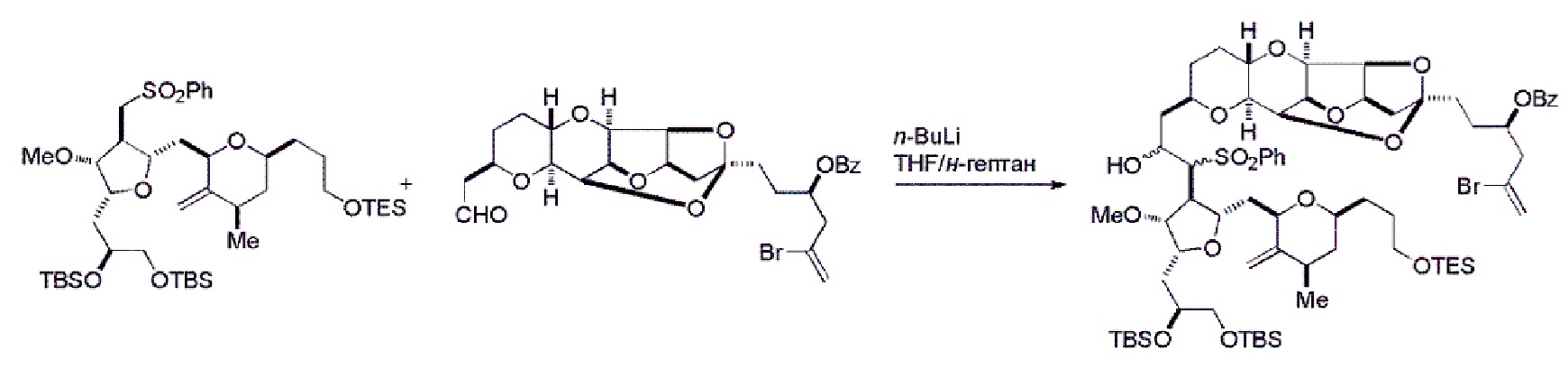
Раствор (S)-5-(((2R,3R,4S,5S)-3-метокси-5-(((2R,4R,6S)-4-метил-3-метилен-6-(3-((триэтилсилил)окси)пропил)тетрагидро-2H-пиран-2-ил)метил)-4-((фенилсульфонил)метил)тетрагидрофуран-2-ил)метил)-2,2,3,3,8,8,9,9-октаметил-4,7-диокса-3,8-дисиладекана (0,478 г, 0,559 ммоль) в THF (4,2 мл) охлаждали до -5°C. Смесь обрабатывали 1,6 M н-BuLi в н-гексане (0,349 мл, 0,559 ммоль) и перемешивали при -5°C в течение 30 минут. После охлаждения до -78°C, смесь обрабатывали раствором (R)-5-бром-1-((2S,3aR,4aR,5S,5aS,7R,9aS,10aR,10bS)-7-(2-оксоэтил)додекагидро-2,5-эпоксифуро[2',3':4,5]фуро[3,2-b]пирано[2,3-e]пиран-2-ил)гекс-5-ен-3-илбензоата (0,21 г, 0,373 ммоль) в смеси н-гептана (1,1 мл) и THF (3,2 мл), поддерживая температуру внутри реактора ниже -65°C. После перемешивания при -78°C в течение 4 часов, реакцию гасили насыщенным водным NH4Cl (5 мл) и экстрагировали три раза MTBE (10 мл). Органические слои объединяли, сушили над MgSO4 и концентрировали в вакууме, получая заявленное в заголовке соединение (690 мг, 130%).
(R)-1-((2S,3aR,4aR,5S,5aS,7R,9aS,10aR,10bS)-7-(3-((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-2-(((2R,4R,6S)-4-метил-3-метилен-6-(3-((триэтилсилил)окси)пропил)тетрагидро-2H-пиран-2-ил)метил)тетрагидрофуран-3-ил)-2-оксо-3-(фенилсульфонил)пропил)додекагидро-2,5-эпоксифуро[2',3':4,5]фуро[3,2-b]пирано[2,3-e]пиран-2-ил)-5-бромгекс-5-ен-3-илбензоат
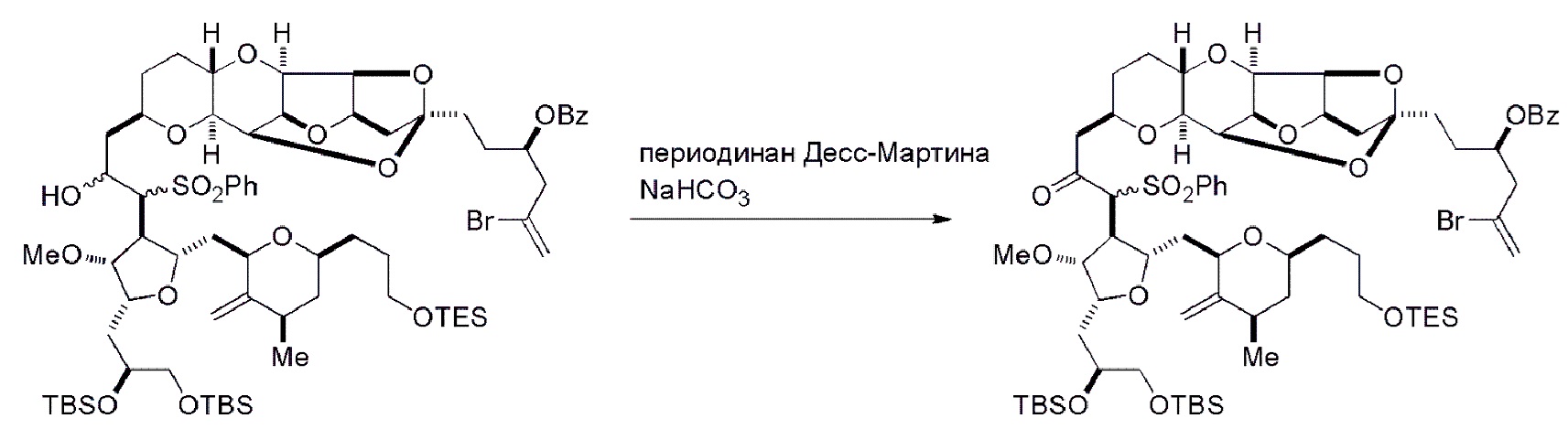
Раствор (3R)-1-((2S,3aR,4aR,5S,5aS,7R,9aS,10aR,10bS)-7-(3-((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-2-(((2R,4R,6S)-4-метил-3-метилен-6-(3-((триэтилсилил)окси)пропил)тетрагидро-2H-пиран-2-ил)метил)тетрагидрофуран-3-ил)-2-гидрокси-3-(фенилсульфонил)пропил)додекагидро-2,5-эпоксифуро[2',3':4,5]фуро[3,2-b]пирано[2,3-e]пиран-2-ил)-5-бромгекс-5-ен-3-илбензоата (0,69 г, 0,49 ммоль) в CH2Cl2 (6,9 мл) обрабатывали бикарбонатом натрия (0,061 г, 0,73 ммоль) и периодинаном Десс-Мартина (0,248 г, 0,584 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 часа, гасили насыщенным водным NaHCO3 (6,9 мл) и 20% Na2SO3 (6,9 мл) и экстрагировали дважды MTBE (10,35 мл, 86,888 ммоль). Органические слои объединяли и промывали соляным раствором. После концентрирования, остаток очищали колоночной хроматографией на силикагеле (этилацетат/н-гептан=1/10-1/2), получая заявленное в заголовке соединение (366 мг, 69% на 2 стадии).
(R)-1-((2S,3aR,4aR,5S,5aS,7R,9aS,10aR,10bS)-7-(3-((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-2-(((2R,4R,6S)-4-метил-3-метилен-6-(3-((триэтилсилил)окси)пропил)тетрагидро-2H-пиран-2-ил)метил) тетрагидрофуран-3-ил)-2-оксопропил)додекагидро-2,5-эпоксифуро[2',3':4,5]фуро[3,2-b]пирано[2,3-e]пиран-2-ил)-5-бромгекс-5-ен-3-илбензоат
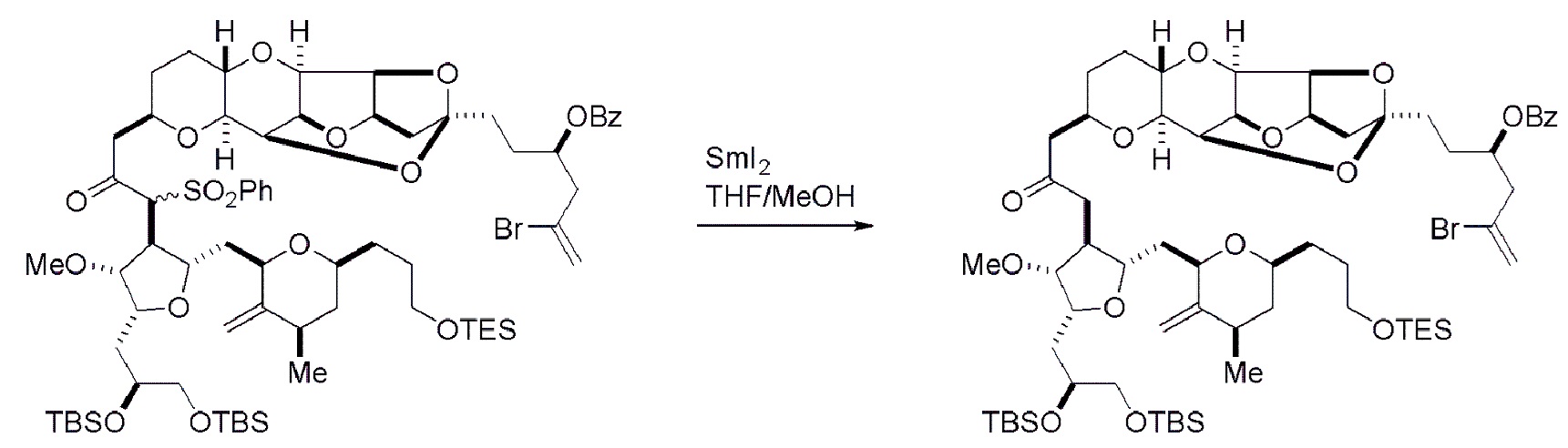
Раствор (R)-1-((2S,3aR,4aR,5S,5aS,7R, 9aS,10aR,10bS)-7-(3-((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-2-(((2R,4R,6S)-4-метил-3-метилен-6-(3-((триэтилсилил)окси)пропил)тетрагидро-2H-пиран-2-ил)метил)тетрагидрофуран-3-ил)-2-оксо-3-(фенилсульфонил)пропил)додекагидро-2,5-эпоксифуро[2',3':4,5]фуро[3,2-b]пирано[2,3-e]пиран-2-ил)-5-бромгекс-5-ен-3-илбензоата (0,366 г, 0,258 ммоль) в смеси THF (2,9 мл) и метанола (1,8 мл) охлаждали до -78°C и обрабатывали 0,1M SmI2 в THF (5,55 мл, 0,555 ммоль). После перемешивания при -78°C в течение 1 часа, ледяную баню удаляли, и смесь обрабатывали смесью сегнетовой соли (1,83 г, 6,48 ммоль) и карбоната калия (1,7 г, 13 ммоль) в воде (18,3 мл). Смесь энергично перемешивали при комнатной температуре в течение 10 мин и экстрагировали дважды MTBE (7,32 мл). Органические слои объединяли и промывали соляным раствором. После концентрирования, остаток очищали колоночной хроматографией на силикагеле (этилацетат/н-гептан=1/10-1/2), получая заявленное в заголовке соединение (289 мг, 88%). 1H ЯМР (400 МГц, CDCl3) δ 0,15 (с, 9H), 0,30 (с, 3H), 0,58 (кв, 6H), 0,88 (с, 9H), 0,89 (с, 9H), 0,95 (т, 9H), 0,98-1,05 (м, 2H), 1,06 (д, 3H), 1,20-1,72 (м, 7H), 1,72-1,84 (м, 3H), 1,84-2,16 (м, 9H), 2,25 (м, 1H), 2,42 (м, 2H), 2,55 (дд, 1H), 2,72-2,86 (м, 2H), 2,92 (м, 2H), 3,34 (дд, 1H), 3,52 (с, 3H), 3,44-3,68 (м, 6H), 3,75 (м, 2H), 3,85 (м, 2H), 4,04 (м, 1H), 4,19 (дд, 1H), 4,24 (м, 1H), 4,39 (м, 1H), 4,59 (м, 1H), 4,67 (м, 1H), 4,78 (с, 1H), 4,84 (м, 1H), 5,45 (м, 1H), 5,48 (с, 1H), 5,68 (с, 1H), 7,41 (м, 2H), 7,58 (м, 1H), 8,02 (м, 2H).
1-((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-2-(((2R,4R,6S)-6-(3-гидроксипропил)-4-метил-3-метилентетрагидро-2H-пиран-2-ил)метил)-4-метокситетрагидрофуран-3-ил)-3-((2S,3aR,4aR,5S,5aS,7R,9aS,10aR,10bS)-2-((R)-5-бром-3-гидроксигекс-5-ен-1-ил)додекагидро-2,5-эпоксифуро[2',3':4,5]фуро[3,2-b]пирано[2,3-e]пиран-7-ил)пропан-2-он
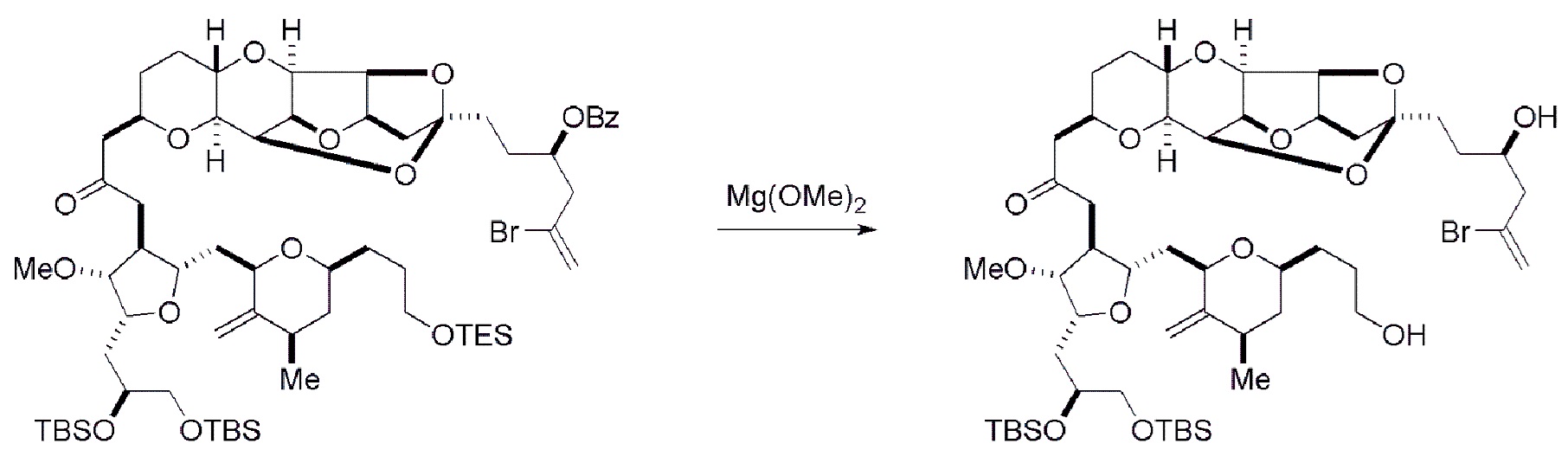
Раствор (R)-1-((2S,3aR,4aR,5S,5aS, 7R,9aS,10aR,10bS)-7-(3-((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-2-(((2R,4R,6S)-4-метил-3-метилен-6-(3-((триэтилсилил)окси)пропил)тетрагидро-2H-пиран-2-ил)метил)тетрагидрофуран-3-ил)-2-оксопропил)додекагидро-2,5-эпоксифуро[2',3':4,5]фуро[3,2-b]пирано[2,3-e]пиран-2-ил)-5-бромгекс-5-ен-3-илбензоата (0,285 г, 0,223 ммоль) в смеси метанола (5,7 мл) и THF (0,29 мл) обрабатывали 6-10% Mg(OMe)2 в метаноле (1,29 г, 0,893 ммоль) и перемешивали при комнатной температуре в течение 5 дней. Добавляли карбонат калия (0,093 г, 0,67 ммоль), и перемешивание продолжали при комнатной температуре в течение следующего 1 дня. Реакцию гасили насыщенным водным NH4Cl (4,28 мл) и соляным раствором (4,28 мл) и экстрагировали три раза MTBE (11,40 мл). Органические слои объединяли, сушили над MgSO4 и концентрировали в вакууме, получая заявленное в заголовке соединение (280 мг, 119%).
1-((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-2-(((2R,4R, 6S)-4-метил-3-метилен-6-(3-((триэтилсилил)окси)пропил)тетрагидро-2H-пиран-2-ил)метил)тетрагидрофуран-3-ил)-3-((2S,3aR,4aR,5S,5aS,7R,9aS,10aR,10bS)-2-((R)-5-бром-3-гидроксигекс-5-ен-1-ил)додекагидро-2,5-эпоксифуро [2',3':4,5]фуро[3,2-b]пирано [2,3-e]пиран-7-ил)пропан-2-он
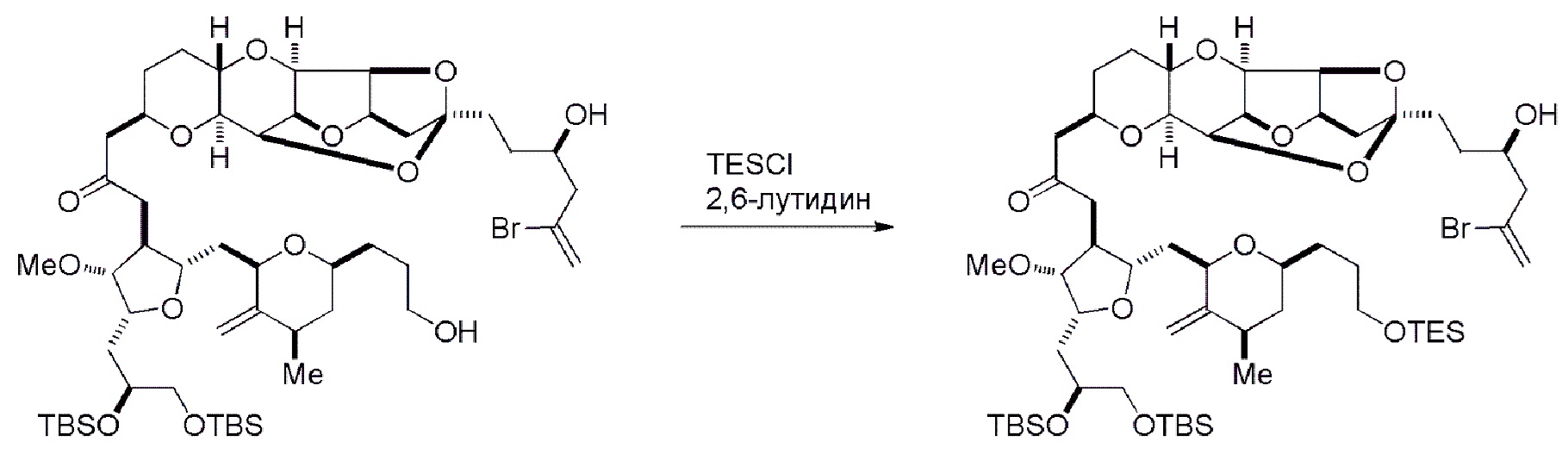
Раствор 1-((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-2-(((2R,4R,6S)-6-(3-гидроксипропил)-4-метил-3-метилентетрагидро-2H-пиран-2-ил)метил)-4-метокситетрагидрофуран-3-ил)-3-((2S,3aR,4aR,5S,5aS,7R,9aS,10aR,10bS)-2-((R)-5-бром-3-гидроксигекс-5-ен-1-ил)додекагидро-2,5-эпоксифуро[2',3':4,5]фуро[3,2-b]пирано[2,3-e]пиран-7-ил)пропан-2-она (0,28 г, 0,265 ммоль) в CH2Cl2 (5,6 мл) охлаждали до -78°C и обрабатывали 2,6-лутидином (0,123 мл, 1,06 ммоль) и хлортриэтилсиланом (0,054 мл, 0,32 ммоль). Реакционную смесь перемешивали при -78°C в течение 2 часов. Реакцию гасили метанолом (0,107 мл, 2,65 ммоль) и перемешивали при -78°C в течение 10 мин. После удаления ледяной бани, смесь обрабатывали водой (5,6 мл) и нагревали до комнатной температуры. Смесь экстрагировали дважды MTBE (11,20 мл). Органические слои объединяли, промывали 0,1 N HCl (6,09 мл, 0,609 ммоль) и насыщенным водным NaHCO3 (2,80 мл), сушили над MgSO4 и концентрировали в вакууме, получая заявленное в заголовке соединение (327 мг, 105%).
(R)-1-((2S,3aR,4aR,5S,5aS,7R,9aS,10aR,10bS)-7-(3-((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-2-(((2R,4R,6S)-4-метил-3-метилен-6-(3-((триэтилсилил)окси)пропил)тетрагидро-2H-пиран-2-ил)метил)тетрагидрофуран-3-ил)-2-оксопропил)декагидро-2,5-эпоксифуро[2',3':4,5]фуро[3,2-b]пирано[2,3-e]пиран-2(3H)-ил)-5-бромгекс-5-ен-3-ил 4-метилбензолсульфонат
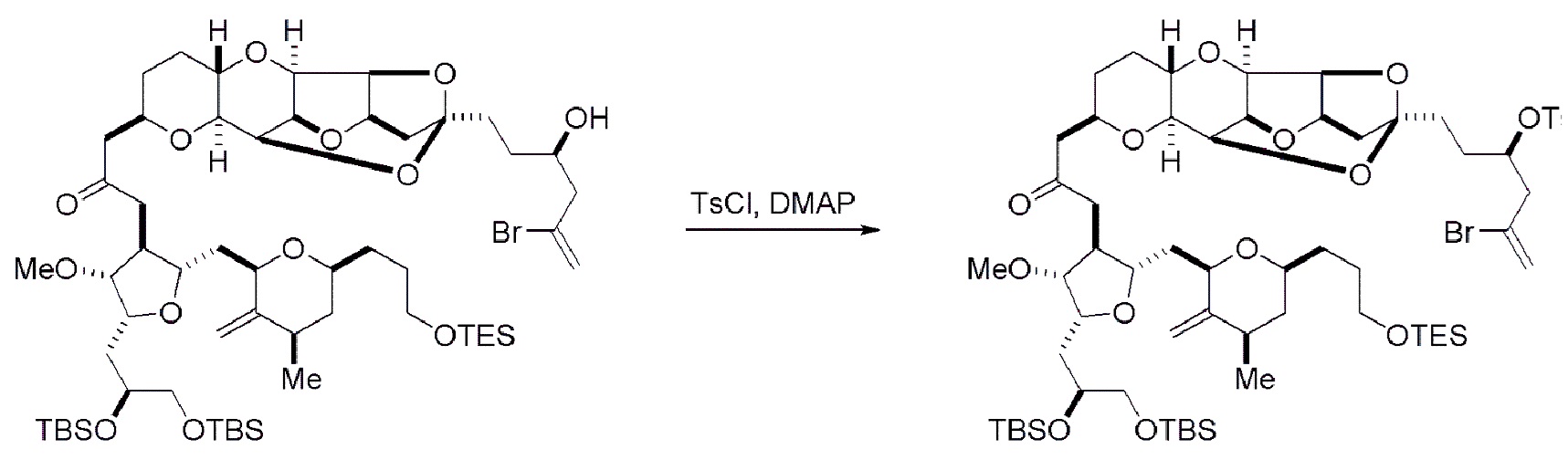
1-((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-2-(((2R,4R,6S)-4-метил-3-метилен-6-(3-((триэтилсилил)окси)пропил)тетрагидро-2H-пиран-2-ил)метил)тетрагидрофуран-3-ил)-3-((2S,3aR,4aR,5S,5aS,7R,9aS,10aR,10bS)-2-((R)-5-бром-3-гидроксигекс-5-ен-1-ил)додекагидро-2,5-эпоксифуро[2',3':4,5]фуро[3,2-b]пирано[2,3-e]пиран-7-ил)пропан-2-он (0,327 г, 0,279 ммоль) растворяли в CH2Cl2 (4,9 мл) и обрабатывали DMAP (0,102 г, 0,837 ммоль) и п-TsCl (0,064 г, 0,34 ммоль). Смесь перемешивали при комнатной температуре в течение 16 часов. Добавляли дополнительный DMAP (0,020 г, 0,17 ммоль) и п-TsCl (0,016 г, 0,084 ммоль), и перемешивание продолжали при комнатной температуре в течение следующих 24 часов. Реакционную смесь разбавляли MTBE (20 мл) и последовательно промывали 0,1 N HCl (8,4 мл × 2), насыщенным водным NaHCO3 (3,3 мл) и соляным раствором (3,3 мл). После концентрирования, остаток очищали колоночной хроматографией (этилацетат/н-гептан=1/10-2/3), получая заявленное в заголовке соединение (215 мг, 72% на 3 стадии). 1H ЯМР (400 МГц, CDCl3) δ 0,03 (2с, 9H), 0,60 (с, 3H), 0,59 (кв, 6H), 0,85 (с, 9H), 0,87 (с, 9H), 0,94 (т, 9H), 0,96-1,10 (м, 2H), 1,06 (д, 3H), 1,28-1,60 (м, 5H), 1,60-1,84 (м, 6H), 1,84-2,16 (м, 8H), 2,24 (м, 1H), 2,42 (м, 2H), 2,51 (дд, 1H), 2,64 (дд, 1H), 2,72 (дд, 1H), 2,82 (дд, 1H), 2,90 (д, 1H), 3,26 (м, 1H), 3,52 (с, 3H), 3,44-3,68 (м, 6H), 3,75 (м, 2H), 3,84 (м, 2H), 4,04 (м, 1H), 4,19 (м, 1H), 4,35 (м, 1H), 4,58 (м, 1H), 4,66 (м, 1H), 4,67 (м, 1H), 4,78 (с, 1H), 4,85 (м, 1H), 4,84 (с, 1H), 5,35 (м, 1H), 5,58 (с, 1H), 7,35 (д, 2H), 7,80 (д, 2H)
(R)-1-((2S,3aR,4aR,5S,5aS,7R,9aS,10aR,10bS)-7-(3-((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-2-(((2R,4R,6S)-4-метил-3-метилен-6-(3-оксопропил)тетрагидро-2H-пиран-2-ил)метил)тетрагидрофуран-3-ил)-2-оксопропил)додекагидро-2,5-эпоксифуро[2',3':4,5]фуро[3,2-b]пирано[2,3-e]пиран-2-ил)-5-бромгекс-5-ен-3-ил 4-метилбензолсульфонат
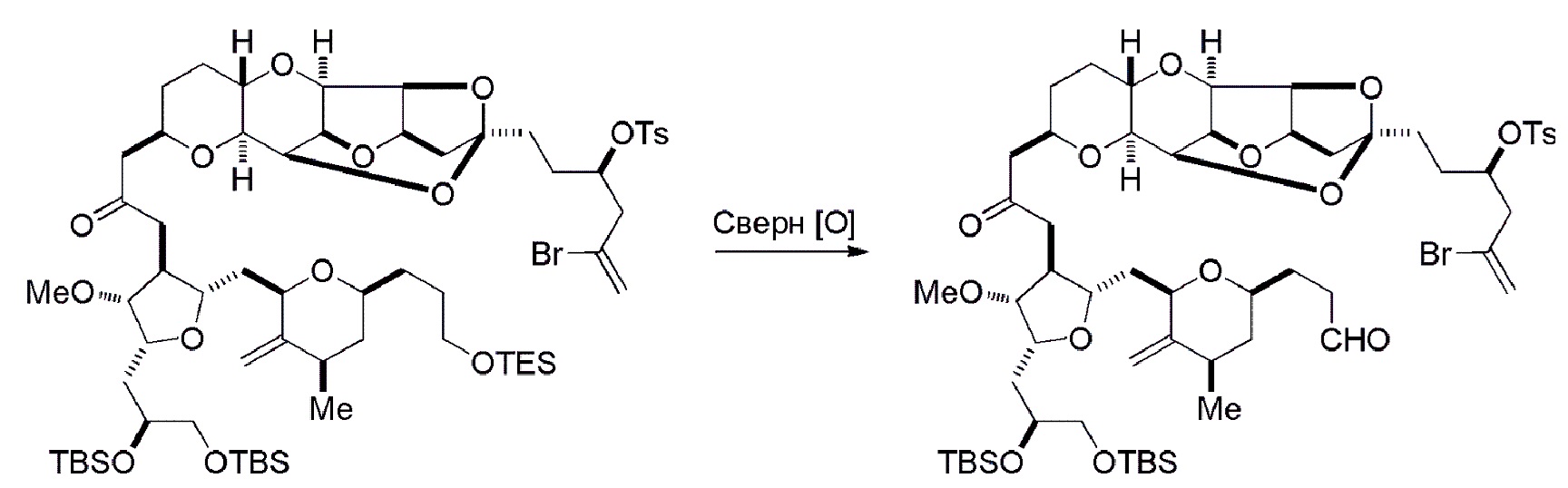
Раствор 2 M оксалилхлорида в CH2Cl2 (0,810 мл, 1,62 ммоль) в CH2Cl2 (4,30 мл) охлаждали до -78°C и обрабатывали DMSO (0,230 мл, 3,24 ммоль). После перемешивания в течение 10 мин при -78°C, добавляли раствор (R)-1-((2S,3aR,4aR,5S,5aS,7R,9aS,10aR,10bS)-7-(3-((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-2-(((2R,4R,6S)-4-метил-3-метилен-6-(3-((триэтилсилил)окси)пропил)тетрагидро-2H-пиран-2-ил)метил)тетрагидрофуран-3-ил)-2-оксопропил)додекагидро-2,5-эпоксифуро[2',3':4,5]фуро[3,2-b]пирано[2,3-e]пиран-2-ил)-5-бромгекс-5-ен-3-ил 4-метилбензолсульфоната (0,215 г, 0,162 ммоль) в CH2Cl2 (2,2 мл). Смесь перемешивали при -78°C в течение 10 мин и при -40°C в течение 1 часа. После охлаждения до -78°C, смесь обрабатывали триэтиламином (1,13 мл, 8,10 ммоль) и перемешивали при -78°C в течение 10 мин и при 0°C в течение 20 минут. Полученную в результате смесь обрабатывали водой (4,3 мл) и разбавляли MTBE (21,5 мл). Органический слой отделяли и промывали соляным раствором. После концентрирования, остаток очищали колоночной хроматографией на силикагеле (этилацетат/н-гептан=1/10-1/1), получая заявленное в заголовке соединение (166 мг, 85%).
Бис-TBS эфир
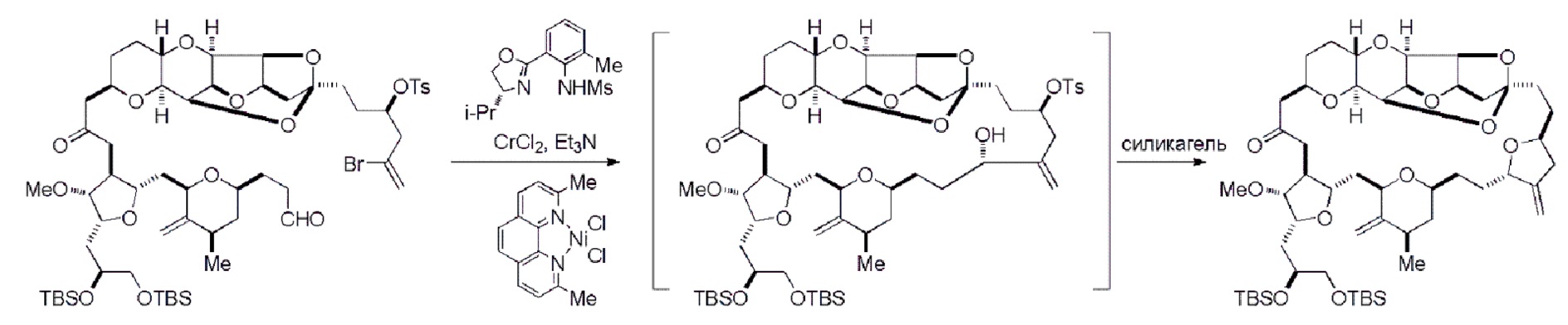
Хлорид хрома (II) (0,520 г, 4,23 ммоль) добавляли в 3-горлую колбу, которую продували N2 в течение 5 минут, и в колбу добавляли раствор (R)-N-(2-(4-изопропил-4,5-дигидрооксазол-2-ил)-6-метилфенил)метансульфамида (1,25 г, 4,23 ммоль) в дегазированном THF (7,5 мл). Смесь нагревали до 30°C, обрабатывали триэтиламином (0,590 мл, 4,23 ммоль) и перемешивали при 33°C в течение 1 часа. После охлаждения до 0°C, смесь обрабатывали комплексом хлорида никеля (II) и 2,9-диметил-1,10-фенантролина (0,023 г, 0,069 ммоль) и продували N2 в течение 5 минут. После удаления бани со льдом, добавляли раствор (R)-1-((2S,3aR,4aR,5S,5aS,7R,9aS,10aR,10bS)-7-(3-((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-2-(((2R,4R,6S)-4-метил-3-метилен-6-(3-оксопропил)тетрагидро-2H-пиран-2-ил)метил)тетрагидрофуран-3-ил)-2-оксопропил)додекагидро-2,5-эпоксифуро[2',3':4,5]фуро[3,2-b]пирано[2,3-e]пиран-2-ил)-5-бромгекс-5-ен-3-ил 4-метилбензолсульфоната (0,083 г, 0,069 ммоль) в дегазированном THF (4,98 мл) в течение 2 часов шприцевым насосом. Смесь перемешивали при комнатной температуре в течение следующих 2 часов. После охлаждения до 0°C, реакцию гасили этилендиамином (0,926 мл, 13,7 ммоль), поддерживая температуру внутри реактора ниже 10°C, и перемешивали при комнатной температуре в течение 10 мин. Смесь обрабатывали водой (9,96 мл) и экстрагировали дважды MTBE (9,96 мл). Органические слои объединяли, сушили над MgSO4 и концентрировали в вакууме.
Остаток растворяли в изопропаноле (IPA) (4,98 мл), обрабатывали силикагелем (166 мг) и перемешивали при комнатной температуре в течение 23 часов. Осадок фильтровали и промывали IPA (3 мл) и гептаном (3 мл). Фильтрат выдерживали в морозильной камере в течение 2 часов. Полученный в результате остаток фильтровали и промывали IPA (5 мл). Фильтрат концентрировали и очищали колоночной хроматографией на силикагеле (этилацетат/н-гептан=1/10-3/2), получая заявленное в заголовке соединение (33 мг, 50%), структуру которого подтверждали сравнением его 1H ЯМР спектра со спектром аутентичного образца. 1H ЯМР (400 МГц, C6D6) δ 0,05 (с, 6H), 0,14 (с, 3H), 0,16 (с, 3H), 0,77 (д, 3H), 0,94 (с, 9H), 0,99 (с, 9H), 1,05-1,30 (м, 2H), 1,30-1,46 (м, 3H), 1,20-1,72 (м, 2H), 1,50-1,70 (м, 3H), 1,84-2,00 (м, 4H), 2,05-2,20 (м, 3H), 2,28-2,40 (м, 4H), 2,50 (м, 2H), 2,60 (м, 2H), 2,70 (м, 2H), 2,86 (м, 1H), 3,50 (м, 1H), 3,52-3,72 (м, 4H), 3,58 (с, 3H), 3,74-3,84 (м, 2H), 3,95 (м, 1H), 4,00-4,22 (м, 7H), 4,04 (м, 1H), 4,38 (м, 1H), 4,56 (уш м, 1H), 4,57 (с, 1H), 4,74 (с, 1H), 4,98 (м, 2H).
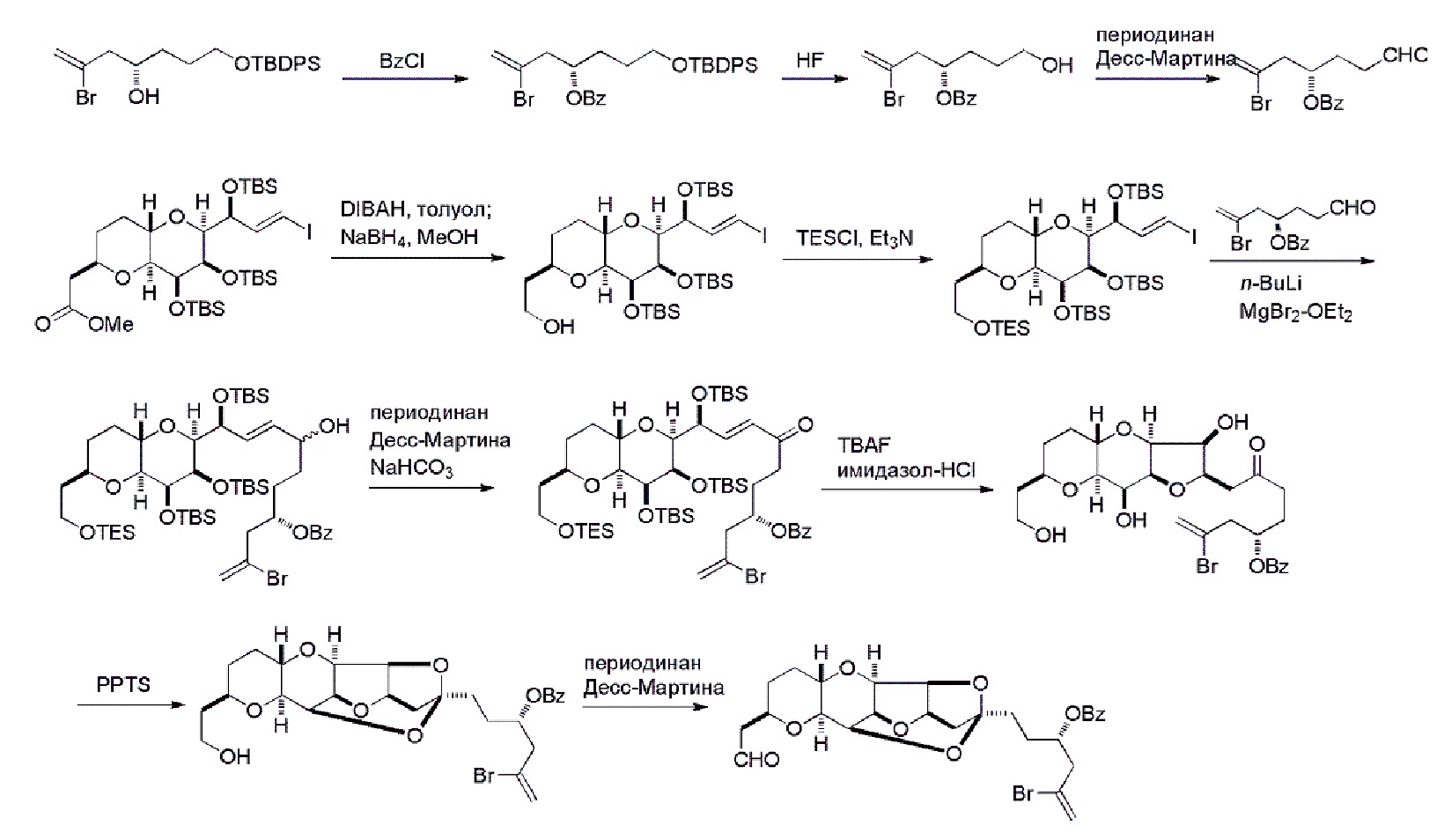
Все соединения получали, следуя тем же способам, показанным выше, исходя из (S)-2-бром-7-((трет-бутилдифенилсилил)окси)гепт-1-ен-4-илбензоата.
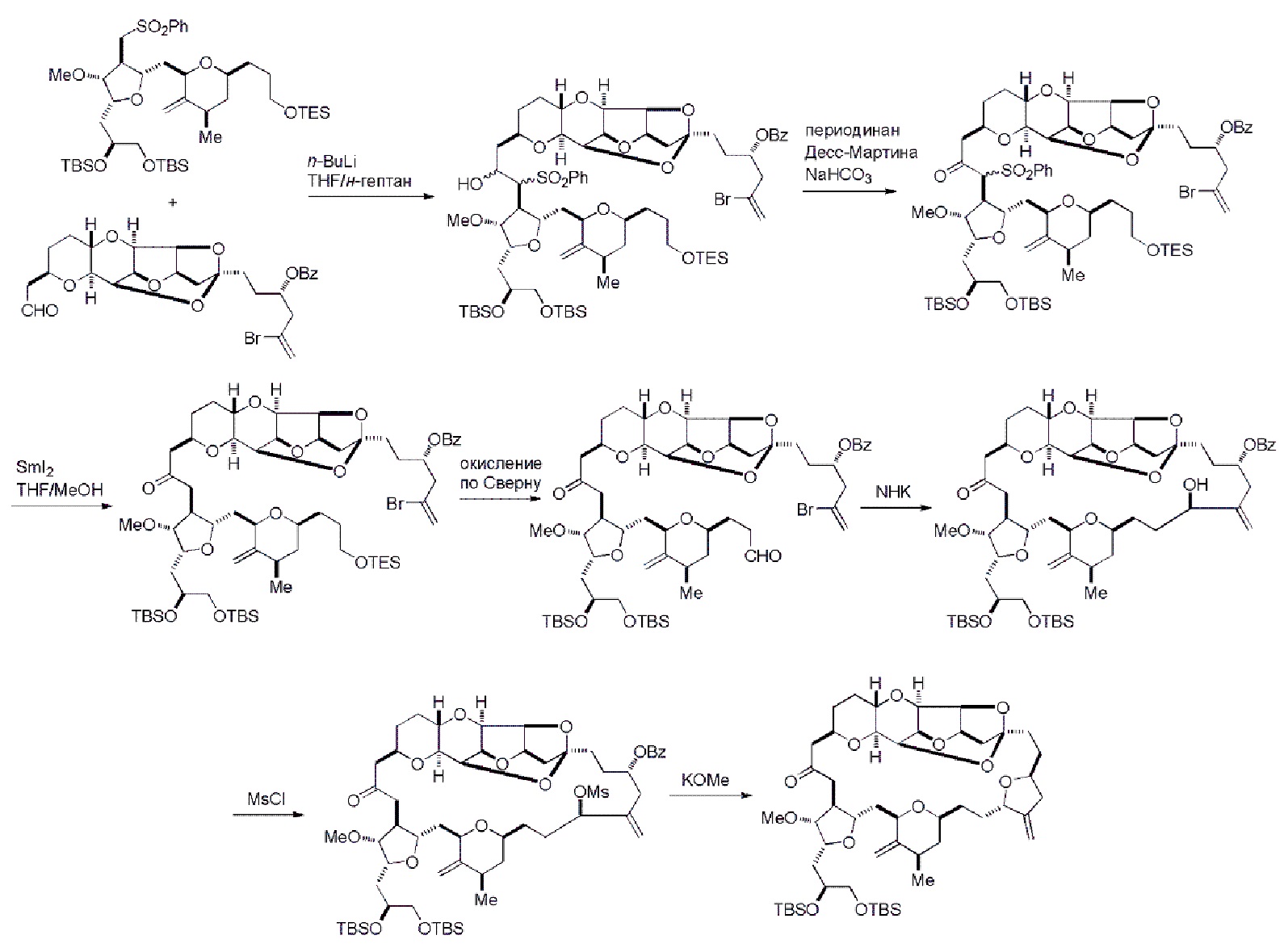
(S)-1-((2S,3aR,4aR,5S,5aS,7R,9aS,10aR,10bS)-7-(3-((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-2-(((2R,4R,6S)-4-метил-3-метилен-6-(3-оксопропил)тетрагидро-2H-пиран-2-ил)метил)тетрагидрофуран-3-ил)-2-оксопропил)додекагидро-2,5-эпоксифуро[2',3':4,5]фуро[3,2-b]пирано[2,3-e]пиран-2-ил)-5-бромгекс-5-ен-3-илбензоат
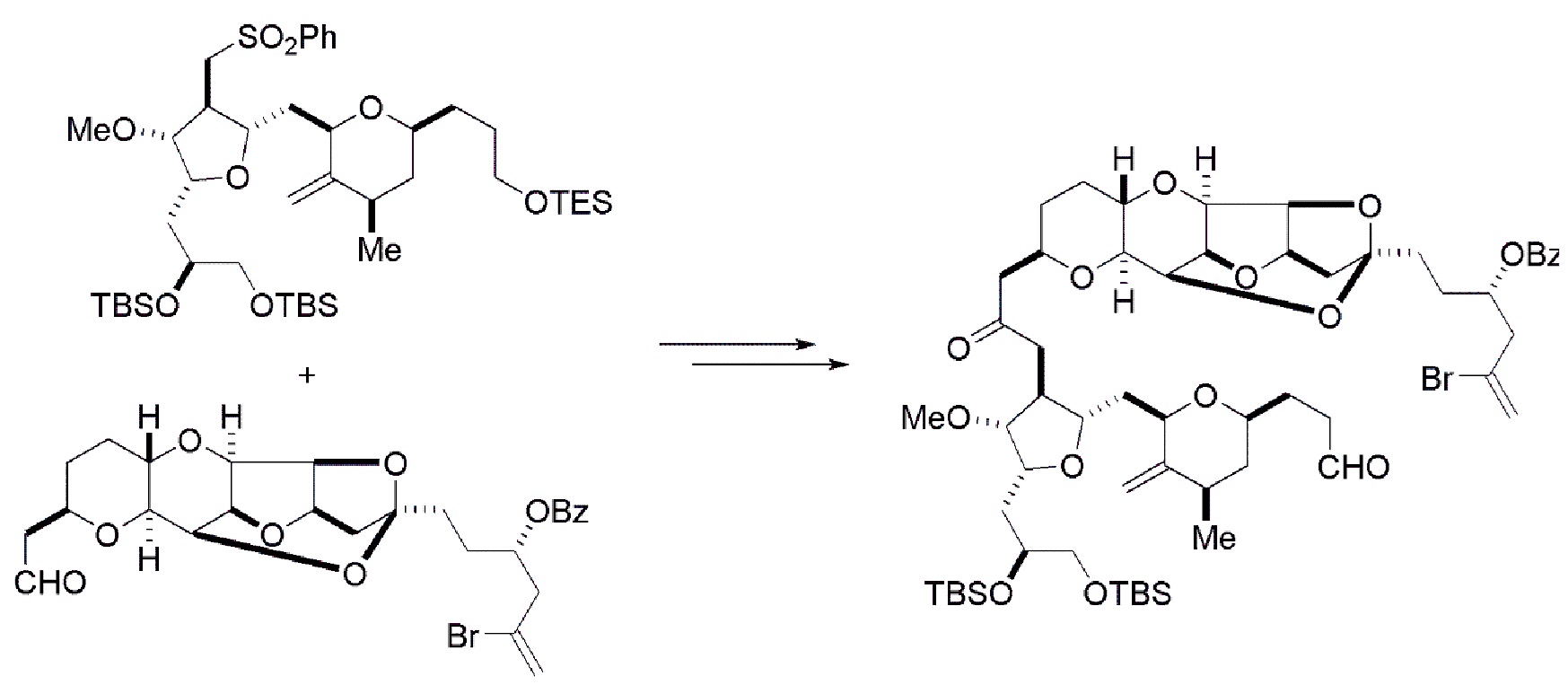
Соединение получали, следуя тем же способам, показанным выше для (3R)-1-((2S,3aR,4aR,5S,5aS,7R,9aS,10aR,10bS)-7-(3-((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-2-(((2R,4R,6S)-4-метил-3-метилен-6-(3-((триэтилсилил)окси)пропил)тетрагидро-2H-пиран-2-ил)метил)тетрагидрофуран-3-ил)-2-гидрокси-3-(фенилсульфонил)пропил)додекагидро-2,5-эпоксифуро[2',3':4,5]фуро[3,2-b]пирано[2,3-e]пиран-2-ил)-5-бромгекс-5-ен-3-илбензоата за исключением того, что (S)-5-бром-1-((2S,3aR,4aR,5S,5aS,7R,9aS,10aR,10bS)-7-(2-оксоэтил)декагидро-2,5-эпоксифуро[2',3':4,5]фуро[3,2-b]пирано[2,3-e]пиран-2(3H)-ил)гекс-5-ен-3-илбензоат применяли в качестве исходного соединения.
NHK макроциклизация
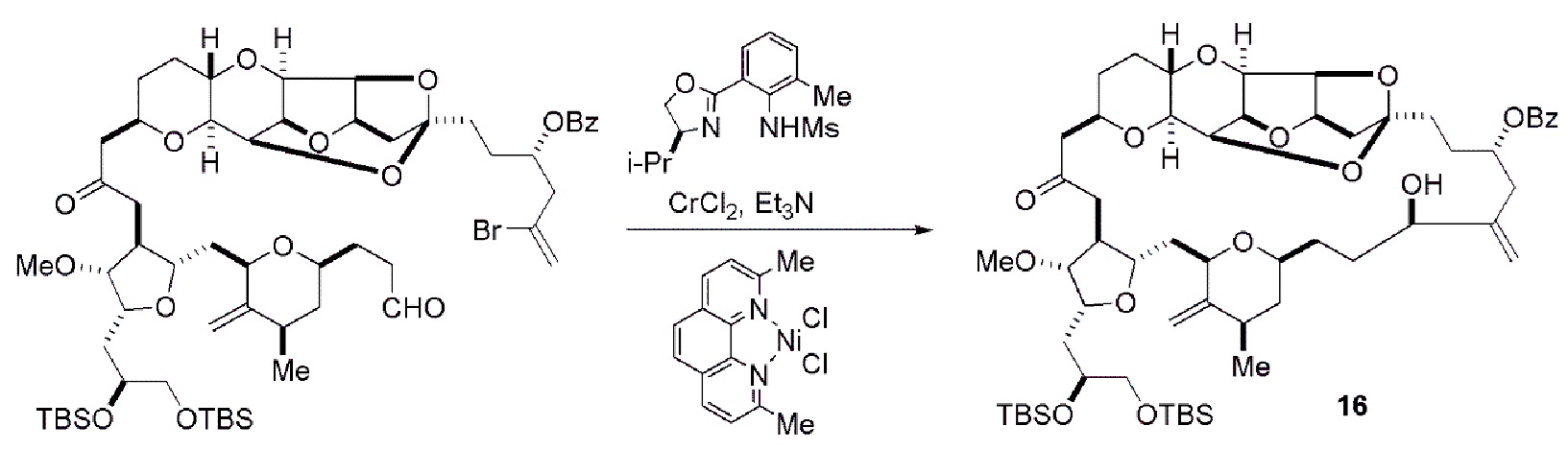
Хлорид хрома (II) (0,636 г, 5,18 ммоль) добавляли в 3-горлую колбу, которую продували N2 в течение 5 минут, и в колбу добавляли раствор (S)-N-(2-(4-изопропил-4,5-дигидрооксазол-2-ил)-6-метилфенил)метансульфамида (1,535 г, 5,18 ммоль) в дегазированном THF (6,80 мл). Полученную в результате смесь нагревали до 30°C, загружали триэтиламин (0,722 мл, 5,18 ммоль) и перемешивали при 33°C в течение 1 часа. После охлаждения до 0°C, смесь обрабатывали комплексом хлорида никеля (II) и 2,9-диметил-1,10-фенантролина (0,040 г, 0,12 ммоль) и продували N2 в течение 5 минут. После удаления бани со льдом, добавляли раствор (S)-1-((2S,3aR,4aR,5S,5aS,7R,9aS,10aR,10bS)-7-(3-((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-2-(((2R, 4R,6S)-4-метил-3-метилен-6-(3-оксопропил)тетрагидро-2H-пиран-2-ил)метил)тетрагидрофуран-3-ил)-2-оксопропил)додекагидро-2,5-эпоксифуро[2',3':4,5]фуро[3,2-b]пирано[2,3-e]пиран-2-ил)-5-бромгекс-5-ен-3-илбензоата (соединение 8; 0,136 г, 0,117 ммоль) в дегазированном THF (6,80 мл) в течение 1,5 часов шприцевым насосом. Смесь перемешивали при комнатной температуре в течение следующих 2 часов. Реакцию охлаждали до 0°C, гасили этилендиамином (1,045 мл, 15,47 ммоль), поддерживая температуру внутри реактора ниже 10°C, и перемешивали при комнатной температуре в течение 10 мин. Смесь обрабатывали водой (16,3 мл) и экстрагировали н-гептаном (8,2 мл) и затем дважды MTBE (16,3 мл). Органические слои объединяли, сушили над MgSO4 и концентрировали в вакууме. Остаток обрабатывали н-гептаном (20 мл) и перемешивали при комнатной температуре в течение 20 минут. Выпавший лиганд отфильтровывали и промывали гептаном (20 мл) и IPA (10 мл). Фильтрат выдерживали в морозильной камере (-20oC) в течение 20 часов. Осадок фильтровали и промывали IPA. Фильтрат концентрировали и очищали колоночной хроматографией на силикагеле (этилацетат/н-гептан=1/10-1/1), получая соединение 16 (88 мг, 69%). 1H ЯМР (400 МГц, CDCl3) δ 0,02 (с, 9H), 0,6 (с, 3H), 0,86 (с, 18H), 1,10 (м, 4H), 1,42 (м, 3H), 1,64-2,00 (м, 8H), 2,06-2,30 (м, 8H), 2,45 (м, 2H), 2,64 (м, 2H), 2,94 (м, 2H), 3,11 (м, 1H), 3,19 (м, 1H), 3,36 (с, 3H), 3,48 (м, 1H), 3,56 (м, 1H), 3,64-3,90 (м, 5H), 3,80-4,30 (м, 4H), 4,41 (м, 1H), 4,59 (м, 1H), 4,68 (м, 1H), 4,79 (м, 1H), 4,92 (с, 1H), 5,06 (с, 1H), 5,28 (с, 1H), 5,40 (м, 1H), 7,41 (м, 2H), 7,58 (м, 1H), 8,02 (м, 2H).
Мезитилирование NHK продукта
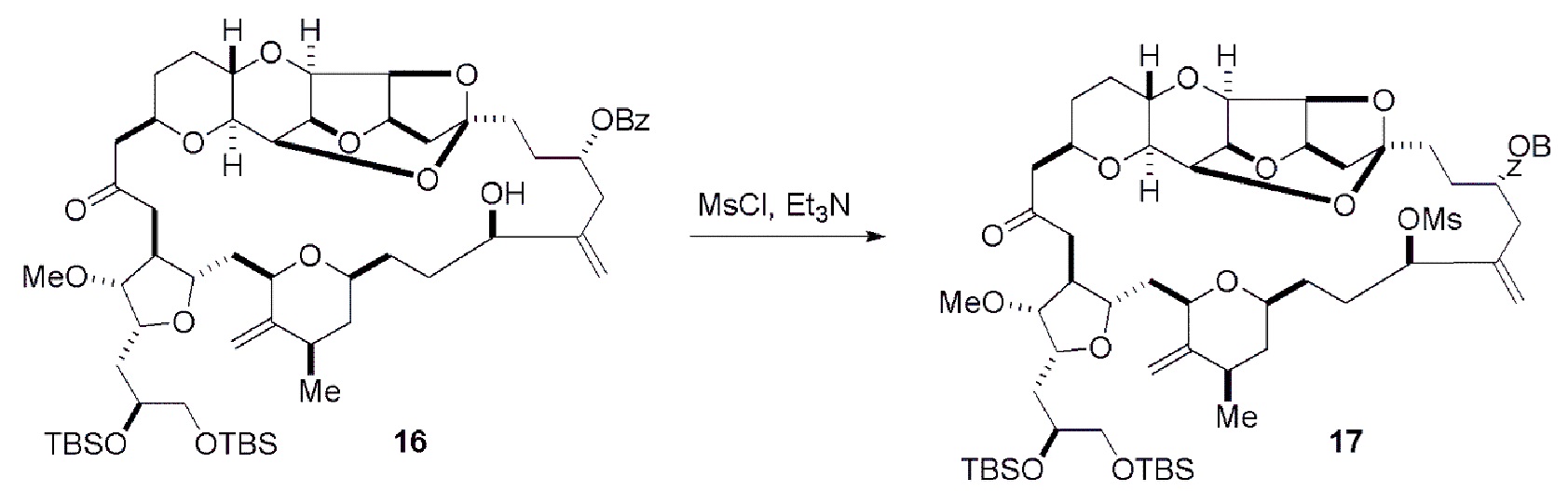
Раствор соединения 16 (0,084 г, 0,078 ммоль) в THF (2,94 мл) охлаждали до 0°C и обрабатывали триэтиламином (0,043 мл, 0,31 ммоль) и метансульфонилхлоридом (0,018 мл, 0,23 ммоль). После перемешивания при 0°C в течение 30 минут, реакцию гасили водой (3,36 мл) и экстрагировали три раза MTBE (5,04 мл). Органические слои объединяли, сушили над MgSO4, и концентрировали, получая соединение 17 (88 мг).
Циклизация с KOMe
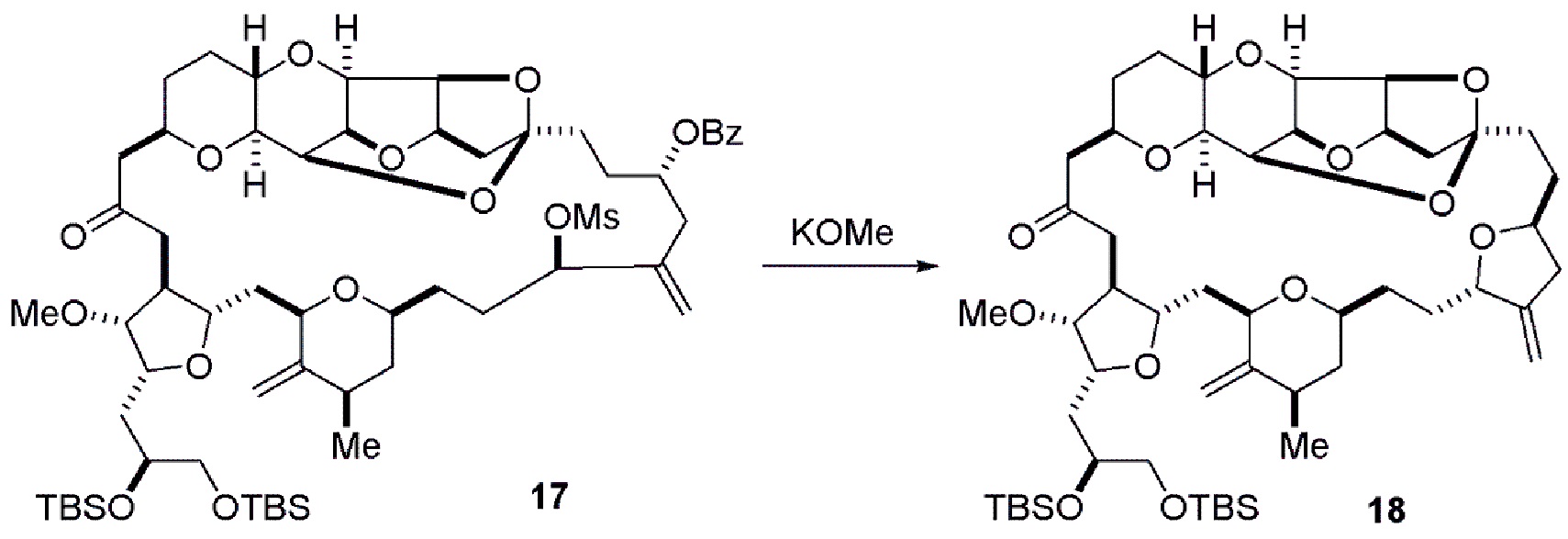
Раствор соединения 17 (0,080 г, 0,069 ммоль) в THF (4,0 мл) охлаждали до 0°C и обрабатывали 25% метоксидом калия в метаноле (0,068 г, 0,24 ммоль). Смесь медленно нагревали при комнатной температуре в течение 20 часов. Реакцию гасили насыщенным водным NH4Cl (2,4 мл) и экстрагировали три раза MTBE (6,4 мл). Органические слои объединяли и сушили над MgSO4. После концентрирования, остаток очищали колоночной хроматографией на силикагеле (этилацетат/н-гептан=1/10-2/1), получая соединение 18 (45 мг, 68% на 2 стадии). 1H ЯМР (400 МГц, C6D6) δ 0,05 (с, 6H), 0,14 (с, 3H), 0,16 (с, 3H), 0,77 (д, 3H), 0,94 (с, 9H), 0,99 (с, 9H), 1,05-1,30 (м, 2H), 1,30-1,46 (м, 3H), 1,20-1,72 (м, 2H), 1,50-1,70 (м, 3H), 1,84-2,00 (м, 4H), 2,05-2,20 (м, 3H), 2,28-2,40 (м, 4H), 2,50 (м, 2H), 2,60 (м, 2H), 2,70 (м, 2H), 2,86 (м, 1H), 3,50 (м, 1H), 3,52-3,72 (м, 4H), 3,58 (с, 3H), 3,74-3,84 (м, 2H), 3,95 (м, 1H), 4,00-4,22 (м, 7H), 4,04 (м, 1H), 4,38 (м, 1H), 4,56 (уш м, 1H), 4,57 (с, 1H), 4,74 (с, 1H), 4,98 (м, 2H).
Пример 8: получение соединения формулы (ID) через C.26-C.27 макроциклизацию
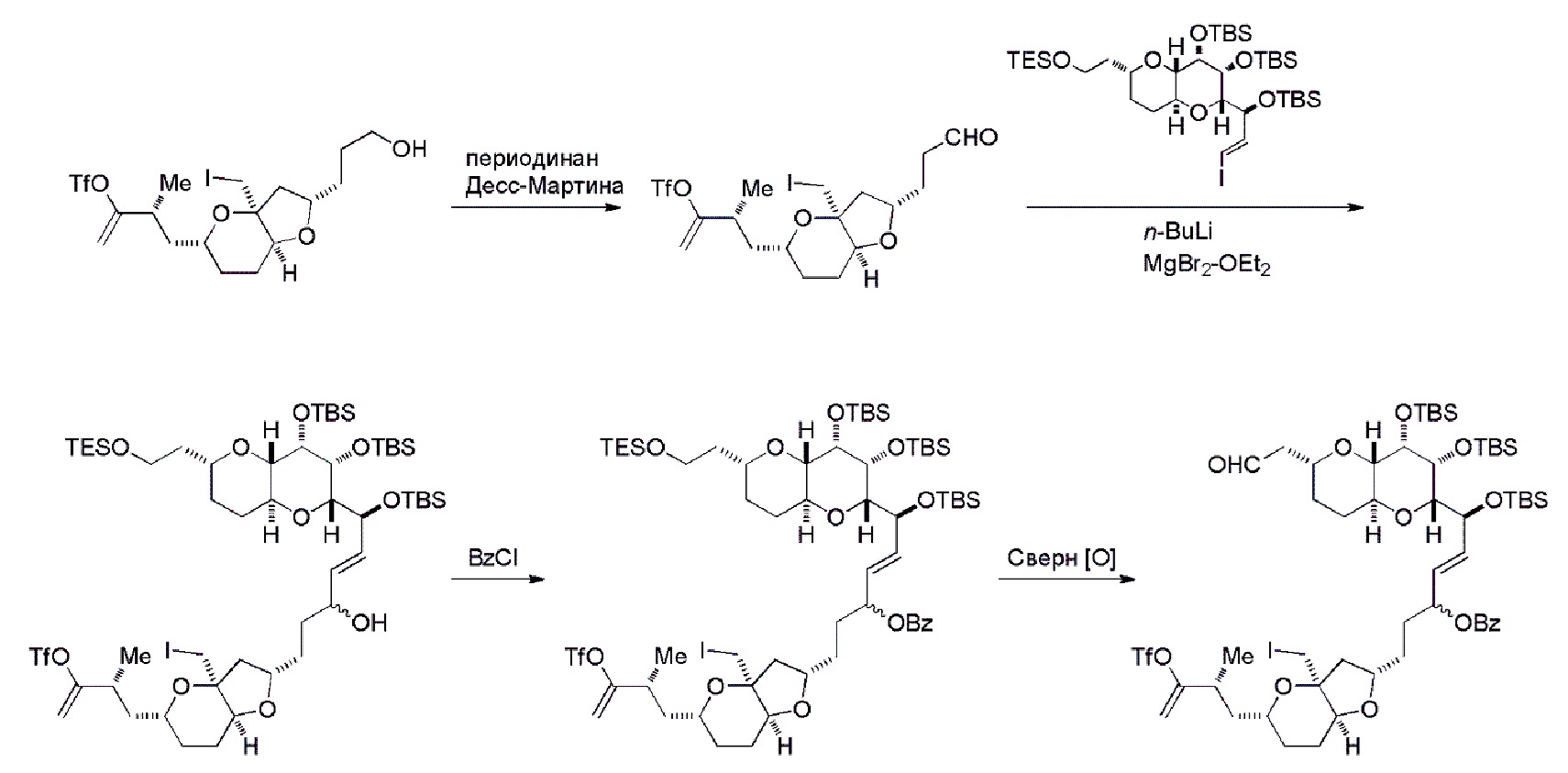
(R)-4-((2S,3aS,5R,7aS)-2-(3-гидроксипропил)-3a-(йодметил)гексагидро-2H-фуро[3,2-b]пиран-5-ил)-3-метилбут-1-ен-2-илтрифторметансульфонат
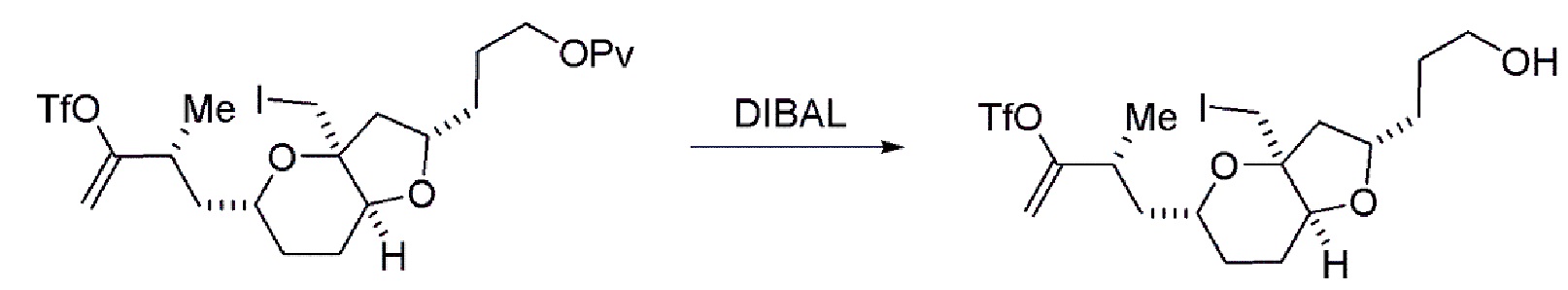
Раствор 3-((2S,3aS,5R,7aS)-3a-(йодметил)-5-((R)-2-метил-3-(((трифторметил)сульфонил)окси)бут-3-ен-1-ил)гексагидро-2H-фуро[3,2-b]пиран-2-ил)пропилпивалата (6,80 г, 10,9 ммоль) в CH2Cl2 (68,0 мл) охлаждали до -78°C и обрабатывали 1 M DIBAL в толуоле (23,88 мл, 23,88 ммоль) в течение 20 минут, поддерживая температуру внутри реактора ниже -70oC. Реакционную смесь перемешивали при -78°C в течение 30 минут. Реакцию гасили метанолом (4,39 мл), поддерживая температуру внутри реактора ниже -60oC. После удаления ледяной бани, смесь обрабатывали 1 N HCl (109 мл) и MTBE (102 мл) и перемешивали при температуре окружающей среды в течение 20 минут. Органический слой отделяли, и водный слой экстрагировали MTBE (102 мл). Органические слои объединяли, сушили над MgSO4 и концентрировали, получая заявленное в заголовке соединение (8,8 г, загрязненное толуолом). 1H ЯМР (400 МГц, CDCl3) δ 1,14 (д, 3H), 1,22 (м, 1H), 1,45-1,70 (м, 8H), 1,72-1,90 (м, 2H), 2,42 (м, 1H), 2,83 (м, 1H), 3,40 (д, 1H), 3,46 (д, 1H), 3,55 (м, 1H), 3,65 (м, 2H), 3,79 (м, 1H), 4,22 (м, 1H), 5,03 (д, 1H), 5,10 (д, 1H).
(R)-4-((2S,3aS,5R,7aS)-3a-(йодметил)-2-(3-оксопропил)гексагидро-2H-фуро[3,2-b]пиран-5-ил)-3-метилбут-1-ен-2-илтрифторметансульфонат
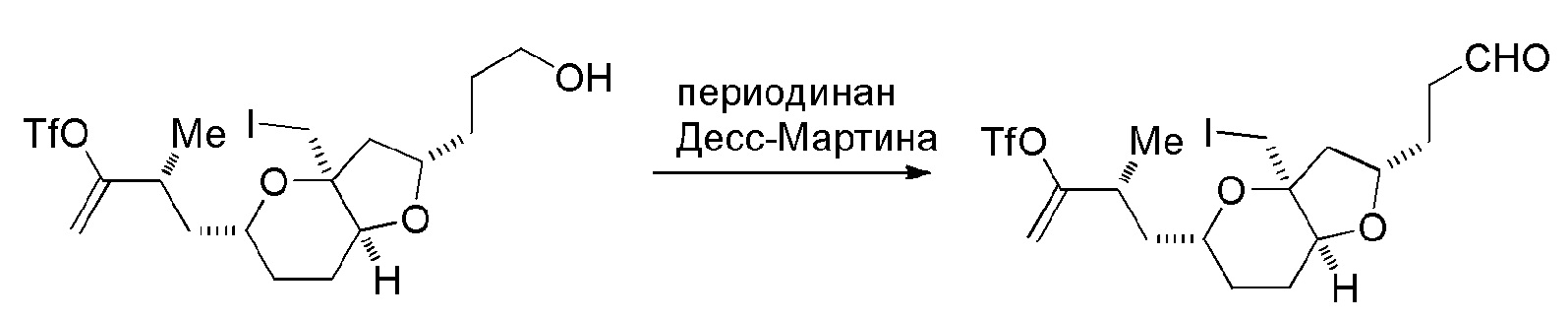
Раствор (R)-4-((2S,3aS,5R,7aS)-2-(3-гидроксипропил)-3a-(йодметил)гексагидро-2H-фуро[3,2-b]пиран-5-ил)-3-метилбут-1-ен-2-илтрифторметансульфоната (2,64 г, 4,87 ммоль) в CH2Cl2 (26,4 мл) обрабатывали периодинаном Десс-Мартина (3,10 г, 7,30 ммоль) и перемешивали при комнатной температуре в течение 1 часа. Реакцию гасили насыщенным водным NaHCO3 (20 мл) и 20% Na2SO3 (20 мл) и экстрагировали три раза MTBE (20 мл). Органические слои объединяли и промывали соляным раствором. После концентрирования, остаток очищали колоночной хроматографией на силикагеле (этилацетат/н-гептан=1/10-1/3), получая заявленное в заголовке соединение (970 мг, 56% на 2 стадии). 1H ЯМР (400 МГц, CDCl3) δ 1,14 (д, 3H), 1,15-1,30 (м, 2H), 1,45-1,70 (м, 5H), 1,72-1,90 (м, 2H), 2,32 (дд, 1H), 2,52 (м, 2H), 2,83 (м, 1H), 3,37 (д, 1H), 3,43 (д, 1H), 3,52 (м, 1H), 3,72 (м, 1H), 4,19 (м, 1H), 5,01 (д, 1H), 5,09 (д, 1H), 9,76 (с, 1H).
(3R)-4-((2S,3aS,5R,7aS)-2-((6S,E)-6-((2S,3R,4S,4aS,6R,8aS)-3,4-бис((трет-бутилдиметилсилил)окси)-6-(2-((триэтилсилил)окси)этил)октагидропирано[3,2-b]пиран-2-ил)-6-((трет-бутилдиметилсилил)окси)-3-гидроксигекс-4-ен-1-ил)-3a-(йодметил)гексагидро-2H-фуро[3,2-b]пиран-5-ил)-3-метилбут-1-ен-2-илтрифторметансульфонат
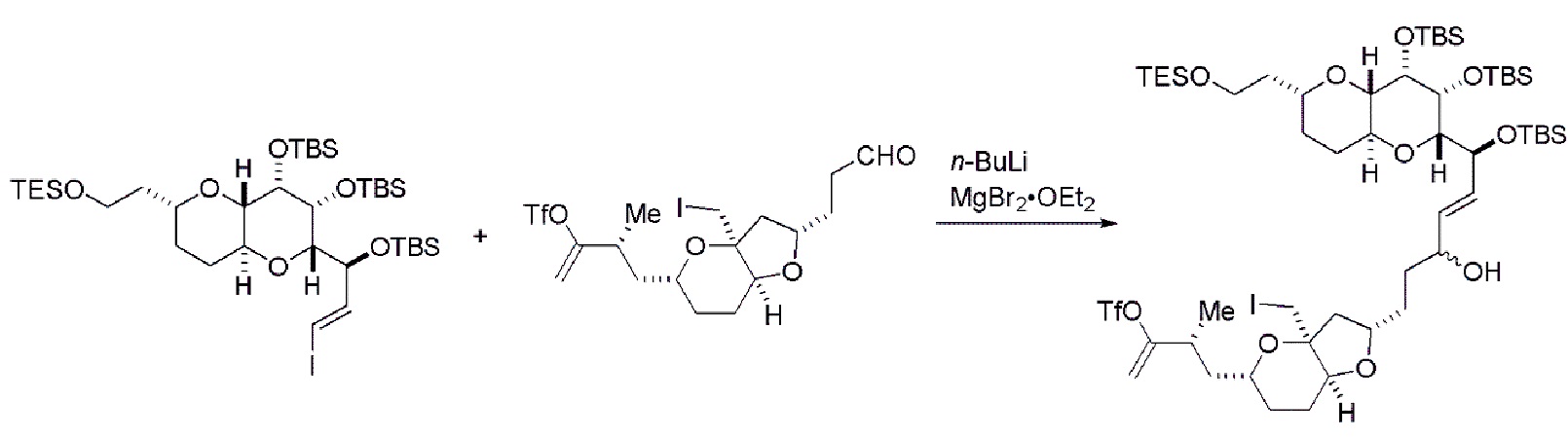
Раствор (((2S,3R,4S,4aS,6R,8aS)-2-((с,E)-1-((трет-бутилдиметилсилил)окси)-3-йодаллил)-6-(2-((триэтилсилил)окси)этил)октагидропирано[3,2-b]пиран-3,4-диил)бис(окси))бис(трет-бутилдиметилсилана) (1,295 г, 1,51 ммоль) в THF (10,20 мл) охлаждали до -78°C и обрабатывали 1,6 M н-BuLi в гексане (0,944 мл, 1,51 ммоль), поддерживая температуру внутри реактора ниже -60°C. После перемешивания при -78°C в течение 15 минут, смесь обрабатывали раствором диэтилэфирата бромида магния (0,390 г, 1,51 ммоль) в смеси THF (6 мл) и толуола (1 мл), поддерживая температуру внутри реактора ниже -60°C, и перемешивали при -78°C в течение 30 минут. Добавляли раствор (R)-4-((2S,3aS,5R,7aS)-3a-(йодметил)-2-(3-оксопропил)гексагидро-2H-фуро[3,2-b]пиран-5-ил)-3-метилбут-1-ен-2-илтрифторметансульфоната (0,68 г, 1,258 ммоль) в THF (6,80 мл), и полученную в результате смесь перемешивали при -78°C в течение 3 часов и медленно нагревали до комнатной температуры в течение 14 часов. Реакцию гасили насыщенным водным NH4Cl (6,80 мл) и экстрагировали дважды MTBE (0,150 мл). Органические слои объединяли и промывали соляным раствором. После концентрирования, остаток очищали колоночной хроматографией на силикагеле (этилацетат/н-гептан=1/10-1/3), получая заявленное в заголовке соединение (455 мг, 28%).
(6S,E)-6-((2S,3R,4S,4aS,6R,8aS)-3,4-бис((трет-бутилдиметилсилил)окси)-6-(2-((триэтилсилил)окси)этил)октагидропирано[3,2-b]пиран-2-ил)-6-((трет-бутилдиметилсилил)окси)-1-((2S,3aS,5R,7aS)-3a-(йодметил)-5-((R)-2-метил-3-(((трифторметил)сульфонил)окси)бут-3-ен-1-ил)гексагидро-2H-фуро[3,2-b]пиран-2-ил)гекс-4-ен-3-илбензоат
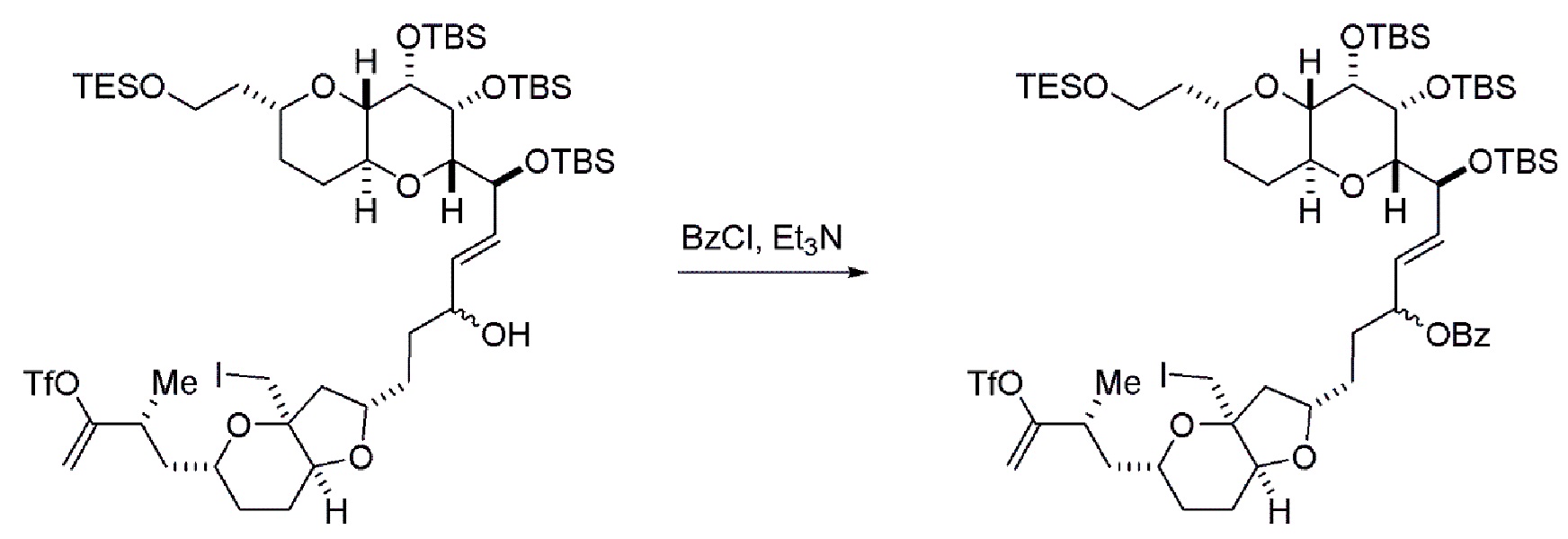
Раствор (3R)-4-((2S,3aS,5R,7aS)-2-((6S,E)-6-((2S,3R,4S,4aS,6R,8aS)-3,4-бис((трет-бутилдиметилсилил)окси)-6-(2-((триэтилсилил)окси)этил)октагидропирано[3,2-b]пиран-2-ил)-6-((трет-бутилдиметилсилил)окси)-3-гидроксигекс-4-ен-1-ил)-3a-(йодметил)гексагидро-2H-фуро[3,2-b]пиран-5-ил)-3-метилбут-1-ен-2-илтрифторметансульфоната (0,455 г, 0,358 ммоль) в CH2Cl2 (4,55 мл) обрабатывали бензоилхлоридом (0,083 мл, 0,72 ммоль), триэтиламином (0,15 мл, 1,1 ммоль) и DMAP (4,4 мг, 0,036 ммоль). Смесь перемешивали при температуре окружающей среды в течение 40 часов. Реакцию гасили водой (4,6 мл) и экстрагировали дважды MTBE (9,1 мл). Органические слои объединяли и промывали соляным раствором. После концентрирования, остаток очищали колоночной хроматографией на силикагеле (этилацетат/н-гептан=1/10-1/5), получая заявленное в заголовке соединение (316 мг, 64%). 1H ЯМР (400 МГц, CDCl3) δ -0,08-0,12 (несколько синглетов, 18H), 0,55 (м, 6H), 0,81 (2с, 9H), 0,85-1,00 (м, 27H), 1,05-1,30 (м, 2H), 1,12 (д, 3H), 1,40-1,90 (м, 16H), 2,29 (м, 1H), 2,80 (м, 2H), 3,30-3,45 (м, 3H), 3,53 (м, 2H), 3,65 (м, 1H), 3,72 (м, 1H), 3,83 (м, 2H), 4,08 (м, 1H), 4,19 (м, 1H), 4,98 (м, 1H), 5,02 (м, 1H), 5,07 (м, 1H), 5,60 (м, 1H), 5,77 (м, 1H), 6,05 (м, 1H), 7,40 (м, 2H), 7,52 (м, 1H), 8,02 (м, 2H).
(6S,E)-6-((2S,3R,4S,4aS,6R,8aS)-3,4-бис((трет-бутилдиметилсилил)окси)-6-(2-оксоэтил) октагидропирано[3,2-b]пиран-2-ил)-6-((трет-бутилдиметилсилил)окси)-1-((2S,3aS,5R,7aS)-3a-(йодметил)-5-((R)-2-метил-3-(((трифторметил)сульфонил)окси)бут-3-ен-1-ил)гексагидро-2H-фуро[3,2-b]пиран-2-ил)гекс-4-ен-3-илбензоат
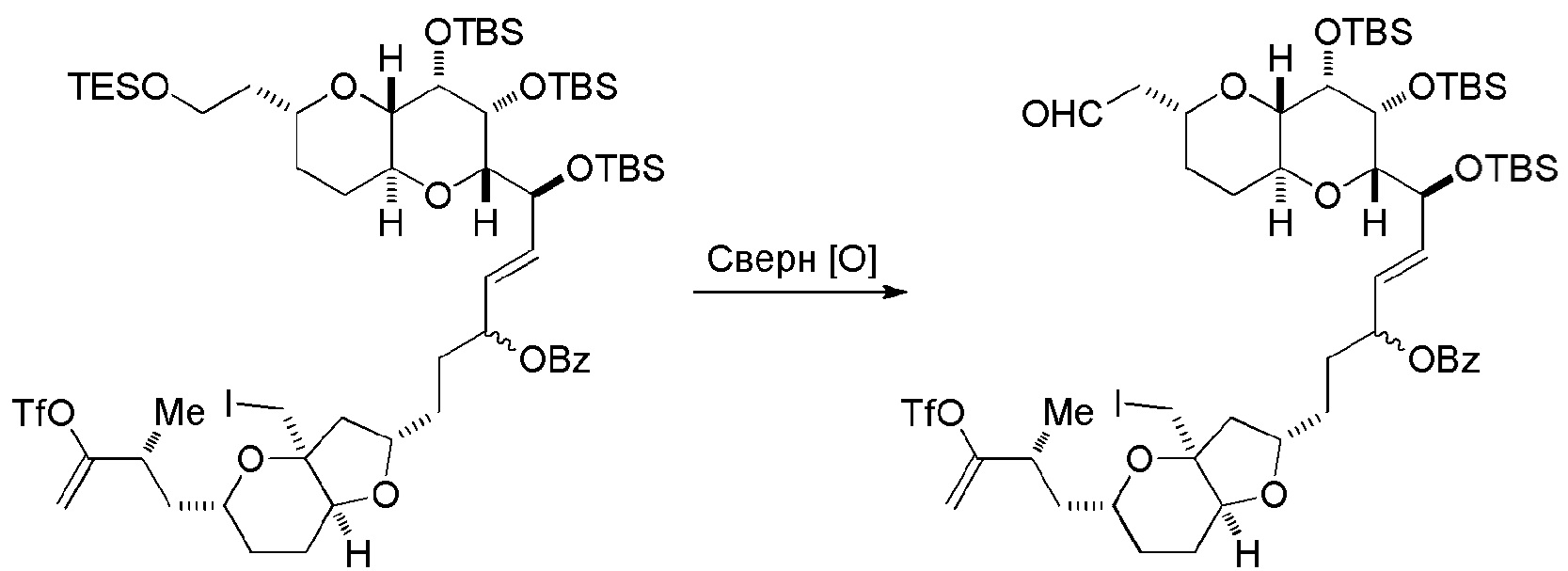
Раствор оксалилхлорида (0,141 мл, 1,61 ммоль) в CH2Cl2 (6,32 мл) охлаждали до -78°C и обрабатывали DMSO (0,228 мл, 3,22 ммоль). После перемешивания в течение 10 мин при -78°C, смесь обрабатывали раствором (6S,E)-6-((2S,3R,4S,4aS,6R,8aS)-3,4-бис((трет-бутилдиметилсилил)окси)-6-(2-((триэтилсилил)окси)этил)октагидропирано[3,2-b]пиран-2-ил)-6-((трет-бутилдиметилсилил)окси)-1-((2S,3aS,5R,7aS)-3a-(йодметил)-5-((R)-2-метил-3-(((трифторметил)сульфонил)окси)бут-3-ен-1-ил)гексагидро-2H-фуро[3,2-b]пиран-2-ил)гекс-4-ен-3-илбензоата (0,316 г, 0,230 ммоль) в CH2Cl2 (3,8 мл). Смесь перемешивали при -78°C в течение 20 минут и при -40°C в течение 1 часа. После охлаждения до -78 oC, смесь обрабатывали триэтиламином (1,12 мл, 8,04 ммоль) и перемешивали при -78°C в течение 10 мин и при 0°C в течение 20 минут. Реакционную смесь обрабатывали водой (6,3 мл) и разбавляли MTBE (6,32 мл). Органический слой отделяли и промывали соляным раствором. После концентрирования, остаток очищали колоночной хроматографией на силикагеле (этилацетат/н-гептан=1/10-1/2), получая заявленное в заголовке соединение (284 мг).
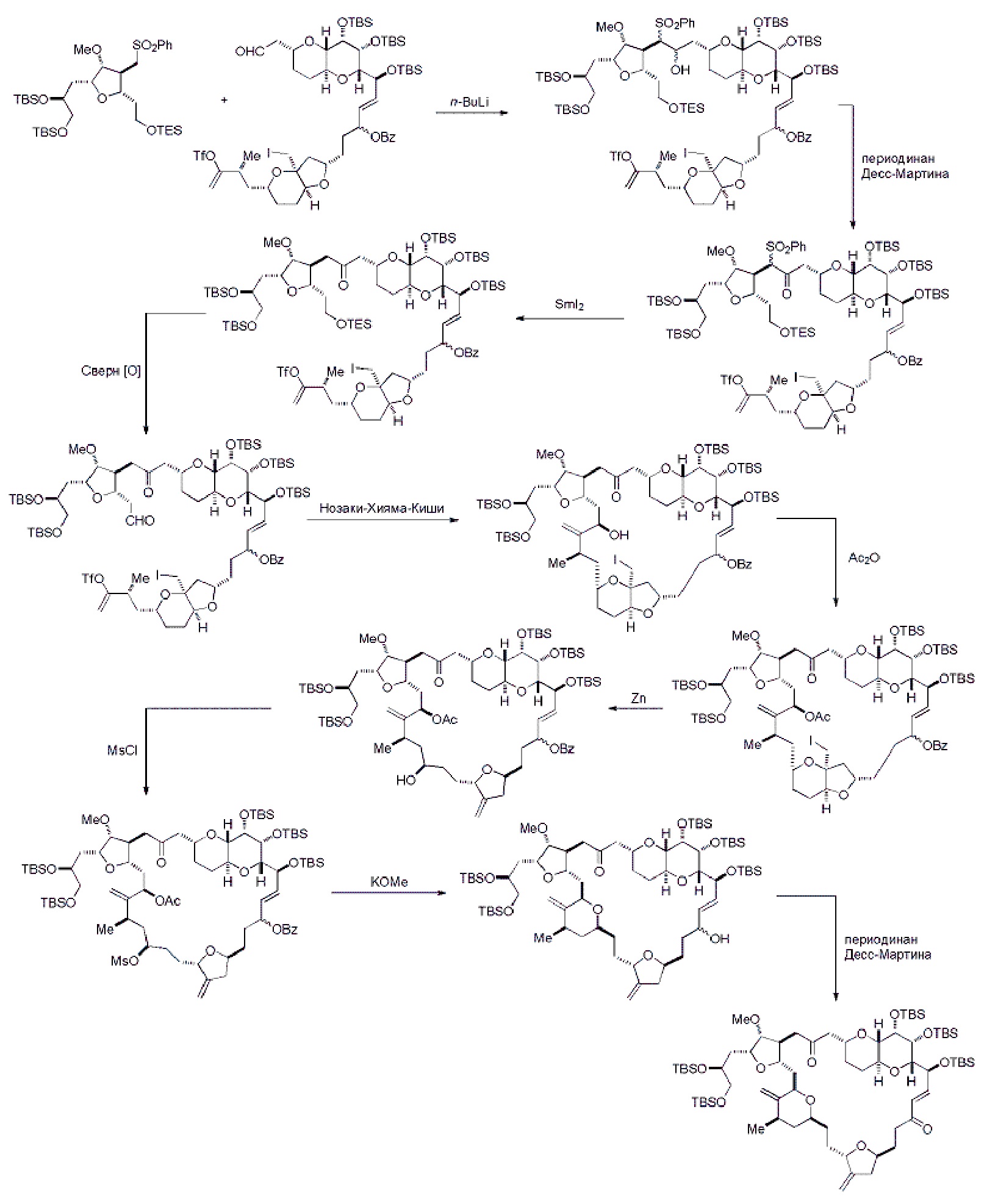
(6S,E)-6-((2S,3R,4S,4aS,6R,8aS)-6-(3-((2S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-2-(2-((триэтилсилил)окси)этил)тетрагидрофуран-3-ил)-2-гидрокси-3-(фенилсульфонил)пропил)-3,4-бис((трет-бутилдиметилсилил)окси)октагидропирано[3,2-b]пиран-2-ил)-6-((трет-бутилдиметилсилил)окси)-1-((2S,3aS,5R,7aS)-3a-(йодметил)-5-((R)-2-метил-3-(((трифторметил)сульфонил)окси)бут-3-ен-1-ил)гексагидро-2H-фуро[3,2-b]пиран-2-ил)гекс-4-ен-3-илбензоат
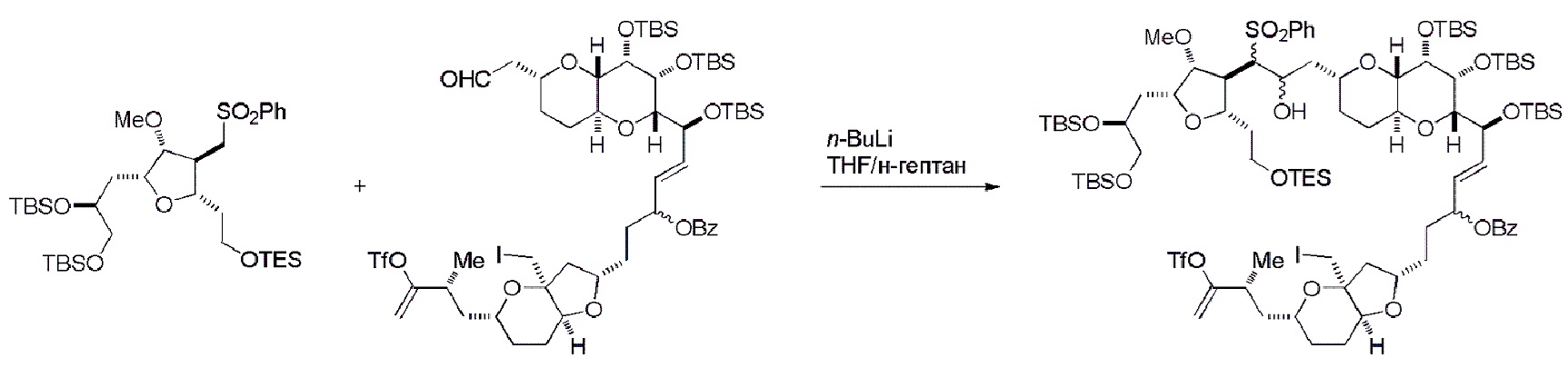
Раствор (S)-5-(((2R,3R,4S,5S)-3-метокси-4-((фенилсульфонил)метил)-5-(2-((триэтилсилил)окси)этил)тетрагидрофуран-2-ил)метил)-2,2,3, 3,8,8,9,9-октаметил-4,7-диокса-3,8-дисиладекана (0,214 г, 0,298 ммоль) в THF (3 мл) охлаждали до -5 oC. Смесь обрабатывали 1,6 M н-BuLi в гексане (0,186 мл, 0,298 ммоль) и перемешивали при -5°C в течение 20 минут. После охлаждения до -78°C, смесь обрабатывали раствором (6S,E)-6-((2S,3R,4S,4aS,6R,8aS)-3,4-бис((трет-бутилдиметилсилил)окси)-6-(2-оксоэтил)октагидропирано[3,2-b]пиран-2-ил)-6-((трет-бутилдиметилсилил)окси)-1-((2S,3aS,5R,7aS)-3a-(йодметил)-5-((R)-2-метил-3-(((трифторметил)сульфонил)окси)бут-3-ен-1-ил)гексагидро-2H-фуро[3,2-b]пиран-2-ил)гекс-4-ен-3-илбензоата (0,150 г, 0,119 ммоль) в н-гептане (4,2 мл). Смесь перемешивали при -78°C в течение 4 часов. Реакцию гасили насыщенным водным NH4Cl (7,5 мл) и экстрагировали дважды MTBE (15 мл). Органические слои объединяли и промывали соляным раствором. После концентрирования, остаток очищали колоночной хроматографией на силикагеле (этилацетат/н-гептан=1/20-1/2), получая заявленное в заголовке соединение (177 мг, 75%).
(6S,E)-6-((2S,3R,4S,4aS,6R,8aS)-6-(3-((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-2-(2-((триэтилсилил)окси)этил)тетрагидрофуран-3-ил)-2-оксо-3-(фенилсульфонил)пропил)-3,4-бис((трет-бутилдиметилсилил)окси)октагидропирано[3,2-b]пиран-2-ил)-6-((трет-бутилдиметилсилил)окси)-1-((2S,3aS,5R,7aS)-3a-(йодметил)-5-((R)-2-метил-3-(((трифторметил)сульфонил)окси)бут-3-ен-1-ил)гексагидро-2H-фуро[3,2-b]пиран-2-ил)гекс-4-ен-3-илбензоат
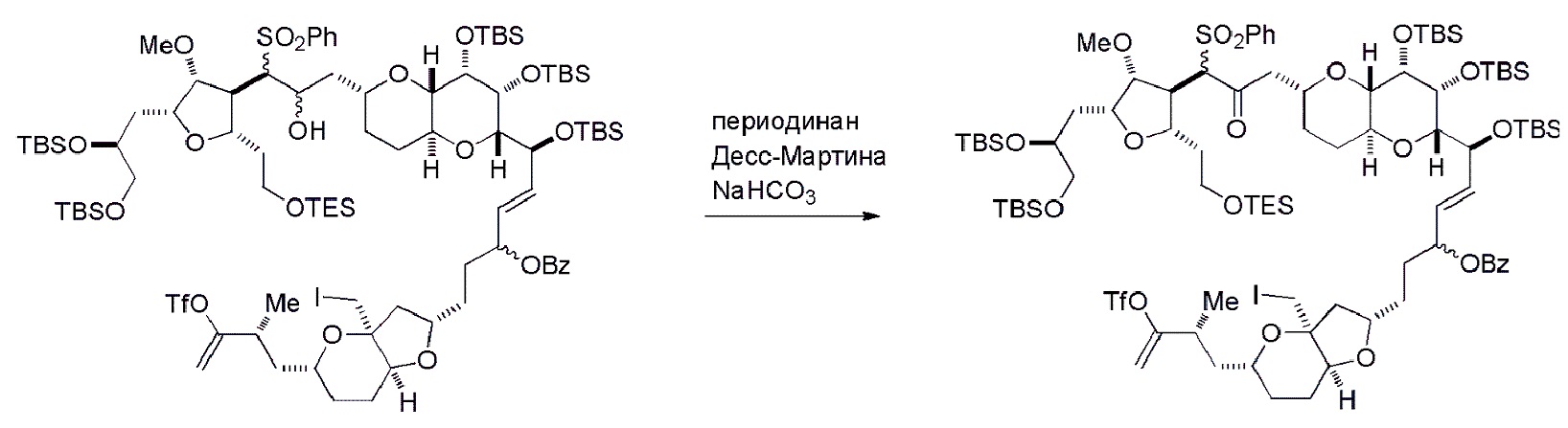
Раствор (6S,E)-6-((2S,3R,4S,4aS,6R,8aS)-6-(3-((2S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-2-(2-((триэтилсилил)окси)этил)тетрагидрофуран-3-ил)-2-гидрокси-3-(фенилсульфонил)пропил)-3,4-бис((трет-бутилдиметилсилил)окси)октагидропирано[3,2-b]пиран-2-ил)-6-((трет-бутилдиметилсилил)окси)-1-((2S,3aS,5R,7aS)-3a-(йодметил)-5-((R)-2-метил-3-(((трифторметил)сульфонил)окси)бут-3-ен-1-ил)гексагидро-2H-фуро[3,2-b]пиран-2-ил)гекс-4-ен-3-илбензоата (0,177 г, 0,09 ммоль) в CH2Cl2 (3,54 мл) обрабатывали бикарбонатом натрия (0,011 г, 0,13 ммоль) и периодинаном Десс-Мартина (0,057 г, 0,13 ммоль) и перемешивали при комнатной температуре в течение 1 часа. Добавляли дополнительный периодинан Десс-Мартина (0,019 г, 0,045 ммоль), и перемешивание продолжали при комнатной температуре в течение следующего 1 часа. Реакцию гасили насыщенным водным NaHCO3 (3,5 мл) и 20% Na2SO3 (3,5 мл) и экстрагировали дважды MTBE (3,5 мл). Органические слои объединяли и промывали соляным раствором. После концентрирования, остаток очищали колоночной хроматографией на силикагеле (этилацетат/н-гептан=1/10-1/3), получая заявленное в заголовке соединение (170 мг, 96%).
(6S,E)-6-((2S,3R,4S,4aS,6R,8aS)-6-(3-((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-2-(2-((триэтилсилил)окси)этил)тетрагидрофуран-3-ил)-2-оксопропил)-3,4-бис((трет-бутилдиметилсилил)окси)октагидропирано[3,2-b]пиран-2-ил)-6-((трет-бутилдиметилсилил)окси)-1-((2S,3aS,5R,7aS)-3a-(йодметил)-5-((R)-2-метил-3-(((трифторметил)сульфонил)окси)бут-3-ен-1-ил)гексагидро-2H-фуро[3,2-b]пиран-2-ил)гекс-4-ен-3-илбензоат
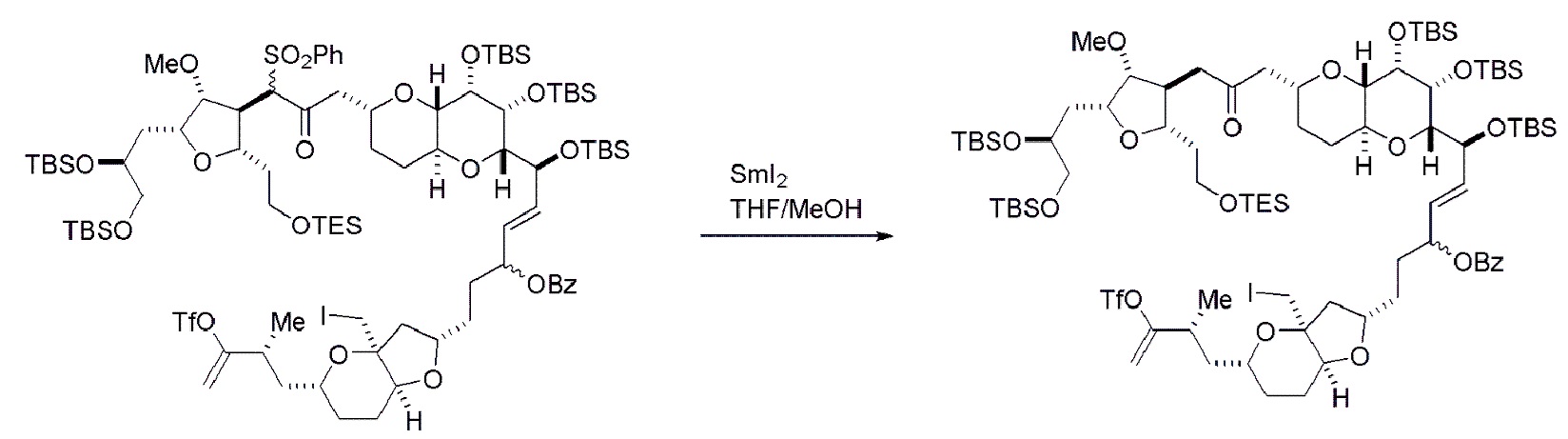
Раствор (6S,E)-6-((2S,3R,4S,4aS,6R,8aS)-6-(3-((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил) окси)пропил)-4-метокси-2-(2-((триэтилсилил)окси)этил)тетрагидрофуран-3-ил)-2-оксо-3-(фенилсульфонил)пропил)-3,4-бис((трет-бутилдиметилсилил)окси)октагидропирано[3,2-b]пиран-2-ил)-6-((трет-бутилдиметилсилил)окси)-1-((2S,3aS,5R,7aS)-3a-(йодметил)-5-((R)-2-метил-3-(((трифторметил)сульфонил)окси)бут-3-ен-1-ил)гексагидро-2H-фуро[3,2-b]пиран-2-ил)гекс-4-ен-3-илбензоата (0,17 г, 0,086 ммоль) в смеси THF (1,4 мл) и метанола (0,85 мл) охлаждали до -78°C и обрабатывали 0,1 M SmI2 в THF (1,29 мл, 0,129 ммоль). После перемешивания при -78°C в течение 1 часа, добавляли дополнительный 0,1 M SmI2 в THF (0,86 мл, 0,086 ммоль), и перемешивание продолжали при -78°C в течение следующих 2 часов. Реакцию гасили смесью сегнетовой соли (510 мг, 1,807 ммоль), карбоната калия (509 мг, 3,69 ммоль) и воды (5,1 мл) и экстрагировали дважды MTBE (8,5 мл). Органические слои объединяли и сушили над MgSO4, получая заявленное в заголовке соединение (127 мг, 80%).
(6S,E)-6-((2S,3R,4S,4aS,6R,8aS)-6-(3-((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-2-(2-оксоэтил)тетрагидрофуран-3-ил)-2-оксопропил)-3,4-бис((трет-бутилдиметилсилил)окси)октагидропирано[3,2-b]пиран-2-ил)-6-((трет-бутилдиметилсилил)окси)-1-((2S,3aS,5R,7aS)-3a-(йодметил)-5-((R)-2-метил-3-(((трифторметил)сульфонил)окси)бут-3-ен-1-ил)гексагидро-2H-фуро[3,2-b]пиран-2-ил)гекс-4-ен-3-илбензоат
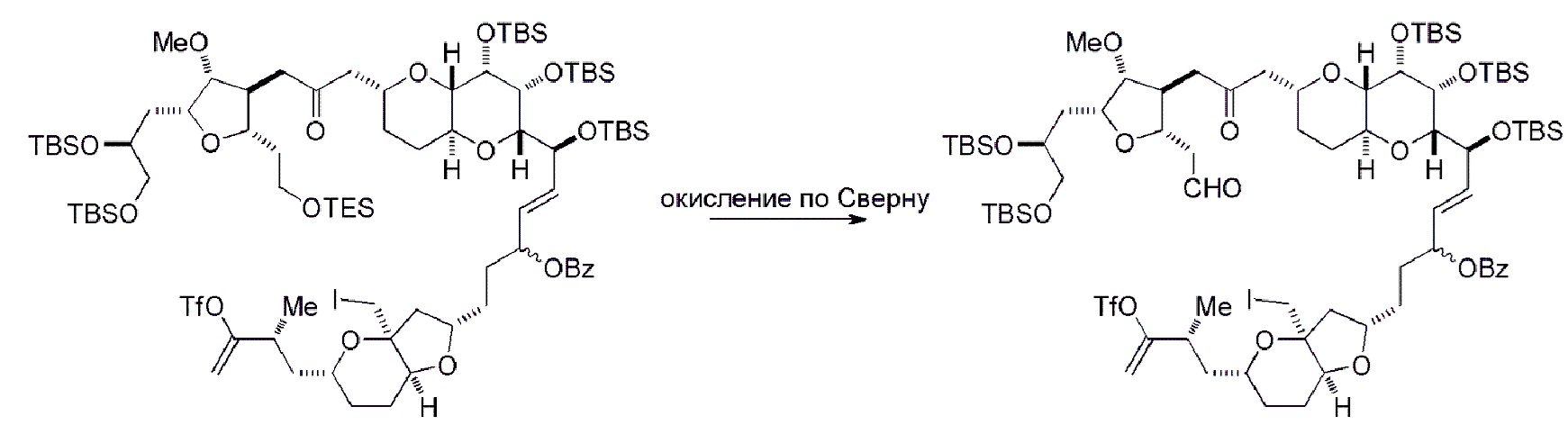
Раствор оксалилхлорида (0,061 мл, 0,69 ммоль) в CH2Cl2 (2,54 мл) охлаждали до -78°C и обрабатывали DMSO (0,098 мл, 1,4 ммоль). После перемешивания при -78°C в течение 10 мин, добавляли раствор (6S,E)-6-((2S,3R,4S,4aS,6R,8aS)-6-(3-((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-2-(2-((триэтилсилил)окси)этил)тетрагидрофуран-3-ил)-2-оксопропил)-3,4-бис((трет-бутилдиметилсилил)окси)октагидропирано[3,2-b]пиран-2-ил)-6-((трет-бутилдиметилсилил)окси)-1-((2S,3aS,5R, 7aS)-3a-(йодметил)-5-((R)-2-метил-3-(((трифторметил)сульфонил)окси)бут-3-ен-1-ил)гексагидро-2H-фуро[3,2-b]пиран-2-ил)гекс-4-ен-3-илбензоата (0,127 г, 0,069 ммоль) в CH2Cl2 (2,5 мл). Полученный в результате раствор перемешивали при -78°C в течение 10 мин и при -40°C в течение 1 часа. После охлаждения до -78°C, смесь обрабатывали триэтиламином (0,5 мл, 3,6 ммоль) и перемешивали при -78°C в течение 10 мин и при 0°C в течение 20 минут. Смесь обрабатывали водой (5 мл) и экстрагировали дважды MTBE (10 мл). Органические слои объединяли и промывали соляным раствором. После концентрирования, остаток очищали колоночной хроматографией на силикагеле (этилацетат/н-гептан=1/10-1/5), получая заявленное в заголовке соединение (86 мг, 72%).
NHK макроциклизация
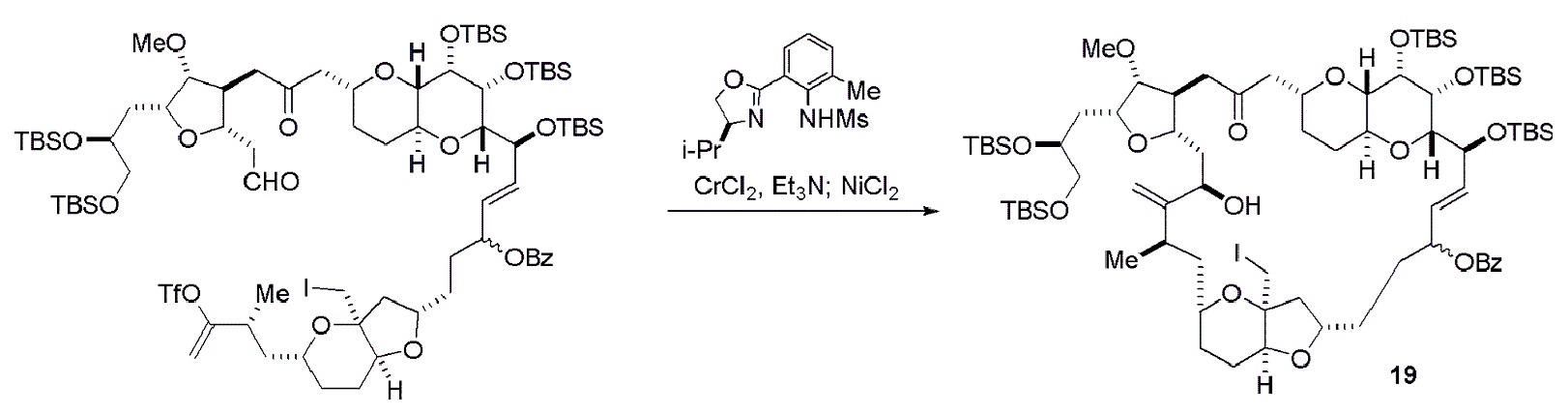
(S)-N-(2-(4-изопропил-4,5-дигидрооксазол-2-ил)-6-метилфенил)метансульфамид (0,829 г, 2,797 ммоль) растворяли в дегазированном ацетонитриле (7,12 мл) и обрабатывали хлоридом хрома (II) (0,346 г, 2,82 ммоль). После продувания газообразным азотом в течение 5 минут, смесь нагревали до 30°C и обрабатывали Et3N (0,39 мл, 2,8 ммоль). Смесь перемешивали при 34°C в течение 1 часа. После охлаждения до 0°C, смесь обрабатывали хлоридом никеля (6,7 мг, 0,052 ммоль) и продували газообразным азотом в течение 5 минут. После удаления бани со льдом, смесь обрабатывали раствором (6S,E)-6-((2S,3R,4S,4aS,6R,8aS)-6-(3-((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси) пропил)-4-метокси-2-(2-оксоэтил)тетрагидрофуран-3-ил)-2-оксопропил)-3,4-бис((трет-бутилдиметилсилил)окси)октагидропирано[3,2-b]пиран-2-ил)-6-((трет-бутилдиметилсилил)окси)-1-((2S,3aS,5R,7aS)-3a-(йодметил)-5-((R)-2-метил-3-(((трифторметил)сульфонил)окси)бут-3-ен-1-ил)гексагидро-2H-фуро[3,2-b]пиран-2-ил)гекс-4-ен-3-илбензоата (0,089 г, 0,052 ммоль) в смеси THF (3,1 мл) и ацетонитрила (1,4 мл) в течение 40 минут через шприцевой насос. Смесь перемешивали при 20°C в течение следующих 2 часов. Смесь разбавляли н-гептаном (8,90 мл), фильтровали, удаляя нерастворимый остаток, и промывали н-гептаном (8,90 мл). Гептановый слой отделяли, и ацетонитрильный слой экстрагировали н-гептаном (8,9 мл). Гептановые слои объединяли и промывали дважды ацетонитрилом (8,90 мл). После концентрирования, остаток очищали колоночной хроматографией на силикагеле (этилацетат/н-гептан=1/10-1/2), получая соединение 19 (18 мг и 11 мг двух продуктов, эпимерных по C.14, суммарно 36%). масса [M+NH4]=1587,0 и 1586,9, соответственно для двух продуктов (расч. 1586,8).
Ацетилирование
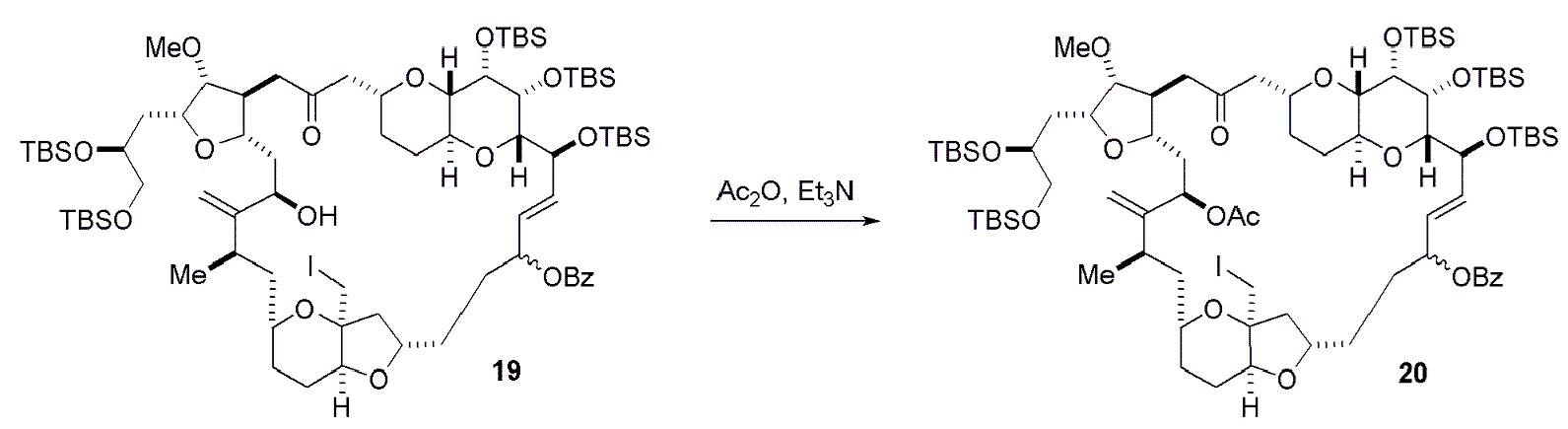
Раствор соединения 19 (0,029 г, 0,018 ммоль) в CH2Cl2 (3 мл) обрабатывали уксусным ангидридом (0,012 мл, 0,13 ммоль), триэтиламином (0,026 мл, 0,19 ммоль) и DMAP (0,226 мг, 1,85 мкмоль). После перемешивания в течение 1 часа при комнатной температуре, добавляли дополнительный триэтиламин (0,026 мл, 0,19 ммоль), уксусный ангидрид (0,012 мл, 0,13 ммоль) и DMAP (0,226 мг, 1,85 мкмоль), и перемешивание продолжали при комнатной температуре в течение следующих 3 часов. Реакцию гасили водой и экстрагировали дважды MTBE. Органические слои объединяли и сушили над MgSO4. После концентрирования, остаток фильтровали через слой силикагеля, и фильтрат концентрировали в вакууме, получая соединение 20 (30 мг).
Фрагментация по Вассела
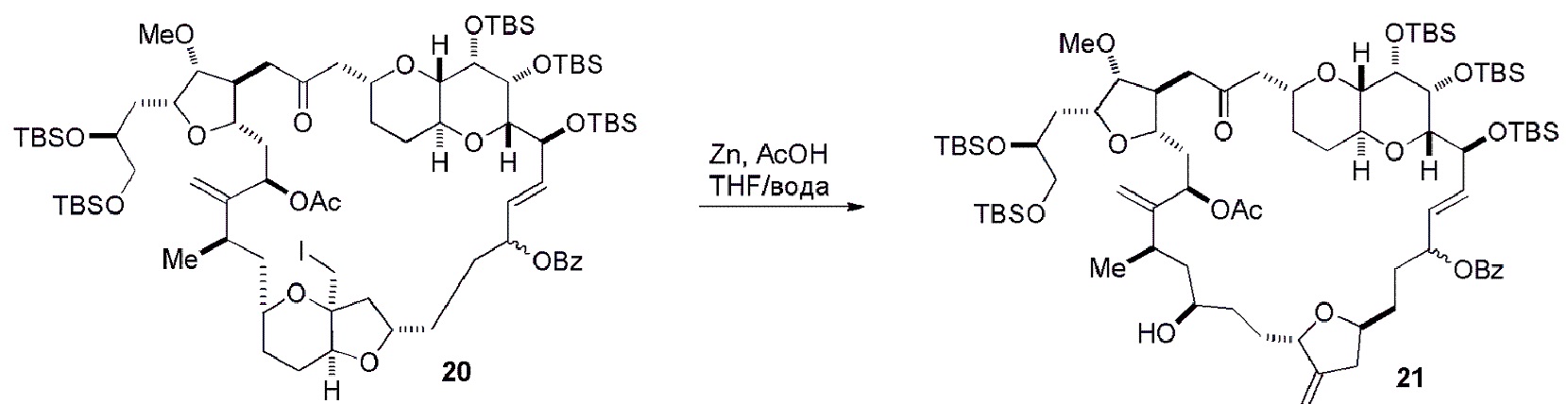
Раствор соединения 20 (0,030 г, 0,019 ммоль) в THF (1,2 мл) обрабатывали водой (0,3 мл), цинковой пылью (0,036 г, 0,56 ммоль) и уксусной кислотой (0,021 мл, 0,37 ммоль). Смесь перемешивали при комнатной температуре в течение 2 часов. Добавляли дополнительную цинковую пыль (0,036 г, 0,56 ммоль) и уксусную кислоту (0,021 мл, 0,37 ммоль), и перемешивание продолжали при комнатной температуре в течение 15 часов. Смесь разбавляли MTBE (30 мл) и фильтровали через слой целита®, удаляя нерастворимый твердый остаток. Фильтрат промывали дважды насыщенным водным NaHCO3 (5 мл), сушили над MgSO4 и концентрировали в вакууме, получая соединение 21 (27 мг).
Мезилирование
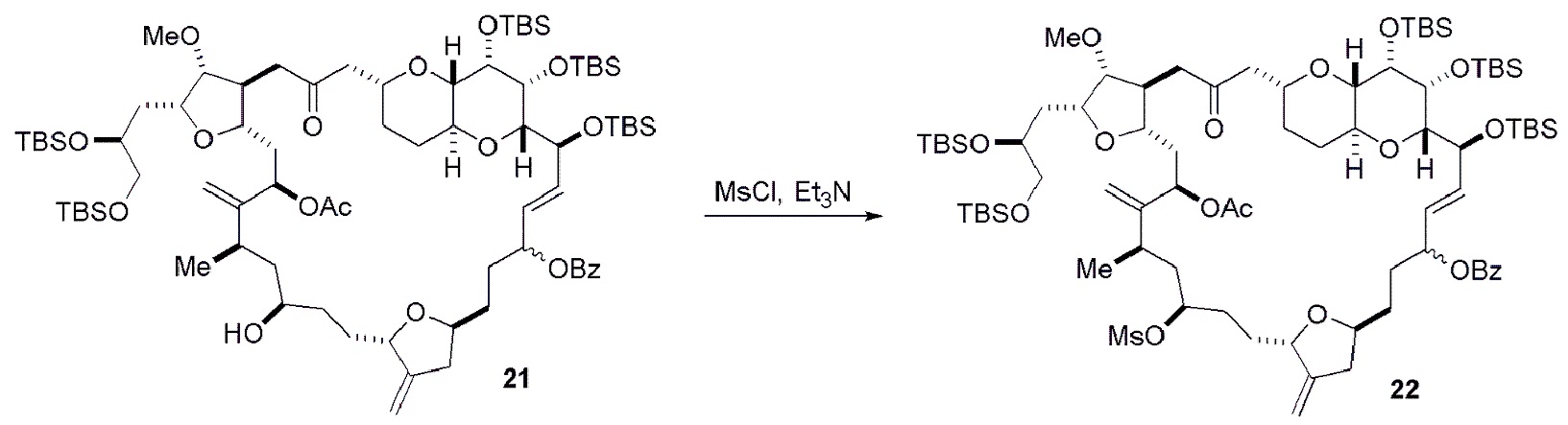
Раствор соединения 21 (0,027 г, 0,018 ммоль) в THF (2 мл) охлаждали до 0°C и обрабатывали MsCl (5,7 мкл, 0,073 ммоль) и триэтиламином (0,020 мл, 0,15 ммоль). Смесь перемешивали при 0°C в течение 1 часа. Реакцию гасили водой (4 мл) и экстрагировали дважды MTBE (8 мл). Органические слои объединяли, сушили над MgSO4 и концентрировали в вакууме, получая соединение 22 (27 мг).
Циклизация с KOMe
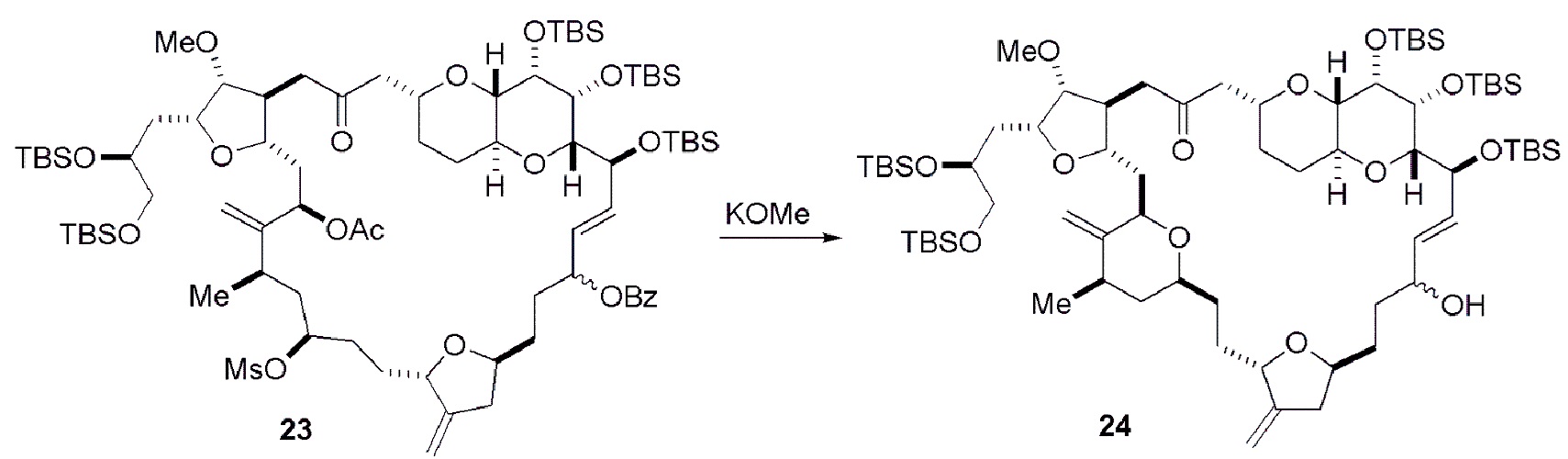
Раствор соединения 23 (0,027 г, 0,017 ммоль) в THF (3 мл) охлаждали до 0°C и обрабатывали 25% метоксидом калия в метаноле (0,025 мл, 0,086 ммоль). Смесь перемешивали при 0°C в течение 3 часов и медленно нагревали до 15°C в течение 14 часов. Реакцию гасили насыщенным водным NH4Cl (2,70 мл) и экстрагировали MTBE (8,10 мл). Органический слой отделяли, сушили над MgSO4 и концентрировали в вакууме, получая соединение 24 (23 мг).
Окисление до сопряженного кетона
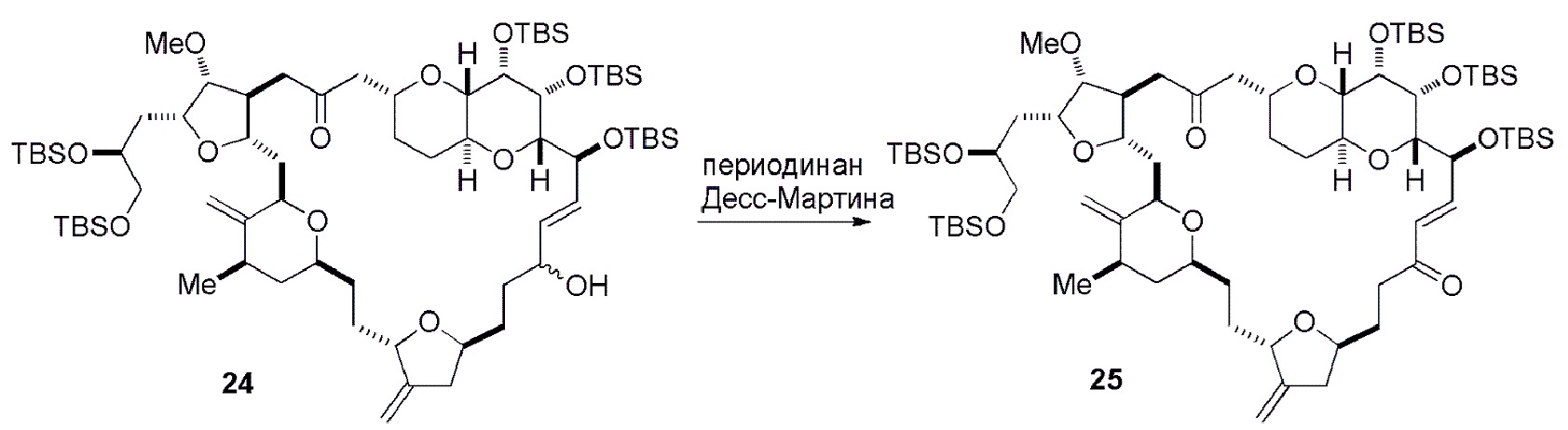
Раствор соединения 24 (0,023 г, 0,017 ммоль) в CH2Cl2 (2 мл) обрабатывали периодинаном Десс-Мартина (0,015 г, 0,035 ммоль) и перемешивали при комнатной температуре в течение 30 минут. Реакцию гасили насыщенным водным NaHCO3 (2 мл) и 20% Na2SO3 (2 мл) и экстрагировали MTBE (2 мл). Органический слой сушили над MgSO4. После концентрирования, остаток очищали колоночной хроматографией на силикагеле (этилацетат/н-гептан=1/10-1/5), получая соединение 25 (1 мг). Структуру подтверждали сравнением 1H ЯМР спектра со спектром аутентичного образца. 1H ЯМР (400 МГц, C6D6) δ -0,08 (с, 3H), 0,02 (с, 12H), 0,03 (с, 3H), 0,04 (с, 3H), 0,11 (с, 3H), 0,13 (с, 3H), 0,18 (с, 3H), 0,85 (с, 27H), 0,92 (с, 9H), 0,95 (с, 9H), 1,01 (м, 1H), 1,05 (д, 3H), 1,20-1,45 (м, 4H), 1,53 (м, 3H), 1,60-1,85 (м, 7H), 1,92 (м, 2H), 2,03 (м, 1H), 2,25 (м, 2H), 2,48 (м, 2H), 2,60-2,78 (м, 4H), 2,84 (дд, 1H), 2,93 (дд, 1H), 3,29 (с, 3H), 3,39 (м, 2H), 3,48 (м, 1H), 3,53 (м, 2H), 3,66 (м, 1H), 3,77 (м, 1H), 3,70-3,80 (м, 4H), 4,01 (д, 1H), 4,05 (с, 2H), 4,22 (м, 1H), 4,75 (с, 1H), 4,82 (с, 1H), 4,88 (с, 1H), 4,98 (с, 1H), 4,99 (м, 1H), 6,33 (д, 1H), 7,25 (дд, 1H).
Пример 9: получение соединения формулы (ID) через C.0-C.1 макроциклизацию
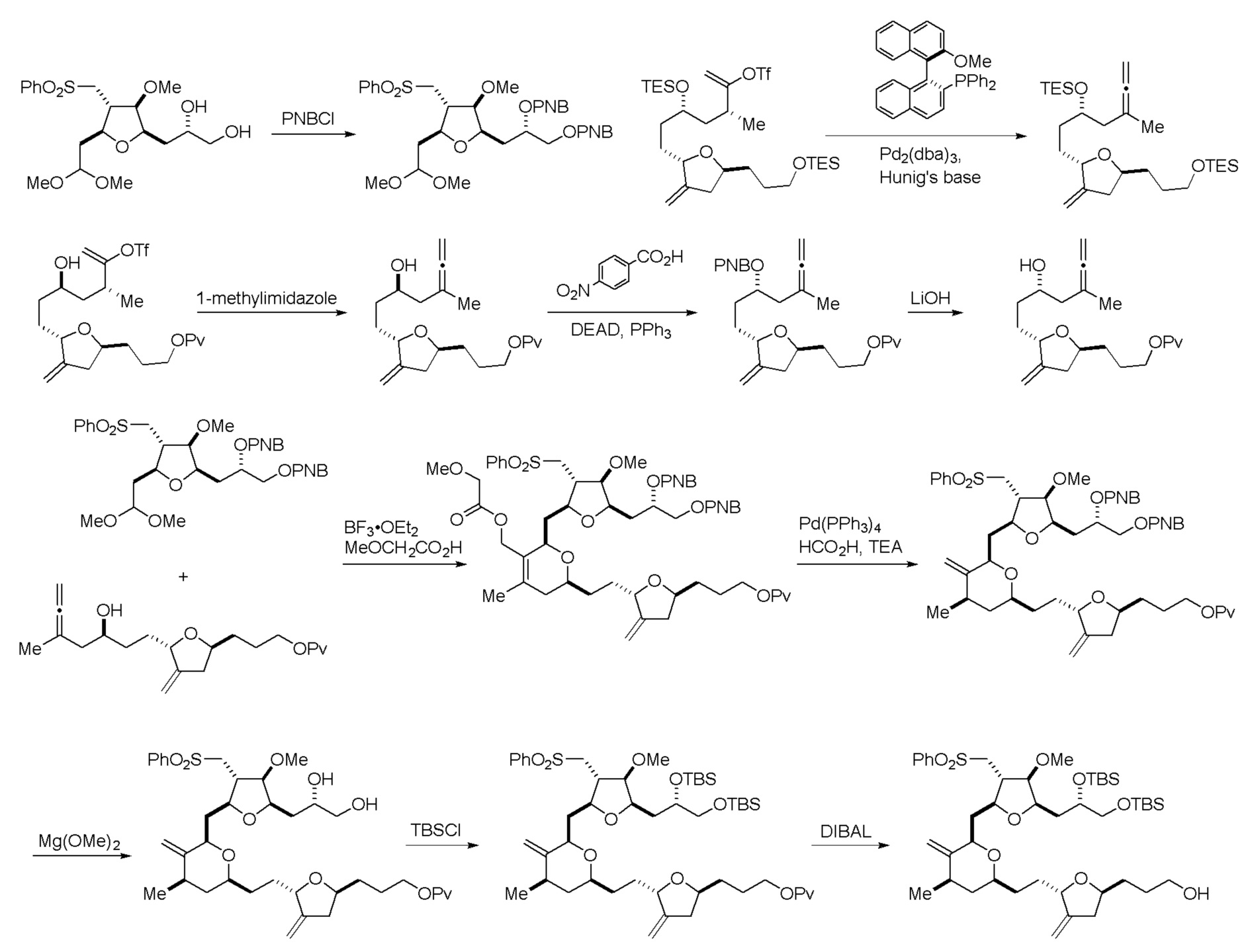
(S)-3-((2R,3R,4S,5S)-5-(2,2-диметоксиэтил)-3-метокси-4-((фенилсульфонил)метил)тетрагидрофуран-2-ил)пропан-1,2-диилбис(4-нитробензоат)
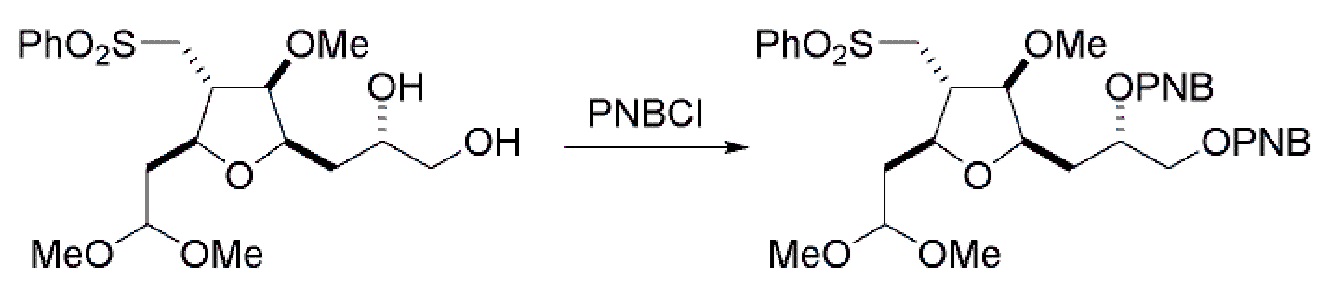
Раствор (S)-3-((2R,3R,4S,5S)-5-(2,2-диметоксиэтил)-3-метокси-4-((фенилсульфонил)метил)тетрагидрофуран-2-ил)пропан-1,2-диола (1,90 г, 4,54 ммоль) растворяли в CH2Cl2 (19 мл) и обрабатывали пиридином (2,203 мл, 27,24 ммоль) и 4-нитробензоилхлоридом (2,53 г, 13,6 ммоль). Смесь перемешивали при комнатной температуре в течение 20 часов и при 40°C в течение 20 часов. Добавляли дополнительный 4-нитробензоилхлорид (0,842 г, 4,54 ммоль) и пиридин (0,734 мл, 9,08 ммоль), и перемешивание продолжали при 40°C в течение следующего 1 дня. Реакцию гасили водой (25 мл), фильтровали, удаляя нерастворимые твердые вещества, и экстрагировали дважды MTBE (25 мл). Органические слои объединяли, промывали 1 N HCl (20 мл) и насыщенным водным NaHCO3 (15 мл), и сушили над MgSO4. После концентрирования, остаток очищали колоночной хроматографией на силикагеле (этилацетат/н-гептан=1/10-1/1), получая заявленное в заголовке соединение (2,05 г, 77% на 2 стадии). 1H ЯМР (400 МГц, CDCl3) δ 1,85 (т, 2H), 2,19 (м, 1H), 2,30 (м, 1H), 2,55 (м, 1H), 3,02 (дд, 1H), 3,09 (дд, 1H), 3,19 (с, 3H), 3,21 (с, 3H), 3,41 (с, 3H), 3,58 (кв, 1H), 3,88 (м, 1H), 3,96 (м, 1H), 4,32 (м, 1H), 4,62 (м, 2H), 5,69 (м, 1H), 7,57 (м, 2H), 7,66 (м, 1H), 7,89 (м, 2H), 8,13 (д, 2H), 8,18 (д, 2H), 8,25 (м, 4H).
Триэтил (((S)-5-метил-1-((2S,5S)-3-метилен-5-(3-((триэтилсилил)окси)пропил)тетрагидрофуран-2-ил)гепта-5,6-диен-3-ил)окси)силан
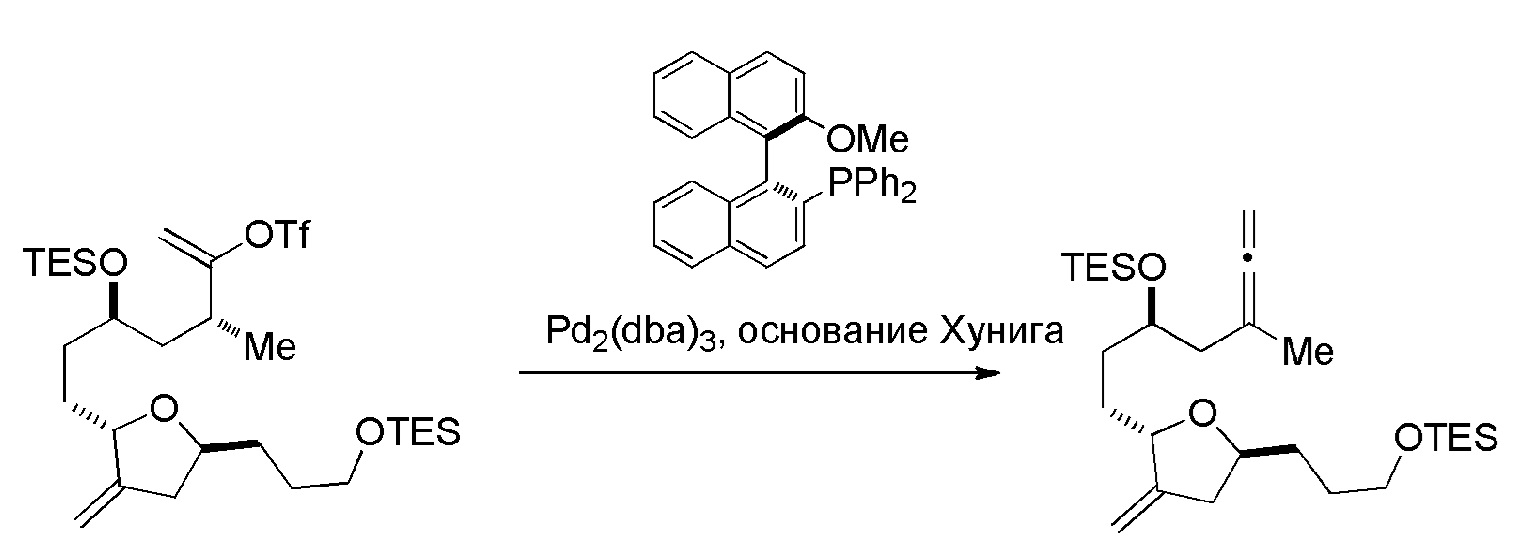
Смесь Pd2(dba)3 (5,7 мг, 6,2 мкмоль) и (S)-(-)-(дифенилфосфино)-2'-метокси-1,1'-бинафтила (0,012 г, 0,025 ммоль) продували азотом в течение 5 минут, обрабатывали н-гептаном (1 мл) и перемешивали при комнатной температуре в течение 10 мин. После добавления основания Хунига (0,11 мл, 0,62 ммоль) и раствора (3R,5R)-3-метил-7-((2S,5S)-3-метилен-5-(3-((триэтилсилил)окси)пропил)тетрагидрофуран-2-ил)-5-((триэтилсилил)окси)гепт-1-ен-2-илтрифторметансульфоната (0,20 г, 0,31 ммоль) в н-гептане (2 мл), смесь перемешивали при комнатной температуре в течение 20 часов, при 35°C в течение 2 дней и при 50°C в течение 1 дня. Смесь охлаждали до комнатной температуры, фильтровали через слой целита®, удаляя катализатор, и слой промывали н-гептаном. Бесцветный фильтрат концентрировали в вакууме, получая заявленное в заголовке соединение (1:1 смесь SM и аллена).
3-((2S,5S)-5-((R)-3-гидрокси-5-метилгепта-5,6-диен-1-ил)-4-метилентетрагидрофуран-2-ил)пропилпивалат
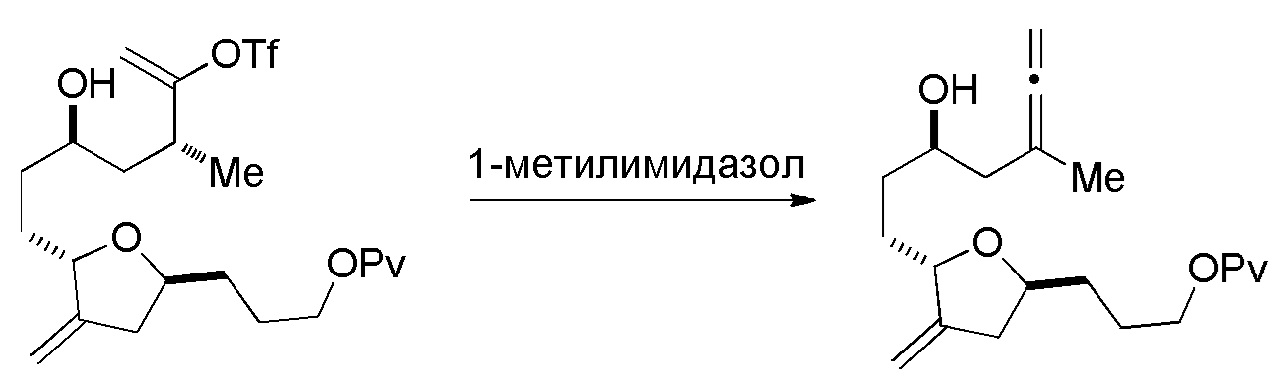
3-((2S,5S)-5-((3R,5R)-3-гидрокси-5-метил-6-(((трифторметил)сульфонил)окси)гепт-6-ен-1-ил)-4-метилентетрагидрофуран-2-ил)пропилпивалат (90,0 г, 180 ммоль) растворяли в 1,2-дихлорэтане (900 мл) и обрабатывали 1-метилимидазолом (25,8 мл, 323,632 ммоль). Смесь перемешивали при 85°C в течение 5 часов. После охлаждения до комнатной температуры, смесь разбавляли MTBE (1,8 л), последовательно промывали 1,0 M HCl в воде (500 мл), водой (200 мл), насыщенным водным бикарбонат натрия (150 мл) и соляным раствором (150 мл), и сушили над Na2SO4. После концентрирования, остаток очищали колоночной хроматографией (этилацетат/н-гептан=3/7), получая смесь аллена и ацетилена. Смесь дополнительно очищали препаративной ВЭЖХ, получая заявленное в заголовке соединение (20 г, 31%). 1H ЯМР (400 МГц, CDCl3) δ 1,10 (с, 9H), 1,40-1,80 (м, 8H), 1,72 (с, 3H), 2,10 (м, 2H), 2,27 (дд, 1H), 2,46 (уш с, 1H), 2,70 (дд, 1H), 3,80 (м, 1H), 4,08 (м, 3H), 4,39 (уш м, 1H), 4,66 (м, 2H), 4,87 (с, 1H), 5,00 (с, 1H).
(S)-5-метил-1-((2S,5S)-3-метилен-5-(3-(пивалоилокси)пропил)тетрагидрофуран-2-ил)гепта-5,6-диен-3-ил 4-нитробензоат
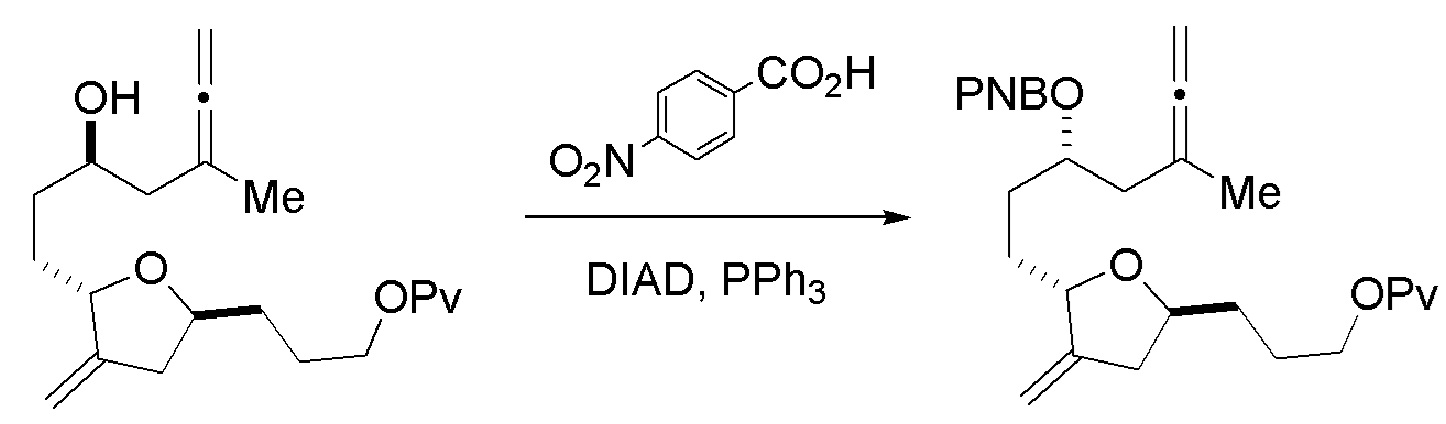
3-((2S,5S)-5-((R)-3-гидрокси-5-метилгепта-5,6-диен-1-ил)-4-метилентетрагидрофуран-2-ил)пропилпивалат (6,94 г, 19,8 ммоль) растворяли в толуоле (35,4 мл) и обрабатывали 4-нитробензойной кислотой (4,30 г, 25,7 ммоль) и трифенилфосфином (6,75 г, 25,7 ммоль). После охлаждения до 0°C, к смеси добавляли DIAD (4,62 мл, 23,7 ммоль) и перемешивали при 0°C в течение 2,5 часов. Смесь разбавляли MTBE (156 мл) и промывали насыщенным водным NaHCO3 (39,0 мл). После концентрирования, остаток очищали колоночной хроматографией на силикагеле (этилацетат/н-гептан=1/9), получая заявленное в заголовке соединение (9,9 г, 100%). 1H ЯМР (400 МГц, CDCl3) δ 1,19 (с, 9H), 1,49 (м, 1H), 1,53-1,80 (м, 5H), 1,73 (с, 3H), 1,88 (м, 2H), 2,28 (м, 2H), 2,41 (м, 1H), 2,68 (м, 1H), 4,02 (м, 1H), 4,08 (м, 2H), 4,40 (м, 1H), 4,45 (м, 1H), 4,52 (м, 1H), 4,81 (с, 1H), 4,99 (с, 1H), 5,34 (м, 1H), 8,20 (м, 2H), 8,30 (м, 2H).
3-((2S,5S)-5-((S)-3-гидрокси-5-метилгепта-5,6-диен-1-ил)-4-метилентетрагидрофуран-2-ил)пропилпивалат
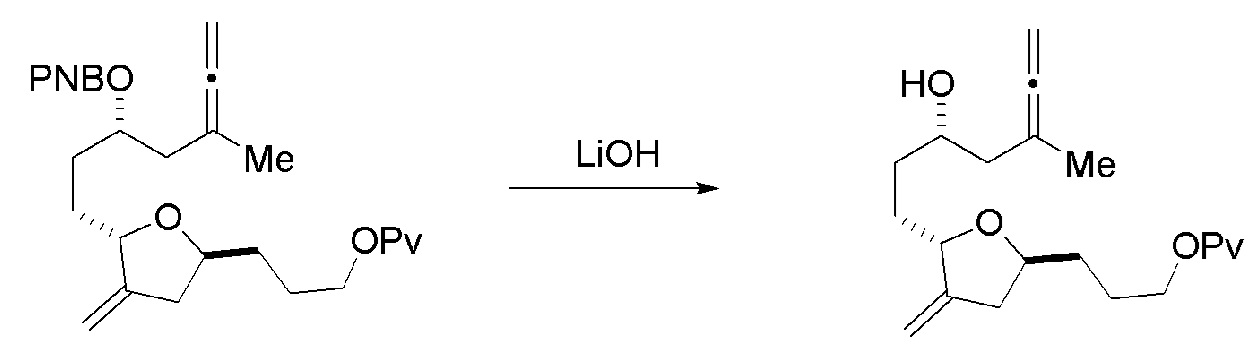
(S)-5-метил-1-((2S,5S)-3-метилен-5-(3-(пивалоилокси)пропил)тетрагидрофуран-2-ил)гепта-5,6-диен-3-ил 4-нитробензоат (9,90 г, 19,8 ммоль) растворяли в смеси THF (100 мл) и воды (50 мл) и обрабатывали моногидратом гидроксида лития (2,50 г, 59,4 ммоль). Смесь перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь разбавляли соляным раствором (118 мл) и экстрагировали MTBE (470 мл). Органический слой концентрировали и очищали колоночной хроматографией на силикагеле (этилацетат/н-гептан= 15/85), получая заявленное в заголовке соединение (5,55 г, 80%). 1H ЯМР (400 МГц, CDCl3) δ 1,20 (с, 9H), 1,40-1,80 (м, 9H), 1,65 (с, 3H), 2,10 (м, 2H), 2,25 (дд, 1H), 2,68 (дд, 1H), 3,79 (м, 1H), 4,05 (м, 2H), 4,40 (м, 1H), 4,62 (м, 2H), 4,85 (с, 1H), 5,00 (с, 1H).
(S)-3-((2R,3R,4S,5S)-3-метокси-5-(((2R,6S)-3-(2-метоксиацетокси)метил-4-метил-6-(2-((2S,5S)-3-метилен-5-(3-(пивалоилокси)пропил)тетрагидрофуран-2-ил)этил)-3,6-дигидро-2H-пиран-2-ил)метил)-4-((фенилсульфонил)метил) тетрагидрофуран-2-ил)пропан-1,2-диил бис(4-нитробензоат)
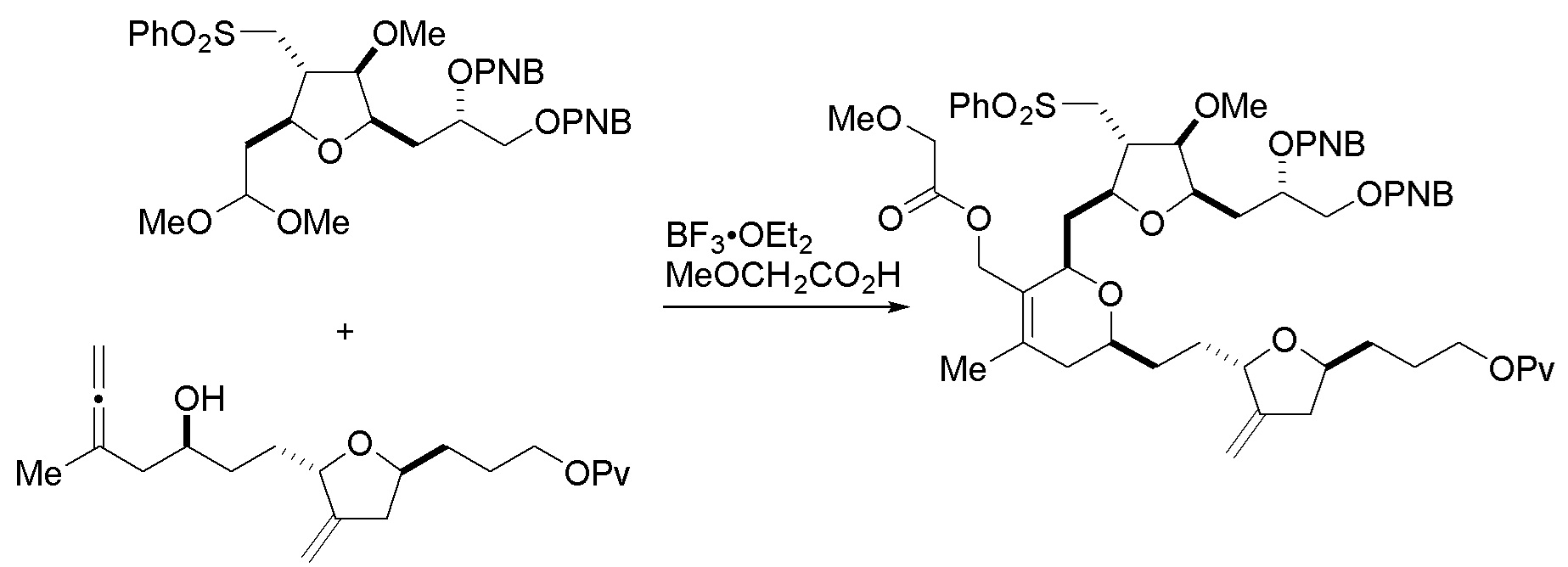
Смесь 3-((2S,5S)-5-((S)-3-гидрокси-5-метилгепта-5,6-диен-1-ил)-4-метилентетрагидрофуран-2-ил)пропилпивалата (0,200 г, 0,571 ммоль) и (S)-3-((2R,3R,4S,5S)-5-(2,2-диметоксиэтил)-3-метокси-4-((фенилсульфонил)метил)тетрагидрофуран-2-ил)пропан-1,2-диил бис(4-нитробензоата) (0,573 г, 0,799 ммоль) растворяли в CH2Cl2 (8,0 мл) и охлаждали до -30°C. Смесь последовательно обрабатывали метоксиуксусной кислотой (0,657 мл, 8,56 ммоль), и затем BF3-OEt2 (0,217 мл, 1,71 ммоль) и перемешивали между -30°C и -20°C в течение 7 часов. Реакцию гасили насыщенным водным NaHCO3 (14,4 мл) и экстрагировали дважды MTBE (10 мл). Органические слои объединяли и промывали соляным раствором. После концентрирования, остаток очищали колоночной хроматографией на силикагеле (этилацетат/н-гептан=1/10-2/3), получая заявленное в заголовке соединение (518 мг, 83%). 1H ЯМР (400 МГц, CDCl3) δ 1,18 (с, 9H), 1,40-1,74 (м, 8H), 1,70 (с, 3H), 1,76-1,96 (м, 4H), 2,16-2,34 (м, 3H), 2,60-2,70 (м, 2H), 3,00 (дд, 1H), 3,16 (дд, 1H), 3,34 (м, 1H), 3,42 (с, 3H), 3,45 (с, 3H), 3,61 (м, 1H), 3,82 (м, 1H), 3,94-3,46 (м, 7H), 4,26 (м, 1H), 4,52 (д, 1H), 4,58-4,69 (м, 3H), 4,73 (с, 1H), 4,92 (с, 1H), 5,66 (м, 1H), 7,58 (м, 2H), 7,62 (м, 1H), 7,90 (м, 2H), 8,1-8,3 (м, 8H).
(S)-3-((2R,3R,4S,5S)-3-метокси-5-(((2R,4R,6S)-4-метил-3-метилен-6-(2-((2S,5S)-3-метилен-5-(3-(пивалоилокси)пропил)тетрагидрофуран-2-ил)этил)тетрагидро-2H-пиран-2-ил)метил)-4-((фенилсульфонил)метил)тетрагидрофуран-2-ил)пропан-1,2-диил бис(4-нитробензоат)
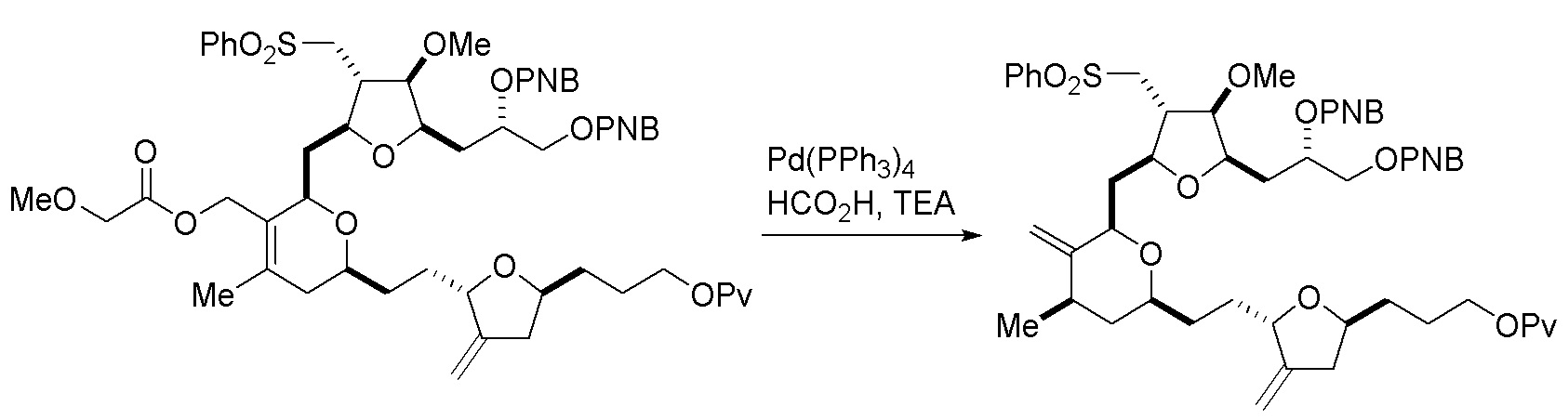
Смесь Pd(Ph3P)4 (0,024 г, 0,021 ммоль) и трифенилфосфина (0,022 г, 0,084 ммоль) в THF (2,3 мл) (в пробирке с крышкой) нагревали до 60°C и перемешивали в течение 5 минут. Смесь обрабатывали смесью (S)-3-((2R,3R,4S,5S)-3-метокси-5-(((2R,6S)-3-(2-метоксиацетокси)метил-4-метил-6-(2-((2S,5S)-3-метилен-5-(3-(пивалоилокси)пропил)тетрагидрофуран-2-ил)этил)-3,6-дигидро-2H-пиран-2-ил)метил)-4-((фенилсульфонил)метил)тетрагидрофуран-2-ил)пропан-1,2-диил бис(4-нитробензоата) (0,230 г, 0,21 ммоль), муравьиной кислоты (0,040 мл, 1,1 ммоль) и триэтиламина (0,147 мл, 1,05 ммоль) в THF (3,4 мл). Смесь перемешивали при 60°C (баня) в течение 46 часов. После охлаждения до комнатной температуры, смесь обрабатывали водой (10,5 мл) и экстрагировали дважды MTBE (10,5 мл). Органические слои объединяли и промывали соляным раствором (10 мл). После концентрирования, остаток очищали колоночной хроматографией на силикагеле (этилацетат/н-гептан=1/10-1/2), получая заявленное в заголовке соединение (148 мг, 70%). 1H ЯМР (400 МГц, CDCl3) δ 1,06 (д, 3H), 1,18 (с, 9H), 1,24-1,68 (м, 8H), 1,68-1,80 (м, 2H), 1,86 (м, 1H), 2,04-2,28 (м, 4H), 2,56 (м, 1H), 2,58-2,68 (м, 2H), 3,05 (м, 2H), 3,36 (м, 1H), 3,46 (с, 3H), 3,58 (дд, 1H), 3,73 (м, 1H), 3,85 (м, 1H), 3,95 (м, 1H), 4,01 (м, 1H), 4,06 (м, 2H), 4,23 (м, 1H), 4,60-4,72 (м, 3H), 4,78 (с, 2H), 4,92 (с, 1H), 5,72 (м, 1H), 7,62 (м, 2H), 7,70 (м, 1H), 7,97 (м, 2H), 8,1-8,3 (м, 8H).
3-((2S,5S)-5-(2-((2S,4R,6R)-6-(((2S,3S,4R,5R)-5-((S)-2,3-дигидроксипропил)-4-метокси-3-((фенилсульфонил)метил)тетрагидрофуран-2-ил)метил)-4-метил-5-метилентетрагидро-2H-пиран-2-ил)этил)-4-метилентетрагидрофуран-2-ил)пропилпивалат
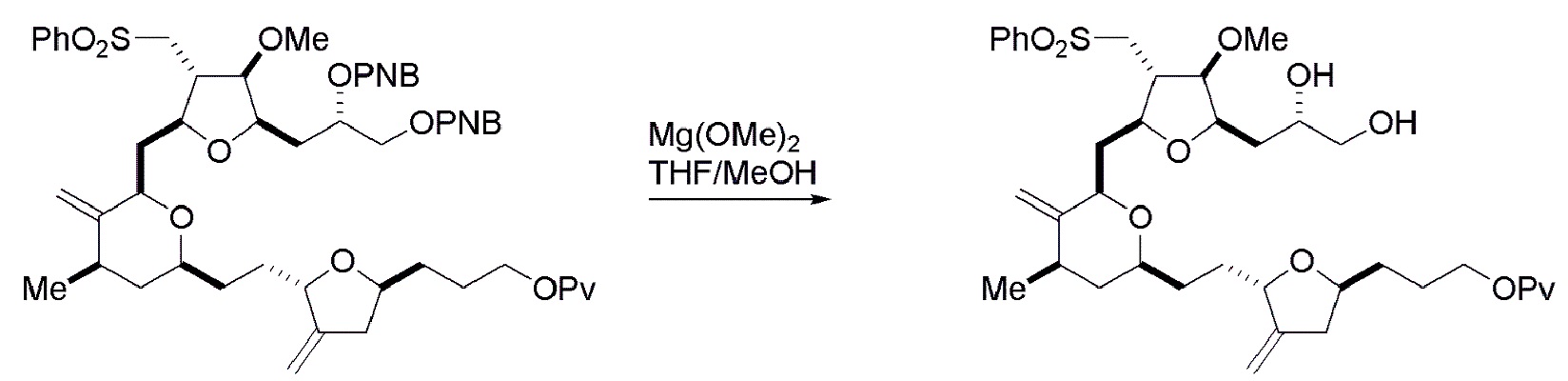
Раствор (S)-3-((2R,3R,4S,5S)-3-метокси-5-(((2R,4R,6S)-4-метил-3-метилен-6-(2-((2S,5S)-3-метилен-5-(3-(пивалоилокси)пропил)тетрагидрофуран-2-ил)этил)тетрагидро-2H-пиран-2-ил)метил)-4-((фенилсульфонил)метил)тетрагидрофуран-2-ил)пропан-1,2-диилбис(4-нитробензоата) (1,90 г, 1,89 ммоль) в смеси THF (1,9 мл) и метанола (38 мл) обрабатывали 6-10% Mg(OMe)2 в метаноле (2,07 мл, 1,13 ммоль). Смесь перемешивали при комнатной температуре в течение 2 часов. Реакцию гасили насыщенным водным NH4Cl (19 мл), концентрировали, удаляя метанол, и экстрагировали три раза этилацетатом (19 мл). Органические слои объединяли и сушили над MgSO4. После концентрирования, остаток очищали колоночной хроматографией (этилацетат/н-гептан=1/10-2/1), получая заявленное в заголовке соединение (934 мг, 70%). 1H ЯМР (400 МГц, CDCl3) δ 1,08 (д, 3H), 1,20 (с, 9H), 1,34-1,84 (м, 11H), 1,90-2,06 (м, 2H), 2,14-2,26 (м, 3H), 2,58-2,68 (м, 2H), 3,04-3,16 (м, 2H), 3,41 (м, 1H), 3,46 (с, 3H), 3,56 (дд, 1H), 3,60 (м, 1H), 3,66 (дд, 1H), 3,83 (м, 1H), 3,92 (с, 2H), 3,92-4,00 (м, 2H), 4,07 (м, 2H), 4,26 (уш м, 1H), 4,68 (д, 1H), 4,80 (д, 1H), 4,85 (с, 1H), 4,92 (с, 1H), 7,62 (м, 2H), 7,70 (м, 1H), 7,99 (м, 2H).
3-((2S,5S)-5-(2-((2S,4R,6R)-6-(((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-3-((фенилсульфонил)метил)тетрагидрофуран-2-ил)метил)-4-метил-5-метилентетрагидро-2H-пиран-2-ил)этил)-4-метилентетрагидрофуран-2-ил)пропилпивалат
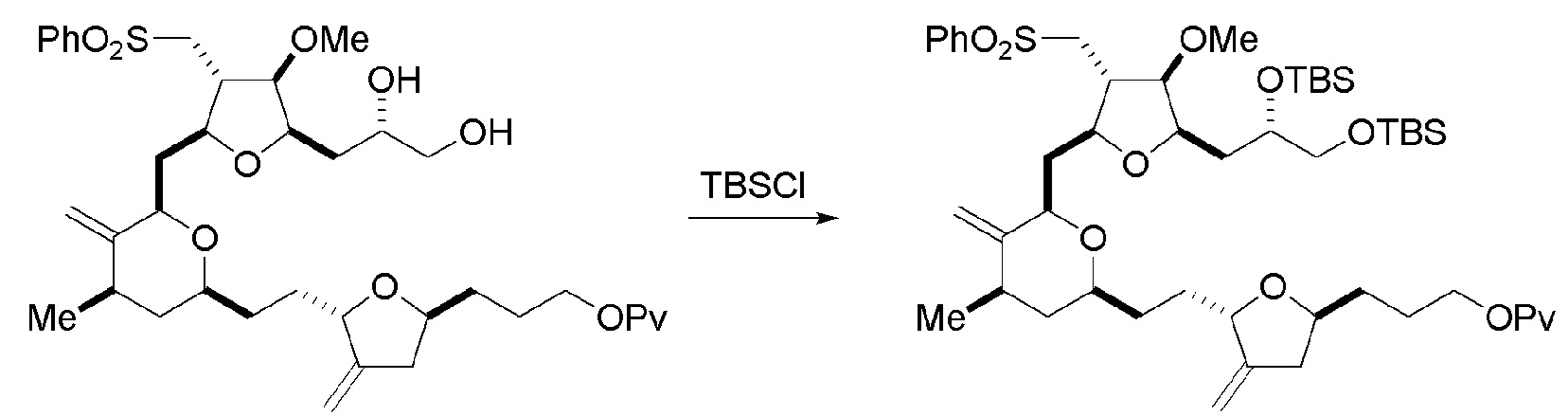
Раствор 3-((2S,5S)-5-(2-((2S,4R,6R)-6-(((2S,3S,4R,5R)-5-((S)-2,3-дигидроксипропил)-4-метокси-3-((фенилсульфонил)метил)тетрагидрофуран-2-ил)метил)-4-метил-5-метилентетрагидро-2H-пиран-2-ил)этил)-4-метилентетрагидрофуран-2-ил)пропилпивалата (0,040 г, 0,057 ммоль) в DMF (1 мл) обрабатывали имидазолом (0,019 г, 0,28 ммоль) и TBSCl (0,026 г, 0,17 ммоль), и перемешивали при комнатной температуре в течение 3 часов. Добавляли дополнительный TBSCl (0,026 г, 0,17 ммоль) и имидазол (0,019 г, 0,28 ммоль), и перемешивание продолжали при комнатной температуре в течение 3 дней. Реакцию гасили водой (4 мл) и разбавляли MTBE (5 мл). Органический слой отделяли, промывали дважды водой (4 мл) и сушили над MgSO4, получая заявленное в заголовке соединение (40 мг).
3-((2S,5S)-5-(2-((2S,4R,6R)-6-(((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-3-((фенилсульфонил)метил)тетрагидрофуран-2-ил)метил)-4-метил-5-метилентетрагидро-2H-пиран-2-ил)этил)-4-метилентетрагидрофуран-2-ил)пропан-1-ол
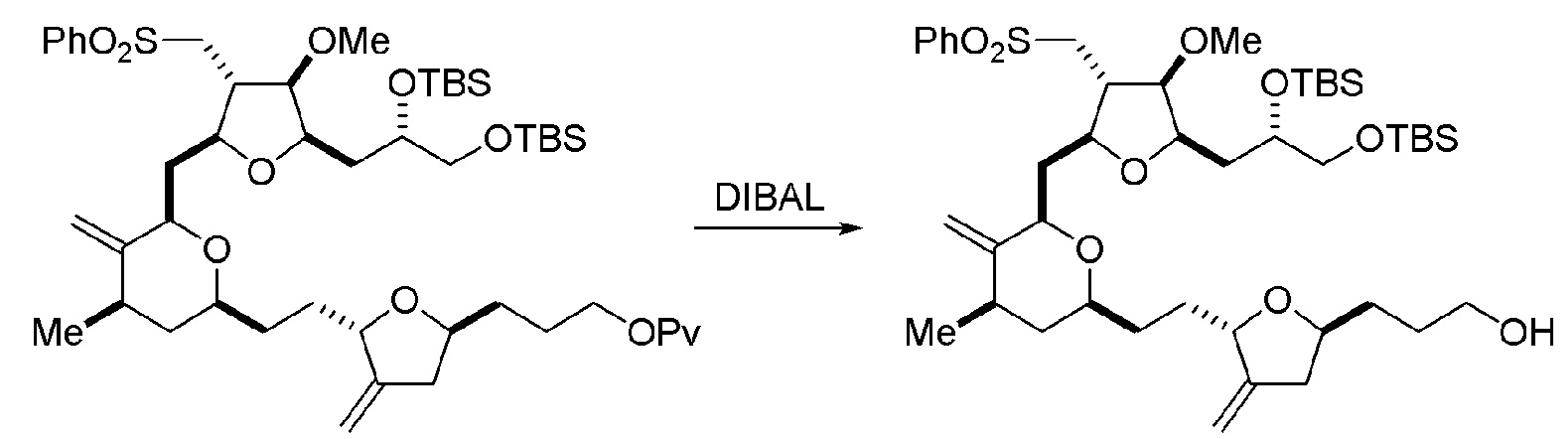
Раствор 3-((2S,5S)-5-(2-((2S,4R,6R)-6-(((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-3-((фенилсульфонил)метил)тетрагидрофуран-2-ил)метил)-4-метил-5-метилентетрагидро-2H-пиран-2-ил)этил)-4-метилентетрагидрофуран-2-ил)пропилпивалата (0,040 г, 0,043 ммоль) в толуоле (1,5 мл) охлаждали до -78°C и обрабатывали 1,5 M DIBAL в толуоле (0,114 мл, 0,171 ммоль). Смесь перемешивали при -78°C в течение 30 минут. Добавляли дополнительный 1,5 M DIBAL в толуоле (0,057 мл, 0,086 ммоль), и перемешивание продолжали при -78°C в течение следующего 1 часа. Реакцию гасили 1 N HCl (1 мл) и MTBE (10 мл) и перемешивали при комнатной температуре в течение 1 часа. Органический слой отделяли и последовательно промывали водой (5 мл), насыщенным водным NaHCO3 (5 мл) и соляным раствором (3 мл). После концентрирования, остаток очищали колоночной хроматографией на силикагеле (этилацетат/н-гептан=1/10-2/3), получая заявленное в заголовке соединение (13 мг, 60% на 3 стадии). 1H ЯМР (400 МГц, CDCl3) δ 0,02 (с, 6H), 0,04 (с, 6H), 0,88 (с, 18H), 1,02 (д, 3H), 1,34-1,48 (м, 2H), 1,48-1,70 (м, 6H), 1,76 (м, 1H), 1,80-1,94 (м, 3H), 2,02 (м, 1H), 2,14-2,28 (м, 3H), 2,56 (м, 1H), 2,64 (м, 1H), 3,20 (м, 2H), 3,40 (м, 1H), 3,43 (с, 3H), 3,48 (дд, 1H), 3,65-3,72 (м, 5H), 3,76-3,86 (м, 3H), 3,98 (м, 1H), 4,30 (м, 1H), 4,68 (с, 1H), 4,78 (с, 1H), 4,86 (с, 1H), 4,92 (с, 1H), 7,60 (м, 2H), 7,70 (м, 1H), 8,21 (м, 2H).
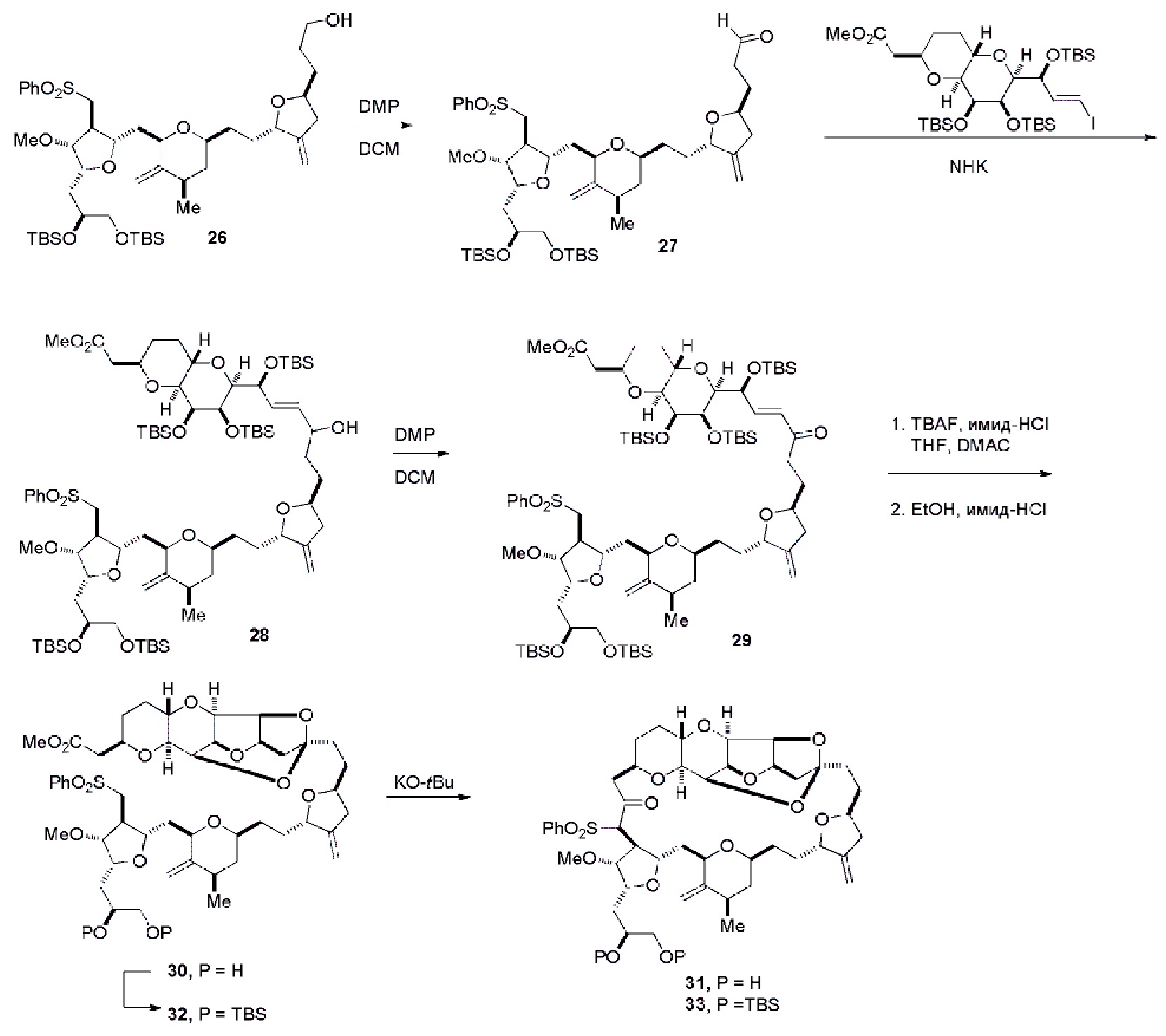
3-((2S)-5-(2-((2S,4R,6R)-6-(((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-3-((фенилсульфонил)метил)тетрагидрофуран-2-ил)метил)-4-метил-5-метилентетрагидро-2H-пиран-2-ил)этил)-4-метилентетрагидрофуран-2-ил)пропан-1-аль
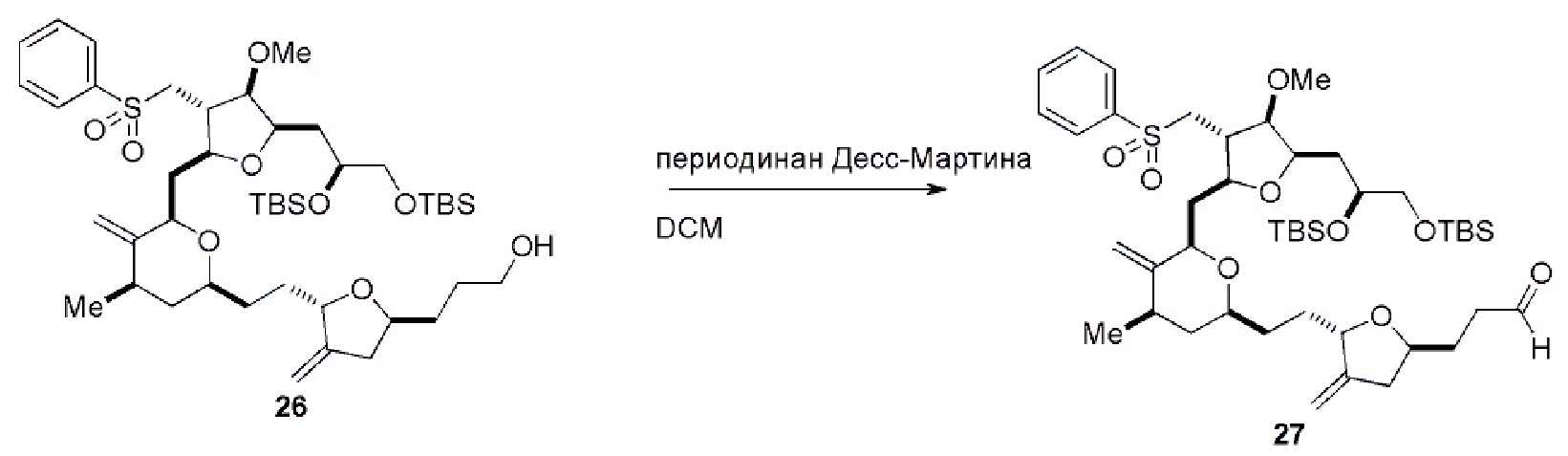
3-((2S)-5-(2-((2S,4R,6R)-6-(((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-3-((фенилсульфонил)метил)тетрагидрофуран-2-ил)метил)-4-метил-5-метилентетрагидро-2H-пиран-2-ил)этил)-4-метилентетрагидрофуран-2-ил)пропан-1-ол 26 (5,72 г, 6,721 ммоль) растворяли в DCM (43,3 мл, 673,711 ммоль) и добавляли воду (0,036 мл, 2,016 ммоль). Добавляли порциями в течение 4 минут периодинан Десс-Мартина (DMP) (3,60 г, 8,488 ммоль), поддерживая температуру ниже 25 oC, и реакцию контролировали ТСХ (MTBE и силикагель). Добавляли дополнительный DMP (2,550 г, 5,012 ммоль), и реакцию перемешивали до потребления соединения 26. Добавляли насыщенный водный бикарбонат натрия (50 мл), с последующим добавлением 10% водного тиосульфата натрия (50 мл). Смесь распределяли, и водный слой экстрагировали дважды дихлорметаном (DCM). Объединенные DCM экстракты промывали водой, и раствор сушили над сульфатом натрия и концентрировали, получая 27 (5,63 г, 99% выход) в виде оранжевого масла, которое применяли как есть в следующей стадии.
Метил 2-((2R,4aS,6S,7R,8S,8aS)-6-((1S,E)-6-((2S)-5-(2-((2S,4R,6R)-6-(((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-3-((фенилсульфонил)метил)тетрагидрофуран-2-ил)метил)-4-метил-5-метилентетрагидро-2H-пиран-2-ил)этил)-4-метилентетрагидрофуран-2-ил)-1-((трет-бутилдиметилсилил)окси)-4-гидроксигекс-2-ен-1-ил)-7,8-бис((трет-бутилдиметилсилил)окси)октагидропирано[3,2-b]пиран-2-ил)ацетат
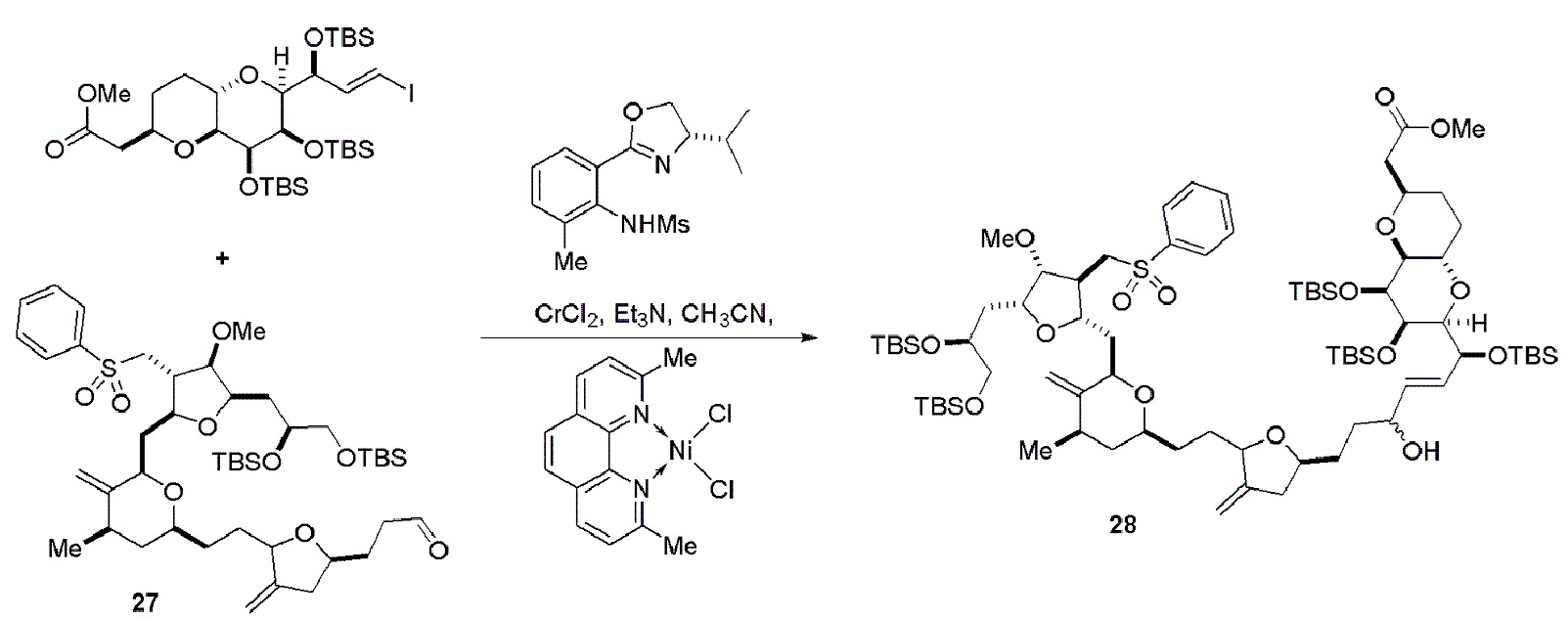
(S)-N-(2-(4-изопропил-4,5-дигидрооксазол-2-ил)-6-метилфенил)метансульфамид (3,84 г, 12,94 ммоль) добавляли в трехгорлую колбу, оснащенную 3-ходовым краном, септой и пульверизатором для загрузки твердых веществ. Хлорид хрома (II) (1,59 г, 12,94 ммоль) добавляли в пульверизатор для загрузки твердых веществ, и аппарат продували азотом (3 x вакуум/продувка противотоком N2- через 3-ходовой кран). Добавляли тетрагидрофуран (17,58 мл). Добавляли порциями CrCl2 в энергично перемешиваемый раствор. Полученную в результате суспензию нагревали до 30°C и добавляли TEA (1,85 мл, 12,94 ммоль). Раствор перемешивали в течение 60 минут перед охлаждением до 0°C. Добавляли комплекс [(2,9-диметил-1,10-фенантролин)дихлорникеля(II)] (0,224 г, 0,663 ммоль) в тетрагидрофуране (2,5 мл), с последующим добавлением смеси 3-((2S)-5-(2-((2S,4R,6R)-6-(((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-3-((фенилсульфонил)метил)тетрагидрофуран-2-ил)метил)-4-метил-5-метилентетрагидро-2H-пиран-2-ил)этил)-4-метилентетрагидрофуран-2-ил)пропаналя 27 (2,198 г, 2,588 ммоль) и метил 2-((2R,4aS,6S,7R,8S,8aS)-7,8-бис((трет-бутилдиметилсилил)окси)-6-((с,E)-1-((трет-бутилдиметилсилил)окси)-3-йодаллил)октагидропирано[3,2-b]пиран-2-ил)ацетата (2,394 г, 3,106 ммоль) в THF (4,4 мл). Реакцию нагревали до комнатной температуры и контролировали ТСХ и ВЭЖХ. После завершения, реакцию охлаждали до 5-10°C и добавляли этилендиамин (2,184 мл, 25,88 ммоль). Смесь перемешивали в течение 1 часа, и затем добавляли н-гептан (25 мл) и воду (25 мл). Слои разделяли, и водный слой экстрагировали дважды н-гептаном (25 мл). Объединенные органические слои объединяли и промывали водным хлороводородом (1,0N, 25 мл), водой (25 мл), насыщенным водным бикарбонатом натрия (25 мл) и насыщенным водным хлоридом натрия (25 мл). Раствор сушили сульфатом натрия, фильтровали и частично концентрировали в вакууме. Осадок (S)-N-(2-(4-изопропил-4,5-дигидрооксазол-2-ил)-6-метилфенил)метансульфамида фильтровали, и остаток на фильтре промывали гептаном (20 мл). Фильтрат и промывку концентрировали досуха, и неочищенный продукт очищали на Biotage® Snap KP-Sil 100 г картридже, кондиционированном гептаном (4 ОК). Неочищенный продукт загружали в гептане и элюировали гептаном/этилацетатом (9:1, 4:1, 7:3 и 1:1 гептан/этилацетат, 5 ОК каждый). Фракции, содержащие продукт, объединяли, получая 28 (2,773 г, 72%) в виде бледно-желтого масла после удаления летучих компонентов в вакууме.
Метил 2-((2R,4aS,6S,7R,8S,8aS)-6-((1S,E)-6-((2S)-5-(2-((2S,4R,6R)-6-(((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-3-((фенилсульфонил)метил)тетрагидрофуран-2-ил)метил)-4-метил-5-метилентетрагидро-2H-пиран-2-ил)этил)-4-метилентетрагидрофуран-2-ил)-1-((трет-бутилдиметилсилил)окси)-4-оксогекс-2-ен-1-ил)-7,8-бис((трет-бутилдиметилсилил)окси)октагидропирано[3,2-b]пиран-2-ил)ацетат
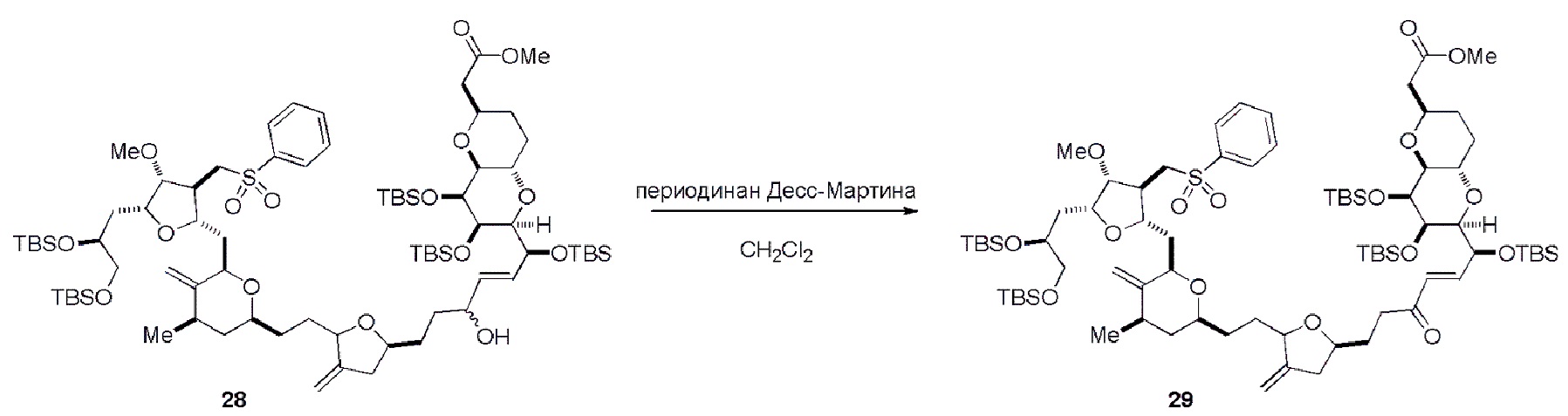
Метил 2-((2R,4aS,6S,7R,8S,8aS)-6-((1S,E)-6-((2S)-5-(2-((2S,4R,6R)-6-(((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-3-((фенилсульфонил)метил)тетрагидрофуран-2-ил)метил)-4-метил-5-метилентетрагидро-2H-пиран-2-ил)этил)-4-метилентетрагидрофуран-2-ил)-1-((трет-бутилдиметилсилил)окси)-4-гидроксигекс-2-ен-1-ил)-7,8-бис((трет-бутилдиметилсилил)окси)октагидропирано[3,2-b]пиран-2-ил)ацетат 28 (2,773 г, 0,1,856 ммоль) растворяли в DCM (13,4 мл) и добавляли воду (1,67 мкл, 0,093 ммоль). Добавляли порциями периодинан Десс-Мартина (0,944 г, 2,227 ммоль), поддерживая температуру ниже 22 oC. Когда реакцию считали завершенной, добавляли 25 мл насыщенного водного бикарбоната натрия, с последующим добавлением 10% водного тиосульфата натрия (25 мл). Смесь перемешивали в течение 20 минут, и слои распределяли. Водный слой экстрагировали дихлорметаном (DCM) (2×40 мл). Объединенные органические слои концентрировали в вакууме, получая 29 (2,688 г, 1,8 ммоль, 97% выход). 1H ЯМР (400 МГц, CDCl3) δ: 7,92 (дд, 2H), 7,68 (т,1H), 7,60 (т, 2H), 7,55-7,63 (м, 2H), 7,08 (дд, 1H), 6,29 (д, 1H), 5,08-5,14 (м, 1H), 4,85-4,89 (м, 1H), 4,83 (с, 1H), 4,76 (с, 1H), 4,62 (д, 1H), 4,17-4,24 (м, 1H), 4,07 (с, 1H), 3,87-4,02 (м, 1H), 3,83 (с, 4H), 3,65-3,66 (м, 3H), 3,65 (с, 3H), 3,62-3,69 (м, 2H), 3,52-3,61 (м, 2H), 3,47 (дд, 1H), 3,41-3,42 (м, 3H), 3,41 (с, 3H), 3,25-3,43 (м, 6H), 2,95-3,06 (м, 1H), 2,90 (дд, 1H), 2,44-2,73 (м, 4H), 2,30-2,37 (м, 1H), 2,12-2,24 (м, 2H), 1,95-2,02 (м, 1H), 1,63-1,92 (м, 6H), 1,13-1,58 (м, 5H), 1,02-1,08 (м, 3H), 1,05 (д, 3H), 0,98-1,10 (м, 3H), 0,93-0,95 (м, 2H), 0,94 (с, 9H), 0,92 (с, 9H), 0,87 (с, 18H), 0,89-0,85 (м, 2H), 0,85 (с, 9H), 0,12 (с, 3H), 0,11 (с, 3H), 0,08 (с, 3H), 0,08 (с, 3H), 0,03 (с, 3H).
Метил 2-((2S,3aR,4aR,5S,5aS,7R,9aS,10aR,10bS)-2-(2-((2S,5S)-5-(2-((2S,4R,6R)-6-(((2S,3S,4R,5R)-5-((S)-2,3-дигидроксипропил)-4-метокси-3-((фенилсульфонил)метил)тетрагидрофуран-2-ил)метил)-4-метил-5-метилентетрагидро-2H-пиран-2-ил)этил)-4-метилентетрагидрофуран-2-ил)этил)додекагидро-2,5-эпоксифуро[2',3':4,5]фуро[3,2-b]пирано[2,3-e]пиран-7-ил)ацетат
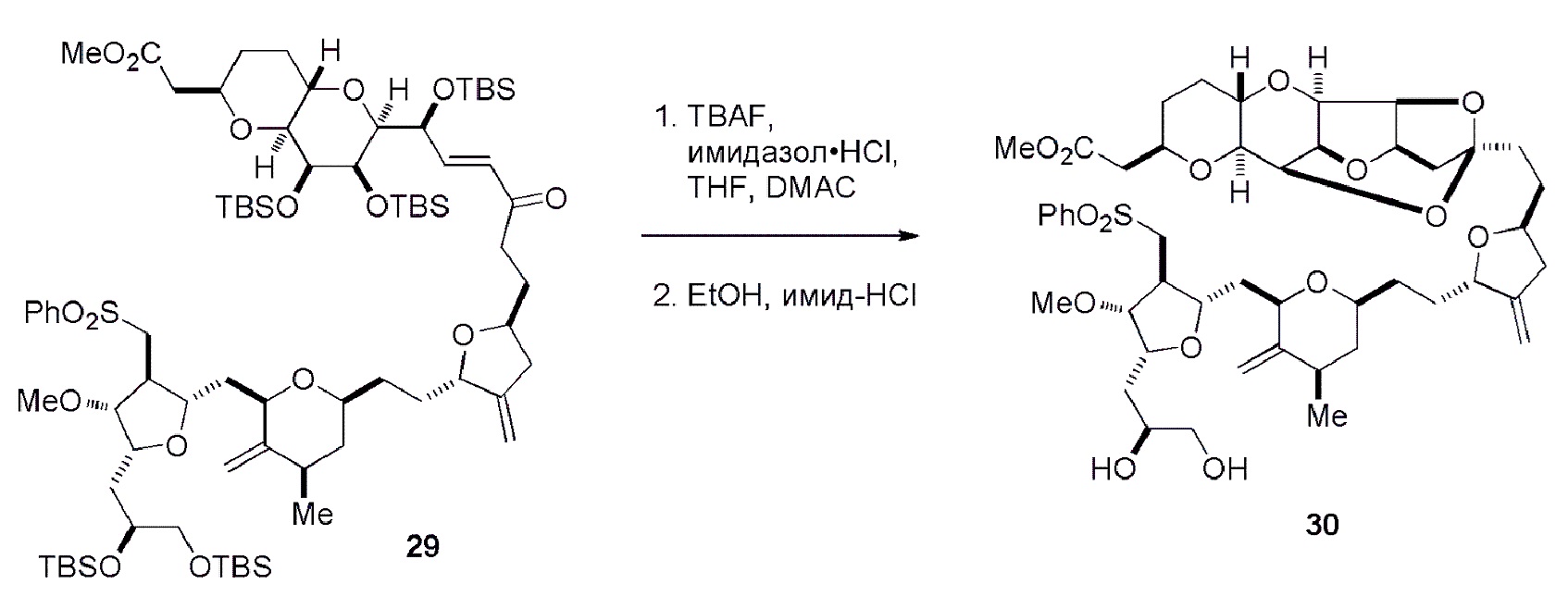
Метил 2-((2R,4aS,6S,7R,8S,8aS)-6-((1S,E)-6-((2S)-5-(2-((2S,4R,6R)-6-(((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-3-((фенилсульфонил)метил)тетрагидрофуран-2-ил)метил)-4-метил-5-метилентетрагидро-2H-пиран-2-ил)этил)-4-метилентетрагидрофуран-2-ил)-1-((трет-бутилдиметилсилил)окси)-4-оксогекс-2-ен-1-ил)-7,8-бис((трет-бутилдиметилсилил)окси)октагидропирано[3,2-b]пиран-2-ил)ацетат 29 (4,26 г, 2,854 ммоль) растворяли в THF (63,9 мл, 779,855 ммоль) и N,N-диметилацетамиде (21,30 мл, 227,375 ммоль). Добавляли гидрохлорид имидазола (0,880 г, 8,421 ммоль), с последующим добавлением TBAF в THF (18,55 мл, 18,554 ммоль). Реакцию контролировали ТСХ (силикагель; 1:1 MTBE/гептан и 9:1 EtOAc/MeOH) и перемешивали в течение 10 дней. Когда реакцию считали завершенной, реакционную смесь концентрировали в вакууме при комнатной температуре, и остаток растворяли в этаноле (90 мл). Добавляли гидрохлорид 1H-имидазола (2,510 г, 24,007 ммоль) и воду (42,6 мл, 2364,659 ммоль), и реакцию контролировали ТСХ на образование соединения 30. Через 24 часа добавляли дополнительную порцию гидрохлорида имидазола (2,5 г), и раствор перемешивали в течение 72 часов. Добавляли водный насыщенный бикарбонат натрия, с последующим добавлением толуола, и смесь концентрировали в вакууме, удаляя EtOH. Остаток разбавляли 30 объемами 2:1 (v/v) THF/толуол, и фазы разделяли. Водный слой экстрагировали 10 объемами 1:1 (v/v) THF/толуол. Объединенные органические слои промывали водой (2×10 объемов), сушили сульфатом натрия и концентрировали в вакууме. Остаток очищали на Biotage® с 300 г HP-Sil картриджем, применяя 2:1 толуол/ацетонитрил (1 л), 1:1 толуол/ацетонитрил (2 л) и 9:1 ацетонитрил/MeOH. Фракции, содержащие соединение 30, объединяли и концентрировали в вакууме, получая 1,8 г продукта. 1H ЯМР (400 МГц, CDCl3) δ 7,93 (д, 2H), 7,68 (т, 1H), 7,60 (т, 2H), 4,89 (д, 1H), 4,82 (с, 1H), 4,77 (с, 1H), 4,68-4,65 (м, 2H), 4,60-4,57 (м, 1H), 4,42-4,40 (м, 1H), 4,29-4,22 (м, 2H), 4,18 (дд, 1H), 4,05 (дд, 1H), 3,98-3,88 (м, 4H), 3,80 (тд, 2H), 3,64 (с, 3H), 3,70-3,49 (м, 1H), 3,42 (с, 3H), 3,38-3,28 (м, 2H), 3,15-3,00 (м, 2H), 2,91 (дд, 1H), 2,65-2,54 (м, 3H), 2,38 (д, 1H), 2,34 (д, 1H), 2,24-2,12 (м, 6H), 2,11-1,84 (м, 5H), 1,84-1,57 (м, 6H), 1,56-1,45 (м, 2H), 1,44-1,26 (м, 4H), 1,09-0,97 (м, 4H).
Метил 2-((2S,3aR,4aR,5S,5aS,7R,9aS,10aR,10bS)-2-(2-((2S,5S)-5-(2-((2S,4R,6R)-6-(((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-3-((фенилсульфонил)метил)тетрагидрофуран-2-ил)метил)-4-метил-5-метилентетрагидро-2H-пиран-2-ил)этил)-4-метилентетрагидрофуран-2-ил)этил)додекагидро-2,5-эпоксифуро[2',3':4,5]фуро[3,2-b]пирано[2,3-e]пиран-7-ил)ацетат
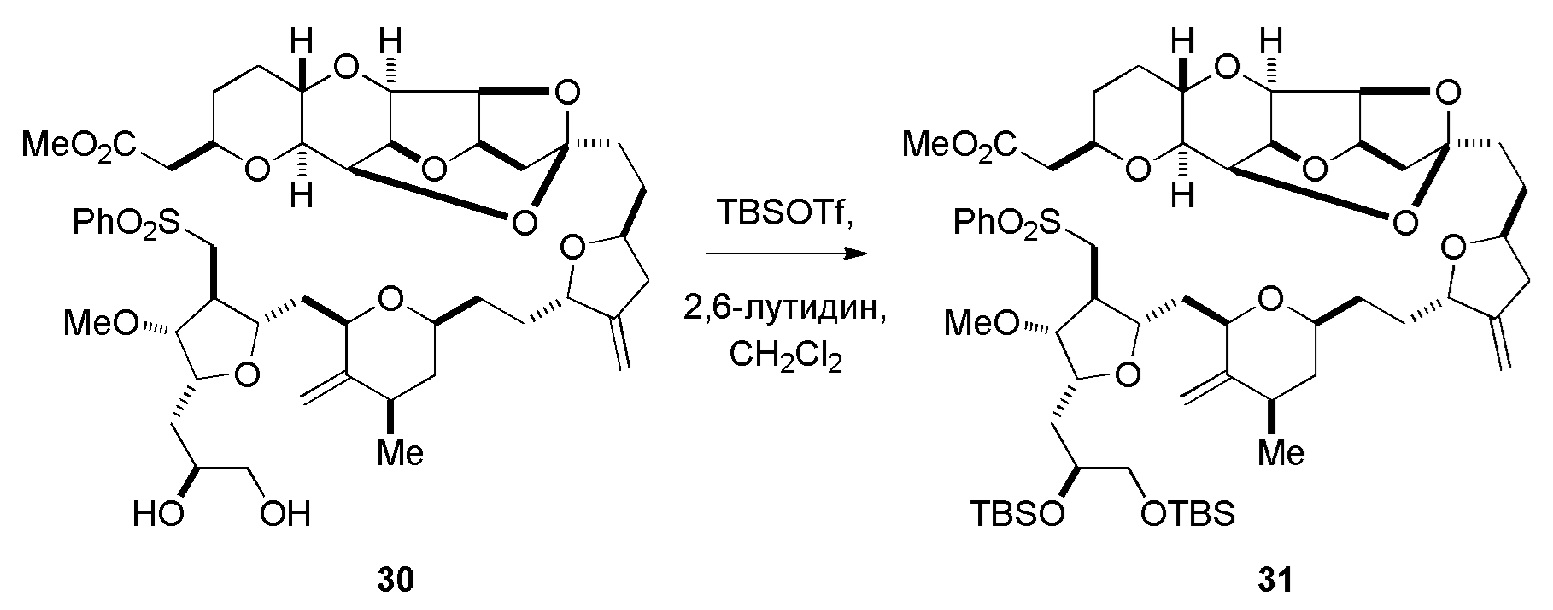
Метил 2-((2S,3aR,4aR,5S,5aS,7R,9aS,10aR,10bS)-2-(2-((2S,5S)-5-(2-((2S,4R,6R)-6-(((2S,3S,4R,5R)-5-((S)-2,3-дигидроксипропил)-4-метокси-3-((фенилсульфонил)метил)тетрагидрофуран-2-ил)метил)-4-метил-5-метилентетрагидро-2H-пиран-2-ил)этил)-4-метилентетрагидрофуран-2-ил)этил)додекагидро-2,5-эпоксифуро[2',3':4,5]фуро[3,2-b]пирано[2,3-e]пиран-7-ил)ацетат 30 (0,734 г, 0,813 ммоль) растворяли в дихлорметане (DCM) (7,34 мл, 114,076 ммоль). К раствору добавляли 2,6-лутидин (0,568 мл, 4,877 ммоль), который, затем, охлаждали до 0°C. Добавляли трет-бутилдиметилсилилтрифторметансульфонат (0,467 мл, 2,032 ммоль), и реакцию перемешивали и контролировали на завершение ТСХ. После завершения реакции добавляли водный насыщенный бикарбонат натрия, и смесь перемешивали в течение 15 минут. Слои разделяли, и водный слой экстрагировали DCM. Объединенные органические слои промывали последовательно водой, 0,1N HCl, водой и водным насыщенным бикарбонатом натрия. Объединенные органические слои концентрировали в вакууме, получая желтое масло. Продукт очищали колоночной хроматографией на силикагеле с компрессором (14 г SiO2, 230-400 мэш). Неочищенную реакционную смесь загружали с DCM/гептаном, и продукт элюировали с колонки гептаном/MTBE (1:1 (v/v), 150 мл), с последующим MTBE (2×150 мл). Фракции, содержащие продукт, объединяли и концентрировали в вакууме, получая 31 (848 мг) в виде белой пены. 1H ЯМР (400 МГц, C6D6) δ=7,96-7,90 (м, 2H), 7,08-7,02 (м, 3H), 4,88-4,84 (м, 1H), 4,82-4,78 (м, 1H), 4,76-4,71 (м, 1H), 4,66-4,62 (м, 1H), 4,52-4,42 (м, 1H), 4,39-4,29 (м, 2H), 4,15-4,04 (м, 4H), 4,03-3,84 (м, 5H), 3,81-3,60 (м, 6H), 3,45 (с, 3H), 3,27 (с, 3H), 3,16-3,08 (м, 1H), 2,94 (с, 2H), 2,58-2,48 (м, 3H), 2,48-2,34 (м, 2H), 2,30-1,87 (м, 12H), 1,00 (с, 9H), 0,94 (с, 9H), 0,96-0,90 (м, 2H), 0,93 (д, J=2,0 Гц, 1H), 0,93 (д, J=1,6 Гц, 1H), 0,89-0,81 (м, 8H), 0,19 (с, 2H), 0,17 (с, 3H), 0,06 (с, 3H), 0,06 (с, 3H).
Бис-TBS эфирный фенилсульфон 32
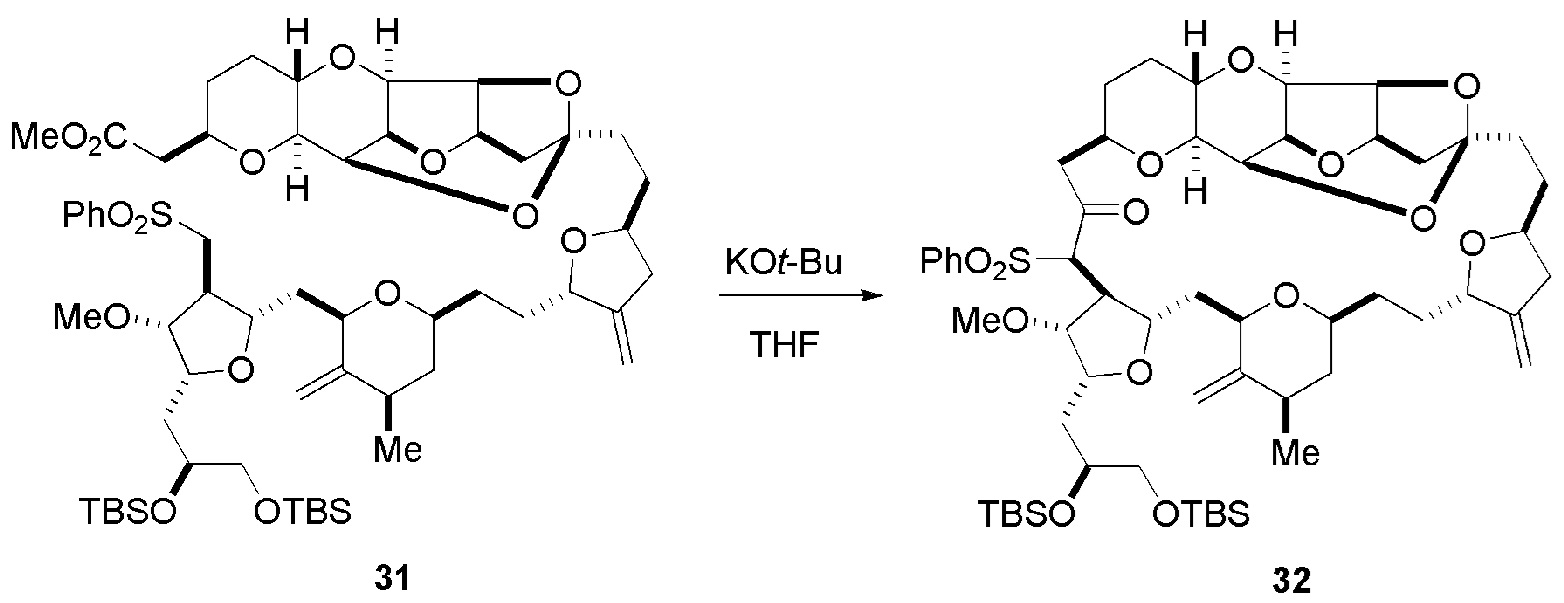
Обработка метил 2-((2S,3aR,4aR,5S,5aS,7R,9aS,10aR,10bS)-2-(2-((2S,5S)-5-(2-((2S,4R,6R)-6-(((2S,3S,4R,5R)-5-((S)-2,3-бис((трет-бутилдиметилсилил)окси)пропил)-4-метокси-3-((фенилсульфонил)метил)тетрагидрофуран-2-ил)метил)-4-метил-5-метилентетрагидро-2H-пиран-2-ил)этил)-4-метилентетрагидрофуран-2-ил)этил)додекагидро-2,5-эпоксифуро[2',3':4,5]фуро[3,2-b]пирано[2,3-e]пиран-7-ил)ацетата 31 в растворителе (например, THF, 2-метилтетрагидрофуране, MTBE, DME, толуоле, хлорбензоле, трет-бутаноле, изопропаноле или другом растворителе) (30-100 объемов) основанием (например, трет-бутоксидом калия, KHMSA, пентоксидом калия или аналогичным основанием) (1-5 экв.). Полученную в результате смесь перемешивали при температуре между -20°C и температурой кипения растворителя и контролировали на потребление исходного соединения. Реакцию можно прекращать добавлением 0,1N HCl (10 объемов). Смесь можно экстрагировать MTBE или другим подходящим органическим растворителем. Органические слои объединяли и промывали последовательно водой, насыщенным водным бикарбонатом натрия и водой. Полученный в результате органический раствор можно сушить над Na2SO4, фильтровать и концентрировать в вакууме, получая 32. Продукт можно очищать хроматографией, при необходимости.
Бис TBS-эфир 18
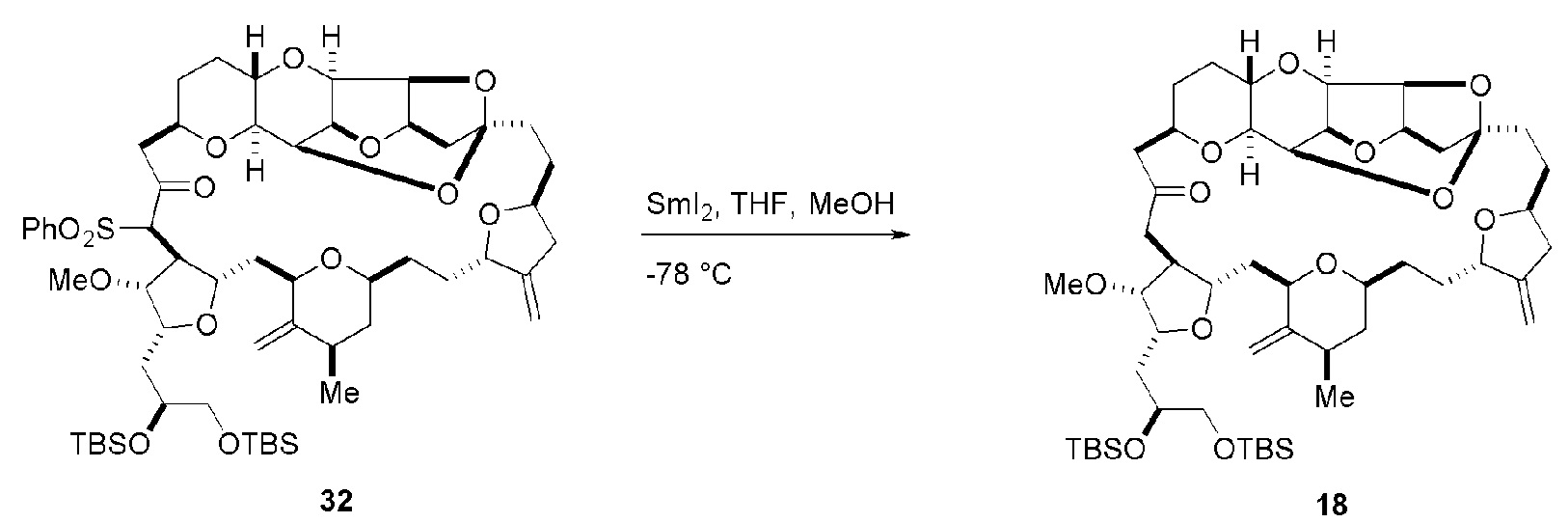
Соединение 32 растворяли в THF (0,35 мл) и MeOH (0,25 мл), и раствор охлаждали до -78°C. Добавляли йодид самария (II) (1,0 M в THF, 0,12 мл, 2,5 экв.), и реакцию контролировали ТСХ. Реакция протекала до приблизительно 50% завершения. Добавляли дополнительный йодид самария (II) (1,0M в THF, 0,6 мл, 12,5 экв.) порциями в течение 1 часа. Степень превращения реакции оставалась равной 50%. Реакционную смесь обрабатывали добавлением сегнетовой соли/карбоната калия/воды (1:1:10 соотношение; 20 мл) и экстрагировали EtOAc (3×20 мл). Объединенные экстракты последовательно промывали насыщенным бикарбонатом натрия, водой и соляным раствором перед сушкой сульфатом натрия. После фильтрования, фильтрат концентрировали в вакууме, получая остаток 18 и 32. 1H ЯМР анализ относительно аутентичного образца 18 подтверждал интерпретацию структуры.
Другие варианты осуществления
Различные модификации и варианты описанного устройства и способов применения настоящего изобретения будут очевидны специалисту в данной области техники, не выходя за пределы объема и сущности настоящего изобретения. Хотя настоящее изобретение описано в связи с конкретными вариантами осуществления, ясно, что настоящее изобретение, как оно заявлено, не следует неоправданно ограничивать данными конкретными вариантами осуществления. Действительно, различные модификации описанных способов осуществления настоящего изобретения, которые являются очевидными специалисту в данной области техники, предполагаются включенными в объем настоящего изобретения.
Другие варианты осуществления представлены в формуле изобретения.