Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ БИОРЕЗОРБИРУЕМОГО СОСУДИСТОГО ПРОТЕЗА МАЛОГО ДИАМЕТРА
Вид РИД
Изобретение
Изобретение относится к области медицины, в частности, к тканезаместительной терапии и тканевой инженерии, а также сердечно-сосудистой хирургии. Изобретение может быть использовано при изготовлении биодеградируемых протезов сосудов, предназначенных для восстановления мелких кровеносных сосудов при различных патологиях, в том числе при снижении их проводящей способности.
Сердечно-сосудистые патологии занимают лидирующие позиции среди болезней, приводящих к летальному исходу и стойкой инвалидизации человека. Снижение проводящей способности кровеносных сосудов может парализовать работу многих органов и систем организма. Примерно 17 миллионов человек умирают от этой болезни ежегодно во всем мире (McAloon et al., 2016). Для восстановления коронарных артерий и периферических сосудов необходимо большое количество трансплантатов. Как правило, применяют трансплантацию аутологичных артерий и вен пациента, что обеспечивает гистосовместимость тканей и дает хороший результат по приживаемости. Однако такой способ лечения ограничивается недостатком аутологичных трансплантатов, обусловленным либо сопутствующими заболеваниями пациента, либо длиной фрагментов аутологичных сосудов и, в некоторых случаях, их низким качеством (Tordoir et al., 2015).
В настоящее время в клинической практике находят применение синтетические сосудистые протезы на основе таких полимерных материалов как полиэтилентерефталат (ПЭТ, Дакрон) и политетрафторэтилен (ПТФЭ). Полимерные сосудистые протезы хорошо выполняют свои функции в случаях замещения сосудов больших диаметров, но при малых диаметрах (менее 4 мм) возникает окклюзия и стеноз (Agaimy et al., 2016). Проходимость таких сосудистых протезов со временем существенно снижается, что вызывает необходимость повторного хирургического вмешательства (Klinkert et al., 2014; Kreienberg et al., 2002). Также для изготовления сосудистых протезов используют сополимеры на основе молочной и гликолевой кислот (Stitzel et al., 2006). Такие сосуды обладают достаточно хорошей прочностью при растяжении, к ним хорошо адгезируют гладкомышечные клетки. Однако значение модуля упругости этих протезов составляет 5 ГПа, что существенно превышает упругость нативных сосудов (Mooney et al., 2006). Большой интерес представляют полиуретаны в качестве материалов для изготовления сосудистых протезов (Tanzi et al., 2000). Сосуды на основе полиуретанов обладают оптимальной прочностью при растяжении и высокой эластичностью. Эти материалы одни из немногих, пригодны для изготовления сосудов малого диаметра (Grasl et al., 2010). Не смотря на общепринятое мнение о том, что полиуретаны являются недеградируемыми полимерными материалами, они могут подвергаться окислительной, гидролитической или ферментативной деградации (Huang et al., 2011). В связи с нестабильным характером поведения сосудистых протезов на основе полиуретанов, их использование на практике пока ограничено.
В настоящее время большое внимание уделяется поли(ε-капролактону) (ПК). ПК медленно деградирует в организме путем гидролиза сложноэфирных связей с образованием ε-гидроксикапроновой кислоты. Продукты деградации ПК полностью перерабатываются клетками организма. Механические свойства, а именно значение эластичности протезов на основе ПК, близки к эластичности нативных сосудов (Nair et al., 2011). Также продемонстрировано, что сосуды на основе ПК выдерживают достаточно высокое давление крови (McClure et al., 2011).
Разные способы изготовления сосудов предлагаются в современной литературе. Так, например, известен способ получения сосудов путем сшивания нетканых полимерных матриц (Mooney et al., 1996). Прямоугольники (1,3×3,0 см) нетканой сетки из волокон на основе полигликолида оборачивают вокруг тефлонового цилиндра (наружный диаметр = 3,0 мм) для образования трубки, а два перекрывающихся конца вручную скрепляют с образованием шва. Тефлоновые цилиндры вращают при 20 об/мин с использованием мешалки (Caframo, Wiarton, Ontario, Canada). Растворы поли(L,L-лактида) и сополимера на основе молочной и гликолевой кислот в хлороформе в концентрации 1-15 масс. %, распыляют на расстоянии 15 см на вращающуюся сетку на основе полигликолида. После завершения распыления сосуды лиофилизируют для удаления остаточного растворителя и снимают с тефлонового цилиндра. Протезы стерилизуют под воздействием этиленоксида в течение 24 часов с последующей дегазацией в течение 24 часов.
Одним из недостатков такого способа получения сосудистого протеза является наличие шва в сосуде, а также необходимость снятия протеза с тефлонового цилиндра, что зачастую приводит к повреждению самого изделия и нарушению топологии внутренней стенки сосуда.
Для получения сосудов используют комбинирование методов выщелачивания и экструзии (Widmer et al., 1996). Сополимер на основе D,L молочной и гликоливой кислот, а также гомополимер на основе L,L - молочной кислоты растворяют в хлористом метилене, а затем добавляют кристаллы соли хлористого натрия в различном соотношении. Полученную дисперсию отливают в формы и сушат до полного удаления растворителя. Высушенный композит на основе полимера и соли, содержащий связанные частицы соли вместе с полимерной матрицей, размельчают на частицы диаметром не более 5 мм и помещают в поршневой экструдер. Затем нагретый до определенной температуры композит (полимер /соль) экструдируют под давлением. В результате экструзии получают сосуды с внутренним диаметром 1,6 мм и наружным диаметром 3,2 мм. Сосудистые протезы охлаждают, затем выдерживают в воде в течение 24 ч до полного растворения соли и высушивают в вакууме.
К недостаткам данного способа получения сосудов на основе сополимеров молочной и гликолевой кислот, а также гомополимера на основе молочной кислоты, являются их достаточно большая толщина, низкая эластичность и прочность, обусловленная используемыми свойствами полимеров, которые препятствуют нормальному функционированию в физиологических условиях.
Известен способ формирования сосудистого протеза методом электроспиннинга, где используют смесь полимеров и белков, в том числе и поликапролактон (патент RU 2572333 С1, опубл. 2016.01.10). Первоначально методом электроспиннинга на металлический электрод-коллектор выбранного диаметра наносят смесь синтетического полимера (поликапролактон (ПКЛ), полибутилентерефталат (ПБТФ), полилактид-ко-гликолид, нейлон) и белка (желатина, эластина, фибронектина) в гексафторизопропаноле 1,0-10,0% от требуемого объема раствора композиции. Затем полученный слой протеза пропитывают 1,0-5,0% водным раствором белка из расчета 1-25 мкл/см2. Далее на сформированный внутренний слой протеза наносят оставшийся объем раствора композиции (при помощи электроспиннинга) и формируют внешний слой протеза сосуда, составляющий 90-99% от заданной толщины стенки протеза сосуда.
Недостатком такого способа приготовления сосудов является необходимость снятия сформированного сосуда с электрода-коллектора, что также зачастую приводит к деформации изделия и невозможности контролировать структуру внутренней стенки сосудов, отвечающей за адгезию клеток и тромбообразование. Недостаточная гемосовместимость таких протезов будет способствовать тромбообразованию.
Известен способ получения сосудистых протезов на основе ПК (Gupta et al., 2012), который является наиболее близким по технической сущности к предлагаемому изобретению и поэтому выбран в качестве прототипа. При этом способе поликапролактон (со средневесовой молекулярной массой 80000) растворяют в хлороформе в трех различных концентрациях 2,5, 5 и 7,5 масс. %. Соль хлорида натрия измельчают в шаровой мельнице (Retsch РМ 100, Германия) в течение 2 часов. Размер частиц измеряют анализатором размера частиц (Brookhaven, США) после их диспергирования в ацетоне. Средний размер частиц составлял 1,8 мкм. Соль в количестве от 33 до 75 масс. % добавляют в раствор полимера при постоянном перемешивании. Стеклянный стержень диаметром 5 мм помещают вручную в раствор полимера на 5 с, затем удаляют и сушат на воздухе. Стеклянные стержни с нанесенным полимером оставляют на ночь в дистиллированной воде при небольшом перемешивании (200 об/мин) для растворения соли хлористого натрия. После растворения соли полимерные трубки снимают со стеклянных стержней, сушат на воздухе и под вакуумом.
Недостатком известного способа являются неэффективность сосудистого протеза, представляющего трубку с пористой и частичной разрушенной при снятии со стержня внутренней стенкой из ПК и низкая гемосовместимость самого протеза, обусловленная свойствами материала сорбировать белки крови с последующим образованием тромба.
Указанные недостатки обусловлены тем, что использование стеклянных стержней при формировании полимерных сосудов не позволяет контролировать и регулировать структуру и топологию внутренней стенки сосуда, а, следовательно, обеспечивать необходимое и достаточное количество прикрепившихся к поверхности протеза клеток. Наряду с этим, отсутствие модификации, увеличивающей гемосовместимость сосудистого протеза приведет к быстрому тромбообразованию имплантата.
Предлагаемое нами изобретение лишено указанных недостатков, благодаря осуществлению получения полимерных сосудистых протезов с помощью растворимых стержней и модификации сосуда веществами, увеличивающими гемосовместимость сосудистого протеза.
Техническим результатом предлагаемого изобретения является повышение эффективности и надежности структуры сосудистого протеза и модификации его полимерных стенок, способствующей повышению гемосовместимости изделия, изобретение имеет ряд преимуществ, которые обусловлены, в основном тем, что:
- использование растворимого стержня, на который наносится раствор полимера, позволяет избежать повреждения сосудистого протеза в процессе его снятия со стержня;
- получение сосудистого протеза с внутренней стенкой, имеющей регулируемую и контролируемую структуру, которая обеспечивает оптимальное количество адгезированных клеток;
- увеличение гемосовместимости сосудистого протеза за счет модификации его фибриногеном.
Технический результат достигается тем, что в известном способе получения полимерного протеза, предназначенного для восстановления сосудов различного диаметра, который включает известные и общие с заявленным новым способом признаки, используют растворение поликапролактона в органическом растворителе, перемешивание его с солью, погружение стеклянного стержня в полученную суспензию, высушивание на воздухе, промывание в дистиллированной воде, снятие со стеклянного стержня, высушивание на воздухе и под вакуумом, в предлагаемом способе получают полимерный сосудистый протез, причем предварительно получают растворимый стержень нужного диаметра, расплавлением сахара до однородной массы с добавлением 10 масс % глицерина для увеличения эластичности стержня, из полученного расплава готовят стержни необходимого диаметра и длины, после высушивания на воздухе стержни опускают в предварительно приготовленный раствор поликапролактона в хлороформе с концентрацией 30 мг/мл на 5 сек, затем стержень вынимают из полимера и оставляют сушиться на воздухе в течение 5 мин, процедуру опускания и высушивания повторяют от 3 до 9 раз, в зависимости от требований к толщине стенок сосудистого протеза, высушивают на воздухе в течение 1 суток, затем сосудистый протез вместе со стержнем опускают в стакан с дистиллированной водой объемом 100 мл на 1 сутки, по истечении которых стержень растворяется, сосуд промывают 3 раза в дистиллированной воде и оставляют сушиться на воздухе, затем опускают в раствор фибриногена с концентрацией 0.1 мг/мл объемом от 25 до 30 мл на 1 сутки, по истечении которых модифицированный сосудистый протез извлекают и промывают 1 раз в фосфатно-солевом буфере рН=7.4 для удаления несвязавшегося белка, сушат на воздухе и стерилизуют в озоновой камере в течение 90 минут для последующей имплантации в брюшную аорту крысы. При этом, в процессе создания, структуру стенок полимерного сосудистого протеза оценивают с помощью сканирующей электронной микроскопии, механические характеристики сосуда оценивают с помощью универсальной разрывной машины, его биосовместимость оценивают с помощью конфокального микроскопа после посева и культивирования на его поверхности гладкомышечных клеток кролика. Заявленный способ был апробирован в лабораторных условиях на базе Федерального государственного бюджетного учреждения науки Института цитологии Российской академии наук г. Санкт-Петербурга. Результаты проведенных исследований поясняются следующими примерами.
Наиболее предпочтительный вариант осуществления предлагаемого изобретения описан в примере 1. В пределах сущности и объема изобретения возможны другие варианты способа приготовления полимерного сосудистого протеза, охватываемые приводимой формулой изобретения.
Пример 1.
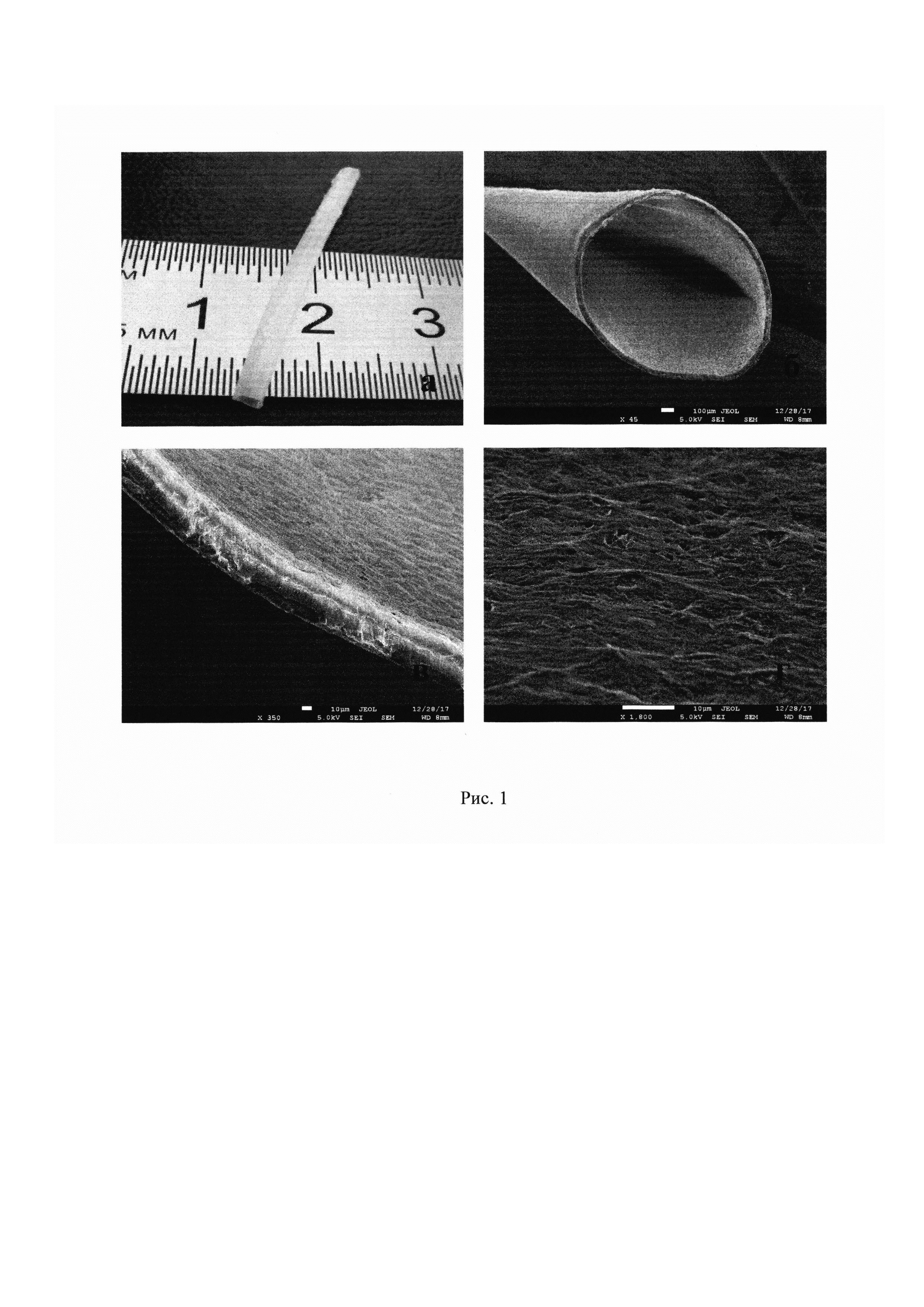
В частном конкретном случае осуществления предлагаемого изобретения получают полимерный сосудистый протез для восстановления поврежденных или утраченных сосудов. Предварительно получают стержень необходимого диаметра и длины. Для этого расплавляют сахар до однородной массы с добавлением 10 масс % глицерина для увеличения эластичности стержня. Из полученного расплава готовят стержни необходимого диаметра и длины, а затем сушат на воздухе. Для получения раствора полимера поли(ε-капролактон) с молекулярной массой 80 кДа (Sigma, США) растворяют в хлороформе (Вектон, Россия) до конечной концентрации раствора полимера 30 мг/мл. Приготовленный стержень из сахара опускают на 5 сек в раствор полимера, затем вынимают и оставляют сушить на воздухе на 5 мин. Процедуру опускания и высушивания повторяют от 3 до 9 раз, в зависимости от требований к толщине стенок сосудистого протеза. Сосудистый протез высушивают на воздухе в течение 1 суток, затем вместе со стержнем опускают в стакан с дистиллированной водой объемом 100 мл на 1 сутки, по истечении которых стержень растворяется, сосуд промывают 3 раза в дистиллированной воде и оставляют сушиться на воздухе. Толщину стенок сосудистого протеза измеряют с помощью микрометра (МК-50-1, Китай). Результаты измерений толщины стенок сосудистых протезов, в зависимости от количества нанесенных слоев, представлены в таблице 1. Структуру внутреннего и внешнего слоев полимерного сосудистого протеза оценивают с помощью сканирующего электронного микроскопа (Jeol JSM-35C, Япония). Результаты сканирующей электронной микроскопии полимерного сосудистого протеза, полученного при нанесении трех слоев, представлены на рис.1 (увел. 2000х). На рис. 1, г видна гладкая поверхность внутреннего слоя сосудистого протеза на основе поликапролактона.
Рис. 1 Сканирующая электронная микроскопия сосудистых протезов.
а - внешний вид сосудистого протеза;
б - торцевой и в - боковой срез сосудистого протеза;
г - структура внутренней стенки сосудистого протеза.
Механические свойства при растяжении образцов полимерных сосудистых протезов на основе ПК определяли с помощью универсальной испытательной машины (Instron 5943, США). Результаты испытаний представлены в таблице 1.

Как следует из табл. 1, полимерный сосудистый протез в виде 3 и 6 слоев демонстрируют схожие механические свойств: прочность около 17 МПа, удлинение при разрыве составляет 600%, а начальный модуль упругости - 220 МПа. Разброс значений находится в пределах погрешности измерений. Сосудистый протез в виде 9 слоев в исходном состоянии имеет значения прочности выше на 35%, модуля упругости - на 23% и удлинения при разрыве - на 42%.
Поликапролактон является гидрофобным полимером, на который хорошо сорбираются белки крови, что приводит к уменьшению просвета сосудов и образованию тромбов. Для увеличения гемосовместимости полимерного сосудистого протеза, его внутреннюю стенку обрабатывали 0.1 мл/мл раствором фибриногена в течение 1 суток. По истечении указанного времени сосудистый протез промывали 1 раз в фосфатно-солевом буфере рН 7.4 для удаления несвязавшегося белка, затем сушат на воздухе и стерилизуют в озоновой камере в течение 90 минут. Готовый сосудистый протез имплантируют в брюшную аорту крысы (рис. 2).
Рис. 2 Имплантация сосудистого протеза в брюшную аорту крысы,
а - формирование дефекта аорты;
б - пришивание сосудистого протеза;
в - сосудисиый протез пришитый к аорте (место соединения указано стрелками).
По истечении 1 месяца проводят гистологические исследования биоптатов. Результаты гистологических исследований представлены на рис. 3.
Рис. 3 Фрагмент брюшной аорты после имплантации полимерного сосудистого протеза. Окраска гемотоксилином и эозином. Увеличение 100х.
а - контроль - просвет аорты вне анастомоза, интима и медия типового строения;
б - сосудистый протез с инфильтрацией гистиоцитами;
в - анастомоз аорты и протеза.
Стенка аорты вне анастомоза эндотелизирована, наблюдается типовое гистологическое строение интимы и медии, с отеком адвентиции (рис. 3, а).
Полимерный сосудистый протез длиной 5 мм, подшитый к стенке аорты, представлен аморфным эозинофильным мелкогранулярным субстратом розового цвета, со стороны просвета (в прилежащей к аорте части) покрыт эндотелием на 0,35-0,5 мм с проксимального конца аорты и 0,15-0,35 мм с дистального конца аорты; на остальной части - без эндотелия, с одиночными микротромбами из эритроцитов, небольшого количества лимфоцитов и нейтрофилов (рис. 3, б). Со стороны жировой клетчатки в скаффолде очаговая инфильтрация гистиоцитами диаметром от 12 мкм до 75 мкм, в цитоплазме которых содержится мелкогранулярный розовый субстрат скаффолда (рис. 3, в).
Пример 2.
В этом варианте осуществления предлагаемого изобретения биосовместимость сосудистого протеза увеличивают за счет посева и культивирования гладкомышечных клеток. Предварительно получают сосудистый протез на основе поликапролактона. Для этого готовят стержни из сахара диаметром 1 мм. Для получения раствора полимера поли(ε-капролактон) с молекулярной массой 80 кДа (Sigma, США) растворяют в хлороформе (Вектон, Россия) до конечной концентрации 30 мг/мл. Приготовленный стержень из сахара опускают на 5 сек, затем вынимают из раствора полимера и оставляют сушиться на воздухе на 5 мин, процедуру опускания и высушивания повторяют от 3 до 9 раз, в зависимости от требований к толщине стенок сосудистого протеза. Сосудистый протез высушивают на воздухе в течение 1 суток, затем вместе со стержнем опускают в стакан с дистиллированной водой объемом 100 мл на 1 сутки, по истечении указанного времени стержень растворяется, сосуд промывают 3 раза в дистиллированной воде и оставляют сушиться на воздухе. Сосудистый протез обрабатывают 0.1 мг/мл раствором фибриногена в течение 1 суток. По истечении указанного времени сосудистый протез промывают 1 раз в фосфатно-солевом буфере рН 7.4 для удаления несвязавшегося белка, сушат на воздухе и стерилизуют в озоновой камере в течение 90 минут.
Гладкомышечные клетки получают из аорты крыс. Культивирование гладкомышечных клеток на таком модифицированном сосудистом протезе осуществляют следующим образом. Суспензию полученных клеток в количестве 200 тыс. на 1 см2 наносят в модифицированный сосудистый протез и культивируют в течение 3 сут в смеси сред α-DMEM (Биолот, Россия), с добавлением 10% FBS (Gibco, США), 5 мкг/мл инсулина, 5 мкг/мл гидрокортизона.
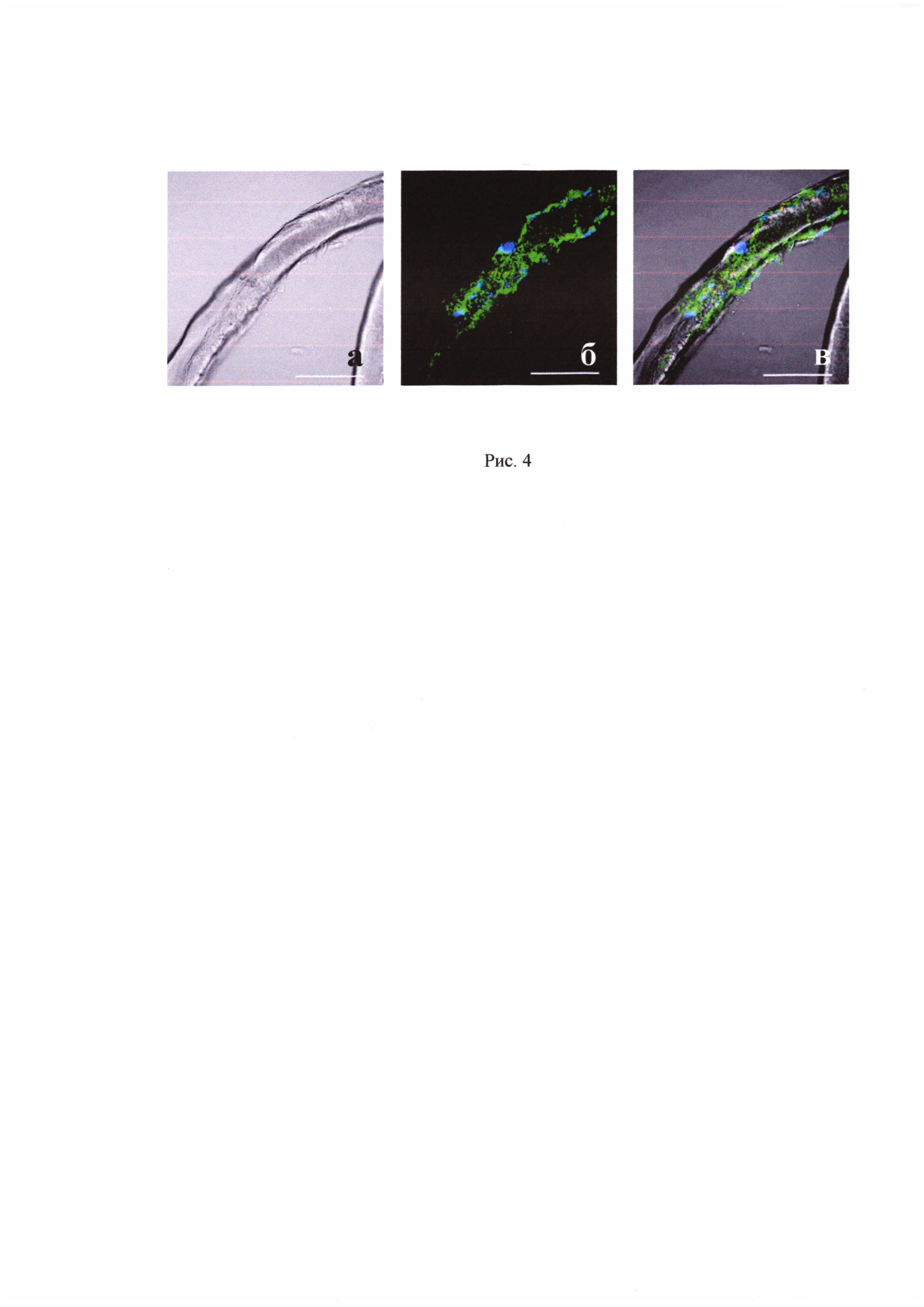
Затем проводят оценку прикрепления, распластывания и роста гладкомышечных клеток на модифицированном сосудистом протезе. Клетки фиксируют и окрашивают DAPI (Vectashield, США) для выявления ядер и антителами на гладкомышечный актин (клон 1А4, DAKO, Германия). Окрашенные препараты анализируют с помощью конфокального микроскопа (Olympus IX83, Германия). Результаты исследований представлены на рис. 4.
Рис. 4 Конфокальная микроскопия гладкомышечных клеток, культивируемых в модифицируемом сосудистом протезе. Шкала, 100 мкм
а - сосудистый протез (проходящий свет);
б - ядра (синий, DAPI), гладко-мышечный актин (зеленый);
в - совмещенное изображение.
На рис. 4 показано, что на внутренней стенке сосуда клетки формируют взаимосвязанную сеть.
Пример 3.
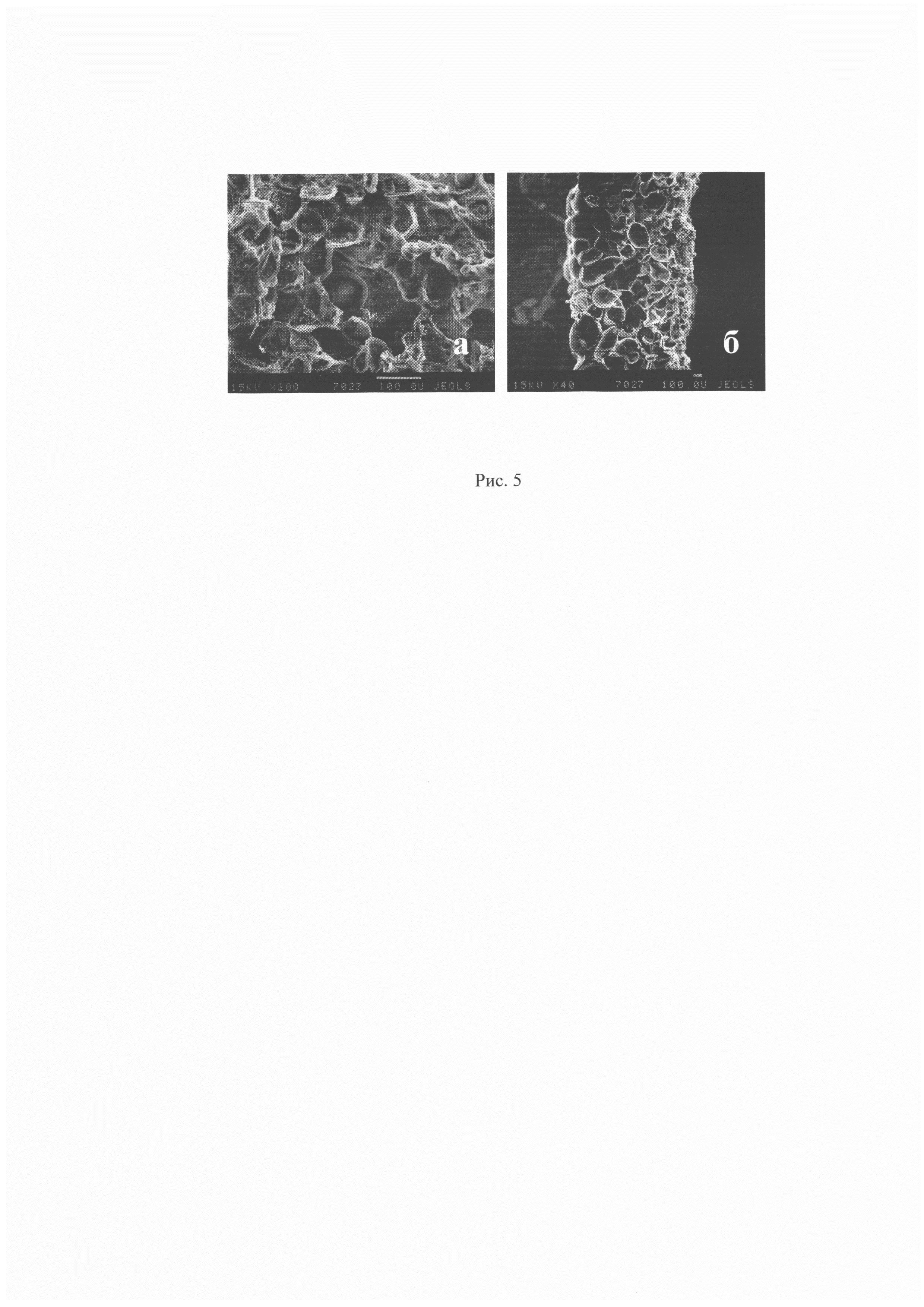
В этом варианте осуществления предлагаемого изобретения получают сосудистый протез с внутренней непроницаемой стенкой и внешней пористой. Предварительно получают стержень на основе сахара необходимого диаметра и длины. Для получения раствора полимера поли(ε-капролактон) с молекулярной массой 80 кДа (Sigma, США) растворяют в хлороформе (Вектон, Россия) до конечной концентрации 30 мг/мл. Приготовленный стержень из сахара опускают на 5 сек, затем вынимают из раствора полимера и оставляют сушить на воздухе на 5 мин, процедуру опускания и высушивания повторяют от 3 раза. Также готовят раствор для получения пористого слоя. Поли(ε-капролактон) с молекулярной массой 80 кДа (Sigma, США) растворяют в хлороформе (Вектон, Россия) до конечной концентрации 30 мг/мл, добавляют соль хлористого натрия в количестве 30 масс %. Размер частиц соли варьирует в диапазоне 150-200 мкм. Смесь тщательно перемешивают. В полученную смесь опускают предварительно приготовленный стержень с нанесенным сплошным слоем на основе поли(ε-капролактона) на 5 сек, затем вынимают из раствора полимера и оставляют сушиться на воздухе на 5 мин, процедуру опускания и высушивания повторяют 3 раза. Сосудистый протез высушивают на воздухе в течение 1 суток, затем вместе со стержнем опускают в стакан с дистиллированной водой объемом 100 мл на 1 сутки, по истечении которых стержень растворяется, сосуд промывают 3 раза в дистиллированной и оставляют сушиться на воздухе. Структуру внешнего слоя полимерного сосудистого протеза оценивают с помощью сканирующего электронного микроскопа (Jeol JSM-35C, Япония). Результаты сканирующей электронной микроскопии полимерного сосудистого протеза, представлены на рис. 5. На рис. 5, а видна пористая поверхность внешнего слоя сосудистого протеза на основе поликапролактона.
Рис. 5 Сканирующая электронная микроскопия внешнего слоя сосудистого протеза. Увеличение 2000х.
а - структура внешнего слоя сосудистого протеза;
a - боковой срез сосудистого протеза.
Список используемой литературы
Степанова А.О., Черноносова B.C., Попова И.В., Карпенко А.А., Покушалов Е.А., Карасъков A.M., Лактионов П.П., Власов В.В. Способ изготовления протезов сосудов малого диаметра с низкой пористостью, Патент РФ 2572333, публикация патента: 10.01.2016
Agaimy A., Ben-Izhak О., Lorey Т., Scharpf М., Rubin В.Р. 2016. Angiosarcoma arising in association with vascular Dacron grafts and orthopedic joint prostheses: clinicopathologic, immunohistochemical, and molecular study. Ann. Diagn. Pathol. 21:21-28.
Grasl С., Bergmeister H., Stoiber M., Schima H., Weigel G. 2010. Electrospun polyurethane vascular grafts: In vitro mechanical behavior and endothelial adhesion molecule expression. J. Biomed. Mater. Res. A. 93(2):716-723.
Gupta В., Patra S. Ray A. 2012. Preparation of porous polycaprolactone tubular matrix by salt leaching process. J. of Appl. Polymer Sc. 126(5): 1505-1510.
Huang C., Chen R., Ke Q., Morsi Y., Zhang K., Mo X. 2011. Electrospun collagen-chitosan-TPU nanofibrous scaffolds for tissue engineered tubular grafts. Colloids Surf. В Biointerfaces. 82(2):307-315.
Klinkert P., Post P.N., Breslau P.J., van Bockel J.H. 2004. Saphenous vein versus PTFE for above-knee femoropopliteal bypass: a review of the literature. Eur. J. Vase. Endovasc. Surg. 27:357-362.
Kreienberg P.В., Darling R.C., Chang B.B., Champagne B.J., Paty P.S., Roddy S.P., Lloyd W.E., Ozsvath K.J., Shah D.M. 2002. Early results of a prospective randomized trial of spliced vein versus polytetrafluoroethylene graft with a distal vein cuff for limb-threatening ischemia. J. Vasc. Surg. 35:299-305.
McAloon C.J., Boylan L.M., Hamborg Т., Stallard N., Osman F., Lim P.В., Hayat S.A. 2016. The changing face of cardiovascular disease 2000-2012: An analysis of the world health organisation global health estimates data. Int. J. Cardiol. 224:256-264.
McClure M.J., Sell S.A., Ayres C.E., Simpson D.G., Bowlin G.L. 2009. Electrospinning-aligned and random polydioxanone-polycaprolactone- silk fibroin-blended scaffolds: geometry for a vascular matrix. Biomed. Mater. 4(5):055010.
Mooney D.J., Mazzoni C.L., Breuer C., McNamara K., Hern D., Vacanti J.P., Langer R. 1996. Stabilized polyglycolic acid fibre-based tubes for tissue engineering. Biomaterials. 17(2): 115-124.
Mooney D.J., Organ G., Vacanti J.P., Longer R. 1994. Design and fabrication of biodegradable polymer devices to engineer tubular tissues. Cell Transplant. 3(2):203-210.
Nair L.S., Laurencin С.Т. 2007. Biodegradable polymers as biomaterials. Prog. Polym. Sci. 32:762-798.
Stitzel J.I., Liu J., Lee S.J., Komura M., Berry J., Soker S., Lim G., Van Dyke M., Czerw R., Yoo J.J., Atala A. 2006. Controlled fabrication of a biological vascular substitute. Biomaterials. 27: 1088-1094.
Tordoir J.H.M., Bode A.S., van Loon M.M. 2015. Preferred strategy for hemodialysis access creation in elderly patients. Eur. J. Vase. Endovasc. Surg. 49(6):738-743
Tanzi M.C., Fare S., Petrini P. 2000. In vitro stability of polyether and polycarbonate urethanes. J. Biomater. Appl. 14:325-348.
Widmer M.S., Gupta P.K., Lu L., Meszlenyi R.K., Evans G.R., Brandt K., Savel Т., Gurlek A., Patrick C.W., Mikos A.G. 1998. Manufacture of porous biodegradable polymer conduits by an extrusion process for guided tissue regeneration. Biomaterials. 19(21):1945-1955.