Результат интеллектуальной деятельности: ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ АНТИАГРЕГАНТНОЙ АКТИВНОСТЬЮ
Вид РИД
Изобретение
Изобретение относится к фармацевтической композиции, а именно к раствору для внутривенного введения, содержащего в качестве активного вещества гетеропептид Fur-Lys-His-Ala-Asp-Asp, где «Fur» - карбоксиметилимидазо[4,5-е]бензо[1,2-с;3,4-с'] дифуроксан, а в качестве вспомогательных лимонной кислоты моногидрат, натрия гидроксида 1М или 2М раствор для доведения рН до 5,35 и воду для инъекций для применения в качестве антиагреганта-ингибитора GPIIb/IIIa-рецепторов тромбоцитов.
Одной из наиболее актуальных проблем современной медицины продолжают оставаться тромбозы и тромбоэмболии, которые играют ключевую роль в развитии различных сердечно-сосудистых осложнений. Тромбоэмболизм в его современной трактовке - это заболевание, характеризующееся тромбообразованием на стенке вен или артерий с сужением или «закупоркой» их просвета в результате роста тромба или перемещения его фрагментов дистальнее кровотока. Определяющую роль в нарушении реологических параметров крови играет агрегационное состояние тромбоцитов и эритроцитов. В настоящее время в качестве средств профилактики тромбообразования применяются лекарственные препараты, оказывающие влияние на разные звенья системы гемостаза, как раздельно, так и в различных сочетаниях. При этом неотъемлемой частью патогенетической терапии заболеваний сердечно-сосудистой системы является именно антиагрегационная терапия. Из дезагрегантов к наиболее известным, применяемым в практической медицине, относятся ацетилсалициловая кислота, клопидогрель, тиклопидин, дипиридамол (курантил), бутадион, антуран, индометацин (метиндол), папаверин, клофибрат, пармидин и др. Данные средства уменьшают функциональную активность тромбоцитов, в первую очередь - их способность к агрегации. Механизмы действия антиагрегантов обусловлены способностью препаратов нарушать метаболизм арахидоновой кислоты, повышать внутриклеточный уровень циклического АМФ (цАМФ), изменять состояние цитоплазматической мембраны тромбоцитов и др. Блокада агрегации может быть достигнута за счет ингибирования эффектов тромбоксана А2 (ингибитор циклооксигеназы - ацетилсалициловая кислота), АДФ (блокаторы АДФ-рецепторов - тиенопиридины - клопидогрель и тиклопидин) или нейтрализацией IIb/IIIa гликопротеиновых рецепторов тромбоцитов (антагонисты IIв/IIIa гликопротеиновых рецепторов - абциксимаб, эптифибатид и тирофибан). Таким образом, профилактика тромбозов и тромбоэмболий, являющихся ключевым моментом в развитии сердечно-сосудистых патологий, с помощью антиагрегантных препаратов является определяющим направлением в лечении больных в терапевтической и хирургической практике [2-6].
Ингибиторы гликопротеиновых рецепторов IIb/IIIa абциксимаб, эптифибатид и тирофибан неконкурентно блокируют конечный путь агрегации, который заключается в перекрестном связывании гликопротеиновых рецепторов тромбоцитов под влиянием фибриногена [Алексеев, А.А. Пептидные ингибиторы агрегации тромбоцитов: математическое моделирование, синтез и оценка специфической активности новых соединений в условиях in vitro /А.А. Алексеев, М.И. Брылев, В.Л. Королев [и др.] //Бутлеровские сообщения. - 2012. - Т. 32. - №11. - С. 96-100]. Обладая умеренным влиянием на последний этап гемостаза - фибринолиз, они также предотвращают связывание первичного тромба с этим адгезивным протеином. Быстрота наступления антитромбоцитарного и фибринолитического эффектов, а также длительность последних являются основными отличительными особенностями данной фармакологической группы [Алексеев, А.А. Пептидные ингибиторы агрегации тромбоцитов / А.А. Алексеев, М.И. Брылев, В.Л. Королев [и др.] // Ученые записки. Электронный научный журнал Курского государственного университета. - 2013. - Т. 2. - №3 (27). - С. 32-37].
Негативной стороной применения ингибиторов гликопротеиновых рецепторов IIb/IIIa являются высокий риск развития кровотечения и удлинения его времени, а также риск тромбоцитопении, в связи с которой при их назначении следует контролировать параметры коагулограммы и число тромбоцитов. Кроме того, безальтернативность парентеральных форм этих препаратов ограничивает сферу их применения, сужая ее до стационарного этапа оказания медицинской помощи.
Таким образом, эптифибатид, абциксимаб и тирофибан нашли возможность своего применения при нестабильной стенокардии и ОКС (с подъемом и без подъема сегмента ST) как до решения вопроса о необходимости реваскуляризационных вмешательств, так и после проведения чрескожной реваскуляризация миокарда (ЧКВ). Ввиду того, что хирургическое удаление атеросклеротической бляшки запускает механизмы агрегации тромбоцитов, основная цель ингибиторов гликопротеиновых рецепторов ИМПа - профилактика внутрикоронарного тромбоза при высоком риске реокклюзии оперированного сосуда [Алексеев, А.А. Синтез и изучение биологической активности новых антиагрегационных пентапептидов / А.А. Алексеев, М.И. Брылев, В.Л. Королев [и др.] // Сб. докл. Первой Всероссийской научно-практической конференции «Проблемы разработки новых лекарственных средств». - Москва. - 2013. - С.5.].
Ассортимент антиагрегантов-ингибиторов GPIIb/IIIа-рецепторов тромбоцитов представлен в клинической практике только четырьмя лекарственный препаратами - Абциксимаб (РеоПро), Руциромаб (Монафрам), Эптифибатид (Интегрилин), Тирофибан (Аграстат). Все перечисленные лекарственные препараты выпускают в лекарственных формах для парентерального применения.
Однако существенным недостатком этих препаратов является явно выраженные побочные эффекты, наиболее существенными среди которых являются кровотечения, что ограничивает их широкое применение [L. Jovanovic, N. Antonijevic, Т. Novakovic, N. Savic et al., Semin. Thromb. Hemost., 2017, 43(1): 14-23); Q. Shi, J. Xu, T. Zhang, B. Zhang, H. Liu. Front Pharmacol., 2017, 8:58]. Кроме того, имеются и иные негативные последствия - такие как тромбоцитопения и аллергические реакции немедленного типа (крапивница, ангионевротический отек или бронхоспазм), а при передозировке - возможность развития геморрагии.
Так как лекарственные препараты антиагрегантов-ингибиторов GPIIb/IIIa-рецепторов тромбоцитов производят только в растворах для внутривенного введения, их применение ограничено стационарным этапом оказания медицинской помощи. Это связано с неудачными попытками фармразработки пероральных лекарственных форм -пептидомиметиков, ингибиторов GPIIb/IIIа-рецепторов тромбоцитов (Ксимелофибана, Орбофибана, Сибрафибана, Лотрафибана) для длительной профилактики тромбозов. Многочисленные клинические исследования (III фаза, более 40000 пациентов) продемонстрировали их неэффективность и/или высокую смертность из-за избыточных кровотечений и неблагоприятных сердечно-сосудистых событий. Предположительно, это связано с неполной блокадой GPIIb/IIIа-рецепторов тромбоцитов пероральными ингибиторами GPIIb/IIIa.
Соответственно, задачей настоящего изобретения расширение ассортимента отечественных препаратов антиагрегантов-ингибиторов GPIIb/IIIа-рецепторов тромбоцитов, обладающих меньшей токсичностью и улучшенной специфической активностью.
Техническим результатом, на достижение которого направлено заявленное изобретение, является создание эффективной внутривенной фармацевтической композиции на основе гетеропептида, обладающей на порядок более высокой специфической активностью при соответствующей аналогам дозировке, а также сниженной токсичностью и выраженными побочными эффектами.
Технический результат достигается за счет разработки фармацевтической композиции, включающей помимо синтетического циклического вещества, состоящего из двух фармакофорных групп (пептидной и фуроксановой): Fur-Lys-His-Ala-Asp-Asp, где «Fur» - карбоксиметилимидазо[4,5-е]бензо[1,2-с;3,4-с'] дифуроксан - гетеропептида в качестве активного вещества, вспомогательные вещества - лимонной кислоты моногидрат, натрия гидроксида 1М или 2М раствор для доведения рН до 5,35 и воду для инъекций, при следующем соотношении компонентов, мг/мл:
|
Наиболее близким аналогом для сравнения составов по принципу действия является "Интегрилин".
Инновационное лекарственное средство Гетеропептид, раствор для внутривенного введения, относится к фармакотерапевтической группе антиагрегантных средств. Действующее вещество - гетеропептид, синтетическое циклическое вещество, состоящее из двух фармакофорных групп (пептидной и фуроксановой): Fur-Lys-His-Ala-Asp-Asp, где «Fur» - карбоксиметилимидазо[4,5-е]бензо[1,2-с;3,4-с'] дифуроксан впервые был описан в диссертации «РАЗРАБОТКА И ИССЛЕДОВАНИЕ ЛЕКАРСТВЕННОГО ПРЕПАРАТА НА ОСНОВЕ НОВЫХ ПЕПТИДНЫХ ИНГИБИТОРОВ АГРЕГАЦИИ ТРОМБОЦИТОВ» Алексеев А. А., Москва 2015. Пептидная фармакофорная группа является ингибитором GPIIb/IIIа-рецепторов тромбоцитов, фуроксановая фармакофорная группа является донором оксида азота. Наличие двух фармакофоров с различными механизмами действия оказывает синергетическое антиагрегантное действие. Предупреждает связывание фибриногена, фактора Виллебранда и других адгезивных лигандов с гликопротеиновыми IIb/IIIa рецепторами тромбоцитов, обратимо подавляет агрегацию тромбоцитов. Лекарственное средство, является антагонистом GP IIb/IIIa рецепторов тромбоцитов и экзогенным донором оксида азота. В состав готовой лекарственной формы входят вспомогательные вещества: вода для инъекций как растворитель, моногидрат лимонной кислоты как стабилизатор раствора, гидроксид натрия как регулятор рН. Основные показания к применению: антиагрегантная терапия при остром коронарном синдроме.
Полученные в экспериментальных исследованиях результаты свидетельствуют о перспективности применения лекарственного средства Гетеропептид, раствор для внутривенного введения, 0,75 мг/мл и 2 мг/мл для подавления агрегации тромбоцитов. Было установлено, что активность исследуемого лекарственного средства на 25% выше, чем у препарата сравнения Интегрилин.
Пептидные лекарственные препараты имеют ряд недостатков, связанных с их структурой и фармакокинетическими характеристиками: термолабильность, метаболическая нестабильность (ферментативная деградация и подверженность гидролизу в кислой среде желудочно-кишечного тракта), короткий период полужизни, быстрый метаболизм и высокий клиренс.
Гетеропептид за счет фуроксанового фрагмента обладает более компактной и защищенной структурой, чем исходные линейные короткоцепочечные полипептиды. Тем не менее, по причине термолабильности фармацевтической субстанции, ее хранение осуществляют при температуре от минус 5 до минус 18°С.
Правильный выбор вспомогательных веществ имеет важное значение в технологии лекарственных форм. Раньше во вспомогательных веществах видели только индифферентные формообразователи, значение которых сводилось к приданию фармацевтической субстанции соответствующей формы и объема для удобства ее приема, транспортировки, хранения. Однако результаты исследований последних десятилетий привели к пересмотру биологической роли вспомогательных веществ. Они могут усиливать, снижать терапевтическую эффективность фармацевтических субстанций или изменять характер их действия под влиянием различных факторов. Вспомогательные вещества должны отвечать основному требованию: раскрывать всю гамму фармакологических свойств лекарственный препарата, обеспечивать его оптимальное действие. Правильный выбор вспомогательных веществ позволяет снизить дозу фармацевтической субстанции при сохранении (или увеличении) ее терапевтического эффекта. С современных позиций нет индифферентных или универсальных вспомогательных веществ, поэтому состав каждого конкретного лекарственного препарата должен быть научно обоснован.
Вспомогательные вещества не только имеют формообразующие и технологические функции, но и являются активными компонентами лекарственной композиции. Установлено, что ни один фармацевтический фактор не оказывает столь существенного и сложного влияния на действие лекарственного препарата как вспомогательные вещества. Влияние вспомогательных веществ на биодоступность и терапевтическую активность велико. Важно учитывать и безопасность используемых вспомогательных веществ, так как их неразумный подбор может привести к ослаблению терапевтической активности, а также ко всевозможным побочным реакциям.
Фармацевтические субстанции пептидной и белковой структуры термолабильны и в большинстве случаев - не отличаются высокой стабильностью, гидролитически неустойчивы, подвержены трансформации, легко метаболизируют в организме [21. Banga, А. K. Therapeutic peptides and proteins: Formulation, Processing, and Delivery Systems. 3rd ed. Atlanta: CRC Press, 2015. - P. 139-167].
Краткое описание чертежей.
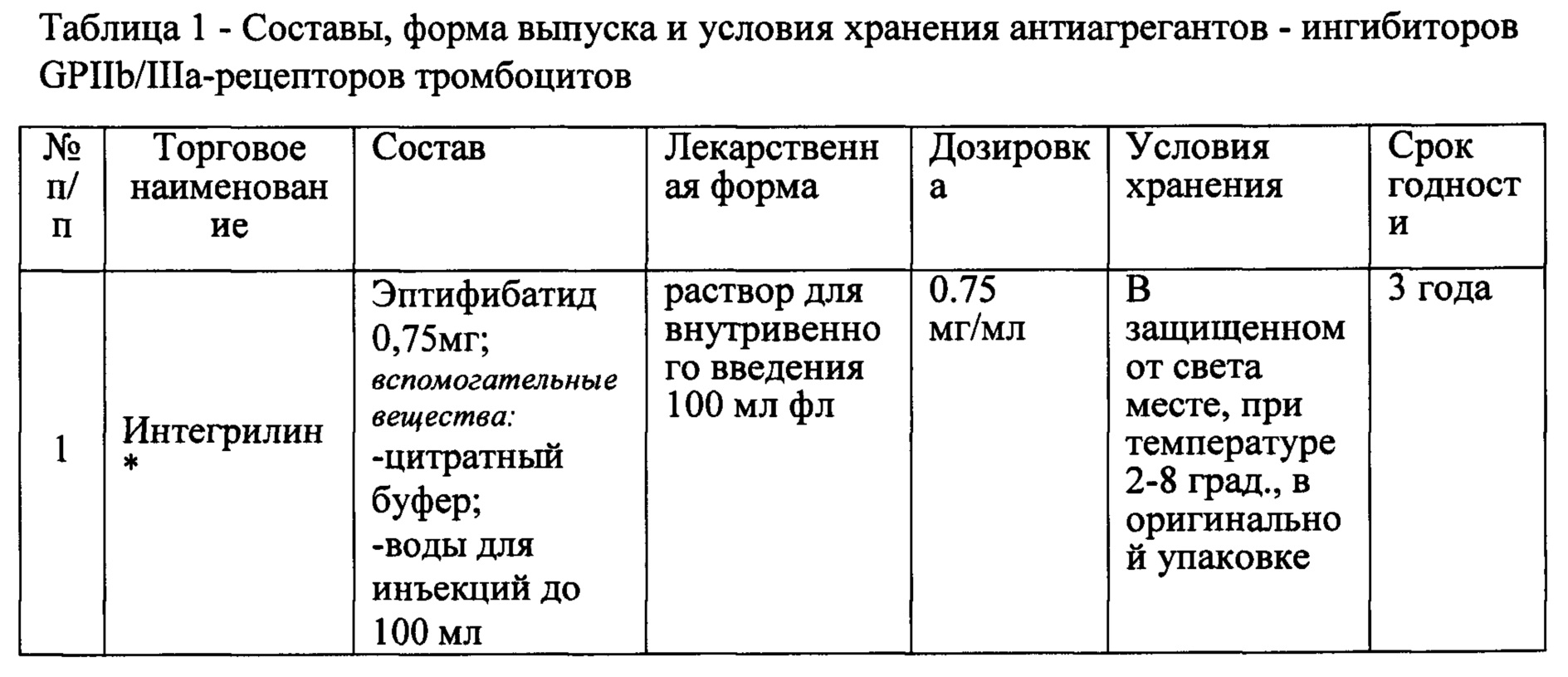
Фигура 1 - Зависимость степени агрегации тромбоцитов от концентрации ингибиторов Интегрилина и гетеропептида (PRC-007) при добавлении ADP 8 μМ.
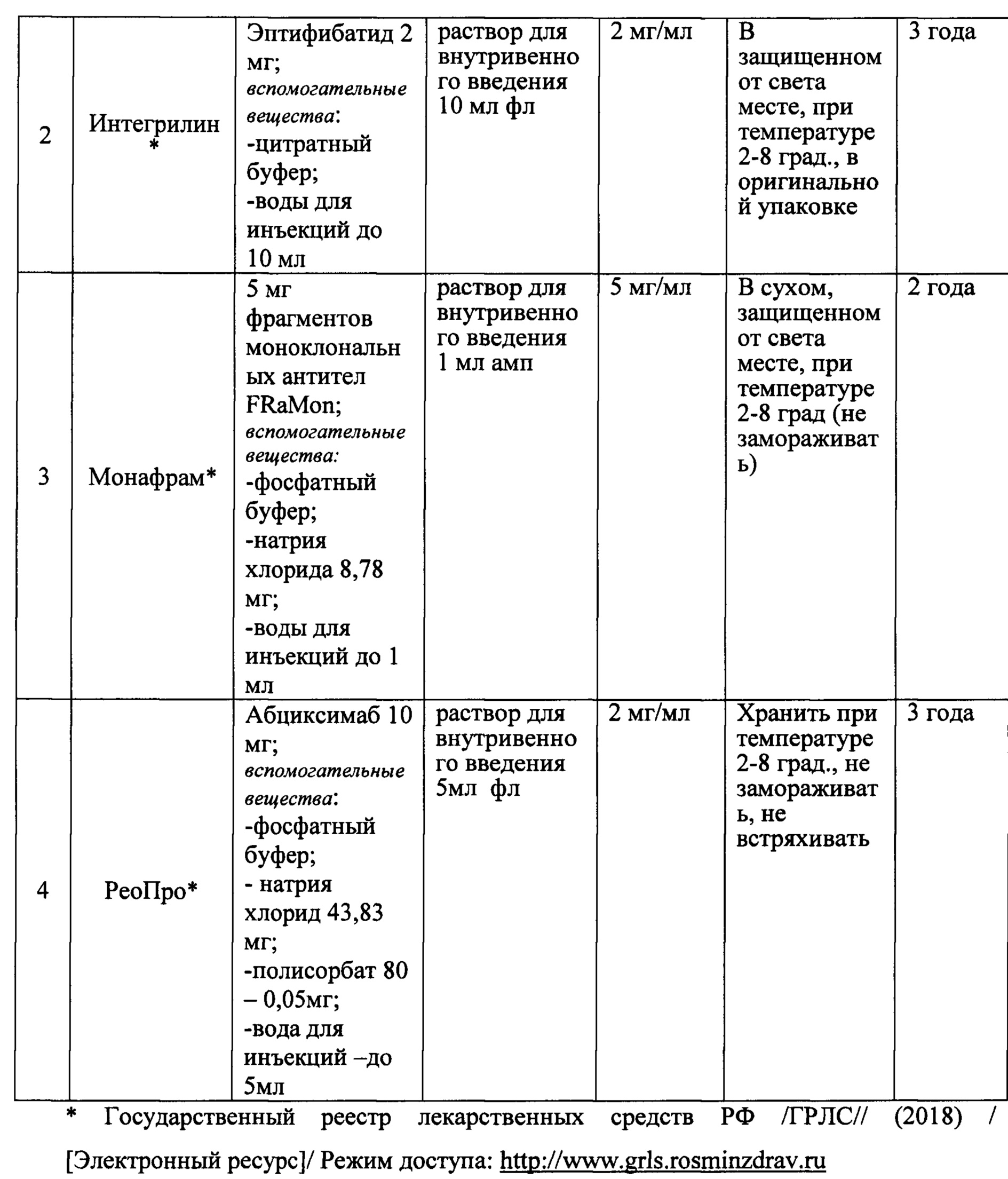
Фигура 2 - Изменение концентрации лекарственного средства во времени в плазме крови крыс после однократного внутривенного введения.
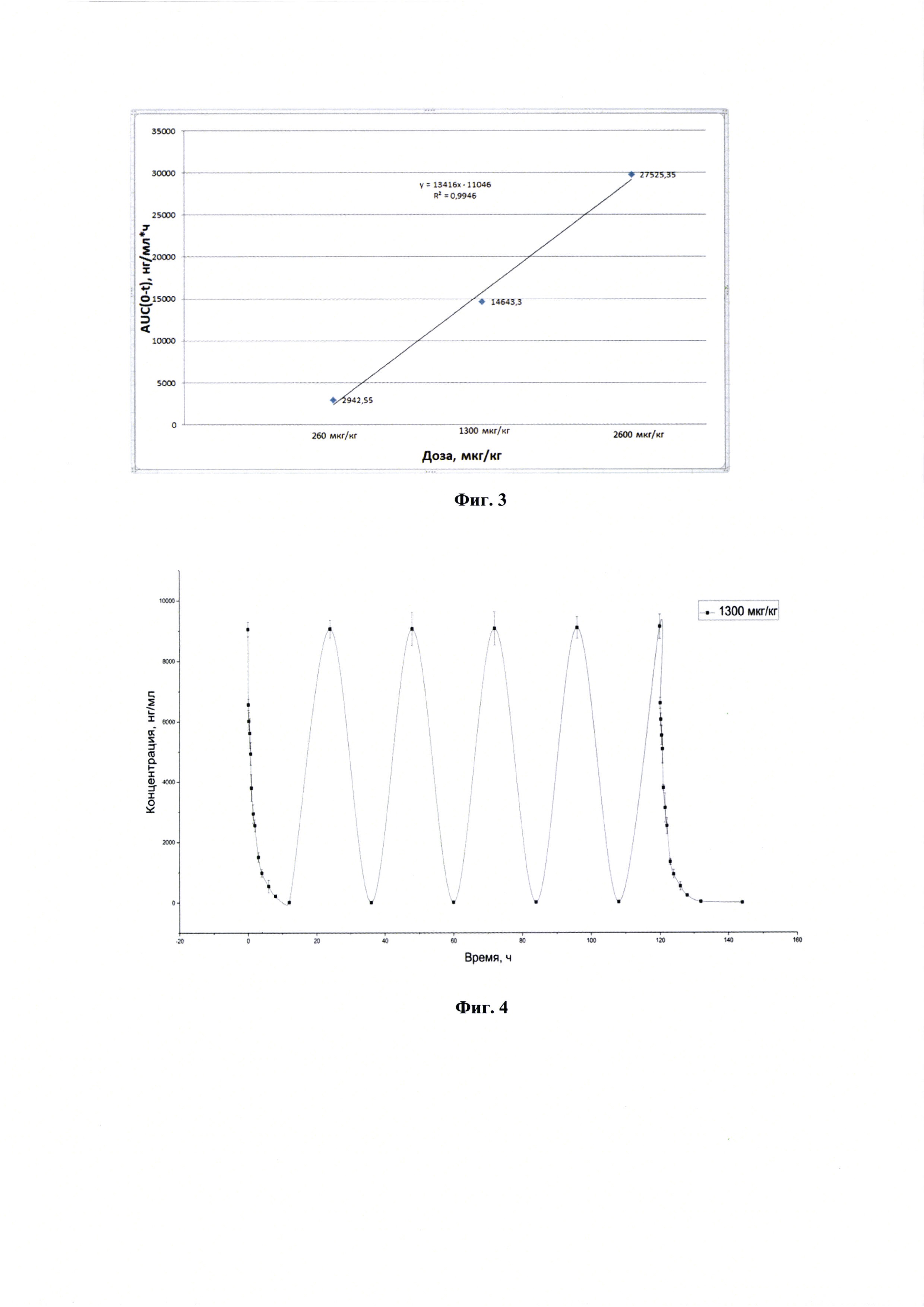
Фигура 3 - Оценка линейной зависимости AUC(0-t) от дозы.
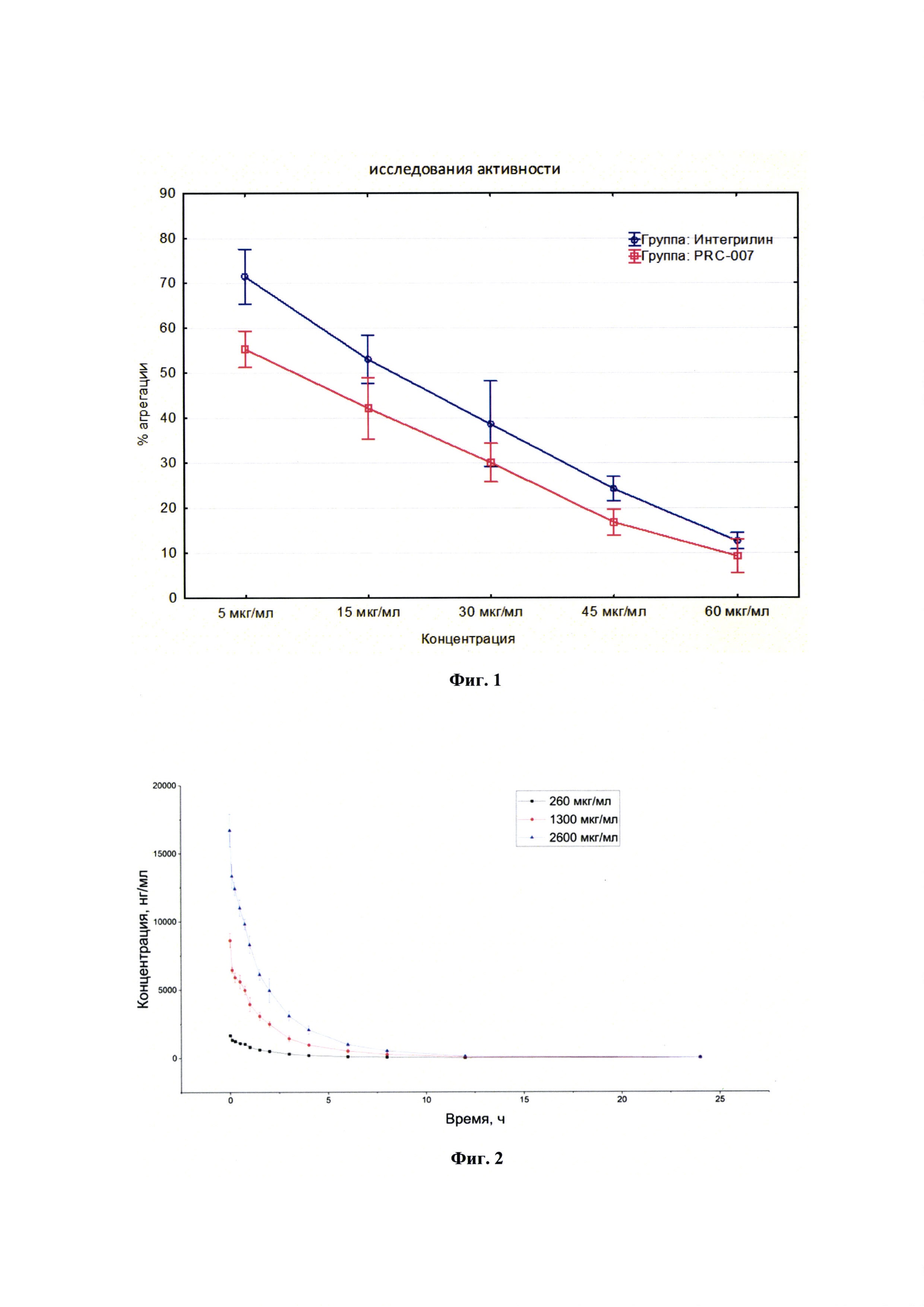
Фигура 4. Изменение концентрации лекарственного средства во времени в плазме кроликов после многократного внутривенного введения.
Пример 1. Исследование готовой лекарственной формы
Негативный опыт многочисленных клинических испытаний пероральных лекарственных форм антиагрегантов-ингибиторов GPIIb/IIIа-рецепторов тромбоцитов определяет целесообразность фармацевтической разработки гетеропептида в лекарственной форме для парентерального применения. К лекарственным формам для парентерального применения относят:
инъекционные и инфузионные лекарственные формы; концентраты для приготовления инъекционных и инфузионных лекарственных форм; твердые лекарственные формы, предназначенные для приготовления инъекционных и инфузионных лекарственных форм; лекарственные формы для имплантации.
На стадии предварительных экспериментальных исследований была предложена твердая лекарственная форма гетеропептида для парентерального применения - лиофилизат для приготовления раствора для инъекций. Лекарственная форма лиофилизат оказалась не совсем удобной с учетом специфики применения лекарственного препарата в клинической практике, так как антиагреганты-ингибиторы ингибиторов GPIIb/IIIа-рецепторов тромбоцитов требуют сначала болюсного инъекционного введения (нагрузочная доза) с последующим инфузионным введением (поддерживающая доза). Поэтому объем вводимого раствора лекарственного средства должен быть не менее 10 мл (в первом случае) и не менее 100 мл (во втором случае). Предложенный на предварительном этапе исследования лиофилизат гетеропептида (8 мг/мл) расфасовывают в ампулы емкостью 2 мл, в которые имеется возможность добавить только 2 мл растворителя. Применение лиофилизата гетеропептида в ампулах небольшой емкости в клинической практике может спровоцировать при финальной подготовке лекарственного препарата (растворение лиофилизата перед введением) опасность микробной контаминации, "перепутывания" раствора, не соблюдения дозировки (человеческий фактор). Теоретическая замена емкости ампул с лиофилизатом гетеропептида с 2 мл на 10 мл не решает проблемы при введении поддерживающей дозы, требующей назначения больших объемов раствора лекарственного препарата.
Учитывая специфику введения лекарственных препаратов -ингибиторов GPIIb/IIIa-рецепторов тромбоцитов (во внутрисосудистое кровяное русло, часто - при чрескожных коронарных вмешательствах, введение сначала нагрузочных, а затем поддерживающих доз из расчета на 1 кг массы тела пациента), оптимальной лекарственной формой гетеропептида является инъекционный (инфузионный) раствор для внутривенного введения.
Инъекционный внутривенный путь введения обладает несомненными достоинствами: предотвращает разрушение фармацевтической субстанции под действием ферментов желудочно-кишечного тракта; обеспечивает точность дозирования фармацевтической субстанции, 100% биодоступность лекарственной формы (фармацевтическая субстанция попадает сразу в кровяное русло, минуя желудочно-кишечный тракт и печень); желаемую скорость и место введения; возможность введения капельно больших объемов жидкостей; возможность немедленного прекращения процесса введения при возникновении побочных эффектов.
Пример 2. Исследование и выбор вспомогательных веществ. Выбор растворителя - первая стадия при разработке состава жидких лекарственных форм, в том числе - растворов. В качестве растворителей используют индивидуальные химические соединения или их смеси, способные растворять различные лекарственные субстанции (образовывать с ними однородные системы - растворы). Требования к фармацевтическим растворителям: высокая растворяющая способность, химическая индифферентность и биологическая безвредность, микробиологическая чистота и доступность. В фармацевтической технологии жидких лекарственных форм наиболее доступный, практически универсальный растворитель - вода. В случае растворимости фармацевтической субстанции в воде, стабильности полученных растворов в процессе хранения лекарственной формы, предпочтение при выборе растворителя отдают в первую очередь воде.
При выборе растворителя для соединений пептидной структуры особую роль играет физиологическая индифферентность воды и ее физико-химическая совместимость с фармацевтической субстанцией. Гетеропептид растворим в воде при соотношении 1:300 - 1:320 при температуре 8°С и при соотношении 1:100 - 1:120 при температуре 20°С. Разрабатываемая лекарственная форма гетеропептида - раствор для внутривенного введения. С учетом относительно низкой дозировки гетеропептида в лекарственной форме (0,75 мг/мл и 2 мг/мл), растворение гетеропептида в указанных концентрациях в воде при 8 и при 20°С будет полным. Учитывая пептидную структуру фармацевтической субстанции, определяющую ее термолабильность, следует максимально ограничить верхний предел температурного режима растворения в производственном процессе - не выше 22°С.
В результате экспериментального исследования было подтверждено, что растворение гетеропептида (0,75 мг/мл и 2 мг/мл) в воде для инъекций при температурах 8 и 20°С происходит полностью, полученные растворы представляют собой бесцветные прозрачные жидкости.
Выбор стабилизатора
При фармацевтической разработке белковых и пептидных лекарственный препаратов, особое внимание уделяют стабилизации структуры фармацевтической субстанции, увеличению сроков хранения, предохранению от воздействия повреждающих факторов, стандартизации технологических процессов и контролю качества готовой продукции с целью производства безопасных лекарственных препаратов.
Вопросам стабильности лекарственных препаратов в настоящее время уделяют большое внимание. В процессе производства и хранения нередко происходит изменение физико-химических свойств лекарственных средств, протекающее с различной скоростью и степенью проявления. Подобные изменения влияют на срок годности лекарственных препаратов. Стабильность лекарственных препаратов зависит от температуры хранения, освещенности, состава окружающей атмосферы, технологии производства, вида упаковки и множества других факторов.
Стабильность парентеральной лекарственной формы складывается из химической, физической и микробиологической стабильности. Химическая стабильность определяется в основном устойчивостью фармацевтической субстанции к гидролитическому разложению и окислению; физическая касается двухфазных систем и определяет их способность оставаться в тонкодисперсном состоянии в течение определенного промежутка времени; микробиологическая определяет устойчивость лекарственных препаратов к действию микроорганизмов в процессе хранения.
Стабилизаторы могут замедлять или ускорять нежелательные химические реакции, создавать определенные значения рН растворов, повышать растворимость фармацевтических субстанций, причем выбор стабилизатора в первую очередь зависит от природы фармацевтической субстанции. Для стабилизации растворов для внутривенного введения нередко используют буферные растворы для поддержания оптимального значения рН.
Буферами и буферными растворами называются растворы, способные сохранять почти постоянное значение рН при добавлении к ним кислоты или щелочи в незначительных количествах. Наиболее часто в состав инъекционных растворов вводят фосфатный, цитратный и цитрат-фосфатные буферные системы.
В ходе исследований были проанализированы составы лекарственных препаратов -антиагрегантов (ингибиторов GPIIb/IIIа-рецепторов тромбоцитов), зарегистрированных на территории РФ для медицинского применения в форме растворов для внутривенного введения (таблица 1). Для стабилизации растворов для внутривенного введения -лекарственных препаратов «Монафрам» и «РеоПро», в их составы введен фосфатный буфер. Интегрилин содержит в своем составе цитратный буфер.
Таким образом, целесообразным может быть введение в состав раствора гетеропептида фосфатного или цитратного буфера. Однако в опубликованном исследовании Adamo et al. (2016) изучено влияние буферных вспомогательных веществ, входящих в состав лекарственный препаратов-ингибиторов GPIIb/IIIа-рецепторов тромбоцитов, на развитие тромбоцитопении. Изначально для поддержания слабокислой рН раствора пептидомиметика Тирофибана использовали фосфатный буфер, однако, из-за недостаточных стабилизирующих свойств он был заменен в рецептуре на цитратный. При клиническом применении составов раствора Тирофибана с фосфатным буфером отмечено значительно большее число случаев тромбоцитопении (первая фаза клинических испытаний), чем при использовании составов с цитратным буфером (вторая фаза клинических испытаний). Таким образом, природа буферного раствора существенно влияла на степень тромбоцитопении, и приоритет был отдан включению в состав лекарственный препаратов-ингибиторов GPIIb/IIIа-рецепторов тромбоцитов именно цитратной буферной системе.
В состав лекарственных форм для парентерального применения разрешено введение стабилизаторов, в перечень которых входят лимонная кислота и натрия гидроксид - компоненты цитратной буферной системы.
Соответственно существует необходимость решить задачу для фармацевтической разработки - выбрать оптимальный состав цитратной буферной системы с целевым диапазоном рН, максимально поддерживающим стабильность гетеропептида в растворе для внутривенного введения. Для достижения стабильности гетеропептида использовали вспомогательные вещества - лимонной кислоты моногидрат и натрия гидроксид, исходя из их функциональных и физико-химических свойств. Были исследованы цитратные буферные системы с различными значениями рН и составом буферных агентов.
В ходе работы проводили контроль образцов раствора гетеропептида. Исследовали поведение фармацевтической субстанции гетеропептид в растворе при характерных и критических для него значениях рН по показателям: прозрачность, цветность и содержание примесей (таблица 2). Целевые идентифицируемые пределы по содержанию примесей установлены для любой единичной неидентифицированной примеси - не более 0,1%; для суммы всех примесей - не более 1,0%. Анализ растворов гетеропептида в терапевтических концентрациях (0,75 мг/мл и 2,0 мг/мл) при различных уровнях рН свидетельствует о необходимости поддержания уровня рН для лекарственной формы в диапазоне от 5,0 до 5,5 во избежание появления примесей деструкции и слабо-желтого окрашивания раствора. Изучение показателей качества раствора гетеропептида проводили при 8°С без температурного воздействия, учитывая пептидную структуру фармацевтической субстанции (термолабильность).
Таким образом, в результате проведенных экспериментальных исследований, анализа научной литературы и контент-анализа ассортимента антиагрегантных лекарственных препаратов-ингибиторов GPIIb/IIIа-рецепторов тромбоцитов научно обоснованы и предложены оптимальные составы растворов гетеропептида для внутривенного введения, обладающие антиагрегационными свойствами:
1) Гетеропептид 0,75 мг/мл; лимонной кислоты моногидрат 5,25 мг и натрия гидроксид 1,70-220 мг/мл до рН 5,35, воды для инъекций до 100 мл;
2) Гетеропептид 2,0 мг/мл; лимонной кислоты моногидрат 5,25 мг и натрия гидроксид 1,70-220 мг/мл до рН 5,35, воды для инъекций до 10 мл.
Для фармацевтической субстанции и вспомогательных веществ в составе лекарственной формы и в производственной стандартной загрузке избытки не предусмотрены.

Пример 3. Определение эффективности исследуемого состава.
Исследование специфической активности необходимо проводить в сравнении с эталонным лекарственным препаратом. В качестве лекарственный препарата сравнения при исследовании антиагрегационных свойств гетеропептида выбрали Интегрилин, имеющий также пептидную структуру. Интегрилин представляет собой синтетическое вещество с пептидной структурой, сходной с последовательностью RGD (Arg-Gly-Asp).
Сведения о лекарственный препарате сравнения Эптифибатид (Интегрилин); Код CAS: 188627-80-7; Лекарственная форма: раствор для внутривенного введения. Интегрилин - синтетический циклический гептапептид, содержащий 6 аминокислот и меркаптопропиониловый остаток - дезаминоцистеинил. Лекарственный препарат предупреждает связывание фибриногена, фактора Виллебранда и других адгезивных лигандов с гликопротеиновыми IIb/IIIa-рецепторами тромбоцитов. Таким образом, механизмы действия Интегрилина и гетеропептида идентичны.
Активность антиагрегантного готовой лекарственной формы (гетеропептида) исследовали на модели АДФ-индуцированной агрегации тромбоцитов на человеческой донорской крови (обогащенной тромбоцитами плазме) в сравнении с лекарственным препаратом Интегрилин, раствор для внутривенного введения 0.75 мг/мл, (Glaxo Operations UK (Великобритания)).
Методика забора крови: для взятия образца венозной крови использовали вакуумные системы забора крови Vacutest с 3,8% цитрата натрия. Обогащенную тромбоцитами плазму получали центрифугированием цельной крови при 200g в течение 20 мин. Для приготовления опытных тромбоцитов обогащенную тромбоцитами плазму подкисляли до рН 6,5 1 М лимонной кислотой; образец центрифугировали при 1500g в течение 20 мин с получением осадка, который ресуспендировали в Са2+ буфере Hepes [152 мМ NaCl, 2,8 мМ KCl, 8,9 мМ NaHCO3, 0,8 мМ KH2PO4, 0,8 мМ MgCl2, 5,6 мМ глюкозы, 10 мкМ EGTA, BSA (3,5 мг/мл) и 10 мМ Hepes, рН 6,5]. Тромбоциты промывали один раз вышеуказанным буфером и суспендировали в том же буфере и рН доводили до 7,4. Концентрацию тромбоцитов стандартизировали до 2,5×108 клеток/мл путем разбавления буфером Hepes. Число тромбоцитов определяли с использованием анализатора гематологии Coulter.
Анализ агрегаиии тромбоцитов: Антиагрегационную активность исследуемых образцов изучали на богатой тромбоцитами плазме с использованием аденозиндифосфата (АДФ) в качестве индуктора агрегации тромбоцитов. Все процедуры проводили в полистирольной посуде, обладающей тромборезистентными свойствами. В течение всего периода исследования богатая и безтромбоцитарная плазма находились при комнатной температуре, а запись агрегации тромбоцитов осуществляли при 37°С.
Агрегацию тромбоцитов изучали с использованием турбидиметрического метода Борна, основанного на изменении пропускания света (540 нм) через исследуемую плазму при ее постоянном перемешивании (1000 об/мин). В качестве образца сравнения использовали безтромбоцитарную плазму. Светопропускание через безтромбоцитарную плазму принимали за 100%, а светопропускание через богатую тромбоцитами плазму принимали за 0%. Концентрацию тромбоцитов доводили в богатой тромбоцитами плазме до 2,5⋅108 клеток/мл с помощью разведения бедной тромбоцитами плазмой. В качестве индуктора использовали АДФ в концентрации 8 мкМ. Изучаемое соединение (в виде водного раствора, при необходимости, содержащего ДМСО до 0,2%) в разных концентрациях (от 5 до 60 мкг/мл) добавляли в пробу до внесения индуктора агрегации (АДФ) в трех независимых экспериментах. При статистической обработке результатов различия считались достоверными при 95% уровне значимости (р≤0.05). Данные ингибирования агрегации тромбоцитов Интегрилином и гетеропептидом (PRC-007) представлены в таблице 3 и на фигуре 1.
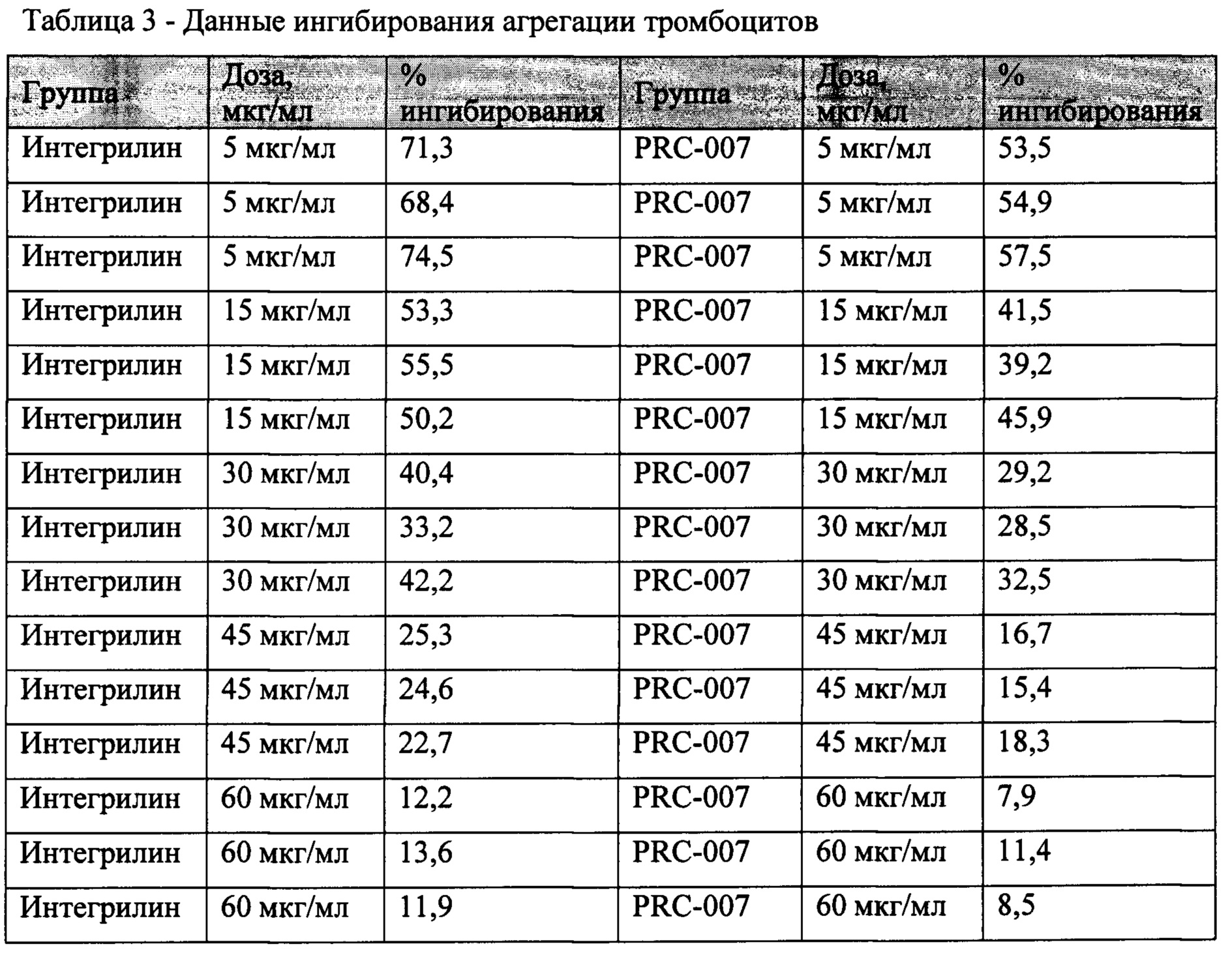
Полученные результаты показывают наличие дозозависимого ингибирования АДФ-индуцированной агрегации тромбоцитов крови здоровых доноров под действием пептидных ингибиторов GP IIb/IIIa - рецепторов тромбоцитов.
В результате проведенных исследований установлены величины IC50 Интегрилина ~15-20 мкг/мл и IC50 гетеропептида (PRC-007) ~8-12 мкг/мл. Таким образом было обнаружено, что антиагрегационная активность гетеропептида (PRC-007) достоверно на 25% выше по сравнению с лекарственным препаратом Интегрилин. Высокая антиагрегационная активность гетеропептида, превышающая активность применяемого в клинической практике Интегрилина (пептидного ингибитора GPIIb/IIIa), может быть объяснима за счет синергетического эффекта от вспомогательных веществ и активного вещества.
Дозировку гетеропептида в растворе для внутривенного введения подбирали, исходя из его антиагрегационной активности, которая на 25% эффективнее антиагрегационной активности лекарственного препарата сравнения - Интегрилина.
Пример 4. Определение нагрузочной и поддерживающей доз.
Исследованы рекомендации по способу введения и доза Интегрилина (МНН: Эптифибатид) при остром коронарном синдроме. В Приложении 8в к Рекомендациям Общества специалистов по неотложной кардиологии «Диагностика и лечение больных с острым коронарным синдромом без подъема сегмента ST электрокардиограммы» (2015) приведены способ введения и дозы Интегрилина: При начале введения до чрескожного коронарного вмешательства: внутривенно, болюсом 180 мкг/кг, затем инфузия 2 мкг/кг/мин в течение 72-96 ч (после чрескожного коронарного вмешательства продолжать в течении 18-24 ч). При начале введения непосредственно перед чрескожным коронарным вмешательством: внутривенно; болюсом 180 мкг/кг с последующей инфузией 2 мкг/кг/мин, через 10 мин 2-й болюс 180 мкг/кг; начать до процедуры, продолжать во время нее и в последующие 18-24 ч. У больных со скоростью клубочковой фильтрации <50 мл/мин/1,73 м2 уменьшить скорость инфузии до 1 мкг/кг/мин; не рекомендуется при скорости клубочковой фильтрации <30 мл/мин/1,73 м2. Время восстановления функции тромбоцитов на 50% после прекращения в/в введения составляет 2-4 часа.
Таким образом, нагрузочную и поддерживающую дозы гетеропептида определили по аналогии с дозами Интегрилина. В процессе антиагрегационной терапии с применением гетеропептида рекомендовано проводить перерасчет с учетом активности нагрузочной и поддерживающей дозы лекарственный препарата из расчета на 1 кг массы тела.
С учетом предполагаемого способа введения, нагрузочной и поддерживающей доз антиагрегантного лекарственного средства, нами обоснованы две эффективные терапевтические дозировки гетеропептида в растворе для внутривенного введения: 0,75 мг/мл и 2 мг/мл.
Пример 5. Получение раствора гетеропептида.
Основной технологический процесс производства раствора гетеропептида (0,75 мг/мл и 2 мг/мл) для внутривенного введения проводят в асептических условиях путем растворения гетеропептида в воде для инъекций при (20+2)°С, с последующей стабилизацией раствора гетеропептида цитратной буферной системой до значения рН 5,35; мембранной стерилизацией с использованием полиэфирсульфоновых или целлюлозных фильтров; розливом в стерильные стеклянные флаконы, укупоркой флаконов стерильными резиновыми пробками и обкаткой алюминиевыми колпачками.
Стадии приготовление раствора и стабилизация раствора гетеропептида
В процессе разработки технологического процесса производства раствора гетеропептида определен оптимальный порядок введения ингредиентов в раствор на стадиях растворения и стабилизации раствора цитратной буферной системой.
Установлено, что порядок введения буферных агентов (лимонной кислоты моногидрата и натрия гидроксида) не влияет на стабильность раствора гетеропептида.
Приготовление водного раствора гетеропептида осуществляли в емкости из нержавеющей стали, что позволит избежать его разлива с учетом вероятного риска повреждения стеклянной емкости. Для полного растворения фармацевтической субстанции и компонентов цитратной буферной системы использовали верхнеприводную переносную мешалку лопастного типа (миксер). Оптимальная скорость вращения мешалки составляет 100-120 оборотов/мин. Время полного растворения гетеропептида около 20 минут при температуре (20±2)°С. Лимитирующий температурный режим растворения гетеропептида - не выше 22°С.
После полного растворения фармацевтической субстанции полученный раствор гетеропептида стабилизировали цитратной буферной системой. Затем анализировали рН раствора, значение которого должно находиться в диапазоне от 5,0 до 5,5. При несоответствии заданному нормативу проводили корректировку 1 М раствором натрия гидроксида.
Стадии фильтрации и стерилизации
Одним из требований, предъявляемых к лекарственным формам для инъекций, является отсутствие механических включений и стерильность. Инъекционные растворы не должны содержать видимых невооруженным глазом частиц.
Практически на всех стадиях производства может произойти загрязнение лекарственных препаратов. Выделяют три типа загрязнения парентеральных лекарственный препаратов: механические, химические (растворимые) и микробные. Механические и микробные загрязнения тесно связаны между собой: часто их источники одинаковы, методы борьбы с ними аналогичны. Присутствующие в инъекционном растворе механические включения могут привести к образованию тромбов, гранулем, возникновению аллергических реакций и других патологических явлений. Поэтому одной из важнейших задач, решаемой в процессе производства стерильных растворов является полное освобождение от механических включений, для этого применяют фильтрацию.
Высокую значимость в настоящее время приобретают наиболее простые экономически выгодные технологии получения лекарственных форм. В случае фармацевтической разработки стерильных растворов для внутривенного введения рационально использовать технологию, включающую объединение двух стадий -фильтрации и стерилизации раствора, чтобы минимизировать влияние технологических фармацевтических факторов на биодоступность лекарственного препарата. Пептидная структура гетеропептида определяет термолабильность фармацевтической субстанции, вследствие этого термические методы стерилизации раствора гетеропептида неприемлемы. Целесообразно использование щадящего метода мембранной фильтрации, который совмещает как стадию фильтрации, так и стадию стерилизации.
При мембранной (или ситовой) фильтрации частицы размером больше, чем размер пор фильтра, задерживаются на его поверхности. В зависимости от соотношения размера пор и размера частиц в мембранных фильтрах реализован глубинный, экранный или смешанный механизмы удержания. Мембранные фильтры имеют определенный размер пор, опосредованный жесткостью каркаса и преимущественно ситовым механизмом разделения. Существенное значение придают совместимости материала фильтрационной системы и фильтруемой жидкости, так как фильтр в процессе фильтрации в течение длительного времени (от 8 до 30 ч) может находиться в контакте с жидкостью. Наиболее часто используют для стерилизации фильтры на основе производных целлюлозы, рабочий интервал рН водных растворов для этих фильтров составляет 1,0-10,0.
Для стерилизации используют мембранные фильтры с размером пор 0,22 мкм и меньше. В процессе разработки технологии получения раствора гетеропептида для внутривенного введения исследовали стабильность раствора гетеропептида при стерилизации через различные виды мембран. В лабораторных условиях для финишной стерилизации использовали фильтрационные установки с гидрофильными мембранами из полиэфирсульфона типа PTGC (Millipore, USA); мембранами из ацетата целлюлозы Corning® Vacuum Filters (USA); нейлоновыми мембранами (Pall Corporation, USA). Мембраны для фильтрации из ацетата целлюлозы обладают низкими адсорбционными характеристиками, мембраны из полиэфирсульфона способны обеспечивать высокую скорость потока, также применимы в широком диапазоне значений рН. Использовали стеклянные фильтродержатели для многократного использования с возможностью замены фильтров. Процесс фильтрации в данных установках зависит от объема и вязкости истинного раствора и происходит под вакуумом.
Оценку стерильных растворов для внутривенных инъекций при выборе материала для фильтрации проводили по показателям: цветность, прозрачность, отсутствие механических включений, изменение рН раствора, количественное содержание гетеропептида. Оценку проводили до и после стерилизации (таблица 4).
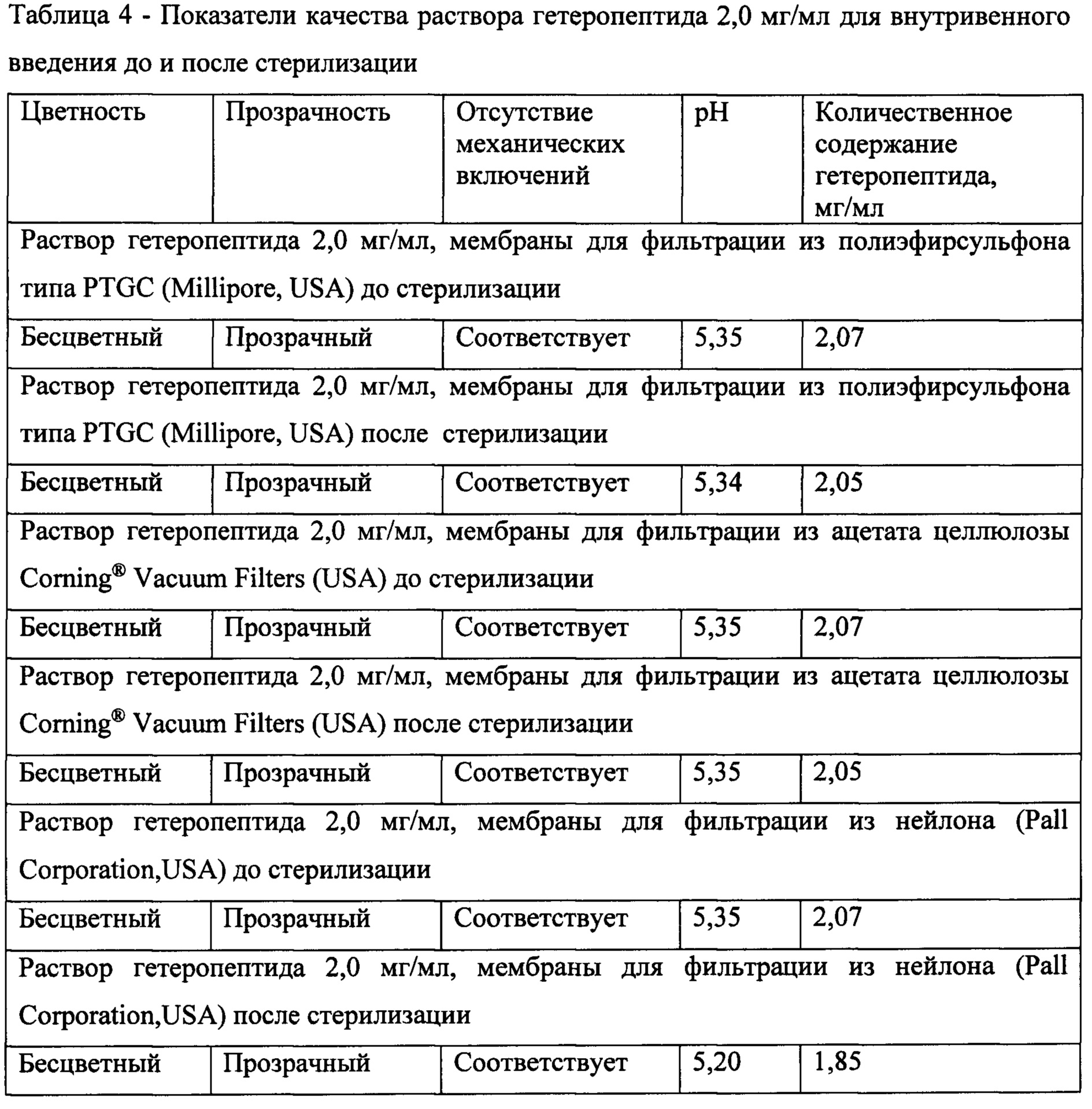
Результаты проведенных исследований подтвердили возможность использования как полиэфирсульфоновых, так и целлюлозных материалов в процессе стерилизующей мембранной фильтрации раствора гетеропептида. Все показатели качества стерилизованных растворов гетеропептида соответствовали целевым значениям. Фильтрация раствора гетеропептида через установку с нейлоновыми фильтрами привела к значительному (более 10% от исходного содержания) снижению концентрации гетеропетида, что вероятно связано с адсорбцией гетеропептида на данном типе фильтров.
Для удаления механических примесей из раствора и его стерилизации использовали стерилизующую фильтрационную установку, состоящую из перистальтического насоса (модель SP 311, «VELP SCETIFICA», Италия) и фильтрующего модуля с использованием мембранного фильтра с диаметром пор 0,22 мкм, который позволяет получить чистые растворы. Этот метод используют для стерилизации термолабильных растворов. В качестве ультрафильтрационных мембран были использованы полиэфирсульфоновые мембраны типа PTGC фирмы (Millipore, USA). В результате фильтрации происходит стерилизация раствора, отделение белков и других высокомолекулярных соединений и механических микропримесей.
Проведено исследование специфической фармакологической активности лекарственного средства. Антиагрегантную активность изучали на богатой тромбоцитами плазме с использованием аденозиндифосфата (АДФ) в качестве индуктора агрегации тромбоцитов. Полученные результаты показали наличие дозозависимого ингибирования АДФ-индуцированной агрегации тромбоцитов крови здоровых доноров под действием исследуемого средства. В результате анализа специфического действия установлено, что активность исследуемого лекарственного средства выше на 25%, чем у препарата сравнения «Интегрилин». IC50 для исследуемого ЛС ~8-12 мкг/мл.
Пример 5. Исследование фармакокинетики.
Методики исследования фармакокинетики проводились в соответствии со стандартными практиками и известны из уровня техники среднему специалисту.
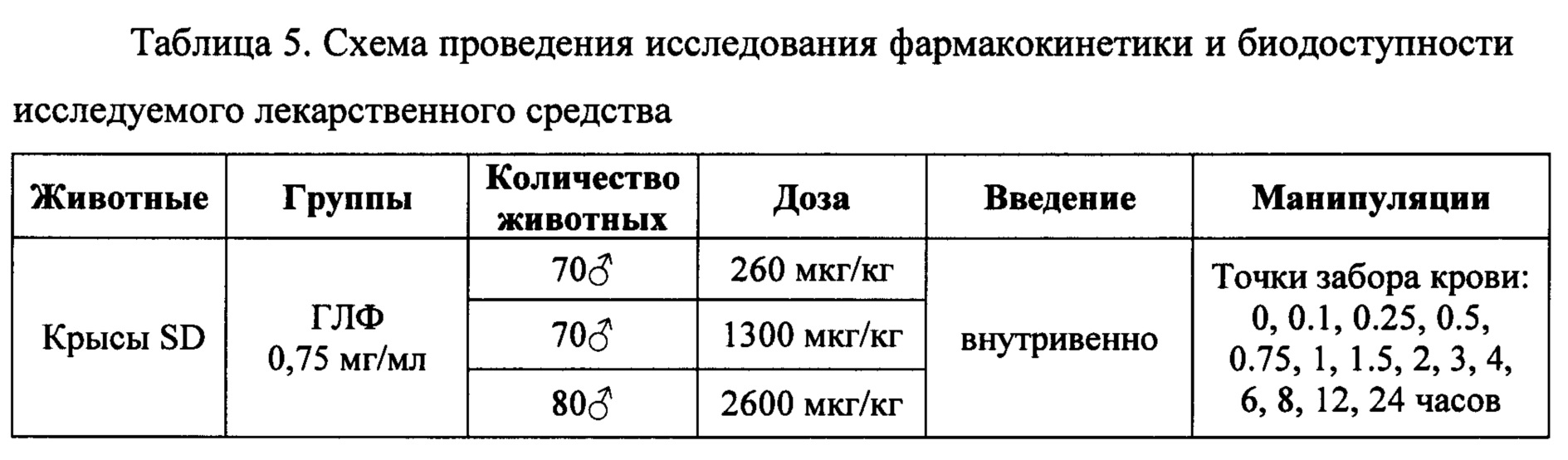
Исследование проводилось как открытое проспективное, с включением животных в различные группы для изучения фармакокинетики. По результатам отбора животных, произведен последовательный набор трех групп крыс. Всего было использовано 220 самцов крыс (таблица 5). За 18-20 часов до исследования животных лишали корма с открытым доступом к воде. Образцы исследуемого лекарственного средства вводили внутривенно однократно в дозах 260 мкг/кг, 1300 мкг/кг и 2600 мкг/кг крысам.
Перед забором крови крыс помещали в CO2 камеру до полной остановки дыхания. Кровь забирали из яремной вены по 1 мл с EDTA в следующие временные точки: 0, 0.1, 0.25, 0.5, 0.75, 1, 1.5, 2, 3, 4, 6, 8, 12, 24 часов. На одну временную точку приходилось по 5 животных. Также на дозе 2600 мкг/кг у животных производили забор органов (мозг, тимус, сердце, легкие, печень, почки, селезенка) для изучения распределения лекарственного средства в следующие временные точки: 0, 0.1, 0.25, 0.5, 0.75, 1, 1.5, 2, 3, 4, 6, 8, 12, 24, 36, 48 часов. Из крови получали плазму обычным методом: центрифугирование - при 3500 об/мин при температуре 4°С и сохранение при минус 20°С в аликвотах по 1 мл.
В ходе всего эксперимента, в том числе и его биологической части, не было зафиксировано никаких отличий в поведении, внешнем виде и проявлений физиологических функций у подопытных крыс до и после получения ими лекарственного средства.
На фигуре 2 представлены экспериментальные данные по определению концентрации исследуемого лекарственного средства в образцах плазмы крови крыс в разные сроки после однократного внутривенного введения в дозах 260 мкг/кг, 1300 мкг/кг и 2600 мкг/кг.
Индивидуальные значения концентрации лекарственного средства в плазме крови крыс после однократного внутривенного введения представлены в таблицах 6-8.
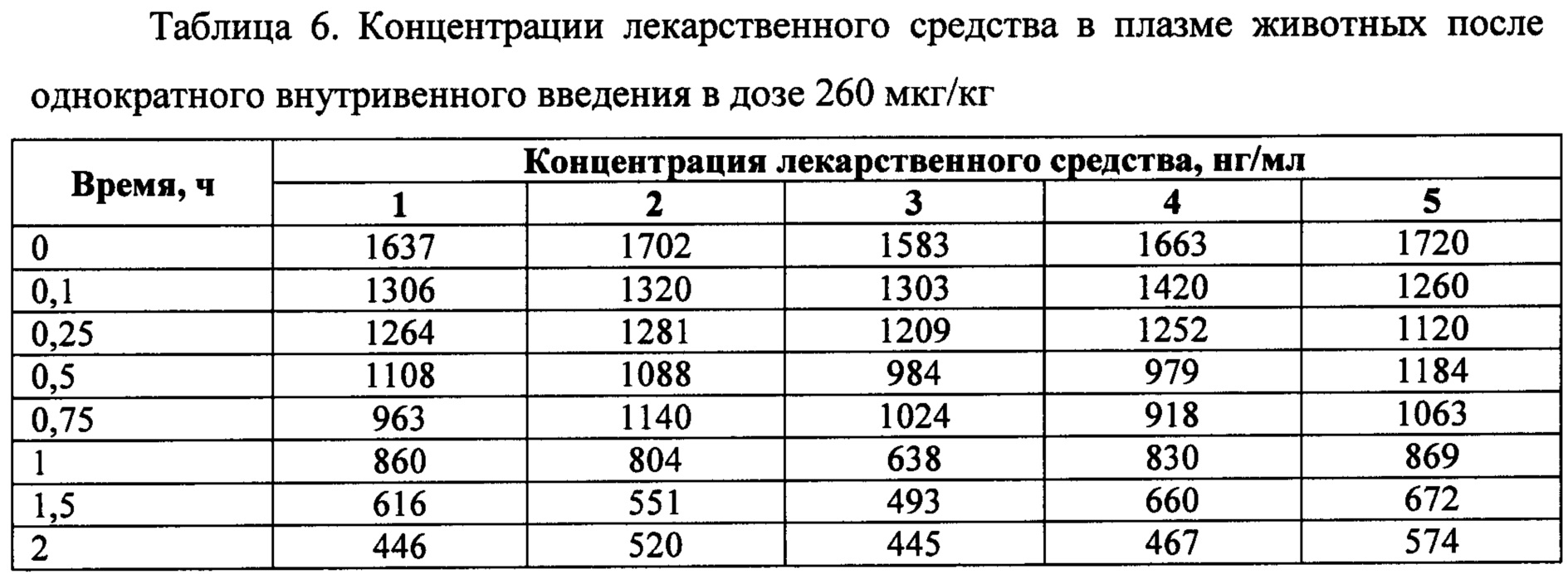
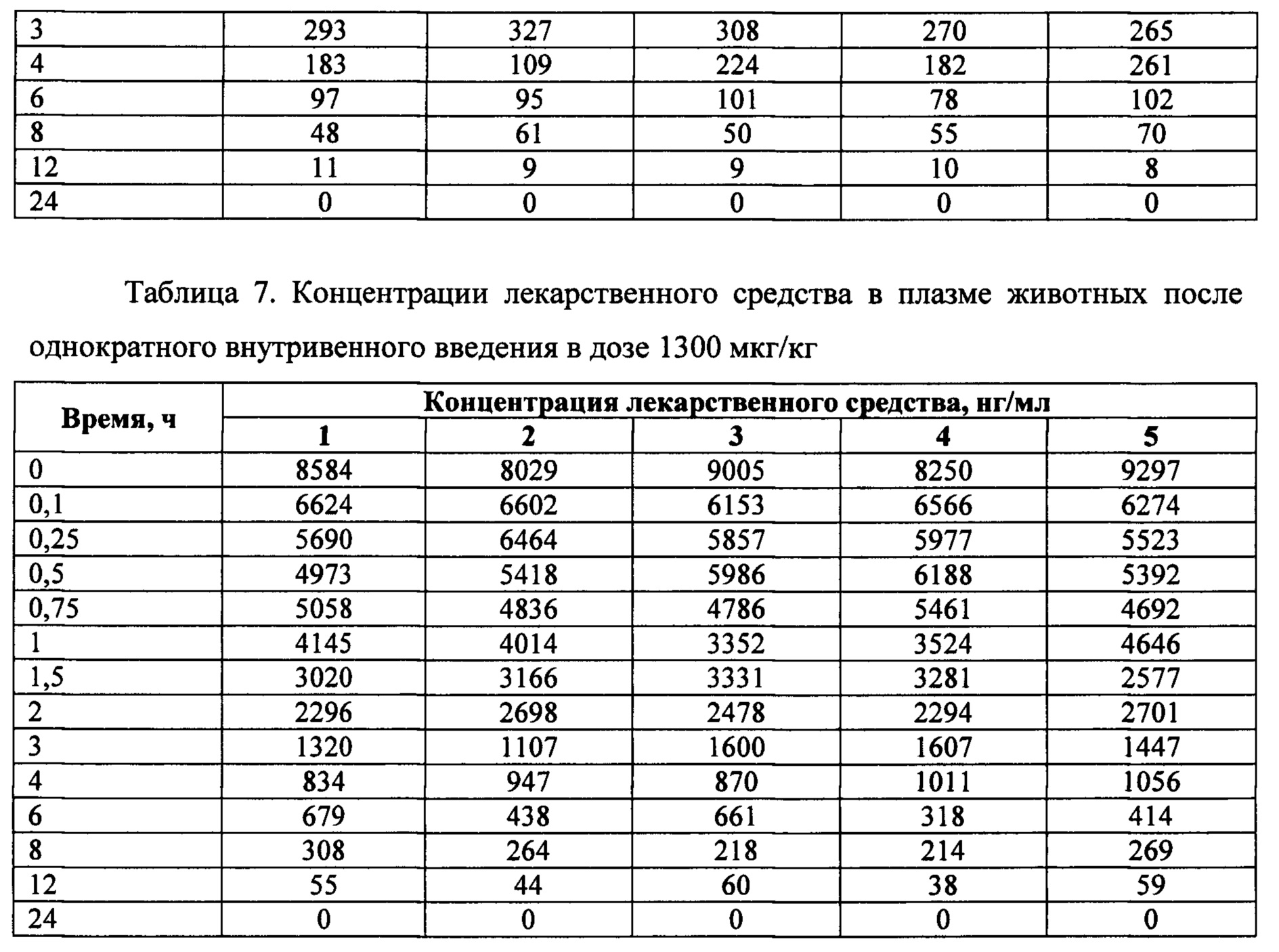
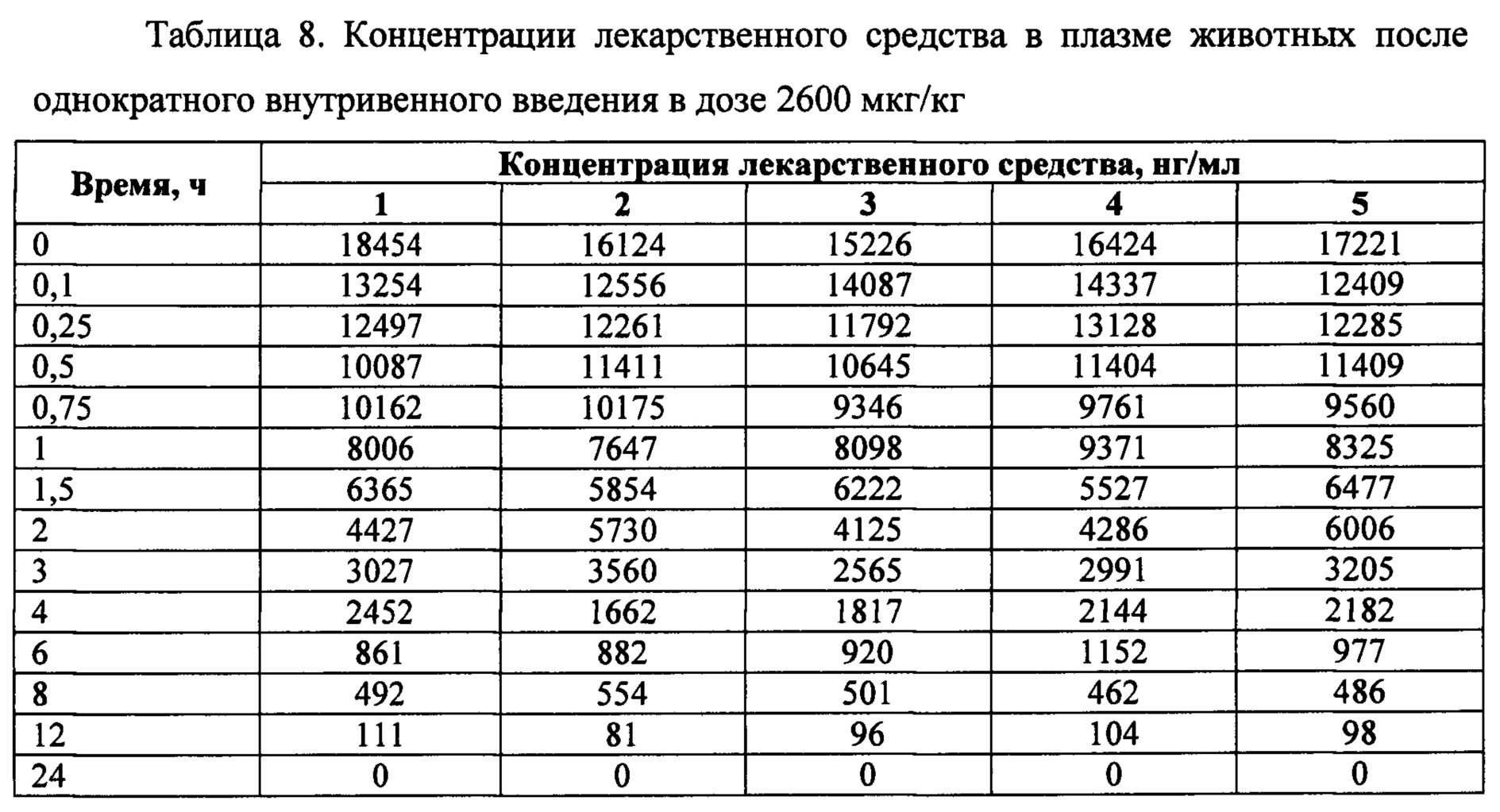
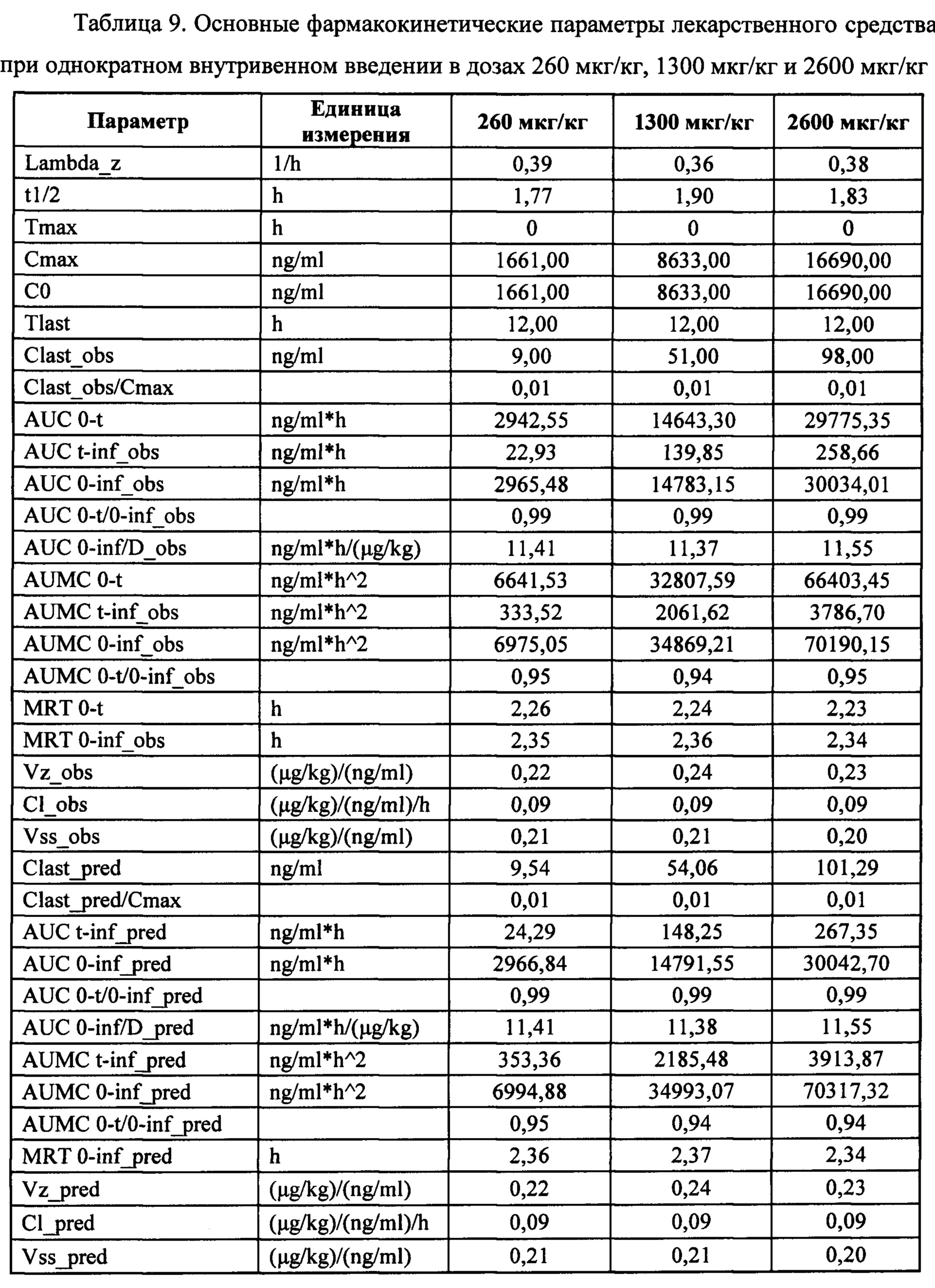
Значения фармакокинетических параметров были получены по экспериментальным данным в автоматическом режиме с использованием программы модуля PK Solver Excel (таблица 9).
После однократного внутривенного введения лекарственного средства крысам в трех возрастающих дозировках 260 мкг/кг, 1300 мкг/кг и 2600 мкг/кг изучали линейность фармакокинетики лекарственного средства. На основании полученных данных была выдвинута гипотеза линейности фармакокинетики лекарственного средства. Для проверки этой гипотезы была оценена статистическая достоверность отклонения от нуля свободного члена линейной регрессии AUC(0-t). Расчет представлен на фигуре 3. Полученные результаты показали, что свободный член незначимо отличается от нуля и гипотезу следует считать верной.
Также проводился анализ концентраций и распределения лекарственного средства в органах животных. Основные фармакокинетические параметры лекарственного средства в органах крыс после однократного внутривенного введения в дозе 2600 мкг/кг представлены в таблице 10.
Таблица 10. Основные фармакокинетические параметры лекарственного средства в органах крыс после однократного внутривенного введения в дозе 2600 мкг/кг
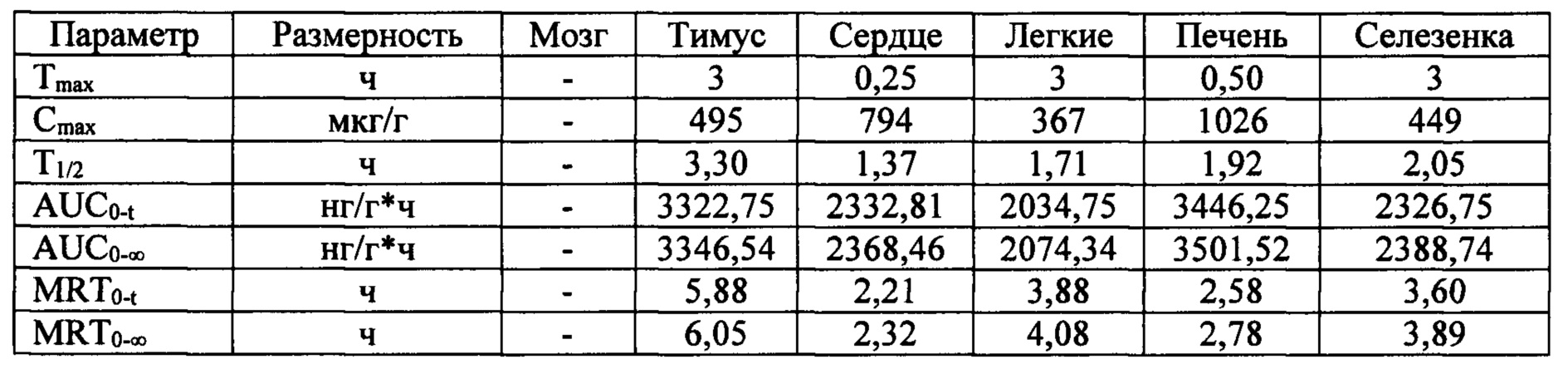
Анализ показал, что наибольшее время удерживания (MRT) лекарственного средства было в следующих органах: тимус (5,88 ч), легкие (3,88 ч) и селезенка (3,60 ч). Время полужизни (Т1/2) лекарственного средства было наибольшим для следующих органов: тимус (3 ч), селезенка (2,05 ч) и печень (1,92).
На основании полученных данных в ходе исследования фармакокинетики лекарственного средства с антиагрегантной активностью на основе гетеромерного пептида при однократном внутривенном введении в дозах 260 мкг/кг, 1300 мкг/кг и 2600 мкг/кг на крысах SD рассчитаны фармакокинетические параметры лекарственного средства. Оценена дозозависимость фармакокинетических параметров лекарственного средства на крысах. Подтверждена гипотеза о линейности фармакокинетики.
Т1/2 лекарственного средства в дозах 260 мкг/кг, 1300 мкг/кг и 2600 мкг/кг при внутривенном введении составило 1,77 ч, 1,90 ч и 1,83 ч, соответственно. Среднее время удерживания (MRT) лекарственного средства в дозах 260 мкг/кг, 1300 мкг/кг и 2600 мкг/кг при внутривенном введении составило 2,26 ч, 2,24 ч и 2,23 ч, соответственно. Клиренс (Cl_obs) лекарственного средства в дозах 260 мкг/кг, 1300 мкг/кг и 2600 мкг/кг при внутривенном введении составил 0,09 (мкг/кг) /(нг/мл) /ч для всех изученных доз.
Для изучения фармакокинетики лекарственного средства при многократном введении было использовано 6 самцов кроликов. За 18-20 часов до исследования животных лишали корма с открытым доступом к воде. Образцы исследуемого лекарственного средства вводили внутривенно в дозе 1300 мкг/кг кроликам. Животные получали лекарственное средство каждые 24 часа в течение 6 суток (144 часа).
Кровь забирали из центральной ушной вены по 1 мл с EDTA в следующие временные точки: 0, 0.1, 0.25, 0.5, 0.75, 1, 1.5, 2, 3, 4, 6, 8, 12, 24, 36, 48, 60, 72, 84, 96, 108, 120, 120.1, 120.25, 120.5, 120.75, 121, 121.5, 122, 123, 124, 126, 128, 132, 144 часов. На одну временную точку приходилось по 6 животных. Из крови получали плазму обычным методом: центрифугирование - при 3500 об/мин при температуре 4°С и сохранение при минус 20°С в аликвотах по 1 мл.
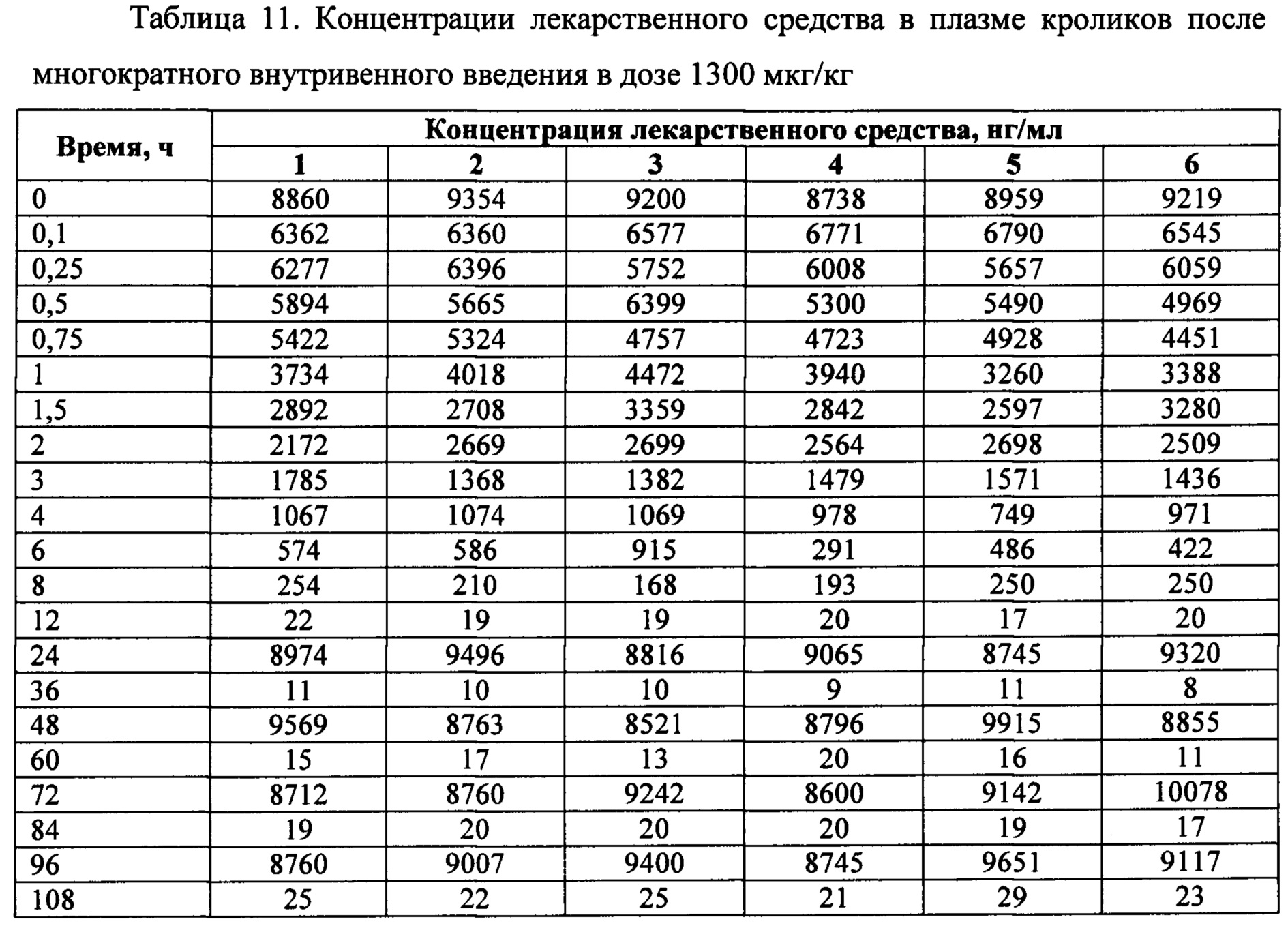
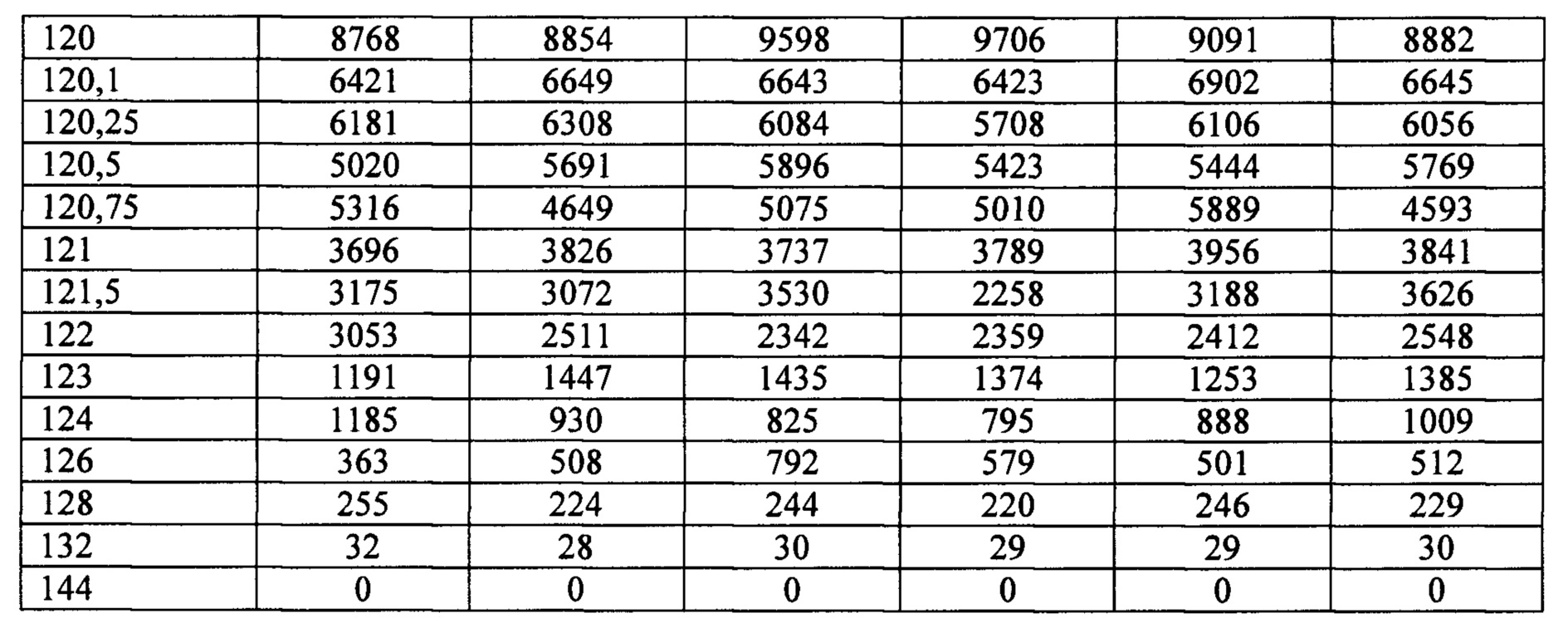
На фигуре 4 представлены экспериментальные данные по определению концентрации исследуемого лекарственного средства в образцах плазмы крови кроликов в разные сроки после многократного внутривенного введения в дозе 1300 мкг/кг.
Индивидуальные значения концентрации лекарственного средства в плазме после многократного внутривенного введения представлены в таблице 11. Значения фармакокинетических параметров были получены по экспериментальным данным в автоматическом режиме с использованием программы модуля PK Solver Excel (таблица 12).
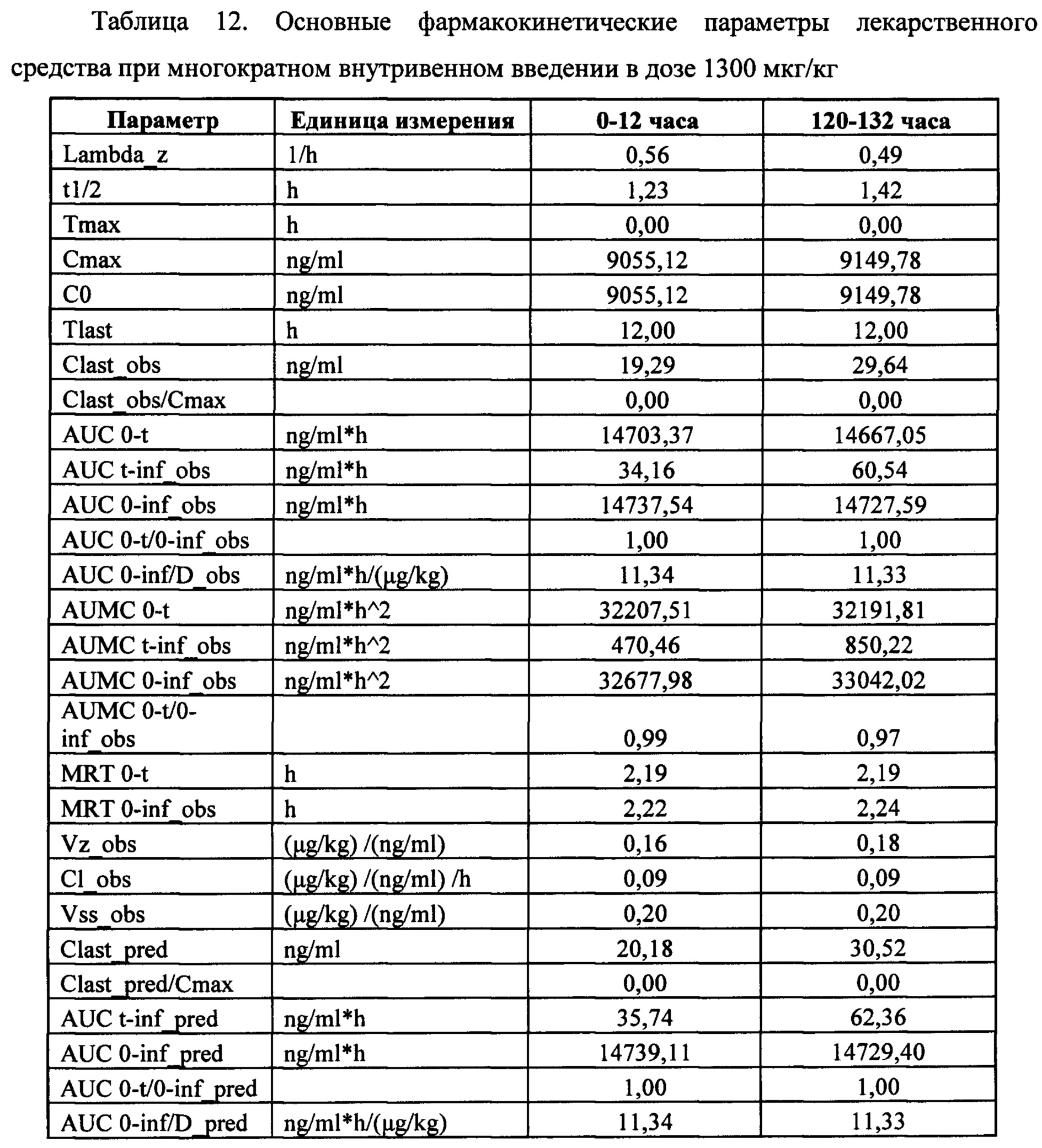
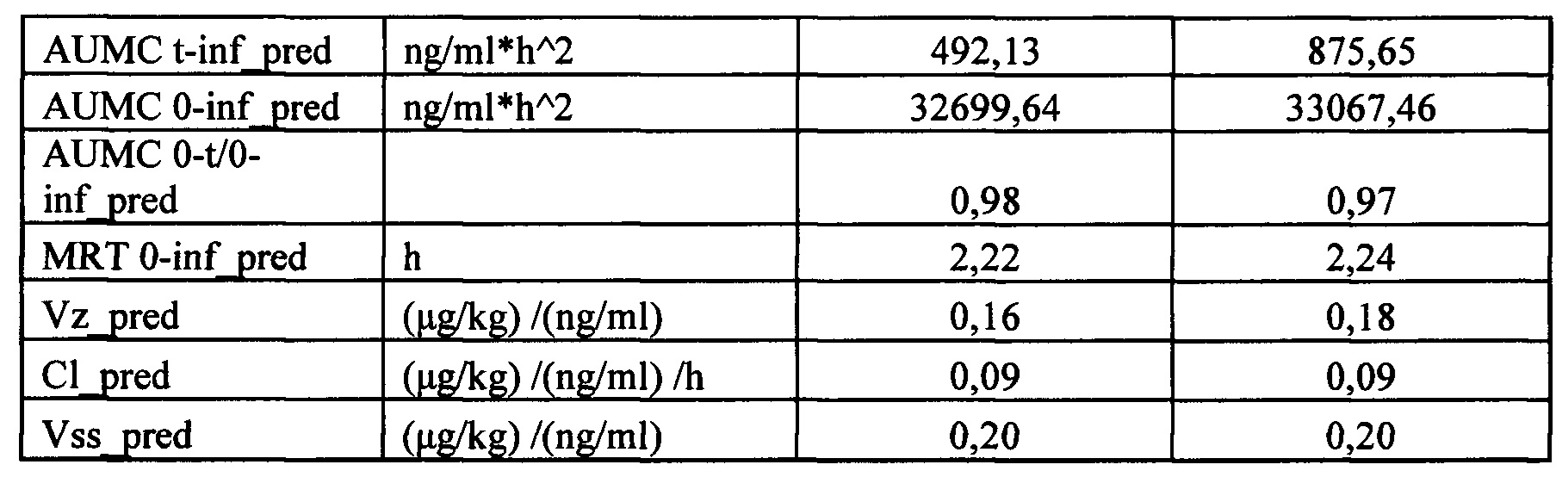
Сопоставление параметров фармакокинетики исследуемого лекарственного средства после многократного введения кроликам в дозе 1300 мкг/кг с интервалом дозирования 24 часа, не показало ускорение выведения лекарственного средства из организма после многократного введения. Клиренс не изменился, среднее время удержания (MRT) не изменилось. Максимальная концентрация, создающаяся в плазме сразу после очередного введения, составляла 9150 нг/мл и достоверно не отличалась от максимальной концентрации в первые 24 часа эксперимента. Таким образом, многократное введение лекарственного средства в дозе 1300 мкг/кг не влияет на его основные фармакокинетические параметры. Пример 6. Исследование токсичности.
Методики оценивания токсичности проводились в соответствии со стандартными практиками и известны из уровня техники среднему специалисту.
Острую токсичность лекарственного средства с антиагрегантной активностью на основе гетеромерного пептида исследовали на четырнадцати экспериментальных группах крыс CD и четырнадцати экспериментальных группах мышей CD-1, по десять самок и десять самцов в каждой группе. Исследуемое лекарственное средство вводили внутривенно в дозах: 7,5, 22,5 и 45 мг/кг (ГЛФ 0,75 мг/мл) и 20, 60, 120 мг/кг (ГЛФ 2 мг/мл) крысам; 18,75, 56,25, 112,5 мг/кг (ГЛФ 0,75 мг/мл) и 50, 150, 300 мг/кг (ГЛФ 2 мг/мл) мышам и внутрибрюшинно в дозах: 18,75, 56,25, 112,5 мг/кг (ГЛФ 0,75 мг/мл) и 50, 150, 300 мг/кг (ГЛФ 2 мг/мл) крысам; 37,5, 112,5, 225 мг/кг (ГЛФ 0,75 мг/мл) и 100, 300, 600 мг/кг (ГЛФ 2 мг/мл) мышам.
Во всех дозах исследуемое лекарственное средство не вызывало гибели и ухудшения состояния животных, спонтанная двигательная активность была аналогична контрольной группе, отставания в приросте массы тела животных опытных групп по сравнению с группой контроля также не зарегистрировано. Отклонений в гематологических и биохимических показателях во всех исследуемых группах по отношению к контролю не наблюдалось. Существенного токсического эффекта исследуемого лекарственного средства на массу органов крыс в остром эксперименте не выявлено. Расчет показателей летальных доз оказался не возможен.
Исследование хронической токсичности лекарственного средства с антиагрегантной активностью на основе гетеромерного пептида в двух лекарственных формах 0,75 мг/мл и 2 мг/мл проводили на крысах и кроликах (самцах и самках). Образцы исследуемого лекарственного средства вводили внутривенно в дозах 260 мкг/кг, 1300 мкг/кг и 2600 мкг/кг крысам и 100 мкг/кг, 500 мкг/кг и 1000 мкг/кг кроликам. Что является эквивалентно равными дозами при пересчете с учетом видового коэффициента и составляет 1, 5 и 10 ТД соответственно. Лекарственные средства вводили ежедневно в течение 30 дней.
Во всех дозах исследуемое лекарственное средство не вызывало ухудшения состояния и гибели животных в течение всего срока наблюдения. Животные сохраняли нормальный внешний вид, шерстный покров, характер выделений и поведенческие реакции, не отличающиеся от подобных показателей у животных в контрольной группе Прирост массы тела не замедлялся и был аналогичен приросту группы контроля.
Хроническое введение лекарственного средства с антиагрегантной активностью на основе гетеромерного пептида в двух готовых лекарственных формах: 0,75 мг/мл и 2 мг/мл не снижает двигательную и познавательную активности крыс по сравнению с животными контрольной группы.
Данные анализа мочи животных при дозе 2600 мкг/кг для крыс и 1000 мкг/кг для кроликов свидетельствуют об отсутствии патологических изменений почек после 30 дней введения лекарственного средства. В моче животных опытной группы и группы сравнения эритроциты и белок не обнаруживались, что указывает целостность фильтрационного аппарата почечных нефронов.
Токсического эффекта исследуемого лекарственного средства в обеих готовых лекарственных формах на систему крови крыс и кроликов в хроническом эксперименте на низких и средних дозах не выявлено. Колебания всех величин находились в пределах физиологической нормы. У крыс на максимальной дозе 2600 мкг/кг в обеих лекарственных формах ГЛФ 0,75 мг/мл и ГЛФ 2 мг/мл наблюдалась тромбоцитопения, снижение уровня гемоглобина и эритроцитов. Уровень тромбоцитов уменьшился на 32,9% и 31,9% в обеих лекарственных формах ГЛФ 0,75 мг/мл и ГЛФ 2 мг/мл соответственно. Уровень гемоглобина уменьшился на 53,9% и 58,2% в обеих лекарственных формах ГЛФ 0,75 мг/мл и ГЛФ 2 мг/мл соответственно. Уровень эритроцитов уменьшился на 55,2% и 76,5% в обеих лекарственных формах ГЛФ 0,75 мг/мл и ГЛФ 2 мг/мл соответственно. У кроликов на максимальной дозе 1000 мкг/кг в обеих лекарственных формах ГЛФ 0,75 мг/мл и ГЛФ 2 мг/мл также наблюдалась тромбоцитопения, снижение уровня гемоглобина и эритроцитов. Уровень тромбоцитов уменьшился на (31,9-25,4) % (самцы-самки) и (26,0-26,0) % (самцы-самки) в обеих лекарственных формах ГЛФ 0,75 мг/мл и ГЛФ 2 мг/мл соответственно. Уровень гемоглобина уменьшился на (29,3-25,0) % (самцы-самки) и (28,0-25,4) % (самцы-самки) в обеих лекарственных формах ГЛФ 0,75 мг/мл и ГЛФ 2 мг/мл соответственно. Уровень эритроцитов уменьшился на (31,6-31,6) % (самцы-самки) и (28,1-33,3) % (самцы-самки) в обеих лекарственных формах ГЛФ 0,75 мг/мл и ГЛФ 2 мг/мл соответственно. Данные изменения являются результатом специфической активности исследуемого лекарственного средства и описаны в литературе для данного класса препаратов - антиагрегантов. Все изменения приходили в норму после восстановительного периода отмены лекарственного средства.
Биохимическое исследование сыворотки крови животных опытных групп (крыс и кроликов), получивших исследуемое лекарственное средство с антиагрегантной активностью на основе гетеромерного пептида в двух лекарственных формах 0,75 мг/мл и 2 мг/мл не выявило статистически значимого изменения активности ферментов по сравнению с контрольной группой. Все значения биохимических параметров находились в пределах физиологической нормы для данного вида животных.
Оценка уровня и характер патологических изменений внутренних органов (систем внутренних органов) экспериментальных животных не выявил патологичных изменений. Гистологический анализ места введения исследуемого лекарственного средства и прилежащих тканей не выявил патологических изменений. Исследуемое лекарственное средство не обладает местно-раздражающим действием.
Лекарственное средство с антиагрегантной активностью на основе гетеромерного пептида в двух готовых лекарственных формах: 0,75 мг/мл и 2 мг/мл при многократном введении не влияет на функции внутренних органов и жизненно важных систем организма: печени, почек, гемопоэтической системы; не оказывает эффекта отсроченных реакций организм и побочных токсических эффектов, которые могут возникнуть при клиническом применении высоких доз препарата.
Пример 7. Иммунотоксические свойства.
Методики исследования иммунотоксических свойств проводились в соответствии со стандартными практиками и известны из уровня техники среднему специалисту.
При изучении иммунотоксических свойств установлено, что лекарственное средство на основе гетеромерного пептида не изменяет гуморальный иммунный ответ в дозе 1 ТД и 10 ТД, не влияет на число антителообразующих клеток в селезенке мышей линий СВА и C57BL/6. Исследуемое лекарственное средство не оказало достоверного влияния на реакцию гиперчувствительности замедленного типа. При оценке влияния исследуемого лекарственного средства на фагоцитарный индекс перитонеальных макрофагов, обнаружено, что его введение не влияет на значение фагоцитарного индекса. Полученные данные показали, что исследуемое лекарственное средство не изменяет достоверно микробицидности макрофагов, но влияет позитивно на кислородзависимую (НСТ-тест) и кислороднезависимую (ЛКТ-тест) микробицидность макрофагов.
Таким образом, можно заключить, что лекарственное средство на основе гетеромерного пептида не оказывает иммунотоксического действия, не ухудшает пролиферативную активность клеток-продуцентов антител, фагоцитоза, активации макрофагов - основных компонентов активного иммунного ответа. В отношении иммунологической безопасности исследуемое лекарственное средство является безопасным в диапазоне испытанных доз.
Пример 8. Аллергизирующие свойства
Методики исследования аллергизирующих свойств проводились в соответствии со стандартными практиками и известны из уровня техники среднему специалисту.
В результате изучения аллергенного действия лекарственного средства с антиагрегантной активностью на основе гетеромерного пептида: конъюнктивальные пробы у морских свинок - отрицательные; тест общей и активной анафилаксии -отрицательный; накожные аппликации - отрицательные, реакция гиперчувствительности замедленного типа на мышах - отрицательная, псевдоаллергические реакции - тест Шор - отрицательный. Следовательно, данное исследование показало отсутствие у испытуемого лекарственного средства аллергизирующих свойств в диапазоне испытанных доз.
Специалистам в данной области будет понятно, что в описанные выше варианты осуществления можно вносить многочисленные изменения и/или модификации без отклонения от широкого общего объема настоящего изобретения. Таким образом, представленные варианты осуществления следует считать во всех аспектах иллюстративными, но не ограничивающими.